Основания: классификация и химические свойства
Основания (гидроксиды) – сложные вещества, молекулы которых в своём составе имеют одну или несколько гидрокси-групп OH. Чаще всего основания состоят из атома металла и группы OH. Например, NaOH – гидроксид натрия, Ca(OH)2 – гидроксид кальция и др.
Существует основание – гидроксид аммония, в котором гидрокси-группа присоединена не к металлу, а к иону NH4+ (катиону аммония). Гидроксид аммония образуется при растворении аммиака в воде (реакции присоединения воды к аммиаку):
NH3 + H2O = NH4OH (гидроксид аммония).
Валентность гирокси-группы – 1. Число гидроксильных групп в молекуле основания зависит от валентности металла и равно ей. Например, NaOH, LiOH, Al (OH)3, Ca(OH)2, Fe(OH)3 и т.д.
Все основания – твёрдые вещества, которые имеют различную окраску. Некоторые основания хорошо растворимы в воде (NaOH, KOH и др.). Однако большинство из них в воде не растворяются.
Растворимые в воде основания называются щелочами. Растворы щелочей «мыльные», скользкие на ощупь и довольно едкие. К щелочам относят гидроксиды щелочных и щелочноземельных металлов (KOH, LiOH, RbOH, NaOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 и др.). Остальные являются нерастворимыми.
Нерастворимые основания – это амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью ведут себя, как кислоты.
Разные основания отличаются разной способностью отщеплять гидрокси-группы, поэтому признаку они делятся на сильные и слабые основания.
|
Сильные основания |
Слабые основания |
|
NaOH гидроксид натрия (едкий натр) KOH гидроксид калия (едкое кали) LiOH гидроксид лития Ba(OH)2 гидроксид бария Ca(OH)2 гидроксид кальция (гашеная известь) |
Mg(OH)2 гидроксид магния Fe(OH)2 гидроксид железа (II) Zn(OH)2 гидроксид цинка NH4OH гидроксид аммония Fe(OH)3 гидроксид железа (III) и т.д. (большинство гидроксидов металлов) |
Сильные основания в водных растворах легко отдают свои гидрокси-группы, а слабые – нет.
Химические свойства оснований
Химические свойства оснований характеризуются отношением их к кислотам, ангидридам кислот и солям.
1. Действуют на индикаторы. Индикаторы меняют свою окраску в зависимости от взаимодействия с разными химическими веществами. В нейтральных растворах – они имеют одну окраску, в растворах кислот – другую. При взаимодействии с основаниями они меняют свою окраску: индикатор метиловый оранжевый окрашивается в жёлтый цвет, индикатор лакмус – в синий цвет, а фенолфталеин становится цвета фуксии.
2. Взаимодействуют с кислотными оксидами с образованием соли и воды:
2NaOH + SiO2 → Na2SiO3 + H2O.
3. Вступают в реакцию с кислотами, образуя соль и воду. Реакция взаимодействия основания с кислотой называется реакцией нейтрализации, так как после её окончания среда становится нейтральной:
2KOH + H2SO4 → K2SO4 + 2H2O.
4. Реагируют с солями, образуя новые соль и основание:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4.
5. Способны при нагревании разлагаться на воду и основной оксид:
Cu(OH)2 = CuO + H2O.
Остались вопросы? Хотите знать больше об основаниях?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Химические свойства оснований — урок. Химия, 8–9 класс.
Химические свойства гидроксида металла во многом зависят от того, к какой группе он принадлежит — к щелочам или к нерастворимым основаниям.
Общие химические свойства щелочей
1. Кристаллы щелочей при растворении в воде полностью диссоциируют, то есть распадаются на положительно заряженные ионы металла и отрицательно заряженные гидроксид-ионы.
A) Например, при диссоциации гидроксида натрия образуются положительно заряженные ионы натрия и отрицательно заряженные гидроксид-ионы:
NaOH→Na++OH−.
Б) Процесс диссоциации гидроксида кальция отображается следующим уравнением:
Ca(OH)2→Ca2++2OH−.
2. Растворы щелочей изменяют окраску индикаторов.
Фактически с индикатором взаимодействуют гидроксид-ионы, содержащиеся в растворе любой щёлочи. При этом протекает химическая реакция с образованием нового продукта, признаком протекания которой является изменение окраски вещества.
Изменение окраски индикаторов в растворах щелочей
Индикатор | Изменение окраски индикатора |
| Лакмус | Фиолетовый лакмус становится синим |
| Фенолфталеин | Беcцветный фенолфталеин становится малиновым |
Универсальный индикатор | Универсальный индикатор становится синим |
Видеофрагмент:
Действие щелочей на индикаторы |
3. Щёлочи взаимодействуют с кислотами, образуя соль и воду.
Реакции обмена между щелочами и кислотами называют реакциями нейтрализации.
А) Например, при взаимодействии гидроксида натрия с соляной кислотой образуются хлорид натрия и вода: NaOH+HCl→NaCl+h3O.
Видеофрагмент:
Взаимодействие гидроксида натрия с соляной кислотой |
Б) Если нейтрализовать гидроксид кальция азотной кислотой, образуются нитрат кальция и вода:
Ca(OH)2+2HNO3→Ca(NO3)2+2h3O.
4. Щёлочи взаимодействуют с кислотными оксидами, образуя соль и воду.
А) Например, при взаимодействии гидроксида кальция с оксидом углерода(\(IV\)) т. е. углекислым газом, образуются карбонат кальция и вода:
Ca(OH)2+CO2→CaCO3↓+h3O.
Обрати внимание!
При помощи этой химической реакции можно доказать присутствие оксида углерода(\(IV\)): при пропускании углекислого газа через известковую воду (насыщенный раствор гидроксида кальция) раствор мутнеет, поскольку выпадает осадок белого цвета — образуется нерастворимый карбонат кальция.
Б) При взаимодействии гидроксида натрия с оксидом фосфора(\(V\)) образуются фосфат натрия и вода:
6NaOH+P2O5→2Na3PO4+3h3O.
5. Щёлочи могут взаимодействовать с растворимыми в воде солями.
Обрати внимание!
Реакция обмена между основанием и солью возможна в том случае, если оба исходных вещества растворимы, а в результате образуется хотя бы одно нерастворимое вещество (выпадает осадок).
А) Например, при взаимодействии гидроксида натрия с сульфатом меди(\(II\)) образуются сульфат натрия и гидроксид меди(\(II\)):
2NaOH+CuSO4→Na2SO4+Cu(OH)2↓.
Б) При взаимодействии гидроксида кальция с карбонатом натрия образуются карбонат кальция и гидроксид натрия:
Ca(OH)2+Na2CO3→CaCO3↓+2NaOH.
6. Малорастворимые щёлочи при нагревании разлагаются на оксид металла и воду.
Например, если нагреть гидроксид кальция, образуются оксид кальция и водяной пар:
Ca(OH)2⟶t°CaO+h3O↑.
Общие химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с кислотами, образуя соль и воду.
А) Например, при взаимодействии гидроксида меди(\(II\)) с серной кислотой образуются сульфат меди(\(II\)) и вода:
Cu(OH)2+h3SO4→CuSO4+2h3O.
Б) При взаимодействии гидроксида железа(\(III\)) с соляной (хлороводородной) кислотой образуются хлорид железа(\(III\)) и вода:
Fe(OH)3+3HCl→FeCl3+3h3O.
Видеофрагмент:
Взаимодействие гидроксида железа(\(III\)) с соляной кислотой |
2. Некоторые нерастворимые основания могут взаимодействовать с некоторыми кислотными оксидами, образуя соль и воду.
Например, при взаимодействии гидроксида меди(\(II\)) с оксидом серы(\(VI\)) образуются сульфат меди(\(II\)) и вода:
Cu(OH)2+SO3⟶t°CuSO4+h3O.
3. Нерастворимые основания при нагревании разлагаются на оксид металла и воду.
А) Например, при нагревании гидроксида меди(\(II\)) образуются оксид меди(\(II\)) и вода:
Cu(OH)2⟶t°CuO+h3O.
Видеофрагмент:
Разложение гидроксида меди(\(II\)) |
Б) Гидроксид железа(\(III\)) при нагревании разлагается на оксид железа(\(III\)) и воду:
2Fe(OH)3⟶t°Fe2O3+3h3O.
www.yaklass.ru
Свойства оснований
Основания – сложные вещества,
состоящие из атома металла и одной или нескольких гидроксильных
групп. Общая формула оснований Ме(ОН)n.
Основания (с точки зрения теории
электролитической диссоциации) – это электролиты, диссоциирующие при
растворении в воде с образованием катионов металла и гидроксид-ионов
ОН
Классификация. По растворимости в воде основания делят на щелочи (растворимые в воде основания) и нерастворимые в воде основания. Щелочи образуют щелочные и щелочно-земельные металлы, а также некоторые другие элементы-металлы. По кислотности (числу ионов ОН–, образующихся при полной диссоциации, или количеству ступеней диссоциации) основания подразделяют на однокислотные (при полной диссоциации получается один ион ОН–; одна ступень диссоциации) и многокислотные (при полной диссоциации получается больше одного иона ОН–; более одной ступени диссоциации). Среди многокислотных оснований различают двухкислотные (например, Sn(OH) 2), трехкислотные (Fe(OH)3) и четырехкислотные (Th(OH)4). Однокислотным является, например, основание КОН.
Выделяют группу гидроксидов, которые проявляют химическую двойственность. Они взаимодействую как с основаниями, так и с кислотами. Это амфотерные гидроксиды (см. таблицу 1).
Таблица 1 — Амфотерные гидроксиды
|
Амфотерный гидроксид (основная и кислотная форма) |
Комплексный ион |
|
|
Zn(OH)2 / H2ZnO2 |
|
[Zn(OH)4]2– |
|
Al(OH)3 / HAlO2 |
AlO2 (I) |
[Al(OH)4]–, [Al(OH)6]3– |
|
Be(OH)2 / H2BeO2 |
BeO2 (II) |
[Be(OH)4]2– |
|
Sn(OH)2 / H2 SnO2 |
SnO2 (II) |
[Sn(OH)4]2– |
|
Pb(OH)2 / H2PbO2 |
PbO2 (II) |
[Pb(OH)4]2– |
|
Fe(OH)3 / HFeO2 |
FeO2 (I) |
[Fe(OH)4]–, [Fe(OH)6]3– |
Cr(OH)3 / HCrO2 |
CrO2 (I) |
[Cr(OH)4]–, [Cr(OH)6]3– |
Физические свойства. Основания — твердые вещества различных цветов и различной растворимости в воде.
Химические свойства оснований
1) Диссоциация: КОН + nН2О К+×mН2О + ОН–×dН2О или сокращенно: КОН К+ + ОН–.
Многокислотные основания диссоциируют по нескольким ступеням (в основном диссоциация протекает по первой ступени). Например, двухкислотное основание Fe(OH) 2диссоциирует по двум ступеням:
Fe(OH)2FeOH+ + OH– (1 ступень);
FeOH+Fe2+ + OH– (2 ступень).
2) Взаимодействие с индикаторами (щелочи окрашивают фиолетовый лакмус в синий цвет, метилоранж – в желтый, а фенолфталеин – в малиновый):
индикатор + ОН– (щелочь) окрашенное соединение.
3)
Разложение с образованием оксида и воды (см. таблицу 2).
Гидроксиды щелочных металлов устойчивы к нагреванию (плавятся
без разложения). Гидроксиды щелочно-земельных и тяжелых металлов
обычно легко разлагаются. Исключение составляет
Ba(OH)
Zn(OH)2 ZnO + H2O.
Таблица 2 — Температуры разложения некоторых гидроксидов металлов
| Гидроксид | tразл, °C | Гидроксид | tразл, °C | Гидроксид | tразл, °C |
| LiOH | 925 | Cd(OH)2 | 130 | Au(OH)3 | 150 |
| Be(OH)2 | 130 | Pb(OH)2 | 145 | Al(OH)3 | >300 |
| Ca(OH)2 | 580 | Fe(OH)2 | 150 | Fe(OH)3 | 500 |
| Sr(OH)2 | 535 | Zn(OH)2 | 125 | Bi(OH)3 | 100 |
| Ba(OH)2 | 1000 | Ni(OH)2 | 230 | In(OH)3 | 150 |
4) Взаимодействие щелочей с некоторыми металлами (например, Al и Zn):
В растворе: 2Al + 2NaOH + 6H2O ® 2Na[Al(OH)4] + 3H2
2Al + 2OH–+ 6H2О ® 2[Al(OH)4]– + 3H2.
При сплавлении: 2Al + 2NaOH + 2H2O 2NaAlО2 + 3H2.
5) Взаимодействие щелочей с неметаллами:
6NaOH + 3Cl2 5NaCl + NaClO3 + 3H2O.
6) Взаимодействие щелочей с кислотными и амфотерными оксидами:
2NaOH + СО2® Na2CO3 + H2O 2OH–+ CO2 ® CO32– + H2O.
В растворе: 2NaOH + ZnO + H2O ® Na2[Zn(OH)4] 2OH–+ ZnO + H2О ® [Zn(OH)4]2–.
При сплавлении с амфотерным оксидом: 2NaOH + ZnO Na2ZnO2 + H2O.
7) Взаимодействие оснований с кислотами:
H2SO4+ Ca(OH)2 ® CaSO4¯ + 2H2O 2H+ + SO42–+ Ca2+ +2OH– ® CaSO4¯ + 2H2O
H2SO4+ Zn(OH)2 ® ZnSO4 + 2H2O 2H+ + Zn(OH)2 ® Zn2+ + 2H2O.
8) Взаимодействие щелочей с амфотерными гидроксидами (см. таблицу 1):
В растворе: 2NaOH + Zn(OH)2 ® Na2[Zn(OH)4] 2OH– + Zn(OH)2 ® [Zn(OH)4]2–
При сплавлении: 2NaOH + Zn(OH)2 Na2ZnO2 + 2H2O.
9) Взаимодействие щелочей с солями. В реакцию вступают соли, которым соответствует нерастворимое в воде основание:
CuSО4 + 2NaOH ® Na2SO4 + Cu(OH)2¯ Cu2++ 2OH– ® Cu(OH)2¯.
Получение. Нерастворимые в воде основания получают путем взаимодействия соответствующей соли со щелочью:
2NaOH + ZnSО4 ® Na2SO4 + Zn(OH)2¯ Zn2++ 2OH– ® Zn(OH)2¯.
Щелочи получают:
1) Взаимодействием оксида металла с водой:
Na2O + H2O ® 2NaOH CaO + H2O ® Ca(OH)2.
2) Взаимодействием щелочных и щелочно-земельных металлов с водой:
2Na + H2O ® 2NaOH + H2 Ca + 2H2O ® Ca(OH)2 + H2.
3) Электролизом растворов солей:
2NaCl + 2H2O H2 + 2NaOH + Cl2.
4) Обменным взаимодействием гидроксидов щелочно-земельных металлов с некоторыми солями. В ходе реакции должна обязательно получаться нерастворимая соль.
Ba(OH)2+ Na2CO3® 2NaOH + BaCO3¯ Ba2+ + CO32– ® BaCO3¯.
Л.А. Яковишин
www.sev-chem.narod.ru
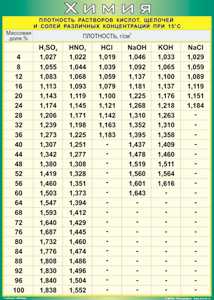
| Химия | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||
| Периодическая система химических элементов Д.И. Менделеева расширенная и доработанная (атомная масса, электронное строение, электро-отрицательность, температура плавления, температура кипения) |
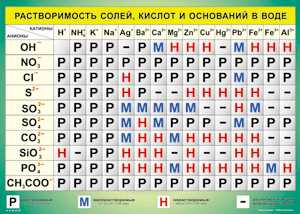
Растворимость солей, кислот и оснований в воде |
Растворимость солей и оснований в воде | ||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сравнение понятий изомер и гомолог |
Химические свойства металлов | Окраска индикаторов в различных средах |
||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
Электрохимический ряд напряжений металлов |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
Плотность и температура плавления металлов |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Растворимость солей и электрохимический ряд | Ряд электроотрицательности элементов | |||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электрохимический ряд напряжений металлов Ряд электроотрицательности неметаллов (2 x 0.6 m) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Растворимость некоторых веществ в воде (при t=25°C) и их молекулярные или формульные массы |
Электрохимический ряд напряжений металлов |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||
| Обобщение сведений о группах углеводородов |
Относительные или молярные массы неорганических соединений |
Химические свойства кислот, солей и оснований |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||
| Общие константы нестойкости некоторых комплексных ионов |
Константы диссоциации воды и некоторых cлабых кислот и оснований в водных растворах |
Стандартные термодинамические величины некоторых веществ | ||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартные электродные потенциалы металлов |
Электродные потенциалы металлов в различных средах, В |
Правила безопасности на уроке химии |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
| Генетические связи органических веществ | Генетические связи неорганических веществ | |||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||
Классификация органических соединений и их свойства |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| < назад | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
www.ma-ko.ru
Основания — классификация, получение и свойства » HimEge.ru
Основаниями называют гидроксиды, которые диссоциируют (распадаются) на гидроксильную группу и положительно заряженный катион.
Общая формула оснований — Э(OН)m, где m – степень окисления металла.
Классификация оснований
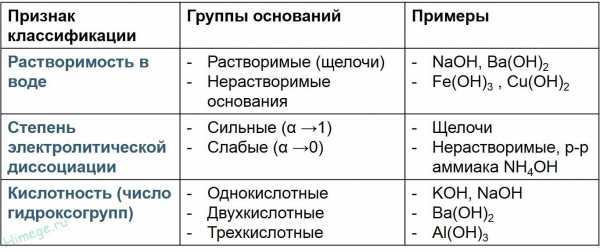
Взаимодействие активных металлов с водой (только щелочи)
2Na + 2H2O = 2NaOH + H2,
Ba + 2H2O = Ba(OH)2 + H2,
Взаимодействие основных оксидов с водой (только щелочи)
Na2O + H2O = 2NaOH,
Взаимодействие солей со щелочами (малорастворимые основания)
CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4,
Cu2+ + 2OH— = Cu(OH)2,
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl,
Al3+ + 3OH— = Al(OH)3.
Электролиз водных растворов солей (промышленный способ)
2NaCl + 2H2O = 2NaOH + H2 + Cl2.
 1) Растворы оснований мыльные на ощупь, изменяют окраску индикаторов: лакмуса – в синий цвет, бесцветного фенолфталеина – в малиновый.
1) Растворы оснований мыльные на ощупь, изменяют окраску индикаторов: лакмуса – в синий цвет, бесцветного фенолфталеина – в малиновый.
В водном растворе растворимые основания диссоциируют, образуя катион металла и гидроксогруппу:
NaOH = Na+ + OH—.
Многоосновные основания диссоциируют ступенчато:
Ba(OH)2 = BaOH+ + OH—,
BaOH+ = Ba2+ + OH—,
суммарное уравнение:
Ba(OH)2 = Ba2+ + 2OH—.
2) Взаимодействие с кислотами (реакция нейтрализации)
NaOH + HCl = NaCl + H2O,
OH— + H+ = H2O.
При реакции нейтрализации взаимодействие сводится к взаимодействию ионов водорода и гидроксогруппы с образованием малодиссоциирующего вещества – воды.
Многоосновные основания образуют основные и средние соли:
Ba(OH)2 + HCl = BaOHCl + H2O,
Ba(OH)2 + 2HCl = BaCl2 + 2H2O.
3) Взаимодействие с кислотными оксидами
Ca(OH)2 + CO2 = CaCO3 + H2O,
4) Взаимодействие с солями
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4,
2Fe3+ + 6OH— = 2Fe(OH)3.
5) Термическое разложение
Cu(OH)2 = CuO + H2O,
2Fe(OH)3 = Fe2O3 + 3H2O .
Щелочи термическому разложению не подвергаются, например, гидроксид натрия кипит при 1400°С без разложения, из всех растворимых оснований разлагается только гидроксид лития:
2LiOH = Li2O + H2O.
6)Взаимодействие с неметаллами
6KOH + 3S = K2SO3 + 2K2S + 3H2O,
2NaOH + Cl2 = NaCl + NaOCl + H2O (на холоде).
himege.ru
Физические и химические свойства оснований
Все неорганические основания классифицируют на растворимые в воде (щелочи) – NaOH, KOH и нерастворимые в воде (Ba(OH)2, Ca(OH)2). В зависимости от проявляемых химических свойств среди оснований выделяют амфотерные гидроксиды.
Химические свойства оснований
При действии индикаторов на растворы неорганических оснований происходит изменение их окраски, так, при попадании в раствор основания лакмус приобретает синюю окраску, метилоранж – жёлтую, а фенолфталеин – малиновую.
Неорганические основания способны реагировать с кислотами с образованием соли и воды, причем, нерастворимые в воде основания взаимодействуют только с растворимыми в воде кислотами:
Cu(OH)2↓ + H2SO4 = CuSO4 +2H2O;
NaOH + HCl = NaCl + H2O.
Нерастворимые в воде основания термически неустойчивы, т.е. при нагревании они подвергаются разложению с образованием оксидов:
2Fe(OH)3 = Fe2O3 + 3 H2O;
Mg(OH)2 = MgO + H2O.
Щелочи (растворимые в воде основания) взаимодействуют с кислотными оксидами с образованием солей:
NaOH + CO2 = NaHCO3.
Щелочей также способны вступать в реакции взаимодействия (ОВР) с некоторыми неметаллами:
2NaOH + Si + H2O → Na2SiO3 +H2↑.
Некоторые основания вступают в реакции обмена с солями:
Ba(OH)2 + Na2SO4 = 2NaOH + BaSO4↓.
Амфотерные гидроксиды (основания) проявляют также свойства слабых кислот и реагируют с щелочами:
Al(OH)3 + NaOH = Na[Al(OH)4].
К амфотерным основаниям относятся гидроксиды алюминия, цинка. хрома (III) и др.
Физические свойства оснований
Большинство оснований – твердые вещества, которые характеризуются различной растворимостью в воде. Щелочи – растворимые в воде основания – чаще всего твердые вещества белого цвета. Нерастворимые в воде основания могут иметь различную окраску, например, гидроксид железа (III)- твердое вещество бурого цвета, гидроксид алюминия – твердое вещество белого цвета, а гидроксид меди (II) – твердое вещество голубого цвета.
Получение оснований
Основания получают разными способами, например, по реакции:
— обмена
CuSO4 + 2KOH → Cu(OH)2↓ + K2SO4;
K2CO3 + Ba(OH)2 → 2KOH + BaCO3↓;
— взаимодействия активных металлов или их оксидов с водой
2Li + 2H2O→ 2LiOH +H2↑;
BaO + H2O→ Ba(OH)2↓;
— электролиза водных растворов солей
2NaCl + 2H2O = 2NaOH + H2 ↑+ Cl2↑.
Примеры решения задач
ru.solverbook.com
Свойства оснований и кислот | Дистанционные уроки
24-Май-2013 | Нет комментариев | Лолита Окольнова
Задание А10 ЕГЭ по химии —
Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот

Темы, которые нужно знать:
И опять определять основные химические свойства оснований и кислот мы будем по таблице:
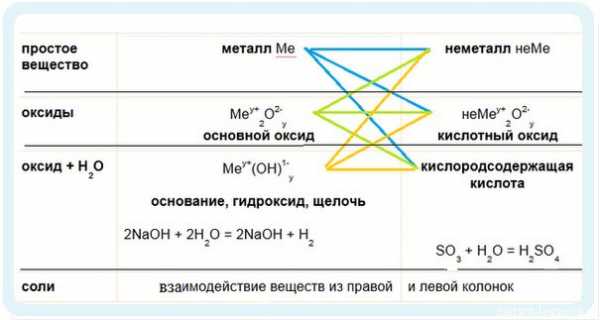
Химические свойства оснований:
1. Взаимодействие с неметаллами (идем по желтым стрелочкам):
при нормальных условиях гидроксиды не взаимодействуют с большинством неметаллов, исключение — взаимодействие щелочей с хлором:
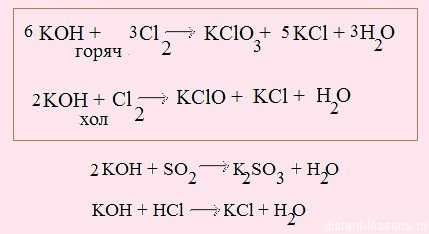
Эту реакцию мы уже рассматривали много раз, например, в контексте свойств простых веществв.
2. Взаимодействие с кислотными оксидами с образованием солей:
2NaOH + SO2 = Na2SO3 + H2O
3. Взаимодействие с кислотами — реакция нейтрализации:
- с образованием средних солей: 3NaOH + H3PO4 = Na3PO4 + 3H2O
условие образования средней соли — избыток щелочи; - с образованием кислых солей: NaOH + H3PO4 = NaH2PO4 + H2O
условие образования кислой соли — избыток кислоты; - с образованием основных солей: Cu(OH)2 + HCl = Cu(OH)Cl + H2O
условие образования основной соли — избыток основания.
4. С солями основания реагируют при выпадении осадка в результате реакции, выделения газа или образования малодиссоциирующего вещества:
2NaOH + CuCl2 = Cu(OH)2 ↓+ 2NaCl
NaOH + NH4Cl = NaCl + NH4OH — малодисс.
Амфотерные гидроксиды:
Ко всем свойствам оснований добавляются взаимодействие с основаниями:
Al(OH)3 + NaOH = Na[Al(OH)4]
Zn(OH)2 + NaOH = Na2[Zn(OH)4]
Основные свойства кислот
1. Кислоты взаимодействуют с металлами с выделением водорода, если металл стоит в ряду напряжений до водорода H:
2Na + 2HCl =2 NaCl + H2
с металлами после водорода Н взаимодействуют только кислоты — окислители и уже без выделения водорода:
Cu +2 H2SO4 = CuSO4 + SO2 +2 H2O
Кислоты — окислители могут взаимодействовать и с неметаллами:
S +2H2SO4 = 3SO2 +2 H2O
Какие кислоты являются окислителями? Те, в которых элемент кислотного остатка проявляет высшую (или близкую к высшей) степень окисления (соответствует номеру группы элемента):
| Кислота — окислитель | Степень окисления элемента |
| H2SO4 | степень окисления серы S= +6 |
| HNO3 | степень окисления азота N= +5 |
| HClO4 | степень окисления хлора Cl= +7 |
| HMnO4 | степень окисления марганца Mn= +7 |
| h3Cr2O7 | степень окисления хрома Cr= +6 |
2. С основными и амфотерными оксидами и основаниями кислоты дают соли:
Na2O + 2HCl = 2NaCl + H2O
2Al(OH)3 +3 H2SO4 = Al2(SO4)3 + H2O
3. C солями кислоты реагируют, если образуется осадок, газ или малодиссоциирующее вещество:
AgNO3 + HCl = AgCl ↓ + HNO3
Na2CO3 + H2SO4= Na2SO4 + CO2 ↑+ H2O
Свойства оснований и кислот определяются самыми простыми реакциями обмена и замещения, дополнительно — различные окислительно-восстановительные с участием кислот — окислителей.
Кстати, в нашем вопросе с гидроксидом калия:
1) Осадок. газ или малодиссоциирующее вещество не образуется — не подходит;
2) С гидроксидом алюминия реакция пойдет, а вот с нитратом серебра — нет;
3) С гидроксидом цинка реакция пойдет, с оксидом — нет, т.к. он основной;
4) 2KOH + ZnCl2 = Zn(OH)2 ↓+ 2KCl — выпадает осадок
6KOH + P2O5 (кислотный оксид) = 2K3PO4 + 3H2O
Ответ: 4)
Еще на эту тему:
Обсуждение: «Свойства оснований и кислот»
(Правила комментирования)distant-lessons.ru