Урок химии по теме «Состав кислот. Соли.» (8 класс)
Урок химии
по теме «Состав кислот. Соли»
Образовательные задачи:
Знать состав кислот, солей;
Определение кислоты и соли.
Уметь составлять химические формулы солей, давать им название, сравнивать по составу кислоты и соли.
Воспитательные задачи:
Продолжить формирование диалектико-материалистического мировоззрения учащихся.
Содействовать трудовому и эстетическому воспитанию учеников.
Формировать умение работать в коллективе, где развиваются чувства товарищества, доброжелательности и требовательности к себе и своему товарищу.
Развивающие задачи:
Развивать познавательный интерес и эмоции школьников, уметь выделять главное, сравнивать, обобщать, логически излагать мысли.
Тип урока:
Урок усвоения новых знаний.
Оборудование:
Образцы кислот и солей.
Ход урока:
1. Учитель знакомит учащихся с темой урока и его задачами, с порядком проведения урока.
2. Изучение новой темы.
I. Состав кислот.
Кислоты – это одни из важнейших продуктов химической технологии, которые находят широкое применение. Чтобы разумно использовать вещества, прежде всего необходимо знать их состав, строение и свойства.
Составьте уравнения химических реакций железа с соляной кислотой и серной кислотой. Вспомним один из способов получения водорода в лаборатории.
К доске выходит ученик и составляет уравнения химических реакций. Класс помогает ему в ответах.
Кроме соляной и серной кислот существуют еще большое количество различных кислот (смотрим и работаем с таблицей № 1)
Учитель демонстрирует на столе кислоты,
Таблица № 1
Формулы некоторых кислот и кислотных остатков.
Название кислоты
Формула кислоты
Кислотный остаток и его валентность
Название соли
Соляная кислота
НСl
С1 —
Хлориды
Серная кислота
H2SO4
SO4 =
Сульфаты
Сернистая кислота
Н2SО3
SO3=
Сульфиты
Азотная кислота
НNО3
NO3 —
Нитраты
Ортофосфорная кислота
Н3РO4
РO4=
Ортофосфаты
Сероводородная кислота
S =
Сульфиды
Угольная кислота
Н2СО3
СOз=
Карбонаты
Кремниевая кислота
Н2SiO3
SiO3 =
Силикаты
Бромоводородная кислота
НВr
Br —
Бромиды
Фтороводородная кислота
HF
F —
Фториды
Иодоводородная кислота
HI
I —
Иодиды
Фронтальная беседа с классом:
Теперь посмотрите на формулы кислот.
Из чего состоят кислоты?
Дайте определение — что такое кислоты?
Теперь посмотрим на уравнения химических реакций железа с соляной и серной кислотами. И даем полное определение кислотам.
Как узнать валентность кислотного остатка?
Посмотрим на уравнение химической реакции взаимодействия железа с кислотами и ответим на следующий вопрос: Разрушаются кислотные остатки в ходе химических реакций?
II. Классификация кислот.
По составу кислоты делят на кислородосодержащие и бескислородные, а по числу содержащихся в них атомов водорода, способных замещаться на металл, — на одноосновные, двухосновные и трехосновные” Ученики работают с таблицей № 2.
Таблица № 2
Кислоты
Бескислородные
Кислородсодержащие
HCl, HBr, HY (одноосновные)
H2S (двухосновная)
HNO3 (одноосновная),
H2SO4 (двухосновная),
H3PO4 (трехосновные)
III. Закрепление изученного материала.
1. Выполним работу №1 по группам: 1 ряд – 1 группа, 2 ряд – 2 группа, 3 ряд – 3 группа.
Цель:
Сформировать умение определять валентность кислотного остатка по формуле кислоты.
1. В приведенных формулах кислот подчеркните кислотный остаток, обозначьте римской цифрой величину его валентности:
Задание 1 группы
азотная кислота – НNО3
серная кислота – H2SО4
ортофосфорная кислота – НзРО4
метафосфорная кислота – НРО3
Задание 2 группы
сероводородная кислота – H2S
хлорная кислота – НClO4
- соляная кислота – НС1
мышьяковая кислота – Н3АsO4
Задание 3 группы
сернистая кислота – Н2SО3
бромоводородная кислота – НВr
кремниевая кислота – Нг8Юз
пирофосфорная кислота – Н4Р2О7
2. Проверьте правильность ответов внутри группы.
3. Проверяем правильность ответов каждой из групп.
IV. Изучение новой темы.
1. Соли, состав, название.
А) Состав солей.
В результате взаимодействия металлов с кислотами образуются соли. Вспомним реакцию железа с кислотами.
FeCl2, FeSO4.
Дайте определение соли?
Демонстрируем образцы солей.
Б) Название солей.
Класс работает с таблицей № 1.
В) Составление формул солей.
2. Что такое валентность химических элементов?
V. Закрепление изученного материала.
Работа 2 (по группам)
1 ряд – 1 группа,
2 ряд – 2 группа,
3 ряд – 3 группа.
Цель: Выработать умение составлять формулы солей по валентности металла и кислотного остатка.
1. Заполнить клетки таблицы формулами солей, образованных указанными кислотами и металлами.
2. Под формулами солей укажите их названия.
Задание № 2 для первой группы
А)
Формула металла
Формула кислоты
HCl
H2SO4
HNO3
H3PO4
K (I)
Al (III)
Б) по названию составьте формулы солей: сульфид натрия, карбонат кальция, силикат калия, нитрат хрома (II)
Задание № 2 для второй группы
А)
Формула металла
Формула кислоты
HCl
H2SO4
HNO3
H3PO4
Ag (I)
Cu (II)
Б) по названию составьте формулы солей: иодид кальция, сльфит калия, силикат лития, сульфат хрома (III).
Задание 2 для третьей группы
А)
Формула металла
Формула кислоты
HCl
H2SO4
HNO3
H3PO4
Fe (II)
Fe (III)
Б) по названию составьте формулы солей: карбонат натрия, бромид магния, сульфид калия, сульфат марганца (II).
3. Проверьте правильность ответов внутри группы.
4. Проверяем правильность ответов каждой из групп.
VI. Домашнее задание: п.21, в. 2 с.112
§ 32. Состав и классификация кислот.
§ 33. Состав, название солей.
Учебник: Габриелян О.С. Химия. 8 класс. М.: Дрофа. 2007.
VIII. Подведение итогов урока.
Учитель объявляет оценки классу и отдельным ученикам.
infourok.ru
ГДЗ Габриелян Сладков 8 класс рабочая тетрадь
ЧАСТЬ 11. Признаки солей:
— сложные вещества;
— состоят из положительных ионов металла и отрицательных ионов кислотного остатка.
2. Способ образования названий солей.
3. Дополните таблицу «Кислоты».
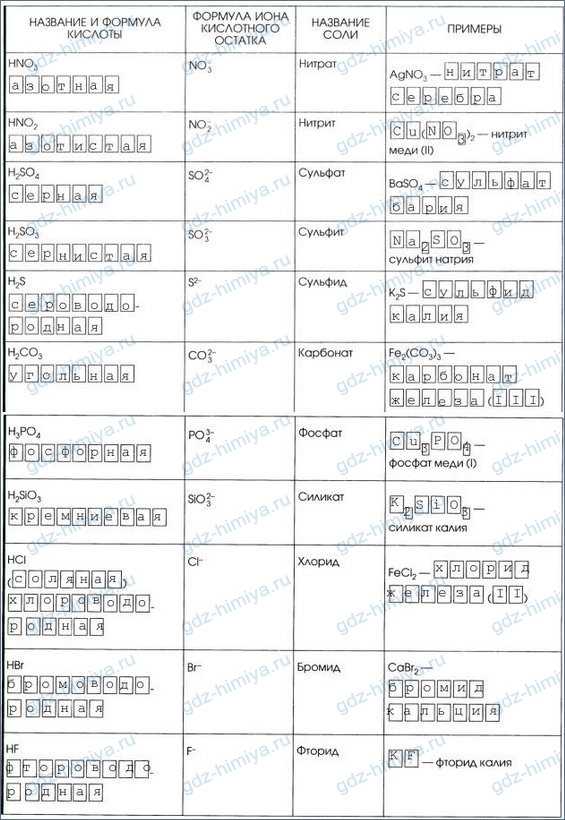
4.

5.
6. Каждой соли кислородсодержащей кислоты соответствуют основание и кислота, а также оксиды металла и неметалла:

7. Дополните таблицу «Соли и соответствующие им гидроксиды и оксиды».
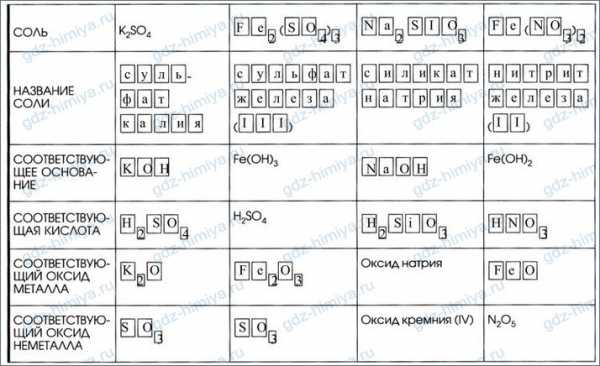
ЧАСТЬ 2
1. Поиграйте в «крестики — нолики». Покажите выигрышный путь, который составляют формулы солей.
2. Составьте формулы солей по названиям.
1) Фосфаты натрия, кальция, алюминия: 21-2-21
3) Сульфиты калия, бария, цинка: 21-2-22
2) Нитраты меди (II), железа (III), серебра: 21-2-23
3. Расставьте заряды ионов в следующих соединениях и степени окисления химических элементов.
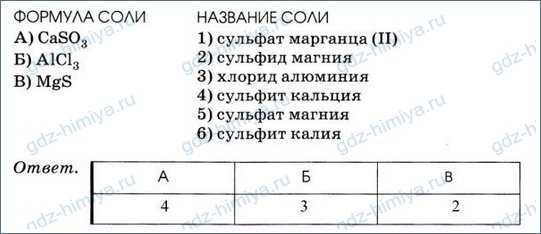
4. Установите соответствие между формулой соли и её названием.
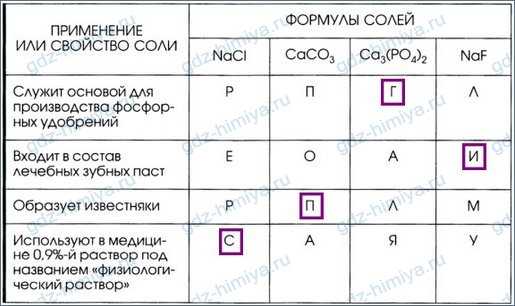
5. Установите соответствие между формулой соли и её применением или свойством. Из букв, указывающих правильный ответ, вы составите название одного из самых древних связующих материалов на основе сульфата кальция: гипс.
6. Запишите формулы солей и соответствующих им гидроксидов (кислот и оснований), оксидов и простых веществ.

Для каждого варианта составьте формулы бинарных соединений, которые могут быть образованы простыми веществами. Напишите их названия.
7. Вычислите количество вещества, которое составляют 222 кг хлорида кальция. Сколько ионов каждого вида будет содержать это количество? Какова массовая доля хлора в соли?
8. Придумайте условие задачи по теме «Соли». Запишите решение.
Дана соль CuCl2 массой 270 г, найти количество вещества этой соли.
gdz-himiya.ru
Шпаргалки по химии для учащихся 8 класса
Правила составления формул химических веществ
по валентности
Валентность бывает:
— высшая (определяется по № группы, если ХЭ находится в подгруппе А)
— низшая (определяется по формуле VIII — №гр.)
1. В соединениях металла с неметаллом
металл проявляет высшую вал., неметалл – низшую
2. В соединениях двух неметаллов
тот НеМе, который находится выше или правее, проявляет низшую валентность,
а тот НеМе, который находится ниже или левее – высшую.
3. Металлы IА – IIIА групп всегда проявляют высшую валентность
4. Всегда: кислород – II, водород — I
5. Неметалл в соединении с водородом проявляет низшую валентность
Определение названий двойных соединений
Двойные соединения называются
по латинскому названию второго ХЭ с добавлением суффикса – ид
Правила составления формул химических веществ
по валентности
Валентность бывает:
— высшая (определяется по № группы, если ХЭ находится в подгруппе А)
— низшая (определяется по формуле VIII — №гр.)
1. В соединениях металла с неметаллом
металл проявляет высшую вал., неметалл – низшую
2. В соединениях двух неметаллов
тот НеМе, который находится выше или правее, проявляет низшую валентность,
а тот НеМе, который находится ниже или левее – высшую.
3. Металлы IА – IIIА групп всегда проявляют высшую валентность
4. Всегда: кислород – II, водород — I
5. Неметалл в соединении с водородом проявляет низшую валентность
Определение названий двойных соединений
Двойные соединения называются
по латинскому названию второго ХЭ с добавлением суффикса — ид
infourok.ru
Общие способы получения средних солей — урок. Химия, 8–9 класс.
Соли образуются в результате целого ряда химических превращений. Выбор способа получения каждой конкретной соли зависит от целого ряда факторов, в частности от доступности исходных веществ, а в промышленности определяется в первую очередь экономической целесообразностью.
Разберём некоторые общие подходы к выбору способов получения средних солей.
1. Соли образуются при взаимодействии металлов с неметаллами.
Например, при взаимодействии железа с хлором образуется хлорид железа(\(III\)):
2Fe+3Cl2⟶t°2FeCl3.
При нагревании смеси железа с серой образуется сульфид железа(\(II\)):
Fe+S⟶t°FeS.
2. Соли образуются при взаимодействии металлов с кислотами.
Например, при взаимодействии железа с соляной кислотой образуется хлорид железа(\(II\)):
Fe+2HCl→FeCl2+h3↑.
При взаимодействии магния с серной кислотой образуется сульфат магния:
Mg+h3SO4→MgSO4+h3↑.
3. Соли можно получить, используя реакции замещения, протекающие при взаимодействии металлов с другими солями.
Например, сульфат железа(\(II\)) образуется при взаимодействии железа с сульфатом меди(\(II\)):
Fe+CuSO4→FeSO4+Cu↓.
Нитрат магния образуется при взаимодействии магния с нитратом серебра:
Mg+2AgNO3→MgNO32+2Ag↓.
4. Соли образуются при взаимодействии основных, кислотных или амфотерных оксидов с оксидами, принадлежащими к другой группе оксидов.
Например, при взаимодействии основного оксида кальция с кислотным оксидом углерода(\(IV\)) образуется карбонат кальция:
CaO+CO2→CaCO3.
При нагревании смеси основного оксида магния с амфотерным оксидом алюминия образуется алюминат магния:
MgO+Al2O3⟶t°MgAlO22.
5. Соли образуются при взаимодействии основных и амфотерных оксидов с кислотами.
Например, сульфат меди(\(II\)) можно получить, используя оксид меди(\(II\)) и серную кислоту:
CuO+h3SO4→CuSO4+h3O.
Хлорид цинка можно получить, используя оксид цинка и соляную кислоту:
ZnO+2HCl→ZnCl2+h3O.
6. Соли образуются при взаимодействии кислотных и амфотерных оксидов с основаниями.
Например, при пропускании углекислого газа через известковую воду (водный раствор гидроксида кальция) выпадает осадок карбоната кальция:
CaOh3+CO2→CaCO3↓+h3O.
При взаимодействии оксида серы(\(IV\)) с гидроксидом натрия образуется сульфит натрия:
2NaOH+SO2→Na2SO3+h3O.
7. Соли образуются при взаимодействии кислот с основаниями или с амфотерными гидроксидами.
Например, сульфат меди(\(II\)) можно получить, используя гидроксид меди(\(II\)) и серную кислоту:
CuOh3+h3SO4→CuSO4+2h3O.
Нитрат алюминия образуется в результате взаимодействия гидроксида алюминия с азотной кислотой:
AlOh4+3HNO3→AlNO33+3h3O.
8. Соли можно получить, используя химическую реакцию обмена, протекающую между кислотой и другой солью.
Например, при взаимодействии сульфида железа(\(II\)) с серной кислотой образуется сульфат железа(\(II\)):
FeS+h3SO4→FeSO4+h3S↑.
Хлорид кальция образуется при взаимодействии соляной кислоты (водного раствора хлороводорода) с карбонатом кальция:
CaCO3+2HCl→CaCl2+h3O+CO2↑.
9. Соли образуются при взаимодействии щелочей с растворимыми в воде солями.
Например, нитрат натрия образуется в результате химической реакции, протекающей между гидроксидом натрия и нитратом меди(\(II\)):
2NaOH+CuNO32→2NaNO3+CuOh3↓.
Сульфат калия образуется в реакции обмена, протекающей между гидроксидом калия и сульфатом железа(\(III\)):
2KOH+FeSO4→K2SO4+FeOh3↓.
10. Соли образуются в реакциях обмена, протекающих между другими солями.
Например, чтобы получить бромид серебра, можно в качестве исходных веществ использовать нитрат серебра и бромид калия:
AgNO3+KBr→AgBr↓+KNO3.
Сульфат бария образуется в реакции обмена, протекающей между сульфатом натрия и хлоридом бария:
Na2SO4+BaCl2→BaSO4↓+2NaCl.
11. Соли можно получить, разлагая некоторые другие соли.
2KClO3⟶катализаторt°2KCl+3O2.
Осадок карбоната кальция образуется при разложении гидрокарбоната кальция:
CaHCO32⇄t°CaCO3↓+h3O+CO2↑.
www.yaklass.ru
это наука!: Для 8 класса.
Напоминаю как работать с таблицей Менделеева для составления схем электронных оболочек:сначала смотрите в каком периоде находится элемент,например К.
* Увидели — «К» находится в 4 периоде , значит мы пишем четыре скобочки.
* В первом периоде всего два элемента ( Н и Не), поэтому под первой скобочкой пишем 2
* Во втором периоде всего 8 элементов, поэтому под второй скобочкой пишем цифру 8
* В третьем периоде всего 8 элементов, поэтому под третьей скобочкой пишем цифру 8
* В четвертом периоде «К» находится на 1месте, считаем его и пишем под четвертой скобочкой цифру 1
Обращаю ваше внимание СУММА ЭЛЕКТРОНОВ (пишется под скобочками) ДОЛЖНА СОВПАДАТЬ С ЗАРЯДОМ ЯДРА (равен порядковому номеру элемента).
Если вам даны только электроны, например, 2е, 8е, 4е, вы считаете сколько всего у вас электронов и узнаете порядковый номер необходимого элемента — Si.
Вариант 1.
Атом любого химического элемента заряжен:
1) положительно; 2) отрицательно; 3) нейтрально; 4) не знаю.
Количество энергетических уровней в атоме определяется:
1) по номеру группы; 2) по порядковому номеру; 3) по номеру периода; 4) по номеру ряда.
Количество электронов в атоме на последнем энергетическом уровне определяется:
1) по номеру группы; 2) по порядковому номеру; 3) по номеру периода; 4) по номеру ряда.
Верны ли следующие суждения? А) Химический элемент – это совокупность атомов с одинаковым зарядом ядра. Б) Изотопы – это атомы одного химического элемента, имеющие разные относительные атомные массы.
1) верно только А; 2) верны оба суждения; 3) верно только Б; 4) оба суждения неверны.
Число протонов в изотопе атома скандия 45Sc (порядковый номер 21):
1) 4; 2) 45; 3) 24; 4) 21.
Число нейтронов в изотопе атома мышьяка 75As (порядковый номер 33):
1) 42; 2) 48; 3) 25; 4) 70.
Изотопами являются:
1) 39K и 80Kr; 2) 39K и 39Аr; 3) 40K и 40Аr; 4) 39K и 40K.
Что происходит с энергией электрона при переходе со второго энергетического уровня на третий:
1) уменьшается; 2) увеличивается; 3) не изменяется; 4) не знаю.
В третьем периоде, в четвёртой группе, главной подгруппе находится:
1) Sc; 2) Ti; 3) Si; 4) Ge.
В пятом периоде, во второй группе, побочной подгруппе находится:
1) Cd; 2) Te; 3) Mo; 4) Bi .
Вариант 2.
В центре атома находится:
1) ядро; 2) электроны; 3) электронные оболочки; 4) у атома нет центра.
Величина заряда ядра определяется :
1) по номеру группы; 2) по порядковому номеру; 3) по номеру периода; 4) по номеру ряда.
Количество нейтронов в ядре атома определяется:
1) по номеру группы; 2) вычитанием из относительной атомной массы количества протонов; 3) по номеру периода; 4) по номеру ряда.
Элементарные частицы, которые имеют заряд 0 и массу, равную массе атома водорода:
1) мезоны; 2) электроны; 3) нейтроны; 4) протоны.
Число нейтронов в изотопе атома кадмия 112Cd (порядковый номер 48):
1) 64; 2) 112; 3) 48; 4) 5.
Число протонов в изотопе атома цинка 65Zn (порядковый номер 30):
1) 50; 2) 40; 3) 30; 4) 35.
Изотопами являются:
1) 16О и 17О; 2) 37Cl и 40Cа; 3) 23Na и 24Mg; 4) 39K и 80Kr.
Какое максимальное количество электронов может быть на первом энергетическом уровне:
1) 2; 2) 8; 3) 18; 4) 32.
В шестом периоде, в пятой группе, побочной подгруппе находится:
1) Te; 2) Mo; 3) Bi; 4) Ta.
Во втором периоде, в седьмой группе, главной подгруппе находится:
1) Fe; 2) W; 3) Tl; 4) F.
Ход решения задачи можно представить в виде таблицы:
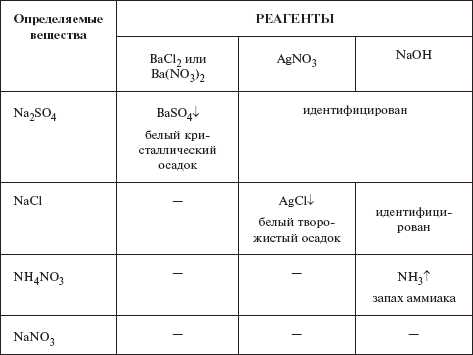
Примечание. Важно не только подобрать реакции, с помощью которых можно обнаружить наличие тех или иных ионов, но и продумать последовательность их проведения. Так, например, в данной задаче сначала рациональнее определить сульфат натрия, а не хлорид натрия. Если начать определение с хлорида натрия, то при добавлении раствора нитрата серебра к пробам, в осадок выпал бы как хлорид серебра, так и, вполне возможно, сульфат серебра Ag2SO4 — малорастворимое соединение.
Типы кристаллических решёток

ximik123.blogspot.com
Конспект урока в 8 классе Состав кислот. Соли.
Состав кислот. СолиОбразовательные задачи:
Знать состав кислот, солей;
Определение кислоты и соли.
Уметь составлять химические формулы солей, давать им название, сравнивать по составу кислоты и соли.
Воспитательные задачи:
Продолжить формирование диалектико-материалистического мировоззрения учащихся.
Содействовать трудовому и эстетическому воспитанию учеников.
Формировать умение работать в коллективе, где развиваются чувства товарищества, доброжелательности и требовательности к себе и своему товарищу.
Развивающие задачи:
Развивать познавательный интерес и эмоции школьников, уметь выделять главное, сравнивать, обобщать, логически излагать мысли.
Тип урока:
Урок усвоения новых знаний.
Оборудование:
Образцы кислот и солей.
Ход урока:
1. Учитель знакомит учащихся с темой урока и его задачами, с порядком проведения урока.
2. Изучение новой темы.
Состав кислот.
Кислоты – это одни из важнейших продуктов химической технологии, которые находят широкое применение. Чтобы разумно использовать вещества, прежде всего необходимо знать их состав, строение и свойства.
Составьте уравнения химических реакций железа с соляной кислотой и серной кислотой. Вспомним один из способов получения водорода в лаборатории.
К доске выходит ученик и составляет уравнения химических реакций. Класс помогает ему в ответах.
Кроме соляной и серной кислот существуют еще большое количество различных кислот (смотрим и работаем с таблицей № 1)
Учитель демонстрирует на столе кислоты,
Таблица № 1
Формулы некоторых кислот и кислотных остатков.
| Название кислоты | Формула кислоты | Кислотный остаток и его валентность | Название соли |
| Соляная кислота | НСl | С1 — | Хлориды |
| Серная кислота | H2SO4 | SO4 = | Сульфаты |
| Сернистая кислота | Н2SО3 | SO3= | Сульфиты |
| Азотная кислота | НNО3 | NO3 — | Нитраты |
| Ортофосфорная кислота | Н3РO4 | РO4= | Ортофосфаты |
| Сероводородная кислота | H2S | S = | Сульфиды |
| Угольная кислота | Н2СО3 | СOз= | Карбонаты |
| Кремниевая кислота | Н2SiO3 | SiO3 = | Силикаты |
| Бромоводородная кислота | НВr | Br — | Бромиды |
| Фтороводородная кислота | HF | F — | Фториды |
| Иодоводородная кислота | HI | I — | Иодиды |
Фронтальная беседа с классом:
Теперь посмотрите на формулы кислот.
Из чего состоят кислоты?
Дайте определение — что такое кислоты?
Теперь посмотрим на уравнения химических реакций железа с соляной и серной кислотами. И даем полное определение кислотам.
Как узнать валентность кислотного остатка?
Посмотрим на уравнение химической реакции взаимодействия железа с кислотами и ответим на следующий вопрос: Разрушаются кислотные остатки в ходе химических реакций?
II. Классификация кислот.
По составу кислоты делят на кислородосодержащие и бескислородные, а по числу содержащихся в них атомов водорода, способных замещаться на металл, — на одноосновные, двухосновные и трехосновные” Ученики работают с таблицей № 2.
Таблица № 2
| Кислоты | |
| Бескислородные | Кислородсодержащие |
| HCl, HBr, HY (одноосновные) H2S (двухосновная) | HNO3 (одноосновная), H2SO4 (двухосновная), H3PO4 (трехосновные) |
III. Закрепление изученного материала.
1. Выполним работу №1 по группам: 1 ряд – 1 группа, 2 ряд – 2 группа, 3 ряд – 3 группа.
Цель:
Сформировать умение определять валентность кислотного остатка по формуле кислоты.
1. В приведенных формулах кислот подчеркните кислотный остаток, обозначьте римской цифрой величину его валентности:
Задание 1 группы
азотная кислота – НNО3
серная кислота – H2SО4
ортофосфорная кислота – НзРО4
метафосфорная кислота – НРО3
Задание 2 группы
сероводородная кислота – H2S
хлорная кислота – НClO4
соляная кислота – НС1
мышьяковая кислота – Н3АsO4
Задание 3 группы
сернистая кислота – Н2SО3
бромоводородная кислота – НВr
кремниевая кислота – Нг8Юз
пирофосфорная кислота – Н4Р2О7
2. Проверьте правильность ответов внутри группы.
3. Проверяем правильность ответов каждой из групп.
IV. Изучение новой темы.
1. Соли, состав, название.
А) Состав солей.
В результате взаимодействия металлов с кислотами образуются соли. Вспомним реакцию железа с кислотами.
FeCl2, FeSO4.
Дайте определение соли?
Демонстрируем образцы солей.
Б) Название солей.
Класс работает с таблицей № 1.
В) Составление формул солей.
2. Что такое валентность химических элементов?
V. Закрепление изученного материала.
Работа 2 (по группам)
1 ряд – 1 группа,
2 ряд – 2 группа,
3 ряд – 3 группа.
Цель: Выработать умение составлять формулы солей по валентности металла и кислотного остатка.
1. Заполнить клетки таблицы формулами солей, образованных указанными кислотами и металлами.
2. Под формулами солей укажите их названия.
Задание № 2 для первой группы
А)
| Формула металла | Формула кислоты | |||
| HCl | H2SO4 | HNO3 | H3PO4 | |
| K (I) |
|
|
|
|
| Al (III) |
|
|
|
|
Б) по названию составьте формулы солей: сульфид натрия, карбонат кальция, силикат калия, нитрат хрома (II)
Задание № 2 для второй группы
А)
| Формула металла | Формула кислоты | |||
| HCl | H2SO4 | HNO3 | H3PO4 | |
| Ag (I) |
|
|
|
|
| Cu (II) |
|
|
|
|
Б) по названию составьте формулы солей: иодид кальция, сльфит калия, силикат лития, сульфат хрома (III).
Задание 2 для третьей группы
А)
| Формула металла | Формула кислоты | |||
| HCl | H2SO4 | HNO3 | H3PO4 | |
| Fe (II) |
|
|
|
|
| Fe (III) |
|
|
|
|
Б) по названию составьте формулы солей: карбонат натрия, бромид магния, сульфид калия, сульфат марганца (II).
3. Проверьте правильность ответов внутри группы.
4. Проверяем правильность ответов каждой из групп.
VI. Домашнее задание:
§ 32. Состав и классификация кислот.
§ 33. Состав, название солей.
Учебник: Рудзитис Г.Е. Фельдман Ф.Г. Химия. 8 класс средней школы. М.: Просвещение., 1993г.
VIII. Подведение итогов урока.
Учитель объявляет оценки классу и отдельным ученикам.
kopilkaurokov.ru
