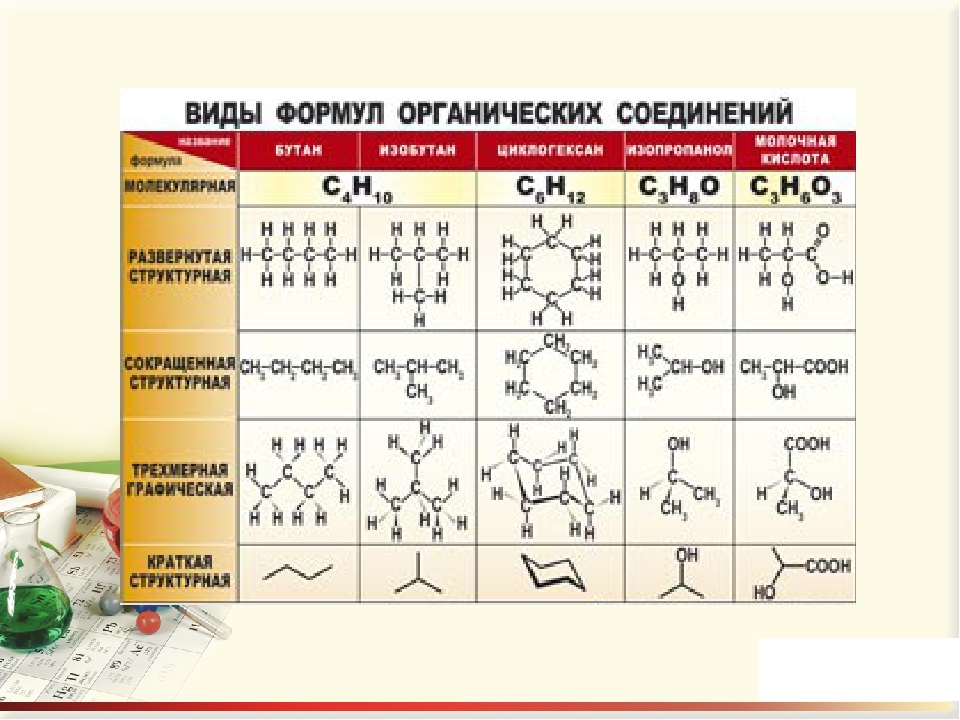
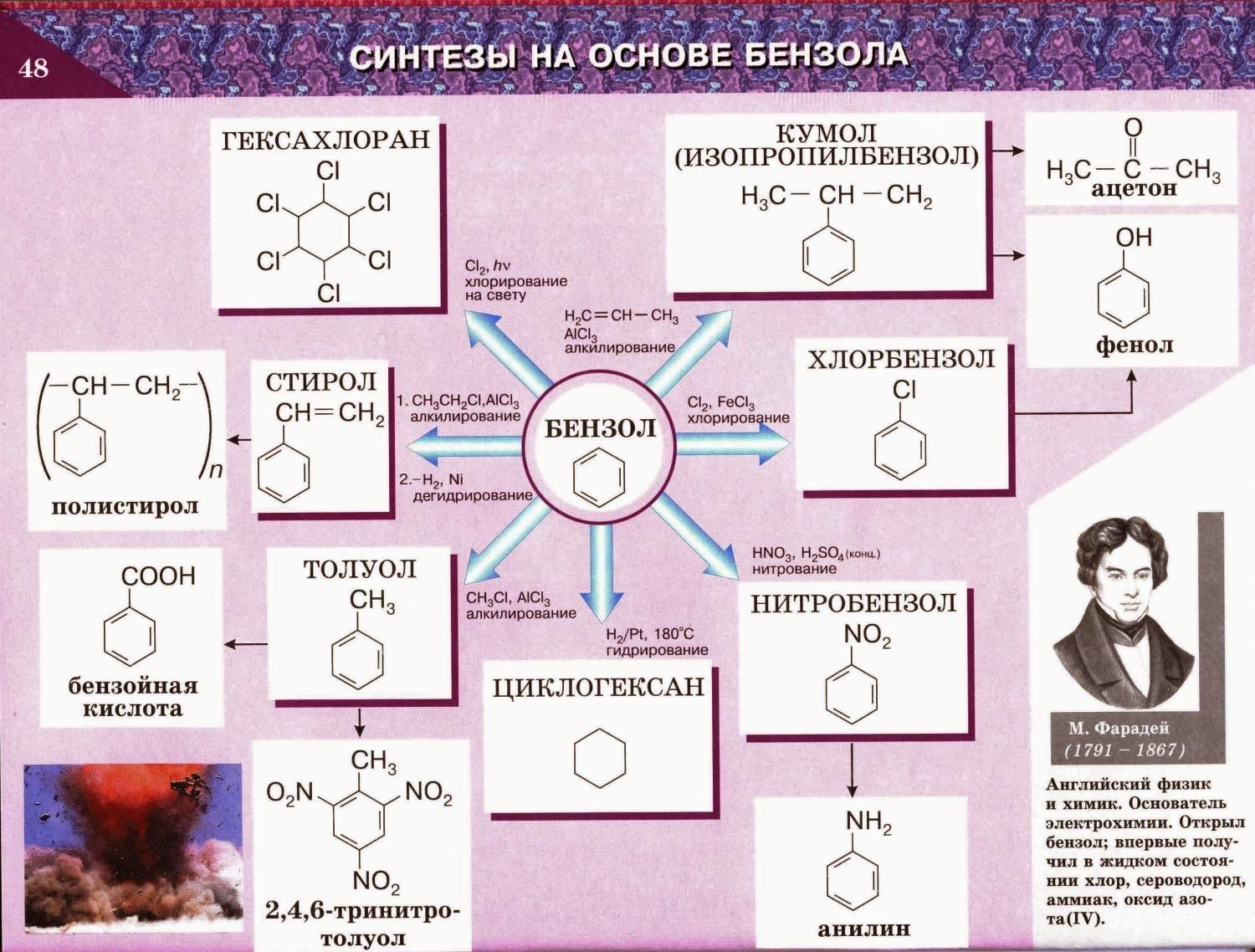
Органическая химия. «Курский государственный университет»
Код и наименование направления подготовки:
04.06.01 Химические науки
Уровень образования
Высшее образование — подготовка кадров высшей квалификации — Аспирантура
Квалификация
не указано
Формы и сроки обучения:
Очная: 4 года
Заочная: 5 лет
Информация по образовательной программе
Описание образовательной программы
Календарный учебный график
Рабочие программы дисциплин
Аннотации к рабочим программам дисциплин
Аннотации к рабочим программам практик
Методические и иные документы, разработанные ОО для обеспечения образовательного процесса
Органическая химия (Факультет физико-математических и естественных наук, аспирантура, очная)
О профессии
Область профессиональной деятельности выпускников, освоивших программу аспирантуры по направлению «Химические науки», включает решение комплексных профессиональных задач в сфере наукоемких технологий и химического образования, охватывающих совокупность направлений теоретической и прикладной химии, а также смежных естественнонаучных дисциплин.
Основными задачами программы являются:
— формирование навыков самостоятельной научно-исследовательской и педагогической деятельности;
— углубленное изучение теоретических и методологических основ химических наук;
— совершенствование философского образования, в том числе ориентированного на профессиональную деятельность;
— совершенствование знаний иностранного языка, в том числе для использования в профессиональной деятельности;
— выполнение итогового оригинального научного исследования, вносящего вклад в создание, расширение и развитие научного знания.
Выпускники аспирантуры могут заниматься научно-исследовательской деятельностью в области химии и в смежных областях (биохимии, геохимии, нефтехимии, экологии, фармацевтике), преподавательской деятельностью в системе высшего образования, а также планированием и организацией работы структурных подразделений для решения конкретных технологических задач химической направленности.
Учебный процесс
Программа аспирантуры по направлению «Химические науки» на факультете физико-математических и естественных наук РУДН направлена на подготовку научных и научно-педагогических кадров высшей квалификации, способных к инновационной деятельности в соответствующей области химии и в смежных областях науки и высшего образования.
Программа аспирантуры состоит из нескольких блоков.
Блок 1. «Дисциплины»:
Базовая часть:
«Английский язык»;
«Философия».
Вариативная часть:
«Методология научных исследований»;
«Приоритетные направления развития химии»;
«Методика преподавания химии в высшей школе».
Блок 2. «Практики»:
— научно-исследовательская практика;
— педагогическая практика.
Блок 3. «Научные исследования».
Блок 4. «Государственная аттестация»:
— подготовка и сдача государственного экзамена;
— подготовка и презентация научного доклада.
Практические занятия и научные исследования проводятся в учебных и исследовательских лабораториях, оснащенных современным приборным и аналитическим оборудованием.
Обучение по программе аспирантуры завершается подготовкой и защитой диссертации на соискание ученой степени кандидата химических наук.
Практика
Педагогическая и научно-исследовательская практики, научные исследования – реальные возможности для аспирантов попробовать себя в качестве преподавателей и химиков-исследователей. Предусмотренные учебным планом практики проводятся на базе научных лабораторий кафедры неорганической химии факультета ФМиЕН, центра коллективного пользования «Физико-химические исследования новых материалов, веществ и каталитических систем», центров Объединенного института химических исследований.
Предусмотренные учебным планом практики проводятся на базе научных лабораторий кафедры неорганической химии факультета ФМиЕН, центра коллективного пользования «Физико-химические исследования новых материалов, веществ и каталитических систем», центров Объединенного института химических исследований.
Аспиранты активно участвуют в работах по научным грантам. Широко используется сотрудничество с ведущими вузами России в плане совместных научно-исследовательских проектов. Имеется возможность международного сотрудничества и обучения за рубежом. Кафедра неорганической химии активно сотрудничает с лабораториями Института элементоорганических соединений РАН, Института нефтехимического синтеза им. А.В. Топчиева РАН, Института металлургии и материаловедения им. А.А. Байкова РАН, НИЦ «Курчатовский институт», НИФХИ им. Л.Я. Карпова, Университетом Нью-Мексико (США).
Карьера
Выпускники, освоившие программу, продолжают свою карьеру в зарубежных университетах и институтах Российской академии наук, в лабораториях научных центров, ведущих исследования в области химии, биохимии, геохимии, нефтехимии, экологии, фармацевтики, в исследовательских и аналитических лабораториях различных производств, а также в учреждениях системы высшего профессионального образования.
профиль специалитета в вузах России
Органическая химия в России: проходные баллы, минимальные баллы, экзамены, в каких вузах учат, стоимость обучения, вступительные экзамены
Сводная информация
Проходной балл: от 172
Мест: 89
Проходной балл: от 118
Мест: 27
Стоимость: от 114160
Параметры программы
Квалификация: Специалитет;
Форма обучения: Очная;
Язык обучения: Русский;
На базе: 11 классов;
Курс: Полный курс;
Где учат
О программе
** набор дисциплин может незначительно отличаться в зависимости от вуза.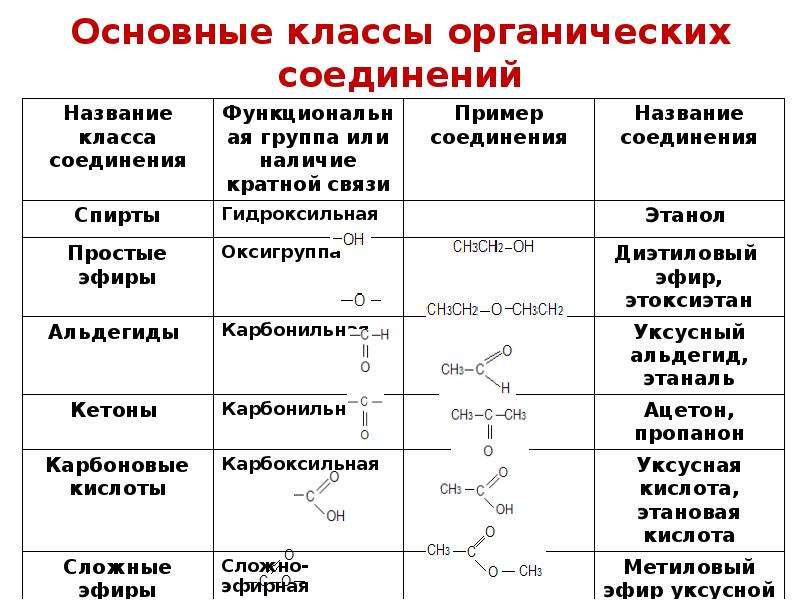 Смотрите подробности на странице программы в нужном вузе
Смотрите подробности на странице программы в нужном вузе
По окончании бакалавриата выпускники подготовлены к решению таких профессиональных задач как: выполнение вспомогательной профессиональной научной деятельности, которая включает подготовку объектов исследований, выбор технических средств и методов испытаний, проведение экспериментальных исследований по заданной методике, обработка результатов эксперимента, подготовка отчета о выполненной работе, а также педагогическая деятельность.
Дисциплины, изучаемые в рамках профиля:
- Бионеорганическая химия
- Неорганические соединения в растворах
- Основы препаративной химии
- Статистическая термодинамика
- Неорганические вещества в медицине
- Углеродные наноматериалы
- Основы лазерной химии
- Химия и физика функциональных материалов
- Химия ультрадисперсного состояния твердых веществ
- Химическая связь в органических соединениях
- Наноматериапы для медицины
- Химия океана
- Дополнительные главы органической химии
- Химическая кинетика, каталитические и мембранные процессы
- Теоретические основы органической химии
- Стереохимия и конформационный анализ органических соединений
- Физико-химические методы исследования органических веществ
- Твердофазный синтез пептидов
- Жидкостная хроматография
- Элементоорганическая химия переходных металлов
- Функциональные свойства полимеров
- Методы разделения и очистки и газовая хроматография
- Методы разделения и очистки природных соединений
- Основы физической органической химии
- Современные представления о молекулярных комплексах
- Основы высокотемпературной химии неорганических материалов
- Масс-спектральные термодинамические исследовани
- Структурная кристаллография
- Химические сенсоры
- Химический дизайн микро- и наноструктур
- Перспективные биоматериалы
- Теория химического сродства
Алканы, подготовка к ЕГЭ по химии
Органическая химия
Мы приступаем к новому разделу — органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать
наизусть, зубрить свойства органических веществ.
Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать
наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций ;)
В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает химическое строение.
- Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его свойствах.
- Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы
Алканы (парафины) — насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к
алифатическим углеводородам, так как не содержат ароматических связей.
Относятся к
алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями — содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда — CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen — имя + calare — созывать) — совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса «ан»: метан, этан, пропан, бутан и т.д.
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos -
соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
- Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.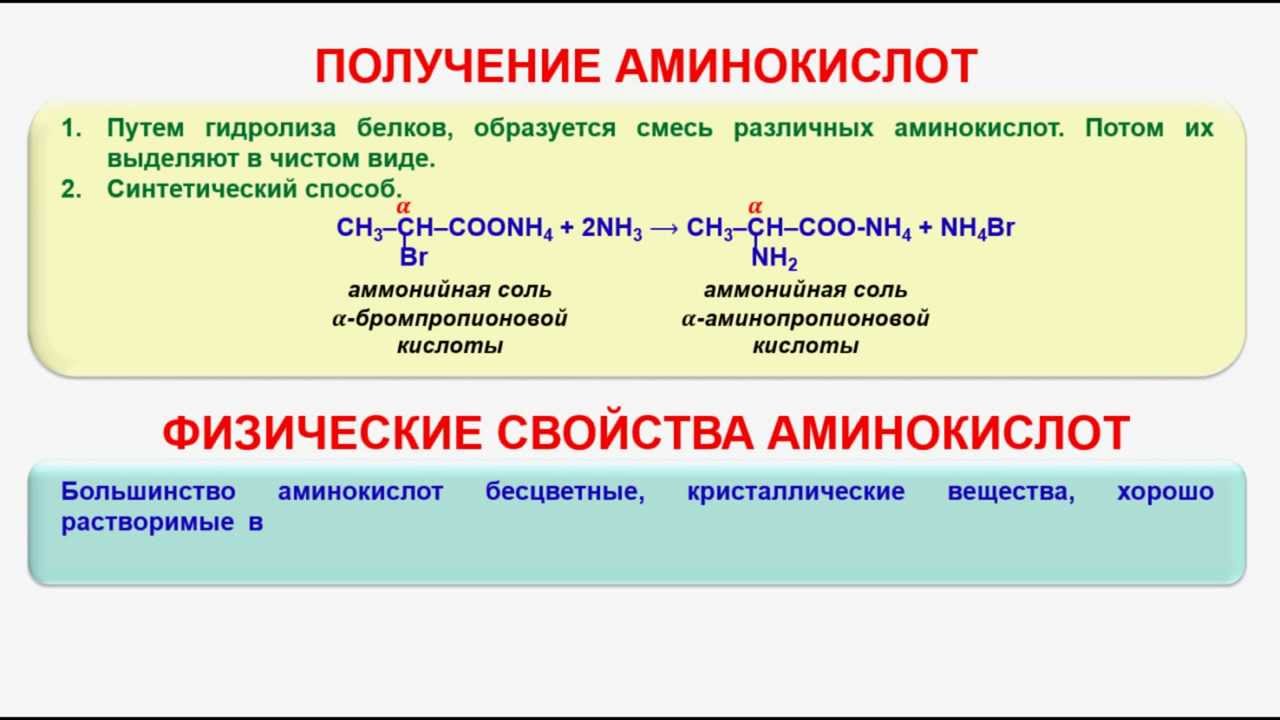
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
Изомерами (греч. isomeros — составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана
C5H12 существует 3 структурных изомера.
Для алканов возможна изомерия только углеродного скелета. Так у пентана
C5H12 существует 3 структурных изомера.
Некоторые данные, касающиеся алканов, надо выучить:
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода — sp3
- Валентный угол (между химическими связями) составляет 109°28′
Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем
крекинга из нефти получают алканы.
Путем
крекинга из нефти получают алканы.
Получение алканов
В промышленности алканы получают путем:
- Крекинга нефти
- Гидрогенизацией угля (торфа, сланца)
- Гидрированием оксида углерода II
В ходе крекинга нефти получается один алкан и один алкен.
C8H18 → C4H8 + C4H10
C12H26 → C6H12 + C6H14
C + H2 → (t, p) CH4
CO + H2 → (t, p, кат.) CH4 + H2O
В лабораторных условиях алканы получают следующими способами:
- Синтез Дюма
- Реакция Вюрца
- Синтез Гриньяра
- Синтез Кольбе
- Разложение карбида алюминия
- Гидрированием ненасыщенных углеводородов
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
CH3-CH=CH2 + H2 → (t, p, Ni) CH3-CH2-CH3
CH2=CH2 + H2 → (t, p, Ni) CH3-CH3
Химические свойства алканов
Алканы — насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для алканов характерны реакции замещения, а не присоединения.
- Галогенирование
- Нитрование (реакция Коновалова)
- Окисление
- Пиролиз
- Изомеризация
- Крекинг
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода,
чуть труднее — у вторичного и значительно труднее — у первичного.
Запомните, что легче всего идет замещение у третичного атома углерода,
чуть труднее — у вторичного и значительно труднее — у первичного.
Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
CH3-CH3 + HNO3(разб.) → CH3-CH2-NO2 + H2O
Для удобства и более глубокого понимания, азотную кислоту — HNO3 — можно представить как HO-NO2.
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
С3H8 + O2 → CO2 + H2O
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
CH4 + O2 → CH3-OH (метанол)
Пиролиз (греч. πῦρ — огонь + λύσις — разложение) — термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения — в отсутствии кислорода.
CH4 → (t > 1000°С) C + H2
CH4 → (t = 1500-1600°С) CH≡CH + H2↑
CH4 → (t = 1200°С, кат. ) CH2=CH2 + H2↑
) CH2=CH2 + H2↑
C2H6 → (t = 1200°С, кат.) CH2=CH2 + H2↑
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
C8H18 → (t) C4H10 + C4H8
C14H30 → (t) C7H14 + C7H16
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Органическая химия. Подготовка к контрольной работе № 2
1. Подготовка к контрольной работе № 2
Cnh3n+2СН3- СН2 — СН3
Cnh3n
СН2 ═ СН — СН3
Две двойных связи
Cnh3n-2
СН2 ═ СН — СН ═ СН2
Алкины
≡
Cnh3n-2
СН ≡ С — СН3
Арены
(ароматические
углеводороды)
Бензольное ядро
Алканы
–
одинарная связь
Алкены
═
двойная связь
Алкадиены (диены)
тройная связь
Cnh3n-6
С6Н6
Спирты
-ОН
гидроксил
Cnh3n+2О
Фенол
-ОН
гидроксил
С6Н5- ОН
Альдегиды
— С═ О
\
Н
СН3-ОН
Cnh3nО
СН3-С═ О
\
Н
карбоксил
Cnh3nО2
СН3- СООН
Сложные эфиры
-СОО- сложноэфирная
Cnh3nО2
СН3- СОО — СН3
Простые эфиры
-О-
Cnh3n+2О
СН3- О — СН3
Карбоновые кислоты -СООН
• Гомологи – вещества одного класса
(схожее строение и свойства),
различающиеся по составу на одну или
несколько групп СН2:
СН3 –СН3 и СН3 –СН2 – СН3
• Изомеры – вещества одинакового
состава, но разного строения,
отличающиеся по свойствам:
СН3 –СН2 – СН2 – ОН
СН3 –СН2 –О – СН3
У этих двух веществ одинаковый состав С3Н8О
4.
 Названия органических веществ строятся от названий алканов с тем же числом атомов углерода: СН4
Названия органических веществ строятся от названий алканов с тем же числом атомов углерода: СН4метан; СН3 – ОН метанол; Н- С═ О метаналь
\
Н
СН3 – СН3 этан; Ch3=Ch3 этен; CH ≡ CH этин; Ch4—Ch3OH этанол
СН3 – СН2 – СН3 пропан; СН2 = СН – СН3 пропен; СН ≡ С–СН3 пропин
СН3 – СН2 –СН2 – СН3 бутан; СН2 =СН –СН2 – СН3 бутен-1;
СН3 – СН =СН – СН3 бутен-2
СН3 – СН2 –СН2 – СН2 – СН3 пентан; СН3 – СН–СН2 – СН2 – СН3
|
пентанол-2
ОН
СН3 – СН2 –СН2 – СН2 – С = О
\
пентановая кислота
ОН
5. Углеводы
МоносахаридыС6Н12О6 – изомеры
Полисахариды:
Крахмал
Дисахариды
С12Н22О11 – сахароза
Целлюлоза
6. Жиры. Мыло
Жиры – это сложные эфиры глицерина и высших карбоновых
кислот:
Реакция образования жира (реакция этерификации)
радикалы, входящие в состав высших карбоновых кислот:
пальмитиновой (-С15Н31), стеариновой (-С17Н35), олеиновой (С17Н33), линолевой (-С17Н31) и др.

• Мыла – натриевые или калиевые соли высших карбоновых
кислот: C17h45COONa. Мыла получаются при гидролизе жиров в
присутствии щелочей:
7. Состояние атома углерода (тип гибридизации)
Связи, имеющиеся вуглеродном скелете
–
одинарная связь
суффикс
-ан
Пример
СН3 — СН2 — СН2 — СН3
Бутан
═
двойная связь
-ен
СН2 ═ СН — СН2 — СН3
Бутен-1
Две двойных связи
— диен
СН2 ═ СН — СН ═ СН2
Бутадиен-1,3
≡
тройная связь
— ин
СН ≡ С — СН2 — СН3
Бутин-1
Тип
гибридизации
sp³
Валентный угол 109º 28´
sp²
Валентный угол 120º
sp²
Валентный угол 120º
sp
Валентный угол 180º
8. Характерные реакции углеводородов:
Для алканов – замещение: Ch4 – Ch4 + Cl2 → Ch4 – Ch3Cl + HCl
Для алкенов, алкадиенов и алкинов – присоединение:
Ch3=Ch3 + Br2 → Br– Ch3—Ch3 – Br
Ch3=CH – CH=Ch3 + HCl → Ch4 – CH =CH –Ch3 –Cl
CH ≡CH + Н2 → Ch3=Ch3
Для аренов – замещение:
Для алкинов возможно замещение:
2HC ≡C—Ch4 + Ag2O → 2AgC ≡ C—Ch4↓ + h3O
2HC ≡CH + 2 CuCl →2HCl + CuC ≡ CCu↓
Для аренов возможно присоединение:
Гидрирование присоединение водорода
Галогенирование
… + Н2 →
… + Br 2 →
CH ≡CH + Н2 → Ch3=Ch3
Ch5 + Cl2 → Ch4Cl + HCl замещение
Ch3=Ch3 + Br2 → Br– Ch3—Ch3 – Br
Присоединение
Гидрогалогенирование
-присоединение
… + НCl→
Ch3=CH – Ch4 + HCl → Ch4 – CH –Ch4
|
Cl
… + НОН →
Ch3=Ch3 + HOН → Ch4—Ch3OH
… + НОН →
С12Н22О11 + HOН →С6Н12О6 + С6Н12О6
галогеноводорода
Гидратация –
присоединение воды
Гидролиз – разложение
вещества водой
Сахароза
глюкоза
фруктоза
Дегидрирование
-отщепление водорода
… → Н2 + …
Ch4 – Ch3– Ch4 → Ch4 – CH=Ch3 +h3
Дегидратация
-отщепление воды
… → НОН +
Ch4–Ch3–OH → СН2 = СН2 + h3O
Нитрование –введение
нитрогруппы NO2
… + НОNO2 →
CH 3-Ch4+ HОNO2 →Ch4 -Ch3+ h3O
Окисление (неполное)
… + [О] →
Ch3=Ch3 + [O] + HOН → HO-Ch3–Ch3-OH
Полимеризация
n … → (…) n
n Ch3=Ch3 → (—Ch3—Ch3—)n
Этерификация –
Спирт + кислота
C2H5OH + НООС-СН3 → С2Н5-ООС-СН3 + h3O
получение сложного эфира
|
NO2
10.
 Качественные реакции • На алкены, алкины, алкадиены – обесцвечивание бромной
Качественные реакции • На алкены, алкины, алкадиены – обесцвечивание бромнойводы:
Ch3=Ch3 + Br 2 → Br– Ch3—Ch3 – Br
– обесцвечивание раствора перманганата калия:
Ch3=Ch3 + [O] + HOН → HO-Ch3–Ch3-OH
На многоатомные спирты – растворение голубого осадка Cu(OH)2
и образование синего раствора
Ch3-OH
|
СН-ОН +
|
СН2 — ОН
СН2 -О
НО
|
\ Cu
\ Cu → CH – O /
НО/
|
СН2 — ОН
+ 2h3O
На фенол – образование фиолетовой окраски при взаимодействии с
FeCl3 :
С6Н5ОН + FeCl3 →(С6Н5О)3Fe + 3НCl
– с бромной водой (раствор обесцвечивается и выпадает белый
осадок):
С6Н5ОН + 3Br2 → С6Н2Вr3(ОН) +3НBr
11. Качественные реакции
На альдегиды – реакция серебряного зеркала:СН3-СН=О + Ag2O → СН3– СОOH + 2Ag
Образование красного осадка при нагревании с Cu(OH)2 :
СН3 — СН=О + 2Сu(ОН)2 → СН3- СООН + Cu2O + 2Н2O
На глюкозу – растворение голубого осадка
Cu(OH)2 без нагревания:
– реакция серебряного зеркала:
HOCh3(CHOH)4CH=O + Ag2O → HOCh3(CHOH)4COOH + 2Ag
— Образование красного осадка при нагревании с Cu(OH)2 :
НОСН2(СНОН)4СН=О + Cu(OH)2 НОСН2(СНОН)4СOОН +Cu2O + 2 h3O
На крахмал – образование синего окрашивания при добавлении йода
• Именные реакции:
Реакция Кучерова – получение уксусного альдегида
(ацетальдегида) гидратацией ацетилена (этина):
CH ≡ CH + HOН → Ch3=CH
→
Ch4 —C =O
│ изомеризация
\
ОН
H
Реакция Вюрца – получение алканов из галогенпроизводных:
СН3- Сl + 2 Na + Cl -Ch4 → 2 NaCl + СН3- Ch4
• Правило Марковникова – при присоединении молекул
галогеноводородов и других водородсодержащих веществ
несимметричного строения к молекулам непредельных
углеводородов водород присоединяется к наиболее
гидрогенизированному атому углерода:
Ch3=CH – Ch4 + HCl → Ch4 – CH –Ch4
|
Cl
13.
 Полимеры:
Полимеры: Получение полиэтилена, полипропилена:
n Ch3=Ch3 → (—Ch3—Ch3—)n полиэтилен
n Ch3=СН—Ch4 → n Ch3=СН → (—Ch3—CH—)n полипропилен
│
│
Ch4
Ch4
Получение синтетических каучуков:
nCh3=CH-CH=Ch3 → (-Ch3-CH=CH-Ch3-)n
каучук бутадиеновый
Природные полимеры – биополимеры
(C6h20O5)n– целлюлоза и крахмал
Получение искусственных полимеров химической обработкой
природных полимеров (биополимеров):
[C6H7O2(OH)3]n + 3nНОNО2 →[C6H7O2(ONO2)3]n + 3nН2О
нитроцеллюлоза – сырье для производства
целлулоида и пороха
[C6H7O2(OH)3]n + 3nСН3СООН → [C6H7O2(OCOCh4)3]n + 3nН2О
триацетат целлюлозы – сырье для
производства искусственного волокна –
ацетатного шелка
Учебная деятельность кафедры химии СибГМУ
Кафедра химии осуществляет подготовку студентов 1 курса лечебного (специальности «Лечебное дело», в том числе билингвальная форма обучения, отделение «Стоматология») и педиатрического факультетов; 1 и 2 курсов фармацевтического факультета, 1-4 курсов медико-биологического факультета (специальности «Медицинская биохимия», «Медицинская биофизика», «Медицинская кибернетика»), по дисциплинам: «Химия», «Химия биологически активных соединений», «Общая и неорганическая химия», «Органическая химия», «Физическая и коллоидная химия», «Неорганическая химия», «Органическая и физическая химия», «Физическая химия», «Физико-химия высокомолекулярных соединений», «Физико-химические методы анализа», «Основы хроматографического анализа», «Основы спектрального анализа».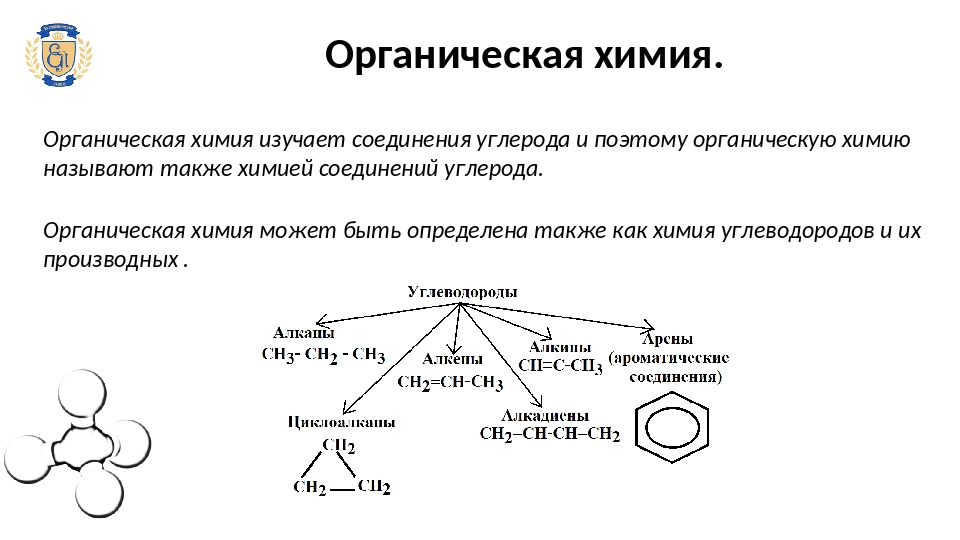
На кафедре реализуется подготовка студентов 3-5 курсов фармацевтического факультета по дополнительной профессиональной программе цикла повышения квалификации «Элитное фармацевтическое образование» по дисциплинам: «Методы исследования структуры лекарственных веществ», «Химические основы очистки и разделения веществ в фармацевтической технологии. Методы установления некоторых физико-химических констант», «Валидация методик и обеспечение достоверности анализа лекарственных средств», «Методы исследования параметров протекания органических реакций», «Стереохимия биологически активных веществ», «Квантово-химическое моделирование соединений и химических реакций», «Органический синтез лекарственных соединений», а также ведется руководство индивидуальными проектами по направлению «Исследование структуры и свойств растительных субстанций и биологически активных веществ природного происхождения».
Преподаватели кафедры химии осуществляют кураторство студентов 1 курса фармацевтического факультета.
На базе кафедры химии проводится подготовка студентов лечебного, фармацевтического и медико-биологического факультетов для участия в Международных, Российских и Региональных олимпиадах по химии. На протяжении последних 10 лет команда студентов СибГМУ занимает первые места.
Преподаватели кафедры химии проводят подготовку школьников и абитуриентов для сдачи экзаменов по химии и поступления в вузы, совмещая работу в центре довузовской подготовки СибГМУ.
На кафедре химии ведет свою деятельность научный студенческий кружок по химии, ежегодно кафедра химии проводит секцию «Актуальные вопросы химии» в рамках Всероссийской итоговой студенческой научной конференции имени Н.И. Пирогова.
образовательные ресурсы
Типовой учебный план
1 СЕМЕСТР
Неорганическая химия
Основы экологии
Высшая математика
Информацирнные. технологии
Интегрированный модуль «История»
Интегрированный модуль «Экономика»
Иностранный язык
Белорусский язык
Введение в специальность
Физическая культура
Библиотековедение
Иностранный язык
2 СЕМЕСТР
Неорганическая химия
Высшая математика
Информационные технологии
Физика
Иностранный язык
Интегрированный модуль «Философия»
Интегрированный модуль «Политология»
Латинский язык
Физическая культура
3 СЕМЕСТР
Аналитическая химия
Фармакогнозия
Физика
Информационные технологии в химии»
Органическая химия
Основы биологии и физиологии человека
Основы права
История ВОВ
Физическая культура
Военная подготовка
4 СЕМЕСТР
Органическая химия
Физическая химия
Физика
Фармацевтическая химия
Основы логики и методологии науки
Основы предпринимательства.
Физическая культура
Военная подготовка
5 СЕМЕСТР
Физическая химия
Электрохимия
Фармацевтическая химия
Коллоидная химия
Квантовая химия и строение молекул
Биологически активные низкомолекулярные соединения
Физическая культура
Военная подготовка
Основы предпринимательской деятельности.
Основы управления интеллектуальной собственностью
6 СЕМЕСТР
Физические методы исследования
Основы энергосбережения
Охрана труда
Строение вещества
Физико-химические методы анализа
Общая химическая технология
Общая фармакология
Биохимия
Свободные радикалы в химии, биологии и медицине
Избранные главы органической стереохимии
Физическая культура
Военная подготовка
7 СЕМЕСТР
ИМ «Экономика»
Физико-химические методы анализа
Биохимия
Общая фармакология
Коллоидная химия
Квантовая химия и строение молекул
Охрана труда
Физическая культура
Коррупция и ее общественная опасность
8 СЕМЕСТР
Защита населения и объектов от ЧС
Биохимия
Общая фармакология
Строение вещества
Основы управления интеллектуальной собственностью
Биоаналитика, Хемометрика
Свободные радикалы в химии, биологии и медицине
Физическая культура
Подготовительный курс по органической химии
В мире есть 2 типа людей:
- Те, кто готовит
- Те, кто этого не делает
Хорошо это или плохо, но если вы собираетесь изучать органическую химию, вы, вероятно, попадаете в категорию №1. Но как, черт возьми, подготовиться к одному из самых сложных занятий в колледже?
Но как, черт возьми, подготовиться к одному из самых сложных занятий в колледже?
Подготовительный курс Orgo Made Simple — это самый эффективный и действенный метод для подготовки к вашему классу O-Chem .У класса две цели:
- Мы гарантируем, что вы освоили основополагающие концепции , которые необходимы во всей органической химии.
- Мы даем вам раннее введение в темы, по которым наибольшее количество студентов бросает учебу. , давая вам поддержку, когда дела идут тяжело.
И, что самое главное, каждая тема преподается на легком для понимания языке Orgo Made Simple, что гарантирует истинное усвоение всех концепций.
Я искренне желаю, чтобы подготовительный курс Orgo Made Simple существовал до того, как я начал изучать органическую химию. Это сэкономило бы мне часы на изучение информации, бесполезной для органической химии, за лето, одновременно обучая меня материалу, который мне действительно нужно было знать.
Это сэкономило бы мне часы на изучение информации, бесполезной для органической химии, за лето, одновременно обучая меня материалу, который мне действительно нужно было знать.
Щелкните здесь, чтобы начать свой путь к отличной цене сегодня.
Что входит в курс?
Мы внимательно изучили первый семестр органической химии и выбрали (1) наиболее важные концепции и (2) концепции, из-за которых большинство студентов бросают учебу.2 лекции посвящены этим основополагающим концепциям и 2 лекции посвящены «отсеиваемым» темам.
Почему это лучший способ подготовки?
Команда Orgo Made Simple внимательно проанализировала первый семестр органической химии, выбрав как самые важные, так и самые сложные концепции в классе. Затем мы преподаем эти концепции нашим простым для понимания способом, работая с вами над созданием прочной основы химии.
Проще говоря, мы пролили этот материал и внимательно проанализировали сотни концепций. Мы выбрали самые важные из них, и мы позаботимся о том, чтобы вы их знали. В первый день лекции мы позаботимся о том, чтобы вы были наиболее подготовленным учеником в классе.
Подготовка к органической химии этой осенью
Отправлено 5 августа, 2017
Один из вопросов, который нам постоянно задают в StudyOrgo: «Как мне продвинуться в области органической химии в этом осеннем семестре?» Многие из вас слышали, что органическая химия — это жестокий урок, который мало что дает, кроме как снизить ваш средний балл.Хотя это правда, что этот курс сложный, мы здесь, в StudyOrgo, посвящаем себя тому, чтобы помочь вам получить «пятерку», которую вы заслуживаете!
Органическая химия получает дурную славу, потому что предполагает, что вы являетесь экспертом в отношении всей общей химии с первого года обучения, и теперь вы обязаны это знать! В качестве аналогии представьте, что ваши курсы химии — это пирамида для достижения вашей степени. Органическая химия находится прямо в середине пирамиды, она будет очень важна не только для экзаменов MCAT или DAT, но и для будущих продвинутых курсов.Органическая химия поддерживается General Chemistry, поэтому вы прошли ее в прошлом году. К счастью, StudyOrgo находится в центре вашей пирамиды, и мы здесь, чтобы ответить на все ваши вопросы по органической химии. Наши простые и четкие объяснения механизмов и концепций реакции легко помогут вам в решении любых проблем, с которыми вы можете столкнуться в этом семестре. Вот несколько советов, как подготовиться к курсу этой осенью.
Органическая химия находится прямо в середине пирамиды, она будет очень важна не только для экзаменов MCAT или DAT, но и для будущих продвинутых курсов.Органическая химия поддерживается General Chemistry, поэтому вы прошли ее в прошлом году. К счастью, StudyOrgo находится в центре вашей пирамиды, и мы здесь, чтобы ответить на все ваши вопросы по органической химии. Наши простые и четкие объяснения механизмов и концепций реакции легко помогут вам в решении любых проблем, с которыми вы можете столкнуться в этом семестре. Вот несколько советов, как подготовиться к курсу этой осенью.
- Откройте учебник — Прочтите название и аннотацию на первой странице каждой главы и проверьте количество страниц.Это даст вам очень быстрое представление о том, что вы будете изучать в каждой главе и сколько материала вы охватите.
- Посмотрите на учебный план — Помните, что ваш учебный план — это официальный договор между вами и профессором.
 Они должны раскрыть, что вам необходимо выучить и как вас будут оценивать. Профессора могут удалять требования, но не могут легко их добавить. Используйте это в своих интересах! Выделите содержание книги или реакцию на нее, которая потребуется, и используйте это, чтобы сосредоточить свое внимание во время обучения в течение семестра.
Они должны раскрыть, что вам необходимо выучить и как вас будут оценивать. Профессора могут удалять требования, но не могут легко их добавить. Используйте это в своих интересах! Выделите содержание книги или реакцию на нее, которая потребуется, и используйте это, чтобы сосредоточить свое внимание во время обучения в течение семестра. - Запланируйте учебу! — Теперь, когда вы знаете, где находится книга, и примерно представляете, за что вы отвечаете, изучая программу, возьмите календарь и разделите время, которое у вас есть на каждый тест, на количество глав. Запланируйте 2–3 часа в неделю на учебу и НЕ ПРОПУСКАТЬ ИЛИ ПЕРЕПИСЫВАТЬ . Думайте об этом как о приеме у врача или стоматолога — вам просто нужно это сделать! Кроме того, если вы планируете учебу заранее, у вас будет меньше шансов запланировать что-то, что мешает, потому что вы уже это написали карандашом! Используйте календарь на смартфоне, чтобы отправлять вам предупреждения и напоминания о назначенной учебе.
- Читать дальше — Если у вас есть время этим летом, прочитайте хотя бы две главы, чтобы опередить класс. Не пытайтесь понять все, просто обращайте внимание на используемые слова и идеи. Это позволит вам уделять больше внимания и задавать вопросы о деталях в классе вместо того, чтобы пытаться записывать заметки и рисунки.
- Зарегистрируйтесь в StudyOrgo — Редакторы StudyOrgo потратили много часов, просматривая и готовя материал самым кристально чистым и точным образом.Мы консультируемся со студентами и спрашиваем их мнение о том, понимают ли они изложенный материал. Мы предоставляем краткие описания и подробные объяснения механизмов. Многие из наших реакций содержат множество примеров, так что вы можете узнать, а затем проверить себя на нашем веб-сайте! Для студентов, которые постоянно находятся в движении, мы также разработали мобильное приложение (iOS и Android), обеспечивающее все функции веб-сайта! Все эти преимущества включены в ваше членство в StudyOrgo!
При небольшом распределении времени и помощи StudyOrgo у вас не будет проблем с получением пятерки по органической химии в году!
Получение карбоновых кислот
Реагенты Гриньяра реагируют с диоксидом углерода с образованием кислотных солей, которые при подкислении дают карбоновые кислоты.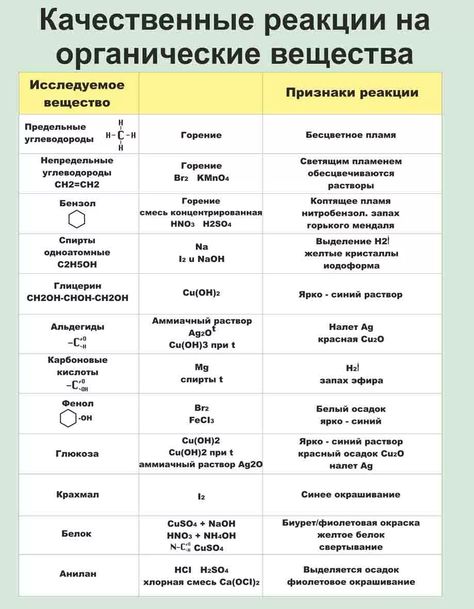
Сложный эфир ацетоуксусной кислоты , сложный эфир, образованный самоконденсацией этилацетата посредством конденсации Клайзена, имеет следующую структуру:
Водороды в метиленовом звене, расположенном между двумя карбонильными функциональными группами, являются кислыми из-за электроноакцепторных эффектов карбонильных групп. Один или оба этих атома водорода могут быть удалены реакцией с сильными основаниями.
Образующиеся карбанионы могут участвовать в типичных реакциях S N , которые позволяют размещать алкильные группы в цепи.
Гидролиз полученного продукта концентрированным раствором гидроксида натрия высвобождает натриевую соль замещенной кислоты.
Добавление водного раствора кислоты высвобождает замещенную кислоту.
Второй водород в метиленовом звене ацетоуксусного эфира также может быть заменен алкильной группой, образуя дизамещенную кислоту. Чтобы осуществить это превращение, продукт реакции на стадии 2, приведенной выше, должен вступить в реакцию с очень сильным основанием с образованием карбаниона.
Чтобы осуществить это превращение, продукт реакции на стадии 2, приведенной выше, должен вступить в реакцию с очень сильным основанием с образованием карбаниона.
Этот карбанион может участвовать в типичной реакции S N , позволяя разместить в цепи вторую алкильную группу.
Гидролиз с использованием концентрированного водного гидроксида натрия приводит к образованию натриевой соли двузамещенной кислоты.
Добавление водного раствора кислоты высвобождает двузамещенную кислоту.
Образовавшаяся кислота имеет метильную и этильную группы вместо двух атомов водорода уксусной кислоты, поэтому ее часто называют дизамещенной уксусной кислотой.
Если использовать разбавленный гидроксид натрия вместо концентрированного, образующийся продукт будет метилкетоном. Этот кетон возникает из-за того, что разбавленный гидроксид натрия имеет достаточную прочность для гидролиза сложноэфирной функциональной группы, но недостаточную силу для гидролиза функциональной группы кетона. Концентрированный гидроксид натрия достаточно силен, чтобы гидролизовать как функциональную группу сложного эфира, так и функциональную группу кетона, и, следовательно, образует замещенную кислоту, а не кетон.
Концентрированный гидроксид натрия достаточно силен, чтобы гидролизовать как функциональную группу сложного эфира, так и функциональную группу кетона, и, следовательно, образует замещенную кислоту, а не кетон.
Реакция между двузамещенным эфиром ацетоуксусной кислоты и разбавленным гидроксидом натрия дает следующие продукты:
При нагревании β-кетокислота становится нестабильной и декарбоксилатируется, что приводит к образованию метилкетона.
Конденсация этилацетата по Клайзену дает эфир ацетоуксусной кислоты.
Реакция конденсации Клайзена происходит путем нуклеофильного присоединения к сложноэфирной карбоксильной группе, которая включает следующие стадии:
Как подготовиться ко второму семестру по органической химии — Репетитор по органической химии
Органическая химия — наука чрезвычайно взаимосвязанная. В виде
вы уже видели в первом семестре курса органической химии,
одна тема связана с другой таким образом, что освоение последующих тем
очень сложно без овладения предыдущими. Прежде чем идти дальше, давайте посмотрим
по типичным темам органической химии первого семестра.
Прежде чем идти дальше, давайте посмотрим
по типичным темам органической химии первого семестра.
Типичная органическая химия 1 Темы
Есть много тем, которые вы обычно видите в первый семестр курса органической химии. Это:
- Номенклатура
- Кислотно-основное равновесие
- Связывание и резонанс
- Стереохимия
- Реакции замещения и отщепления
- Алкены и их реакции
Тогда есть некоторые «возможно» темы, которые могут быть в первых числах. или во втором семестре органической химии.Обычно это зависит от предпочтения преподавателя и учебник, который он использует. На основе моих собственных опыта, эти темы:
- Алкины и их реакции (обычно OChem 1)
- Спектроскопия (я бы сказал, что это соотношение 50/50 между первым и вторым семестром. последние годы.)
- Спирты, тиолы, простые эфиры, эпоксиды и сульфиды. (Чаще всего это тема семестра 1 -го .Но опять же, это действительно зависит от преподавателя и учебника).

Итак, я собираюсь убрать эти «возможно» темы из нашей разговор на данный момент и сосредоточьтесь только на тех, которые вы определенно видели в первый семестр. Если вы не совсем помните, о чем это все или, может быть, привыкли называть их по-другому, я вкратце перейду те, чтобы освежить вашу память.
Номенклатура
Это одна из тех тем, которая проходит через весь курс и появляется снова, когда мы начинаем каждую новую главу.Номенклатура — это язык органической химии, поэтому знание того, как правильно называть молекулы, важный. Некоторые инструкторы подчеркивают это больше, чем другие. Однако вы абсолютно хочу знать основы номенклатуры для любых стандартизированных экзамены типа MCAT или ACS.
Вывод: Номенклатура — это вид тему, которую полезно знать, но это не обязательно, если вы хотите преуспеть в второй семестр.
Кислотно-основное равновесие
Это большой.Хотя вы видели, что кислотно-щелочной
вопросы в первом семестре, обычно это были отдельные вопросы. в
по темам второго семестра вы будете использовать A cid- B ase C hemistry
(ABC) концепции очень часто как часть вопроса. Итак, если бы раньше мы
всегда указывайте, что вам нужно выбрать самую сильную кислоту, или ранжируйте их
кислоты, или найти лучшую основу и т. д., теперь мы будем ожидать, что вы сможете это сделать
самостоятельно. ТОГДА мы ожидаем, что вы воспользуетесь этой информацией для решения следующих
немного в проблеме.
в
по темам второго семестра вы будете использовать A cid- B ase C hemistry
(ABC) концепции очень часто как часть вопроса. Итак, если бы раньше мы
всегда указывайте, что вам нужно выбрать самую сильную кислоту, или ранжируйте их
кислоты, или найти лучшую основу и т. д., теперь мы будем ожидать, что вы сможете это сделать
самостоятельно. ТОГДА мы ожидаем, что вы воспользуетесь этой информацией для решения следующих
немного в проблеме.
Вывод: ABC обязательно! Итак, сделайте убедитесь, что вы освежите эти концепции в перерывах.
Связывание и резонанс
Помните все эти надоедливые резонансные структуры, которые вам приходилось рисовать для всех этих карбокатионов? Что ж, никуда они не денутся! Более того, вы будете использовать резонанс больше, чем даже во втором семестре по органической химии! Вы будете объяснять огромное количество реактивности и механизмов, используя резонансные структуры. Итак, убедитесь, что вы пересмотрели свои резонансные структуры и как с ними бороться.
Итак, убедитесь, что вы пересмотрели свои резонансные структуры и как с ними бороться.
Когда дело доходит до связи в целом, вы не собираетесь узнавать много новой информации. Это будут те же самые σ- и π-связи. В некоторой степени важно помнить о трехмерной ориентации орбиталей. Но это будут вопросы того же типа, что мы уже видели, имея дело с резонансом.
Однако, как и в случае с ABC, мы ожидаем, что вы применяйте концепции связи и резонанса для решения проблем! Те больше не будут отдельными вопросами.Итак, выявление резонанса структуры и распознавание различных моделей склеивания будет очень важно.
Заключение: Склеивание и резонанс являются обязательными для обзора.
Стереохимия
Хотя стереохимия важна, вы не увидите много ее во втором семестре. Ну да ладно, неправда. Позвольте мне перефразировать это. Вы не увидите ничего нового в отношении стереохимии среди тем второго семестра. Стереохимия всегда будет темой, которую вы захотите оставить в тени, поскольку она может всплыть в любой момент. Хотя большинство реакций, которые вы будете проводить во втором семестре по органической химии, не являются стереоспецифическими, они все же могут образовывать хиральные центры, поэтому вы должны проявлять бдительность.
Хотя большинство реакций, которые вы будете проводить во втором семестре по органической химии, не являются стереоспецифическими, они все же могут образовывать хиральные центры, поэтому вы должны проявлять бдительность.
Вывод: Стереохимия — это хорошо тема для рассмотрения, но это не будет решающим фактором, если вы немного припарковали в ней на начало семестра.
Замещение, отщепление и реакции алкенов
Темы, связанные с реакциями, на самом деле не «Фундаментальные» темы.Они строятся на таких фундаментальных принципах, как связь и ABC. Тем не менее важны реакции! Не ошибитесь, думая, что вы больше никогда не увидите алкены или спирты, потому что они были частью последнего семестр материал. Поскольку органическая химия создает новые темы поверх старых один, все , которые вы рассмотрели на сегодняшний день, — это честная игра. И да, мы ожидаем, что вы вспомните, что было изучено в прошлом семестре. И теперь кикер: нет, мы НЕ собираемся делать обзор первым семестр, так что все на вас!
Одна из основных задач органической химии — синтез
новых молекул. Вы можете рассчитывать на 3-5 шагов синтеза как на «обычный вторник» к
конец семестра. И эти синтезы будут кумулятивными. Так что если
вы устали от реакции в первом семестре, вам будет очень тяжело
с окончанием материала второго семестра. Я не собираюсь приукрашивать: если
вы не помните темы первого семестра, там очень высокий
шанс, что вы не справитесь с органической химией 2. По моему опыту, я не видел
одинокий студент, чтобы успешно сдать OChem 2 без приличной подготовки в
ОЧем 1 темы.
Вы можете рассчитывать на 3-5 шагов синтеза как на «обычный вторник» к
конец семестра. И эти синтезы будут кумулятивными. Так что если
вы устали от реакции в первом семестре, вам будет очень тяжело
с окончанием материала второго семестра. Я не собираюсь приукрашивать: если
вы не помните темы первого семестра, там очень высокий
шанс, что вы не справитесь с органической химией 2. По моему опыту, я не видел
одинокий студент, чтобы успешно сдать OChem 2 без приличной подготовки в
ОЧем 1 темы.
Вывод: пока вы будете учиться много новых реакций, не забывайте старые.
Я много говорил на темы первого семестра, но что о темах по органической химии второго семестра? Кем вы хотите стать покрытие? Как и в случае с OChem 1, есть некоторая «классика», которую все набирает во втором семестре:
- Ароматичность и реакции ароматических соединений
- Химия альдегидов и кетонов (плюс енолы и енолаты)
- Химия карбоновых кислот и их производных
- Амины и N-содержащие соединения
Вы также можете увидеть некоторые темы «может быть» что будет там
на основе учебной программы вашей школы и предпочтений преподавателя. Я говорил
об этом чуть ранее в этом посте. Вы также можете увидеть некоторые элементы
биохимия, такая как введение белков, углеводов и липидов. Так,
Какие темы OChem 1 будут наиболее актуальны для тем в OChem 2?
Я говорил
об этом чуть ранее в этом посте. Вы также можете увидеть некоторые элементы
биохимия, такая как введение белков, углеводов и липидов. Так,
Какие темы OChem 1 будут наиболее актуальны для тем в OChem 2?
Ароматические соединения и ароматичность
Резонанс, резонанс и многое другое! Ты будешь объяснение> 90% реакционной способности ароматических соединений через резонанс. Ароматный химия также является типичной первой (или одной из первых) тем, которые вы увидите в Ваш второй семестр курса органической химии.Итак, предлагаю вам обзор резонанс и связь перед началом семестра.
Химия альдегидов и кетонов
Здесь будет два основных филиала. Первый будет имеют дело с реакциями нуклеофильного присоединения к связи C = O. Итак, вы можете захотеть освежить в памяти концепции электрофилов и нуклеофилов, которые вы видели в главах о замене и устранении. Вы помните, что делает хорошее нуклеофил? Все это вам снова понадобится!
Вторая ветвь карбонильной химии будет заниматься
химия соседнего с C = O углерода (мы будем называть его α-углеродом или
α-положение).
Химия карбоновых кислот и их производных
Хотя вы увидите много разных реакций, они будут все очень похожи друг на друга. Это будет очень разнообразная глава, так что Я не могу выделить здесь ни одной наиболее важной «фундаментальной» темы.Вы увидите много азбуки, вы увидите некоторую связь и резонанс, будет много равновесия … оно будет повсюду. Но, как я уже упоминал, минуту назад реакции будут очень похожи друг на друга, и вы не будете изучать любые новые фундаментальные концепции на этом этапе.
Итак, в заключение, ваш список дел должен иметь следующие темы для рассмотрения:
Необходимо просмотреть
- Связывание и резонанс
- Кислотно-основное равновесие
Следует пересмотреть
- Реакции
- Стереохимия
Рана пригодна для проверки
- Номенклатура
- Спектроскопия (если вы рассмотрели ее в OChem 1)
Я также предлагаю вам отправить сообщение своему инструктору и спросить
им то, что они предлагают вам просмотреть.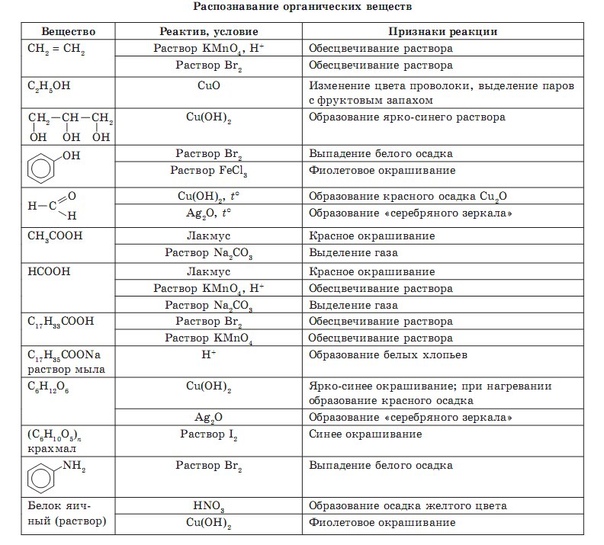 Хотя (по крайней мере, по моему опыту) они могут
просто скажу вам просмотреть свои старые заметки, не помешает спросить. Это особенно
важно, если в этом семестре у вас другой учитель или вы используете
другой учебник.
Хотя (по крайней мере, по моему опыту) они могут
просто скажу вам просмотреть свои старые заметки, не помешает спросить. Это особенно
важно, если в этом семестре у вас другой учитель или вы используете
другой учебник.
Приготовление органической жидкости | практические видео | 16–18 студентов | Практический
Все спецификации, предназначенные для учащихся 16–18 лет, включают некоторую форму синтеза чистой органической жидкости или твердого вещества. Учащимся необходимо понимать, что органический синтез может включать в себя несколько реакций, за которыми следуют этапы экстракции и очистки.
Заголовки глав: 00:10 Введение и обзор; 01:08 Приготовление: объединение концентрированной соляной кислоты с 2-метилпропан-2-олом; 02:07 Разделение: удаление водного слоя с помощью делительной воронки; 03:10 Очистка: сначала добавляют раствор гидрокарбоната натрия для удаления непрореагировавшей соляной кислоты; 04:43 Затем добавляют твердый безводный сульфат натрия (осушающий агент) для удаления любых следов воды; 05:25 Наконец, дистилляция отделяет образец от оставшегося реагента.
Заметки учителя
Полные заметки для учителя доступны в буклете вспомогательных ресурсов, включая идеи о том, как использовать это видео, и вспомогательные ресурсы как часть вашего обучения.
Это практическое занятие проводит учащихся через этапы подготовки, разделения и очистки органической жидкости. Весь процесс очистки, как правило, более сложен и сложен, чем подготовка в первую очередь, и учащиеся должны понимать, почему идея очистки так важна при создании химических соединений — ссылки на реальные примеры, такие как приготовление лекарств.
Это практическое занятие состоит из нескольких этапов, что дает учащимся хорошую возможность попрактиковаться в ряде экспериментальных техник и процедур. Помогите им связать разные ситуации и процессы, в которых используются одни и те же методы, например, делительная воронка используется всякий раз, когда у нас есть две несмешивающиеся жидкости, которые мы хотим разделить.
В многоэтапных экспериментах учащиеся могут бездумно следовать инструкциям, не останавливаясь, чтобы оценить химию, лежащую в основе каждого шага. Использование видео в качестве поддержки поможет учащимся чувствовать себя более уверенно в процедурах и лучше понять причину каждой задачи, прежде чем они начнут выполнять практические занятия — это поможет им сосредоточиться на навыках и развить понимание, когда они дойдут до этого.
Использование видео в качестве поддержки поможет учащимся чувствовать себя более уверенно в процедурах и лучше понять причину каждой задачи, прежде чем они начнут выполнять практические занятия — это поможет им сосредоточиться на навыках и развить понимание, когда они дойдут до этого.
Примечания для техника, включая список оборудования и указания по технике безопасности. Если вы планируете проводить практические занятия в классе, вам нужно будет провести собственную оценку рисков.
Дальнейшая практическая деятельность и другие ресурсы
Завершите процесс, проверив органический образец на чистоту с помощью тонкослойной хроматографии.
Сопутствующий эксперимент, основанный на приготовлении органического твердого вещества, показан в нашем эксперименте с экраном с аспирином — интерактивном эксперименте, в котором учащиеся проходят через экспериментальный процесс, прежде чем они опробуют его в лаборатории.
Предварительные знания
Видео и ресурсы предполагают следующие предварительные знания:
- Реакция нуклеофильного замещения спиртов.

- Метод разделения: делительная воронка, используемая для несмешивающихся жидкостей — полярных / неполярных растворенных веществ и растворителей — органический галогеналкан не связывается с водным растворителем, поэтому можно использовать делительную воронку.
- Часто используемые реагенты либо кислые, либо щелочные, и эта нейтрализация является важным шагом после того, как продукт нейтрализует любой непрореагировавший реагент.
- Дистилляция как метод разделения, когда интересующий нас продукт имеет температуру кипения, отличную от температуры кипения других соединений в смеси.
- Как пройти тест на хроматографию ТСХ (если учащиеся сделали только бумажную хроматографию, используйте это как основу с некоторым дополнительным обучением в то время).
Распространенные заблуждения
Имейте в виду, что учащиеся могут заблуждаться относительно этого практического занятия, например:
- Чистота в химии — это не то же самое, что чистота в других контекстах.
 Чистый элемент или соединение содержит только одно вещество, без каких-либо других примесей. Таким образом, чистая вода с химической точки зрения — это молекулы H 2 O, в которых ничего не смешано. Это не похоже на «реальный» взгляд на чистую воду, часто Имеется в виду вода из крана или горного источника — эти образцы воды будут содержать растворенные минералы, поэтому они не являются химически чистыми.
Чистый элемент или соединение содержит только одно вещество, без каких-либо других примесей. Таким образом, чистая вода с химической точки зрения — это молекулы H 2 O, в которых ничего не смешано. Это не похоже на «реальный» взгляд на чистую воду, часто Имеется в виду вода из крана или горного источника — эти образцы воды будут содержать растворенные минералы, поэтому они не являются химически чистыми. - Непонимание необходимости очистки . В случае жидкости видимые различные слои помогают ввести необходимость разделения продукта, но примеси остаются даже тогда, когда слои больше не видны, как показано на более поздних этапах этого практического занятия. Это заблуждение может быть больше проблемой для органических твердых веществ, поскольку образовавшийся сырой продукт представляет собой чистое вещество, хотя и содержит примеси, которые необходимо удалить. В первую очередь стоит разобраться, что и почему могут возникать примеси, чтобы не заучивать наизусть фразу «удалить примеси», не понимая, что это такое на самом деле.

- Учащиеся могут с трудом осознать, что каждая техника имеет цель и, следовательно, может использоваться в различных синтетических маршрутах — эти методы не ограничиваются только этой практикой. Чтобы бороться с этим, сосредоточьтесь на объяснении того, почему используется каждый метод, и отговаривайте учащихся от копирования механических процессов, не понимая, почему они делают каждый шаг.
Страница не найдена | Добавочный номер UC Berkeley
В этом заявлении объясняется, как мы используем файлы cookie на нашем веб-сайте.Для получения информации о том, какие типы личной информации будут собираться при посещении веб-сайта и как эта информация будет использоваться, см. Нашу политику конфиденциальности.
Как мы используем файлы cookie
Все наши веб-страницы используют файлы cookie. Файл cookie — это небольшой файл из букв и цифр, который мы помещаем на ваш компьютер или мобильное устройство, если вы согласны. Эти файлы cookie позволяют нам отличать вас от других пользователей нашего веб-сайта, что помогает нам обеспечить вам удобство при просмотре нашего веб-сайта и позволяет нам улучшать наш веб-сайт.
Эти файлы cookie позволяют нам отличать вас от других пользователей нашего веб-сайта, что помогает нам обеспечить вам удобство при просмотре нашего веб-сайта и позволяет нам улучшать наш веб-сайт.
Типы файлов cookie, которые мы используем
Мы используем следующие типы файлов cookie:
- Строго необходимые файлы cookie — они необходимы, чтобы вы могли перемещаться по веб-сайтам и использовать их функции. Без этих файлов cookie не могут быть предоставлены запрашиваемые вами услуги, такие как вход в учетную запись.
- Файлы cookie производительности — эти файлы cookie собирают информацию о том, как посетители используют веб-сайт, например, какие страницы посетители посещают чаще всего.Мы используем эту информацию для улучшения наших веб-сайтов и помощи в расследовании проблем, возникающих у посетителей. Эти файлы cookie не собирают информацию, идентифицирующую посетителя.
- Функциональные файлы cookie — эти файлы cookie позволяют веб-сайту запоминать сделанный вами выбор и предоставлять больше личных функций.
 Например, функциональный файл cookie можно использовать для запоминания товаров, которые вы поместили в корзину. Информация, собираемая этими файлами cookie, может быть анонимной, и они не могут отслеживать вашу активность на других веб-сайтах.
Например, функциональный файл cookie можно использовать для запоминания товаров, которые вы поместили в корзину. Информация, собираемая этими файлами cookie, может быть анонимной, и они не могут отслеживать вашу активность на других веб-сайтах.
Большинство веб-браузеров позволяют контролировать большинство файлов cookie через настройки браузера. Чтобы узнать больше о файлах cookie, в том числе о том, как узнать, какие файлы cookie были установлены, а также как управлять ими и удалять их, посетите https://www.allaboutcookies.org/.
Конкретные файлы cookie, которые мы используем
В приведенном ниже списке указаны файлы cookie, которые мы используем, и разъясняются цели, для которых они используются. Мы можем время от времени обновлять информацию, содержащуюся в этом разделе.
- JSESSIONID: этот файл cookie используется сервером приложений для идентификации уникального сеанса пользователя.
- registrarToken: этот файл cookie используется для запоминания товаров, которые вы добавили в корзину.
- locale: этот файл cookie используется для запоминания ваших языковых и языковых настроек.
- cookieconsent_status: этот файл cookie используется для запоминания, если вы уже отклонили уведомление о согласии на использование файлов cookie.
- _ga_UA — ########: эти файлы cookie используются для сбора информации о том, как посетители используют наш сайт. Мы используем эту информацию для составления отчетов и улучшения нашего веб-сайта.Файлы cookie собирают информацию в анонимной форме, включая количество посетителей веб-сайта, с которых посетители перешли на сайт, и страницы, которые они посетили. Эти анонимные данные о посетителях и просмотрах хранятся в Google Analytics.
Изменения в нашем Заявлении о файлах cookie
Любые изменения, которые мы можем внести в нашу Политику использования файлов cookie в будущем, будут опубликованы на этой странице.
Качественный анализ органических соединений.
Качественный анализ органических соединений.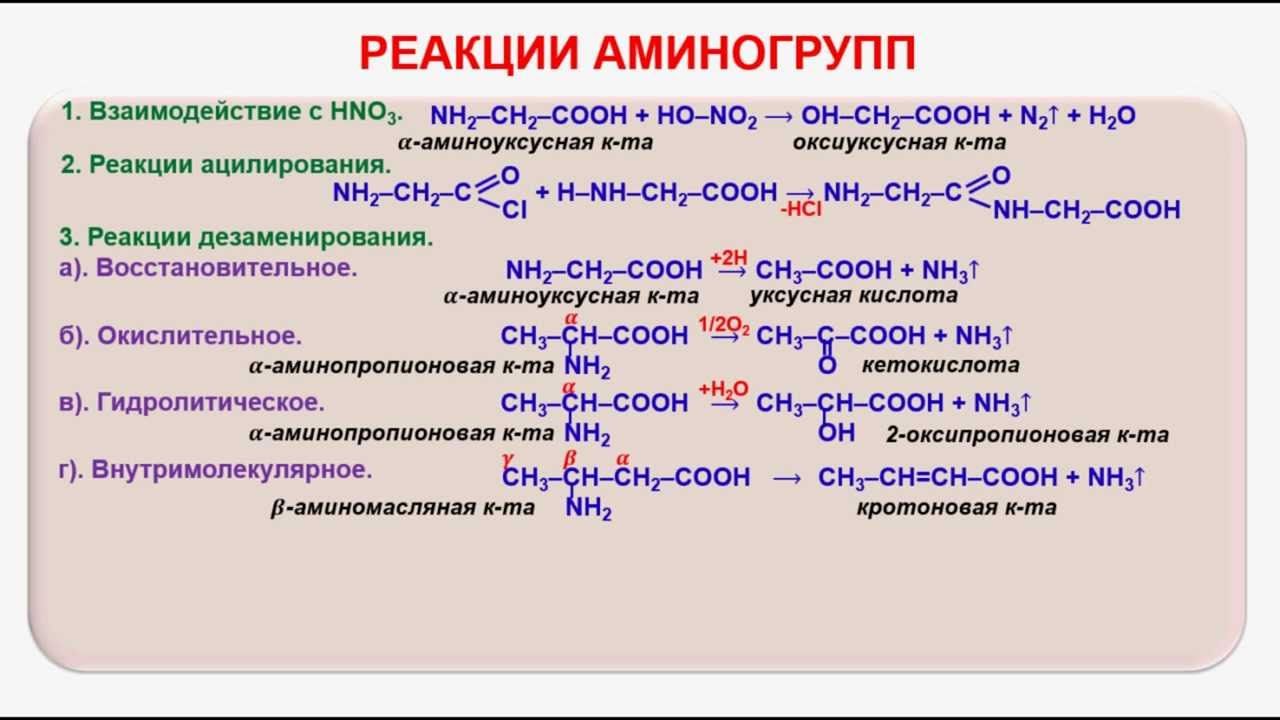
Качественный анализ органических соединений.
Анализ и идентификация неизвестных органических соединений составляет очень важный аспект экспериментальной органической химия.Не существует определенной процедуры, которая могла бы быть применяется к органическому качественному анализу. В различных книгах есть разные подходы, но системный подход, основанный на приведенная ниже схема даст хорошие результаты.
Студенты должны, однако, ознакомиться с руководством по лаборатории и Учебник практической органической химии, А.И. Фогель (4-й Версия).
Практические заметки
Прежде чем обрисовать общую схему, необходимо отметить один или два пункта. Следует отметить практическое значение.(а) Количества вещества для испытаний. Для большинства тестов о 0,1 г твердого вещества или 0,1 — 0,2 мл (2 — 3 капли) жидкого материала (НЕ БОЛЬШЕ).
(b) Реагенты, которые могут встретиться при анализе органических веществ, включены
полки с реагентами.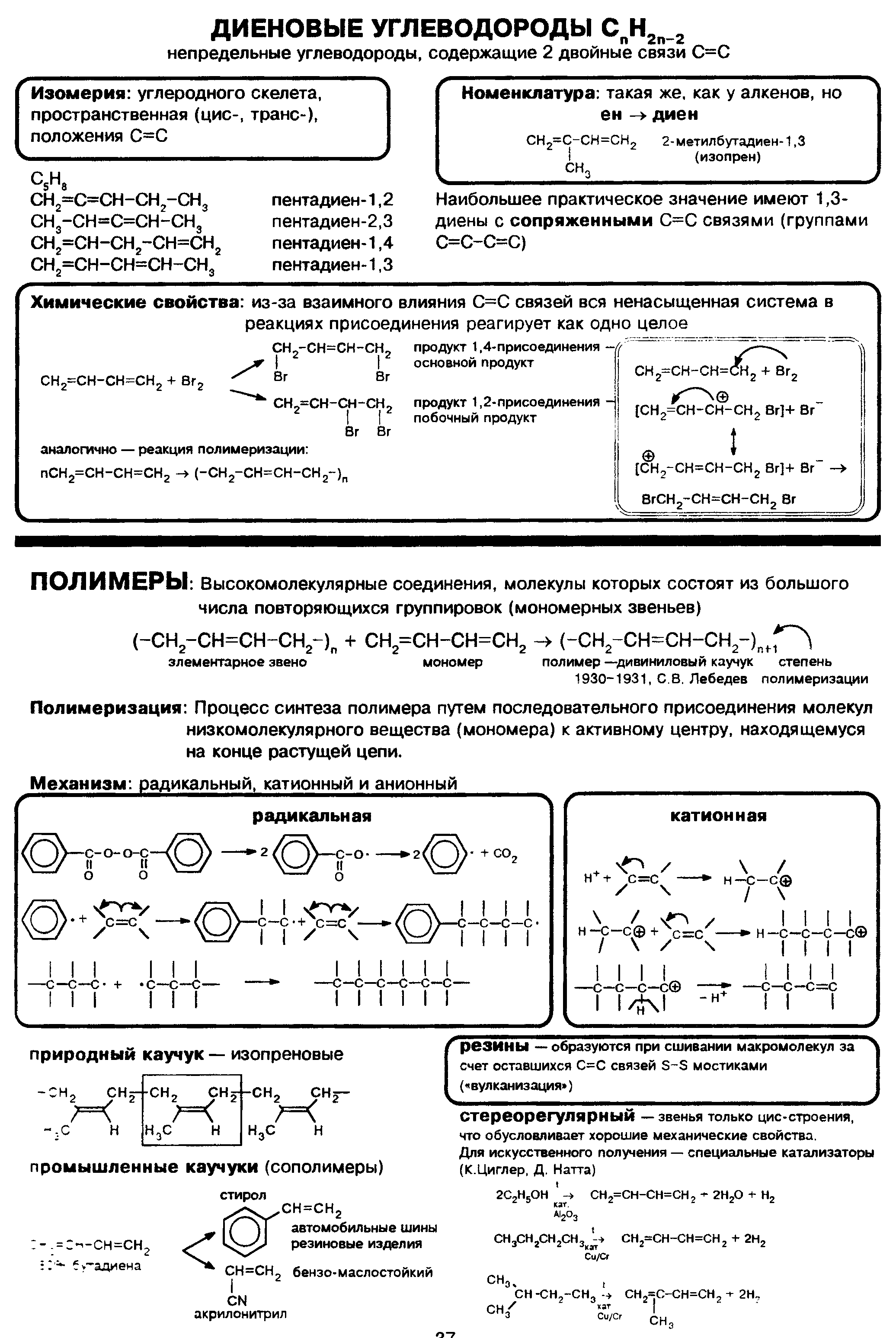 Студентам рекомендуется развивать общий
знание физических характеристик обычных органических
соединения.Если сомневаетесь в ожидаемом результате теста
между определенным соединением и реагентом провести пробный тест
с известным соединением и сравните с неизвестным.
Студентам рекомендуется развивать общий
знание физических характеристик обычных органических
соединения.Если сомневаетесь в ожидаемом результате теста
между определенным соединением и реагентом провести пробный тест
с известным соединением и сравните с неизвестным.
(c) Количество производных веществ. Студенты потратили впустую много времени и материала в прошлом, взяв слишком большое количество вещества для приготовления производного. В целом 0,5 — 1 г (или 0,5 — 1 мл) вещества дает наиболее удовлетворительный Результаты.
Если практическая книга предписывает использовать большие количества (3 — 4 г или более), количество следует уменьшить до 1 г или 1 мл неизвестного вещества и соответствующие количества следует использовать реагенты.
Общая схема анализа
А. Предварительные тесты(a) Обратите внимание на физические характеристики — твердое, жидкое, цветное и запах.
(b) Проведите испытание на зажигание (нагрейте металл небольшим количеством тепла). шпатель), чтобы определить, является ли соединение алифатическим или
ароматические (т.е. светящееся пламя — алифатическое; сажистое пламя —
ароматный).
шпатель), чтобы определить, является ли соединение алифатическим или
ароматические (т.е. светящееся пламя — алифатическое; сажистое пламя —
ароматный).
B. Физические константы
Определите температуру кипения или плавления.Дистилляция рекомендуется для жидкостей (см. Приложение 3). Это служит двойная цель определения b.p., а также очистки жидкости для последующих испытаний.
C. Анализ присутствующих элементов
На уровне C10 вам будут сообщены присутствующие элементы, но прочтите метод.
D. Испытания на растворимость
Растворимость неизвестного вещества в следующих реагентах предоставляет очень полезную информацию.Обычно около 3 мл растворитель используется с 0,1 г или 0,2 мл (2-3 капли) субстанция. Класс соединения может быть указан из следующая таблица:
ТАБЛИЦА РАСТВОРИМОСТИ
| РЕАГЕНТ И ТЕСТ | КЛАСС | ГРУППА СОЕДИНЕНИЙ |
Растворим в холоде или
горячая вода. (Если неизвестное
растворимый НЕ
выполните нижеприведенные испытания на растворимость) (Если неизвестное
растворимый НЕ
выполните нижеприведенные испытания на растворимость) |
Нейтральный, кислый или базовый.(Тест с лакмусовая или универсальная индикаторная бумага) | Нижние члены серии. Нейтральный, например спирты; Кислый, например кислоты, фенолы; Базовый, например амины | Растворим в дил. HCl | Базовый | Большинство аминов (кроме III амины с только ароматическими группами |
| Растворим в дил. NaOH | Кислый | Большинство кислот, большинство фенолов. |
| Растворим в NaHCO 3 | Сильно кислый | Большинство карбоновых кислот. |
| не растворим в воде, кислота и щелочь | нейтральный | Углеводороды, нитрогидроуглероды, алкил или арил галогениды, сложные эфиры и простые эфиры. Спирты, альдегиды и кетоны с более высокой молекулярной массой |
E.
 Групповые классификационные тесты
Групповые классификационные тесты
Из предыдущих тестов часто можно вывести функциональные группы, присутствующие в неизвестном соединении.Проконсультируйтесь с i.r. спектры при их наличии.
Затем выполняются отдельные тесты для выявления и подтверждения присутствующие функциональные группы.
ПРИМЕЧАНИЕ:
1. Студентам настоятельно не рекомендуется выполнять ненужные тесты, так как они не только пустая трата времени, но и увеличивают возможность ошибки. Таким образом, бессмысленно сначала проверять спирт или кетон в основном соединении, содержащем азот! Вместо тестов на амины и т. Д.надо делать на таком компаунде.2. Системный подход в группе сложно переоценить. классификационные тесты, чтобы избежать путаницы и ошибок.
F. Консультации по литературе
После определения функциональной группы ссылка
внесены в таблицы в книге по органическому анализу для оценки
возможности и для приготовления подходящего твердого
производные.
Следует отметить, что хотя два вещества с одинаковым функциональная группа может иногда иметь очень похожие b.п. или т.пл., твердые производные обычно можно выбрать из литературы, при этом m.p. различий около 10 (или более), которые различают две возможности.
Пример:
СОЕДИНЕНИЕ Б.П. ПРОИЗВОДНЫЕ (М.П.)
2,4-ДНФ ПОЛУКАРБАЗОН
Диэтилкетон 102 156 139
Метил-н-пропилкетон 102 144 112
Г.Приготовление производных
Окончательная характеристика неизвестного дана получение подходящих твердых производных. Производная должна быть тщательно отобранным и его т.пл. предпочтительно должно быть между 90 — 150 для облегчения кристаллизации и т.пл. определение.
Следует попытаться получить одну производную. В производное следует очистить перекристаллизацией, высушить и m.p. определенный. Деривативы должны подаваться правильно помечены для оценки вместе с записью.
Запись результатов
Результаты следует регистрировать систематически. Результаты
должны быть записаны в практическую тетрадь в то время (не записываются
вверх потом).
Результаты
должны быть записаны в практическую тетрадь в то время (не записываются
вверх потом).
Следует регистрировать каждое проведенное испытание, независимо от того, ПОЛУЧЕН ли ОТРИЦАТЕЛЬНЫЙ РЕЗУЛЬТАТ .
Должны быть даны испытания, наблюдения и заключения.
По завершении анализа краткое изложение результатов. следует включить, указав имя, b.п. или т.пл., и формула анализируемое соединение.
Качественный анализ элементов (только для справки)
В органических соединениях элементы, обычно встречающиеся с углеродом и водородом, кислород, азот, сера, хлор, бром и йод. Обнаружение этих элементов зависит от их преобразования в водорастворимые ионные соединения и применение специальных тестов.
Тест на синтез натрия Лассеня
C, H, O, N, S, X NaX
NaCN
-> Na2S
NaCNS
ПРОЦЕДУРА
Поместите кусок чистого металлического натрия размером с горошину. в термоядерную трубку.Добавьте немного соединения (50 мг или 2–3
капель). * Сначала осторожно нагрейте трубку, чтобы
образуется, чтобы упасть обратно на расплавленный натрий. Когда начинается обугливание,
нагрейте дно тюбика до тусклого покраснения около трех
минут и, наконец, погрузите еще горячую трубку в
чистую посуду с холодной дистиллированной водой (6 мл) и крышку
немедленно чистой проволочной сеткой. **
в термоядерную трубку.Добавьте немного соединения (50 мг или 2–3
капель). * Сначала осторожно нагрейте трубку, чтобы
образуется, чтобы упасть обратно на расплавленный натрий. Когда начинается обугливание,
нагрейте дно тюбика до тусклого покраснения около трех
минут и, наконец, погрузите еще горячую трубку в
чистую посуду с холодной дистиллированной водой (6 мл) и крышку
немедленно чистой проволочной сеткой. **
* Для жидкостей лучше сначала расплавить натрий, добавить жидкость по капле.
** ВНИМАНИЕ: Трубка разлетится, а остатки металлического натрия реагирует с водой. Перемешать, кипятить 1-2 мин. штатив и фильтр горячим через рифленую бумагу.
«плавленый» фильтрат, который должен быть прозрачным и бесцветным, используется для СПЕЦИАЛЬНЫХ ИСПЫТАНИЙ, ОПИСАННЫХ НИЖЕ:
1. К порции (2 мл) «плавленого» фильтрата добавить 0,2 г
порошкообразные кристаллы сульфата железа (II). Варить смесь полторы
минут, охладите и подкислите, добавив разбавленную серную кислоту
по каплям. Образование голубовато-зеленого осадка (берлинская лазурь).
или синий раствор указывает на то, что исходное вещество содержит
азот. Если осадка не выпало, дать постоять 15
минут, отфильтруйте и осмотрите фильтровальную бумагу.
Образование голубовато-зеленого осадка (берлинская лазурь).
или синий раствор указывает на то, что исходное вещество содержит
азот. Если осадка не выпало, дать постоять 15
минут, отфильтруйте и осмотрите фильтровальную бумагу.
2. СЕРЫ (СУЛЬФИДНАЯ)
К фильтрату холодного «плавления» (1 мл) добавить несколько капель холода,
свежеприготовленный разбавленный раствор нитропруссида натрия. В
последний может быть получен добавлением небольшого кристалла твердого вещества к
2 мл воды.Получение насыщенного пурпурного цвета указывает на то, что
исходное вещество содержит серу. Этот тест очень
чувствительный. Значимы только сильные положительные результаты.
3. ГАЛОГЕНЫ (ГАЛИДЫ)
Подкислите часть (1 мл) фильтрата «плавленого» с помощью 2н азотной кислоты.
кислоты, и, если присутствуют азот и / или сера, кипятить 1-2 раза.
минут. * Охладите и добавьте водный раствор нитрата серебра (1 мл), сравните
с пробелом. Образование тяжелого белого или желтого осадка. галогенида серебра означает галоген.Если положительный результат
Получено: подкисить оставшуюся часть фильтрата «плавления»
разбавленной серной кислотой, вскипятить и остудить. Добавить углерод
тетрахлорид (1 мл) и несколько капель свежеприготовленного хлора
вода. Смесь встряхнуть.
галогенида серебра означает галоген.Если положительный результат
Получено: подкисить оставшуюся часть фильтрата «плавления»
разбавленной серной кислотой, вскипятить и остудить. Добавить углерод
тетрахлорид (1 мл) и несколько капель свежеприготовленного хлора
вода. Смесь встряхнуть.
(а) Если слой четыреххлористого углерода остается бесцветным: указывает на хлор.
(b) Если слой четыреххлористого углерода коричневый — означает бром.
(c) Если слой четыреххлористого углерода фиолетовый — означает йод.
* Если также присутствуют азот и / или сера, добавление нитрат серебра в подкисленный раствор «плавления» будет осаждают цианид серебра и / или сульфид серебра в дополнение к галогениды серебра. Удаление цианистого водорода и / или Сероводород получают путем кипячения «плавленого» раствора. ГРУППОВЫЕ КЛАССИФИКАЦИОННЫЕ ИСПЫТАНИЯ
Некоторые тесты функциональных групп перечислены ниже. Студенты должны
обратитесь к практическому пособию для получения подробной информации, а также
информация, e. г. Фогель.
г. Фогель.
Тесты на ненасыщенность
1. Холодный разбавленный раствор перманганата калия.
2. Раствор брома в четыреххлористом углероде.
Испытания соединений, содержащих азот
1. Амины
(а) Азотистая кислота.
(б) Подтверждающие тесты.
2. Соединения, дающие амины или аммиак в кислотной или щелочной среде.
гидролиз:
Амиды, замещенные амиды, анилиды, нитрилы.
3.Соединения, дающие амины при восстановлении:
Нитро, нитрозо, азо, гидразо, нитрилы.
Испытания на соединения, содержащие C, H и, возможно, кислород
1. Карбоновые кислоты
Раствор Na2CO3 или NaHCO3 выделяет углекислый газ.
2. Фенолы
(а) Раствор гидроксида натрия (растворимый). Нерастворим в СО2 и не содержит его.
из NaHCO3 (кроме случаев, когда присутствуют группы, притягивающие электроны, например,
2,4-динитрофенол).
(б) Раствор хлорида железа.
(c) Бромная вода.
3. Альдегиды и кетоны
(а) 2,4-динитрофенилгидразин (в качестве реагента Брэди) для
С = О.
(б) Йодоформный тест на Ch4CO-.
4. Только альдегиды (восстанавливающие свойства)
(а) Решение Фелинга.
(б) Реагент Толлена (аммиачный раствор AgNO3).
(c) Реагент Джонса.
5. Спирты
(а) Реагент Лукаса для различения спиртов I, II и III.
(б) Реагент Джонса.
(c) Металлический натрий (используйте сухую жидкость и сухую трубку).
6. Сахар
(а) Тест Молиша.
7. Сложные эфиры
(а) Тест с гидроксамовой кислотой.
(б) Гидролиз.
Запишите идентификацию неизвестного органического соединения
Дата......................................
Соединение, содержащее C, H (N, Hal, S)
Физические характеристики ...................... (твердое вещество, жидкость, газ, цвет, запах и т. д.)
Испытание на воспламенение .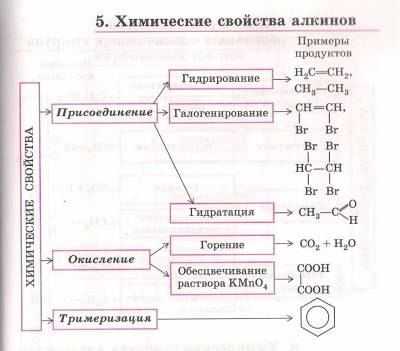 ............................. (ароматическое или алифатическое)
Физическая константа ........................ (точка кипения или точка плавления)
Тесты на растворимость (в табличной форме)
Групповые классификационные тесты (в табличной форме)
Вывод наблюдений теста
Из приведенных выше тестов и наблюдений данное соединение, вероятно, является
......................... (кислота, фенол, альдегид и др.)
Консультация по литературе (Возможности) М.П. производной
а)
(б)
(c)
Приготовление производной (способ приготовления)
Наблюдаемая т.пл. производной
Лит. m.p. производной
Результат
Соединение № ........................ это ...................... ......
(дайте формулу)
............................. (ароматическое или алифатическое)
Физическая константа ........................ (точка кипения или точка плавления)
Тесты на растворимость (в табличной форме)
Групповые классификационные тесты (в табличной форме)
Вывод наблюдений теста
Из приведенных выше тестов и наблюдений данное соединение, вероятно, является
......................... (кислота, фенол, альдегид и др.)
Консультация по литературе (Возможности) М.П. производной
а)
(б)
(c)
Приготовление производной (способ приготовления)
Наблюдаемая т.пл. производной
Лит. m.p. производной
Результат
Соединение № ........................ это ...................... ......
(дайте формулу)
ИСПЫТАНИЯ ДЛЯ ФУНКЦИОНАЛЬНЫХ ГРУПП
Я.НЕНАСЫЩЕННЫЕ СОЕДИНЕНИЯ Двумя распространенными типами ненасыщенных соединений являются алкены и
алкины, характеризующиеся двойным и тройным углерод-углеродным
связь, соответственно, как функциональная группа. Два общих
качественными тестами на ненасыщенность являются реакции
соединения с (а) бромом в четыреххлористом углероде и (б)
перманганат калия.
Два общих
качественными тестами на ненасыщенность являются реакции
соединения с (а) бромом в четыреххлористом углероде и (б)
перманганат калия.
(a) 2% брома в четыреххлористом углероде
Растворите 0,2 г (или 0,2 мл) соединения в 2 мл углерода.
тетрахлорид или другой подходящий растворитель и добавить раствор
по каплям в 2 мл 2% раствора брома в четыреххлористом углероде
и встряхнуть.
например
Быстрое исчезновение цвета брома с образованием бесцветного раствор — положительный тест на ненасыщенность.
ПРИМЕЧАНИЕ: Реагент потенциально опасен. Оставь это
с кожи и одежды; защитите глаза и нос.
(b) 2% водный перманганат калия
Растворите 0,2 г (или 0,2 мл) вещества в 2 мл воды.
(в качестве растворителя также можно использовать ацетон). Добавьте калий
раствор перманганата по каплям и наблюдайте за результатом.
например
Для пустого определения подсчитайте количество капель, добавленных к
2 мл ацетона, пока цвет не исчезнет. Значительный
разница в количестве капель, необходимых в двух случаях, составляет
положительный тест на ненасыщенность.
Значительный
разница в количестве капель, необходимых в двух случаях, составляет
положительный тест на ненасыщенность.
II. СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ АЗОТ
1. Амины
(а) Реакция с азотистой кислотой Растворите амин (0,5 мл) в
концентрированная кислота (2,0 мл) и вода (3 мл) и охлаждают раствор.
до 0-5 на ледяной бане в течение 5 минут.Добавьте холодный раствор
(ледяная баня) нитрита натрия (0,5 г) в воде (2,0 мл) из
капельница, с завихрением пробирки, все еще сохраняя
смесь на ледяной бане.
РЕАКЦИЯ АМИНА
У меня алифатический N2 эволюционировал.
RNh3 + HNO2 -> ROH + N2 + h3O
__________________________________________________________________
Образуется ароматическая соль диазония I.ArNh3 + HNO2 -> ArN = N +
Добавьте холодный раствор диазония и при перемешивании
к холодному раствору 2-нафтола (0,2 г) в 5% NaOH
раствор (2 мл). Образуется оранжево-красный азокраситель. __________________________________________________________________
II алифатические и желтые маслянистые нитрозамины обычно образуются.II ароматический R2NH + HNO2 -> R2N-NO
__________________________________________________________________
III алифатический Нет видимой реакции.
__________________________________________________________________
III ароматические диалкиланилины дают зеленый твердый п-нитрозо
соединения (если p-положение незамещено).
__________________________________________________________________
__________________________________________________________________
II алифатические и желтые маслянистые нитрозамины обычно образуются.II ароматический R2NH + HNO2 -> R2N-NO
__________________________________________________________________
III алифатический Нет видимой реакции.
__________________________________________________________________
III ароматические диалкиланилины дают зеленый твердый п-нитрозо
соединения (если p-положение незамещено).
__________________________________________________________________
(b) Реакция с бензолсульфонилхлоридом
Бензолсульфонилхлорид реагирует с первичными и вторичными, но не с третичными аминами с образованием замещенных сульфонамидов.
например (а) C6H5SO2Cl + H-NHR + NaOH -> C6H5SO2NHR + NaCl + h3O (б) C6H5SO2Cl + H-NR2 + NaOH -> C6H5SO2NR2 + NaCl + h3O.Замещенный сульфонамид, образованный из первичного амина растворяется в щелочной среде, а образующийся из вторичный амин нерастворим в щелочи.
Поместите 0,5 мл (или 0,5 г) соединения, 15-10 мл 5% NaOH. и 1 мл бензолсульфонилхлорида в пробирке, закрыть трубку и встряхивайте, пока не исчезнет запах сульфонилхлорида. исчезнувший.Раствор необходимо поддерживать щелочным (если реакции нет. произошло, вероятно, это третичный амин).
Если в щелочном растворе появился осадок, разбавить около 10 мл воды и взболтать; если не выпадет осадок растворяется, появляется вторичный амин.
Если осадка нет, осторожно подкислить до конго красного. с концентрированной соляной кислотой (добавляют по каплям): a осадок указывает на первичный амин.
2. Амиды R-CO-Nh3
Простые первичные амиды можно разложить кипячением с щелочью.
и тем самым выделяя аммиак.
например Ch4-CO-Nh3 + NaOH -> Ch4-CO2- Na + + Nh4
Кипятить 0,5 г соединения с 5 мл 10% гидроксида натрия.
раствора и наблюдайте, выделяется ли аммиак.
III. СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ C, H И ВОЗМОЖНО КИСЛОРОД
1.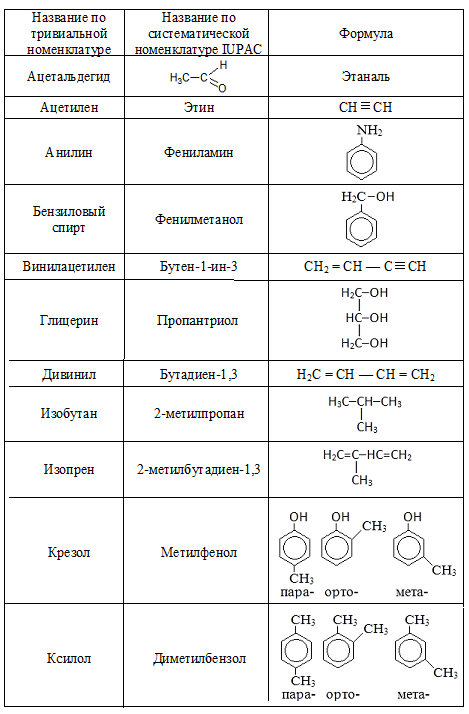 Карбоновые кислоты — тест с 5% водн. NaHCO3
Карбоновые кислоты — тест с 5% водн. NaHCO3
R-CO2H + NaHCO3 -> R-CO2- Na + + CO2 + h3OГидрокарбонат натрия реагирует с карбоновыми кислотами с образованием натриевая соль кислоты и высвобождает диоксид углерода. Если кислота нерастворима в воде и реакция растворяется медленно. кислоту в метаноле и осторожно добавьте к насыщенному раствору натрия. раствор гидрокарбоната, когда будет бурное вскипание наблюдаться.
2. Фенолы [растворимы в NaOH и не производят CO2 из
NaHCO3]
(а) Бромная вода
Фенолы обычно очень реактивны по отношению к электрофильным веществам.
реагенты и легко бромируются бромной водой. например
Растворить или суспендировать около 0,05 г соединения в 2 мл
разбавить соляную кислоту и по каплям добавлять бромную воду до
цвет брома сохраняется. Белый осадок бромфенола
может образоваться.Твердые производные бромфенола могут быть использованы для
подтверждение структуры фенола (см. получение
производные).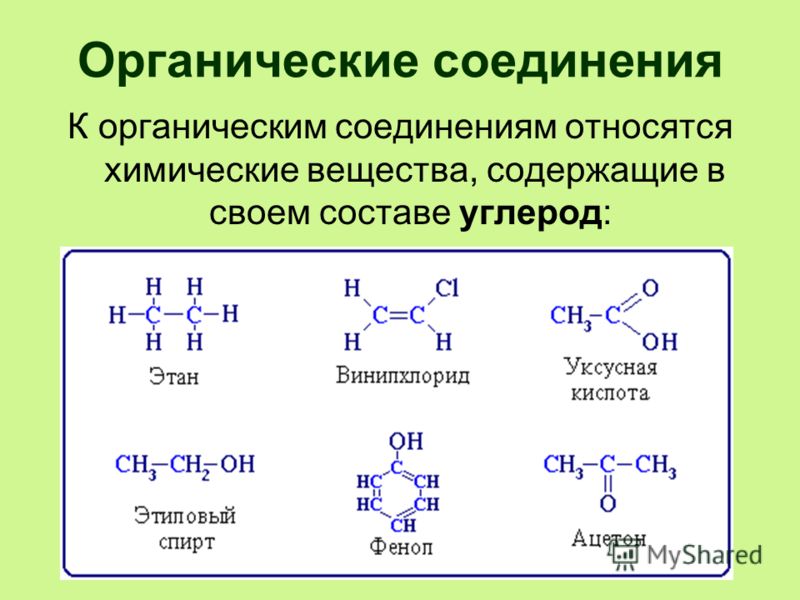
(b) Тест с хлоридом железа
Большинство фенолов реагируют с хлоридом железа (III) с образованием окрашенных
комплексы. Цвета различаются — красный, фиолетовый, синий или зеленый —
в зависимости от различных факторов, например используемое фенольное соединение,
растворитель, концентрация. Поскольку некоторые фенолы не дают
цвета, отрицательный результат не может считаться значимым без
Вспомогательная информация.
Растворите 0,05 г соединения в 2 мл воды (или смеси воду и этанол, если соединение не растворяется в воде) и добавьте водный раствор хлорного железа по каплям. Соблюдайте любые возможны изменения цвета.
3. Альдегиды и кетоны
(а) 2,4-Динитрофенилгидразин (в качестве реагента Брэди) Тест на
карбонильная группа (C = O) в альдегидах и кетонах.
2,4-Динитрофенилгидразин дает труднорастворимый желтый или красный цвет.
2,4-динитрофенилгидразоны с альдегидами и кетонами.
Добавьте 3 мл реагента к 2 каплям соединения в тесте. тюбик и встряхните. Если сразу не образуется осадок, нагреть и
дать постоять 5-10 минут. Кристаллический осадок
указывает на присутствие карбонильного соединения.
тюбик и встряхните. Если сразу не образуется осадок, нагреть и
дать постоять 5-10 минут. Кристаллический осадок
указывает на присутствие карбонильного соединения.
Настольный реагент очень разбавлен и предназначен для
только качественные тесты и не должны использоваться при приготовлении
производного инструмента для целей идентификации. (б) Йодоформный тест
для Ch4CO-
Растворить 0.1 г (или 5 капель) соединения в 2 мл воды; если
нерастворим в воде, добавьте достаточно диоксана для получения
однородный раствор. Добавьте 2 мл 5% раствора NaOH, а затем
вводят по каплям йодид калия — йодный реагент с
встряхивание до тех пор, пока не будет сохраняться определенный темный цвет йода. Разрешить
постоять 2 — 3 минуты; если в комнате не выделяется йодоформ
температуры, прогрейте пробирку в стакане с водой до 60 ° С. Добавлять
еще несколько капель йодного реагента, если йодный цвет слабый
исчезает.Продолжайте добавлять реагент до темноты.
цвет не исчезает после 2 минут нагревания при 60. Удалять
избыток йода путем добавления нескольких капель разбавленного
раствор гидроксида натрия при встряхивании, разбавить равным
объем воды и дать постоять 10 минут. Тест
положительный, если выпал желтый осадок йодоформа. Фильтр
от желтого осадка, высушить на подушечках фильтровальной бумаги и
определить т.пл. Йодоформ плавится при 120 (может быть
перекристаллизован из смеси метанол-вода).
Удалять
избыток йода путем добавления нескольких капель разбавленного
раствор гидроксида натрия при встряхивании, разбавить равным
объем воды и дать постоять 10 минут. Тест
положительный, если выпал желтый осадок йодоформа. Фильтр
от желтого осадка, высушить на подушечках фильтровальной бумаги и
определить т.пл. Йодоформ плавится при 120 (может быть
перекристаллизован из смеси метанол-вода).
Реакция осуществляется ацетальдегидом и простым метилом. кетоны. Спирты, содержащие группу Ch4CHROH, будут окисляться в условиях реакции, а также дать положительный результат.
4. Только альдегиды (восстанавливающие свойства).
(а) Раствор Фелинга
Альдегиды восстанавливают раствор Фелинга до желтой или красной меди (I).
окись.
Приготовление реагента: смешать равные объемы раствора Фелинга. раствор раствор I (водный щелочной виннокислый калий) и Раствор Фелинга II (раствор медного купороса).
Добавьте 2 капли (или 0,05 г) соединения и 2–3 капли
реагент и нагреть на кипящей водяной бане 3 — 4 мин.
Тест на алифатические альдегиды положительный, но часто нерешительно для ароматических альдегидов, где часто встречается реагент Джонса. полезно (см. 5).
(б) Реактив Толлена (раствор аммиачной селитры серебра)
Альдегиды легко окисляются до карбоновых кислот и будут
уменьшите количество реактива Толлена, чтобы на внутренней стороне получилось серебряное зеркало.
чистой пробирки.
СНАЧАЛА очистите пробирку небольшим количеством горячей азотной кислоты (дым шкаф) и промойте дистиллированной водой.
Приготовление реагента: к 1 мл раствора нитрата серебра. добавить несколько капель гидроксида натрия. Затем добавьте разбавленный аммоний. гидроксид по каплям до полного растворения осадка.
Добавьте 2–3 капли соединения в метаноле к 2–3 мл раствора. Раствор Толлена содержится в очень чистой пробирке. Если нет реакция протекает на холоде, нежно в тепле в воде ванна.
ВНИМАНИЕ: После испытания слить содержимое
пробирку в раковину и промойте пробирку разбавленным
азотная кислота.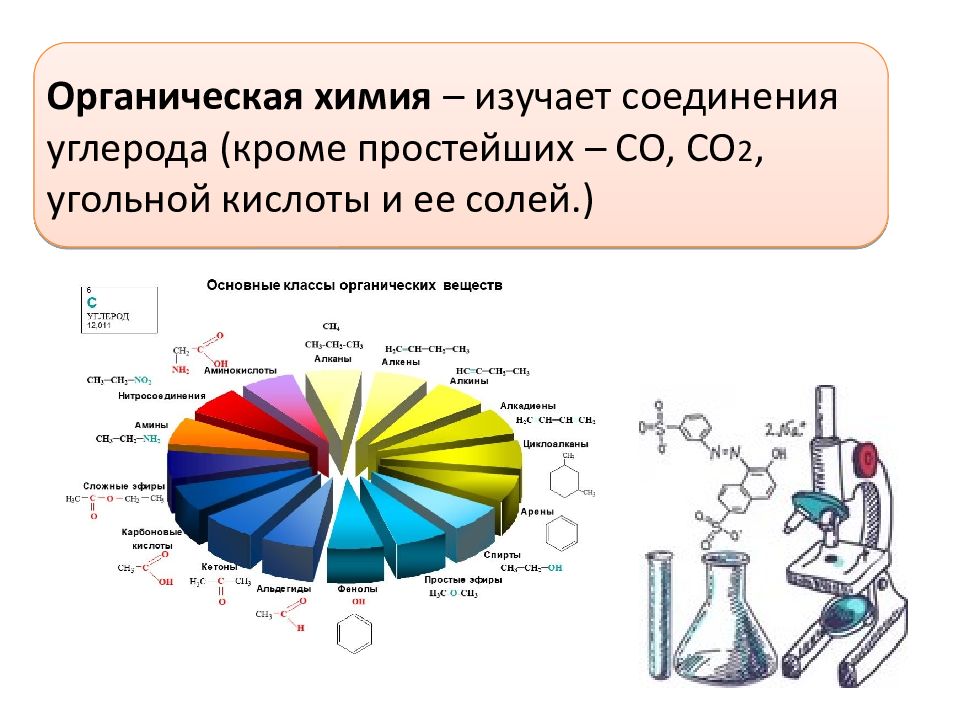 Любой гремучий серебряный подарок, что очень дорого.
взрывчатое вещество, когда высохнет, будет уничтожено.
Любой гремучий серебряный подарок, что очень дорого.
взрывчатое вещество, когда высохнет, будет уничтожено.
(c) Реагент Джонса (см. Раздел о спиртах).
5. Спирты
Тесты на гидроксильную группу не только обнаруживают присутствие
группа, но также может указывать, является ли она первичной, вторичной
или третичное.
(a) Реагент Джонса (CrO 3 -H 2 SO 4
дюйм H 2 O)
Этот реагент отличает первичные и вторичные спирты от
третичные спирты; тест основан на гораздо большем
устойчивость к окислению третичных спиртов по сравнению с
два других типа. Альдегиды также дают положительный результат.
Поместите 1 мл ацетона в пробирку и растворите одну каплю
жидкость или около 10 мг твердого спирта или альдегида в нем.Добавлять
одну каплю реагента в раствор ацетона и встряхнуть
пробирка для перемешивания содержимого. Первичные и вторичные спирты реагируют
в течение двух секунд, о чем свидетельствует исчезновение
оранжевый цвет реагента и образование зеленого или
сине-зеленый осадок или эмульсия.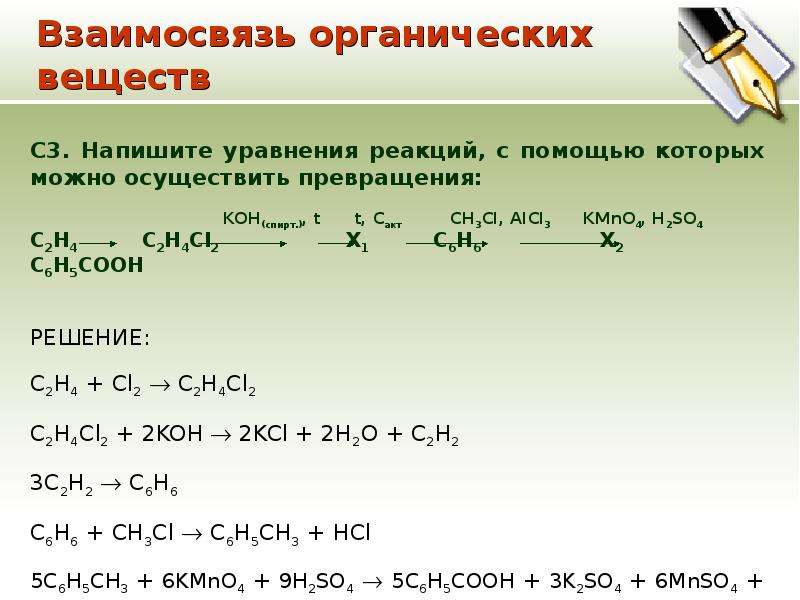
Третичные спирты не вступают в реакцию даже через 3 минуты.
(I) RCh3OH -> RCHO -> RCO2H (II) R2CHOH -> R2C = O (III) R3COH -> без видимой реакции.
(b) Реагент Лукаса [ZnCl 2 — конц. HCl]
Этот реагент превращает спирты в соответствующий алкил.
хлориды. Хлорид цинка (кислота Льюиса) увеличивает реакционную способность
спиртов в сторону кислоты. Тест зависит от скорости
реакция первичных, вторичных и третичных спиртов с
реагент при комнатной температуре.
(I) RCh3OH -> при комнатной температуре реакции нет. (II) R2CHOH -> R2CHCl + h3O (1 час или больше) (III) R3COH -> R3CCl + h3O (сразу)К 1 мл спирта в небольшой пробирке добавьте 6 мл Lucas ‘ реагент при комнатной температуре.Трубку закрыть пробкой, встряхнуть и дать постоять.
(i) Первичные спирты — водная фаза остается прозрачной (кроме аллиловый спирт — по каплям через 7 минут).
(ii) Вторичные спирты — очень медленная реакция (~ 1 час или
может быть дольше), когда можно увидеть капли хлористого алкила.
(iii) Третичные спирты — очень быстрая реакция и капли почти сразу образуется алкилхлорид.
6.Сахар, углеводы
Тест Молиша
Это общий тест на углеводы. Растворить 20-30 мг
соединение в 2 мл воды и добавить 0,5 мл реагента (20%
раствор 2-нафтола в этаноле). Налейте 2 мл концентрированной
серную кислоту из капельницы осторожно вниз по стенке пробирки
так что кислота образует слой под водным раствором
не смешивая с ней. Красный цвет, переходящий в темный
фиолетовые формы на интерфейсе.Проведите второй тест на бланке.
решение.
7. Сложные эфиры
Тест с гидроксамовой кислотой
R-CO-OR '+ h3N-OH -> R-CO-NH-OH + R'-OH
Сложные эфиры реагируют с гидроксиламином в присутствии натрия гидроксида с образованием натриевой соли соответствующего гидроксамового кислота. При подкислении и добавлении хлорида железа пурпурный комплекс железа (III) гидроксамовой кислоты сформирован.
Всегда рекомендуется убедиться, что неизвестное соединение
не давать окраску с хлоридом железа (III) перед проведением
тест с гидроксамовой кислотой.
Методика испытания гидроксамовой кислоты
(а) Тест с хлоридом железа
Растворите каплю или несколько мелких кристаллов соединения в 1 мл.
95% этанола (спирт-ректификованный) и добавить 1 мл M соляной кислоты.
кислота. Обратите внимание на цвет, полученный, когда 1 капля 5% железа (III)
к раствору добавляется хлорид.Если ярко выраженный фиолетовый, синий,
красный или оранжевый цвет, проба с гидроксамовой кислотой
описанное ниже НЕ ПРИМЕНИМО.
(b) Тест с гидроксамовой кислотой
Смешайте 1 каплю или несколько мелких кристаллов (около 0,05 г) соединения.
с 1 мл 0,5 М гидрохлорида гидроксиламина в 95% этаноле и
добавляют 0,2 мл 6 М водного гидроксида натрия. Нагрейте смесь до
кипения и после того, как раствор немного остынет, добавить 2 мл M
соляная кислота. Если раствор мутный, добавьте 2 мл 95% раствора.
этиловый спирт.Обратите внимание на цвет, полученный, когда 1 капля 5% железа (III)
добавляется раствор хлорида. Если получившийся цвет не
настаивают, продолжайте добавлять реагент по каплям до тех пор, пока не появится наблюдаемая
цвет пронизывает все решение. Обычно всего 1 капля
необходим раствор хлорида железа (III). Сравните цвет
с результатом, полученным в тесте (а). Положительный тест будет
отчетливый бордовый или пурпурный цвет по сравнению с желтым
цвет наблюдается при испытании исходного соединения с железом
(III) раствор хлорида в присутствии кислоты.Это часто
целесообразно проводить параллельно испытание, скажем, этиловым
ацетат, чтобы гарантировать, что условия для этого теста
правильный.
Обычно всего 1 капля
необходим раствор хлорида железа (III). Сравните цвет
с результатом, полученным в тесте (а). Положительный тест будет
отчетливый бордовый или пурпурный цвет по сравнению с желтым
цвет наблюдается при испытании исходного соединения с железом
(III) раствор хлорида в присутствии кислоты.Это часто
целесообразно проводить параллельно испытание, скажем, этиловым
ацетат, чтобы гарантировать, что условия для этого теста
правильный.
ПОЛУЧЕНИЕ ПРОИЗВОДНЫХ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Предварительный экзамен и тесты групповой классификации указать конкретный класс (функциональную группу), к которому может принадлежать неизвестное органическое соединение. Дальнейшая характеристика и идентификация зависит от выбора и подготовки подходящее твердое производное и точное определение его точка плавления (лучше всего от 90 до 150). В следующей таблице перечислены некоторые классы органических
соединения и выбор производных, которые могут быть получены для
охарактеризуйте их. Сверьтесь с таблицами температур плавления в
Vogel, какие производные наиболее подходят для
характеристика вашего конкретного соединения.
Сверьтесь с таблицами температур плавления в
Vogel, какие производные наиболее подходят для
характеристика вашего конкретного соединения.
| КЛАСС СОЕДИНЕНИЯ | ПРОИЗВОДНЫЕ |
| 1. СПИРТЫ | 3,5-динитробензоат |
| 2.ФЕНОЛЫ | бензоат, ацетат, бромпроизводное |
| 3. Альдегиды и кетоны | семикарбазон, 2,4-динитрофенилгидразон, оксим |
| 4. КИСЛОТЫ | анилид, амид, п-толуидид. |
| 5. АМИНЫ | производные бензоила, ацетила и сульфонамида |
СПИРТЫ
(i) 3,5-Динитробензоаты
3,5-Динитробензоилхлорид обычно частично гидролизуется и
готовить в чистом виде, осторожно нагревая смесь
3,5-динитробензойной кислоты (1 г) и пентахлорида фосфора
(1.5 г) в сухой пробирке до растворения (5 мин) *.
жидкость наливают на сухое часовое стекло и дают застыть. Фосфорилхлориды удаляются прессованием твердого вещества с
шпателем на пачке фильтровальной бумаги. Остаточный хлорангидрид
подходит для немедленного использования при приготовлении
производные.
Фосфорилхлориды удаляются прессованием твердого вещества с
шпателем на пачке фильтровальной бумаги. Остаточный хлорангидрид
подходит для немедленного использования при приготовлении
производные.
* Работа под вытяжным шкафом. Пары раздражают глаза и нос.
3,5-Динитробензоилхлорид смешивают со спиртом (0.5 — 1 мл) в неплотно закупоренную сухую пробирку и нагревают на пару ванна около 10 мин. Вторичные и третичные спирты требуют до до 30 мин. После охлаждения добавить 10 мл гидрокарбоната натрия. раствора, перемешивайте до кристаллизации сложного эфира и фильтруйте при насос. Промыть небольшим количеством карбонатного раствора, водой и рассосать. сухой. Перекристаллизовать из минимального горячего этанола или света нефть. Остудите медленно, чтобы избежать образования маслянистых капель ваш эфир.
ФЕНОЛЫ
(i) Бензоаты (метод Шттен-Баумана).
К фенолу (0,5 г) добавляют 5% гидроксид натрия (10 мл) в
хорошо закупоренная трубка для кипячения или небольшая коническая колба. Бензоил
хлорид (2 мл) добавляется в небольших количествах за один раз, и
смесь энергично взбалтывают с периодическим охлаждением под краном
или в ледяной воде. Через 15 мин твердый бензоат отделяется:
раствор по окончании реакции должен быть щелочным; если
не щелочной, или если продукт маслянистый, добавьте твердую гранулу
гидроксид натрия и снова взболтать.Собрать бензоат, промыть
тщательно холодной водой и перекристаллизовать из спирта или
легкая нефть.
Бензоил
хлорид (2 мл) добавляется в небольших количествах за один раз, и
смесь энергично взбалтывают с периодическим охлаждением под краном
или в ледяной воде. Через 15 мин твердый бензоат отделяется:
раствор по окончании реакции должен быть щелочным; если
не щелочной, или если продукт маслянистый, добавьте твердую гранулу
гидроксид натрия и снова взболтать.Собрать бензоат, промыть
тщательно холодной водой и перекристаллизовать из спирта или
легкая нефть.
(ii) Ацетаты
Ацетаты многих простых фенолов являются жидкостями; однако это
подходящее производное для многоатомных и замещенных фенолов. В
фенол (0,5 г) растворяют в 10% растворе гидроксида натрия и
добавляется равное количество колотого льда, а затем уксусная
ангидрид (2 мл). Смесь интенсивно встряхивают в закрытой пробке.
пробирку до отделения ацетата.Продукт фильтруется
и перекристаллизовали из спирта.
iii) Производные брома
Фенол (0,3 г) суспендируют в разбавленной соляной кислоте (10 мл). и бромную воду добавляли по каплям до тех пор, пока не перестанет обесцвечиваться
имеет место. Выпадающее в осадок бромпроизводное отфильтровывают.
выключили и перекристаллизовали из спирта.
и бромную воду добавляли по каплям до тех пор, пока не перестанет обесцвечиваться
имеет место. Выпадающее в осадок бромпроизводное отфильтровывают.
выключили и перекристаллизовали из спирта.
АЛЬДЕГИДЫ И КЕТОНЫ
(i) Семикарбазоны
Растворите гидрохлорид семикарбазида (1 г) и ацетат натрия.
(1.5 г) в воде (8-10 мл), добавьте альдегид или кетон (0,3 мл).
и встряхнуть. Встряхните смесь несколько минут, а затем остудите.
вода со льдом. Отфильтровать кристаллы, промыть небольшим количеством холодной воды.
и перекристаллизовать из метанола или этанола.
(ii) 2,4-Динитрофенилгидразоны
Развести 0,25 г 2,4-динитрофенилгидразина в 5 мл метанола.
и осторожно добавьте 0,5 мл концентрированной серной кислоты. Фильтр
теплый раствор и добавить раствор 0.2 г карбонила
соединение в 1 мл метанола. Перекристаллизовать производную из
метанол, этанол или этилацетат.
(iii) Оксимы
Гидроксиламина гидрохлорид (0,5 г) растворяют в воде (2
мл). 10% гидроксид натрия (2 мл) и карбонильное соединение (0,2 —
0,3 г) растворенного в спирте (1-2 мл), смесь
подогревают на паровой бане 10 мин, затем охлаждают на льду.
Кристаллизация вызывается царапинами по бокам теста.
трубка со стеклянным стержнем.Оксимы могут кристаллизоваться из
алкоголь.
10% гидроксид натрия (2 мл) и карбонильное соединение (0,2 —
0,3 г) растворенного в спирте (1-2 мл), смесь
подогревают на паровой бане 10 мин, затем охлаждают на льду.
Кристаллизация вызывается царапинами по бокам теста.
трубка со стеклянным стержнем.Оксимы могут кристаллизоваться из
алкоголь.
КИСЛОТЫ
(i) Амиды, анилиды и п-толуидиды
Кислоту (0,5 г) кипятят с тионилхлоридом (2-3 мл) в
вытяжной шкаф примерно на 30 минут *.
пробка из ваты в верхней части конденсатора орошения, чтобы исключить
влага. Конденсатор удаляется и избыток тионила
хлорид отгоняют (т.кип.78). Таким образом, хлорангидрид
обрабатывают концентрированным раствором аммиака (5 мл) или
анилин (0.5-1 мл) или п-толуидина (0,5-1 г), когда твердое вещество
производная отделяется. Его собирают и перекристаллизовывают из
спирт с добавлением обесцвечивающего древесного угля при необходимости.
* В качестве альтернативы используйте PCl 5 для образования хлорангидрида.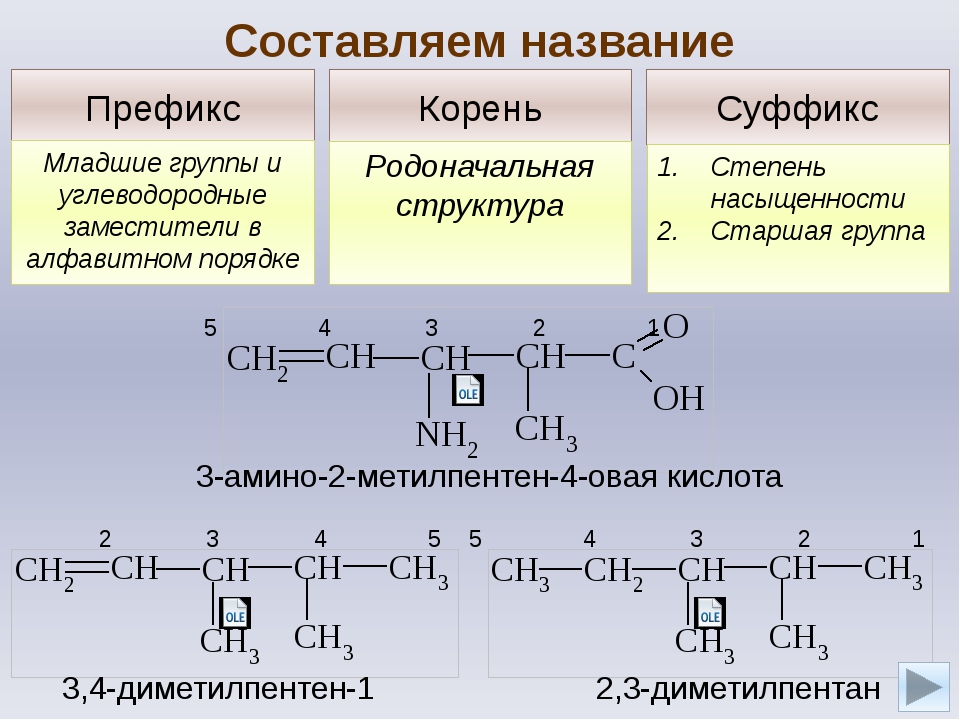
АМИНЫ
(i) Ацетилпроизводные (ацетамиды)
Осторожно кипятите с обратным холодильником в небольшой сухой колбе под сухим конденсатором.
амина (1 г) с уксусным ангидридом (3 мл) в течение 15 мин. Охладите
реакционную смесь и вылить в 20 мл холодной воды.Варить до
разложите избыток уксусного ангидрида. Охлаждение и фильтрация всасыванием
нерастворимое производное. Перекристаллизовать из этанола.
(ii) Бензоильные производные (бензамиды)
Суспендировать 1 г амина в 20 мл 5% -ного водного раствора гидроксида натрия.
в хорошо закупоренную колбу и добавьте 2 мл бензоилхлорида (дым
капюшон!), примерно 0,5 мл за раз, при постоянном встряхивании. Встряхнуть
энергично в течение 5-10 мин до появления запаха бензоилхлорида.
исчез.Убедитесь, что смесь остается щелочной. Фильтр
от твердого производного, промыть небольшим количеством холодной воды и
перекристаллизовать из этанола.
(iii) бензолсульфонамиды
К 1 г амина в 20 мл 5% раствора гидроксида натрия в
в хорошо закупоренную колбу добавьте 1 мл бензолсульфонилхлорида (дым
капот!). Встряхивайте смесь до появления запаха сульфонила.
хлорид исчезает. Убедитесь, что раствор щелочной. Подкислить
при необходимости получить осажденное производное.Концентрированный
следует использовать соляную кислоту, добавляемую по каплям. Отфильтровать
продукт, промыть небольшим количеством холодной воды и высохнуть.
Перекристаллизовать из этанола.
Встряхивайте смесь до появления запаха сульфонила.
хлорид исчезает. Убедитесь, что раствор щелочной. Подкислить
при необходимости получить осажденное производное.Концентрированный
следует использовать соляную кислоту, добавляемую по каплям. Отфильтровать
продукт, промыть небольшим количеством холодной воды и высохнуть.
Перекристаллизовать из этанола.
Вернуться в химию, UWI-Mona, Домашняя страница
Авторские права © 2005 Роберт Джон Ланкашир, все права защищены.
Создано и поддерживается профессором Робертом Дж. Ланкашир,Кафедра химии Вест-Индского университета,
Кампус Мона, Кингстон 7, Ямайка. Создан в марте 1997 г. Ссылки проверены и / или последние изменен 11 декабря 2005 г.
URL http://wwwchem.uwimona.edu.jm/lab_manuals/c10expt25.html .