Измерение скорости химической реакции
Для экспериментального определения скорости химической реакции необходимо иметь данные об изменении концентрации исходных или конечных веществ во времени. Методы, с помощью которых это можно сделать, подразделяются на химическиеифизико-химические.
Химические методы основаны на непосредственном определении количества вещества или его концентрации в реакционном сосуде.
Чаще всего для этих целей используют такие виды количественного анализа, как титриметрия и гравиметрия. Если реакция протекает медленно, то для контроля за расходованием реагентов через определённые промежутки времени из реакционной среды осуществляют отбор пробы. Затем определяют в них содержание нужного вещества. Например, титрованием щёлочью определяют количество кислоты в системе по мере протекания реакции
R1 – COOH + R2 – OH → R1 – COO – R2 + H2O
Если реакция протекает с большой скоростью, то для отбора пробы её останавливают с помощью резкого охлаждения, быстрого удаления катализатора, разбавления либо перевода одного из реагентов в нереакционное состояние.
Химические методы анализа отличает простота, доступность и хорошая точность.
В современной экспериментальной кинетике чаще всего используют физико-химические методы анализа. Они позволяют контролировать изменение концентрации вещества непосредственно в ходе протекания реакции, не останавливая её и не делая отбора пробы.Эти методы основаны на измерении какого-либо физического свойства системы, меняющегося во времени и зависящего от количественного содержания в ней определённого соединения; например: давления (если в реакции участвуют газы), электропроводности, показателя преломления, спектра поглощения реагента или продукта реакции в ультрафиолетовой, видимой либо инфракрасной областях. Широко используются спектры электронного парамагнитного резонанса (ЭПР) и ядерного магнитного резонанса (ЯМР).
Применение спектральных методов основано на том, что поглощение электромагнитного излучения пропорционально количеству вещества или его концентрации в системе.
Обычно экспериментально
изучают реакции в замкнутой системе
(т.е. при постоянном объёме) и представляют
результаты графически в виде так
называемой кинетической кривой,
выражающей зависимость концентрации
реагента или продукта реакции от времениt. Аналитический вид этой
зависимости называетсяуравнением
кинетической кривой. В отличие от
основного кинетического уравнения,
уравнения кривых расходования реагирующих
веществ (или накопления продуктов
реакции) содержат в качестве параметров
начальные концентрации компонентов
(С
Из этих уравнений выводят формулы для расчёта константы скорости реакции и времени полупревращения(t½) – промежутка времени, в течение которого расходуется половина взятого исходного вещества, т.е. его концентрация уменьшится в 2 раза и станет равной Со/2.
В реакциях нулевого порядка концентрация исходного вещества линейно уменьшается со временем (рис. 37)
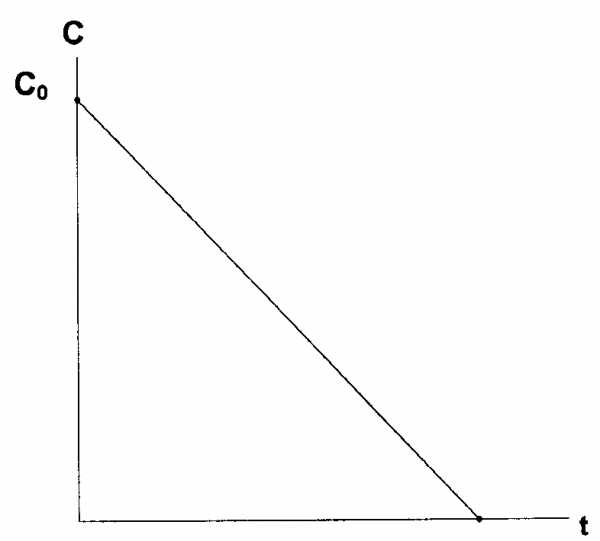
Рис. 37. Изменение концентрации исходного вещества от времени в реакции нулевого порядка
Математически данная линейная зависимость запишется следующим образом
С = С0–kt
где k – константа скорости, С0 – начальная молярная концентрация реагента, С – концентрация в момент времени
t.Из неё можно вывести формулу для расчёта константы скорости химической реакции нулевого порядка.
k
=
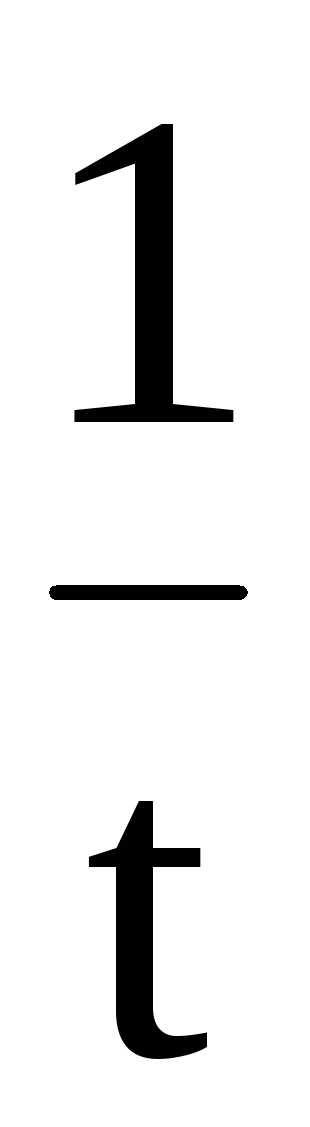 (C0
– C).
(C0
– C).
Константа скорости нулевого порядка измеряется в моль/л ∙ с (моль · л-1· с-1).
Время полупревращения для реакции нулевого порядка пропорционально концентрации исходного вещества
t½=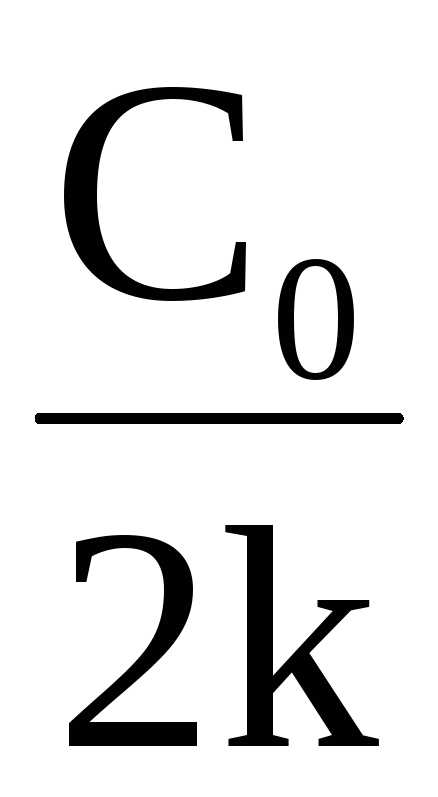
Для реакций первого порядка кинетическая кривая в координатах С,tносит экспоненциальный характер и выглядит следующим образом (рис. 38) Математически данная кривая описывается следующим уравнением
С = С0e—kt
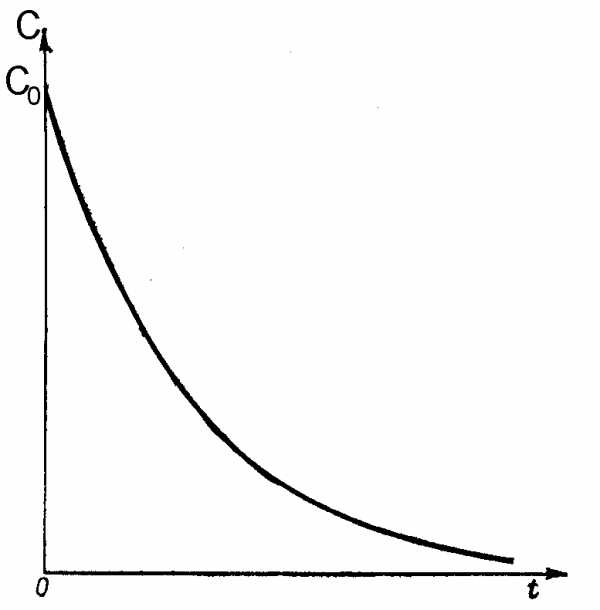
Рис. 38. Изменение концентрации исходного вещества от времени в реакции первого порядка
На практике для реакций первого порядка кинетическую кривую чаще всего строят в координатах ℓnC,t. В этом случае наблюдается линейная зависимость ℓnС от времени (рис. 39)
ℓnС = ℓnС0–kt
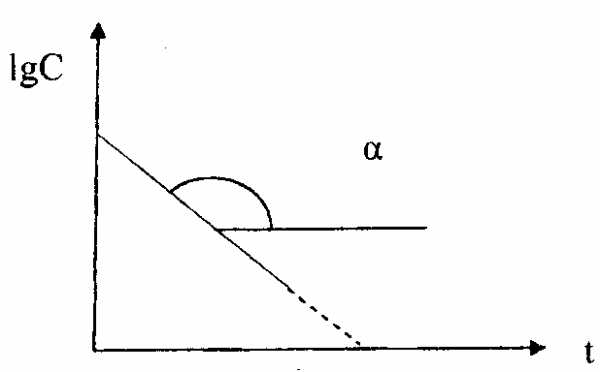
ℓnС
Рис. 39. Зависимость логарифма концентрации реагента от времени протекания для реакции первого порядка
Соответственно, величину константы скорости и время полупревращения можно рассчитать по следующим формулам
k
=
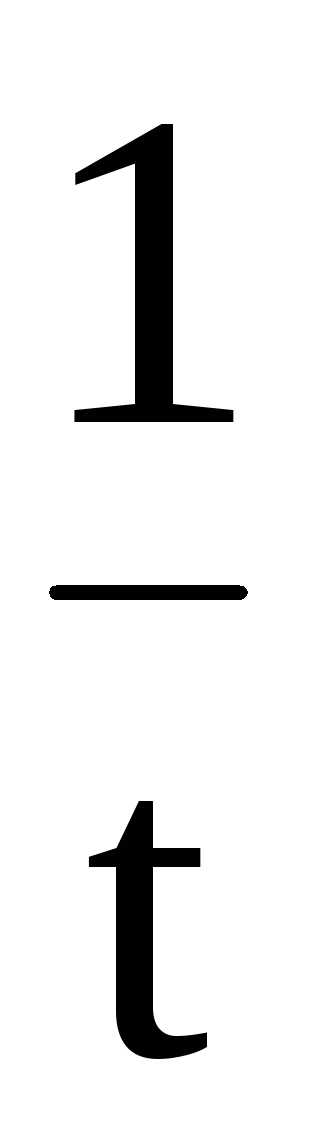
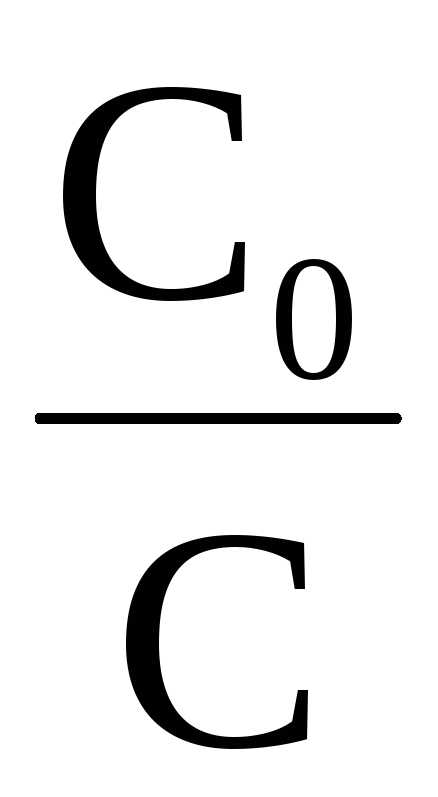 илиk= 2,303
илиk= 2,303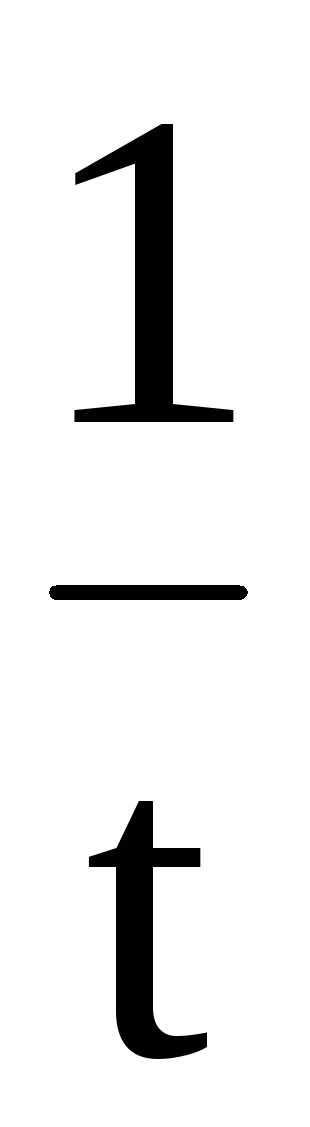 ℓg
ℓg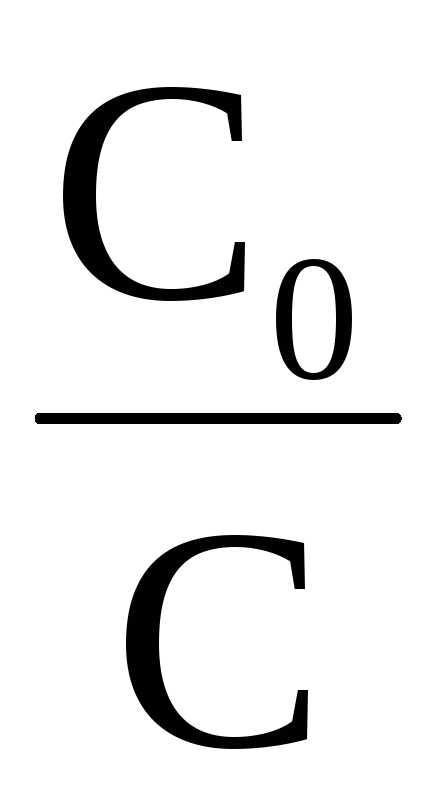
(при переходе от десятичного логарифма к натуральному).
t½
=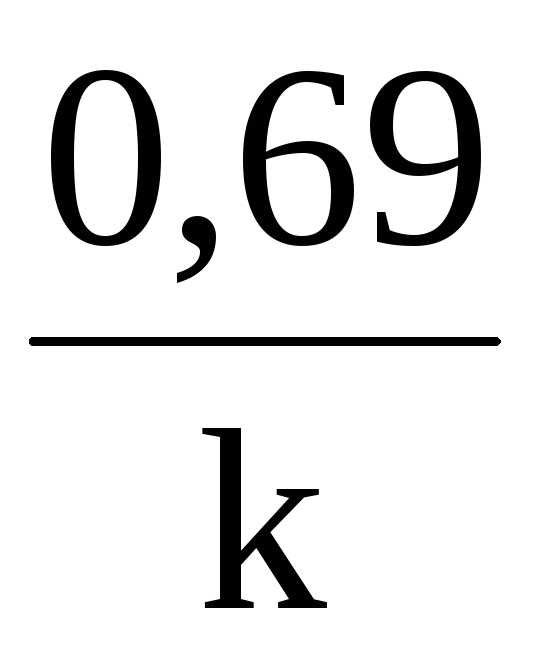
Константа скорости реакции первого порядка имеет размерность t –1 , т.е. 1/с и не зависит от единиц измерения концентрации.Она показывает долю, которую составляют молекулы, вступившие в реакцию за единицу времени, от общего числа молекул реагента в системе. Таким образом, в реакциях первого порядка за одинаковые промежутки времени расходуются одинаковы доли взятого количества исходного вещества.
Вид уравнения зависимости концентрации от времени для реакций второго порядка рассмотрим только для простейшего случая, когда в элементарном акте участвуют 2 одинаковые молекулы, или молекулы разных веществ, но начальные концентрации их (С0) равны. При этом линейная зависимость наблюдается в координатах 1/С,t(рис. 40). Математическое уравнение этой зависимости запишется следующим образом
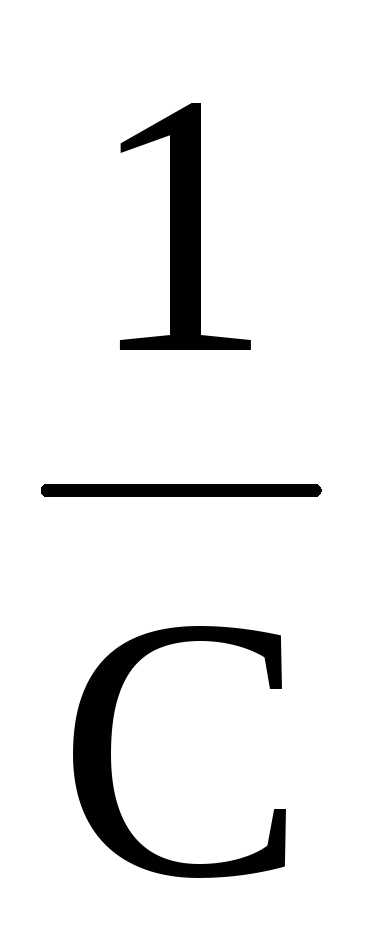 =
=
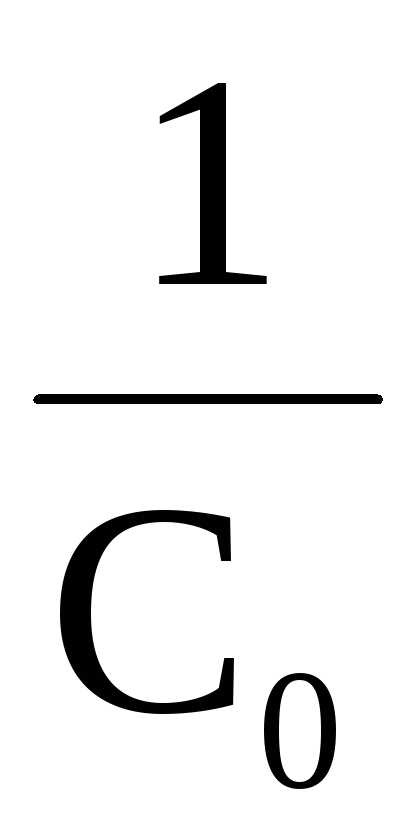 +kt
+kt
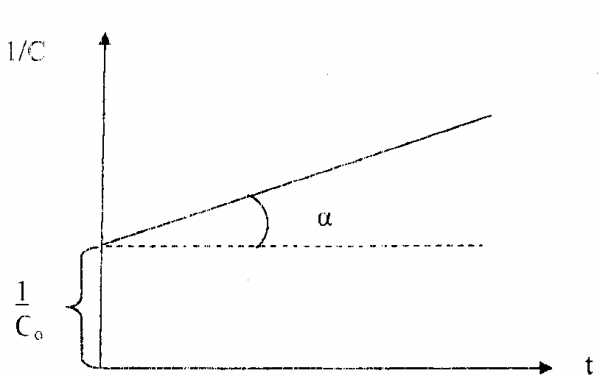
Рис. 40. Зависимость величины обратной концентрации реагента от времени для реакции второго порядка
Константа скорости вычисляется по формуле
k=
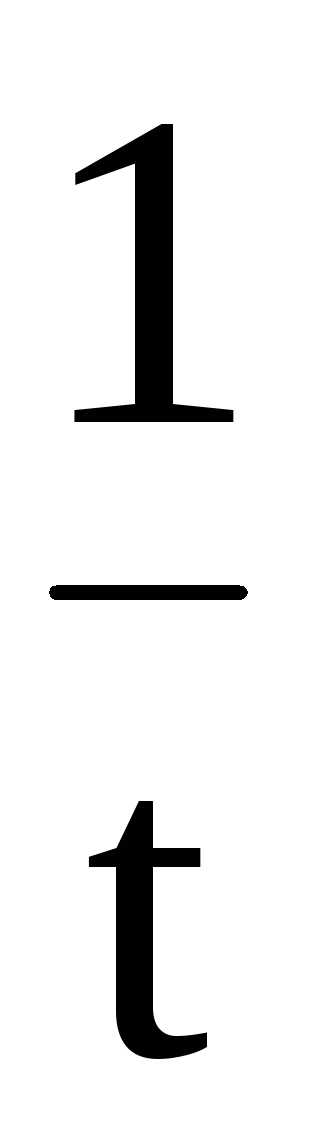 (
(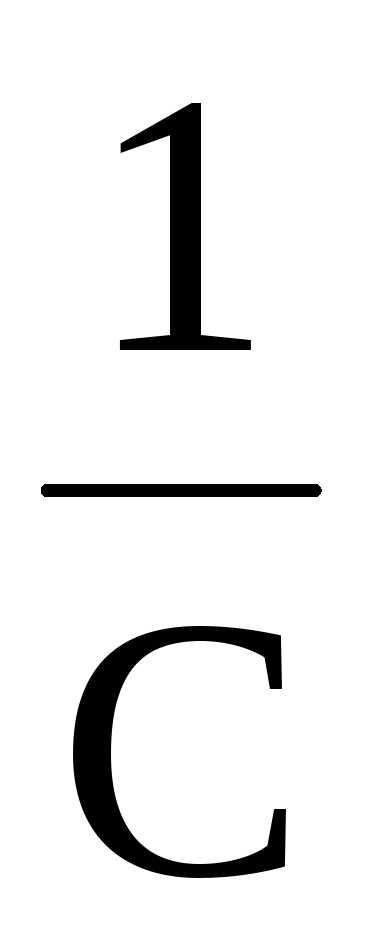 –
–
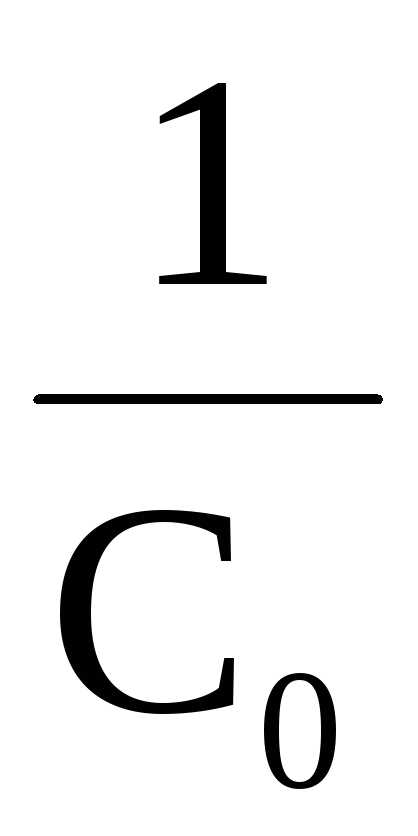 )
)
и измеряется в л∙с-1∙моль-1, т.е. ее численное значение зависит от того, в каких единицах измеряется концентрация вещества.
Период полупревращения реакций второго порядка обратно пропорционален начальной концентрации реагента
t½=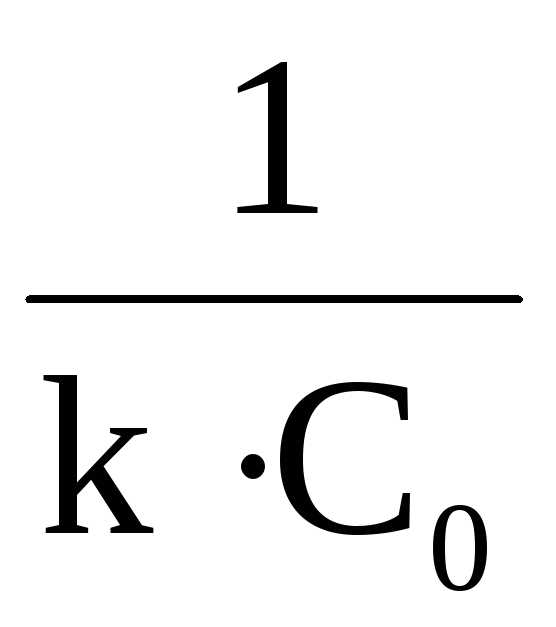
Это связано с тем, что скорость реакций второго порядка в сильной мере зависит от числа столкновений между молекулами реагирующих веществ в единицу времени, которое, в свою очередь, пропорционально числу молекул в единице объема, т.е. концентрации вещества. Таким образом, чем больше концентрация вещества в системе, тем чаще сталкиваются молекулы между собой и тем за меньший промежуток времени половина их успеет прореагировать.
Реакции третьего порядка, как уже было сказано ранее, встречаются крайне редко и не представляют практического интереса. Поэтому в связи с этим мы их не будем рассматривать.
studfiles.net
Измерение скорости химической реакции
Для экспериментального определения скорости химической реакции необходимо иметь данные об изменении концентрации исходных или конечных веществ во времени. Методы, с помощью которых это можно сделать, подразделяются на химическиеифизико-химические.
Химические методы основаны на непосредственном определении количества вещества или его концентрации в реакционном сосуде.
Чаще всего для этих целей используют такие виды количественного анализа, как титриметрия и гравиметрия. Если реакция протекает медленно, то для контроля за расходованием реагентов через определённые промежутки времени из реакционной среды осуществляют отбор пробы. Затем определяют в них содержание нужного вещества. Например, титрованием щёлочью определяют количество кислоты в системе по мере протекания реакции
R1 – COOH + R2 – OH → R1 – COO – R2 + H2O
Если реакция протекает с большой скоростью, то для отбора пробы её останавливают с помощью резкого охлаждения, быстрого удаления катализатора, разбавления либо перевода одного из реагентов в нереакционное состояние.
Химические методы анализа отличает простота, доступность и хорошая точность.
В современной экспериментальной кинетике чаще всего используют физико-химические методы анализа. Они позволяют контролировать изменение концентрации вещества непосредственно в ходе протекания реакции, не останавливая её и не делая отбора пробы.Эти методы основаны на измерении какого-либо физического свойства системы, меняющегося во времени и зависящего от количественного содержания в ней определённого соединения; например: давления (если в реакции участвуют газы), электропроводности, показателя преломления, спектра поглощения реагента или продукта реакции в ультрафиолетовой, видимой либо инфракрасной областях. Широко используются спектры электронного парамагнитного резонанса (ЭПР) и ядерного магнитного резонанса (ЯМР).
Применение спектральных методов основано на том, что поглощение электромагнитного излучения пропорционально количеству вещества или его концентрации в системе.
Обычно экспериментально изучают реакции в замкнутой системе (т.е. при постоянном объёме) и представляют результаты графически в виде так называемой кинетической кривой, выражающей зависимость концентрации реагента или продукта реакции от времениt. Аналитический вид этой зависимости называетсяуравнением кинетической кривой. В отличие от основного кинетического уравнения, уравнения кривых расходования реагирующих веществ (или накопления продуктов реакции) содержат в качестве параметров начальные концентрации компонентов (С0) в момент времениt=0.
Из этих уравнений выводят формулы для расчёта константы скорости реакции и времени полупревращения(t½) – промежутка времени, в течение которогорасходуется половина взятого исходного вещества, т.е. его концентрация уменьшится в 2 раза и станет равной Со/2.
В реакциях нулевого порядка концентрация исходного вещества линейно уменьшается со временем (рис. 37)
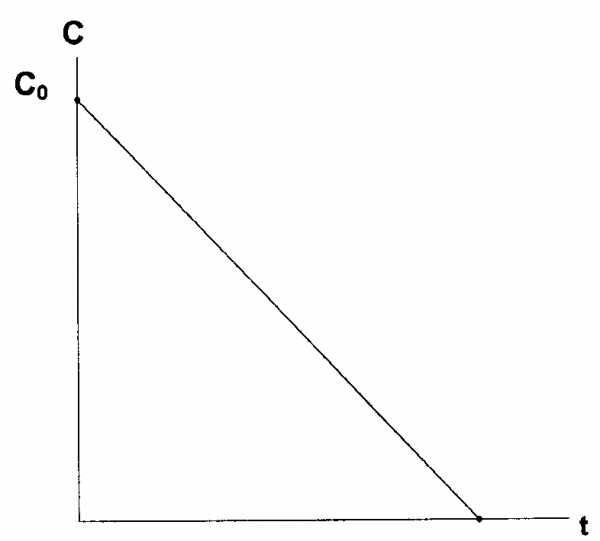
Рис. 37. Изменение концентрацииисходного вещества от временив реакции нулевого порядка
Математически данная линейная зависимость запишется следующим образом
С = С0–kt
где k – константа скорости, С0 – начальная молярная концентрация реагента, С – концентрация в момент времени t.
Из неё можно вывести формулу для расчёта константы скорости химической реакции нулевого порядка.
k
=
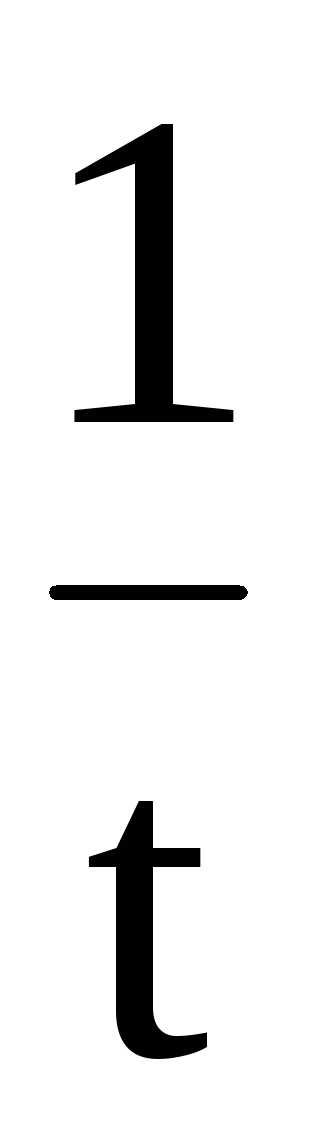 (C0
– C).
(C0
– C).
Константа скорости нулевого порядка измеряется в моль/л ∙ с (моль · л-1· с-1).
Время полупревращения для реакции нулевого порядка пропорционально концентрации исходного вещества
t½=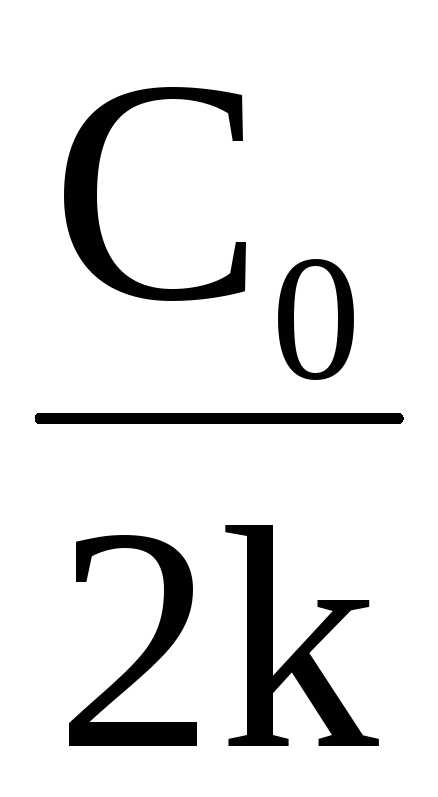
Для реакций первого порядка кинетическая кривая в координатах С,tносит экспоненциальный характер и выглядит следующим образом (рис. 38) Математически данная кривая описывается следующим уравнением
С = С0e—kt
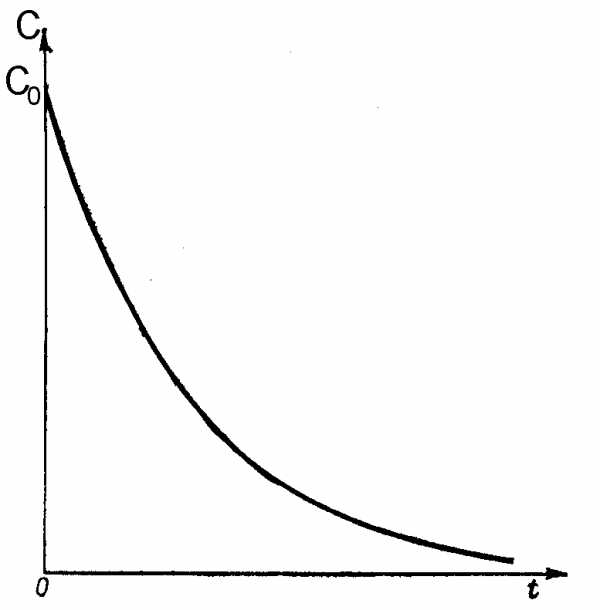
Рис. 38. Изменение концентрации исходного вещества от времени в реакции первого порядка
На практике для реакций первого порядка кинетическую кривую чаще всего строят в координатах ℓnC,t. В этом случае наблюдается линейная зависимость ℓnС от времени (рис. 39)
ℓnС = ℓnС0–kt
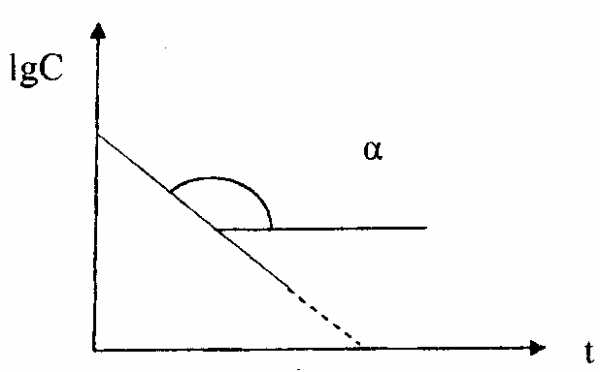
ℓnС
Рис. 39. Зависимость логарифма концентрации реагента от времени протекания для реакции первого порядка
Соответственно, величину константы скорости и время полупревращения можно рассчитать по следующим формулам
k
=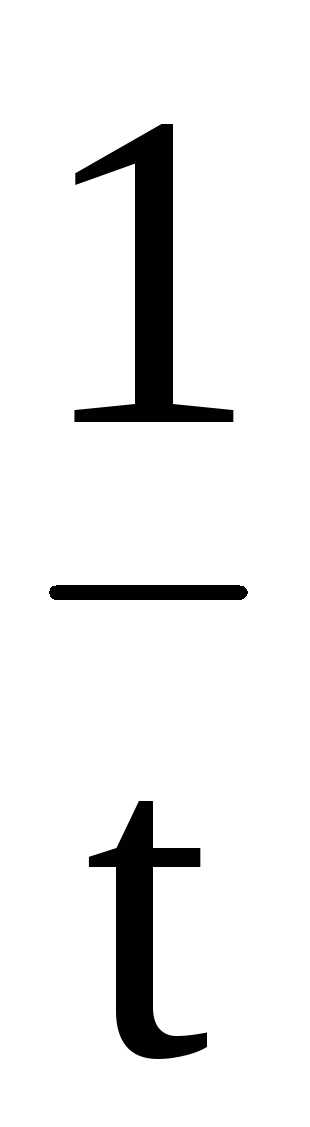 ℓn
ℓn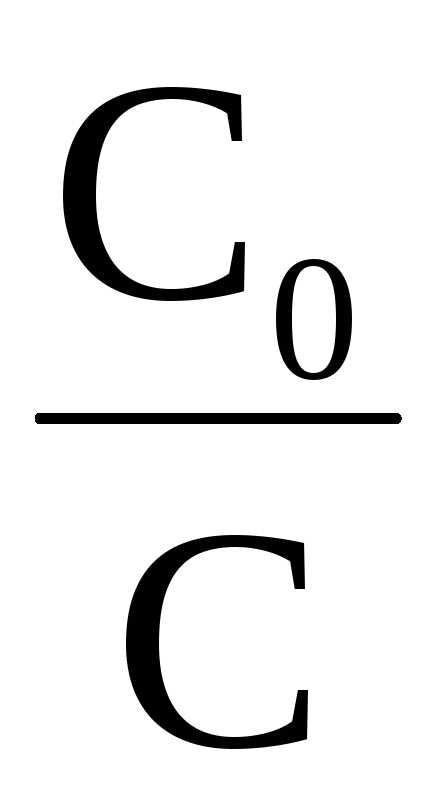 илиk= 2,303
илиk= 2,303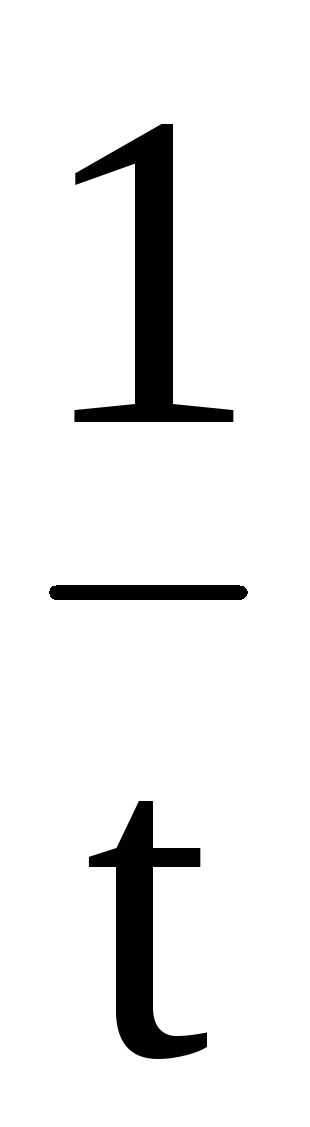 ℓg
ℓg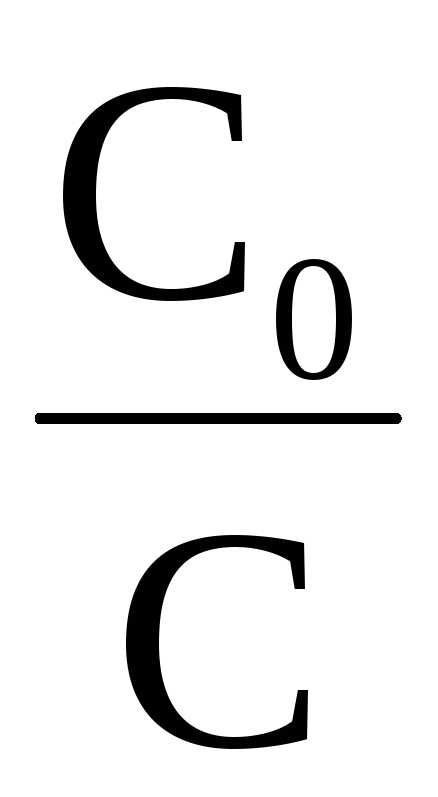
(при переходе от десятичного логарифма к натуральному).
t½=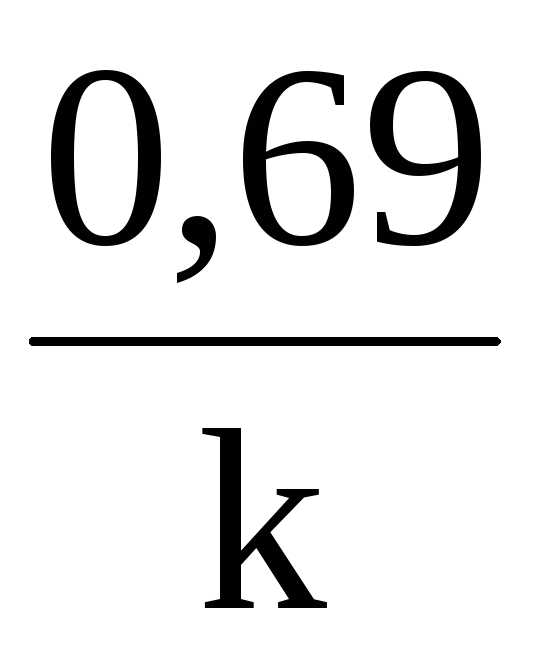
Константа скорости реакции первого порядка имеет размерность t–1 , т.е. 1/с и не зависит от единиц измерения концентрации.Она показывает долю, которую составляют молекулы, вступившие в реакцию за единицу времени, от общего числа молекул реагента в системе. Таким образом, в реакциях первого порядка за одинаковые промежутки времени расходуются одинаковы доли взятого количества исходного вещества.
Второй отличительной особенностью реакций первого порядка является то, что t½для них не зависит от начальной концентрации реагента, а определяется только константой скорости.
Вид уравнения зависимости концентрации от времени для реакций второго порядка рассмотрим только для простейшего случая, когда в элементарном акте участвуют 2 одинаковые молекулы, или молекулы разных веществ, но начальные концентрации их (С0) равны. При этом линейная зависимость наблюдается в координатах 1/С,t(рис. 40). Математическое уравнение этой зависимости запишется следующим образом
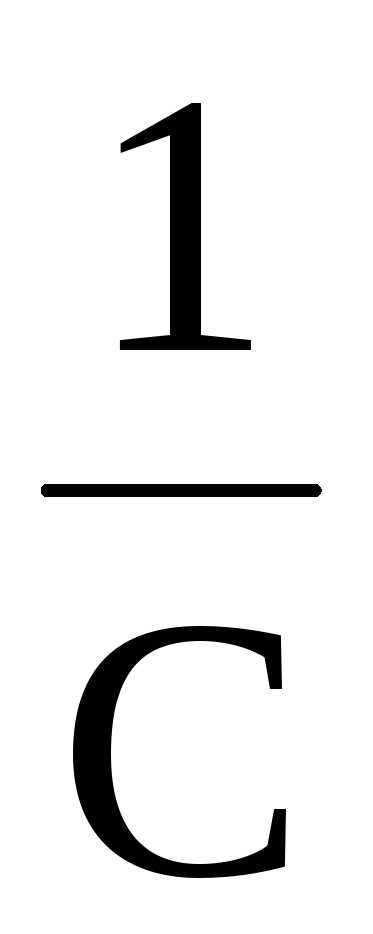 =
=
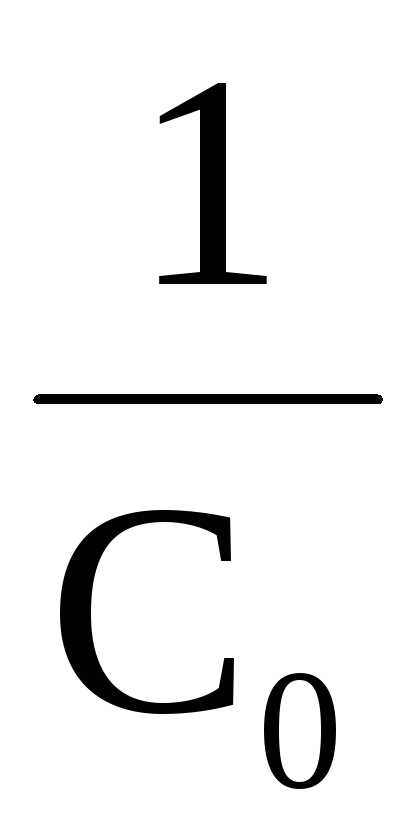 +kt
+kt
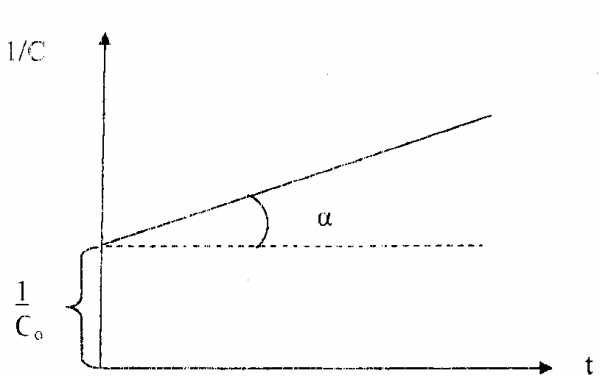
Рис. 40. Зависимость величины обратной концентрации реагента от времени для реакции второго порядка
Константаскорости вычисляется по формуле
k=
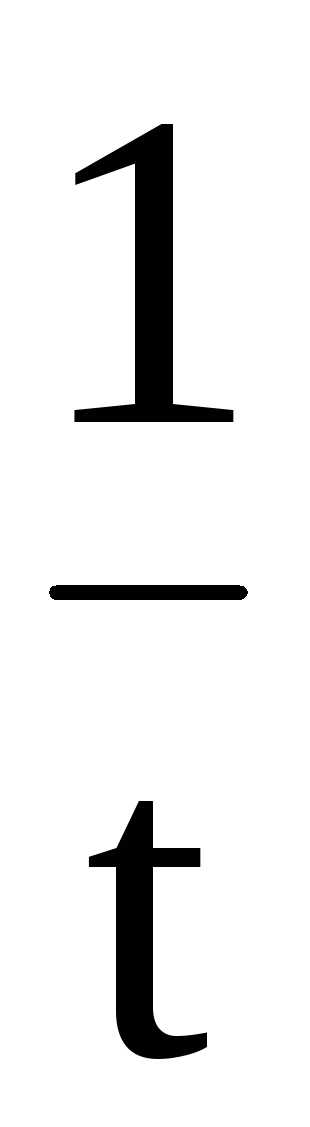 (
(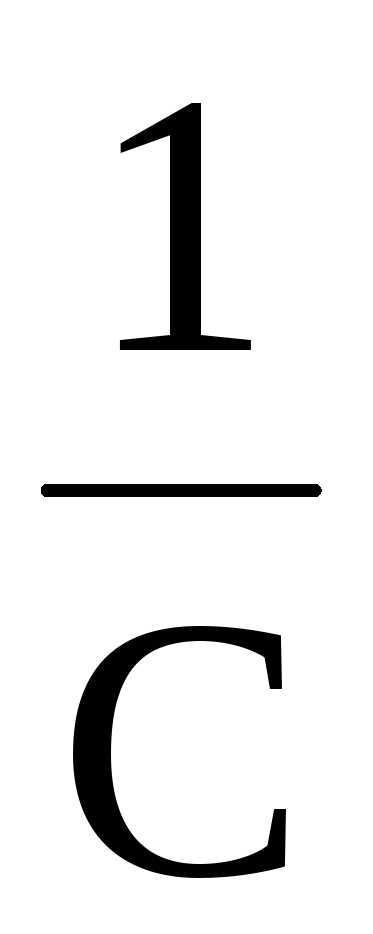 –
–
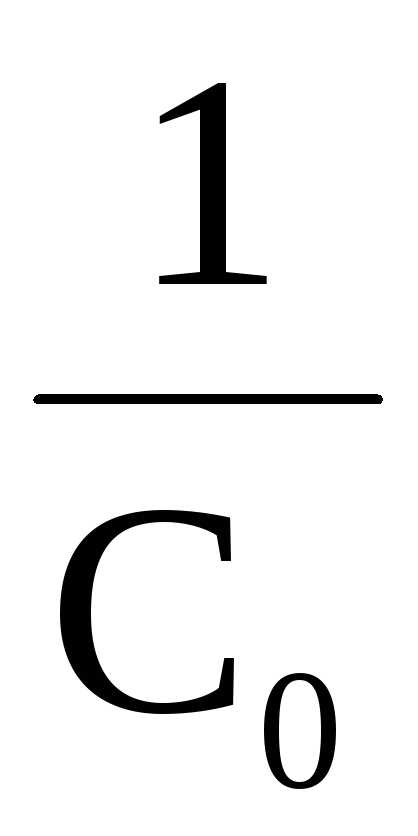 )
)
и измеряется в л∙с-1∙моль-1, т.е. ее численное значение зависит от того, в каких единицах измеряется концентрация вещества.
Период полупревращения реакций второго порядка обратно пропорционален начальной концентрации реагента
t½=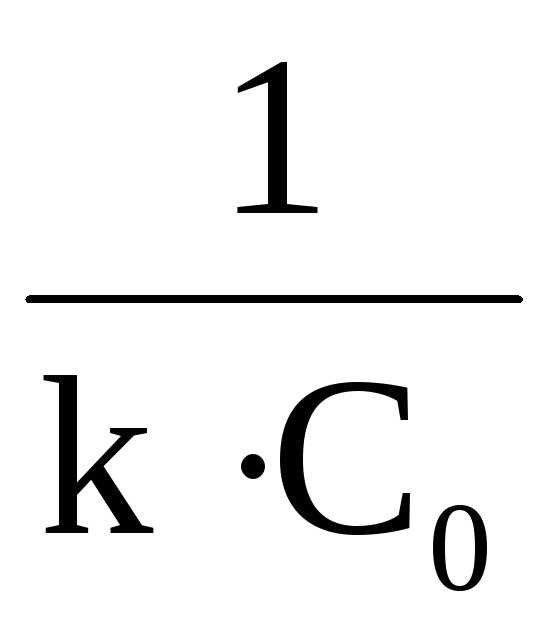
Это связано с тем, что скоростьреакций второго порядка в сильной мере зависит от числа столкновений между молекулами реагирующих веществ в единицу времени, которое, в свою очередь, пропорционально числу молекул в единице объема, т.е. концентрации вещества. Таким образом, чем больше концентрация вещества в системе, тем чаще сталкиваются молекулы между собой и тем за меньший промежуток времени половина их успеет прореагировать.
Реакции третьего порядка, как уже было сказано ранее, встречаются крайне редко и не представляют практического интереса. Поэтому в связи с этим мы их не будем рассматривать.
studfiles.net
Что такое скорость химической реакции?
Скорость химической реакции определяется как изменение молярной концентрации одного из реагирующих веществ за единицу времени. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции) , то полученное значение домножается на −1. В 1865 году Н. Н. Бекетовым и в 1867 году Гульдбергом и Вааге был сформулирован закон действующих масс: Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в некоторые степени. Для элементарных реакций показатель степени при значении концентрации каждого вещества равен его стехиометрическому коэффициенту, для более сложных реакций это правило не соблюдается. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа) , площадь поверхности реагирующих веществ. Если мы рассмотрим самую простую химическую реакцию A + B → C, то мы заметим, что мгновенная скорость химической реакции величина непостоянная
Скорость химической реакции — это изменение концентрации какого-либо из участников реакции за секунду.
это то что сколько одно вещество сможет за какое время потрахать другое вещество (пошутил) Скорость химической реакции определяется как изменение молярной концентрации одного из реагирующих веществ за единицу времени. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции) , то полученное значение домножается на −1.
touch.otvet.mail.ru
Измерение скорости химической реакции
Для экспериментального определения скорости химической реакции необходимо иметь данные об изменении концентрации исходных или конечных веществ во времени. Методы, с помощью которых это можно сделать, подразделяются на химическиеифизико-химические.
Химические методы основаны на непосредственном определении количества вещества или его концентрации в реакционном сосуде.
Чаще всего для этих целей используют такие виды количественного анализа, как титриметрия и гравиметрия. Если реакция протекает медленно, то для контроля за расходованием реагентов через определённые промежутки времени из реакционной среды осуществляют отбор пробы. Затем определяют в них содержание нужного вещества. Например, титрованием щёлочью определяют количество кислоты в системе по мере протекания реакции
R1 – COOH + R2 – OH → R1 – COO – R2 + H2O
Если реакция протекает с большой скоростью, то для отбора пробы её останавливают с помощью резкого охлаждения, быстрого удаления катализатора, разбавления либо перевода одного из реагентов в нереакционное состояние.
Химические методы анализа отличает простота, доступность и хорошая точность.
В современной экспериментальной кинетике чаще всего используют физико-химические методы анализа. Они позволяют контролировать изменение концентрации вещества непосредственно в ходе протекания реакции, не останавливая её и не делая отбора пробы.Эти методы основаны на измерении какого-либо физического свойства системы, меняющегося во времени и зависящего от количественного содержания в ней определённого соединения; например: давления (если в реакции участвуют газы), электропроводности, показателя преломления, спектра поглощения реагента или продукта реакции в ультрафиолетовой, видимой либо инфракрасной областях. Широко используются спектры электронного парамагнитного резонанса (ЭПР) и ядерного магнитного резонанса (ЯМР).
Применение спектральных методов основано на том, что поглощение электромагнитного излучения пропорционально количеству вещества или его концентрации в системе.
Обычно экспериментально изучают реакции в замкнутой системе (т.е. при постоянном объёме) и представляют результаты графически в виде так называемой кинетической кривой, выражающей зависимость концентрации реагента или продукта реакции от времениt. Аналитический вид этой зависимости называетсяуравнением кинетической кривой. В отличие от основного кинетического уравнения, уравнения кривых расходования реагирующих веществ (или накопления продуктов реакции) содержат в качестве параметров начальные концентрации компонентов (С0) в момент времениt=0.
Из этих уравнений выводят формулы для расчёта константы скорости реакции и времени полупревращения(t½) – промежутка времени, в течение которого расходуется половина взятого исходного вещества, т.е. его концентрация уменьшится в 2 раза и станет равной Со/2.
В реакциях нулевого порядка концентрация исходного вещества линейно уменьшается со временем (рис. 37)
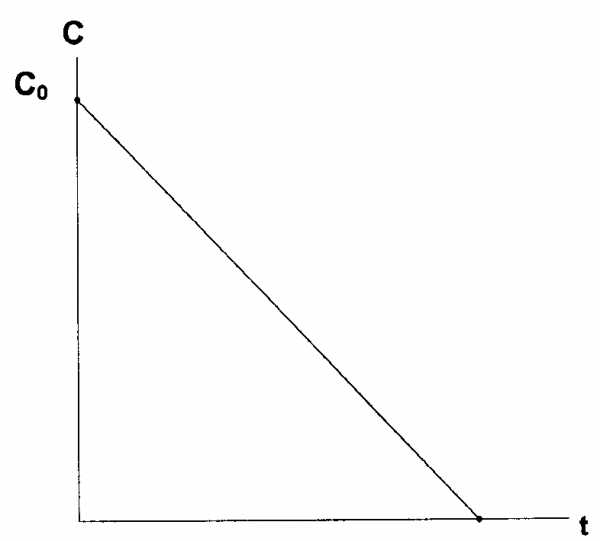
Рис. 37. Изменение концентрации исходного вещества от времени в реакции нулевого порядка
Математически данная линейная зависимость запишется следующим образом
С = С0–kt
где k – константа скорости, С0 – начальная молярная концентрация реагента, С – концентрация в момент времени t.
Из неё можно вывести формулу для расчёта константы скорости химической реакции нулевого порядка.
k
=
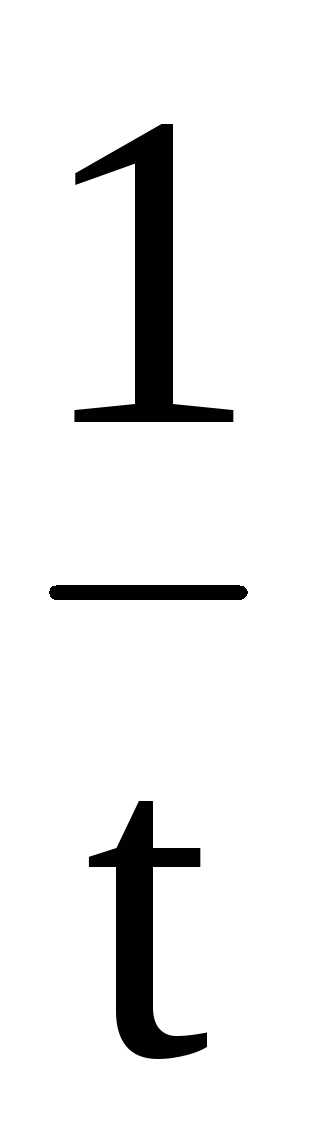 (C0
– C).
(C0
– C).
Константа скорости нулевого порядка измеряется в моль/л ∙ с (моль · л-1· с-1).
Время полупревращения для реакции нулевого порядка пропорционально концентрации исходного вещества
t½=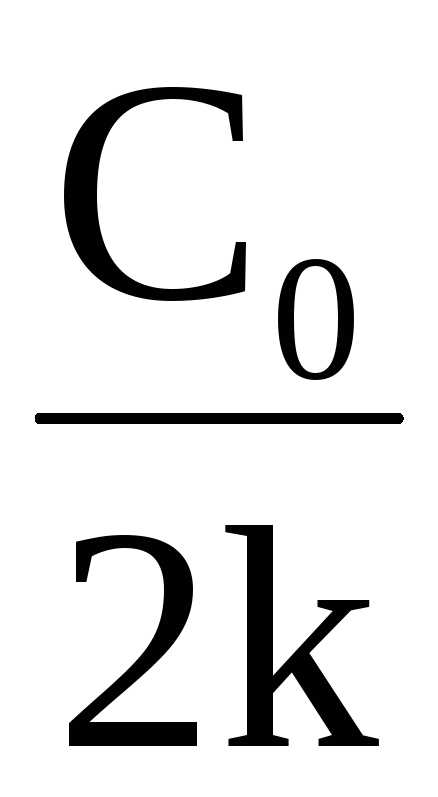
Для реакций первого порядка кинетическая кривая в координатах С,tносит экспоненциальный характер и выглядит следующим образом (рис. 38) Математически данная кривая описывается следующим уравнением
С = С0e—kt
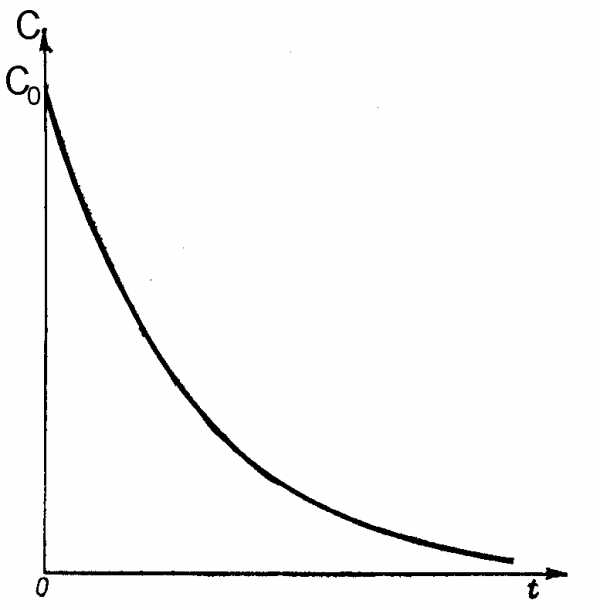
Рис. 38. Изменение концентрации исходного вещества от времени в реакции первого порядка
На практике для реакций первого порядка кинетическую кривую чаще всего строят в координатах ℓnC,t. В этом случае наблюдается линейная зависимость ℓnС от времени (рис. 39)
ℓnС = ℓnС0–kt
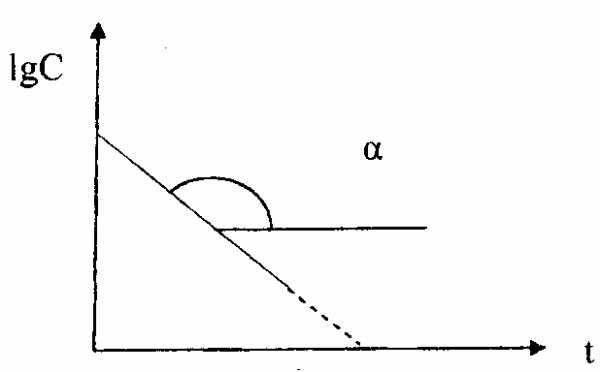
ℓnС
Рис. 39. Зависимость логарифма концентрации реагента от времени протекания для реакции первого порядка
Соответственно, величину константы скорости и время полупревращения можно рассчитать по следующим формулам
k
=
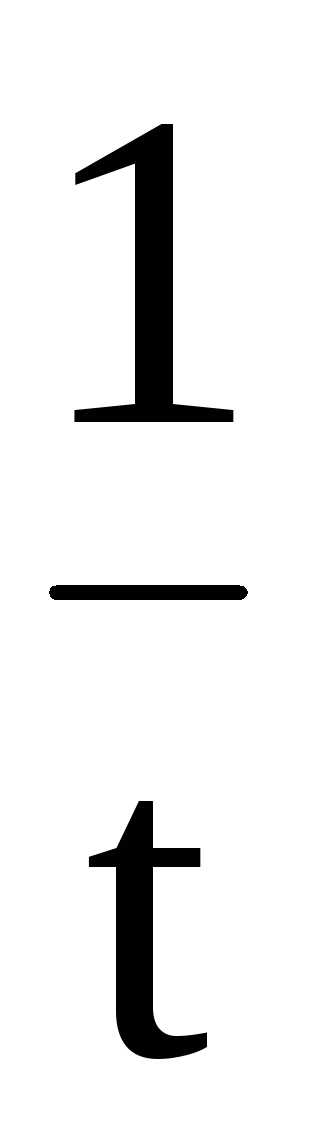 ℓn
ℓn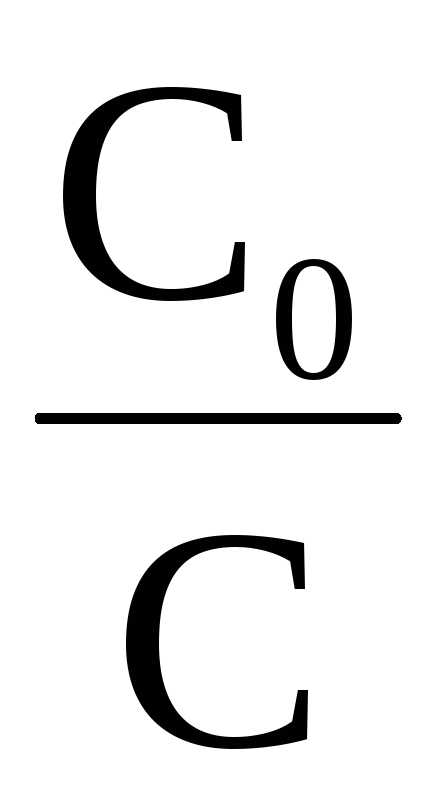 илиk= 2,303
илиk= 2,303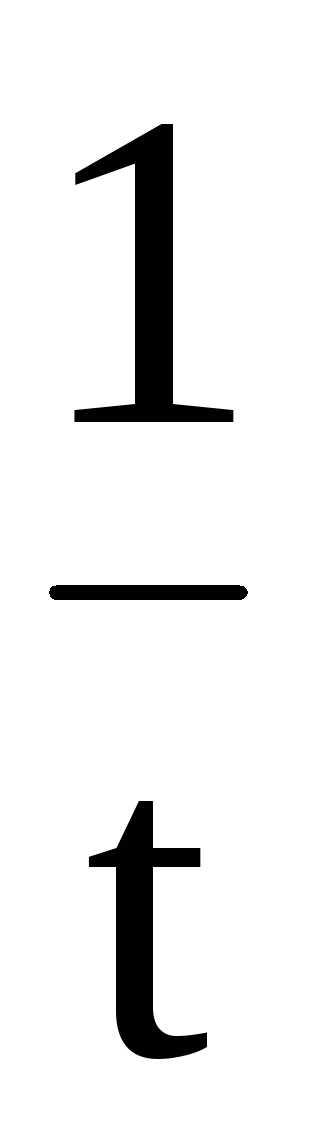 ℓg
ℓg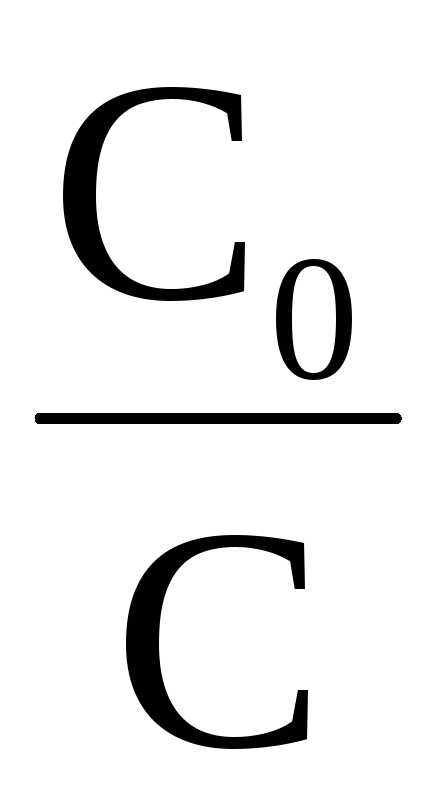
(при переходе от десятичного логарифма к натуральному).
t½ =
Константа скорости реакции первого порядка имеет размерность t –1 , т.е. 1/с и не зависит от единиц измерения концентрации.Она показывает долю, которую составляют молекулы, вступившие в реакцию за единицу времени, от общего числа молекул реагента в системе. Таким образом, в реакциях первого порядка за одинаковые промежутки времени расходуются одинаковы доли взятого количества исходного вещества.
Второй отличительной особенностью реакций первого порядка является то, что t½ для них не зависит от начальной концентрации реагента, а определяется только константой скорости.
Вид уравнения зависимости концентрации от времени для реакций второго порядка рассмотрим только для простейшего случая, когда в элементарном акте участвуют 2 одинаковые молекулы, или молекулы разных веществ, но начальные концентрации их (С0) равны. При этом линейная зависимость наблюдается в координатах 1/С,t(рис. 40). Математическое уравнение этой зависимости запишется следующим образом
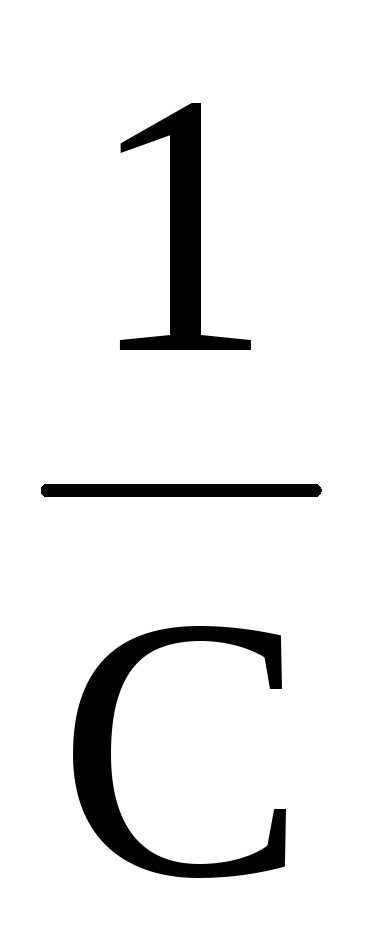 =
=
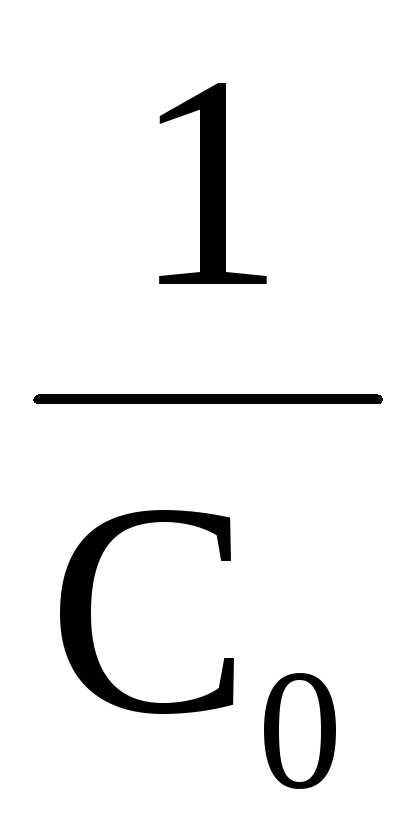 +kt
+kt
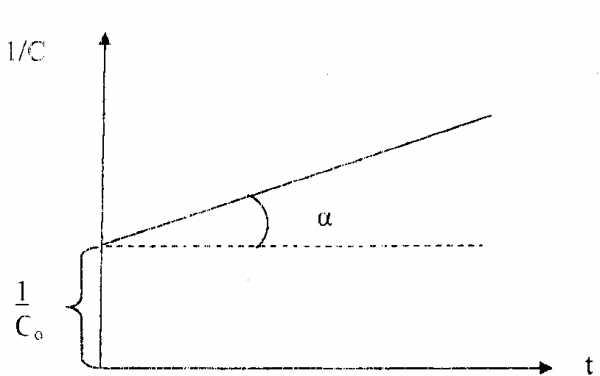
Рис. 40. Зависимость величины обратной концентрации реагента от времени для реакции второго порядка
Константа скорости вычисляется по формуле
k=
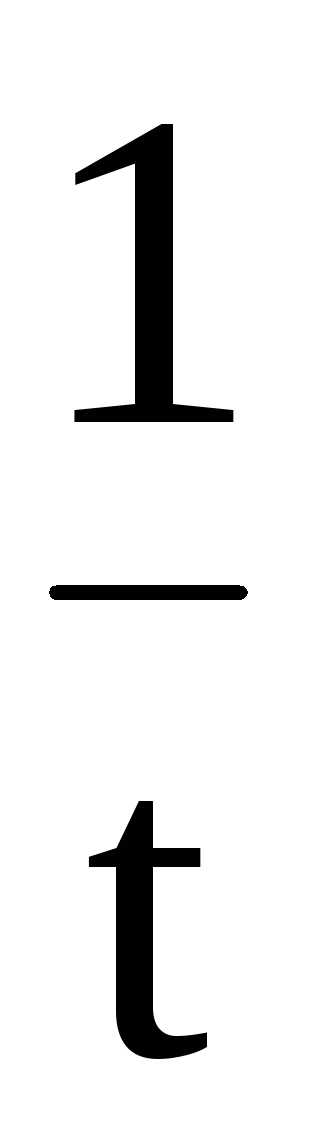 (
(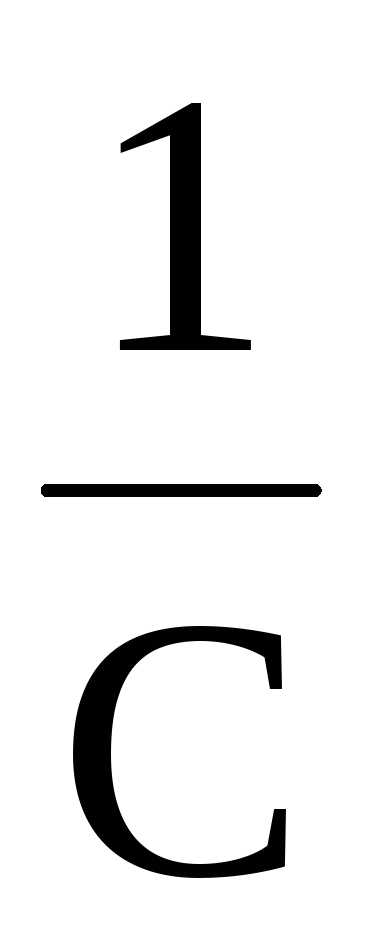 –
–
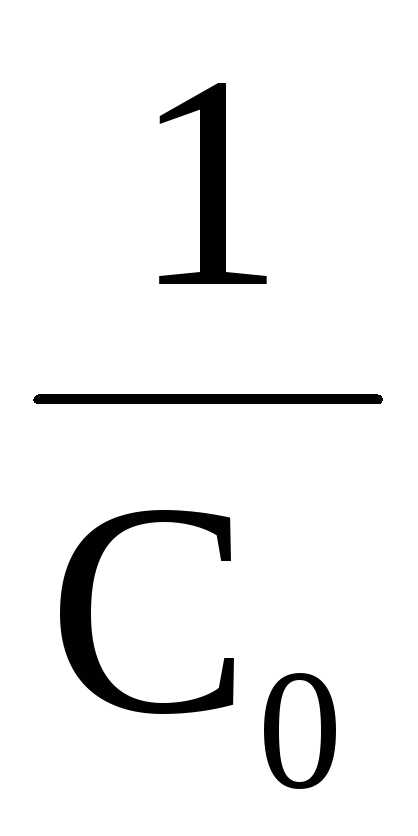 )
)
и измеряется в л∙с-1∙моль-1, т.е. ее численное значение зависит от того, в каких единицах измеряется концентрация вещества.
Период полупревращения реакций второго порядка обратно пропорционален начальной концентрации реагента
t½=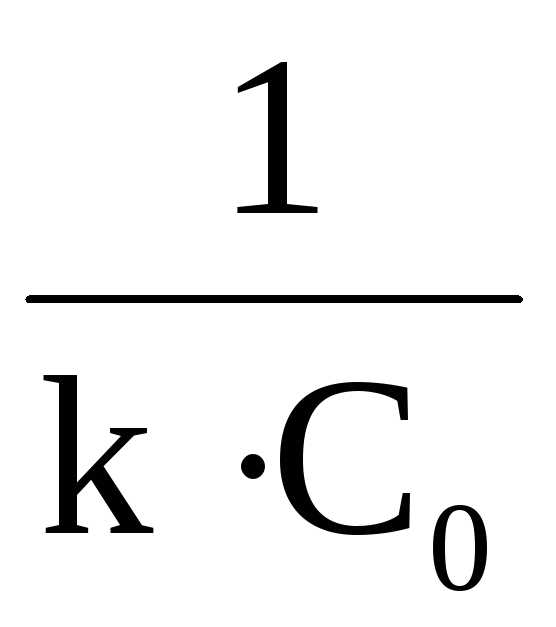
Это связано с тем, что скорость реакций второго порядка в сильной мере зависит от числа столкновений между молекулами реагирующих веществ в единицу времени, которое, в свою очередь, пропорционально числу молекул в единице объема, т.е. концентрации вещества. Таким образом, чем больше концентрация вещества в системе, тем чаще сталкиваются молекулы между собой и тем за меньший промежуток времени половина их успеет прореагировать.
Реакции третьего порядка, как уже было сказано ранее, встречаются крайне редко и не представляют практического интереса. Поэтому в связи с этим мы их не будем рассматривать.
studfiles.net
Тема 6. Скорость химической реакции.
Часть I
1. Скорость химической реакции (Vp)– это изменение концентраций реагирующих веществ в единицу времени.
Формула для нахождения Vp = ΔC/Δt
2. Концентрация – это количество реагентов, участвующих в химической реакции.
3. Химическая кинетика – это раздел химии, в котором изучают скорости и механизмы реакций.
4. Зависимость Vp от природы реагирующих веществ на примере взаимодействия:
кислота + металл = соль + водород.
5. Зависимость Vp от концентрации – при увеличении Vp растёт.
6. Пути повышения Vp:
Зависимость Vp от концентрации и от температуры – прямо пропорциональная зависимость – это закон Вант-Гоффа.
Vp зависит от катализатора (см. тему следующего урока).
Часть II
1. Единица измерения скорости химической реакции:
1) моль/л•с
2. Скорость любой химической реакции зависит от:
2) температуры
3. С наибольшей скоростью с водородом реагирует:
1) фтор
4. С наименьшей скоростью с водой реагирует:
1) литий
5. Одинаковые по размеру кусочки магния взаимодействуют с наибольшей скоростью с соляной кислотой, если:
2) увеличить концентрацию кислоты
6. Для увеличения скорости химической реакции
необходимо:
4) увеличить концентрацию кислоты
Создайте изображение, показывающее зависимость Vp от площади соприкосновения реагирующих веществ.
7. Какой график отражает зависимость Vp от t?
Ответ: 3.
superhimik.ru
Скорость химической реакции — это… Что такое Скорость химической реакции?
величина, характеризующая интенсивность реакции химической (См. Реакции химические). Скоростью образования продукта реакции называется количество этого продукта, возникающее в результате реакции за единицу времени в единице объёма (если реакция гомогенна) или на единице площади поверхности (если реакция гетерогенна). Для исходных веществ аналогичным образом определяется скорость их расходования. Количества веществ выражают в молях (См. Моль). Тогда скорости образования продуктов и расходования исходных веществ относятся как стехиометрия, коэффициенты этих веществ в уравнении реакции. Например, в случае реакции N2 + ЗН2 = 2NH3 скорость расходования водорода в 3 раза, а скорость образования аммиака в 2 раза больше скорости расходования азота. Отношение скорости образования продукта реакции, или скорости расходования исходного вещества, к соответствующему стехиометрическому коэффициенту называется С. х. р. В случае гомогенной реакции, происходящей в закрытой системе постоянного объёма, С. х. р. ci — концентрация продукта реакции, т. е. число молей его в единице объёма, bi — стехиометрический коэффициент этого вещества, t — время. Это уравнение применимо и к исходному веществу, если, как принято, стехиометрические коэффициенты исходных веществ считать отрицательными.Для технических целей скорости гетерогенно-каталитических реакций обычно рассчитывают не на единицу поверхности катализатора, а на единицу массы катализатора или на единицу объёма слоя гранул катализатора.
С. х. р. может варьировать в чрезвычайно широких пределах — от очень малой (в случае геологического процессов, длящихся миллионы лет) до очень большой (в случае ионных реакций, завершающихся за миллионные доли секунды). О теории С. х. р. см. Кинетика химическая.Для измерения С. х. р. служат разнообразные методы. Выбор метода определяется характером реакции и её скоростью. Не затрагивая реакций специальных типов (электродные, фотохимические, радиационно-химические), охарактеризуем основные методы измерения скоростей обычных реакций, обусловленных энергией теплового движения. При использовании статического метода реакцию проводят в замкнутом сосуде. О её скорости судят по изменению состава реагирующей смеси на основании анализа проб или по какому-либо свойству реагирующей смеси, зависящему от состава. В случае газовых реакций, сопровождаемых изменением числа молекул, часто следят за реакцией по изменению давления. Проточный метод заключается в том. что реагирующую смесь пропускают с постоянной скоростью сквозь зону реакции: для гетерогенной реакции — это обычно объём, заполненный гранулами катализатора; в случае гомогенной реакции — область повышенной температуры. Степень превращения исходных веществ в продукты определяют по составу смеси, выходящей из зоны реакции.
Оба указанных метода просты для осуществления, но не дают непосредственно значения С. х. р. В статической системе состав реагирующей смеси, а следовательно и С. х. р., изменяется во времени; поэтому требуется дифференцирование измеренной величины концентрации по времени для определения скорости реакции или интегрирование по времени теоретические выражения скорости реакции для сопоставления его с опытными данными. В случае проточного метода состав реагирующей смеси не зависит от времени, но различен в разных участках зоны реакции; поэтому сопоставление теоретического выражения для С. х. р. с результатами опыта требует предварительного интегрирования этого выражения по объёму зоны реакции.
Прямое измерение скорости гомогенной реакции достигается с помощью проточного перемешиваемого реактора. В сосуд, снабженный мощной мешалкой, с постоянной скоростью вводят исходные вещества и выводят реагирующую смесь так, чтобы её количество в реакционном сосуде было постоянно. При установившемся стационарном состоянии анализ отбираемой смеси показывает состав реагирующей смеси. Зная, кроме того, скорость отбора этой смеси, определяют количество вещества, образовавшегося в результате реакции за единицу времени, а отсюда — С. х. р. Для гетерогенно-каталитических процессов с неподвижным катализатором эквивалентом описанного метода является проточно-циркуляционный метод: однородность состава реагирующей смеси в зоне реакции достигается с помощью создаваемой насосом интенсивной циркуляции реагирующей смеси. Проточные перемешиваемые реакторы и проточно-циркуляционные системы принадлежат к классу безградиентных реакторов, называемых так потому, что в них практически отсутствуют градиенты (перепады) концентраций, а также температуры в зоне реакции.
Особые трудности возникают при изучении очень быстрых реакций в растворах. Если реакция успевает пройти в значительной степени за время, которое требуется для смешения растворов исходных веществ, то обычные методы непригодны. Задача измерения скоростей таких реакций решается с помощью релаксационных методов, разработанных М. Эйгеном. Система, в которой может происходить обратимая реакция, вначале находится в состоянии равновесия химического (См. Равновесие химическое). Затем весьма быстро изменяют параметр, влияющий на значение константы равновесия: температуру, давление или электрическое поле. Система переходит к новому состоянию равновесия в течение некоторого времени; этот процесс называется релаксацией (См. Релаксация). Следя за изменением состава каким-либо безынерционным методом (например, по электропроводности), определяют С. х. р. Удаётся наблюдать время релаксации до 10-6 сек: таким путём была измерена, например, скорость реакции Н++ OH— = H2O в воде.Лит.: Кондратьев В. Н., Определение констант скорости газофазных реакций, М., 1971; Колдин Е., Быстрые реакции в растворе, пер. с англ., М., 1966; Проблемы теории и практики исследований в области катализа, под ред. В. А. Ройтера, К., 1973, гл. 3; Уэйт Н., Химическая кинетика, пер. с англ., М., 1974.
М. И. Тёмкич.
dic.academic.ru
Скорость химической реакции
Термин скорость реакции означает скорость, с которой расходуются реагенты при протекании химической реакции. Скорости реакций могут сильно отличаться. В некоторых реакциях превращение исходных реагентов в продукты реакции происходит мгновенно, например, взрывы, ионные реакции.
Так как химические процессы могут протекать в системах, состоящих из одной или нескольких фаз, то различают гомогенные и гетерогенные реакции. Гомогенные химические реакции протекают в одной фазе, например, в смеси газов, в жидком растворе, в твердом теле. В таких системах реакции протекают во всем объеме. Системы, состоящие из нескольких фаз, являются гетерогенными. В них реакция протекает на поверхности раздела фаз. Скорости гомогенных и гетерогенных реакций определяются различно.
При протекании химической реакции с течением времени изменяются количества реагирующих веществ. Однако изменение количества вещества в реакционном пространстве может быть обусловлено как протеканием реакции, так и обменом веществом с окружающей средой. Поэтому отдельно рассматривают кинетику химических реакций в закрытых и открытых системах.
Мы будем рассматривать закрытые системы. В закрытой системе изменение количества вещества с течением времени происходит только за счет протекания реакции.
Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени, в единице объёма (для гомогенных реакций) или на единице поверхности раздела фаз (для гетерогенных реакций). Обычно скорость реакции характеризуют изменением количества вещества, вступившего в реакцию или образовавшегося в результате реакции за единицу времени в единице объёма (для гомогенной реакции) или на единице поверхности раздела фаз (для гетерогенной реакции). В последнем случае если площадь поверхности твердого тела нельзя измерить, то скорость гетерогенной реакции относят к единице массы или объёма твердой фазы, а не к единице площади поверхности.
Таким образом, скорость химической реакции в газовой фазе или в растворе определяется изменением числа молекул (или числа молей n) вещества в единицу времени в единице объёма:
v = ± (1).
Знак плюс используют, если скорость реакции определяют по продукту, а минус – по исходному реагенту. Если реакция протекает при постоянном объёме, то скорость выражают через молярную концентрацию
с = (2),
которая имеет размерность моль∙л-1
v = ± (3).
Молярную концентрацию часто обозначают квадратными скобками, например, концентрация вещества А запишется как [А]. Для реакции
аА + bB + …→dD + eE + …
скорость определяют образом
v = — = — = = (4),
где а, b, с, d – стехиометрические коэффициенты; A, B, C, D – символы веществ.
Если в моменты времени t1 и t2 концентрация одного из исходных веществ равны соответственно с1 и с2, то среднюю скорость vср в интервале времени t1 и t2 можно найти по формуле
vср = (с1 – с2)/(t1 – t2) = — (5).
Поскольку речь идет об убыли концентрации исходного вещества, изменение концентрации берется со знаком минус. На рисунке приведен график зависимости концентрации исходного вещества от времени.
Для реакций, протекающих в газовой фазе, скорость реакции можно определить через парциальные давления веществ. Скорость реакции выражают в различных единицах: моль∙л-1 ∙сек-1; моль ∙см-3 ∙сек-1; Па ∙сек-1 .
О скорости реакции можно судить также по скорости изменения какого-либо свойства системы, например, окраски, интенсивности поглощения света, угла оптического вращения, электропроводности.
Экспериментальное определение скорости реакции
Рассмотрим экспериментальное определение скорости реакции на примере реакции, описываемой уравнением:
Дело осложняется тем, что в ходе реакции ее скорость меняется. Обычно скорость реакции максимальна вначале и постепенно уменьшается, приближаясь к нулевой.
После добавления разбавленной хлороводородной кислоты НСl к карбонату кальция, реакционная смесь сразу же бурно вскипает из-за быстрого образования диоксида углерода. По мере замедления реакции выделение пузырьков уменьшается. Выделяющийся диоксид углерода собирают с помощью газовой пипетки (газового шприца) и определяют его объём. За изменением скорости реакции можно проследить, измеряя объем выделившегося СО2 через равные промежутки времени по мере протекания реакции. Результаты эксперимента приведены в таблице 1.
Таблица 1
Объём, выделившегося диоксида углерода в результате реакции
взаимодействия хлороводородной кислоты с карбонатом кальция
| Время, с | Объем, собранного СО2 , см3 |
Если по этим данным построить график, то получится кривая скорости реакции.
Кривая скорости реакции показывает изменение со временем количества образующегося продукта либо используемого реагента.
Кривая скорости реакции показывает изменение со временем количества образующегося продукта.
Угол наклона касательной к кривой скорости реакции в какой-либо её точке, показывает, насколько быстро протекает реакция в соответствующий момент времени. Чем круче угол наклона касательной к кривой скорости, тем быстрее протекает реакция.
На рис. 1 представлены угол наклона касательной к кривой скорости, соответствующий начальной скорости реакции (касательная 1) и в момент t=35 сек (касательная 2). По наклону касательной к кривой скорости реакции видно, что реакция протекает быстрее в первый момент. По мере протекания реакции наклон касательной к кривой уменьшается, то есть скорость реакции замедляется.
Для измерения скорости реакции используют различные методы: физические, химические, электрохимические.
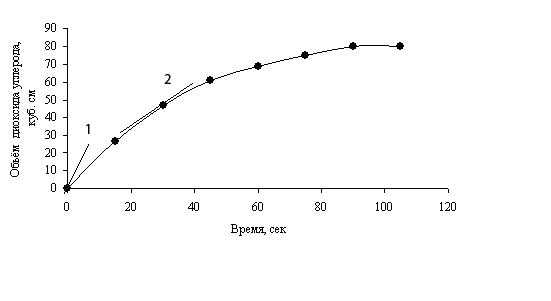
Рис. 1. Кривая скорости реакции между разбавленной HCl и CaCO3
Физические методы измерения скорости реакции обычно применяют для нахождения изменения давления или объёма в ходе реакции. Если число молей газообразных исходных реагентов не отличается от числа молей газообразных продуктов, то в этом случае нельзя определить скорость реакции, измеряя давление или объём.
Например, для реакции
2NO (г) + O2 (г) → 2NO2 (г)
можно определить скорость реакции, измеряя давление или объём. Однако в реакции
H2 (г) + I2 (г) → 2HI (г)
не происходит изменения объёма. Поэтому скорость этой реакции нельзя определить, измерением давления или объёма.
Химические методы анализа также используют для измерения скорости реакции. Отбирая небольшие пробы реакционной смеси в разные моменты времени и анализируя их тем или иным химическим методом, определяют скорость реакцию Например, реакция омыления этилацетата
C2H5CO2C2H5 (водн.) + NaOH (водн.) → C2H5CO2Na (водн.) + С2Н5ОН (водн.)
Через равные промежутки времени по мре протекания реакции из реакционной смеси берут пробу и титруют её кислотой. Это дает возможность определить концентрации гидроксида натрия в реакционной смеси в ходе реакции, и соответственно его убыль и скорость реакции.
Электрохимические методы также позволяют измерить скорости многих реакций. Используя измерение электропроводности, можно определить скорость реакции. Например, измерение электропроводности можно использовать для определения скорости омыления этилацетата. В данном случае электропроводность почти полностью обусловлена гидроксидом натрия, так как он является единственным сильным электролитом в реакционной смеси. По мере протекания реакции происходит потребление гидроксида натрия и следовательно уменьшение электропроводности раствора. По уменьшению электропроводности можно судить о скорости реакции. При этом нет необходимости брать образцы из реакционной смеси.
Похожие статьи:
poznayka.org
