Фосфор. Фосфин | АЛХИМИК
Фосфор
Следующий за азотом элемент пятой группы, фосфор, был открыт на несколько столетий раньше своего предшественника по подгруппе. По иронии судьбы фосфор открывали несколько раз, причём всякий раз получали его из мочи. Есть упоминания о том, что арабский алхимик Альхильд Бехиль открыл фосфор при перегонке мочи в смеси с глиной, известью и углём. Однако достоверное открытие и описание свойств этого вещества принадлежит немецкому алхимику-любителю Хеннигу Бранду. В 1669 г. Бранд был занят поиском магической жидкости, с помощью которой можно превращать неблагородные металлы в золото. В одном из экспериментов он пытался получить ее из большого количества мочи, предварительно собранной в солдатских казармах. При её нагревании Бранду удалось выделить тяжелое красное масло, которое перегонялось с образованием твёрдого остатка. Нагревая последний без доступа воздуха, он заметил образование белого дыма, оседавшего на стенках сосуда и ярко светившегося в темноте. Бранд и назвал полученное им вещество фосфором, что в переводе с греческого означает «светоносец».

 Красный фосфор
Красный фосфорНесколько лет «рецепт приготовления» фосфора хранился в строжайшей тайне и был известен лишь нескольким алхимикам. В 1680 г. это вещество независимо от Бранда выделил Р.Бойль.
В несколько модифицированном виде старинный метод получения фосфора использовали и в XVIII столетии: нагреванию подвергались смесь мочи с оксидом свинца, поваренной солью, поташом и углем. Лишь в 1774 г. К. В. Шееле разработал способ получения фосфора из рога и костей животных.
В наши дни фосфор производят в электрических печах, восстанавливая апатит углём в присутствии кремнезёма:
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 5CO↑ + P2↑
Пары фосфора при этой температуре почти полностью состоят из молекул Р 2, которые при охлаждении конденсируются в молекулы Р4.
При конденсации паров образуется белый (желтый) фосфор, который состоит из молекул Р4, имеющих форму тетраэдра. Это очень реакционноспособное мягкое воскообразное вещество бледно-желтого цвета, растворимое в сероуглероде и бензоле. На воздухе фосфор воспламеняется при 34 оС. Он обладает уникальной способностью светиться в темноте за счет медленного окисления до низших оксидов. Именно белый фосфор и был в своё время выделен Брандом.
Если белый фосфор нагревать без доступа воздуха, он переходит в красный (впервые его получили лишь в 1847 г.). Название красный фосфор относится сразу к нескольким модификациям, различающихся по плотности и окраске: она колеблется от оранжевой до тёмно-красной и даже фиолетовой. Все разновидности красного фосфора нерастворимы в органических растворителях, по сравнению с белым фосфором они менее реакционноспособны (воспламеняются на воздухе при t>200
При повышенном давлении белый фосфор переходит в чёрный фосфор, построенный из объёмных шестиугольников с атомами фосфора в вершинах, связанных друг с другом в слои. Впервые это превращение осуществил в 1934 г. американский физик Перси Уильямс Бриджмен. Структура чёрного фосфора напоминает графит, с той лишь разницей, что слои, образованные атомами фосфора, не плоские, а «гофрированные». Черный фосфор – это наименее активная модификация фосфора. При нагревании без доступа воздуха он, как и красный, переходит в пар, из которого конденсируется белый фосфор.
Белый фосфор очень ядовит: смертельная доза около 0,1 г. Из-за опасности самовоспламенения на воздухе его хранят под слоем воды. Красный и чёрный фосфор менее ядовиты, так как нелетучи и практически нерастворимы в воде.
Аллотропные модификации фосфораХимические свойства
Наиболее химически активным является белый фосфор (в уравнениях реакций с участием белого фосфора для простоты записывают как Р, а не Р4, тем более, что аналогичные реакции возможны и с участием красного фосфора, молекулярный состав которого неопределен). Фосфор непосредственно соединяется со многими простыми и сложными веществами. В химических реакциях фосфор, как и азот, может быть и окислителем, и восстановителем.
Как окислитель фосфор взаимодействует со многими металлами с образованием фосфидов, например:
2P + 3Ca = Ca3P2
P + 3Na = Na3P
Обратите внимание, что непосредственно с водородом фосфор практически не соединяется.
Как восстановитель фосфор взаимодействует с кислородом, галогенами, серой (т.е. с более электроотрицательными неметаллами). При этом в зависимости от условий проведения реакций могут образовываться как соединения фосфора (III), так и соединения фосфора (V).
а) при медленном окислении или при недостатке кислорода фосфор окисляется до оксида фосфора (III), или фосфористого ангидрида Р2О3:
4Р + 3О2 = 2Р2О3
При сгорании фосфора в избытке кислорода (или воздуха) образуется оксид фосфора (V), или фосфорный ангидрид Р2О5:
4Р + 5О2 = 2Р2О5
б) в зависимости от соотношения реагентов при взаимодействии фосфора с галогенами и серой образуются соответственно галогениды и сульфиды трех- и пятивалентного фосфора; например:
2Р + 5Cl2(изб.) = 2PCl5
2P + 3Cl2(недост.) = 2PCl3
2P + 5S(изб.) = P 2S5
2P + 3S(недост.) = P2S3
Следует отметить, что с йодом фосфор образует только соединение PI3.
Роль восстановителя фосфор играет в реакциях с кислотами-окислителями:
— с разбавленной азотной кислотой:
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑
— с концентрированной азотной кислотой:
P + 5HNO3 = H3PO4 + 5NO2↑ + H2O
— с концентрированной серной кислотой:
2P + 5H2SO4 = 2H3PO4 + 5SO2↑ + 2H2O
С другими кислотами фосфор не взаимодействует.
При нагревании с водными растворами щелочей фосфор подвергается диспропорционированию, например:
4P + 3KOH + 3H2O = PH3↑ + 3KH2PO2
8P + 3Ba(OH)2 + 6H2O = 2PH3
Кроме фосфина РН3 в результате этих реакций образуются соли фосфорноватистой кислоты Н3РО2 – гипофосфиты, в которых фосфор имеет характерную степень окисления +1.
Применение фосфора
Основная часть производимого в мире фосфора расходуется на производство фосфорной кислоты, из которой получают удобрения и другие продукты. Красный фосфор используется при изготовлении спичек, он содержится в массе, которая наносится на спичечную коробку.
Фосфин
Наиболее известным водородным соединением фосфора является фосфин РН3. Фосфин – бесцветный газ с чесночным запахом, очень ядовит. Хорошо растворимый в органических растворителях. В отличие от аммиака малорастворим в воде. Практического значения фосфин не имеет.
Получение
Выше был рассмотрен способ получения фосфина при взаимодействии фосфора с водными растворами щелочей. Другой способ – действие соляной кислоты на фосфиды металлов, например:
Zn3P2 + 6HCl = 2PH3↑ + 3ZnCl2
Химические свойства
- Кислотно – основные свойства
Будучи малорастворим в воде, фосфин образует с ней неустойчивый гидрат, который проявляет очень слабые основные свойства:
PH3 + H2O ⇄ PH3∙H2O ⇄ PH4+ + OH—
Соли фосфония образуются только с сильными кислотами:
PH3 + HCl = PH4Cl
PH3 + HClO4 = PH4ClO4
- Окислительно – восстановительные свойства
Как и азот в аммиаке, фосфор в молекуле фосфина имеет низшую степень окисления – 3. Однако для фосфора эта степень окисления менее устойчива, чем для азота, поэтому фосфин проявляет более ярко выраженные восстановительные свойства, чем аммиак. Так, фосфин при температуре около 150
2PH3 + 4O2 = P2O5 + 3H2O
Фосфин восстанавливает соли некоторых малоактивных металлов до свободных металлов, например:
PH3 + 8AgNO3 + 4H2O = H3PO4 + 8Ag + 8HNO3
Скачать:
Скачать бесплатно реферат на тему: «Фосфор» Фосфор.doc (7 Загрузок)
а также на тему: «Фосфор и его соединения» Фосфор-и-его-соединения.doc (5 Загрузок)
Весь список рефератов можно посмотреть здесь
*на изображении записи фотография белого фосфора
Читайте также
Похожее
al-himik.ru
Содержание
Инструкция
|
completerepair.ru
4.2. Фосфор
Фосфор представлен в природе одним изотопом — 31Р, кларк фосфора равен 0,05 мол.%. Встречается в виде фосфатных минералов: Ca3(PO4)2 — фосфорит, Ca5(PO4)3X (X = F,Cl,OH) — апатиты. Входит в состав костей и зубов животных и человека, а также в состав нуклеиновых кислот (ДНК и РНК) и аденозинфосфорных кислот (АТФ, АДФ и АМФ).
Получают фосфор восстановлением фосфорита коксом в присутствии диоксида кремния.
t
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
Простое вещество — фосфор — образует несколько аллотропных модификаций, из которых основными являются белый, красный и черный фосфор. Белый фосфор образуется при конденсации паров фосфора и представляет собой белое воскоподобное вещество (т.пл. 44 С), нерастворимое в воде, растворимое в некоторых органических растворителях. Белый фосфор имеет молекулярное строение и состоит из тетраэдрических молекул P4.
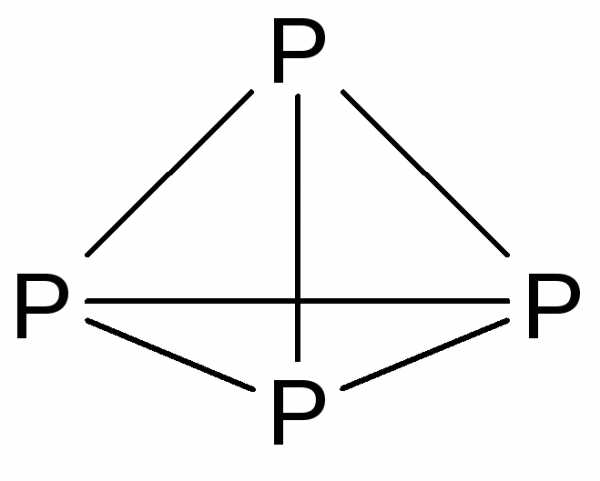
Напряженность связей (валентный угол P-P-P составляет всего 60 ) обусловливает высокую реакционную способность и токсичность белого фосфора (смертельная доза около 0,1 г). Поскольку белый фосфор хорошо растворим в жирах, в качестве антидота при отравлении нельзя применять молоко. На воздухе белый фосфор самопроизвольно воспламеняется, поэтому хранят его в герметически упакованной химической посуде под слоем воды.
Красный фосфор имеет полимерное строение. Получается при нагревании белого фосфора или облучении его светом. В отличие от белого фосфора малореакционноспособен и нетоксичен. Однако остаточные количества белого фосфора могут придавать красному фосфору токсичность!
Черный фосфор получается при нагревании белого фосфора под давлением 120 тыс.атм. Имеет полимерное строение, обладает полупроводниковыми свойствами, химически устойчив и нетоксичен.
Химические свойства. Белый фосфор самопроизвольно окисляется кислородом воздуха при комнатной температуре (окисление красного и черного фосфора идет при нагревании). Реакция протекает в два этапа и сопровождается свечением (хемилюминесценция).
t t
2P + 3O2 = 2P2O3; P2O3 + O2 = P2O5
Ступенчато происходит также взаимодействие фосфора с серой и галогенами.
t t
2P + 3Cl2 = 2PCl3; PCl3 + Cl2 = PCl5
При взаимодействии с активными металлами фосфор выступает в роли окислителя, образуя фосфиды — соединения фосфора в степени окисления -3.
t
3Ca + 2P = Ca3P2
Кислотами-окислителями (азотная и концентрированная серная кислоты) фосфор окисляется до фосфорной кислоты.
P + 5HNO3(конц) = H3PO4 + 5NO2 + H2O
При кипячении с растворами щелочей белый фосфор диспропорционирует:
4P0 + 3KOH + 3H2O = P-3H3 + 3KH2P+1O2
фосфин гипофосфит калия
Соединения фосфора
Соединения со степенью окисления –3. Фосфиды s-элементов представляют соединения с ионно-ковалентным типом связи, они солеподобны, легко разлагаются водой:
Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3
Фосфиды d-металлов являются соединениями переменного состава (бертолидами), обычно тугоплавки, имеют металлический блеск, электропроводны и химически малоактивны.
Ковалентным фосфином является PH3 — фосфин — бесцветный газ, с характерным неприятным запахом чеснока, очень токсичен. На воздухе самопроизвольно воспламеняется, в воде малорастворим. В отличие от аммиака образует соли только с очень сильными кислотами.
2PH3 + 4О2 = Р2O5 + 3H2O; PH3 + HI = РH4I
иодид фосфония
Образуется фосфин при диспропорционировании белого фосфора в щелочных растворах. Лабораторным методом получения является гидролиз фосфидов:
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
Соединения со степенью окисления +1. Наиболее важными соединениями фосфора в степени окисления +1 являются фосфорноватистая кислота и ее соли — гипофосфиты. Фосфорноватистая кислота — H[H2PO2] — бесцветное кристаллическое вещество, хорошо растворимое в воде, сильная одноосновная кислота (Ka = 810-2).
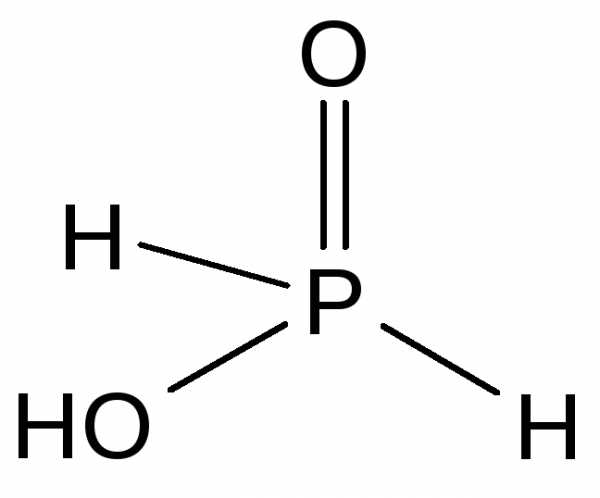
Фосфорноватистая кислота и гипофосфиты — сильные восстановители. При нагревании фосфорноватистая кислота диспропорционирует:
3H[H2P+1O2] = P-3H3 + 2H2[HP+3O3]
фосфористая кислота
Соединения со степенью окисления +3. Степень окисления +3 фосфор имеет в галогенидах, оксиде, фосфористой кислоте – H2[HPO3] — и ее солях — фосфитах. PF3 — газ, PCl3 и PBr3 – жидкости, дымящиеся на воздухе вследствие гидролиза.
PCl3 + 3H2O = H2[HPO3] + 3HCl
Молекула тригалогенида фосфора имеет геометрию тригональной пирамиды с атомом фосфора в вершине. В образовании связей принимают участие sp3-гибридные орбитали, валентный угол составляет приблизительно 100.

Оксид фосфора(III) — P2O3 – существует в нескольких модификациях, построенных из пирамидальных структурных единиц — PO3. Обычная форма имеет молекулярную решетку, образованную молекулами – P4O6 – бесцветное кристаллическое вещество следующего строения:
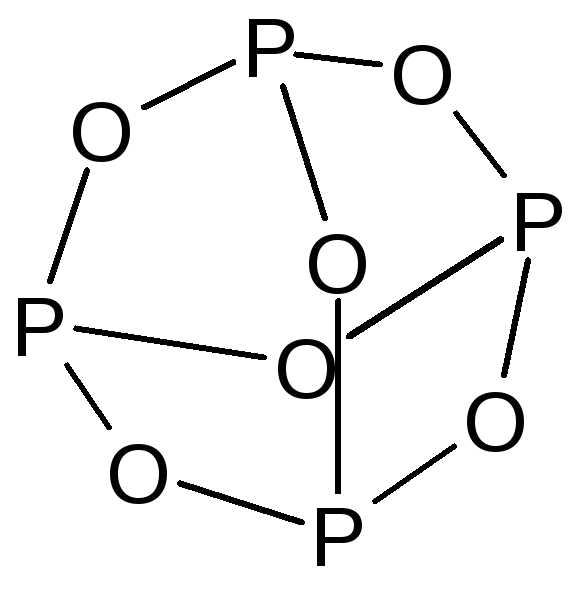
По химическим свойствам типичный кислотный оксид — ангидрид фосфористой кислоты.
P2O3 + 3H2O = 2H2[HPO3]; P2O3 + 4NaOH = 2Na2[HPO3] + H2O
Фосфористая кислота — H2[HPO3] — бесцветные гигроскопичные кристаллы, хорошо растворимые в воде. H2[HPO3] является сильной двухосновной кислотой (K1 = 210-2, K2 = 610-7).
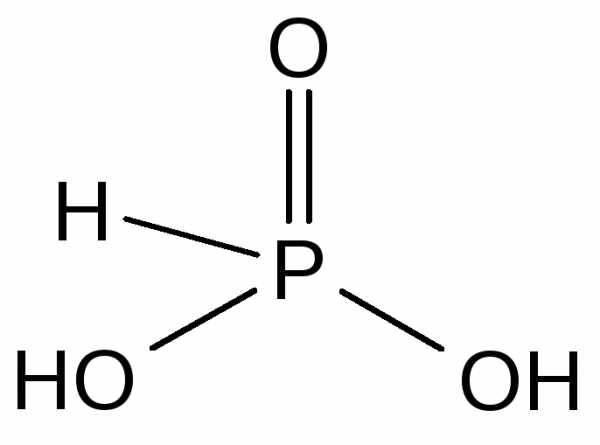
Фосфористая кислота и её соли — фосфиты — сильные восстановители.
Hg+2Cl2
+ H2[HP+3O3]
+ H2O
= H3P+5O4
+ Hg
Соединения со степенью окисления +5. Основные соединения фосфора в степени окисления +5: PHal5, POHal3 (Hal = F, Cl, Br), P2O5, H3PO4 и ее соли.
Фторид фосфора(V) — газообразное вещество, молекула которого имеет геометрию тригональной бипирамиды:
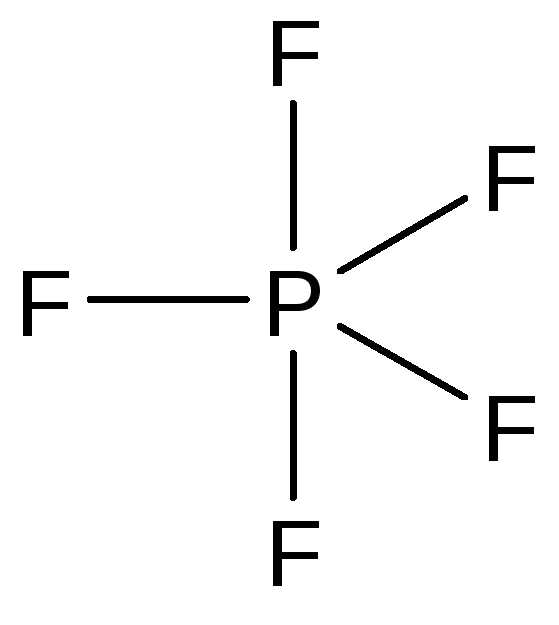
Аналогичное строение имеют другие галогениды фосфора(V) в газообразном состоянии. В кристаллах их строение соответствует следующим формулам: [PCl4]+[PCl6]—, [PBr4]+Br—. Галогениды фосфора — реакционноспособные и гидролитически неустойчивые соединения.
PF5 + HF = H[PF6]; PCl5 + 4H2O = H3PO4 + 5HCl
Оксогалогениды фосфора(V) также гидролитически неустойчивы, например:
POCl3 + 3H2O = H3PO4 + 3HCl
Широко применяются в органической химии для получения хлорсодержащих и фосфорорганических соединений.
Оксид фосфора(V) — P2O5, точнее P4O10 — бесцветное снегоподобное вещество.
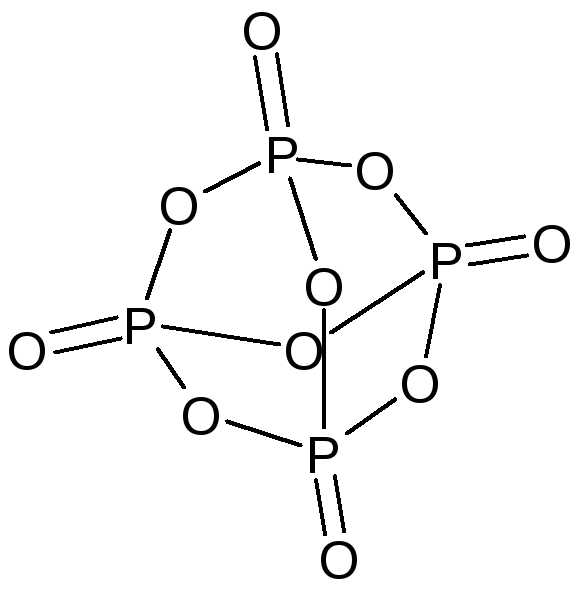
Типичный кислотный оксид, реакция с водой идет ступенчато и приводит в конечном счете к образованию ортофосфорной кислоты:
t
P2O5 + H2O = 2HPO3; HPO3 + H2O = H3PO4
метафосфорная кислота ортофосфорная кислота
Повышенное сродство к воде позволяет использовать оксид фосфора(V) для осушки газов и органических растворителей, а также в качестве водоотнимающего средства, например:
P2O5 + 2HClO4 = 2HPO3 + Cl2O7
Ортофосфорная кислота — H3PO4 — бесцветные гигроскопичные кристаллы (т.пл. 42 С) неограниченно растворимые в воде.
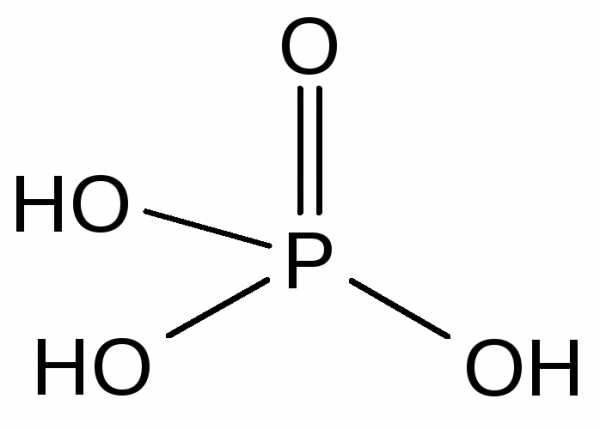
Кислота средней силы при диссоциации по первой ступени (K1 = 810-3), слабая — при диссоциации по второй и третьей ступеням (K2 = 610-8, K3 = 110-12). Образует три ряда солей, например, NaH2PO4 — дигидрофосфат натрия; Na2HPO4 — гидрофосфат натрия; Na3PO4 — фосфат (ортофосфат) натрия. Фосфаты щелочных металлов и аммония хорошо растворимы в воде. Фосфаты остальных металлов малорастворимы. Переход к кислым солям сопровождается заметным повышением растворимости. Фосфаты щелочноземельных металлов и аммония применяются в качестве фосфорных удобрений: Ca3(PO4)2 — фосфоритная мука; CaHPO42H2O — преципитат; Ca(H2PO4)2H2O — двойной суперфосфат; Ca(H2PO4)2H2O + 2CaSO4 — суперфосфат; NH4H2PO4 + (NH4)2HPO4 — аммофос. Широко применяются комбинированные удобрения, содержащие несколько питательных элементов: аммофос + KNO3 — азофоска; (NH4)2HPO4 + NH4NO3 + KCl — нитрофоска.
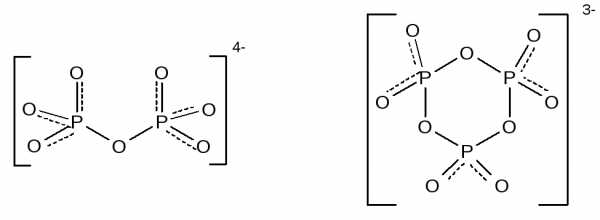
Присоединение фосфорного ангидрида к фосфорной кислоте приводит к образованию ряда полифосфорных кислот, простейшей из которых является дифосфорная (пирофосфорная) кислота — H4P2O7.

Полифосфорные кислоты образуют ряд солей с открытой цепью из 2 – 10 атомов фосфора –полифосфаты – или циклического строения – метафосфаты. Полифосфаты представляют собой соли аниона общей формулы – [PnO3n+1](n+2)-. Например, Na4P2O7 – диполифосфат (пирофосфат), Na5P3O10 — триполифосфат. К метафосфатам относятся соли аниона общей формулы – [PnO3n]n-. Например, Na3P3O9 – триметафосфат, Na4P4O12 — тетраметафосфат. Структура диполифосфат- и триметафосфат-анионов:
studfiles.net
