ИМЦРО Официальный сайт | Школьный этап ВсОШ-2018 по химии
Все материалы по проведению школьного и муниципального этапов можно посмотреть, перейдя по ключевому слову #олимпиада (вкладки «Актуальное», «Анонсы»)
Дата проведения: 10 октября 2018 года
Начало олимпиады в общеобразовательных организациях города Иркутска: 12:00 — 14:00
Дата сдачи итогового протокола: 16 октября 2018 года (до 16:00)
ЗАГРУЗИТЬ ПРОТОКОЛЫ
Сведения о сдаче протоколов школьного этапа всероссийской олимпиады школьников по химии в 2018-2019 учебном году
| № | ОУ | Отметка о загрузке протокола |
|---|---|---|
| 1 | МАОУ Лицей ИГУ | + |
| 2 | МБОУ Лицей № 1 | + |
| 3 | МБОУ лицей-интернат № 1 | + |
| 4 | МБОУ СОШ № 1 | + |
| 5 | МБОУ ВСОШ № 1 | |
| 6 | МАОУ гимназия № 2 | + |
| 7 | МБОУ лицей № 2 | + |
| 8 | МБОУ СОШ № 2 | + |
| 9 | МБОУ гимназия № 3 | + |
| 10 | МБОУ лицей № 3 | + |
| 11 | МБОУ СОШ № 3 | + |
| 12 | МБОУ СОШ № 4 | + |
| 13 | МБОУ СОШ № 5 | + |
| 14 | МБОУ СОШ № 6 | + |
| 15 | МБОУ СОШ № 7 | + |
| 16 | МБОУ ООШ № 8 | + |
| 17 | МБОУ СОШ № 9 | + |
| 18 | МБОУ СОШ № 10 | + |
| 19 | МБОУ ЦО № 10 | |
| 20 | МБОУ СОШ № 11 | |
| 21 | МБОУ СОШ № 12 | + |
| 22 | МБОУ школа-интернат № 13 | + |
| 23 | МБОУ СОШ № 14 | + |
| 24 | МБОУ СОШ № 15 | + |
| 25 | МБОУ СОШ № 16 | + |
| 26 | МБОУ СОШ № 17 | + |
| 27 | МБОУ СОШ № 18 | + |
| 28 | МБОУ СОШ № 19 | + |
| 29 | МБОУ СОШ № 20 | + |
| 30 | МБОУ СОШ № 21 | + |
| 31 | МБОУ СОШ № 22 | + |
| 32 | МБОУ СОШ № 23 | + |
| 33 | МБОУ СОШ № 24 | + |
| 34 | МБОУ Гимназия № 25 | + |
| 35 | МБОУ СОШ № 26 | + |
| 36 | МБОУ СОШ № 27 | + |
| 37 | МБОУ СОШ № 28 | + |
| 38 | МБОУ СОШ № 29 | + |
| 39 | МБОУ СОШ № 30 | + |
| 40 | МБОУ СОШ № 31 | + |
| 41 | МБОУ СОШ № 32 | + |
| 42 | МБОУ СОШ № 34 | + |
| 43 | МБОУ СОШ № 35 | + |
| 44 | МБОУ СОШ № 36 | + |
| 45 | МБОУ СОШ № 37 | + |
| 46 | МБОУ СОШ № 38 | + |
| 47 | МБОУ СОШ № 39 | + |
| 48 | МБОУ СОШ № 40 | + |
| 49 | МБОУ СОШ № 42 | + |
| 50 | МБОУ СОШ № 43 | + |
| 51 | МБОУ Гимназия № 44 | + |
| 52 | МБОУ СОШ № 45 | + |
| 53 | МБОУ СОШ № 46 | + |
| 54 | МАОУ ЦО № 47 | + |
| 55 | МБОУ СОШ № 49 | + |
| 56 | МБОУ СОШ № 50 | + |
| 57 | МБОУ СОШ № 53 | + |
| 58 | МБОУ СОШ № 55 | + |
| 59 | МБОУ СОШ № 57 | + |
| 60 | МАОУ СОШ № 63 | + |
| 61 | МБОУ СОШ № 64 | + |
| 62 | МБОУ СОШ № 65 | + |
| 63 | МБОУ СОШ № 66 | + |
| 64 | МБОУ СОШ № 67 | + |
| 65 | МБОУ ООШ № 68 | |
| 66 | МАОУ СОШ № 69 | + |
| 67 | МБОУ СОШ № 71 | + |
| 68 | МБОУ СОШ № 72 | + |
| 69 | МБОУ СОШ № 73 | + |
| 70 | МБОУ СОШ № 75 | + |
| 71 | МБОУ СОШ № 76 | + |
| 72 | МБОУ СОШ № 77 | + |
| 73 | МБОУ СОШ № 80 | + |
| 74 | Православная женская гимназия | |
| 75 | Лицей № 36 ОАО «РЖД» | + |
| 76 | Школа Леонова | + |
| 77 | Иркутский кадетский корпус | + |
Скачать
Ключевые слова
cimpo.irkutsk.ru
Олимпиада по Химии 8 класс
ШКОЛЬНЫЙ ЭТАП ВСЕРОССИЙСКОЙ ОЛИМПИАДЫ ШКОЛЬНИКОВ
2018 – 2019 УЧЕБНЫЙ ГОД
Химия, 8 класс
Время выполнения работы –
Задание 1. Юный химик составил список химических явлений, которые можно наблюдать на кухне: а) гашение соды уксусом при приготовлении теста;
б) прокисание молока;
в) растворение сахара в воде;
г) плавление сливочного масла на горячей сковородке;
д) засахаривание варенья;
е) брожение сока.
Однако он включил в список физические явления. Укажите их. (За каждый правильный ответ – 1 балл)
—
Задание 2. Чтобы Золушка не смогла поехать на бал, мачеха придумала ей работу: она смешала соль с мелкими гвоздями, деревянными стружками и речным песком и велела Золушке очистить соль, а гвозди сложить в отдельную коробку. Золушка быстро справилась с заданием и успела поехать на бал. Объясните, как можно быстро выполнить задание. (3 балла)
Задание 3. Предложите способы, с помощью которых можно различить бесцветные прозрачные жидкости: дистиллированную воду, раствор сахара, раствор спирта. (Каждый способ-2 балла)
Задание 4. Какие химические элементы названы в честь стран? Приведите не менее четырех названий. Укажите количество протонов и нейтронов, содержащихся в ядрах атомов, названных вами элементах. (4 балла)
Задание 5. Винтик и Шпунтик думают, из какого материала сделать каркас для корзины, чтобы она была легкой и прочной. Помогите им выбрать материал по схемам строения атомов:
А ) ) ) Б ) ) ) В ) ) ) ) Г ) ) ) ) ) ) Д ) ) )
2 8 1 2 8 3 2 8 14 2 2 8 18 32 18 4 2 8 6
Свой выбор обоснуйте. (4 балла)
Задание 6. Мушка и Кнопочка пытаются отстирать рабочие костюмы коротышек. Комбинезоны Винтика и Шпунтика запачканы ржавчиной, доктор Пилюлькин пролил на свой халат йод, Пончик и Сиропчик готовят съестные припасы, и их фартуки запачканы кондитерским жиром. Девочки решают, какие вещества, имеющиеся под рукой, использовать для каждого случая: соль, соду, лимонную кислоту, мыло, бензин, крахмал, ванилин, уксус. А как поступили бы в каждом случае вы? Ответ обоснуйте. ( За каждый правильный обоснованный ответ-1 балл)
Задание 7. Гермиона решила позолотить свою серебряную волшебную палочку. Для этого она положила её в раствор хлорида золота(3) массой 300 г с массовой долей растворенного вещества 3%. Сколько граммов золота может максимально осесть на волшебной палочке? (5 баллов)
Итого 28 баллов
Ответы химия 8 класс
Задание 1. В, г, д. (За каждый правильный ответ – 1 балл). Итого 3 балла
Задание 2. Гвозди отделить магнитом.
Соль с деревянными стружками и речным песком растворить в воде. Деревянные стружки всплывут на поверхности воды, их убрать ложкой. Соль с речным песком профильтровать. Песок останется на фильтре. Соляной раствор выпарить. Вода испарится. Останется в чашке соль. Итого 3 балла.
Задание 3. Раствор спирта определить по запаху. Раствор сахара быстрее и точнее всего — на вкус, хотя это и не научно. Ну и останется всего лишь пробирка с водой. (Каждый способ-2 балла). Итого 6 баллов.
Задание 4. Франций – названный в честь Франции.
Полоний – в честь Польши.
Рутений – в честь России.
Скандий — в честь Скандинавии;
Галлий — в честь старого названия Франции — «Галлия»;
Германий — в честь Германии.
Индий — Индия
Нейтроны (п)
Ru № 44
+44
57
Ро № 84
+84
125
Fr № 87
+87
136
Ge №32
+32
41
Ga №31
+31
39
In №49
+49
66
4 примера. (За каждый правильный ответ – 1 балл). Итого 4 балла.
Задание 5. Б – алюминий – свойство – легкий металл.
В – железо – свойство – прочность.
(За каждый правильный ответ – 2 балла). Итого 4 балла.
Задание 6. Для удаления ржавчины — использовать лимонную или уксусную кислоты.
Иод – использовать крахмал. Насыпать прямо на пятно.
Кондитерский жир – можно использовать соль и соду, или бензин.
Затем всю одежду постирать используя мыло.
( За каждый правильный обоснованный ответ-1 балл). Итого 3 балла.
Задание 7. W % =m (в-в)/m (р-ра)
m(в-ва)= W% х m (р-ра) /100%
m(в-ва)= 3% х 300 г /100%= 9г.
В-во AuCL3
Ответ m(в-ва)= 9г
Итого 5 баллов.
Итого 28 баллов
infourok.ru
Олимпиада по Химии 9 класс
ШКОЛЬНЫЙ ЭТАП ВСЕРОССИЙСКОЙ ОЛИМПИАДЫ ШКОЛЬНИКОВ
2018-2019 УЧЕБНЫЙ ГОДХимия, 9 класс
Время выполнения работы –
Программированное задание
Наименьший радиус имеет атом
1) Li 2) C 3) Be 4) B
Распределение электронов по энергетическим уровням в ионе Са2+ соответствует ряду чисел
1) 2,8,8,2 2) 2,8,8,1 3) 2,8,8,0 4) 1,8,8,0
Вещество с ковалентной полярной связью имеет формулу
1) SO2 2) KCl 3)Cl2 4) NaBr
В окислительно – восстановительной реакции, схема которой
KMnO4 + K2SO3 + H2O → MnO2 + K
1) 4 2) 3 3) 2 4) 1
Какой из оксидов является амфотерным
1) Li2O 2) MgO 3) NO2 4) Al2O3
Формула, какого из соединений записана неверно
1) NO2 2) SO3 3) FO2 4) CaO
Сколько молекул содержится в 88 г. углекислого газа
1) 6 · 1023 2) 3 ·1023 3) 9 · 1023 4) 12 · 1023
Какая из реакций не идет
1) Pb + H2SO4 → 3) Na + H2O →2) Mg + HCl → 4) Fe + CuSO4 →
Самый легкий металл
1) Mg 2) Al 3) Li 4) Na
К щелочноземельным металлам относится
1)Na 2) Ba 3) Al 4) Fe
Задачи
Определите массу технического алюминия (массовая доля алюминия 98,4 %), который потребуется для алюминотермического получения ванадия массой 15,3 кг. из оксида ванадия (V) V2O5
Какая масса цинка может прореагировать с соляной кислотой, объемом 50 мл. и плотностью 1,1 г/мл, массовая доля HCl в котором составляет 0,2? Какой объем водорода, измеренный при нормальных условиях, выделится при этом?
Простое вещество красного цвета нагрели без доступа воздуха, получили белое вещество, которое легко сгорает на воздухе. Продукт горения поместили в избыток воды, а к полученному раствору прилили избыток раствора гидроксида калия. В результате получили раствор массой 84,8 г, содержащий фосфат калия, массовая доля которого равна 5 %. Какое простое вещество взяли для осуществления указанных выше превращений? Определите массу этого вещества.
Ответы к школьной олимпиаде по химии 9 класс
Программированное задание (за каждый правильный ответ 1 балл)
Задачи
1)
Решение:
3 V2O5 + 10 Al = 5 Al2O3 + 6 V
1)
2)
3)
4)
Ответ:
Уравнение реакции – 1 б
Расчеты по 0,5 – 2 б
Всего – 3 б
2)
Решение:
Zn + 2 HCl = 2 ZnCl2 + H2↑
1)
2)
3)
4)
5)
6)
7)
Ответ:
За все реакции и все расчеты по 0,5 б
Всего – 4 б
3)
mp(K3PО4)=84,8 г(K3PО4)= 5 %
Решение:
1) 4 Р + 5 О2 = 2 Р2О5
2) Р2О5 + 3 Н2О = 2 Н3РО4
3) Н3РО4 + 3 КОН = К3РО4 + 3 Н2О
4)
5)
6)
7)
8)
9)
Ответ: вещество – красный фосфор
Уравнение реакции – 1 б
Расчеты по 0,5 б
Всего – 6 б
Максимальное число баллов – 23
infourok.ru
Химия 10 класс, школьный (первый) этап, г. Москва, 2017-2018 год
Содержание
- Задача 1. Левые части
- Задача 2. От азотной кислоты к алюминату
- Задача 3. Получение и окисление алкена
- Задача 4. Запах газа
- Задача 5. «Медный всадник»
- Задача 6. Осторожное получение газа
В итоговую оценку из 6 задач засчитываются 5 решений, за которые участник набрал наибольшие баллы, то есть одна из задач с наименьшим баллом не учитывается.
Задача 1. Левые части
Содержание ↑
Восстановите левые части уравнений химических реакций.
- … + … → KI + N2↑ + 2H2O
- … + … + … = 2MnO2 +3KNO3 + 2KOH
- … + … + … = 2K2FeO4 + 6KBr + 8H2O
- … + … + … = 2Na2CrO4 + 3Na2SO4 + 8H2O
- … + … = 8MnO2 + 3K2SiO3 + 2KOH + 5H2O
Решение
Содержание ↑
- KNO2 + NH4I → KI + N2↑ + 2H2O
- 3KNO2 + 2KMnO4 + H2O = 2MnO2 +3KNO3 + 2KOH
- 2Fe(OH)3 + 3Br2 + 10KOH = 2K2FeO4 + 6KBr + 8H2O
- Cr2(SO4)3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 3Na2SO4 + 8H2O
- 3SiH4 + 8KMnO4 = 8MnO2 + 3K2SiO3 + 2KOH + 5H2O
Критерии оценивания:
каждое уравнение – 2 балла
(если правильные реагенты, но не уравнено – 1 балл)
Итого 10 баллов
Задача 2. От азотной кислоты к алюминату
Содержание ↑
Напишите уравнения реакций к схеме превращений:
Определите вещества X, Y, Z, E, если известно, что
X – простое вещество,
Y – сложное вещество, твёрдое, при гидролизе образует щёлочь.
Решение
Содержание ↑
X – N2, Y – Li3N, Z – LiOH, E – Li2CO3.
Уравнения реакций:
- 10Al + 36HNO3 = 10Al(NO3)3 + 3N2 + 18H2O
- N2 + 6Li = 2Li3N
- Li3N + 3H2O = 3LiOH + NH3 (допускается запись NH3·H2O)
- 2LiOH + CO2 = Li2CO3 + H2O
- Li2CO3 + Al2O3 = 2LiAlO2 + CO2
Критерии оценивания:
каждое уравнение – 2 балла
(если правильные вещества, но не уравнено – 1 балл)
Итого 10 баллов
Задача 3. Получение и окисление алкена
Содержание ↑
При взаимодействии галогеналкана со спиртовым раствором щёлочи образуется алкен, плотность паров которого в 2,157 раза меньше плотности паров исходного галогеналкана.
- Определите молекулярную формулу исходного галогеналкана. Расчёты запишите.
- Установите все возможные структурные формулы исходного галогеналкана и структурную формулу алкена, если известно, что алкен в условиях жёсткого окисления образует кетон и кислоту.
- Приведите уравнение реакции окисления искомого алкена подкисленным раствором перманганата калия.
Решение
Содержание ↑
1) Уравнение реакции дегидрогалогенирования исходного галогеналкана:
CnH2n+1Hal + КОН(сп.р-р) → CnH2n + KCl + H2O.
Отношение плотностей паров галогеналкана и алкена равно отношению их молярных масс:
М(CnH2n+1Hal) = 14n + 1 + М(Hal) г/моль; М(CnH2n) = 14n г/моль.
(14n + 1 + М(Hal)) / (14n) = 2,157, отсюда М(Hal) + 1= 16,2n.
В состав галогеналкана могли входить фтор, хлор, бром или иод. Подставляя в полученное уравнение значения молярных масс галогенов, можно определить значение n и природу галогена: при n = 5, M(Hal) = 80 г/моль – бром.
Молекулярная формула галогеналкана С5Н11Br
4 балла
2) При окислении алкена образуются кетон и кислота, следовательно, алкен имеет разветвлённый углеродный скелет, а двойная связь находится в середине цепи:
CH3 – CH = C(CH3) – CH3
2-метилбутен-2
Структурные формулы бромалканов, при дегидрогалогенировании которых образуется 2-метилбутен-2:
| CH3–CH(Br)–CH(CH3)–CH3 | и | CH3–CH2–C(Br)(CH3)–CH3 |
| 2-бром-3-метилбутан | 2-бром-2-метилбутан |
3 балла
(баллы ставятся только за структуры, называть вещества не обязательно)
3) Уравнение реакции окисления 2-метилбутена-2 перманганатом калия в кислой среде:
5CH3CH = C(CH3)CH3 + 6KMnO4 + 9H2SO4 →
→ 5(CH3)2С = О + 5CH3CООН + 3К2SO4 + 6MnSO4 + 9H2O
3 балла
Итого 10 баллов
Задача 4. Запах газа
Содержание ↑
Запах, который люди чувствуют при утечке бытового газа на кухне, связан с присутствием газа Х, который используется в качестве одоранта. Газ Х
обладает резким неприятным запахом. Согласно данным элементного анализа Х имеет следующий состав: 38,71 %(масс.) углерода, 9,68 % водорода, а также некоторый элемент Y.
- Определите элемент Y и структуру газа X. Ответ подтвердите расчётом.
- При сжигании газа Х на воздухе образовавшуюся газовую смесь пропустили через баритовую воду. Затем аналогичную газовую смесь пропустили через раствор перманганата калия. Запишите уравнения происходящих химических реакций и укажите наблюдаемые признаки реакций.
Решение
Содержание ↑
1. ω(Y) = 51,61%. 1 балл
Пусть формула X – CkHmYn, тогда можно составить пропорцию:
m(C) = 12k – 38,71%
m(Y) = n×M(Y) – 51,61%
откуда M(Y) = 16(k/n)
Рассмотрим возможные случаи:
| k = 1 | k = 2 | |
| n = 1 | M(Y) = 16 (О) ⇒ СH3O | M(Y) = 32 (S) ⇒ С2H6S |
| n = 2 | M(Y) = 8 (×) | M(Y) = 16 (O) ⇒ С2H6O2 |
Состав СН3О невозможен, остаётся два варианта – С2H6S и С2H6O2. Так как Х – обладает резким неприятным запахом, это указывает на присутствие серы.
Следовательно,
Y – S 1 балл
X – C2H5SH – этантиол
(принимается также (CH3)2S – диметилсульфид) 2 балла
2. Уравнение реакции горения:
2C2H5SH + 9O2 → 2SO2 + 4CO2 + 6H2O 1 балл
(если Х определён неправильно, но уравнение верное – 1 балл)
SO2 + Ba(OH)2 → BaSO3 + H2O 1 балл
CO2 + Ba(OH)2 → BaCO3 + H2O 1 балл
Признак: помутнение раствора или выпадение белого осадка 0,5 балла
5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4 2 балла
Признак: обесцвечивание раствора 0,5 балла
(если написаны неправильные коэффициенты – за уравнение ставить половину от максимума)
Итого 10 баллов
Задача 5. «Медный всадник»
Содержание ↑
Памятник Петру Великому в СанктПетербурге («Медный всадник») установлен на Гром-камне, монолите весом 1600 т. Открытие памятника состоялось 7 августа 1782 года при участии императрицы Екатерины II. Монумент уникален тем, что имеет всего три точки опоры: задние ноги коня и извивающийся хвост змеи. Для того чтобы скульптура приобрела устойчивость, мастерам пришлось облегчать её переднюю часть, поэтому толщина бронзовых стенок передней части намного тоньше задних стенок, что значительно усложнило отливку монумента.

Памятник Петру Великому в СанктПетербурге («Медный всадник»)
На берегу пустынных волн
Стоял он, дум великих полн…
(А.С. Пушкин, «Медный всадник»)
В лабораторию для анализа состава сплава, из которого был отлит памятник, поступило 10,00 г образца. Лаборант аккуратно растворил образец в концентрированной азотной кислоте, при этом наблюдалось выделение газа бурого цвета, а на дне колбы образовался осадок. После того, как осадок был отфильтрован, к фильтрату добавили избыток щёлочи, после чего выпал осадок голубого цвета, который отделили и прокалили, при этом образовалось 10,00 г чёрного остатка. Осадок, оставшийся после растворения сплава в концентрированной азотной кислоте, прокалили, при этом образовался оксид массой 2,54 г, в котором массовая доля неизвестного элемента составляет 78,8 %.
- Определите качественный и количественный (ω, %) состав сплава. Ответ подтвердите расчётами.
- Запишите уравнения всех реакций, упомянутых в тексте.
Решение
Содержание ↑
1) Определим формулу неизвестного оксида, образовавшегося при прокаливании осадка. Пусть формула оксида X2Оn, тогда
при n = 4, M(X) = 119 г/моль, что соответствует Sn – олово, тогда формула оксида – SnO2. 2 балла
m(SnO2) = 2,54 г, найдём массу олова в сплаве:
тогда масса второго компонента сплава равна 8,00 г.
Логично предположить, что остаток чёрного цвета – это оксид, так как получен при разложении гидроксида, образовавшегося при взаимодействии фильтрата с гидроксидом натрия. Для оксида состава Y2On имеем:
при n = 2, M(Y) = 64 г/моль, что соответствует Cu – медь, тогда формула оксида – CuO. 2 балла
(без расчётов и доказательств – 0 баллов, если в качестве доказательства указаны цветовые переходы – 1 балл)
Состав сплава – 80% (масс.) Cu и 20% Sn. 1 балл
2)Уравнения реакций:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Sn + 4HNO3 → SnO2×xH2O + 4NO2 + (2–x)H2O
SnO2·xH2O → SnO2 + xH2O
Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3
Cu(OH)2 → CuO + H2O
За каждое уравнение 1 балл, всего – 5 баллов
(за уравнение с неправильными коэффициентами – 0,5 балла)
Итого 10 баллов
Задача 6. Осторожное получение газа
Содержание ↑
Для получения газа X собрали прибор, как показано на рисунке.
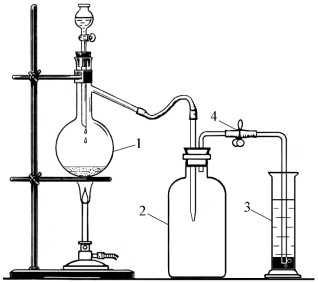
Газоотводную трубку от колбы Вюрца 1 ввели через пробку в банку 2. Чтобы газ Х не попал в атмосферу, газоотводную трубку, выходящую из банки 2, опустили в цилиндр 3, на дне которого находилась ртуть. Поверх ртути в цилиндре была налита вода. Открыли зажим 4 на трубке, соединяющей банку 2 и цилиндр 3.
В колбу Вюрца 1 поместили вещество А, из капельной воронки к соли прилили вещество В, смесь нагрели. Выделяющийся газ Х постепенно заполнял банку 2.
В цилиндре 3 пузырьки газа Х проходили через слой ртути и попадали в воду, в которой растворялись.
Известно, что А – бесцветное кристаллическое вещество без запаха, хорошо растворяется в воде, окрашивает пламя в яркий жёлто-оранжевый цвет.
Вещество А широко применяется как приправа к пище и один из важнейших консервантов. В – бесцветная маслянистая жидкость без запаха, хорошо растворяется в воде, выделяя при этом много тепла, обугливает многие органические вещества. Вещество В издавна считают «матерью всех кислот».
- О каких веществах А и В идёт речь в условии задачи?
- Какой газ Х получали в данном приборе? Приведите соответствующее уравнение реакции.
- Почему старались избежать попадания газа в помещение лаборатории, где проводили эксперимент? Какую роль играет вода в цилиндре 3?
- С какой целью на дно цилиндра 3 налили ртуть? Что может произойти, если конец газоотводной трубки оставить в воде?
- Можно ли было собрать газ X в банке 2, не открывая зажим 4, исключив из прибора цилиндр с водой и ртутью? Чем можно заменить токсичную ртуть в данном приборе?
- Что представляет собой раствор газа Х? Какие реакции следует провести, чтобы доказать качественный состав полученного раствора?
Решение
Содержание ↑
1) А – хлорид натрия, В – концентрированная серная кислота. 1 балл
2) В приборе получали газ Х – хлороводород:
NaCl + H2SO4 = NaHSO4 + HCl↑
или
2NaCl + H2SO4 = Na2SO4 + 2HCl↑ 2 балла
3) Хлороводород – удушливый едкий газ с резким запахом, может вызвать ожоги слизистой дыхательных путей, глаз, кожи. Необходимо остерегаться его попадания в помещение, где находятся люди.
Вода играет роль поглотителя. После того как банка 2 наполнится HCl, избыточный газ поглотится водой, растворяясь в ней. 2 балла
4) Ртуть играет роль затвора, потому что хлороводород очень хорошо растворяется в воде. Если бы слоя ртути не было, то вода бы перелилась из цилиндра 3 в банку 2.
HCl дойдёт по газоотводной трубке до воды в цилиндре 3, и сразу начнётся его растворение. Объём газа станет быстро уменьшаться, а давление в банке 2 падать. Давление может падать быстрее, чем поступать новые порции газа из колбы 1. В банке 2 создастся разряжение, под действием атмосферного давления вода перетечёт в неё из цилиндра. 2 балла
5) Закрыть зажим 4 во время проведения опыта нельзя, т. к. вытесняемый воздух должен выходить из банки 2. В противном случае давление в приборе начнёт критически нарастать, что может привести к его разрушению.
Вместо воды с ртутным затвором можно использовать твёрдые поглотители, например, негашёную или натронную известь. Вместо ртутного затвора можно использовать обратные клапаны (например, бунзеновский клапан), которые предотвратят поступление воды из цилиндра.
2 балла за любое разумное и обоснованное решение
6) Водный раствор газа Х – соляная кислота. Хлороводород диссоциирует в водном растворе:
HCl → H+ + Cl–
Избыток катионов H+ (ионов гидроксония H3O+) можно доказать с помощью индикатора, например лакмуса, который в кислой среде примет красную окраску.
Наличие хлорид-анионов можно доказать с помощью раствора соли серебра, например AgNO3, в результате реакции выпадает творожистый осадок белого цвета:
HCl + AgNO3 → HNO3 +AgCl↓
Cl– + Ag+ → AgCl↓
1 балл за любое разумное и обоснованное решение
Итого 10 баллов
Содержание ↑
olimpiadnye-zadanija.ru
