Сера | Химия свойства элементов
Общие сведения и методы получения
Сера (S) — неметалл, представляющий собой хрупкие кристаллы желтого цвета.
Известна с древнейших времен (за 2000 лет до н.э.). Элементарную природу серы установил французский химик Лавуазье. В 1822 г, Ми-черлих обнаружил аллотропию серы. Название элемента связано с его цветом — от латинского «sulfur» светло-желтый. Русское название «сера» происходит от санскритского «сира», что также означает светло-желтый; имеется и другое древнерусское название серы «жупель» — сера горючая.
Общее содержание серы в земной коре составляет —0,1 % (по массе).
Сера встречается в природе как в свободном виде (самородная), так и в соединениях.
Известно более 200 минералов, содержащих серу. Наиболее распространены соединения серы с различными металлами — сульфиды: PbS — свинцовый блеск; ZnS — цинковая обманка; Cu2S —медный блеск; FeS2 — пирит; HgS — киноварь и др. Широко распространены в природе также сульфаты: Na2SO|- 10Н2О — глауберов»! соль; BaS04— тяжелый шпат; CaS04-2H20 — гипс и др. В виде сульфатов натрия, калия, магния и других элементов сера содержится в водах мирового океана (0,08—0,09 %), в углях, нефти, сланцах, природных газах.
Элементарную серу получают из самородных руд, используя ее способность легко плавиться. Полученную серу очищают перегонкой в рафинировочных печах, где она нагревается до кипения и конденсируется на стенках камеры в виде светло-желтого порошка или при температуре свыше 120 °С в виде жидкости, которую выпускают из камеры в формы, где она застывает в виде лалочек.
Серу получают также из сероводорода H2S и восстановлением диоксида серы S02.
Важными источниками получения серы являются пирит FeS2 и полиметаллические руды, содержащие сернистые соединения меди, цинка и других цветных металлов. Некоторое количество серы (газовая сера) получают из газов, образующихся при коксовании и газификации угля.
Физические свойства
Атомные характеристики. Атомный номер 16, атомная масса 32,064 а. е. м., атомный объем 15,38*10-6 м3/моль, атомный радиус 0,104 нм, ионные радиусы s2- 0,174 нм, s+ 0,037 нм, s6+ 0,034 нм. Конфигурация внешних электронных оболочек 3s23p4. Значения потенциалов ионизации / (эВ): 10,357; 23,4; 34,8. Сродство к электрону 2,07—2,33 эВ. Электроотрицательность 2,6.
Существует ряд кристаллических и аморфных модификаций серы. До 95,6 °С устойчива ромбическая, или a-S, с параметрами а= 1,04646 нм, 6=1,28660 нм, с = 2,44860 нм; в интервале 95,6—119,3°С моноклинная, или B -S, с параметрами решетки а=0,090 нм, 6=1,096 нм, с= 1,102 нм; 6 = 86 16′. Энергия кристаллической решетки серы 223,0 мкДж/ /кмоль. Выше 119,3°С Й -S переходит в жидкую X-S. При быстром нагреве ромбическая a-S непосредственно превращается в подвижную жидкость соломенного цвета X-S.
В жидкой сере наблюдается равновесие A ,-S =<=tB -s +n -s и при 160 °С в ней содержится 89,2 % ^-S; 4,1 % p-S; 6,7 % я -S.
Аморфная темно-красная пластическая p-S образуется при резком охлаждении жидкой серы; она нерастворима в сероуглероде и быстро переходит в ромбическую a-S.
Химические свойства
В соединениях сера проявляет степени окисления —2, +2, +3, +4, +5, +6.
Элементарная сера химически активна и взаимодействует при нагревании со многими металлами и неметаллами (за исключением золота, платины, азота, иода и инертных газов), с органическими и неорганическими соединениями. При комнатной температуре во влажном воздухе сера слабо окисляется, при 280 °С она горит в кислороде, а при 360 °С — на воздухе. Смесь паров серы и кислорода взрывается.
При обычных условиях сера с кислородом не взаимодействует. При цагреваиии на воздухе или в кислороде сера образует оксиды: S02 — оксид серы (IV), или сернистый газ, представляющий собой бесцветный газ с резким удушливым запахом, легко конденсирующийся в бесцветную жидкость, кипящую при —10 °С, хорошо растворяющуюся в воде с образованием сернистой кислоты H2S03; S03 — оксид серы (VI), серный ангидрид, представляющий собой бесцветную легкоподвижную жидкость, кипящую при 44,7 «С и кристаллизующуюся при 16,9 °С; при хранении в присутствии следов влаги превращается в длинные шелковистые кристаллы, хорошо растворяется в воде, образуя серную кислоту H2S04. Известны малоустойчивые оксиды серы: S20, SO, S203, S04, S07, S3O10.
Существует ряд кислородсодержащих кислот: H2S03— сернистая кислота — непрочное соединение, существует только в водных растворах, окисляется кислородом воздуха, превращаясь в серную кислоту H2S04, хороший восстановитель, двухосновная кислота, образует два ряда солей: сульфиты и гидросульфиты!
H2S04 — серная кислота — бесцветная маслянистая жидкость без запаха, нелетучая, кристаллизующаяся при 10,3 °С, тяжелая, активно поглощает пары воды, сильный окислитель, двухосновная кислота, образует два ряда солей: сульфаты и гидросульфаты, из которых практически нерастворимы только BaS04, PbS04 и SrS04.
H2S207 — пиросерная, или двусерная кислота. Растворением серного ангидрида S03 в серной кислоте получают олеум, состоящий главным образом из пиросерной кислоты. При охлаждении олеума кислота выделяется в виде бесцветных кристаллов. Пиросерная кислота образует соли — дисульфаты или пиросульфаты, которые при нагревании выше температуры плавления разлагаются, превращаясь в сульфаты.
H2S02 — сульфоксиловая кислота; в свободном состоянии не выделена.
H2S208 —пероксодвусерная, или надсерная, кислота, обладает сильными окислительными свойствами, образует соли персульфаты.
H2S202 — тиосернистая кислота, образуется как промежуточный продукт при различных реакциях.
H2S203 — тиосерная кислота — неустойчива, уже при комнатной температуре распадается, образует соли — тиосульфаты, которые значительно устойчивее кислоты.
H2S204 — дитионистая кислота, существует только в виде солей.
Существует группа политионовых кислот, отвечающих общей форму, ле H2S*06, где х принимает значения от 2 до 6. К группе таких кислот принадлежат H2S4O0 (тетратионовая кислота) и H2S2Oe (дитионовая кислота). Политионовые кислоты неустойчивы и известны лишь в водных растворах. Соли их — полнтионаты — более устойчивы, некоторые из них получены в виде кристаллов.
При обычных условиях сера с водородом ие соединяется, при нагревании образует соединения, отвечающие общей формуле PbS* — суль-фаны; H2S — сероводород; H2S2 — двухсернистый водород; H2S3 — трех-сернистый водород и т. д. Водные растворы сульфанов обладают свойствами слабых двухосновных кислот. Сероводород H2S —бесцветный газ с характерным запахом, ядовитый, немного тяжелее воздуха, горючий, легко воспламеняется, сильный восстановитель, хорошо растворяется в воде, образуя сероводородную кислоту, соли которой — сульфиды.
Остальные сульфаны — малоустойчивые желтоватые маслянистые жидкости; растворимы в воде с образованием соответствующих кислот, соли которых — полисульфиды.
Сера взаимодействует почти со всеми металлами (кроме золота, иридия, платины), образуя сульфиды. Прн комнатной температуре сера соединяется со щелочными н щелочноземельными металлами, а также с Си, Ag, Hg; при иагреваиин — с Pb, Sn, Ni, Со, Zn, Mn, Cr, Al; в присут ствии влаги — с Fe; тугоплавкие металлы н некоторые металлы платиновой группы взаимодействуют с серой прн высокой температуре в мелкораздробленном состоянии; некоторые — с парами серы под дав лением.
Различают основные сульфиды (Na2S, MgS), амфотерные (A1 2 S3, Cr 2 S3) и кислотные (MoS, WS3). Сульфиды могут соединяться друг с другом, образуя тиосоли (например. Na2WS4 — тиовольфрамат натрия).
Соединения серы с азотом получены косвенным путем. Известны N4S4 —азотистая сера — золотисто-желтые кристаллы с температурой плавления 178 °С; при ударе и нагревании выше температуры плавления разлагаются на элементы, в воде не растворяются; N2 S4 — четырехсер-иистый азот — темно-красные кристаллы с температурой плавления 23 °С, постепенно самопроизвольно разлагающиеся; при нагревании вспыхивают, в воде не растворяются; N2Ss — сернистый азот.
При 800—900 °С сера взаимодействует с углеродом, образуя сероуглерод CS2 — бесцветную жидкость, которая кипит при 40 °С, плохо растворяется в воде; сероуглерод хорошо растворяет жиры, масла, смолы, склонен к полимеризации. При взаимодействии углерода, кислорода и серы при высокой температуре образуется серооксид COS. Известны неустойчивые низшие сульфиды углерода: CS — белый налет, который уже при —180 «С со взрывом превращается в коричневый продукт полимери. зации (OS)*; несколько более устойчива C3S2 —слезоточивая жидкость, затвердевающая при 5 °С и склонная к полимеризации.
При сплавлении фосфора с серой, взятых в соответствующих соотношениях, образуются тиоангидриды P4S3, P4S5, P4S7, P4Si0, которые гид-ролизуются во влажном воздухе с выделением фосфииа РН3.
Галогены, за исключением иода, непосредственно соединяются с се рой. Уже на холоду сера энергично взаимодействует со фтором, образуя ряд соединений: SF6 — бесцветный газ, термически и химически стойкий, не реагирующий с водой, соляной кислотой, едким натром, водородом и кислородом; SF4 — бесцветный газ, энергично взаимодействующий с во-дой, термически устойчивый до 600 °С, хороший фторирующий агент; S2Fi0 и др.
При полном отсутствии влаги уже при комнатной температуре сера взаимодействует с хлором н бромом, образуя соединения: S2C19 — оранжево-желтую маслянистую жидкость с температурой кипения 137 «С, хорошо растворяющую серу, дымящую во влажном воздухе; в воде подвергается гидролизу; SC12 — красную жидкость с удушливым за. пахом, гидролитически разлагающуюся водой; SC14 — белый порошок, устойчивый только в твердом состоянии при низкой температуре; S2Br2 — красную маслянистую жидкость, очень чувствительную к влаге воздуха; прн температуре выше 90 °С разлагается на элементы.
Соединения серы с иодом неустойчивы, легко разлагаются. Получены соединения S*I2, где х —от 2 до 6.
Кроме того, известны галогенопроизводные сульфанов, имеющие общую формулу Sx(^)2, где X — галогены. Многообразны оксигалогениды серы общей формулы SO(A»)2и S02(X)2.
С водой и разбавленными кислотами сера не взаимодействует. Концентрированная азотная кислота окисляет серу до серной кислоты. Соляная кислота не действует на серу, но в присутствии окислителей пе реводит серу в серную кислоту. Царская водка также окисляет серу до серной кислоты. Концентрированная серная кислота на холоду на серу не действует, с расплавленной серой реагирует с образованием сернисто го газа S02и воды.
Со щелочами сера взаимодействует с образованием сульфидов и сульфитов (реакция обратимая). При нагревании в растворе аммиака NH3 сера образует полисульфид и тиосульфат аммония.
Расплавленная сера реагирует с оксидами щелочных металлов с образованием сульфидов, сульфитов и сульфатов. С оксидами тяжелых металлов сера заметно взаимодействует при 150—200 °С с выделением сернистого газа.
В воде сера практически не растворяется, хорошо растворяется в безводном аммиаке, сероуглероде и ряде органических растворителей (феноле, бензоле, дихлорэтане и др.).
Области применения
Основной потребитель серы — химическая промышленность: около 50% добываемой серы идет на производство серной кислоты. Большое количество серы расходуется в резиновой и целлюлозно-бумажной промышленности, вискозном и спичечном производстве, в органическом синтезе (получение сернистых красителей, сероуглерода, искусственных волокон, фармацевтических препаратов, ускорителей вулканизации каучука). Серу применяют при получении различных цементов, замазок, асфальтов, дымного пороха, светящихся составов, бенгальских огней.
В сельском хозяйстве серу широко применяют в виде серного цвета, используя для уничтожения некоторых вредителей растений; серные удобрения повышают морозостойкость растений и злаков.
Добавки серы улучшают обрабатываемость автоматных сталей и антифрикционные свойства спеченных антифрикционных материалов.
В медицине используют как элементарную серу, так и ее соединения. Все сульфамидные препараты — это органические соединения серы.
Широко применяются соединения серы:
— FeS2 (пирит) — для получения серной кислоты; сульфиды щелочных и щелочноземельных металлов (Na2S, CaS и BaS) —в кожевенной промышленности; сульфиды цинка ZnS и кадмия CdS служат основой люминофоров; некоторые сульфиды обладают полупроводниковыми свойствами и применяются в электронной технике; многие природные сульфиды используются в металлургии для выплавки цветных и редких металлов;
— оксид серы (IV) S02 — для получения серной кислоты; для отбеливания соломы, шерсти, шелка; как дезинфицирующее средство; для лечения домашних животных;
— сульфиты калия K2S03 и натрия Na2S0.3 для отбеливания некоторых материалов в текстильной промышленности при крашении тканей, в фотографии;
— гидросульфит кальция Ca(HS03)2 — при переработке древесины в сульфитную целлюлозу, из которой затем получают бумагу;
— сульфат натрия Na2S04 — при производстве стекла; глауберову соль Na2SO4-10H2O в медицине; гипс CaS04-2H20 для изготовления отливочных форм и слепков с различных предметов, в строительстве, в хирургии; медный купорос CaS04-5H20 — в сельском хозяйстве, для приготовления минеральных красок, для электролитического покрытия металлов медью; алюмокалиевые квасцы KA1(S04)2— 12Н20 — для дубления кожи, в красильном деле;
— олеум H2S207 — для очистки нефтепродуктов, для производства некоторых красителей и взрывчатых веществ;
— серная кислота H2S04 — для получения минеральных удобрений, некоторых кислот (НС1, Н3Р04 и др.), взрывчатых веществ, красок, при очистке керосина, нефтяных масел и продуктов коксохимического производства (бензола, толуола), при травлении черных металлов (снятия окалины), в свинцовых аккумуляторах;
— персульфаты — как средства для отбелки, в качестве окислителей в лабораторной практике и для некоторых технических целей;
— тиосульфат натрия Na2S203 — в фотографии как закрепитель, в текстильной промышленности для удаления остатков хлора после отбелки тканей, в медицине и ветеринарии;
— хлорид серы (I) S2C12 — для вулканизации каучука.
ibrain.kz
Сера и её характеристики
Общая характеристика серы
Сера встречается в природе как в свободном состоянии (самородная сера), так и в различных соединениях. Очень распространены соединения серы с различными металлами. Многие из них являются ценными рудами (например, свинцовый блеск PbS, цинковая обманка ZnS, медный блеск Cu2S) и служат источником получения цветных металлов.
Из соединений серы в природе также распространены сульфаты, главным образом, кальция и магния, Наконец, соединения серы содержатся в организмах растений и животных.
Общее содержание серы земной коре составляет приблизительно 0,1%.
Атомная и молекулярная масса серы
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) – во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Значения атомной и молекулярной масс серы совпадают; они равны 32,059.
Аллотропия и аллотропные модификации серы
Сера существует в виде двух аллотропных модификаций – ромбической и моноклинной.
При обычных давлениях сера образует хрупкие кристаллы желтого цвета, плавящиеся при 112,8oС; плотность равна 2,07 г/см 3. Она нерастворима в воде, но довольно хорошо растворима в сероуглероде, бензоле и некоторых других жидкостях. При испарении этих жидкостей сера выделяется из раствора в виде желтых кристаллов ромбической системы, имеющих форму октаэдров, у которых обычно часть углов или ребер как бы срезана (рис.1). Эта модификация серы называется ромбической.
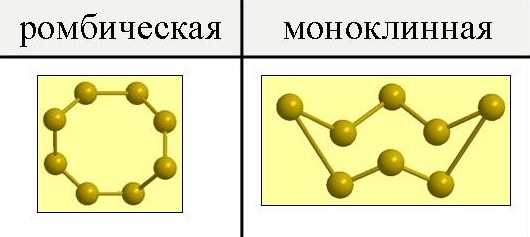
Рис. 1. Аллотропные модификации серы.
Иной формы кристаллы получаются, если медленно охлаждать расплавленную серу и, когда она частично затвердевает, слить еще не успевшую застыть жидкость. При этих условиях стенки сосуда оказываются покрыты изнутри длинными темно-желтыми игольчатыми кристаллами моноклинной системы. Эта модификация серы называется моноклинной. Она имеет плотность 1,96 г/см 3, плавится при 119,3oС и устойчива только при температуре выше 96oС.
Изотопы серы
Известно, что в природе сера может находиться в виде четырех стабильных изотопов 32S, 33S, 34S и 36S. Их массовые числа равны 32, 33, 34 и 36 соответственно. Ядро атома изотопа серы 32S содержит шестнадцать протонов и шестнадцать нейтронов, а изотопов 33S, 34S и 36S– такое же количество протонов, семнадцать, восемнадцать и двадцать нейтронов соответственно.
Существуют искусственные изотопы серы с массовыми числами от 26-ти до 49-ти, среди которых наиболее стабильным является 35S с периодом полураспада равным 87 суток.
Ионы серы
На внешнем энергетическом уровне атома серы имеется шесть электронов, которые являются валентными:
1s22s22p63s23p4.
В результате химического взаимодействия сера может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженные ионы или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженные ионы:
S0 –6e → S6+;
S0 -4e → S4+;
S0 -4e → S2+;
So +2e → S2-.
Молекула и атом серы
Молекула серы одноатомна — S. Приведем некоторые свойства, характеризующие атом и молекулу серы:
|
Энергия ионизации атома, эВ |
10,35 |
|
Относительная электроотрицательность |
2,56 |
|
Радиус атома, нм |
0,127 |
Примеры решения задач
ru.solverbook.com
Сера — это… Что такое Сера?
| Внешний вид простого вещества | |
|---|---|
|
Светло-жёлтое хрупкое твёрдое вещество |
|
| Свойства атома | |
| Имя, символ, номер |
Сера / Sulfur (S), 16 |
| Атомная масса (молярная масса) |
32,066 а. е. м. (г/моль) |
| Электронная конфигурация |
[Ne] 3s2 3p4 |
| Радиус атома |
127 пм |
| Химические свойства | |
| Ковалентный радиус |
|
| Радиус иона |
30 (+6e) 184 (-2e) пм |
| Электроотрицательность |
2,58 (шкала Полинга) |
| Электродный потенциал |
0 |
| Степени окисления |
+6, +4, +2, 0, -1, −2 |
| Энергия ионизации (первый электрон) |
999,0 (10,35) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) |
2,070 г/см³ |
| Температура плавления |
386 К (112,85 °С) |
| Температура кипения |
717,824 К (444,67 °С) |
| Теплота плавления |
1,23 кДж/моль |
| Теплота испарения |
10,5 кДж/моль |
| Молярная теплоёмкость |
22,61[1] Дж/(K·моль) |
| Молярный объём |
15,5 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
орторомбическая |
| Параметры решётки |
a=10,437 b=12,845 c=24,369 Å |
| Прочие характеристики | |
| Теплопроводность |
(300 K) 0,27 Вт/(м·К) |
Се́ра — элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S (лат. sulphur). В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде.
Сера является шестнадцатым по химической распространённости элементом в земной коре. Встречается в свободном (самородном) состоянии и связанном виде.
Важнейшие природные соединения серы: FeS
История открытия
Сера в самородном состоянии, а также в виде сернистых соединений известна с древнейших времён. С запахом горящей серы, удушающим действием сернистого газа и отвратительным запахом сероводорода человек познакомился, вероятно, ещё в доисторические времена. Именно из-за этих свойств сера использовалась жрецами в составе священных курений при религиозных обрядах. Сера считалась произведением сверхчеловеческих существ из мира духов или подземных богов. Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы. Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников. Около VIII в. китайцы стали использовать её в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, лёгкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что её считали «принципом горючести» и обязательной составной частью металлических руд. Пресвитер Теофил (XII в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, ещё в древнем Египте. В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов. В дальнейшем она стала одним из трёх принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения её из пиритов; последний был распространён в древней Руси. Впервые в литературе он описан у Агриколы. Таким образом, точно происхождение серы не установлено, но, как сказано выше, этот элемент использовался до Рождества Христова, а значит знаком людям с давних времён.
Происхождение названия
Слово «сера», известное в древнерусском языке с XV в., заимствовано из старославянского «сѣра» – «сера, смола», вообще «горючее вещество, жир». Этимология слова не выяснена до настоящих времен, поскольку первоначальное общеславянское название вещества утрачено и слово дошло до современного русского языка в искаженном виде[2].
По предположению Фасмера[3], «сера» восходит к лат. sera – «воск» или лат. serum – «сыворотка».
Латинское sulphur (происходящее из эллинизированного написания этимологического sulpur) предположительно восходит к индоевропейскому корню *swelp — «гореть»[4].
Происхождение серы
Большие скопления самородной серы встречаются не так уж часто. Чаще она присутствует в некоторых рудах. Руда самородной серы — это порода с вкраплениями чистой серы.
От того, образовались эти вкрапления одновременно с сопутствующими породами или позже, зависит направление поисковых и разведочных работ. Существует несколько совершенно различных теорий по этому вопросу.
Теория сингенеза (то есть одновременного образования серы и вмещающих пород) предполагает, что образование самородной серы происходило в мелководных бассейнах. Особые бактерии восстанавливали сульфаты, растворённые в воде, до сероводорода, который поднимался вверх, попадал в окислительную зону и здесь химическим путём или при участии других бактерий окислялся до элементарной серы. Сера осаждалась на дно, и впоследствии содержащий серу ил образовал руду.
Теория эпигенеза (вкрапления серы образовались позднее, чем основные породы) имеет несколько вариантов. Самый распространённый из них предполагает, что подземные воды, проникая сквозь толщи пород, обогащаются сульфатами. Если такие воды соприкасаются с месторождениями нефти или природного газа, то ионы сульфатов восстанавливаются углеводородами до сероводорода. Сероводород поднимается к поверхности и, окисляясь, выделяет чистую серу в пустотах и трещинах пород.
В последние десятилетия находит всё новые подтверждения одна из разновидностей теории эпигенеза — теория метасоматоза (в переводе с греческого «метасоматоз» означает замещение). Согласно ей в недрах постоянно происходит превращение гипса CaSO4-H2O и ангидрита CaSO4 в серу и кальцит СаСО3. Эта теория создана в 1935 году советскими учёными Л. М. Миропольским и Б. П. Кротовым. В её пользу говорит, в частности, такой факт.
В 1961 году в Ираке было открыто месторождение Мишрак. Сера здесь заключена в карбонатных породах, которые образуют свод, поддерживаемый уходящими вглубь опорами (в геологии их называют крыльями). Крылья эти состоят в основном из ангидрита и гипса. Такая же картина наблюдалась на отечественном месторождении Шор-Су.
Геологическое своеобразие этих месторождений можно объяснить только с позиций теории метасоматоза: первичные гипсы и ангидриты превратились во вторичные карбонатные руды с вкраплениями самородной серы. Важно не только соседство минералов — среднее содержание серы в руде этих месторождений равно содержанию химически связанной серы в ангидрите. А исследования изотопного состава серы и углерода в руде этих месторождений дали сторонникам теории метасоматоза дополнительные аргументы.
Но есть одно «но»: химизм процесса превращения гипса в серу и кальцит пока не ясен, и потому нет оснований считать теорию метасоматоза единственно правильной. На земле и сейчас существуют озёра (в частности, Серное озеро близ Серноводска), где происходит сингенетическое отложение серы и сероносный ил не содержит ни гипса, ни ангидрита.
Всё это означает, что разнообразие теорий и гипотез о происхождении самородной серы — результат не только и не столько неполноты наших знаний, сколько сложности явлений, происходящих в недрах. Ещё из элементарной школьной математики все мы знаем, что к одному результату могут привести разные пути. Этот закон распространяется и на геохимию.
Получение
Гранулированная сераВ древности и в средние века серу добывали, вкапывая в землю большой глиняный горшок, на который ставили другой, с отверстием в дне. Последний заполняли породой, содержащей серу, и затем нагревали. Сера плавилась и стекала в нижний горшок.
В настоящее время серу получают главным образом путём выплавки самородной серы непосредственно в местах её залегания под землёй. Серные руды добывают разными способами — в зависимости от условий залегания. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о возможности её самовозгорания.
Добыча руды открытым способом происходит так. Шагающие экскаваторы снимают пласты пород, под которыми залегает руда. Взрывами рудный пласт дробят, после чего глыбы руды отправляют на сероплавильный завод, где из концентрата извлекают серу.
В 1890 г. Герман Фраш, предложил плавить серу под землёй и через скважины, подобные нефтяным, выкачивать её на поверхность. Сравнительно невысокая (113 °C) температура плавления серы подтверждала реальность идеи Фраша. В 1890 г. начались испытания, приведшие к успеху.
Известно несколько методов получения серы из серных руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
Также сера в больших количествах содержится в природном газе в газообразном состоянии (в виде сероводорода, сернистого ангидрида). При добыче она откладывается на стенках труб и оборудования, выводя их из строя. Поэтому её улавливают из газа как можно быстрее после добычи. Полученная химически чистая мелкодисперсная сера является идеальным сырьём для химической и резиновой промышленности.
Крупнейшее месторождение самородной серы вулканического происхождения находится на острове Итуруп с запасами категории A+B+C1 — 4227 тыс. тонн и категории C2 — 895 тыс. тонн, что достаточно для строительства предприятия мощностью 200 тыс. тонн гранулированной серы в год.
Производители
Основными производителями серы в России являются предприятия ОАО Газпром: ООО Газпром добыча Астрахань и ООО Газпром добыча Оренбург, получающие её как побочный продукт при очистке газа.
Применение
Серу применяют для производства серной кислоты, вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона.
Свойства
Физические свойства
Природный сросток кристаллов самородной серыСера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами. В воде сера нерастворима, некоторые её модификации растворяются в органических растворителях, например в сероуглероде, скипидаре. Плавление серы сопровождается заметным увеличением объёма (примерно 15 %). Расплавленная сера представляет собой жёлтую легкоподвижную жидкость, которая выше 160 °C превращается в очень вязкую тёмно-коричневую массу. Наибольшую вязкость расплав серы приобретает при температуре 190 °C; дальнейшее повышение температуры сопровождается уменьшением вязкости и выше 300 °C расплавленная сера снова становится подвижной. Это связано с тем, что при нагревании серы она постепенно полимеризуется, увеличивая длину цепочки с повышением температуры. При нагревании серы свыше 190 °C полимерные звенья начинают рушиться. Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд[5].
Химические свойства
Горение серыНа воздухе сера горит, образуя сернистый ангидрид — бесцветный газ с резким запахом:
С помощью спектрального анализа установлено, что на самом деле процесс окисления серы в двуокись представляет собой цепную реакцию и происходит с образованием ряда промежуточных продуктов: моноокиси серы S2O2, молекулярной серы S2, свободных атомов серы S и свободных радикалов моноокиси серы SO[6].
Восстановительные свойства серы проявляются в реакциях серы и с другими неметаллами, однако при комнатной температуре сера реагирует только со фтором:
Расплав серы реагирует с хлором, при этом возможно образование двух низших хлоридов[7]:
При нагревании сера также реагирует с фосфором, образуя смесь сульфидов фосфора[8], среди которых — высший сульфид P2S5:
Кроме того, при нагревании сера реагирует с водородом, углеродом, кремнием:
- (сероводород)
- (сероуглерод)
При нагревании сера взаимодействует со многими металлами, часто — весьма бурно. Иногда смесь металла с серой загорается при поджигании. При этом взаимодействии образуются сульфиды:
- .
Растворы сульфидов щелочных металлов реагируют с серой с образованием полисульфидов:
Из сложных веществ следует отметить прежде всего реакцию серы с расплавленной щёлочью, в которой сера диспропорционирует аналогично хлору:
- .
Полученный сплав называется серной печенью.
С концентрированными кислотами-окислителями (HNO3, H2SO4) сера реагирует только при длительном нагревании:
- (конц.)
- (конц.)
Биологическая роль
Сера — один из биогенных элементов. Сера входит в состав некоторых аминокислот (цистеин, метионин), витаминов (биотин, тиамин), ферментов. Сера участвует в образовании третичной структуры белка (формирование дисульфидных мостиков). Также сера участвует в бактериальном фотосинтезе (сера входит в состав бактериохлорофилла, а сероводород является источником водорода). Окислительно-восстановительные реакции серы — источник энергии в хемосинтезе[9].
Человек содержит примерно 2 г серы на 1 кг своего веса.
Самородная сера на почтовой марке, 2009Пожароопасные свойства серы
Тонкоизмельченная сера склонна к химическому самовозгоранию в присутствии влаги, при контакте с окислителями, а также в смеси с углём, жирами, маслами. Сера образует взрывчатые смеси с нитратами, хлоратами и перхлоратами. Самовозгорается при контакте с хлорной известью.
Средства тушения: распылённая вода, воздушно-механическая пена[10].
По данным В. Маршалла пыль серы относится к разряду взрывоопасных, но для взрыва необходима достаточно высокая концентрация пыли — порядка 20 г/м³ (20 000 мг/м³), такая концентрация во много раз превышает предельно допустимую концентрацию для человека в воздухе рабочей зоны — 6 мг/м³[11].
Пары образуют с воздухом взрывчатую смесь[12].
Горение серы протекает только в расплавленном состоянии аналогично горению жидкостей. Верхний слой горящей серы кипит, создавая пары, которые образуют слабосветящееся пламя высотой до 5 см[13]. Температура пламени при горении серы составляет 1820 °C[14].
Так как воздух по объёму состоит приблизительно из 21 % кислорода и 79 % азота и при горении серы из одного объёма кислорода получается один объём SO2, то максимальное теоретически возможное содержание SO2 в газовой смеси составляет 21 %. На практике горение происходит с некоторым избытком воздуха, и объёмное содержание SO2 в газовой смеси меньше теоретически возможного, составляя обычно 14…15 %[6].
Обнаружение горения серы пожарной автоматикой является трудной проблемой. Пламя сложно обнаружить человеческим глазом или видеокамерой, спектр голубого пламени лежит в основном в ультрафиолетовом диапазоне. Тепловыделение при пожаре приводит к температуре ниже, чем при пожарах других распространенных пожароопасных веществ. Для обнаружения горения тепловым извещателем необходимо размещать его непосредственно близко к сере. Пламя серы не излучает в инфракрасном диапазоне. Таким образом оно не будет обнаружено распространёнными инфракрасными извещателями. Ими будут обнаруживаться лишь вторичные возгорания. Пламя серы не выделяет паров воды. Таким образом детекторы ультрафиолетовых извещателей пламени, использующие соединения никеля, не будут работать.
Для эффективного обнаружения пламени рекомендуется использовать ультрафиолетовые извещатели с детекторами на основе молибдена. Они имеют спектральный диапазон чувствительности 1850…2650 ангстрем, который подходит для обнаружения горения серы[15].
Для выполнения требований пожарной безопасности на складах серы необходимо:
- конструкции и технологическое оборудование должны регулярно очищаться от пыли;
- помещение склада должно постоянно проветриваться естественной вентиляцией при открытых дверях;
- дробление комков серы на решётке бункера должно производиться деревянными кувалдами или инструментом из неискрящего материала;
- конвейеры для подачи серы в производственные помещения должны быть снабжены металлоискателями;
- в местах хранения и применения серы необходимо предусматривать устройства (бортики, пороги с пандусом и т. п.), обеспечивающие в аварийной ситуации предотвращение растекания расплава серы за пределы помещения или открытой площадки;
- на складе серы запрещается:
- производство всех видов работ с применением открытого огня;
- складировать и хранить промасленную ветошь и тряпки;
- при ремонте применять инструмент из искродающего материала[16].
Пожары на складах серы
В декабре 1995 года на открытом складе серы предприятия, расположенного в городе Сомерсет-Уэст Западной Капской провинции Южно-Африканской Республики произошёл крупный пожар, погибли два человека[17][18].
16 января 2006 г. около пяти вечера на череповецком предприятии «Аммофос» загорелся склад с серой. Общая площадь пожара — около 250-ти квадратных метров. Полностью ликвидировать его удалось лишь в начале второго ночи. Жертв и пострадавших нет[19].
15 марта 2007 рано утром на ООО «Балаковский завод волоконных материалов» произошёл пожар на закрытом складе серы. Площадь пожара составила 20 кв.м. На пожаре работало 4 пожарных расчёта с личным составом в 13 человек. Примерно через полчаса пожар был ликвидирован. Никто не пострадал[20].
4 и 9 марта 2008 года произошло возгорание серы в Атырауской области в хранилище серы ТШО на Тенгизском месторождении. В первом случае очаг возгорания удалось потушить быстро, во втором случае сера горела 4 часа. Объём горевших отходов нефтепереработки, к каковым по казахстанским законам отнесена сера, составил более 9 тысяч килограммов[21].
В апреле 2008 недалеко от посёлка Кряж Самарской области загорелся склад, на котором хранилось 70 тонн серы. Пожару была присвоена вторая категория сложности. К месту происшествия выехали 11 пожарных расчётов и спасатели. В тот момент, когда пожарные оказались около склада, горела ещё не вся сера, а только её небольшая часть — около 300 килограммов. Площадь возгорания вместе с участками сухой травы, прилегающими к складу, составила 80 квадратных метров. Пожарным удалось быстро сбить пламя и локализовать пожар: очаги возгорания были засыпаны землёй и залиты водой[22].
В июле 2009 в Днепродзержинске горела сера. Пожар произошёл на одном из коксохимических предприятий в Баглейском районе города. Огонь охватил более восьми тонн серы. Никто из сотрудников комбината не пострадал[23].
В конце июля 2012 под Уфой в поселке Тимашево загорелся склад с серой площадью 3200 квадратных метров. На место выехало 13 единиц техники, в тушении пожара задействован 31 пожарный. Произошло загрязнение атмосферного воздуха продуктами горения. Погибших и пострадавших нет.[24].
См. также
Примечания
- ↑ Химическая энциклопедия: в 5 т. / Редкол.:Зефиров Н. С. (гл. ред.). — Москва: Советская энциклопедия, 1995. — Т. 4. — С. 319. — 639 с. — 20 000 экз. — ISBN 5—85270—039—8
- ↑ Этимологический словарь русского языка Семенова
- ↑ Фасмер М. Этимологический словарь русского языка, том 3. — М.: Прогресс. — 1964 – 1973. — С. 603.
- ↑ Mallory J. P., Adams D.Q. The Oxford Introduction To Proto-Indo-European And Indo-European World. — Oxford:University Press. — 2006. — С. 124.
- ↑ Б. В. Некрасов. Основы общей химии. — 3-е изд., исправленное и доп. — М.: Химия, 1973. — Т. 1. — 656 с.
- ↑ 1 2 Непенин Н. Н. Технология целлюлозы. Производство сульфитной целлюлозы. — М.: «Лесная промышленность», 1976. — С. 151.
- ↑ Ключников Н. Г. Неорганчиеский синтез. М., Просвещение, 1971, С. 267—269
- ↑ Реми Г. Курс неорганической химии. — М.: «Издательство иностранной литературы», 1961. — С. 695.
- ↑ Т.Л.Богданова, Е.А.Солодова. Биология: Справочник для старшеклассников и поступающих в ВУЗы. — М.: АСТ-ПРЕСС КНИГА. — 2011. — С. 85.
- ↑ А. Я. Корольченко, Д. А. Корольченко. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х ч. — 2-е изд., перераб и доп. — М.: Асе. «Пожнаука», 2004. — Т. 2. — 396 с.
- ↑ Е. П. Белобров, А. В. Сидоров «Эколого-гигиенические последствия взрывов пыли и пожаров комовой серы, сопровождающие её перегрузку в порту Мариуполь»
- ↑ РД 50-290-81 Методические указания. Анализаторы содержания серы в нефти. Методы и средства поверки — скачать бесплатно
- ↑ В. Аксютин, П. Щеглов, В. Жолобов, С. Алексанянц «Ликвидация пожаров при аварийных ситуациях с опасными грузами»
- ↑ Теребнев В. В. Справочник руководителя тушения пожара. Тактические возможности пожарных подразделений. — М.: Пожкнига, 2004. — С. 99.
- ↑ http://www.det-tronics.com/utcfs/ws-462/Assets/77-1022_sulfur_fire_detection.pdf
- ↑ ППБО 157-90 Правила пожарной безопасности в лесной промышленности 5.11. Склады серы и негашёной извести
- ↑ South African sulphur fire
- ↑ AECI fire puts sulphur stockpiles in spotlight-01/01/1996-ECN
- ↑ Радио «Трансмит» : Новости : Пожар на череповецком «Аммофосе»! Накануне около пяти вечера на этом предприятии загорелся склад с серой
- ↑ В Балакове сгорел склад с серой — Информационное агентство Взгляд-инфо
- ↑ ТОО «Тенгизшевройл» оштрафуют за два пожара в хранилище серы | Информационный портал ZAKON.KZ
- ↑ KP.RU // МЧСники ищут владельца сарая с серой, который горел под Самарой
- ↑ Коксохим горел в Днепродзержинске
- ↑ Под Уфой горел склад с серой
Литература
Ссылки
dal.academic.ru
Дихлорид серы — Википедия
Материал из Википедии — свободной энциклопедии
Перейти к навигации Перейти к поиску| Дихлорид серы | |
|---|---|
| Общие | |
| Систематическое наименование |
Дихлорид серы |
| Традиционные названия | Хлористая сера |
| Хим. формула | SCl2 |
| Физические свойства | |
| Состояние | тёмно-красная жидкость |
| Молярная масса | 102,97 г/моль |
| Плотность | 1,621 г/см³ |
| Термические свойства | |
| Т. плав. | -121; -78 °C |
| Т. кип. | 59,6 °C |
| Мол. теплоёмк. | 103,4 Дж/(моль·К) |
| Энтальпия образования | -49,4 кДж/моль |
| Оптические свойства | |
| Показатель преломления | 1,557 |
| Классификация | |
| Рег. номер CAS | 10545-99-0 |
| PubChem | 25353 |
| Рег. номер EINECS | |
ru.wikipedia.org
Сера — Популярная химия
Элемент сера S — твёрдое, хрупкое, жёлтое кристаллическое вещество с температурой плавления 119,3°С. Но не надо путать эту серу с серой на спичках.
На головках спичек в основном находятся сложные вещества, одним из которых — хлорат калия (KClO3), которое способно самовоспламеняться при трении или температуре.
Элемент сера — простое вещество и здесь присутствует в качестве одного из компонентов, составляющих спичечную головку.

Модификации серы
Существует две модификации серы: хрупкая сера и пластическая сера. При 113 °С кристаллическая сера плавится, превращаясь в жёлтую водянистую жидкость.
Расплавленная сера при температуре 187°С становится очень вязкой и быстро темнеет. При этом меняется её структурное состояние. А если нагреть серу до 445 °С, она закипает.
Выливая кипящую серу тонкой струйкой в холодную воду, можно получить пластическую серу — резиноподобную модификацию, состоящую из полимерных цепочек.
В этом состоянии сера способна деформироваться, растягиваться, при этом материал не разрушается. Но стоит ей полежать несколько дней на воздухе, как она превращается опять в хрупкий материал.
Элемент сера — диэлектрик. Она может служить теплоизолятором. Сера легко окисляет почти все металлы, кроме золота Au, платины Pt и рутения Ru.
Элемент сера окисляет даже при комнатной температуре щелочные (натрий Na, калий K, литий Li, кальций Ca) и щелочноземельные металлы (алюминий Al, магний Mg).
На воздухе кристаллическая сера горит синим пламенем с образованием диоксида серы SO2 (газ с неприятным удушливым запахом).
Если сжигать кристаллическую серу в атмосфере водорода, то образуется газ с запахом протухших яиц. Это сероводород h3S. Если Вы проезжали мимо шельфа Чёрного моря, то наверняка чувствовали этот запах.
Чёрное море, начиная с глубины уже 150 м имеет повышенную концентрацию сероводорода. А на мелководье этот газ выходит наружу. Этим объясняется тот факт, что на глубине порядка уже 150 м практически нет жизни.
Физические свойства
Сера существенно отличается от кислорода способностью образовывать устойчивые гомоцепи. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество желтого цвета.

Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета. Формулу пластической серы чаще всего записывают просто S, так как она имеет атомарную структуру, а не молекулярную. В воде сера нерастворима, некоторые её модификации растворяются в органических растворителях, например сероуглероде.
Химические свойства
При комнатной температуре сера реагирует со фтором, хлором и концентрированными кислотами-окислителями (HNO3, h3SO4), проявляя восстановительные свойства: S + 3F2 = SF6 S + Cl2 = SCl2 S + 6HNO3(конц.) = h3SO4 + 6NO2 ^ + 2h3O S + 2h3SO4(конц.) = 3SO2 ^ + 2h3O На воздухе сера горит, образуя сернистый ангидрид — бесцветный газ с резким запахом: S + O2 = SO2 При взаимодействии с металлами образует сульфиды.
При нагревании сера реагирует с углеродом, кремнием, фосфором, водородом: C + 2S = CS2 (сероуглерод). Сера при нагревании растворяется в щелочах — реакция диспропорционирования 3S + 6KOH = K2SO3 + 2K2S + 3h3O.

Полезные и лечебные свойства серы
Сера – это макроэлемент. Она входит в состав таких аминокислот, как метионин и цистин. Сера содержится также в витамине тиамин и ферменте инсулин.
Она активно помогает организму бороться с вредными бактериями, защищая протоплазму крови.
Свертываемость крови также зависит от количества серы – она помогает поддерживать достаточный уровень свертываемости.
Еще одна способность серы также делает ее необходимой – она способствует поддержанию нормальной концентрации вырабатываемой организмом желчи, что необходимо для переваривания пищи.
Замечательное свойство серы – замедлять процессы старения организма. Из-за одного этого свойства серу можно назвать королевой макроэлементов. Не будем делать это лишь из-за понимания того, что все минеральные вещества действуют в комплексе.
Замедление старения возможно благодаря способности серы предохранять организм от радиации и других подобных воздействий окружающей среды.
Это очень важно в условиях современной экологии и постоянного нахождения человека вблизи электроприборов и различных волновых излучателей.

Сера также жизненно необходима при синтезе коллагена. Это известное вещество придает коже необходимую структуру. Трио «кожа, ногти, волосы» сохраняют здоровый вид во многом благодаря этому макроэлементу.
Так что не стоит употреблять искусственный коллаген или делать инъекции – достаточно есть продукты, богатые серой. Ровный и стойкий загар также зависит от серы, т.к. она входит в пигмент кожи меланин.
Сера содержится в гемоглобине. А мы знаем, что от уровня гемоглобина в крови напрямую зависит транспортировка кислорода к клеткам тканей организма из органов дыхания и перемещение углекислого газа из клеток в органы дыхания.
То есть возможность насыщать кровь кислородом и тем самым обеспечивать человека жизненной энергией.
Потребность организма в сере
За одни сутки организм взрослого человека должен получить от 1 до 3 г серы – тогда он будет чувствовать себя бодрым и полным сил. Где содержится сера?
Продукты, содержащие серу
Чтобы получить необходимое количество этого вещества, нужно употреблять в пищу следующие продукты:
-Сыр
-Яйца
-Мясо
-Рыбу
-Хлеб
-Крупы
-Бобовые
-Брюссельскую капусту
-Белокочанную капусту
-Чеснок
-Лук
-Салат
-Репу
-Проростки пшеницы.
Диетологи говорят, что наибольшее количество серы содержится в перепелиных яйцах. Недаром их считают панацеей для выведения радионуклидов из организма. Однако куриные яйца также содержат много серы.
ximik.biz
