Характерные химические свойства щелочных металлов » HimEge.ru
•Восстановительная способность увеличивается в ряду ––Li–Na–K–Rb–Cs.
•Все соединения щелочных металлов имеют ионный характер.
•Практически все соли растворимы в воде.
•Вследствие своей активности щелочные металлы хранят под слоем керосина, чтобы преградить доступ воздуха и влаги. Литий очень легкий и в керосине всплывает на поверхность, поэтому его хранят под слоем вазелином.
1. Щелочные металлы активно взаимодействуют с водой:
2Na + 2H2O → 2NaOH + H2
2Li + 2H2O → 2LiOH + H2
2. Реакция щелочных металлов с кислородом:
4Li + O2 → 2Li2O (оксид лития)
2Na + O2 → Na2O2 ( пероксид натрия)
K + O2 → KO2 (надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
2Li + Cl2 → 2LiCl (галогениды)
2Na + S → Na2S (сульфиды)
2Na + H
6Li + N2 → 2Li3N (нитриды)
2Li + 2C → Li2C2 (карбиды)
4. Реакция щелочных металлов с кислотами
(проводят редко, идет конкурирующая реакция с водой):
2Na + 2HCl → 2NaCl + H2
5. Взаимодействие щелочных металлов с аммиаком
(образуется амид натрия):
2Li + 2NH3 = 2LiNH2 + H2
6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2;
2K + 2C6H5OH = 2C6H5OK + H2;
7. Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета:
Li+ – карминово-красный
Na+ – желтый
K+, Rb+ и Cs+ – фиолетовый
Получение щелочных металлов
Металлические литий, натрий и калий получают электролизом расплава солей (хлоридов), а рубидий и цезий – восстановлением в вакууме при нагревании их хлоридов кальцием: 2CsCl+Ca=2Cs+CaCl
2
В небольших масштабах используется также вакуум-термическое получение натрия и калия:
2NaCl+CaC2=2Na+CaCl2+2C;
4KCl+4CaO+Si=4K+2CaCl2+Ca2SiO4.
Активные щелочные металлы выделяются в вакуум-термических процессах благодаря своей высокой летучести (их пары удаляются из зоны реакции).
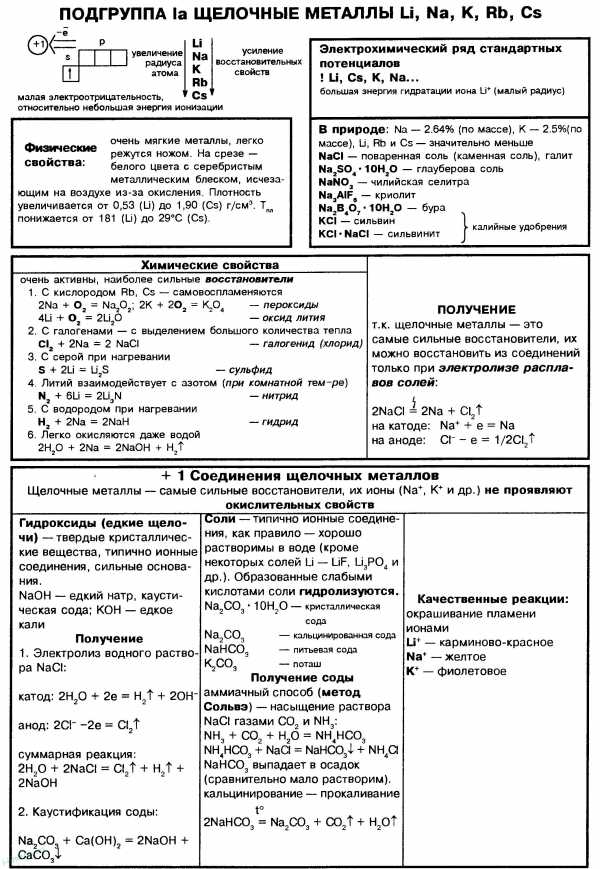
 Особенности химических свойств s-элементов I группы и их физиологическое действие
Особенности химических свойств s-элементов I группы и их физиологическое действие
Электронная конфигурация атома лития 1s22s1 . У него самый большой во 2-м периоде атомный радиус, что облегчает отрыв валентного электрона и возникновение иона Li+ со стабильной конфигурацией инертного газа (гелия). Следовательно, его соединения образуются с передачей электрона от лития к другому атому и возникновением ионной связи с небольшой долей ковалентности. Литий ‑ типичный металлический элемент. В виде вещества это щелочной металл. От других членов I группы он отличается малыми размерами и наименьшей, по сравнению с ними, активностью. В этом отношении он напоминает расположенный по диагонали от Li элемент II группы ‑ магний. В растворах ион Li
Малый размер иона Li+, высокий заряд ядра и всего два электрона создают условия для возникновения вокруг этой частицы довольно значительного поля положительного заряда, поэтому в растворах к нему притягивается значительное число молекул полярных растворителей и его координационное число велико, металл способен образовывать значительное число литийорганических соединений.
Натрием начинается 3-й период, поэтому у него на внешнем уровне всего 1е—, занимающий 3s-орбиталь. Радиус атома Na — наибольший в 3-м периоде. Эти две особенности определяют характер элемента. Его электронная конфигурация 1s 22s22p63s1. Единственная степень окисления натрия +1. Электроотрицательность его очень мала, поэтому в соединениях натрий присутствует только в виде положительно заряженного иона и придает химической связи ионный характер. По размеру ион Na+ значительно больше, чем Li+, и сольватация его не так велика. Однако в растворе в свободном виде он не существует.
Физиологическое значение ионов К+ и Na+ связано с их различной адсорбируемостью на поверхности компонентов, входящих в состав земной коры. Соединения натрия лишь незначительно подвержены адсорбции, в то время как соединения калия прочно удерживаются глиной и другими веществами. Мембраны клеток, являясь поверхностью раздела клетка ‑ среда, проницаемы для ионов К+, вследствие чего внутриклеточная концентрация К+ значительно выше, чем ионов Na
Из различных поражений, связанных с применением соединений щелочных металлов, чаще всего встречаются ожоги растворами гидроксидов. Действие щелочей связано с растворением в них белков кожи и образованием щелочных альбуминатов. Щелочь вновь выделяется в результате их гидролиза и действует на более глубокие слои организма, вызывая появление язв. Ногти под влиянием щелочей становятся тусклыми и ломкими. Поражение глаз, даже очень разбавленными растворами щелочей, сопровождается не только поверхностными разрушениями, но нарушениями более глубоких участков глаза (радужной оболочки) и приводит к слепоте. При гидролизе амидов щелочных металлов одновременно образуется щелочь и аммиак, вызывающие трахеобронхит фибринозного типа и воспаление легких.
Калий был получен Г. Дэви практически одновременно с натрием в 1807 г. при электролизе влажного гидроксида калия. От названия этого соединения ‑ «едкое кали» и получил свое наименование элемент. Свойства калия заметно отличаются от свойств натрия, что обусловлено различием величин радиусов их атомов и ионов. В соединениях калия связь более ионная, а в виде иона К+ он обладает меньшим поляризующим действием, чем натрий, из-за больших размеров. Природная смесь состоит из трех изотопов 39К, 40К, 41К. Один из них 40
В 1861 г. при исследовании соли минеральных источников спектральным анализом Роберт Бунзен обнаружил новый элемент. Его наличие доказывалось темно-красными линиями в спектре, которых не давали другие элементы. По цвету этих линий элемент и был назван рубидием (rubidus—темно-красный). В 1863 г. Р. Бунзен получил этот металл и в чистом виде восстановлением тартрата рубидия (виннокислой соли) сажей. Особенностью элемента является легкая возбудимость его атомов. Электронная эмиссия у него появляется под действием красных лучей видимого спектра. Это связано с небольшой разницей в энергиях атомных 4d и 5s-орбиталей. Из всех щелочных элементов, имеющих стабильные изотопы, рубидию (как и цезию) принадлежит один из самых больших атомных радиусов и маленький потенциал ионизации. Такие параметры определяют характер элемента: высокую электроположительность, чрезвычайную химическую активность, низкую температуру плавления (39 0C) и малую устойчивость к внешним воздействиям.
Открытие цезия, как и рубидия, связано со спектральным анализом. В 1860 г. Р.Бунзен обнаружил две яркие голубые линии в спектре, не принадлежащие ни одному известному к тому времени элементу. Отсюда произошло и название «цезиус» (caesius), что значит небесно-голубой. Это последний элемент подгруппы щелочных металлов, который ещё встречается в измеримых количествах. Наибольший атомный радиус и наименьшие первые потенциалы ионизации определяют характер и поведение этого элемента. Он обладает ярко выраженной электроположительностью и ярко выраженными металлическими качествами. Стремление отдать внешний 6s-электрон приводит к тому, что все его реакции протекают исключительно бурно. Небольшая разница в энергиях атомных 5d- и 6s-орбиталей обусловливает легкую возбудимость атомов. Электронная эмиссия у цезия наблюдается под действием невидимых инфракрасных лучей (тепловых). Указанная особенность структуры атома определяет хорошую электрическую проводимость тока. Все это делает цезий незаменимым в электронных приборах. В последнее время все больше внимания уделяется цезиевой плазме как топливу будущего и в связи с решением проблемы термоядерного синтеза.
На воздухе литий активно реагирует не только с кислородом, но и с азотом и покрывается пленкой, состоящей из Li3N (до 75%) и Li2O. Остальные щелочные металлы образуют пероксиды (Na2O2) и надпероксиды (K2O4 или KO2).
Перечисленные вещества реагируют с водой:
Li3N + 3 H2O = 3 LiOH + NH3 ;Na2O2 + 2 H2O = 2 NaOH + H2O2 ;
K2O4 + 2 H2O = 2 KOH + H2O2 + O2 .
Для регенерации воздуха на подводных лодках и космических кораблях, в изолирующих противогазах и дыхательных аппаратах боевых пловцов (подводных диверсантов) использовалась смесь «оксон»:
Na2O2+CO2=Na2CO3+0,5O2 ;
K2O4 + CO2 = K2CO3+ 1,5 O2 .
В настоящее время это стандартная начинка регенерирующих патронов изолирующих противогазов для пожарных.
Щелочные металлы реагируют при нагревании с водородом, образуя гидриды:
2Li+H2=2LiH.
Гидрид лития используется как сильный восстановитель.
Гидроксиды щелочных металлов разъедают стеклянную и фарфоровую посуду, их нельзя нагревать и в кварцевой посуде:
SiO2+2NaOH=Na2SiO3+H2O.
Гидроксиды натрия и калия не отщепляют воду при нагревании вплоть до температур их кипения (более 13000С). Некоторые соединения натрия называют содами:
а) кальцинированная сода, безводная сода, бельевая сода или просто сода – карбонат натрия Na2CO3;
б) кристаллическая сода – кристаллогидрат карбоната натрия Na2CO3.10H2O;
в) двууглекислая или питьевая – гидрокарбонат натрия NaHCO3;
г) гидроксид натрия NaOH называют каустической содой или каустиком.
himege.ru
Химические свойства щелочных металлов.
Щелочными металлами (ЩМ) называют все элементы IA группы таблицы Менделеева, т.е. литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
У атомов ЩМ на внешнем электронном уровне находится только один электрон на s-подуровне, легко отрывающийся при протекании химических реакций. При этом из нейтрального атома ЩМ образуется положительно заряженная частица – катион с зарядом +1:
М0 – 1 e → М+1
Семейство ЩМ является наиболее активным среди прочих групп металлов в связи с чем в природе обнаружить их в свободной форме, т.е. в виде простых веществ невозможно.
Простые вещества щелочные металлы являются крайне сильными восстановителями.
Взаимодействие щелочных металлов с неметаллами
с кислородом
Щелочные металлы реагируют с кислородом уже при комнатной температуре, в связи с чем их требуется хранить под слоем какого-либо углеводородного растворителя, такого как, например, керосина.
Взаимодействие ЩМ с кислородом приводит к разным продуктам. С образованием оксида, с киcлородом реагирует только литий:
4Li + O2 = 2Li2O
Натрий в аналогичной ситуации образует с кислородом пероксид натрия Na2O2:
2Na + O2 = Na2O2,
а калий, рубидий и цезий – преимущественно надпероксиды (супероксиды), общей формулы MeO2:
K + O2 = KO2
Rb + O2 = RbO2
с галогенами
Щелочные металлы активно реагируют с галогенами, образуя галогениды щелочных металлов, имеющих ионное строение:
2Li + Br2 = 2LiBr бромид лития
2Na + I2 = 2NaI иодид натрия
2K + Cl2 = 2KCl хлорид калия
с азотом
Литий реагирует с азотом уже при обычной температуре, с остальными же ЩМ азот реагирует при нагревании. Во всех случаях образуются нитриды щелочных металлов:
6Li + N2 = 2Li3N нитрид лития
6K + N2 = 2K3N нитрид калия
с фосфором
Щелочные металлы реагируют с фосфором при нагревании, образуя фосфиды:
3Na + P = Na3Р фосфид натрия
3K + P = K3Р фосфид калия
с водородом
Нагревание щелочных металлов в атмосфере водорода приводит к образованию гидридов щелочных металлов, содержащих водород в редкой степени окисления – минус 1:
Н2 + 2K = 2KН-1гидрид калия
Н2 + 2Rb = 2RbН гидрид рубидия
с серой
Взаимодействие ЩМ с серой протекает при нагревании с образованием сульфидов:
S + 2K = K2S сульфид калия
S + 2Na = Na2S сульфид натрия
Взаимодействие щелочных металлов со сложными веществами
с водой
Все ЩМ активно реагируют с водой с образованием газообразного водорода и щелочи, из-за чего данные металлы и получили соответствующее название:
2HOH + 2Na = 2NaOH + H2↑
2K + 2HOH = 2KOH + H2↑
Литий реагирует с водой довольно спокойно, натрий и калий самовоспламеняются в процессе реакции, а рубидий, цезий и франций реагируют с водой с мощным взрывом.
с галогенпроизводными углеводородов (реакция Вюрца):
2Na + 2C2H5Cl → 2NaCl + C4H10
2Na + 2C6H5Br → 2NaBr + C6H5–C6H5
со спиртами и фенолами
ЩМ реагируют со спиртами и фенолами, замещая водород в гидроксильной группе органического вещества:
2CH3OH + 2К = 2CH3OК + H2↑
метилат калия
2C6H5OH + 2Na = 2C6H5ONa + H2
фенолят натрия
scienceforyou.ru
Химия щелочных металлов и их соединений
Щелочные металлы
1. Положение в периодической системе химических элементов
2. Электронное строение и закономерности изменения свойств
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и фосфором
7.1.3. Взаимодействие с водородом
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с углеродом
7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с водой
7.2.2. Взаимодействие с минеральными кислотами
7.2.3. Взаимодействие с серной кислотой
7.2.4. Взаимодействие с азотной кислотой
7.2.5. Взаимодействие со слабыми кислотами
7.2.6. Взаимодействие с солями
Оксиды щелочных металлов
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с кислотными и амфотерными оксидами
2.2. Взаимодействие с кислотами
2.3. Взаимодействие с водой
2.4. Взаимодействие с кислотами
Пероксиды щелочных металлов
1. Химические свойства
1.1. Взаимодействие с водой
1.2. Взаимодействие с кислотными и амфотерными оксидами
1.3. Взаимодействие с кислотами
1.4. Разложение
1.5. Взаимодействие с восстановителями
1.6. Взаимодействие с окислителями
Гидроксиды щелочных металлов (щелочи)
1. Способы получения
2. Химические свойства
2.1. Взаимодействие щелочей с кислотами
2.2. Взаимодействие щелочей с кислотными оксидами
2.3. Взаимодействие щелочей с амфотерными оксидами и гидроксидами
2.4. Взаимодействие щелочей с кислыми солями
2.5. Взаимодействие щелочей с неметаллами
2.6. Взаимодействие щелочей с металлами
2.7. Взаимодействие щелочей с солями
2.8. Разложение щелочей
2.9. Диссоциация щелочей
2.10. Электролиз щелочей
Соли щелочных металлов
Щелочные металлы
Положение в периодической системе химических элементов
Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева (или просто в 1 группе в длиннопериодной форме ПСХЭ). Это литий Li, натрий Na, калий K, цезий Cs, рубидий Rb и франций Fr.
Электронное строение щелочных металлов и основные свойства
Электронная конфигурация внешнего энергетического уровня щелочных металлов: ns1, на внешнем энергетическом уровне находится 1 s-электрон. Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Рассмотрим некоторые закономерности изменения свойств щелочных металлов.
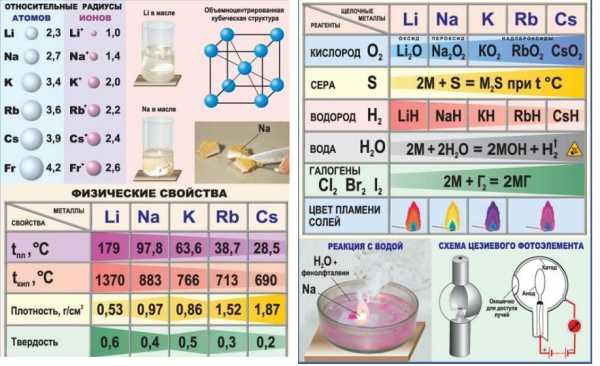
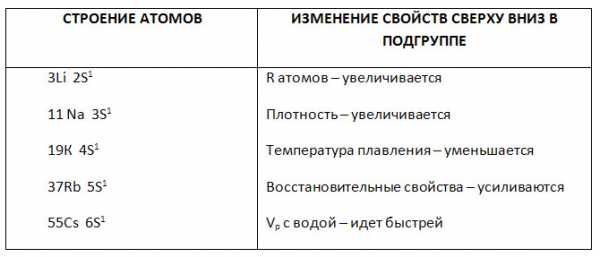
В ряду Li-Na-K-Rb-Cs-Fr, в соответствии с Периодическим законом, увеличивается атомный радиус, усиливаются металлические свойства, ослабевают неметаллические свойства, уменьшается электроотрица-тельность.
Физические свойства
Все щелочные металлы — вещества мягкие, серебристого цвета. Свежесрезанная поверхность их обладает характерным блеском.
Кристаллическая решетка щелочных металлов в твёрдом состоянии — металлическая. Следовательно, щелочные металлы обладают высокой тепло- и электропроводимостью. Кипят и плавятся при низких температурах. Они имеют также небольшую плотность.
Нахождение в природе
Как правило, щелочные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы, в которых присутствуют щелочные металлы:
Поваренная соль, каменная соль, галит — NaCl — хлорид натрия
Сильвин KCl — хлорид калия
Сильвинит NaCl · KCl
Глауберова соль Na2SO4⋅10Н2О – декагидрат сульфата натрия
Едкое кали KOH — гидроксид калия
Поташ K2CO3 – карбонат калия
Поллуцит — алюмосиликат сложного состава с высоким содержанием цезия:
Способы получения
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения темпе-ратуры плавления смеси):
2LiCl = 2Li + Cl2
Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
Калий получают также электролизом расплавов солей или расплава гидроксида калия. Также распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов. В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний:
KCl + Na = K↑ + NaCl
KOH + Na = K↑ + NaOH
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl → 2Cs + CaCl2
В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме.
Качественные реакции
Качественная реакция на щелочные металлы — окрашивание пламени солями щелочных металлов.

Цвет пламени:
Li — карминно-красный
Na — жѐлтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Химические свойства
1. Щелочные металлы — сильные восстановители. Поэтому они реагируют почти со всеми неметаллами.
1.1. Щелочные металлы легко реагируют с галогенами с образованием галогенидов:
2K + I2 = 2KI
1.2. Щелочные металлы реагируют с серой с образованием сульфидов:
2Na + S = Na2S
1.3. Щелочные металлы активно реагируют с фосфором и водородом (очень активно). При этом образуются бинарные соединения — фосфиды и гидриды:
3K + P = K3P
2Na + H2 = 2NaH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
6Li + N2 = 2Li3N
Остальные щелочные металлы реагируют с азотом при нагревании.
1.5. Щелочные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
2Na + 2C = Na2C2
1.6. При взаимодействии с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – преимущественно пероксид, калий и остальные металлы – надпероксид.
4Li + O2 = 2Li2O
2Na + O2 = Na2O2
K + O2 = KO2
Цезий самовозгорается на воздухе, поэтому его хранят в запаянных ампулах. Видеоопыт самовозгорания цезия на воздухе можно посмотреть здесь.
2. Щелочные металлы активно взаимодействуют со сложными веществами:
2.1. Щелочные металлы бурно (со взрывом) реагируют с водой. Взаимодействие щелочных металлов с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
Например, калий реагирует с водой очень бурно:
2K0 + H2+O = 2K+OH + H20
Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Щелочные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например, натрий бурно реагирует с соляной кислотой:
2Na + 2HCl = 2NaCl + H2↑
2.3. При взаимодействии щелочных металлов с концентрированной серной кислотой выделяется сероводород.
Например, при взаимодействии натрия с концентрированной серной кислотой образуется сульфат натрия, сероводород и вода:
8Na + 5H2SO4(конц.) → 4Na2SO4 + H2S + 4H2O
2.4. Щелочные металлы реагируют с азотной кислотой. При взаимодейст-вии с концентрированной азотной кислотой образуется оксид азота (I):
8Na + 10HNO3 (конц) → N2O + 8NaNO3 + 5H2O
С разбавленной азотной кислотой образуется молекулярный азот:
10Na + 12HNO3 (разб)→ N2 +10NaNO3 + 6H2O
При взаимодействии щелочных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
8Na + 10HNO3 = 8NaNO3 + NH4NO3 + 3H2O
2.5. Щелочные металлы могут реагировать даже с веществами, которые проявляют очень слабые кислотные свойства. Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами, фенолом и органическими кислотами.
Например, при взаимодействии лития с аммиаком образуются амиды и водород:
2Li + 2NH3 = 2LiNH2 + H2 ↑
Ацетилен с натрием образует ацетиленид натрия и также водород:
Н ─ C ≡ С ─ Н + 2Na → Na ─ C≡C ─ Na + H2
Фенол с натрием реагирет с образованием фенолята натрия и водорода:
2C6H5OH + 2Na → 2C6H5ONa + H2↑
Метанол с натрием образуют метилат натрия и водород:
2СН3ОН + 2Na → 2 CH3ONa + H2↑
Уксусная кислота с литием образует ацетат лития и водород:
2СH3COOH + 2Li → 2CH3COOOLi + H2↑
Щелочные металлы реагируют с галогеналканами (реакция Вюрца).
Например, хлорметан с натрием образует этан и хлорид натрия:
2CH3Cl + 2Na → C2H6 + 2NaCl
2.6. В расплаве щелочные металлы могут вытеснять менее активные металлы из солей. Обратите внимание! В растворе щелочные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например, натрий вытесняет алюминий из расплава хлорида алюминия :
3Na + AlCl3 → 3NaCl + Al
Оксиды щелочных металлов
Способы получения
Оксиды щелочных металлов (кроме лития) можно получить только косвенными методами: взаимодействием натрия с окислителями в расплаве:
1. Оксид натрия можно получить взаимодействием натрия с нитратом натрия в расплаве:
10Na + 2NaNO3 → 6Na2O + N2 ↑
2. Взаимодействием натрия с пероксидом натрия:
2Na + Na2O2 → 2Na2O
3. Взаимодействием натрия с расплавом щелочи:
2Na + 2NaOН → 2Na2O + Н2↑
4. Оксид лития можно получить разложением гидроксида лития:
2LiOН → Li2O + Н2O
Химические свойства
Оксиды щелочных металлов — типичные основные оксиды. Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
1. Оксиды щелочных металлов взаимодействуют с кислотными и амфотерными оксидами:
Например, оксид натрия взаимодействует с оксидом фосфора (V):
3Na2O + P2O5 → 2Na3PO4
Оксид лития взаимодейсвует с амфотерным оксидом алюминия:
Na2O + Al2O3 → 2NaAlO2
2. Оксиды щелочных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например, оксид калия взаимодействует с соляной кислотой с образованием хлорида калия и воды:
K2O + 2HCl → 2KCl + H2O
3. Оксиды щелочных металлов активно взаимодействуют с водой с образованием щелочей.
Например, оксид лития взаимодействует с водой с образованием гидроксида лития:
Li2O + H2O → 2LiOH
4. Оксиды щелочных металлов окисляются кислородом (кроме оксида лития): оксид натрия — до пероксида, оксиды калия, рубидия и цезия – до надпероксида.
2Na2O + O2 = 2Na2O2
Пероксиды щелочных металлов
Химические свойства
Свойства пероксидов очень похожи на свойства оксидов. Однако пероксиды щелочных металлов, в отличие от оксидов, содержат атомы кислорода со степенью окисления -1. Поэтому они могут могут проявлять как окислительные, так и восстановительные свойства.
1. Пероксиды щелочных металлов взаимодействуют с водой. При этом на холоде протекает обменная реакция, образуются щелочь и пероксид водорода:
Na2O2 + 2H2O (хол.) = 2NaOH + H2O2
При нагревании пероксиды диспропорционируют в воде, образуются щелочь и кислород:
2Na2O2 + 2H2O (гор.) = 4NaOH + O2↑
2. Пероксиды диспропорционируют при взаимодействии с кислотными оксидами.
Например, пероксид натрия реагирует с углекислым газом с образовани-ем карбоната натрия и кислорода:
2Na2O2 + CO2 = 2Na2CO3 + O2↑
3. При взаимодействии с минеральными кислотами на холоде пероксиды вступают в обменную реакцию. При этом образуются соль и перекись водорода:
Na2O2 + 2HCl = 2NaCl + H2O2
При нагревании пероксиды, опять-таки, диспропорционируют:
2Na2O2 + 2H2SO4 (разб.гор.) = 2Na2SO4 + 2H2O + O2↑
4. Пероксиды щелочных металлов разлагаются при нагревании, с образованием оксида и кислорода:
2Na2O2 = 2Na2O + O2↑
5. При взаимодействии с восстановителями пероксиды проявляют окис-лительные свойства.
Например, пероксид натрия с угарным газом реагирует с образованием карбоната натрия:
Na2O2 + CO = Na2CO3
Пероксид натрия с сернистым газом также вступает в ОВР с образовани-ем сульфата натрия:
Na2O2 + SO2 = Na2SO4
2Na2O2 + S = Na2SO3 + Na2O
Na2O2 + 2H2SO4 + 2NaI = I2 + 2Na2SO4 + 2H2O
Na2O2 + 2H2SO4 + 2FeSO4 = Fe2(SO4)3 + Na2SO4 + 2H2O
3Na2O2 + 2Na3[Cr(OH)6] = 2Na2CrO4 + 8NaOH + 2H2O
6. При взаимодействии с сильными окислителями пероксиды проявляют свойства восстановителей и окисляются, как правило, до молекулярного кислорода.
Например, при взаимодействии с подкисленным раствором пермангана-та калия пероксид натрия образует соль и молекулярный кислород:
5Na2O2 + 8H2SO4 + 2KMnO4 = 5O2 + 2MnSO4 + 8H2O + 5Na2SO4 + K2SO4
Гидроксиды щелочных металлов (щелочи)
Способы получения
1. Щелочи получают электролизом растворов хлоридов щелочных метал-лов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии щелочных металлов, их оксидов, пероксидов, гид-ридов и некоторых других бинарных соединений с водой также образуют-ся щелочи.
Например, натрий, оксид натрия, гидрид натрия и пероксид натрия при растворении в воде образуют щелочи:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
Na2O2 + H2O → 2NaOH + H2O2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Например, карбонат калия с гидроксидом кальция образует карбонат кальция и гидроксид калия:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Химические свойства
1. Гидроксиды щелочных металлов реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например, гидроксид калия с фосфорной кислотой реагирует с образова-нием фосфатов, гидрофосфатов или дигидрофосфатов:
3KOH + H3PO4 → K3PO4 + H2O
2KOH + H3PO4 → K2HPO4 + 2H2O
KOH + H3PO4 → KH2PO4 + H2O
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например, гидроксид натрия с углекислым газом реагирует с образова-нием карбонатов или гидрокарбонатов:
2NaOH(избыток) + CO2 → Na2CO3 + H2O
NaOH + CO2(избыток) → NaHCO3
Необычно ведет себя оксид азота (IV) при взаимодействии с щелочами. Дело в том, что этому оксиду соответствуют две кислоты — азотная (HNO3) и азотистая (HNO2). «Своей» одной кислоты у него нет. Поэтому при взаимодействии оксида азота (IV) с щелочами образуются две соли- нитрит и нитрат:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
А вот в присутствии окислителя, например, молекулярного кислорода, образуется только одна соль — нитрат, т.к. азот +4 только повышает степень окисления:
2KOH + 2NO2 + O2 = 2KNO3 + H2O
3. Гидроксиды щелочных металлов реагируют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например, гидроксид натрия с оксидом алюминия реагирует в расплаве с образованием алюминатов:
2NaOH + Al2O3 → 2NaAlO2 + H2O
в растворе образуется комплексная соль — тетрагидроксоалюминат:
2NaOH + Al2O3 + 3H2O → 2Na[Al(OH)4]
Еще пример: гидроксид натрия с гидроксидом алюминия в расплаве образут также комплексную соль:
NaOH + Al(OH)3 → Na[Al(OH)4]
4. Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например: гидроксид калия реагирует с гидрокарбонатом калия с образованием карбоната калия:
KOH + KHCO3 → K2CO3 + H2O
5. Щелочи взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется щелочами до силиката и водорода:
2NaOH + Si + H2O → Na2SiO3 + H2
Фтор окисляет щелочи. При этом выделяется молекулярный кислород:
4NaOH + 2F2 → 4NaF + O2 (OF2)+ 2H2O
Другие галогены, сера и фосфор — диспропорционируют в щелочах:
3KOH + P4 + 3H2O = 3KH2PO2 + PH3↑
2KOH(холодный) + Cl2 = KClO + KCl + H2O
6KOH(горячий) + 3Cl2 = KClO3 + 5KCl + 3H2O
Сера взаимодействует с щелочами только при нагревании:
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
6. Щелочи взаимодействуют с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
2KOH + Zn → K2ZnO2 + H2
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксиды щелочных металлов вступают в обменные реакции с растворимыми солями.
С щелочами взаимодействуют соли тяжелых металлов.
Например, хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с щелочами взаимодействуют соли аммония.
Например, при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксиды всех щелочных металлов плавятся без разложения, гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Все гидроксиды щелочных металлов проявляют свойства сильных оснований. В воде практически нацело диссоциируют, образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na+ + OH—
10. Гидроксиды щелочных металлов в расплаве подвергаются электролизу. При этом на катоде восстанавливаются сами металлы, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Соли щелочных металлов
Нитраты и нитриты щелочных металлов
Нитраты щелочных металлов при нагревании разлагаются на нитраты и кислород. Исключение — нитрат лития. Он разлагается на оксид лития, оксид азота (IV) и кислород.
Например, нитрат натрия разлагается при нагревании на нитрит натрия и молекулярный кислород:
2NaNO3 → 2NaNO2 + O2
Нитраты щелочных металлов в реакциях могут выступать в качестве окислителей.
Нитриты щелочных металлов могут быть окислителями или восстановителями.
В щелочной среде нитраты и нитриты — очень мощные окислители.
Например, нитрат натрия с цинком в щелочной среде восстанавливается до аммиака:
NaNO3 + 4Zn + 7NaOH + 6H2O = 4Na2[Zn(OH)4] + NH3↑
Сильные окислители окисляют нитриты до нитратов.
Например, перманганат калия в кислой среде окисляет нитрит натрия до нитрата натрия:
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
Поделиться ссылкой:
chemege.ru
Щелочные металлы в химии
К щелочным металлам относятся металлы IA группы Периодической системы Д.И. Менделеева – литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). На внешнем энергетическом уровне щелочных металлов находится один валентный электрон. Электронная конфигурация внешнего энергетического уровня щелочных металлов – ns1. В своих соединениях они проявляют единственную степень окисления равную +1. В ОВР являются восстановителями, т.е. отдают электрон.
Физические свойства щелочных металлов
Все щелочные металлы легкие (обладают небольшой плотностью), очень мягкие (за исключением Li легко режутся ножом и могут быть раскатаны в фольгу), имеют низкие температуры кипения и плавления (с ростом заряда ядра атома щелочного металла происходит понижение температуры плавления).
В свободном состоянии Li, Na, K и Rb – серебристо-белые металлы, Cs – металл золотисто-желтого цвета.
Щелочные металлы хранят в запаянных ампулах под слоем керосина или вазелинового масла, поскольку они обладают высокой химической активностью.
Щелочные металлы обладают высокой тепло- и электропроводностью, что обусловлено наличием металлической связи и объемоцентрированной кристаллической решетки
Получение щелочных металлов
Все щелочные металлы возможно получить электролизом расплава их солей, однако на практике таким способом получают только Li и Na, что связано с высокой химической активностью K, Rb, Cs:
2LiCl = 2Li + Cl2↑
2NaCl = 2Na + Cl2↑
Любой щелочной металл можно получить восстановлением соответствующего галогенида (хлорида или бромида), применяя в качестве восстановителей Ca, Mg или Si. Реакции проводят при нагревании (600 – 900С) и под вакуумом. Уравнение получения щелочных металлов таким способом в общем виде:
2MeCl + Ca = 2Mе↑ + CaCl2,
где Ме – металл.
Известен способ получения лития из его оксида. Реакцию проводят при нагревании до 300°С и под вакуумом:
2Li2O + Si + 2CaO = 4Li + Ca2SiO4
Получение калия возможно по реакции между расплавленным гидроксидом калия и жидким натрием. Реакцию проводят при нагревании до 440°С:
KOH + Na = K + NaOH
Химические свойства щелочных металлов
Все щелочные металлы активно взаимодействуют с водой образуя гидроксиды. Из-за высокой химической активности щелочных металлов протекание реакции взаимодействия с водой может сопровождаться взрывом. Наиболее спокойно с водой реагирует литий. Уравнение реакции в общем виде:
2Me + H2O = 2MeOH + H2↑
где Ме – металл.
Щелочные металлы взаимодействуют с кислородом воздуха образую ряд различных соединений – оксиды (Li), пероксиды (Na), надпероксиды (K, Rb, Cs):
4Li + O2 = 2Li2O
2Na + O2 =Na2O2
K + O2 = KO2
Все щелочные металлы при нагревании реагируют с неметаллами (галогенами, азотом, серой, фосфором, водородом и др.). Например:
2Na + Cl2 =2NaCl
6Li + N2 = 2Li3N
2Li +2C = Li2C2
2K + S = K2S
2Na + H2 = 2NaH
Щелочные металлы способны взаимодействовать со сложными веществами (растворы кислот, аммиак, соли). Так, при взаимодействии щелочных металлов с аммиаком происходит образование амидов:
2Li + 2NH3 = 2LiNH2 + H2↑
Взаимодействие щелочных металлов с солями происходит по следующему принципу –вытесняют менее активные металлы (см. ряд активности металлов) из их солей:
3Na + AlCl3 = 3NaCl + Al
Взаимодействие щелочных металлов с кислотами неоднозначно, поскольку при протекании таких реакций металл первоначально будет реагировать с водой раствора кислоты, а образующаяся в результате этого взаимодействия щелочь будет реагировать с кислотой.
Щелочные металлы реагируют с органическими веществами, такими, как спирты, фенолы, карбоновые кислоты:
2Na + 2C2H5OH = 2C2H5ONa + H2↑
2K + 2C6H5OH = 2C6H5OK + H2↑
2Na + 2CH3COOH = 2CH3COONa + H2↑
Качественные реакции
Качественной реакцией на щелочные металлы является окрашивание пламени их катионами: Li+ окрашивает пламя в красный цвет, Na+ — в желтый, а K+, Rb+, Cs+ — в фиолетовый.
Примеры решения задач
ru.solverbook.com
Тема 12. Щелочные металлы. | 9 класс
Часть I
1. Заполните таблицу «Изменение свойств щелочных металлов».
2. Схема химической связи: М-1е=М+1
связь металлическая.
3. Общие химические свойства.
Дополните уравнения реакций щелочных металлов с различными соединениями, записав окислительно-восстановительный баланс к ним.
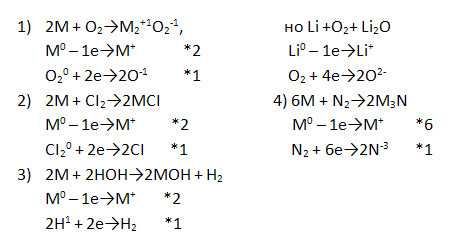
4. Получение – электролиз расплавов хлоридов или гидроксидов.
Часть II
1. Дополните цепочку переходов. Запишите уравнения реакцией, с помощью которых можно осуществить превращения по схеме. Рассмотрите их с позиций окисления-восстановления, а последний переход представьте в свете ТЭД.
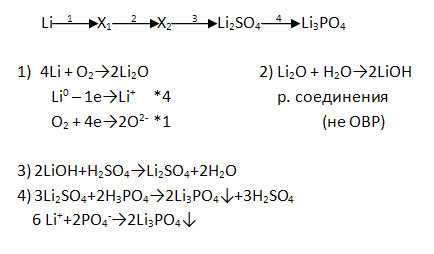
2. Дополните цепочку переходов. Запишите уравнения реакций, с помощью которых можно осуществить превращения по схеме. Рассмотрите переходы как ОВР, а два последних перехода представьте в свете ТЭД.
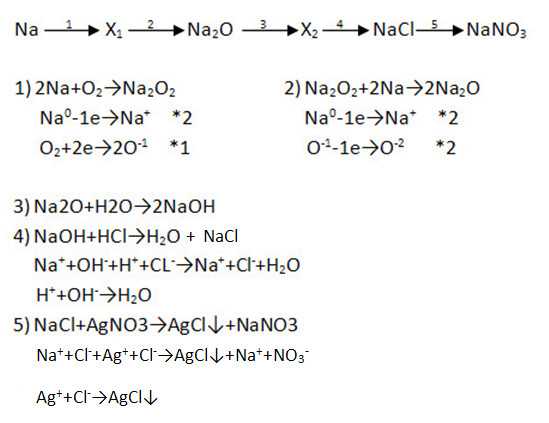
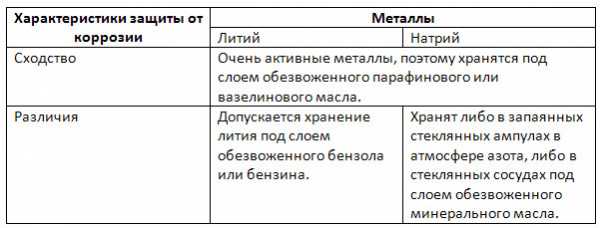
3. Сравните способы защиты от коррозии Li и Na.
4. Рассчитайте массу натрия и объём хлора, полученных в результате электролиза 585 кг хлорида натрия, содержащего 12% примесей.

5. Какой объём займёт водород, выделившейся при растворении в 0,5 л воды 69 г натрия? Какова массовая доля щёлочи в полученном растворе?
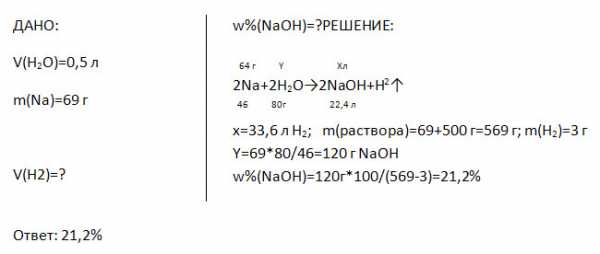
6. С помощью дополнительных источников информации (интернет), подготовьте небольшое сообщение об одном из щелочных металлов. Запишите план этого сообщения или тезисы в особой тетради.
Литий был открыт в 1817 году шведским химиком и минералогом Иоганном Арфведсоном сначала в минерале петалите. Металлический литий впервые получил Гемфри Дэви в 1825 году.
Свое название литий получил из-за того, что был обнаружен в «камнях» (от греч. литий – камень). Основные минералы лития — слюда лепидолит.
Литий — серебристо-белый металл, мягкий и пластичный, тверже натрия, но мягче свинца. Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения, у него самая низкая плотность при комнатной температуре среди всех металлов.
Литий является наименее активным щелочным металлом, с сухим воздухом при комнатной температуре практически не реагирует. По этой причине литий является единственным щелочным металлом, который не хранят в керосине, он может непродолжительное время храниться на воздухе. Литий и его соли окрашивают пламя в карминово-красный цвет.
Применение:
• Термоэлектрические материалы
• Химические источники тока
• Ракетное топливо
• Лазерные материалы
• Сплавы – в авиации и космонавтике
• Оптический материал в радиоэлектронике, аккумуляторы
• Металлургия – восстановления методами металлотермии редких металлов
• Ядерная энергетика
• В медицине
• В качестве смазочных материалов
• Прочие области применения: соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики).
superhimik.ru
общая характеристика, строение; свойства и получение простых веществ — урок. Химия, 8–9 класс.
Щелочными металлами называются химические элементы-металлы \(IA\) группы Периодической системы Д. И. Менделеева: литий \(Li\), натрий \(Na\), калий \(K\), рубидий \(Rb\), цезий \(Cs\) и франций \(Fr\).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns1. Поэтому для всех металлов группы \(IA\) характерна степень окисления \(+1\).
Этим объясняется сходство свойств всех щелочных металлов.
Для них (сверху вниз по группе) характерно:
- увеличение радиуса атомов;
- уменьшение электроотрицательности;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
Основными источниками натрия и калия являются:
- каменная соль (хлорид натрия \(NaCl\)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na2SO4 \(·\) 10h3O,
- сильвин — хлорид калия \(KCl\),
- сильвинит — двойной хлорид калия-натрия \(KCL\) \(·\)\(NaCl\) и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами \(IA\) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.

Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ=1,01 г/см3, у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Все щелочные металлы активно реагируют с водой, выделяя из неё водород.
Пример:
2Na+2h3O=2NaOH+h3↑.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
В расплаве хлорида натрия присутствуют ионы:
NaCl⇄Na++Cl−.
При электролизе
на катоде восстанавливаются катионы Na+, а на аноде окисляются анионы Cl−:
катод (\(–\)): 2Na++2e=2Na,
анод (\(+\)): 2Cl−−2e=Cl2↑.
Суммарное уравнение реакции при электролизе расплава хлорида натрия:
2NaCl→2Na+Cl2↑.
Источники:
Иллюстрация: https://arhivurokov.ru/multiurok/html/2017/02/26/s_58b332582fb94/img1.jpg
www.yaklass.ru
Щелочные металлы
Общая характеристикаНАХОЖДЕНИЕ В ПРИРОДЕ
ПОЛУЧЕНИЕ Литий
ПОЛУЧЕНИЕ Натрий
ПОЛУЧЕНИЕ Калий
ПОЛУЧЕНИЕ Рубидий
ПОЛУЧЕНИЕ Цезий
ПОЛУЧЕНИЕ Франций
Физические свойства
Химические свойства
Химические свойства
Химические свойства
Химические свойства
Роль металлов в организме человека Литий
Роль металлов в организме человека Литий
Роль металлов в организме человека Натрий
Роль металлов в организме человека Натрий
Роль металлов в организме человека Натрий
Роль металлов в организме человека Калий
Роль металлов в организме человека Калий
Роль металлов в организме человека Калий
Роль металлов в организме человека Рубидий, Цезий и Франций
Роль металлов в организме человека Рубидий, Цезий и Франций
Щелочноземельные металлы
Общая характеристикаНАХОЖДЕНИЕ В ПРИРОДЕ
ПОЛУЧЕНИЕ Кальций
ПОЛУЧЕНИЕ Стронций
ПОЛУЧЕНИЕ Барий
ПОЛУЧЕНИЕ Радий
Физические свойства
Химические свойства
Химические свойства
Роль металлов в организме человека Кальций
Роль металлов в организме человека Кальций
Роль металлов в организме человека Стронций
Роль металлов в организме человека Стронций
Роль металлов в организме человека Барий
Роль металлов в организме человека Радий
|
rpp.nashaucheba.ru
