Открытие атомного ядра. Курс истории физики
Открытие атомного ядра

Рассмотрим несколько подробнее одно из фундаментальных открытий Резерфорда —открытие атомного ядра и планетарной модели атома. Мы видели, что уподобление атома планетной системе делалось еще в самом начале XX в. Но эту модель было трудно совместить с законами электродинамики, и она была оставлена, уступив место модели Томсона. Однако в 1904 г. начались исследования, приведшие к утверждению планетарной модели. Вильям Брэгг (1862—1942) в Австралии, изучая прохождение а-частиц через вещество, нашел, что частицы не рассеиваются веществом, а поглощаются им, проходя в веществе до поглощения определенный прямолинейный отрезок — длину пробега.
Одна из тем, выдвинутая Резерфордом в Манчестере,— рассеяние ?-частиц. Она была поручена Гейгеру и Марсдену (1889-1970).
Метод, применявшийся этими исследователями, заключался в следующем: а-частицы, испускаемые источником, диафрагмировались щелью и попадали на экран из сернистого цинка, на котором получалось изображение щели в виде узкой полоски. Затем между щелью и экраном помещали тонкую металлическую пластинку, изображение щели размывалось, что указывало на рассеяние а-частиц веществом пластинки. Исследуя угол рассеяния, Гейгер установил, что наиболее вероятный угол рассеяния пропорционален атомному весу и обратно пропорционален кубу скорости частицы.
Рис. 45. Схема счётчика Гейгера
Но наиболее поразительным оказался факт, открытый Гейгером и Марсденом в 1909 г., — существование больших углов рассеяния. Некоторая, очень небольшая часть а-частиц (примерно 1/8000) рассеивается на угол, больший прямого, отбрасываясь, таким образом, обратно к источнику. Тонкая пластина отбрасывала частицы, летящие с большой скоростью. Как раз в том же, 1909 г. Резерфорд и Ройдс неопровержимо доказали, что а-частицы являются дважды ионизированными атомами гелия. Для таких тяжелых быстро движущихся частиц рассеивание на углы, большие прямого, казалось весьма невероятным. Резерфорд говорил, что это так же невероятно, как если бы пуля отскакивала от листа папиросной бумаги.
Одно из возможных объяснений аномального рассеяния состояло в том, что оно складывается из многих небольших углов отклонений, вызванных атомами рассеивающего вещества.
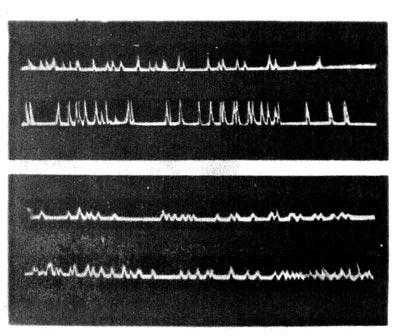
Рис. 64. Записи импульсов с первого счётчика Гейгера
Исходя из модели Томсона, Резерфорд подсчитал, что это не может давать больших отклонений даже при многих столкновениях с частицей. И здесь Резерфорд обратился к планетарной модели.

Рис. 65. Лаборатория Резерфорда в Кембридже
Когда а-частица проходит мимо заряженного ядра, то под воздействием кулоновской силы, пропорциональной заряду ядра и заряду а-частицы и обратно пропорциональной квадрату расстояния между ними, она движется по гиперболе, удаляясь по ее ветви после прохождения мимо ядра. Ее прямолинейный путь, таким образом, искривляется, и она отклоняется на угол рассеяния ф.
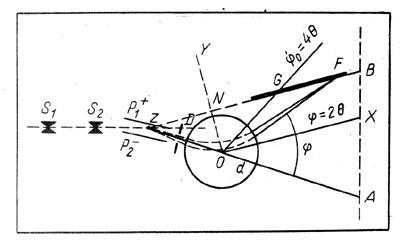
Рис. 48. Схема масс-спектрометра Астона
7 марта 1911 г. Резерфорд сделал в философском обществе в Манчестере доклад «Рассеяние а- и в-лучей и строение атома». В докладе он, в частности, говорил: «Рассеяние заряженных частиц может быть объяснено, если предположить такой атом, который состоит из центрального электрического заряда, сосредоточенного в точке и окруженного однородным сферическим распределением противоположного электричества равной величины. При таком устройстве атома а- и в-частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала».
Резерфорд рассчитал вероятность такого отклонения и показал, что она пропорциональна числу атомов n в единице рассеивающего материала, толщине рассеивающей пластинки и величине b2, выражаемой следующей формулой:
где Ne — заряд в центре атома, Е — заряд отклоняемой частицы, m — ее масса, u — ее скорость. Кроме того, эта вероятность зависит от угла рассеяния ? , так что число рассеянных частиц на единицу площади пропорционально (cosec)4 Ф/2
Этот «закон косеканса» был проверен экспериментально Гейгером и был найден справедливым в пределах экспериментальных ошибок.
Важным следствием теории Резерфорда было указание на заряд атомного центра, который Резерфорд положил равным ± Ne. Заряд оказался пропорциональным атомному весу. «Точное значение заряда центрального ядра не было определено, — писал Резерфорд, — но для атома золота оно приблизительно равно 100 единицам заряда».


В 1913 г. Гейгер и Марсден предприняли новую экспериментальную проверку формулы Резерфорда, подсчитывая рассеяние частиц по производимым ими сцинтилляционным вспышкам «Это была трудная, кропотливая работа, — характеризовал Резерфорд работу своих сотрудников, — так как нужно было считать много тысяч частиц. Результаты Гейгера и Марсдена весьма близко согласуются с теорией». Из этих утомительных и кропотливых исследований и возникло представление о ядре как устойчивой части атома, несущей в себе почти всю массу атома и обладающей положительным (Резерфорд еще в 1913 г. считал знак заряда неопределенным) зарядом. При этом число элементарных зарядов оказалось пропорциональным атомному весу.

Рис. 67. Здание каведишской лаборатории
Заряд ядра оказался важнейшей характеристикой атома. Бор вспоминал, что в 1912—1913 гг. «в центре интересов всей манчестерской группы было исследование многочисленных следствий открытия атомного ядра». Далее он писал: «С самого начала было ясно, что благодаря большой массе ядра и его малой протяженности в пространстве сравнительно с размерами всего атома строение электронной системы должно зависеть почти исключительно от полного электрического заряда ядра. Такие рассуждения сразу наводили на мысль о том, что вся совокупность физических и химических свойств каждого элемента может определяться одним целым числом…»
В 1913 г Ван ден Брук показал, что заряд ядра совпадает с номером элемента в таблице Менделеева. В том же 1913 г. ф. Содди и К. фаянс пришли к закону смещения Содди — фаянса, согласно которому при а-распаде радиоактивный продукт смещается в менделеевской таблице на два номера выше, а при (3-распаде — на номер ниже. С точки зрения представления о номере элемента как о заряде ядра этот закон получает простое истолкование. К этому же времени Содди пришел к представлению об изотопах как разновидностях одного и того же элемента, ядра атомов которых имеют одинаковый заряд, но разные массы.

Рис. 68. Установка Резерфорда по расщеплению ядра
Заметим, что эта интерпретация пришла в голову Бору еще до того, как Содди и фаянс открыли закон смещения чисто эмпирически. Эта же модель, все плодотворное значение которой было осознано Бором во время его пребывания в Манчестере, была положена им в основу первой квантовой модели атома. В богатом событиями 1913 г. были опубликованы три знаменитые статьи Бора «О строении атомов и молекул», открывшие путь к атомной квантовой механике.
Бор. Нильс Бор родился 7 октября 1885 г. в семье профессора физиологии Копенгагенского университета Христиана Бора. В 1903 г. Бор поступил в Копенгагенский университет. Еще в студенческие годы Бор выполнил конкурсную работу по поверхностному натяжению. Работа была удостоена золотой медали Датской Академии наук.

В 1909 г., спустя два года после окончания Бором университета, эта работа — «Определение коэффициента поверхностного натяжения воды методом колебания струи» — была опубликована в трудах Лондонского Королевского общества.
Весной 1911 г. состоялась защита докторской диссертации Бора на тему «Анализ электронной теории металла», в сентябре того же года Бор приехал на стажировку в Кембридж к Д. Д. Том-сону. Д. Д. Томсон в это время занимался анализом положительных лучей. Им был разработан метод точного анализа—метод парабол, с помощью которого он впервые обнаружил у неона существование двух разновидностей атомов: с атомным весом 20 и 22. Продолжая эти исследования уже после войны, ученик Томсона Астон открыл изотопы многих стабильных элементов. Исследования самого Томсона были обобщены им в монографии «Лучи положительного электричества и их применение к химическому анализу», вышедшей в 1913 г. Томсон поручил и Бору провести эксперимент с положительными лучами. Бор собрал вакуумную установку, однако дело дальше не пошло, и он начал готовить к изданию свою докторскую диссертацию. Томсон отнесся без внимания к работе Бора и не прочитал ее.
В том же, 1911 г., когда Бор приехал в Кембридж, сотрудник Томсона Чарлз Томас Рис Вильсон (1869-1959) изобрел замечательный прибор, известный ныне под названием «камера Вильсона». Этот прибор позволяет видеть заряженную частицу по оставляемому ею туманному следу. Резерфорд, приехавший на традиционный ежегодный обед в Кембридж, в своей речи с энтузиазмом отозвался о приборе Вильсона и полученных первых результатах. Бор, который впервые увидел Резерфорда на этом обеде, вспоминал, «что наибольшее восхищение у Резерфорда, как это он подчеркивал в своей речи, вызвала настойчивость, с которой Вильсон (в то время они уже были связаны тесной дружбой в Кавендишской лаборатории. — П. К.) продолжал свои исследования по образованию тумана со все более и более усовершенствованными аппаратами». Великий исследователь ядра ясно видел возможности, открываемые камерой Вильсона в изучении ядерных процессов. Позднее в том же Кембридже ученик и сотрудник Резер-форда Блэккет (1897—1974) получил вильсоновскую фотографию расщепления ядра азота а-частицей, первой ядерной реакции, открытой Резерфордом.
Встреча с Резерфордом произвела на Бора огромное впечатление. Вскоре по своим личным делам он побывал в Манчестере, и ему удалось встретиться и побеседовать с Резерфордом. «Во время беседы, в которой Резерфорд с подлинным энтузиазмом говорил о многих новых перспективах развития физики, он любезно согласился на мою просьбу о том, чтобы присоединиться к группе, работающей в его лаборатории, после того как ранней весной 1912 г. я должен был закончить свои занятия в Кембридже; там я был сильно увлечен оригинальными идеями Дж. Дж. Томсона, касающимися электронного строения атомов».
В апреле 1912 г. Бор приехал в Манчестер. История позаботилась о том, чтобы создатель квантовой модели атома поработал сперва с автором первой модели атома, а затем приехал к автору планетарной модели, чтобы на основе этой модели создать теорию атома Резерфорда — Бора. Знаменитая статья Бора, в которой были заключены основы этой теории, начиналась с указания на модели Резерфорда и Томсона и обсуждения их особенностей и различий. Бор послал свою статью Резерфорду. Резерфорд сразу понял революционный характер идей Бора и высказал критические замечания по самым фундаментальным пунктам теории Бора. Бор был вынужден поехать в Манчестер с переработанным вариантом статьи, чтобы договориться с Резерфордом. После длительных дискуссий статья Бора и две его последующие статьи были опубликованы. Однако окончательный ответ на возражения Резерфорда был дан только созданием квантовой механики, и Бор по существу всю жизнь разрабатывал теоретико-познавательные основы физики микромира, уточняя и развивая идеи, начало которым было положено его статьями 1913 г.
Сотрудничество Резерфорда и Бора обещало быть длительным и тесным. В мае 1914 г. Резерфорд прислал Бору предложение занять в Манчестере освободившееся место. Бор с радостью принял это предложение и послал заявление Резерфорду. Работа Бора в Манчестере началась в тяжелых условиях первой мировой войны. Резерфорд с рядом сотрудников был в Австралии и возвратился оттуда в разгар военных действий. Мозли был призван в армию и убит. Ему удалось сделать замечательное открытие в области рентгеновских спектров и установить связь между частотами линий характеристического излучения и порядковым номером элемента. В декабре 1913 г. была опубликована статья, в которой он писал: «Полученные результаты имеют большое значение для изучения структуры атома и полностью подтверждают точку зрения Резерфорда и Бора».
Генри Мозли родился 23 ноября 1887 г., умер 10 августа 1915 г. «Страшным потрясением для всех нас было трагическое известие о безвременной гибели Мозли в 1915 г. во время Галли-польской операции; его смерть вызвала скорбь у физиков всего мира», — писал Бор в своих воспоминаниях о Резерфорде. Сам Бор в 1916 г. покинул Манчестер и занял пост профессора теоретической физики в Копенгагенском университете.
Бор, несмотря на все трудности военного времени, продолжал разрабатывать свою теорию. В 1915 г. он опубликовал работы «О сериальном спектре водорода и строении атома» и «Спектр водорода и гелия», «О квантовой теории излучения в структуре атома». Он развил исследования, выполненные им в Манчестере в августе 1912 г., и опубликовал их под названием «Теория торможения заряженных частиц при их прохождении через вещество». Через три года, также в Манчестере, он закончил и опубликовал статью «О торможении быстро движущихся заряженных частиц при прохождении через вещество».

В декабре 1915 и январе 1916 г. Арнольд Зоммерфельд (1868—1951) развил теорию Бора, рассмотрев движение электрона по эллиптическим орбитам и обобщив правила квантования Бора. Зоммерфельд дал также теорию тонкой структуры спектральных линий, введя релятивистское изменение массы со скоростью. В его расчеты вошла безразмерная универсальная постоянная тонкой структуры:
Бор получил статью Зоммерфельда в Манчестере в марте 1916 г. и с восторгом отозвался о ней. Он писал, что «работа Зоммерфельда в значительной степени изменила современное понимание квантовой теории». Теория атома после открытия Зоммерфельда стала называться теорией Бора —Зоммерфельда.
По возвращении в Копенгаген Бор обнаружил пакет со статьей Эренфеста, содержащей теорию адиабатических инвариантов. Эта теория давала критерий квантующихся величин и до создания квантовой механики была единственной руководящей нитью при применении правил квантования, предвосхищавшей многие выводы, следующие из статьи Бора.

К 1916 г. теория Бора начала разрабатываться многими физиками. Была создана квантовая теория эффекта Зеемана и открытого в 1913 г. Штарком (1874-1957) эффекта влияния электрического поля на спектры. «Область нашей работы, — писал Бор Резерфорду, — после получения статьи Эренфеста превратилась из страны с довольно малочисленным населением в донельзя перенаселенное государство».
Продолжая развивать свои идеи, Бор сформулировал принцип соответствия (1918), означавший шаг вперед в ответе на вопросы, поставленные Ре-зерфордом. Чрезвычайно существенно, что благодаря Бору Копенгаген превратился в центр теоретической физики.
Рис.69. Камера Вильсона
К Бору примкнул молодой физик, ставший его ассистентом, Гендрик Антон Крамере (1894-1952). Бор создал институт теоретической физики, в организации которого ему деятельную поддержку оказывал Резерфорд. Осенью 1920 г., когда сооружение здания института подходило к концу, в Копенгаген приехал Резерфорд, которому Копенгагенский университет присвоил почетную степень. Поддержка Резерфорда имела для Бора огромное значение, и он вспоминал об этом в своей статье «Памяти Резерфорда». В институте Бора работал радиомеханик Георг Хевеши (1885-1966), который в 1922 г., руководствуясь идеями Бора, открыл вместе с Костером (1889—1950) новый элемент — гафний. В 1922 г. к группе теоретиков института примкнули Паули и Гейзенберг, будущие создатели квантовой механики.
В 1922 г. Бор получил Нобелевскую премию по физике. В прочитанном им 11 декабря 1922 г. в Стокгольме нобелевском докладе он развернул картину состояния атомной теории к этому времени. Одним из наиболее существенных успехов теории было нахождение ключа к периодической системе элементов, которая объяснялась наличием электронных оболочек, окружающих ядра атомов. Огромная физическая интуиция позволила Бору, еще не зная принципа Паули и спина электрона, наметить правильную картину построения периодической системы, исправить ошибку химиков в классификации редких земель и предсказать существование нового элемента, который и был открыт Костером и Хевеши, давшими ему название гафний.
В 1925 г. работой Гейзенберга началось создание квантовой механики. В том же году Уленбек и Гаудсмит, работавшие у Эренфеста, открыли спин электрона, а Паули открыл принцип, носящий ныне его имя. С тех пор мысли Бора сосредоточились на проблемах квантовой механики, которые он горячо обсуждал со своими молодыми коллегами. После открытия Гейзенбергом в 1927 г. принципа неопределенности Бор выдвинул в качестве основной теоретической идеи квантовой теории принцип дополнительности.
В сентябре 1927 г. в связи со столетием со дня смерти Вольта на его родине, в Италии, на берегу озера Комо состоялся Международный конгресс физиков. На этом конгрессе Бор выступил с докладом «Квантовый постулат и новейшее развитие атомной теории», которым было положено начало так называемой «копенгагенской» интерпретации квантовой теории.
В октябре состоялся Сольвеевский конгресс в Брюсселе по теме «Электроны и фотоны». На конгрессе вспыхнула дискуссия между Бором и Эйнштейном по вопросу о копенгагенской интерпретации, которую Эйнштейн оспаривал. Дискуссия продолжалась с новой силой на Сольвеевском конгрессе 1930 г. В этих дискуссиях участвовал и Эренфест. Затем в 1935 г. дискуссия продолжалась в печати. Эйнштейн до самой смерти оставался противником копенгагенской точки зрения, а Бор до самой смерти продолжал развивать и уточнять свою концепцию.
В 1936 г. Бор выступил со статьей «Захват нейтрона и строение ядра», в которой предложил капельную модель ядра и механизм захвата нейтрона ядром. Ядерной физике была посвящена также работа 1937 г. «О превращении атомных ядер, вызванных столкновением с материальными частицами». Странно, ни Бор, ни кто другой не мог предсказать деления ядра, подсказываемого капельной моделью. Интерпретация опытов ферми 1934 г. затянулась, и лишь после опытов Гана и Штрассмана в конце 1938 — начале 1939 г. было открыто деление урана. Бор немедленно реагировал на это открытие и посвятил ему ряд работ, в том числе и совместную работу с Дж. А. Уил-лером «Механизм деления ядер».
В 1939 г. началась вторая мировая война, а в 1940 г. Дания была оккупирована гитлеровцами. К этому времени уже началась работа по осуществлению цепной реакции деления. В 1942 г. в США под руководством ферми был построен первый реактор. Широким фронтом развернулась работа по изготовлению атомной бомбы. Пребывание Бора в оккупированной гитлеровцами Дании становилось опасным. Осенью 1943 г. Бор выехал в Швецию, а 6 октября 1943 г. его на самолете вывезли в Англию. Затем Бор уехал в США, где принял участие в работе над проектом атомной бомбы в Лос-Анджелесе, где он жил под именем Николаса Бейкера.

По окончании войны в августе 1945 г. Бор вернулся в Данию. Мир уже знал об атомной бомбе, разрушившей Хиросиму и Нагасаки. С этого момента и до конца жизни проблема предотвращения атомной войны волновала Бора. Он принял участие в работе Первой Женевской конференции по мирному использованию атомной энергии. В 1957 г. ему была присвоена первая премия «Атом для мира».
В 1961 г. Бор приехал в Советский Союз. Он посетил Объединенный институт ядерных исследований в Дубне, физический институт Академии наук в Москве, Московский и Тбилисский университеты. Это была его последняя в.стреча с советскими учеными. 18 ноября 1962 г. он неожиданно скончался.
Эренфест. Говоря о Боре, мы упомянули имя Эренфеста. Его имя в истории физики XX в. встречается часто. Он был связан и с Бором, и с Эйнштейном, и с Лоренцем, и многими другими физиками. Он был связан и с русскими физиками и в последние годы жизни собирался перейти в один из советских университетов.
Пауль Эренфест, которого в России называли Павлом Сигизмундовичем, родился в Вене 18 января 1880 г. В 1899-1901 гг. и в 1903-1904 гг. он учился в Венском университете, где слушал лекции Больцмана, и в 1901—1903 гг. —в Геттингенском университете.
Вернувшись в 1903 г. из Геттингена в Вену, Эренфест стал активным участником семинара, которым руководил Больцман. На семинаре родилась и тема докторской диссертации Эренфеста «Движение твердых тел в жидкостях и механика Герца». Больцман, бывший его оппонентом, с большой похвалой отозвался о диссертации, которую Эренфест защитил в июне 1904 г. В том же году Эренфест вступил в брак с Т. А. Афанасьевой (1876-1964). Прожив в Вене и Геттингене до лета 1907 г., Эренфесты отправились в Россию. В России они прожили пять лет. В Петербурге Эренфест организовал на своей квартире семинар, в котором принимали участие молодые физики Петербурга Д. С. Рождественский, К. К. Баумгарт, Л. Д. Исаков и студенты-физики Ю. А. Крутков, В. Р. Бурсиан, В. Г. Хлопин, В. М. Чулановский и другие. Это были будущие советские ученые—академики и профессора. Семинар Эренфеста стал точкой роста будущей советской теоретической физики. Сам Эренфест готовился к магистерским экзаменам, которые держал в 1909—1910 гг., читал курс по проблемам математической физики в политехническом институте, писал статьи по вопросам теоретической физики. Среди этих работ поистине классической стала совместная статья П. С. Эренфеста и Т. А. Афанасьевой-Эренфест «Принципиальные основы статистического понимания в механике», опубликованная в Математической энциклопедии в 1912 г. Весьма интересной была его совместная заметка с Л. Д. Исаковым «О так называемой «групповой скорости», в которой Эренфест исправил ошибку Рэлея и показал, что методом аберрации измеряется не фазовая, а групповая скорость.
Однако получить прочное место в Петербурге Эренфесту не удалось. Как ни ценили его петербургские физики, как ни старались они помочь ему устроиться на кафедру какого-либо из петербургских институтов, министерство просвещения было непреклонно, и места в Петербурге Эренфесту получить не удалось. Начались поиски места в Вене, в Праге, во Львове. Поиски были безрезультатными. И здесь совершенно неожиданно судьба Эренфеста круто повернулась. В апреле 1912 г. Эренфест разослал оттиски статьи, напечатанной в Математической энциклопедии, различным ученым, в том числе и Лоренцу. 20 апреля 1912 г. Лоренц прислал Эренфесту письмо, в котором дал высокую оценку статье и задал Эренфесту вопрос о том, где он сейчас работает и как складывается его судьба.
Эренфеста несколько удивила озабоченность Лоренца его судьбой, но в следующем письме Лоренц разъяснил смысл своих вопросов. Он собирался оставить ординарную профессуру по кафедре теоретической физики Лейденского университета и подыскивал себе преемника. «Я подумал также и о Вас», —писал Лоренц. В результате Эренфест принял предложение Лоренца, и состоялось избрание Эренфеста профессором кафедры теоретической физики Лейденского университета. Профессором в Лейдене Эренфест пробыл двадцать один год, до трагической гибели 25 сентября 1933 г.
Эренфест был искренним другом Советского Союза. Он был другом многих советских физиков: А. ф. Иоффе, Д. С. Рождественского, Ю. А. Круткова и других, часто приезжал в Советский Союз. 6 декабря 1924 г. Эренфест по представлению А. ф. Иоффе и П. П. Лазарева был избран членом-корреспондентом Академии наук СССР вместе с Бором, Ланжевеном, Майкельсоном,
Милликеном, Лауэ, Дебаем, Борном. В представлении Лазарев и Иоффе, перечисляя заслуги Эренфеста, писали: «В частности, П. С. Эренфест сыграл весьма крупную роль и в России. Его следует считать основателем школы теоретической физики, к которой принадлежали Г. Г. Вейхардт, В. Р. Бурсиан, Ю. А. Крутков».
Поделитесь на страничкеСледующая глава >
fis.wikireading.ru
Открытие атомного ядра
с. 1Введение
Предположение о том, что все тела состоят из мельчайших частиц, было высказано древнегреческими философами Левкиппом и Демокритом примерно 2500 лет назад. Частицы эти были названы атомами, что означает неделимые. Этим названием хотели подчеркнуть, что атом – это мельчайшая, простейшая, не имеющая составных частей и поэтому неделимая частица.
Но примерно с сер. XIX в. Стали появляться экспериментальные факты, которые ставили под сомнение предствления о неделимости атомов. Результаты этих экспериментов наводили на мысль о том, что атомы имеют сложную структуру и что в их состав входят электрически заряженные частицы.
Наиболее ярким свидетельством сложного строения атома явилось открытие явления радиоактивности Анри Беккерелем в 1896г. Он обнаружил, что химический элемент уран самопроизвольно излучает раннее неизвестные невидимые лучи, которые позже были названы радиоактивным излучением. В ходе изучения явления радиоактивности учёные выяснили, что и некоторые другие элементы (например, радий) тоже самопроизвольно испускают радиоактивные лучи.
В 1899 г. В результате опыта Эрнестом Резерфордом были обнаружены альфа-, бета- и гамма-частицы, составляющие радиоактивные лучи. В 1913 г. Резерфорд выдвинул гипотезу о том, что одной из частиц, входящих в состав атомных ядер всех химических элементов, является ядро атома водорода. Так был открыт протон.
В 1932 г Джеймс Чедвик (ученик Резерфорда) открыл нейтрон, что дало мощный толчок к понимаю того, как устроены ядра атомов.
Открытие атомного ядра
Уподобление атома планетной системе делалось еще в начале XX века. Но эту модель было трудно совместить с моделями электродинамики, и она была оставлена, уступив место модели Томсона. Однако в 1904 году начались исследования, приведшие к утверждению планетарной модели.
При изучении a-частиц Резерфорд, исходя из модели Томсона, подсчитал, что рассеивание a-частиц не может давать больших углов отклонений даже при многих столкновениях с частицей. И здесь Резерфорд обратился к планетарной модели.
7 марта 1911 года Резерфорд сделал в философском обществе в Манчестере доклад “Рассеяние a и b-лучей и строение атома”. В докладе он, в частности, говорил: “Рассеяние заряженных частиц может быть объяснено, если предположить такой атом, который состоит из центрального электрического заряда, сосредоточенного в точке и окруженного однородным сферическим распределением противоположного электричества равной величины. При таком устройстве a и b-частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала”.
Важным следствием теории Резерфорда было указание на заряд атомного центра, который Резерфорд положил равным ±Ne. Заряд оказался пропорциональным атомному весу. “Точное значение заряда центрального ядра не было определено,- писал Резерфорд, — но для атома золота оно приблизительно равно 100 единицам заряда”.
Из последующих исследований и экспериментов Гейгера и Мардсена, предпринявших проверку формул Резерфорда, возникло представление о ядре как устойчивой части атома, несущей в себе почти всю массу атома и обладающей положительным (Резерфорд считал знак заряда неопределенным) зарядом. При этом число элементарных зарядов оказалось пропорциональным атомному весу.
Заряд ядра оказался важнейшей характеристикой атома. В 1913 году было показано, что заряд ядра совпадает с номером элемента в таблице Менделеева. После знакомства с Резерфордом Бор, отказавшись от изучения электронной модели, начал работу в его группе. Обратившись к планетарной модели, Бор создал на ее основе теорию атома Резерфорда-Бора. Во время Первой Мировой войны Бор продолжает работать в лаборатории Резерфорда. В 1915 году он опубликовал работы “О сериальном спектре водорода” и “О квантовой теории излучения в структуре атома”. В 1916 году была опубликована статья Зоммерфельда, где он рассмотрел движение электрона по эллиптическим орбитам и обобщил правила квантования Бора. Бор с восторгом отозвался об этой статье. Теория атома после открытий Зоммерфельда стала называться теорией Бора — Зоммерфельда.
В 1936 году Бор выступил со статьей “Захват нейтрона и строение ядра”, в которой предложил капельную модель ядра и механизм захвата нейтрона ядром. Ни Бор, ни другие не могли сразу предсказать деление ядра, подсказываемое капельной моделью, пока в начале 1939 г. не было открыто деление урана.
Атом Бора
Бор, как и Томсон до него, ищет такое расположение электронов в атоме, которое объяснило бы его физические и химические свойства. Бор берет за основу модель Резерфорда. Ему также известно, что заряд ядра и число электронов в нем, равное числу единиц заряда, определяется местом элемента в периодической системе элементов Менделеева. Таким образом, это важный шаг в понимании физико-химических свойств элемента. Но остаются непонятными две вещи: необычайная устойчивость атомов, несовместимая с представлением о движении электронов по замкнутым орбитам, и происхождение их спектров, состоящих из вполне определенных линий. Такая определенность спектра, его ярко выраженная химическая индивидуальность, очевидно, как-то связана со структурой атома. Все это трудно увязать с универсальностью электрона, заряд и масса которого не зависят от природы атома, в состав которого они входят. Устойчивость атома в целом противоречит законам электродинамики, согласно которым электроны, совершая периодические движения, должны непрерывно излучать энергию и, теряя ее, “падать” на ядро. К тому же и характер движения электрона, объясняемый законами электродинамики, не может приводить к таким характерным линейчатым спектрам, которые наблюдаются на самом деле. Линии спектра группируются в серии, они сгущаются в коротковолновом “хвосте” серии, частоты линий соответствующих серий подчинены странным арифметическим законам. Бору удалось найти объяснение этого основного закона спектроскопии. Он вводит в физику атома представления о стационарных состояниях атомов, находясь в которых электрон не излучает, хотя и совершает периодическое движение по круговой орбите.
Расщепление ядра
В 1919 году Резерфордом было сделано новое сенсационное открытие — расщепление ядра.
Резерфорд изучал столкновение a-частиц с легкими атомами. Столкновения a-частицы с ядрами таких атомов должны их ускорять. Так, при ударе a-частицы о ядро водорода оно увеличивает свою скорость в 1,6 раза, и ядро отбирает у a-частицы 64% ее энергии.
С помощью многочисленных опытов Резерфорд показал, что в результате таких столкновений получаются частицы с максимальным пробегом, таким же, как у Н-атомов. Так было открыто явление расщепления ядер азота при ударах быстрых a-частиц и впервые высказана мысль, что ядра водорода представляют собой составную часть ядер атомов. Впоследствии Резерфорд предложил термин “протон” для этой составной части ядра. Резерфорд заканчивал свою статью словами: “Результаты в целом указывают на то, что если a-частицы или подобные им быстро движущиеся частицы со значительно большей энергией могли бы применяться для опытов, то можно было бы обнаружить разрушение ядерных структур многих легких атомов”.
В 1920 году Резерфорд в лекции “Нуклеарное строение атома” делает предположение о том, что существуют ядра с массой 3 и 2 и ядра с массой ядра водорода, но с нулевым зарядом. При этом он исходил из гипотезы, высказанной впервые М. Склодовской-Кюри, что в состав ядра входят электроны.
Резерфорд пишет, что ему “кажется весьма правдоподобным, что один электрон может связать два Н-ядра и, возможно, даже и одно Н-ядро. Если справедливо первое предположение, то оно указывает на возможность существования атома с массой около 2 и с одним зарядом. Такое вещество нужно рассматривать как изотоп водорода. Второе предположение заключает в себе мысль о возможности существования атома с массой 1 и нуклеарным зарядом, равным нулю. Подобные образования представляются вполне возможными”. Так была высказана гипотеза о существовании нейтрона и тяжелого изотопа водорода.
Протонно-нейтронная модель ядра
В 1932 году Д.Д. Иваненко опубликовал заметку, в которой высказал предположение, что нейтрон является наряду с протоном структурным элементом ядра. Однако протонно-нейтронная модель ядра была встречена большинством физиков скептически. Даже Резерфорд полагал, что нейтрон — это лишь сложное образование протона и электрона.
В 1933 году Иваненко на конференции в Ленинграде сделал доклад о модели ядра, в котором он защищал протонно-нейтронную модель, сформулировав основной тезис: в ядре имеются только тяжелые частицы. Иваненко отверг идеи о сложной структуре нейтрона и протона. По его мнению, обе частицы должны обладать одинаковой степенью элементарности, т.е. и нейтрон, и протон могут переходить друг в друга. В дальнейшем протон и нейтрон стали рассматриваться как два состояния одной частицы — нуклона, и идея Иваненко стала общепринятой, а в 1932 году в составе космических лучей была открыта еще одна элементарная частица — позитрон.
Искусственная радиоактивность
В 1934 году Фредерик Жолио и Ирен Кюри сообщили об открытии ими нового вида радиоактивности. Им удалось доказать методом камеры Вильсона, что некоторые легкие элементы (бериллий, бор, алюминий) испускают положительные электроны при бомбардировке их a-частицами полония. Жолио и Кюри, исследуя это явление, показали, что в этом случае возникает новый этап радиоактивности, сопровождаемый испусканием положительных электронов. Они впервые искусственно вызвали радиоактивность, создав новые радиоактивные изотопы, не наблюдаемые до этого в природе.
Строение и важнейшие свойства атомных ядер
Основные свойства и строение ядра
1. Ядром называется центральная часть атома, в которой сосредоточена практически вся масса атома и его положительный электрический заряд. Все атомные ядра состоят из элементарных частиц: протонов и нейтронов, которые считаются двумя зарядовыми состояниями одной частицы — нуклона. Протон имеет положительный электрический заряд, равный по абсолютной величине заряду электрона. Нейтрон не имеет электрического заряда.
2. Зарядом ядра называется величина Ze, где е — величина заряда протона, Z — порядковый номер химического элемента в периодической системе Менделеева, равный числу протонов в ядре. В настоящее время известны ядра с Z от Z=1 до Z=107. Для всех ядер, кроме и некоторых других нейтронодефицитных ядер NіZ, где N — число нейтронов в ядре. Для легких ядер N/Z”1; для ядер химических элементов, расположенных в конце периодической системы, N/Z”1,6.
3. Число нуклонов в ядре A=N+Z называется массовым числом. Нуклонам (протону и нейтрону) приписывается массовое число, равное единице, электрону — нулевое значение А.
Ядра с одинаковыми Z, но различными А называются изотопами. Ядра, которые при одинаковом А имеют различные Z, называются изобарами. Ядро химического элемента X обозначается , где Х — символ химического элемента.
Всего известно около 300 устойчивых изотопов химических элементов и более 2000 естественных и искусственно полученных радиоактивных изотопов.
4. Размер ядра характеризуется радиусом ядра, имеющим условный смысл ввиду размытости границы ядра. Эмпирическая формула для радиуса ядра м, может быть истолкована как пропорциональность объема ядра числу нуклонов в нем.
Плотность ядерного вещества составляет по порядку величины 1017 кг/м3 и постоянна для всех ядер. Она значительно превосходит плотности самых плотных обычных веществ.
5. Ядерные частицы имеют собственные магнитные моменты, которыми определяется магнитный момент ядра Рmяд в целом. Единицей измерения магнитных моментов ядер служит ядерный магнетон mяд:
(в СИ)
(в СГС).
Здесь е — абсолютная величина заряда электрона, mp — масса протона, с — электродинамическая постоянная. Ядерный магнетон в раз меньше магнетона Бора, откуда следует, что магнитные свойства атомов определяются магнитными свойствами его электронов.
6. Распределение электрического заряда протонов по ядру в общем случае несимметрично. Мерой отклонения этого распределения от сферически симметричного является квадрупольный электрический момент ядра Q. Если плотность заряда считается везде одинаковой, то Q определяется только формой ядра.
Энергия связи ядер. Дефект массы
1. Нуклоны в ядрах находятся в состояниях, существенно отличающихся от их свободных состояний. За исключением ядра обычного водорода во всех ядрах имеется не менее двух нуклонов, между которыми существует особое ядерное сильное взаимодействие — притяжение — обеспечивающее устойчивость ядер, несмотря на отталкивание одноименно заряженных протонов.
2. Энергией связи нуклона в ядре называется физическая величина, равная той работе, которую нужно совершить для удаления нуклона из ядра без сообщения ему кинетической энергии.
Энергия связи ядра определяется величиной той работы, которую нужно совершить, чтобы расщепить ядро на составляющие его нуклоны без придания им кинетической энергии. Из закона сохранения энергии следует, что при образовании ядра должна выделяться такая же энергия, какую нужно затратить при расщеплении ядра на составляющие его нуклоны. Энергия связи ядра является разностью между энергией всех свободных нуклонов, составляющих ядро, и их энергией в ядре.
3. При образовании ядра происходит уменьшение его массы: масса ядра меньше, чем сумма масс составляющих его нуклонов. Уменьшение массы ядра при его образовании объясняется выделением энергии связи. Если Wсв — величина энергии, выделяющейся при образовании ядра, то соответствующая ей масса Dm, равная
называется дефектом массы и характеризует уменьшение суммарной массы при образовании ядра из составляющих его нуклонов. Если ядро с массой Mяд образовано из Z протонов с массой mp и из (A-Z) нейтронов с массой mn, то
Dm=Zmp+(A-Z)mn—Mяд.
Вместо массы ядра Мяд величину Dm можно выразить через атомную массу Мат:
Dm=ZmН+(A-Z)mn—Mат,
где mH — масса водородного атома.
При практическом вычислении Dm массы всех частиц и атомов выражаются в атомных единицах массы.
Дефект массы служит мерой энергии связи ядра:
Wсв=Dmс2=[Zmp+(A-Z)mn-Mяд]с2
Одной атомной единице массы соответствует атомная единица энергии (а.е.э.): а.е.э.=931,5016 МэВ.
4. Удельной энергией связи ядра wсв называется энергия связи, приходящаяся на один нуклон: wсв=. Величина wсв составляет в среднем 8 МэВ/нуклон. По мере увеличения числа нуклонов в ядре удельная энергия связи убывает.
5. Критерием устойчивости атомных ядер является соотношение между числом протонов и нейтронов в устойчивом ядре для данных изобаров. (А=const).
Ядерные силы
1. Ядерное взаимодействие свидетельствует о том, что в ядрах существуют особые ядерные силы, не сводящиеся ни к одному из типов сил, известных в классической физике (гравитационных и электромагнитных).
2. Ядерные силы являются короткодействующими силами. Они проявляются лишь на весьма малых расстояниях между нуклонами в ядре порядка 10-15 м. Длина (1,5ј2,2)10-15 м называется радиусом действия ядерных сил.
3. Ядерные силы обнаруживают зарядовую независимость: притяжение между двумя нуклонами одинаково независимо от зарядового состояния нуклонов — протонного или нуклонного. Зарядовая независимость ядерных сил видна из сравнения энергий связи в зеркальных ядрах. Так называются ядра, в которых одинаково общее число нуклонов, но число протонов в одном равно числу нейтронов в другом. Например, ядра гелия тяжелого водорода трития — .
4. Ядерные силы обладают свойством насыщения, которое проявляется в том, что нуклон в ядре взаимодействует лишь с ограниченным числом ближайших к нему соседних нуклонов. Именно поэтому наблюдается линейная зависимость энергий связи ядер от их массовых чисел А. Практически полное насыщение ядерных сил достигается у a-частицы, которая является очень устойчивым образованием.
Радиоактивность, g-излучение, a и b-распад
1. Радиоактивностью называется превращение неустойчивых изотопов одного химического элемента в изотопы другого элемента, сопровождающееся испусканием некоторых частиц.
Естественной радиоактивностью называется радиоактивность, наблюдающаяся у существующих в природе неустойчивых изотопов.
Искусственной радиоактивностью называется радиоактивность изотопов, полученных в результате ядерных реакций.
2. Обычно все типы радиоактивности сопровождаются испусканием гамма-излучения — жесткого, коротковолнового электроволнового излучения. Гамма-излучение является основной формой уменьшения энергии возбужденных продуктов радиоактивных превращений. Ядро, испытывающее радиоактивный распад, называется материнским; возникающее дочернее ядро, как правило, оказывается возбужденным, и его переход в основное состояние сопровождается испусканием g-фотона.
3. Альфа-распадом называется испускание ядрами некоторых химических элементов a-частиц. Альфа-распад является свойством тяжелых ядер с массовыми числами А>200 и зарядами ядер Ze>82. Внутри таких ядер происходит образование обособленных a-частиц, состоящих каждая из двух протонов и двух нейтронов.
4. Термином бета-распад обозначают три типа ядерных превращений: электронный (b—) и позитронный (b+) распады, а также электронный захват. Первые два типа превращения состоят в том, что ядро испускает электрон (позитрон) и электронное антинейтрино (электронное нейтрино). Эти процессы происходят путем превращения одного вида нуклона в ядре в другой: нейтрона в протон или протона в нейтрон. В случае электронного захвата превращение заключается в том, что исчезает один из электронов в ближайшем к ядру слое. Протон, превращаясь в нейтрон, как бы “захватывает” электрон; отсюда произошел термин ”электронный захват”. Электронный захват в отличие от b± -захвата сопровождается характеристическим рентгеновским излучением.
5. b—-распад происходит у естественно-радиоактивных, а также искусственно-радиоактивных ядер; b+-распад характерен только для явления искусственной радиоактивности.
Деление ядер урана
Деление ядер урана при бомбардировке их нейтронами было открыто в 1939 г. Отто Ганном и Фрицем Штрассманом.
Поглотив лишний нейтрон, ядро U235 возбуждается и деформируется, приобретая вытянутую форму. Так как в ядре действуют два вида сил: электростатические силы отталкивания между протонами, стремящиеся разорвать ядро, и ядерные силы притяжения между всеми нуклонами, Но ядерные силы — короткодействующие, поэтому в вытянутом ядре они уже не могут удержать сильно удаленные друг от друга части ядра. Под действием электростатических сил отталкивания ядро разрывается на две части которые разлетаются в разные стороны с огромной скоростью и излучают при этом 2—3 нейтрона. часть внутренней энергии ядра переходит в кинетическую энергию разлетающихся осколков и частиц. Осколки быстро тормозятся в окружающей среде, в результате чего их кинетическая энергия преобразуется во внутреннюю энергию среды. При одновременном делении большого количества ядер урана внутренняя энергия окружающей уран среды и соответственно ее температура заметно возрастают Таким образом, реакция деления ядер урана идет с выделением энергии в окружающую среду.
Энергия, заключенная в ядрах атомов, колоссальна. Например, при полном делении всех ядер, имеющихся в 1 г урана, выделилось бы столько же энергии, сколько выделяется при сгорании 2,5 т нефти.
Цепная реакция
Для преобразования внутренней энергии атомных ядер в электрическую на атомных электростанциях используют так называемые цепные реакции деления ядер.
Ядро атома урана, которое в результате захвата нейтрона разделилось на две части, излучив при этом три нейтрона. Два из этих нейтронов вызвали реакцию деления еще двух ядер, при этом образовалось уже четыре нейтрона. Эти, в свою очередь, вызвали деление четырех ядер, после чего образовалось девять нейтронов и т. д.
Цепная реакция возможна благодаря тому, что при делении каждого ядра образуется 2—3 нейтрона, которые могут принять участие в делении других ядер.
На рисунке показана схема цепной реакции, при которой общее число свободных нейтронов в куске урана лавинообразно увеличивается со временем. Соответственно резко возрастает число делений ядер и энергия, выделяющаяся в единицу времени. Поэтому такая реакция носит взрывной характер (она протекает в атомной бомбе). Возможен другой вариант, при котором число свободных нейтронов уменьшается со временем. В этом случае цепная реакция прекращается. Следовательно, такую реакцию тоже нельзя использовать для производства электроэнергии.
В мирных целях возможно использовать энергию только такой цепной реакции, в которой число нейтронов не меняется с течением времени. С этим связаны факторы, влияющие на увеличение и на уменьшение общего числа свободных нейтронов в куске урана, в котором протекает цепная реакция.
Одним из таких факторов является масса урана. Не каждый нейтрон, излученный при делении ядра, вызывает деление других ядер. Если масса (и соответственно размеры) куска урана слишком мала, то многие нейтроны вылетят за его пределы, не успев встретить на своем пути ядро, вызвать его деление и породить таким образом новое поколение нейтронов, необходимых для продолжения реакции. В этом случае цепная реакция прекратится. Чтобы реакция не прекращалась, нужно увеличить массу урана до определенного значения, называемого критическим. Чем больше масса куска, тем больше его размеры и тем длиннее путь, который проходят в нем нейтроны. При этом вероятность встречи нейтронов с ядрами возрастает. Соответственно увеличивается число делений ядер и число излучаемых нейтронов. Если масса урана больше критической, то в результате резкого увеличения числа свободных нейтронов цепная реакция приводит к взрыву, а если меньше критической, то реакция не протекает из-за недостатка свободных нейтронов.
Уменьшить потерю нейтронов (которые вылетают из урана, не прореагировав с ядрами) можно не только за счет увеличения массы урана, но и с помощью специальной отражающей оболочки. Для этого кусок урана помещают в оболочку, сделанную из вещества, хорошо отражающего нейтроны (например, из бериллия). Отражаясь от этой оболочки, нейтроны возвращаются в уран и могут принять участие в делении ядер.
Помимо массы и наличия отражающей оболочки существует еще несколько факторов, от которых зависит возможность протекания цепной реакции. Например, если кусок урана содержит слишком много примесей других химических элементов, то они поглощают большую часть нейтронов и реакция прекращается.
Еще одним фактором, влияющим на ход реакции, является наличие в уране так называемого замедлителя нейтронов. Дело в том, что ядра урана-235 с наибольшей вероятностью делятся под действием медленных нейтронов. А при делении ядер образуются быстрые нейтроны. Если быстрые нейтроны замедлить, то большая их часть захватится ядрами урана-235 с последующим делением этих ядер. В качестве замедлителей используются такие вещества, как графит, вода, тяжелая вода (в состав которой входит дейтерий — изотоп. водорода с массовым числом 2) и некоторые другие. Эти вещества только замедляют нейтроны, почти не поглощая их.
Таким образом, возможность протекания цепной реакции определяется массой урана, количеством примесей в нем, наличием оболочки и замедлителя и некоторыми другими факторами.
Критическая масса шарообразного куска урана-235 приблизительно равна 50 кг. При этом его радиус составляет всего 9 см, поскольку уран имеет очень большую плотность.
Применяя замедлитель и отражающую оболочку и уменьшая количество примесей, удается снизить критическую массу урана до 0,8 кг.
Заключение
Изучение строения атомного ядра, открытие изотопов, деления ядер урана, явления ядерных сил и цепной реакции произвело огромный переворот в науке и в жизни человечества. В XX в. Было создано ядерное оружие и открыты атомные электростанции. Существует мнение, что для всех было бы лучше, если бы явления радиоактивности и деления ядер не открыли никогда. Тогда бы не существовало бы такой страшной угрозы для Земли и человечества, как ядерное оружие, лучевая болезнь, атомный взрыв. Но с другой стороны, изучение строение атомного ядра позволило отчасти решить одну из важнейших проблем – проблему источников энергии. Потребление энергии растёт столь быстро, что известные в настоящее время запасы топлива окажутся исчерпанными в сравнительно короткое время. Например, надежно подтверждаемых запасов угля может хватить примерно на 350 лет, нефти — на 40 лет, природного газа — на 60 лет. В настоящее время реальный вклад в энергоснабжение вносит ядерная энергетика. До 1940 г. многие ученые считали, что ядерная физика представляет чисто научный интерес, не имея при этом никакого практического применения. Так, в 1937 г. Резерфорд утверждал, что получение ядерной энергии в более или менее значительных количествах, достаточных для практического использования, никогда не будет возможным.
Однако уже в 1942 г. в США под руководством Энрико Ферми был построен первый ядерный реактор. Первый европейский реактор был создан в 1946 г. в Советском Союзе под руководством Игоря Васильевича Курчатова.
В 1954 г. в нашей стране (в г. Обнинске) была введена в действие первая в мире АЭС. Ее мощность была невелика — всего 5000 кВт. Современные АЭС имеют в сотни раз большую мощность.
АЭС имеют ряд преимуществ перед другими видами электростанций. Основное их преимущество заключается в том, что для работы АЭС требуется очень небольшое количество топлива. Правда, строительство тепловых станций (ТЭС) обходится дешев-1 ле, чем атомных. Поэтому на сегодняшний день стоимость тепловым и атомных станций сопоставима. Но в перспективе атомная энерге-1 тика станет более выгодной.
Второе преимущество АЭС (при правильной их эксплуатации) заключается в их экологической чистоте по сравнению с ТЭС. Конечно, в выбросах АЭС содержатся радиоактивные газы и частицы, Но большая часть радиоактивных ядер (так называемых радионук-1 лидов), содержащихся в выбросах АЭС, довольно быстро распадается, превращаясь в нерадиоактивные. А количество долгоживущих радионуклидов и мощность их излучения сравнительно невелики Поэтому для населения, проживающего в районах размещения АЭС дополнительная радиационная нагрузка не превышает нескольких десятых процента от естественного радиационного фона.
Список использованной литературы:
-
Карпенков С. Х. Концепции современного естествознания М.:ЮНИТИ, 1997 -
Пёрышкин А.В., Гутник Е.М. Физика. Учебник. М.: Дрофа, 2001 -
Яворский Б. М., Детлаф А.А. Справочник по физике. М.:Наука, 1990 -
Ресурсы Интернет
с. 1
kz3.fatwords.org
Открытие атомного ядра
Уподобление атома планетной системе делалось еще в
начале XX века. Но эту модель было трудно совместить с моделями
электродинамики, и она была оставлена, уступив место модели Томсона.
Однако в 1904 году начались исследования, приведшие к утверждению
планетарной модели.
При изучении a-частиц Резерфорд, исходя из модели
Томсона, подсчитал, что рассеивание a-частиц не может давать больших
углов отклонений даже при многих столкновениях с частицей. И здесь
Резерфорд обратился к планетарной модели.
7 марта 1911 года Резерфорд сделал в философском
обществе в Манчестере доклад «Рассеяние a и b-лучей и строение атома».
В докладе он, в частности, говорил: «Рассеяние заряженных частиц может
быть объяснено, если предположить такой атом, который состоит из
центрального электрического заряда, сосредоточенного в точке и
окруженного однородным сферическим распределением противоположного
электричества равной величины. При таком устройстве a и b-частицы,
когда они проходят на близком расстоянии от центра атома, испытывают
большие отклонения, хотя вероятность такого отклонения мала».
Важным следствием теории Резерфорда было указание на
заряд атомного центра, который Резерфорд положил равным ±Ne. Заряд
оказался пропорциональным атомному весу. «Точное значение заряда
центрального ядра не было определено,- писал Резерфорд, — но для атома
золота оно приблизительно равно 100 единицам заряда». Из последующих
исследований и экспериментов Гейгера и Мардсена, предпринявших проверку
формул Резерфорда, возникло представление о ядре как устойчивой части
атома, несущей в себе почти всю массу атома и обладающей положительным
(Резерфорд считал знак заряда неопределенным) зарядом. При этом число
элементарных зарядов оказалось пропорциональным атомному весу.
Заряд ядра оказался важнейшей характеристикой атома. В
1913 году было показано, что заряд ядра совпадает с номером элемента в
таблице Менделеева. Бор писал: «С самого начала было ясно, что
благодаря большой массе ядра и его малой протяженности в пространстве
сравнительно с размерами всего атома строение электронной системы
должно зависеть почти исключительно от полного электрического заряда
ядра. Такие рассуждения сразу наводили на мысль о том, что вся
совокупность физических и химических свойств каждого элемента может
определяться одним целым числом…»
После знакомства с Резерфордом Бор, отказавшись от
изучения электронной модели, начал работу в его группе. Обратившись к
планетарной модели, Бор создал на ее основе теорию атома
Резерфорда-Бора. Резерфорд понял революционный характер идей Бора и
обсудил с ним основы этой теории, высказал критические замечания, после
чего статьи Бора были опубликованы.
Во время Первой Мировой войны Бор продолжает работать в
лаборатории Резерфорда. В 1915 году он опубликовал работы «О сериальном
спектре водорода» и «О квантовой теории излучения в структуре атома». В
1916 году была опубликована статья Зоммерфельда, где он рассмотрел
движение электрона по эллиптическим орбитам и обобщил правила
квантования Бора. Бор с восторгом отозвался об этой статье. Теория
атома после открытий Зоммерфельда стала называться теорией Бора -
Зоммерфельда.
В 1936 году Бор выступил со статьей «Захват нейтрона и
строение ядра», в которой предложил капельную модель ядра и механизм
захвата нейтрона ядром. Странно, но ни Бор, ни другие не могли сразу
предсказать деление ядра, подсказываемое капельной моделью, пока в
начале 1939 г. не было открыто деление урана.
www.examen.ru
|
Первая страница статьи Э. Резерфорда в журнале Philosophical Magazine, 6, 21 (1911), в которой впервые водится понятие «атомное ядро».
Открытое 100 лет назад Э.Резерфордом атомное ядро является связанной системой взаимодействующих протонов и нейтронов. Каждое атомное ядро по-своему уникально. Для описания атомных ядер разработаны различные модели, описывающие отдельные специфические особенности атомных ядер. Изучение свойств атомных ядер открыло новый мир – субатомный квантовый мир, привело к установлению новых законов сохранения и симметрии. Полученные в ядерной физике знания широко используются в естествознании от изучения живых систем до астрофизики. 1. 1911 г. Резерфорд открывает атомное ядро.
В июньском 1911 г. номере журнала
«Philosophical
Magazine»
была опубликована работа Э. Резерфорда «Рассеяние α- и
β-частиц веществом и строение атома», в которой впервые
было введено понятие «атомное ядро».
Измеренное Гейгером и Марсденом угловое распределение α-частиц можно было объяснить только в том случае, если предположить, что атом имеет центральный заряд, распределенный в области размером <10-12 см. Результирующий заряд ядра приблизительно равен Ae/2, где A – вес атома в атомных единицах массы, e – фундаментальная единица заряда. Точность определения величины заряда ядра золота составила ≈ 20%. Так возникла планетарная модель атома, согласно которой атом состоит из массивного положительно заряженного атомного ядра и вращающихся вокруг него электронов. Так как в целом атом электрически нейтрален – положительный заряд ядра компенсировался отрицательным зарядом электронов. Число электронов в атоме определялось величиной заряда ядра Z. 1909–1911 г. Опыты Г. Гейгера и Э. Марсдена
В 1910 г. к Резерфорду в лабораторию
приехал работать молодой ученый по имени Марсден. Он попросил
Резерфорда дать ему какую-нибудь очень простую задачу. Резерфорд
поручил ему считать α-частицы, проходящие через материю, и
найти их рассеяние. При этом Резерфорд заметил, что по его мнению
Марсден ничего заметного не обнаружит. Свои соображения Резерфорд
основывал на принятой в то время модели атома Томсона. В соответствии
с этой моделью атом представлялся сферой размером 10–8
см с равнораспределенным положительным
зарядом, в которую были вкраплены электроны. Гармонические колебания
последних определяли спектры лучеиспускания. Легко показать, что
α-частицы должны были легко проходить через такую сферу, и
особенного рассеяния их нельзя было ожидать. Всю энергию на пути
своего пробега α-частицы тратили на то, чтобы выбрасывать
электроны, которые ионизировали окружающие атомы. П.Л. Капица. «Воспоминания о профессоре Э. Резерфорде» 1909–1911 г. Опыты Г. Гейгера и Э. Марсдена
Г. Гейгер и Э. Марсден увидели, что при прохождении через тонкую фольгу из золота большинство α-частиц, как и ожидалось, пролетает без отклонения, но неожиданно было обнаружено, что часть α-частиц отклоняется на очень большие углы. Некоторые α-частицы рассеивались даже в обратном направлении. Расчеты напряженности электрического поля атомов в моделях Томсона и Резерфорда показывают существенное различие этих моделей. Напряжённость поля положительного заряда распределенного по поверхности атома в случае модели Томсона ~1013 В/м. В модели Резерфорда положительный заряд, находящийся в центре атома в области R < 10-12 см создаёт напряженности поля на 8 порядков больше. Только такое сильное электрического поле массивного заряженного тела может отклонить α-частицы на большие углы, в то время как в слабом электрическом поле модели Томсона это было невозможно. Э. Резерфорд, 1911 г. «Хорошо известно, что α- и β-частицы при столкновении с атомами вещества испытывают отклонение от прямолинейного пути. Это рассеяние гораздо более заметно у β-частиц нежели у α-частиц, т.к. они обладают значительно меньшими импульсами и энергиями. Поэтому нет сомнения в том, что столь быстро движущиеся частицы проникают сквозь атомы, встречающиеся на их пути, и что наблюдаемые отклонения обусловлены сильным электрическим полем, действующим внутри атомной системы. Обычно предполагалось, что рассеяние пучка α- или β-лучей при прохождении через тонкую пластинку вещества есть результат многочисленных малых рассеяний при прохождении атомов вещества. Однако наблюдения проведенные Гейгером и Марсденом показали, что некоторое количество α-частиц при однократном столкновении испытывают отклонение на угол больше 90°. Простой расчет показывает, что в атоме должно существовать сильное электрическое поле, чтобы при однократном столкновении создавалось столь большое отклонение». 1911 г. Э. Резерфорд. Атомное ядро
Исходя из планетарной модели атома, Резерфорд вывел формулу описывающую рассеяние α-частиц на тонкой фольге из золота, согласующуюся с результатами Гейгера и Марсдена. Резерфорд предполагал, что α-частицы и атомные ядра с которыми они взаимодействуют можно рассматривать как точечные массы и заряды и что между положительно заряженными ядрами и α-частицами действуют только электростатические силы отталкивания и что ядро настолько тяжелое по сравнению с α-частицей , что оно не смещается в процессе взаимодействия. Электроны вращаются вокруг атомного ядра на характерных атомных масштабах ~10-8 см и из-за малой массы не влияют на рассеяние α-частиц.
Вначале
Резерфорд получил зависимость угла рассеяния
θ
α-частицы
с энергией
E
от величины прицельного параметра
b
столкновения с точечным массивным ядром.
b − прицельный параметр − минимальное расстояние
на которое α-частица
подошла бы к ядру, если бы между ними не действовали силы
отталкивания, θ
− угол рассеяния α-частицы,
Z1e
− электрический заряд α-частицы,
Z2e
− электрический заряд ядра.
Э. Резерфорд, 1911 г.: «Наиболее простым является предположение, что атом имеет центральный заряд, распределенный по очень малому объему, и что большие однократные отклонения обусловлены центральным зарядом в целом, а не его составными частями. В то же время экспериментальные данные недостаточно точны, чтобы можно было отрицать возможности существования небольшой части положительного заряда в виде спутников, находящихся на некотором расстоянии от центра … Следует отметить, что найденное приближенное значение центрального заряда атома золота (100e) примерно совпадает с тем значением, который имел бы атом золота, состоящий из 49 атомов гелия, несущих каждый заряд 2e. Быть может, это лишь совпадение, но оно весьма заманчиво с точки зрения испускания радиоактивным веществом атомов гелия, несущих две единицы заряда».
Э. Резерфорд, 1921 г.:
«Представление о нуклеарном строении атома первоначально
возникло из попыток объяснить рассеяние α-частиц на большие
углы при прохождении через тонкие слои материи. Так как α частицы
обладают большою массою и большою скоростью, то эти значительные
отклонения были в высшей степени замечательны; они указывали на
существование весьма интенсивных электрически! или магнитных полей
внутри атомов. Чтобы объяснить эти результаты, необходимо было
предположить, что атом состоит из заряженного массивного ядра, весьма
малых размеров по сравнению с обычно принятой величиной диаметра
атома. Это положительно заряженное ядро содержит большую часть массы
атома и окружено на некотором расстоянии известным образом
распределенными отрицательными электронами; число которых равняется
общему положительному заряду ядра. При таких условиях вблизи ядра
должно существовать весьма интенсивное электрическое поле и
α-частицы, при встрече с отдельным атомом проходя вблизи от
ядра, отклоняются на значительные углы. Допуская, что электрические
силы изменяются обратно пропорционально квадрату расстояния в
области, прилегающей к ядру, автор получил соотношение, связывающее
число α-частиц, рассеянных на некоторый угол с зарядом ядра и
энергией α-частицы.
Несмотря на то, что комбинация двух
протонов и двух нейтронов исключительно устойчивое образование, в
настоящее время считается, что α-частицы
не входит в состав ядра в качестве самостоятельного структурного
образования. В случае α-радиоактивных
элементов энергия связи α-частицы
больше, чем энергия которую необходимо затратить на то, чтобы по
отдельности удалить из ядра два протона и два нейтрона, поэтому α-частица
может быть испущена из ядра, хотя она не присутствует в ядре как
самостоятельное образование. |
|
nuclphys.sinp.msu.ru
