ПРИГОТОВЛЕНИЕ РАСТВОРОВ РАЗЛИЧНЫХ КОНЦЕНТРАЦИЙ
Новые рефераты:
- Повышение пенсионного возраста.
- Безработица и её социально-экономические последствия.
- Основные направления в развитии социологической теории ХХ века.
- Колебательные реакции.
- Предмет формальной логики.
- Роль и значение времени в управлении.
- Античная философия.
- Социальная поддержка многодетных семей (на примере Архангельской области).
- Рыночные структуры.
- Причины и типология кризисов в социально-экономических системах.
-
Этапы реинжиниринга бизнес-процессов. Роль творчества в процессе реинжиниринга.
Образование ПРИГОТОВЛЕНИЕ РАСТВОРОВ РАЗЛИЧНЫХ КОНЦЕНТРАЦИЙ
Наименование параметра Значение Тема статьи: ПРИГОТОВЛЕНИЕ РАСТВОРОВ РАЗЛИЧНЫХ КОНЦЕНТРАЦИЙ Рубрика (тематическая категория) Образование
Растворами называются гомогенные системы переменного состава, состоящие из двух или большего числа компонентов и продуктов их взаимодействия.
Под компонентами подразумеваются растворенные вещества и растворитель.
Важнейшей характеристикой раствора является концентрация.
Относительное содержание растворенного вещества в растворе можно выразить через размерные величины — концентрации и безразмерные — доли.
Учитывая зависимость отцелей использования раствора применяют различные способы выражения концентрации, основные из которых рассмотрены ниже.
1. Массовая доля и процентная концентрация
Массовой долей (ω) принято называть отношение массы растворенного вещества к массе раствора:
где тв — масса растворенного вещества, г; m(p-pa)- масса раствора, ᴦ.
При выражении этой величины в процентах она принято называть
процентной концентрацией:
2. Молярная концентрация (молярность)
Молярная концентрация (См)- это отношение количества (числа молей) вещества к объёму раствора, выраженному в литрах.
Так как
— количество вещества (моль), то:
где См — молярная концентрация раствора, моль/л;
тв — масса растворенного вещества, г;
Мв — молярная масса растворенного вещества, г/моль; Vр-ра — объём раствора, л.
3. Молярная концентрация эквивалента (нормальность)
Нормальность (Сн) — это количество эквивалентов растворенного вещества, содержащееся в 1 литре раствора:
— количество эквивалентов вещества, моль.
то
где сн — нормальность раствора, моль/л;
ть — масса растворенного вещества, г;
fэкв — фактор эквивалентности;
Мэкв — молярная масса эквивалента͵ моль/л; Vр-ра — объём раствора, л.
4. Моляльная концентрация (моляльность) Моляльная концентрация (Cm) определяется числом молей растворенного вещества в 1000 граммах (1 кг) растворителя: где тв — масса растворенного вещества, г;
Mв — молярная масса растворенного вещества, г/моль; mр-теля— масса растворителя, ᴦ.
5. Титр раствора
Титр раствора (7) определяется массой растворенного вещества в 1 мл раствора:
где Т—титр раствора, г/мл;
тв — масса растворенного вещества, г; Vр-ра — объём раствора, мл.
Экспериментальная часть
Опыт 1. Приготовление раствора соляной кислоты заданной концентрации
Раствор готовится разбавлением более концентрированного раствора исходной кислоты.
Для определения концентрации раствора исходной соляной кислоты измерьте ареометром ее плотность (ρ, г/см ). Для этого кислоту налейте в цилиндр, опустите в нее ареометр.
Размещено на реф.рф
Отметьте деление шкалы ареометра, совпадающее с нижним мениском жидкости в цилиндре. Это и есть плотность раствора. Пользуясь табл. 1, определите процентную концентрацию исходной соляной кислоты (ωисх, %).Далее рассчитайте (с точностью до десятых долей миллилитра) объём исходной кислоты, необходимый для приготовления 100 мл раствора с концентрацией, указанной преподавателем. Проверьте правильность расчета͵ показав его преподавателю.
Раствор готовится в мерной колбе объёмом 100 мл. Мерную колбу примерно наполовину заполните дистиллированной водой.
пипетку и пере- Отберите вычисленный объём исходной кислоты в
несите кислоту в мерную колбу. Аккуратно доведите объём раствора до риски дистиллированной водой. Закройте колбу пробкой и, придерживая пробку пальцем, тщательно перемешайте, переворачивая колбу 8-10 раз вверх дном так, чтобы воздушный пузырь перемещался через всю колбу.
Плотность
Таблица 1 растворов некоторых кислот и оснований при 20°С
Массовая доля, % Н2SO4 HNO3 HCI NaOH NH3 1.012 1,009 1.008 1,021 0.990 1,025 1,020 1,018 1,043 0,981 1,038 1,031 1,023 1,065 0,973 1,052 1,043 1,038 1,087 0,965 1,066 1,054 1,047 1,109 0,958 1,080 1,066 1,057 1,131 0,950 1,095 1,078 1,153 0,943 1,109 1,090 1,078 1,175 0,936 1,124 1,103 1,088 1,197 0,930 1,139 1,115 1,098 1,219 0,923 1,155 1,128 1,108 1,241 0,916 1,170 1,140 1,119 1,263 0,910 1,186 1,153 1,129 1,285 0,904 1,202 1,167 1,139 1,306 0,898 1,219 1,180 1,149 1,328 0,892 1,235 1,193 1,158 1,349 0,886 1,252 1,207 1,169 1,370 1,268 1,221 1,179 1,390 1,286 1,234 1,189 1,410 1,303 1,246 1,198 1,430 1,321 1,259 1,449 1,337 1,272 1,469 1,357 1,285 1,487 1,376 1,298 1,507 1,395 1,310 1,525 1,415 1,322 1,543 1,435 1,334 Опыт 2. Определение концентрации кислоты методом титрования
Перед началом титрования бюретку сполосните раствором щелочи, выданным для работы. Нормальность раствора щелочи указана на этикетке склянки.
Заполните бюретку щелочью несколько выше нулевого деления. Установите уровень щелочи (по нижнему мениску) на нулевом делении бюретки. В случае если нулевая отметка находится значительно выше уровня глаз, титрование можно вести от другого деления, к примеру от 10 мл.
Проведите ориентировочное титрование. Для этого в пипетку с помощью груши наберите 10 мл (аликвотную часть) приготовленного раствора кислоты. Из пипетки кислоту вылейте в коническую колбу для титрования, внесите туда 2-3 капли индикатора фенолфталеина. Из бюретки по каплям прилейте щелочь, постоянно перемешивая содержимое колбы кругообразными движениями. Титрование проведите на белом фоне, подложив под колбу лист белой бумаги. Как только раствор станет от прибавления одной капли щелочи бледно-розовым, добавление щелочи прекратите и запишите объём щелочи, пошедший на титрование.
Титрование нужно будет повторить еще два раза. Каждый раз перед титрованием новой пробы кислоты подливайте щелочь в бюретку до нулевой отметки или до того уровня, с которого начали титровать в первом опыте. После каждого титрования объём щелочи с точностью до десятых долей миллилитра записывайте в таблицу. Эти объёмы не должны отличаться более чем на 0,1 мл. В случае если результаты титрования отличаются на большую величину, титрование следует повторить.
Рассчитайте нормальную концентрацию приготовленного раствора кислоты, используя закон эквивалентов: вещества взаимодействуют друг с другом в эквивалентных количествах, т. е. число эквивалентов щелочи, пошедшее на титрование (Nщ), равно числу эквивалентов кислоты, взятой для анализа (NK):
Nщ=NK.
Число эквивалентов растворенного вещества в данном объеме раствора (V) равно произведению объёма раствора на его нормальность, т. е.
N=V-CН,
где V- объем раствора, л;
Сн — нормальность раствора, моль/л. Тогда:
отсюда:
где Сн(к) и Сн(щ) — нормальные концентрации кислоты и щелочи, моль/л;
Vщ — средний объём щелочи, пошедший на титрование, л; VK — объём кислоты, взятый для титрования (объем пипетки), л. Расчет концентрации кислоты произведите с точностью до четвертого знака после запятой.
При оформлении результатов опыта:
1. Запишите плотность (рисх) и процентную концентрацию (ωиех, %) исходного раствора.
2. Приведите расчет объёма исходной кислоты (Vисх), необходимого для приготовления заданного раствора,
3. Запишите объём кислоты, взятый для титрования (объем пипетки, Vк), нормальность раствора щелочи Сн(щ). Далее заполните табл. 2.
Таблица 2
Результаты титрования
Объем кислоты, взятый для титрования, Vk , мл Объем щелочи, пошедший на каждое титрование, Vщ, мл 1 Средний объём щелочи, Vщ ср, мл i ■. . — Опыт 3. Приготовление раствора соли с заданной массо вой долей (ω соли, %)
Получите у преподавателя задание. Рассчитайте, сколько граммов соли и какой объём воды потребуются для приготовления 100 мл раствора соли заданной концентрации.
Взвесьте на лабораторных весах нужное количество соли и высыпьте ее в мерную колбу, предварительно налив в нее небольшой объём воды. Далее дистиллированной водой доведите объём раствора в колбе до метки (воду крайне важно приливать постепенно, все время перемешивая раствор). Приготовленный раствор из колбы отлейте в цилиндр и измерьте ареометром его плотность. По плотности с помощью табл. 3 определите массовую долю соли в приготовленном растворе. (Совпадает ли она с рассчитанной вами?)
Таблица 3 Плотность растворов некоторых солей при 20°С
Массовая доля, % NaCl KCl Nh5C1 Na2S04 (Nh5)2SO4 A12(S04)3 Na2SO4.10h3O 1,007 1,05 1,01 1,007 1,004 1,009 1,004 1,014 1,011 1,004 1,016 1,010 1,019 1,008 1,022 1,017 1,008 1,026 1,016 1,029 1,012 1,029 1,024 1,011 1,035 1,022 1,040 1,016 1,036 1,030 1,014 1,044 1,028 1,050 1,020 1,044 1,037 1,017 1,053 1.034 1,061 1,024 1,051 1,043 1,020 1,063 1.040 1,072 1,028 1,058 1,050 1,023 1,072 1,046 1,083 1,032 1,065 1,056 1,026 1,082 1,051 1,094 1,036 1,073 1,063 1,029 1,091 1,057 1,105 1,040 И 1,081 1,070 1,031 1,101 J 1,063 1,117 1,044 1,089 1,077 1,034 1,111 1,06 1,129 1,048 1,096 1,083 1,037 1,121 1,075 1,140 1,052 1,104 1,090 1,040 1,131 1,081 1,152 1,056 1,119 1,104 1,046 1,141 1,092 1,176 1,064 1,135 1,113 1,051 1,104 1,201 1,072 1,143 1,126 1,054 1,109 1,213 1,077 1,151 1.133 1,057 1,115 1,226 1,081 1,159 1,140 1,059 1,121 1,239 1,085 1,062 1,127 1,252 1,067 1,257 1,073 1,306 1,333 Рассчитайте молярную, нормальную концентрации и титр приготовленного раствора. Результаты опыта сведите в табл. 4.
Таблица4
Результаты опыта приготовления раствора соли
Масса, г Плотность раствора, р, г/мл Концентрация Приготовленного раствора соли соли воды молярная, См, моль/л нормальная, Сн, моль/л титр, г/мл Задания для самоконтроля
1. Содержание сульфата железа (II) в растворе (пл. 1,122 г/см ) составляет 12%. Вычислите молярную концентрацию и молярную концентрацию эквивалента сульфата железа (И) в растворе.
2. На нейтрализацию 50 мл раствора КОН пошло 10 мл 0,8н раствора НС1. Рассчитайте нормальность раствора щелочи.
3. Для приготовления 0,025М раствора хлорида кальция используют СаСl2 в ампулах с массовой долей 0,45% (пл. 1,04 г/см). Сколько мл этого раствора крайне важно для приготовления 500 мл 0,02 5М раствора?
ПРИГОТОВЛЕНИЕ РАСТВОРОВ РАЗЛИЧНЫХ КОНЦЕНТРАЦИЙ — понятие и виды. Классификация и особенности категории «ПРИГОТОВЛЕНИЕ РАСТВОРОВ РАЗЛИЧНЫХ КОНЦЕНТРАЦИЙ» 2014, 2015.
referatwork.ru
2. Приготовление растворов заданной концентрации разбавлением
Пример. Приготовить 20 мл раствора с содержанием 0,1 моль/лNaОН из раствора с содержанием 0,5 моль/л NaОН.
Решение. Находим массу NaОН, которая должна содержаться в 20 мл раствора с концентрацией 0,1 моль NaОН.
В 1000 мл р-ра (0,1 моль/л NaОН) содержится 4 г NaОН,
В 20 мл р-ра (0,1 моль/л NaОН) содержится х г NaОН,
тогда х =
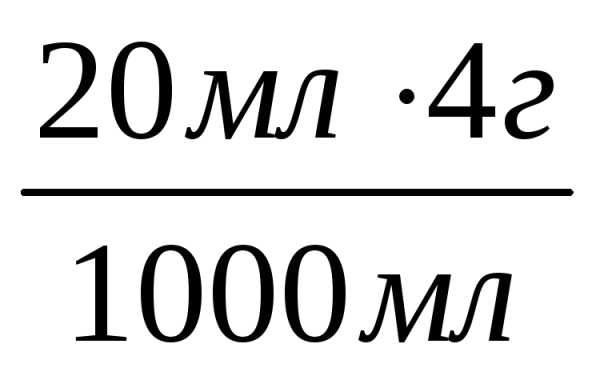 = 0,08 г
= 0,08 г
Далее находим объем (мл) раствора с концентрацией 0,5 моль/л, в котором содержится 0,08 г NaОН.
20 г NaОН содержится в 1000 мл р-ра (0,5 моль/л NaОН)
0,08 г NaОН содержится в y мл р-ра (0,5 моль/л NaОН)
тогда у =
 = 4 мл
= 4 мл
Следовательно, чтобы приготовить 20 мл раствора с содержанием 0,1 моль/л NaОН надо взять 4 мл раствора с содержанием 0,5 моль/л NaОН и прилить 16 мл воды (20мл – 4 мл).
3. Приготовление раствора промежуточной концентрации из
двух растворов большей и меньшей концентрации
Пример. В каких массовых отношениях надо смешать 20%-ный раствор и 5%-ный раствор NaОН, чтобы получить 10%-ный раствор?
Решение. Допустим, надо взять Х массовых частей 20%-ного раствора и у массовых частей 5%-ного раствора. Количество массовых частей растворенного вещества в 20%-ном растворе:
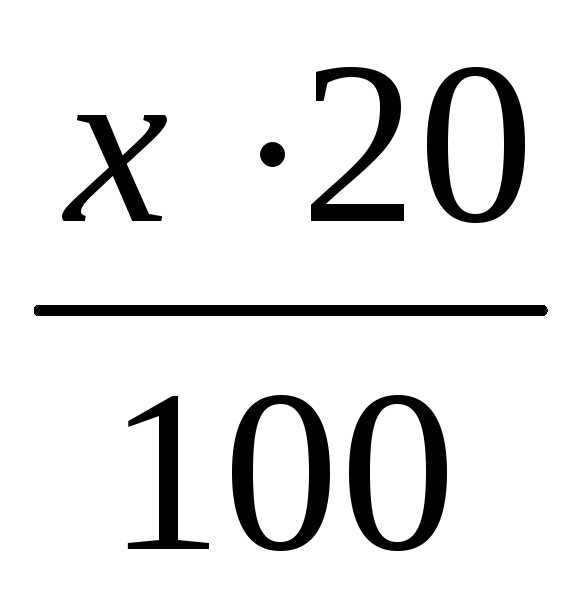 = 0,2х.
= 0,2х.
Количество
массовых частей растворенного вещества
в 5%-ном растворе равно:
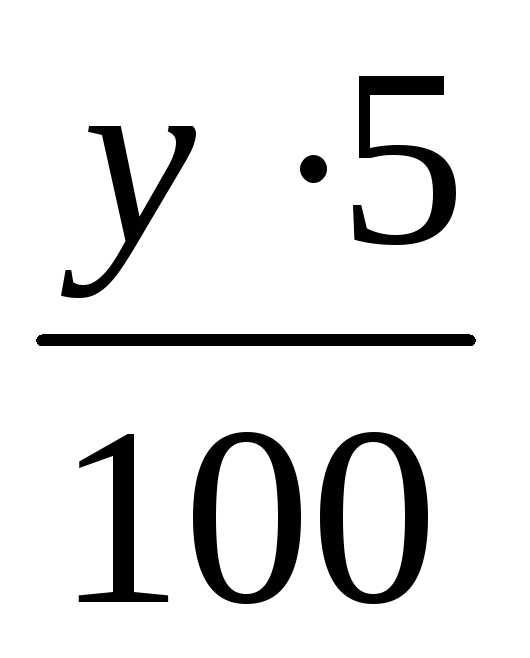 =
0,05у
=
0,05у
Количество массовых частей растворенного вещества в 10%-ном растворе равно: 0,1 (х+у).
Масса растворенного вещества до сливания равна массе растворенного вещества после сливания.
Составляем и решаем уравнение: 0,2х + 0,05у = 0,1 (х+у)
0,2х + 0,05у = 0,1 (х+у)
0,2х – 0,1х = 0,1у – 0,05у
0,1х = 0,05у
 =
=
 =
=
Следовательно, 20%-ного раствора надо взять 1 массовую часть, а 5%-ного раствора — 2 массовых части.
Когда не требуется особенной точности для разбавления растворов или смешивания их для получения растворов другой концентрации, можно воспользоваться следующим простым и быстрым способом, используя диагональную схему (правило креста).
«Правило креста»
В центре схемы пишут искомую концентрацию. Пишем вначале так:
20
10%, где 20 и 5 – процентные концентрации исходных
5 растворов.
Теперь из 20 вычитаем 10, и полученное значение пишем в правом нижнем углу, вычитая 5 из 10, пишем полученную цифру в правом верхнем углу. Схема примет вид: 20 5, т.е. нужно взять 5 мас-
10
5 10
совых частей 20%-ного раствора и 10 массовых частей 5%-ного раствора или 1 массовую часть 20%-ного раствора и 2 массовых части 5%-ного раствора.
Экспериментальная часть
Измерительными приборами, применяемыми в объемном анализе, служат мерная колба, пипетка и бюретка.

Рис. 1 а) б) в)
Мерная колба – круглая плоскодонная колба с узким горлом, плотно закрывающимся пробкой (рис. 1а). На горле имеется метка, а на самой колбе указан ее рабочий объем и температура, при которой производилась градуировка.
Для приготовления растворов данной концентрации определенный объем жидкости при помощи пипетки переносят в мерную колбу, доливают водой до метки и перемешивают. Отсчет уровня жидкости в мерной колбе производится по нижнему мениску. Уровень жидкости прозрачных растворов устанавливают по нижнему краю мениска, а непрозрачных – по верхнему краю мениска.
Для перемешивания раствора в колбе ее плотно закрывают пробкой, переворачивают вверх дном и, держа одной рукой за круглую часть, другой – за пробку, несколько раз сильно встряхивают.
Пипетка – стеклянная трубка с расширением в средней части и меткой в верхней части (рис.1б). Нижняя часть пипетки заканчивается оттянутым кончиком. На расширенной или верхней частях указывают ее рабочий объем и температуру калибровки (рис. 1б). Чтобы наполнить пипетку, надо втянуть в нее резиновой грушей жидкость выше метки и быстро закрыть указательным пальцем правой руки ее верхнее отверстие.
Вынув пипетку из жидкости и держа ее над ним вертикально, установить глаз на вертикальном уровне с меткой пипетки. Осторожным движением указательного пальца дать вытекать жидкости из пипетки до тех пор, пока нижний край мениска не опустится до метки; в этот момент следует плотно закрыть пальцем отверстие пипетки и перелить в сосуд. После вытекания раствора из пипетки остающуюся каплю жидкости в ее кончике удаляют, коснувшись кончиком пипетки стенки того сосуда, в который выливается жидкость.
Бюретка – узкая трубка с делениями, отмеривающая объем вытекающей жидкости (рис.1в). Емкость бюреток различна – от 5 до 100 мл. Бюретки заполняются жидкостью через воронку с коротким концом, таким, чтобы он не доходил до нулевого деления бюретки. Затем открывают кран или зажим и заполняют раствором часть бюретки, расположенную ниже крана. Это нужно проделывать тщательно, чтобы в отводной части бюретки не оставалось пузырьков воздуха. Бюретки следует заполнять, чтобы вначале уровень жидкости был несколько выше нулевого деления шкалы, затем, осторожно приоткрывая кран, устанавливают уровень жидкости на нулевой отметке.
Опыт 1. Определение массовой доли соли в растворе по его относительной плотности, измеренной ареометром (рис.2).
Ознакомьтесь с устройством ареометра. Ареометры калибруются при 200С, поэтому, если температура испытуемого раствора отличается от 200С, следует нагреванием или охлаждением довести ее до 200С. Налейте в цилиндр около 250 мл испытуемого раствора соли при 200С и осторожно опустите в него ареометр. Отмерьте по шкале ареометра его показание. Ареометр не должен касаться стенок цилиндра. Приподняв ареометр на 1-2 см, вновь его опустите в раствор, еще раз определите показание. (Повторите это три раза). Раствор вылейте в склянку, вымойте ареометр.

Рис.2.
Таблица 1
studfiles.net
ПРИГОТОВЛЕНИЕ РАСТВОРОВ ЗАДАННОЙ КОНЦЕНТРАЦИИ — МегаЛекции
ТЕМА: Растворы. Способы выражения концентрации. Приготовление раствора заданной концентрации.
Цель: Научиться навыкам проведения расчетов, необходимых для приготовления растворов различных концентраций и умению готовить такие растворы.
Задачи:
1. Ознакомиться со способами выражения концентрации растворов.
2. Разобрать обучающие задачи по расчету концентрации растворов.
3. Подготовиться к лабораторной работе «Приготовление раствора соли заданной концентрации».
Студент должен знать:
1. до изучения темы: Понятия массовой доли, количества вещества, концентрации раствора и их взаимную связь.
2. после изучения темы: Понятия: раствор, растворитель, растворенное вещество; особенности структуры воды в жидком и твердом состояниях; растворимость твердых веществ, газов в воде; факторы, влияющие на растворимость; способы выражения концентрации растворов: по растворению точной навески (объема) сухого вещества, кристаллогидрата, газа; из концентрированного раствора путем его разбавления; из разбавленного раствора путем его концентрирования.
Студент должен уметь: Проводить необходимые расчеты для приготовления раствора с заданной концентрацией раствора. Пользоваться аналитическими весами, мерной посудой (пипетки, бюретки, мерные пробирки, цилиндры, мензурки) и химическими приборами (ареометр).
Теоретическое введение
Растворы играют важную роль в живой и неживой природе, а также в науке и технике.
Большинство физиологических процессов в организмах человека, животных и в растениях, различных промышленных процессов, биохимических процессов в почвах и т.п. протекают в растворах.
Раствор – это гомогенная многокомпонентная система, в которой одно вещество распределено в среде другого или других веществ.
Растворы могут быть в газообразном (воздух), жидком и твердом (сплавы, цветные стекла) агрегатных состояниях. Чаще всего приходится работать с жидкими растворами.
Содержание данного вещества в единице массы или объема раствора называется концентрацией раствора. На практике наиболее часто пользуются следующими способами выражения концентрации:
1. Массовая доля – отношение массы данного компонента в растворе к общей массе этого раствора. Массовая доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млнˉ1). Массовая доля данного компонента, выраженная в процентах, показывает, сколько граммов данного компонента содержится в 100 г раствора.
2. Массовая концентрация – отношение массы компонента, содержащегося в растворе, к объему этого раствора. Единицы измерения массовой концентрации кг/м3, г/л.
3. Титр Т – число граммов растворенного вещества в 1 мл раствора. Единицы измерения титра – г/мл, кг/см3.
4. Молярная концентрация с – отношение количества вещества (в молях), содержащегося в растворе, к объему раствора. Единицы измерения — моль/м3, (моль /л). Раствор, имеющий концентрацию 1 моль/л, обозначают 1М; 0,5 моль/л, обозначают 0,5 М.
5. Молярная концентрация эквивалентов сэк (нормальная концентрация) – это отношение количества вещества эквивалентов (моль) к объему раствора (л). Единица измерения нормальной концентрации моль/л. Например, сэк(KOH) = 1 моль/л, сэк(1/2h3SO4) = 1 моль/л, сэк(1/3 AlCl3) = 1 моль/л. Раствор в 1 л которого содержится 1 моль вещества эквивалентов, называют нормальным и обозначают 1 н.
6. Моляльность b — это отношение количества растворенного вещества (в молях) к массе m растворителя. Единица измерения моляльности — моль/кг. Например, b(HCl/h3O) = 2 моль/кг.
7. Молярная доля – отношение числа молей растворенного вещества к общему числу молей вещества и растворителя. Молярная доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млн-1).
Для приготовления растворов определенной концентрации, для точного измерения объемов применяют мерную посуду: мерные колбы, пипетки и бюретки.
Мерные колбы – тонкостенные плоскодонные сосуды с длинным узким горлом, на котором нанесена метка в виде кольцевой черты. На каждой колбе обозначены ее емкость и температура, при которой эта емкость измерена. Колба должна плотно закрываться пробкой (рис.1).
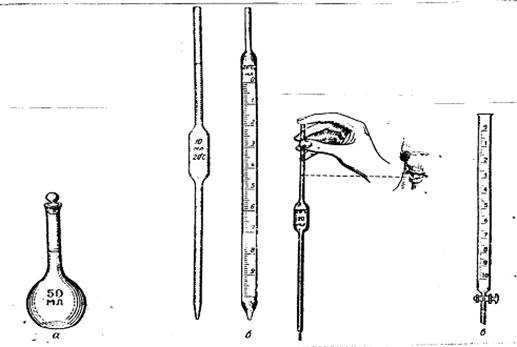
Рис. 1 Мерная посуда
а — мерная колба; б – пипетки; в – бюретка.
Пипетки используют для отбора определенного объема пробы жидкости.
Пипетки Мора представляют собой стеклянные трубки с расширением посередине. Нижний конец оттянут в капилляр, на верхнем конце нанесена метка, до которой следует набирать измеряемую жидкость. На пипетке указана объемность.
Широко применяют также градуированные пипетки различной емкости, на наружной стенке которых нанесены деления. Для наполнения пипетки нижний конец ее опускают в жидкость и втягивают последнюю при помощи груши или специального приспособления. Жидкость набирают так, чтобы она поднялась на 2-3 см выше метки, затем быстро закрывают верхнее отверстие указательным пальцем правой руки, придерживая в то же время пипетку большим и средним пальцами. Затем ослабляют нажим указательного пальца, в результате чего жидкость будет медленно вытекать из пипетки. В тот момент, когда нижний мениск (уровень) жидкости окажется на одном уровне с меткой, палец снова прижимают. Введя пипетку в сосуд, отнимают указательный палец и дают жидкости стечь по стенке сосуда. После того, как жидкость вытечет, пипетку держат еще 5секунд прислоненной к стенке сосуда, слегка поворачивая вокруг оси.
Бюретки применяют при титровании, для измерения точных объемов и т.д.
ЛАБОРАТОРНАЯ РАБОТА
ПРИГОТОВЛЕНИЕ РАСТВОРОВ ЗАДАННОЙ КОНЦЕНТРАЦИИ
Опыт 1. Приготовление растворов кислот заданной концентрации
Раствор готовится разбавлением более концентрированного раствора исходной кислоты.
В соответствии со своим вариантом (таблица 1) рассчитайте (с точностью до десятых долей миллилитра) объемы кислот, необходимые для приготовления указанного объема раствора с заданной концентрацией.
Таблица 1. Варианты для выполнения опыта 1
| Вариант | Н2SO4 | HNO3 | HCl |
| 0,1М | 0,01н | 12% | |
| 0,01н | 0,1М | 8% | |
| 0,001М | 0,05н | 4% | |
| 0,05н | 0,001М | 6% | |
| 0,005М | 0,025н | 2% | |
| 0,025н | 0,005М | 10% | |
| 20% | 1М | 0,01н | |
| 26% | 0,02н | 0,1М | |
| 30% | 0,01М | 0,05н | |
| 38% | 0,25н | 0,001М | |
| 40% | 0,005М | 0,025н | |
| 0,025н | 60% | 0,005М | |
| 0,8М | 56% | 1н | |
| 0,5н | 18% | 2М | |
| 0,75н | 10% | 0,5М |
Пользуясь таблицей «Плотность растворов некоторых кислот при 20°С», определите процентную концентрацию исходной кислоты.
Плотность растворов некоторых кислот при 20°С (г/мл)
| Массовая доля, % | H2SO4 | HNO3 | HCl |
| 1.0116 | 1.0091 | 1.0081 | |
| 1.0250 | 1.0202 | 1.0179 | |
| 1.0385 | 1.0314 | 1.0278 | |
| 1.0522 | 1.0427 | 1.0377 | |
| 1.0661 | 1.0543 | 1.0476 | |
| 1.0802 | 1.0660 | 1.0576 | |
| 1.0947 | 1.0780 | 1.0676 | |
| 1.1094 | 1.0901 | 1.0777 | |
| 1.1245 | 1.1025 | 1.0878 | |
| 1.1398 | 1.1150 | 1.0980 | |
| 1.1554 | 1.1277 | 1.1083 | |
| 1.1714 | 1.1406 | 1.1185 | |
| 1.1872 | 1.1536 | 1.1288 | |
| 1.2031 | 1.1668 | 1.1391 | |
| 1.2191 | 1.1801 | 1.1492 | |
| 1.2353 | 1.1934 | 1.1594 | |
| 1.2518 | 1.2068 | 1.1693 | |
| 1.2685 | 1.2022 | 1.1791 | |
| 1.2855 | 1.2335 | 1.1886 | |
| 1.3028 | 1.2466 | 1.1977 | |
| 1.3205 | 1.259 | ||
| 1.3386 | 1.272 | ||
| 1.3570 | 1.285 | ||
| 1.3759 | 1.297 | ||
| 1.3952 | 1.310 | ||
| 1.4149 | 1.322 | ||
| 1.4351 | 1.333 | ||
| 1.4558 | 1.345 | ||
| 1.4770 | 1.356 | ||
| 1.4987 | 1.367 | ||
| 1.520 | 1.377 | ||
| 1.542 | 1.386 | ||
| 1.565 | 1.396 | ||
| 1.587 | 1.405 | ||
| 1.6105 | 1.413 | ||
| 1.634 | 1.422 | ||
| 1.657 | 1.430 | ||
| 1.681 | 1.437 | ||
| 1.704 | 1.445 | ||
| 1.7272 | 1.452 | ||
| 1.749 | 1.459 | ||
| 1.769 | 1.465 | ||
| 1.802 | 1.477 | ||
| 1.8144 | 1.482 | ||
| 1.8240 | 1.487 | ||
| 1.8312 | 1.409 | ||
| 1.8355 | 1.497 | ||
| 1.8361 | 1.505 | ||
| 1.8305 | 1.513 |
Пример 1. Нужно узнать объем 96% Н2SO4 (ρ=1,8355 г/мл), необходимый для приготовления 500мл 1М раствораН2SO4.
Рассчитаем массу Н2SO4:
См = (1), отсюда m(Н2SO4) = См ∙М(Н2SO4)∙Vр-ра=1моль/л∙98г/моль∙0,5л=49г.
Вычислим, в какой массе 96% раствора содержится 49г Н2SO4:
ω%= ∙100% (2), следовательно, m р-ра = = =51г.
Переведем массу 96% раствора Н2SO4 в объем, учитывая плотность:
ρ= (3), значит V = =27,8 мл
Если необходимо приготовить раствор Н2SO4 с заданной нормальностью, расчеты ведут аналогично, но при расчете необходимой массы кислоты вместо формулы 1 пользуются формулой:
Сн = (4) .
Пример 2. Нужно узнать объем 36% HCl (ρ=1,1791 г/мл), необходимый для приготовления 250 мл 20% раствора НСl (ρ= 1,0980 г/мл).
Найдем массу 250 мл 20% раствора НСl:
ρ= , значитm (20% р-ра)= ρ∙ V=1,0980г/мл∙250мл=274,5г.
Узнаем массу кислоты, необходимую для приготовления 247,5 г 20% раствора НСl:
ω%= ∙100%, следовательно m(НСl)= = =54,9г.
Вычислим, в какой массе 36% раствора содержится 54,9 г НСl:
ω%= ∙100% , тогда m р-ра = = =152,5г.
Переведем массу 36% раствора НСl в объем, учитывая плотность:
ρ= , значит V = =129,3 мл
Результат запишите в таблицу
| № | Объем раствора кислоты | Объем воды |
Проверьте правильность своих расчетов, показав их преподавателю.
Растворы готовятся в мерной колбе объемом 100 мл. Внимание! Разбавление концентрированных кислот (особенно Н2SO4) следует производить, приливая кислоту в воду, а не наоборот. В противном случае возможно вскипание жидкости и ее разбрызгивание. Запомните: Сначала вода, потом – кислота! Иначе случится большая беда! Мерную колбу примерно наполовину заполните дистиллированной водой. Отберите вычисленный объем исходной кислоты в пипетку и перенесите кислоту в мерную колбу. Кислоту следует приливать малыми порциями или очень тонкой струей при непрерывном перемешивании раствора. При сильном разогревании раствора следует дать ему охладиться. Аккуратно доведите объем раствора до метки дистиллированной водой. Закройте колбу пробкой и, придерживая пробку пальцем, тщательно перемешайте, переворачивая колбу 8-10 раз вверх дном так, чтобы воздушный пузырь перемещался через всю колбу.
Опыт 2. Приготовление раствора соли с заданной массовой долей (%) из навески соли
Рассчитайте, сколько граммов соли и воды потребуются для приготовления 100 г раствора соли заданной концентрации в соответствии со своим вариантом (таблица 3).
Таблица 3. Варианты для выполнения опыта 2
| Вариант | КВr | MgSO4∙7Н2О | NaH2PO4∙2Н2О |
| 1% | 14% | 4% | |
| 3% | 10% | 7% | |
| 5% | 12% | 1% | |
| 8% | 6% | 10% | |
| 10% | 3% | 15% | |
| 14% | 1% | 9% | |
| 0,5% | 24% | 2% | |
| 20% | 0,5% | 7% | |
| 2% | 20% | 0,5% | |
| 40% | 5% | 20% | |
| 9% | 16% | 5% | |
| 24% | 5% | 16% | |
| 6% | 18% | 3% | |
| 4% | 20% | 32% | |
| 30% | 7% | 40% | |
Пример 1. Нужно узнать какую массу медного купороса CuSO4∙5Н2О и какой объем воды необходимо взять для приготовления 500 г раствора с массовой долей 16 %.
Найдем массу CuSO4, необходимую для приготовления 500г 16% раствора:
ω%= ∙100% (1), следовательно, m (CuSO4)= = =80г.
М(CuSO4) = 64∙2+32+16∙4=160 г/моль.
М(CuSO4∙5H2O) = 64∙2+32+16∙4+5∙(1∙2+16) = 250 г/моль.
Учитывая, что приготовление раствора производится из кристаллогидрата CuSO4∙5Н2О, составим пропорцию:
160 г CuSO4 – 250 г CuSO4∙5Н2О
80 г CuSO4 – х г CuSO4∙5Н2О
х= =125г CuSO4∙5Н2О
Находим массу воды:
m(р-ра) = m(CuSO4∙5Н2О) + m(Н2О) (2),
значит m(Н2О)= m(р-ра) — m(CuSO4∙5Н2О)=500-125=375 г или 375 мл.
В том случае, если раствор готовится из безводной соли, используют формулы 1 и 2 и не прибегают к составлению пропорции:
m (CuSO4)= (3) ; m(Н2О)= m(р-ра) — m(CuSO4) (4).
Результат запишите в таблицу
| № | Масса навески соли | Масса воды |
Проверьте правильность расчета, показав его преподавателю.
Взвесьте на лабораторных весах нужное количество соли и высыпьте ее в стакан. Вылейте в этот стакан необходимое количество воды. Воду необходимо приливать постепенно, все время перемешивая раствор. После полного растворения соли приготовленный раствор перелейте в цилиндр и измерьте ареометром его плотность. По плотности с помощью таблицы «Плотность растворов некоторых солей при 20°С» определите массовую долю соли в приготовленном растворе. Совпадает ли она с рассчитанной вами?
Плотность растворов некоторых солей при 20°С(г/мл)
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
megalektsii.ru
Приготовление растворов заданной концентрации.
Глава 4. РАСТВОРЫ
Раствором называют однородную смесь, состоящую из двух или более веществ (компонентов), состав которой в определенных пределах может непрерывно изменяться. Как правило, компоненты раствора подразделяют на растворитель и растворенные вещества. Растворителем называют то вещество, которое в чистом виде находится в той же фазе, что и раствор. Так, при растворении в жидкости твердого или газообразного вещества, растворителем считают жидкость. Если же одна жидкость растворяется в другой, то растворителем обычно считается та, которой в растворе больше.
Наряду с давлением и температурой важным параметром состояния раствора является его состав. Количественный состав раствора выражается с помощью концентраций. Под концентрацией понимают относительное содержание компонентов в растворе. Рассмотрим наиболее часто применяемые способы выражения концентрации.
1. Массовая доля (wi) или массовое содержание (wi, %) данного компонента, выраженное в процентах, – отношение массы растворенного вещества к общей массе раствора, выраженное в долях единицы или в процентах:
, %,
где — масса i-го компонента, кг, г; — сумма масс компонентов раствора, кг или г.
2. Объемная доля ( ) или объемное содержание ( , %) данного компонента, выраженное в процентах, – отношение объема растворенного вещества к объему раствора, выраженное в долях единицы или в процентах:
, %,
где — объем i-го компонента, , л или мл; — объем компонентов раствора, , л или мл.
3. Молярная концентрация ( ) – количество (число молей) i -го компонента к объему раствора, выраженная в моль/м3, моль/дм3, моль/см3 или моль/л:
,
где – число молей растворенного вещества, моль, V — объем раствора, м3, дм3, см3 или л. В том случае, когда объем раствора выражается в литрах, молярную концентрацию называют молярностью.
4. Молярная концентрация эквивалента вещества (нормальная концентрация) ( , С(1/z В)) – количество (число молей эквивалента) i -го компонента к объему раствора, выраженная в моль/м3, моль/дм3, моль/см3 или моль/л:
,
где – число молей эквивалента растворенного вещества, моль, V — объем раствора, м3, дм3, см3 или л. В том случае, когда объем раствора выражается в литрах, нормальную концентрацию называют нормальностью.
5. Моляльность (Сm,i) — количество i -го компонента в молях в 1000 г растворителя, измеряется в моль/1000 г или моль/кг растворителя:
, или ,
где – число молей i -го компонента в молях, m – масса растворителя, г или кг.
6. Молярная доля ( ) или молярное содержание данного компонента, выраженное в процентах — отношение числа молей i-го компонента к общему числу молей компонентов раствора:
, %,
где — число молей i-го компонента, — общее число молей компонентов раствора, .
5. Титр (Т) — число граммов растворенного вещества в 1 см3 ( или в 1 мл ) раствора, г/ см3 или г/мл:
,
где m – масса вещества в г, V – объем раствора в см3 или мл.
Перейти от одних единиц концентраций к другим можно, составив уравнения связи между ними.
Приведем в качестве примера уравнения связи между единицами концентраций для двухкомпонентного (бинарного) раствора, содержащего в объеме V литров молей растворителя с молярной массой и молей растворенного вещества с молярной массой , и плотностью r.
Связь между молярностью и процентами по массе определяется соотношением:
;
между моляльностью и процентами по массе :
;
между молярной долей и процентами по массе :
;
между титром Т и процентами по массе :
;
между молярностью и моляльностью :
;
между моляльностью и молярной долей :
.
Работа 4.1. Приготовление раствора из фиксанала.
Фиксаналы (стандарт-титры) – запаянные в стеклянную ампулу точно отвешенные количества различных твердых веществ или точно отмеренные объемы титрованных растворов, необходимые для приготовления 1 л раствора точно известной концентрации (нормальности или молярности). Использование других методик такой точности не дает, так как большинство веществ, из которых готовят растворы, трудно получить химически чистыми. Например, серная кислота Н2SO4 всегда содержит воду, гидроксид натрия NaOH – гигроскопическую воду и некоторое количество Na2CO3 вследствие поглощения СО2 из воздуха.
Экспериментальная часть
Необходимое оборудование: мерная колба на 1 л, боек, промывалка с дистиллированной водой, стеклянная воронка.
Необходимые реактивы: фиксанал раствора или твердого вещества (по заданию преподавателя), дистиллированная вода.
Экспериментальная часть
Необходимое оборудование: мерная колба на 100 (200, 250) мл, мерный цилиндр (10 мл).
Необходимые реактивы: 20 % серная кислота, дистиллированная вода.
Методика проведения эксперимента
Рассчитайте объем 20 %-го раствора серной кислоты плотностью 1,14 г/мл, который необходим для приготовления 100 (200, 250) мл раствора серной кислоты заданной молярной концентрации (0.05 – 0.2 М, по указанию преподавателя).
В соответствующую мерную колбу влейте примерно на 1/3 часть ее объема дистиллированной воды и отмеренный при помощи цилиндра рассчитанный объем 20 %-й серной кислоты. Перемешайте раствор и, постепенно приливая дистиллированную воду, доведите объем раствора в колбе до метки, закройте ее пробкой и тщательно перемешайте.
На колбу с готовым раствором наклеивают этикетку с названием и концентрацией раствора.
Экспериментальная часть
Необходимое оборудование: лабораторные электронные весы, шпатель, бюкс, мерная колба (100, 200, 250 мл), воронка, мерная посуда.
Необходимые реактивы: соль по заданию преподавателя, дистиллированная вода.
Методика проведения эксперимента
Рассчитывают массу навески соли, необходимую для приготовления 100 (200 или 250) мл раствора соли заданной концентрации.
Рассчитанную навеску соли взвешивают в бюксе.
В мерную колбу наливают дистиллированной воды на 1/3 ее объема. Осторожно переносят в нее через воронку навеску соли. Для этого бюкс медленно наклоняют над воронкой и не допускают рассыпания и распыления вещества. Остатки вещества в бюксе и на стенках воронки смывают в колбу.
При непрерывном перемешивании растворяют все кристаллы соли.
Затем доводят объем раствора в колбе до метки дистиллированной водой, закрывают ее пробкой и еще раз тщательно перемешивают раствор, переворачивая колбу несколько раз вверх дном.
На колбу с готовым раствором наклеивают этикетку с названием и концентрацией раствора.
Далее этот раствор используют как концентрированный для приготовления раствора меньшей концентрации (указывается преподавателем).
Рассчитывают объем концентрированного раствора, необходимый для приготовления заданного объема разбавленного раствора. Отмеряют рассчитанный объем исходного раствора и через воронку вливают его в мерную колбу соответствующего объема. Воронку ополаскивают и вынимают из горлышка колбы. Доводят объем раствора в колбе дистиллированной водой до метки, закрывают ее пробкой и тщательно перемешивают раствор.
На колбу с готовым раствором наклеивают этикетку с названием и концентрацией раствора.
Экспериментальная часть
Необходимое оборудование: лабораторные электронные весы, шпатель, часовое стекло или бюкс, коническая колба (100, 200, 250 мл), воронка, мерный цилиндр.
Необходимые реактивы: соль по заданию преподавателя, дистиллированная вода.
Методика проведения эксперимента
Первая часть работы состоит в приготовлении раствора соли с заданным массовым процентом. Масса раствора (50 – 100 г) или его объем (100 – 250 мл) задается преподавателем.
Получив у преподавателя задание, рассчитывают, сколько потребуется соли и воды для приготовления раствора заданной концентрации. Плотность раствора, необходимая для расчета, определяется по справочным таблицам или указывается преподавателем.
В бюксе или на часовом стекле взвешивают навеску соли (с точностью до 0,01 г), используя метод “взятия навески по разности”. Навеску соли высыпают через воронку в коническую колбу. Затем отмеряют цилиндром необходимое количество воды и вливают в колбу с солью (воду необходимо приливать постепенно, все время перемешивая раствор). Колбу закрывают пробкой и наклеивают этикетку с названием и концентрацией раствора.
Во второй части работы из полученного раствора готовят раствор соли меньшей концентрации, используя метод разбавления. Концентрация разбавленного раствора задается преподавателем.
Рассчитывают объемы готового раствора и дистиллированной воды, необходимые для приготовления разбавленного раствора.
Отмеряют цилиндрами рассчитанные объемы исходного раствора и дистиллированной воды, вливают их в коническую колбу и тщательно перемешивают полученный раствор. Колбу закрывают пробкой, и наклеивают этикетку с названием и концентрацией раствора.
Экспериментальная часть
Необходимое оборудование: пикнометр, аналитические весы, разновесы, термометр, химический стакан, мензурка, воронка, пипетка, стеклянная палочка.
Необходимые реактивы: реактивы по заданию преподавателя.
Методика выполнения работы
Работа состоит из двух частей: приготовление раствора с заданным процентом по массе и определение его плотности.
После получения задания от преподавателя готовят раствор заданной концентрации по методике, описанной в работах № 4.3 или 4.4.
Далее определяют плотность раствора. Для этого взвешивают на аналитических весах пустой сухой пикнометр, пикнометр с водой и пикнометр с исследуемым раствором. Измеряют температуру воды и исследуемого раствора, они должны быть одинаковыми. Заполнение пикнометра жидкостями производится до метки. Капли жидкости выше метки необходимо удалить фильтровальной бумагой. Перед заполнением пикнометра исследуемым раствором его следует ополоснуть этим раствором.
Глава 4. РАСТВОРЫ
Раствором называют однородную смесь, состоящую из двух или более веществ (компонентов), состав которой в определенных пределах может непрерывно изменяться. Как правило, компоненты раствора подразделяют на растворитель и растворенные вещества. Растворителем называют то вещество, которое в чистом виде находится в той же фазе, что и раствор. Так, при растворении в жидкости твердого или газообразного вещества, растворителем считают жидкость. Если же одна жидкость растворяется в другой, то растворителем обычно считается та, которой в растворе больше.
Наряду с давлением и температурой важным параметром состояния раствора является его состав. Количественный состав раствора выражается с помощью концентраций. Под концентрацией понимают относительное содержание компонентов в растворе. Рассмотрим наиболее часто применяемые способы выражения концентрации.
1. Массовая доля (wi) или массовое содержание (wi, %) данного компонента, выраженное в процентах, – отношение массы растворенного вещества к общей массе раствора, выраженное в долях единицы или в процентах:
, %,
где — масса i-го компонента, кг, г; — сумма масс компонентов раствора, кг или г.
2. Объемная доля ( ) или объемное содержание ( , %) данного компонента, выраженное в процентах, – отношение объема растворенного вещества к объему раствора, выраженное в долях единицы или в процентах:
, %,
где — объем i-го компонента, , л или мл; — объем компонентов раствора, , л или мл.
3. Молярная концентрация ( ) – количество (число молей) i -го компонента к объему раствора, выраженная в моль/м3, моль/дм3, моль/см3 или моль/л:
,
где – число молей растворенного вещества, моль, V — объем раствора, м3, дм3, см3 или л. В том случае, когда объем раствора выражается в литрах, молярную концентрацию называют молярностью.
4. Молярная концентрация эквивалента вещества (нормальная концентрация) ( , С(1/z В)) – количество (число молей эквивалента) i -го компонента к объему раствора, выраженная в моль/м3, моль/дм3, моль/см3 или моль/л:
,
где – число молей эквивалента растворенного вещества, моль, V — объем раствора, м3, дм3, см3 или л. В том случае, когда объем раствора выражается в литрах, нормальную концентрацию называют нормальностью.
5. Моляльность (Сm,i) — количество i -го компонента в молях в 1000 г растворителя, измеряется в моль/1000 г или моль/кг растворителя:
, или ,
где – число молей i -го компонента в молях, m – масса растворителя, г или кг.
6. Молярная доля ( ) или молярное содержание данного компонента, выраженное в процентах — отношение числа молей i-го компонента к общему числу молей компонентов раствора:
, %,
где — число молей i-го компонента, — общее число молей компонентов раствора, .
5. Титр (Т) — число граммов растворенного вещества в 1 см3 ( или в 1 мл ) раствора, г/ см3 или г/мл:
,
где m – масса вещества в г, V – объем раствора в см3 или мл.
Перейти от одних единиц концентраций к другим можно, составив уравнения связи между ними.
Приведем в качестве примера уравнения связи между единицами концентраций для двухкомпонентного (бинарного) раствора, содержащего в объеме V литров молей растворителя с молярной массой и молей растворенного вещества с молярной массой , и плотностью r.
Связь между молярностью и процентами по массе определяется соотношением:
;
между моляльностью и процентами по массе :
;
между молярной долей и процентами по массе :
;
между титром Т и процентами по массе :
;
между молярностью и моляльностью :
;
между моляльностью и молярной долей :
.
Приготовление растворов заданной концентрации.
Растворы определенной концентрации готовят следующими методами: 1) из фиксаналов; 2) растворением известной навески твердого вещества в определенной массе или объеме растворителя или раствора; 3) разбавлением концентрированных растворов.
При приготовлении и разбавлении растворов часто приходится переходить от одних способов выражения концентраций к другим.
Методику таких расчетов покажем на следующем примере.
Пример 1. Имеется водный раствор Al2(SO4)3 c концентраций w = 10 % и плотностью r = 1,105 г/мл. Каковы молярность, нормальность, титр, моляльность и молярная доля вещества этого раствора?
Решение. 1. При переходе от процентной концентрации к молярной или нормальной необходимо учитывать плотность раствора. Как известно, масса тела (m), его плотность (r) и объем (V) связаны соотношением m = r×V или V = m/r.
Тогда, масса 1 л раствора равна mр = rр×Vр = 1,105×1000 = 1105 г. По
определению массового процента, в 100 г раствора содержится 10 г соли, следовательно, в 1105 г (т. е. в 1 л) соответственно (1105×10)/100 = 110,5 г Al2(SO4)3. Молярная масса Al2(SO4)3М(Al2(SO4)3) = 342 г/моль. Таким образом, в 1 л раствора содержится n = 110,5/342 = 0.32 моля Al2(SO4)3 и молярная концентрация раствора С равна 0,32 моль/л, или 0,32 М.
2. Эквивалент молекулы Al2(SO4)3Э(Al2(SO4)3) = 1/6Al2(SO4)3. Соответственно 1 моль эквивалента составляет 1/6 часть моля Al2(SO4)3. Следовательно, в одном моле Al2(SO4)3 содержится 6 молей эквивалента Al2(SO4)3, а в 1 л раствора – nэкв = 0,32×6 = 1,92 молей эквивалента Al2(SO4)3 (nэкв = n×z, где nэкв – число молей эквивалента вещества, n – число молей вещества, z – эквивалентное число, в данном случае z = 6). Молярная концентрация эквивалента вещества Сэкв. (или нормальность) равна 1,92 моль/л или 1,92 н.
3. Поскольку выше было найдено, что в 1000 мл раствора содержится 110,5 г растворенного вещества, то в 1 мл находится 110,5/1000 = 0,1105 г Al2(SO4)3 и титр раствора Т = 0,1105 г/мл.
4. По условию в 100 г раствора содержится 10 г Al2(SO4)3 и 90 г Н2О. Тогда на 1000 г воды приходится (1000×10)/90 = 111,11 г Al2(SO4)3. Это составляет 111,11/342 = 0,325 моля. Следовательно, в 1000 г растворителя содержится 0,325 молей растворенного вещества, и моляльность раствора Сm, по определению, равна 0,325 моль/1000 г Н2О.
5. Из данных п. 1 следует, что в 1 л раствора содержится 1105-110,5 = 994,5 г воды. Это составляет 994,5/18 = 55,25 молей воды. Откуда молярная доля Al2(SO4)3 в растворе x = 0,32/(0,32 + 55,25) = 0,058.
infopedia.su
Расчеты при приготовлении водных растворов
Приблизительные растворы. При приготовлении приблизительных растворов количества веществ, которые должны быть взяты для этого, вычисляют с небольшой точностью. Атомные веса элементов для упрощения расчетов допускается брать округленными иногда до целых единиц. Так, для грубого подсчета атомный вес железа можно принять равным 56 вместо точного —55,847; для серы — 32 вместо точного 32,064 и т. д.
Вещества для приготовления приблизительных растворов взвешивают на технохимических или технических весах.
Принципиально расчеты при приготовлении растворов совершенно одинаковы для всех веществ.
Количество приготовляемого раствора выражают или в единицах массы (г, кг), или в единицах объема (мл, л), причем для каждого из этих случаев вычисление количества растворяемого вещества проводят по-разному.
Пример. Пусть требуется приготовить 1,5 кг 15%-ного раствора хлористого натрия; предварительно вычисляем требуемое количе-ство соли. Расчет проводится согласно пропорции:
т. е. если в 100 г раствора содержится 15 г соли (15%), то сколько ее потребуется для приготовления 1500 г раствора?
Расчет показывает, что нужно отвесить 225 г соли, тогда воды иужио взять 1500 — 225 = 1275 г. ¦
Если же задано получить 1,5 л того же раствора, то в этом случае по справочнику узнают его плотность, умножают последнюю на заданный объем и таким образом находят массу требуемого количества раствора. Так, плотность 15%-нoro раствора хлористого натрия при 15 0C равна 1,184 г/см3. Следовательно, 1500 мл составляет
Следовательно, количество вещества для приготовления 1,5 кг и 1,5 л раствора различно.
Расчет, приведенный выше, применим только для приготовления растворов безводных веществ. Если взята водная соль, например Na2SO4-IOh3O1 то расчет несколько видоизменяется, так как нужно принимать во внимание и кристаллизационную воду.
Пример. Пусть нужно приготовить 2 кг 10%-ного раствора Na2SO4, исходя из Na2SO4 *10h3O.
Молекулярный вес Na2SO4 равен 142,041, a Na2SO4*10h3O 322,195, или округленно 322,20.
Расчет ведут вначале па безводную соль:
Следовательно, нужно взять 200 г безводной соли. Количество десятиводной соли находят из расчета:
Воды в этом, случае нужно взять: 2000 — 453,7 =1546,3 г.
Так как раствор не всегда готовят с пересчетом на безводную соль, то на этикетке, которую обязательно следует наклеивать на сосуд с раствором, нужно указать, из какой соли приготовлен раствор, например 10%-ный раствор Na2SO4 или 25%-ный Na2SO4*10h3O.
Часто случается, что приготовленный ранее раствор нужно разбавить, т. е. уменьшить его концентрацию; растворы разбавляют или по объему, или по массе.
Пример. Нужно разбавить 20%-ный раствор сернокислого аммония так, чтобы получить 2 л 5%-иого раствора. Расчет ведем следующим путем. По справочнику узнаем, что плотность 5%-ного раствора (Nh5)2SO4 равна 1,0287 г/см3. Следовательно, 2 л его должны весить 1,0287*2000 = 2057,4 г. В этом количестве должно находиться сернокислого аммония:
Теперь можно подсчитать, сколько нужно взять 20%-ного рас* твора, чтобы получить 2 л 5%-ного раствора.
Полученную массу раствора можно пересчитать на объем его. Для этого массу раствора делят на его плотность (плотность 20%-ного раствора равна 1.1149 г/см3), т. е.
Учитывая, что при отмеривании могут произойти потери, нужно взять 462 мл и довести их до 2 л, т. е. добавить к ним 2000—462 = = 1538 мл воды.
Если же разбавление проводить по массе, расчет упрощается. Но вообще разбавление проводят из расчета на объем, так как жидкости, особенно в больших количествах, легче отмерить по объему, чем взвесить.
Нужно помнить, что при всякой работе как с растворением, так и с разбавлением никогда не следует выливать сразу всю воду в сосуд. Водой ополаскивают несколько раз ту посуду, в которой проводилось взвешивание или отмеривание нужного вещества, и каждый раз добавляют эту воду в сосуд для раствора.
Когда не требуется особенной точности, при разбавлении растворов или смешивании их для получения растворов другой концентрации можно пользоваться следующим простым и быстрым способом.
Возьмем разобранный уже случай разбавления 20%-ного раствора сернокислого аммония до 5%-ного. Пишем вначале так:
где 20 — концентрация взятого раствора, 0 — вода и 5’—-требуемая концентрация. Теперь из 20 вычитаем 5 и полученное значение пишем в правом нижнем углу, вычитая же нуль из 5, пишем цифру в правом верхнем углу. Тогда схема примет такой вид:
Это значит, что нужно взять 5 объемов 20%-ного раствора и 15 объемов воды. Конечно, такой расчет не отличается точностью.
Если смешивать два раствора одного и того же вещества, то схема сохраняется та же, изменяются только числовые значения. Пусть смешением 35%-ного раствора и 15%-ного нужно приготовить 25%-ный раствор. Тогда схема примет такой вид:
т. е. нужно взять по 10 объемов обоих растворов. Эта схема дает приблизительные результаты и ею можно пользоваться только тогда, когда особой точности не требуется.Для всякого химика очень важно воспитать в себе привычку к точности в вычислениях, когда это необходимо, и пользоваться приближенными цифрами в тех случаях, когда это не повлияет на результаты работы.Когда нужна большая точность при разбавлении растворов, вычисление проводят по формулам.
Разберем несколько важнейших случаев.
Приготовление разбавленного раствора. Пусть с — количество раствора, m%—концентрация раствора, который нужно разбавить до концентрации п%. Получающееся при этом количество разбавленного раствора х вычисляют по формуле:
а объем воды v для разбавления раствора вычисляют по формуле:
Смешивание двух растворов одного и того же вещества различной концентрации для получения раствора заданной концентрации. Пусть смешиванием а частей m%-ного раствора с х частями п%-ного раствора нужно получить /%-ный раствор, тогда:
Точные растворы. При приготовлении точных растворов вычисление количеств нужных веществ проверят уже с достаточной степенью точности. Атомные весы элементов берут по таблице, в которой приведены их точные значения. При сложении (или вычитании) пользуются точным значением слагаемого с наименьшим числом десятичных знаков. Остальные слагаемые округляют, оставляя после запятой одним знаком больше, чем в слагаемом с наименьшим числом знаков. В результате оставляют столько цифр после запятой, сколько их имеется в слагаемом с наименьшим числом десятичных знаков; при этом производят необходимое округление. Все расчеты производят, применяя логарифмы, пятизначные или четырехзначные. Вычисленные количества вещества отвешивают только на аналитических весах.
Взвешивание проводят или на часовом стекле, или в бюксе. Отвешенное вещество высыпают в чисто вымытую мерную колбу через чистую сухую воронку небольшими порциями. Затем из промывалки несколько раз небольшими порциями воды обмывают над воронкой бнже или часовое стекло, в котором проводилось взвешивание. Воронку также несколько раз обмывают из промывалки дистиллированной водой.
Для пересыпания твердых кристаллов или порошков в мерную колбу очень удобно пользоваться воронкой, изображенной на рис. 349. Такие воронки изготовляют емкостью 3, 6, и 10 см3. Взвешивать навеску можно непосредственно в этих воронках (негигроскопические материалы), предварительно определив их массу. Навеска из воронки очень легко переводится в мерную колбу. Когда навеска пересыпается, воронку, не вынимая из горла колбы, хорошо обмывают дистиллированной водой из промывалки.
Как правило, при приготовлении точных растворов и переведении растворяемого вещества в мерную колбу растворитель (например, вода) должен занимать не более половины емкости колбы. Закрыв пробкой мерную колбу, встряхивают ее до полного растворения твердого вещества. После этого полученный раствор дополняют водой до метки и тщательно перемешивают.
Молярные растворы. Для приготовления 1 л 1 M раствора какого-либо вещества отвешивают на аналитических весах 1 моль его и растворяют, как указано выше.
Пример. Для приготовления 1 л 1 M раствора азотнокислого серебра находят в таблице или подсчитывают молекулярную массу AgNO3, она равна 169,875. Соль отвешивают и растворяют в воде.
Если нужно приготовить более разбавленный раствор (0,1 или 0,01 M), отвешивают соответственно 0,1 или 0,01 моль соли.
Если же нужно приготовить меньше 1 л раствора, то растворяют соответственно меньшее количество соли в соответствущем объеме воды.
Нормальные растворы готовят аналогично, только отвешивая не 1 моль, а 1 грамм-эквивалент твердого вещества.
Если нужно приготовить полунормальный или децинормальный раствор, берут соответственно 0,5 или 0,1 грамм-эквивалента. Когда готовят не 1 л раствора, а меньше, например 100 или 250 мл, то берут1/10 или 1/4 того количества вещества, которое требуется для приготовления I л, и растворяют в соответствующем объеме воды.
Рис 349. Воронки для пересыпания навески а колбу.
После приготовления раствора его нужно обязательно проверить титрованием соответствующим раствором другого вещества с известной нормальностью. Приготовленный раствор может не отвечать точно той нормальности, которая задана. В таких случаях иногда вводят поправку.
В производственных лабораториях иногда готовят точные растворы «по определяемому веществу». Применение таких растворов облегчает расчеты при анализах, так как достаточно умножить объем раствора, пошедший на титрование, на титр раствора, чтобы получить содержание искомого вещества (в г) во взятом для анализа количестве какого-либо раствора.
Расчет при приготовлении титрованного раствора по определяемому веществу ведут также по грамм-эквиваленту растворяемого вещества, пользуясь формулой:
Пример. Пусть нужно приготовить 3 л раствора марганцовокислого калия с титром по железу 0,0050 г/мл. Грамм-эквивалент KMnO4 равен 31,61., а грамм-эквивалент Fe 55,847.
Вычисляем по приведенной выше формуле:
Стандартные растворы. Стандартными называют растворы с разными, точно определенными концентрациями, применяемые в колориметрии, например растворы, содержащие в 1 мл 0,1, 0,01, 0,001 мг и т. д. растворенного вещества.
Кроме колориметрического анализа, такие растворы бывают нужны при определении рН, при нефелометрических определениях и пр. Иногда стандартные растворы» хранят в запаянных ампулах, однако чаще приходится готовить их непосредственно перед применением. Стандартные растворы готовят в объеме не больше 1 л, а ча ще — меньше. Только при большом расходе стандартного раствори можно готовить несколько литров его и то при условии, что стандартный раствор не будет храниться длительный срок.
Количество вещества (в г), необходимое для получения таких растворов, вычисляют по формуле:
Пример. Нужно приготовить стандартные растворы CuSO4 • 5h3O для колориметрического определения меди, причем в 1 мл первого раствора должно содержаться 1 мг меди, второго — 0,1 мг, третьего —0,01 мг, четвертого — 0,001 мг. Вначале готовят достаточное количество первого раствора, например 100 мл.
В данном случае Mi = 249,68; АСu = 63,54; следовательно, для приготовления 100 мл раствора, 1 мл которого содержал бы 1 мг меди (Т = 0,001 г/мл), нужно взять
Навеску соли переносят в мерную колбу емкостью 100 мл и добавляют воду до метки. Другие растворы готовят соответствующим разбавлением приготовленного.
Эмпирические растворы. Концентрацию этих растворов чаще всего выражают в г/л или г/мл. Для приготовления эмпирических растворов применяют очищенные перекристаллизацией вещества или реактивы квалификации ч. д. а. или х. ч.
Пример. Нужно приготовить 0,5 л раствора CuSO4, содержашего Cu 10 мг/мл. Для приготовления раствора применяют CuSO4 • 5h3O.
Чтобы подсчитать, сколько следует взять этой солн для приготовления раствора заданного объема, подсчитывают, сколько Cu должно содержаться в нем. Для этого объем умножают на заданную концентрацию, т. е.
500*10 = 5000 мг, или 5,0000 г
После этого, зная молекулярный вес соли, подсчитывают нужное количество ее:
На аналитических весах отвешивают в бюксе точно 19,648 г чистой соли, переводят ее в мерную колбу емкостью 0,5 л. Растворение проводят, как указано выше.
К оглавлению
см. также
- Основные понятия о растворах
- Классификация растворов
- Концентрация растворов
- Техника приготовления растворов
- Расчеты при приготовлении водных растворов
- Растворы солей
- Растворы щелочей
- Растворы кислот
- Фиксаналы
- Некоторые замечания о титровании и точных растворах
- Расчеты при титровании с помощью весовых бюреток
- Рациональные величины
- Растворение жидкостей
- Растворение газов
- Индикаторы
- Автоматическое титрование
- Неводные растворы
- Растворение в органических растворителях
- Обесцвечивание растворов
www.himikatus.ru
Раствор заданной концентрации. Приготовление растворов заданной молярной и нормальной концентрации
Для приготовления растворов с заданной молярной или нормальной концентрацией используются мерные колбы — плоскодонные круглые колбы с узким горлом и пришлифованной стеклянной пробкой. Мерные колбы выпускаются различной вместимости: на 25, 50, 100, 200, 250, 500, 1000 и более миллилитров. Вместимость колбы, так же как и температура, которой она соответствует, указаны на самой колбе.
Мерной колбой пользуются и в тех случаях, когда необходимо разбавить раствор в строго определенное число раз, например из 0,5 н. раствора приготовить 0,1 н. Примеры приготовления растворов рассмотрены ниже.
Пример 1. Приготовить 250 мл 0,5 н. раствора сульфата алюминия, исходя из кристаллогидрата состава Аl 2 (SO 4) 3 * 18Н 2 0.
Рассчитывают массу соли, необходимую для приготовления заданного раствора, учитывая при этом и кристаллизационную воду. Это объясняется тем, что при приготовлении растворов, концентрация которых выражена в единицах нормальности или молярности, количество воды отдельно не вычисляется, а определяется, как об этом было сказало, ранее, общим объемом приготовляемого раствора, а, следовательно, вместимостью мерной колбы, взятой для приготовления раствора.
В 250 мл 0,5 н. раствора содержится 0,5 * 0,25 = 0,125 эквивалента Аl 2 (SO 4) 3 * 18Н 2 0. Эквивалентная масса Аl 2 (SO 4) 3 * 18Н 2 0 равна 1/6 молярной массы соли и составляет 666,42 / 6=111,07 г, следовательно, для приготовления раствора необходимо взять 111.07 * 0,125 = 13,88 г Аl 2 (SO 4) 3 * 18Н 2 0.
Рассчитанное количество соли отвешивают в маленьком стакане на 50 мл, массу которого предварительно определяют на аналитических или технохимических весах в зависимости от точности, с которой должен быть приготовлен раствор. При взвешивании стакана с навеской на технохимических весах массу следует округлить до 13 ,9 г.
Навеску растворяют в небольшом объеме воды в том же стакане, в котором производилось взвешивание, затем раствор переносят в мерную колбу на 250 мл. При переливании раствора из стакана в мерную колбу в горлышко мерной колбы вставляют небольшую воронку. Стакан несколько раз ополаскивают небольшими количествами воды, которую присоединяют к раствору, после чего содержимое колбы разбавляют до метки водой.
Разбавление можно вначале вести быстро, когда же уровень жидкости будет ниже метки на 0,5-1 см, добавлять воду следует по каплям, лучше всего небольшой пипеткой. Разбавление можно считать законченным, когда нижний мениск жидкости коснется метки. Затем колбу закрывают пробкой и перемешивают раствор, многократно переворачивая колбу, держа ее за горлышко правой рукой и придерживая пробку большим пальцем.
1.4 ОБЪЁМНЫЙ АНАЛИЗ
1.4.1 МЕТОД НЕЙТРАЛИЗАЦИИ
В основе метода нейтрализации лежит реакция соединения ион Н + кислых растворов с ионами ОН» щелочных растворов
Н + + ОН — = Н 2 O
Метод, нейтрализации применяется для количественного определения кислот, щелочей, а также солей, гидролизующихся в растворе образованием кислой или щелочной среды.
Рабочими растворами в этом методе являются растворы сильных кислот или сильных щелочей. Для определения щелочей чаще всего применяются 0,1 н растворы НСl или H 2 S0 4 , для определения кислот — 0,1 н растворы NaOH или КОН. Приготовить титрованные растворы указанных кислот и щелочей по навеске невозможно, так как эти вещества не отвечают требованиям, предъявляемым к исходным веществам. Поэтому титрование рабочих растворов при методе нейтрализации чаще всего бывает установленным. В качестве исходных веществ для установления титра кислот используют буру Na 2 B 4 0 7 -1ОН 2 О или химически чистую соду Na 2 C0 3 , а для установления титра щелочей — щавелевую кислоту Н 2 С 2 О 4 * 2H 2 O или янтарную кислоту. Н 2 С 4 Н 4 О 4 . При титровании сильной кислоты сильной щелочью (и наоборот) в точке эквивалентности среда раствора нейтральна, например:
К0Н + НСl = КСl + Н 2 0
В этом случае при достижении точки эквивалентности в растворе содержится только соль сильного основания и сильной кислоты и концентрация ионов водорода равна концентрации ионов гидроксила. Показатель рН такого раствора равен 7.
Однако не всегда при титровании кислот щелочами (и наоборот) точка эквивалентности совпадает с нейтральностью среды. Это объясняется гидролизом образующихся при титровании солей. При титровании слабой кислоты сильным основанием образующаяся соль, подвергавшаяся гидролизу, создает в точке эквивалентности щелочную среду; рН такого раствора > 7.
В качестве индикаторов в этом методе применяют различные органические вещества, которые изменяют свою окраску в зависимости от величины рН среды. Область значений рН раствора в которой происходит заметное (видимое) изменение окраски индикатора, называется областью перехода индикатора. Например, видимое изменение окраски метилового оранжевого происходит при рН от 3,1 до 4,4. Это означает, что если к раствору щелочи, к которому прибавлены 1-2 метилового оранжевого, постепенно добавлять раствор кислоты, то метиловый оранжевый порозовеет лишь только тогда, когда рН достигнет величины 4,4. Дальнейшее прибавление кислоты (уменьшение вызывает порозовение раствора и при рН = 3,1 раствор становится розовым. Дальнейшее прибавление кислоты заметного изменения окраски не вызывает.
Таким образом, при рН>4,4 метиловый оранжевый имеет желтую окраску, при рН=3,1 — розовую. В интервале же от рH=4,4 до рН=3,1 окраска его постепенно изменяется из желтой в розовую.
Другой широко используемый индикатор фенолфталеин при рН=8 и в кислой среде бесцветен, в щелочной среде имеет ярко-розовую окраску. Если к раствору щелочи, к которому прибавлено 1-2 капли фенолфталеина, постепенно прибавлять кислоту (реакция нейтрализации) то уже при рН=10 ярко-розовая окраска фенолфталеина бледнеть и при рН=8 рас обесцветится.
Для приготовления раствора с определенной м
vladyal.ru
РАСТВОРЫ. ПРИГОТОВЛЕНИЕ РАСТВОРОВ РАЗЛИЧНЫХ КОНЦЕНТРАЦИЙ
Теоретическая часть
Растворы – это однородные (гомогенные) системы, состоящие их двух и более компонентов (составных частей) и продуктов их взаимодействия.
Важной характеристикой любого раствора является его количественный состав, который выражается концентрацией.
Концентрацией раствора называют, количество растворенного вещества, содержащегося в определенном количестве раствора или растворителя.
Существуют различные способы выражения концентрации растворов: процентная (по массе), молярная, нормальная, титр, мольная доля, мольная концентрация.
Процентная концентрация (С % или W) определяет — процентное отношение массы растворенного вещества к общей массе раствора.
, где
– масса растворенного вещества
– общая масса раствора
Молярная масса или молярность ( ) выражается числом молей растворенного вещества, содержащегося в 1 литре раствора.
, где
– масса растворенного вещества,
– молярная масса растворенного вещества
– объем раствора (л)
Размерность –
Нормальная концентрация или нормальность ( ) выражается числом растворенного вещества, содержащегося в 1 литре раствора
, где
– масса растворенного вещества,
– эквивалентная масса растворенного вещества,
– объем раствора (л).
Размерность
Титр (Т) – это количество растворенного вещества в граммах, содержащихся в 1 мл раствора. Расчет титра в зависимости от нормальности производится по формуле:
, где
– нормальность раствора,
– эквивалентная масса растворенного вещества.
Размерность
Мольная доля ( ) – это отношение числа молей растворенного вещества – к сумме числа молей всех компонентов раствора ( ).
Мольная доля – безразмерная величина. Сумма мольных долей всех компонентов раствора всегда равна единице. ( )
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 1. Приготовление раствора заданной концентрации из навески
Этот способ применяется главным образом для приготовления растворов солей.
1. Получите у преподавателя номер вашего варианта (см. табл. 1)
2. Рассчитайте количество вещества, необходимое для приготовления раствора заданной концентрации, взвесьте его на технических весах с точностью до 0.01 г.
3. Рассчитайте необходимое количество воды (исходя из массы соли и концентрации раствора), отмерьте воду мерным цилиндром.
4. Возьмите плоскодонную колбу и через воронку осторожно перенесите в нее навеску соли. Воду, отмеренную для растворения, вылейте через воронку в колбу небольшими порциями так, чтобы всю соль с воронки смыть в колбу. Закройте пробкой колбу, встряхните её несколько раз, чтобы вся соль полностью растворилась.
5. Измерьте плотность полученного раствора ареометром и проверьте по таблице правильность приготовления раствора. Для этого перелейте приготовленный раствор в цилиндр и осторожно опустите ареометр. Затем выньте ареометр и промойте его под водопроводной водой.
Таблица 1
Варианты опыта
| Вари- ант | Объем раствора см3 | Концентрация раствора % масс | Плотность раствора K2Cr2O7 (p) г/см3 |
| 1,0052 | |||
| 1,0121 | |||
| 1,0193 | |||
| 1,0264 | |||
| 1,0336 | |||
| 1,0408 | |||
| 1,0051 |
Опыт 2. Определение процентной (масс) концентрации раствора и пересчет её на молярную и процентную концентрацию
Порядок проведения опыта
1. В стеклянный цилиндр с раствором соли (ваш вариант задачи) плавно опускают ареометр, так, чтобы он не касался стенок сосуда. Делают отсчет плотности.
2. В таблице 2. находят процентную концентрацию раствора. Если найденная плотность находится между двумя значениями в таблице, то процентную концентрацию находят интерполяцией по уравнению
где – процентная концентрация,
– плотность раствора,
– ближайшее меньшее значение плотности в таблице,
– ближайшее большее значение плотности в таблице,
– % – концентрация раствора с плотностью,
– % – концентрация раствора с плотностью.
По рассчитанной процентной концентрации определяют молярность и нормальность раствора.
где – рассчитанная процентная концентрация соли,
– соответствующая плотность,
– значение эквивалента соли,
– молярная масса соли.
Таблица 2
| NaCl | KCl | NH4Cl | CuSO4 | NaNO3 | |||||
| % масс | % масс | % масс | % масс | % масс | |||||
| 1,0053 1,0125 1,0268 1,0413 1,0559 1,0707 1,0857 1,1009 1,1162 1,1319 1,1478 | 1,0045 1,0108 1,0239 1,0369 1,0500 1,0633 1,0768 1,0905 1,1043 1,1185 1,1323 | 1,0013 1,0045 1,0107 1,0168 1,0227 1,0286 1,0344 1,0401 1,0457 1,0512 1,0567 | 1,009 1,019 1,040 1,062 1,084 1,107 1,131 1,155 1,180 1,206 – | 1,0049 1,0117 1,0254 1,0392 1,0532 1,0674 1,0819 1,0967 1,1118 1,1272 1,1426 |
Вопросы и задачи
1. Что называется концентрацией раствора и способы её выражения. Дать определение и показать на конкретных примерах.
2. Сколько грамм KCl следует растворить в 100 граммах воды для получения 5%- ного раствора.
3. Какова процентная концентрация раствора, полученного в результате растворения 90г вещества в 180 г воды?
4. В 240 мл воды растворили 80 г соли, плотность воды равна 1 г/мл. Какова процентная концентрация.
5. Что означает 1 н Ca(OH)2, PbCl2, AgNO3, 2 M Al(OH)3, KNO3, CaCl2. Покажите расчетами.
6. Рассчитать навеску K2Cr2O7 для приготовления 2% раствора объемом в 250 мл, плотность равна 1,0347 г/мл.
7. Сколько граммов Na2SO3 потребуется для приготовления 5 л 8%-ного раствора, плотность которого 1,075.
8. Чем объяснить устойчивость истинных растворов.
9. Чему равна молярность и нормальность 3%-ного раствора FeCl3, плотность 1,037 г/мл.
10. Дать определение растворам.
11. Раствор содержит смесь солей: AgNO3, Ba(NO3)2и Zn(CH3COO)2. К нему добавили избыток HCl. Написать ионные уравнения возможных реакций.
12. Написать уравнения ступенчатой диссоциации H2S. В каком направлении будут смещаться эти равновесия при добавлении HCl и NaOH?
13. На нейтрализацию 25 мл HCl неизвестной концентрации пошло 30 мл 0,1 н раствора NaOH. Вычислить нормальность и молярность, а также титр раствора HCl.
14. Попарно смешали растворы следующих веществ:
| а) NaCl + CH3COOH | г) NaClO + CH3COOH |
| б) NaCl + KOH | д) Na2SO4 + NaOH |
| в) MgCl2 + KOH | е) NaHSO4 + NaOH |
Между какими из указанных веществ возможны реакции обмена? Написать ионные реакции возможных реакций.
15. Какова нормальность 40%-ного раствора H2SO4 плотностью 1,3 г/см.
Лабораторная работа № 4
infopedia.su
