Окислительно-восстановительные реакции с участием органических веществ » HimEge.ru
В окислительно-восстановительных реакциях органические вещества чаще проявляют свойства восстановителей, а сами окисляются. Легкость окисления органических соединений зависит от доступности электронов при взаимодействии с окислителем. Все известные факторы, вызывающие увеличение электронной плотности в молекулах органических соединений (например, положительные индуктивный и мезомерные эффекты), будут повышать их способность к окислению и наоборот.
Склонность органических соединений к окислению возрастает с ростом их нуклеофильности, что соответствует следующим рядам:
Рост нуклеофильности в ряду
Рассмотрим окислительно-восстановительные реакции представителей важнейших классов органических веществ с некоторыми неорганическими окислителями.
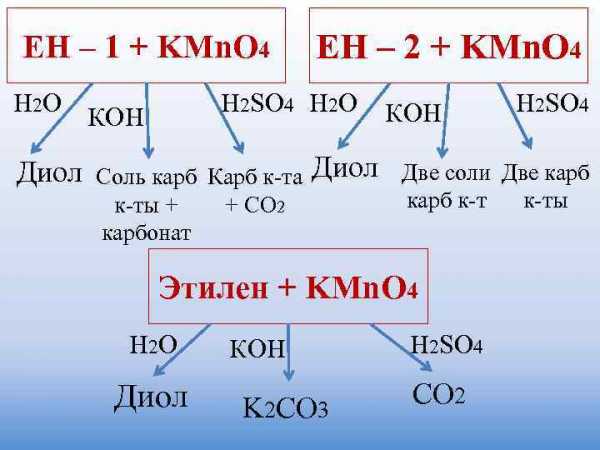
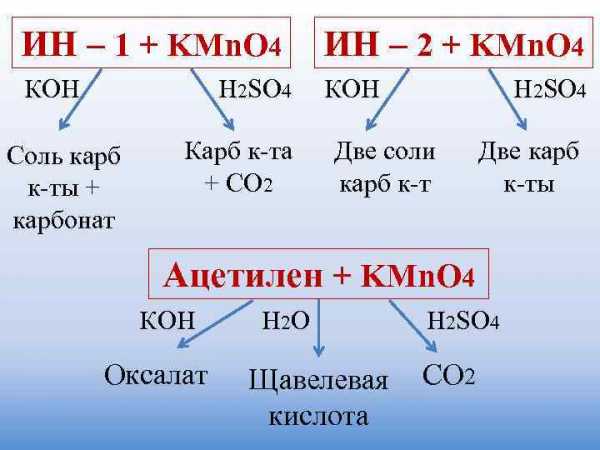
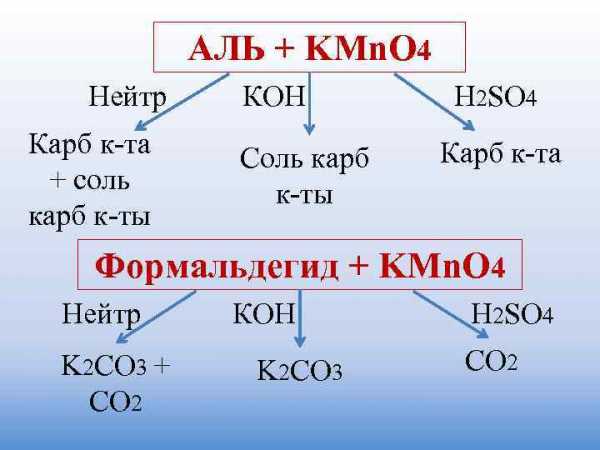
Окисление алкенов
При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде следующим образом:
3C2H4 + 2KMnO4 + 4H2O → 3CH2OH–CH2OH + 2MnO2 + 2KOH
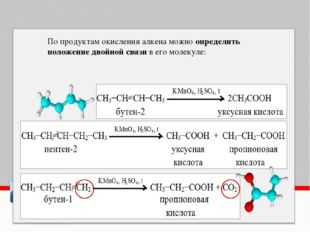
В более жестких условиях окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот (в сильно щелочной среде – двух солей) или кислоты и диоксида углерода (в сильно щелочной среде – соли и карбоната):
1) 5CH3CH=CHCH2CH3 + 8KMnO4 + 12H2SO4 → 5CH3COOH + 5C2H5COOH + 8MnSO4 + 4K2SO4 + 17H2O
2) 5CH3CH=CH2 + 10KMnO4 + 15H2SO4 → 5CH3COOH + 5CO2 + 10MnSO4 + 5K2SO4 + 20H2O
3) CH3
CH=CHCH2CH3 + 8KMnO4 + 10KOH → CH3COOK + C2H5COOK + 6H2O + 8K2MnO44) CH3CH=CH2 + 10KMnO4 + 13KOH → CH3COOK + K2CO3 + 8H2O + 10K2MnO4
Дихромат калия в сернокислотной среде окисляет алкены аналогично реакциям 1 и 2.
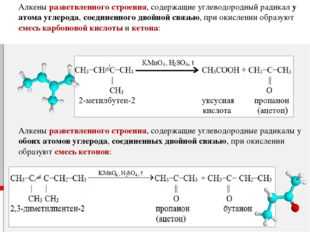
При окислении алкенов, в которых атомы углерода при двойной связи содержат по два углеродных радикала, происходит образование двух кетонов:
Окисление алкинов
Алкины окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи. Как и в случае алкенов, атомы-восстановители здесь – атомы углерода, связанные кратной связью. В результате реакций образуются кислоты и диоксид углерода. Окисление может быть проведено перманганатом или дихроматом калия в кислотной среде, например:
Ацетилен может быть окислен перманганатом калия в нейтральной среде до оксалата калия:
3CH≡CH +8KMnO4→ 3KOOC –COOK +8MnO2 +2КОН +2Н2О
В кислотной среде окисление идет до щавелевой кислоты или углекислого газа:
5CH≡CH +8KMnO4 +12H2SO4 → 5HOOC –COOH +8MnSO4 +4К2SO4 +12Н2О
CH≡CH + 2KMnO4 +3H2SO4 → 2CO2 + 2MnSO4 + 4H2O + K2SO4
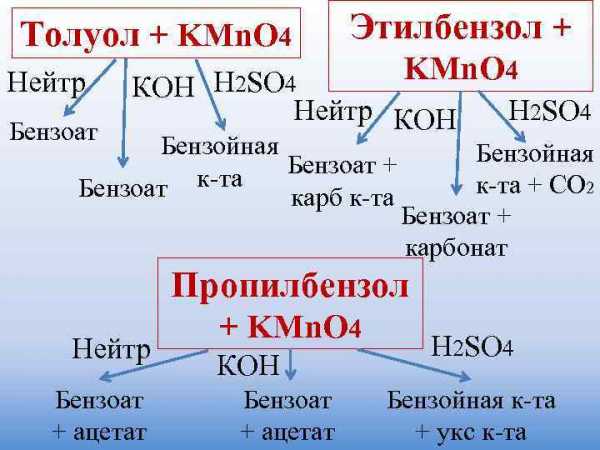
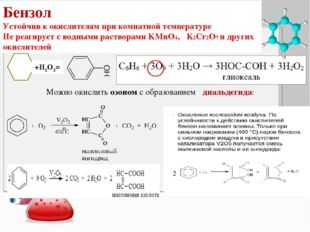
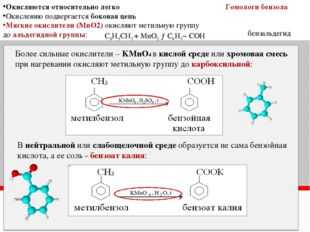
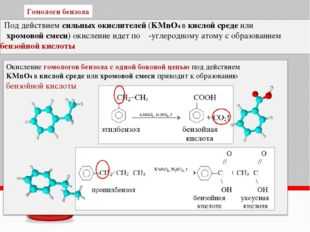
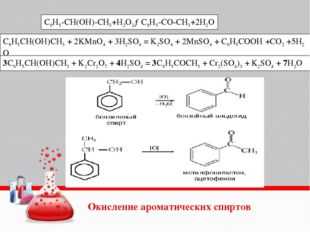
Окисление гомологов бензола
Бензол не окисляется даже в довольно жестких условиях. Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде до бензоата калия:
C6H5CH3 +2KMnO 4 → C6H5COOK + 2MnO2 + KOH + H2O
C6H5CH2CH3 + 4KMnO4 → C6H5COOK + K2CO3 + 2H2O + 4MnO2 + KOH
Окисление гомологов бензола дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты.
5С6Н5СН3+6КMnO4+9 H2SO4→ 5С6Н5СООН+6MnSO4 +3K2SO4 + 14H2O
5C6H5–C2H5 + 12KMnO4 + 18H2SO4 → 5C6H5COOH + 5CO2 + 12MnSO4 + 6K2SO4 + 28H2O

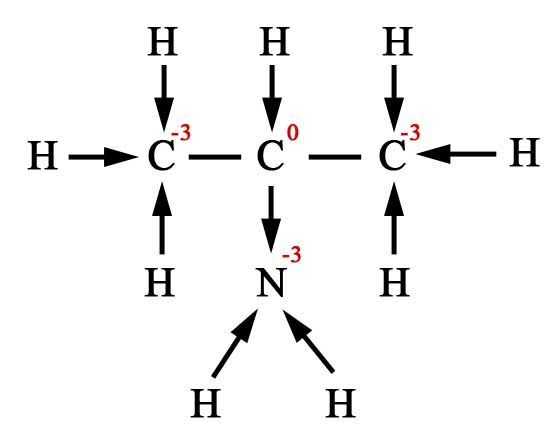
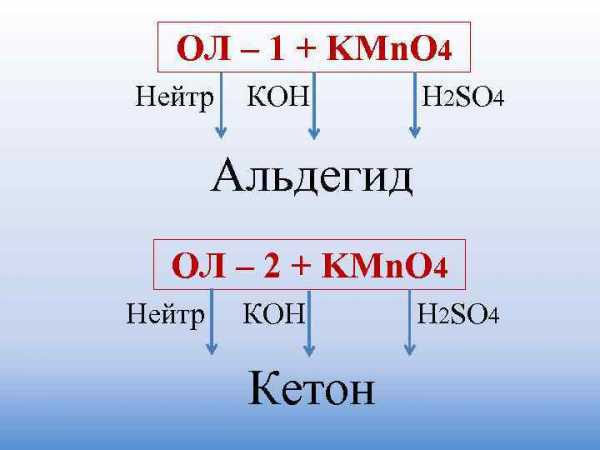
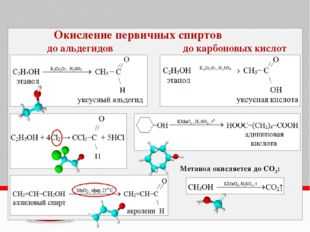
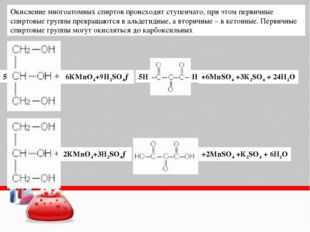
Окисление спиртов
Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
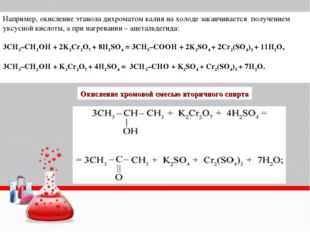
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3CHO + K2SO4 + Cr2(SO4)3 + 7H2O
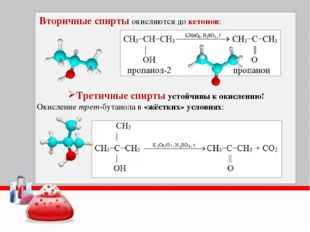
С избытком окислителя (KMnO4, K2Cr2O7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов.
5C2H5OH + 4KMnO4 + 6H2SO4 → 5CH3COOH + 4MnSO4 + 2K2SO4 + 11H2O
3CH3–CH2OH + 2K2
Cr2O7 + 8H2SO4 → 3CH3–COOH + 2K2SO4 + 2Cr2(SO4)3 + 11H2OТретичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа.
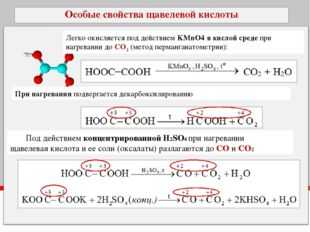
Двухатомный спирт, этиленгликоль HOCH2–CH2OH, при нагревании в кислой среде с раствором KMnO4 или K2Cr2O7 легко окисляется до щавелевой кислоты, а в нейтральной – до оксалата калия.
5СН2(ОН) – СН2(ОН) + 8КMnO4+12H2SO4→ 5HOOC –COOH +8MnSO4 +4К2SO4 +22Н2О
3СН2(ОН) – СН2(ОН) + 8КMnO4→ 3KOOC –COOK +8MnO2 +2КОН +8Н2О
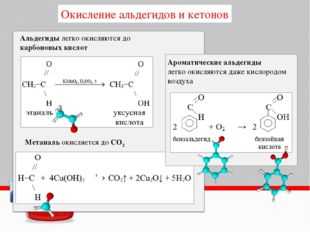
Окисление альдегидов и кетонов
Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO4, K
3CH3CHO + 2KMnO4 → CH3COOH + 2CH3COOK + 2MnO2 + H2O
3CH3CHO + K2Cr2O7 + 4H2SO4 → 3CH3COOH + Cr2(SO4)3 + 7H2O
CH3CHO + 2KMnO4 + 3KOH → CH3COOK + 2K2MnO4 + 2H2O
5CH3CHO + 2KMnO4 + 3H2SO4 → 5CH3COOH + 2MnSO4 + K2SO4 + 3H2O
CH3CHO + Br2 + 3NaOH → CH3COONa + 2NaBr + 2H2O
реакция «серебряного зеркала»
C аммиачным раствором оксида серебра альдегиды окисляются до карбоновых кислот которые в аммиачном растворе дают соли аммония (реакция «серебрянного зеркала»):
CH3CH=O + 2[Ag(NH3)2]OH → CH3COONH4 + 2Ag + H2O + 3NH3
CH3–CH=O + 2Cu(OH)2 → CH3COOH + Cu2O + 2H2O
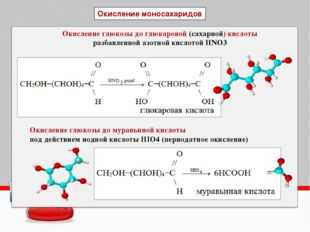
Муравьиный альдегид (формальдегид) окисляется, как правило, до углекислого газа:
5HCOH + 4KMnO4(изб) + 6H2SO4 → 4MnSO4 + 2K2SO4 + 5CO2 + 11H2O
3СН2О + 2K2Cr2O7 + 8H2SO4 → 3CO2 +2K2SO4 + 2Cr2(SO4)3 + 11H2O
HCHO + 4[Ag(NH3)2]OH → (NH4)2CO3 + 4Ag↓ + 2H2O + 6NH3
HCOH + 4Cu(OH)2 → CO2 + 2Cu
Кетоны окисляются в жестких условия сильными окислителями с разрывом связей С-С и дают смеси кислот:
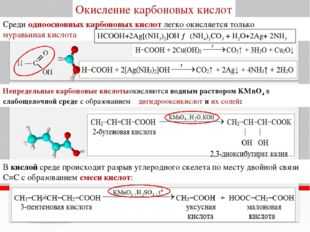
Карбоновые кислоты. Среди кислот сильными восстановительными свойствами обладают муравьиная и щавелевая, которые окисляются до углекислого газа.
НСООН + HgCl2 =CO2 + Hg + 2HCl
HCOOH+ Cl2 = CO2 +2HCl
HOOC-COOH+ Cl2 =2CO2 +2HCl
Муравьиная кислота, кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например:
2KMnO4 + 5HCOOH + 3h3SO4 → K2SO4 + 2MnSO4 + 5CO2↑ + 8h3O
При нагревании с сильными водоотнимающими средствами (h3SO4 (конц.) или P4O10) разлагается:
HCOOH →(t) CO↑ + h3O
Каталитическое окисление алканов:

Каталитическое окисление алкенов:
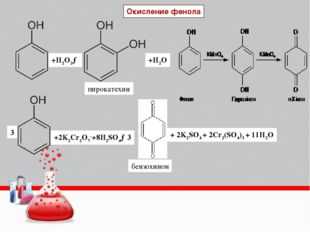
Окисление фенолов:
himege.ru
Тренировочные задания. Окислительно-восстановительные реакции с участием органических веществ
1. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
2. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
3. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
4. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
5. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
6. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
7. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
8. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
9. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
10. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
11. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
12. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
13. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
14. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
Ответы
Вы завершили курс по самостоятельной подготовке к ЕГЭ по химии. Если остались пробелы — закройте их с онлайн репетитором. Выбрать репетитора можно на сайте — http://profi-teacher.ru/school-predmety/repetitors-ximii/
himi4ka.ru
Урок «ОВР в органической химии»
Урок по теме:
«Окислительно-восстановительные реакции в органической химии»
Цель:
Формирование умения составлять уравнения окислительно-восстановительных процессов, идущих в стандартных условиях.
Сформировать систему понятий, которые будут усваиваться в процессе изучения данной темы.
На основании строения атома научить определять возможные степени окисления каждого элемента, т.е. все многообразие возможных состояний атомов.
Создать положительную мотивацию к изучению данного материала.
Использовать проблемные ситуации, решение, которых возможно с помощью действий, формирование которых намечено на данных занятиях.
Закрепить химические знания об окислительно-восстановительных реакциях.
Систематизировать сведения об окислителях.
Становить связь между строением органических веществ и их степени окисления.
Находить зависимость окислительно-восстановительной способности органического вещества от его строения.
Формировать умения устанавливать связь между классом органических веществ и окислением нужной силы, агрегатного состояния и механизма действия.
Формировать знания предсказывать условия проведения реакции и ожидаемые продукты окисления.
Задачи: обеспечить усвоение знаний в области ОВР; научить прогнозировать состав продуктов ОВР;
расширить умения решать задачи повышенной сложности
Тип урока: урок совершенствования знаний, умений и навыков
Вид урока: лекция (2 часа)
Методы приемов обучения: монологическое изложение материала (1 час), закрепление (2 час)
Ход урока:
Оргмомент.
Изложение материала
Среди разнообразных химических процессов, протекающих в окружающем мире, важное место занимают окислительно-восстановительные реакции. Процессы горения обеспечивают человечество энергией. Технологические процессы — органические и неорганические синтезы, получение металлов, электролиз- также связаны с ОВР. И в биологических процессах таких, как дыхание и фотосинтез, окислительно-восстановительные реакции играют существенную роль. Поэтому, прежде всего, необходимо научить учащихся выделять из всего многообразия химических реакций, протекающих в окружающем мире, окислительно-восстановительные процессы.
Степень окисления -формальный заряд, который можно прописать атому, считая, что он отдал или принял некоторое количество электронов.
Элемент в определенной степени окисления Э+n, Э—n. Для определения потенциальных степеней окисления атома сначала необходимо построить модель строения атома в виде электронных ячеек. Т.к. атомы отдают только валентные электроны, то следующий шаг — выделение в структуре атома валентных электронов. Затем определить число валентных электронов и положение в периодической системе — группу и подгруппу.
С+4)2)2
Из электронной структуры следует:
-атом элемента главной подгруппы IV группы отдает и принимает электроны. Максимально может быть отдано 4 электрона. Однако в атоме имеются 2 спаренных s- и 2 не спаренных p-электрона, а затем еще и 2 s- электрона. Максимально можно определить 4 электрона.
-углерод имеет степени окисления :-4,-2,-3,0,+1,+2,+3,+4.
Окислительно-восстановительная реакция- это процесс, в котором одновременно происходит и окисление и восстановление атомов элементов в различных степенях окисления или окислительно-восстановительные реакции- это химические реакции, в которых происходит перенос электронов от одних частиц (атомы, радикалы, ионы, молекулы) к другим частицам.
В ходе химической реакции идет перенос электронов, следовательно, возникает электрический ток, который характеризуется силой и разностью потенциалов. Раз есть переход электронов от атомов одного элемента к атомам другого, следовательно, изменяются степени окисления элементов.
В качестве упражнений для распознавания окислительно-восстановительного процесса можно задать упражнения:
При фотосинтезе электроны перемещаются от одного вещества к другому. Является ли данный процесс окислительно-восстановительным?
В различных бытовых приборах используют аккумуляторы. К какому типу процессов относятся реакции, протекающие в аккумуляторах?
Подавляющее большинство животных используют кислород воздуха для окисления органических веществ. Что можно сказать об изменении степеней окисления атомов кислорода в этих процессах?
При сжигании ископаемого топлива в атмосферу выбрасывается огромное количество углекислого газа, оксидов серы и оксидов азота. Эти вещества растворяются в атмосферных осадках и в виде кислотных дождей выпадают на землю. Какие из описанных процессов являются окислительно-восстановительными, а какие нет?
Расскажите, какие процессы, протекающие в окружающем мире, являются окислительно-восстановительными?
Можно ли отнести дыхание животных к окислительно-восстановительному процессу?
Электроны не могут исчезать в никуда и появляться ниоткуда, т.е. число электронов, принятых в процессе восстановления, должно быть равно числу электронов, отданных, в процессе окисления. Такое равновесие называется электронным балансом. Процедура уравнения числа отданных и принятых электронов называется составление электронного баланса.
Для составления электронного баланса находят наименьшее общее кратное и коэффициент, для каждой полуреакции, представляющий собой наименьшее общее кратное на число электронов, перемещенных в данной полуреакции.
Число атомов, вступивших в реакцию, должно быть равно числу атомов, получившихся в результате реакции. Такое равновесие называется материальным балансом.
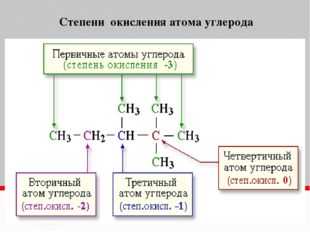
Определение степени окисления атомов в органических веществах.
Степень окисления любого атома углерода в органических веществах равна алгебраической сумме всех его связей с атомами более электроотрицательных элементов (хлор, кислород, сера, азот и др.), учитываемых со знаком «+», и связей с атомами водорода (или другого более электроположительного элемента), учитываемых со знаком «-«. При этом связи с соседними атомами углерода не учитываются.
Определим степени окисления атомов углерода в молекулах пропана и этанола:
+1 -3
-2 +1
-3 +1
-3 +1
-1 +1
-2 +1
-4 +1
-2 +1 -1
-4 +1 +1
+4 -1
-1 +1
Н3С-
СН2—
СН3;
СН3—
СН2—
ОН;
СН4;
CH3CI;
CH3Li;
CCI4;
C 2 H2
При определении степени окисления по электронной формуле допускаются полное смещение обобщенных электронов полярных связей к более электроотрицательному атому и делят поровну обобщенные электроны неполярных связей между атомами углерода. После этого сравнивают по числу электронов во внешнем слое каждый атом в соединении и нейтральный атом искомого элемента. Если число электронов в атоме элемента в соединении больше, чем в нейтральном, его степень окисления отрицательная, а его значение равно разности между числом электронов в данных атомах. В противном случае степень окисления положительная.
Составление уравнений окислительно-восстановительного реакций затрудняется содержанием нескольких атомов углерода в молекуле.
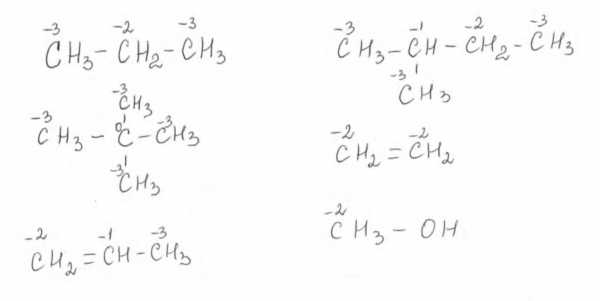
Генетическая связь между классами органических соединений представляется как ряд окислительно-восстановительных реакций, обеспечивающих переход от одного класса органических соединений к другому. Завершают его продукты полного окисления (горения) любого из представителей класса органических соединений.
При переходе от одного класса органических соединений к другому и увеличении степени разветвленного углеродного скелета молекул соединений внутри отдельного класса степень окисления атома углерода, ответственного за восстанавливающую способность соединения, изменяется. Органические вещества, в молекулах которых содержатся атомы углерода с максимальными положительными и отрицательными значениями степени окисления (-4,-3,+2,+3), вступают в реакцию полного окисления-горения, но устойчивы к действиям мягких окислителей и окислителей средней силы. Вещества, в молекулах которых содержатся атомы углерода в степени окисления -1,0,+1 окисляются легко, восстановительные способности их близки, поэтому их неполное описание может быть достигнуто за счет одного из известных окислителей малой и средней силы. Эти вещества могут проявлять двойственную природу, выступая и в качестве окислителя.
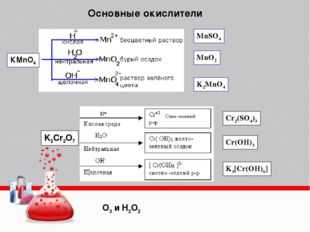
Окислители органических соединений.
К окислителям органических соединений относятся в первую очередь вещества неорганической природы:
По агрегатному состоянию:
-газообразные: (О2, О3)
-жидкие ( Ag2O/NH3, Cu (OH)2, H2O2, KMnO4 (раствор), KMnO4+H2SO4 (РАСТВОР), KMnO4+H2SO4 (КОНЦ.), H2SO4 (КОНЦ.), HNO3, K2Cr2O7 + H2SO4 (КОНЦ.)
-твердые: KMnO4, K2Cr2O7, CrO3
II. Окислители органической природы (Pb(СH3 COO)4, HCOOH (надмуравьиная кислота), CH3 COOH (надуксусная кислота), (CH3)2 SO.
III.-Мягкие окислители применяют для окисления органических соединении, содержащих кратные связи С=С, С=О, где степень окисления активного углерода от -1 до +1 и +1 до +3 (окисление алкенов, алкинов, альдегидов).
-Окислители средней силы работают, окисляя вторичные спирты до кетонов (степень окисления изменяется от 0 до +2), альдегиды – до карбоновых кислот (-1 до +3), алкены – до кетонов и карбоновых кислот (-1 до +2,+3).
-Жесткие окислители разрушают органические вещества со степенью окисления +4 до -2 до продуктов со степенями окисления +3,+4 и до простого вещества углерода. В этом случае процесс называется осмолением.
-Жидкие окислители чаще используют для окисления жидких органических веществ и применяют в лаборатории.
Классификация реакций окисления.
Горение CnH2n+2+O2 при температуре равной 300-350 0С протекает при высокой скорости. При нагревании происходит разрыв связей С-Н, С-С, О=О (Н.Н. Семенов).
Жидкофазное окисление CnH2n+2 CnH2n+1ОН, которые под действием серной кислоты превращаются в алкилсульфаты – синтетические моющие средства (температура 200 0C в присутствии марганцевых катализаторов (способ А.Н. Башкирова)), при этом углеродная цепь становится у спирта меньше.
Твердофазное окисление (окислительная деструкция) наблюдается при старении полиолефинов под действием атмосферного кислорода.
Все три процесса – радикально-цепные, автокаталитические.
Механизм реакции окисления органических соединений.
Радикальное расщепление при температуре 300-350 0С реализуется при разрыве связей С-Н, С-С. Инициирование может быть осуществлено нагреванием (горением), действием пероксида водорода, окислительных реагентов (раствор перманганата калия), лучи:
R-R R + R
R-H R + H
Рост цепи:
R+ О2 ROO
ROO+RH ROOH + R
RH +ROOH R+ RO+H2O (разветвленный автокаталитический)
Пероксидный радикал- ключевой при окислении CnH2n+2 кислородом. В результате образуются продукты окисления: спирты, простые эфиры, сложные эфиры, угарный или углекислый газы, вода:
RCOO R + CO2
ROO RCHO+ HO
HO +RH R+ H2O
R + RO R-O-R
Степень окисления углерода изменяется от -4,-3 до +1,+4.
Каталитическое и хемоселективное окисление органических соединений.
Каталитическое окисление или окисление в присутствии катализаторов лишь увеличивают скорость прохождения процесса окисления, снижая энергию разрыва связей С-С, Н-Н, способствуют максимальному выходу необходимого продукта окисления (1).
Под хемоселективным окислением понимают способность ряда окислителей избирательно воздействовать на определенные функциональные группы, при этом, не затрагивая другие имеющиеся в молекуле соединения, способные к окислительно-восстановительному процессу. Для окисления альдегидов применяют азотную кислоту (25 % окисляет альдегидные и первичные спиртовые группы (2)).
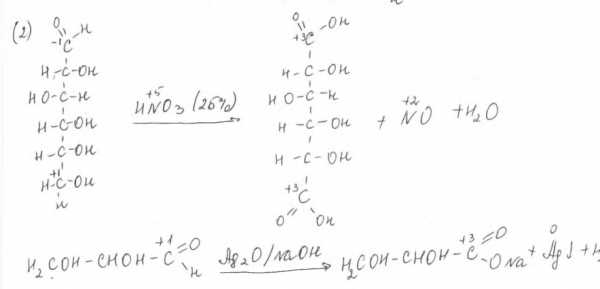
Особенности природы ми строения органических соединений обуславливают специфичность протекания ряда реакций с их участием (3).
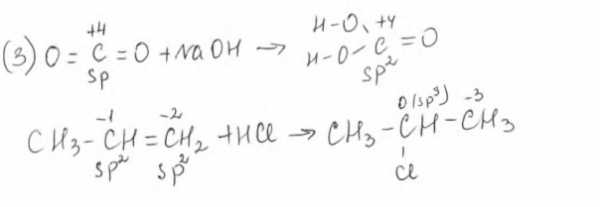
Все химические реакции сопровождаются перестройкой электронных оболочек атомов реагирующих веществ.
Реакции разложения сложных неорганических соединений на менее сложные относятся электроностатическим (4).
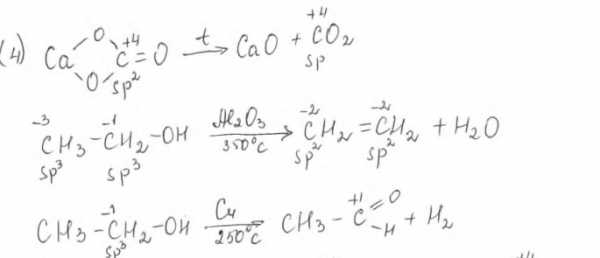
На характер получающихся в окислительно-восстановительной реакции веществ оказывает влияние среда. При окислении алкенов перманганатом калия в нейтральной среде, в результате разрыва пи-связи и присоединения гидроксильных групп образуются двухатомные спирты (5).
Под действием перманганата калия и серной кислоты при нагревании происходит разрыв пи- и сигма-связи и образуются карбонильные соединения.
Оба атома углерода в исходном алкане выполняют роль восстановителей и в ходе реакции окисляются. Необходимо установить, на сколько единиц изменяются степени окисления атомов углерода и марганца.
Многие спирты при контакте с кислородом окисляются до кислот:
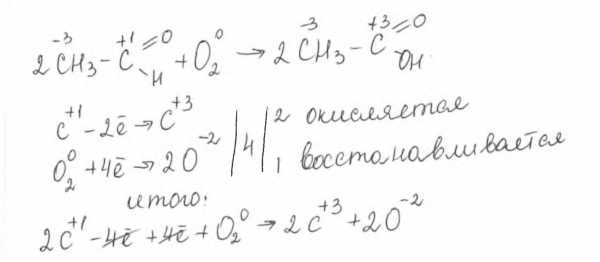
или восстанавливаются:
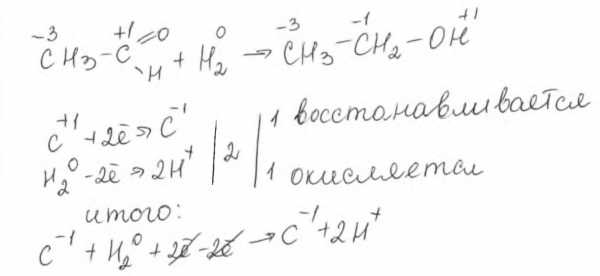
Реакция Канниццаро:
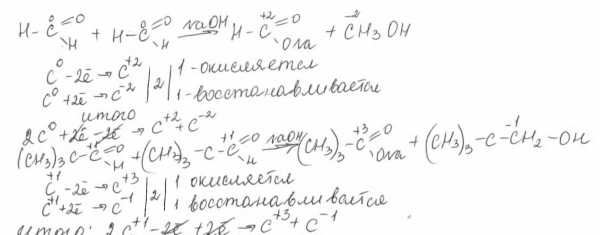
Закрепление
Решение заданий
В схеме электронного перехода с участием органического вещества указываем число отданных и принятых атомов кислорода и водорода.


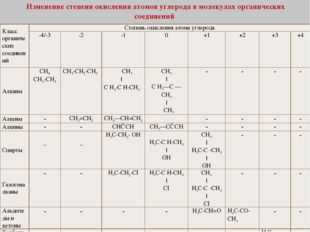
| Класс органических соединений | Степень окисления атома углерода | |||||||
| -4,-3 | -2 | -1 | 0 | +1 | +2 | +3 | +4 | |
| Алканы | первичные | вторичные | третичные | четвертичные | — | — | — | — |
| Алкены | — | первичные | вторичные | третичные | — | — | — | — |
| Алкины | — | — | первичные | вторичные | — | — | — | — |
| Спирты | — | — | СН3 –СН2-ОН | СН3—СН(ОН)-СН3 | СН3—С(СН3)(ОН)-СН3 | — | — | — |
| Галогеналканы | — | — | СН3 –СН2-CI | СН3—СН(CI)-СН3 | СН3—С(СН3)(CI)-СН3 | — | — | — |
| Альдегиды и кетоны | — | — | — | — | СН3 –СН=O | СН3 –С— СН3 O | — | — |
| Карбоновые кислоты | — | — | — | — | — | — | R-C-OOH | — |
| Сложные эфиры | — | — | — | — | — | — | CH3 –CO-O-CH3 | — |
| Амида | — | — | — | — | — | — | CH3 –CONH2 | — |
| Продукт полного сгорания | — | — | — | — | — | — | — | CO2 |
infourok.ru
| Почему учителям и воспитателям следует проходить курсы повышения квалификации и профессиональной переподготовки в учебном центре «Инфоурок» ?• Огромный каталог: 677 курсов профессиональной переподготовки и повышения квалификации;• Очень низкая цена, при этом доступна оплата обучения в рассрочку – первый взнос всего 10%, оставшуюся часть необходимо оплатить до конца обучения; • Курсы проходят полностью в дистанционном режиме (форма обучения в документах не указывается); • Возможность оплаты курса за счёт Вашей организации. • Дипломы и Удостоверения от проекта «Инфоурок» соответствуют всем установленным законодательству РФ требованиям. (Согласно ФЗ «Об образовании в Российской Федерации» от 2012 года). |
infourok.ru
овр в органике
Documents войти Загрузить ×- Естественные науки
- Химия
Related documents

Маршрутный лист обучающихся Проблемная тема урока: «Кто-то теряет, а кто-то находит» Почему?

Типы химических реакций

Системный анализ и управление» (2010

Тема: Окислительно-восстановительные реакции.

Степень окисления и валентность

ОФО ЗФО ХИМИЯ ВОПРОСЫ К ЭКЗАМЕНАМ И ЗАДАЧИ 1

подборка тестов по химии

антиокислительные свойства фенольных соединений

a5 zadania

Классификация и изомерия органических соединений
Скачать advertisementstudydoc.ru
ОВР с участием органических веществ
ОВР с участием органических веществ
В ОВР органических веществ с неорганическими органические вещества чаще всего являются восстановителями. Так, при сгорании органического вещества в избытке кислорода всегда образуется углекислый газ и вода. Сложнее протекают реакции при использовании менее активных окислителей. В этом параграфе рассмотрены только реакции представителей важнейших классов органических веществ с некоторыми неорганическими окислителями.
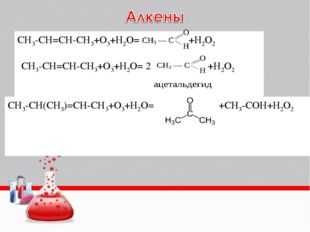
Алкены. При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде следующим образом:
C2 H4 + 2KMnO4 + 2H2 O
CH2 OH–CH2 OH + 2MnO2 + 2KOH (охлаждение)В более жестких условиях окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот (в сильно щелочной среде – двух солей) или кислоты и диоксида углерода (в сильно щелочной среде – соли и карбоната):
1) 5CH3 CH=CHCH2 CH3 + 8KMnO4 + 12H2 SO4
5CH3 COOH + 5C2 H5 COOH + 8MnSO4 + 4K2 SO4 + 17H2 O (нагревание)2) 5CH3 CH=CH2 + 10KMnO4 + 15H2 SO4
5CH3 COOH + 5CO2 + 10MnSO4 + 5K2 SO4 + 20H2 O (нагревание)3) CH3 CH=CHCH2 CH3 + 6KMnO4 + 10KOH
CH3 COOK + C2 H5 COOK + 6H2 O + 6K2 MnO4 (нагревание)4) CH3 CH=CH2 + 10KMnO4 + 13KOH
CH3 COOK + K2 CO3 + 8H2 O + 10K2 MnO4 (нагревание)Дихромат калия в сернокислотной среде окисляет алкены аналогично реакциям 1 и 2.
Алкины. Алкины начинают окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи. Как и в случае алканов, атомы-восстановители здесь – атомы углерода, связанные в данном случае тройной связью. В результате реакций образуются кислоты и диоксид углерода. Окисление может быть проведено перманганатом или дихроматом калия в кислотной среде, например:
5CH3 C
CH + 8KMnO4 + 12H2 SO45CH3 COOH + 5CO2 + 8MnSO4 + 4K2 SO4 + 12H2 O (нагревание)Иногда удается выделить промежуточные продукты окисления. В зависимости от положения тройной связи в молекуле это или дикетоны (R1 –CO–CO–R2 ), или альдокетоны (R–CO–CHO).
Ацетилен может быть окислен перманганатом калия в слабощелочной среде до оксалата калия:
3C2 H2 + 8KMnO4 = 3K2 C2 O4 +2H2 O + 8MnO2 + 2KOH
В кислотной среде окисление идет до углекислого газа:
C2 H2 + 2KMnO4 +3H2 SO4 =2CO2 + 2MnSO4 + 4H2 O + K2 SO4
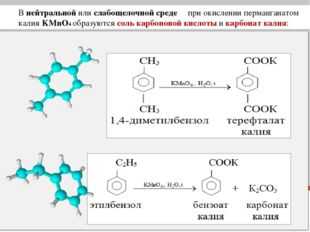
Гомологи бензола. Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде до бензоата калия:
C6 H5 CH3 +2KMnO4 = C6 H5 COOK + 2MnO2 + KOH + H2 O (при кипячении)
C6 H5 CH2 CH3 + 4KMnO4 = C6 H5 COOK + K2 CO3 + 2H2 O + 4MnO2 + KOH (при нагревании)
Окисление этих веществ дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты.
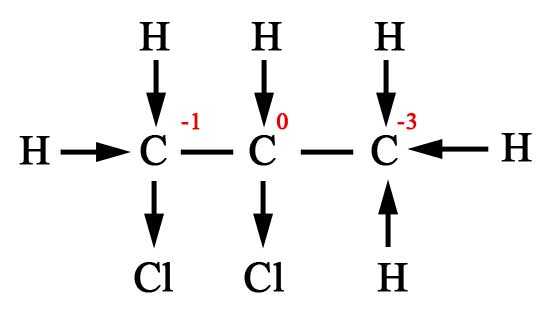
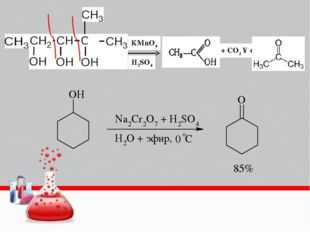
Спирты. Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
3C2 H5 OH + K2 Cr2 O7 + 4H2 SO4 = 3CH3 CHO
+ K2 SO4 + Cr2 (SO4 )3 + 7H2 O (нагревание)С избытком окислителя (KMnO4 , K2 Cr2 O7 ) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов. Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа. Все реакции идут при нагревании.
Двухатомный спирт, этиленгликоль HOCH2 –CH2 OH, при нагревании в кислотной среде с раствором KMnO4 или K2 Cr2 O7 легко окисляется до углекислого газа и воды, но иногда удается выделить и промежуточные продукты (HOCH2 –COOH, HOOC–COOH и др.).
Альдегиды. Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO4 , K2 Cr2 O7 , [Ag(NH3 )2 ]OH. Все реакции идут при нагревании:
3CH3
CHO + 2KMnO4
= CH3
COOH + 2CH3
COOK + 2MnO2
+ H2
O
3CH3
CHO + K2
Cr2
O7
+ 4H2
SO4
= 3CH3
COOH + Cr2
(SO4
)3
+ 7H2
O
CH3
CHO + 2[Ag(NH3
)2
]OH = CH3
COONH4
+ 2Ag + H2
O + 3NH3
Формальдегид с избытком окислителя окисляется до углекислого газа.
mirznanii.com
Окислительно-восстановительные реакции в органической химии
Теория ОВР в органической химии
Окисление органических веществ. Зависимость продуктов реакции окисления органических веществ от среды. Применение метода электронного баланса в органических реакциях.
Окислительно-восстановительные реакции с участием органических веществ встречаются в заданиях С3 и вызывают наибольшие затруднения у школьников. Как правило, большинство выпускников пишут схемы окислительно-восстановительных реакций, показывая окислитель [O], не указывая продукты ОВР, кроме основного; вызывает затруднение и расстановка коэффициентов в органических ОВР.
Мы рассмотрим:
Графический метод определения степени окисления в органических веществах;
Окислительно-восстановительные реакции с участием органических веществ, их разновидности, определение продуктов;
Метод макроподстановки при расставлении коэффициентов в органических ОВР
1. Графический метод определения степени окисления в органических веществах
В органических веществах можно определять степени окисления элементов алгебраическим методом, при этом получается усредненное значение степени окисления. Этот метод наиболее применим в том случае, если все атомы углерода органического вещества по окончании реакции приобрели одинаковую степень окисления (реакции горения или полного окисления)
Рассмотрим такой случай:
Пример 1. Обугливание дезоксирибозы серной концентрированной кислотой с дальнейшим окислением:
С5Н10О4 + H2SO4 CO2 + H2O + SO2
Найдём степень окисления углерода х в дезоксирибозе: 5х + 10 – 8 = 0; х = — 2/5
В электронном балансе учитываем все 5 атомов углерода:
5С -2/5 – 22е 5С+4 2 1
Окисление
S+6 + 2е S+4 22 11
восстановление
С5Н10О4 + 11H2SO4 5CO2 + 16H2O + 11SO2
В большинстве случаев окислению подвергаются не все атомы органического вещества, а только некоторые. В этом случае в электронный баланс вносятся только атомы, изменившие степень окисления, а, следовательно, нужно знать степень окисления каждого атома. Легче всего это сделать графическим методом:
1) изображается полная структурная формула вещества;
2) по каждой связи стрелкой показывается смещение электрона к наиболее электроотрицательному элементу;
3) все связи С – С считаются неполярными;
4) далее ведется подсчет: сколько стрелок направлено к атому, столько «–» , сколько от атома – столько «+». Сумма «–» и «+» определяет степень окисления атома. Рассмотрим несколько примеров:
Н
Н С С О
Н О Н
Углерод карбоксильной группы смещает от себя 3 электрона, его степень окисления +3, углерод метильного радикала притягивает к себе 3 электрона от водорода, его степень окисления – 3.
Cl
Н С С О
H H
Углерод альдегидной группы отдает 2 электрона (+2) и притягивает к себе 1 электрон ( — 1), итого степень окисления углерода альдегидной группы +1. Углерод радикала притягивает 2 электрона от водорода (-2) и отдает 1 электрон хлору (+1), итого степень окисления этого углерода -1.
Н Н
Н С С С ≡ С Н
Н Н
У первого углерода (начинаем считать справа) степень окисления -1, у второго 0, так как мы считаем все связи углерод-углерод неполярными, у третьего – 2, у четвертого – 3.
2. Окислительно-восстановительные реакции с участием органических веществ, их разновидности, определение продуктов
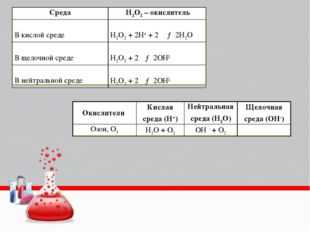
Все ОВР в органике можно условно разделить на 3 группы:
Полное окисление и горение. В качестве окислителей используются кислород (другие вещества, поддерживающие горение, например оксиды азота), концентрированные азотная и серная кислота, можно использовать твердые соли, при нагревании которых выделяется кислород (хлораты, нитраты, перманганаты и т.п.), другие окислители (например, оксид меди (II)). В этих реакциях наблюдается разрушение всех химических связей в органическом веществе. Продуктами окисления органического вещества являются углекислый газ и вода.
Мягкое окисление. В этом случае не происходит разрыва углеродной цепи. К мягкому окислению относится окисление спиртов до альдегидов и кетонов, окисление альдегидов до карбоновых кислот, окисление алкенов до двухатомных спиртов (Реакция Вагнера), окисление ацетилена до оксалата калия, толуола – до бензойной кислоты и т.д. В качестве окислителей в этих случаях используются разбавленные растворы перманганата калия, дихромата калия, азотной кислоты, аммиачный раствор оксида серебра, оксид меди (II), гидроксид меди (II).
Пример 2. Окисление этилена водным раствором перманганата калия при обычных условиях (реакция Вагнера) :
CH2=CH2 + KMnO4 + H2O HO-CH2-CH2-OH + MnO2 + KOH
Степень окисления углерода в этилене – 2, в этиленгликоле – 1. В балансе учитываем оба атома углерода, так как они соединены неполярной связью.
2С -2 – 2е 2С-1 3 восстановитель
Окисление
Mn+7 + 3е Mn+4 2 окислитель
Восстановление
3CH2=CH2 + 2KMnO4 + 4H2O 3HO-CH2-CH2-OH + 2MnO2 + 2KOH
Пример 3. Окисление этаналя подкисленным раствором перманганата калия при нагревании :
CH3-CHО + KMnO4 + H2SO4 CH3-COOH + MnSO4+ K2SO4 + H2O
Степень окисления углерода в альдегидной группе +1, в карбоксильной группе +3, это используем в балансе, метильный радикал в реакции не участвовал, его не имеет смысла учитывать.
С+1 – 2е С+3 5 восстановитель
Окисление
Mn+7 + 5е Mn+2 2 окислитель
Восстановление
5CH3-CHО + 2KMnO4 + 3H2SO4 5CH3-COOH + 2MnSO4+ K2SO4 + 3H2O
Деструктивное окисление. Происходит в более жестких условиях, чем мягкое окисление, сопровождается разрывом некоторых углерод-углеродных связей. В качестве окислителей используются более концентрированные растворы перманганата калия, дихромата калия при нагревании. Среда этих реакций может быть кислой, нейтральной и щелочной. От этого будут зависеть продукты реакций.
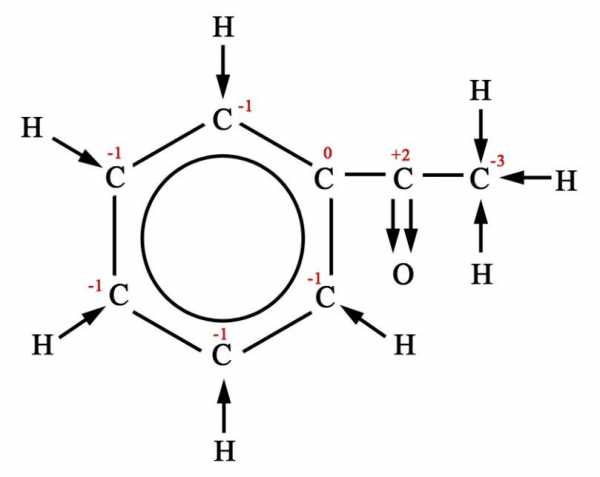
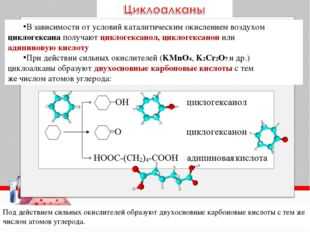
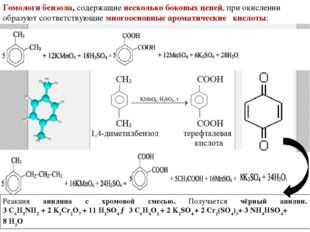
Деструкция (разрыв углеродной цепи) происходит у алкенов и алкинов – по кратной связи, у производных бензола – между первым и вторым атомами углерода, если считать от кольца, у третичных спиртов – у атома, содержащего гидроксильную группу, у кетонов – у атома при карбонильной группе. Если при деструкции оторвался фрагмент, содержащий 1 атом углерода, то он окисляется до углекислого газа (в кислой среде), гидрокарбоната и (или) карбоната (в нейтральной среде), карбоната (в щелочной среде). Все более длинные фрагменты превращаются в кислоты (в кислой среде) и соли этих кислот (в нейтральной и щелочной среде). В некоторых случаях получаются не кислоты, а кетоны (при окислении третичных спиртов, разветвленных радикалов у гомологов бензола, у кетонов, алкенов).
Ниже в схемах представлены возможные варианты окисления производных бензола в кислой и щелочной среде. Разными цветами выделены атомы углерода, участвующие в окислительно-восстановительном процессе. Выделение цветом позволяет проследить «судьбу» каждого атома углерода.
Схема 1. Окисление производных бензола в кислой среде
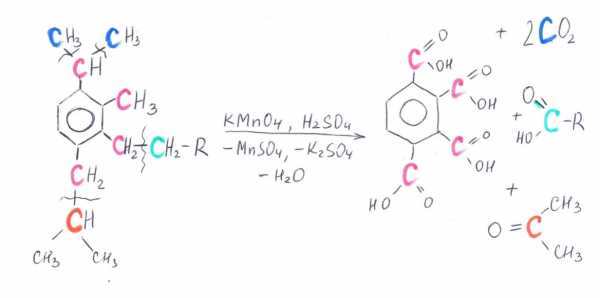
Схема 2. Окисление производных бензола в щелочной среде
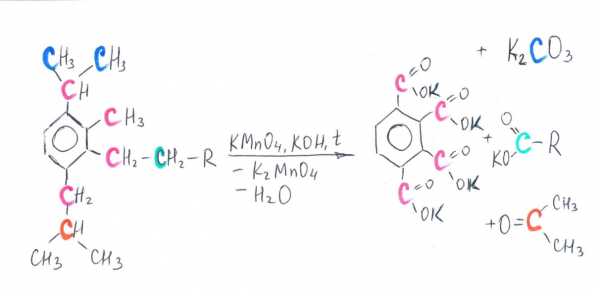
Несколько сложнее составить уравнение реакции окисления в нейтральной среде. Точно определить, какие продукты получатся, можно только при расстановке коэффициентов. Рассмотрим последовательно такой случай.
Пример 4. Окисление фенилацетилена водным раствором перманганата калия при нагревании. При этой реакции происходит деструкция по тройной связи, образуется бензоат калия, оксид марганца (IV), остальные продукты пока не ясны, запишем КОН и КНСО3. Кстати, при расстановке коэффициентов может выясниться, что воду нужно перенести в правую часть уравнения:
С6Н5—С≡СН + KMnO4 + H2O С6Н5—СООК + MnO2 + KOH+ КНСО3
С 0 – 3е С+3
С -1– 5е С+4 8 3 восстановитель
Окисление
Mn+7 + 3е Mn+4 8 окислитель
Восстановление
Ставим коэффициенты из баланса перед углеродом и марганцем:
3С6Н5—С≡СН + 8KMnO4 + H2O 3С6Н5—СООК + 8MnO2 + KOH+ 3КНСО3
После этого уравниваем калий:
3С6Н5—С≡СН + 8KMnO4 + H2O 3С6Н5—СООК + 8MnO2 + 2KOH+ 3КНСО3
Учитывая то, что кислая соль нейтрализуется щелочью:
2KOH+ 3КНСО3 2К2СО3 + КНСО3 + 2H2O, изменим продукты реакции:
3С6Н5—С≡СН + 8KMnO4 + H2O 3С6Н5—СООК + 8MnO2 + 2К2СО3 + КНСО3
Проверим число атомов водорода в правой части уравнения – 16, в левой части – 18 без учета воды, следовательно, воду нужно перенести в правую часть:
3С6Н5—С≡СН + 8KMnO4 3С6Н5—СООК + 8MnO2 + 2К2СО3 + КНСО3+ H2O
Пример 5. Окисление бутена-1 водным раствором перманганата калия при нагревании. При этой реакции происходит деструкция по двойной связи, образуется пропионат калия, оксид марганца (IV), остальные продукты пока не ясны, запишем КОН и КНСО3.
CH3-CH2—CH=CH2 + KMnO4 + H2O С2Н5—СООК + MnO2 + KOH+ КНСО3
С -1 – 4е С+3
С -2 – 6е С+4 10 3 восстановитель
Окисление
Mn+7 + 3е Mn+4 10 окислитель
Восстановление
Ставим коэффициенты из баланса перед углеродом и марганцем:
3CH3-CH2—CH=CH2 + 10KMnO4 + H2O 3С2Н5—СООК + 10MnO2 + KOH+ 3КНСО3
После этого уравниваем калий:
3CH3-CH2—CH=CH2 + 10KMnO4 + H2O 3С2Н5—СООК + 10MnO2 + 4KOH+ 3КНСО3
Учитывая то, что кислая соль нейтрализуется щелочью:
4KOH+ 3КНСО3 3К2СО3 + КOH + 3H2O, изменим продукты реакции:
3CH3-CH2—CH=CH2 + 10KMnO4 + H2O 3С2Н5—СООК + 10MnO2 + KOH+ 3К2СО3
Проверим число атомов водорода в правой части уравнения – 16, в левой части – 24 без учета воды, следовательно, воду нужно перенести в правую часть:
3CH3-CH2—CH=CH2 + 10KMnO4 3С2Н5—СООК + 10MnO2 + KOH+ 3К2СО3 + 4H2O
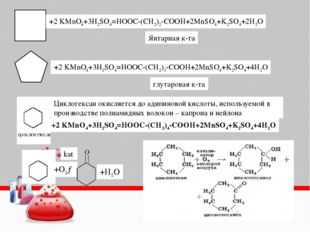
3. Метод макроподстановки при расставлении коэффициентов в органических ОВР
В случае, когда множество атомов углерода меняют степень окисления, рассматривается каждый атом отдельно, а затем все отданные атомами углерода электроны складываются. В этом и состоит сущность макроподстановки. Рассмотрим пример 6. Пользуясь схемой 1, составим формулы продуктов реакции окисления.
 + KMnO4 + H2SO4
+ KMnO4 + H2SO4
+ CO2 + CH3COOH + MnSO4 + K2SO4 + H2O
Теперь определим степени окисления всех атомов углерода, которые будут меняться: в гидроксильной группе – 1, в альдегидной группе +1, в метильном радикале – 3, в этильном радикале будет менять степень окисления только атом, связанный с СН, его степень окисления – 2, в СН степень окисления С – 1. Первые от бензольного кольца атомы углерода приобрели степень окисления +3, метильный радикал превратился в углекислый газ +4, углерод этильного радикала – в карбоксильную группу +3.
С -1 – 4е С+3
С +1 – 2е С+3
С -1 – 4е С+3 22 5
С -3 – 7е С+4
С -2 – 5е С+3
Окисление
Mn+7 + 5е Mn+2 22 окислитель
Восстановление
ИЛИ
С -1 +С +1 +С -1 +С -3 +С -2 – 22 е 4С+3 + С+4
— 6 е +16 е
Расставим коэффициенты (органические вещества записаны в виде молекулярных формул, но так записывать не обязательно)
5С12Н16О2+ 22KMnO4 + 33H2SO4 5С9Н6О6 + 5CO2 + 5CH3COOH + 22MnSO4 + 11K2SO4 + 38H2O
Задание 4.
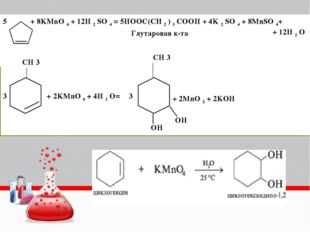
1) Составьте уравнение реакции деструктивного окисления по обеим двойным связям 4-метилпентадиена – 1,3 подкисленным раствором перманганата калия при нагревании.
2) Составьте уравнение реакции окисления стирола водным раствором перманганата калия при нагревании.
3) Составьте уравнение реакции окисления 1-изопропил-3-метил-2-пропил-5-этилбензола щелочным раствором перманганата калия при нагревании.
Для расставления коэффициентов используйте метод макроподстановки.
infourok.ru

 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:
 Описание слайда:
Описание слайда:



