Химическое равновесие. Смещение химического равновесия.
Обратимые и необратимые химические реакции
Химические реакции бывают обратимые и необратимые.
| Необратимыми реакциями называют такие реакции, которые идут только в одном (прямом →) направлении: |
т.е. если некоторая реакция A + B = C + D необратима, это значит, что обратная реакция C + D = A + B не протекает.
| Обратимые реакции – это такие реакции, которые идут как в прямом, так и в обратном направлении (⇄): |
т.е., например, если некая реакция A + B = C + D обратима, это значит, что одновременно протекает как реакция A + B → C + D (прямая), так и реакция С + D → A + B (обратная).
По сути, т.к. протекают как прямая, так и обратная реакции, реагентами (исходными веществами) в случае обратимых реакций могут быть названы как вещества левой части уравнения, так и вещества правой части уравнения. То же самое касается и продуктов.
Однако, условно принято считать, что реагентами в каждом конкретном уравнении обратимой реакции являются те вещества, которые записаны в его левой части, а продуктами – те, что записаны в правой, т.е.:
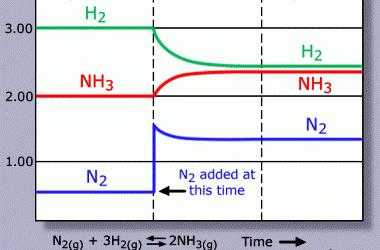
Для любой обратимой реакции возможна ситуация, когда скорость прямой и обратной реакций равны. Такое состояние называют состоянием равновесия.
В состоянии равновесия концентрации как всех реагентов, так и всех продуктов неизменны. Концентрации продуктов и реагентов в состоянии равновесия называют равновесными концентрациями.
Смещение химического равновесия под действием различных факторов
Вследствие таких внешних воздействий на систему, как изменение температуры, давления или концентрации исходных веществ или продуктов, равновесие системы может быть нарушено. Однако после прекращения этого внешнего воздействия система через некоторое время перейдет в новое состояние равновесия. Такой переход системы из одного равновесного состояния в другое равновесное состояние называют смещением (сдвигом) химического равновесия.
Для того чтобы уметь определять, каким образом сдвигается химическое равновесие при том или ином типе воздействия, удобно пользоваться принципом Ле Шателье:
Если на систему в состоянии равновесия оказать какое-либо внешнее воздействие, то направление смещения химического равновесия будет совпадать с направлением той реакции, которая ослабляет эффект от оказанного воздействия.
Влияние температуры на состояние равновесия
При изменении температуры равновесие любой химической реакции смещается. Связано это с тем, что любая реакция имеет тепловой эффект. При этом тепловые эффекты прямой и обратной реакции всегда прямо противоположны. Т.е. если прямая реакция является экзотермической и протекает с тепловым эффектом, равным +Q, то обратная реакция всегда эндотермична и имеет тепловой эффект, равный –Q.
Таким образом, в соответствии с принципом Ле Шателье, если мы повысим температуру некоторой системы, находящейся в состоянии равновесия, то равновесие сместится в сторону той реакции, при протекании которой температура понижается, т.е. в сторону эндотермической реакции. И аналогично, в случае, если мы понизим температуру системы в состоянии равновесия, равновесие сместится в сторону той реакции, в результате протекания которой температура будет повышаться, т.е. в сторону экзотермической реакции.
Например, рассмотрим следующую обратимую реакцию и укажем, куда сместится ее равновесие при понижении температуры:
Как видно из уравнения выше, прямая реакция является экзотермической, т.е. в результате ее протекания выделяется тепло. Следовательно, обратная реакция будет эндотермической, то есть протекает с поглощением тепла. По условию температуру понижают, следовательно, смещение равновесия будет происходить вправо, т.е. в сторону прямой реакции.
Влияние концентрации на химическое равновесие
Повышение концентрации реагентов в соответствии с принципом Ле Шателье должно приводить к смещению равновесия в сторону той реакции, в результате которой реагенты расходуются, т.е. в сторону прямой реакции.
И наоборот, если концентрацию реагентов понижают, то равновесие будет смещаться в сторону той реакции, в результате которой реагенты образуются, т.е. сторону обратной реакции (←).
Аналогичным образом влияет и изменение концентрации продуктов реакции. Если повысить концентрацию продуктов, равновесие будет смещаться в сторону той реакции, в результате которой продукты расходуются, т.е. в сторону обратной реакции (←). Если же концентрацию продуктов, наоборот, понизить, то равновесие сместится в сторону прямой реакции (→), для того чтобы концентрация продуктов возросла.
Влияние давления на химическое равновесие
В отличие от температуры и концентрации, изменение давления оказывает влияние на состояние равновесия не каждой реакции. Для того чтобы изменение давления приводило к смещению химического равновесия, суммы коэффициентов перед газообразными веществами в левой и в правой частях уравнения должны быть разными.
Т.е. из двух реакций:
изменение давления способно повлиять на состояние равновесия только в случае второй реакции. Поскольку сумма коэффициентов перед формулами газообразных веществ в случае первого уравнения слева и справа одинаковая (равна 2), а в случае второго уравнения – различна (4 слева и 2 справа).
Отсюда, в частности, следует, что если среди и реагентов, и продуктов отсутствуют газообразные вещества, то изменение давления никак не повлияет на текущее состояние равновесия. Например, давление никак не повлияет на состояние равновесия реакции:
Если же слева и справа количество газообразных веществ различается, то повышение давления будет приводить к смещению равновесия в сторону той реакции, при протекании которой объем газов уменьшается, а понижение давления – в сторону той реакции, в результате которой объем газов увеличивается.
Влияние катализатора на химическое равновесие
Поскольку катализатор в равной мере ускоряет как прямую, так и обратную реакции, то его наличие или отсутствие никак не влияет на состояние равновесия.
Единственное, на что может повлиять катализатор, — это на скорость перехода системы из неравновесного состояния в равновесное.
Воздействие всех указанных выше факторов на химическое равновесие сведено ниже в таблицу-шпаргалку, в которую поначалу можно подглядывать при выполнении заданий на равновесия. Однако же пользоваться на экзамене ей не будет возможности, поэтому после разбора нескольких примеров с ее помощью, ее следует выучить и тренироваться решать задания на равновесия, уже не подглядывая в нее:
Обозначения: T – температура, p – давление, с – концентрация, ↑ — повышение, ↓ — понижение
|
T |
↑Т — равновесие смещается в сторону эндотермической реакции |
| ↓Т |
|
|
p |
↑p — равновесие смещается в сторону реакции с меньшей суммой коэффициентов перед газообразными веществами |
| ↓p — равновесие смещается в сторону реакции с большей суммой коэффициентов перед газообразными веществами | |
|
c |
↑c(реагента) – равновесие смещается в сторону прямой реакции (вправо) |
| ↓c(реагента) – равновесие смещается в сторону обратной реакции (влево) | |
| ↑c(продукта) – равновесие смещается в сторону обратной реакции (влево) | |
| ↓c(продукта) – равновесие смещается в сторону прямой реакции (вправо) | |
| Катализатор | На равновесие не влияет!!! |
scienceforyou.ru
Способы смещения равновесия
Принцип Ле Шателье. Состояние химического равновесия при неизменных внешних условиях может сохраняться сколь угодно долго. В действительности же реальные системы обычно испытывают различные воздействия (изменение температуры, давления или концентрации реагентов), выводящие систему из состояния равновесия. Как только в системе нарушается равновесие, скорости прямой и обратной становятся неодинаковыми и в системе преимущественно протекает процесс, который приводит ее к состоянию равновесия, но уже отвечающему новым условиям. Изменения, происходящие в системе в результате внешних воздействий, определяются принципом подвижного равновесия —
Внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении той реакции, при которой эффект произведенного воздействия ослабляется.
Внешнее воздействие на систему изменяет соотношение между скоростями прямого и обратного процесса, благоприятствуя тому из них, который противодействует внешнему влиянию ( увеличивается скорость прямой или обратной реакции ).
Принцип Ле Шателье универсален, так как применим не только к чисто химическим процессам, но и к физико-химическим явлениям, таким, как кристаллизация, растворение, кипение, фазовые превращения в твердых телах.
Смещение химического равновесия при изменении:
а)концентрации. Увеличение концентрации одного из реагирующих веществ сначала приводит к увеличению числа молекул этого вещества. Поскольку число столкновений с участием этих молекул увеличивается, реакция, для которой они являются реагентами, ускоряется. Это приводит к увеличению концентраций реагентов у противоположной реакции и т. д. В результате изменяется концентрация всех веществ, участвующих в химической реакции и вновь наступает состояние химического равновесия.
Можно сделать вывод, что при увеличении концентрации одного из реагирующих веществ равновесие смещается в сторону расхода этого вещества, при уменьшении концентрации равновесие смещается в сторону образования этого вещества.
б)давления. Влияние давления очень напоминает эффект изменения концентраций реагирующих веществ, но сказывается оно практически только на газовых системах. При повышении давления увеличивается число молекул в единице объема газовой системы. Прямая или обратная реакция, в которой участвует большее количество газообразных веществ, протекает при этом с большей скоростью. В результате этой реакции образуется больше молекул тех веществ, которые участвуют в обратной реакции. Произойдет изменение скорости обратной реакции, и в конце концов будет достигнуто новое состояние равновесия.
При увеличении давления( уменьшении объёма ) равновесие смещается в сторону уменьшения числа молекул газообразных веществ, т. е. в сторону понижения давления; при уменьшении давления ( увеличении объёма ) равновесие смещается в сторону возрастания числа молекул газообразных веществ, т. е. в сторону увеличения давления. Если реакция протекает без изменения числа молекул газообразных веществ, то давление не влияет на положение равновесия в этой системе.
в)температуры. Повышение температуры увеличивает кинетическую энергию всех молекул, участвующих в реакции. Но молекулы, вступающие в реакцию, при которой происходит поглощение энергии (эндотермическая реакция), начинают взаимодействовать между собой быстрее. Это увеличивает концентрацию молекул, участвующих в обратной реакции, и ускоряет ее. В результате достигается новое состояние равновесия с повышенным содержанием продуктов реакции, протекающей с поглощением энергии.
При повышении температуры равновесие смещается в сторону эндотермической реакции, при понижении температуры — в сторону экзотермической реакции.
studfiles.net
Химическое равновесие — Википедия
Материал из Википедии — свободной энциклопедии
Химическое равновесие — состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем[1].
А2 + В2 ⇄ 2AB
Принцип работы: если на систему воздействовать, то она противодействует.
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняется закономерности, которая была высказана в общем виде в 1885 году французским учёным Ле Шателье.
Факторы, влияющие на химическое равновесие:
1) температура
При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении — в сторону экзотермической (выделение) реакции.
CaCO3=CaO+CO2 -Q t↑ →, t↓ ←
N2+3H2↔2NH3 +Q t↑ ←, t↓ →
2) давление
При повышении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении — в сторону большего объёма. Этот принцип действует только на газы, то есть если в реакции участвуют твёрдые вещества, то они в расчёт не берутся.
CaCO3=CaO+CO2 P↑ ←, P↓ →
1моль=1моль+1моль
3) концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при понижении концентрации — в сторону исходных веществ.
S+O2=SO2 [S], [O2]↑ →, [SO2]↑ ←
Катализаторы не влияют на смещение химического равновесия
ru.wikipedia.org
Химическое равновесие и способы его смещения
Скорость прямой реакции в начале обратимых процессов является максимальной, однако после она уменьшается из-за того, что сокращается концентрация исходных веществ, которые расходуются на создание продуктов реакции. И напротив, скорость обратной реакции вначале является минимальной, она возрастает по мере увеличения концентрации продуктов реакции. Немного позже, наступает момент, когда скорость прямой и обратной реакции становятся равными.
Состояние химически обратимого процесса называется химическим равновесием, если при этом скорость прямой реакции равна скорости обратной реакции.
Химическое равновесие является движущимся, т.к. при его наступлении реакция продолжается и концентрации компонентов остаются неизменными, другими словами, за единицу времени образуется такое же количество продуктов реакции, какое преобразуется в исходные вещества. Если температура и давление являются постоянными величинами, то равновесие в данной реакции может длиться неопределенно долгое время.
В промышленности в большинстве случаев заинтересованы в преимущественном протекании прямой реакции. К примеру, при получении аммиака, оксида серы (VI), оксида азота (II). Каким образом можно вывести данную систему из равновесия? Как влияет на него изменение внешних условий, при которых протекает тот или иной химический процесс? В этом нам поможет принцип Ле Шателье.
Любая система, которая находится в состоянии термодинамического равновесия, при внешнем воздействии (изменение температуры, давления и т.д.) стремится вернуться в исходное состояние химическоой устойчивости, при этом компенсируя оказанное воздействие.
Такой принцип было бы проще назвать так: «делай все с точностью до наоборот и добьешься желаемого». Давайте проанализируем, что нужно сделать, чтобы сдвинуть равновесие, если трансформировать каждое из условий реакции, на примере реакции синтеза аммиака: N2 + 3H2 ↔ 2NH3 + Q.
Рассмотрим подробнее характеристику данного процесса.
1) Прямая реакция является реакцией соединения, т.к. из двух простых веществ – азота и водорода – создается одно сложное вещество – аммиак. Естественно, обратная реакция по этому признаку относится к реакциям разложения.
2) Т.к. обе реакции – и прямая, и обратная – проходят в присутствии катализатора (им может стать универсальная платина, или недорогой железный катализатор с добавками оксидов К и Al) то обе реакции являются каталитическими. Необходимо отметить, что катализатор не является причиной смещения равновесия. Он в равной мере изменяет скорость как прямой, так и обратной реакции.
3) Прямая реакция проходит с образованием теплоты, поэтому ее относят к экзотермическим реакциям. Будет логично предположить, что обратная реакция станет эндотермической (проходит с поглощением теплоты).
А теперь давайте рассмотрим, как применим принцип Ле Шателье, или принцип противодействия, для сдвига равновесия в реакции синтеза аммиака.
1) Трансформация равновесных концентраций. Чтобы сдвинуть равновесие в сторону образования аммиака, следует увеличить концентрацию начальных веществ (концентрацию азота и водорода) и свести к минимуму концентрацию аммиака. Равновесные концентрации принято обозначать на письме квадратными скобками, в отличие от неравновесных, которые обозначаются буквой с. Таким образом, если мы хотим изменить равновесие реакции в право, следует повысить концентрацию азота и водорода ([N2] и [H2]) и свести к минимуму концентрацию аммиака ([NH3]), т.е. вывести его из сферы реакции. Разумеется, для изменения равновесия влево, нужно сделать все наоборот.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
§16. Обратимость химической реакции. Химическое равновесие и способы его смещения
§16. Обратимость химической реакции. Химическое равновесие и способы его смещения
1. Какие реакции называют необратимыми? Приведите примеры таких реакций из органической и неорганической химии, запишите их уравнения.
Необратимыми называются химические реакции, в результате которых исходные вещества полностью превращаются в конечные продукты (например, реакции горения или обмена, протекающие в соответствии с правилом Бертолле):
2. Какие реакции называют обратимыми? Что такое химическое равновесие? Как его сместить?
Обратимыми называются химические реакции, которые протекают одновременно в двух противоположных направлениях – прямом и обратном. Состояние обратимого процесса, при котором скорость прямой реакции равна скорости обратной, называется химическим равновесием. Сместить равновесие можно, если изменить температуру, давление или равновесную концентрацию веществ.
3. Дайте характеристику реакции синтеза оксида серы (VI) из оксида серы (IV) и кислорода. Рассмотрите, как нужно измерить концентрацию веществ, давление и температуру, чтобы сместить равновесие вправо.
4. Для смещения равновесия в реакции синтеза аммиака вправо необходимо понизить температуру. Почему же на производстве этот процесс проводят при достаточно высокой температуре 500 — 550°С?
Согласно правилу Вант-Гоффа, если проводить реакцию при низкой температуре, то ее скорость уменьшается. Поэтому при синтезе аммиака была выбрана оптимальная температура, чтобы поддерживать и скорость и сместить равновесие.
5. Как нужно изменить концентрацию веществ, температуру и давление синтеза йодоводорода: , чтобы сместить равновесие вправо?
Увеличивать концентрацию водорода и йода, давление никак не влияет (из 2 молей смеси получается 2 моль продукта), температуру необходимо уменьшить.
6. Выберите уравнения обратимых реакций, в которых изменение давления не вызовет смещения химического равновесия:
Б) (нет газообразных веществ) и В) (4 моля водяного пара и 4 моля водорода, т.е. объем газообразных исходных веществ равен объему продуктов).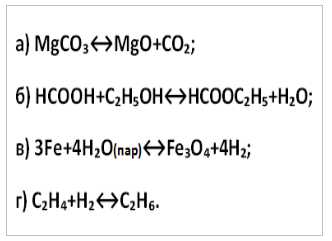
7. Что служит сырьем для синтеза аммиака? Назовите источники этого сырья.
8. Используя свои знания по биологии и неорганической химии, охарактеризуйте народнохозяйственное значение аммиака.
superhimik.ru
Химическое равновесие и создание условий для его смещения :: SYL.ru
Изучение параметров системы, включающей исходные вещества и продукты реакции, позволяет выяснить, какие факторы смещают химическое равновесие и ведут к желаемым изменениям. На выводах Ле Шателье, Брауна и других ученых о способах проведения обратимых реакций основаны промышленные технологии, позволяющие осуществить ранее казавшиеся невозможными процессы, получить экономическую выгоду.
Разнообразие химических процессов
По особенностям теплового эффекта многие реакции относят к экзо- или эндотермическим. Первые идут с образованием теплоты, например, окисление углерода, гидратация концентрированной серной кислоты. Второй тип изменений связан с поглощением тепловой энергии. Примеры эндотермических реакций: распад карбоната кальция с образованием гашеной извести и углекислого газа, образование водорода и углерода при термическом разложении метана. В уравнениях экзо- и эндотермических процессов необходимо указывать тепловой эффект. Перераспределение электронов между атомами реагирующих веществ происходит в окислительно-восстановительных реакциях. Четыре типа химических процессов выделяют по особенностям реагентов и продуктов:
- соединение А + В = С;
- разложение С = А + В;
- замещение АВ + С = АС + В;
- обмен АВ + СД = АС + ВД.
Для характеристики процессов важна полнота взаимодействия реагирующих соединений. Этот признак лежит в основе деления реакций на обратимые и необратимые.
Обратимость реакций
Обратимые процессы составляют большинство среди химических явлений. Образование конечных продуктов из реагентов является прямой реакцией. В обратной же исходные вещества получаются из продуктов своего разложения или синтеза. В реагирующей смеси возникает химическое равновесие, при котором получается столько же соединений, сколько разлагается исходных молекул. В обратимых процессах вместо знака «=» между реагентами и продуктами используются символы «↔» или «⇌». Стрелки могут быть неодинаковыми по длине, что связано с доминированием одной из реакций. В химических уравнениях можно указывать агрегатные характеристики веществ (г — газы, ж — жидкости, т — твердые). Огромное практическое значение имеют научно обоснованные приемы влияния на обратимые процессы. Так, производство аммиака стало рентабельным после создания условий, сдвигающих равновесие в сторону образования целевого продукта: 3Н2(г) + N2(г) ⇌ 2NH3(г). Необратимые явления приводят к появлению нерастворимого или малорастворимого соединения, образованию газа, покидающего сферу реакции. К таким процессам можно отнести ионный обмен, распад веществ.
Химическое равновесие и условия его смещения
На характеристики прямого и обратного процессов влияет несколько факторов. Один из них — время. Концентрация взятого для реакции вещества постепенно снижается, а конечного соединения — возрастает. Реакция прямого направления идет все медленнее, обратный процесс набирает скорость. В определенный промежуток два противоположных процесса идут синхронно. Взаимодействие между веществами происходит, но концентрации не меняются. Причина — динамическое химическое равновесие, установившееся в системе. Его сохранение или изменение зависит от:
- температурных условий;
- концентрации соединений;
- давления (для газов).
Смещение химического равновесия
В 1884 году выдающийся ученый из Франции А. Л. Ле Шателье предложил описание способов вывода системы из состояния динамического равновесия. В основе метода лежит принцип нивелирования действия внешних факторов. Ле Шателье обратил внимание, что в реагирующей смеси возникают процессы, компенсирующие влияние посторонних сил. Сформулированный французским исследователем принцип гласит, что изменение условий в состоянии равновесия благоприятствует протеканию реакции, ослабляющей постороннее воздействие. Смещение равновесия подчиняется этому правилу, оно соблюдается, когда меняется состав, температурные условия и давление. Технологии, основанные на выводах ученых, используются в промышленности. Многие химические процессы, считавшиеся практически неосуществимыми, проводятся благодаря способам смещения равновесия.

Влияние концентрации
Сдвиг равновесия происходит, если изъять из зоны взаимодействия определенные компоненты или дополнительно ввести порции вещества. Удаление продуктов из реакционной смеси обычно вызывает увеличение скорости их образования, добавление веществ, наоборот, приводит к их преимущественному распаду. В процессе этерификации для обезвоживания используют серную кислоту. При введении ее в сферу реакции повышается выход метилацетата: СН3СООН + СН3ОН ↔ СН3СООСН3 + Н2О. Если добавлять кислород, взаимодействующий с диоксидом серы, то химическое равновесие смещается в сторону прямой реакции образования триоксида серы. Кислород связывается в молекулы SO3, его концентрация понижается, что согласуется с правилом Ле Шателье для обратимых процессов.
Изменение температуры
Процессы, идущие с поглощением или выделением тепла, — эндо- и экзотермические. Для смещения равновесия используется нагревание или отвод тепла от реагирующей смеси. Рост температуры сопровождается повышением скорости эндотермических явлений, в которых дополнительная энергия поглощается. Охлаждение приводит к преимуществу экзотермических процессов, идущих с выделением тепла. При взаимодействии диоксида углерода с углем нагревание сопровождается увеличением концентрации монооксида, а охлаждение ведет к преимущественному образованию сажи: СО2(г) + С(т) ↔ 2СО(г).
Влияние давления
Изменение давления — важный фактор для реагирующих смесей, включающих в себя газообразные соединения. Также следует обратить внимание на разницу объемов исходных и получившихся веществ. Понижение давления ведет к преимущественному протеканию явлений, в которых увеличивается общий объем всех компонентов. Рост давления направляет процесс в сторону снижения объема всей системы. Такая закономерность соблюдается в реакции образования аммиака: 0,5N2(г) + 1,5Н2(г) ⇌ NH3(г). Изменение давления не повлияет на химическое равновесие в тех реакциях, которые идут при неизменном объеме.

Оптимальные условия осуществления химического процесса
Создание условий для смещения равновесия во многом определяет развитие современных химических технологий. Практическое использование научной теории способствует получению оптимальных результатов производства. Наиболее яркий пример — получение аммиака: 0,5N2(г) + 1,5Н2(г) ⇌ NH3(г). Повышение содержания в системе молекул N2 и Н2 благоприятно для синтеза сложного вещества из простых. Реакция сопровождается выделением теплоты, поэтому снижение температуры вызовет увеличение концентрации NH3. Объем исходных компонентов больше, чем целевого продукта. Рост давления обеспечит повышение выхода NH3.
В условиях производства подбирают оптимальное соотношение всех параметров (температуры, концентрации, давления). Кроме того, имеет большое значение площадь соприкосновения между реагентами. В твердых гетерогенных системах увеличение поверхности ведет к росту скорости реакции. Катализаторы увеличивают скорость прямой и обратной реакции. Применение веществ с такими свойствами не приводит к смещению химического равновесия, но ускоряет его наступление.
www.syl.ru
|
Скорость химической реакции, (V) |
— изменение количества вещества в единицу времени в единице реакционного пространства |
|
Гомогенные реакции |
— реакции, протекающие в однородной среде (одной фазе) |
|
Гетерогенные реакции |
— реакции, протекающие на границе раздела фаз |
|
Факторы, определяющие скорость реакции |
— природа реагентов, их концентрации, температура, наличие катализаторов, давление (для газов) |
|
Механизм химической реакции |
— последовательность всех элементарных стадий |
|
Кинетическое уравнение |
— выражение зависимости скорости реакции от концентрации реагентов уравнение реакции: Н2(г) + I2(г)= 2HI(г) кинетическое уравнение реакции: V = k CH2CI2 |
|
Константа скорости (k) |
— скорость реакции при концентрациях реагирующих веществ, равных 1 моль/л |
|
Факторы, определяющие константу скорости |
— природа реагентов, температура |
|
Катализ |
— изменение скорости химической реакции под воздействием веществ, количество и природа которых после завершения реакции остаются неизменными |
|
Катализатор |
— нерасходуемый реагент, увеличивающий скорость реакции |
|
Ингибитор |
— вещество, препятствующее протеканию реакции |
|
Энергия активации |
— минимальная энергия, которой должны обладать молекулы, чтобы реакция стала возможной |
|
Порядок реакции, (n) |
— сумма показателей степеней в кинетическом уравнении реакции. Для реакции Н2(г) + I2(г)= 2HI(г), кинетическое уравнение: V = k CH2CI2, Порядок реакции: n=1+1=2 |
|
Молекулярность реакции |
— число частиц, участвующих в элементарном химическом акте |
|
Необратимые химические реакции |
— реакции, в результате которых исходные вещества полностью превращаются в продукты |
|
Обратимые химические реакции |
— реакции идущие одновременно в двух противоположных направлениях |
|
Химическое равновесие |
— динамическое состояние системы. При котором скорость прямой и обратной реакции равны |
|
Равновесные концентрации, [С] |
— концентрации реагирующих веществ, установившиеся к моменту наступления равновесия |
studfiles.net


