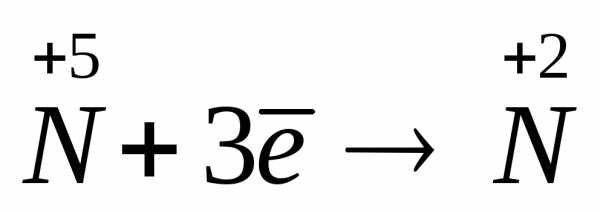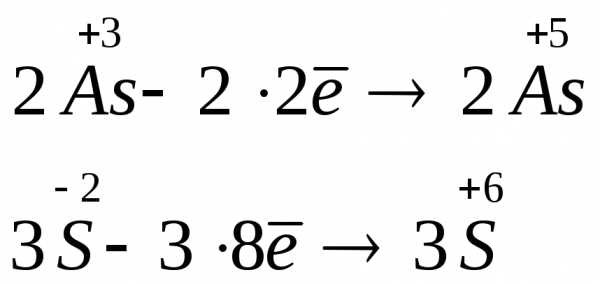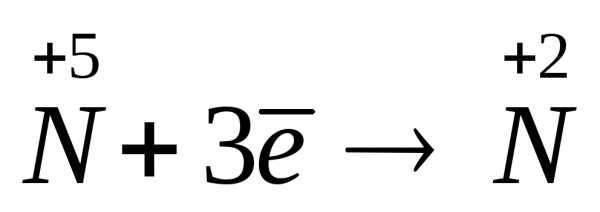Расставление коэффициентов в окислительно-восстановительных реакциях
Как расставлять коэффициенты в окислительно-восстановительных реакциях методом электронно-ионного баланса:
1. Определить степени окисления
2. Понять, атомы каких элементов меняют степень окисления
3. Записываем электронно-ионный баланс. Для этого, записываем атом элемента сначала со степенью окисления в левой части, а затем в правой
4. Считаем, сколько электронов было отдано или принято
5. Находим общее кратное, делим его на соответствующее количество отданных или принятых электронов
6. Атом элемента, отдающий электроны, является восстановителем (отдача — окисление), принимающий электроны — окислителем.
7. Расставляем коэффициенты
8. Подводим баланс по водороду и кислороду
Рассмотрим пример:
HClO3 + P → h4PO4 + HCl
В данной реакции хлор и фосфор меняют степень окисления. Запишем баланс.
Фосфор в левой части находится в состоянии простого вещества, а в правой в составе ортофосфорной кислоты, то есть меняет степень окисления с 0 на +5.
Р(0) → Р(+5)
Положительная степень окисления означает, что атом отдал электроны, фосфор отдает пять электронов.
Р(0) -5е → Р(+5)
Восстановитель отдает электроны, значит фосфор является восстановителем.
Хлор в левой части находится в составе хлорноватой кислоты, а в правой — в составе соляной.
Хлор меняет степень окисления с +5 на -1, то есть хлор принимает 6 электронов.
Cl(+5) +6e → Cl(-1)
Окислитель принимает электроны.
Находим общее кратное между 5 и 6, это — 30. То есть, около хлора мы должны поставить 5, а около фосфора — 6.
Расставим коэффициенты.
5HClO3 + 5P → 6h4PO4 + 5HCl
Перед соединениями хлора поставим 5. Теперь слева 15 атомов кислорода, тогда справа перед ортофосфорной кислотой тоже поставим 6. В этот момент мы понимаем, что не можем уравнять, так как слева не хватает атомов водорода. Добавим воду слева.
5HClO3 + 5P + 9Н2О → 6h4PO4 + 5HCl
И перед водой поставим 9. Теперь все коэффициенты расставлены правильно.
Не во всех уравнениях коэффициенты расставляются так (добавлением воды).
Поэтому разберем окислительно-восстановительную реакцию из варианта ЕГЭ.
KMnO4 + K2SO3 + KOH = K2MnO4 + K2SO4 + h3O
В данной реакции меняют степень окисления марганец и сера.
Марганец меняет степень окисления с +7 на +6, а сера с +4 на +6.
Mn(+7) +1e → Mn(+6) (марганец принимает 1 электрон, значит является окислителем)
S(+4) -2e → S(+6) (сера отдает 2 электрона, значит является восстановителем)
Общее кратное — 2, перед марганцем нужно поставить 2, перед серой — единички.
2KMnO4 + K2SO3 + KOH = 2K2MnO4 + K2SO4 + h3O
Слева получилось 5 атомов калия, а слева 6, поставим 2 перед гидроксидом калия.
2KMnO4 + K2SO3 + 2KOH = 2K2MnO4 + K2SO4 + h3O
Теперь коэффициенты расставлены правильно!
Задания по теме
1. Al + … + KNO3 + KOH = K[Al(OH)4] + Nh4↑
Алюминий и азот меняют степень окисления. Запишем баланс.
Al(0) -3e → Al(+3) | 8 — восстановитель
N(+5) +8e → N(-3) | 3 — окислитель
Слева не хватает атомов водорода, поэтому добавим воды. Перед алюминием слева и справа ставим 8, а перед азотом ставим 3. Считаем атомы водорода и кислорода, перед водой ставим 18.
8Al + 18Н2О + 3KNO3 + 5KOH = 8K[Al(OH)4] + 3Nh4↑
2. Al + HNO3 → Al(NO3)3 + N2O + …
Справа не хватает атомов водорода, добавим их в составе воды.
Al + HNO3 → Al(NO3)3 + N2O + Н2О
Алюминий и азот меняют степень окисления. Запишем баланс.
Al(0) -3e → Al(+3) | 4 — восстановитель
N(+5) +4e → N(+1) | 3 — окислитель
Перед алюминием ставим не 4, а 8 — иначе уравнять не получится. Перед оксидом алюминия — 3.
8Al + HNO3 → 8Al(NO3)3 + 3N2O + Н2О
Справа 30 атомов азота. значит слева перед азотной кислотой ставим 30, тогда получается 15 молекул воды.
8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15Н2О
3. Al + HNO3 → Al(NO3)3 + Nh5NO3 + …
Справа не хватает воды.
Al + HNO3 → Al(NO3)3 + Nh5NO3 + Н2О
Алюминий и азот меняют степень окисления. Запишем баланс.
Al(0) -3e → Al(+3) | 8 — восстановитель
N(+5) +8e → N(-3) | 3 — окислитель
Перед алюминием ставим 8, перед нитратом аммония — 3.
8Al + HNO3 → 8Al(NO3)3 + 3Nh5NO3 + Н2О
Тогда справа получается 30 атомов азота, значит перед азотной кислотой поставим 30, а перед водой — (30 — 12)/2 = 9.
8Al + 30HNO3 → 8Al(NO3)3 + 3Nh5NO3 + 9Н2О
4. KNO3 + … + S → N2 + CO2 + …
Слева не хватает углерода, а справа соединения серы.
Сера превращается в сульфид.
KNO2 + С + S → N2 + CO2 + h3S
C(0) -4e → C(+4) | 5 — восстановитель
S(0) +2e → S(-2) | 10 — окислитель
2N(+5) +10e → N2(0) | 2 — окислитель
Если углерод отдает электроны и превращается в С(+4), то сера должна эти электроны принимать, иначе баланс не получится.
Расставляем коэффициенты.
2KNO3 + 3С + S → N2 + 3CO2 + К2S
5. KNO3 + Al → KAlO2 + … + N2
Справа не хватает соединения алюминия, а именно оксида.
KNO3 + Al → KAlO2 + Al2O3 + N2
Записываем баланс.
Al(0) -3e → Al(+3) | 10 — восстановитель
2N(+5) +10e → N2(0) | 3 — окислитель
Расставляем коэффициенты.
6KNO3 + 10Al → 6KAlO2 + 2Al2O3 + 3N2
cleverpenguin.ru
Алгоритм расстановки коэффициентов в уравнениях овр
Существует несколько методов определения коэффициентов в уравнениях окислительно-восстановительных реакций. Мы используем метод электронного баланса, при котором составление полного уравнения ОВР проводится в следующей последовательности:1. Составляют схему реакции, указав вещества, вступившие в реакцию, и вещества, получившиеся в результате реакции, например:
2. Определяют степень окисления атомов и пишут ее знак и величину над символами элементов, отмечая элементы, степень окисления которых изменилась:
3. Записывают электронные уравнения реакций окисления и восстановления, определяют число электронов, отданных восстановителем и принятых окислителем, и затем уравнивают их, умножая на соответствующие коэффициенты:
|
число
|
Коэф-ты |
процесс | |
|
2 |
3 |
окисление | |
|
|
6 3 |
2 |
восстановление |
4. Полученные коэффициенты, отвечающие электронному балансу, переносят в основное уравнение:
5.Уравнивают число атомов и ионов, не меняющих степени окисления (в последовательности: металлы, неметаллы, водород):
6.Проверяют правильность подбора коэффициентов по числу атомов кислорода в левой и правой части уравнения реакции – они должны быть равны (в этом уравнении 24 = 18 + 2 + 4, 24 = 24).
Рассмотрим более сложный пример:
Определим степени окисления атомов в молекулах:
Составим электронные уравнения реакций окисления и восстановления и уравняем число отданных и принятых электронов:
|
Число
|
Коэф-ты |
процесс | |
|
|
28 84 |
3 |
окисление |
|
|
3 |
28 |
восстановл-е |
Перенесем коэффициенты в основное уравнение:
Уравняем число атомов, не меняющих степень окисления:
Подсчитав число атомов кислорода в правой и левой части уравнения, убедимся, что коэффициенты подобраны правильно.
Важнейшие окислители и восстановители
Окислительно-восстановительные свойства элементов зависят от строения электронной оболочки атомов и определяются их положением в периодической системе Менделеева.
Металлы, имея на внешнем энергетическом уровне 1-3 электрона, легко их отдают и проявляют только восстановительные свойства. Неметаллы (элементы IV-VII групп) могут как отдавать, так и принимать электроны, поэтому они могут проявлять и восстановительные и окислительные свойства. В периодах с увеличением порядкового номера элемента восстановительные свойства простых веществ ослабевают, а окислительные усиливаются. В группах с повышением порядкового номера восстановительные свойства усиливаются, а окислительные ослабевают. Таким образом, из простых веществ лучшими восстановителями являются щелочные металлы, алюминий, водород, углерод; лучшими окислителями являются галогены и кислород.
Окислительно-восстановительные
свойства сложных веществ зависят от
степени окисления атомов, входящих в
их состав. Вещества,
содержащие атомы с низшей степенью
окисления, проявляют восстановительные
свойства.
Важнейшими восстановителями являются
оксид углерода
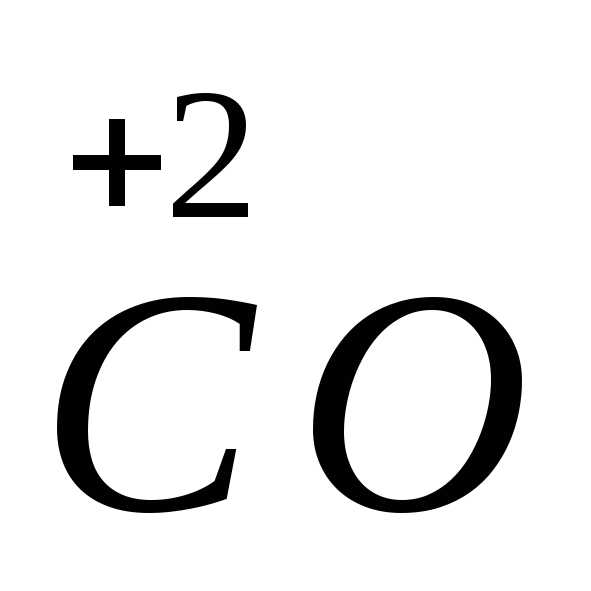 ,
сероводород
,
сероводород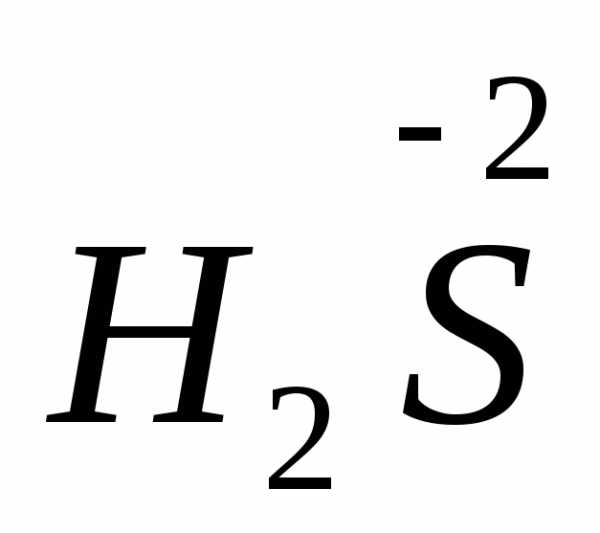 ,
сульфат железа(II)
,
сульфат железа(II)
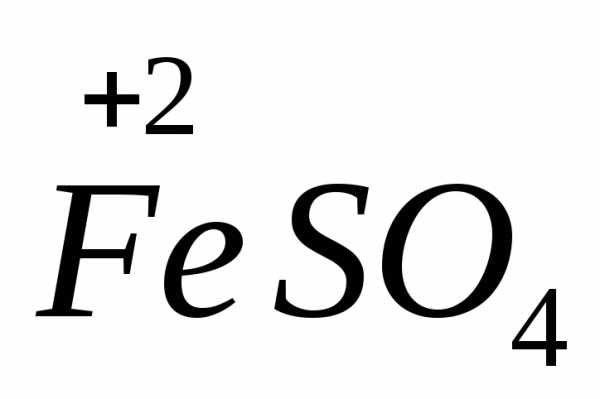 .
Вещества,
в состав которых входят атомы с высшей
степенью окисления, проявляют окислительные
свойства
.
Вещества,
в состав которых входят атомы с высшей
степенью окисления, проявляют окислительные
свойства
 ,
дихромат калия
,
дихромат калия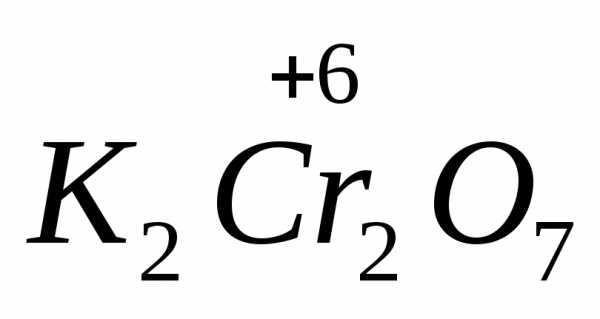 ,
пероксид водорода
,
пероксид водорода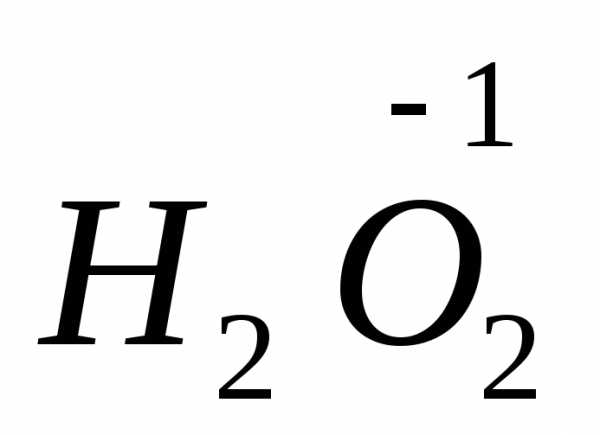 ,
азотная кислота
,
азотная кислота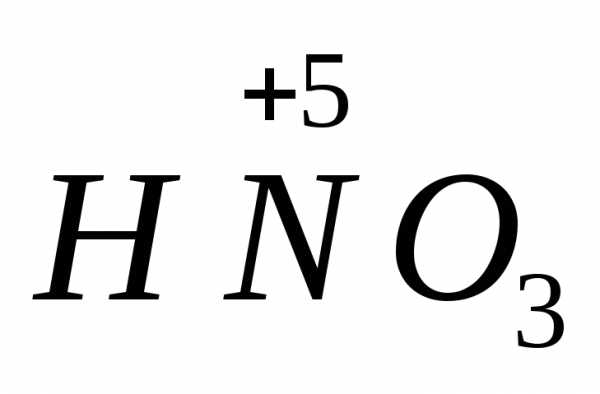 ,
концентрированная серная кислота
,
концентрированная серная кислота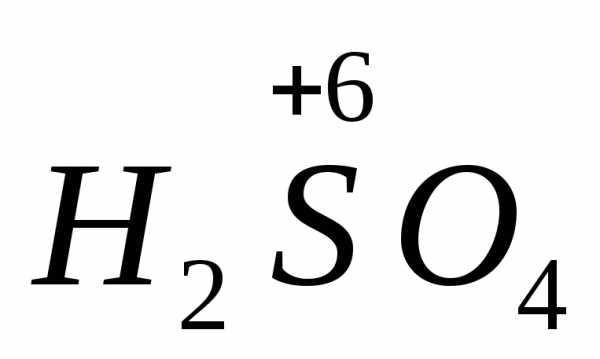 .
.
Вещества,
содержащие атомы с промежуточной
степенью окисления, могут вести себя
как окислители или восстановители
в зависимости от свойств веществ, с
которыми они взаимодействуют, и условий
протекания реакции. Так в реакции с
 сернистая кислота проявляет
восстановительные свойства:
сернистая кислота проявляет
восстановительные свойства:
,
а при взаимодействии с сероводородом является окислителем:
Кроме того, для таких веществ возможны реакции самоокисления-самовосстановления, протекающие с одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента, например:
Сила многих
окислителей и восстановителей зависит
от рН среды. Например,
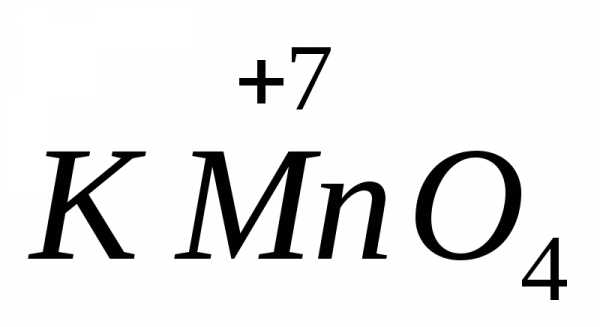 в щелочной среде восстанавливается до
в щелочной среде восстанавливается до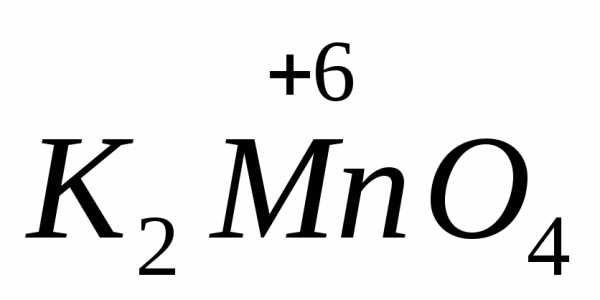 ,
в нейтральной до
,
в нейтральной до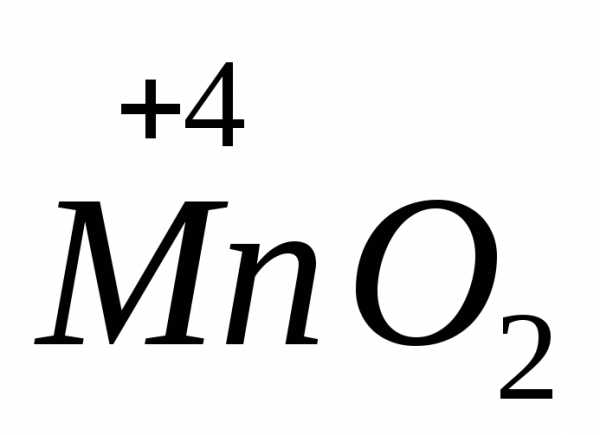 ,
в присутствии серной кислоты — до
,
в присутствии серной кислоты — до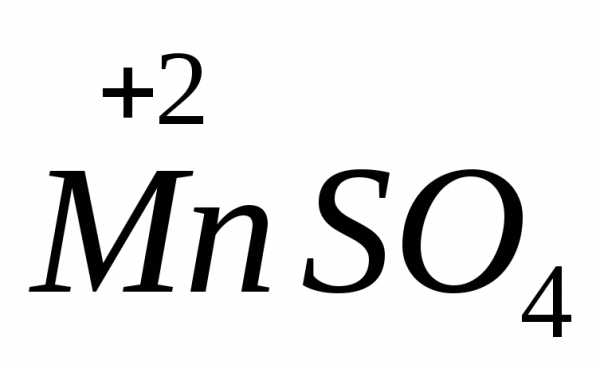 .
.
studfiles.net
Расстановка коэффициентов любых ОВР реакций
Расстановка коэффициентов любых ОВР реакций представляет большую головную боль, как для школьников, так и для студентов, изучающих химию!
В этом уроке я покажу как расставлять коэффициенты для любых окислительно-восстановительных реакций и продемострирую это на примере одной очень сложной реакции диспропорционирования:
FeS2 + K2Cr2O7 + Na2CO3 = NaFeO2 + KCrO2 + Na2SO4 + CO2
Прежде чем приступить, попробуйте сами расставить коэффициенты для данной реакции!
Метод решения, который я объясняю в статье, позволяет безошибочно расставить все коэффициенты без использования метода электронного баланса.
Шаг первый — неизвестные
Первое что нам потребуется сделать, это присвоить неизвестные каждому коэффициенту:
Было:
_FeS2 + _K2Cr2O7 + _Na2CO3 = _NaFeO2 + _KCrO2 + _Na2SO4 + _CO2
Стало:
X1FeS2 + X2K2Cr2O7 + X3Na2CO3 = X4NaFeO2 + X5KCrO2 + X6Na2SO4 + X7CO2
Шаг второй — равенства
Обратим внимание на элементы, которые встречаются до знака и после знака равенства 1 раз!
Это железо «Fe» в соединениях FeS2 и NaFeO2, из этого делаем вывод что:
X1 = X4
Коэффициент перед железосодержащими соединениями будет одинаковым, т.к. железо встречается единожды до и после знака равенства)
Далее это сера «S» в соединениях FeS2 и Na2SO4, из этого делаем вывод что:
X1 = X6/2
Обратите внимание откуда появился коэффициент «2», это связано с тем, что в соединении FeS2 у серы коэффициент два, а в Na2SO4 у серы коэффициент один, соответственно, чтобы количество серы до и после было равным, нужно разделить коэффициент X6 Na2SO4 на 2, т.е. коэффициент X6 по условию уравнения будет больше в два раза по сранению с X1!
Значит:
X1= X4 = X6/2
Теперь следующий элемент — «Cr» в соединениях K2Cr2O7 и KCrO2, следовательно:
X2 = X5/2
И наконец «C» в соединениях Na2CO3 и CO2, следовательно:
X3 = X7
Подводим итог:
X1= X4 = X6/2
X2 = X5/2
X3 = X7
Шаг третий — составление уравнения
Решение данного задания является математическим, и нам нужно составить уравнение на основе того, что количество элементов до, должно равняться количеству после! Поэтому составим уравнение, где коэффициенты становятся множителями элементов:
X1(Fe + 2S) + X2(2K + 2Cr + 7O) + X3(2Na + C + 3O) = X4(Na + Fe + 2O) + X5(K + Cr + 2O) + X6(2Na + S + 4O) + X7(C + 2O)
Шаг четвертый — подстановка
Мы уже знаем, что:
X1= X4 = X6/2
X2 = X5/2
X3 = X7
Отсюда:
X1= X4
2X1 = X6
2X2 = X5
X3 = X7
Давайте подставим все неизвестные выразив их через X1, X2 и X3, получим:
X1(Fe + 2S) + X2(2K + 2Cr + 7O) + X3(2Na + C + 3O) = X1(Na + Fe + 2O) + 2X2(K + Cr + 2O) + 2X1(2Na + S + 4O) + X3(C + 2O)
Шаг пятый — привидение уравнения
Теперь у нас все готово, для того, чтобы раскрыть скобки уравнения, это мы и сделаем:
X1Fe + 2X1S+ 2X2K + 2X2Cr + 7X2O + 2X3Na + X3C + 3X3O =
X1Na + X1Fe + 2X1O + 2X2K + 2X2Cr + 4X2O + 4X1Na + 2X1S + 8X1O + X3C + 2X3O
Сократим все что сможем:
3X2O + 2X3Na + X3O = 5X1Na + 10X1O
Получилось весьма компактно!
Шаг шестой — решение уравнения
Чтобы решить полученное уравнение нам нужно выразить X2 и X3 через X1, для этого рассмотрим элементы, которые находятся не в единичном количестве до, и после знака равенства, это Na и O, составим для них уравнения!
Для натрия, из уравнения выше — так как мы знаем, что количество элемента до, равно количеству элемента после:
2X3Na = 5X1Na
Сокращаем натрий:
2X3 = 5X1
2X3/5 = X1
Для кислорода:
3X2O + X3O = 10X1O
3X2 + X3 = 10X1, так как 2X3/5 = X1, то подставляем X1:
3X2 + X3 = 10*2X3/5
3X2 + X3 = 4X3
3X2 = 3X3
X2 = X3
Подытожим:
5X1/2 = X2 = X3
Так как мы ранее узнали, что:
X1= X4
2X1 = X6
2X2 = X5
X3 = X7
То теперь мы можем выразить все неизвестные через X1!
Поставим все неизвестные в самое начальное уравнение, выразив их через X1 и представив X1 = 2 (это нужно для того, что бы не было дробных значений, впрочем если вы представите X1 = 1, то ошибки не будет):
2FeS2 + 5K2Cr2O7 + 5Na2CO3 = 2NaFeO2 + 10KCrO2 + 4Na2SO4 + 5CO2
Вот и наше решение!
Такой метод идеально подходит для решений реакций диспропорционирования и конпропорционирования, а также для решения олимпиадных задач по химии и любых ОВР реакций!
Пример
Для примера попробуем расставить коэффициенты у следующей реакции ОВР, попробуем решить эту задачу в укороченном варианте:
X1KMnO4 = X2K2MnO4 + X3MnO2 + X4O2
Из уравнения (для калия):
X1/2 = X2
Составим уравнение по марганцу:
X1Mn = X1Mn/2 + X3Mn
Сократим марганец:
X1 = X1/2 + X3
X1/2 = X3
Отсюда:
X1/2 = X3 = X2
Составим уравнение по кислороду:
4X1O = 4X2O + 2X3O + 2X4O
Т.к.:
X1/2 = X3 = X2
То подставив, выразив через X1:
4X1O = 4X1O/2 + 2X1O/2 + 2X4O
4X1O = 2X1O + X1O + 2X4O
X1 = 2X4
X1/2 = X4
Значит:
X1/2 = X3 = X2 = X4
Выразим через X1 все неизвестные:
X1KMnO4 = (X1/2)K2MnO4 + (X1/2)MnO2 + (X1/2)O2
Примем X1 = 2:
2KMnO4 = 1K2MnO4 + 1MnO2 + 1O2
Конечно, данное уравнение можно было решить и методом перебора, и методом электронного баланса, однако наш метод дает вам стопроцентное решение в любой реакции ОВР!
www.chem-mind.com
Как расставить коэффициенты в ОВР видео Видео
…
4 лет назад
Баланс с органическими в-ми и комплексами: https://youtu.be/3c75eSPVZDU Задания на баланс из ЕГЭ https://youtu.be/o8LYQoEcv6E Вебинары…
…
4 лет назад
Уравнивание ОВР методом электронного баланса. ЕГЭ. Ссылки на дополнительные видео: 1) ОВР Метод электронно-и…
…
3 лет назад
в видеофрагменте представлен пример составления ОВР.
…
6 лет назад
Составление уравнений окислительно-восстановительных реакций. Метод электронного баланса. Окислитель,…
…
7 лет назад
На этом уроке дается понятие о процессах окисления и восстановления, типичных окислителях и восстановител…
…
2 лет назад
Совсем несложно записать схему реакции, которая показывает, какие вещества вступают в реакцию, а какие…
…
2 лет назад
Пройти тест по теме: https://goo.gl/kBrKAr Перейти к тренажерам: https://goo.gl/5qk4wx Домашнее задание от Домашней Школы InternetUro…
…
11 меc назад
В этом уроке рассматриваем метод электронного баланса, позволяющий расставить коэффициенты в окислительн…
…
10 меc назад
УрокиПоХимии #ChemEra #ОкислительноВосстановительныеРеакции #ОВР #ЭлектронныйБаланс #ЗадачиПоХимии #Коэффиц…
…
4 лет назад
Химия. Учимся расставлять коэффициенты в уравнениях химических реакций методом подбора. Пошаговая инструк…
…
8 лет назад
Расстановка коэффициентов простейшими приемами.
…
2 лет назад
Видео-урок по теме «Качественный и количественный состав вещества». Как определить качественный состав…
…
2 лет назад
Химия, 8 класс. Понятия: ОВР, окислитель, восстановитель, окисление, восстановление. Расстановка коэффициент…
…
6 меc назад
Прямые эфиры в Инстаграм-аккаунте Ирины Владимировны https://www.instagram.com/ufahimik Каждый день в Stories изучаем новую…
…
1 лет назад
УрокиПоХимии #ChemEra #УравнениеРеакций #КоэффициентыХимия #РасстановкаКоэффициентов #ТипыХимическихРеакци…
…
6 лет назад
Учимся определять степень окисления.
…
4 меc назад
В данном ролике мы разобрали, что такое степень окисления, заряд и ОВР, а также научились их уравнивать с…
video-kroft.ru
Метод полуреакций при расстановке коэффициентов в ОВР
Поиск ЛекцийЗакономерности протекания окислительно-восстановительных реакций. Влияние различных факторов на протекание окислительно-восстановительных реакций
ОВ-реакции – это такие реакции, которые протекают с переходом электронов от одних частиц (восстановителя) к другим (окислителю), например, при вытеснении цинком меди из раствора сульфата меди (II).
CuSO4 + Zn → Сu + ZnSO4
Можно дать и другое определение: ОВ-реакция – это реакция, протекающая с изменением степени окисления атомов реагирующих веществ.
При протекании ОВ-реакции происходит процесс окисления и процесс восстановления.
Окисление – это процесс отдачи электронов частицей (молекулой, атомом, ионом). Частица, отдавая электроны, окисляется, а сама является восстановителем по отношению к другой частице.
Zn° — 2e ® Zn2+ – процесс окисления, а цинк будет восстановителем.
При окислении степень окисления атома повышается (цинк повышает степень окисления от нуля до +2, то есть переходит из менее окисленного состояния Zno в более окисленное состояние Zn2+).
Восстановление – это процесс присоединения электронов частицей. Частица, присоединяя электроны, восстанавливается, а сама является окислителем по отношению к другой частице.
Cu2+ + 2e ® Cu° – процесс восстановления, а ион Cu2+ будет окислителем. При восстановлении степень окисления атома уменьшается (медь понижает степень окисления с +2 до нуля).
Окислительно-восстановительные свойства элементов зависят от строения атома данного элемента и определяются положением элемента в ПСЭ. В периоде слева направо (®) восстановительные свойства элементов уменьшаются, а окислительные свойства увеличиваются. В главных подгруппах сверху вниз восстановительные свойства элементов увеличиваются. Поэтому чем правее и выше находится элемент в ПСЭ, тем будет проявлять более сильные окислительные свойства. Самыми сильными окислителями поэтому являются галогены (кроме йода) и кислород. И наоборот, чем левее и ниже находится элемент в ПСЭ, тем сильнее проявляет восстановительные свойства. Поэтому самыми сильными восстановителями являются щелочные (Na, K, Cs и др.) и щелочноземельные (Ca, Sr, Ba) металлы.
Окислительно-восстановительные свойства зависят также от степени окисления элемента в веществе:
1) Если элемент (например, Mn и Cr) находится в высшей степени окисления (например, KMnO4, K2Cr2O7 и др.), то он может только понижать степень окисления, то есть только принимать электроны, являясь только окислителем.
2) Если элемент (например, йод и сера) находится в низшей степени окисления (KI, Na2S и др.), то может только повышать степень окисления, являясь только восстановителем.
3) Если элемент может проявлять в соединениях различную степень окисления и при этом в данном соединении имеет промежуточную степень окисления (Na2SO3, NaNO2, MnO2), то данный элемент может и повышать степень окисления, и понижать, то есть может и окисляться, и восстанавливаться, проявляя окислительно-восстановительную двойственность (то есть может быть и окислителем, и восстановителем).
Например, в КNO2 азот имеет промежуточную степень окисления, равную +3 и может повышать ее до +5 (окисляясь до КNO3), и понижать до +2 (NO), то есть КNO2 может быть и окислителем, и восстановителем.
Метод полуреакций при расстановке коэффициентов в ОВР
Этот метод, как и метод электронного баланса, основывается на том положении, что число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Только метод электронного баланса рассматривает отдельные атомы элементов (Mn+7, Ag+, Cr+6, N-3), а метод полуреакций рассматривает частицы (ионы, молекулы), которые реально есть в растворе, в котором протекает ОВ-реакция.
Рассмотрим ОВ-реакцию, протекающую в кислой среде (среду создает H2SO4):
KMnO4 + KNO2 + H2SO4 ® MnSO4 + KNO3 + K2SO4 + H2O
Определяем степени окисления элементов, которые изменяют степени окисления (то есть марганца и азота), а затем определяем окислитель и восстановитель.
| KMn+7O4 + KN+3O2 + H2SO4 ® Mn+2SO4 + KN+5O3 + K2SO4 + К2SO4 + H2O окислитель восстановитель |
Далее записываем ионную схему реакции: сильные и хорошо растворимые электролиты записываем в виде ионов; слабые электролиты, неэлектролиты, газы и осадки записываем в виде молекул.
Затем составляем полуреакции окисления и восстановления, т.е. процессы окисления и восстановления.
Следует знать следующие два основных правила:
1. Полуреакции отщепления кислорода (восстановления) в кислой среде протекают за счет катионов водорода с образованием молекул воды; в нейтральной и щелочной средах – за счет молекул воды с образованием OH— ионов.
2. Полуреакции присоединения кислорода (окисления) в кислой и нейтральной средах протекают за счет молекул воды с образованием катионов водорода; щелочной среде – за счет OH— ионов с образованием молекул воды.
| MnO4— + 8Н+ | +5e ® | Mn2+ + 4H2O | полуреакция восстановления | |
| 1 + 8 = +7 | +2 + 4×0 = +2 | |||
| NO2— + H2O | –2e ® | NO3— + 2H+ | полуреакция окисления | |
| -1 + 0 = -1 | -1 + 2 = +1 |
Н2О и ионы Н+ есть слева и справа, поэтому сокращаем:
2MnO4— + 6H+ + 5NO2— ® 2Mn2+ + 3H2O + 5NO3—
Уравнение ОВ-реакции в молекулярной форме:
2KMnO4 + 5KNO2 + 3H2SO4 ® 2MnSO4 + 5KNO3 + K2SO4 + + 3H2O
Направление ОВ – реакции, как и любой реакции, можно определить по изменению энергии Гиббса этой реакции, т.е. по ΔG. Рассмотрим, например, ОВ-реакцию Zno + Cu2+ → Cuo + Zn2+. Изменение энергии Гиббса при стандартных условиях для любой ОВ-реакции будет равно:
ΔGореакции = -ZF (jоокисл. — jовосст.),
где F – число Фарадея, равное 96 500 Кулон/моль экв.,
Z – число электронов, участвующих в данной ОВ-реакции,
jоокисл. и jовосст. – стандартные электродные потенциалы окислительной (jоокисл.) и восстановительной (jовосст.) систем.
┌─2e─↓
Для ОВ-реакции Zno + Cu2+ → Cuo + Zn2+, окислительной системой будет медная, для которой jоCu+2/Cuo = + 0,34 в, а восстановительной системой будет цинковая, для которой jоZn2+/Zno = -0,76 в. При этом Z = 2, т.е. два электрона передаются в этой ОВ-реакции от цинка к ионам Cu2+. Поэтому получаем:
ΔGо = — ZF (jоокисл — jовосст) = — 2 ∙ 96 500 (+0,34 – (-0,76)) = -212 300 Дж.
Для данной ОВ-реакции получили ΔGо < 0, поэтому эта реакция будет протекать в прямом направлении, т.е. слева направо (→).
Таким образом, ОВ-реакция будет протекать в прямом направлении (т.е. ΔGо будет меньше нуля) в том случае, когда jоокисл > jовосст.
Рекомендуемые страницы:
poisk-ru.ru
Как расставлять коэффициенты в химических уравнениях
Уравнением реакции в химии называется запись химического процесса с помощью химических формул и математических знаков.
Такая запись является схемой химической реакции. Когда возникает знак «=», то это называется «уравнение». Попробуем его решить.
Пример разбора простых реакций
В кальции один атом, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. С правой стороны уравнения Са тоже один. По кальцию нам не надо работать.
Это интересно: алканы – химические свойства предельных углеводородов.
Смотрим следующий элемент — кислород. Индекс 2 говорит о том, что здесь 2 иона кислорода. С правой стороны нет индексов, то есть одна частица кислорода, а с левой – 2 частицы. Что мы делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты – это то, что написано перед наименьшей частью. Они имеют право меняться. Для удобства саму формулу не переписываем. С правой части один умножаем на 2, чтобы получить и там 2 иона кислорода.
После того как мы поставили коэффициент, получилось 2 атома кальция. С левой стороны только один. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество атомов элементов равно с обеих сторон, то можем поставить знак «равно».
Другой наглядный пример: два водорода слева, и после стрелочки у нас тоже два водорода.
Смотрим дальше:
- Два кислорода до стрелочки, а после стрелочки индексов нет, значит, один.
- Слева больше, а справа меньше.
- Ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось два атома водорода. И чтобы получить 4, мы должны водород умножить на два.
Вот тот случай, когда элемент в одной и в другой формуле с одной стороны, до стрелочки.
Один ион серы слева, и один ион — справа. Две частицы кислорода, плюс еще две частицы кислорода. Значит, что с левой стороны 4 кислорода. Справа же находится 3 кислорода. То есть с одной стороны получается четное число атомов, а с другой – нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. Для этого умножаем на два всю формулу после стрелочки. После умножения получаем шесть ионов кислорода, да еще и 2 атома серы. Слева же имеем одну микрочастицу серы. Теперь уравняем ее. Ставим слева уравнения перед серой 2.
Уравняли.
Сложные реакции
Этот пример более сложный, так как здесь больше элементов вещества.
Это называется реакцией нейтрализации. Что здесь нужно уравнивать в первую очередь:
- С левой стороны один атом натрия.
- С правой стороны индекс говорит о том, что здесь 2 натрия.
Напрашивается вывод, что надо умножить всю формулу на два.
Теперь смотрим, сколько серы. С левой и правой стороны по одной. Обращаем внимание на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем 2.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны также 6 атомов. Проверяем водород. Два атома водорода и еще 2 атома водорода. То есть будет четыре атома водорода с левой стороны. И с другой стороны также четыре атома водорода. Все элементы уравнены. Ставим знак «равно».
Следующий пример.
Здесь пример интересен тем, что появились скобки. Они говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на него. Начать необходимо с азота, так как его меньше, чем кислорода и водорода. Слева азот один, а справа, с учетом скобок, его два.
Справа два атома водорода, а нужно четыре. Мы выходим из положения, просто умножая воду на два, в результате чего получили четыре водорода. Отлично, водород уравняли. Остался кислород. До реакции присутствует 8 атомов, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Последний пример.
На очереди у нас барий. Он уравнен, его трогать не нужно. До реакции присутствует два хлора, после нее – всего один. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Теперь за счет коэффициента, который только что поставлен, после реакции получилось два натрия, и до реакции тоже два. Отлично, все остальное уравнено.
Также уравнивать реакции можно методом электронного баланса. Этот метод имеет ряд правил, по которым его можно осуществлять. Следующим действием мы должны расставить степени окисления всех элементов в каждом веществе для того, чтобы понять где произошло окисление, а где восстановление.
obrazovanie.guru
Как быстро расставить коэффициенты в уравнениях окислительно-восстановительных реакций
Важнейшие окислители и восстановители
Важнейшие окислители и восстановители Весьма важным является определение самой возможности протекания ОВР, а также установление продуктов реакции. В связи с этим следует отметить, что направление протекания
ПодробнееОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
РАЗДЕЛ 5 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ Химические реакции, протекающие с изменением степеней окисления атомов нескольких элементов реагирующих веществ, называются окислительно-восстановительными.
ПодробнееОкислительно-восстановительные реакции
Окислительно-восстановительные реакции Для составления электронно-ионных уравнений необходимо помнить, что вещества, атомы или молекулы которых отдают электроны, называются восстановителями. Степень окисления
ПодробнееMnO 2 Манганат (K 2 MnO 4 или KNaMnO 4, Na 2 MnO 4 ) —
Перманганат калия как окислитель. KMnO 4 + восстановители в кислой среде Mn +2 в нейтральной среде Mn +4 в щелочной среде Mn +6 (соль той кислоты, которая участвует в реакции) MnSO 4, MnCl 2 MnO 2 Манганат
ПодробнееПодготовка к ЕГЭ по химии
Подготовка к ЕГЭ по химии Окислительновосстановительные реакции МБОУ гимназия «Лаборатория Салахова» О.Г. Степаненко Место окислительно восстановительных реакций в КИМ ЕГЭ 2015 года по ХИМИИ 1 Часть1 Строение
ПодробнееОКИСЛИТЕЛЬНО ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
КАЗАНСКАЯ ГОСУДАРСТВЕННАЯ АРХИТЕКТУРНО — СТРОИТЕЛЬНАЯ АКАДЕМИЯ Кафедра химии ОКИСЛИТЕЛЬНО ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Методические указания к лабораторной работе по химии для студентов дневного, заочного
ПодробнееОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Министерство образования и науки Российской Федерации Государственное образовательное учреждение высшего профессионального образования «САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ МОРСКОЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
ПодробнееУЧИСЬ САМОСТОЯТЕЛЬНОСТИ
1 Ю.И. Юнг, В.Ю. Юнг УЧИСЬ САМОСТОЯТЕЛЬНОСТИ ХИМИЯ ПОСОБИЕ ПО ХИМИИ ДЛЯ УЧАЩИХСЯ ОСНОВНОЙ ШКОЛЫ (7-8 классы) Часть 1 Ангарск 2 ХИМИЧЕСКИЕ УРАВНЕНИЯ. Необходимо знать: — химические уравнения; Вам необходимо
ПодробнееПримеры решения задач
Пример 1 Примеры решения задач Исходя из степени окисления брома в соединениях: КBr, Br, BrF, BrO, HBrO, определите, какое из веществ может быть только окислителем, какое только восстановителем, а какое
Подробнее2. Пояснительная записка
2. Пояснительная записка Рабочая программа элективного курса «Удивительный мир окислительно-восстановительных реакций» составлена на основе авторской программы и методических рекомендаций для учащихся
ПодробнееВХОДНЫЕ ТЕСТЫ ПО ХИМИИ
Вариант 1 1. Укажите символ элемента Водород (поставьте знак ): О Н N 2. Вещество это (поставьте знак ): железо стакан стекло 3. Заполните таблицу, используйте такие слова: вода, кислород, соль, железо.
ПодробнееКЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ. Сложные
ПодробнееХимия 2018 ГОТОВИМСЯ К ЕГЭ
Химия 2018 ГОТОВИМСЯ К ЕГЭ САЙТ ФИПИ HTTP://FIPI.RU/ABOUT МАТЕРИАЛЫ САЙТА МАТЕРИАЛЫ САЙТА МЕТОДИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ЕГЭ Кодификатор элементов содержания и требований к уровню подготовки выпускников Спецификация
ПодробнееПрактическое занятие 1, 2
Практическое занятие 1, 2 Основные классы неорганических соединений Преподаватель: асс. каф. ОХХТ к.х.н. Абрамова Полина Владимировна еmail: [email protected] ПЛАН ЗАНЯТИЯ I. Классификация неорганических
ПодробнееПояснительная записка
Пояснительная записка Рабочая тетрадь рекомендована для студентов очной формы обучения, реализующих образовательную программу среднего (полного) общего образования технического профиля. Данная рабочая
ПодробнееЗадание 37 ЕГЭ по химии (решения)
Верное решение задания 37 должно содержать уравнения четырёх За верную запись каждого уравнения реакции можно получить 1 балл. Максимально за выполнение этого задания можно получить 4 балла. Каждое верное
ПодробнееЗАДАНИЕ 3. Примеры решения задач
ЗАДАНИЕ 3 Примеры решения задач Пример 1. В четырех пробирках без надписей находятся растворы следующих веществ: сульфата натрия, карбоната натрия, нитрата натрия и йодида натрия. Покажите, с помощью каких
ПодробнееОкислительно-восстановительные реакции
Окислительно-восстановительные реакции Нобелевские премии, присужденные за исследование окислительновосстановительных реакций Генри ТАУБЕ 1983 «за его работу по механизмам реакций электронного переноса,
ПодробнееДемонстрационный вариант 1
Химия. 9 класс. I Используется с бланками ответов — 2 Демонстрационный вариант 1 контрольных измерительных материалов для проведения в 2014 году государственной (итоговой) аттестации (в новой форме) по
Подробнееdocplayer.ru