|
|
nscience.ru
Названия основных неорганических кислот и солей. Неорганические кислоты, соли
| Формулы кислот | Названия кислот | Названия соответствующих солей |
| HClO4 | хлорная | перхлораты |
| HClO3 | хлорноватая | хлораты |
| HClO2 | хлористая | хлориты |
| HClO | хлорноватистая | гипохлориты |
| H5IO6 | иодная | периодаты |
| HIO3 | иодноватая | иодаты |
| H2SO4 | серная | сульфаты |
| H2SO3 | сернистая | сульфиты |
| H2S2O3 | тиосерная | тиосульфаты |
| тетратионовая | тетратионаты | |
| HNO3 | азотная | нитраты |
| HNO2 | азотистая | нитриты |
| H3PO4 | ортофосфорная | ортофосфаты |
| HPO3 | метафосфорная | метафосфаты |
| H3PO3 | фосфористая | фосфиты |
| H3PO2 | фосфорноватистая | гипофосфиты |
| H2CO3 | угольная | карбонаты |
| H2SiO3 | кремниевая | силикаты |
| HMnO4 | марганцовая | перманганаты |
| H2MnO4 | марганцовистая | манганаты |
| H2CrO4 | хромовая | хроматы |
| H2Cr2O7 | дихромовая | дихроматы |
| HF | фтороводородная (плавиковая) | фториды |
| HCl | хлороводородная (соляная) | хлориды |
| HBr | бромоводородная | бромиды |
| HI | иодоводородная | иодиды |
| H2S | сероводородная | сульфиды |
| HCN | циановодородная | цианиды |
| HOCN | циановая | цианаты |
Напомню кратко на конкретных примерах, как следует правильно называть соли.
Пример 1. Соль K2SO4 образована остатком серной кислоты (SO4) и металлом К. Соли серной кислоты называются сульфатами. K2SO4 — сульфат калия.
Пример 2. FeCl3 — в состав соли входит железо и остаток соляной кислоты (Cl). Название соли: хлорид железа (III). Обратите внимание: в данном случае мы не только должны назвать металл, но и указать его валентность (III). В прошлом примере в этом не было необходимости, т. к. валентность натрия постоянна.
Важно: в названии соли следует указывать валентность металла только в том случае, если данный металл имеет переменную валентность!
Пример 3. Ba(ClO)2 — в состав соли входит барий и остаток хлорноватистой кислоты (ClO). Название соли: гипохлорит бария. Валентность металла Ва во всех его соединениях равна двум, указывать ее не нужно.
Пример 4. (NH4)2Cr2O7. Группа NH4 называется аммоний, валентность этой группы постоянна. Название соли: дихромат (бихромат) аммония.
В приведенных выше примерах нам встретились только т. н. средние или нормальные соли. Кислые, основные, двойные и комплексные соли, соли органических кислот здесь обсуждаться не будут.
Для тренировки рекомендую вам самостоятельно назвать следующие соединения: LiF, NaClO3, Al2(SO4)3, Ni(NO3)2, KMnO4, AgBr, ZnCO3, (NH4)3PO4.
Если вас интересует не только номенклатура солей, но и методы их получения и химические свойства, рекомендую обратиться к соответствующим разделам справочника по химии: «Химические свойства неорганических соединений» и «Методы получения неорганических соединений».
www.repetitor2000.ru
РЯД СИЛЫ КИСЛОТ
РЯД СИЛЫ КИСЛОТТАБЛИЦА СИЛЫ КИСЛОТ. РЕДАКЦИЯ 1.2
Составитель – М. С. Шмарлин. Данные для 50 различных кислот. Обновление по сравнению с редакцией 1.0 : указана основность кислот и показаны константы кислотности по нескольким ступеням — обозначены как pKa(1), pKa(2) и т.д.
Кислота |
Название |
Основность |
pKa(1) |
pKa(2) |
pKa(3) |
|
Йодоводородная |
1 |
-10 |
|||
|
HClO4 |
Хлорная |
1 |
-10 |
||
|
HBr |
Бромоводородная |
1 |
-9 |
||
|
HCl |
Соляная (хлороводородная) |
1 |
-7 |
||
|
H2SO4 |
Серная |
2 |
-3 |
1.9 |
|
|
H2SeO4 |
Селеновая |
2 |
-3 |
1.9 | |
|
H3O+ |
Гидроксоний |
3 |
-1.74 |
15.7 |
21 |
|
HNO3 |
Азотная |
1 |
-1.4 |
||
|
HClO3 |
Хлорноватая |
1 |
-1 |
||
|
HIO3 |
Йодноватая |
1 |
0.8 |
||
|
NH2SO3H |
Сульфаминовая |
1 |
0.99 |
||
|
H2C2O4 |
Щавелевая |
2 |
1.42 |
4.27 | |
|
H5IO6 |
Йодная |
5 |
1.6 |
||
|
H3PO3 |
Фосфористая |
2 |
1.8 |
6.5 | |
|
H2SO3 |
Сернистая |
2 |
1.92 |
7.20 | |
|
HSO4— |
Гидросульфат |
1 |
1.92 |
||
|
H3PO2 |
Фосфорноватистая |
1 |
2.0 |
||
|
HClO2 |
Хлористая |
1 |
2.0 |
||
H3PO4 |
Фосфорная |
3 |
2.1 |
7.12 | 12.4 |
|
[Fe(H2O)6]3+ |
Гексаакважелеза (III) катион |
6 |
2.22 |
||
|
H3AsO4 |
Мышьяковая |
3 |
2.32 |
6.85 | 11.5 |
|
H2SeO3 |
Селенистая |
2 |
2.6 |
7.5 | |
|
H2TeO3 |
Теллуристая |
2 |
2.7 |
7.7 | |
|
HF |
Фтороводородная (плавиковая) |
1 |
3 |
||
|
H2Te |
Теллуроводородная |
2 |
3 |
12.16 | |
|
HNO2 |
Азотистая |
1 |
3.35 |
||
|
CH3COOH |
Уксусная |
1 |
4.76 |
||
|
[Al(H2O)6] 3+ |
Гексаакваалюминия (III) катион |
6 |
4.85 |
||
|
H2CO3 |
Угольная |
2 |
6.52 |
10.32 | |
|
H2S |
Сероводородная |
2 |
6.92 |
13 | |
|
H2PO4— |
Дигидрофосфат |
2 |
7.12 |
12.4 | |
|
HClO |
Хлорноватистая |
1 |
7.25 |
||
|
H4GeO4 |
Ортогерманиевая |
4 |
8.6 |
12.7 | |
|
HBrO |
Бромноватистая |
1 |
8.7 |
||
|
H6TeO6 |
Ортотеллуровая |
6 |
8.8 |
11 | 15 |
|
H3AsO3 |
Мышьяковистая |
2 |
9.2 |
||
|
HCN |
Синильная (циановодородная) |
1 |
9.21 |
||
|
H3BO3 |
Ортоборная |
1 |
9.24 |
||
|
NH4+ |
Аммоний |
1 |
9.25 |
||
|
H4SiO4 |
Ортокремниевая |
4 |
9.5 |
11.7 | 12 |
|
HCO32- |
Гидрокарбонат |
1 |
10.4 |
||
|
HIO |
Йодноватистая |
1 |
11.0 |
||
|
H2O2 |
Пероксид водорода |
2 |
11.7 |
||
|
HPO42- |
Гидрофосфат |
1 |
12.4 |
||
|
HS— |
Гидросульфат |
1 |
14.0 |
||
|
H2O |
Вода |
2 |
15.7 |
21 | |
|
OH— |
Гидроксид |
1 |
21 |
||
|
PH3 |
Фосфин |
1 |
27 |
||
|
NH3 |
Аммиак |
1 |
33 |
||
|
CH4 |
Метан |
1 |
34 |
||
|
H2 |
Водород |
1 |
38.6 |
Примечание. Показатель кислотности pKa есть отрицательный десятичный логарифм константы кислотности Ка — константы равновесия АH + H2O « H3O+ + A—
© Primchem 2002
Авторство: М. С. Шмарлин, Д. Н. Пелагеев. Администратор и web — мастер — М. С. Шмарлин. С вопросами и предложениями обращаться по адресу: [email protected]
primchem.narod.ru
Cайт учителя химии Ващенко Н.Ю.
Кислоты — сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков.
Классификация кислот
1. По числу атомов водорода: число атомов водорода (n) определяет основность кислот:
n = 1 одноосновная
n = 2 двухосновная
n = 3 трехосновная
2. По составу:
а) Таблица кислород содержащих кислот, кислотных остатков и соответствующих кислотных оксидов:

б) Таблица бескислородных кислот
Физические свойства кислот
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная h4BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая h3SiO3. Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
Способы получения кислот

Химические свойства кислот
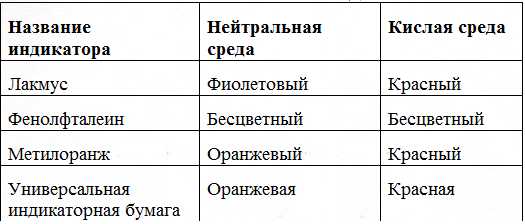
1. Изменяют окраску индикаторов
Видео «Действие кислот на индикаторы»
2. Реагируют с металлами в ряду активности до h3
(искл. HNO3 –азотная кислота)
Видео «Взаимодействие кислот с металлами»
Ме + КИСЛОТА =СОЛЬ + h3↑ (р. замещения)
Zn + 2HCl = ZnCl2 + h3
3. С основными (амфотерными) оксидами – оксидами металлов
Видео «Взаимодействие оксидов металлов с кислотами»
МехОу + КИСЛОТА= СОЛЬ + Н2О (р. обмена)
CuO + h3SO4 = CuSO4 + h3O
4. Реагируют с основаниями – реакция нейтрализации
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ h3O ( р. обмена)
h4PO4 + 3NaOH = Na3PO4 + 3h3O
5. Реагируют с солями слабых, летучих кислот — если образуется соль, выпадающая в осадок или выделяется газ:
2NaCl (тв.) + h3SO4(конц.) = Na2SO4 + 2HCl↑ ( р. обмена)
Видео «Взаимодействие кислот с солями»
6. Разложение кислородсодержащих кислот при нагревании
(искл. h3SO4 ; h4PO4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения )
Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду:
h3CO3 ↔ h3O + CO2↑
h3SO3 ↔ h3O + SO2↑
Видео «Химические свойства соляной кислоты»
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Распределите химические формулы кислот в таблицу. Дайте им названия:
LiOH, Mn2O7, CaO, Na3PO4, h3S, MnO, Fe(OH)3, Cr2O3, HI, HClO4 ,HBr, CaCl2, Na2O, HCl, h3SO4, HNO3, HMnO4, Ca(OH)2, SiO2, h3SO3, Zn(OH)2, h4PO4, HF, HNO2, h3CO3, N2O, NaNO3, h3S, h3SiO3
№2. Составьте уравнения реакций:
Ca + HCl
Na + h3SO4
Al + h3S
Ca + h4PO4
Назовите продукты реакции.
№3. Составьте уравнения реакций, назовите продукты:
Na2O + h3CO3
ZnO + HCl
CaO + HNO3
Fe2O3 + h3SO4
№4. Составьте уравнения реакций взаимодействия кислот с основаниями и солями:
KOH + HNO3
NaOH + h3SO3
Ca(OH)2 + h3S
Al(OH)3 + HF
HCl + Na2SiO3
h3SO4 + K2CO3
HNO3 + CaCO3
Назовите продукты реакции.
ТРЕНАЖЁРЫ
Тренажёр №1. «Формулы и названия кислот»
Тренажёр №2. «Установление соответствия: формула кислоты — формула оксида»
Тренажёр №3. «Действие кислот на индикаторы»
Тренажёр №4. «Классификация кислот по наличию кислорода в кислотном остатке»
Тренажёр №5. «Классификация кислот по основности»
Тренажёр №6. «Классификация кислот по растворимости в воде»
Тренажёр №7. «Классификация кислот по стабильности»
Техника безопасности — Оказание первой помощи при попадании кислот на кожу
Техника безопасности — Правила техники безопасности при работе с кислотами
Техника безопасности — Правило разбавления концентрированной серной кислоты водой
himiknoginsk.ucoz.ru
Таблица «Кислоты». Формулы, названия кислот, солей.
|
Молекулярная формула |
Название кислоты |
Сила |
Кислотный остаток и его заряд |
Название солей |
|
HCl |
соляная или хлороводородная |
сильная |
-Cl— |
хлориды |
|
H2 S |
сероводородная |
слабая |
-HS— =S2 — |
гидросульфиды сульфиды |
|
H2SO3 |
сернистая |
слабая |
-HSO3— =SO32 — |
гидросульфиты сульфиты |
|
HNO3 |
азотная |
сильная |
-NO3— |
нитраты |
|
H2SO4 |
серная |
сильная |
-H2SO4— =SO42 — |
гидросульфаты сульфаты |
|
H2SiO3 |
кремниевая |
слабая |
=SiO32 — |
силикаты |
|
H2CO3 |
угольная |
слабая |
-HCO3 — =CO3 2 — |
гидрокарбониты карбонаты |
|
H3PO4 |
фосфорная (ортофосфорная) |
слабая |
-H2PO4 — =HPO4 2 — =PO4 3 — |
дигидрофосфаты гидрофосфаты фосфаты
|
|
CH3COOH |
уксусная |
слабая |
CH3COOH— |
ацетаты |
|
HNO2 |
азотистая |
слабая |
-NO2 — |
нитриты |
Обратите внимание
Многоосновные кислоты образуют два вида солей: средние и кислые, причем трехосновная фосфорная образует кислые соли двух типов: дигидрофосфаты и гидрофосфаты. В порядке уменьшения силы наиболее распространенные кислоты располагаются так:
HNO3
H2SO4 H2SO3 H3PO4 CH3COOH
H2CO3 H2S
HClO
H2SiO3
HCl
iumka.ru
| Сила кислоты | Химическая формула | Название кислоты | Кислотный остаток с валентностью | Название кислотного остатка | Соответств. кислотный оксид | Примеры формул солей |
| Cильные | НСlO4 | ХЛОРНАЯ перхлоратная | -ClO4 | ПЕРХЛОРАТ | Cl2O7 | Ca(ClO4)2 перхлорат кальция |
| HNO3 | АЗОТНАЯ нитратная | -NO3 | НИТРАТ | N2O5 | KNO3 нитрат калия | |
| H2SO4 | СЕРНАЯ, сульфатная | =SO4 | СУЛЬФАТ | SO3 | BaSO4 сульфат бария | |
| HI | ИОДОВОДОРОД- НАЯ, иодидная | -I | ИОДИД | — | KI иодид калия | |
| HBr | БРОМОВОДОРОД- НАЯ, бромидная | -Br | БРОМИД | — | NaBr бромид натрия | |
| HCl | ХЛОРОВОДОРОД- НАЯ, СОЛЯНАЯ, Хлоридная | -Cl | ХЛОРИД | — | AgCl хлорид серебра | |
| Средние | H3PO4 | ОРТОФОСФОРНАЯ Ортофосфатная | =PO4 | ОРТОФОС- ФАТ | P2O5 | K3PO4 ортофос- фат калия |
| HF | ФТОРОВОДОРОД- НАЯ, фторидная | -F | ФТОРИД | — | BaF2 фторид бария | |
| HPO3 | МЕТАФОСФОР- НАЯ, метафосфатная | — PO3 | Метафос- фат | P2O5 | NaPO3 метафос- фат натрия | |
| Слабые | H2SO3 | СЕРНИСТАЯ, сульфитная | =SO3 | СУЛЬФИТ | SO2 | CaSO3 сульфит кальция |
| H2S | CЕРОВОДОРОД- НАЯ, сульфидная | —S | CУЛЬФИД | — | CuS сульфид меди(II) | |
| H2SiO3 | КРЕМНИЕВАЯ, силикатная | =SiO3 | CИЛИКАТ | SiO2 | Na2SiO3 силикат натрия | |
| H2CO3 | УГОЛЬНАЯ, карбонатная | =CO3 | КАРБОНАТ | CO2 | MgCO3 карбонат магния | |
| HNO2 | АЗОТИСТАЯ, | -NO2 | НИТРИТ | N2O3 | KNO2 |
infourok.ru
список кислот
Названия важнейших кислот и их солей
|
Формула кислоты |
Название кислоты |
Кислотный остаток |
Название солей (кислотного остатка) |
|
HF |
Фтороводородная |
F— |
Фториды |
|
NCl |
Хлороводородная |
Cl— |
Хлориды |
|
HBr |
Бромоводородная |
Br— |
Бромиды |
|
HI |
Иодоводородная |
I— |
Иодиды |
|
HCN |
Циановодородная |
CN— |
Цианиды |
|
H2S |
Сероводородная |
S2- |
Сульфиды |
|
H2SO4 |
Серная |
SO42- |
Сульфаты |
|
H2SO3 |
Сернистая |
SO32- |
Сульфиты |
|
HNO3 |
Азотная |
NO3— |
Нитраты |
|
HNO2 |
Азотистая |
NO2— |
Нитриты |
|
H2CO3 |
Угольная |
CO32- |
Карбонаты |
|
H3PO4 |
Ортофосфорная |
PO43- |
Ортофосфаты |
|
HPO3 |
Метафосфорная |
PO3— |
Метафосфаты |
|
H3PO3 |
Фосфористая |
HPO32- |
Фосфиты |
|
H2CrO4 |
Хромовая |
CrO42- |
Хроматы |
|
H2CrO7 |
Дихромовая |
Cr2O72- |
Дихроматы |
|
H3CrO3 |
Ортохромистая |
CrO33- |
Ортохромиты |
|
HMnO4 |
Марганцовая |
MnO4— |
Перманганаты |
|
H2MnO4 |
Марганцовистая |
MnO42- |
Манганаты |
|
H3BO3 |
Ортоборная |
BO33- |
Ортобораты |
|
HBO2 |
Метаборная |
BO2— |
Метабораты |
|
H2B4O7 |
Тетраборная |
B4O72- |
Тетрабораты |
|
H3AlO3 |
Ортоалюминиевая |
AlO33- |
Ортоалюминаты |
|
HalO2 |
Метаалюминиевая |
AlO2— |
Метаалюминаты |
|
H2ZnO2 |
Цинковая |
ZnO22- |
Цинкаты |
|
H4SiO4 |
Ортокремниевая |
SiO44- |
Ортосиликаты |
|
H2SiO3 |
Метакремниевая |
SiO32- |
Метасиликаты |
|
HСlO4 |
Хлорная |
ClO4— |
Перхлораты |
|
HСlO3 |
Хлорноватая |
ClO3— |
Хлораты |
|
HСlO2 |
Хлористая |
ClO2— |
Хлориты |
|
HСlO |
Хлорноватистая |
ClO— |
Гипохлориты |
studfiles.net
