Школьная олимпиада по химии — химия, прочее
Всероссийская олимпиада школьников по химии (2016-2017)
Школьный этап
8 класс
Задание 1. ТЕСТ (3,5 балла)
Выберите один правильный ответ(1 балл за каждый ответ)
1. Мельчайшая частица вещества , являющаяся носителем его химических свойств, называется:
1. крупинка 2. кристаллик 3. атом 4. молекула
2. Какой элемент назван в честь небесного тела — спутника Земли:
1. Со — кобальт 2. Те — теллур
3. Sе — селен 4. U — уран
3. Одним из первых металлических сплавов, которые человек начал использовать в глубокой древности, является:
1. сталь; 2. бронза; 3. дюралюминий; 4. чугун; 5. победит.
4. К чистым веществам относится:
1. уксус 2. дистиллированная вода
3. воздух 4. молоко
5. Является веществом:
1. капля росы; 2. медная монета;
3. кусочек мела; 4. ртуть.
6.Одинаковую относительную массу имеют вещества, формулы которых:
1. CuSO4 и CuS 2. CuS и CuO
3. CuO и Cu2S 4. CuSO4 и Cu2S
7. Укажите простое вещество, которое не является металлом:
1. олово; 2. фосфор; 3. ртуть; 4. магний; 5. медь.
Задание 2. (2 балла)
В начале ХХ столетия геологи зашифровали на картах места открытия руд ценных металлов при помощи координат химических элементов в Периодической системе. Арабской цифрой указывали номер периода, а римской – номер группы. Кроме того, в записях были еще буквы русского алфавита – А и Б. На одной из старых картах карт нашли обозначения: 4VIБ, 4VIIIБ2, 6IБ, 6IIБ. Задание: Расшифруйте записи геологов.
Задание 3. (6 баллов)
Предложите несколько вариантов (не более трех) решения цепочки реакций А→ Б → В и составьте уравнения реакций к данной схеме. Вещества А, Б, В – сложные неорганические соединения, относящиеся к разным классам соединений.
Задание 4. (3 балла)
Кто из нас не мечтал разыскать сокровища, спрятанные когда-то, в глубине веков, морскими пиратами?! Если разгадаете головоломку, то узнаете, как наверняка найти настоящий клад.
| Si – тон, Ar – оящ, Ne – др, Fe – ад, Mg — — э, F – Ий, Cr – кл, Cl –аст, Li – хо, Sc – Ий, N – рош, Na – уг. |
Задание 5. (4 балла)
Чтобы золушка не смогла поехать на бал, мачеха придумала ей работу: она смешала соль с мелкими гвоздями, деревянными стружками и речным песком и велела золушке очистить соль, а гвозди сложить в отдельную коробку. Золушка быстро справилась с заданием и успела поехать на бал. Объясните, как можно быстро выполнить задание мачехи.
Задание 6. (6 баллов)
В природе железо образует ряд минералов. Это магнетит Fe3O4 , гематит Fe2O3 лимонит 2Fe2O3 3Н2О. В каком из минералов массовая доля железа наибольшая.
Всероссийская олимпиада школьников по химии (2016-2017)
Школьный этап
9 класс
Задание 1. ТЕСТ (3 балла)
К каждому заданию даны несколько ответов, из которых только один верный. Выберите верный ответ. Запишите номер задания и поставьте номер выбранного ответа.
1. Наибольшую молекулярную массу имеет
1) BaCl2 2) ВаS04 3) Ва3(Р04)2; 4) Ва3Р2.
2. Сумма коэффициентов в молекулярном уравнении реакции
(СuОН)2СО3
+ НС1 = СuС12 + СО2 + …1) 10: 2) 11; 3) 12; 4) 9.
3. Количество вещества (моль), содержащееся в 6,255 г хлорида фосфора (V)
1) 0,5; 2) 0,3; 3) 0,03; 4) 0,15.
4. Число протонов и нейтронов в ядре изотопа 40 К
1) р = 20, n=19; 2) р = 40, n = 19;
3) р= 19, n = 21: 4) р = 21,n=19.
5. Реакция, в результате которой выпадает осадок
1) КОН + НС1; 2) К2С03 + Н2S04;
3) Cu(OH)2 +HNO3; 4) Nа2S + Рb(N03)2.
6. В 250 мл воды растворили 150 г хлорида кальция. Массовая доля соли в растворе (в процентах) равна:
1) 60; 2) 37,5; 3) 75; 4) 62,5
Задание 2. (7 балла)
Дана цепочка превращений:
X → XO2 → XO3 → H2
↓
K2XO3 KMnO4/H+
Определите элемент Х. Напишите уравнения соответствующих реакций.
Задание 3. (3 балла)
Напишите уравнения реакций, при помощи которых, используя простые вещества кальций, фосфор и кислород, можно получить фосфат кальция.
Задание 4. (3 балла)
Сумма протонов, нейтронов и электронов в атоме равна 42. Число нейтронов равно числу протонов. Определите химический элемент. Дайте объяснения.
Задание 5. (3 балла)
При взаимодействии 9,6 г оксида металла (III) с серной кислотой образуется 24 г сульфата металла (III). Определите металл.
Задание 6. (5 баллов)
В четырех пронумерованных склянках находятся растворы: гидроксида натрия, хлорида натрия, соляной кислоты и фенолфталеина. Как определить, в какой склянке какое вещество находится, не используя дополнительных реактивов, но имея достаточное количество пустых пробирок. Напишите уравнения проведенных реакций.
Всероссийская олимпиада школьников по химии (2016-2017)
Школьный этап
10 класс
Задание 1. (8 баллов)
Напишите уравнения реакций, с помощью которых можно осуществить превращения: пропан → 2-хлорпропан → пропен → 1,2-дихлорпропан → пропин → → пропен → пропанол-2 → 2-бромпропан → 2,3-диметилбутан.
Задание 2. (3 балла)
Расставьте коэффициенты в схемах следующих реакций методом электронного баланса
KMnO4 + H2O2 + H2SO4 = K2SO4 + MnSO4 + H2O + O2.
Задание 3. (7 баллов)
При нагревании навески некоторого твердого вещества
Задание 4. (5 баллов)
К раствору 6,75 г смеси хлоридов меди (II) и цинка прибавили избыток раствора гидроксида натрия. Выпавший осадок отделили, прокалили и получили при этом 2 г сухого остатка. Определите процентный состав смеси.
Задание 5. (5 баллов)
В 1862 г. М. Бертло синтезировал газ при пропускании водорода через электрическую дугу между двумя угольными электродами. Ученый определил его состав и дал ему название.
1) Определите формулу газа, если массовые доли элементов в соединении составляют: С- 92,3%, Н – 7,7%. Относительная плотность паров этого вещества по водороду равна 13. Запишите структурную формулу вещества и назовите его по систематической и тривиальной номенклатуре.
2) Запишите уравнение реакции получения этого газа в промышленности.
3) Запишите уравнения реакций взаимодействия этого вещества с избытком водорода и брома.
4) Запишите уравнение реакции взаимодействия этого газа с веществом Х, если в ходе реакции образуется вещество У желтоватого цвета, способное взрываться от удара.
Задание 6. (8 баллов)
В четырех пронумерованных пробирках находятся растворы хлорида бария, карбоната натрия, сульфата калия и хлороводородная кислота. Предложите способ распознавания веществ без использования дополнительных реактивов. Напишите уравнения реакций.
Всероссийская олимпиада школьников по химии (2016-2017)
11 класс
Задание 1. (6 баллов)
Осуществите следующие превращения. Назовите продукты реакции, укажите условия их проведения. Определите неизвестное вещество.( 6 баллов)

С6Н14 → → → Х→ → CH3COOCH2C6H5
Задание 2. (3 балла)
Расставьте коэффициенты в схемах следующих реакций методом электронного баланса
KMnO4 + H2O2 + H2SO4 = K2SO4 + MnSO4 + O2 +….
Задание 3. (5 баллов)
Космический корабль потерпел аварию и совершил посадку на неизвестную планету. Командир корабля поручил одному из космонавтов определить состав атмосферы. В распоряжении космонавта оказались лишь яблоко, малахитовая шкатулка, известковая вода. Он установил, что разрезанное яблоко не изменяется в атмосфере планеты, известковая вода не мутнеет, а при нагревании малахита образуется красный порошок. К какому выводу пришел космонавт и почему.
Задание 4. (5 баллов)
Сожгли смесь пропана и этана объемом 6,72 л. Продукт сгорания пропустили в известковую воду. При этом образовался осадок массой 80г. Определите процентный состав смеси.
Задание 5. (5 баллов)
Сожгли 2, 3 г неизвестного вещества, при этом образовалось 2, 24 л углекислого газа и 2, 7 г воды. Напишите молекулярную и структурную формулу данного вещества, если плотность его паров по азоту равна 1,64.
Задание 6. (8 баллов)
В пяти пронумерованных пробирках находятся растворы следующих веществ: KCL, KОН, K
Ключи
Всероссийская олимпиада школьников по химии (2016-2017)
Школьный этап
8 класс (макс. 24,5 баллов)
Задание 1. 3,5 балла (0,5 балла за каждое задание)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 3 | 3 | 2 | 2 | 4 | 4 | 2 |
Задание 2. 2 балла (0,5 балла за каждый элемент)
Координаты 4VIБ в Периодической системе означают 4-й период и VIБ – группу, элемент хром 4VIIIБ2 – 4-й период, VIIIБ2 — группу, элемент никель 6IБ – 6-й период, IБ – группа, элемент – золото 6IIБ – 6-й период, IIБ – группа, элемент ртуть.
Задание 3. 6 баллов (1 балл за каждую реакцию)
Варианты решения задания могут быть различными, например: CuCl2→Cu(OH)2 →CuO (не более трех вариантов)
1) CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl 2) Cu(OH)2 → CuO + H2O
Задание 4. 3 балла
Если расположить символы химических элементов в порядке возрастания их порядковых номеров, то из набора букв, записанных рядом с химическими знаками, получится фраза: «Хороший друг – это настоящий клад».
Задание 5. 4 балла
Древесные стружки от мелких железных гвоздей можно разделить при помощи магнита — 1 балл
Сахар с речным песком растворить в воде – 1 балл
Профильтровать — 1 балл
Выпарить воду – 1 балл
Задание 6. 6 баллов
1) Fe3O4 2 балла
2) Fe2O3
2 балла
2Fe2O3 3H2O
2 балла
Ключи
Всероссийская олимпиада школьников по химии (2016-2017)
Школьный этап
9 класс (макс. 24 балла)
Задание 1. 3 балла (0,5 балла за каждое задание)
| вопрос | 1 | 2 | 3 | 4 | 5 | 6 |
| ответ | 3 | 2 | 3 | 3 | 4 | 2 |
Задание 2 7 баллов (допускаются иные формулировки ответа, не искажающие его смысла)
Элемент Х – сера S 0,5 баллов
S + О2 = SО2 1 балл
2SО2 + О2 = 2SО3 1 балл
SО3 + Н2О = Н2SO4 + Q 1 балл
Н2SO4 + 2KOH = K2SO4 + 2H2O 1 балл
SО2 + 2KOH = K2SO3 +H2O 1 балл
2KMnO4 + 5K2SO3+ 3 H2SO4 = 2MnSO4 + 6K2SO4 + 3 H2O 1,5 балла (уравнение
– 1 балл, коэффициенты – 0,5 балла)
Задание 3 3 балла
4 Р + 5О2 = 2 Р2О5 1 балл
2 Сa + O2 = 2 CaO 1 балл
3 СaO + P2 O5 = Ca3 (PO4)2 1 балл
Задание 4 3 балла
Число протонов РАВНО числу электронов. Так как (по условию) число протонов равно числу нейтронов, следовательно, нейтроны = протоны = электроны, следовательно, 42:3=14. – 1 балл
Мы знаем число протонов, нейтронов и электронов. Число электронов равно порядковому номеру элемента, следовательно, это элемент под номером 14 — Si (кремний). – 1 балл
28 Si — электронов — 14, протонов — 14, нейтронов — 28-14 = 14. – 1 балл
Задание 5 3 балла
Me2O3 + 3 H2SO4 = Me2(SO4)3 + 3 H2O 1 балл
1 моль 1 моль
(2х + 48) г /моль (2х + 288) г/ моль
n (X) = m (X) / M (X)
n (Me2O3 ) = n (Me2(SO4)3)
9, 6 / 2х + 48 = 24 / 2х + 288;
х = 56 (Fe –железо) 2 балла
Задание 6 5 баллов
| 1 | Раствор фенолфталеина готовится с использованием этилового спирта и поэтому имеет характерный запах | 1 балл |
| 2 | Фенолфталеин приливают к трем веществам, в гидроксиде натрия появляется малиновая окраска. NaOН = Na+ + OH— при добавлении фенолфталеина появление малиновой окраски. | 1 балл |
| 3 | Окрашенный фенолфталеином раствор разливают в две пробирки и приливают два других раствора NaOH +HCl = H2O + NaCl – исчезновение малиновой окраски В пробирке — HCl | 0.5 балла 1 балл 0.5 балла |
| 4 | Оставшийся раствор – хлорид натрия | 1 балл |
Ключи
Всероссийская олимпиада школьников по химии (2016-2017)
Школьный этап
10 класс (макс. 36 баллов)
Задание 1. 8 баллов (по 1 за каждое уравнение)
Уравнения реакций:
1. CH3–CH2–CH3 + Cl2 → CH3–CHCl–CH3 + HCl (hν, to)
2. CH3–CHCl–CH3 + KOH(спирт.р-р) → СН3–СН=СН2 + KCl + H2O
3. СН3–СН=СН2 + Cl2 → СН3–СНCl–СН2Cl
4. СН3–СНCl–СН2Cl + 2 KOH(спирт.р-р) → СН3–С≡СН + 2 KCl + 2 H2O
5. СН3–С≡СН + H2 → СН3–СН=СН2 (to, p, kt)
6. СН3–СН=СН2 + HOH → СН3–СН(OH)–СН3 (to, p, kt)
7. СН3–СН(OH)–СН3 + HBr → СН3–СНBr–СН3 + H2O (при to)
8. 2 СН3–СНBr–СН3 + 2 Na → СН3–СН(CH3)–CH(CH3)–СН3 + 2 NaBr
(рекция Вюрца)
Задание 2. 3 балла
2KMnO4 + 5H2O2 + 3H2SO4 = K2SO4 + 2MnSO4 + 8H2O + 5O2 – 2 балла
электронный баланс:
Mn+7 + 5e = Mn+2—-x2 восстановление, окислитель 0,5 балла
2O-1 — 2e = O20——-x5 окисление, восстановитель 0,5 балла
Задание 3. 7 баллов (по 0,5 балла за каждое вещество, по 1 баллу за реакцию)
Определены все вещества: А – карбонат кальция, Б – оксид кальция, В – углекислый газ, Г – гидроксид кальция, Д – гидроксид калия, Е – карбонат калия
Составлены уравнения реакций: СаСО3 → СаО + СО2 СаО + Н2О → Cа(ОН)2
СО2 + 2КОН → К2СО3 + Н2О К2СО3 + Cа(ОН)2 → СаСО3 + 2КОН
Задание 4. (5 баллов)
| 1 | CuCL2 + 2 NaOH = Cu(OH)2 ¯ + 2NaCL | 1 – балл |
| 2 | ZnCL2 + 4 NaOH = Na2 [ Zn(OH)4 ] + 2NaCL | 1 – балл |
| 3 | Cu(OH)2 = CuO+ H2O | 0.5 – балла |
| 4 | Рассчитаем количество вещества оксида меди (II): n(CuO) = 2 г / 80г/моль = 0, 025 моль | 0.5 – балла |
| 5 | Значит, CuCL2 было также 0, 025 моль | 0.5 – балла |
| 6 | Отсюда масса CuCL2 равна: m ( СuCL2) = 0,025 моль · 136 г/моль= 3, 375 г | 0.5 – балла |
| 7 | масса ZnCL2 6,75 г – 3, 375 г = 3, 375 г | 0.5 – балла |
| 8 | Состав смеси: 50% CuCL2 и 50% ZnCL2 | 0.5 – балла |
| Итого | 5 баллов |
Задание 5. 5 баллов
1) Мr(СхНу)= 13х2=26 x : y = 92,3/12 : 7,7/1 =1:1 СН- простейшая формула. 0,5 балла
Истинная формула С2Н2 СН≡СН этин, ацетилен 0,5 балла
2) 2СН4→ С2Н2 + 3Н2 (15000) 1 балл
3) СН≡СН + 2Н2 → СН3 – СН3 (Темп., кат.) 1 балл
СН≡СН + 2Br2 → СНBr2 – СНBr2 1 балл
4) СН≡СН + 2 [Ag(NH3)2]OH → AgC ≡ CAg↓ + 4 NH3 + 2 H2O 1 балл
Задание 6. 8 баллов
Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысла)
Составлена таблица мысленного эксперимента
| BaCl2 | Na2CO3 | K2SO4 | HCl | |
| BaCl2 | выпадает осадок белого цвета | выпадает осадок белого цвета | без изменений | |
| Na2CO3 | выпадает осадок белого цвета | Без изменений | выделяется газ без цвета и запаха | |
| K2SO4 | выпадает осадок белого цвета | Без изменений | Без изменений | |
| HCl | Без изменений | Выделяется газ без цвета и запаха | Без изменений |
Приведены уравнения реакций в молекулярном и ионном виде:
BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl;
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
BaCl2 + K2SO4 = BaSO4↓ + 2KCl;
Указания по оцениванию
За составление таблицы – 1 балл
За таблицу мысленного эксперимента — 4 балла
За каждое правильно составленное молекулярное уравнение по 1 балла (3 уравнения) – 3 балла
Ключи
Всероссийская олимпиада школьников по химии (2016-2017)
Школьный этап
11 класс (макс. 32 балла)
Задание 1. 6 баллов
| 1 | С6Н14 →С6Н6+ 4 Н2 | 1 – балл |
| 2 | С6Н6 + CH3Cl → С6Н5 —CH3 + HCl ( кат.AlCl3 t) | 1 – балл |
| 3 | С6Н5 —CH3 + Cl2 → С6Н5 –CH2Cl + HCl ( на свету) | 1 – балл |
| 4 | С6Н5 –CH2Cl + NaOH → С6Н5 –CH2OH + NaCl ( водн. р-р) | 1 – балл |
| 5 | С6Н5 –CH2OH + СН3СООН → CH3COOCH2C6H5 + Н2О ( в присут. H2SO4) | 1 – балл |
| 6 | X1 — С6Н5 –CH2Cl | 1 – балл |
Задание 2. 3 балла
2KMnO4 + 5H2O2 + 3H2SO4 = K2SO4 + 2MnSO4 + 5O2+ 8H2O 2 балла
электронный баланс:
Mn+7 + 5e = Mn+2—-x2 восстановление, окислитель 0,5 балла
2O-1 — 2e = O20——-x5 окисление, восстановитель 0,5 балла
Задание 3. 5 баллов
| 1 | Яблоко не изменилось – нет кислорода. | 0,5 балла |
| 2 | Известковая вода не мутнеет – нет углекислого газа. | 0,5 балла |
| 3 | При нагревании малахит разлагается на оксид меди, воду, углекислый газ. Cu2(OH)CO3→ 2CuO + H2O + CO2 | 1 – балл |
| 4 | CuO + H2→ Cu +H2O | 0,5 балла |
| 5 | CuO + CO→Cu +CO2 | 1 – балл |
| 6 | 3CuO + 2NH3→ 3Cu + N2 +3H2O | 1 – балл |
| 7 | Атмосфера может содержать: водород, оксид углерода(II), азот. | 0,5 балла |
Задание 4. 5 баллов
| 1 | С2Н6 + 7\2О2 = 2 СО2 + 3Н2О | 0,5 – балла |
| 2 | С3Н8 + 2О2 = 2 СО2 + 3Н2О | 0,5 – балла |
| 3 | СО2 + Са (ОН)2 = СаСО3 + Н2О | 0,5 – балла |
| 4 | υ (смеси) = 6.72 л : 22. 4 л\моль = 0. 3 моль | 0,5 балла |
| 5 | υ (СаСО3 ) = 80 г : 100 г\моль = 0. 8 моль | 0,5 балла |
| 6 | х +у =0.3 х= 0.3 — у х= 0.3 — у х= 0.1 2х + 3у = 0.8 2( 0.3 — у ) + 3 у = 0.8 у=0.2 ω (С2Н6 ) = 0.1 : 0.3 = 0.33 или 33% ω (С3Н8 ) = 67% | 0,5 – балла 1 балл 1 балл |
Задание 5. 5 баллов
| 1 | Находим молярную массу в-ва М= 28* 1.64 = 46 | 1 балл |
| 2 | Находим массу углерода М=2.24\22,4 * 12= 1,2 | 1 балл |
| 3 | Находим массу водорода М=2,7*2\18= 0.3 | 1 балл |
| 4 | 2.3- (1.2+0.3)=0.8- масса кислорода | 1 балл |
| 5 | а:в:с= 1,2\12:0,3\1: 0.8\16= 0.1: 0.3:0.5= 2:6:1 | 1 балл |
| 6 | С2Н5ОН |
Задание 6. 8 баллов
Сливаем вещества поочередно
| 1. KCl , | 2. KОН | 3. K2CO3 | 4. H2SO4 | 5. ZnSO4 | |
| 1. KCl | — | — | — | — | — |
| 2. KОН | — | — | — | Разогрев пробирки | Выпадение осадка, затем растворение 1 балл |
| 3. K2CO3 | Выделение газа 1 балл | ||||
| 4. H2SO4 | Разогрев пробирки 1 балл | Выделение газа | |||
| 5. ZnSO4 | Выпадение осадка, затем растворение | ||||
| H2SO4 +2 KОН = 2H2О + K2SO4 | 1 балл | ||||
| K2CO3 + H2SO4 = K2SO4 + H2О + CO2 | 1 балл | ||||
| ZnSO4 + 2 KОН= Zn(ОН)2 + K2SO4 | 1 балл | ||||
| 2 KОН= Zn(ОН)2 = К2 [Zn(ОН)4] | 1 балл | ||||
| Составление таблицы | 1 балл | ||||
| Итого | 8 баллов | ||||
kopilkaurokov.ru
Всероссийская олимпиада школьников по химии
Всероссийская олимпиада школьников по химии | ГлавнаяЗадания и решения муниципального этапа 2008-2009 уч. года
Задания и решения муниципального этапа 2009-2010 уч. года
9 класс, 10 класс, 11 класс
Задания и решения школьного этапа 2010-2011 уч. года
Задания и решения муниципального этапа 2010-2011 уч. года
Задания и решения теоретического тура регионального этапа 2010-2011 уч. года
Задания и решения экспериментального тура регионального этапа 2010-2011 уч. года
Задания и решения теоретического тура регионального этапа 2011-2012 уч. года
Задания и решения экспериментального тура регионального этапа 2011-2012 уч. года
Примеры заданий школьного этапа 2012-2013 уч. года
задания: 9 класс | 10 класс | 11 класс
ответы: 9 класс | 10 класс | 11 класс
Задания и решения муниципального этапа 2012-2013 уч. года
Региональный этап 2012-2013 уч. года
теоретический тур: задания-9-10-11 | ответы-9-10-11
практический тур: задания-9-10-11 | ответы-9-10-11
Заключительный этап 2012-2013 уч. года
Задания и решения школьного этапа 2013-2014 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и решения школьного и муниципального этапов 2015-2016 уч. года
Школьный этап
задания: 7-8 кл. | 9 кл. | 10 кл. | 11 кл. | справочные материалы
решения: 7-8 кл. | 9 кл. | 10 кл. | 11 кл.
Муниципальный этап
задания: 7-8 кл. | 9 кл. | 10 кл. | 11 кл.
решения: 7-8 кл. | 9 кл. | 10 кл. | 11 кл
Задания и решения регионального этапа 2015-2016 уч. года
задания теоретического тура: 9 класс 10 класс 11 класс
решения теоретического тура: 9 класс 10 класс 11 класс
задания практического тура: 9 класс 10 класс 11 класс
решения практического тура: 9 класс 10 класс 11 класс
moschem.olimpiada.ru
Школьный этап Всероссийской олимпиады по химии 11 класс
УПРАВЛЕНИЕ ОБЩЕГО ОБРАЗОВАНИЯ АДМИНИСТРАЦИИ ГОРОДА МЦЕНСК ОРЛОВСКОЙ ОБЛАСТИ
ШКОЛЬНЫЙ ЭТАП ВСЕРОССИЙСКОЙ ОЛИМПИАДЫ ШКОЛЬНИКОВ ПО ХИМИИ
2016-2017 УЧЕБНЫЙ ГОД
11 класс
Задание №
Напишите уравнения реакций, протекающих в водных растворах
а) Na2SO3 + KMnO4 + H2SO4 → X + …
Для данного уравнения- установите продукты реакции, составьте электронный баланс, определите окислитель и восстановитель. Определите вещество Х, которое будет вступать в реакцию б)
б) Х + КОН →
Для второго уравнения составьте молекулярное и сокращённое ионное уравнение.
Задание № 2.
Вещество серебристо-белого цвета, полученное при прокаливании нитрата серебра, поместили в атмосферу озона и немного нагрели. Образованное темно-коричневое вещество полностью растворили в растворе аммиака. Через полученный бесцветный раствор пропустили ацетилен до выпадения жёлтого осадка. Напишите уравнения описанных реакций.
Задание № 3.
Напишите цепочку органических веществ, отвечающую указанным степеням окисления углерода
С-4 → С-1 → С+1 → С+3 → С-4
Напишите уравнения реакций с участием органических веществ, отвечающих схеме превращений.
В уравнениях используйте структурные формулы и указывайте условия протекания химической реакции
Задание № 4.
Смешали 100 мл 15% раствора гидроксида калия (плотность1,10 г/мл) и 331,7 мл 10% раствора бромоводородной кислоты (плотность 1,05 г/мл). Определите среду полученного раствора и массовую долю бромида калия в нём.
Задание № 5.
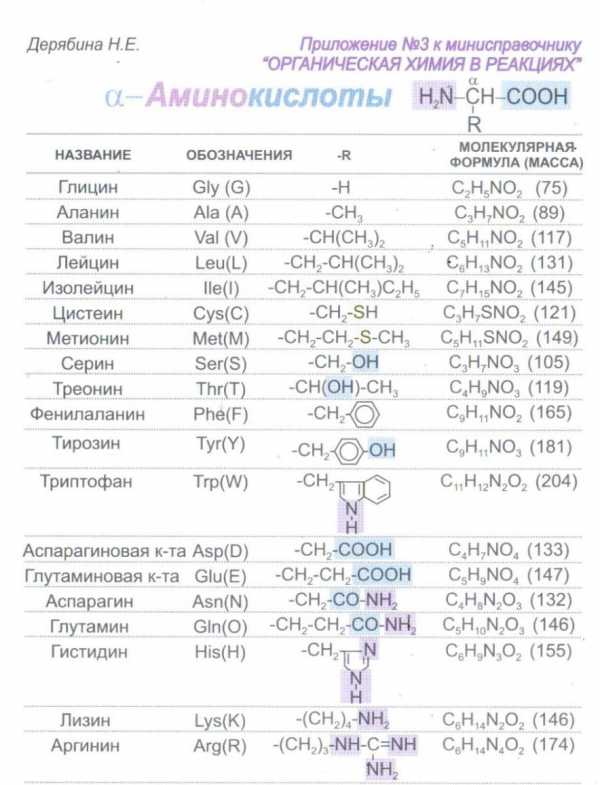
Установите строение трипептида, если известно, что число атомов углерода в нем в 3 раза больше числа атомов азота и в 1,8 раза больше числа атомов кислорода, при его частичном гидролизе образуются два изомерных дипептида, а для полного гидролиза 1 моль этого трипептида требуется 3 моль гидроксида калия
Критерии оценивания:
Верно составлена окислительно – восстановительная реакция5Na2SO3 +4KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4+ K2SO4+ 3H2O
Верно составлен электронный баланс
Верно указан окислитель и восстановитель
Верно определено вещество Х из продуктов реакции для второго превращения и написано молекулярное уравнение его взаимодействия с гидроксидом калия
MnSO4 + 2KOH = Mn(OH)2↓+ K2SO4
Написано сокращённое ионное уравнение для второй реакции
Mn+2 + 2OH— = Mn(OH)2↓
1 балл
1 балл
1 балл
1 балл
1 балл
ИТОГО 6 баллов
Задание № 2
2AgNO3 = 2Ag+2NO2 + O2
2Ag + O3 = Ag2O + O2
Возможен вариант
2Ag +2 O3 = Ag2O2 +2O2
Ag2O + 4NH4OH → 2 [Ag(NH3)2]OH + 3H2O
HC = CH + 2 [Ag(NH3)2]OH → AgC = CAg + 4NH3 + H2O
1 балл
1 балл
1 балл
1 балл
ИТОГО
4 балла
Задание № 3
Один из вариантов цепочки превращений
CH4 → C2H2 → CH3 – C(H)O → CH3 – COOK → CH4
2CH4 → C2H2 + 3H2
HC = CH + H2O → CH3 – C(H)O
CH3 – C(H)O + 2KMnO4 + 3KOH → CH3COOK + 2K2MnO4 +
2H2O
CH3COOK + KOH → CH4 + K2CO3
1 балл
1 балл
1 балл
1 балл
1 балл
ИТОГО 5 балов
Задание № 4
Составлено уравнение реакции
KOH + HBr = KBr+ H2O
Произведены расчёты по гидроксиду калия
m(р-ра КОН) = 100 ∙1.10= 110 г
m(КОН) = 110∙ 0,15=16,5 г
n(КОН) =16,5/56= 0,3 моль
Произведены расчёты по бромоводородной кислоте
m(р-ра HBr)= 331,7 ∙ 1,05 = 348,3 г
m(HBr)= 348,3 ∙0,1= 34,83 г
n(HBr)= 34,83/81= 0,43 моль
Из уравнения n(КОН): n(HBr)= 1:1
Из условия n(КОН): n(HBr)= 0,3: 0,43
Следовательно бромоводородная кислота в избытке.
Среда полученного раствора – кислая
По недостатку n(KBr)=n(KOH)= 0,3 моль
m(KBr)= 119∙0,3= 35,7 г
ω(KBr)= 35,7/110+348,3= 35,7/ 458,3= 0,0778∙ 100%=7,8%
Ответ: ω(KBr)=7,8%, среда раствора — кислая
1 балл
1 балл
1 балл
1 балл
1 балл
1 балл
1 балл
1 балл
ИТОГО
8 баллов
Задание № 5
Запишем формулу трипептида, исходя из того, что при его гидролизе образуются 2 изомерных дипептида (концевые аминокислоты одинаковые):
NH2-(CHR1)-CO NH-(CHR2)-CO NH-(CHR1)-COOH
На гидролиз 1 моль трипептида затрачивается 2 моль щелочи + 1 моль – на нейтрализацию концевой карбоксильной группы, итого 3 моль. Следовательно, дополнительно карбоксильных групп или фенольной гидроксильной группы в трипептиде не содержалось
Предположим, что атомов азота в трипептиде было 3, тогда атомов углерода 3∙3 = 9, а атомов кислорода 9 : 1,8 = 5.
В известной части трипептида (см. общую формулу) содержится 6 атомов углерода и 4 атома кислорода, следовательно, в искомых аминокислотах в радикалах должно оказаться 3 атома углерода и 1 атом кислорода
Пользуясь таблицей аминокислот (см. приложение), определим R2 – он должен содержать гидроксильную группу, это может быть серин или треонин. Треонин не подходит по числу атомов углерода. На каждый радикал приходится по 1 атому С, следовательно, это серин и аланин.
Ответ: ала-сер-ала
NH2-(CH-СН3)-CO NH-(CH-СН2-ОН)-CO NH-(CH-СН3)-COOH
1 балл
1 балл
1 балл
1 балл
1 балл
1 балл
1 балл
ИТОГО
7 баллов
ВСЕГО
30 балов
Литература:
Н.Е. Кузьменко, В.В. Ерёмин. 2400 задач для школьников и поступающих в ВУЗы
М.А. Ахметов. Окислительно- восстановительные реакции в органической химии
В.Н. Доронькин. Химия. Подготовка к ЕГЭ
Примечание: приложение № 1 раздаётся каждому участнику олимпиады
Приложение 1
infourok.ru
Архив заданий | Московская олимпиада школьников по химии
Архив заданий | ГлавнаяЗадания и решения очного теоретического тура заключительного этапа 2017-2018 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и ответы отборочного этапа 2017-2018 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и решения очного теоретического тура 2016-2017 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и ответы отборочного этапа 2016-2017 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и решения очного теоретического тура 2015-2016 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и решения очного теоретического тура 2014-2015 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и решения отборочного интернет-тура 2014-2015 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и решения очного теоретического тура 16.02.2014
8 КЛАСС 9 КЛАСС 10 КЛАСС 11 КЛАСС
Задания и решения очного теоретического тура 17.02.2013
8 класс 9 класс 10 класс 11 класс
Задания и решения отборочного интернет-тура 2012-2013 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и решения 2002-2003
8 класс 9 класс 10 класс 11 класс
Задания и решения 2003-2004
8 класс 9 класс 10 класс 11 класс
Задания и решения 2004-2005
8 класс 9 класс 10 класс 11 класс
Задания и решения 2005-2006
8 класс 9 класс 10 класс 11 класс
Задания и решения 2006-2007
8 класс 9 класс 10 класс 11 класс
Задания и решения 2007-2008
8 класс 9 класс 10 класс 11 класс
Задания и решения 2008-2009
8 класс 9 класс 10 класс 11 класс
Задания и решения 2009-2010
8 класс 9 класс 10 класс 11 класс
Задания и решения 2010-2011
8 класс 9 класс 10 класс 11 класс
Задания и решения 2011-2012
8 класс 9 класс 10 класс 11 класс
moschem.olimpiada.ru
Всероссийская школьная олимпиада по химии 10 класс
Муниципальное казенное общеобразовательное учреждение
«Мало-Каменская средняя общеобразовательная школа» Большесолдатского района Курской области
Школьный этап всероссийской
олимпиады школьников по химии
10 класс
2018-2019 учебный год
Учитель Пыхтина Валентина Дмитриевна
Всероссийская олимпиада школьников по химии (2018-2019)
Школьный этап
10 класс
Общее время выполнения работы – 2,5 часа.
Задание 1. (8 баллов)
Напишите уравнения реакций, с помощью которых можно осуществить превращения: пропан → 2-хлорпропан → пропен → 1,2-дихлорпропан → пропин → пропен → пропанол-2 → 2-бромпропан → 2,3-диметилбутан.
Задание 2. (3 балла)
Расставьте коэффициенты в схемах следующих реакций методом электронного баланса
KMnO4 + H2O2 + H2SO4 = K2SO4 + MnSO4 + H2O + O2.
Задание 3. (7 баллов)
При нагревании навески некоторого твердого вещества А образуется 5,6 г твердого вещества Б и газ В. Б растворили в воде, при этом образовался раствор, содержащий 7,4 г вещества Г. В пропустили через избыток раствора вещества Д, в результате чего образовалось 13,8 г вещества Е. При взаимодействии последнего в водном растворе с Г образуется А и Д. Определите все вещества.
Задание 4. (5 баллов)
К раствору 6,75 г смеси хлоридов меди (II) и цинка прибавили избыток раствора гидроксида натрия. Выпавший осадок отделили, прокалили и получили при этом 2 г сухого остатка. Определите процентный состав смеси.
Задание 5. (5 баллов)
В 1862 г. М. Бертло синтезировал газ при пропускании водорода через электрическую дугу между двумя угольными электродами. Ученый определил его состав и дал ему название.
1) Определите формулу газа, если массовые доли элементов в соединении составляют: С- 92,3%, Н – 7,7%. Относительная плотность паров этого вещества по водороду равна 13. Запишите структурную формулу вещества и назовите его по систематической и тривиальной номенклатуре.
2) Запишите уравнение реакции получения этого газа в промышленности.
3) Запишите уравнения реакций взаимодействия этого вещества с избытком водорода и брома.
4) Запишите уравнение реакции взаимодействия этого газа с веществом Х, если в ходе реакции образуется вещество У желтоватого цвета, способное взрываться от удара.
Задание 6. (8 баллов)
В четырех пронумерованных пробирках находятся растворы хлорида бария, карбоната натрия, сульфата калия и хлороводородная кислота. Предложите способ распознавания веществ без использования дополнительных реактивов. Напишите уравнения реакций.
Список литературы, интернет-ресурсов и других источников для использования при составлении заданий школьного этапа олимпиады
1. Чуранов С.С., Демьянович В.М. Химические олимпиады школьников. – М.: Знание, 1979.
2. Белых З.Д. Проводим химическую олимпиаду. – Пермь: Книжный мир, 2001.
3. Лунин В., Тюльков И., Архангельская О. Химия. Всероссийские олимпиады. Выпуск 1. (Пять колец) / Под ред. акад. Лунина В. В. — Просвещение Москва, 2010.
4. Лунин В., Тюльков И., Архангельская О. Химия. Всероссийские олимпиады. Выпуск 2. (Пять колец) / Под ред. акад. Лунина В. В. — Просвещение Москва, 2012.
5. Задачи Всероссийской олимпиады школьников по химии/ Под общей редакцией академика РАН, профессора В.В.Лунина / О. Архангельская, И. Тюльков, А. Жиров и др. — Экзамен Москва, 2003.
6. «Химия в школе» — научно-методический журнал
7. Энциклопедия для детей, Аванта+, Химия, т.17, М: «Аванта+», 2003.
8. Потапов В.М., Татаринчик С.Н. «Органическая химия», М.: «Химия», 1989
9. Органическая химия / под ред. Н.А. Тюкавкиной в двух томах, М.: «Дрофа», 2008
ИНТЕРНЕТ-РЕСУРСЫ:
1. Методический сайт Всероссийской олимпиады школьников http://vserosolymp.rudn.ru/mm/mpp/him.php;
2. Раздел «Школьные олимпиады по химии» портала “ChemNet” – http://www.chem.msu.ru/rus/olimp/;
3. Электронная библиотека учебных материалов по химии портала “ChemNet” http://www.chem.msu.ru/rus/elibrary/;
4. Архив задач на портале «Олимпиады для школьников» – https://info.olimpiada.ru/tasks 5. Сайт «Всероссийская олимпиада школьников в г. Москве» http://vos.olimpiada.ru/.
Критерии проверки
Всероссийская олимпиада школьников по химии (2018-2019)
Школьный этап
10 класс (макс. 36 баллов)
Рекомендации
к проверке работ учащихся на школьном этапе Всероссийской олимпиаде по химии
1. Допускаются любые формулировки ответов, не искажающие его смысла.
2. Призёрами являются учащиеся, набравшие больше половины максимального балла.
3. Победителем считается ученик, набравший максимальный балл среди призёров.
При подведении итогов олимпиады рекомендуется придерживаться следующей системы оценивания (количество баллов должно быть целым числом).
Задание 1. 8 баллов (по 1 за каждое уравнение)
Уравнения реакций:
1. CH3–CH2–CH3 + Cl2 → CH3–CHCl–CH3 + HCl (hν, to)
2. CH3–CHCl–CH3 + KOH(спирт.р-р) → СН3–СН=СН2 + KCl + H2O
3. СН3–СН=СН2 + Cl2 → СН3–СНCl–СН2Cl
4. СН3–СНCl–СН2Cl + 2 KOH(спирт.р-р) → СН3–С≡СН + 2 KCl + 2 H2O
5. СН3–С≡СН + H2 → СН3–СН=СН2 (to, p, kt)
6. СН3–СН=СН2 + HOH → СН3–СН(OH)–СН3 (to, p, kt)
7. СН3–СН(OH)–СН3 + HBr → СН3–СНBr–СН3 + H2O (при to)
8. 2 СН3–СНBr–СН3 + 2 Na → СН3–СН(CH3)–CH(CH3)–СН3 + 2 NaBr
(рекция Вюрца)
Задание 2. 3 балла
2KMnO4 + 5H2O2 + 3H2SO4 = K2SO4 + 2MnSO4 + 8H2O + 5O2 – 2 балла
электронный баланс:
Mn+7 + 5e = Mn+2—-x2 восстановление, окислитель — 0,5 балла
2O-1 — 2e = O20——-x5 окисление, восстановитель — 0,5 балла
Задание 3. 7 баллов (по 0,5 балла за каждое вещество, по 1 баллу за реакцию)
Определены все вещества: А – карбонат кальция, Б – оксид кальция, В – углекислый газ, Г – гидроксид кальция, Д – гидроксид калия, Е – карбонат калия
Составлены уравнения реакций: СаСО3 → СаО + СО2 СаО + Н2О → Cа(ОН)2
СО2 + 2КОН → К2СО3 + Н2О К2СО3 + Cа(ОН)2 → СаСО3 + 2КОН
Задание 4. (5 баллов)
Рассчитаем количество вещества оксида меди (II):n(CuO) = 2 г / 80г/моль = 0, 025 моль
0.5 – балла
5
Значит, CuCL2 было также 0, 025 моль
0.5 – балла
6
Отсюда масса CuCL2 равна:
m ( СuCL2) = 0,025 моль · 136 г/моль= 3, 375 г
0.5 – балла
7
масса ZnCL2 6,75 г – 3, 375 г = 3, 375 г
0.5 – балла
8
Состав смеси: 50% CuCL2 и 50% ZnCL2
0.5 – балла
Итого
5 баллов
Задание 5. 5 баллов
1) Мr(СхНу)= 13х2=26 x : y = 92,3/12 : 7,7/1 =1:1 СН- простейшая формула. 0,5 балла
Истинная формула С2Н2 СН≡СН этин, ацетилен 0,5 балла
2) 2СН4→ С2Н2 + 3Н2 (15000) 1 балл
3) СН≡СН + 2Н2 → СН3 – СН3 (Темп., кат.) 1 балл
СН≡СН + 2Br2 → СНBr2 – СНBr2 1 балл
4) СН≡СН + 2 [Ag(NH3)2]OH → AgC ≡ CAg↓ + 4 NH3 + 2 H2O 1 балл
Задание 6. 8 баллов
Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысла)
Составлена таблица мысленного эксперимента
BaCl2
Na2CO3
K2SO4
HCl
BaCl2
выпадает осадок белого цвета
выпадает осадок белого цвета
без изменений
Na2CO3
выпадает осадок белого цвета
Без изменений
выделяется газ без цвета и запаха
K2SO4
выпадает осадок белого цвета
Без изменений
Без изменений
HCl
Без изменений
Выделяется газ без цвета и запаха
Без изменений
Приведены уравнения реакций в молекулярном и ионном виде:
BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl;
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
BaCl2 + K2SO4 = BaSO4↓ + 2KCl;
Указания по оцениванию
За составление таблицы – 1 балл
За таблицу мысленного эксперимента — 4 балла
За каждое правильно составленное молекулярное уравнение по 1 балла (3 уравнения) – 3 балла
infourok.ru
Материаы для школьной олимпиады по химии для 8,9,10,11 класса
Всероссийская олимпиада школьников по химии-2013.
Школьный этап. 8 класс. Продолжительность – 2 ч
Задание 1.
В головоломке затаились названия четырёх простых веществ. Читать названия можно только по вертикали и горизонтали или сверху вниз и снизу вверх, или слева направо и справа налево. Найдите эти названия. Какими элементами образованы эти вещества?
Задание 2.
Используя латинские названия химических элементов, определите, какой химический элемент обязательно входит в состав сложных веществ: а) сульфиды б) силициды в) фосфаты д) оксиды. Укажите количество протонов и нейтронов в ядрах атомов найденных элементов.
Задание 3.
Какая вода: морская, речная, дождевая, снеговая, колодезная, водопроводная — содержит наибольшее количество примесей? Какая из них по содержанию примесей ближе к дистиллированной? Почему?
Задание 4.
Какие химические элементы названы в честь ученых, географических и астрономических объектов, мифических персонажей?
Задание 5.
Мальчик проделал два опыта. Сначала в чашку для выпаривания он налил 2 мл спирта и поджег его, после чего залил пламя водой из заранее подготовленной пробирки. Пламя сразу погасло. Затем мальчик повторил тот же опыт с 2 мл. бензина. На этот раз при добавлении воды пламя сразу не погасло, и жидкость продолжала гореть. Как можно объяснить такой результат?
Задание 6.
Сумма протонов, нейтронов и электронов в атоме равна 42. Число нейтронов равно числу протонов. Определите химический элемент. Дайте объяснения.
Всероссийская олимпиада школьников по химии-2013.
Школьный этап. 9 класс. Продолжительность – 2 ч
Тест. Выберете один правильный ответ.
1.Символ элемента, названного в честь России: 1)Rh 2)Ru 3)Rb 4)Ra
2.Истинный раствор образуется при смешивании с водой:1) уксусной кислоты 2) цемента 3) молока 4) подсолнечного масла
3.Массовая доля углерода наибольшая в веществе, формула которого: 1) CCl4 2) CHCl3 3) CH2Cl2 4) CH3Cl
4.Вещество, молекулярная формула которого содержит три атома: 1)азот 2)кислород 3) сера 4) углекислый газ
5.Количество вещества, содержащегося в 64 г кислорода, равно: 1)1 моль 2)2 моль 3)3 моль 4)4 моль
6.Масса вещества в 44,4 л (н.у.) газообразного кислорода равна: 1)16 г 2)32г 3)64г 4)80г
7.Расставьте коэффициенты в схеме: Р + О2 ® Р2О5. Сумма коэффициентов в уравнении реакции равна: 1)5 2)8 3)9 4)11
8.Самый распространенный элемент на земле: 1) кислород 2) алюминий 3) железо
4) кальций
9.Латунь в природе встречается в виде:
1) оксидов; 2) карбонатов; 3) самородном; 4) вообще не встречается.
10. Отстаивание применяют для разделения смесей веществ с водой в тех случаях, когда нерастворимые в воде вещества отличаются от нее по:
1) температуре кипения; 2) плотности; 3) массовой доле в смеси; 4) запаху.
Задание 1. Сколько литров этена (С2H4) можно получить из 160 г ацетилена (С2H2) по реакции: С2H2 + H2 = С2H4, если теоретический выход целевого продукта равен 80%?
Задание 2. Уголь сожгли в избытке кислорода. К продукту реакции добавили воду. В образовавшийся бесцветный раствор добавили избыток раствора гидроксида кальция. Выпал белый осадок. Осадок отфильтровали и прокалили. К полученному веществу добавили соляную кислоту. Составьте уравнения описанных реакций. Укажите их тип.
Напишите названия и класс веществ, образовавшихся во всех описанных реакциях.
Задание 3. Смесь порошков серы и железа массой 19,2 г обработали избытком разбавленного раствора серной кислоты. При этом выделилось 4,48 л (н.у.) газа и остался непрореагировавший твердый остаток. Вычислите массовую долю серы и железа в исходной смеси.
Задание 4.
Составьте уравнения реакций, с помощью которых можно осуществить цепочку превращений: К® К2О2® К2О ®KOH ® K2CO3® KCl ® KNO3
Каждое превращение осуществлять в одну стадию.
Запишите уравнения реакций в молекулярной, полной и краткой ионной формах.
Задание 5
В трёх пробирках под номерами находятся растворы веществ: HCl, CaCl2, KCl. В каждую из них добавили раствор карбоната натрия. В пробирке №1 видимых изменений не произошло. В пробирке №2 выпал осадок. В пробирке №3 выделился газ.
Растворы каких веществ находились в каждой пробирке? Запишите уравнения каждой из происходящих реакций.
Всероссийская олимпиада школьников по химии-2013.
Школьный этап. 10 класс. Продолжительность – 2 ч
Задание 1.
Составьте структурные формулы всех изомеров состава C4H8Br2 . Дайте им названия.
Задание 2.
Имеются три одинаковые колбы с бесцветными растворами. Известно, что в одной из них находится хлорид бария, в другой – соляная кислота, а третьей — карбонат натрия.
Предложите способ, позволяющий определить, в какой именно колбе какой раствор находится, используя только пробирки с растворами и не применяя других реактивов. Приведите уравнения реакций.
Задание 3.
Содержание углерода в углеводороде 85.71%, его плотность по азоту равна 2.5. Назовите все вещества, удовлетворяющие условию задачи.
Задание 4.
Определите объем воздуха, необходимый для сжигания 100 м3 природного газа, содержащего 89,6 % метана, 5,6% этана и несгораемые примеси.
Задание 5.
Один крупный металлургический завод оштрафовали на крупную сумму денег за то, что он плохо очищал сточные воды, которые спускал в городской пруд. В сточных водах этого завода содержались ионы металлов: Fe3+, Al3+, Pb2+, Cu2+, Zn2+, Mg2+. Перед главным химиком-технологом была поставлена задачи придумать наиболее простой и безвредный способ очистки сточных вод от этих ионов. Помогите главному технологу. Предложите реактив (или реактивы), которые можно использовать для удаления данных ионов из раствора, составьте уравнения реакций.
Задание 6.
Напишите уравнения реакций, описывающих следующие превращения:
Ca ® CaO ® Ca(OH)2® CaCO3® CaO ® Ca ® CaCl2® CaCO3®Ca(HCO3)2® CaCO3
Всероссийская олимпиада школьников по химии-2013.
Школьный этап. 11 класс. Продолжительность – 2 ч
Задание 1.
Напишите уравнения реакций, описывающих следующие превращения:
Ca ® CaO ® Ca(OH)2® CaCO3® CaO ® Ca ® CaCl2® CaCO3®Ca(HCO3)2® CaCO3
Задание 2.
Неизвестный алкен в присутствии серной кислоты присоединил 0,72 г воды и образовал 2,4 г продукта реакции. Выведите формулу алкена.
Задание 3.
Смесь медных и железных стружек массой 1,12 г обработали избытком соляной кислоты. При этом выделилось 0,112 л водорода (н.у.). Рассчитайте массовую долю каждого из металлов в смеси.
Задание 4.
В четырёх пробирках под номерами находятся растворы веществ: HCl, CaCl2, KCl, FeCl3. В каждую из них добавили раствор карбоната натрия. В пробирке №1 видимых изменений не произошло. В пробирке №2 выпал осадок. В пробирке №3 выделился газ. В пробирке №4 произошло одновременное выпадение осадка и выделение газа.
Растворы каких веществ находились в каждой пробирке? Запишите уравнения каждой из происходящих реакций.
Задание 5.
Уголь сожгли в избытке кислорода. К продукту реакции добавили воду. В образовавшийся бесцветный раствор добавили избыток раствора гидроксида кальция. Выпал белый осадок. Осадок отфильтровали и прокалили. К полученному веществу добавили соляную кислоту.
Составьте уравнения описанных реакций. Укажите их тип.
Напишите названия и класс веществ, образовавшихся во всех описанных реакциях.
Задание 6.
Даны формулы оксидов:
- 1)SiO2
- 2)MgO
- 3)CaO
- 4)CO2
- 5)Al2O3
Дайте ответы на следующие вопросы:
- 1)Какие из перечисленных оксидов реагируют с водой?
- 2)Какие оксиды могут реагировать с кислотами?
- 3)Какие оксиды реагируют с щелочами?
- 4)Какие оксиды называют негашёная известь, сухой лёд, кварц?
В ответах запишите последовательность цифр.
uchkopilka.ru
Школьный этап олимпиады по химии 8 класс 2017-2018
Задания
школьного этапа Всероссийской олимпиады школьников по химии
8 класс
2017-2018 учебный год
Подготовил:
учитель химии Семеновского филиала
МБОУ «Куйбышевская СОШ»
Апальков Андрей Дмитриевич
Задания
школьного этапа Всероссийской олимпиады школьников по химии
8 класс
Общее (максимальное) количество баллов – 24
1.Определите названия чистых веществ и смесей: зубная паста, лимонная кислота, озон, сталь, спиртовой раствор йода, морская вода, йод. (2 балла)
2. Выпишите из предложенного ряда химические явления. Укажите признаки, которые подтверждают Ваш выбор.
Плавление парафина; горение свечи; скисание молока; выпечка блинов; образование накипи. (2 балла)
3. Три сосуда одинакового объема при нормальных условиях заполнены тремя различными веществами: азотом, хлороводородом и водой. Расположите сосуды в порядке возрастания числа молекул в них. Ответ обоснуйте. (2 балла)
4. Скорлупа яиц состоит преимущественно из карбоната кальция СаСО3. Подсчитайте, сколько кальция теряет организм курицы с каждым снесенным яйцом, если масса скорлупы в среднем равна 10 г. (4 балла).
5. Ученик получил задание, в котором по названиям веществ необходимо было составить их химические формулы. Выполняя это задание, он не оставил пробелы между формулами веществ, в результате чего у него получилась запись:
H2OP2O5AlO2NaH2O3CO2Na3NCFeCl3N2К2SiO3
Выделите из этой записи формулы индивидуальных веществ, подчеркните простые вещества. (4 балла)
6. Основным витамином, содержащимся в чае, является витамин Р. Его формула — C36H28O15. Определите массу одной молекулы витамина Р (в граммах). (4 балла)
7. В соединении железа с кислородом отношение масс элементов составляет 7 : 3. Установите формулу данного соединения. (6 баллов)
Олимпиада по химии школьный этап 8 класс
Ответы
Задание 1. Определите названия чистых веществ и смесей: зубная паста, лимонная кислота, озон, сталь, спиртовой раствор йода, морская вода, йод.
Чистые вещества: лимонная кислота,озон, йод1
Смеси: зубная паста, спиртовой раствор йода, сталь, морская вода
1
Максимальное количество баллов
2
Задание 2. Выпишите из предложенного ряда химические явления. Укажите признаки, которые подтверждают Ваш выбор.
Плавление парафина; горение свечи; скисание молока; выпечка блинов; образование накипи.
Химические явления и их признаки:– Горение свечи, так как выделяется тепло, образуются новые вещества – сажа и вода. Или выделение теплоты и света.
– Скисание молока, так как появляется запах и осадок.
– Выпечка блинов, так как происходит изменение цвета.
– Образование накипи, так как образуется осадок.
Плавление парафина не является химическим процессом.
0,25
0,25
0,25
0,25
Плавление парафина не является химическим процессом, так это физическое явление. Признак — изменение агрегатного состояния.
1
Максимальное количество баллов
2
Задание 3. Три сосуда одинакового объема при нормальных условиях заполнены тремя различными веществами: азотом, хлороводородом и водой. Расположите сосуды в порядке возрастания числа молекул в них. Ответ обоснуйте.
Число молекул пропорционально количеству вещества. При равных условиях равные объемы газов содержат равные количества веществ, следовательно, и равное число молекул. При нормальных условиях азот и водород – газы, а вода жидкость.1
Следовательно, расположение будет осуществляться так:
n(N2) = n(HCL) < n(H2O)
1
Максимальное количество баллов
2
Задание 4. Скорлупа яиц состоит преимущественно из карбоната кальция СаСО3. Подсчитайте, сколько кальция теряет организм курицы с каждым снесенным яйцом, если масса скорлупы в среднем равна 10 г. (4 балла)
М(СаСО3) = 100г/моль. w (Са) = 40%,2
В 10г скорлупы содержится 4г кальция.
Ответ. С каждым яйцом курица теряет 4г кальция.
2
Максимальное количество баллов
4
Задание 5. Ученик получил задание, в котором по названиям веществ необходимо было составить их химические формулы. Выполняя это задание, он не оставил пробелы между формулами веществ, в результате чего у него получилась запись: H2OP2O5AlO2NaH2O3CO2Na3NCFeCl3N2К2SiO3
Выделите из этой записи формулы индивидуальных веществ, подчеркните простые вещества.
H2O; P2O5; Al; O2; Na; H2; O3; CO2; Na3N; C; FeCl3; N2; К2SiO32
Al; O2; Na; H2; C; N2;
2
Максимальное количество баллов
4
Задание 6. Основным витамином, содержащимся в чае, является витамин Р. Его формула — C36H28O15. Определите массу одной молекулы витамина Р (в граммах).
Массу одной молекулы кофеина находим по формуле m(C6H12O2N4)=, где NА— число Авогадро
М(C6H12O2N4)=6·12 + 12·1 +4·14 = 172 г/моль;
2
m(C6H12O2N4)=1·172 : 6,02·1023=28,57·10-23(г)
2
Максимальное количество баллов
4
Задание 7. В соединении железа с кислородом отношение масс элементов составляет 7 : 3. Установите формулу данного соединения. (6 баллов)
Массовая доля элемента в соединении рассчитывается по формуле= ω(х.э.)
2
Запишем формулу оксида железа в виде FexOy, тогда, зная из условия, что отношение масс железа и кислорода составляет 7 : 3, получим следующее уравнение:
=
2
Предположим, что y=1, тогда, решая уравнение, получим х=0,7.
Если у=2, то х=1,3.
Если у=3, то х=2.
То, х и у должны быть целыми числами, то есть подходит последний вариант – тогда исходный оксид- Fe2O3.
Ответ: Fe2O3.
2
Максимальное количество баллов
6
Победитель – от 14 баллов.
Призеры- от 8 до 14 баллов.
infourok.ru
