Азотная кислота — строение и химические свойства » HimEge.ru
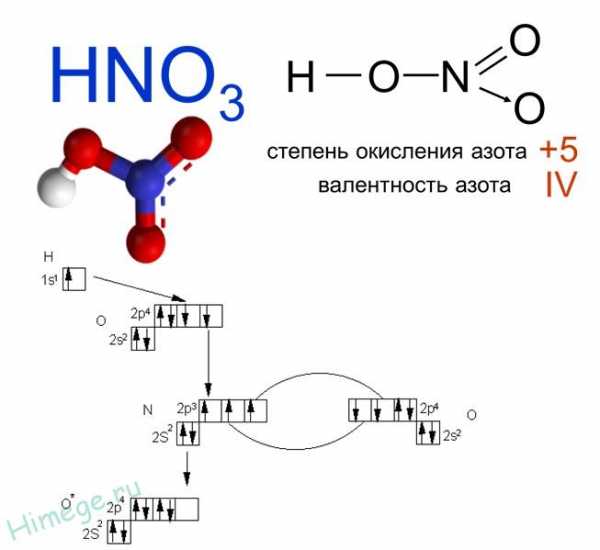
Азотная кислота – бесцветная гигроскопичная жидкость, c резким запахом, «дымит» на воздухе, неограниченно растворимая в воде.
tкип. = 83ºC.. При хранении на свету разлагается на оксид азота (IV), кислород и воду, приобретая желтоватый цвет:
4HNO3 = 4NO2 + 2H2O + O2.
Азотная кислота ядовита.
В растворе — сильная кислота; нейтрализуется щелочами, гидратом аммиака, реагирует с основными оксидами и гидроксидами, солями слабых кислот. Сильный окислитель; реагирует с металлами, неметаллами, типичными восстановителями. Концентрированная кислота пассивирует Al, Be, Bi, Со, Cr, Fe, Nb, Ni, Pb, Th, U; не реагирует с Au, Ir, Pt, Rh, Та, W, Zr. Не разрушает диоксид кремния. Смесь концентрированных HNO3 и HCl («царская водка») обладает сильным окислительным действием (превосходит чистую HNO3), переводит в раствор золото и платину. Еще более активна смесь концентрированных HNO3 и HF.
Mr = 63, 01; d = 1, 503(25); tпл = -41, 6 oC; tкип +82,6 oC (разл.).


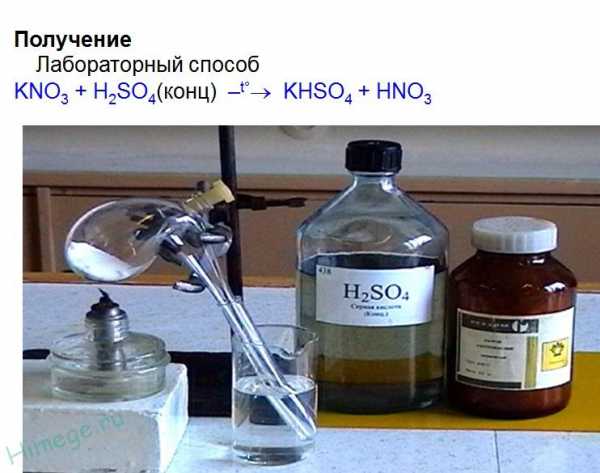
1. Типичные свойства кислот:
1) Взаимодействует с основными и амфотерными оксидами:
2HNO3 + CuO = Cu(NO3)2 + H2O
6HNO3 + Al2O3 = 2Al(NO3)3 + 3H2O
2) С основаниями, амфотерными гидроксидами:
HNO3 + NaOH = NaNO3 + H2O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O
3) Вытесняет слабые кислоты из их солей:
2HNO3 + Na2CO3 = 2NaNO3 + H2O + CO2
2HNO3 + Na2SiO3 = H2SiO3 ↓+ 2NaNO3
2. Специфические свойства азотной кислоты как окислителя
1) Взаимодействие азотной кислоты с металлами
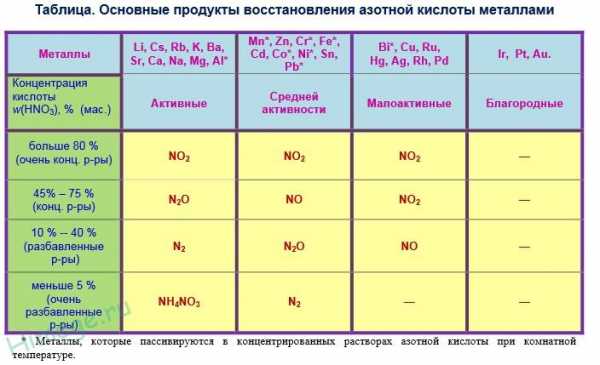
В качестве окислителя выступает азот в степени окисления +5, а не водород. В результате реакций образуется продукт восстановления нитрат-иона, соль и вода. Глубина восстановления нитрат-иона зависит от концентрации кислоты и от положения металла в электрохимическом ряду напряжений металлов. Возможные продукты взаимодействия металлов с азотной кислотой приведены в таблице ниже. Чем активнее металл и выше степень разбавления кислоты, тем глубже происходит восстановление нитрат-ионов азотной кислоты.

4 HN+5O3(конц.) + Cu0
N+5 + 1e → N+4 2 окислитель, пр-с восстановления
Cu0 – 2e → Cu+2 1 восстановитель, пр-с окисления
8 HN+5O3(разб.) + 3 Cu0 = 3 Cu+2(NO3)2 + 2 N+2O + 4 H2O
N+5 + 3e → N+2 2 окислитель, пр-с восстановления
Cu0 – 2e → Cu+2 3 восстановитель, пр-с окисления
2) Проявляет окислительные свойства при взаимодействии с неметаллами:
S + 6HNO3(конц) = H2SO4 + 6NO2 + 2H2O;
B + 3HNO3 = H3BO3 + 3NO2;
3P + 5HNO3 + 2H 2O = 5NO + 3H3PO4.
3) Азотная кислота окисляет сложные вещества:
6HI + 2HNO3 = 3I2 + 2NO + 4H2O;
FeS + 12HNO3 = Fe(NO3)3 + H2SO4 + 9NO2 + 5H2O.
4) Ксантопротеиновая реакция:
Азотная кислота окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук – «ксантопротеиновая реакция»).
Реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляют концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака (в щелочной среде) окраска переходит в оранжевую. Появление окрашивания свидетельствует о наличии ароматических аминокислот в составе белка.
5) Окислительные свойства «царской водки»:
HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O;
4HNO3 + 18HCl + Pt = 3H2[PtCl6] + 4NO + 8H2O
4HNO3 = 4NO2 + 2H2O + O2 (комн., на свету).
HNO3 + H2O = NO3– + H3O+.
HNO3 (разб.) + NaOH = NaNO3 + H2O ,
HNO3 (разб.) + NH3 · H2O = NH4NO3 + H2O.
2HNO3 (2-3%-я) + 8H0(Zn, разб. H2SO4) = NH4NO3 + 3H2O,
2HNO3 (5%-я) + 8H0(Mg, разб. H2SO4) = N2O ↑ + 5H 2O,
HNO3 (30%-я) + 3H0(Zn, разб. H2SO4) = NO2↑ H2O,
HNO3 (60%-я) + 2H0(Zn, разб. H2SO4) = HNO2 + H2O. (кат Pd)
2HNO3 (конц.) +Ag = AgNO3 + NO2 ↑ + H2O.
8HNO3 (разб.) + 3Cu = 3Cu(NO3)2 + 2NO↑ + 4H2O
10HNO3 (разб.) + 4Mg = 4Mg(NO3)2 +N2O↑ + 5H2O (примесь H2)
12HNO3 (разб.) + 5Sn —t—5Sn(NO3)2 + N2 ↑ + 6H2O (примесь NO)
30HNO3 (оч. разб.) + 8Al = 8Al(NO3)3 + 3 NH4NO3 + 9H2O (примесь H2)
12HNO3 (оч. разб.) + 5Fe = 5Fe(NO3)2 + N2
4HNO3 (разб.) + Fe = Fe(NO3)3 + NO↑ + 2H2O.
4HNO3 (конц., гор.) + Hg = Hg(NO3)2 + 2NO2 ↑ + 2H2O,
8HNO3(разб., хол) + 6Hg = 3Hg2(NO3)2 + 2NO ↑ + 4H2O.
6HNO3 (конц.) + S = H2SO4 + 6NO2 ↑ + 2H2O (кип.),
2HNO3 (конц.) + 6HCl(конц.) = 2NO↑ + 3Cl2↑ + 4H2O (100-150 oC).
HNO3 (конц.) + 4HCl(конц.) + Au = H[AuCl4] + NO↑ + 2H2O.
4HNO3 (конц.) + 18HCl(конц.) + 3Pt = 3H2[PtCl6] + 4NO↑ + 8H2O
4HNO3 (конц.) + 18HF(конц.) + 3Si = 3H2[SiF6] + 4NO↑ + 8H2O.
4HNO3 (дымящ.) + P 4O10 = 2N2O5 + 4HPO3 (в атмосфере O2+O3)
himege.ru
5.Взаимодействие металлов с азотной кислотой (разб. И конц.).
Окислителем в азотной кислоте любой концентрации является нитрат-ион (N5+). На сильные окислительные свойства нитрат-иона указывают высокие положительные значения ОВПОТ систем, например:
NO3— + 2H+ +e NO2+ H2O Eo = +0,76B
NO3— + 4H+ + 3e NO + 2H2O Eo = +0,96B
Катион водорода не может конкурировать с таким сильным окислителем, как нитрат-ион, поэтому водород не выделяется при взаимодействии металлов с азотной кислотой. Азотная кислота окисляет все металлы, кроме металлов платиновой группы, золота и титана.
N5+(NO3—) + ne → N4+( NO2),N2+( NO),N+( N2O),No(N2),N3-(NH3).
Аммиак в растворе азотной кислоты образует нитрат аммония: NH3 + НNO3 = NH4NO3. Любой из этих продуктов может образоваться при действии на металлы азотной кислоты.
Схематично реакцию можно представить следующим образом:
Ме + НNO3(р.,к.) → Ме(NO3)х + H2O + (NO2 NO, N2O, N2, NH4 NO3)
Исключение составляют металлы, оксиды которых обладают кислотными свойствами (Sn, Ge). С этими металлами реакция идет до образования не солей, а кислот:
Sn + 4НNO3 (конц.) = Н2SnO3↓ + 4NO2 + H2O
3Sn + 4НNO3(разб.)+H2O = 3Н2SnO3↓ + 4NO
Металлы Продукты вос-я Продукты вос-я
НNO3(конц.) НNO3(разб.)
Акт.металлы N2O N2O, N2, NH4 NO3
(до Zn вкл.)
Неакт.мет. NO2 NO
(ниже Zn)
Следует иметь в виду, что предлагаемая схема является упрощенной и при необходимости получения более строгой информации о поведении конкретного металла в растворе азотной кислоты, рекомендуется обращаться к специальной литературе (Н.Реми, Химия металлов в 2-х томах).
Разбавленная азотная кислота является более сильным окислителем, чем концентрированная, т.к. реакция протекает в более благоприятной среде ионов Н+, образующихся за счет сильной диссоциации кислоты в разбавленном растворе.
Необходимо помнить, что, как очень сильный окислитель, азотная кислота окисляет многие металлы до высоких степеней окисления (аналогично концентрированной серной кислоте, т.е. FeFe3+, CrCr3+, SnSn4+ и т.д.).
Примеры реакции:
Холодная концентрированная азотная кислота пассивирует некоторые металлы аналогично серной кислоте (железо, хром, никель, алюминий, кобальт, бериллий), что позволяет транспортировать эти кислоты в железных цистернах предварительно пассивированных этими кислотами. Реакцию пассивации азотной кислотой можно записать следующим образом:
Fe + 4НNO3(конц.) = Fe2O3 + 2Н2О + NО2 (на холоду).
Азотная кислота окисляет все металлы, за исключением золота, металлов платиновой группы и титана.
Взаимодействие металлов с «царской водкой»- (3V НСl + 1V HNO3)
Платина, золото и другие благородные металлы могут быть окислены «царской водкой». Химическая сущность процесса следующая:
Реакция между азотной и соляной кислотами приводит к образованию неустойчивого хлорида нитрозила, который распадается с образованием атомарного химически активного хлора:
3HCl + HNO3 = Cl2 + 2H2O + NOCl (NO +Cl)
NO3— + 4H+ + 3e NO + 2H2O x1
Cl— — e Clox3
NO3— + 4H+ + 3Cl— = NO + 2H2O +3Clo
Атомарный хлор окисляет металл с образованием хлорида металла в высшей степени окисления:
Au + 4HCl + HNO3 = H[AuCl4] + NO + 2H2O
NO3— + 4H+ + 3e NO + 2H2O x1
Auo — 3e Au3+x1
NO3— + 4H+ + Auo = NO + 2H2O + Au3+
studfiles.net
Азотная кислота. Cвойства азотной кислоты
 Концентрированная азотная кислота
Концентрированная азотная кислота Азотная кислота
Азотная кислота (HNO3) — одна из сильных одноосновных кислот с резким удушливым запахом, чувствительна к свету и при ярком освещении разлагается на один из оксидов азота (ещё называемый бурым газом — NO2 ) и воду. Поэтому её желательно хранить в тёмных ёмкостях. В концентрированном состоянии она не растворяет алюминий и железо, поэтому можно хранить в соответствующих металлических ёмкостях.
Азотная кислота — является сильными электролитом как многие кислоты) и очень сильный окислитель. Её часто используют при реакциях с органическими веществами.
Безводная азотная кислота — бесцветная летучая жидкость (t кип=83 °С; из-за летучести безводную азотную кислоту называют «дымящей») с резким запахом.
Азотная кислота как и озон может образовываться в атмосфере при вспышках молнии. Азот, который составляет 78% состава атмосферного воздуха, реагирует с атмосферным кислородом, образуя оксид азота NO. При дальнейшем окислении на воздухе этот оксид переходит в диоксид азота (бурый газ NO2), который реагирует с атмосферной влагой (облаками и туманом), образуя азотную кислоту . Но такое малое количество совершенно безвредно для экологии земли и живых организмов.
Один объем азотной и три объема соляной кислоты образуют соединение, называемое «царской водкой». Она способна растворять металлы (платину и золото), нерастворимые в обычных кислотах. При внесении в эту смесь бумаги, соломы, хлопка, произойдёт энергичное окисление, даже воспламенение.
При кипячении она раскладывается на составляющие компоненты (химическая реакция разложения):
HNO3 = 2NO2 +O2 + 2H2O — выделяется бурый газ (NO2), кислород и вода.
 Азотная кислота
Азотная кислота(при нагревании выделяется бурый газ)
Cвойства азотной кислоты
Cвойства азотной кислоты могут быть разнообразными даже при реакциях с одним тем же веществом. Они напрямую зависят от концентрации азотной кислоты. Рассмотрим варианты химических реакций.
— азотная кислота концентрированная:
С металлами железом (Fe), хромом (Cr), алюминием (Al), золотом (Au), платиной (Pt), иридием (Ir), натрием (Na) — не взаимодействует по причине образования на их поверхности защитной плёнки, которая не позволяет дальше окисляться металлу.
Со всеми остальными металлами при химической реакции выделяется бурый газ
(NO2). Например, при химической реакции с медью (Cu):
4HNO3 конц. + Cu = Cu(NO3)2 + 2NO2 + H2O
С неметаллами, например с фосфором:
5HNO3 конц. + P = H3PO4 + 5NO2 + H2O
— разложения солей азотной кислоты
В зависимости от растворённого металла разложение соли при температуре происходит следующими образом:
Любой металл (обозначен как Me) до магния (Mg):
MeNO3 = MeNO2 + O2
Любой металл от магния (Mg) до меди (Cu):
MeNO3 = MeO + NO2 + O2
Любой металл после меди (Cu):
MeNO3 = Me + NO2 + O2
— азотная кислота разбавленная:
При взаимодействии с щелочно-земельными металлами, а также цинком (Zn), железом (Fe), она окисляется до аммиака
(NH3) или же до аммиачной селитры (NH4NO3). Например при реакции с магнием (Mg):
10HNO3 разбавл. + 4Zn = 4Zn(NO3)2 + NH4NO3 + 3H2O
Но может также и образовываться закись азота (N2O), например , при реакции с магнием (Mg):
10HNO3 разбавл. + 4Mg = 4Mg(NO3)2 + N2O + 3H2O
С остальными металлами реагирует с образованием оксида азота (NO), например, растворяет серебро (Ag):
2HNO3 разбавл. + Ag = AgNO3 + NO + H2O
Аналогично реагирует с неметаллами, например с серой:
2HNO3 разбавл. + S = H2SO4 + 2NO — окисление серы до образования серной кислоты
и выделения газа оксида азота.
— химическая реакция с оксидами металлов, например, оксид кальция:
2HNO3 + CaO = Ca(NO3)2 + H2O — образуется соль (нитрат кальция) и вода
— химическая реакция с гидроксидами (или основаниями), например, с гашеной известью
2HNO3 + Ca(OH)2 = Ca(NO3)2 + H2O — образуется соль (нитрат кальция) и вода — реакция нейтрализации
— химическая реакция с солями, например с мелом:
2HNO3 + CaCO3 = Ca(NO3)2 + H2O + CO2 — образуется соль (нитрат кальция) и другая кислота (в данном случае образуется угольная кислота, которая распадается на воду и углекислый газ).
www.kristallikov.net
Cайт учителя химии Ващенко Н.Ю.
Азотная кислота
HNO3


Опытным путём доказано, что в молекуле азотной кислоты между двумя атомами кислорода и атомом азота две химические связи абсолютно одинаковые – полуторные связи. Степень окисления азота +5, а валентность равна IV.
Физические свойства
Азотная кислота HNO3 в чистом виде — бесцветная жидкость с резким удушливым запахом, неограниченно растворимая в воде; t°пл.= -41°C; t°кип.= 82,6°С, r = 1,52 г/см3. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде.
N2 + O2 грозовые эл.разряды→ 2NO
2NO + O2 → 2NO2
Под действием света азотная кислота частично разлагается с выделением NО2 и за cчет этого приобретает светло-бурый цвет:
4НNО3 свет→ 4NО2↑(бурый газ) + 2Н2О + О2
Азотная кислота высокой концентрации выделяет на воздухе газы, которые в закрытой бутылке обнаруживаются в виде коричневых паров (оксиды азота). Эти газы очень ядовиты, так что нужно остерегаться их вдыхания. Азотная кислота окисляет многие органические вещества. Бумага и ткани разрушаются вследствие окисления образующих эти материалы веществ. Концентрированная азотная кислота вызывает сильные ожоги при длительном контакте и пожелтение кожи на несколько дней при кратком контакте. Пожелтение кожи свидетельствует о разрушении белка и выделении серы (качественная реакция на концентрированную азотную кислоту – жёлтое окрашивание из-за выделения элементной серы при действии кислоты на белок – ксантопротеиновая реакция). То есть – это ожог кожи. Чтобы предотвратить ожог, следует работать с концентрированной азотной кислотой в резиновых перчатках.
Получение
1. Лабораторный способKNO3 + h3SO4(конц) → KHSO4 + HNO3 (при нагревании)
2. Промышленный способ
Осуществляется в три этапа:
a) Окисление аммиака на платиновом катализаторе до NO
4Nh4 + 5O2 → 4NO + 6h3O (Условия: катализатор – Pt, t = 500˚С)
б) Окисление кислородом воздуха NO до NO2
2NO + O2 → 2NO2
в) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2h3O ↔ 4HNO3
Химические свойства
1. Очень сильная кислота. Диссоциирует в водном растворе практически нацело:
HNO3 = H+ + NO3-
Реагирует:
2. с основными оксидами
CuO + 2HNO3 = Cu(NO3)2 + h3O
CuO + 2H+ + 2NO3- = Cu2+ + 2NO3- + h3O
или CuO + 2H+ = Cu2+ + h3O
3. с основаниями
HNO3 + NaOH = NaNO3 + h3O
H+ + NO3- + Na+ + OH- = Na+ + NO3- + h3O
или H+ + OH- = h3O
4. вытесняет слабые кислоты из их солей
2HNO3 + Na2CO3 = 2NaNO3 + h3O + CO2
2H+ + 2NO3- + 2Na+ + СO32- = 2Na+ + 2NO3- + h3O + CO2
2H+ + СO32- = h3O + CO2
Специфические свойства азотной кислоты
Сильный окислитель
1. Разлагается на свету и при нагревании
t°
4HNO3 = 2h3O + 4NO2 + O2
2. Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук — «ксантопротеиновая реакция»)
3. При взаимодействии с металлами никогда не выделяется водород
металл + HNO3 = соль азотной кислоты + вода + газ

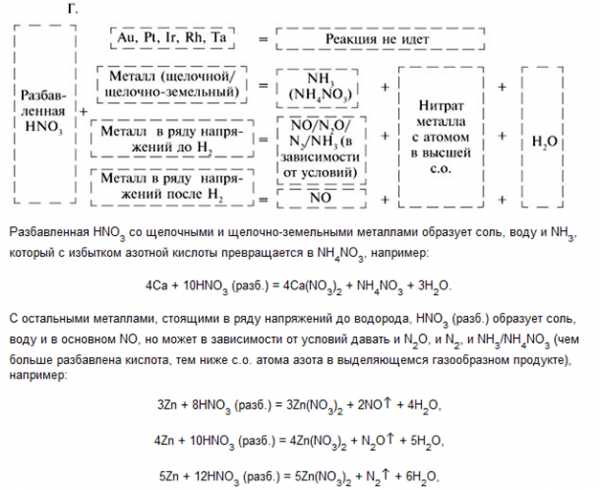

Царская водка: V(HNO3) : V(HCl) = 1 : 3 растворяет благородные металлы.
HNO3 + 4HCl + Au = H[AuCl4] + NO + 2h3O
4HNO3 + 18HCl + 3Pt = 3h3[PtCl6] + 4NO +8h3O
4. Взаимодействует с некоторыми неметаллами
Применение
— в производстве минеральных удобрений;
— в военной промышленности;
— в фотографии — подкисление некоторых тонирующих растворов;
— в станковой графике — для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише).
— в производстве взрывчатых и отравляющих веществ
himiknoginsk.ucoz.ru
Азотная кислота химические свойства | Дистанционные уроки
19-Окт-2012 | комментария 4 | Лолита Окольнова
— сильный окислитель.
Это сильная кислота. Бесцветная, концентрированная азотная кислота на воздухе дымит. Очень быстро становится коричневого (бурого) цвета из-за реакции разложения:
4HNO3 = 4NO2 + 2h3O + O2
Очень рекомендую почитать лекцию ПОДГРУППА АЗОТА — тогда многие химические свойства азотной кислоты будут более понятны.
Почему? Да потому что азот N проявляет в этом соединении степень окисления +5, что соответствует номеру его группы. Т.е. сам азот N может только понизит свою степень окисления — восстановиться. Значит, по химическим свойствам азотная кислота — сильный окислитель.
S + HNO3 = NO2 + SO2 + h3O
окислитель N(+5) +1e(-) = N(+4) — восстановление
восстановитель S(0) -4e(-) =S(+4) — окисление
S +4 HNO3 = 4NO2 + SO2 + 2h3O
Это просто один из примеров таких реакций. Продукт реакции — оксид азота (IV) — NO2, не единственно возможный, есть еще варианты, и их образование подчиняется определенным правилам.
Химические свойства азотной кислоты
Правила взаимодействия азотной кислоты и металлов
1 правило — правило концентрации
Концентрированная азотная кислота восстанавливается до оксида азота (IV) — NO2
Zn + 4HNO3 (конц) = Zn(NO3)2 + 2NO2 + 2h3O
Разбавленная азотная кислота восстанавливается до оксида азота (II) — NO
3Zn + 8HNO3 (разб) = 3Zn(NO3)2 + 2NO + 4h3O
2 правило — правило металла
Смотрим ряд активности металлов!
- С золотом (Au) и платиной (Pt)азотная кислота не реагирует ни при каких условиях.
- Азотная кислота и металлы, стоящие в ряду напряжений после водорода — применимо правило 1 — правило концентрации:
Сu + 4HNO3 (конц) = Cu(NO3)2 + 2NO2 + 2h3O
3Cu + 8HNO3 (разб) = 3Cu(NO3)2 + 2NO + 4h3O - Азотная кислота и металлы, стоящие в ряду напряжений до водорода: вариантов продуктов немало, есть закономерность:
Все реакции азотной кислоты — окислителя ( с металлами и неметаллами) изучаем ЗДЕСЬ!
Соли азотной кислоты
(нитраты)
Здесь мы рассмотрим вопрос реакций разложения нитратов
-
- Разложение нитратов металлов, стоящих в ряду напряжений ДО МАГНИЯ — до нитритов:
2KNO3 = 2KNO2 + O2
- Разложение нитратов металлов, стоящих в ряду напряжений ДО МАГНИЯ — до нитритов:
-
- Разложение нитратов металлов правее магния ( и после водорода) и до меди (Сu) — на соответствующий оксид металла и оксид азота (IV) NO2:
2Сu(NO3)2 = 2CuO + 4NO2 + O2
- Разложение нитратов металлов правее магния ( и после водорода) и до меди (Сu) — на соответствующий оксид металла и оксид азота (IV) NO2:
-
- Разложение нитратов металлов правее ртути — до металла:
2AgNO3 =2 Ag + 2NO2 + O2
- Разложение нитратов металлов правее ртути — до металла:
- Нитрат аммония разлагается до образования оксида азота(I) — N2O:
Nh5NO3 = N2O + 2h3O
На нитрат-ионы NO3(-) нет качественных реакций — все соли азотной кислоты очень хорошо растворимы в воде.
Еще на эту тему:
Обсуждение: «Азотная кислота химические свойства»
(Правила комментирования)distant-lessons.ru
7.3. Взаимодействие металлов с кислотами
Почти все металлы реагируют с кислотами, образуя соли. Характер взаимодействия металла с кислотой зависит от активности металла, его свойств и концентрации кислоты.
При действии
кислоты на металл роль окислителя играет
или ион водорода (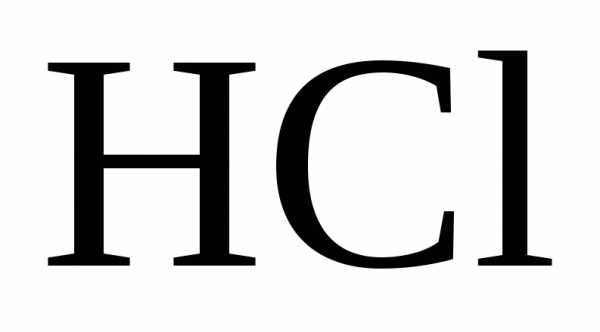 ,
разбавленная
,
разбавленная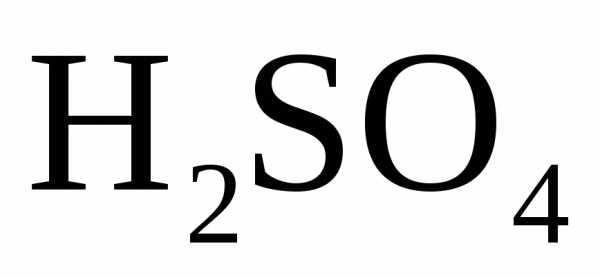 ),
или кислотный остаток кислородсодержащей
кислоты (
),
или кислотный остаток кислородсодержащей
кислоты ( ,
,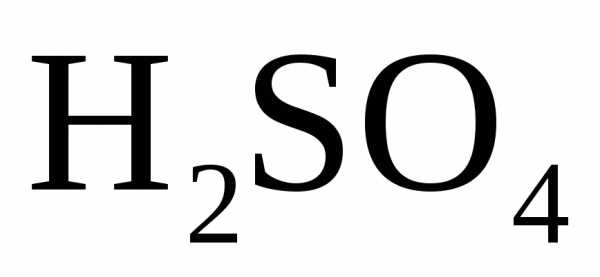 – концентрированная).
– концентрированная).
Взаимодействие металлов с соляной кислотой.
С соляной кислотой взаимодействуют металлы, стоящие в ряду напряжений до водорода.
.
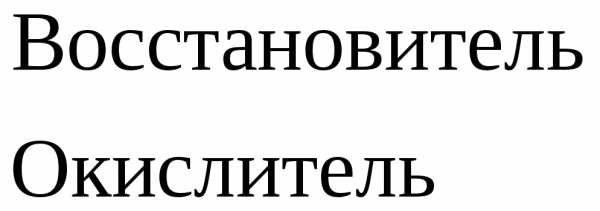


Вывод: окислителем являются катионы водорода, которые принимают электроны от атома металла.
Взаимодействие металлов с азотной кислотой
Концентрированная
и разбавленная азотная кислота
окисляет
металлы без выделения водорода, так как
в ней окислителем является нитрат-ион
( ).
).
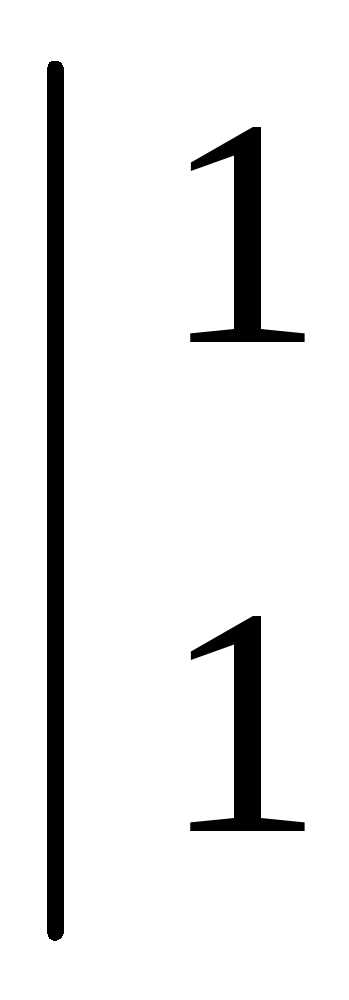
Восстановление азотной кислоты различной концентрации при взаимодействии с металлами разной активности можно представить в виде схемы.


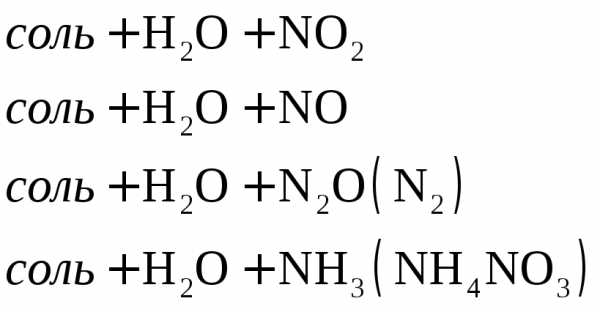
Согласно схеме степень окисления азота при взаимодействии кислоты с металлами меняется от +5 до -3.
Рассмотрим несколько примеров.
.
Коэффициенты в уравнении реакции подбираем ионно-электронным методом.

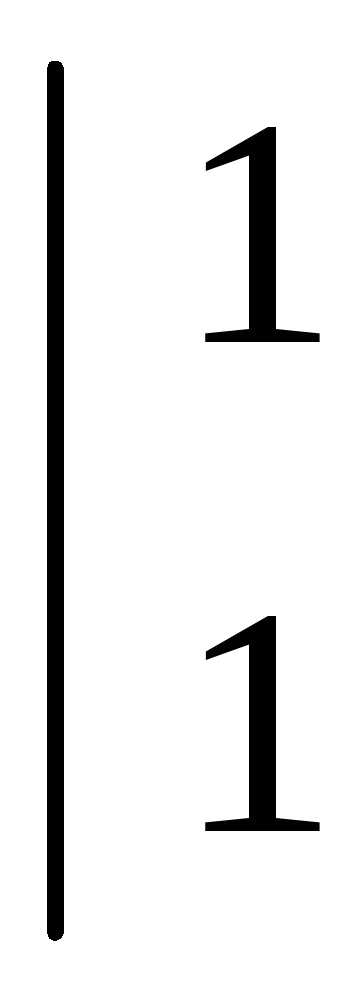

или .
.
Разбавленная
азотная кислота при взаимодействии с
неактивными металлами восстанавливается
до
 ,
образуется соль
,
образуется соль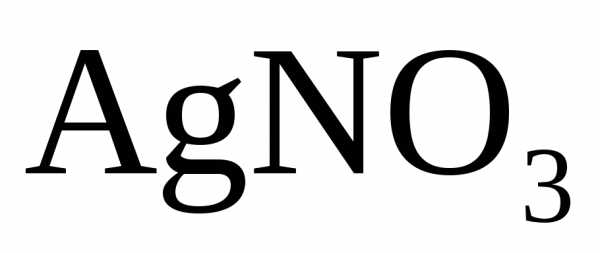 и вода.
и вода.



или .
.
При взаимодействии
активных металлов с разбавленной азотной
кислотой образуется соль, вода и
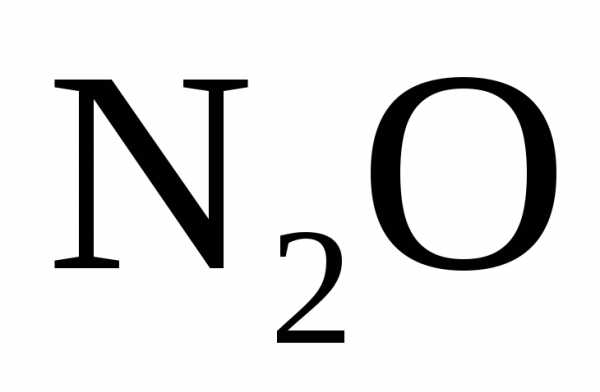 или
или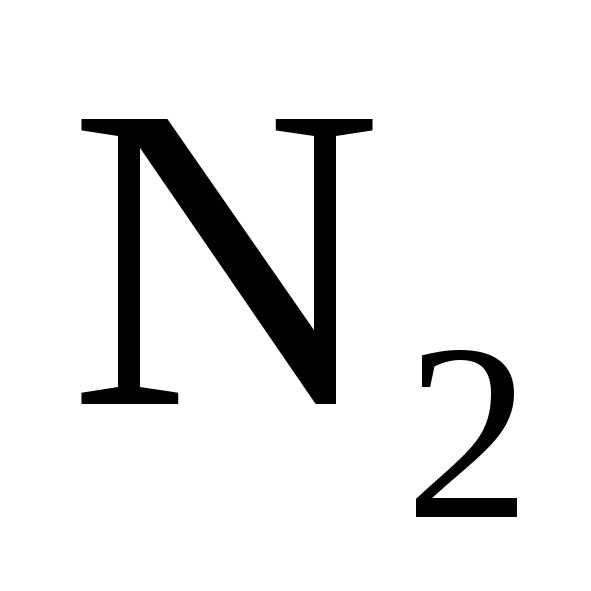 .
.



или .
.
При взаимодействии активных металлов с очень разбавленной азотной кислотой образуется соль, вода и аммиак или нитрат аммония.
или
Вывод:
окислителем в азотной кислоте является
нитрат-анион. Концентрированная азотная
кислота пассивирует
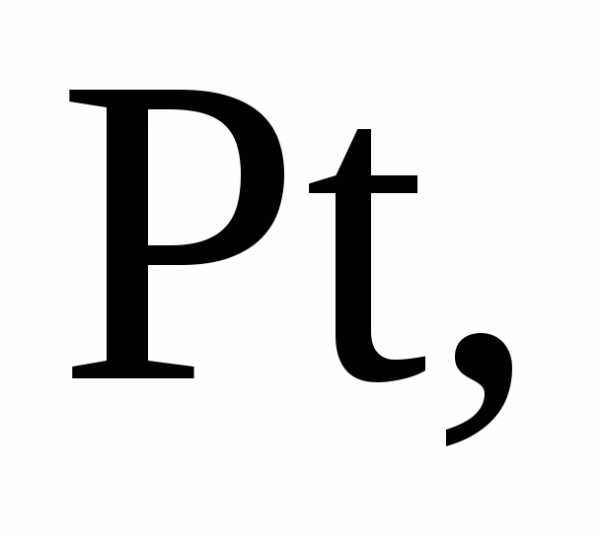 …
…
Следует иметь в виду, что во многих случаях при действии азотной кислоты на металлы образуется смесь различных азотсодержащих соединений, в которых преобладает какое-либо из них.
Взаимодействие металлов с серной кислотой
С разбавленной серной кислотой.
В разбавленной
серной кислоте окислителем являются
ионы водорода
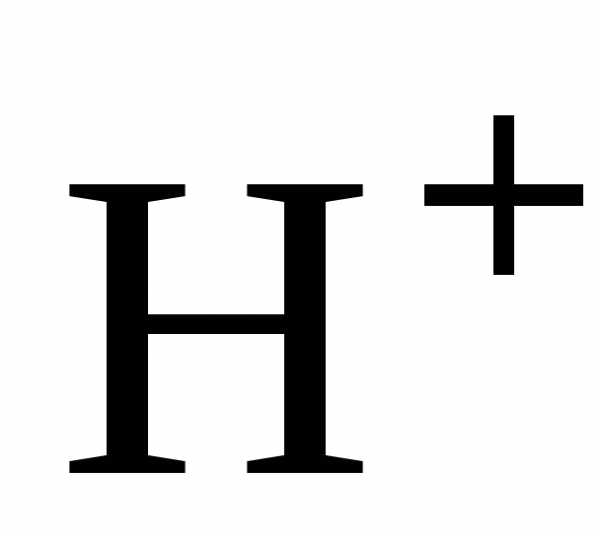 ,
поэтому она взаимодействует с металлами,
расположенными в ряду напряжений до
водорода.
,
поэтому она взаимодействует с металлами,
расположенными в ряду напряжений до
водорода.

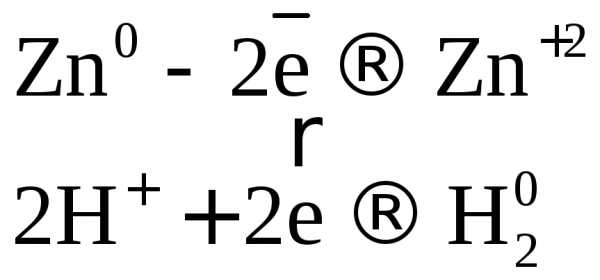

С концентрированной серной кислотой.
В концентрированной
серной кислоте окислителем является
ион
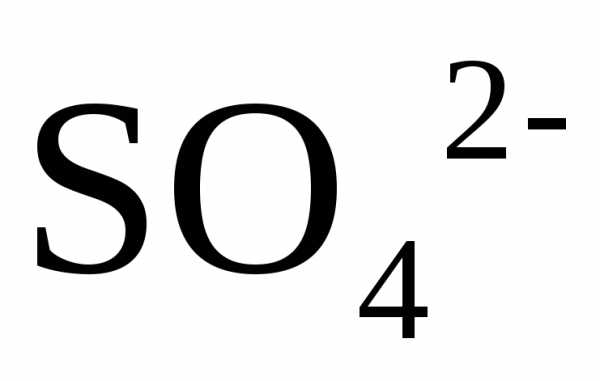 но так как сульфат-ион не является
сильным окислителем, то большинство
реакций идет при нагревании. Степень
окисления серы может меняться от
+6 до
— 2. Чем
активнее металл, тем больше степень
восстановления серы.
но так как сульфат-ион не является
сильным окислителем, то большинство
реакций идет при нагревании. Степень
окисления серы может меняться от
+6 до
— 2. Чем
активнее металл, тем больше степень
восстановления серы.
Взаимодействие металлов с серной кислотой можно представить в виде схемы.
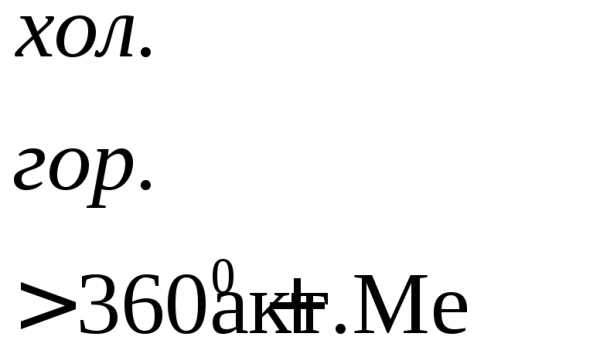
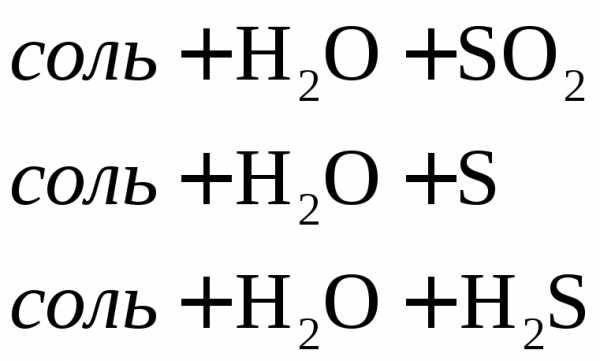
Характер взаимодействия зависит от активности металла, условий проведения реакции.
Например: при нагревании серной концентрированной кислоты с цинком сначала выделяется сернистый газ, а затем элементарная сера и сероводород.

В одном из уравнений расставим коэффициенты ионно-электронным методом.



Вывод:
Окислителем в концентрированной серной
кислоте является ион
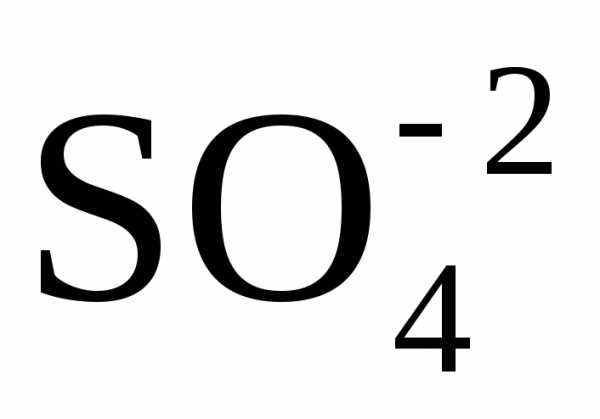 .
Концентрированная серная кислота
окисляет многие металлы, в том числе и
такие, которые в ряду напряжений
расположены правее водорода, при этом
обычно выделяется сернистый газ.
.
Концентрированная серная кислота
окисляет многие металлы, в том числе и
такие, которые в ряду напряжений
расположены правее водорода, при этом
обычно выделяется сернистый газ.
Концентрированная серная кислота не действует на и пассивирует .
studfiles.net
Окислительные свойства азотной кислоты | Дистанционные уроки
02-Янв-2015 | Нет комментариев | Лолита Окольнова
Окислительные свойства азотной кислоты.
ОВР в статье специально выделены цветом. Обратите на них особое внимание. Эти уравнения могут попасться в ЕГЭ.

автор статьи — Саид Лутфуллин
Азотная кислота – в любом виде (и разбавленная, и концентрированная) является сильным окислителем.
Причем, разбавленная восстанавливается глубже, чем концентрированная.
Окислительные свойства обеспечиваются азотом в высшей степени окисления +5
Какая валентность у азота в этом соединении? Вопрос очень хитрый, многие отвечают на него корректно. У азота в азотной кислоте валентность IV.
Атом азота не может образовать больше ковалентных связей, посмотрите на электронную диаграмму:
Три связи с каждым атомом кислорода, и четвертая как бы распределяется, образуется полуторная связь. Таким образом, валентность азота IV, а степень окисления +5
Первое самое интересное свойство: взаимодействие с металлами.
Водород при взаимодействии с металлами никогда не выделяется
Схема реакции азотной кислоты (и разбавленной, и концентрированной) с металлами:
HNO3 + Ме → нитрат + H2O + продукт восстановленного азота
Два нюанса:
1. Алюминий, железо и хром с концентрированной азотной кислотой в нормальных условиях не реагируют, из-за пассивации. Нужно нагреть.
2. С платиной и золотом концентрированная азотная кислота не реагирует вообще.
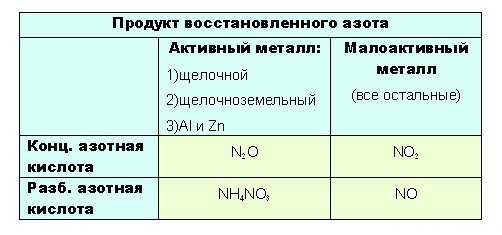
Чтобы понять до чего вообще может восстанавливаться азот, посмотрим на диаграмму его степеней окисления:
Азот +5 – окислитель, будет восстанавливаться, то есть понижать степень окисления.
Все возможные продукты восстановления азотной на диаграмме обведены красным.
(Не все конечно, такие реакции вообще что угодно дать могут, но в ЕГЭ образуются только эти).
Определить какой именно продукт будет образовываться можно чисто логически:
- до таких низких степеней окисления как -3 или +1, с образованием продуктов NH4NO3 или N2O соответственно, азот восстанавливают только достаточно сильные, активные металлы: щелочные — 1-я группа главная подгруппа, щелочноземельные, а так же Al и Zn. Как ранее уже было сказано, разбавленная кислота восстанавливается глубже, поэтому при взаимодействии активных металлов с конц. азотной кислотой образуется N2O, а при взаимодействии с разб. азотной кислотой NH4NO3.
4Ba + 10HNO3(конц.) → 4Ba(NO3)2 + 5H2O + N2O↑
4Ba + 10HNO3(разб.) → 4Ba(NO3)2 + 3H2O + NH4NO3
8Li + 10HNO3(конц.) → 8LiNO3 + 5H2O + N2O↑
8Li + 10HNO3(разб.) → 8LiNO3 + 3H2O + NH4NO3
8Al + 30HNO3(конц.) (t)→ 8Al(NO3)3 + 15H2O + 3N2O↑
8Al + 30HNO3(разб.) → 8Al(NO3)3 + 9H2O + 3NH4NO3
Остальные металлы восстанавливают азотную кислоту до +2 или +4, с образованием продуктов соответственно: NO или O2.
Разбавленная кислота восстанавливается глубже
- при взаимодействии с ней металлов, не отличающихся особой активностью, будет образовываться NO. Ну а с конц. азотной NO2:
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2H2O + 2NO2↑
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 4H2O + 2NO↑
Fe + 6HNO3(конц.) (t)→ Fe(NO3)3 + 3H2O + 3NO2↑
Fe + 4HNO3(разб.) → Fe(NO3)3 + 2H2O + NO↑
(обратите внимание, что железо окисляется до высшей степени окисления)
Ag + 2HNO3(конц.) → AgNO3 + H2O + NO2↑
3Ag + 4HNO3(разб.) → 3AgNO3 + 2H2O + NO↑
Если тяжело сразу понять всю логичность выбора, вот таблица:
Азотная кислота окисляет неметаллы до высших оксидов.
Так как неметаллы – не такие сильные восстановители, как активные металлы, азот может восстановиться только до +4, образовав NO2 или NO соответственно.
При окислении неметаллов концентрированной азотной кислотой образуется бурый газ (NO2), а если кислота разбавленная, то образуется NO. Схемы реакций следующие:
неметалл + HNO3(разб.) → соединение неметалла в высшей степени окисления + NO
неметалл + HNO3(конц.) → соединение неметалла в высшей степени окисления + NO2
C + 4HNO3(конц.) → CO2↑ + 2H2O + 4NO2↑
3C + 4HNO3(разб.) → 3CO2↑ + 2H2O + 4NO↑
(угольная кислота не образуется, так как она не стабильна)
P + 5HNO3(конц.) → H3PO4 + H2O + 5NO2↑
3P + 5HNO3(разб.) + 2H2O → 3H3PO4 + 5NO↑
B + 3HNO3(конц.) → H3BO3 + 3NO2↑
B + HNO3(разб.) + H2O → H3BO3 + NO↑
S + 6HNO3(конц.) → H2SO4 + 2H2O + 6NO2↑
S + 2HNO3(разб.) → H2SO4 + 2NO↑
- концентрированная азотная кислота окисляет сероводород. Окисление идет глубже при нагревании:
2HNO3(конц.) + H2S → S↓ + 2NO2 + 2H2O
H2S + 8HNO3(конц.) → H2SO4 + 8NO2↑ + 4H2O
- концентрированная азотная кислота окисляет сульфиды до сульфатов:
CuS + 8HNO3(конц.) → CuSO4 + 4H2O + 8NO2↑
- азотная кислота настолько сурова, что может окислить даже ГАЛОГЕН. Только один – иод. Разбавленная восстанавливается глубже: до +2, концентрированная до +4. А вот иод окисляется не до высшей степени окисления +7 (слишком круто), а до +5, образуя иодноватую кислоту HIO3:
10HNO3(конц.) + I2 (t)→ 2HIO3 + 10NO2↑ + 4H2O
10HNO3(разб.) + 3I2 (t)→ 6HIO3 + 10NO↑ + 2H2O
- концентрированная азотная кислота реагирует с хлоридами и фторидами. Только следует понимать, что с фторидами и хлоридами протекает обычная реакция ионного обмена с вытеснением галогеноводорода и образованием нитрата:
NaCl(тв.) + HNO3(конц.) → HCl↑ + NaNO3
NaF(тв.) + HNO3(конц.) → HF↑ + NaNO3
- А вот с бромидами и иодидами (и с бромоводородами, и с иодоводородами) протекает ОВР. В обоих случаях образуется свободный галоген, а азот восстанавливается до NO2:
8HNO3(конц.) + 6KBr(тв.) → 3Br2 + 4H2O + 6KNO3 + 2NO2↑
4HNO3(конц.) + 2NaI(тв.) → 2NaNO3 + 2NO2↑ + 2H2O + I2↓
Образовавшийся иод окисляется дальше до иодноватой кислоты, поэтому реакцию можно записать сразу:
7HNO3(конц.) + NaI → NaNO3 + 6NO2↑ + 3H2O + HIO3
То же самое происходит при взаимодействии с иодо- и бромоводородами:
2HNO3(конц.) + 2HBr → Br2 + 2NO2↑ + 2H2O
6HNO3(конц.) + HI → HIO3 + 6NO2↑ + 3H2O
Еще на эту тему:
Обсуждение: «Окислительные свойства азотной кислоты»
(Правила комментирования)distant-lessons.ru
