Жирные кислоты
В природе обнаружено свыше 200 жирных кислот, которые входят в состав липидов микроорганизмов, растений и животных.
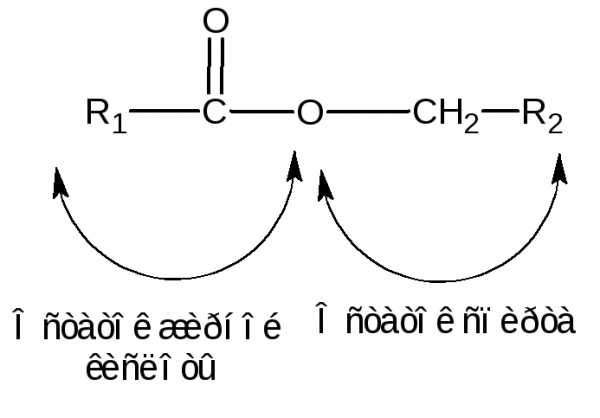
Жирные кислоты – алифатические карбоновые кислоты (рисунок 2). В организме могут находиться как в свободном состоянии, так и выполнять роль строительных блоков для большинства классов липидов.
Все жирные кислоты, входящие в состав жиров, делят на две группы: насыщенные и ненасыщенные. Ненасыщенные жирные кислоты, имеющие две и более двойных связей, называют полиненасыщенными. Природные жирные кислоты весьма разнообразны, однако имеют ряд общих черт. Это монокарбоновые кислоты, содержащие линейные углеводородные цепи. Почти все они содержат четное число атомов углерода (от 14 до 22, чаще всего встречаются с 16 или 18 атомами углерода). Гораздо реже встречаются жирные кислоты с более короткими цепями или с нечетным числом атомов углерода. Содержание ненасыщенных жирных кислот в липидах, как правило, выше, чем насыщенных. Двойные связи, как правило, находятся между 9 и 10 атомами углерода, почти всегда разделены метиленовой группой и имеют цис-конфигурацию.
Высшие жирные кислоты практически нерастворимы в воде, но их натриевые или калиевые соли, называемые мылами, образуют в воде мицеллы, стабилизируемые за счет гидрофобных взаимодействий. Мыла обладают свойствами поверхностно-активных веществ.
Жирные кислоты отличаются:
– длиной их углеводородного хвоста, степенью их ненасыщенности и положением двойных связей в цепях жирных кислот;
– физико-химическими свойствами. Обычно насыщенные жирные кислоты при температуре 22 0С имеют твердую консистенцию, тогда как ненасыщенные представляют собой масла.
Ненасыщенные жирные кислоты имеют более низкую температуру плавления. Полиненасыщенные жирные кислоты быстро окисляются на открытом воздухе, чем насыщенные. Кислород реагирует с двойными связями с образованием пероксидов и свободных радикалов;
Таблица 1 – Основные карбоновые кислоты, входящие в состав липидов
|
Число С-атомов |
Число двойных связей |
Наименование кислоты |
Структурная формула | |
|
Насыщенные | ||||
|
12 14 16 18 20 |
0 0 0 0 |
Лауриновая Миристиновая Пальмитиновая Стеариновая Арахиновая |
СН3–(СН2)10–СООН СН3–(СН2)12–СООН СН3–(СН2)14–СООН СН3–(СН2)16–СООН СН3–(СН2)18–СООН | |
|
Ненасыщенные | ||||
|
18 18 18 20 |
1 2 3 4 |
Олеиновая Линолевая Линоленовая Арахидовая |
СН3–(СН2)7–СН=СН–(СН2)7–СООН СН3–(СН2)4–(СН=СН–СН2)2–(СН2)6–СООН СН3–СН2–(СН=СН–СН2)3–(СН2)6–СООН СН3–(СН2)4–(СН=СН–СН2)4–(СН2)2–СООН | |
В высших растениях присутствуют, в основном, пальмитиновая кислота и две ненасыщенные кислоты – олеиновая и линолевая. Доля ненасыщенных жирных кислот в составе растительных жиров очень высока (до 90 %), а из предельных лишь пальмитиновая кислота содержится в них в количестве 10-15 %.
Стеариновая кислота в растениях почти не встречается, а содержится в значительном количестве (25 % и более) в некоторых твердых животных жирах (жир баранов и быков) и маслах тропических растений (кокосовое масло). Лауриновой кислоты много в лавровом листе, миристиновой – в масле мускатного ореха, арахиновой и бегеновой – в арахисовом и соевом маслах. Полиненасыщенные жирные кислоты – линоленовая и линолевая – составляют главную часть льняного, конопляного, подсолнечного, хлопкового и некоторых других растительных масел. Жирные кислоты оливкового масла на 75% представлены олеиновой кислотой.
В организме человека и животных не могут синтезироваться такие важные кислоты, как линолевая, линоленовая. Арахидоновая – синтезируется из линолевой. Поэтому они должны поступать в организм с пищей. Эти три кислоты получили название незаменимых жирных кислот. Комплекс этих кислот называют витамином F. При длительном отсутствии их в пище у животных наблюдается отставание в росте, сухость и шелушение кожи, выпадение шерсти. Описаны случаи недостаточности незаменимых жирных кислот и у человека. Так, у детей грудного возраста, получающих искусственное питание с незначительным содержанием жиров, может развиться чешуйчатый дерматит, т.е. проявляются признаки авитаминоза.
В последнее время большое внимание уделяется жирным кислотам Омега-3. Эти кислоты обладают сильным биологическим действием – уменьшают слипание тромбоцитов, тем самым предупреждают инфаркты, снижают артериальное давление, уменьшают воспалительные процессы в суставах (артриты), необходимы для нормального развития плода у беременных. Эти жирные кислоты содержатся в жирных сортах рыб (скумбрия, лосось, семга, норвежская сельдь). Рекомендуется употреблять морскую рыбу 2-3 раза в неделю.
Номенклатура жиров
Нейтральные ацилглицеролы служат главными составными частями природных жиров и масел, чаще всего это смешанные триацилглицеролы. По происхождению природные жиры делят на животные и растительные. В зависимости от жирно-кислотного состава жиры и масла по консистенции бывают жидкими и твердыми. Животные жиры (баранье, говяжье, свиное сало, молочный жир) обычно содержат значительное количество насыщенных жирных кислот (пальмитиновой, стеариновой и др.), благодаря чему при комнатной температуре они твердые.
Жиры, в состав которых входит много ненасыщенных кислот (олеиновая, линолевая, линоленовая и др.), при обычной температуре жидкие и называются маслами.
Жиры, как правило, содержатся в животных тканях, масла – в плодах и семенах растений. Особенно высоко содержание масел (20-60 %) в семенах подсолнечника, хлопчатника, сои, льна. Семена этих культур используются в пищевой промышленности для получения пищевых масел.
По способности высыхать на воздухе масла подразделяются: на высыхающие (льняное, конопляное), полувысыхающие (подсолнечное, кукурузное), невысыхающие (оливковое, касторовое).
Физические свойства
Жиры легче воды и нерастворимы в ней. Хорошо растворимы в органических растворителях, например, в бензине, диэтиловом эфире, хлороформе, ацетоне и т.д. Температура кипения жиров не может быть определена, поскольку при нагревании до 250оС они разрушаются с образованием из глицерина при его дегидратации сильно раздражающего слизистые оболочки глаз альдегида акролеина (пропеналя).
Для жиров прослеживается довольно четкая связь химического строения и их консистенции. Жиры, в которых преобладают остатки насыщенных кислот – твёрдые (говяжий, бараний и свиной жиры). Если в жире преобладают остатки ненасыщенных кислот, он имеет жидкую консистенцию. Жидкие растительные жиры называется маслами (подсолнечное, льняное, оливковое и т.д. масла). Организмы морских животных и рыбы содержат жидкие животные жиры. В молекулы жиров мазеобразной (полутвёрдой) консистенции входят одновременно остатки насыщенных и ненасыщенных жирных кислот (молочный жир).
Химические свойства жиров
Триацилглицеролы способны вступать во все химические реакции, свойственные сложным эфирам. Наибольшее значение имеет реакция омыления, она может происходить как при ферментативном гидролизе, так и при действии кислот и щелочей. Жидкие растительные масла превращают в твердые жиры при помощи гидрогенизации. Этот процесс широко используется для изготовления маргарина и кулинарного жира.
Жиры при сильном и продолжительном взбалтывании с водой образуют эмульсии – дисперсные системы с жидкой дисперсной фазой (жир) и жидкой дисперсионной средой (водой). Однако эти эмульсии нестойки и быстро разделяются на два слоя – жир и воду. Жиры плавают над водой, поскольку их плотность меньше плотности воды (от 0,87 до 0,97).
Гидролиз. Среди реакций жиров особое значение имеет гидролиз, который можно осуществить как кислотами, так и основаниями (щелочной гидролиз называют омылением):
Омыляемые липиды 2
Простые липиды 2
Жирные кислоты 3
Химические свойства жиров 6
АНАЛИТИЧЕСКАЯ ХАРАКТЕРИСТИКА ЖИРОВ 11
Сложные липиды 14
Фосфолипиды 14
Мыла и детергенты 16
Гидролиз жиров идет постепенно; например, при гидролизе тристеарина получается сначала дистеарин, затем моностеарин и, наконец, глицерин и стеариновая кислота.
Практически гидролиз жиров производят или перегретым паром, или же нагреванием в присутствии серной кислоты или щелочей. Превосходными катализаторами гидролиза жиров являются сульфокислоты, получаемые сульфированием смеси непредельных жирных кислот с ароматическими углеводородами (контакт Петрова). В семенах клещевины находится особый фермент — липаза, ускоряющий гидролиз жиров. Липаза широко применяется в технике для каталитического гидролиза жиров.
Химические свойства
Химические свойства жиров определяются сложноэфирным строением молекул триглицеридов и строением и свойствами углеводородных радикалов жирных кислот, остатки которых входят в состав жира.
Как сложные эфиры жиры вступают, например, в следующие реакции:
– Гидролиз в присутствии кислот (кислотный гидролиз)
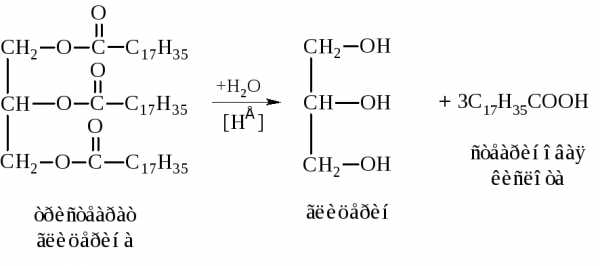
Гидролиз жиров может протекать и биохимическим путем под действием фермента пищеварительного тракта липазы.
Гидролиз жиров может медленно протекать при длительном хранении жиров в открытой упаковке или термической обработке жиров в условиях доступа паров воды из воздуха. Характеристикой накопления в жире свободных кислот, придающих жиру горечь и даже токсичность является «кислотное число»: число мг КОН, пошедшее на титрование кислот в 1г жира.
– Омыление:
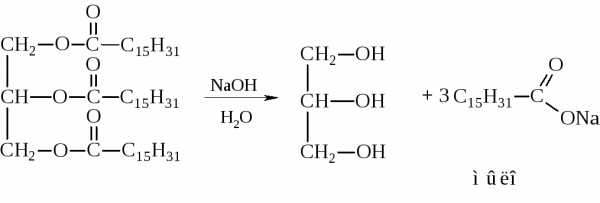
Наиболее интересными и полезными реакциями углеводородных радикалов являются реакции по двойным связям:
– Гидрогенизация жиров

Растительные масла (подсолнечное, хлопковое, соевое) в присутствии катализаторов (например, губчатый никель) при 175-190оС и давлении 1,5-3 атм гидрируются по двойным С = С связям углеводородных радикалов кислот и превращаются в твёрдый жир – саломас. При добавлении к нему так называемых отдушек для придания соответствующего запаха и яиц, молока, витаминов для улучшения питательных качеств получают маргарин. Саломас используется также в мыловарении, фармации (основы для мазей), косметике, для изготовления технических смазок и т.д.
– Присоединение брома
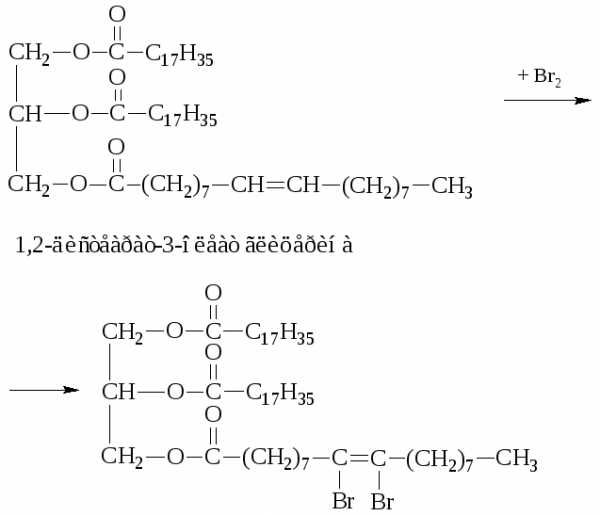
Степень ненасыщенности жира (важная технологическая характеристика) контролируется по «йодному числу»: число мг йода, пошедшее на титрование 100 г жира в процентах (анализ с бисульфитом натрия).
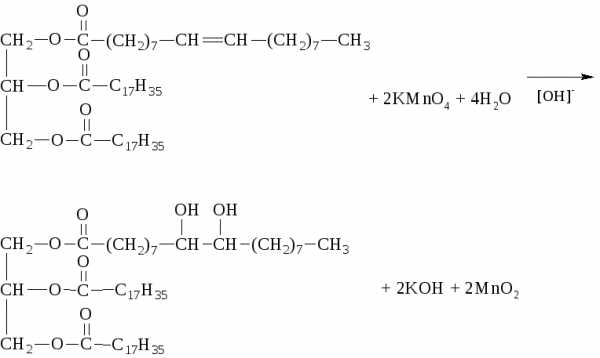
– Окисление
Окисление перманганатом калия в водном растворе приводит к образованию предельных дигидроксикислот (реакция Вагнера)
ПРОГОРКАНИЕ
При хранении растительные масла, животные жиры, а также жиросодержащие продукты (мука, крупа, кондитерские изделия, мясные продукты) под влиянием кислорода воздуха, света, ферментов, влаги приобретают неприятный вкус и запах. Иными словами, жир прогоркает.
Прогоркание жиров и жиросодержащих продуктов – результат сложных химических и биохимических процессов, протекающих в липидном комплексе.
В зависимости от характера основного процесса, протекающего при этом, различают гидролитическое и окислительное прогоркание. Каждый из них может быть разделен на автокаталитическое (неферментативное) и ферментативное (биохимическое) прогоркание.
ГИДРОЛИТИЧЕСКОЕ ПРОГОРКАНИЕ
При гидролитическом прогоркании происходит гидролиз жира с образованием глицерина и свободных жирных кислот.
Неферментативный гидролиз протекает с участием растворенной в жире воды, и скорость гидролиза жира при обычных температурах невелика. Ферментативный гидролиз происходит при участии фермента липазы на поверхности соприкосновения жира и воды и возрастает при эмульгировании.
В результате гидролитического прогоркания увеличивается кислотность, появляется неприятный вкус и запах. Особенно это сильно выражено при гидролизе жиров (молочного, кокосового и пальмового), содержащих низко- и среднемолекулярные кислоты, такие как масляную, валериановую, капроновую. Высокомолекулярные кислоты не имеют вкуса и запаха, а повышение их содержания не приводит к изменению вкуса масел.
ОКИСЛИТЕЛЬНОЕ ПРОГОРКАНИЕ
Наиболее распространенным видом порчи жиров в процессе хранения является окислительное прогоркание. В первую очередь окислению подвергаются свободные, а не связанные в триацилглицеролах ненасыщенные жирные кислоты. Процесс окисления может происходить неферментативным и ферментативным путями.
В результате неферментативного окисления кислород присоединяется к ненасыщенным жирным кислотам по месту двойной связи с образованием циклической перекиси, которая распадается с образованием альдегидов, придающих жиру неприятный запах и вкус:
Также в основе неферментативного окислительного прогоркания лежат цепные радикальные процессы, в которых участвуют кислород и ненасыщенные жирные кислоты.
Под действием перекисей и гидроперекисей (первичных продуктов окисления) происходит дальнейший распад жирных кислот и образование вторичных продуктов окисления (карбонилсодержащих): альдегидов, кетонов и других неприятных на вкус и запах веществ, вследствие чего жир прогоркает. Чем больше двойных связей в жирной кислоте, тем выше скорость ее окисления.
При ферментативном окислении этот процесс катализируется ферментом липоксигеназой с образованием гидроперекисей. Действие липоксигеназы сопряжено с действием липазы, которая предварительно гидролизует жир.
АНАЛИТИЧЕСКАЯ ХАРАКТЕРИСТИКА ЖИРОВ
Кроме температуры плавления и затвердевания, для характеристики жиров применяются следующие величины: кислотное число, перекисное число, число омыления, йодное число.
Природные жиры нейтральны. Однако при переработке или хранении вследствие процессов гидролиза или окисления образуются свободные кислоты, количество которых непостоянно
Под действием ферментов липазы и липоксигеназы изменяется качество жиров и масел, которое характеризуется следующими показателями или числами:
Кислотное число (К.ч.) – это количество миллиграммов гидроксида калия, необходимого для нейтрализации свободных жирных кислот в 1 г жира.
При хранении масла наблюдается гидролиз триацилглицеролов, это приводит к накоплению свободных жирных кислот, т.е. к возрастанию кислотности. Повышение К.ч. указывает на снижение его качества. Кислотное число является гостированным показателем масла и жира.
Йодное число (Й.ч.) – это количество граммов йода, присоединившегося по месту двойных связей к 100 г жира:
Йодное число позволяет судить о степени ненасыщенности масла (жира), о склонности его к высыханию, прогорканию и другим изменениям, происходящим при хранении. Чем больше содержится в жире ненасыщенных жирных кислот, тем выше йодное число. Уменьшение йодного числа в процессе хранения масла является показателем его порчи. Для определения йодного числа применяют растворы хлорида иода IC1, бромида иода IBr или иода в растворе сулемы, которые более реакционноспособны, чем сам иод. Йодное число является мерой ненасыщенности кислот жиров. Оно важно для оценки качества высыхающих масел.
Перекисное число (П.ч.) показывает количество перекисей в жире, выражают его в процентах йода, выделенного из йодистого калия перекисями, образовавшимися в 1 г жира.
В свежем жире перекиси отсутствуют, но при доступе воздуха они появляются сравнительно быстро. В процессе хранения перекисное число увеличивается.
Число омыления (Ч.о.) – равно числу миллиграммов гидроксида калия, расходующихся при омылении 1 г жира кипячением последнего с избытком гидроксида калия в спиртовом растворе. Число омыления чистого триолеина равно 192. Высокое число омыления указывает на присутствие кислот с «меньшими молекулами». Малые числа омыления указывают на присутствие более высокомолекулярных кислот или же неомыляемых веществ.
Полимеризация масел. Весьма важными являются реакции автоокисления и полимеризации масел. По этому признаку растительные масла делятся на три категории: высыхающие, полувысыхающие и невысыхающие.
Высыхающие масла в тонком слое обладают способностью образовывать на воздухе эластичные, блестящие, гибкие и прочные пленки, нерастворимые в органических растворителях, устойчивые к внешним воздействиям. На этом свойстве основано использование этих масел для приготовления лаков и красок. Наиболее часто применяемые высыхающие масла приведены в табл. 34.
Таблица 34. Характеристики высыхающих масел
|
Масло |
Йодное число |
Содержание жирных кислот, % | |||||
|
пальмитиновая |
стеариновая |
олеиновая |
лино- левая |
лино- лено- вая |
элео- стеари- новая | ||
|
Тунговое |
160—180 |
4,0 |
1,5 |
15,0 |
79,5 | ||
|
Льняное |
170—185 |
5,0 |
3,5 |
5,0 |
61,5 |
25,0 |
— |
|
Периллевое |
180—206 |
7,5 |
— |
8,0 |
38,0 |
46,5 |
— |
Основной характерной чертой высыхающих масел является высокое содержание непредельных кислот. Для оценки качества высыхающих масел применяют йодное число (оно должно быть не менее 140).
Процесс высыхания масел заключается в окислительной полимеризации. Все ненасыщенные эфиры жирных кислот и их глицериды окисляются на воздухе. По-видимому, процесс окисления представляет собой цепную реакцию, приводящую к неустойчивой гидроперекиси, которая разлагается с образованием окси- и кетокислот.
Высыхающие масла, содержащие глицериды ненасыщенных кислот с двумя или тремя двойными связями, служат для приготовления олифы. Для получения олифы льняное масло нагревают до 250—300 °С в присутствии катализаторов.
Полу высыхающие масла (подсолнечное, хлопковое) отличаются от высыхающих меньшим содержанием непредельных кислот (йодное число 127—136).
Невысыхающие масла (оливковое, миндальное) имеют йодное число ниже 90 (например, для оливкового масла 75—88).
Воски
Это сложные эфиры высших жирных кислот и высших одноатомных спиртов жирного (реже ароматического) ряда.
Воски являются твердыми соединениями с ярко выраженными гидрофобными свойствами. Природные воски содержат также некоторое количество свободных жирных кислот и высокомолекулярных спиртов. В состав восков входят как обычные, содержащиеся в жирах, – пальмитиновая, стеариновая, олеиновая и др., так и жирные кислоты, характерные для восков, имеющие гораздо большие молекулярные массы, – карноубовая С24Н48О2, церотиновая С27Н54О2, монтановая С29Н58О2 и др.
Среди высокомолекулярных спиртов, входящих в состав восков, можно отметить цетиловый – СН3–(СН2)14–СН2ОН, цериловый – СН3–(СН2)24–СН2ОН, мирициловый СН3–(СН2)28–СН2ОН.
Воски встречаются как в животных, так и в растительных организмах и выполняют, главным образом, защитную функцию.
В растениях они покрывают тонким слоем листья, стебли и плоды, тем самым, предохраняя их от смачивания водой, высыхания, механических повреждений и поражения микроорганизмами. Нарушение этого налета приводит к быстрой порче плодов при их хранении.
Например, значительное количество воска выделяется на поверхности листьев пальмы, произрастающей в Южной Америке. Этот воск, называемый карноубским, является, в основном, церотиново-мирициловым эфиром:
,
имеет желтый или зеленоватый цвет, очень тверд, плавится при температуре 83-900С, идет на выделку свечей.
Среди животных восков наибольшее значение имеет пчелиный воск, под его покровом хранится мед и развиваются личинки пчелы. В пчелином воске преобладает пальмитиново-мирициловый эфир:
,
а также высокое содержание высших жирных кислот и различных углеводородов, плавится пчелиный воск при температуре 62-700С.
Другими представителями воска животных является ланолин и спермацет. Ланолин предохраняет волосы и кожу от высыхания, очень много его содержится в овечьей шерсти.
Спермацет – воск, добывающий из спермацетового масла черепных полостей кашалота, состоит, в основном, (на 90%) из пальмитиново-цетилового эфира:
твердое вещество, его температура плавления 41-490С.
Различные воска широко применяют для изготовления свечей, помад, мыла, разных пластырей.
studfiles.net
Кислоты карбоновые жирные — Справочник химика 21
По катионообменному механизму металлы из водных растворов экстрагируются органическими кислотами — карбоновыми (жирными, нафтеновыми), фосфорорганическими, сульфоновыми (тиокислотами). [c.10]В зависимости от условий проведения процесса и применяемого катализатора соотношение между жидкими углеводородами и реакционной водой колеблется в очень широких пределах — от 1 0,4 до 1 2,6. В воде наряду с нейтральными кислородсодержащими веществами содержатся и кислоты. В жирных кистотах, выделенных из содового раствора, подаваемого на скрубберы для промывки синтез-газа, обычно содержатся муравьиная, уксусная, пропионовая и другие карбоновые кислоты с числом углеродных атомов до 16. [c.117]
ЖИРНЫЕ КИСЛОТЫ — см. Карбоновые кислоты. Высшие жирные кислоты. [c.97]
Исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.), животные жиры, а также гидроксид натрия или кальцинированная сода. Растительные масла предварительно подвергаются гидрогенизации, т. е. их превращают в твердые жиры. Применяются также заменители жиров—синтетические карбоновые жирные кислоты с большой молекулярной массой. [c.332]
Мыла — это соли высших карбоновых жирных) кислот. Обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот, причем натриевые соли образуют твердые мыла, калиевые соли — жидкие мыла. [c.395]
Выбор между схемами 4 и 5 определяется требованиями к качеству товарных жирных кислот, качество которых жестко нормировано по двум показателям массовой доле смоляных кнслот н неомыляемых веществ. При отборе жирно-кислотной фракции из низа третьей колонны, как это предусмотрено схемой 5, в этом целевом продукте концентрируются смоляные кислоты, приходящие с исходной смесью в колонну, а также труднолетучие неомыляемые вещества, в том числе ангидриды кислот. Кроме того, в продуктах содержится некоторое остаточное количество легколетучих неомыляемых веществ, основная часть которых отбирается с легким маслом из верха той же колонны. Попытки снижения массовой доли смоляных кислот в жирно-кислотной фракции за счет интенсификации разделения во второй колонне путем увеличения высоты колонны, флегмового числа, подвода теплоты в испаритель неизбежно приводят к усилению термической деструкции компонентов в этой колонне. При этом наряду с уменьшением доли смоляных кислот в питании третьей колонны возрастает доля неомыляемых веществ, что отрицательно сказывается на качестве жирных кислот. Следовательно, качество талловых жирных кислот, получаемых по схеме 5, не стабильно и нет возможности управлять им. Это положение можно несколько исправить, если отбирать жирно-кислотную фракцию через боковой отбор в паровой фазе, а с кубовым продуктом третьей колонны выводить труднолетучие неомыляемые вещества. Разделение по схеме 5 вызывает минимальные потери карбоновых кислот вследствие термического разложения. Менее стойкие смоляные кислоты полностью выводятся по этой схеме так же, как в схеме 2 из второй колонны, т. е. раньше, чем в других схемах. [c.117]
По числу карбоксильных групп различают моно-, ди-, три- и т. д. карбоновые кислоты. Алифатические монокарбоновые кислоты называют также жирными кислотами. Карбоновые кислоты вступают в многочисленные реакции, при которых карбоксильные группы специфическим образом могут быть преобразованы в группировки функциональ-ных производных. При других типах реакций изменениям могут подвергаться углеводородные радикалы, при этом образуются замещенные карбоновые кислоты с двумя или несколькими функциональными группами. Большое число незамещенных и замещенных карбоновых кислот в свободном состоянии или в виде функциональных производных было выделено из природных объектов животного и растительного происхождения. Важное значение имеют прежде всего липиды (см. раздел 3.2). [c.389]
Жиры представляют собой сложные эфиры высших карбоновых (жирных) кислот с глицерином, а воски — эфиры жирных кислот с другими высшими спиртами (схема 7.9). Жиры и воски экстрагируются из древесины органическими растворителями (диэтиловым эфиром, нетролейным эфиром, ацетоном и др.). Массовая доля жиров составляет 0,3—0,4 % по отношению к абсолютно сухой дре- [c.152]
В триацилглицерины входят ацильные остатки высших карбоновых кислот, называемых жирными оттого, что впервые эти кис- [c.423]
Как известно, пластификаторы сложноэфирного типа, применяемые в настоящее время, в основном содержат от 16 до 24 атомов С. Имея в виду это, гликолевые эфиры синтезировали на основе товарной фракции карбоновых кислот Су—С9 и дихлорэтана, этиловые эфи ры—на основе диэтилсульфата и более высокомолекулярных карбоновых кислот, а именно Сю— 6 и С- -Сгх. Синтезы для сравнения производились также и на базе товарных фракций этих карбоновых кислот, получаемых на Шебекинском комбинате синтетических жирных кислот и жирных спиртов [236]. [c.212]
Все большее число исследователей начинают понимать, что в неф-тях присутствует довольно сложная гамма карбоновых кислот экспериментально доказано наличие среди них жирных кислот карбоновых кислот, содержащих в молекуле одно или несколько полиметиленовых (циклопентановых или циклогексановых) колец, и, [c.318]
Декарбоксилирование карбоновых кислот как жирного (см. опыт 23), так и ароматического ряда—отщепление углекислого газа из карбоксильной группы при нагревании со щелочью, обычно протекает довольно гладко. Незамещенные кислоты при этом образуют преимущественно углеводороды [c.215]
Природные жиры и масла представляют собой смеси триглицеридов, т. е. сложных эфиров глицерина с жирными кислотами (карбоновыми кислотами с длинной углеводородной цепью см. т. 1, стр. 154, и т. 4, стр. 150). Мыла — это соли жирных кислот, получаемые путем омыления триглицеридов растворами щелочей, обычно едкого натра. [c.516]
Определение. Классификация. Глицеридами называются сложные эфиры глицерина и высокомолекулярных карбоновых (жирных) кислот. Они составляют основную массу липидов (в отдельных случаях до 95—97%) и являются, по существу, жирами. [c.200]
Как видно из табл. 82, свойства резиновых смесей на основе- НК и СК почти не изменились при замене стеариновой кислоты техническими карбоновы.ми кислотами, введенными в них. без какой-либо рафинации. Особенно ма.ло изменились физикомеханические показатели каркасных смесей на основе СК , в которые вводились нефтяные продукты. Результаты этих сравнительных испытаний показывают, между прочим, что в составе технических карбоновых кислот преобладают жирные кислоты. [c.200]
Насыщенные и ненасыщенные жирные кислоты Карбоновые кислоты Малеиновая, фумаровая и янтарная кислоты [c.322]
Э( 4)ективным методом разделения металлов является экстракция карбоновыми кислотами [1—3], ранее применявшаяся лишь для аналитических целей [4—7]. Как показано в предварительных сообщениях [2, 3], при значительном различии свойств металлов (при разнице в значении pH осаждения гидроокисей порядка 0,5—1) сравнительно полное извлечение и разделение достигается простой экстракцией карбоновой кислотой из водного раствора минеральных солей металлов, pH которого доведен до нужного значения за счет добавки щелочи. Если же металлы близки по своим свойствам (например, никель и кобальт), то для разделения необходимо осуществить обменную реакцию между металлами, находящимися в разных фазах в органической — в виде солей карбоновых (жирных) кислот (сокращенно мыл), в водной — в виде солей минеральных кислот [1—3]. Последовательное изучение экстракции карбоновыми кислотами, распределения мыл между органической и водной фазами и, наконец, обменных реакций между солями жирных кислот и сульфатами (или хлоридами) различных металлов показало, что все эти процессы тесно связаны друг с другом и что эта связь может быть сформулирована количественно. [c.87]
Окисление альдегидов азотной кислотой различной концентрации может применяться для получения карбоновых кислот как жирного, так и ароматического ряда. Так, р-хлор-пропионовый альдегид, получаемый присоединением хлористого водорода к акролеину, при окислении дымящей азотной кислотой дает р-хлорпропионовую кислоту (выход 65%) [c.216]
В качестве исходного органического сырья в этих процессах конденсации используются главным образом замещенные и незамещенные ароматические углеводороды (бензол, толуол, хлорбензол и т. д.), а также ангидриды и хлорангидриды карбоновых кислот как жирного, так и ароматического ряда. [c.319]
Все большее число исследователей начинают понимать, что в нефтях присутствует довольно сложная гамма карбоновых кислот экспериментально доказано наличие среди них жирных кислот карбоновых кислот, содержащих в молекуле одно или несколько полиметиленовых (циклопентановых или циклогексановых) колец, и, наконец, высказывается весьма вероятное предположение и приводятся отдельные экспериментальные данные, свид ельствующие [c.318]
ВЫСШИЕ ЖИРНЫЕ КИСЛОТЫ -карбоновые кислоты алифатического ряда, Природные В. ж. к, имеют четное число углеродных атомов и неразветвлен-иое строение. Наиболее распространен- [c.61]
Как можно видеть из данных табл. 3.12, методом, основанным на восстановлении, определяются многие амиды. Были определены первичные, вторичные и третичные амиды низкомолекулярных кислот и жирных карбоновых кислот, а также бифункциональные амиды. Кроме того, определяли циклический амид (метилпирролидон). Восстановление акриламида, N-тр г-бутил-акриламида и карбамида протекает неудовлетворительно. Образующийся при восстановлении М,М-дифенилацетамида дифенил-этиламин оказался слишком слабым основанием для прямого титрования даже в растворителях, рекомендуемых для титрования слабых оснований. [c.160]
Под действием Torulopsis api ola, а также Т. gropengiesser чистый углеводородный субстрат, по-видимому, сначала подвер гается окислению по концевой метильной группе с образованием спирта, который затем окисляется до карбоновой кислоты. Эта жирная кислота далее окисляется по противоположному концу молекулы с образованием ш-оксикислоты и (или) (оз —1)-окси-кислоты. Эфиры жирных кислот, взятые в качестве субстрата, сначала гидролизуются и далее подвергаются метаболизму, обычному для жирных кислот. Имеется четко выраженное оптимальное расстояние между карбоксильной группой и местом (u-окисления, которое может быть выражено длиной цепи (23,ЗА —общая длина молекулы жирной кислоты [109]), либо числом (14) метиленовых групп [111] между карбоксильной группой и местом гидроксилирования. Жирные кислоты, длина молекулы которых превышает указанную величину, подвергаются р-окислению, в результате которого длина цепи каждый раз уменьшается на два атома углерода до тех пор, пока не будет достигнут оптимальный размер. р-Окисление жирной кислоты представляет, конечно, конкурентный путь при метаболизме этих соединений, который весьма существенно нарушается при образовании гликолипидных молекул. [c.48]
Детально эта реакция на протяжении многих лет изучалась С. В. Завгородним. Им была изучена реакция 13 органических кислот (пяти жирных одноосновных, трех двухосновных, двух ароматических и трех га-лоидуксусных) с 18 непредельными соединениями (шестью олефинами, одним циклоолефином, одним арилолефином, тремя галоидолефинами, двумя алкилвиниловыми эфирами, тремя аллилалкиловыми эфирами, одним терпеном и одним диеновым углеводородом). В результате этих исследований показано, что фтористый бор является весьма активным катализатором для реакции присоединения органических карбоновых кислот к этиленовым соединениям. Он может применяться или самостоятельно или в виде молекулярных соединений с простыми эфирами, или с органическими и минеральными кислотами. В тех случаях, когда нет большой необходимости в изучении количественной стороны процесса, фтористый бор можно применять самостоятельно или в виде молекулярного соединения с уксусной кислотой. Однако лучшим катализатором во всех отношениях является этилэфират фтористого бора, который позволяет вести реакцию присоединения кислот к этиленовым соединениям в относительно мягких условиях, не вызывающих побочных процессов (главным образом, полимеризации олефинов), и получать эфиры с выходом 40—95% [44]. [c.193]
На основе отечественных научно-исследовательских и опытных работ, а также данных, полученных за рубежом в области окисления углеводородов, в СССР создана новая промышленность по окислению парафинов в целях получения карбоновых кислот и жирных спиртов. Первенцами этой промышленности являются Шебе-кинский комбинат СЖК и ЖС [165—167], Волго-Донской комбинат жирозаменителей [168] и другие. За основу технологической схемы процесса принят низко—температурный режим реакции окисления. Для полу- чения карбоновых кислот, применяемых в мыловаренной прпмытттле нногти, твердые парафины различного [c.43]
Наряду с производством синтетических материалов и поверхностноактивных веществ большое значение имеет еще производство таких химических полупродуктов, на основе или при участии которых осуществляется органический синтез. Главнейшими из них являются спирты — метиловый, этиловый, изопропиловый, бутиловые и высшие спирты, эти-ленгликоль, синтетический глицерин, альдегиды и кетоны — ацетальдегид и высшие альдегиды, ацетон, метилэтилкетон и другие кетоны, окиси олефинов — окись этилена, окись пропилена, карбоновые кислоты, уксусная кислота, синтетические жирные кислоты, ароматические дикарбоно-вые кислоты, адипиновая кислота, фенолы — фенол, алкилфенолы, двухатомные фенолы, полупродукты для СК, пластмасс и синтетических волокон — бутадиен и изопрен, изобутилен, чистые олефины от С5Н10 до СшНзг, стирол, дивинилбензол и а-метилстирол, акрилонитрил и акрилаты, аминокислоты и канролактам, галоидопроизводные — дихлорэтан, хлористый этил, тетрафторэтилен, перфторолефины и парафины, ядохимикаты (гексахлорциклогексан, ДДТ и др.). [c.33]
Поливинилхлорид Поликсиметилен Поликарбонат Хлористый водород Формальдегид, муравьиная кислота Карбоновые кислоты Оловоорганические соединения, соли свинца, соли жирных кислот металлов 1 и И групп, эфиры фосфорной кислоты Амины, нитрилы, дицианди-амин Моно- и поли карбамиды [c.344]
В тех же случаях, жирноароматических карбоновых кислотах типа фенилуксусной кислоты, каталитическое образование кетонов проходит вполне нормальным образом, и при 0М0щи каталитичес гого способа можно получать с хорошим выходом кетоны также и из смесей ароматических кислот с жирными или жирноароматичес ими кислотами. Следовательно, при 1 0птакт-ном способе необходимо только, чтобы по крайней мере одна из взятых для реакции кислот была пригодна для этох реакции. [c.486]
Жиры и масла, представляющие собой сложные эфиры глицерина и высокомолекулярных жирных кислот или жирных кислот среднего молекулярного веса, можно обнаружить по реакции на глицерин, описанной на стр. 529. Зта реакция основана на дегидратации глицерина до акролеина, который можно идентифицировать по цветной реакции с раствором нитропруссида натрия, содержащим пиперидин. Различные воски ссстоят преимущественно из эфиров высших одноосновных карбоновых кислот и высших едноатомных спиртов. Их можно обнаружить пробой на сложные эфиры, описанной на стр. 319. Для этого их переводят в гидроксамовые кислоты, которые образуют окрашенные внутренние комплексные соли железа (III), Зтой реакцией можно обнаружить [c.677]
Ингибиторы коррозии подразделяют на органические и неорганические. Из неорганических ингибиторов в синтетические СОЖ вводят силикаты (соли кремниевой кислоты) и полифосфаты в концентрации до 1 %. Такие ингибиторы, как нитрит натрия и хроматы, малоэффективны вви.цу их высокой токсичности. В качестве органических ингибиторов используют различные органические кислоты (ароматические, жирные, олефиновые, оксикарбоновые и др.), азот- и серосодержащие соединения (алифатические амины, алкилоамиды, имидазолины, азолы, амипоспирты, тиолы, тиазолы и др.). Из солей ароматических карбоновых кислот в практике чаще всего используют бензоат натрия. Однако в растворах с высоким содержанием хлоридов и сульфатов его эффективность снижается. Слабое ингибирующее действие оказывает бензоат натрия на цветные металлы. Хорошо замедляют коррозию металлов при невысоких концентрациях (до 100 мг/л) в воде соли винной и глюконовой кислот. Ингибитор коррозии Антикор-2 , представляющий собой комплексные соединения борной кислоты с глюконатом кальция, [c.176]
Название кислот карбоновые происходит от латинского названия угольной кислоты A idum arboni um, которая была первой изученной в истории химии углеродсодержащей кислотой. Их часто называют жирными кислотами, так как высшие гомологи впервые были получены нз природных жиров. [c.113]
В ГИПИ ЛКП, Ленинградском НПО Пигмент и ряде ведущих центральных заводских лабораторий отрасли проведены работы по прямой замене пищевых масел, используемых при производстве алкидных смол, непищевыми продуктами высшими изомерными карбоновыми кислотами, синтетическими жирными кислотами нормального строения, жирными кислотами таллового масла, низкомолекулярными каучуками, биожиром. Получаемые па основе таких плепкообразователей покрытия не уступают, а в ряде случаев превосходят по свойствам материалы на основе традиционных алкидных смол. Это касается покрытий, содержащих алкидные смолы, модифицированные а-разветвлепными высшими изомерными карбо- [c.241]
chem21.info
Жирные кислоты также Карбоновые кислоты
Существует определенная связь между химическим строением и свойствами поверхностно-активных веществ — эмульгаторов. Так, соли карбоновых кислот (растворимые в воде) со щелочными металлами, аммиаком или аминами обычно способствуют образованию эмульсий типа масло в воде, а их кальциевые, магниевые или алюминиевые соли — эмульсий типа вода в масле. Сложные эфиры жирных кислот с полиспиртами (гликолями) также способствуют образованию эмульсий типа вода в масле. [c.336]Свойства. Непредельные кислоты представляют собой или ЖИДКОСТИ, ИЛИ кристаллические вещества. Низшие кислоты растворимы в воде и обладают острым кислотным запахом. Кислоты этого ряда являются значительно более сильными кислотами (особенно те, у которых двойная связь находится рядом с карбоксильной группой), чем предельные жирные кислоты. Непредельные кислоты обладают всеми характерными свойствами органических кислот, т. е. способностью давать соли, хлорангидриды, ангидриды, сложные эфиры, амиды и прочие производные карбоновых кислот. Но, кроме того, наличие этиленовой связи придает этим кислотам способность вступать з свойственные этиленовым углеводородам реакции присоединения, а также способность легко расщепляться при реакциях окисления. [c.468]
Жирные кислоты, пригодные для производства синтетических пищевых жиров, должны подвергаться особой очистке. В настоящее время длительными опытами точно установлено, что присутствующие в этих жирах кислоты с нечетным числом атомов углерода усваиваются человеческим организмом так же, как кислоты с четным числом поэтому нет никаких оснований удалять жирные кислоты с нечетным числом углеродных атомов из смеси синтетических жирных кислот. С технической точки зрения нет смысла осуществлять такое разделение кислот, поскольку оба типа кислот присутствуют почти в одинаковых количествах. Напротив, кислоты изостроения должны быть удалены, насколько это возможно, так как они являются причиной появления в моче кислых соединений, растворимых в эфире. Установлено также, что крысы, которых кормили жирами, синтезированными из жирных кислот, полученных на основе синтетического парафинового гача, испытывали задержку в росте. Известно, что эти кислоты имеют довольно разветвленное строение. Жирные кислоты изостроения можно в достаточной степени отделить экстракцией растворителями, например метанолом, метилэтилкетоном, ацетоном, бензином и низкомолекулярными карбоновыми кислотами, в которых они легче растворимы, чем кислоты с прямой цепью [101]. [c.474]
Исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.), животные жиры, а также гидроксид натрия или кальцинированная сода. Растительные масла предварительно подвергаются гидрогенизации, т. е. их превращают в твердые жиры. Применяются также заменители жиров—синтетические карбоновые жирные кислоты с большой молекулярной массой. [c.332]
Алифатические амины можно получать не только ранее упомянутым восстановлением нитропарафинов, но главным образом каталитическим гидрированием нитрилов. Поскольку при этом легко отщепляется ЫНд и образуется смесь первичных, вторичных и третичных аминов, гидрирование часто проводят в среде газообразного ЫНд в присутствии никелевого или кобальтового катализатора при 200—210°. В этих условиях образуются преимущественно первичные амины. Как известно, нитрилы легко получаются каталитической дегидратацией аммониевых солей жирных кислот. Для этого пары карбоновых кислот можно пропускать в смеси с избытком циркулирующего аммиака при 320—400° над катализатором, например силикагелем, фосфатом или окисью алюминия особенно эффективным катализатором является фосфат бора. Таким способом из уксусной кислоты получается ацетонитрил, из стеариновой кислоты—нитрил стеариновой кислоты, из адипиновой кислоты—нитрил адипиновой кислоты (выход его составляет всего 75%). Предложены новые пути получения нитрила адипиновой кислоты с лучшими выходами, например из ацетилена. Амины могут быть получены также непосредственно из кислот и аммиака на специальных катализаторах, в присутствии которых одновременно протекают дегидратация и гидрирование. [c.237]
Исследуя кислоты, полученные при окислении парафиновых углеводородов изостроения, можно составить представление о пунктах окислительной атаки кислорода. Последний действует преимущественно на точку разветвления, иначе говоря, на третичный атом водорода, В результате отщепления боковых цепей образуются в основном кислоты с прямой цепью. Тем не менее парафины с сильно разветвленным угле- родным скелетом продолжают оставаться непонгодными для промышленных целей сырьем [42], При их окислении получают главным обраэом низкомолекулярные и более глубоко окисленные карбоновые кислоты с числом атомов углерода меньше 12, не говоря уже о значительных количествах кислот с разветвленным скелетом. Эти кислоты обладают неприятным запахом и неудовлетворительным моющим действием. Технические нефтяные дистилляты, хотя и обогащенные парафинами, непригодны для получения жирных кислот, предназначенных для мыловарения, так как содержат нафтеновые и ароматические углеводороды, а также другие циклические соединения. [c.445]
Окисление парафина воздухом при повышенных температурах значительно ускоряется в присутствии катализаторов [58, 59]. В качестве катализаторов применяют соли тяжелых металлов высших жирных кислот, а также высокомолекулярные спирты и кетоны, выделенные из продуктов окисления парафина. В этом случае окисление идет более глубоко, и в качестве основных продуктов реакции образуются карбоновые кислоты и нейтральные карбонильные соединения. [c.60]
Нафтеновые кислоты представляют собой карбоновые кислоты циклического строения и являются производными главным образом цикланов, в частности, пятичленных. В некоторых нефтях существуют нафтеновые кислоты би-, три- и тетра-циклического строения, а по данным А. Е. Чичибабина также карбоновые кислоты жирного ряда. [c.36]
Выбор между схемами 4 и 5 определяется требованиями к качеству товарных жирных кислот, качество которых жестко нормировано по двум показателям массовой доле смоляных кнслот н неомыляемых веществ. При отборе жирно-кислотной фракции из низа третьей колонны, как это предусмотрено схемой 5, в этом целевом продукте концентрируются смоляные кислоты, приходящие с исходной смесью в колонну, а также труднолетучие неомыляемые вещества, в том числе ангидриды кислот. Кроме того, в продуктах содержится некоторое остаточное количество легколетучих неомыляемых веществ, основная часть которых отбирается с легким маслом из верха той же колонны. Попытки снижения массовой доли смоляных кислот в жирно-кислотной фракции за счет интенсификации разделения во второй колонне путем увеличения высоты колонны, флегмового числа, подвода теплоты в испаритель неизбежно приводят к усилению термической деструкции компонентов в этой колонне. При этом наряду с уменьшением доли смоляных кислот в питании третьей колонны возрастает доля неомыляемых веществ, что отрицательно сказывается на качестве жирных кислот. Следовательно, качество талловых жирных кислот, получаемых по схеме 5, не стабильно и нет возможности управлять им. Это положение можно несколько исправить, если отбирать жирно-кислотную фракцию через боковой отбор в паровой фазе, а с кубовым продуктом третьей колонны выводить труднолетучие неомыляемые вещества. Разделение по схеме 5 вызывает минимальные потери карбоновых кислот вследствие термического разложения. Менее стойкие смоляные кислоты полностью выводятся по этой схеме так же, как в схеме 2 из второй колонны, т. е. раньше, чем в других схемах. [c.117]
В этой главе описывается разделение низших карбоновых и среднемолекулярных жирных кислот (разделению высших жирных кислот посвящена гл. 26), а также ди- и трикарбоновых кислот и кетокислот (алифатических, ароматических и циклических). Однако механизмы разделения не позволяют провести более детальную классификацию внутри классов в соответствии с различными типами соединений и, следовательно, более удобна классификация, основанная на различных механизмах разделения (1). В большинстве работ, рассматриваемых в этой главе, фактически все типы кислот, которые встречаются в смесях, разделялись одним из нижеописанных методов. Разделение сахарных кислот детально обсуждалось в главе, посвященной углеводам (гл. 22). В этой главе обсуждаются только те работы, в которых описано хроматографическое разделение смесей сахарных с другими типами кислот. [c.151]
Введение галоида в жирные кислоты не вызывает коренного изменения типа соединения, как это установил Дюма еще в 1839 г. Однако галоидированные жирные кислоты, особенно содержащие галоид в а-положении к карбоксильной группе, все же обладают значительно повышенной кислотностью. Это является, как мы уже указывали выше (см. стр. 146), следствием индуктивного эффекта заместителя. Аналогичное влияние оказывают и другие заместители в а-положении, имеющие повышенное сродство к электронам, а также группы с повышенной способностью к мезомерии, например ви-нильная или фенильная. Однако как только между электроотрицательным заместителем и карбоксильным углеродным атомом появляется валентнонасыщенный атом углерода, эффект сильно убывает. В общем кислотность карбоновых кислот определяется мезомерией карбоксильной группы, однако эта мезомерия может подвергаться существенным изменениям в результате наложения индуктивных эффектов заместителей. [c.343]
Некоторые из кислот, содержащихся в нефтях, в частности низшие жирные кислоты, могут, конечно, образоваться из углеводородов в процессах добычи, хранения и переработки нефти. Однако, как показали многочисленные исследования карбоновых кислот, выделенных из нефтепродуктов и из сырых нефтей, большая часть нефтяных кислот уже содержится в сырой нефти следовательно, они образовались из первичного материнского вещества (растительного и животного происхождения), из которого возникла и основная часть нефти — нефтяные углеводороды. Вещества масляно-жирового и углеводного характера явились, по-видимому, основным источником образования нефтяных кислот, а также и углеводородов. Имеются и прямые экспериментальные данные, иллюстрирующие превращение алифатических кислот в углеводороды и нафтеновые кислоты [56, 231. [c.324]
Над специальными катализаторами синтезы углеводородов можно проводить и при очень высоких давлениях. Так, например, над Ru-катализатором можно получать твердые парафины с молекулярным весом до 23 ООО и т. пл. до 133° (стр. 692). Такие парафины либо применяют как очень хороший изолирующий материал, либо путем окислительного крекинга превращают в твердые жирные карбоновые кислоты для мыл. Так называемый изосинтез (стр. 694) проводят при 450 и 300 ат. Некоторые Fe-катализаторы также работают при 100—300 ат. [c.687]
В реакционной воде, составляющей почти 50% от жидких углеводородов, содержится 1,5—2% кислородсодержащих соединений спирты, альдегиды и кетоны, а также жирные карбоновые кислоты (от уксусной до ундециловой). [c.688]
При синтезах, которые должны были бы привести к образованию (-оксикарбоновых кислот, часто вместо них получаются непосредственно 7-лактоны например, лактоны образуются при восстановлении 7-кето-карбоновых кислот и циклических ангидридов кислот амальгамой натрия в кислом растворе, а также при кипячении -(-галоидзамещенных жирных кислот с водой [c.325]
Желчные кислоты 867, 870, 871, 872 Женевская номенклатура 28, 29, 59, 76, 108, 109, 240 Жирные кислоты 38, 84, 238 и сл. см. также Карбоновые кислоты высшие 252 и сл. [c.1174]
В качестве исходного органического сырья в этих процессах конденсации используются главным образом замещенные и незамещенные ароматические углеводороды (бензол, толуол, хлорбензол и т. д.), а также ангидриды и хлорангидриды карбоновых кислот жирного и ароматического ряда. Конденсирующим реагентом в этих процессах служит безводный хлористый алюминий, по возможности не содержащий примесей. [c.342]
Исследования обнаружили также наличие в обычных нафтеновых кислотах значительных количеств карбоновых кислот парафинового ряда. Так, Танака и Кувата установили присутствие пальмитиновой, стеариновой, миристиновой и арахиновои кислот в нафтеновых кислотах, выделенных из одной японской нефти, причем количество жирных кислот составляло около / от общего веса кислот. Жирные карбоновые кислоты были обнаружены также в советских нефтях, в частности в низкокипящих фракциях бакинских нафтеновых кислот. [c.28]
Номенклатура. Алифатические карбоновые кислоты называются часто жирными кислотами, так как многие средние и высшие члены этого ряда встречаются в жирах и были из последних выделены Большинство карбоновых кислот имеет тривиальные названия (муравь иная кислота, уксусная кислота, масляная кислота, стеариновая кис лота и т. д.). Можно, конечно, рассматривая кислоты как карбоксиль ные производные углеводородов, дать им также названия метанкарбо новая кислота СН3СООН, этанкарбоновая кислота С2Н5СООН и т. д [c.239]
Производные пиридина встречаются в природе, и о некоторых из них пойдет речь в т. 2, разд. 17.5 и 17.7. Мы, однако, можем сразу же отметить тот факт, что очень важный биохимический окислительно-восстановительный процесс включает четвертичную соль амида никотиновой кислоты (никоти-намид, витамин РР). Биохимики называют это сложное соединение НАД (со-кращенпе от дкотиндмидаденинЗинуклеотид), и оно, вместе с подобным ему веществом Н А ДФ, играет значительную роль в процессах клеточного дыхания, фотосинтеза, синтеза карбоновых кислот с длинной углеродной цепью ( жирных кислот ), а также в процессе зрения. Ниже представлена схема процесса превращения НАД в его восстановленную форму. Заметьте, что окислительно- [c.635]
Тесная связь строения углеводородной и кислотной частей нефти с близким числом атомов углерода в молекуле проявлялась также и в том, что содержание нафтеновых кислот повышается при переходе от нефтей менее цикличных, т. е. парафинистых, к нефтям нафтенового основания. Появилось значительное число экспериментальных данных, свидетельствующих о том, что среди кислот, выделенных из бензино-керосиновых фракций, присутствуют наряду с нафтеновыми кислотами низшие гомологи (С —С7) жирных кислот. Содержание этих кислот в нефтях значительно меньше, чем нафтеновых кислот, причем с увеличением молекулярных весов нефтяных фракций оно снижается точно так же, как снижается и доля парафиновых углеводородов в этих фракциях. Жирные кислоты никак нельзя было подвести под определение нафтеновые кислоты, поэтому еще Аскан предложил в качестве общего понятия, охватывающего все выделяемые из нефти карбоновые кислоты, ввести понятие более широкое, а именно нефтяные кислоты. Это предложение Аскана позже было поддержано Гурвичем. Что касается часто употребляемого названия нефтяные кислоты ( Ре1го1заиге ), — пишет Гурвич, то, по предложению Аскана, его следует оставить для обозначения вообще всех кислот, встречающихся в нефти, а в ней, кроме нафтеновых, попадаются, хотя и в небольших количествах, и некоторые кислоты жирного ряда муравьиная, уксусная и т. д. под нафтеновыми же следует подразумевать исключительно карбоновые кислоты, производящиеся от нафтеновых углеводородов [14]. Наметкин нефтяными кислотами называет кислоты, выделяемые из нефти щелочной обработкой, хотя он тут же подчеркивает И по составу и по свойствам нефтяные кислоты вполне соответствуют нафтеновым кислотам, т. е. синтетическим кислотам, являющимся производными нафтенов [15]. [c.310]
Роль ангидрида и соли кислоты в этой реакции оценивается различно. Первоначально считали более вероятным, что ангидрид нужен лишь для отнятия воды и что реагирующим веществом является только соль жирной кислоты. Более поздними работами было показано важное значение ангидрида кислоты, который и является, как полагал еще Перкин, активным участником конденсации. Оказалось возможным заменить соль другими веществами, не имеющими ничего общего с карбоновыми кислотами и играющими, как и соль кислоты, роль катализаторов в этом процессе конденсации. Такими катализаторами являются третичные основания пиридин, хинолин и т. п., а также щелочнореагирующие соли, например поташ. Действие катализаторов, повидимому, заключается в энолизации ангидрида кислоты или пр0дукт днца 1ин ния его к ароматическому альдегиду [c.718]
Аналогичную полярно-неполярную структуру с длинными алкильными цепями на одном конце молекул имеют и антикоррозионные добавки к смазочным маслам. Как и влияние ингибиторов коррозии, добавляемых к кислоте при травлении стали, эффективность этих веществ обусловлена адсорбцией их поверхностью металла, так что многие из соединений, используемых в качестве добавок для высоких давлений, могут выполнять также функцию ингибиторов коррозии, и наоборот. В качестве таких веществ были предложены следующие типы соединения соли тяжелых металлов алкилированных моноамидов фталевой и янтарной кислот, соли высших алкиламинов и фосфорной кислоты или кислые алкилфосфаты, металлические соли алкилтио-фосфорных кислот, соли тяжелых металлов растворимых в масле нефтяных сульфокислот, диалкил фенол сульфиды, соли высших аминов жирных кислот и нафтеновых кислот, алкилированные ароматические карбоновые кислоты, а также металлические соли алкилированных фенолов [10]. [c.485]
Амиды низших жирных кислот не являются подходящими производными при работе с микро- и полумикроколичествами. Помимо их заметной растворимости в водно-спиртовых смесях, приготовление этих производных аммонолизом в воде сопровождается потерями вследствие гидролиза галоид-ангидрида. Аммонолиз в безводной среде приводит к потерям при выделении и очистке. п-Толуидиды и анилиды являются более подходящими производными. п-Толуидиды карбоновых кислот, имеющих менее 8 атомов углерода в цепи, можно получить, нагревая кислоту с /г-толуидином. Для характеристики жирных кислот, имеющих более 10 атомов углерода в цепи, рекомендуются диамиды, образующиеся при реакции с 4,4 -диаминодифенил-метаном. Среди замещенных амидов следует отметить 2-алкилбензимидазолы [216—218], образующиеся путем конденсации карбоновых кислот с о-фе-нилендиамином. К этой группе можно отнести также фенилгидразиды КСОЫНЫНСвНй, однако они рассматриваются в следующем разделе при обсуждении солей фенилгидразина. [c.448]
Отдельную группу составляют алкиламины карбоновых кислот (например, триэтаноламиннафтенат), являющиеся уже катионоактивными или электроней-тральными ПАВ. Эти ПАВ широко используются как эмульгаторы, а также как смачиватели и диспергаторы. К этому типу примыкают ПАВ, являющиеся четвертичными аммониевыми солями жирных кислот. [c.57]
Многие карбоновые кислоты успешно поддаются декарбоксилированию, либо в свободном виде, либо в виде солей, однако это не распространяется на простые жирные кислоты [350]. Исключение составляет уксусная кислота, которая в виде ацетата при нагревании с основанием с хорошим выходом дает метан. Декарбоксилированию успешно подвергаются те алифатические кислоты, которые содержат определенные функциональные группы, а также двойную или тройную связь в а- или -положении. Некоторые из них приведены в табл. 12.2. Декарбоксилирование ароматических кислот см. реакцию 11-41. При декарбоксилировании а-цианокислот могут образовываться или нитрилы, или карбоновые кислоты в зависимости от того, гидролизуется или нет цианогруппа в ходе реакции. Помимо соединений, перечисленных в табл. 12.2, декарбоксилирование можно провести для а,р-ненасыщенных и а,р-ацетиленовых кислот. Декарбоксилирование а-галогенозамещенных кислот сопровождается элиминированием [351] [c.469]
Хлорфенолы и другие хлорсодержащие соединения, жирные спирты и карбоновые кислоты, красители, ПАВ, серусодержащие соединения, цианиды, нитриты также окисляются пероксидом водорода или реактивом Фентона. Деструкция таких органических веществ, как полимерные материалы, протекает в результате автокаталитических реакций с кислородом, инициируемых катализаторами. Скорость деградации полимера в значительной степени зависит от его структуры. Окислительная деструкция протекает по механизму цепной реакции. Автоокисление инициирует образование радикалов, продолжение цепи, при этом кислород взаимодействует со свободным радикалом полимера с образованием гидропероксидов. В результате обрыва цепи образуются нереакционные продукты. Соединения металлов и Н2О2 могут ускорять автоокисление. Вследствие разрыва достаточно большого количества связей в полимерных материалах образуются низкомолекулярные продукты, которые поступают в окружающую среду. [c.293]
Кислые сточные воды производства синтетических жирных кислот содержат до 207о низкомолекулярных кислот (муравьиной, уксусной, пропиоповой и масляной), а также соединения эфирного и карбонильного характера, примеси высокомолекулярных карбоновых кислот, нейтральные соединения. [c.165]
Основными достоинствами анионных моющих веществ, содержащих гидрофильные сульфогруппы (кислые сложиЬю эфиры серной кислоты, алкилсульфо- и алкиларилсуль-фокислоты), являются большая растворимость в воде их кальциевых и магниевых солей, чем растворимость солей карбоновых кислот этих же металлов. Это позволяет использовать их в жесткой воде, так как образующиеся соли не мешают процессу мойки. Стабильность этих соединений в кислой среде также больше, чем стабильность солей карбоновых кислот, которые представляют собою соли слабых кислот и сильных оснований. (При использовании мыл карбоновых кислот в кислых средах выделяются жирные кислоты, оставляя пятна на очищаемых волокнах. Карбоновые мыла гидролизуют-также отрицательно влияет на во- [c.336]
Нафтеновые кислоты представляют собой карбоновые кислоти циклического строения, главным образом производные пятичленных нафтеновых углеводородов. В отдельных нефтях найдены би-, три- и тетрациклические нафтеновые кислоты, а также и карбоновые кислоты жирного ряда. Содержание нафтеновых кислот в нефтях невелико. Наименьшее количество нафтеновых кислот содержится в парафинистых нефтях и их фракциях, наибольшее — в смолистых нефтях. В Советском Союзе наибольшее количество нафтеновых кислот найдено в нефтях о-ва Сахалин (4,8 вес. % в одоптинскон и 2,8 вес. % в горской), в нефтях Азербайджана (1,67 вес. % в балаханской, 1,34 вес. % в бинагадинской и 0,3 вес. % в биби-эйбатской), Северного Кавказа (1,0 вес. % в грозненской беспарафиновой) и Эмбы (0,8 вес. % в доссорской). Распределение нафтеновых кислот по фракциям крайне неравномерно. Преимущественно они сосредоточены в легких и средних газойлевых фракциях, значительно беднее ими бензино-керосиновые и тяжелые дистилляты. [c.31]
Несмотря на то, что практическое значение простых алифатических сульфокислот в настоящее время сравнительно невелико, они хорошо описаны в литературе, и некоторые из их производных являются интересными с промышленной точки зрения. Наибольшее внимание было уделено исследованию производных метана, этана и карбоновых кислот. Эфиры, полученные из жирных кислот и 2-01 иэтан-1-сульфокислоты (изэтионовой кислоты), а также амиды 2-амипоэтан-1-сульфокислоты (таурина) нашли применение в качестве детергентов и смачивающих агентов. Сульфокислоты присутствуют в некотором количестве в сульфированных маслах , используемых для различных целей в текстильной промышленности. Строение продуктов сульфирования такого типа в большинстве случаев неизвестно, в связи с чем эта область богата интересными возможностями для исследования. Существующие данные носят главным образом эмпирический характер, и представляется затруднительным отличить факты от предположений в обширной патентной литературе. [c.105]
В качестве противокоррозионных присадок к бензинам предложены высшие жирные кислоты и их олигомеры, простые и сложные эфиры, некоторые комплексные соли высших жирных и нафтеновых кислот и аминов или амидов. Используются также среднемолекулярные сульфонаты двухвалентных металлов кальция, магния, бария. Однако сульфонаты обладают повышенной зольностью, увеличивающей износ деталей двигателя. Поэтому предпочтение отдается беззольным присадкам, к которым относятся смешанные соли карбоновых кислот, диаминов и ароматических сульфокислот, алкилянтарные кислоты, нит- [c.373]
Однако возможно также прогоркание жиров под влиянием бактерий и плесневых грибков. Этому разлол ению подвергаются и жиры, содержащие насыигенные жирные кислоты. Плесневые грибки действуют на насыщенные карбоновые кислоты, расщепляя их по принципу р-окнсления, причем здесь, по-видимому, не образуется -окси-кислот в качестве промежуточных продуктов, как при классическом 3-окислении (стр. 245), поскольку -оксикислоты не превращаются в кетоны при действии плесневых грибков [c.270]
А. И кетоны называют также оксосо-единениями. По старой (тривиальной) номенклатуре названия А. производят от названий соответствующих карбоновых кислот, которые могут образоваться в результате окисления А муравьиный А., или формальдегид,— простейший член ряда жирных А.— соответствует муравьиной кислоте, уксусный А., или ацетальдегид,— уксусной кислоте и т. д. По современной научной международной номенклатуре названия производят от названий предельных углеводородов с тем же строением углеродного скелета и окончанием -ал(-аль) Н—СНО — метаналь, СНд—СНО — эта-наль и т. д. Наиболее распространенные методы получения А.— окисление первичных спиртов или восстановление производных кислот. Промышленное значение имеет синтез ацетальдегида, в основе которого лежит реакция Кучеро-ва — присоединение воды к ацетилену в присутствии солей ртути (И) [c.20]
Окисление углеводородов. Этот метод получения карбоновых кислот представляет большой практический интерес, так как углеводороды являются доступным сырьем. Непредельные углеводороды, как известно (стр. 73), могут легко окисляться с распадом молекулы по месту двойной связи в качестве продуктов окисления при этом получаются и кислоты. Предельные углеводороды окисляются также с распадом молекулы, но значительно труднее, причем разрыв углеродной цепи может происходить в различных ее местах поэтому в результате образуются сложные смеси карбоновых кислот. В настоящее время разработано каталитическое окисление предельных углеводородов кислородом воздуха при умеренных температурах при этом наблюдается значительно меньший распад цепей и образуются главным образом высшие жирные кислоты. Так, из высокомолекулярных углеводородов нефти (пара(1зина) получают высшие жирные кислоты (стр. 54). [c.162]
Из электрохимических производств, основанных на использовании электролиза для проведения окислительных или восстановительных реакций, можно назвать электрохимическое окисление Na l в Na lOa производство перхлоратов окислением хлоратов электрохимическое получение хлорной кислоты при обессоливании морской и минерализованных вод электролизным методом получение диоксида хлора и т. д. В органической химии процессы электролиза используются в реакциях катодного восстановления нитросоединений, иминов, имидоэфиров, альдегидов и кетонов, карбоновых кислот, сложных эфиров, а также в реакциях анодного окисления жирных кислот и их солей, ненасыщенных кислот ароматического ряда, ацетилирова-ния, алкилирования и др. [c.357]
chem21.info
Жирные кислоты
Жирные кислоты, или карбоксильные кислоты — органические соединения, состоящие из углеродного цепочки, длиной до 24 атомов углерода с карбоксильной группой (-СООН) на одном конце.
1. Общие сведения
Ковалентные связи между атомами углерода могут быть одинарные или двойные, когда создаются двойные связи, атомы углерода имеют один, а не два атома водорода. Цепочки с одинарной связью имеют максимальное количество атомов водорода, поэтому они называются насыщенными. Цепочки с одним двойной связью называются ненасыщенными, а двумя и более (как правило расположены в молекуле через одну группу CH 2) — полиненасыщенными. Они также различаются по количеству атомов углерода в цепи, а в случае ненасыщенных кислот, по положению и конформации (как правило большинство природных кислот находятся в цис-конформации). Условно жирные кислоты делятся на низкие (до семи атомов углерода), средние (восемь-двинадцять атомов углерода) и высшие (более двинадцяты атомов). Судя по исторничний названии данные вещества должны быть компонентами жиров, но сегодня этот термин распространяется на значительно большую группу веществ. Жирные кислоты входит в состав сложных липидов, которые играют значительную роль в биологии клетки.
Карбоновые кислоты, начиная с масляной кислоты (С4) считаются жирными, хотя жирные кислоты полученные непосредственно из животных жиров имеют в основном восемь и более атомов углерода (каприловой кислота). Количество атомов углерода в натуральных жирных кислотах в основном парное, что обусловлено их биосинтеза с участием ацетил- кофермента А.
Группа жирных кислот (известно более 400, хотя из них наиболее распространены около 12-ти) находятся в масле семян.
Незаменимыми жирными кислотами считаются те, которые не могут быть синтезированными в организме. Для человеческого организма такими кислотами являются те, в которых есть хотя бы одна двойная связь на расстоянии более девяти атомов углерода от карбоксильной группы.
2. Биохимия
2.1. Расщепление
Жирные кислоты в виде ТГ накапливаются в жировых тканях. При необходимости под действием таких веществ как адреналин, норадреналин, глюкагон и адренокортикотропина запускается процесс липолиза. Освобожденные жирные кислоты выделяются в кровоток, по которому и попадаются в клетки, которым нужна энергия. Сначала при участии АТФ происходит связывание (активация) с коферментом А (КоА). При этом АТФ гидролизируется в АМФ с высвобождением двух молекул остатка неорганической фосфорной кислоты (P i).
- R-COOH + КоА-SH + АТФ> R-CO-S-КоА + 2P i + H + + АМФ
2.2. Синтез
В растительном и животном организме жирные кислоты образуются как продукты углеводного и жирового обмена. Синтез жирных кислот происходит как процесс, противоположный расщеплению в цитозоле.
3. Циркуляция
3.1. Пищеварения и всасывания
Кратко-и со средней жирные кислоты всасываются направления в кровь через капилляры кишечного тракта и проходят через воротной вены, вместе с другими питательными веществами. Жирные кислоты с длинными цепями слишком велики, чтобы напрямую попасть через малые отверстия капилляров кишечника. Вместо этого они поглощаются жирными ворсинками стенок кишечника и заново синтезируются в триглицериды. Триглицериды покрываются холестерином и белками с образованием хиломикронов. Внутри ворсинки хиломикроны попадают в лимфатические сосуды. Затем транспортируется по лимфатическим сосудам к месту, рядом с сердцем, где кровеносные артерии и вены крупные. Там грудной канал и избавляется хиломикронов, которые попадают в подключенных вен. Таким образом триглицериды транспортируются к местам, в которых есть потребность. [1]
3.2. Виды существование в организме
Жирные кислоты существуют в разных формах на разных стадиях циркуляции крови. Они поглощаются в кишечнике, образуя хиломикроны, но в то же время существуют и в виде липопротеинов низкой плотности после преобразования в печени. При выделении из адипоцитах жирные кислоты поступают в свободном виде в кровь.
4. Разветвленные кислоты
Разветвленные карбоновые кислоты не относятся к жирных кислот. Их можно найти в некоторых эфирных маслах. Так в масле валерианы содержится изовалериановая кислота.
4.1. Насыщенные жирные кислоты
Общая формула: C n H 2n +1 COOH или CH 3 — (CH 2) n-COOH
| Тривиальное название | Систематическая название (IUPAC) | Химическая формула | Рациональная напиврозвернуты формула | Нахождение | Т.пл. | pKa |
|---|---|---|---|---|---|---|
| Муравьиная кислота | Метановая кислота | HCOOH | НСООН | Выделение желез муравьев | 8 ? C | 3,75 |
| Уксусная кислота | Етанова кислота | CH 3 COOH | CH 3 COOH | Уксус, продукты окисления многих р-вин | 16,2 ? C | 4,76 |
| Пропионовая кислота | Пропановая кислота | C 2 H 5 COOH | CH 3 (CH 2) COOH | Живица | -24 ? C | 4,87 |
| Масляная кислота | Бутановая кислота | C 3 H 7 COOH | CH 3 (CH 2) 2 COOH | Сливочное масло, древесный уксус | -8 ? C | 4,82 |
| Валериановая кислота | Пентановая кислота | C 4 H 9 COOH | CH 3 (CH 2) 3 COOH | Валериана (растение) | -35 ? C | 4,84 |
| Капроновая кислота | Гексановой кислота | C 5 H 11 COOH | CH 3 (CH 2) 4 COOH | Нефть | -4 ? C | 4,85 |
| Энантовый кислота | Гептанова кислота | C 6 H 13 COOH | CH 3 (CH 2) 5 COOH | -7,5 ? C | ||
| Каприловая кислота | Октановое кислота | C 7 H 15 COOH | CH 3 (CH 2) 6 COOH | 17 ? C | 4,89 | |
| Пеларгонова кислота | Нонанового кислота | C 8 H 17 COOH | CH 3 (CH 2) 7 COOH | 12,5 ? C | 4.96 | |
| Каприновый кислота | Деканова кислота | C 9 H 19 COOH | CH 3 (CH 2) 8 COOH | Кокосовое масло | 31 ? C | |
| Ундецилова кислота | Ундеканова кислота | С 10 Н 21 СООН | CH 3 (CH 2) 9 COOH | |||
| Лауриновая кислота | Додеканова кислота | С 11 н 23 СООН | CH 3 (CH 2) 10 COOH | 43,2 ? C | ||
| — | Тридеканова кислота | С 12 н 25 СООН | CH 3 (CH 2) 11 COOH | |||
| Миристинова кислота | Тетрадеканова кислота | С 13 н 27 СООН | CH 3 (CH 2) 12 COOH | 53,9 ? C | ||
| — | Пентадеканова кислота | С 14 Н 29 СООН | CH 3 (CH 2) 13 COOH | 43,2 ? C | ||
| Пальмитиновая кислота | Гексадеканова кислота | С 15 Н 31 СООН | CH 3 (CH 2) 14 COOH | 62,8 ? C | ||
| Маргариновая кислота | Гептадеканова кислота | С 16 н 33 СООН | CH 3 (CH 2) 15 COOH | 61,3 ? C | ||
| Стеариновая кислота | Октадеканова кислота | С 17 н 35 СООН | CH 3 (CH 2) 16 COOH | 69,6 ? C | ||
| — | Нонадеканова кислота | С 18 Н 37 СООН | CH 3 (CH 2) 17 COOH | |||
| Арахиновая кислота | Ейкозанова кислота | С 19 н 39 СООН | CH 3 (CH 2) 18 COOH | 75,4 ? C | ||
| — | Генейкозанова кислота | С 20 Н 41 СООН | CH 3 (CH 2) 19 COOH | |||
| Бегенова кислота | Докозанова кислота | С 21 Н 43 СООН | CH 3 (CH 2) 20 COOH | |||
| — | Трикозанова кислота | С 22 Н 45 СООН | CH 3 (CH 2) 21 COOH | |||
| Лигноцериновая кислота | Тетракозанова кислота | С 23 н 47 СООН | CH 3 (CH 2) 22 COOH | |||
| — | Пентакозанова кислота | С 24 н 49 СООН | CH 3 (CH 2) 23 COOH | |||
| Церотинова кислота | Гексакозанова кислота | С 25 Н 51 СООН | CH 3 (CH 2) 24 COOH | |||
| — | Гептакозанова кислота | С 26 н 53 СООН | CH 3 (CH 2) 25 COOH | |||
| Горный кислота | Октакозанова кислота | С 27 Н 55 СООН | CH 3 (CH 2) 26 COOH | |||
| — | Нонакозанова кислота | С 28 Н 57 СООН | CH 3 (CH 2) 27 COOH | |||
| Мелиссового кислота | Триакозанова кислота | С 29 Н 59 СООН | CH 3 (CH 2) 28 COOH | |||
| — | Гентриаконтанова кислота | С 30 Н 61 СООН | CH 3 (CH 2) 29 COOH | |||
| — | Дотриаконтанова кислота | С 31 Н 63 СООН | CH 3 (CH 2) 30 COOH | |||
| Псиластеарилова кислота | Тритриаконтанова кислота | С 32 Н 65 СООН | CH 3 (CH 2) 31 COOH |
4.2. Мононенасыщенные жирные кислоты
Общая формула: СН 3 — (СН 2) m-CH = CH-(CH 2) n-COOH (m = ω -2; n = Δ -2)
| Тривиальное название | Систематическая название (IUPAC) | Химическая формула | IUPAC формула (с мет.кинця) | IUPAC формула (с карб.кинця) | Рациональная напиврозгорнута формула | |
|---|---|---|---|---|---|---|
| Акриловая кислота | 2-пропенова кислота | С 2 Н 3 COOH | 3:1 ω1 | 3:1 Δ2 | СН 2 = СН-СООН | |
| Метакриловая кислота | 2-метил-2-пропенова кислота | С 3 Н 5 OOH | 4:1 ω1 | 3:1 Δ2 | СН 2 = С (СН 3)-СООН | |
| Кротоновая кислота | 2-бутенова кислота | С 3 Н 5 СOOH | 4:1 ω2 | 4:1 Δ2 | СН 2-СН = СН-СООН | |
| Винилоцтова кислота | 3-бутенова кислота | С 3 Н 6 СOOH | 4:1 ω1 | 4:1 Δ3 | СН 2 = СН-СН 2-СООН | |
| Лауроолеинова кислота | цис-9-додекенова кислота | С 11 Н 21 СOOH | 12:1 ω3 | 12:1 Δ9 | СН 3-СН 2-СН = СН-(СН 2) 7-СООН | |
| Миристоолеинова кислота | цис-9-тетрадекенова кислота | С 13 н 25 СOOH | 14:1 ω5 | 14:1 Δ9 | СН 3 — (СН 2) 3-СН = СН-(СН 2) 7-СООН | |
| — | транс-3-гексадекенова кислота | С 15 Н 29 СOOH | 16:1 ω13 | 16:1 Δ3 | СН 3 — (СН 2) 11-СН = СН-(СН 2)-СООН | |
| Пальмитолеинова кислота | цис-9-гексадекенова кислота | С 15 Н 29 СOOH | 16:1 ω7 | 16:1 Δ9 | СН 3 — (СН 2) 5-СН = СН-(СН 2) 7-СООН | |
| Петроселинова кислота | цис-6-октадекенова кислота | С 17 н 33 СOOH | 18:1 ω12 | 18:1 Δ6 | СН 3 — (СН 2) 16-СН = СН-(СН 2) 4-СООН | |
| Олеиновая кислота | цис-9-октадеценова кислота | С 17 н 33 СOOH | 18:1 ω9 | 18:1 Δ9 | СН 3 — (СН 2) 7-СН = СН-(СН 2) 7-СООН | |
| Елаидинова кислота | транс-9-октадеценова кислота | С 17 н 33 СOOH | 18:1 ω9 | 18:1 Δ9 | СН 3 — (СН 2) 7-СН = СН-(СН 2) 7-СООН | |
| Цис-вакценова кислота | цис-11-октадекенова кислота | С 17 н 33 СOOH | 18:1 ω7 | 18:1 Δ11 | СН 3 — (СН 2) 5-СН = СН-(СН 2) 9-СООН | |
| Транс-вакценова кислота | транс-11-октадекенова кислота | С 17 н 33 СOOH | 18:1 ω7 | 18:1 Δ11 | СН 3 — (СН 2) 5-СН = СН-(СН 2) 9-СООН | |
| Гадолеинова кислота | цис-9-ейкозенова кислота | С 19 Н 37 СOOH | 20:1 ω11 | 19:1 Δ9 | СН 3 — (СН 2) 9-СН = СН-(СН 2) 7-СООН | |
| Гондоинова кислота | цис-11-ейкозенова кислота | С 19 Н 37 СOOH | 20:1 ω9 | 20:1 Δ11 | СН 3 — (СН 2) 7-СН = СН-(СН 2) 9-СООН | |
| Эруковой кислоты | цис-9-доказенова кислота | С 21 Н 41 СOOH | 22:1 ω13 | 22:1 Δ9 | СН 3 — (СН 2) 11-СН = СН-(СН 2) 7-СООН | |
| Нервонова кислота | цис-15-тетракозенова кислота | С 23 Н 45 СOOH | 24:1 ω9 | 23:1 Δ15 | СН 3 — (СН 2) 7-СН = СН-(СН 2) 13-СООН |
5. Полиненасыщенные жирные кислоты
Общая формула: СН 3 — (СН 2) m — (CH = CH-(CH 2) х (СН 2) n-COOH
| Тривиальное название | Систематическая название (IUPAC) | Химическая формула | IUPAC формула (с мет.кинця) | IUPAC формула (с карб.кинця) | Рациональная напиврозвернуты формула | |
|---|---|---|---|---|---|---|
| Сорбиновая кислота | транс, транс-2 ,4-гексадиенова кислота | С 5 Н 7 COOH | 6:2 ω3 | 6:2 Δ2, 4 | СН 3-СН = СН-СН = СН-СООН | |
| Линолевая кислота | цис, цис-9 ,12-октадекадиеновая кислота | С 17 Н 31 COOH | 18:2 ω6 | 18:2 Δ9, 12 | СН 3 (СН 2) 3 — (СН 2-СН = СН) 2 — (СН 2) 7-СООН | |
| ?-Линоленовая кислота | цис, цис, цис-6 ,9,12-октадекатриенова кислота | С 17 Н 28 COOH | 18:3 ω6 | 18:3 Δ9, 12,15 | СН 3 — (СН 2) — (СН 2-СН = СН) 3 — (СН 2) 6-СООН | |
| ?-Линоленовая кислота | цис, цис, цис-9 ,12,15-октадекатриенова кислота | С 17 Н 29 COOH | 18:3 ω3 | 18:3 Δ9, 12,15 | СН 3 — (СН 2-СН = СН) 3 — (СН 2) 7-СООН | |
| Арахидоновая кислота | цис-5 ,8,11,14-ейкозотетраенова кислота | С 19 Н 31 COOH | 20:4 ω6 | 20:4 Δ5, 8,11,14 | СН 3 — (СН 2) 4 — (СН = СН-СН 2) 4 — (СН 2) 2-СООН | |
| Дигомо-?-Линоленова кислота | 8,11,14-эйкозатриенова кислота | С 19 н 33 COOH | 20:3 ω6 | 20:3 Δ8, 11,14 | СН 3 — (СН 2) 4 — (СН = СН-СН 2) 3 — (СН 2) 5-СООН | |
| — | 4,7,10,13,16-докозапентаенова кислота | С 19 Н 29 COOH | 20:5 ω4 | 20:5 Δ4, 7,10,13,16 | СН 3 — (СН 2) 2 — (СН = СН-СН 2) 5 — (СН 2)-СООН | |
| Тимнодонова кислота | 5,8,11,14,17-эйкозапентаеновая кислота | С 19 Н 29 COOH | 20:5 ω3 | 20:5 Δ5, 8,11,14,17 | СН 3 — (СН 2) — (СН = СН-СН 2) 5 — (СН 2) 2-СООН | |
| — | 4,7,10,13,16,19 — докозагексаеновая кислота | С 21 Н 31 COOH | 22:6 ω3 | 22:3 Δ4, 7,10,13,16,19 | СН 3 — (СН 2) — (СН = СН-СН 2) 6 — (СН 2)-СООН | |
| — | 5,8,11-эйкозатриенова кислота | С 19 н 33 COOH | 20:3 ω9 | 20:3 Δ5, 8,11 | СН 3 — (СН 2) 7 — (СН = СН-СН 2) 3 — (СН 2) 2-СООН |
6. Кислотность
Кислоты с короткой углеводородным хвостом, такие, как муравьиная и уксусно кислоты, полностью смешиваются с водой и диссоциирует с образованием достаточно кислых растворов ( pKa 3.77 и 4.76, соответственно). Жирные кислоты с более длинным хвостом несущественно отличаются по кислотности. Например, pKa нонанового кислоты составляет 4.96. Но с увеличением длины хвоста растворимость жирных кислот в воде уменьшается очень быстро, в результате кислоты мало меняют pH раствора. Значение величины pKa для каждой кислоты приобретают только в реакциях, в которые эти кислоты способны вступать. Кислоты, нерастворимые в воде, могут растворяться в теплом этаноле, и оттитрованы раствором гидроксида натрия, используя фенолфталеин, в качестве индикатора до бледно-розового цвета. Такой анализ позволяет определить содержание жирных кислот в порции триглицеридов после гидролиза.
7. Реакции жирных кислот
Жирные кислоты реагируют так же, как и другие карбоновые кислоты, например реакции этерификации и кислотные реакции. Восстановление жирных кислот приводит к образованию жирных спиртов. Ненасыщенные жирные кислоты также могут вступать в реакции присоединения, наиболее характерной и показательна гидрогенизация, используемые для претворення растительных жиров в маргарин. В результате частичного гидрирования ненасыщенных жирных кислот цис-изомеры, характерные для природы жиров, могут перейти в транс-форму. В реакции Варрентраппа ненасыщенные жиры могут разщеплюватися в разплавленому лугу. Эта реакция имеет важное значение для определения структуры ненасыщенных жирных кислот.
8. Автоокислення и пригиркання
Жирные кислоты при комнатной температуре подвергаются автоокисленню и пригирканню. При этом они разлагаются на углеводороды, кетоны, альдегиды и небольшое количество эпоксидов и спиртов. Тяжелые металлы, содержащиеся в небольших количествах в жирах и маслах, ускоряют автоокислення. Чтобы предотвратить это, жиры и олихи часто обрабатываются хелатирующим реагентами, такими как лимонная кислота.
9. Применение
Натриевые и калиевые соли высших жирных кислот являются эффективными ЮАР и используются яко мыла. Натриевые соли жирных кислот обычно твердые (стандартные детское, банное или хозяйственное мыло), а калиевые — жидкие.
В пищевой промышленности жирные кислоты зарегистрированы как Пищевые добавки E570, как стабилизатор пены, глазирующие агент и пеногаситель. [2]
10. Сноски
См.. также
nado.znate.ru
Жирные кислоты | Info-Farm.RU
Жирные кислоты — органические соединения, состоящие из углеродного цепочки, длиной до 24 атомов углерода с карбоксильной группой (-СООН) на одном конце.
Общие сведения
Ковалентные связи между атомами углерода могут быть одинарные или двойные, когда создаются двойные связи, атомы углерода имеют один, а не два атома водорода. Цепочки с одинарной связью имеют максимальное количество атомов водорода, поэтому они называются насыщенными. Цепочки с одним двойной связью называются ненасыщенными, а двумя и более (как правило расположены в молекуле через одну группу CH 2) — полиненасыщенными. Они также различаются по количеству атомов углерода в цепи, а в случае ненасыщенных кислот, по положению и конформации (как правило большинство природных кислот находятся в цис конформации). Условно жирные кислоты делятся на низшие (до семи атомов углерода), средние (восемь-двенадцать атомов углерода) и высшие (более двенадцати атомов). Судя по исторничний названии данные вещества должны быть компонентами жиров, но на сегодня это срок распространяется на значительно большую группу веществ. Жирные кислоты входит в состав сложных липидов, которые играют значительную роль в биологии клетки.
Карбоновые кислоты, начиная с масляной кислоты (С4) считаются жирными, хотя жирные кислоты получены непосредственно из животных жиров имеют в основном восемь и более атомов углерода (Каприловая кислота). Количество атомов углерода в натуральных жирных кислотах в основном парное, что обусловлено их биосинтеза с участием ацетил-кофермента А.
Большая группа жирных кислот (известно более 400, хотя из них наиболее распространены около 12-ти) находятся в масле семян.
Незаменимыми жирными кислотами считаются те, которые не могут быть синтезированными в организме. Для человеческого организма такими кислотами являются те, в которых есть хотя бы одна двойная связь на расстоянии более девяти атомов углерода от карбоксильной группы.
Биохимия
Расщепление
Жирные кислоты в виде триглицеридов накапливаются в жировых тканях. При необходимости под действием таких веществ как адреналин, норадреналин, глюкагон и адренокортикотропина запускается процесс липолиза. Освобожденные жирные кислоты выделяются в кровоток, по которому и попадаются в клетки, которым нужна энергия. Сначала при участии АТФ происходит связывание (активация) с коферментом А (КоА). При этом АТФ гидролизует до АМФ с высвобождением двух молекул остатка неорганической фосфорной кислоты (P i).
-
-
-
- R-COOH + КоА-SH + АТФ> R-CO-S-КоА + 2P i + H + + АМФ
-
-
Синтез
В растительном и животном организме жирные кислоты образуются как продукты углеводного и жирового обмена. Синтез жирных кислот происходит как процесс, противоположный расщеплению в цитозоле.
Циркуляция
Пищеварения и всасывания
Кратко- и со средней жирные кислоты всасываются направления в кровь через капилляры кишечного тракта и проходят через воротной вену, вместе с другими питательными веществами. Жирные кислоты с длинными цепями слишком велики, чтобы непосредственно попасть через малые отверстия капилляров кишечника. Вместо этого они поглощаются жирными ворсинками стенок кишечника и заново синтезируются в триглицериды. Триглицериды покрываются холестерином и белками с образованием хиломикронов. Внутри ворсинки хиломикроны попадают в лимфатические сосуды. Затем транспортируется по лимфатическим сосудам к месту, рядом с сердцем, где кровеносные артерии и вены крупные. Там грудной канал и избавляется ХМ, которые попадают в подключенных вен. Таким образом триглицериды транспортируются к местам, в которых есть необходимость.
Виды существования в организме
Жирные кислоты существуют в различных формах на разных стадиях циркуляции крови. Они поглощаются в кишечнике, образуя хиломикроны, но в то же время существуют и в виде липопротеинов низкой плотности после преобразования в печени. При выделении из адипоцитов жирные кислоты поступают в свободном виде в кровь.
Разветвленные кислоты
Разветвленные карбоновые кислоты не относятся к жирным кислотам. Их можно найти в некоторых эфирных маслах. Так в масле валерианы содержится изовалериановая кислота.
Насыщенные жирные кислоты
Общая формула: C n H 2n + 1 COOH или CH 3 — (CH 2) n -COOH
| Тривиальное название | Систематическая название (IUPAC) | Химическая формула | Рациональная напиврозвернуты формула | Нахождение | Т.пл. | pKa |
|---|---|---|---|---|---|---|
| Муравьиная кислота | Метановая кислота | HCOOH | НСООН | Выделение желез муравьев | 8 ° C | 3,75 |
| Уксусная кислота | Етанова кислота | CH 3 COOH | CH 3 COOH | Уксус, продукты окисления многих р-вин | 16,2 ° C | 4,76 |
| Пропионовая кислота | Пропановая кислота | C 2 H 5 COOH | CH 3 (CH2) COOH | Живица | -24 ° C | 4,87 |
| Масляная кислота | Бутановая кислота | C 3 H 7 COOH | CH 3 (CH2)2 COOH | Сливочное масло, древесный уксус | -8 ° C |
4,82 |
| Валериановая кислота | Пентановых кислота | C 4 H 9 COOH | CH 3 (CH2)3 COOH | Валериана (растение) | -35 ° C | 4,84 |
| Капроновая кислота | Гексаново кислота | C 5 H 11 COOH | CH 3 (CH2) 4 COOH | Нефть | -4 ° C | 4,85 |
| Энантового кислота | Гептанов кислота | C 6 H 13 COOH | CH 3 (CH2) 5 COOH | -7,5 ° C | ||
| Каприловая кислота | Октановое кислота | C 7 H 15 COOH | CH 3 (CH2) 6 COOH | 17 ° C | 4,89 | |
| Пеларгоновая кислота | Нонанового кислота | C 8 H 17 COOH | CH 3 (CH2)7 COOH | 12,5 ° C | 4.96 | |
| Каприновая кислота | Деканова кислота | C 9 H 19 COOH | CH 3 (CH2)8 COOH | Кокосовое масло | 31 ° C | |
| Ундецилова кислота | Ундеканова кислота | С 10 Н 21 СООН | CH 3 (CH2)9 COOH | |||
| Лауриновая кислота | Додеканова кислота | С 11 Н 23 СООН | CH 3 (CH2)10 COOH | 43,2 ° C | ||
| — | Тридеканова кислота | С 12 Н 25 СООН | CH 3 (CH2)11 COOH | |||
| Миристиновая кислота | Тетрадеканова кислота | С 13 Н 27 СООН | CH 3 (CH2)12 COOH | 53,9 ° C | ||
| — | Пентадеканова кислота | С 14 Н 29 СООН | CH 3 (CH2)13 COOH | 43,2 ° C | ||
| Пальмитиновая кислота | Гексадеканова кислота | С 15 Н 31 СООН | CH 3 (CH2)14 COOH | 62,8 ° C | ||
| Маргариновая кислота | Гептадеканова кислота | С 16 Н 33 СООН | CH 3 (CH2)15 COOH | 61,3 ° C | ||
| Стеариновая кислота | Октадеканова кислота | С 17 Н 35 СООН | CH 3 (CH2)16 COOH | 69,6 ° C | ||
| — | Нонадеканова кислота | С 18 Н 37 СООН | CH 3 (CH2)17 COOH | |||
| Арахиновая кислота | Ейкозанова кислота | С 19 Н 39 СООН | CH 3 (CH2)18 COOH | 75,4 ° C | ||
| — | Генейкозанова кислота | С 20 Н 41 СООН | CH 3 (CH2)19 COOH | |||
| Бегеновая кислота | Докозанова кислота | С 21 Н 43 СООН | CH 3 (CH2)20 COOH | |||
| — | Трикозанова кислота | С 22 Н 45 СООН | CH 3 (CH2)21 COOH | |||
| Лигноцериновой кислота | Тетракозанова кислота | С 23 Н 47 СООН | CH 3 (CH2)22 COOH | |||
| — | Пентакозанова кислота | С 24 Н 49 СООН | CH 3 (CH2)23 COOH | |||
| Церотиновая кислота | Гексакозанова кислота | С 25 Н 51 СООН | CH 3 (CH2)24 COOH | |||
| — | Гептакозанова кислота | С 26 Н 53 СООН | CH 3 (CH2)25 COOH | |||
| Горный кислота | Октакозанова кислота | С 27 Н 55 СООН | CH 3 (CH2)26 COOH | |||
| — | Нонакозанова кислота | С 28 Н 57 СООН | CH 3 (CH2)27 COOH | |||
| Мелиссовая кислота | Триакозанова кислота | С 29 Н 59 СООН | CH 3 (CH2)28 COOH | |||
| — | Гентриаконтанова кислота | С 30 Н 61 СООН | CH 3 (CH2)29 COOH | |||
| — | Дотриаконтанова кислота | С 31 Н 63 СООН | CH 3 (CH2)30 COOH | |||
| Псиластеарилова кислота | Тритриаконтанова кислота | С 32 Н 65 СООН | CH 3 (CH2)31 COOH |
Мононенасыщенные жирные кислоты
Общая формула: СН 3 — (СН 2)m -CH = CH- (CH 2)n -COOH(m = ω -2, n = Δ -2)
| Тривиальное название | Систематическая название (IUPAC) | Химическая формула | IUPAC формула (с мет.кинця) | IUPAC формула (с карб.кинця) | Рациональная напиврозгорнута формула | |
|---|---|---|---|---|---|---|
| Акриловая кислота | 2-пропенова кислота | С 2 Н 3 COOH | 3: 1ω1 | 3: 1Δ2 | СН 2 = СН-СООН | |
| Метакриловая кислота | 2-метил-2-пропенова кислота | С 3 Н 5 OOH | 4: 1ω1 | 4: 1Δ2 | СН 2 = С (СН 3) -СООН | |
| Кротоновая кислота | 2-бутенова кислота | С 3 Н 5 COOH | 4: 1ω2 | 4: 1Δ2 | СН 2 СН = СН-СООН | |
| Винилоцтова кислота | 3-бутенова кислота | С 3 Н 6 COOH | 4: 1ω1 | 4: 1Δ3 | СН 2 = СН-СН 2 -СООН | |
| Лауроолеинова кислота | цис-9-додекенова кислота | С 11 Н 21 COOH | 12: 1ω3 | 12: 1Δ9 | СН 3 СН 2 СН = СН (СН 2) 7 СООН | |
| Миристоолеинова кислота | цис-9-тетрадекенова кислота | С 13 Н 25 COOH | 14: 1ω5 | 14: 1Δ9 | СН 3 — (СН 2) 3 СН = СН (СН 2) 7 СООН | |
| — | транс-3-гексадекенова кислота | С 15 Н 29 COOH | 16: 1ω13 | 16: 1Δ3 | СН 3 — (СН 2) 11 СН = СН (СН 2) -СООН | |
| Пальмитолеиновая кислота | цис-9-гексадекенова кислота | С 15 Н 29 COOH | 16: 1ω7 | 16: 1Δ9 | СН 3 — (СН 2) 5 -СН = СН (СН 2) 7 СООН | |
| Петроселинова кислота | цис-6-октадекенова кислота | С 17 Н 33 COOH | 18: 1ω12 | 18: 1Δ6 | СН 3 — (СН 2) 16 СН = СН (СН 2) 4 -СООН | |
| Олеиновая кислота | цис-9-октадеценова кислота | С 17 Н 33 COOH | 18: 1ω9 | 18: 1Δ9 | СН 3 — (СН 2) 7 СН = СН (СН 2) 7 СООН | |
| Елаидинова кислота | транс-9-октадеценова кислота | С 17 Н 33 COOH | 18: 1ω9 | 18: 1Δ9 | СН 3 — (СН 2) 7 СН = СН (СН 2) 7 СООН | |
| Цис-вакценова кислота | цис-11-октадекенова кислота | С 17 Н 33 COOH | 18: 1ω7 | 18: 1Δ11 | СН 3 — (СН 2) 5 -СН = СН (СН 2) 9 -СООН | |
| Транс-вакценова кислота | транс-11-октадекенова кислота | С 17 Н 33 COOH | 18: 1ω7 | 18: 1Δ11 | СН 3 — (СН 2) 5 -СН = СН (СН 2) 9 -СООН | |
| Гадолеинова кислота | цис-9-ейкозенова кислота | С 19 Н 37 COOH | 20: 1ω11 | 19: 1Δ9 | СН 3 — (СН 2) 9 СН = СН (СН 2) 7 СООН | |
| Гондоинова кислота | цис-11-ейкозенова кислота | С 19 Н 37 COOH | 20: 1ω9 | 20: 1Δ11 | СН 3 — (СН 2) 7 СН = СН (СН 2) 9 -СООН | |
| Эруковая кислота | цис-9-доказенова кислота | С 21 Н 41 COOH | 22: 1ω13 | 22: 1Δ9 | СН 3 — (СН 2) 11 СН = СН (СН 2) 7 СООН | |
| Нервонова кислота | цис-15-тетракозенова кислота | С 23 Н 45 COOH | 24: 1ω9 | 23: 1Δ15 | СН 3 — (СН 2) 7 СН = СН (СН 2) 13 -СООН |
Полиненасыщенные жирные кислоты
Общая формула: СН 3 — (СН 2) m — (CH = CH- (CH 2) х (СН 2) n-COOH
| Тривиальное название | Систематическая название (IUPAC) | Химическая формула | IUPAC формула (из м. Конца) | IUPAC формула (с р. Конца) | Рациональная напиврозгорнута формула |
|---|---|---|---|---|---|
| Сорбиновая кислота | транс, транс-2,4-гексадиенова кислота | С 5 Н 7 COOH | 6: 2ω3 | 6: 2Δ2,4 | СН 3 СН = СН-СН = СН-СООН |
| Линолевая кислота | цис, цис-9,12-октадекадиеновая кислота | С 17 Н 31 COOH | 18: 2ω6 | 18: 2Δ9,12 | СН 3 (СН 2) 3 — (СН 2 СН = СН) 2 — (СН 2) 7 СООН |
| ? -линоленова кислота | цис, цис, цис-6,9,12-октадекатриенова кислота | С 17 Н 28 COOH | 18: 3ω6 | 18: 3Δ9,12,15 | СН 3 — (СН 2) — (СН 2 СН = СН) 3 — (СН 2) 6 -СООН |
| α-линоленовая кислота | цис, цис, цис-9,12,15-октадекатриенова кислота | С 17 Н 29 COOH | 18: 3ω3 | 18: 3Δ9,12,15 | СН 3 — (СН 2 СН = СН) 3 — (СН 2) 7 СООН |
| Арахидоновая кислота | цис-5,8,11,14-ейкозотетраенова кислота | С 19 Н 31 COOH | 20: 4ω6 | 20: 4Δ5,8,11,14 | СН 3 — (СН 2) 4 — (СН = СН-СН 2) 4 — (СН 2) 2 -СООН |
| Дыгой -? — Линоленовая кислота | 8,11,14-ейкозатриенова кислота | С 19 Н 33 COOH | 20: 3ω6 | 20: 3Δ8,11,14 | СН 3 — (СН 2) 4 — (СН = СН-СН 2) 3 — (СН 2) 5 -СООН |
| — | 4,7,10,13,16-докозапентаенова кислота | С 19 Н 29 COOH | 20: 5ω4 | 20: 5Δ4,7,10,13,16 | СН 3 — (СН 2) 2 — (СН = СН-СН 2) 5 — (СН 2) -СООН |
| Тимнодонова кислота | 5,8,11,14,17-эйкозапентаеновая кислота | С 19 Н 29 COOH | 20: 5ω3 | 20: 5Δ5,8,11,14,17 | СН 3 — (СН 2) — (СН = СН-СН 2) 5 — (СН 2) 2 -СООН |
| — | 4,7,10,13,16,19-докозагексаеновая кислота | С 21 Н 31 COOH | 22: 6ω3 | 22: 3Δ4,7,10,13,16,19 | СН 3 — (СН 2) — (СН = СН-СН 2) 6 — (СН 2) -СООН |
| — | 5,8,11-эйкозатриенова кислота | С 19 Н 33 COOH | 20: 3ω9 | 20: 3Δ5,8,11 | СН 3 — (СН 2) 7 — (СН = СН-СН 2) 3 — (СН 2) 2 -СООН |
Кислотность
Кислоты с короткой углеводородным хвостом, такие, как муравьиная и уксусная кислоты, полностью смешиваются с водой и диссоциируют с образованием достаточно кислых растворов (pKa 3.77 и 4.76, соответственно). Жирные кислоты с более длинным хвостом несущественно отличаются по кислотности. Например, pKa нонанового кислоты составляет 4.96. Но с увеличением длины хвоста растворимость жирных кислот в воде уменьшается очень быстро, в результате кислоты мало меняют pH раствора. Значение величины pKa для каждой кислоты приобретают только в реакциях, в которые эти кислоты способны вступать. Кислоты, которые нерастворимые в воде, могут растворяться в теплом этаноле, и оттитрованы раствором гидроксида натрия, используя фенолфталеин, в качестве индикатора до бледно-розового цвета. Такой анализ позволяет определить содержание жирных кислот в порции триглицеридов после гидролиза.
Реакции жирных кислот
Жирные кислоты реагируют как и другие карбоновые кислоты, например реакции этерификации и кислотные реакции. Восстановление жирных кислот приводит к образованию жирных спиртов. Ненасыщенные жирные кислоты также могут вступать в реакции присоединения, наиболее характерна и показательна гидрогенизация, которую используют для претворення растительных жиров в маргарин. В результате частичного гидрирования ненасыщенных жирных кислот цис-изомеры, характерные для природы жиров, могут перейти в транс-форму. В реакции Варрентраппа ненасыщенные жиры могут разщеплюватися в разплавленому лугу. Эта реакция имеет важное значение для определения структуры ненасыщенных жирных кислот.
Автоокислення и пригиркання
Жирные кислоты при комнатной температуре подвергаются автоокисленню и пригирканню. При этом они разлагаются на углеводороды, кетоны, альдегиды и небольшое количество эпоксидов и спиртов. Тяжелые металлы, содержащиеся в небольших количествах в жирах и маслах, ускоряют автоокислення. Чтобы предотвратить это, жиры и масла часто обрабатываются хелатирующими реагентами, такими как лимонная кислота.
Применение
Натриевые и калиевые соли высших жирных кислот являются эффективными ЮАР и используются как мыла. Натриевые соли жирных кислот обычно твердые (стандартные детское, банное или хозяйственное мыло), а калиевые — жидкие.
В пищевой промышленности жирные кислоты зарегистрированы как пищевые добавки E570, как стабилизатор пены, глазирующий агент и пеногаситель.
Дистиллированные жирные кислоты являются сырьем для изготовления туалетного мыла, резинотехнических изделий, хлопчатобумажных тканей, эмульгаторов, косметических препаратов и др. Жидкая фракция жирных кислот с содержанием олеиновой кислоты не менее 75% (олеин) используется в производстве химических волокон. Техническая стеариновая кислота (стеарин) используется при изготовлении автопокривок, фотопленки, ударопрочного полистирола, стабилизаторов для полимеров, короткоцепочечные жирные кислоты (КЖК) является ароматизаторами.
Видео по теме
Изображения по теме
info-farm.ru
Карбоновые кислоты жирные, получение — Справочник химика 21
Эфиры дифенилолпропана и жирных карбоновых кислот. Описано получение сложных эфиров дифенилолпропана и кислот жирного ряда нагреванием дифенилолпропана с хлорангидридами этих кислот [c.39]Описываемый способ получения ангидридов кислот в мягких условиях находит широкое применение ангидриды карбоновых КИСЛОТ жирного и ароматического рядов, а также ангидриды сульфокислот можно получать с хорошими выходами даже при низких температурах. Таким образом синтезирован ра- [c.162]
Получение циклических кислот при помощи малонового эфира. Эти синтезы представляют собой модификацию синтезов карбоновых кислот жирного ряда. Циклические кислоты могут быть получены двумя путями. [c.38]
Получение метиловых эфиров карбоновых кислот (см. Получение метиловых эфиров жирных кислот , стр. 113.) v [c.119]
Основным сырьем для получения полиэфиров являются поли-функциональные спирты и карбоновые кислоты. Для получения полиэфиров определенного строения широко используются также высыхающие масла и их жирные одноосновные кислоты, алифатические и ароматические монокарбоновые кислоты и другие соединения (табл. 3.1). [c.45]
Жирные кислоты каталитическим процессом превращают в кетоны, которые каталитически восстанавливают, как указано выше. Низкомолекулярные жирные кислоты в кетоны целесообразно превращать в паровой фазе над катализатором на основе окиси тория. Для превращения же высокомолекулярных кислот, как миристиновая, пальмитиновая или стеариновая, целесообразно использовать метод получения кетонов по Грюну в присутствии железа в качестве катализатора. При этом достигаются хорошие выходы кетона, содержащего 2п—1 углеродных атома п — число углеродных атомов в исходной кислоте), и карбонильная группа всегда находится точно в середине цепи молекулы. Если же проводить реакцию кетонизации, исходя из карбоновых кислот, содержащих четное и нечетное числа атомов углерода, то образуются кетоны с несимметрично расположенной карбонильной группой [c.61]
Полученное таким способом мыло-сырец еще непригодно к употреблению, поскольку оно состоит из натровых солей жирных кислот (С4— 22). При помощи разбавленной минеральной кислоты, например серной, его разлагают в освинцованных железных аппаратах, в керамических или в футерованных емкостях в соответствующие карбоновые кислоты, которые затем следует перегонять, чтобы выделить кислоты (С[2—С18), годные для мыловарения. [c.460]
Жирные кислоты, пригодные для производства синтетических пищевых жиров, должны подвергаться особой очистке. В настоящее время длительными опытами точно установлено, что присутствующие в этих жирах кислоты с нечетным числом атомов углерода усваиваются человеческим организмом так же, как кислоты с четным числом поэтому нет никаких оснований удалять жирные кислоты с нечетным числом углеродных атомов из смеси синтетических жирных кислот. С технической точки зрения нет смысла осуществлять такое разделение кислот, поскольку оба типа кислот присутствуют почти в одинаковых количествах. Напротив, кислоты изостроения должны быть удалены, насколько это возможно, так как они являются причиной появления в моче кислых соединений, растворимых в эфире. Установлено также, что крысы, которых кормили жирами, синтезированными из жирных кислот, полученных на основе синтетического парафинового гача, испытывали задержку в росте. Известно, что эти кислоты имеют довольно разветвленное строение. Жирные кислоты изостроения можно в достаточной степени отделить экстракцией растворителями, например метанолом, метилэтилкетоном, ацетоном, бензином и низкомолекулярными карбоновыми кислотами, в которых они легче растворимы, чем кислоты с прямой цепью [101]. [c.474]
Как уже отмечалось, некоторые из жирных карбоновых кислот, полученных окислением углеводородов, находят применение для синтеза мыл. [c.222]
Гидролиз жиров едкими щелочами протекает очень быстро и необратимо, в результате чего получаются глицерин и соответствующие соли жирных карбоновых кислот (мыла). Этот процесс каталитически активируется добавками даже малых количеств щелочи, но для получения мыл щелочь берут ио расчету. [c.533]
Реакции алкоголиза могут быть использованы для получения эфиров высших карбоновых кислот. В основе этих реакций лежит старое наблюдение, что при действии абсолютного этилового спирта с 1 % хлористого водорода на глицериды жирных карбоновых кислот получаются их этиловые эфиры. Было проведено много реакций алкоголиза коксового, льняного, касторового и иных растительных масел с метиловым спиртом. Нагревание с избытком абсолютного [c.545]
Такая дисмутация в особенности характерна для ароматических альдегидов и часто протекает настолько гладко, что может быть использована для препаративного получения некоторых ароматических спиртов и кислот. Из альдегидов жирного ряда такое превращение претерпевают, например, формальдегид и ацетальдегид. Возможно, что эта реакция играет значительную роль при некоторых биологических процессах (например, при спиртовом брожении, стр. 119). Одновременное образование спирта и карбоновой кислоты из альдегидов открыто Канниццаро и поэтому носит название реакции Канниццаро [в применении к алифатическим альдегидам ее обычно называют реакцией Тищенко]. [c.207]
Вторая глава посвящена гидратации олефинов с получением спиртов, синтезу высших жирных спиртов окислением -парафинов, получению ацетальдегида прямым окислением этилена, получению карбоновых кислот из парафинов, получению гидроперекиси изопропилбензола и ее разложению на фенол и ацетон. [c.5]
Основным сырьем для их получения долгое время служили природные жиры — сложные эфиры глицерина и различных жирных кислот, омылением которых обычно и получали мыла карбоновых кислот. Необходимость огромного расхода ценного пищевого сырья потребовала развития производства синтетических жирных (кислот (СЖК). В настоящее время СЖК нормального строения, содержащие 10—20 атомов углерода в молекуле, получают рядом методов (см. ниже) и широко используют в производстве ПАВ. [c.77]
ПАВ отличает достаточная простота технологии их получения (следовательно, относительно низкая стоимость) и, что очень важно, полная биоразлагаемость. Мыла карбоновых кислот обладают хорошим моющим действием только в щелочной среде, в кислой же среде (из-за образования малорастворимых жирных кислот) и в жесткой воде (из-за образования нерастворимых кальциевых и магниевых солей) моющая способность этих ПАВ низка. [c.92]
Основными гидрофобными исходными материалами являются высшие жирные спирты, алкилфенолы, жирные кислоты или их эфиры, амины, амиды карбоновых кислот, меркаптаны. Присоединение идет при 140—160° в присутствии поблочных катализаторов в автоклавах под давлением в атмосфере азота. Реакция экзотермична, так что необходимо охлаждение реакционной смеси. Для получения продукта, точно соответствующего спецификации, необходимо тщательно поддерживать постоянную температуру. [c.453]
Синтетические жирные кислоты. С целью замены пищевых жиров для мыловарения разработан способ промышленного получения карбоновых кислот с числом углеродов в цепи от [c.263]
Термином липиды называют очень большую и крайне разнородную группу веществ. В основе отнесения этих веществ к единой категории лежит их высокая растворимость в неполярных растворителях или близость к соединениям, которые обладают таким свойством. Большинство липидов не является высокополимерными соединениями и состоит всего из нескольких связанных одна с другой молекул. Некоторые из этих строительных блоков представляют собой линейные цепи ряда карбоновых кислот, образующихся в ходе сложных реакций полимеризации, Полученные в результате молекулы, например молекулы жирных кислот, имеют по большей части гидрофобный характер, однако обычно содержат как минимум одну полярную группу, которая может служить местом связывания с другими компонентами. Довольно часто присутствуют ионные группы (фосфат, —ЫНз) или полярные углеводные компоненты. Липиды, содержащие как полярные, так и неполярные группы, обычно встречаются в мембранах и на других поверхностях раздела между водной средой и гидрофобными областями внутри клеток. [c.146]
Под жирными кислотами принято принимать карбоновые кислоты с числом углеродных атомов выше 8. здесь приведены сведения обо всех товарных фракциях кислот, полученных при разделении широкой фракции. [c.227]
Превращение уксусной кислоты в уксусный ангидрид действием кетена осуществляется в большом масштабе, в особен-, ности в производстве ацетилцеллюлозы. В этом случае в уксусный ангидрид, нужный для ацетилирования, превращают уксусную кислоту, образующуюся в качестве побочного продукта при реакции. Кетен легко реагирует в отсутствие катализаторов с другими карбоновыми кислотами с образованием смешанных ангидридов, из которых затем путем диспропорционирования можно получить простые ангидриды [71, 133, 252]. Реакцию можно проводить без растворителя или в таком инертном растворителе, как бензол, ацетон или эфир. Так, при действии кетена на бензойную кислоту образуется с количественным выходом смешанный ангидрид, который при перегонке в вакууме полностью превращается в уксусный й бензойный ангидриды. Этот метод использовался для получения ангидридов высших кислот жирного ряда [253]. [c.206]
Нафтеновое мыло обладает резким неприятным запахом нефти, а мыло из синтетических жирных кислот имела неприятный запах окиси карбоновых кислот, что объясняется недостаточной очисткой синтетических жирных кнслот в процессе нх получения. [c.43]
Способ получения углеводородов нагреванием натриевых солей карбоновых кислот с натронной известью, как показала проверка, является общим лабораторным способом получения ряда углеводородов не только жирного, но, как мы увидим ниже, и ароматического ряда (опыт 87). [c.31]
Карбоновые кислоты можно использовать также для непосред ственного получения алканов, содержащих более длинную цепь углеродных атомов, чем исходная кислота. Для этой цели наиболее широко используется электрохимический синтез Кольбе (уравнение 20) [117]. Электролиз соли щелочного металла и карбоновой кислоты дает диоксид углерода и алкан, который содержит удвоенное число углеродных атомов по сравнению с числом атомов углерода в алкильном радикале кислоты. Реакция проходит через образование карбоксилатного радикала. Декарбоксилирование этого радикала приводит к алкильным радикалам, которые образуют алкан путем димеризации. С хорошими выходами алканы получают при электролизе жирных кислот, содержащих шесть п более атомов углерода. Низшие члены ряда, за исключением уксусной кислоты, дают алканы с довольно низкими выходами и большие [c.137]
В этом главе будет рассмотрена только первая группа методов получения карбоновых кислот, так как вторая группа. методов основывается на реакциях, подробно описанных в других главах этой книга. Так например получение жирных кислот из ненасыщенных основано на восстановлении и поэтому описано в соответствующей главе т. II. [c.368]
При действии углекислоты цинкалкилы также дают соли жирных кислот но теперь этот. метод совершенно вытеснен простым и удобным способом получения карбоновых кислот из магнийорганических соединений. [c.400]
Несмотря на то, что практическое значение простых алифатических сульфокислот в настоящее время сравнительно невелико, они хорошо описаны в литературе, и некоторые из их производных являются интересными с промышленной точки зрения. Наибольшее внимание было уделено исследованию производных метана, этана и карбоновых кислот. Эфиры, полученные из жирных кислот и 2-01 иэтан-1-сульфокислоты (изэтионовой кислоты), а также амиды 2-амипоэтан-1-сульфокислоты (таурина) нашли применение в качестве детергентов и смачивающих агентов. Сульфокислоты присутствуют в некотором количестве в сульфированных маслах , используемых для различных целей в текстильной промышленности. Строение продуктов сульфирования такого типа в большинстве случаев неизвестно, в связи с чем эта область богата интересными возможностями для исследования. Существующие данные носят главным образом эмпирический характер, и представляется затруднительным отличить факты от предположений в обширной патентной литературе. [c.105]
Об отщеплении бромистого водорода от дибромидов а,8-нена-сыщенных карбоновых кислот жирного ряда имеется сообщение Бриан-Бахмана [959]. Он рассматривает возможность проведения отщепления в различных условиях и приводит прописи, в частности для получения 1-бромолефинов, которые могут быть использованы в синтезе ацетиленовых углеводородов. [c.343]
Этот способ наиболее удобен для получения карбоновых кислот жирного ряда, так как соответствующие нитрилы могут быть легко получены из доступных галогенопроизводных при нагревании их с цианистым калием. Это позволяет получать равличные карбоновые кислоты из более простых галогенопроизводных. [c.333]
Изучение взаимодействия амидов карбоновых кислот с пятихлористым фосфором начато еще в середине XIX века, но исследование этой реакции с самого начала пошло по неправильному пути. Ошибочные выводы при изучении реакции амидов карбоновых кислот с пятихлористым фосфором объясняются главным образом особенностями химических свойств трихлорфосфазокарбацилов и в первую очередь их нестойкостью в присутствии хлороводорода и при нагревании. Работа с ними требует соблюдения строго определенных условий. Если эти условия тщательно выполняются, то получение трихлорфосфазокарбацилов не представляет никаких трудностей, но при их нарушении выделить трихлорфосфазокарбацилы невозможно — получаются только те или иные продукты их распада или превращений. Долгие годы особенности свойств трихлорфосфазокарбацилов оставались незамеченными. Экспериментальные ошибки влекли за собой неправильные теоретические выводы, которые, в свою очередь, отрицательно влияли на дальнейшие исследования [1 —17]. Так, например, при реакции пятихлористого фосфора с амидами некоторых карбоновых кислот жирного и ароматического ряда были выделены только нитрилы соответствующих кислот и хлорокись фосфора, а образование [c.80]
Стиртон с сотрудниками [2991 синтезировали и изучили ряд а-сульфо-карбоновых кислот. Метод получения этих веществ заключается в обработке раствора жирных кислот в тетрахлорэтане жидким серным ангидридом. Установлено, что наилучшими моющими свойствами обладает а-сул опальмити-новая кислота. Такие соединения особенно интересны тем, что их синтез является одним из наиболее прямых путей превращения жирных кислот в устойчивые к солям кальция моющие вещества, физические свойства которых позволяют применять их в быту. [c.50]
Из этих обоих примеров видно, как важно особенно для получения высокомолекулярных корбоновых кислот (жирных кислот для мыловарения) иметь возможность направлять нитрогруипу при прямом нитровании параф1иновых углеводородов на конец цепи молекулы. Тогда, исходя из когазина II, можно было бы осуществить прямое получение карбоновых кислот с 12—18 углеродными атомами без расщепления углеродного скелета [190]. [c.338]
Исследуя кислоты, полученные при окислении парафиновых углеводородов изостроения, можно составить представление о пунктах окислительной атаки кислорода. Последний действует преимущественно на точку разветвления, иначе говоря, на третичный атом водорода, В результате отщепления боковых цепей образуются в основном кислоты с прямой цепью. Тем не менее парафины с сильно разветвленным угле- родным скелетом продолжают оставаться непонгодными для промышленных целей сырьем [42], При их окислении получают главным обраэом низкомолекулярные и более глубоко окисленные карбоновые кислоты с числом атомов углерода меньше 12, не говоря уже о значительных количествах кислот с разветвленным скелетом. Эти кислоты обладают неприятным запахом и неудовлетворительным моющим действием. Технические нефтяные дистилляты, хотя и обогащенные парафинами, непригодны для получения жирных кислот, предназначенных для мыловарения, так как содержат нафтеновые и ароматические углеводороды, а также другие циклические соединения. [c.445]
В качестве сырья использовались промышленные образцы пентаэритрита, диэтиленгликоля, индивидуальные карбоновые кислоты от Сц до 15 марки Ч и синтетические жирные кислоты, образующиеся как промежуточная фракция при получении сырья для синтмасел на промышленной установке производства СЖК,. состав которых приведен в табл. 1. Синтез эфиров осуществлялся, путем этерификации соответствующих кислот и спиртов в присутствии 0,3% катализатора окиси цинка с 5%-ным избытком кислот против стехиометрического соотношения. Катализатор из-полученного этерификата удалялся обработкой последнего 3%-ным раствором Н2504 с последующей промывкой водой, а избыток кислот путем отгона их под вакуумом. [c.117]
Установлено, что образование оксикислот растет с глубиной окисления, поэтому в настоящее время окисление углеводородов проводят лишь на 20—30%, в результате чего образуются почти исключительно жирные карбоновые кислоты. По одному из многочисленных методов рекомендуется проводить окисление воздухом при 100° в течение 24 час. в присутствии солей тяжелых металлов, что дает смесь из 30% жирных карбоновых кислот и 70% неокислен-ных углеводородов. Повышение температуры выше 100° нежелательно, так как в этом случае полученный продукт представляет смесь жидких и твердых карбоновых кислот с оксикислотами и их производными—лактидами, лактонами и эстолидами. Эту смесь необходимо обрабатывать едким натром и содой при 300—400° под давлением в результате конверсии оксикислот и их производных повышается выход монокарбоновых кислот. [c.219]
А. И кетоны называют также оксосо-единениями. По старой (тривиальной) номенклатуре названия А. производят от названий соответствующих карбоновых кислот, которые могут образоваться в результате окисления А муравьиный А., или формальдегид,— простейший член ряда жирных А.— соответствует муравьиной кислоте, уксусный А., или ацетальдегид,— уксусной кислоте и т. д. По современной научной международной номенклатуре названия производят от названий предельных углеводородов с тем же строением углеродного скелета и окончанием -ал(-аль) Н—СНО — метаналь, СНд—СНО — эта-наль и т. д. Наиболее распространенные методы получения А.— окисление первичных спиртов или восстановление производных кислот. Промышленное значение имеет синтез ацетальдегида, в основе которого лежит реакция Кучеро-ва — присоединение воды к ацетилену в присутствии солей ртути (И) [c.20]
Углеводороды нефти, содержащие от 8 до 20 и более атомов углерода, являются очень важным сырьем для получения гидрофобных радикалов. Обычно для этих целей используют фракции керосина, светлых нефтепродуктов и парафина, которые можно обработать различными методами а) хлорированием, а затем конденсацией с ароматическими кольцами или дегидрогалогеиизацией с образованием олефинов б) превращением непосредственно в сульфохлориды в результате реакции с диоксидом серы и хлором (реакция Рида) в) окислением в карбоновые кислоты, которые, в свою очередь, могут быть использованы аналогично природным жирным кислотам. [c.65]
Окисление углеводородов. Этот метод получения карбоновых кислот представляет большой практический интерес, так как углеводороды являются доступным сырьем. Непредельные углеводороды, как известно (стр. 73), могут легко окисляться с распадом молекулы по месту двойной связи в качестве продуктов окисления при этом получаются и кислоты. Предельные углеводороды окисляются также с распадом молекулы, но значительно труднее, причем разрыв углеродной цепи может происходить в различных ее местах поэтому в результате образуются сложные смеси карбоновых кислот. В настоящее время разработано каталитическое окисление предельных углеводородов кислородом воздуха при умеренных температурах при этом наблюдается значительно меньший распад цепей и образуются главным образом высшие жирные кислоты. Так, из высокомолекулярных углеводородов нефти (пара(1зина) получают высшие жирные кислоты (стр. 54). [c.162]
Из электрохимических производств, основанных на использовании электролиза для проведения окислительных или восстановительных реакций, можно назвать электрохимическое окисление Na l в Na lOa производство перхлоратов окислением хлоратов электрохимическое получение хлорной кислоты при обессоливании морской и минерализованных вод электролизным методом получение диоксида хлора и т. д. В органической химии процессы электролиза используются в реакциях катодного восстановления нитросоединений, иминов, имидоэфиров, альдегидов и кетонов, карбоновых кислот, сложных эфиров, а также в реакциях анодного окисления жирных кислот и их солей, ненасыщенных кислот ароматического ряда, ацетилирова-ния, алкилирования и др. [c.357]
При введении радиоактивного изотопа в виде простого химического соединения в живой организм образуются более сложные продукты, содержащие радиоактивный атом. Биосинтетический способ получения меченых соединений применяют в тех случаях, когда химический синтез этих веществ слишком сложен. Этот способ был использован для метки многих природных соединений, например белков, полисахаридов, нуклеиновых кислот, пуринов, пиримидинов, витаминов, гормонов, стероидов, алкалоидов, терпенов, карбоновых кислот, аминокислот, жиров и жирных кислот из радиоизотопов чаще всего применяют и Р -. Биосинтезы приводят обычно к неспецифически меченным соединениям с низким выходом требуемого продукта. Однако, если большая часть образующихся меченых соединений может быть использована для различных целей, то их биосинтез экономически выгоден. [c.683]
Способ получения ацетапей, по Фишеру, в жирно. ад ряду дает хорошие результаты, однако на вышеприведенном основании в случае некоторых аро.адатических альдегидов типа бензальдегида — оставляет желать лучшего. Только при введении в ядро сильно электроотрицательной группы образование ацеталей протекает гладко. Так, о-нитробензальдегид уже при комнатной температуре превращается в ацеталь на 70%, 2, 5-д и х л о р б е н з а л ь-л с г и д — на 83%, 2- н и т р о-З, 6-дихлорбензальдегид — на 70%. Затруднений с образованием ацеталей при орто-замещенных, как при образовании сложных эфиров ароматических карбоновых кислот, установить не удалось. [c.229]
chem21.info
А. Карбоновые кислоты / Биохимия
Жирными кислотами называются карбоновые кислоты с углеводородной цепью не менее 4 атомов углерода. Они присутствуют в организмах всех видов в виде сложных эфиров (например, с глицерином и холестерином) и служат структурными элементами жиров и мембранных липидов. Свободные жирные кислоты (сокращённо СЖК) присутствуют в организме в небольших количествах, например в крови.В таблице приведён ряд алифатических карбоновых кислот, обнаруженных в растительных и животных тканях. В высших растениях и животных содержатся главным образом жирные кислоты с длинной и неразветвлённой цепью из 16 и 18 углеродных атомов, а именно пальмитиновая и стеариновая. Все длинноцепочечные природные жирные кислоты состоят из чётного числа углеродных атомов, что обусловлено биосинтезом этих соединений из C2-предшественников (см. Питание. Органические вещества).
Многие жирные кислоты имеют одну или несколько двойных связей. К наиболее распространённым ненасыщенным кислотам относятся олеиновая и линолевая. Из двух возможных цис- и транс-конфигураций двойной связи (см. Углеводы) в природных липидах присутствует лишь цис-форма. Разветвлённые жирные кислоты встречаются только в бактериях. Для обозначения жирных кислот иногда применяют сокращённые названия, где первая цифра означает число углеродных атомов, вторая цифра указывает число двойных связей, а последующие — положение этих связей. Как обычно, нумерация атомов углерода начинается с наиболее окисленной группы (карбоксигруппа = C-1). Для этих целей используются также буквы греческого алфавита (α = C-2, β = C-3, ω = последний C-атом).
На схеме приведено полное строение капроновой кислоты. Молекула в целом неполярна, исключение составляет карбоксигруппа. К незаменимым жирным кислотам относятся те из них, которые не синтезируются в организме и должны поступать с пищей. Речь идёт о сильно ненасыщенных кислотах, в частности арахидоновой (20:4;5,8,11,14), линолевой (18:2;9,12) и линоленовой (18:3;9,12,15). Арахидоновая кислота является предшественником эйкозаноидов (простагландинов и лейкотриенов) (см. Эйкозаноиды) и поэтому обязательно должна присутствовать в пищевом рационе. Линолевая и линоленовая кислоты, имеющие более короткую углеродную цепь, могут превращаться в арахидоновую за счёт наращивания цепи, и, следовательно, являются её заменителями.
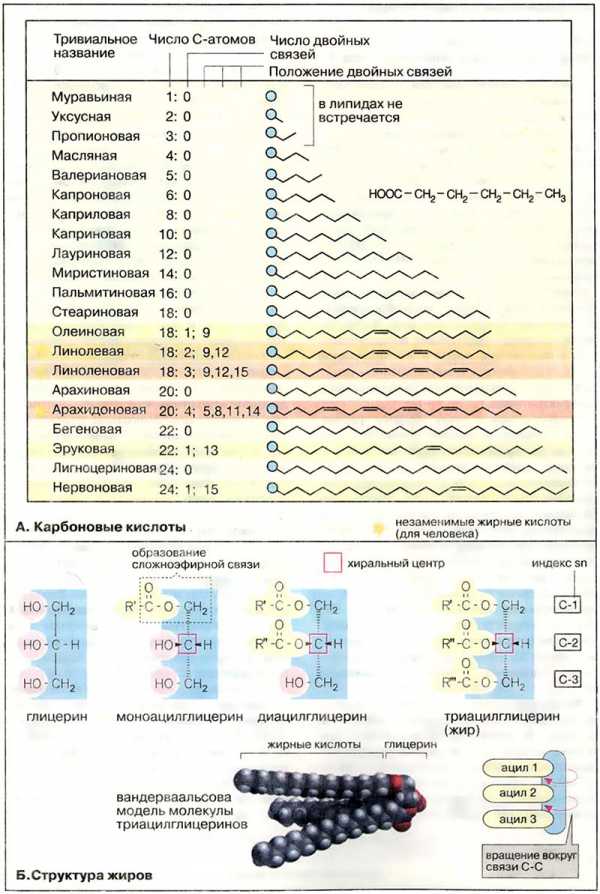
Статьи раздела «Жирные кислоты и нейтральные жиры»:
— Следущая статья | — Вернуться в раздел
www.drau.ru
