Химические свойства спиртов и карбоновых кислот!!!
Спирты́ (устар. алкого́ли) — органические соединения, содержащие одну или несколько гидроксильных групп (гидроксил, -OH), непосредственно связанных с атомом углерода в углеводородном радикале. Общая формула простых предельных (ациклических) спиртов Cnh3n+1OH.Химические свойства
1) Кислотные свойства: Спирты — слабые кислоты, могут образовывать соли и комплексы с активными металлами. Например:
СН3-ОН + Na —> СН3—О — Na + Н2
Соли одноатомных спиртов называются алкоголятами. Отдельные представители называются: Ch4ONa — метилат натрия; C2H5ONa — этилат натрия. Алкоголяты представляют собой твердые вещества, растворимые в спирте. Они легко гидролизуются водой с образованием соответствующего спирта и щелочи:
СН3-ОNa + h3O—> СН3—ОH + NaOH
2) Взаимодействие с галогеноводородами:
R-OH + HHal -> RHal + h3O
HF не вступает в эту реакцию так как его кислотность недостаточна. Для проведения этой реакции ипользуют реактив Лукаса (Лукаша) : безводный хлорид цинка, растворенный в концентрированной соляной кислоте. Реакция протекает быстрее всего с третичными спиртами, медленнее всего — с первичными. Данная реакция отображает способность спирта образовывать карбокатион.
3) Межмолекулярная дегидратация (образование простых эфиров) :
R-OH + R’-OH -> R-O-R’ + h3O
Катализатором данной реакции служит кислота. Чаще всего используют серную кислоту. Легче всего реагируют третичные спирты.
4) Внутримолекулярная дегидратация: C2H5OH -> Ch3=Ch3 + h3O Спирты дегидратируются по правилу Зайцева. Легче всего отщепляют воду третичные спирты. Межмолекулярная и внутримолекулярная дегидратация являются конкурирующими реакциями. Но вторая протекает при более высокой температуре.
5) Реакция этерификации
Спирты реагируют с кислотами при этом образуются сложные эфиры.
1)R—ОН + HNO3 —> R—О — NO2 + Н2О
2)R’-OH + R-COOH -> R-C(O)-OR’ + h3O
Реакция является обратимой. Также при взаимодействии с неорганическими кислотами-окислителями (например с азотной) протекает побочная реакция — окисление.
6) Окисление спиртов Спирты окисляются легче, чем углеводороды. Первичные и вторичные спирты окисляются легче третичных. Первичные окисляются до альдегидов, вторичные — до кетонов. В случае первичных спиртов может протекать дальнейшее окисление образующихся альдегидов до соответствующих карбоновых кислот.
R-OH -> R-CHO -> R-COOH
Карбо́новые кисло́ты — класс органических соединений, молекулы которого содержат одну или несколько функциональных карбоксильных групп -COOH.
Наиболее важные химические свойства, характерные для большинства карбоновых кислот:
1) Карбоновые кислоты при реакции с металлами или их осно́вными гидроксидами дают соли соответствующих металлов:
2 Ch4COOH + Mg = (Ch4COO)2Mg + h3
Ch4COOH + NaOH = Ch4COONa + h3O
Также карбоновые кислоты могут вытеснять более слабую кислоту из её соли, например:
Ch4COOH + NaHCO3 = Ch4COONa + h3CO3 (потом h3CO3 разлагается на углекислый газ и воду)
2) Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации) :
Ch4COOH + СН3СН2ОН = Ch4COOСН2СН3 + h3O
3) При нагревании аммонийных солей карбоновых кислот образуются их амиды:
Ch4COONh5 = Ch4CONh3 + h3O
4) Под действием SOCl2 карбоновые кислоты превращаются в соответствующие хлорангидриды.
Ch4COOH + SOCl2 = Ch4COCl + HCl + SO2
otvet.mail.ru
Восстановление сложных эфиров и карбоновых кислот до первичных спиртов
Карбоновые кислоты могут восстанавливаться сразу к спиртам. Наиболее широко используемый метод — восстановление алюмогидридом лития $LiAlH_4$
Рисунок 1.
Механизм и закономерности протекания реакций
Механизм реакции представлены ниже. Первая стадия реакции — это образование комплексной соли.
Рисунок 2.
Именно восстановление начинается с нуклеофильной атаки карбоксильного углерода гидрид-ионом, что приводит к образованию 1,1-диола, который сразу же отщепляет воду с образованием альдегида, который легко поддается новой атаке.
Рисунок 3.
Для проведения реакции используют растворитель, который не взаимодействует с реагентом. Таким растворителем выступает эфир и ТГФ. Общая методика для восстановления алюмогидридом лития имеет следующий вид:
- к эфирной суспензии восстановителя (небольшой избыток) добавляют по каплям при перемешивании эфирный раствор кислоты, смесь подогревают;
- затем смесь охлаждают, добавляют раствор кислоты или щелочи для растворения осадка и гидролиза продуктов; отделяют эфирный слой, водяной фракцию промывают эфиром несколько раз, который затем сливают в один сосуд и упаривают в роторе досуха; остаток перекристализовуют.
Выход спирта зависит от характера радикала — чем он объемнее, тем труднее подойти гидрид-иону к карбонильному углероду, и поэтому несколько падает выход спирта.
Рисунок 4.
Алюмогидридом лития до спиртов можно восстанавливать не только кислоты и сложные эфиры, но и хлорангидриды кислот.
Так как карбонильная группа лучше восстанавливается, чем карбоксильная, в случае кетокислот нужно предварительно проводить защиту карбонильной группы:
Рисунок 5.
Реакция восстановления карбоксильной группы алюмогидридом лития, в отличие от других методов получения спиртов, протекает достаточно энергично.
Более мягкий восстановитель — боргидрид натрия — применяется для восстановления эфиров и фенолов. Высокий выход по этой реакции фиксируются при наличии электроноакцепторных заместителей в бензольном кольце.
Для восстановления карбоновых кислот можно использовать диборан. Реакцию проводят в кислой среде в тетрагидрофуране:
Рисунок 6.
Для восстановления эфиров применяются также $LiBEt_3H$, $BH_3-SMe_2$ в кипящем ТГФ.
Реакция Буво — Блана
До открытия указанных выше методов применялась реакция Буво — Блана — восстановление металлическим натрием в абсолютном спирте. Карбоновая кислота при таких условиях сразу превращается в эфир.
Рисунок 7.
Механизм реакции можно себе представить так: поставщиком электронов является металлический натрий, а донором протонов — спирт.
Рисунок 8.
Реакция, по сравнению с использованием алюмогидрида, менее энергична, но более селективна, хотя сейчас почти не применяется и имеет скорее историческое значение.
Реакции восстановления сложных эфиров и карбоновых кислот
Первичный спирт можно получить восстановлением сложного эфира или карбоновой кислоты, например $LiAlH_4$ и $NaBH_4$ алюмогидридом лития в эфире и ТГФ.
Следует отметить, что $NaBH_4$ не восстанавливает сложноэфирные и карбоксильные группы. Это позволяет проводить реакции селективного восстановления карбонильных групп с помощью боргидрида натрия в присутствии этих групп. Выход продуктов редко бывает ниже 80%. Сложный эфир можно восстановить и с помощью боргидрида лития:
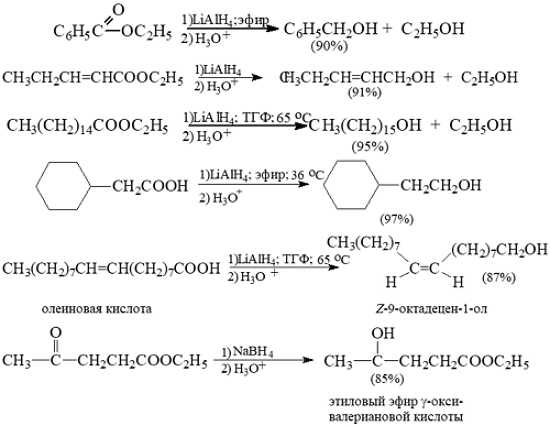
Рисунок 9.
Восстановление карбонильных групп гидридом относится является реакцией нуклеофильного присоединения, характерной для соединений с карбонильными группами. Роль нуклеофильных агентов в этом случае выполняют гидрид-ионы, при этом атомы углерода карбонильных групп изменяют гибридизацию с $sp^2$ до $sp^3$:
Рисунок 10.
Расщепление под действием кислот (ацидолиз)
Реакцию расщепления органических соединений под действием кислот называют ацидолизом. Концентрированные кислоты ($HI$, $HBr$, $H_2SO_4$) уже при комнатной температуре расщепляют эфиры, одним из возможных продуктов реакций ацидолиза являются спирты.
В реакции с йодидной кислотой при эквимолярном соотношении реагентов образуются галогенуглеводороды и спирты, в избытке кислоты — только галогенуглеводороды.
Рисунок 11.
В несимметричных эфирах нуклеофильной атаке преимущественно подвергается наиболее стерически достижимый радикал.
Реакция протекает по механизму $S_N2$:
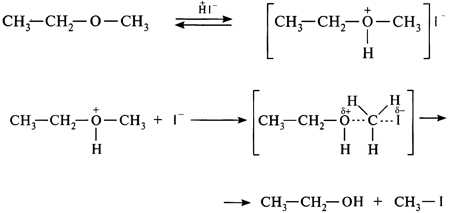
Рисунок 12.
При взаимодействии эквимолярных количеств галогенидных кислот и диалкилових эфиров, в составе которых один радикал первичный, а другой — третичный, алильного или бензильную, образуется первичный спирт.
Рисунок 13.
Реакция проходит по механизму $S_N1$:
Рисунок 14.
При взаимодействии эквимолярных количеств галогенидных кислот и алкилариловых эфиров образуются фенол и алкилгалогениды.
Рисунок 15.
Эта реакция взята за основу метода Цейзеля, который применяется для количественного определения метокси- и этокси- групп.
Диариловые эфиры не поддаются расщеплению под действием галогенидных кислот. Расщепление эфиров под действием концентрированной серной кислоты приводит к образованию эфиров серной кислоты:
Рисунок 16.
spravochnick.ru
Химические свойства спиртов и карбоновых кислот!!!
Спирты#769; (устар. алкого#769;ли) органические соединения, содержащие одну или несколько гидроксильных групп (гидроксил, -OH), непосредственно связанных с атомом углерода в углеводородном радикале. Общая формула простых предельных (ациклических) спиртов Cnh3n+1OH.Химические свойства
1) Кислотные свойства: Спирты слабые кислоты, могут образовывать соли и комплексы с активными металлами. Например:
СН3-ОН + Na gt; СН3О Na + Н2
Соли одноатомных спиртов называются алкоголятами. Отдельные представители называются: Ch4ONa — метилат натрия; C2H5ONa — этилат натрия. Алкоголяты представляют собой твердые вещества, растворимые в спирте. Они легко гидролизуются водой с образованием соответствующего спирта и щелочи:
СН3-ОNa + h3Ogt; СН3ОH + NaOH
2) Взаимодействие с галогеноводородами:
R-OH + HHal -gt; RHal + h3O
HF не вступает в эту реакцию так как его кислотность недостаточна. Для проведения этой реакции ипользуют реактив Лукаса (Лукаша) : безводный хлорид цинка, растворенный в концентрированной соляной кислоте. Реакция протекает быстрее всего с третичными спиртами, медленнее всего — с первичными. Данная реакция отображает способность спирта образовывать карбокатион.
3) Межмолекулярная дегидратация (образование простых эфиров) :
R-OH + R-OH -gt; R-O-R + h3O
Катализатором данной реакции служит кислота. Чаще всего используют серную кислоту. Легче всего реагируют третичные спирты.
4) Внутримолекулярная дегидратация: C2H5OH -gt; Ch3=Ch3 + h3O Спирты дегидратируются по правилу Зайцева. Легче всего отщепляют воду третичные спирты. Межмолекулярная и внутримолекулярная дегидратация являются конкурирующими реакциями. Но вторая протекает при более высокой температуре.
5) Реакция этерификации
Спирты реагируют с кислотами при этом образуются сложные эфиры.
1)RОН + HNO3 gt; RО NO2 + Н2О
2)R-OH + R-COOH -gt; R-C(O)-OR + h3O
Реакция является обратимой. Также при взаимодействии с неорганическими кислотами-окислителями (например с азотной) протекает побочная реакция — окисление.
6) Окисление спиртов Спирты окисляются легче, чем углеводороды. Первичные и вторичные спирты окисляются легче третичных. Первичные окисляются до альдегидов, вторичные до кетонов. В случае первичных спиртов может протекать дальнейшее окисление образующихся альдегидов до соответствующих карбоновых кислот.
R-OH -gt; R-CHO -gt; R-COOH
Карбо#769;новые кисло#769;ты класс органических соединений, молекулы которого содержат одну или несколько функциональных карбоксильных групп -COOH.
Наиболее важные химические свойства, характерные для большинства карбоновых кислот:
1) Карбоновые кислоты при реакции с металлами или их осно#769;вными гидроксидами дают соли соответствующих металлов:
2 Ch4COOH + Mg = (Ch4COO)2Mg + h3
Ch4COOH + NaOH = Ch4COONa + h3O
Также карбоновые кислоты могут вытеснять более слабую кислоту из е соли, например:
Ch4COOH + NaHCO3 = Ch4COONa + h3CO3 (потом h3CO3 разлагается на углекислый газ и воду)
2) Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации) :
Ch4COOH + СН3СН2ОН = Ch4COOСН2СН3 + h3O
3) При нагревании аммонийных солей карбоновых кислот образуются их амиды:
Ch4COONh5 = Ch4CONh3 + h3O
4) Под действием SOCl2 карбоновые кислоты превращаются в соответствующие хлорангидриды.
Ch4COOH + SOCl2 = Ch4COCl + HCl + SO2
info-4all.ru
спирты (метанол, этанол, глицерин), карбоновые кислоты (уксусная и стеариновая) – HIMI4KA

Спиртами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильные группы (–OH).
По числу гидроксильных групп спирты делят на одноатомные, двухатомные, трёхатомные и многоатомные.
Предельными одноатомными спиртами называют класс химических веществ, отвечающий общей формуле CnH2n+1OH и содержащий в своей молекуле функциональную гидроксильную группу –OH, связанную с углеводородным радикалом.
Родоначальником гомологического ряда предельных одноатомных спиртов является метиловый спирт, или метанол. Его структурная формула CH3OH.
Метиловый спирт представляет собой бесцветную жидкость с характерным запахом, которая смешивается с водой во всех отношениях. Его температура кипения равна +64,7 °С, температура плавления –93,9 °С. В промышленности его получают из смеси оксида углерода (II) и водорода в присутствии катализатора — окиси цинка и хрома при высокой температуре:
Метиловый спирт реагирует с щелочными металлами с образованием соответствующих метилатов, вступает в обратимые реакции с галогенводородными кислотами, а также в окислительно-восстановительные реакции:
При межмолекулярной дегидратации метилового спирта (катализатор — концентрированная серная кислота) происходит образование простого эфира:
Метиловый спирт применяют в производстве формальдегида, полимерных материалов, в качестве растворителя в различных процессах.
Метиловый спирт очень ядовит. Известны многочисленные случаи тяжёлых отравлений этим соединением, часто со смертельным исходом.
Ближайший гомолог метилового спирта — этиловый спирт, или этанол. Его структурная формула CH3–CH2–OH. Он представляет собой бесцветную жидкость с характерным запахом. Смешивается с водой во всех отношениях. Его температура кипения равна +78,3 °С, температура плавления –114,2 °С.
Разработано несколько промышленных методов получения этанола. Наиболее важными являются спиртовое брожение сахаристых веществ, например глюкозы в присутствии дрожжей, а также каталитическая гидратация этилена:
Этиловый спирт реагирует с щелочными металлами с образованием соответствующих этилатов, вступает в обратимые реакции с галогенводородными кислотами, а также в окислительно-восстановительные реакции:
При межмолекулярной дегидратации этилового спирта (катализатор — концентрированная серная кислота) происходит образование простого эфира:
Если в реакцию этерификации взять смесь метилового и этилового спиртов одним из продуктов реакции может быть эфир несимметричного строения:
Этиловый спирт широко применяется в химической промышленности для производства красителей, ядохимикатов, пороха, пластмасс, уксусной кислоты и т. д. Этиловый спирт применяют в медицине и парфюмерии.
Трехатомные спирты. Эти спирты содержат три гидроксильные группы при разных углеродных атомах. Общая формула трёхатомных спиртов CnH2n-1(OH)3. Простейшим представителем трехатомных спиртов является глицерин. Его структурная формула HOCH2–CH(OH)–CH2OH. Он представляет собой бесцветную сиропообразную жидкость, сладкую на вкус. Смешивается с водой и этиловым спиртом во всех отношениях. Его температура кипения равна +290 °С, температура плавления +17 °С.
Получают глицерин омылением жиров, а также из непищевого сырья.
Глицерин способен образовывать жиры при реакции с карбоновыми кислотами, а его реакция со смесью азотной и серной кислот приводит к образованию тринитрогилцерина NO2–OCH2–CH(O–NO2)–CH2O–NO2— мощного взрывчатого вещества.

При взаимодействии глицерина со свежеосаждённым гидроксидом меди образуется глицерат меди, имеющий характерный ярко-синий цвет. Эта реакция является качественной для определения глицерина.
Глицерин применяют для изготовления полиэфирных полимеров, взрывчатых веществ, в парфюмерии, текстильной и пищевой промышленности.
Уксусная кислота H3CC(O)OH представляет собой бесцветную жидкость с резким запахом. Безводная уксусная кислота, имеющая температура плавления 16,6 °С называется ледяной.
Уксусная кислота широко распространена в природе. Она образуется при уксуснокислом брожении жидкостей, содержащих спирт, содержится в растениях и т. д.
В промышленности уксусную кислоту получают из уксусного альдегида или жидкофазным окислением углеводородов в присутствии солей марганца в качестве катализатора, например:
Уксусная кислота является слабой кислотой. Её производные называют ацетаты.
Она вступает в реакцию с основаниями и амфотерными гидроксидами (реакция нейтрализации), основными и амфотерными оксидами. Во всех случаях образуются соль и вода:
Уксусная кислота может реагировать с активными металлами с образованием солей и выделением водорода:
При хлорировании уксусной кислоты в присутствии красного фосфора образуется хлоруксусная кислота:
Уксусную кислоту используют в качестве полупродукта при производстве ацетонового шелка, красителей и др. Уксусную кислоту также широко применяют в пищевой промышленности. Водные растворы уксусной кислоты с концентрацией 70—80% называются уксусной эссенцией, а с концентрацией 3—5% — столовым уксусом.
Стеариновая кислота СН3(СН2)16СООН представляет собой бесцветные кристаллы с температурой плавления 69,6 °С. В воде стеариновая кислота очень мало растворима. Эта кислота входит в состав животных и растительных жиров, которые и служат источником её получения. Используют стеариновую кислоту в фармацевтической и косметической промышленности. Её натриевая соль — стеарат натрия СН3(СН2)16СООН образуется в результате взаимодействия стеариновой кислоты с гидроксидом или карбонатом натрия.
Стеарат натрия является основной составной частью обычного твёрдого мыла, а стеарат калия — жидкого мыла.
Тренировочные задания
1. Для метанола верны следующие утверждения:
1) это жидкость с характерным запахом, хорошо растворимая в воде
2) содержит в своём составе карбоксильную группу
3) содержит в своём составе гидроксильную группу
4) не горит на воздухе
5) реагирует с бромной водой
2. Для метанола верны следующие утверждения:
1) это газ при нормальных условиях
2) атомы углерода в нём находятся в состоянии sp-гибридизации
3) реагирует с металлическим натрием
4) реагирует с гидроксидом натрия
5) горит на воздухе
3. Для этанола верны следующие утверждения:
1) это жидкость с характерным запахом, не растворимая в воде
2) это низкокипящий газ, хорошо растворимый в воде
3) реагирует с гидроксидом натрия
4) реагирует с хлороводородом
5) реагирует с калием
4. Для этанола верны следующие утверждения:
1) его используют в медицине и пищевой промышленности
2) реагирует с концентрированными щелочами
3) не вступает в окислительно-восстановительные реакции
4) при дегидратации даёт ацетилен
5) при дегидратации даёт этилен
5. Для глицерина верны следующие утверждения:
1) все атомы в его молекуле находятся в состоянии sp-гибридном состоянии
2) реагирует с водой
3) даёт ярко-синее окрашивание со свежеосаждённым раствором гидроксида меди (II)
4) реагирует с угольной кислотой
5) реагирует с азотной кислотой
6. Для глицерина верны следующие утверждения:
1) это предельный двухатомный спирт
2) это предельный трехатомный спирт
3) реагирует с бромной водой
4) реагирует с железом
5) реагирует с натрием
7. Для уксусной кислоты верны следующие суждения:
1) это жидкость с характерным резким запахом, нерастворимая в воде
2) это жидкость с характерным резким запахом, хорошо растворимая в воде
3) все атомы углерода находятся в состоянии sp2-гибридизации
4) атом углерода карбоксильной группы находится в состоянии sp2-гибридизации
5) сгорает на воздухе с образованием углекислого газа и водорода
8. Для уксусной кислоты верны следующие суждения:
1) сильнее соляной кислоты, но слабее угольной кислоты
2) сильнее угольной кислоты, но слабее соляной кислоты
3) не реагирует с основаниями
4) окисляет серу
5) реагирует со щелочами
9. Для стеариновой кислоты верны следующие суждения:
1) это непредельная одноосновная кислота
2) содержит в своём составе карбоксильную группу и углеводородный радикал C17H35
3) сильнее уксусной кислоты
4) сильнее соляной кислоты
5) в виде сложных эфиров входит в состав растительных и животных жиров
10. Для стеариновой кислоты верны следующие суждения:
1) это твёрдое вещество белого цвета, не растворимое в воде
2) реагирует с сульфатом натрия
3) реагирует с гидроксидом натрия
4) относится к сильным кислотам
5) содержит в своём составе углеводородный радикал формулы C15H31
Ответы
himi4ka.ru
18.2. Получение карбоновых кислот
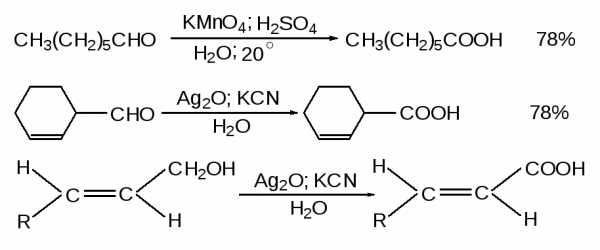
В этом разделе, как нередко делалось раннее, будет приведена только краткая сводка основных методов получения карбоновых кислот.1) Окисление первичных спиртов (глава 11).
Первичные спирты окисляются до карбоновых кислот реагентом Джонса или перманганатом калия в кислой или нейтральной среде.
2) Окисление альдегидов (глава 16).
Для окисления альдегидов используются эти же реагенты, а также оксид серебра. Аллиловые спирты избирательно окисляются до ,-ненасыщенных кислот смесью оксида серебра и цианида калия без изменения конфигурации двойной связи.
3) Диспропорционирование альдегидов по Канниццаро
Эта реакция, в принципе, применима для получения ароматических кислот.
4) Окисление кетонов до сложных эфиров (реакция Байера-Виллигера; глава 16)
Эта реакция находит очень ограниченную область применения для окисления симметричных кетонов или метилкетонов под действием перкислот.
5) Галоформная реакция для метилкетонов (глава 17)
6) Окислительное расщепление алкенов (глава 5)
Алкены, имеющие при двойной связи один атом углерода, при окислительной деструкции дают карбоновые кислоты. Раньше для этой цели использовали перманганат калия или бихромат калия в кислой среде, однако выходы карбоновых кислот при этом были невысокие. Современный метод окислительной деструкции алкенов основан на использовании смеси перманганата калия и периодата натрия в водном ацетоне в нейтральной среде.
Каждый из этих реагентов выполняет свою функцию: перманганат окисляет алкен до вицинального диола, а периодат окисляет диол до карбоновых кислот. Для реакции требуется лишь каталитические количества перманганата, так как избыток периодата вновь окисляет Mn+4 до Mn+7. Метод отличается очень высокой селективностью.
Другой разновидностью окислительной деструкции алкенов является окисление перманганатом калия в условиях межфазного катализа солями тетраалкиламмония.
7) Окисление алкилбензолов и других алкиларенов (глава 12)
Это наиболее распространенный метод синтеза ароматических карбоновых кислот. Первичные и вторичные алкильные группы, присоединенные к бензольному кольцу, окисляются до карбоксильной группы. В качестве окислителя применяются водный щелочной или нейтральный растворы перманганата калия, бихромата натрия в кислой среде или водная азотная кислота. Выходы карбоновых кислот колеблются в весьма широких пределах.
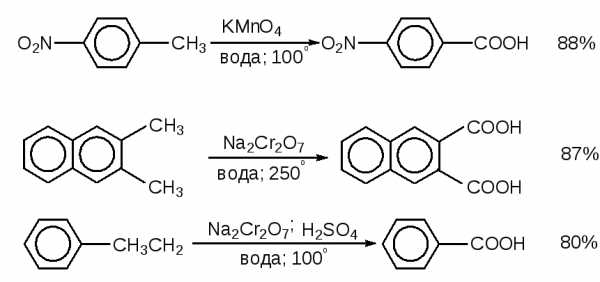
Перманганат калия можно перевести в раствор даже в неполярной среде с помощью комплексообразования катиона калия с 18-краун-6 полиэфиром.Таким образом в бензоле можно получить стабильный раствор перманганата калия с концентрацией 0.06 М, который называется “пурпурным бензолом”. Этот раствор гладко окисляет алкилбензолы до карбоновых кислот.
8) Карбонилирование алкенов
Этот процесс используют для промышленного получения карбоновых кислот. Алкены в присутствии тетракарбонила никеля присоединяют окись углерода и воду в жестких условиях (Реппе).
Вместо тетракарбонила никеля в качестве катализатора карбонилирования можно использовать комплекс хлористого палладия с трифенилфосфином. Изучение механизма этих реакций является предметом обстоятельных исследований в последние годы и содержит еще много неясных моментов.
studfiles.net
Тема 1. Спирты. Карбоновые кислоты — КиберПедия
1. Из пропилового спирта и масляной кислоты получите простой эфир, сложный эфир и пропионовую кислоту. Назовите все продукты реакции.
2. Напишите известные вам уравнения реакций получения бутилового спирта, уксусного альдегида, масляной и молочной кислот.
3. Напишите формулы: одноатомного спирта, альдегида, одноосновной кислоты, каждая из которых содержит по три атома углерода в молекуле, и назовите эти соединения.
4. Напишите структурные формулы: кетона, простого эфира, альдегида, где в каждом из радикалов содержится по одному атому углерода. Назовите эти соединения.
5. 5. С помощью, каких качественных реакций можно обнаружить в органических соединениях следующие функциональные группы: гидроксильную, альдегидную, кетонную, карбоксильную? Ответ подтвердите уравнениями реакций.
6. Сколько граммов бутилата натрия образуется при взаимодействии 370г бутанола с натрием.
7. Для каких кислот характерны реакции присоединения: а)акриловой; б)стеариновой; в) сорбиновой; г) линолевой. Ответ подтвердите уравнениями реакций.
8. Вычислите молекулярную массу вещества, образующегося присоединением 11,2л водорода к 15г формальдегида. К какому классу соединений оно относится и какими свойствами обладает?
9. Что получается при непосредственном гидролизе 1,1 дихлорэтана? Ответ подтвердите уравнениями реакции.
10. Определите массу полученного этинолята в реакции этанола массой 20,24г и металлического натрия массой 8,28г
11. Рассчитайте химическое количество бромводорода, который необходимо взять для реакции с этанолом массой 44,16г
12. Определите массовую долю этанола в растворе, полученном при смешении этанола массой 36,8г и раствора этанола в воде массой 200г с массовой долей спирта 4,6% (плотность 1,0 г/см 3).
13. Определите объем (н.у.) кислорода, затраченного на сжигание этанола массой 64,413г, содержащего 0,02% негорючих примесей.
14. Составьте уравнения реакций, характерных для уксусной кислоты.
15. Как опытным путем отличить раствор пропановой кислоты от раствора пропантриола-1,-2,-3? Ответ подтвердите уравнениями реакций.
16. Определите массу соли, полученной в реакции раствора уксусной кислоты и раствора гидроксида калия объемом 145,2 см3 (плотность 1,109 г/см3) с массовой долей щелочи 12%.
17. Составьте структурную формулу насыщенной карбоновой кислоты. Если известно, что в реакции кислоты массой 11,84г с магнием выделился водород объемом (н.у.) 1,792дм3.
18. Рассчитайте массовую долю соли (%), полученной при добавлении к раствору уксусной кислоты массой 50г с массовой долей кислоты 6% раствора гидроксида натрия массой 40г. Щелочи в растворе было достаточно для полной нейтрализации кислоты.
19. С помощью какой реакции можно доказать, что олеиновая кислота относится к ненасыщенным кислотам?
20. Охарактеризуйте химические свойства сложных эфиров.
21. Составьте уравнения реакций кислотного гидролиза эфиров: пропилэтаноата и метилметаноата.
22. Составьте уравнения реакций щелочного гидролиза следующих эфиров: метилпропаноата и изопропилбутаноата.
23. В процессе щелочного гидролиза раствором гидроксида калия метилового эфира уксусной кислоты получили соль массой 66,64г. Определите массу эфира, подвергшегося гидролизу.
24. В реакции этерификации получили сложный эфир. Для реакции была взята пропановая кислота массой 59,2г и этиловый спирт массой 32,2г. Определите массу полученного эфира.
25. Какие вещества и какой массы следует взять для получения метилацетата массой 159,1г, зная, что практический выход реакции равен 84%?
26. Для получения этилацетата был взят раствор этанола массой 40г с массовой долей спирта 95% и раствор уксусной кислоты массой 309,75г с массовой долей кислоты 16%. Определите массу полученного эфира, зная, что выход продукта реакции равен 90%.
27. Укажите возможные способы получения сложных эфиров.
28. Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения:
СН3СНО → СН3СООН → СН3СООС2Н5 → С2Н5ОН → СН3СНО
Назовите продукты реакций.
29. Метиловый эфир муравьиной кислоты массой 333,6г получили согласно схеме:
СН4 → СН3СО → СН3ОН → НСООСН3
Метан какого объема (дм3, н.у.) был при этом израсходован?
Тема 2. Углеводы
30. В какой среде быстрее протекает гидролиз углеводов: а) в щелочной; б) в кислотной; в) нейтральной? Ответ обоснуйте.
31. Сколько глюкозы можно получить из 81т крахмала, если выход глюкозы составляет 75% от теоретически возможного?
32. Сколько литров оксида углерода (IV) выделится при брожении 360г глюкозы?
33. В чем различие в строении крахмала, клетчатки, Напишите реакции их гидролиза.
34. Какие соединения относятся к пектиновым веществам? В чем заключается изменение протопектина при созревании фруктов и в процессе тепловой обработке продуктов?
35. Какие углевода подвергаются изменениям при тепловой обработке продуктов?
36. Напишите уравнения реакции инверсии сахарозы. Укажите значение этой реакции и ее механизм.
37. Приведите примеры восстанавливающих и невосстанавливащих дисахаридов. Укажите физические и химические их свойства.
38. Приведите реакции основных видов брожения и укажите использование продуктов брожения в промышленности.
39. Какие соединения называются глюкозидами? Перечислите известные вам природные глюкозиды. Напишите их формулы.
Тема 3. Белки
40. Белки каких пищевых продуктов являются полноценными? Приведите формулы незаменимых аминокислот.
41. Укажите аминокислоту, способную давать биполярный ион:
а) НООС – СНNH2 – COOH
б) NH2 – CH2 – CH – NH2 – COOH
в) CH3 – CHNH3 – COOH
г) NH2 – (CH2)2 – CHNH2 – COOH
Ответ обоснуйте
42. Назовите цветные реакции белков. Дайте их характеристику.
43. Укажите значение аминокислот и их основные химические свойства.
44. Как изменяются фибриллярные и глобулярные белки мяса при нагревании?
45. К какому классу белков относится фиброин? Его свойства и распространение в природе.
46. Какая из нижеприведенных аминокислот имеет нейтральную реакцию среды: лейцин, лизин, глютаминовая кислота? Напишите структурные формулы этих кислот. Ответ обоснуйте.
47. Приведите классификацию белков по составу и строению. Перечислите белки, образующие основу продуктов питания.
48. В чем принцип строения белков? Их биологическое значение и использование в промышленности.
49. Получите трипептид, состоящий из остатков трех незаменимых аминокислот, и трипептид аминомасляной кислоты. Сравните полученные пептиды по числу пептидных связей и концевым группам.
cyberpedia.su
Лекция № 12. Карбоновые кислоты и их производные
План
1. Классификация карбоновых кислот.
2. Номенклатура, получение.
3. Изомерия, строение.
4. Монокарбоновые кислоты (предельные, непредельные, ароматические).
5. Дикарбоновые кислоты.
6. Производные карбоновых кислот.
Производные углеводородов, содержащие карбоксильную группу -СООН,называются карбоновыми кислотами.
Карбоновые кислоты классифицируют по двум структурным признакам:
а) по природе радикала, различают — алифатические R(CООН)n (предельные, непредельные) и ароматические кислоты Аr(СООН)n;
б) по числу карбоксильных групп, различают — монокарбоновые ( n =1), ди- и поликарбоновые (n ≥ 2) кислоты.
Номенклатура. По номенклатуре ИЮПАК названия кислот образуют от названия углеводорода, добавляя окончание —овая кислота, например, СН3СООН — этановая кислота. Широко распространены тривиальные названия кислот: уксусная, масляная, олеиновая, винная, щавелевая и т.д.
Получение.
а) Окисление алкенов, алкинов, первичных спиртов и альдегидов (см. «Химические свойства» соответствующих классов соединений):
R-СН= СН-СН3 + [О] → R-СООН + СН3-СООН
алкен
R-СН2 -ОН + [О] → R-СН=О + [О] → R-СООН
спирт альдегид кислота
Окислители — КМnО4, К2Сr2О7 в кислой среде.
б) Окисление алканов: R-CH2-CH2-R’ + [O] → R-COOH + R’-COOH + H2O Окисление осуществляют в присутствии катализаторов — солей кобальта или марганца.
в) Окисление алкилбензолов (см. «Химические свойства ароматических углеводородов»). г) Гидролиз нитрилов, производных карбоновых кислот в кислой или щелочной среде: R-C≡N + 2H2O + HСl → R-COOH + NH4Сl
R-C≡N + H2O + NaOH → R-COONa + NH3
X: -OR, -Наl, -OCOR, -NH2.
д) Металлорганический синтез:
Строение. Атомы углерода и кислорода карбоксильной группы находятся в состоянии sр2-гибридизации. σ-связь С-О образована перекрыванием sр2-sр2-гибридизованных орбиталей, σ-связь О-Н — перекрыванием sр2 — s- орбиталей, π- связь С-О — перекрыванием негибридизованных р-р-орбиталей. Карбоксильная группа представляет собой плоскую р,π- сопряженную систему:
В результате сопряжения связь С-О становится короче по сравнению с аналогичной связью в спиртах, связь С=О — длиннее по сравнению с аналогичной связью в карбонильных соединениях, т.е. происходит заметное выравнивание длин связей в карбоксильной группе.
Межмолекулярное взаимодействие карбоновых кислот характеризуется сильными водородными связями, в результате чего образуются линейные ассоциаты и циклические димеры:
и
Водородная связь в карбоновых кислотах более прочная, чем в спиртах. Это обусловливает более высокие растворимость в воде, температуры кипения и плавления карбоновых кислот по сравнению со спиртами близкой молекулярной массы.
Взаимное влияние карбонильной и гидроксильной групп в составе карбоксильной группы обусловливает химические свойства, отличные от свойств карбонильных соединений и спиртов. Реакции с участием карбоксильной группы протекают по следующим основным направлениям: кислотно-основное взаимодействие, нуклеофильное замещение, декарбоксилирование.
Химические свойства карбоновых кислот рассмотрены далее на примере предельных монокарбоновых кислот.
Монокарбоновые кислоты (предельные, непредельные, ароматические кислоты).
Общая молекулярная формула предельных монокарбоновых кислот
Сn Н2nО2.
Таблица 4.
Гомологический ряд предельных монокарбоновых кислот
|
Кислота |
Формула |
Тпл., С |
Ткип., С |
Ацильный остаток — кислотный остаток |
|
Муравьиная (метановая) |
H-COOH |
+8,25 |
100,5 |
формил — формиаты |
|
Уксусная (этановая) |
CH3COOH |
+16,60 |
118,5 |
ацетил — ацетаты |
|
пропионовая (пропановая) |
CH3-CH2-COOH |
-20,70 |
141,1 |
пропионил — пропионаты |
|
масляная (бутановая) |
CH3-(CH2)2-COOH |
-3,10 |
163,0 |
бутирил — бутираты |
|
валериановая |
CH3-(CH2)3-COOH |
-34,50 |
186,0 |
валерил — валераты |
|
капроновая |
CH3-(CH2)4-COOH |
-1,50 |
205,3 |
капроноил |
|
лауриновая |
CH3-(CH2)10-COOH |
+44,30 |
225 |
лаурил |
|
пальмитиновая |
CH3-(CH2)14-COOH |
+62,60 |
271 |
пальмитил-пальмитаты |
|
стеариновая |
CH3-(CH2)16-COOH |
+69,40 |
287 |
стеарил — стеараты |
В таблице приведены названия ацильных (R-СО-) и кислотных (R-СОО-) остатков некоторых монокарбоновых кислот предельного ряда.
Изомерия. Для предельных монокарбоновых кислот характерна структурная изомерия (различное строение углеродной цепи и различное расположение функциональной группы ). Например, молекулярной формуле С4Н8О2 соответствуют изомеры: СН3-СН2-СН2-СООН (бутановая кислота), (СН3)2 СН-СООН (2-метилпропановая или изобутановая кислота), СН3-СН2-СООСН3 (метилпропаноат) (подробно см. раздел «Изомерия»).
Физические свойства. Кислоты с числом атомов углерода от 1 до 9 — бесцветные жидкости с неприятными запахами, с С≥ 10 — твердые вещества без запаха. Кислоты с числом атомов углерода от 1 до 3 хорошо растворяются в воде, с С≥ 4 — не растворимые в воде вещества, но хорошо растворимые в органических растворителях (спирт, эфир).
Химические свойства.
а) кислотные свойства
Водные растворы карбоновых кислот имеют кислую реакцию:
кислота карбоксилат-ион
Делокализация электронной плотности (р,π- сопряжение) в карбоксилат-ионе приводит к полному выравниванию порядков длин обеих связей С-О, увеличению его стабильности по сравнению с алкоголят- и фенолят-ионами. Поэтому карбоновые кислоты по силе превосходят спирты и фенолы, угольную кислоту, но уступают таким минеральным кислотам, как соляная, серная, азотная и фосфорная.
На силу карбоновых кислот существенное влияние оказывает природа радикала при карбоксильной группе: электронодонорные группы дестабилизируют карбоксилат-ион и, следовательно, уменьшают кислотные свойства, электроноакцепторные — стабилизируют карбоксилат-ион и увеличивают кислотные свойства.
В гомологическом ряду предельных монокарбоновых кислот с увеличением числа атомов углерода в составе кислоты кислотные свойства понижаются. Самая сильная кислота — муравьиная.
Карбоновые кислоты образуют соли при взаимодействии с активными металлами, оксидами металлов, основаниями, солями. Например, СН3-СООН + Nа2СО3 → СН3-СООNа + СО2 + Н2О
Соли низших карбоновых кислот хорошо растворимы в воде, высших — растворимы только натриевые и калиевые соли. Соли карбоновых кислот и щелочных металлов подвергаются гидролизу и их водные растворы имеют щелочную среду:
R-COO— Na+ + HOH ↔ R-COOH + NaOH
Соли карбоновых кислот используют для получения производных карбоновых кислот, углеводородов, поверхностно-активных веществ.
Огромное значение в народном хозяйстве имеют натриевые и калиевые соли высших жирных кислот — мыла. Обычное твердое мыло представляет собой смесь натриевых солей различных кислот, главным образом пальмитиновой и стеариновой: С15Н31СООNa (пальмитат натрия) и С17Н35СООNa (стеарат натрия). Калиевые мыла — жидкие.
Мыло в глубокой древности получали из жира и буковой золы. В эпоху Возраждения вернулись к забытому ремеслу, рецепты держали в секрете. Сейчас получают мыла главным образом исходя из растительных и животных жиров.
Мыла являются поверхностно-активными веществами (ПАВ), химическим гибридом, состоящим из гидрофильного (карбоксилат-ион) и гидрофобного (страх, боязнь) конца (углеводородный радикал). Мыла резко снижают поверхностное натяжение воды, вызывают смачивание частиц или поверхностей, обладающих водоотталкивающим действием, способствуют образованию устойчивой пены.
В жесткой воде моющая способность мыла резко снижается, растворимые натриевые или калиевые соли высших жирных кислот вступают в обменную реакцию с имеющимися в жесткой воде растворимыми кислыми карбонатами щелочноземельных металлов, главным образом кальция:
2C15H31COONa + Ca(HCO3)2 → (C15H31COO)2Ca + 2NaHCO3
Получающиеся при этом нерастворимые кальциевые соли высших жирных кислот образуют осадки.
Огромные количества мыла применяют в быту для гигиенических целей, для стирки и т.д., а также в различных отраслях промышленности, особенно для мытья шерсти, тканей и других текстильных материалов.
б) нуклеофильное замещение — SN (образование функциональных производных карбоновых кислот)
Основной тип реакций карбоновых кислот — нуклеофильное замещение у sр2-гибридизованного атома углерода карбоксильной группы, в результате которого гидроксильная группа замещается на другой нуклеофил. Вследствие р,π-сопряжения в карбоксильной группе подвижность гидроксильной группы по сравнению со спиртами значительно меньше, поэтому реакции нуклеофильного замещения проводят в присутствии катализатора — минеральной кислоты или щелочи.
Реакции сопровождаются образованием функциональных производных карбоновых кислот — галогенангидридов (1), ангидридов (2), сложных эфиров (3), амидов (4):
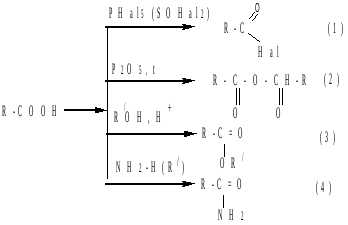
в) декарбоксилирование
Декарбоксилирование — это удаление карбоксильной группы в виде СО2. В зависимости от условий реакции образуются соединения разных классов. Электроноакцепторые группы в составе радикала при карбоксильной группе облегчают протекание реакций этого типа.
Примеры реакций декарбоксилирования:
1) термический распад натриевых или калиевых солей в присутствии натронной извести
R-COONa + NaOH → R-Н + Na2СО3
2) термический распад кальциевых или бариевых солей
R-COO-Са-ООС-R → R-СО-R + СаСО3
3) электролиз натриевых или калиевых солей (синтез Кольбе)
2R-COONa + 2НОН → R-R + 2NaОН +2CO2 + Н2
г) замещение атомов водорода у α-углеродного атома
Атом галогена в α-галогензамещенных кислотах легко замещается под действием нуклеофильных реагентов. Поэтому α-галогензамещенные кислоты являются исходными веществами в синтезе широкого круга замещенных кислот, в том числе α-амино- и α-гидроксикислот:
пропионовая к-та α-хлорпропионовая к-та
Врезультате влияния атома галогена на карбоксильную группу галогенпроизводные кислоты (например, трихлоруксусная кислота) являются во много раз более сильными кислотами и приближаются в этом отношении к сильным неорганическим кислотам.
д) специфические свойства муравьиной кислоты
В составе муравьиной кислоты наряду с карбоксильной группой можно выделить карбонильную группу, поэтому муравьиная кислота проявляет свойства как карбоновых кислот, так и альдегидов:
1. окисление
НСООН + [O]→ СО2 + Н2О
окислители: Сu(ОН)2, [Ag(NH3)2]ОН (реакция «серебряного зеркала»)
2. дегидратация
НСООН + Н2SО4(конц.) →СО + Н2О
Нахождение в природе и применение кислот:
а) муравьиная кислота — бесцветная жидкость с острым запахом, смешивается с водой. Впервые выделена в ХVII веке из красных муравьев перегонкой с водяным паром. В природе свободная муравьиная кислота встречается в выделениях муравьев, в соке крапивы, в поте животных. В промышленности муравьиную кислоту получают, пропуская оксид углерода через нагретую щелочь:
NaOH + CO → H-COONa
H-COONa + H2SO4 → H-COOH + NaHSO4
Применяют муравьиную кислоту при крашении тканей, в качестве восстановителя, в различных органических синтезах.
б) уксусная кислота
Безводная уксусная кислота (ледяная уксусная кислота) — бесцветная жидкость с характерным острым запахом и кислым вкусом, замерзает при температуре +160С, образуя кристаллическую массу, напоминающую лед. 70-80 % водный раствор кислоты называется уксусной эссенцией.
Она широко распространена в природе, содержится в выделениях животных, в растительных организмах, образуется в результате процессов брожения и гниения в кислом молоке, в сыре, при скисании вина, прогаркании масла и т.п. Используют в пищевой промышленности в качестве вкусовой приправы и консерванта, широко — в производстве искусственных волокон, растворителей, в получении лекарственных препаратов.
в) масляная кислота — бесцветная жидкость, растворы кислоты имеют неприятный запах старого сливочного масла и пота. Встречается в природе в виде сложных эфиров, эфиры глицерина и масляной кислоты входят в состав жиров и сливочного масла. Используют в органическом синтезе для получения ароматных сложных эфиров.
в) изовалериановая кислота — бесцветная жидкость с острым запахом, в разбавленных растворах имеет запах валерианы. Встречается в корнях валерианы, используют для получения лекарственных веществ и эссенций.
г) пальмитиновая, стеариновая кислоты
Это твердые вещества со слабыми запахами, плохо растворимые в воде. Широко распространены в природе, в виде сложных эфиров с глицерином входят в состав жиров. Используют для получения свечей, поверхностно-активных веществ.
Непредельные кислоты
Непредельные кислоты — карбоновые кислоты, содержащие в углеводородном радикале кратные связи (двойные или тройные). Наибольшее значение имеют непредельные моно- и дикарбоновые кислоты с двойными связями.
Номенклатура и изомерия.
Названия для непредельных кислот составляют по номенклатуре ИЮПАК, однако чаще всего применяют тривиальные названия:
СH2=CH-CОOH — 2-пропеновая или акриловая кислота
CH3-CH=CH-CОOH — 2-бутеновая или кротоновая кислота
СH2=C(СH3)-CОOH — 2-метилпропеновая или метакриловая кислота
CH2=CH-CH2-CОOH — 3-бутеновая или винилуксусная кислота
CH3-(СН2)7-CH=CH-(СН2 )7-CОOH — олеиновая кислота
СН3 -(СН2)4 -CH=CH-СН2 -CH=CH-(СН2 )7-CОOH — линолевая кислота
СН3-СН2-CH=CH-СН2-CH=CH-СН2-CH=CH-(СН2)7-CОOH- линоленовая кислота.
Структурная изомерия непредельных кислот обусловлена изомерией углеродного скелета (например,кротоновая и метакриловая кислоты) и изомерией положения двойной связи (например, кротоновая и винилуксусная кислоты).
Непредельным кислотам с двойной связью, так же как и этиленовым углеводородам, свойственна и геометрическая или цис-транс изомерия.
Химические свойства. По химическим свойствам непредельные кислоты аналогичны моно- и дикарбоновым кислотам, но имеют ряд отличительных особенностей, обусловленных наличием в молекуле кратных связей и карбоксильной группы и их взаимным влиянием.
Непредельные кислоты, особенно содержащие кратную связь в α-положении к карбоксильной группе, являются более сильными кислотами, чем предельные. Так, непредельная акриловая кислота (К=5,6*10-5) в четыре раза сильнее пропионовой кислоты (К=1,34*10-5).
Непредельные кислоты вступают во все реакции по месту кратных связей, свойственные непредельным углеводородам.
а) Электрофильной присоединение:
1. галогенирование
βCH2=αCH-COOH + Br2 → СH2 Br-CHBr-COOH
пропеновая кислота α,β-дибромпропионовая к-та
Это качественная реакция на непредельные кислоты, по количеству израсходованного галогена (брома или иода) можно определить количество кратных связей.
2. гидрогалогенирование
αCH2 δ+ = βCHδ-→COOH+ Нδ+ — Brδ- → СH2 Br-CH2-COOH
У α,β-непредельных кислот реакция присоединения протекает против правила Марковникова.
б) Гидрирование
В присутствии катализаторов (Pt, Ni) водород присоединяется по месту двойной связи и непредельные кислоты переходят в предельные:
CH2=CH-COOH + Н2 → CH3-CH2-COOH
акриловая кислота пропионовая кислота
Процесс гидрирования (гидрогенизация) имеет большое практическое значение, особенно для превращения высших непредельных жирных кислот в предельные; на этом основано превращение жидких масел в твердые жиры.
в) Окисление
В условиях реакции Вагнера (см. «Алкены») непредельные кислоты окисляются до дигидроксикислот, при энергичном окислении — до карбоновых кислот.
Нахождение в природе и применение кислот:
а) акриловая CH2=CH-COOH и метакриловая CH2=C(СH3)-COOH кислоты — бесцветные жидкости с острыми запахами. Кислоты и их сложные (метиловые) эфиры легко полимеризуются, на этом основано их использование в промышленности полимерных материалов (органического стекла).
Нитрил акриловой кислоты — акрилонитрил CH2=CH-C≡N применяют в производстве синтетического каучука и высокомолекулярной смолы полиакрилонитрила (ПАН), из которой получают синтетическое волокно нитрон (или орлон) — один из видов искусственной шерсти.
б) высшие непредельные кислоты
-цис-олеиновая кислота в виде эфира с глицерином входит в состав почти всех жиров животного и растительного происхождения, особенно высоко содержание олеиновой кислоты в оливковом («прованском») масле — до 80 % , калиевые и натриевые соли олеиновой кислоты являются мылами;
-цис, цис-линолевая и цис, цис-линоленовая кислоты в виде эфира с глицерином входят в состав многих растительных масел, например в соевое, конопляное, льняное масло. Линолевая и линоленовая кислоты называются незаменимыми кислотами, поскольку не синтезируются в организме человека. Именно эти кислоты обладают наибольшей биологической активностью: они участвуют в переносе и обмене холестерина, синтезе простагландинов и других жизненно важных веществ, поддерживают структуру клеточных мембран, необходимы для работы зрительного аппарата и нервной системы, влияют на иммунитет. Отсутствие в пище этих кислот тормозит рост животных, угнетает их репродуктивную функцию, вызывает различные заболевания.
Сложные эфиры кислот используют в производстве лаков и красок (высыхающие масла).
Ароматические монокарбоновые кислоты
Кислоты являются бесцветными кристаллическими веществами, некоторые из них имеют слабый приятный запах. Для них характерна сопряженная (π, π) система:
Важнейшие представители:
бензойная кислота
фенилуксусная кислота
транс-коричная кислота
Ароматические кислоты являются более сильными кислотами, чем предельные кислоты (кроме муравьиной кислоты). Для кислот этого типа характерны все реакции насыщенных карбоновых кислот в карбоксильной группе и реакции электрофильного замещения в бензольном кольце (карбоксильная группа — заместитель 2 рода, м-ориентант).
Нахождение в природе и применение кислот:
Ароматические кислоты используют для получения красителей, душистых и лекарственных веществ; сложные эфиры кислот содержатся в эфирных маслах, смолах и бальзамах. Бензойная кислота и ее натриевая соль содержатся в плодах калины, рябины, бруснике, клюкве, придают им горьковатый вкус, обладают бактерицидными свойствами, широко используются в консервировании пищевых продуктов.
Амид о-сульфобензойной кислоты называют сахарином , он слаще сахара в 400 раз.
Производные карбоновых кислот.
Общая формула производных карбоновых кислот:
, где Х: — Hal, -ООС-R, -OR, -NH2.
Для производных карбоновых кислот наиболее характерны реакции нуклеофильного замещения (SN). Поскольку продукты этих реакций содержат ацильную группу R-С=О, реакции называют ацилированием, а карбоновые кислоты и их производные — ацилирующими реагентами.
В общем виде процесс ацилирования может быть представлен следующей схемой:
По ацилирующей способности производные карбоновых кислот располагаются в следующий ряд:
соли < амиды < сложные эфиры <ангидриды <галогенангидриды
В этом ряду предыдущие члены могут быть получены из последующих ацилированием соответствующего нуклеофила (например, спирта, аммиака и т.д.). Все функциональные производные могут быть получены непосредственно из кислот и превращаются в них при гидролизе.
Амиды, в отличии от других производных карбоновых кислот, образуют межмолекулярные водородные связи и являются твердыми веществами (амид муравьиной кислоты HCONH2 — жидкость).
Сложные эфиры
Методы получения. Основной способ получения сложных эфиров — реакции нуклеофильного замещения:
а) реакция этерификации R-СООН + RО-Н ↔ R-СО-ОR + Н2 О
Реакцию проводят в присутствии катализатора — минеральной кислоты. Реакции этерификации обратимы. Для смешения равновесия в сторону образования сложного эфира используют избыток одного из реагентов или удаление продуктов из сферы реакции.
б) ацилирование спиртов галогенангидридами и ангидридами
в) из солей карбоновых кислот и алкилгалогенидов
R-COONa + RCl → RCOOR + NaCl Номенклатура. По номенклатуре ИЮПАК название сложных эфиров составляют следующим образом:
СН3 -СН2 -СН2 -СО-ОСН3
углеводород радикал
радикал+углеводород+оат — метилбутаноат.
Если указывают тривиальные названия ацильных остатков , то название данного эфира — метилбутират. Эфиры можно называть по радикально-функциональной номенклатуре — метиловый эфир масляной кислоты.
Физические свойства. Сложные эфиры представляют собой бесцветные жидкости, нерастворимые в воде и обладающие по сравнению с исходными кислотами и спиртами низкими температурами кипения и плавления, что обусловлено отсутствием в эфирах межмолекулярных водородных связей. Многие сложные эфиры обладают приятным запахом, часто запахом ягод или фруктов (фруктовые эссенции).
Химические свойства. Для сложных эфиров наиболее характерны реакции нуклеофильного замещения (SN), протекающие в присутствии кислотного или основного катализатора. Важнейшими SN-реакциями являются гидролиз, аммонолиз и переэтерификация.
Кислотный гидролиз сложных эфиров — реакция обратимая, щелочной гидролиз протекает необратимо.
RCOOR + Н2О(Н+) ↔ RCOOН + ROH
RCOOR + NaOH → RCOO— Na+ + ROH
Жиры
Жиры (триглицериды) — сложные эфиры, образованные глицерином и высшими предельными и непредельными кислотами.
Из жиров выделено несколько десятков разнообразных предельных и непредельных кислот; почти все они содержат неразветвленные цепи углеродных атомов, число которых, как правило, четное и колеблется от 4 до 26. Однако именно высшие кислоты, преимущественно с 16 и 18 углеродными атомами — главная составная часть всех жиров. Из предельных высших жирных кислот наиболее важны пальмитиновая С15Н31СООН и стеариновая С17Н35СООН, из непредельных — олеиновая С17Н33СООН (с одной двойной связью), линолевая С17Н31СООН (с двумя двойными связями) и линоленовая С17Н29СООН (с тремя двойными связями). Непредельные кислоты, содержащие в радикале фрагмент (-СН2-СН=СН-), называются незаменимыми.
Простые триглицериды содержат остатки одинаковых, смешанные — разных жирных кислот. Названия составляют на основе названий ацильных остатков, входящих в их состав жирных кислот:
трипальмитин диолеостеарин
Значение жиров исключительно велико. Прежде всего они — важнейшая составная часть пищи человека и животных наряду с углеводами и белковыми веществами. Наибольшей пищевой ценностью обладают растительные масла, которые наряду с незаменимыми жирными кислотами содержат необходимые для организма фосфолипиды, витамины, полезные фитостерины (предшественники витамина D). Суточная потребность взрослого человека в жирах 80-100г.
Жиры практически не растворимы в воде, но хорошо растворимы в спирте, эфире и других органических растворителях. Температура плавления жиров зависит от того, какие кислоты входят в их состав. Жиры, содержащие преимущественно остатки предельных кислот (животные жиры — говяжье, баранье или свиное сало), имеют наиболее высокие Тпл. и представляют собой твердые или мазеобразные вещества. Жиры, содержащие преимущественно остатки непредельных кислот (растительные масла — подсолнечное, оливковое, льняное и т.д.), жидкости с более низкими температурами плавления.
Химические свойства триглицеридов определяются наличием сложноэфирной связи и ненасыщенностью:
а) гидрогенизация (гидрирование) жиров
Присоединение водорода по месту двойных связей в остатках кислот ведут в присутствии катализатора — мелкораздробленного металлического никеля при 160-2400С и давлении до 3 атм. При этом жидкие жиры и масла превращаются в твердые насыщенные жиры — саломас, который широко применяют в производстве маргарина, мыла, глицерина.
б) гидролиз жиров
При щелочном гидролизе (омылении) жиров образуются соли жирных кислот (мыла) и глицерин, при кислотном — жирные кислоты и глицерин.
в) присоединение и окисление
Трилглицериды, содержащие остатки ненасыщенных жирных кислот, вступают в реакции присоединения по двойной связи (бромирование, иодирование) и окисления перманганатом калия. Обе реакции позволяют определить степень ненасыщенности жиров.
Все жиры являются горючими веществами. При их горении выделяется большое количество тепла: 1г жира при горении дает 9300кал.
Знаетели вы, что
-В 1906году русским ученым С.А. Фокиным разработан, а в 1909г. им же осуществлен в промышленном масштабе метод гидрогенизации (отверждение) жиров.
-Маргарин ( с греч. — «жемчуг») получен в 1869 году. Различные его сорта получают, смешивая саломас с молоком, а в некоторых случаях — с яичным желтком. Получается продукт, по внешнему виду напоминающий сливочное масло, приятный запах маргарина достигается введением в его состав специальных ароматизаторов – сложных композиций различных веществ, непременной составной частью которых является диацетил (бутандион) — жидкость желтого цвета, содержится в коровьем масле.
-Однако встречаются и животные жиры, содержащие значительное количество непредельных кислот и представляющие собой жидкие вещества (ворвань, тресковый жир или рыбий жир).
-Растительные жиры- масла добывают из семян и мякоти плодов различных растений. Они отличаются высоким содержанием олеиновой и других непредельных кислот и содержат лишь незначительное количество стеариновой и пальмитиновой кислот (подсолнечное, оливковое, хлопковое, льняное и др. масла). Лишь в некоторых растительных жирах преобладают предельные кислоты, и они являются твердыми веществами (кокосовое масло, масло какао и др.).
-Сложные эфиры фруктовых эссенций обладают приятным запахом фруктов, цветов, например изоамилацетат — запахом груш, амилформиат — вишен, этилформиат — рома, изоамилбутират — ананасов и т.д. Их применяют в кондитерском производстве, при изготовлении безалкогольных напитков, в парфюмерии.
-Из полиметилметакрилата готовят исключительно ценный синтетический материал — органическое стекло (плексиглас). Последнее превосходит силикатное стекло по прозрачности и по способности пропускать УФ-лучи. Его используют в машино- и приборостроении, при изготовлении различных бытовых и санитарных предметов, посуды, украшений, часовых стекол. Благодаря физиологической индифферентности полиметилметакрилат нашел применение для изготовления зубных протезов и т.п.
-Винилацетат — эфир винилового спирта и уксусной кислоты. Его получают, например, при пропускании смеси паров уксусной кислоты и ацетилена над ацетатами кадмия и цинка при 180-220оС:
СН3-СООН + СН≡СН → СН3-СО-О-СН=СН2
Винилацетат – бесцветная жидкость, легко полимеризуется, образуя синтетический полимер — поливинилацетат (ПВА), применяется для изготовления лаков, клеев, искусственной кожи.
Дикарбоновые кислоты
Дикарбоновые кислоты содержат две карбоксильные группы. Наиболее известными являются кислоты линейного строения, содержащие от 2 до 6 атомов углерода:
НООС-СООН — этандиовая (номенклатура ИЮПАК) или щавелевая кислота (тривиальная номенклатура)
НООС-СН2 -СООН — пропандиовая или малоновая кислота
НООС-СН2-СН2-СООН — бутандиовая или янтарная кислота
НООС-СН2-СН2-СН2-СООН — пентандиовая или глутаровая кислота
НООС-СН2-СН2-СН2-СООН — адипиноавя кислота
Физические свойства. Двухосновные кислоты — кристаллические вещества с высокими температурами плавления, причем у кислот с четным числом атомов углерода она выше; низшие кислоты растворимы в воде.
Химические свойства. По химическим свойствам двухосновные кислоты аналогичны монокарбоновым кислотам, но имеют ряд отличительных особенностей, обусловленных наличием в молекулах двух карбоксильных групп и их взаимным влиянием.
Дикарбоновые кислоты более сильные кислоты, чем монокарбоновые кислоты с тем же числом атомов углерода: Кион. щавелевой кислоты (Н2С2О4) — 5,9 •10-2 , 6,4•10-5, уксусной кислоты — 1,76 •10-5 . По мере увеличения расстояния между карбоксильными группами кислотные свойства дикарбоновых кислот уменьшаются. Дикарбоновые кислоты могут образовывать два ряда солей — кислые, например НООС-СООNa и средние — NaООС-СООNa.
Дикарбоновые кислоты имеют ряд специфических свойств, которые определяются наличием в молекуле двух карбоксильных групп. Например, отношение дикарбоновых кислот к нагреванию.
Превращения дикарбоновых кислот при нагревании зависят от числа атомов углерода в их составе и определяются возможностью образования термодинамически стабильных пяти- и шестичленных циклов.
При нагревании щавелевой и малоновой кислот происходит декарбоксилирование с образованием монокарбоновых кислот:
НООС-СООН→ НСООН + СО2 и далее НСООН → СО + Н2 О
НООС-СН2 -СООН → СН3-СООН + СО2
Янтарная, глутаровая кислоты при нагревании легко отщепляют воду с образованием пяти- и шестичленных циклических ангидридов:
Адипиновая кислота при нагревании декарбоксилирует с образованием циклического кетона — циклопентанона:
Дикарбоновые кислоты взаимодействуют с диаминами и диолами с образованием соответственно полиамидов и полиэфиров, которые используются в производстве синтетических волокон.
Наряду с насыщенными дикарбоновыми кислотами известны непредельные, ароматические дикарбоновые кислоты.
Нахождение в природе и применение кислот:
Щавелевая кислота широко распространена в растительном мире. В виде солей содержится в листьях щавеля, ревеня, кислицы. В организме человека образует труднорастворимые соли (оксалаты), например оксалат кальция, которые отлагаются в виде камней в почках и мочевом пузыре. Применяют как отбеливающее средство: удаление ржавчины, красок, лака, чернил; в органическом синтезе.
Малоновая кислота (сложные эфиры и соли — малоноаты) содержится в некоторых растениях, например сахарной свекле. Широко используется в органическом синтезе для получения карбоновых кислот.
Янтарная кислота (соли и сложные эфиры называются сукцинатами) участвует в обменных процессах, протекающих в организме. Является промежуточным соединением в цикле трикарбоновых кислот. В 1556 году немецким алхимиком Агриколой впервые выделена из продуктов сухой перегонки янтаря. Кислота и ее ангидрид широко используются в органическом синтезе.
Фумаровая кислота (НООС-СН=СН-СООН — транс-бутендиовая кислота), в отличие от цис-малеиновой, широко распространена в природе, содержится во многих растениях, много — в грибах, участвует в процессе обмена веществ, в частности в цикле трикарбоновых кислот.
Малеиновая кислота(цис-бутендиовая кислоты) в природе не встречается. Кислота и ее ангидрид широко используются в органическом синтезе.
Орто-фталевая кислота, широкое применение имеют производные кислоты — фталевый ангидрид, сложные эфиры — фталаты (репелленты).
Терефталевая кислота- крупнотоннажный промышленный продукт, применяют для получения целого ряда полимеров — например, волокно лавсан, полиэтилентерефталат (ПЭТФ), из которого изготавливают пластиковые посуду, бутыли и т.д.
studfiles.net
