Соединения серы: формулы, свойства и примеры
Сера
В свободном состоянии сера – твердое кристаллическое вещество желтого цвета. Для серы характерно явление аллотропии, т.е. существование в виде нескольких простых веществ – аллотропных модификаций. Аллотропные модификации серы – ромбическая (наиболее устойчивая), моноклинная и пластическая. Молекулы серы в ромбической модификации состоят из 8-ми атомов.
Сера относится к семейству p-элементов. Электронная конфигурация серы [Ne]3s23p4. Для серы характерно наличие трех степеней окисления «-2», «+4» и «+6».
Для получения серы используют реакцию Вакенродера (1) или получают ее неполным окислением сероводорода (2):
2H2S + SO2 = 3S↓ + 2H2O (1)
H2S + O2 = 2S↓ + 2H2O (2)
Из-за наличия нескольких степеней окисления сера способна проявлять и окислительные (в реакциях с металлами) и восстановительные (в реакциях с сильными окислителями) свойства:
Fe +S = FeS
Fe0 -2e = Fe2+ — процесс окисления (восстановитель)
S0 +2e = S2- — процесс восстановления (окислитель)
S + O2 = SO2
S0 – 4e = S4+ — процесс окисления (восстановитель)
O20 + 2e = 2O2- — процесс восстановления (окислитель)
Сера взаимодействует с концентрированными растворами кислот (растворяется в них) и со щелочами (диспропорционирует):
S +2H2SO4 = 3SO2 + 2H2O
3S + NaOH = K2SO3 + 2K2
S + 3H2OСероводород. Сероводородная кислота. Сульфиды
При нагревании серы с водородом происходит обратимая реакция в результате которой выделяется сероводород – бесцветный газ с запахом тухлых яиц, ядовитый и плохо растворимый в воде:
S + H2 ↔H2S ↑
Однако, выход сероводорода в этой реакции невелик и для его получения чаще всего используют реакцию действия разбавленных кислот на сульфиды (соли сероводородной кислоты):
FeS + 2HCl = FeCl2 + H2S ↑
Водный раствор сероводорода – очень слабая кислота, диссоциация которой протекает в две ступени:
H2S↔H+ + HS—
HS— ↔ H+ + S2-
В связи с этим, для сероводородной кислоты характерна способность к образованию солей двух видов – средних – сульфидов (кислотный остаток — S
Сероводородная кислота – сильный восстановитель, т.к. сера, входящая в состав этого вещества, находится в низшей степени окисления и способна повысить её до «+4» или «+6», поэтому состав продуктов реакции определяется силой и количеством окислителя:
H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl
H2S + 3H2SO4=4SO2 + 4H2O
H2S + 4Br2 = S + 3HBr
Для сульфидов, как для солей образованных слабой кислотой, характерна способность к гидролизу. Сульфиды металлов, стоящих в ряду активности левее железа, растворимы в сильных кислотах:
ZnS + H2SO4 = ZnSO4 + H2
S ↑Качественной реакцией на H2S и растворимые в воде сульфиды является:
H2S + Pb(NO3)2 = PbS↓ + 2HNO3
S2- + Pb2+ = PbS↓ (осадок черного цвета)
Оксид серы (IV). Сернистая кислота
В степени окисления «+4» сера образует оксид, которому соответствует кислота. Оксид серы (IV) представляет собой газообразное вещество (сернистый газ) без цвета, но обладающее резким запахом, хорошо растворимое в воде.
Выделяют промышленные и лабораторные способы получения оксида серы (IV). Так, в промышленности (1), его получают при обжиге сульфидов, а в лаборатории (2) – при действии сильных кислот на сульфиты:
4FeS2 + 11O2 =2Fe2O3 + 8SO2↑ (1)
Na2SO3 + 2HCl = 2NaCl + SO2
В водном растворе оксида серы (IV) возможно одновременное существование нескольких химических равновесий:
H2O + SO2 ↔ H2SO3 ↔H+ + HSO3— ↔ 2H+ + SO32-
Образующаяся в результате сернистая кислота (H2SO3) является двухосновной, поэтому способна к образованию двух типов солей – средних — сульфитов (кислотный остаток SO32) и кислых — гидросульфитов (кислотный остаток HSO2—).
Для оксида серы (IV), сернистой кислоты и её солей характерны химические свойства, которые можно разделить на 3 группы: кислотно-основные реакции (1), реакции окисления (2) и реакции восстановления (2):
Ca(OH)2 + SO2 = CaSO3↓ + H2O (1)
Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl (2)SO2 + C= S↓ + CO2↑ (3)
Качественная реакция на SO2 и сульфиты – обесцвечивание раствора перманганата калия:
5SO2 + 2KMnO4 + 2H2O = 2H2SO4 + K2SO4 + MnSO4
Оксид серы (VI). Серная кислота
Оксид серы (VI) представляет собой бесцветную жидкость, которую получают окислением оксида серы (IV) кислородом в присутствии катализатора (V2O 5):
2SO2 + O2 ↔ 2SO3
Оксид серы (VI) хорошо растворим в воде (образуется серная кислота) и в 100%-ной серной кислоте (образуется олеум):
SO3 + H2O = H2SO4
Серная кислота представляет собой тяжелую вязкую жидкость, которая хорошо смешивается с водой в любых отношениях. Водный раствор серной кислоты – сильная кислота. Поскольку H2SO4 двухосновная кислота, она способна образовывать два типа солей – средние – сульфаты (кислотный остаток SO42-) и кислые – гидросульфиты (кислотный остаток HSO4—).
При взаимодействии с металлами (как, стоящими в ряду активности до водорода, так и после него) серная кислота восстанавливается до оксида серы (IV):
Zn + H2SO4 = ZnSO4 + SO2↑ +2H2O
Cu +2H2SO4= CuSO4 + SO2↑ +2H2O
Разбавленная серная кислота окисляет только металлы, стоящими в ряду активности до водорода:
Zn + H2
SO4 = ZnSO4 + H2↑Качественной реакцией на серную кислоту и растворимые сульфаты является образование осадка сульфата бария – осадка белого цвета, нерастворимого в щелочах и кислотах:
Ba2+ + SO42- = BaSO4↓
Примеры решения задач
ru.solverbook.com
Сера и ее соединения
скачать СЕРА И ЕЕ СОЕДИНЕНИЯИсторическая справка
Сера – одно из немногих веществ, которое было известно с древнейших времен, её использовали первые химики. Одна из причин известности серы – распространенность самородной серы в странах древнейших цивилизаций. Её разрабатывали греки и римляне, производство серы значительно увеличилось после изобретения пороха.
Место серы в Периодической системе химических элементов Д.И. Менделеева
Сера расположена в 16 группе Периодической системы химических элементов Д.И. Менделеева.
На внешнем энергетическом уровне атома серы содержится 6 электронов, которые имеют электронную конфигурацию 3s23p4. В соединениях с металлами сера проявляет отрицательную степень окисления элементов -2, в соединениях с кислородом и другими активными неметаллами – положительные +2, +4, +6. Сера – типичный неметалл, в зависимости от типа превращения может быть окислителем и восстановителем.
Распространенность в природе
Сера довольно широко распространена в природе. Её содержание в земной коре составляет 0,0048 мас. %. Значительная часть серы встречается в самородном состоянии.
Также сера встречается в форме сульфидов: пирит, халькопирит и сульфатов: гипс, целестин и барит.
Много соединений серы содержится в нефти (тиофен C4H4S, органические сульфиды) и нефтяных газах (сероводород).
Аллотропные модификации серы
Существование аллотропных модификаций серы связано с её способностью образовывать устойчивые гомоцепи – S – S –. Устойчивость цепей объясняется тем, что связи – S – S – оказываются прочнее, чем связь в молекуле S2. Гомоцепи серы имеют зигзагообразную форму, поскольку в их образовании принимают участие электроны взаимно перпендикулярных р-орбиталей.
Существует три аллотропные модификации серы: ромбическая, моноклинная и пластическая. Ромбическая и моноклинная модификации построены из циклических молекул S8, размещенных по узлам ромбической и моноклинной решеток.
Молекула S8 имеет форму короны, длины всех связей – S – S – равны 0,206 нм и углы близки к тетраэдрическим 108°.
В ромбической сере наименьший элементарный объем имеет форму прямоугольного параллелепипеда, а в случае моноклинной серы элементарный объем выделяется в виде скошенного параллелепипеда.
Кристалл ромбической серы Кристалл моноклинной серы
Пластическая модификация серы образована спиральными цепями из атомов серы с левой и правой осями вращения. Эти цепочки скручены и вытянуты в одном направлении.
При комнатной температуре устойчива ромбическая сера. При нагревании она плавится, превращаясь в желтую легкоподвижную жидкость, при дальнейшем нагревании жидкость загустевает, так как в ней образуются длинные полимерные цепочки. При медленном охлаждении расплава образуются темно-желтые игольчатые кристаллы моноклинной серы, а если вылить расплавленную серу в холодную воду, получится пластическая сера – резиноподобная структура, состоящая из полимерных цепочек. Пластическая и моноклинная сера неустойчивы и самопроизвольно превращаются в ромбическую.
Физические свойства серы
Сера представляет собой твердое хрупкое вещество желтого цвета, в воде практически нерастворима, не смачивается водой и плавает на её поверхности. Хорошо растворяется в сероуглероде и других органических растворителях, плохо проводит тепло и электрический ток. При плавлении сера образует легкоподвижную жидкость желтого цвета, которая при 160°С темнеет, её вязкость повышается, и при 200 °С сера становится темно-коричневой и вязкой, как смола. Это объясняется разрушением кольцевых молекул и образованием полимерных цепей. Дальнейшее нагревание ведет к разрыву цепей, и жидкая сера снова становится более подвижной. Пары серы имеют цвет от оранжево-желтого до соломенно-желтого цвета. Пар состоит из молекул состава S8, S6, S4, S2. При температуре выше 1500 °С молекула S2 диссоциирует на атомы.
Физические свойства аллотропных модификаций серы приведены в таблице:
|
Свойство |
Ромбическая сера |
Моноклинная сера |
Пластическая сера |
|
Цвет |
Светло-желтый порошок |
Желтые иглы |
Темно-желтая масса |
|
Плотность, г/см3 |
2,07 |
1,96 |
— |
|
Температура плавления,°С |
112,8 |
119,3 |
— |
|
Температура кипения,°С |
444,6 | ||
Химические свойства серы
При комнатной температуре сера вступает в реакции только с ртутью. С повышением температуры её активность значительно повышается. При нагревании сера непосредственно реагирует со многими простыми веществами, за исключением инертных газов, азота, селена, теллура, золота, платины, иридия и йода. Сульфиды азота и золота получены косвенным путем.
Сера – типичный неметалл, обладает окислительно-восстановительной двойственностью.
Сера – окислитель
-
Как окислитель сера проявляет себя в реакциях с металлами, водородом и менее электроотрицательными элементами неметаллами.
а) с металлами взаимодействует при нагревании (кроме Na,К)
Zno + SoZn+2S-2
2 Zno — 2→ Zn+2 1- восстановитель
So + 2 → S-2 1- окислитель
-
Взаимодействие с водородом происходит при 150–200 °С:
S0 + H → HS0
2 H — 2 → 2H+1 1- восстановитель
So+ 2 → S-2 1- окислитель
-
Взаимодействие с фосфором и углеродом
При нагревании без доступа воздуха сера реагирует с фосфором, углеродом, проявляя окислительные свойства:
2Ро + 3So → РS
6 Ро — 3 → P+3 2 — восстановитель
So + 2 → S-2 3 – окислитель
2S + C = CS2.
Сера – восстановитель:
Как восстановитель сера ведет себя при взаимодействии с кислородом, галогенами, сложными веществами.
а) с кислородом: Сера горит в кислороде при 280 °С, на воздухе при 360 °С, при этом образуется смесь оксидов:
So+ О S+4О
4 So — 4→ S+4 1 — восстановитель
О+ 4 → 2О-2 1- окислитель
2S + 3O2 = 2SO3.
б) с галогенами:
В присутствии сильных окислителей проявляет восстановительные свойства:
So + 3F → S+6F
6 So — 6 → S+6 1 — восстановитель
F + 2 → 2F-1 3 – окислитель
в) со сложными веществами:
So + 6HO3(K) → H2O4 + 2H2O + 6O2↑
6 So — 6 → 1 — восстановитель
+ 1 → 6 – окислитель
Реакция диспропорционирования
Сера способна к реакциям диспропорционирования, при взаимодействии со щелочью образуются сульфиды и сульфиты:
3S + 6KOH = K2S+4O3 + 2K2S2 + 3h3O.
Получение серы
Из самородных руд
-
При нагревании пирита без доступа воздуха
FeS2 = FeS + S.
-
Окислением сероводорода при недостатке кислорода
2H2S + O2 = 2S + 2H2O.
-
Из отходящих газов металлургических и коксовых печей, при нагревании в присутствии катализатора
H2S + SO2 = 2H2O + 3S.
СЕРОВОДОРОД
Водородное соединение серы – сероводород H2S. Сероводород – ковалентное соединение. Строение молекулы аналогично строению молекулы воды, атом серы находится в состоянии sp3-гибридизации, однако в отличие от воды молекулы сероводорода не образуют между собой водородных связей. Атом серы менее электроотрицательный, чем атом кислорода, имеет больший размер и, как следствие, меньшую плотность заряда. Валентный угол HSH составляет 91,1°, длина связи H – S равна 0,133 нм.
Физические свойства
При обычных условиях сероводород – бесцветный газ, с сильным характерным запахом тухлых яиц. Тпл = -86 °С, Ткип = -60 °С, плохо растворим в воде, при 20 °С в 100 г воды растворяется 2,58 мл H2S. Очень ядовит, при вдыхании вызывает паралич, что может привести к смертельному исходу. В природе выделяется в составе вулканических газов, образуется при гниении растительных и животных организмов. Хорошо растворим в воде, при растворении образует слабую сероводородную кислоту.
Сероводородная кислота и её соли
Химические свойства.
Сероводородной кислоте присущи все свойства слабых кислот. Она реагирует с металлами, оксидами металлов, основаниями.
В водном растворе сероводород ведет себя как слабая двухосновная кислота:
H2S = H+ + HS—
HS- = H+ + S2-
Диссоциация по второй ступени незначительна.
Как двухосновная, кислота образует два типа солей — гидросульфиды и средние — сульфиды. Сульфиды щелочных и щелочноземельных металлов не окрашены, остальные имеют характерную окраску, например, сульфиды меди (II), никеля и свинца – черные, кадмия, индия, олова – желтые, сурьмы – оранжевый.
Все гидросульфиды растворимы в воде и существуют только в водных растворах.
Сульфиды делятся на три группы:
1. Растворимые в воде — сульфиды щелочных и щелочно-земельных металлов, например Na2S, K2S.
2. Нерастворимые в воде, но растворимые в разбавленной серной или соляной кислотах: FeS, MnS, ZnS и др.
3. Нерастворимые в воде и кислотах сульфиды тяжелых металлов: PbS, CuS, HgS, NiS. Сульфиды этой группы растворяются только в концентрированной азотной кислоте, например:
CuS + 4HNO3 = Cu(NO3)2 + S + 2NO2 + 2H2O
Растворимые в воде сульфиды сильно гидролизованы, их растворы имеют сильнощелочную реакцию:
S2- + H2O = HS— + OH—
Некоторые сульфиды, например Al2S3, гидролизуются необратимо:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Сероводород проявляет свойства сильного восстановителя:
а) обесцвечивает бромную и иодную воду:
H2S + Br2 = S + 2HBr
H2S + I2 = S + 2HI
б) хлор окисляет сероводород до серной кислоты:
H2S + 4Cl2+ 4H2O = H2SO4 + 8HCl
в) на воздухе сероводород горит голубым пламенем:
2H2S + 3O2 = 2H2O + 2SO2
г) сероводород обесцвечивает подкисленный раствор пермарганата калия:
KМnO4 + H2S + H2SO4 = K2SO4 + MnSO4 + H2O
д) сероводородная вода при хранении постепенно мутнеет за счет окисления Н2S растворенным в воде кислородом:
2H2S + O2 = 2S + 2H2O
В присутствии кислорода сероводород вызывает почернение серебра:
4Ag + 2H2S + O2 = 2Ag2S + 2H2O
Сульфиды, также как и сероводород проявляют восстановительные свойства
Сульфиды цветных металлов встречаются в природе как минералы и руды, служат сырьем для получения металлов.
Получение сероводорода и сульфидов
В промышленности сероводород получают при очистке нефти, природного газа и коксового газа.
В лаборатории — действием соляной или разбавленной серной кислоты на сульфиды железа или цинка, например:
FeS + 2HCl = FeCl2 + H2S
-
Прямое взаимодействие простых веществ при нагревании в инертной атмосфере
Fe + S = FeS.
-
Восстановление твердых солей оксокислот
BaSO4 + 4C = BaS + 4CO (при 1000°С)
SrSO3 + 2NH3 = SrS + N2 + 3H2O (при 800°С)
CaCO3 + H2S + H2 = CaS + CO + 2H2O (при 900°С)
-
Малорастворимые сульфиды металлов осаждают из их растворов действием сероводорода или сульфида аммония
Mn(NO3)2 + H2S = MnS↓ + 2HNO3
Pb(NO3)2 + (NH4)2S = PbS↓ + 2NH4NO3
Химические свойства сульфидов
-
Растворимые сульфиды в воде сильно гидролизованны, имеют щелочную среду:
Na2S + H2O = NaHS + NaOH;
S2- + H2O = HS— + OH—.
-
Окисляются кислородом воздуха, в зависимости от условий возможно образование оксидов, сульфатов и металлов:
2CuS + 3O2 = 2CuO + 2SO2;
CaS + 2O2 = CaSO4;
Ag2S + O2 = 2Ag + SO2.
-
Сульфиды, особенно растворимые в воде, являются сильными восстановителями:
2KMnO4 + 3K2S + 4H2O = 3S + 2MnO2 + 8KOH.
Токсичность сероводорода
На воздухе сероводород воспламеняется около 300 °С. Взрывоопасны его смеси с воздухом, содержащие от 4 до 45 об. % Н2S. Ядовитость сероводорода часто недооценивают и работы с ним ведут без соблюдения достаточных мер предосторожности. Между тем уже 0,1 % Н2S в воздухе быстро вызывает тяжелое отравление. При вдыхании сероводорода в значительных концентрациях может мгновенно наступить обморочное состояние или даже смерть от паралича дыхания (если пострадавший не был своевременно вынесен из отравленной атмосферы). Первым симптомом острого отравления служит потеря обоняния. В дальнейшем появляются головная боль, головокружение и тошнота. Иногда через некоторое время наступают внезапные обмороки. Противоядием служит, прежде всего, чистый воздух. Тяжело отравленным сероводородом дают вдыхать кислород. Иногда приходится применять искусственное дыхание. Хроническое отравление малыми количествами Н2S обусловливает общее ухудшение самочувствия, исхудание, появление головных болей и т.д. Предельно допустимой концентрацией Н2S в воздухе производственных помещений считается 0,01 мг/л.
СОЕДИНЕНИЯ СЕРЫ (IV)
Степень окисления +4 для серы является довольно устойчивой и проявляется в тетрагалогенидах SHal4, оксодигалогенидах SOHal2, диоксиде SO2 и в отвечающих им анионах. Мы познакомимся со свойствами диоксида серы и сернистой кислоты.
Оксид серы (IV)
Строение молекулы SO2
Строение молекулы SO2 аналогично строению молекулы озона. Атом серы находится в состоянии sp2-гибридизации, форма расположения орбиталей – правильный треугольник, форма молекулы – угловая. На атоме серы имеется неподеленная электронная пара. Длина связи S – O равна 0,143 нм, валентный угол составляет 119,5°.
Строение соответствует следующим резонансным структурам:
В отличие от озона, кратность связи S – O равна 2, то есть основной вклад вносит первая резонансная структура. Молекула отличается высокой термической устойчивостью.
Физические свойства
При обычных условиях диоксид серы или сернистый газ – бесцветный газ с резким удушливым запахом, температура плавления -75 °С, температура кипения -10 °С. Хорошо растворим в воде, при 20 °С в 1 объеме воды растворяется 40 объемов сернистого газа. Токсичный газ.
Соединения серы +4 – проявляют окислительно-восстановительную двойственность, но с преобладанием восстановительных свойств.
1. Взаимодействие SO2 c кислородом
2S+4О2 + О 2 S+6О
4 S+4 — 2 → S+6 2 — восстановитель (окисление)
О + 4 → 2О-2 1 — окислитель (восстановление)
2. При пропускании SO2 через сероводородную кислоту образуется сера.
S+4О2 + 2Н2S-2 → 3So + 2 Н2О
4 S+4 + 4 → So 1 — окислитель (восстановление)
S-2 — 2 → Sо 2 — восстановитель (окисление)
3. Сернистая кислота медленно окисляется кислородом воздуха в серную кислоту.
2H2S+4O3 + 2О → 2H2S+6O
4 S+4 — 2 → S+6 2 — восстановитель (окисление)
О + 4 → 2О-2 1 — окислитель (восстановление)
Сернистый газ проявляет свойства восстановителя:
а) обесцвечивает бромную воду:
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
б) при пропускании SO2 через водный раствор перманганата калия раствор обесцвечивается:
5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4
в) кислородом SO2 окисляется только в присутствии катализаторов (V2O5, NO):
2SO2 + O2 = 2SO3
г) восстанавливает Pb (+4) до Pb (+2):
PbO2 + SO2 = PbSO4
д) при нагревании в присутствии катализатора — активированного угля — реагирует с хлором, образуя хлористый сульфурил (хлорангидрид серной кислоты):
SO2 + Cl2 = SO2Cl2
— бесцветное вещество с резким запахом, легко гидролизуется:
SO2Cl2 + 2H2O = H2SO4 + 2HCl
При взаимодействии с сильными восстановителями сернистый газ проявляет свойства окислителя:
а) при пропускании SO2 через сероводородную воду происходит помутнение из-за образования свободной серы:
SO2 + 2H2S = 3S + 2H2O
Сернистый газ обесцвечивает фуксин и некоторые другие органические красители.
В водных растворах SO2 устанавливается равновесие:
SO2 + H2O = H2SO3
при этом образуется непрочная сернистая кислота H2SO3, существующая только в разбавленных водных растворах. Сернистая кислота — двухосновная:
H2SO3 = H+ + HSO3-
HSO3- = H+ + SO32-
По первой ступени H2SO3 диссоциирует как кислота средней силы, по второй — как слабая кислота
Сернистая кислота — сильный восстановитель:
а) окисляется кислородом воздуха в серную кислоту:
2H2SO3 + O2 = 2H2SO4
б) взаимодействует с водными растворами галогенов:
H2SO3 + Br2 + H2O = H2SO4 + 2HBr
При взаимодействии с сильными восстановителями сернистая кислота проявляет свойства окислителя:
а) окисляет сероводородную воду:
H2SO3 + 2H2S = 3S + 2H2O
Кислые соли сернистой кислоты — гидросульфиты, средние — сульфиты. Соли сернистой кислоты — восстановители:
а) медленно окисляются кислородом:
2Na2SO3 + O2 = 2Na2SO4
б) обесцвечивают бромную и иодную воду:
K2SO3 + Br2 + H2O = K2SO4 + 2HBr
в) обесцвечивают подкисленный раствор пермарганата калия:
K2SO3 + KMnO4 + H2SO4 = K2SO4 + MnSO4 + H2O
г) сульфиты щелочных металлов при прокаливании диспропорционируют:
4Na2SO3 = Na2S + 3Na2SO4
д) восстановительные свойства сульфита натрия проявляются в образовании тиосульфита натрия:
Na2SO3 + S = Na2S2O3 — при кипячении
Тиосульфат натрия содержит серу в степенях окисления -2 и +6:
Получение SO2 и сульфитов.
Сернистый газ в промышленности получают:
а) сжиганием серы:
S + O2 = SO2
б) обжигом пирита:
4FeS + 11O2 = 2Fe2O3 + 8SO2
В лаборатории — действием серной кислоты на сульфиты:
Na2SO3 + H2SO4 = Na2SO4 + H2O + SO2
или при взаимодействии концентрированной серной кислоты с медными стружками:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
Сульфиты (натрия, калия и кальция) получают пропусканием сернистого газа в раствор щелочи или карбоната соответствующего металла.
СОЕДИНЕНИЯ СЕРЫ (VI)
Степень окисления +6 для серы является довольно устойчивой и проявляется в соединениях с более электроотрицательными элементами: в гексафториде SF6, оксо- и диоксогалогенидах, оксиде и соответствующих им анионах. Мы познакомимся со свойствами триоксида серы и серной кислоты.
Соединения серы +6 – проявляют только окислительные свойства.
1. Взаимодействие концентрированной серной кислоты с медью.
2H2S+6O+ Cuo → Cu+2SO4 + 2Н2О + S+4О2↑
2 Cuo — 2 → Cu+2 1 — восстановитель (окисление)
S+6 + 2 → S+4 1 — окислитель (восстановление)
Оксид серы (VI)
Строение молекулы SO3
В газовой фазе триоксид серы существует в виде мономерных молекул. Атом серы находится в состоянии sp2-гибридизации, форма молекулы – правильный треугольник. Длина связи S – O равна 0,142 нм, валентный угол составляет 120°. Кратность связи S – O равна 2.
Твердый серный ангидрид образует несколько полиморфных модификаций. В льдоподобной γ-SO3 тетраэдры SO4 связаны общими вершинами в циклические тримеры S3O9, напоминающие циклические силикаты.
γ-SO3 кристаллизуется в моноклинной сингонии.
В асбестоподобных модификация тетраэдры SO4 образуют спиральные цепи со степенью полимеризации порядка нескольких тысяч (β-SO3, моноклинная сингония) или связанные в слои (α-SO3, ромбическая сингония).
При плавлении образуется жидкость, состоящая, главным образом, из тримеров.
Химические свойства.
Серный ангидрид активно реагирует с водой с образованием серной кислоты:
SO3 + H2O = H2SO4
реакция сопровождается выделением большого количества тепла.
SO3 — сильный окислитель, окисляет HBr:
2HBr + SO3 = Br2 + SO2 + H2O
Серная кислота — сильная двухосновная кислота, диссоциация ее протекает по двум ступеням:
H2SO4 = H+ + HSO4— — первая ступень
HSO4— =H+ + SO42- — вторая ступень
В концентрированных растворах диссоциация серной кислоты по второй ступени незначительна.
Серная кислота — сильнейшее дегидратирующее (водоотнимающее) вещество. Она поглощает влагу из воздуха (гигроскопична), отнимает воду от кристаллогидратов:
H2SO4 конц.
CuSO4•5H2O голубой ————————> CuSO4 белый + 5H2O
углеводов (обугливает дерево и бумагу):
H2SO4 конц.
C12H22O11 —————————> 12C + 11H2O
спиртов:
H2SO4 конц.
C2H5OH ——————————> CH2=CH2 + H2O
Серная кислота проявляет все свойства сильных кислот:
а) взаимодействует с основными оксидами, например:
CuO + H2SO4 = CuSO4 + H2O
б) с основаниями, например:
2NaOH + H2SO4= Na2SO4 + 2H2O
в) вытесняет другие кислоты из их солей, например те, которые слабее нее:
CaCO3 + H2SO4 = CaSO4 + CO2 + H2O
или более летучие (обладающие температурами кипения ниже, чем у серной кислоты):
NaNO3твердый + H2SO4 конц.= NaHSO4 + HNO3— при нагревании
В окислительно-восстановительных реакциях разбавленная серная кислота проявляет свойства обычной кислоты (неокислитель) — при этом восстанавливаются ионы Н+, например:
Fe + H2SO4 разб.= FeSO4 + H2
Разбавленная H2SO4 не взаимодействует с металлами, стоящими в ряду напряжений правее водорода.
Концентрированная серная кислота — кислота-окислитель, при этом восстанавливается сера (+6).
Она окисляет металлы, стоящие в ряду напряжений правее водорода:
Cu + 2H2SO4конц. = CuSO4 + SO2 + 2H2O
и металлы,стоящие левее водорода, при этом сера восстанавливается до степени окисления +4, 0 и -2:
Zn + 2H2SO4 = ZnSO4 + SO2 + 2H2O
3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O
4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
Железо, алюминий, хром концентрированной серной кислотой пассивируются, однако при сильном нагревании реакция начинается, например:
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
Концентрированная серная кислота окисляет неметаллы, например:
C + 2H2SO4 = CO2 + 2SO2 + 2H2O
S +2H2SO4 = 3SO2 + 2H2O
Концентрированная серная кислота окисляет также сложные вещества, например HI и HBr:
2HBr + H2SO4 = Br2 + SO2 + 2H2O
8HI + H2SO4 = 4I2 + H2S + 4H2O
соли железа (2):
2FeSO4 + 2H2SO4 = Fe2(SO4)3 + 2H2O + SO2
Сульфаты.
Серная кислота как двухосновная кислота образует два ряда солей — кислые — гидросульфаты и средние — сульфаты. В безводном состоянии выделены только гидросульфаты щелочных металлов. Средние сульфаты (безводные) — как правило, бесцветные кристаллические вещества, склонные к образованию кристаллогидратов (часто окрашеных), например:
Na2SO4•10H2O — глауберова соль (мирабилит) — бесцветная
MgSO4•7H2O — горькая (английская) соль — бесцветная
CuSO4•5H2O — медный купорос — голубой
FeSO4•7H2O — железный купорос — голубовато-зеленый
CaSO4•2H2O — гипс — белый
Сульфаты при нагревании разлагаются (кроме сульфатов щелочных металлов, которые термически устойчивы), например CaSO4 — при 1400oС:
2CaSO4 = 2CaO + 2SO2 + O2
Сульфаты переходных металлов разлагаются при более низких температурах, напримерFe2(SO4)3 — при 700-800oС:
Fe2(SO4)3 = Fe2O3 + 3SO3
5.15. Применение серы и её соединений
Серу используют для производства серной кислоты, изготовления спичек, черного пороха, бенгальских огней, для борьбы с вредителями сельского хозяйства и лечения болезней, в производстве красителей, взрывчатых веществ, люминофоров.
Сероводород идет на производство серы, сульфитов, тиосульфатов и серной кислоты, в лабораторной практике – для осаждения сульфидов
Оксид серы (IV) применяется в производстве серной кислоты, сульфитов, тиосульфатов, для отбеливания шелка, шерсти, как средство для дезинфекции, для консервирования фруктов и ягод.
Оксид серы (VI) применяется для получения серной кислоты и олеума, используется в производстве азотной кислоты.
Серная кислота – один из важнейших продуктов основной химической промышленности. Служит электролитом в свинцовых аккумуляторах. Применяется в производстве фосфорной, соляной, борной, плавиковой и др. кислот. Концентрированная серная кислота служит для очистки нефтепродуктов от сернистых и непредельных органических соединений. Разбавленная серная кислота применяется для удаления окалины с проволоки и листов перед лужением и оцинкованием, для травления металлических поверхностей перед покрытием хромом, никелем, медью и др. Серная кислота – необходимый компонент нитрующих смесей и сульфирующее средство при получении многих красителей и лекарственных веществ. Благодаря высокой гигроскопичности применяется для осушки газов, для концентрирования азотной кислоты.
nenuda.ru
Сера
Электронное строение атома.
Сера относится к элементу, находящемуся в VI-й группе главной подгруппы периодической системы Д.И.Менделеева. Его электронная конфигурация атома 1s22s22p63s23p4.
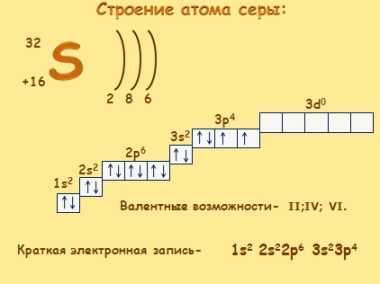
Нахождение в природе.
В обычных условиях сера представляет собой лёгкие, жёлтые кристаллы, нерастворимые в воде, но хорошо растворимые в сероуглероде. Кристаллическая решётка серы – молекулярная, в узлах которой находится циклическая молекула S8. Сера имеет ряд аллотропных модификаций.
Вышеуказанная форма серы называется моноклинной серой, при охлаждении которой переходит в устойчивые кристаллы ромбической серы.
Если расплавленную серу влить в холодную воду, то образуется ещё одна аллотропная модификация – пластическая сера. Температура кипения серы +445оС. В парах расплавленной серы содержатся молекулы S8, S6, S4, S2.
В природе сера встречается в трёх формах:

1) Самородная сера
2) Сульфидная сера:
FeS2 – серный или железный колчедан, пирит.
CuS – медный блеск.
CuFeS2 – халькопирит или медный колчедан.
PbS – свинцовый блеск.
ZnS – цинковая обманка.
HgS – киноварь.
3) Сульфатная сера:
CaSO4x2h3O – гипс.
CaSO4xh3O – алебастр.
Na2SO4x10h3O – глауберова соль.
MgSO4x 7h3O – горькая соль.
Химические свойства.
1. Свойства простого вещества.
Сера может проявлять как окислительные, так и восстановительные свойства. Окислителем сера является в первую очередь по отношению к металлам:
S + 2Na = Na2S
S + Ca = CaS
3S +2Al = Al2S3
В качестве окислителя сера проявляет свои свойства и при взаимодействии с неметаллами:
S + h3 = h3S
3S + 2P = P2S3
2S + C = CS2
Однако с неметаллами, имеющими электроотрицательность бóльшую, чем у серы, она реагирует в качестве восстановителя:
S +3F2 = SF6
S + Cl2 = SCl2
Сера реагирует со сложными веществами, как правило, окислителями. Причём азотная кислота окисляет её до серной кислоты:
S + 6HNO3 = h3SO4 + 6NO2 + 2h3O
Другие окислители окисляют серу до степени окисления (+4):
S + 2h3SO4 = 3SO2 + 2h3O
3S + 2KClO3 = 3SO2 + 2KCl
По механизму реакции ДИСПРОПОРЦИОНИРОВАНИЯ сера реагирует с щелочами. В процессе этой реакции образуются соединения серы (-2) и (+4):
3S + 6KOH = K2SO3 + 2K2S + 3h3O
Непосредственно с водой сера не реагирует, однако при нагревании подвергается дисмутации в атмосфере водяного пара.
Сера может быть получена в процессе реакций:
SO2 + 2CO = S + 2CO2
Na2S2O3 + 2HCl = S + SO2 + 2NaCl + h3O
2. Соединения серы (-2).
У серы в степени окисления (-2) соединения называются сульфидами. Это бинарные соединения, в которых одним из элементов является металл: Na2S, ZnS, Al2S3, PbS2 и др.
Соединение серы (-2) с водородом называется сероводород – h3S. Сероводород – газ без цвета, неприятного запаха, тяжелее воздуха, очень ядовит, мало растворим в воде. Сероводород можно получить различными способами. Oбычно, в лаборатории, сероводород получают, действуя на сульфиды сильными кислотами:
FeS + 2HCl = FeCl2 + h3S
Для сероводорода и его солей характерны восстановительные свойства:
h3S + SO2 = 3S + 2h3O
В указанной реакции сера образуется по механизму конпропорционирования ( из двух атомов серы, имеющих различные степени окисления (-2) и (+4) образуется соединение серы со степенью окисления (0).
SO2 + 2CO = S + 2CO2
Na2S2O3 + 2HCl = S + SO2 + 2NaCl + h3O
В лаборатории сероводород получают:
FeS + 2HCl = FeCl2 + h3S
При сгорании в кислороде он образует различные продукты:
2h3S + O2 = 2h3O + 2S (недостаток кислорода)
2h3S + 3O2 = 2h3O + 2SO2 (избыток кислорода)
Cероводород легко окисляется галогенами, оксидом серы, хлоридом железа (III):
h3S + Cl2 = 2HCl + S
2h3S + SO2 = 2h3O + 3S
h3S + 2FeCl3 = 2FeCl2 + S + 2HCl
На воздухе сероводород окисляет серебро, чем и объясняется почернение серебряных изделий со временем:
2h3S + 4Ag + O2 = 2Ag2S + 2h3O
Водные растворы сероводорода являются слабой кислотой. Диссоциирует в две стадии, образует два типа солей: гидросульфиды и сульфиды:
h3S ↔ HS-1 + H+
HS-1 ↔ H+ + S-2
Сульфиды большинства металлов нерастворимы и имеют различную окраску. Это является фактором, благодаря которому можно распознавать те или иные катионы в растворах:
Чёрные – HgS, Ag2S, PbS, CuS, FeS, NiS;
Коричневые – SnS, Bi2S3;
Оранжевые – Sb2S3, Sb2S5;
Жёлтые – As2S3, As2S5, SnS2, CdS;
Розовые — MnS
Белые – ZnS, Al2S3, BaS, CaS;
Cульфиды в водной среде проявляют восстановительные свойства, обычно окисляясь до серы: 
3h3S + 2KMnO4 = 3S + 2MnO2 + 2KOH + 2h3O
h3S + 2HNO3 = S + 2NO2 + 2h3O
3h3S + 2FeCl3 = S + FeS + 6HCl
h3S + J2 = S + 2HJ
При взаимодействии с более сильными окислителями сульфиды окисляются до соединений со степенью окисления (+6):
h3S + 4h3O + Cl2 = h3SO4 + 8HCl
MnS + 3HNO3 = MnSO4 + 8NO2 + 4h3O
PbS + 4h3O2 = PbSO4 + 4h3O
3. Соединение серы (+4).
Из соединений серы со степенью окисления (+4) наиболее характерны оксид серы (SO2) или сернистый газ и сернистая кислота (h3SO3) и её соли. Оксид серы представляет собой газ с резким запахом, бесцветный, тяжелее воздуха, хорошо растворяется в воде. Получают при неполном горении сероводорода или при окислении сульфидов. В лаборатории его получают при взаимодействии меди с концентрированной серной кислотой:
Cu + h3SO4 = CuSO4 + SO2 + h3O
Na2SO3 + 2HCl = 2NaCl + SO2 + h3O
Для оксида серы (+4) характерны как окислительные:
SO2 + h3S = 3S + 2h3O
так и восстановительные свойства:
2SO2 + O2 = 2SO3
2SO2 + 2h3O + Br2 = h3SO4 + 2HBr
SO2 + Cl2 = SO2Cl2
SO2 + 2HNO3 = h3SO4 + 2NO2
Оксид серы (+4) – типичный кислотный оксид, он реагирует с основания-ми с образованием солей, с водой образует сернистую кислоту:
SO2 + 2NaOH = Na2SO4 + h3O
SO2 + h3O = h3SO3
Сернистая кислота – слабая кислота, диссоциирует в две стадии, образует два типа солей: кислые — гидросульфитыи средние —сульфиты :
h3SO3 ↔ HSO3— + H+
HSO3—↔ SO32- + H+
Соли сернистой кислоты неустойчивы, разлагаются при действии более сильных кислот и при нагревании:
Na2SO3 + HNO3 = 2NaNO3 + SO2 + h3O
K2SO3 = K2O + SO2
В растворах сульфит-ионы проявляют чаще всего восстановительные свойства:
Na2SO3 + 2KOH + KMnO4 = Na2SO4 + 2K2MnO4 + h3O
4. Соединения серы (+6)
Из соединений серы в степени окисления (+6) наиболее характерны оксид серы — SO3 или серный ангидрид и h3SO4 — cерная кислота. SO3 — бесцветный газ с характерным резким запахом, тяжелее воздуха, хорошо растворим в воде.
Оксид серы (+6) получают окислением оксида серы (+4) в присутствии катализатора и высоком давлении:
2SO2 + O2 = 2SO3
SO3 + h3O = h3SO4
Оксид серы (+6) является сильным окислителем:
SO3 + 2KJ = J2 + K2SO3
SO3 + h3S = 4SO2 + h3O2
5SO3 + 2P = P2O5 + 5SO2
Кроме того, он проявляет кислотные свойства, так как является кислотным оксидом:
SO3 + ZnO = ZnSO4
SO3 + KOH = KHSO4
SO3 + 2KOH = K2SO4 + h3O
Серная кислота, её соли.
Серная кислота представляет собой бесцветную маслообразную жидкость, максимальная плотность которой 1,84 г/мл. Исходным сырьём для получения серной кислоты является серный колчедан или пирит:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Далее, под воздействием катализатора — V2O5 происходит окисление оксида серы (+4) до оксида серы (+6):
2SO2 + O2 = 2SO3
Полученная безводная серная кислота называется олеум, т.к. в действительности, оксид серы (+4) растворяют в 98%-ной серной кислоте.
SO3 + h3O = h3SO4
Концентрированная серная кислота проявляет сильное водоотнимающее действие. Это свойство положено в основу многочисленных химических процессов, особенно в органической химии (получение спиртов, простых и сложных эфиров, альдегидов и т.д.). Концентрированная серная кислота является сильным окислителем. Например, при взаимодействии с просты-ми веществами, она окисляет их до кислот или оксидов:
2P + 5h3SO4 = 2h4PO4 + 5SO2 + 2h3O
C + h3SO4 = 2SO2 + CO2 + 2h3O
При обычной температуре она окисляет галогенводороды и сероводород:
h3SO4 + 8HJ = 4J2 + h3S + 4h3O
h3SO4 + 2HBr = Br2 + SO2 + 2h3O
h3SO4 + h3S = S + SO2 + 2h3O
Серная кислота термически устойчива и не летуча, поэтому способна вытеснять другие кислоты из их солей:
h3SO4 + KClO3 = KHSO4 + HClO4
Cерная кислота диссоциирует в две стадии, образует два типа солей:
кислые – гидросульфатыи средние – сульфаты:
h3SO4 ↔ HSO4— + H+
HSO4— ↔ SO42— + H+
Серная кислота проявляет свойства, характерные для остальных кислот: она реагирует с металлами, оксидами металлов, гидроксидами, солями слабых кислот. Качественной реакцией на сульфат-ионы в растворах является взаимодействие её с ионами бария Ва2+, в результате чего выпадает белый осадок:
Ba2+ + SO42- = BaSO4
При прокаливании сульфаты разлагаются на различные классы соединений в зависимости от металла, входящего в состав соли. Сульфаты щелочных металлов плавятся без разложения. Сульфаты металлов средней активности разлагаются на соответствующие оксиды:
ZnSO4 = ZnO + SO3
Сульфат железа (II) разлагается по механизму внутримолекулярной ОВР:
4FeSO4 = 2Fe2O3 + 4SO2 + O2
Сульфаты наиболее тяжёлых или малоактивных металлов разлагаются с образованием простых веществ – металла и кислорода:
HgSO4 = Hg + SO2 + O2
Некоторые сульфаты, являясь окислителями, реагируют с простыми веществами:
CaSO4 + C = CaO + SO2 + CO
BaSO4 + 4C = BaS + 4CO
Большое значение в промышленности, лабораторных исследованиях имеет взаимодействие серной кислоты с металлами. Эта тема заслуживает особого внимания, т.к. образуются различные продукты реакции в зависимости от положения реагируемого металла в ряду напряжений, степени разбавленности кислоты, температуры, катализаторов.
Разбавленная серная кислота с металлами, стоящими в ряду активности до водорода, при обычной температуре образует соль и водород:
h3SO4 + Zn = ZnSO4 + h3
Разбавленная кислота не реагирует с металлами, стоящими в ряду активности после водорода (медь, серебро, ртуть), но концентрированная кислота образует с ними соль, оксид серы (+4) и воду:
h3SO4 + Cu = CuSO4 + SO2 + h3O
Такие же продукты реакции концентрированная серная кислота образует при взаимодействии с металлами, стоящими в ряду активности до водорода:
2h3SO4 + Zn = ZnSO4 + SO2 + 2h3O
Однако, концентрированная серная кислота реагирует не со всеми металлами. Алюминий, железо, свинец и олово она пассивирует с образованием на их поверхности тонких оксидных плёнок, предотвращающих дальнейшее растворение металла:
h3SO4 + Al = Al2O3 + SO2 + h3O
Активные щелочные и щелочноземельные металлы могут образовывать с разбавленной кислотой не только водород. Например, магний с очень разбавленной серной кислотой на холоду образует соль, серу и воду:
h3SO4 + Mg = MgSO4 + S + h3O
Натрий при обычной температуре с очень разбавленной серной кислотой образует соль, серу и воду:
h3SO4 + Na = Na2SO4 + S + h3O,
а при охлаждении образует сероводород:
h3SO4 + Na = Na2SO4 + Н2S + h3O
Соли серной кислоты находят большое применение в промышленности, сельском хозяйстве, в быту.
Na2SO4x 10h3O – глауберова соль, применяется в медицине в качестве слабительного,
(Nh5)2SO4 – азотное удобрение для сельского хозяйства,
CaSO4 – безводный гипс, применяется в строительстве.
CaSO4x 2h3O – водный гипс,
2CaSO4 xh3O – алебастр, продукт получения гипса,
MgSO4 – горькая соль, применяется в медицине как слабительное и гипотензивное средство,
BaSO4 – баритова каша, средство, применяемое как рентгеноконтрастное средство.
CuSO4 x 5h3O – медный купорос, применяется в строительстве,
FeSO4x 7h3O – железный купорос,
ZnSO4 x 7h3O – цинковый купорос,
KАl(SO4)2 x 12h3O – алюмокалиевые квасцы.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Соединения серы: свойства и примеры
Соединения серы: свойства и примеры
От Masterweb
10.03.2018 16:00В шестую группу периодической системы Д.И.Менделеева, подгруппу кислорода, входят несколько элементов, получивших название халькогенов. К ним относится и сера. Она распространена как в живой, так и неживой природе, и встречается в свободном состоянии, а также в составе сложных неорганических и органических веществ. В нашей статье мы изучим соединения серы и приведем примеры их применения в промышленности.
Распространение серы в природе
Элемент составляет примерно 0,05 массы земной коры. Простое вещество в виде самородной серы добывают в Крыму, Поволжье, государствах Средней Азии, а также в Италии и США. В составе соединений элемент встречается в горных породах и минералах: в железном колчедане, киновари, свинцовом блеске и цинковой обманке. В качестве макроэлемента молекулы серы входят в состав белков растений, животных и человека. В незначительных количествах соединения серы можно обнаружить в жидких природных углеводородах, например, нефти.

Особенности строения атома
Химический символ элемента – S, он расположен в третьем периоде. Сера является неметаллом, то есть является p-элементом. На последнем энергетическом уровне ее атома находится шесть электронов. Они образуют две электронные пары, а еще две отрицательно заряженные частицы остаются неспаренными. Такое состояние атома является невозбужденным. Например, химическое соединение серы — сероводород h3S, содержит частицу S, имеющую степень окисления -2. В других веществах, таких как диоксид серы SO2, степень окисления элемента равна +4. В возбужденном состоянии атома валентными становятся все шесть электронов. Например, в серной кислоте h3SO4 сера будет иметь степень окисления +6.
Физическая характеристика
Твердое вещество желтого цвета, легко крошащееся при механическом ударе, не смачивается водой – это сера. В природе обнаружено четыре ее стойких изотопа. Она может растворяться в анилине, сероуглероде, плохо проводит электрический ток и тепло. Рассмотрим аллотропные соединения серы. Химия выделяется следующие их виды: ромбическая, пластическая и моноклинная. Первая представлена кристаллами в виде октаэдров, она характерна для природного вещества. Температура плавления — 113⁰, плотность составляет 2,07 г/см3. Чтобы получить порцию моноклинной серы, требуется расплавить вещество, а затем медленно его охлаждать. Образуются кристаллы в виде иголок, темно-желтого цвета, сохраняющие свои свойства (температура плавления 119⁰, плотность – 1,96 г/см3) только при температуре, выше 96°.

Если же вещество продолжает остывать, оно переходит в ромбическую модификацию. Существует еще одна форма – аморфная, коричневого цвета, пластическая сера. Внешне она очень похожа на резину, может принимать любую форму и даже растягиваться в виде нитей. Получают вещество, струей выливая расплавленную серу в холодную воду. Находясь длительное время на воздухе, она затвердевает и теряет пластичность, становясь ромбической формой. Для серы характерно не только твердая или жидкая фаза, но и газообразное состояние. Так, при температуре 444,6⁰ она кипит и переходит в пар темно-коричневого цвета. При резком его охлаждении появляется серный цвет – порошок, состоящий из чешуйчатых мелких кристаллов серы.
Строение молекулы
Твердая ромбическая сера имеет молекулы, состоящие из восьми атомов. Они соединены между собой ковалентными неполярными связями, образуя кольцевидную структуру, которая в период нагревания разрушается. Вещество будет иметь вид обрывков цепей с частицами S, образуется полимерная структура со свойствами резины. Пары серы можно представить как систему, в которой устанавливается химическое равновесие между молекулами, содержащими различное количество атомов серы: два, четыре, шесть или восемь. Существование различных физических форм серы можно объяснить строением ее молекул.

Кислородные соединения серы
Формула оксида химического элемента S зависит от того, какую степень окисления имеет в нем атом серы. Например, SO2 – это диоксид серы, проявляющей степень окисления +4. Это газообразное вещество бесцветно и обладает удушливым резким запахом. Уже при температуре -10° оно переходит в жидкую фазу. В химических процессах ведет себя, как восстановитель. Сернистый ангидрид получают несколькими способами, например, сжигая серу:
S + O2 → SO2 + Q
Сернистый газ можно также добыть в реакции меди с концентрированной сульфатной кислотой при нагревании:
Cu + 2h3SO4 = CuSO4 + SO2 + 2h3O
Промышленный способ получения диоксида серы заключается в сжигании пирита или других серосодержащих минералов, например, свинцового блеска или цинковой обманки. Соединение используют как основное сырье в производстве сульфатной кислоты.

Трехокись серы
Продолжая рассматривать кислородные соединения серы, остановимся на серном ангидриде. Это жидкость без цвета, при температуре ниже +17⁰ она переходит в твердые кристаллы. Проявляет сильные гигроскопические свойства, и, поглощая пары воды, превращается в серную кислоту:
SO3 + h3O → h3SO4
Хранят серный ангидрид в герметически закрытых емкостях, обычно это — запаянные колбы. Вещество имеет свойства кислотного оксида и является промежуточным продуктом в сульфатном производстве.
Сероводород и соли сульфидной кислоты
В состав компонентов вулканических газов и минеральных источников часто входят молекулы h3S. Водородное соединение серы — сероводород – газ с запахом тухлых яиц, ядовит, хорошо растворим в воде. Он является продуктом распада белковых веществ, присутствующих в растительных и животных организмах. Газ получают в лаборатории под вытяжкой из водорода и серы, нагревая смесь исходных реагентов. Более распространенным способом получения сероводорода в лабораторных условиях является действие разбавленной хлоридной или сульфатной кислоты на сульфид железа.

В производственных технологиях, идущих с образованием сероводорода, необходимо соблюдать правила техники безопасности. Концентрация газа в цехе или другом помещении не должна превышать 0,01 в 1 л воздуха, так как вещество разрушает, прежде всего, нервную систему человека. Раствор сероводорода в воде называют сульфидной кислотой, она является слабым электролитом и образует два вида солей: сульфиды и гидросульфиды. Соединения серы, в состав которых входят атомы щелочных и щелочноземельных металлов, а также практически все кислые соли, хорошо растворимы в воде. Чтобы определить присутствие в растворе свободных ионов S2-, проводят качественную реакцию с растворимыми солями, содержащими ион свинца. Выпадение осадка сульфида свинца черного цвета указывает на то, что исследуемое вещество является сульфидной кислотой или ее солью.

Получают сульфиды, пропуская h3S через раствор сульфата соответствующего металла. Большинство средних солей имеют характерную окраску: например, сульфид марганца – розовую, соли свинца или меди – черную, сульфид кадмия – желтую. Эта особенность используется в аналитической химии для анализа катионов.
Сульфатная кислота
Какое соединение серы является наиболее важным в химии? Конечно же, это сульфатная кислота. Она является много тоннажным продуктом химического производства и востребована в большинстве сфер человеческой деятельности. Серную кислоту применяют при очистке нефтепродуктов, в производстве минеральных удобрений, пластмасс, красителей, лекарственных средств, а также в сельском хозяйстве. Технология получения h3SO4 состоит из трех стадий: получение диоксида серы выжиганием пирита, окисление его до серного ангидрида, поглощение его концентрированной серной кислотой и образование олеума. Его разбавляют водой и получают сульфатную кислоту заданной концентрации. Хранят ее в специальных стальных цистернах, которые можно перевозить к месту дальнейшего использования.
www.nastroy.info
Cера — химические свойства, получение, соединения. VIа группа » HimEge.ru
Сера расположена в VIа группе Периодической системы химических элементов Д.И. Менделеева.
На внешнем энергетическом уровне атома серы содержится 6 электронов, которые имеют электронную конфигурацию 3s23p4. В соединениях с металлами и водородом сера проявляет отрицательную степень окисления элементов -2, в соединениях с кислородом и другими активными неметаллами – положительные +2, +4, +6. Сера – типичный неметалл, в зависимости от типа превращения может быть окислителем и восстановителем.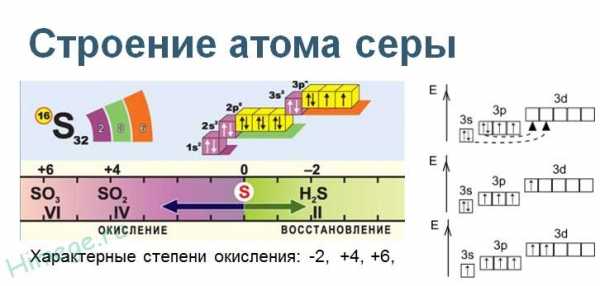
Сера встречается в свободном (самородном) состоянии и связанном виде.
Важнейшие природные соединения серы:
FeS2 — железный колчедан или пирит,
ZnS — цинковая обманка или сфалерит (вюрцит),
PbS — свинцовый блеск или галенит,
HgS — киноварь,
Sb2S3 — антимонит.
Кроме того, сера присутствует в нефти, природном угле, природных газах, в природных водах (в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды). Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
Аллотропия — это способность одного и того же элемента существовать в разных молекулярных формах (молекулы содержат разное количество атомов одного и того же элемента, например, О2 и О3, S2 и S8, Р2 и Р4 и т.д).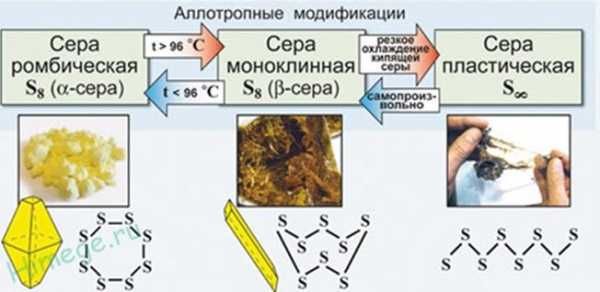
Сера отличается способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны S8, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета.
Открытые цепи имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую).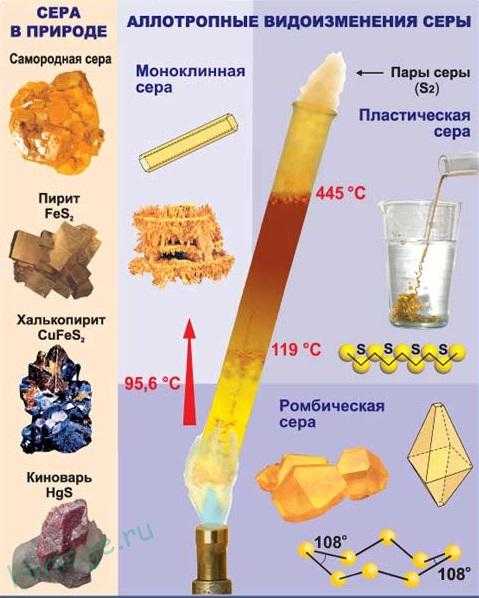
1) ромбическая — S8
t°пл. = 113°C; r = 2,07 г/см3
Наиболее устойчивая модификация.
2) моноклинная — темно-желтые иглы
t°пл. = 119°C; r = 1,96 г/см3
Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
3) пластическая — коричневая резиноподобная (аморфная) масса
Неустойчива, при затвердевании превращается в ромбическую
- Промышленный метод — выплавление из руды с помощью водяного пара.
- Неполное окисление сероводорода (при недостатке кислорода):
2H2S + O2 → 2S + 2H2O
- Реакция Вакенродера:
2H2S + SO2 → 3S + 2H2O
Окислительные свойства серы
(S0 + 2ē → S-2)
1) Сера реагирует со щелочными металлами без нагревания:
2Na + S → Na2S
c остальными металлами (кроме Au, Pt) — при повышенной t°:
2Al + 3S –→ Al2S3
Zn + S –→ ZnS
2) С некоторыми неметаллами сера образует бинарные соединения:
H2 + S → H2S
2P + 3S → P2S3
C + 2S → CS2
Восстановительные свойства сера проявляет в реакциях с сильными окислителями:
(S — 2ē → S+2; S — 4ē → S+4; S — 6ē → S+6)
3) c кислородом:
S + O2 –t° → S+4O2
2S + 3O2 –t°;pt → 2S+6O3
4) c галогенами (кроме йода):
S + Cl2→ S+2Cl2
S + 3F2→ SF6
Со сложными веществами:
5) c кислотами — окислителями:
S + 2H2SO4(конц) → 3S+4O2 + 2H2O
S + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
Реакции диспропорционирования:
6) 3S0 + 6KOH → K2S+4O3 + 2K2S-2 + 3H2O
7) сера растворяется в концентрированном растворе сульфита натрия:
S0 + Na2S+4O3 → Na2S2O3 тиосульфат натрия


himege.ru
свойства и примеры :: SYL.ru
В шестую группу периодической системы Д.И.Менделеева, подгруппу кислорода, входят несколько элементов, получивших название халькогенов. К ним относится и сера. Она распространена как в живой, так и неживой природе, и встречается в свободном состоянии, а также в составе сложных неорганических и органических веществ. В нашей статье мы изучим соединения серы и приведем примеры их применения в промышленности.
Распространение серы в природе
Элемент составляет примерно 0,05 массы земной коры. Простое вещество в виде самородной серы добывают в Крыму, Поволжье, государствах Средней Азии, а также в Италии и США. В составе соединений элемент встречается в горных породах и минералах: в железном колчедане, киновари, свинцовом блеске и цинковой обманке. В качестве макроэлемента молекулы серы входят в состав белков растений, животных и человека. В незначительных количествах соединения серы можно обнаружить в жидких природных углеводородах, например, нефти.

Особенности строения атома
Химический символ элемента – S, он расположен в третьем периоде. Сера является неметаллом, то есть является p-элементом. На последнем энергетическом уровне ее атома находится шесть электронов. Они образуют две электронные пары, а еще две отрицательно заряженные частицы остаются неспаренными. Такое состояние атома является невозбужденным. Например, химическое соединение серы — сероводород H2S, содержит частицу S, имеющую степень окисления -2. В других веществах, таких как диоксид серы SO2, степень окисления элемента равна +4. В возбужденном состоянии атома валентными становятся все шесть электронов. Например, в серной кислоте H2SO4 сера будет иметь степень окисления +6.
Физическая характеристика
Твердое вещество желтого цвета, легко крошащееся при механическом ударе, не смачивается водой – это сера. В природе обнаружено четыре ее стойких изотопа. Она может растворяться в анилине, сероуглероде, плохо проводит электрический ток и тепло. Рассмотрим аллотропные соединения серы. Химия выделяется следующие их виды: ромбическая, пластическая и моноклинная. Первая представлена кристаллами в виде октаэдров, она характерна для природного вещества. Температура плавления — 113⁰, плотность составляет 2,07 г/см3. Чтобы получить порцию моноклинной серы, требуется расплавить вещество, а затем медленно его охлаждать. Образуются кристаллы в виде иголок, темно-желтого цвета, сохраняющие свои свойства (температура плавления 119⁰, плотность – 1,96 г/см3) только при температуре, выше 96°.

Если же вещество продолжает остывать, оно переходит в ромбическую модификацию. Существует еще одна форма – аморфная, коричневого цвета, пластическая сера. Внешне она очень похожа на резину, может принимать любую форму и даже растягиваться в виде нитей. Получают вещество, струей выливая расплавленную серу в холодную воду. Находясь длительное время на воздухе, она затвердевает и теряет пластичность, становясь ромбической формой. Для серы характерно не только твердая или жидкая фаза, но и газообразное состояние. Так, при температуре 444,6⁰ она кипит и переходит в пар темно-коричневого цвета. При резком его охлаждении появляется серный цвет – порошок, состоящий из чешуйчатых мелких кристаллов серы.
Строение молекулы
Твердая ромбическая сера имеет молекулы, состоящие из восьми атомов. Они соединены между собой ковалентными неполярными связями, образуя кольцевидную структуру, которая в период нагревания разрушается. Вещество будет иметь вид обрывков цепей с частицами S, образуется полимерная структура со свойствами резины. Пары серы можно представить как систему, в которой устанавливается химическое равновесие между молекулами, содержащими различное количество атомов серы: два, четыре, шесть или восемь. Существование различных физических форм серы можно объяснить строением ее молекул.

Кислородные соединения серы
Формула оксида химического элемента S зависит от того, какую степень окисления имеет в нем атом серы. Например, SO2 – это диоксид серы, проявляющей степень окисления +4. Это газообразное вещество бесцветно и обладает удушливым резким запахом. Уже при температуре -10° оно переходит в жидкую фазу. В химических процессах ведет себя, как восстановитель. Сернистый ангидрид получают несколькими способами, например, сжигая серу:
S + O2 → SO2 + Q
Сернистый газ можно также добыть в реакции меди с концентрированной сульфатной кислотой при нагревании:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
Промышленный способ получения диоксида серы заключается в сжигании пирита или других серосодержащих минералов, например, свинцового блеска или цинковой обманки. Соединение используют как основное сырье в производстве сульфатной кислоты.

Трехокись серы
Продолжая рассматривать кислородные соединения серы, остановимся на серном ангидриде. Это жидкость без цвета, при температуре ниже +17⁰ она переходит в твердые кристаллы. Проявляет сильные гигроскопические свойства, и, поглощая пары воды, превращается в серную кислоту:
SO3 + H2O → H2SO4
Хранят серный ангидрид в герметически закрытых емкостях, обычно это — запаянные колбы. Вещество имеет свойства кислотного оксида и является промежуточным продуктом в сульфатном производстве.
Сероводород и соли сульфидной кислоты
В состав компонентов вулканических газов и минеральных источников часто входят молекулы H2S. Водородное соединение серы — сероводород – газ с запахом тухлых яиц, ядовит, хорошо растворим в воде. Он является продуктом распада белковых веществ, присутствующих в растительных и животных организмах. Газ получают в лаборатории под вытяжкой из водорода и серы, нагревая смесь исходных реагентов. Более распространенным способом получения сероводорода в лабораторных условиях является действие разбавленной хлоридной или сульфатной кислоты на сульфид железа.

В производственных технологиях, идущих с образованием сероводорода, необходимо соблюдать правила техники безопасности. Концентрация газа в цехе или другом помещении не должна превышать 0,01 в 1 л воздуха, так как вещество разрушает, прежде всего, нервную систему человека. Раствор сероводорода в воде называют сульфидной кислотой, она является слабым электролитом и образует два вида солей: сульфиды и гидросульфиды. Соединения серы, в состав которых входят атомы щелочных и щелочноземельных металлов, а также практически все кислые соли, хорошо растворимы в воде. Чтобы определить присутствие в растворе свободных ионов S2-, проводят качественную реакцию с растворимыми солями, содержащими ион свинца. Выпадение осадка сульфида свинца черного цвета указывает на то, что исследуемое вещество является сульфидной кислотой или ее солью.

Получают сульфиды, пропуская H2S через раствор сульфата соответствующего металла. Большинство средних солей имеют характерную окраску: например, сульфид марганца – розовую, соли свинца или меди – черную, сульфид кадмия – желтую. Эта особенность используется в аналитической химии для анализа катионов.
Сульфатная кислота
Какое соединение серы является наиболее важным в химии? Конечно же, это сульфатная кислота. Она является много тоннажным продуктом химического производства и востребована в большинстве сфер человеческой деятельности. Серную кислоту применяют при очистке нефтепродуктов, в производстве минеральных удобрений, пластмасс, красителей, лекарственных средств, а также в сельском хозяйстве. Технология получения H2SO4 состоит из трех стадий: получение диоксида серы выжиганием пирита, окисление его до серного ангидрида, поглощение его концентрированной серной кислотой и образование олеума. Его разбавляют водой и получают сульфатную кислоту заданной концентрации. Хранят ее в специальных стальных цистернах, которые можно перевозить к месту дальнейшего использования.
www.syl.ru
Соединения серы: свойства и примеры
В шестую группу периодической системы Д.И.Менделеева, подгруппу кислорода, входят несколько элементов, получивших название халькогенов. К ним относится и сера. Она распространена как в живой, так и неживой природе, и встречается в свободном состоянии, а также в составе сложных неорганических и органических веществ. В нашей статье мы изучим соединения серы и приведем примеры их применения в промышленности.
Распространение серы в природе
Элемент составляет примерно 0,05 массы земной коры. Простое вещество в виде самородной серы добывают в Крыму, Поволжье, государствах Средней Азии, а также в Италии и США. В составе соединений элемент встречается в горных породах и минералах: в железном колчедане, киновари, свинцовом блеске и цинковой обманке. В качестве макроэлемента молекулы серы входят в состав белков растений, животных и человека. В незначительных количествах соединения серы можно обнаружить в жидких природных углеводородах, например, нефти.

Особенности строения атома
Химический символ элемента – S, он расположен в третьем периоде. Сера является неметаллом, то есть является p-элементом. На последнем энергетическом уровне ее атома находится шесть электронов. Они образуют две электронные пары, а еще две отрицательно заряженные частицы остаются неспаренными. Такое состояние атома является невозбужденным. Например, химическое соединение серы — сероводород h3S, содержит частицу S, имеющую степень окисления -2. В других веществах, таких как диоксид серы SO2, степень окисления элемента равна +4. В возбужденном состоянии атома валентными становятся все шесть электронов. Например, в серной кислоте h3SO4 сера будет иметь степень окисления +6.
Физическая характеристика
Твердое вещество желтого цвета, легко крошащееся при механическом ударе, не смачивается водой – это сера. В природе обнаружено четыре ее стойких изотопа. Она может растворяться в анилине, сероуглероде, плохо проводит электрический ток и тепло. Рассмотрим аллотропные соединения серы. Химия выделяется следующие их виды: ромбическая, пластическая и моноклинная. Первая представлена кристаллами в виде октаэдров, она характерна для природного вещества. Температура плавления — 113⁰, плотность составляет 2,07 г/см3. Чтобы получить порцию моноклинной серы, требуется расплавить вещество, а затем медленно его охлаждать. Образуются кристаллы в виде иголок, темно-желтого цвета, сохраняющие свои свойства (температура плавления 119⁰, плотность – 1,96 г/см3) только при температуре, выше 96°.

Если же вещество продолжает остывать, оно переходит в ромбическую модификацию. Существует еще одна форма – аморфная, коричневого цвета, пластическая сера. Внешне она очень похожа на резину, может принимать любую форму и даже растягиваться в виде нитей. Получают вещество, струей выливая расплавленную серу в холодную воду. Находясь длительное время на воздухе, она затвердевает и теряет пластичность, становясь ромбической формой. Для серы характерно не только твердая или жидкая фаза, но и газообразное состояние. Так, при температуре 444,6⁰ она кипит и переходит в пар темно-коричневого цвета. При резком его охлаждении появляется серный цвет – порошок, состоящий из чешуйчатых мелких кристаллов серы.
Строение молекулы
Твердая ромбическая сера имеет молекулы, состоящие из восьми атомов. Они соединены между собой ковалентными неполярными связями, образуя кольцевидную структуру, которая в период нагревания разрушается. Вещество будет иметь вид обрывков цепей с частицами S, образуется полимерная структура со свойствами резины. Пары серы можно представить как систему, в которой устанавливается химическое равновесие между молекулами, содержащими различное количество атомов серы: два, четыре, шесть или восемь. Существование различных физических форм серы можно объяснить строением ее молекул.

Кислородные соединения серы
Формула оксида химического элемента S зависит от того, какую степень окисления имеет в нем атом серы. Например, SO2 – это диоксид серы, проявляющей степень окисления +4. Это газообразное вещество бесцветно и обладает удушливым резким запахом. Уже при температуре -10° оно переходит в жидкую фазу. В химических процессах ведет себя, как восстановитель. Сернистый ангидрид получают несколькими способами, например, сжигая серу:
S + O2 → SO2 + Q
Сернистый газ можно также добыть в реакции меди с концентрированной сульфатной кислотой при нагревании:
Cu + 2h3SO4 = CuSO4 + SO2 + 2h3O
Промышленный способ получения диоксида серы заключается в сжигании пирита или других серосодержащих минералов, например, свинцового блеска или цинковой обманки. Соединение используют как основное сырье в производстве сульфатной кислоты.

Трехокись серы
Продолжая рассматривать кислородные соединения серы, остановимся на серном ангидриде. Это жидкость без цвета, при температуре ниже +17⁰ она переходит в твердые кристаллы. Проявляет сильные гигроскопические свойства, и, поглощая пары воды, превращается в серную кислоту:
SO3 + h3O → h3SO4
Хранят серный ангидрид в герметически закрытых емкостях, обычно это — запаянные колбы. Вещество имеет свойства кислотного оксида и является промежуточным продуктом в сульфатном производстве.
Сероводород и соли сульфидной кислоты
В состав компонентов вулканических газов и минеральных источников часто входят молекулы h3S. Водородное соединение серы — сероводород – газ с запахом тухлых яиц, ядовит, хорошо растворим в воде. Он является продуктом распада белковых веществ, присутствующих в растительных и животных организмах. Газ получают в лаборатории под вытяжкой из водорода и серы, нагревая смесь исходных реагентов. Более распространенным способом получения сероводорода в лабораторных условиях является действие разбавленной хлоридной или сульфатной кислоты на сульфид железа.

В производственных технологиях, идущих с образованием сероводорода, необходимо соблюдать правила техники безопасности. Концентрация газа в цехе или другом помещении не должна превышать 0,01 в 1 л воздуха, так как вещество разрушает, прежде всего, нервную систему человека. Раствор сероводорода в воде называют сульфидной кислотой, она является слабым электролитом и образует два вида солей: сульфиды и гидросульфиды. Соединения серы, в состав которых входят атомы щелочных и щелочноземельных металлов, а также практически все кислые соли, хорошо растворимы в воде. Чтобы определить присутствие в растворе свободных ионов S2-, проводят качественную реакцию с растворимыми солями, содержащими ион свинца. Выпадение осадка сульфида свинца черного цвета указывает на то, что исследуемое вещество является сульфидной кислотой или ее солью.

Получают сульфиды, пропуская h3S через раствор сульфата соответствующего металла. Большинство средних солей имеют характерную окраску: например, сульфид марганца – розовую, соли свинца или меди – черную, сульфид кадмия – желтую. Эта особенность используется в аналитической химии для анализа катионов.
Сульфатная кислота
Какое соединение серы является наиболее важным в химии? Конечно же, это сульфатная кислота. Она является много тоннажным продуктом химического производства и востребована в большинстве сфер человеческой деятельности. Серную кислоту применяют при очистке нефтепродуктов, в производстве минеральных удобрений, пластмасс, красителей, лекарственных средств, а также в сельском хозяйстве. Технология получения h3SO4 состоит из трех стадий: получение диоксида серы выжиганием пирита, окисление его до серного ангидрида, поглощение его концентрированной серной кислотой и образование олеума. Его разбавляют водой и получают сульфатную кислоту заданной концентрации. Хранят ее в специальных стальных цистернах, которые можно перевозить к месту дальнейшего использования.
www.aktivno.net
