Фосфор
Разделы: Химия
Тип урока: изучение нового материала с использованием мультимедийной презентации
Цели урока.
- Повторить строение атома, аллотропию и сравнительные характеристики аллотропных модификаций фосфора.
- Рассмотреть химические свойства фосфора, его биологическое значение и применение с учетом предприятий, находящихся в городе.
Аппаратное обеспечение:
- персональные компьютеры (в случае проведения урока в компьютерном классе),
- либо компьютер,
- проектор,
- экран (в случае отсутствия компьютерного класса).
Урок начинается с зачитывания учителем отрывка из произведения Артура Конан-Дойля “Собака Баскервилей”:
“…Да! Это была собака, огромная, черная, как смоль. Но такой собаки еще никто из нас, смертных, не видывал. Из ее отверстой пасти вырывалось пламя, глаза метали искры, по морде и загривку переливался мерцающий огонь. Ни в чьем воспаленном мозгу не могло возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана… Страшный пес, величиной с молодую львицу. Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами.
Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте. Фосфор, – сказал я” [6].
Речь на уроке пойдет о фосфоре. Фосфор был открыт в 1669 г. немецким алхимиком Хеннингом Брандом. (слайд №1)
Вопрос к классу:
Что вы можете сказать о фосфоре как о химическом элементе?
Учащиеся дают характеристику фосфору по положению его в ПСХЭ, сравнивают его свойства со свойствами раннее изученного азота.
Выводы демонстрируются на слайде №2.
Затем учитель предлагает поговорить о фосфоре как о простом веществе. Для этого сначала нужно вспомнить:
- Что называют аллотропией и аллотропными модификациями элементов?
- С какими видами аллотропии элементов вы уже встречались?
Ученики вспоминают определение аллотропии, повторяют аллотропные модификации кислорода и серы. Учитель объясняет, что в отличие от азота фосфор в свободном состоянии образует аллотропные модификации. Важнейшие из них: белый, красный и черный фосфор. Они взаимосвязаны и способны переходить друг в друга. Рассказывается об этих модификациях, демонстрируются слайды – 3, 4, 5,6.
Свободный фосфор кроме реакций аллотропных превращений вступает также в окислительно-восстановительные реакции, где может быть как восстановителем, так и окислителем. Валентные возможности у фосфора больше, чем у азота, благодаря наличию d- орбиталей. Поэтому в соединениях фосфор может проявлять валентность, равную III и V, и степени окисления -3, +3, +5. Переходим к рассмотрению химических свойств.
1. Фосфор – восстановитель.
1) Фосфор как восстановитель реагирует с простыми веществами: с кислородом, с галогенами. Ученикам предлагается дописать следующие уравнения реакций:
- если недостаток кислорода Р + О2 =
- если избыток кислорода Р + О2 =
- если недостаток хлора Р + Cl2 =
- если избыток хлора Р + Cl2 =
Затем расставить коэффициенты, используя метод электронного баланса. Правильные ответы можно увидеть на слайдах №8,9 после того, как каждый ученик сделает это задание самостоятельно и обменяется тетрадью с соседом по парте для проверки правильности выполнения.
2) Фосфор может окисляться и сложными веществами-окислителями. Например, при реакции взаимодействия фосфора с бертолетовой солью КClО3 , которую можно наблюдать, зажигая спичку (зажигается спичка):
Р + КC lО3 = Р2О5 + КC l
Расставить коэффициенты, используя метод электронного баланса. Правильность задания проверить, обменявшись тетрадью с соседом по парте и глядя на слайд №10.
2. Фосфор – окислитель
В реакциях с активными металлами фосфор приобретает степень окисления -3 Продуктами реакции являются фосфиды:
Са + Р =
Дописать уравнение химической реакции. Расставить коэффициенты, используя метод электронного баланса. Правильность выполнения задания проверить так же, как это делалось в предыдущих случаях (слайд №11).
Биологическое значение фосфора
Учитель рассказывает о биологической роли фосфора. Свыше 85% содержащегося в организме фосфора приходится на долю костной ткани. В костях содержится преимущественно ортофосфат кальция Са3 (РО4)2, в зубах – более твердый апатит 3Са3 (РО4)2 · Са (ОН)2 и фторапатит 3Са3 (РО4)2 · СаF2. Фосфор входит также в состав многих биологически важных органических соединений – фосфолипидов, фосфопротеидов, сложных эфиров глюкозы и фруктозы с ортофосфорной кислотой, нуклеиновых кислот, АТФ и др. Эти вещества играют ключевую роль в энергетическом обмене, в метаболизме жиров, углеводов и т.д. Ортофосфорная кислота и ее кислые соли образуют фосфатную буферную систему, регулирующую рН среды в организме человека.
Применение фосфора и его соединений.
Красный фосфор используют для производства спичек, фосфорной кислоты, которая, в свою очередь, идет на производство фосфорных удобрений и кормовых добавок для животноводства. Кроме того, фосфор применяют для получения ядохимикатов.
Предлагается ученикам назвать предприятия, имеющиеся в городе, связанные с применением фосфора и его соединений. Ученики без особого труда вспоминают и называют два предприятия. Это ЗАО «Череповецкая спичечная фабрика «ФЭСКО» и Череповецкое открытое акционерное общество «Аммофос». Глядя на слайды №12 — 18 разговор идет о продукции, выпускаемой на этих предприятиях.
В конце урока предлагается ответить на несколько вопросов теста, тексты которого положены на парты:
- Электронная формула атома фосфора:
- 1S2 2 S22p4
- 1S2 2 S22p6
- 1S2 2 S22p63S23p3
- 1S2 2 S22p63S23p3
- Минимальная степень окисления фосфора в соединении с формулой:
- Р4
- РН3
- Р2О3
- Н3РО4
- Белый фосфор в отличие от азота …
- обладает заметной электрической проводимостью
- химически высоко реакционноспособен
- не встречается в природе в свободном состоянии
- хорошо растворим в воде
- Фосфор, как и азот, входит …
- в состав всех минеральных солей
- в состав всех живых организмов
- в состав воздуха
- царской водки
- Какая из аллотропных модификаций фосфора наименее реакционноспособна?
- Белый фосфор
- Черный фосфор
- Красный фосфор
- Фосфор так же, как и азот, не имеет аллотропных модификаций
- Формулы высшего оксида и летучего водородного соединения элемента №15:
- ЭО2 и ЭН4
- Э2О5 и ЭН3
- ЭО3 и Н2Э
- Схеме превращения: Р-3 > Р+5 Соответствует химическое уравнение:
- 4Р + 5О2 = 2 Р2О5
- 3Мg + 2Р = Мg3Р2
- 4Р + 3О2 = 2 Р2О3
- 2РН3 + 4О2 = Р2О5 + 3Н2О
Затем поменяться тетрадью с соседом по парте и проверить его работу. Правильность ответов посмотреть на слайде №19. Весь класс по результатам работы оценивается.
Домашнее задание: § 27 стр. 122-123, упр. 3, 4 стр.126
Литература:
- О. С. Габриелян, И. Г. Остроумов. Настольная книга учителя. Химия 9 класс. М.:Дрофа.2002г.
- О. С. Габриелян. Химия. 9 класс: Учеб. для общеобразоват. учреждений. – М.: Дрофа, 2003
- Химия. Тесты для школьников и поступающих в вузы: Учебное пособие / Н. Е. Кузьменко, В. В. Ерёмин. – М.: Издательство “Экзамен”, 2006
- Химия: Учебник для учащихся 9 класса общеобразовательных учреждений. – 2-е изд., с исправл. – М.: Вентана-Граф, 2005
- А.С. Егоров, Н.М. Иванченко, К.П. Шацкая. Химия внутри нас: Введение в бионеорганическую и биоорганическую химию. – Ростов н/Д: Феникс, 2004
- А. Конан-Дойль Собрание сочинений в 8-ми томах, т.3, М., Издательство “Правда”, 1966
20.03.2008
xn--i1abbnckbmcl9fb.xn--p1ai
Фосфор — Химические свойства
Химия — Фосфор — Химические свойства
01 марта 2011Оглавление:
1. Фосфор
2. История
3. Происхождение названия
4. Химические свойства
5. Применение
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность резко снижается. Белый фосфор на воздухе светится в темноте, свечение обусловлено окислением паров фосфора до низших оксидов.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:
- 4P + 5O2 → 2P2O5,
- 4P + 3O2 → 2P2O3.
Взаимодействует со многими простыми веществами галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами окислитель, образует фосфиды:
- 2P + 3Ca → Ca3P2,
- 2P + 3Mg → Mg3P2.
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами восстановитель:
- 2P + 3S → P2S3,
- 2P + 3Cl2 → 2PCl3.
Не взаимодействует с водородом.
Взаимодействие с водой
Взаимодействует с водой, при этом диспропорционирует:
- 8Р + 12Н2О = 5РН3 + 3Н3РО4.
Взаимодействие со щелочами
В растворах щелочей диспропорционирование происходит в большей степени:
- 4Р + 3KOH + 3Н2О → РН3 + 3KН2РО2.
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
- 3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO;
- 2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O.
Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
- 6P + 5KClO3 → 5KCl + 3P2O5
Просмотров: 9032
4108.ru
| 1. Фосфор – окислитель при взаимодействии с: | |
| г) хлоратом калия | |
| 2. Соль ортофосфорной кислоты нельзя получить при взаимодействии между собой: | |
| а) H3PO4 и NH3 (водный р-р) | б) BaCl2 (р-р) и K3PO4 (р-р) |
| 3. Укажите формулу двойного суперфосфата: | |
| а) Ca(H2PO4)2*2H2O + CaSO4*2H2O | |
| 4. Какую массу фосфора (г) можно получить из 310 г фосфорита, содержащего 90 % ортофосфата кальция, при выходе реакции 75% (ответ округлите до целых): | |
| 5. Укажите формулу фосфида: | |
| 6. Оксиду фосфора (III) отвечает кислота: | |
| 7. Чтобы дигидрофосфат калия перевести в гидрофосфат калия нужно воспользоваться реактивом: | |
| б) ортофосфорной кислотой | |
| г) серной кислотой | |
| 8. Какая минимальная масса (кг) фосфорита с массовой долей Ca3 (PO4)2, равной 90 %, нужна для получения 62 кг фосфора при выходе реакции 80 %: | |
| 9. В реакции NH3 + H2PO4— → NH4+ + HPO42- дигидрофосфат-ион ведет себя как: | |
| а) восстановитель | |
| в) донор протонов | г) акцептор протонов |
| 10. Белый фосфор более активен, чем азот, так как: | |
| а) заряд ядра фосфора меньше | б) молекулы фосфора имеют большую массу |
| в) число протонов в ядре атома азота меньше, чем у фосфора | г) энергия связи между атомами в молекуле белого фосфора меньше, чем в молекуле азота |
himiy88.blogspot.com
Окислительно-восстановительные свойства соединений фосфора — Справочник химика 21
Общая характеристика элементов главной подгруппы V группы периодической системы. Азот. Строение атома, строение молекулы, степени окисления. Круговорот азота в природе. Получение, физические и химические свойства азота. Аммиак, строение молекулы, получение, физические и химические свойства. Восстановительные свойства аммиака. Аммиачная вода. Соли аммония, их получение. Термическое разложение солей аммония. Оксиды азота, их получение и основные химические свойства. Азотистая кислота. Окислительно-восстановительные свойства соединений азота со степенью окисления +3. Азотная кислота, ее получение и химические свойства. Окислительные свойства азотной кислоты в реакциях взаимодействия с металлами и неметаллами. Царская водка. Соли азотной кислоты, их термическое разложение. Азотные удобрения. Фосфор, строение атома, степени окисления. Аллотропия. Физические и химические свойства. Фосфин. Фосфиды, их гидролиз. Оксиды фосфора (III) и (V), их получение, свойства. Ортофосфор-ная кислота, ее получение. Одно-, двух- и трехзамещен-ные фосфаты. Их растворимость и гидролиз. Метафос-форная кислота, ее общая характеристика. Фосфорные удобрения. [c.7]Окислительно-восстановительные свойства соединений фосфора [c.224]
Исходя из степени окисления фосфора в соединениях РН3, Н3РО4, Н3РО3, определите, какое из них является только окислителем, только восстановителем и какое может проявляться как окислительные, так и восстановительные свойства. Почему Расставьте коэффициенты в уравнении реакции, идущей по схеме [c.394]
На рис. В.33 для сравнения окислительно-восстановительных свойств соединений азота и фосфора приведены две диаграммы [c.543]
К элементам подгруппы азота относятся азот, фосфор, мышьяк, сурьма и висмут. Во внешнем электронном слое атомов этих элементов имеется по 5 электронов они обладают восстановительными и окислительными свойствами. Они могут терять различное число электронов, проявляя в соединениях соответствующую положительную валентность от 1 до 5. В соединениях высшей валентности проявляются ковалентные связи. [c.250]
Окислительно— восстановительные свойства соединений фосфора отражены в диаграмме Латимера для фосфора. [c.72]
Вопросы для самопроверки 1. Дайте общую характеристику элементов V А подгруппы, исходя из их положения в периодической системе. Какие степени окисления характерны для элементов этой подгруппы 2. Как в ряду N—Р—Аз—5Ь—изменяются окислительно-восстановительные свойства элементов 3. Какова максимальная ковалентность азота и какова фосфора Ответ обоснуйте, исходя из положения этих элементов в различных периодах и строения их атомов. 4. По какому типу химической связи построена молекула N2 Какова кратность связи в молекуле азота Как объяснить малую реакционную способность азота 5. Какие степени окисления характерны для азота В каких гибридных состояниях могут находиться валентные орбитали атома азота Приведите примеры соединений азота с различным типом гибридизации его валентных орбиталей 6. При каких условиях осуществляется синтез аммиака Какими свойствами обладает аммиак Какова форма молекулы ЫНз Какую среду имеет водный раствор аммиака 7. Чем объясняется, что молекула ЫНз является донором электронной пары Какое строение имеет ион МН 8. Какие кислородные соед шения образует азот Какое строение имеют молекулы оксидов азота Какие из оксидов азота являются кислотообразующими 9. Какое строение имеет молекула азотистой кислоты Какие две таутомерные структуры известны для НЫОг Чем можно объяснить малую термическую устойчивость НЫОг 10. Приведите примеры реакций, подтверждающих окислительно-восстановительные [c.50]
Комм. Почему после добавления цинка в реакционную смесь при pH окисление иодид-иона Сравните окислительные свойства нитрат- и ниТрит-ионов, фосфатов(У), фосфатов(Ш) и фосфатов(Т). Дайте оценку окислительных свойств висмутата(У) натрия, используя результаты опыта П5 (окисление катиона марганца(П) до перманганат-иона характерного цвета). Сравните окислительно-восстановительные свойства кислородных соединений элементов в степенях окисления (+П1) и (+V) по ряду азот — фосфор — мышьяк — сурьма — висмут. [c.166]
Б химии органических соединений азота наиболее устойчивыми формами являются амины, обладающие лишь очень слабыми восстановительными свойствами. Окиси третичных аминов RзN->0 и даже нитро-соединения—-вещества с выраженными окислительными свойствами (окиси третичных аминов, например, выделяют иод из подкисленного раствора иодистого калия). В химии фосфорорганических соединений наиболее устойчивы производные фосфора в высших валентных состояниях фосфины — сильные восстановители (низшие фосфины самовоспламеняются на воздухе), а окиси третичных фосфинов, фосфоновые и фосфиновые кислоты вовсе лишены окислительных свойств. С другой стороны, есть некоторые функции азота, такие, как, например, азосоединения R—Ы = R, которых не существует в химии фосфора. При попытках синтеза подобного рода веществ образуются только димеры [c.389]
Комм. Какой газообразный продукт получается в результате обработки фосфида кальция а) хлороводородной кислотой, б) водой Какой из продуктов реакции самовоспламеняется на воздухе и поджигает фосфин Каково строение молекулы фосфина Сравните протолитические и окислительно-восстановительные свойства всех известных вам водородных соединений азота и фосфора. [c.161]
Вместе с тем понятие степень окисления очень полезно для классификации веществ и при составлении химических уравнений. Так, степени окисления фосфора в соединениях НР О , НзР 0 и Н Ра От одинаковы, значит эти соединения сходны по строению и должны сильно отличаться по свойствам от соединения НзР Оз, в котором степень окисления фосфора другая. Особенно широко используется понятие степень окисления при подборе стехиометрических коэффициентов в уравнениях окислительно-восстановительных реакций. [c.49]
Общая характеристика IVA-, VA-, VIA-, VIIA-групп периодической системы. Водород, его химические и физические свойства. Свойства и способы получения хлороводорода и хлоридов, гипохлоритов, хлоратов. Кислород, его получение, сравнение физических и химических свойств кислорода и озона, окислительно-восстановительные реакции с участием пероксида водорода. Сера, ее физические и химические свойства. Свойства и способы получения соединений серы сероводорода и сульфидов, оксидов, сульфитов, серной кислоты и сульфатов. Азот, его физические и химические свойства, получение. Свойства аммиака и солей аммония, оксидов азота (+1), (+2) и (+4), азотистой кислоты и нитритов, азотной кислоты и нитратов. Получение аммиака и азотной кислоты. Фосфор, его физические и химические свойства. Свойства соединений фосфора фосфороводорода и фосфидов, оксидов фосфора (+3) и (+5), фосфорной кислоты и фосфатов. > лерод, его зичес-кие и химические свойства. Свойства и способы получения оксидов углерода и карбонатов. Свойства угольной кислоты. Свойства кремния, оксида кремния, кремниевой кислоты и силикатов. Медикобиологическое значение соединений указанных неметаллов. [c.757]
В химии органических соединений азота наиболее устойчивыми формами являются амины, обладаюш,ие лишь очень слабыми восстановительными свойствами. Окиси третичных аминов ВдК О и даже нитросоединения вещества с выраженными окислительными свойствами (окиси третичных аминов, например, выделяют иод из подкисленного раствора иодистого калия). В химии фосфорорганических соединений наиболее устойчивы производные фосфора в высших валентных состояниях [c.427]
Соединения фосфора по своим окислительно-восстановительным свойствам резко отличаются от аналогичных соединений хлора (соответствующие соединения серы занимают промежуточное положение). Так, высшая кислородная кислота фосфора Н3РО4 устойчива и не является окислителем, а соответствующая кислота хлора НС1О4 —очень сильный окислитель. Низшие кислородные кислоты фосфора — сильные восстановители, тогда как соответствующие соединения хлора —сильные окислители. Фосфид-ион Р обладает столь сильными восстановительными свойствами, что его нельзя получить сульфид-ион 5 — сильный восстановитель, а хлорид-ион устойчив. [c.224]
Одна[ко понятие степень окпсления очень полезно для классификации веществ и при состап.ленпи химических уравнений. Так, например, определив степень окисления фосфора в соедшгениях (НР «Оз) , НзР 04 и Н4Р2 07, мы видим, что эти соединения являются родственными и должны сильно отличаться по свойствам от соединения Н3Р+Ю3, в котором степень окисления фосфора другая. Особенно широко используется понятие степень- окисления при изучении окислительно-восстановительных реакций. [c.45]
Фосфор проявляет восстановительные и окислительные свойства. Он легко окисляется кислородом, галогенами, серой и др. При недостатке окислителя обычно образуются соединения фосфора (П1) (РаОа, РНа1з, Ра5з), при избытке — соединения фосфора (V) (РаОв, РНаи, Р 8б). Окислительная активность фосфора проявляется при взаимодействии с металлами. При нагревании в воде и в особенности в щелочных растворах фосфор диспропорционирует. [c.410]
Фосфор проявляет восстановительные и окислительные свойства. Он легко окисляется кислородом, галогенами, серой и др. При недостатке окислителя обычно образуются соединения фосфора (И1) (Р2О3, [c.397]
Фосфор. Изучено электровосстановление элементарного фосфора [182, 59, 496, 423] и его соединений [423, 656]. Элементарный фосфор весьма реакционноспособен, он в равной мере способен проявлять окислительные и восстановительные свойства, т. е. должен вступать как в катодные, так и в анодные реакции. На катоде желтый фосфор (Р4) в зависимости от материала катода, растворителя и концентрации способен восстанавливаться до различных степеней окисления. В апротонных растворителях (АН, ДМФ) на ртутном электроде при концентрациях Р4двух электронов с образованием двухзарядного бианиона Р42-, в концентрированных растворах фосфора образуется однозарядный анион Р4+е—>-Р4-. Восстановление протекает через образование хемосорбированного комплекса Р4Нд [59, 423]. Характер катодного процесса диффузионный. Анионы Р4″ и Р4 способны взаимодействовать с находящимися в приэлектродном слое органическими соединениями с образованием фосфорорганических соединений [182, 59]. В протолитических растворителях процесс восстановления протекает необратимо с присоединением трех электронов также через промежуточное образование поверхностного хемосорбированного соединения Р4Ндж, электрохимически восстанавливающегося до фосфористого водоро- [c.102]
Величины степени окисления элементов используются при образовании названий химических соединений и при подборе коэффициентов в уравнениях окислительно-восстановительных реакций. В некоторых случаях по степени окисления можно более отчетливо, чем по валентности, различить свойства элементов в соединениях. Так, фосфор в фосфорной, фосфористой и фос-форноватистой кислотах пятивалентен, в то время как степени окисления фосфора в этих кислотах +5, +3, -Ы. Здесь степени окисления существенно отличаются, и они определяют химические свойства этих кислот. В некоторых случаях численная величина валентности и степени окисления совпадают, например, в сероводороде сера двухвалентна и степень окисления ее равна —2. [c.48]
Высо низкая степень окисления элемента не всегда является показателем его высокой окислительной ИЛИ восстановительной активности. Так, НРОя, SiOj, соединения Мо п W в противоположность аналогичным по составу HNO ,, PbOj, соединениям хрома (VI) окислительных свойств не проявляют, что связано с большой устойчивостью максимальной степени окисления для фосфора, кремния, молибдена и вольфрама. [c.246]
chem21.info
Окислительно-восстановительные реакции
Реакции, в результате которых изменяется степень окисления хотя бы одного из элементов, называются окислительно-восстановительными реакциями.
Изменение степени окисления элементов происходит в результате перехода электронов от атома одного элемента к другому атому или в результате смещения электронных пар, образующих химическую связь.
Степень окисления — это условный заряд, который присваивается атому элемента в соединении из расчета, что все связи в нем ионные. Степень окисления может иметь положительное, отрицательное и нулевое значение.
Нулевое значение степени окисления имеют атомы в молекулах простых веществ. Металлы в соединениях проявляют положительную степень окисления, а неметаллы – как положительную, так и отрицательную.
Водород в соединениях с неметаллами имеет степень окисления +1, а кислород в большинстве соединений -2.
В молекулах алгебраическая сумма степеней окисления всех атомов, входящих в их состав, равна 0, так как молекулы электронейтральны. Исходя из этого, можно вычислить степень окисления атомов в молекулах сложных соединений.
Пример. Вычислить степень окисления серы в серной кислоте и фосфора в пирофосфорной кислоте.
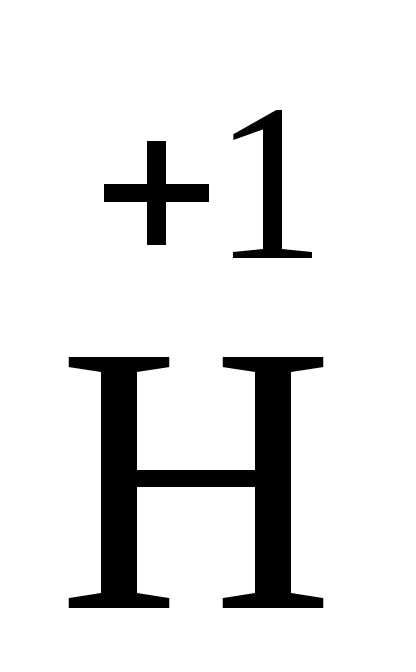 2
2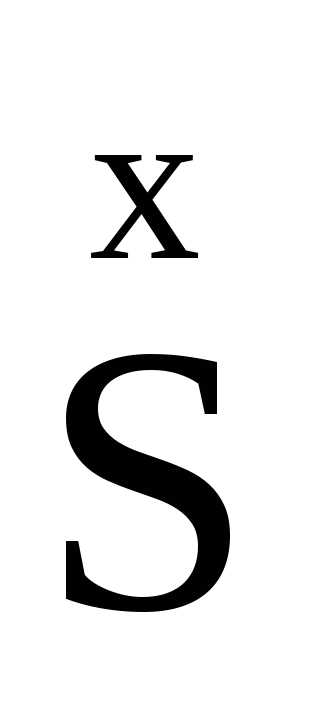
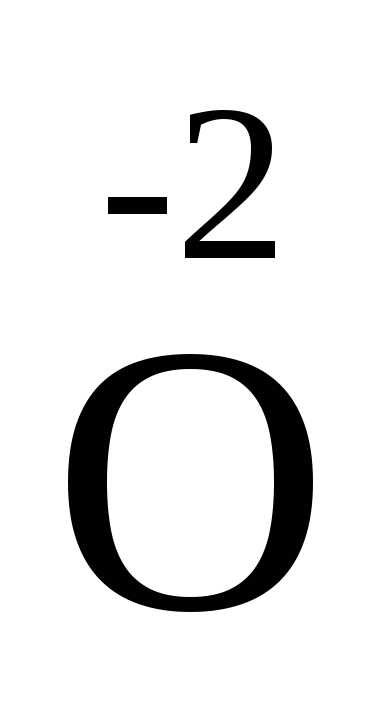 4: 2·1 + x + 4·(-2) = 0, x = 6.
4: 2·1 + x + 4·(-2) = 0, x = 6.
Следовательно, сера в серной кислоте имеет степень окисления +6.
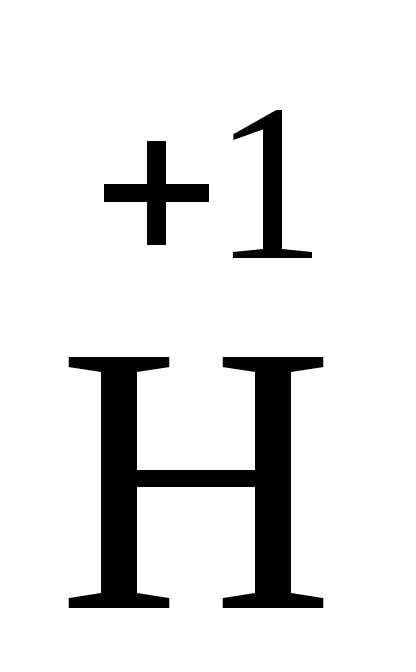 4
4 2
2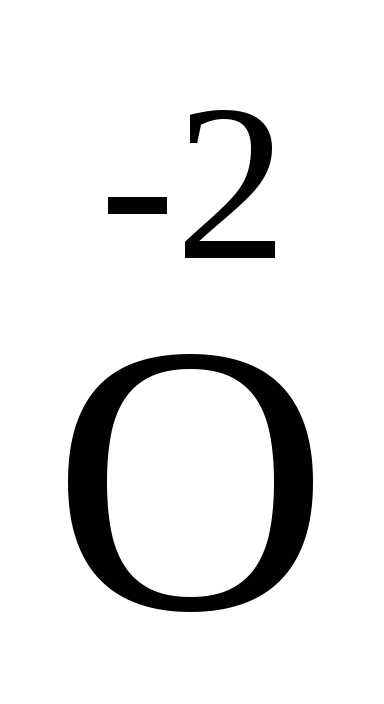 7: 4·1+
2x + 7·(-2) = 0, x = 5.
7: 4·1+
2x + 7·(-2) = 0, x = 5.
Степень окисления фосфора в пирофосфорной кислоте +5
Процесс потери электронов, сопровождающийся повышением степени окисления атома, называется окислением. Процесс присоединения электронов, сопровождающийся понижением степени окисления атома, называется восстановлением. Окислительно-восстановительная реакция – это единый процесс: без окисления не может быть восстановления.
Вещество, которое в реакции отдает электроны, называется восстановителем. В окислительно-восстановительном процессе оно окисляется. Вещество, которое в реакции принимает электроны, называется окислителем. В ходе реакции оно восстанавливается.
Важнейшие окислители и восстановители
Восстановители
1.Простые вещества:
-металлы: Me – nē → Men+;
-неметаллы: водород, углерод: H2– 2ē → 2H+,
C – 4ē →
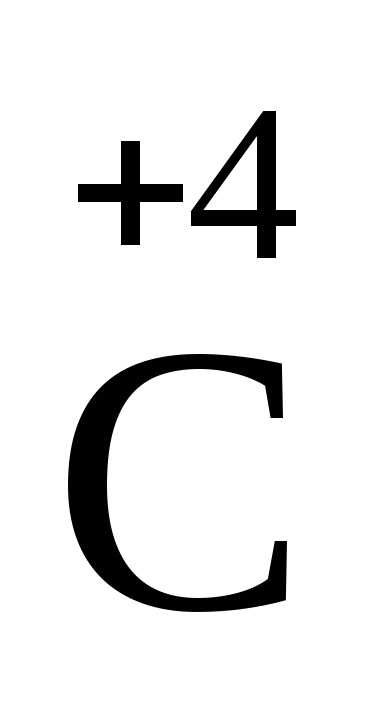 .
.
2.Соединения:
-положительно заряженные
ионы в низшей степени окисления:  — 1ē →
— 1ē → ;
;
-отрицательно заряженные простые ионы (S2-,J—): S2-— 2ē → S0, J—— 1ē → J0;
-сложные анионы с
атомом элемента в низшей степени
окисления:  O
O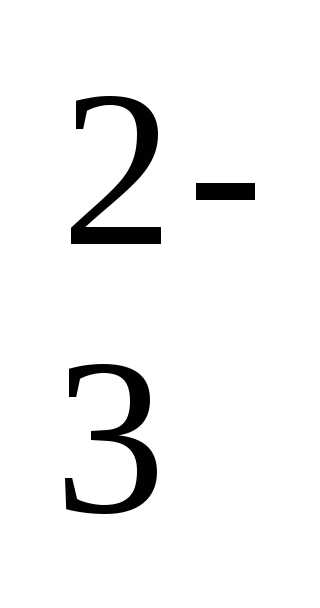 — 2ē →
— 2ē →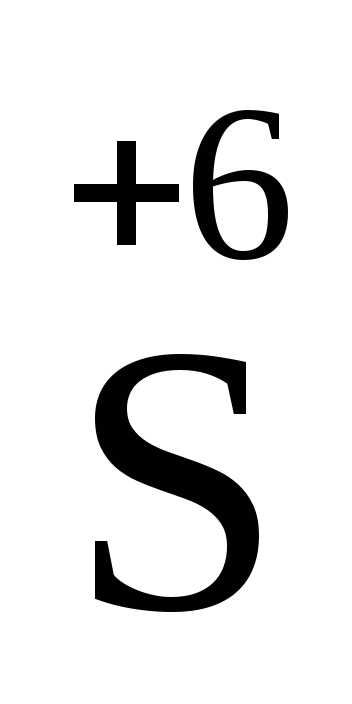 O
O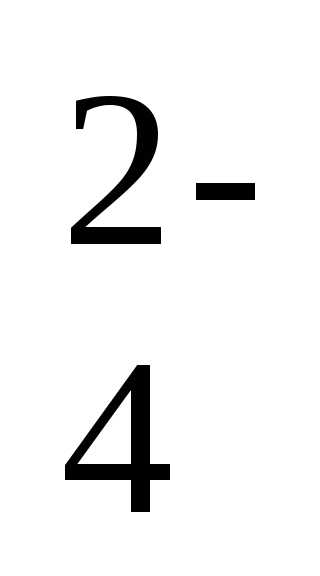 ,
,
O — 2ē →
— 2ē → O
O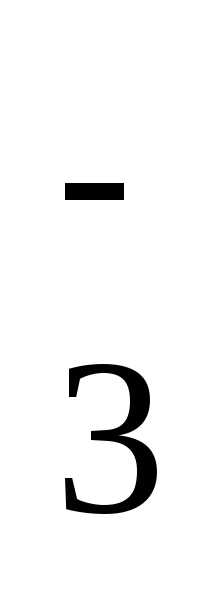 .
.
Окислители
1. Простые вещества – неметаллы (кислород, галогены, сера): O2+ 4ē → 2O2-,
S + 2ē → S2-,
Cl2+ 2ē → 2Cl—.
2.Соединения:
-положительно заряженные
ионы металлов в высшей степени окисления: 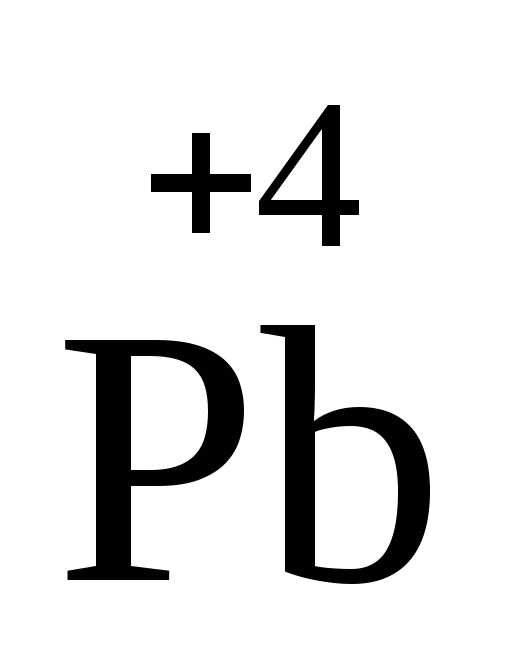 + 2ē →
+ 2ē →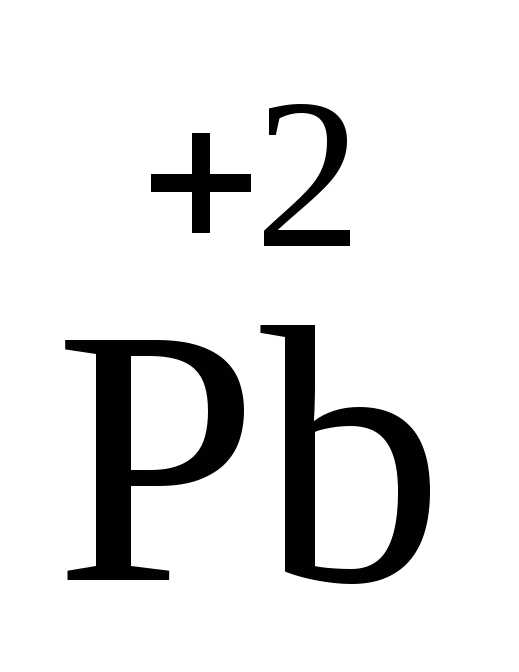 ;
;
-положительно заряженные ионы благородных металлов: Ag+ + 1ē → Ag;
-соединения, содержащие
анионы с атомом элемента в высшей степени
окисления: концентрированная и
разбавленная азотная кислота и ее соли,
концентрированная серная кислота,
перманганат калия K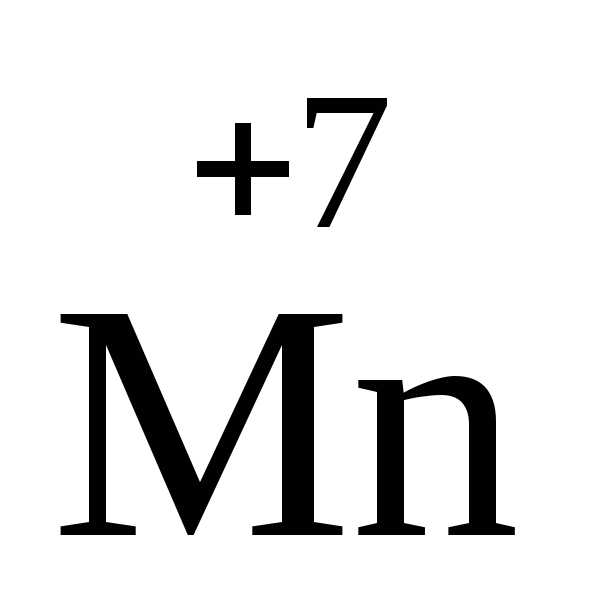 O4,
дихромат калия K2
O4,
дихромат калия K2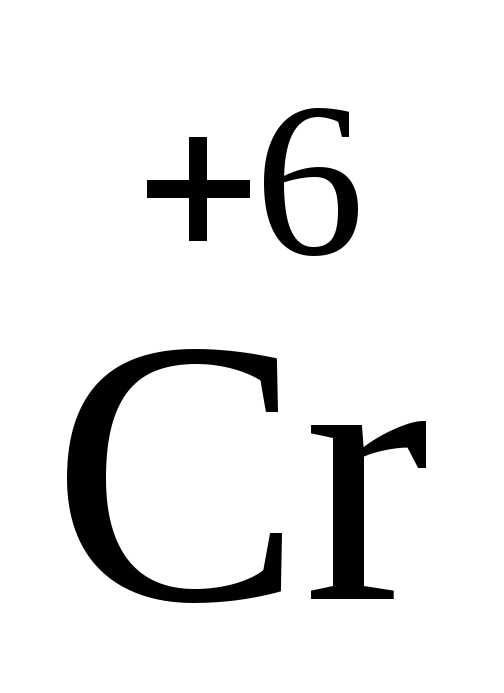 2O7,
кислородные соединения галогенов.
2O7,
кислородные соединения галогенов.
Составление окислительно-восстановительных реакций
Составить уравнение окислительно-восстановительной реакции – значит определить какие продукты реакции образуются и найти коэффициенты перед всеми веществами.
Одним из методов определения коэффициентов в уравнении реакции является метод электронного баланса. В основе этого метода лежит нахождение коэффициентов перед молекулами восстановителя и окислителями, при которых суммарное число электронов, отданных восстановителем, равно суммарному числу электронов, присоединенных окислителем.
Рассмотрим этот метод
на простейшем примере окисления алюминия
кислородом:  + O2→
+ O2→ 2O3.
2O3.
Алюминий – металл, он является восстановителем. Атом алюминия отдает 3 электрона. Кислород – неметалл, он является окислителем. Молекула кислорода принимает 4 электрона, образуя два иона кислорода (всегда нужно определять число принятых или отданных электронов молекулой реагирующего вещества). Находим наименьшее общее кратное число отданных и полученных электронов, умножая 3 на 4. Это число указывает на количество электронов, принимающих участие в окислительно-восстановительной реакции:
 – 3ē =
– 3ē =
12
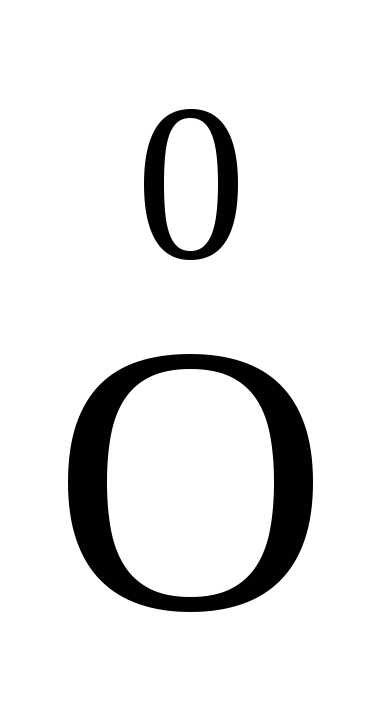 2+ 4ē = 2
2+ 4ē = 2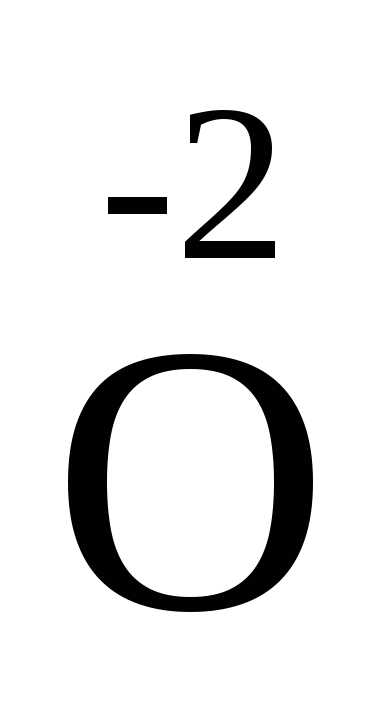
Чтобы восстановитель отдал 12 электронов, должно быть 4 атома алюминия. Чтобы окислитель присоединил 12 электронов, должно быть 3 молекулы кислорода:
 – 3ē =
– 3ē = 4
4
12
O2+ 4ē = 2O3
В левой частях уравнения реакции 4 атома алюминия, в правой части должно быть столько же, т. е. перед Al2O3нужно поставить коэффициент 2: 4Al + 3O2= 2Al2O3.
Проверка на кислород показывает, что в левой и правой части уравнения 6 атомов кислорода. Коэффициенты в уравнении реакции расставлены правильно.
Коэффициенты, стоящие перед восстановителем и окислителем, можно увеличивать или уменьшать, не изменяя их соотношения, полученного при составлении схемы электронного баланса.
Часто в окислительно-восстановительных реакциях, происходящих в растворах, принимает участие третий компонент – среда. Например,
K +K2
+K2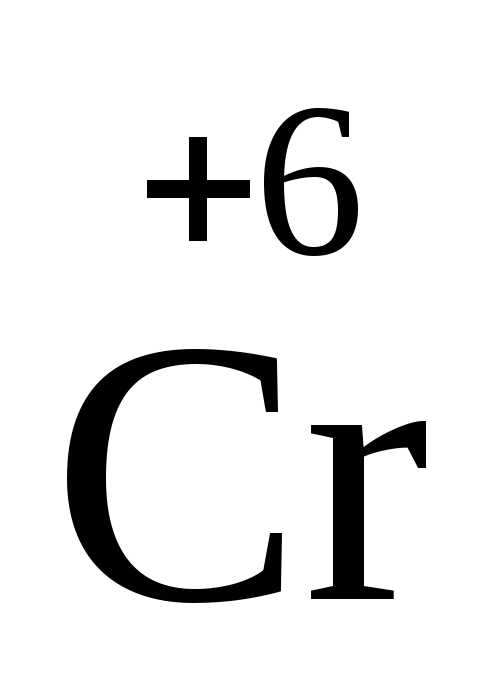 2O7+H2SO4→
2O7+H2SO4→ 2+
2+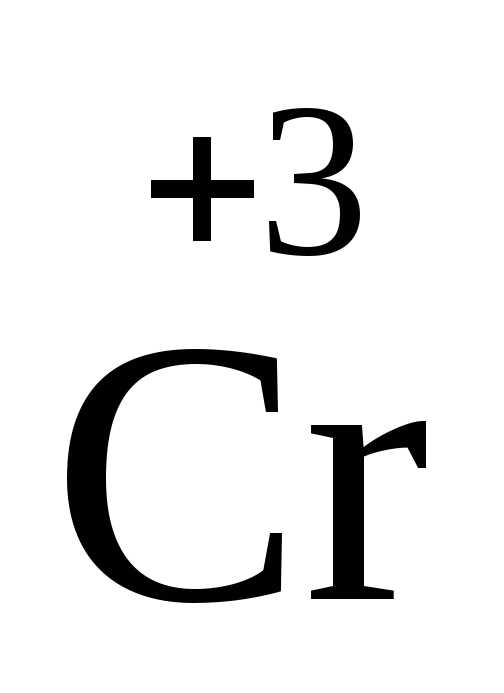 2(SO4)3+K2SO4+H2O.
2(SO4)3+K2SO4+H2O.
В этой реакции восстановителем является иодид калия, а окислителем – дихромат калия. Составляем схему электронного баланса:
 — 1ē =
— 1ē =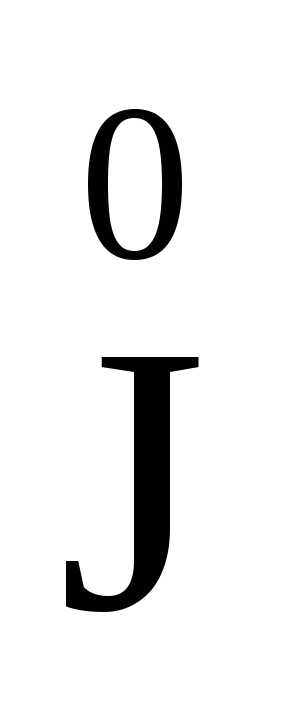 6
6
6
2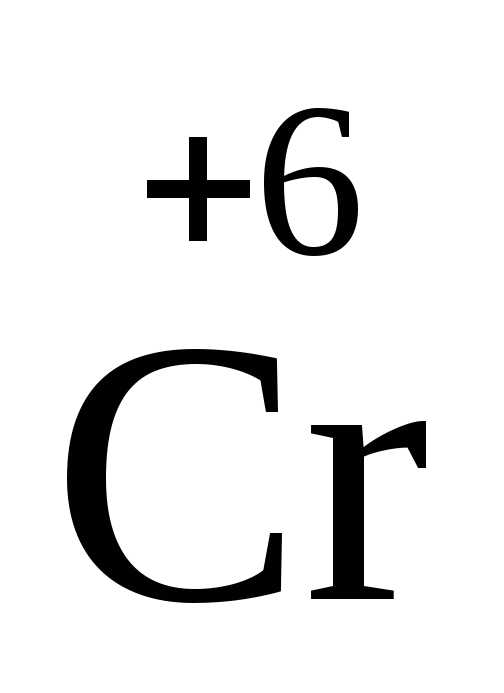 + 6ē = 2
+ 6ē = 2 1
1
Один ион иода отдает 1 электрон, а два атома хрома принимают 6 электронов. Отсюда получаются коэффициенты перед молекулами восстановителя и окислителя 6 и 1. Эти коэффициенты определяют соотношение между числом молекул восстановителя и его окисленной формой, с одной стороны, и числом молекул окислителя и его восстановленной формой, с другой:
6KJ + K2Cr2 O7 + H2SO4 → 3J2 + Cr2(SO4)3 + K2SO4 + H2O.
Серная кислота необходима для связывания в соль образовавшихся катионов K+и Cr+3. Количество молекул K2SO4определяется суммарным числом атомов калия в левой части уравнения: из 8 атомов калия получается 4 молекулы K2SO4. Для образования одной молекулы Сr2(SO4)3и четырех молекул K2SO4необходимо 7 молекул серной кислоты. Ионы водорода в кислой среде образуют воду. Количество молекул воды определяется количеством атомов водорода, содержащихся в 7 молекулах серной кислоты. Таким образом, законченное уравнение этой реакции имеет вид
6KJ + K2Cr2 O7+ 7H2SO4= 3J2+ Cr2(SO4)3+4K2SO4+ 7H2O.
Правильность составления уравнения реакции определяется подсчетом атомов кислорода в левой и правой частях уравнения реакции: 35 = 35.
В некоторых случаях роль среды играет окислитель или восстановитель. Тогда в уравнении реакции формулу окислителя (или восстановителя) полезно написать дважды.
В качестве примера рассмотрим окисление меди разбавленной азотной кислотой. Азотная кислота здесь играет двойную роль – роль окислителя и среды:
3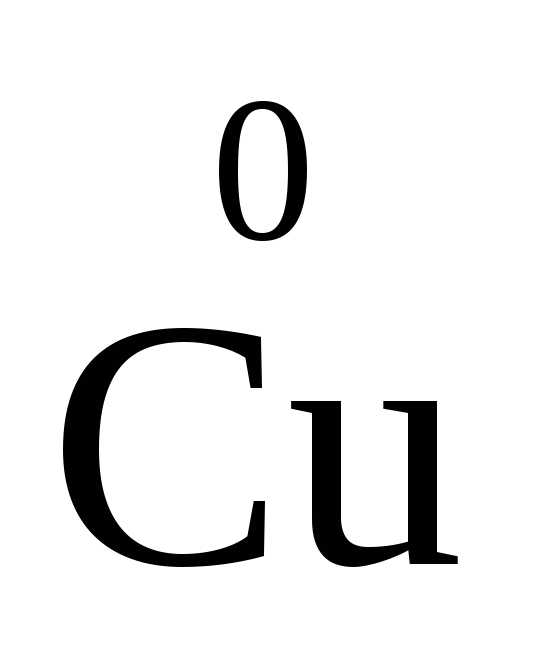 + 2H
+ 2H O3
+ 6HNO3 (среда)
= 3
O3
+ 6HNO3 (среда)
= 3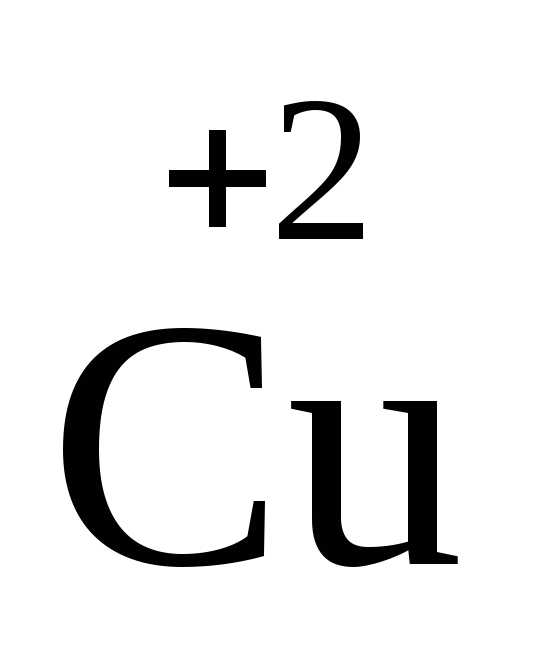 (NO3)2
+ 2
(NO3)2
+ 2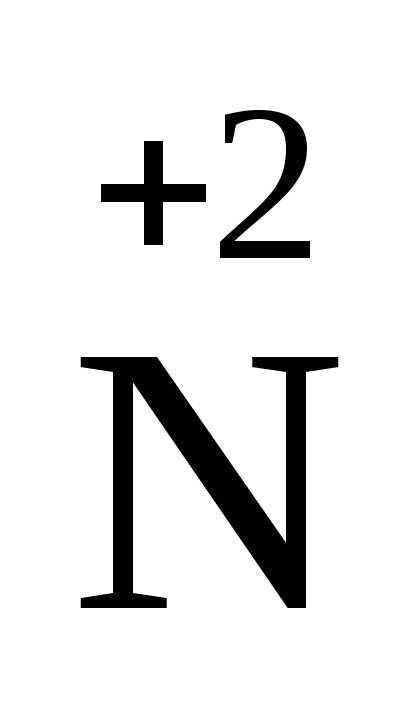 O
+ 4H2O;
O
+ 4H2O;
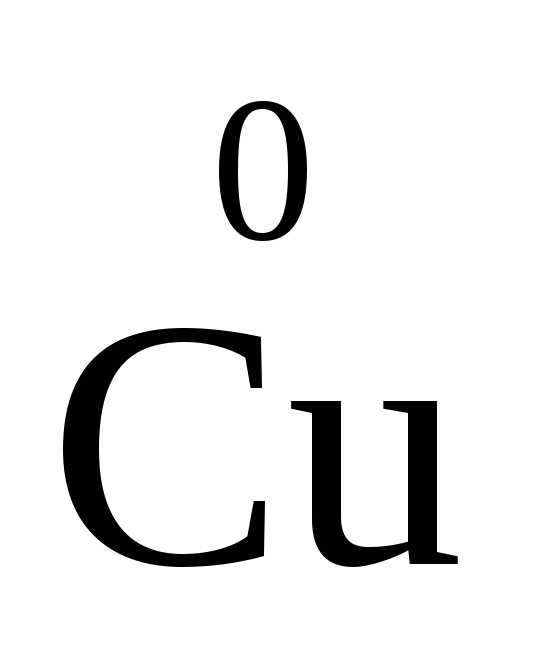 — 2ē =
— 2ē =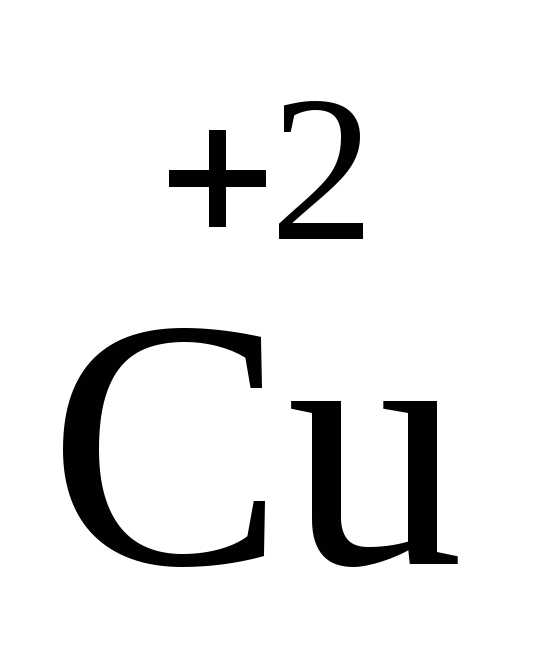 3
3
6
 + 3ē =
+ 3ē =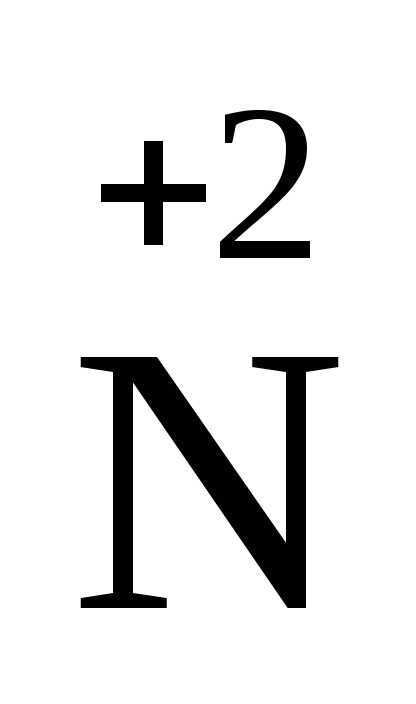 2
2
Две молекулы азотной кислоты играют роль окислителя. В этих молекулах изменяется степень окисления азота. Кислотные остатки шести других молекул связываются с образовавшимися катионами Cu2+.
Молекулы некоторых веществ могут проявлять как восстановительные, так и окислительные функции. В этом случае возможны реакции самоокисления-самовосстановления, или диспропорционирования. Примером такой реакции является реакция разложения азотистой кислоты на оксид азота (II), азотную кислоту и воду. При составлении уравнения реакции этого типа формулу одного и того же вещества полезно записать дважды:
H O2
+ 2H
O2
+ 2H O2
= H
O2
= H O3
+ 2O
+ H2O;
O3
+ 2O
+ H2O;
 — 2ē =
— 2ē =  1
1
 + 1ē =
+ 1ē =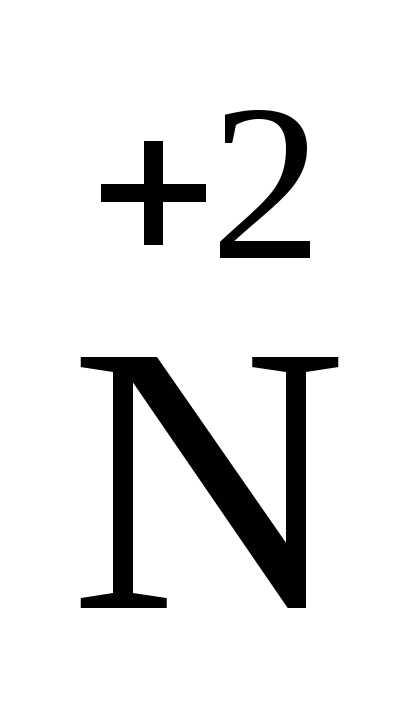 2
2
Как следует из этого уравнения одна молекула HNO2является восстановителем, превращаясь в одну молекулу HNO3, а две другие ее молекулы выступают в роли окислителя, образуя две молекулы NO.
Существуют вещества, в молекулах которых есть атомы, способные отдавать, и атомы, способные принимать электроны. Разложение этих веществ представляет собой реакцию внутримолекулярного окисления-восстановления:
(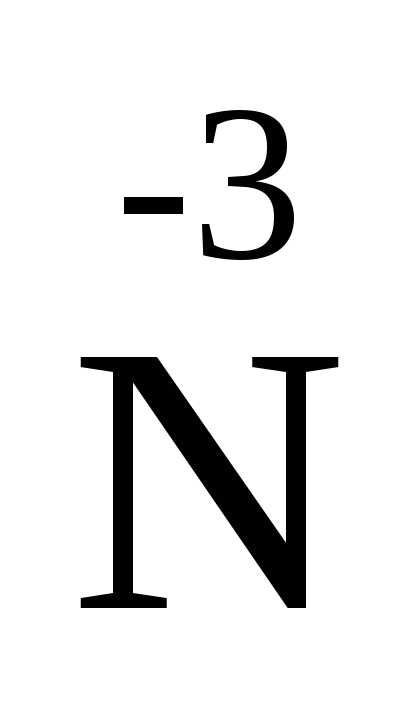 H4)2
H4)2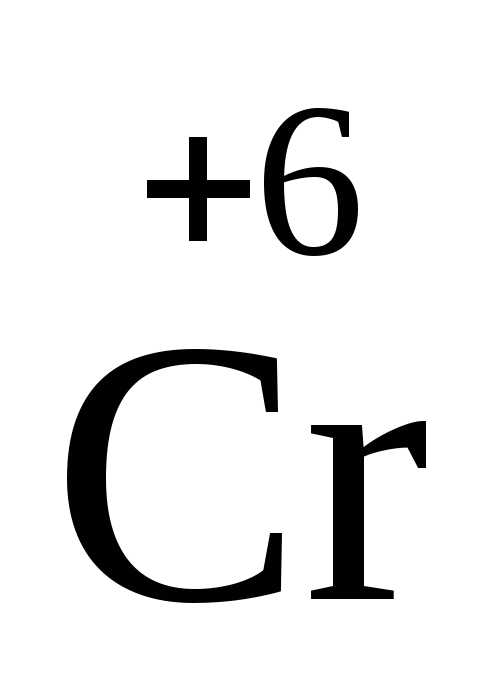 2O7
=
2O7
=
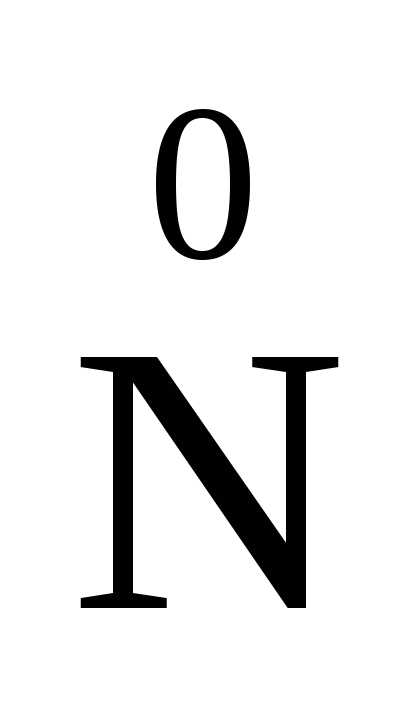 2
+
2
+
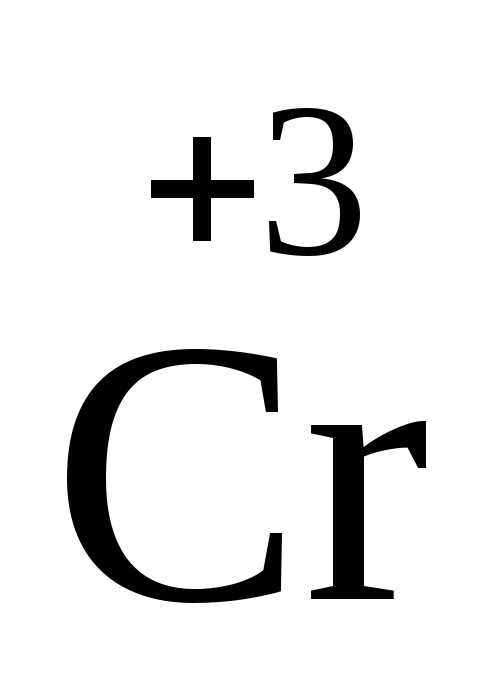 2O3
+ 4H2O;
2O3
+ 4H2O;
2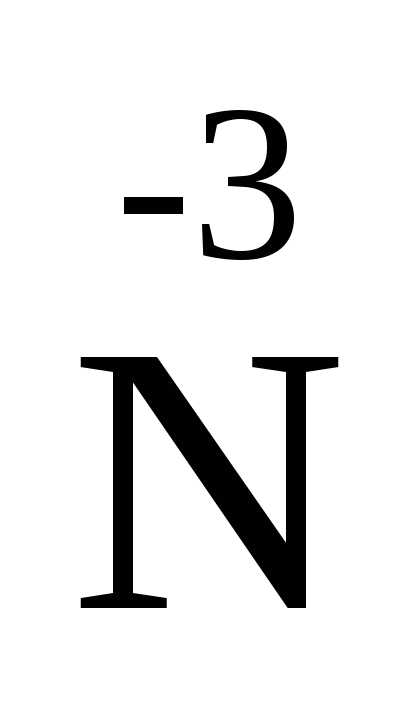 – 6ē =
– 6ē =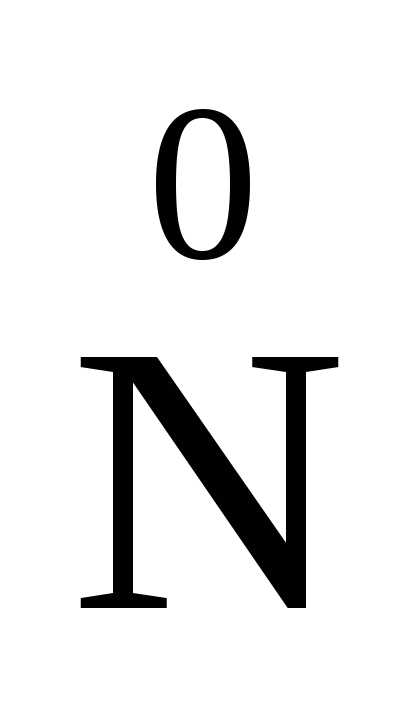 2
6 1
2
6 1
2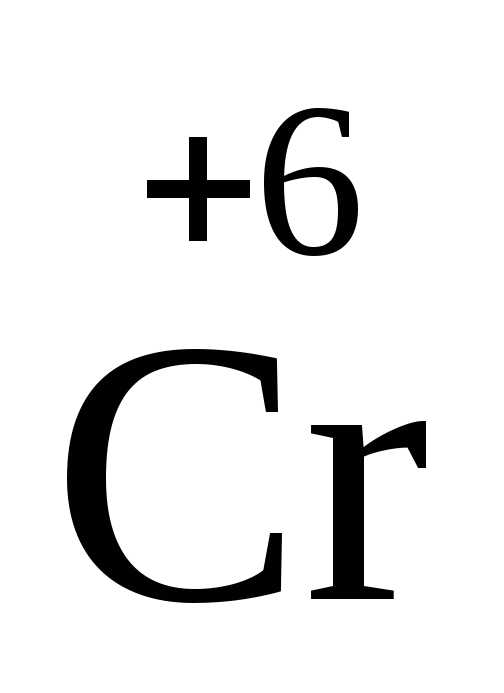 + 6ē = 2
+ 6ē = 2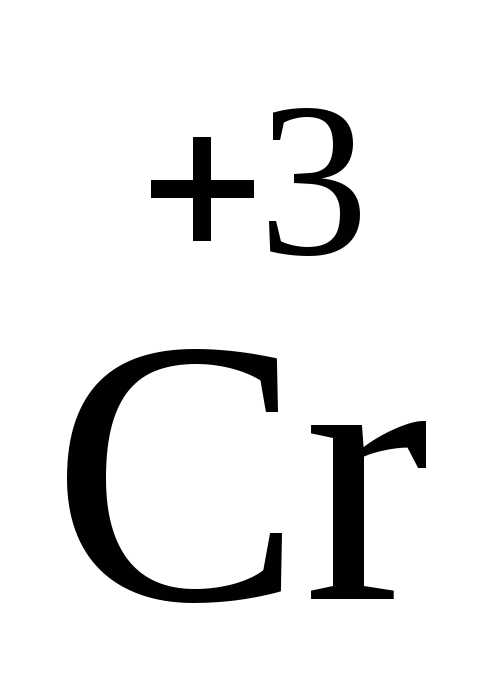 6 1
6 1
В этой реакции азот в ионе NH4+отдает электроны хрому в дихромат-ионе.
studfiles.net
Урок изучения нового материала по химии «Фосфор и его соединения»
Разделы: Химия
Цель урока:
- дать общую характеристику фосфора по положению в ПСХЭ,
- рассмотреть аллотропные модификации фосфора, его физические и химические свойства;
- изучить кислородсодержащие соединения фосфора: оксид фосфора (V), фосфорную кислоту
- развивать познавательную активность учащихся
Оборудование и реактивы:
- Инструктивные карточки по теме «Фосфор и его соединения»
- Красный фосфор, лакмус, вода, сосуд для сжигания веществ, спички, ложка для сжигания веществ, К3РО4, AgNO3, пробирки.
- Учебник: автор — О.С.Габриелян.
Тип урока: урок изучения нового материала.
Методы: словесно-наглядные.
Ход урока
I проверка домашнего задания: (у доски)
1 .Перечислить оксиды азота, указав степени окисления и их классификацию.
2. Рассказать о химических свойствах азотной кислоты
а) свойства характерные для всех кислот
б) специфические свойства азотной кислоты
3. Записать у доски общую схему разложения нитратов.
Работа по карточкам( 5 человек)
| Вариант 1 Закончить уравнения реакций, к первой реакции составить молекулярные и ионные уравнения, ко 2 и 3 реакциям — ОВР: HNO3 + Na2CO3 -> N2 + Cа -> AgNO3 -> |
Вариант 2 Закончить уравнения реакций, к первой реакции составить молекулярные и ионные уравнения, ко 2 и 3 реакциям — ОВР: HNO3 + Ca(OH)2 -> N2 + H2 -> KNO3 -> |
| Вариант 3 Закончить уравнения реакций, к первой реакции составить молекулярные и ионные уравнения, ко 2 и 3 реакциям — ОВР: HNO3 + Al2O3 -> N2 + Li -> Zn(NO3)2 -> |
Вариант 4 Закончить уравнения реакций, к первой реакции составить молекулярные и ионные уравнения, ко 2 и 3 реакциям — ОВР: HNO3 + K2SiO3 -> N2 + O2 -> Hg(NO3)2 -> |
II изучение нового материала
А) общая характеристика фосфора по ПСХЭ Менделеева Д.И.
У доски 1 ученик: +15Р 2е—, 8е—, 5е—; ковалентная неполярная связь.
Для простого вещества фосфора характерно явление аллотропии.
Б) аллотропные модификации фосфора, работа с карточками:
| Виды фосфора | Белый | Красный | Чёрный |
| Тип кристаллической решётки | Р4 -молекулярная | Р-атомная | Р-атомная |
| Физические свойства | Мягкое кристаллическое вещество, не растворяется в воде, растворяется в С2 (сероуглерод), яд | Порошок, не растворяется в воде и сероуглероде, неядовит | По внешнему виду похож на графит, жирный на ощупь, полупроводник, неядовит |
| Химические свойства | Окисляется на воздухе и светится в темноте 4Р+5О2 -> 2Р2О5 | 2600С 4Р+502 -> 2Р2О5 не светится в темноте |
4900С 4Р+502 -> 2Р2О5 не светится в темноте |
В) химические свойства фосфора:
Так как фосфор находится в 3 периоде, по сравнению с азотом у него больший атомный радиус, а это говорит о том, что у данного элемента окислительные свойства выражены слабее, а восстановительные сильнее, чем у азота. Степень окисления высшая +5, низшая -3.
Фосфор в реакциях чаще всего выступает как восстановитель (с кислородом, галогенами, бертолетовой солью, азотной кислотой), окислительные свойства проявляет в реакциях с металлами.
Далее учащиеся работают с инструктивными картами.
Задание: составить ОВР, расставить коэффициенты:
| Фосфор-восстановитель | Фосфор-окислитель |
| 1. Р+ О2 -> Р2О5 | 1. Мg + P -> Mg3P2 |
| 2. Р + Cl2 -> PCl5 | 2. Na + P -> Na3P |
| 3. P + KClO3 -> Р2О5 + KCl |
Г) соединения фосфора
Учитель демонстрирует горение фосфора в ложечке, которую вносит в колбу. После заполнения колбы белым дымом приливает туда немного воды и взбалтывает до полного растворения оксида фосфора. Затем добавляет в колбу несколько капель индикатора — лакмуса.
После демонстрации опыта учащимся задаются вопросы:
- Что за дым образуется в колбе при горении фосфора?
- Хорошо или плохо растворяется образовавшийся оксид фосфора (V) в воде?
- Какое вещество при этом образуется и что нам показал индикатор?
Ответ:
При горении фосфора мы получили кислотный оксид Р2О5, далее добавив воду в колбу мы растворили в ней наш оксид и получили фосфорную кислоту Н3РО4, добавив индикатор мы доказали наличие кислой среды.
Ортофосфорная кислота — трехосновная. Это твердое вещество, хорошо растворимое в воде, кислота средней силы, образует несколько видов солей, которые мы будем изучать на следующем уроке.
Как и все кислоты, фосфорная может взаимодействовать:
- со щелочами NaOH, KOH
- с основными оксидами Na2O, Li2O
- с металлами стоящими в ряду активности до водорода Mg, Al
- с солями K2CO3
Дома привести примеры данных реакций в тетради!
Для определения фосфат-ионов существует качественная реакция с использованием нитрата серебра, при этом выпадает осадок жёлтого цвета, который хорошо растворяется в сильных кислотах. Демонстрация опыта учителем.
Запись уравнения реакции на доске (ученик):
Н3РО4 + AgNO3 = Ag3РО4 v + Н NO3
3Ag+ + РО4 3- = Ag3РО4 v жёлтый фосфат серебра
Заключительная часть
Д/з, прочитать параграф, выполнить задания в тетради по фосфорной кислоте.
Рефлексия: тест по вариантам из 5 вопросов
| Тест по теме «Фосфор и его
соединения» Вариант 1 1.Фосфор находится в группе номер: 2. Высшая степень окисления у фосфора равна: 3. Какие свойства у фосфора выражены сильнее:
4. Фосфор является восстановителем в реакции с:
5. При взаимодействии H3РO4 с KOH, получается:
|
Тест по теме «Фосфор и его
соединения» Вариант 2 1.На последнем внешнем энергетическом уровне у фосфора электронов: 2. Низшая степень окисления у фосфора равна: 3. Какие свойства у фосфора выражены слабее:
4. Фосфор является окислителем в реакции с:
5. При взаимодействии H3РO4 с Nа2O, получается:
|
3.03.2011
Поделиться страницей:xn--i1abbnckbmcl9fb.xn--p1ai
Элементы третьего периода как окислители и восстановители
Если сделать обзор окислительно-восстановительных свойств элементов третьего периода, то можно заметить плавный переход от сильного восстановителя (натрий) через восстановители и окислители средней силы (фосфор и сера) до сильного окислителя (хлор, восстановительные свойства которого выражены очень слабо). Такой переход полностью согласуется с изменением энергии ионизации и распределением электронов в атоме. Закономерности такого рода помогают запомнить особенности химического поведения элементов и предсказать свойства других элементов периодической таблицы. [c.551]В результате этого в пределах каждого периода по мере повы> шения порядкового номера элемента восстановительные свойства простых веществ понижаются, а окислительные свойства повышаются и становятся максимальными у галогенов. Например, из элементов третьего периода натрий — самый активный восстановитель, а хлор — самый активный окислитель. [c.151]
ЭЛЕМЕНТЫ ТРЕТЬЕГО ПЕРИОДА КАК ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ [c.545]
Следовательно, в этих реакциях фосфор проявляет себя и как восстановитель и как окислитель. Такое двойственное поведение можно объяснить на основе электронной конфигурации и энергии ионизации атома фосфора. Тот факт, что энергия ионизации фосфора выше, чем у предыдущих элементов третьего периода, указывает на то, что он является более слабым восстановителем, чем, например, алюминий. Сочетание заметного сродства к электрону с наличием трех заполненных наполовину Зр-орбит объясняет появление слабых окислительных свойств у фосфора. Поскольку фосфор не может легко терять или приобретать электроны, он не является ни сильным восстановителем, ни сильным окислителем. [c.549]
В предыдущем разделе мы видели, что изменение реакционной способности элементов третьего периода основано на изменении электронных конфигураций атомов. Элементы, имеющие высокую энергию ионизации и свободные валентные орбиты, обычно присоединяют электроны и действуют как окислители. Элементы, у которых энергия ионизации заметно ниже, имеют тенденцию отдавать электроны и действуют как восстановители. Теперь мы попытаемся объяснить кислотно-основные свойства гидроокисей элементов третьего периода также на основе электронного строения атома. Подобную проблему мы уже рассматривали в главе 19 для кислородсодержащих кислот хлора. В этой главе мы опять столкнулись с соединениями, содержащими группу [c.551]
Металлы чаще всего обладают восстановительными свойствами. В периодах с повышением порядкового номера элемента восстановительные свойства простых веществ понижаются, а окислительные возрастают и становятся максимальными у галогенов. Например, в третьем периоде натрий — самый активный восстановитель, а хлор — самый активный окислитель. У элементов главных подгрупп с повышением порядкового номера усиливаются восстановительные свойства и ослабевают окислительные. Наиболее сильные восстановители — щелочные металлы, наиболее активные из них Fr и s. Лучшие окислители — галогены. [c.320]
В периодах с повышением порядкового номера элемента восстановительные свойства простых веществ понижаются, а окислительные возрастают и становятся максимальными у галогенов. Так, например, в третьем периоде натрий — самый активный в периоде восстановитель, а хлор — самый активный в периоде окислитель. [c.134]
Окислительно-восстановительные свойства. Наиболее электроположительные элементы, щелочные металлы являются самыми сильными восстановителями, наиболее электроотрицательные элементы проявляют свойства сильных окислителей. По периодам ослабевают восстановительные и усиливаются окислительные свойства элементов. Например, в третьем периоде восстановительная способность уменьшается в последовательности Ма, Mg, А1, 81, Р окислительная способность растет в последовательности Р, 8, С1. Окислительно-восстановитель-ные свойства элементов зависят от числа проявляемых ими степеней окисления. По периоду число проявляемых элементами степеней окисления возрастает Ма проявляет две степени окисления, а С1 — семь (табл. 10.5). [c.139]
Атомам в соединениях и комплексных ионах приписывают степень окислении, чтобы иметь возможность описывать перенос электронов при химических реакциях. Составление уравнения окислительно-восстановительной реакции основывается на требовании выполнения закона сохранения заряда (электронов). Высшая степень окисления атома, как правило, увеличивается с ростом порядкового номера элемента в пределах периода. Например, в третьем периоде наблюдаются такие степени окисления На + ( + 1), Мя» + ( + 2), А1 -» ( + 3), 81Си( + 4), РР5(5), 8Рв( + 6) и СЮЛ + 7). Степень окисления атома часто называется состоянием окисления атома (или элемента) в соединении. Реакции, в которых происходят изменения состояний окисления атомов, называются окислительно-восстановительными реакциями. В таких реакциях частицы, степень окисления которых возрастает, называются восстановителями, а частицы, степень окисления которых уменьшается, называются окислителями. В окислительно-восстановительной реакции происходит перенос электронов от восстановителя к окислителю. Частицы, подверженные самопроизвольному окислению — восстановлению, называются диспропорционирующими. В полном уравнении окислительно-восстановительной реакции суммарное число электронов, теряемых восстановителем, равно суммарному числу электронов, приобретаемых окислителем. Грамм-эквивалент окислителя или восстановителя равен отношению его молекулярной массы к изменению степени окисления в рассматриваемой реакции. Нормальность раствора окислителя или восстановителя определяется как число его эквивалентов в 1 л раствора. Следовательно, нормальность раствора окислителя или восстановителя зависит от того, в какой реакции участвует это вещество. [c.456]
chem21.info
