Химик.ПРО — Число частиц (метан)
Рудничный газ или метан (CH4). Рассчитайте объем, массу и число частиц, если количество вещества равна 3 моль.
Решение задачи
Объем метана (CH4) найдем по формуле, устанавливающей связь между объемом и химическим количеством вещества:
Получаем:
V (CH4) = 3 моль ⋅ 22,4 л/моль = 67,2 (л).
Массу метана (CH4) найдем по формуле, устанавливающей связь между массой и химическим количеством вещества:
Используя таблицу Менделеева, рассчитаем молярную массу метана (CH4):
M (CH4) = 12 + 4⋅1 = 16 (г/моль).
Получаем:
m (CH4) = 3 моль ⋅ 16 г/моль = 48 (г).
Число частиц найдем по формуле, устанавливающей связь между числом частиц и химическим количеством вещества:
Постоянная Авогадро (NА) указывает число структурных единиц в одном моле вещества:
Получаем:
N (CH4) = 3 моль ⋅ 6,02 ⋅ 1023 моль-1 = 18,06 ⋅ 1023.
Ответ:
объем метана равен 67,2 литра;
масса метана равна 48 грамм;
число частиц метана равно 18,06 ⋅ 1023.
Похожие задачи по химии
himik.pro
Метан | Наука | FANDOM powered by Wikia
https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D1%82%D0%B0%D0%BD
Мета́н — простейший углеводород, бесцветный газ без запаха, химическая формула — CH4. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты со специфическим «запахом газа».
Основной компонент природных (77—99 %), попутных нефтяных (31—90 %), рудничного и болотного газов (отсюда другие названия метана — болотный или рудничный газ). В анаэробных условиях (в болотах, переувлажнённых почвах, рубце жвачных животных) образуется биогенно. Получается также при коксовании каменного угля, гидрировании угля.
Химические свойства Править
Горит синим пламенем. С воздухом образует взрывоопасные смеси.горение метана
Вступает с галогенами в реакции замещения (например, CH4 + ЗСl2= СНСl3+ ЗНСl).
Соединения включения Править
Метан образует соединения включения — газовые гидраты, широко распространенные в природе.
Сырьё для получения многих ценных продуктов химической промышленности — формальдегида, ацетилена, сероуглерода, хлороформа, синильной кислоты, сажи. Для получения водяного газа (CH4 + Н2О = СО + ЗН2). Применяется как топливо.
Метан и экология Править
Является парниковым газом. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность метана составит 21 единицу (Газ на дне океана. В.Фрадкин.).
Шаблон:Алканы
ru.science.wikia.com
Формула метана в химии
Определение и формула метана
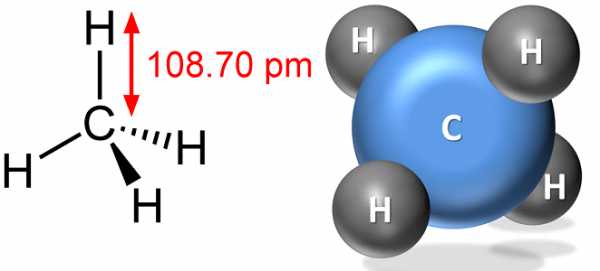
Формула –
Молярная масса равна г/моль.
Физические свойства – в обычных условиях бесцветный газ, не имеющий запаха.
Плохо растворяется в воде.
Известный физик А. Вольта обнаружил метан в болоте в 1776 году.
Метан является главным компонентом природного газа, он содержится в больших количествах в атмосфере газовых гигантов.
Химические свойства метана
Получение
В лабораторных условиях метан получают нагреванием безводного гидроксида натрия с ледяной уксусной кислотой:
Другой способ получения основывается на сплавлении ацетата натрия с :
Применение
Метан широко используется в качестве промышленного и бытового газа. химически перерабатывается главным образом в ацетилен, газовую сажу, фторо- и хлоропроизводные.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Метан — это… Что такое Метан?
Метан — Метан … Википедия
МЕТАН — (СН4), УГЛЕВОДОРОД без цвета и запаха, простейший АЛКАН (или парафин). Метан является основным компонентом ПРИРОДНОГО ГАЗА, из которого метан и получают, и РУДНИЧНОГО ГАЗА. Метан взрывается, когда его смешивают с кислородом и поджигают. Этот газ… … Научно-технический энциклопедический словарь
МЕТАН — Метиловый водород, болотный газ, состоящий из двух атомов углерода и четырех атомов водорода. Объяснение 25000 иностранных слов, вошедших в употребление в русский язык, с означением их корней. Михельсон А.Д., 1865. МЕТАН метиловый водород,… … Словарь иностранных слов русского языка
метан — а, м. méthane m. англ. methane <гр. вино. Простейшее соединение водорода с углеродом; болотный или рудничный газ. БАС 1. Метановый ая, ое. Лекс. Брокг. метан; Уш. 1938: мета/н; БСЭ 2: мета/новое брожение … Исторический словарь галлицизмов русского языка
МЕТАН — Ch5, бесцветный газ, tкип 164 .C. Основной компонент природных (77 99%), попутных нефтяных (31 90%), рудничного и болотного газов. Горит бесцветным пламенем. С воздухом образует взрывоопасные смеси. Сырье для получения многих ценных продуктов… … Большой Энциклопедический словарь
МЕТАН — МЕТАН, метана, мн. нет, муж. (от греч. methy мед) (хим.). То же, что болотный газ (см. болотный). Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
МЕТАН — МЕТАН, а, муж. Горючий болотный или рудничный газ без цвета и запаха, соединение углерода с водородом. | прил. метановый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Метан — Ch5, насыщенный углеводород парафинового ряда. В стандартных условиях М. газ без цвета к запаха, относится к пожаро и взрывоопасным веществам. Молекулярная масса 16,04 кг/кмоль, температура плавления 90,66 К, температура кипения 111,67 К,… … Энциклопедия техники
метан — сущ., кол во синонимов: 4 • алкан (37) • газ (55) • топливо (48) • … Словарь синонимов
МЕТАН — (СН4) простейший углеводород; газ без цвета и запаха; легче воздуха; смесь М. с воздухом взрывоопасна. Образуется в природе при разложении органических веществ без доступа воздуха (напр., на дне болот, в рудниках отсюда названия М.: болотный газ … Российская энциклопедия по охране труда
dic.academic.ru
Решение. Молярная масса молекулы метана равна
Задача 1.17. Найти молярную массу и массу молекулы метана.
Решение.
Молярная масса молекулы метана равна:
= 12+4 = 16 г/моль
Масса молекулы метана:
M = MC + 4MH = = 26.58 кг
Задача 2.20. После того как в комнате включили электрокамин, температура воздух повысилась от 17 до 22 при неизменном давлении. На сколько процентов уменьшилось число молекул воздуха в комнате?
Решение.
Считая воздух идеальным газом, можно записать:
Количество молекул в комнате пропорционально объему, поэтому:
Уменьшение произошло на:
Задача 3.27. Сосуд, содержащий 10 л воздуха при давлении 1 МПа, соединяют с пустым сосудом вместимостью 4 л. Найти давление, установившееся в сосудах. Процесс изотермический.
Решение.
Уравнение изотермического процесса:
pV = const
Отсюда:
= = 714.3 кПа
Задача 4.54. В цилиндре под поршнем находится кислород. Определить массу кислорода, если известно, что работа, совершаемая при нагревании газа от 273 до 473 К, равна 16 кДж. Трение не учитывать.
Решение.
Первое начало термодинамики дает:
Откуда:
Где
подведенное тепло
– изменение внутренней энергии
Будем считать, для определенности, что процесс нагрева происходит при постоянном давлении. Тогда:
=
Отсюда:
Масса кислорода будет равной:
число степеней свободы (для кислорода i = 5).
г
Задача 5.23. Медную деталь, нагретую до 993 К, погрузили в 1.75 кг воды при температуре 291 К. Вся вода при этом нагрелась до 373 К и 75 г ее обратилось в пар. Определить массу детали. Потерями энергии пренебречь. Решение.
Запишем уравнение теплового баланса.
Отсюда:
= 0.45 кг
Задача 5.43. Сухой термометр психрометра показывает 21, а влажный – 16. Какова относительная влажность воздуха и сколько водяного пара содержится в 1 м3 воздуха.
Решение.
Разность показаний сухого и увлажненного термометра составляет 5. По психрометрической таблице находим относительную влажность воздуха: .
Объем водяного пара в 1 кубометре воздуха составляет:
м3
Задача 6.22. Найти массу ртути, опустившейся в капиллярной трубке при погружении ее в ртуть. Диаметр канала трубки 0.1 мм.
Решение.
Масса ртути равна:
Откуда:
коэффициент поверхностного натяжения ртути
= 15.1 мкг
Задача 7.18. Определить площадь поперечного сечения стального троса подъемного крана, поднимающего равномерно груз в 6 т, если предел прочности материала 780 Мпа при запасе прочности, равном 10.
Решение.
При условии 10-кратного запаса прочности, допустимое напряжение 78 МПа. При равномерном подъеме груза:
Откуда:
= 753.85 мм2
Задача
8.29. На сколько повысилась температура
алюминиевого листа, если в процессе
нагревания его площадь увеличилась на
3200 мм
Решение.
При нагревании тела имеют тенденцию к расширению. Если обозначить – температурный коэффициент линейного расширения, то можно записать:
Отсюда:
= = 35
Задача 9.22. Металлическому шарику радиусом 5 см передали заряд 1.57 Кл. Какова поверхностная плотность заряда на шаре.
Решение.
Поверхностная плотность заряда есть отношение самого заряда к площади поверхности:
= = 500 нКл/м2
Задача 9.53. Рассматривая Землю как шар радиусом 6400 км, определить ее электрический заряд и потенциал, если напряженность земного поля вблизи ее поверхности 130 В/м.
Решение.
gigabaza.ru
Моль, молярная масса | Учеба-Легко.РФ

 В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль — это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро (NA= 6,02Ч1023 моль-1).
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12С:
Таким образом, 1 моль вещества содержит 6,02 Ч 1023 частиц этого вещества.
Исходя из этого, любое количество вещества можно выразить определенным числом молей n (ню). Например, в образце вещества содержится 12,04 Ч 1023 молекул. Следовательно, количество вещества в этом образце составляет:
В общем виде:
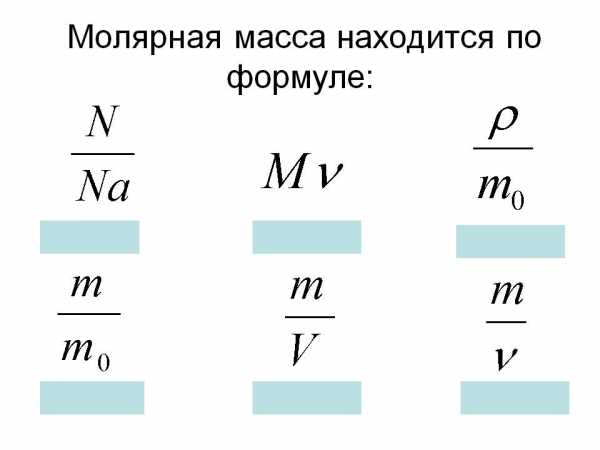
где N — число частиц данного вещества;NA — число частиц в одном моле вещества (постоянная Авогадро).
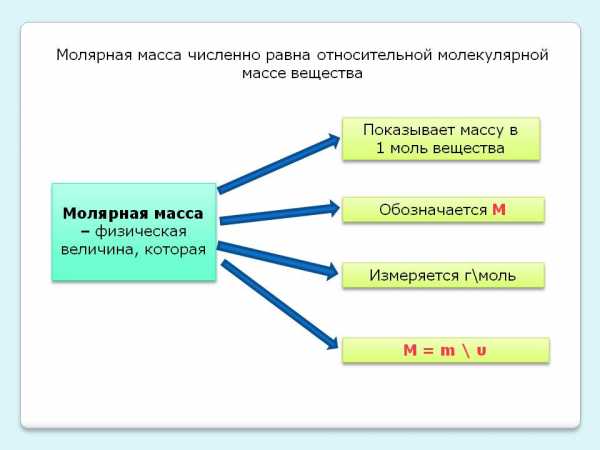
Молярная масса вещества (M) – масса одного моля этого вещества.
По величине она равна относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar). Молярная масса имеет размерность г/моль.
Например, молярная масса метана CH4 определяется следующим образом:
Мr(CH4) = Ar(C) + 4 Ar(H) = 12+4 =16
M(CH4)=16 г/моль, т.е. 16 г CH4 содержат 6,02Ч1023 молекул.
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) n, по формуле:
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
или найти массу вещества по числу молей и молярной массе:
m = n Ч M .
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar.
Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
Пример:
Вычислить массы метана CH4 и этана С2H6, взятых в количестве
n = 2 моль каждого.
Молярная масса метана равна 16 г/моль, а этана С2Н6 – 30 г/моль. Отсюда:
m(CH4) = 2 моль Ч 16 г/моль = 32 г;m(С2Н6) = 2 моль Ч 30 г/моль = 60 г.
Таким образом, моль — это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
n(CH4) = n(С2Н6), но m(CH4) < m(С2Н6)
Вычисление n используется практически в каждой расчетной задаче.
uclg.ru
|
Таблица. Молярная масса газов (г/моль = кг/кмоль) от азота до хлористого этила.
|
tehtab.ru
