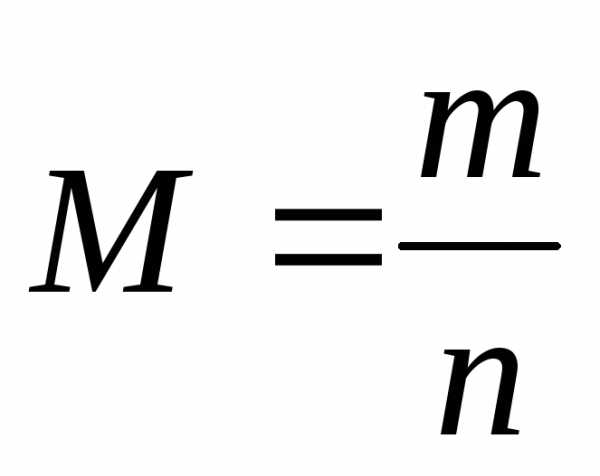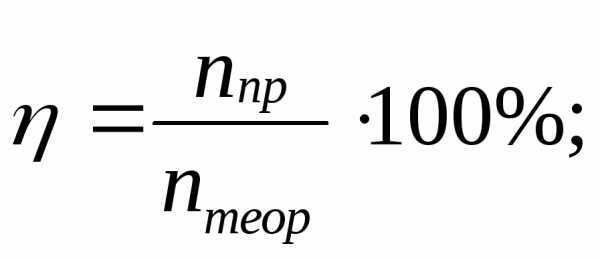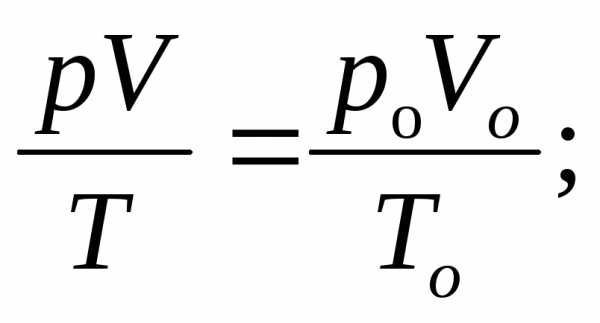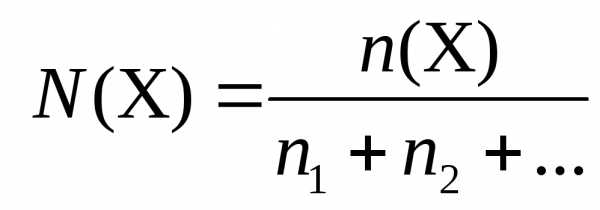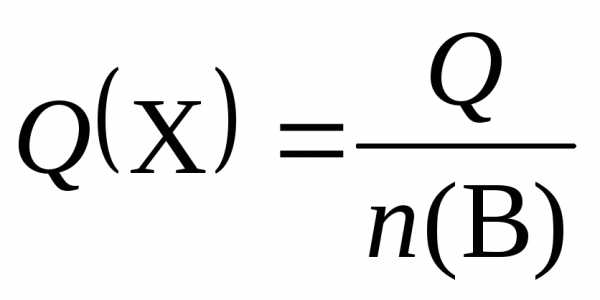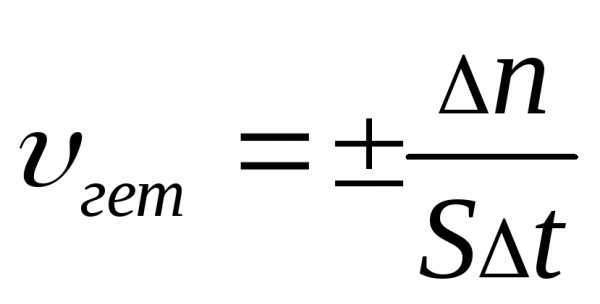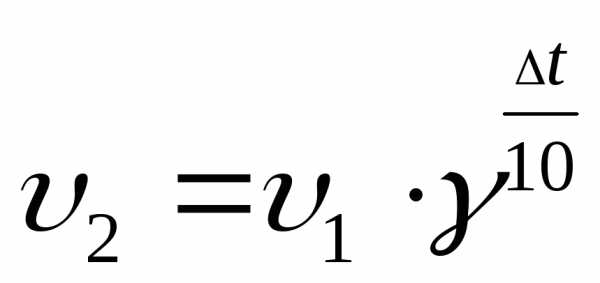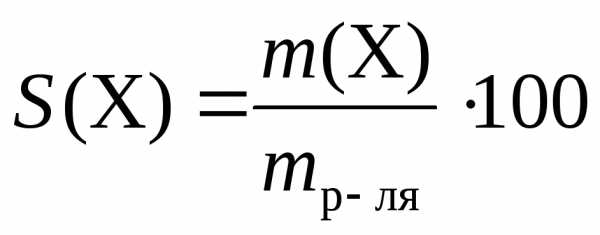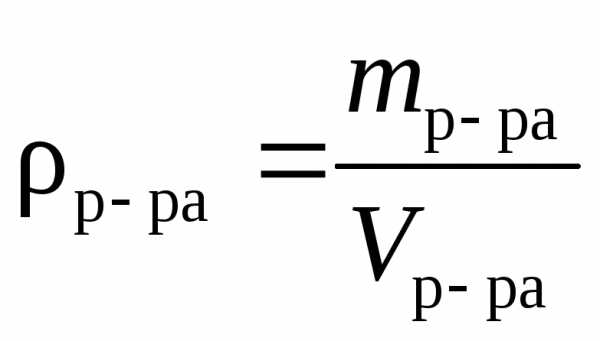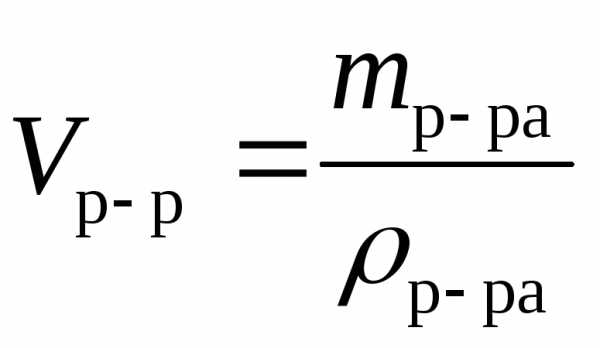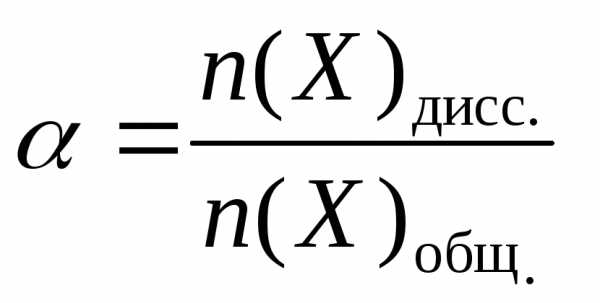Основные формулы для решения задач по химии
05-Авг-2012 | комментарий 381 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов)Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества.
Обозначается как Mr. Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 г\моль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём
Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=m\Mr
n=V\22.4 (л\моль)
Масса веществаm (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (л\моль)
или вот еще удобная табличка:

Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
_________________________________________________________________________________________________
Еще вам могут понадобиться:
- в ЕГЭ это вопрос А27
- А28
- задачи части С — 4 и 5
Категории: |
Обсуждение: «Основные формулы для решения задач по химии»
distant-lessons.ru
Формулы для решения задач по химии ЕГЭ 2019 / Блог :: Бингоскул
- Блог
- →
- Формулы для решения задач по химии ЕГЭ 2019
Формулы для расчета:
- v — количества моль, моль
- m — масса, г
- M — молярная масса, г/моль
- C — концентрация, моль/л
- N — количество атомов, молекул
- NA — число Авогадро
- V — объем, л
- Vm — молярный объем = 22,4 л/моль
- p — плотность
- D — относительная плотность
Число Авогадро NA
1 моль = 6,02 · 1023 частиц
Закон Авогадро: 1 моль идеального газа при нормальных условиях имеет один и тот же объём Vm = 22,413 996(39) л
Количество вещества n (моль)
n=m\Mr
n=V\22.4 (л\моль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n • 22.4 (л\моль)
Масса
- m = v ⋅ M
- m = N/NA⋅ M
- m = V : Vm⋅ M
- m = C ⋅ M ⋅ V
Количество вещества
- v = m : M
- v = V : Vm
- v = N : NA
Объем
- V = v⋅Vm
- V = m : M ⋅ Vm
- V = m : P
Число частиц
- N0 = m/m0
- N0 = v ⋅ NA
- N0 = m/M ⋅ NA
- N0 = V/Vm ⋅ NA
Молярный объем
- Vm = V : v
- Vm = V ⋅ M : m
- Vm = M : p
Молярная масса
- M = Dh3 ⋅ Mh3
- M = m : v
Относительная молекулярная масса
- Mr = 2Dh3
- Mr =32DO2
- Mr = 29Dвозд
Решай с ответами:
bingoschool.ru
Основные Химические формулы для решения задач.
| № | Количественные характеристики вещества | Обозначение | Единицы измерения | Формула для расчета |
|---|---|---|---|---|
| 1 | Плотность вещества | ρ | кг/м³ | ρ = m / V(Массу делим на объем вещества) |
| 2 | Относительная атомная масса элемента | Аr | — | Ar = ma / u см. в периодической система химических элементов |
| 3 | Атомная единица массы | u а.е.м. |
кг | u = 1/12 * ma (12C) const = 1.66*10-27 |
| 4 | Масса атома (абсолютная) | ma | кг | ma = Ar * u |
| 5 | Относительная молекулярная (формульная) масса вещества | Mr | — | Mr (AxBy)=m(AB) / u Mr(AxBy)=x*Ar(A) + y*Ar(B) |
| 6 | Масса молекулы (формульной единицы) | m M | кг | mM = Mr*u |
| 7 | Количество вещества | n | моль | n=m/M n=N/NA n=V/VM |
| 8 | Молярная масса (масса 1 моль вещества) | M | г/моль | M=m/n M=Mr M=Ar (для простых веществ) |
| 9 | Масса вещества | m | г (кг) | m=M*n m=ρ*V |
| 10 | Число структурных единиц | N | атомов, молекул, ионов, частиц, формульных единиц (Ф.Е.) | N=NA*n |
| 11 | Молярный объем — число 1 моль ГАЗООБРАЗНОГО вещества в нормальных условиях (н.у.) | VM | л/моль | const=22,4 |
| 12 | Объем газа при н.у. | V | л | V=VM*n V=m/ρ |
| 13 | Постоянная Авогадро | NA | частиц/моль | const=6,02*1023 |
| 14 | Массовая доля вещества (омега) | ωЭ/В | % | ωЭ/В = (Ar(э) * k) / Mr(В) |
| Формула | Название кислоты | Формула кислотного остатка | Название кислотного остатка |
|---|---|---|---|
| HF | Фтороводород, плавиковая | F— | Фторид |
| HCl | Хлороводород, соляная | Cl— | Хлорид |
| HBr | Бромоводород | Br— | Бромид |
| HI | Йодоводород | I— | Йодид |
| h3S | Сероводород | S2- | Сульфид |
| HCN | Циановодородная | CN— | Цианид |
| HNO2 | Азотистая | NO2— | Нитрит |
| HNO3 | Азотная | NO3— | Нитрат |
| h4PO4 | Ортофосфорная | PO43- | Фосфат |
| h4AsO4 | Мышьяковая | AsO43- | Арсенат |
| h3SO3 | Сернистая | SO32- | Сульфит |
| h3SO4 | Серная | SO42- | Сульфат |
| h3CO3 | Угольная | CO32- | Карбонат |
| h3SiO3 | Кремниевая | SiO32- | Силикат |
| h3CrO4 | Хромовая | CrO42- | Хромат |
| h3Cr2O7 | Дихромовая | Cr2O72- | Дихромат |
| HMnO4 | Марганцовая | MnO4— | Перманганат |
| HClO | Хлорноватистая | ClO— | Гипохлорит |
| HClO2 | Хлористая | ClO2— | Хлорит |
| HClO3 | Хлорноватая | ClO3— | Хлорат |
| HClO4 | Хлорная | ClO4— | Перхлорат |
| HCOOH | Метановая, муравьиная | HCOO— | Формиат |
| Ch4COOH | Этановая, уксусная | Ch4COO— | Ацетат |
| h4C2O4 | Этандиовая, щавелевая | C2O42- | Оксалат |
Нажмите на картинку для увеличения
5urokov.ru
Основные формулы для решения задач
|
Величина и ее размерность |
Соотношение |
|
Атомная масса элемента Х (относительная) |
|
|
Порядковый номер элемента |
Z = N(е–) = N(р +) |
|
Массовая доля элемента Э в веществе Х, в долях единицы, в %) |
|
|
Количество вещества Х, моль |
|
|
Количество вещества газа, моль |
н.у. – р = 101 325 Па, Т = 273 К |
|
Молярная масса вещества Х, г/моль, кг/моль |
|
|
|
m(X) = n(X)M(X) |
|
Молярный объем газа, л/моль, м3/моль |
Vm = 22,4 л/моль при н.у. |
|
Объем газа, м3 |
V = Vm×n |
|
Выход продукта |
|
|
Плотность вещества Х, г/л, г/мл, кг/м3 |
|
|
Плотность газообразного вещества Х по водороду |
|
|
Плотность газообразного вещества Х по воздуху |
М(воздуха) = 29 г/моль |
|
Объединенный газовый закон |
|
|
Уравнение Менделеева-Клапейрона |
PV = nRT, R = 8,314 Дж/моль×К |
|
Объемная доля газообразного вещества в смеси газов, в долях единицы или в % |
|
|
Молярная масса смеси газов |
|
|
Молярная доля вещества (Х) в смеси |
|
|
Количество теплоты, Дж, кДж |
Q = n(X)Q(X) |
|
Тепловой эффект реакции |
Q =–H |
|
Теплота образования вещества Х, Дж/моль, кДж/моль |
|
|
Скорость химической реакции (моль/лсек) |
|
|
Закон действия масс (для простой реакции) |
aA + вB = сС + dD u = kс a(A)с в(B) |
|
Правило Вант-Гоффа |
|
|
Растворимость вещества (Х) (г/100 г растворителя) |
|
|
Массовая доля вещества Х в смеси А + Х, в долях единицы, в % |
|
|
Масса раствора, г, кг |
m(р-р) = m(X) + m(H2O) m(р-р) = V(р-р)(р-р) |
|
Массовая доля растворенного вещества в растворе, в долях единицы, в % |
|
|
Плотность раствора |
|
|
Объем раствора, см3, л, м3 |
|
|
Молярная концентрация, моль/л |
|
|
Степень диссоциации электролита (Х), в долях единицы или % |
|
|
Ионное произведение воды |
K(H2O) = [H+][OH–] |
|
Водородный показатель |
рН = –lg[H+] |
Рекомендуемая литература
Основная:
Кузнецова Н.Е. и др. Химия. 8 кл-10 кл.. – М.: Вентана-Граф, 2005-2007.
Кузнецова Н.Е., Литвинова Т.Н., Левкин А.Н. Химия.11 класс в 2-х частях, 2005-2007 гг.
Егоров А.С. Химия. Новое учебное пособие для подготовки в вузы. Ростов н/Д: Феникс, 2004.– 640 с.
Егоров а.С. Химия: современный курс для подготовки к егэ. Ростов н/д: Феникс, 2011. (2012)– 699 с.
Егоров А.С. Самоучитель по решению химических задач. – Ростов-на-Дону: Феникс, 2000.– 352 с.
Химия/пособие-репетитор для поступающих в вузы. Ростов-н/Д, Феникс, 2005– 536 с.
Хомченко Г.П.,Хомченко И.Г. Задачи по химии для поступающих в вузы. М.: Высшая школа. 2007.–302с.
Дополнительная:
Врублевский А.И. Учебно-тренировочные материалы для подготовки к централизованному тестированию по химии/ А.И. Врублевский –Мн.: ООО «Юнипресс», 2004.– 368 с.
Врублевский А.И. 1000 задач по химии с цепочками превращений и контрольными тестами для школьников и абитуриентов.– Мн.: ООО «Юнипресс», 2003.– 400 с.
Егоров А.С. Все типы расчетных задач по химии для подготовки к ЕГЭ.–Ростов н/Д: Феникс, 2003.–320с.
Егоров А.С., Аминова Г.Х. Типовые задания и упражнения для подготовки к экзамену по химии. – Ростов н/Д: Феникс, 2005.– 448 с.
Единый государственный экзамен 2007. Химия. Учебно-тренировочные материалы для подготовки учащихся/ФИПИ – М.: Интеллект-Центр, 2007.– 272 с.
ЕГЭ-2011. Химия. Учебно-тренировочный комплект под ред. А.А. Кавериной.– М.: Национальное образование, 2011.
Единственные реальные варианты заданий для подготовки к единому государственному экзамену. ЕГЭ.2007. Химия/В.Ю. Мишина, Е.Н. Стрельникова. М.: Федеральный центр тестирования, 2007.–151с.
Каверина А.А. Оптимальный банк заданий для подготовки учащихся. Единый государственный экзамен 2012.Химия. Учебное пособие./ А.А. Каверина, Д.Ю. Добротин, Ю.Н. Медведев, М.Г. Снастина.– М.: Интеллект-Центр, 2012.– 256 с.
Литвинова Т.Н., Выскубова Н.К., Ажипа Л.Т., Соловьева М.В. Тестовые задания в дополнение к контрольным работам для слушателей 10-месячных заочных подготовительных курсов (методические указания). Краснодар, 2004. – С. 18 – 70.
Литвинова Т.Н. Химия. ЕГЭ-2011. Тренировочные тесты. Ростов н/Д: Феникс, 2011.– 349 с.
Литвинова Т.Н. Химия. Тесты к ЕГЭ. Ростов н/Д.: Феникс, 2012. — 284 с.
Литвинова Т.Н. Химия. Законы, свойства элементов и их соединений. Ростов н/Д.: Феникс, 2012. — 156 с.
Литвинова Т.Н., Мельникова Е.Д., Соловьева М.В., Ажипа Л.Т., Выскубова Н.К. Химия в задачах для поступающих в вузы.– М.: ООО «Изд-во Оникс»: ООО «Изд-во «Мир и образование», 2009.– 832 с.
Учебно-методический комплекс по химии для учащихся медико-биологических классов под ред. Т.Н.Литвиновой.– Краснодар.: КГМУ, – 2008.
Химия. ЕГЭ–2008. Вступительные испытания, учебно-методическое пособие / под ред. В.Н. Доронькина. – Ростов н/Д: Легион, 2008.– 271 с
Список сайтов по химии:
1. Alhimik. http://www.alhimik.ru
2. Химия для всех. Электронный справочник за полный курс химии.
http://www.informika.ru/text/database/chemy/START.html
3. Школьная химия – справочник. http://www.schoolchemistry.by.ru
4. Репетитор по химии. http://www. chemistry.nm.ru
Интернет-ресурсы
Alhimik. http://www.alhimik.ru
Химия для всех. Электронный справочник за полный курс химии.
http://www.informika.ru/text/database/chemy/START.html
Школьная химия – справочник. http://www.schoolchemistry.by.ru
http://www.classchem.narod.ru
Репетитор по химии. http://www. chemistry.nm.ru
http://www.alleng.ru/edu/chem.htm — образовательные ресурсы Интернета по химии
http://schoolchemistry.by.ru/ — школьная химия. На этом сайте есть возможность пройти On-line тестирование по разным темам, а также демонстрационные варианты Единого Государственного Экзамена
Химия и жизнь–ХХ1 век: научно-популярный журнал. http://www.hij.ru
studfiles.net
Памятка по химии «Формулы для решения задач» (8 класс)
Формулы для решения задач по химии.
1.Вычисление относительной молекулярной массы вещества:
Mr (H2SO4)=Ar(H)∙2+Ar(S)+Ar(O)∙4=98
2.Вычисление массовой доли элемента в веществе:
3.Выведение молекулярной формулы вещества:
4.Вычисление количества вещества:
а.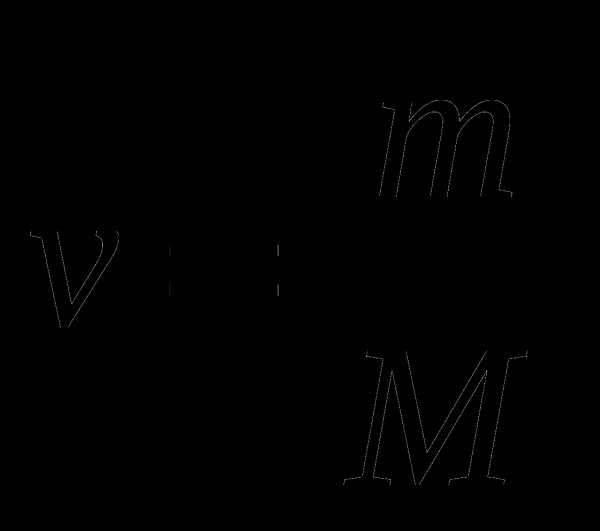
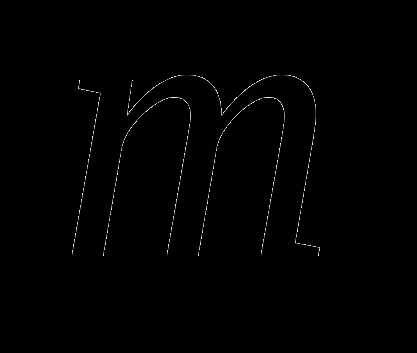 -масса (грамм)
-масса (грамм)
 -молярная масса (грамм/моль)
-молярная масса (грамм/моль)
б. только для газообразных веществ при нормальных условиях ( 00 С, 750 мм. рт. ст.)

 объем (литр)
объем (литр)
 -молярный объем (литр/моль)
-молярный объем (литр/моль)
в. 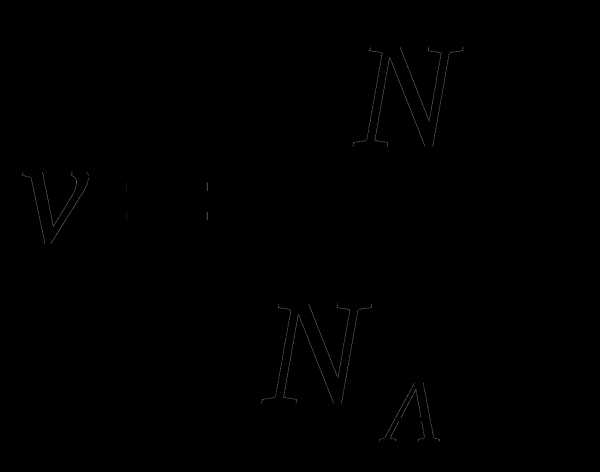
 -число частиц
-число частиц
 — постоянная Авогадро 6 ∙ 1023
— постоянная Авогадро 6 ∙ 1023
5.Массовая доля растворенного вещества:


6.Вычисление массы:

7.Вычисление относительной плотности газов:
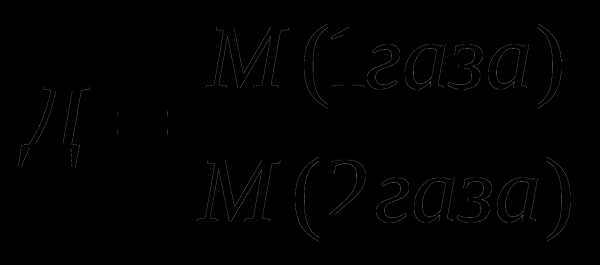
8.Вычисление выхода продукта (%) от теоретически возможного:
infourok.ru
Примеры решения типовых задач на расчёт по формулам и вывод формул
Важно знать! Как научиться решать задачи по химии.
Задача 4.1. Определите массовые доли элементов в сульфате меди CuSO4.
Решение. Записываем формулу сульфата меди и определяем массы элементов в одном моле вещества:
М(С2Н5ОН) = 1 • 64 + 1 • 32 + 4 • 16 = 64 + 32 + 64 = 160 г/моль
Видно, что в 1 моле сульфата меди массой 160 г содержится 64 г меди, 32 г серы и 64 г кислорода.
Отсюда имеем:
w(Cu) = 64 г / 160 г = 0,40, w(S) = 32 г / 160 г = 0,20,
w(О) = 64 г / 160 г = 0,40.
Имея массовые доли элементов в соединении, можно вывести его молекулярную формулу, то есть определить числа атомов в молекулах. Так, для молекулы АxВyСz имеем массовые доли атомов: w(А) = х • М(А) / М,
w(В) = у • М(В) / М,
w(С) = z • М(С) / М,
где М — молярная масса молекулы,
М(А), М(В) и М(С) — молярные массы атомов А, В и С.
Имеем числа атомов элементов в молекуле:
х = w(А) • М / М(А),
у = w(В) • М / М(В),
z = w(С) • М / М(С).
Отсюда соотношение между числами атомов в молекуле равно частному от деления массовых долей элементов на молярные массы их атомов. Так, для молекулы АxВyСz имеем:
х : у : z = w(А) / М(А) : w(В) / М(В) : w(С) / М(С).
При этом массовые доли удобнее выражать в процентах. Вместо массовых долей можно брать пропорциональные им массы элементов для одного и того же количества вещества АxВyСz. Полученное соотношение необходимо преобразовать до получения наименьших целых чисел х, у, z: разделив на наименьшее из них, а при необходимости помножив на нужное число. Полученная формула является простейшей.
Задача 4.2. Соль содержит по массе 6,25% водорода, 43,75% азота и 50,0% кислорода. Определите простейшую формулу соли.
Решение. Для HxNyOz имеем:
х : у : z = 6,25 / 1 : 43,75 / 14 : 50 / 16 = 6,25 : 3,125 : 3,125 = 2 : 1 : 1 = 4 : 2 : 2.
Откуда получаем простейшую формулу Н2NO.
В соли отсутствует металл, но есть азот и водород, значит это соль аммония, и в молекуле должно быть не менее четырех атомов водорода. Поэтому формула соли — Н4N2O2 или NH4NO2.
Задача 4.3. Определите предельный двухатомный спирт, массовая доля углерода в котором равна 0,4737.
Решение. Общая формула членов гомологического ряда предельных двухатомных спиртов — СnН2n+2O2.
Молярная масса равна:
М(СnН2n+2O2) = n • М(С) + (2n + 2) • М(Н) + 2 • М(O) = 12n + 2n + 2 + 32 = (14n + 34) г/моль.
Видно, что в 1 моле спирта массой (14n + 34) г содержится 12n г углерода, (2n + 2) г водорода и 32 г кислорода.
Массовая доля углерода в спирте равна:
w = m(С) / m(СnН2n+2O2) = 12n / (14n + 34) = 0,4737.
Находим (14n + 34) = 12n / 0,4737 = 25,33n; 11,33n = 34; n = 3.
Общая формула спирта С3Н8O2. Этой формуле отвечают два предельных двухатомных спирта: пропандиол-1,2 СН3—СНОН—СН2ОН и пропандиол-1,3 СН2ОН—СН2—СН2ОН.
Задача 4.4. Определите формулу кристаллогидрата карбоната натрия, массовая доля кислорода в котором равна 0,7273.
Решение. Общая формула кристаллогидрата Na2CO3 • nН2O. Молярная масса равна М(Na2CO3 • nН2O) = 2 • M(Na) + 1 • М(С) + З • М(О) + 2nМ(Н) + n • М(О) = 2 • 23 + 1 • 12 + 3 • 16 + 2n • 1 + n • 16 = (18n + 106) г/моль.
Видно, что в 1 моле массой (18n + 106) г содержится (16n + 48) г кислорода.
Массовая доля кислорода в кристаллогидрате равна:
w = m(O) / m(Na2C02 • nН2O) = (16n + 48) / (18n + 106) = 0,7273;
(16n + 48) = (18n + 106) • 0,7273 = 13,09n + 77,09;
2,91n = 29,09;
n = 10.
Формула кристаллогидрата Na2C02 • 10Н2O.
Задача 4.5. При сжигании органического соединения массой 24,0 г образовалось 17,92 л (н.у.) оксида углерода (IV) и 14,4 г воды. Установите формулу этого соединения и назовите его, если относительная плотность его паров по неону равна 3,0.
Решение. Определим массу углерода в углекислом газе. Для этого найдем количество вещества оксида углерода (IV) : v(C02) = V / VM = 17,92 л / (22,4 л/моль) = 0,80 моль.
Поскольку в одной молекуле СO2 имеется один атом С, то:
v(C) = v(CO2) = 0,80 моль и m(C) = M • v = 12 г/моль • 0,8 моль = 9,6 г.
Аналогично находим массу водорода в образовавшейся воде: v(H2O) = m / M = 14,4 г / (18 г/моль) = 0,80 моль.
v(H) = 2 • v(H2O) = 2 • 0,8 моль = 1,6 моль и m(Н) = M • v = 1 г/моль • 1,6 моль = 1,6 г.
Сумма масс углерода и водорода в соединении, равная 9,6 + 1,6 = 11,2 г, меньше, чем масса соединения, равная 24,0 г. Это означает, что исходное соединение содержит еще один элемент — кислород, поскольку продукты сгорания содержат только три элемента: углерод, водород и кислород. Масса кислорода равна 24,0 — 11,2 = 12,8 г.
Запишем формулу исходного соединения в виде CxНyОz.
х : у : z = 9,6 / 12 : 1,6 / 1 : 12,8 / 16 = 0,8 : 1,6 : 0,8 = 1 : 2 : 1. Простейшая формула СН2O.
Молярная масса простейшей формулы равна: М(СН2O) = 30 г/моль.
По условию D = М(CxНyОz) / М(Аr) = 3.
Откуда
М(CxНyОz) = 3 • М(Аr) = 3 • 20 г/моль = 60 г/моль.
Видно, что молярная масса истинной формулы вдвое больше, чем молярная масса простейшей формулы. Значит, истинная формула — С2Н4O2. Этой формуле отвечают уксусная кислота СН3СООН и метилформиат НСООСН3. [Сборник задач, упражнений и тестов по химии: 11 класс: к учебнику Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия: 11 класс» / М.А. Рябов]
Поделитесь с друзьями:
zadachi-po-ximii.megapetroleum.ru
Методы решения задач по химии. Задачи на вывод химической формулы вещества
Разделы: Химия
С задачами на вывод химической формулы вещества учащиеся встречаются при прохождении программы химии с 8 по 11 классы. К тому же, данный тип задач довольно часто встречается в олимпиадных заданиях, контрольно – измерительных материалах ЕГЭ (части В и С). Диапазон сложности данных задач достаточно широк. Как показывает опыт, у школьников часто возникают затруднения уже на первых этапах решения при выводе молярной массы вещества.
В данной разработке предлагаются задачи на нахождение формулы вещества, исходя из разных параметров в условиях. В представленных задачах приведены различные способы нахождения молярной массы вещества. Задачи составлены таким образом, чтобы учащиеся могли освоить оптимальные методы и различные варианты решения. Наглядно демонстрируются наиболее общие приёмы решений. Для учащихся предлагаются решённые задачи по принципу нарастания сложности и задачи для самостоятельного решения.
Таблица 1
Вывод химической формулы вещества: |
Номер задачи |
Вычисление молярной массы вещества |
Задачи для самостоятельного решения |
— на основании массовых долей (%) атомов элементов |
1 |
M, где n — число атомов |
Определить химическую формулу соединения, имеющего состав: натрий – 27,06%; азот – 16,47 %; кислород – 57,47%. Ответ: NaNO3 |
— на основании массовых долей (%) атомов элементов и плотности соединения |
2 |
М (CхНу) = D(Н2) ·М (Н2) |
Относительная плотность паров органического кислородсодержащего соединения по кислороду равна 3, 125. Массовая доля углерода равна 72%, водорода – 12 %. Выведите молекулярную формулу этого соединения. Ответ:C6H12О |
— по плотности вещества в газообразном состоянии |
3 |
М (в-ва) = ρ · М (газообр. в-ва) |
Относительная плотность паров предельного альдегида по кислороду равна 1,8125. Выведите молекулярную формулу альдегида. Ответ: C3Н6О |
— на основании массовых долей (%) атомов элементов и массе соединения |
4 |
М находится по соотношению, |
Углеводород содержит 81,82 % углерода. Масса 1 л. этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу углеводорода. |
— по массе или объёму исходного вещества и продуктам горения |
5 |
М (в-ва)=Vm·ρ |
Относительная плотность паров кислородсодержащего органического соединения по гелию равна 25,5. При сжигании 15,3 г. этого вещества образовалось 20,16 л. СО2 и 18,9 г. Н2О. Выведите молекулярную формулу этого вещества.Ответ: C6H14О |
Приводится пример решения задачи № 6 на применение уравнения Менделеева – Клайперона
Задача № 1
Массовая доля кислорода в одноосновной аминокислоте равна 42,67%. Установите молекулярную формулу кислоты.
Дано: |
Решение: M кислоты = 75 (г/моль) |
Вывести формулу соединения |
Вернуться к табл.1
Задача № 2
Относительная плотность углеводорода по водороду, имеющего состав: w(С) = 85,7 %; w (Н) = 14,3 %, равна 21. Выведите молекулярную формулу углеводорода.
Дано: |
Решение:
М (CхНу)= 21 · 2 = 42
m (Н) = 42г. /100% · 14,3 %= 6 г. Ответ: истинная формула вещества C3Н6. |
Вывести формулу соединения |
Вернуться к табл.1
Задача № 3
Определите молекулярную формулу алкана, если известно, что его пары в 2,5 раза тяжелее аргона.
Дано: |
Решение: |
Вывести формулу алкана |
Вернуться к табл.1
Задача № 4
Массовая доля углерода в соединении равна 39,97 %, водорода 6, 73 %, кислорода 53,30 %. Масса 300 мл. (н.у.) этого соединения равна 2,41 г. Выведите молекулярную формулу этого вещества.
Дано: |
Решение: |
Вывести формулу соединения |
Вернуться к табл.1
Задача № 5
Какова молекулярная формула углеводорода, имеющего плотность 1,97 г/л, если при сгорании 4,4 г. его в кислороде образовалось 6,72 л. СО2 и 7,2 г. Н2О.
Дано: |
Решение: Составляем пропорции: |
Вывести формулу |
Вернуться к табл.1
Задача № 6
Соединение содержит 62,8% S и 37,2% F. Масса 118 мл данного соединения при 70 и 98,64 КПа равна 0,51 г. Вывести формулу соединения.
Дано: |
Решение:
n(S) : n(F) = 62,80/32 : 37,2/19 = 1,96 : 1,96 = 1 : 1
M= (0, 51 · 8,31 · 280)/(98,64 ·103·118 ·10-6) = =101,95 г/моль.
Следовательно, формула соединения S2 F2 Ответ: S2F2 |
Вывести формулу соединения |
Вернуться к табл.1
Поделиться страницей:xn--i1abbnckbmcl9fb.xn--p1ai


 Vm
= 22,4 л/моль (н.у.)
Vm
= 22,4 л/моль (н.у.)