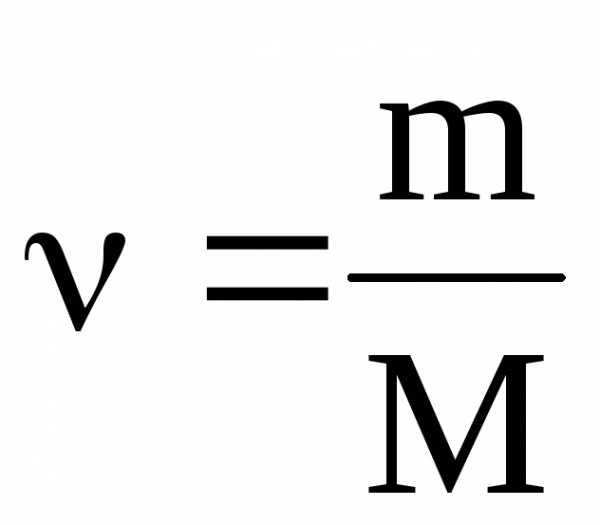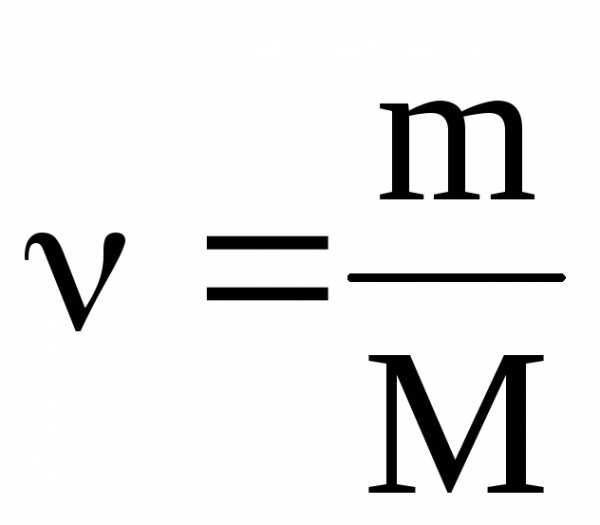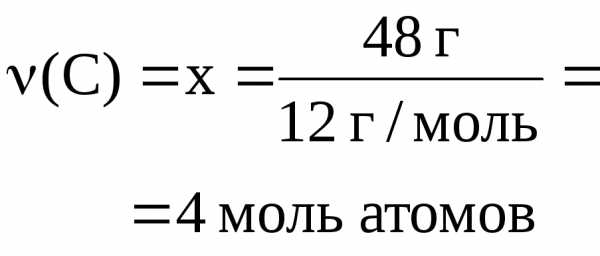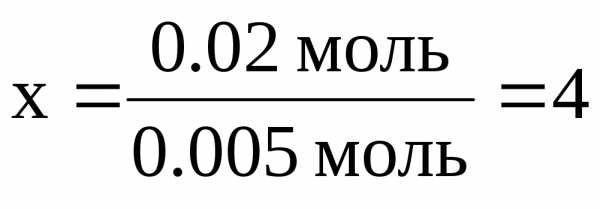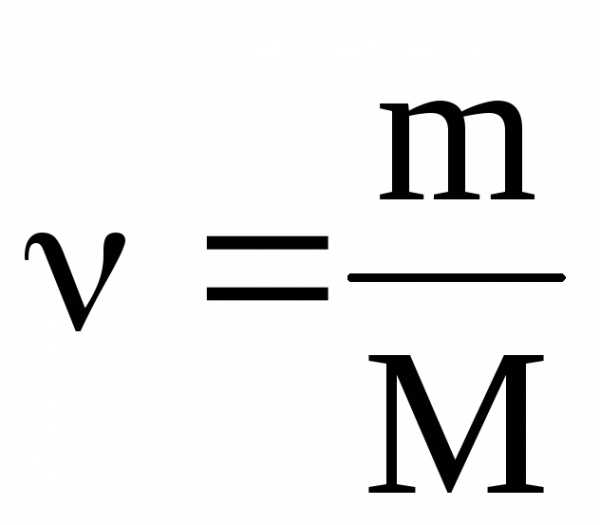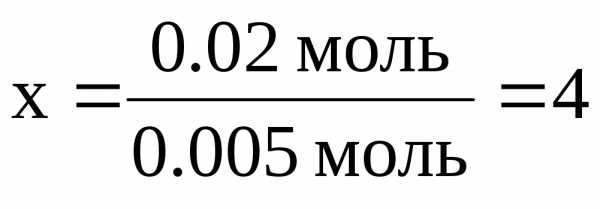Решение расчетных задач в 10 классе
В 10 классе изучается органическая химия. Расчеты по уравнениям реакций здесь ведутся аналогично тем, что велись при решении задач по неорганической химии. Задачи могут быть на избыток и недостаток, примесь, массовую долю выхода и др.
С первых уроков в 10 классе, кроме того, решаются задачи разных типов для повторения и закрепления материала неорганической химии.
В курсе органической химии сравнительно новыми являются задачи на:
1. Нахождение молекулярной формулы органического вещества на основании его плотности и массовых долей элементов (процентного состава).
2. Нахождение молекулярной формулы органического вещества по массе (объему) продуктов его сгорания.
Тип 1: Нахождение молекулярной формулы органического вещества на основании его плотности и массовых долей элементов (процентного состава).
Задача: Хлоропроизводное предельного углеводорода имеет плотность по водороду, равную 118.5.
Массовые доли элементов в этом соединении следующие: Cl ‑ 89.9%; C — 10.1%. Найти молекулярную формулу данного соединения.
|
Дано: | |
|
(Cl) = 89.9% | |
|
(C) = 10.1% | |
|
CxCly = ? |
Решение:
Находим Mr (необходимо помнить, что без знания Mr установить точную формулу нельзя):
Mr = 2 · 118.5 = 237.
Существуют два способа дальнейшего решения задачи.Способ 1 решения (наиболее простой): на основании математической формулы массовой доли элемента.
С исходными математическими формулами учащиеся знакомы еще с 8 класса (ранее был выделен данный тип задач, сейчас – нет).
Если вещество CxCly, его относительная молекулярная масса известна, то
, ,
из чего следует:
, ,
, .
Ответ: Молекулярная формула соединения – C2Cl6.
Способ 2 решения задачи используется чаще всего, если не известна Mr. Он заключается в нахождении первоначально соотношения числа (N) атомов элементов, образующих молекулу.
Исходим из тех же математических формул для x и y:
,
после преобразований получаем:
, .
Следует объяснить учащимся, что число атомов может быть только целым, поэтому надо разделить большее число на меньшее:
x : y = 1 : 3.
Таким образом,
простейшая формула соединения CCl3.
Сравним Mr
данной молекулы с Mr,
вычисленной на основании
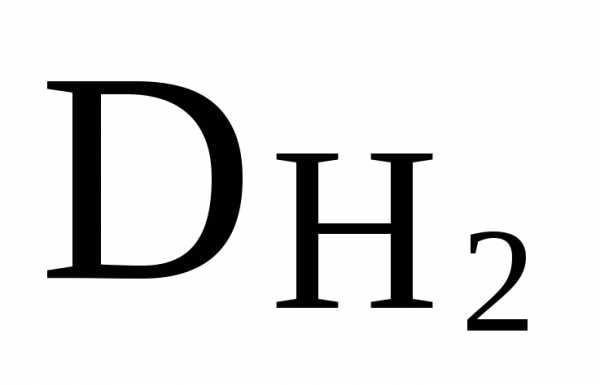 .
.
Mr(CCl3) = 12 + 3 · 35.5 = 118.5,
что в два раза
меньше, чем вычислено по
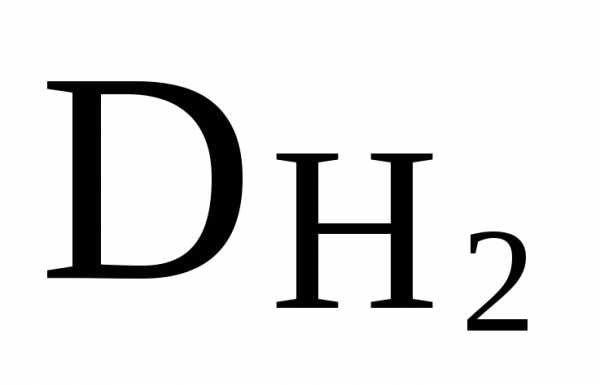 ,
то есть формула соединения (CCl3)2
или C2H6.
,
то есть формула соединения (CCl3)2
или C2H6.
Первый способ, если известна относительная молекулярная масса, является более предпочтительным.
Тип 2: Нахождение молекулярной формулы органического вещества по массе (объему) продуктов его сгорания.
Задача: Определить молекулярную формулу углеводорода по следующим данным: при сгорании газообразного углеводорода массой 0.29 г образовались углекислый газ объемом 0.448 л и пары воды массой 0.45 г. Плотность углеводорода по водороду равна 29.
Первый способ решения задачи основан на следующих рассуждениях: органические вещества состоят из углерода и водорода, поэтому по продуктам сгорания можно определить массу и количество вещества каждого из этих элементов.
1. Решение начинаем с нахождения относительной молекулярной массы:
Mr = 2 · 29 = 58 M = 58 г/моль.
2. По стехиометрической схеме находим массу углерода в CO2 объемом 0.448 л и массу водорода в H2O массой 0.45 г:
0.448 л x г 0.45 г
CO2 C H2O 2H
= 1 моль = 1 моль = 1 моль = 2 моль
Vm=22.4 л/моль M=12 г/моль M=18 г/моль M=1 г/моль
(CO2) = (C) = 0.02 моль (H) = 2(H2O) = 0.05 моль.
x = 0.24 г. y = 0.05 г.
Обращаем внимание учащихся, что сумма масс равна 0.29 г, то есть массе исходного вещества, следовательно, других элементов нет (если сумма меньше, то еще есть кислород).
3. Далее решение может быть осуществлено двумя вариантами:
|
а) |
по массе: |
б) |
по количеству вещества: Найдем |
|
Составим пропорции: |
число моль исходного вещества: | ||
|
0.29 г CxHy – 0.24 г C 58 г CxHy – x’ г C |
| ||
|
|
Количество моль атомов:
| ||
|
Аналогично: |
Составим пропорции: | ||
|
0.29 г CxHy – 0.05 г H 58 г CxHy – y’ г H |
0.005 моль CxHy – 0.02 моль атомов C 1 моль CxHy – x моль атомов C | ||
|
| |||
|
(H) = 10 моль атомов. |
Аналогично: | ||
|
0.005 моль CxHy – 0.05 моль атомов H 1 моль C xHy – y моль атомов H | |||
|
. | |||
|
Ответ: формула C4H10. |
Ответ: формула C4H10. |
Второй способ решения задачи. Расчет по уравнению горения.
0.29 г 0.448 л 0.45 г
1. CxHy
+
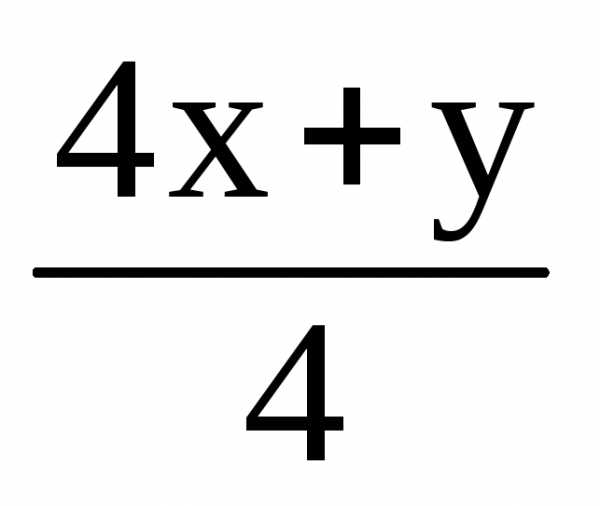 O2
= x CO2
+
O2
= x CO2
+
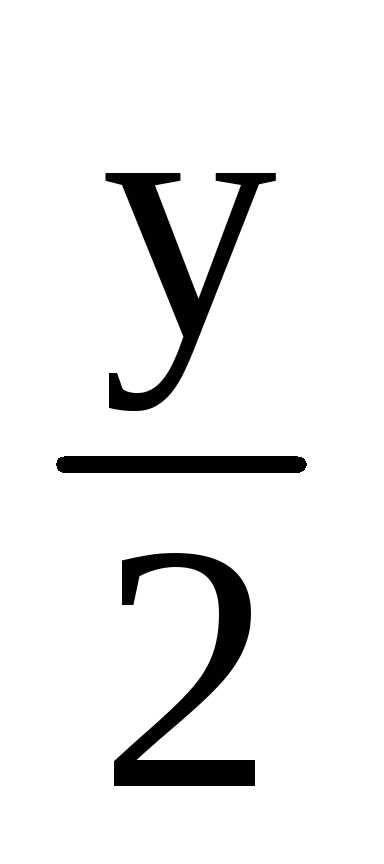 H2O.
H2O.
= 1 моль = х моль = 0.5y
M = 58 г/моль V = х·22.4 л M = 18 г/моль
2. Далее решение может быть осуществлено двумя вариантами:
|
а) |
по массе: |
б) |
по количеству вещества: |
|
Составим пропорции: 0.29 г CxHy – 0.448 л CO2 58 г CxHy – x·22.4 л CO2 |
Найдем
число моль исходного вещества и
продуктов сгорания:
| ||
|
Аналогично: | |||
|
0.29 г CxHy – 0.45 г HO2 58 г CxHy – 9·y г HO2 | |||
|
Составим пропорции: 0.005 моль CxHy – 0.02 моль CO2 1 моль CxHy – x моль CO2 | |||
|
Ответ: формула C4H10. |
| ||
|
Аналогично: 0.005 моль CxHy – 0.025 моль HO2 | |||
|
. | |||
|
Ответ: формула C4H10. |
Сравниваем Mr
данной молекулы с Mr,
рассчитанной по
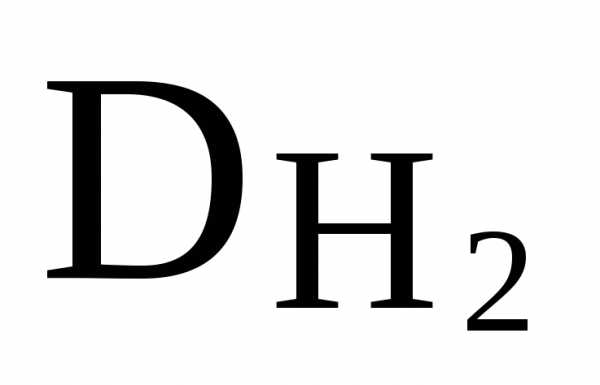 .
Если Mr
не совпадают, то есть кислород.
.
Если Mr
не совпадают, то есть кислород.
Если сгоревшее вещество содержало кислород, то в уравнении меняется коэффициент только перед O2, но этот коэффициент на решение не влияет:
CxHyOz
+
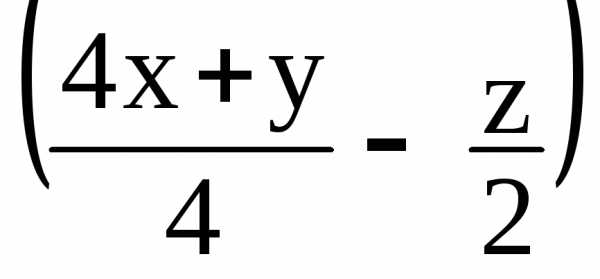 O2
= x CO2
+
O2
= x CO2
+
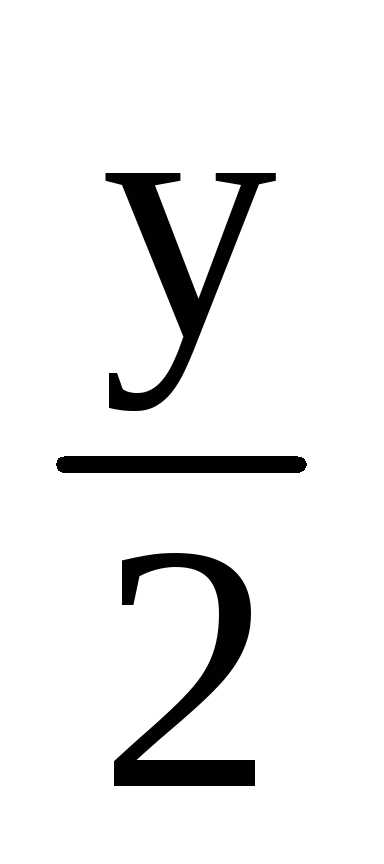 H2O.
H2O.
studfiles.net
Решение задач на определение состава органических веществ
Тема: Введение в органическую химию
Урок: Решение задач на определение состава органических веществ
Суть анализа органических соединений основана на общем свойстве: все органические соединения горят и, сгорая, образуют углекислый газ, воду и некоторые другие продукты.
Рис. 1. Прибор для органического анализа
Суть анализа проста: надо взять известную массу органического соединения, сжечь его и определить, сколько получилось продуктов сгорания. Затем перейти к решению задачи на вывод формулы органического соединения. Прибор для органического анализа состоит из устройства для сжигания в воздухе обогащенным кислородом и системы ловушек для поглощения основных продуктов сгорания. Современные приборы действуют на том же самом принципе, хотя их чувствительность и скорость несравнимы с приборами Дюма и Либиха. Приборы, выпускаемые сейчас, позволяют взять для анализа буквально десятые доли милиграмма. При этом анализ выполняется очень быстро.
Рассмотрим примеры решения таких задач.
Условие задачи. При сжигании в избытке кислорода 0,22 г пропана, получено 0,66 г углекислого газа и 0,36 г воды. Определите состав газа.
Решение.
Согласно данным условия задачи, имеется только углекислый газ и вода, следовательно, в исходное вещество могут входить углерод, водород и кислород.
1. Напишем уравнение реакции в общем виде:
CxHyOz + O2 → xCO2 + y/2 H2O
2. Определим количества веществ углекислого газа и воды:
n = ; n(CO2) = = 0,015 моль.n(H2O) = = 0,02 моль.
3. Исходная проба 0,22 г пропана дает:
m(C) = 12 г/моль 0,015 моль = 0,18 г
m(H) = 1 г/моль·0,04 моль = 0,04 г
Сумма равна 0,18 г + 0,04 г = 0,22 г, что равно исходной массе пропана.
Вывод: Исходное вещество содержало только углерод и водород и не содержало кислорода.
Соотношение 0,015/0,04 = 3/8, следовательно, формула пропана С3Н8.
Простейшая формула газа: С3Н8.
4. Соответствует ли простейшая формула истинной формуле? Да, соответствует, потому что углеводорода С6Н16 не существует.
Ответ: Состав газа С3Н8.
Условие задачи. При сжигании 0,62 г этиленгликоля получено 0,88 г углекислого газа и 0,54 г воды. Определите состав этого вещества, если плотность его по воздуху равна 2,14.
Решение.
Согласно данным условия задачи, получается только углекислый газ и вода, следовательно, в исходное вещество могут входить углерод, водород и кислород.
1. Напишем уравнение реакции в общем виде:
CxHyOz + O2 → xCO2 + y/2 H2O
2. Определим количества веществ углекислого газа и воды:
n = ; n(CO2) = = 0,02 моль ; n(H2O) = = 0,03 моль.
3. Исходная проба дает:
m(C) = 12 г/моль ·0,02 моль = 0,24 г
m(H) = 1 г/моль ·0,06 моль = 0,06 г
В сумме 0,24 г+ 0,06 г =0,30 г, что существенно меньше сгоревшей массы этиленгликоля. Отсюда вывод, что в исходном веществе кроме углерода и водорода мог содержаться кислород.
4. Определяем массу кислорода и количество вещества.
m (O) = 0,62 – 0,30 = 0,32 г; n (O) = = 0,02 моль.
5. Находим соотношение атомов в сгоревшем веществе:
С: Н: О = 0,02: 0,06: 0,02 = 1:3:1.
6. Простейшая формула имеет состав СН3О. М (СН3О) = 31 г/моль.
7. Используя плотность по воздуху из условия задачи, находим молярную массу сгоревшего вещества, ; Мвоздух = 29 г/моль; М вещества = 29 г/моль ⋅ 2,14 = 62,06 г/моль. Это соответствует удвоенной его простейшей формуле.
Отсюда следует, что формула этиленгликоля: С2Н6О2.
Ответ: Формула этиленгликоля: С2Н6О2.
Подведение итога урока
В ходе урока вы получили общее представление о решении задач по теме «Решение задач на определение состава органических веществ». Вы узнали, что определение состава органических веществ происходит на основе способности всех органических веществ гореть. Рассмотрели алгоритм при решении подобного рода задач. Решили две разнотипные задачи на определение состава органических веществ с записью молекулярной формулы.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2008. – 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2010. – 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: РИА «Новая волна»: Издатель Умеренков, 2012. – 278 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Interneturok.ru (Источник).
2. Органическая химия (Источник).
3. Химик (Источник).
Домашнее задание
1. №№ 6, 7 (с. 23) Рудзитис Г.Е. Химия. Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. В чем заключается суть анализа органических веществ?
3. Какие продукты реакции получаются при горении углеводородов?
interneturok.ru
Задача 35 ЕГЭ по химии » HimEge.ru
Нахождение молекулярной формулы веществ
Для решения задач этого типа необходимо знать общие формулы классов органических веществ и общие формулы для вычисления молярной массы веществ этих классов:
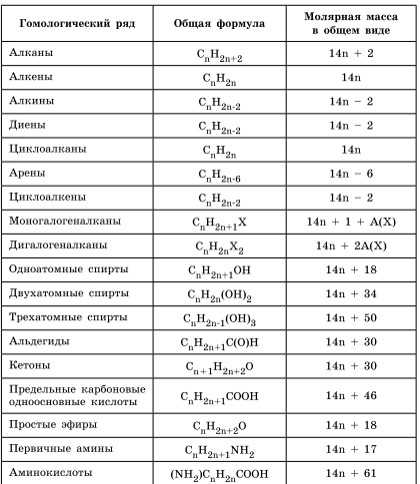
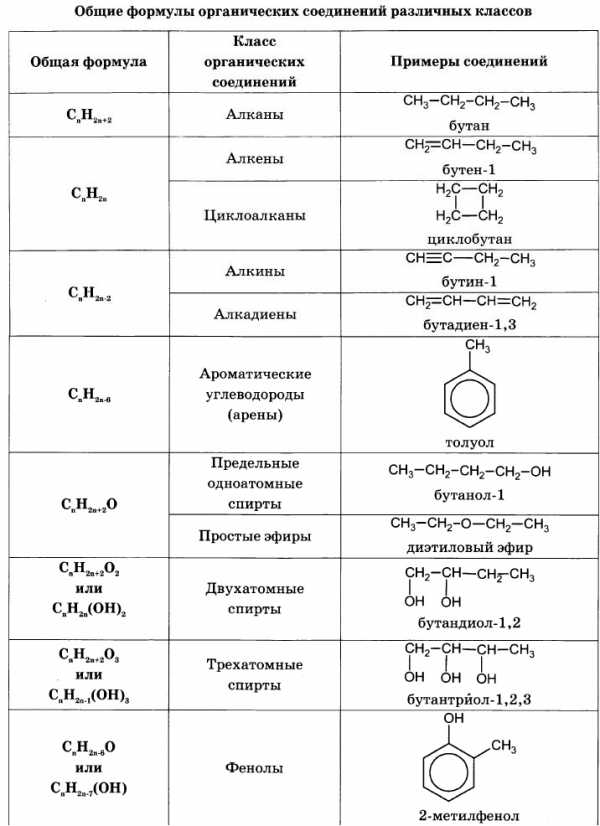
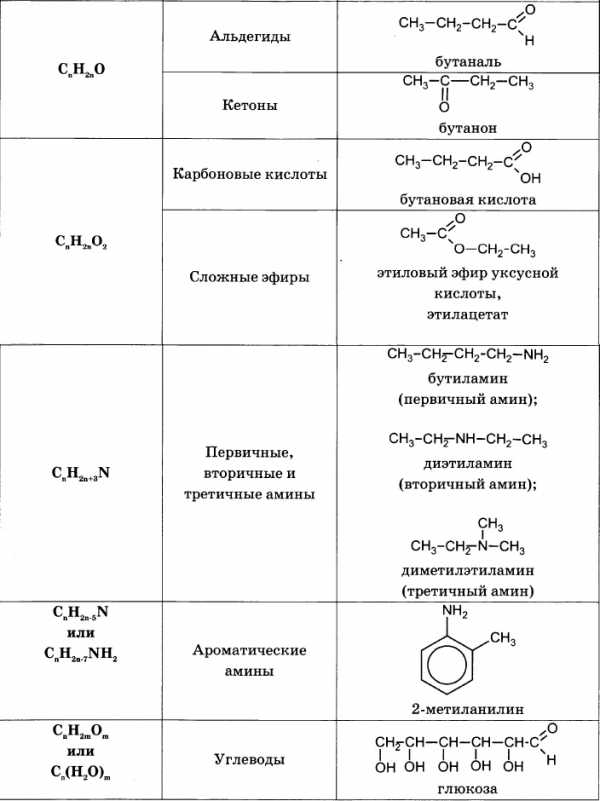
Алгоритм решения большинства задач на нахождение молекулярной формулы включает следующие действия:
— запись уравнений реакций в общем виде;
— нахождение количество вещества n, для которого даны масса или объем, или массу или объём которого можно вычислить по условию задачи;
— нахождение молярной массы вещества М = m/n, формулу которого нужно установить;
— нахождение числа атомов углерода в молекуле и составление молекулярной формулы вещества.
Примеры решения задачи 35 ЕГЭ по химии на нахождение молекулярной формулы органического вещества по продуктам сгорания с объяснением
Задача 1.
При сгорании 11,6 г органического вещества образуется 13,44 л углекислого газа и 10,8 г воды. Плотность паров этого вещества по воздуху равна 2. Установлено, что это вещество взаимодействует с аммиачным раствором оксида серебра, каталитически восстанавливается водородом с образованием первичного спирта и способно окисляться подкисленным раствором перманганата калия до карбоновой кислоты. На основании этих данных:
1) установите простейшую формулу исходного вещества,
2) составьте его структурную формулу,
3) приведите уравнение реакции его взаимодействия с водородом.
Решение: общая формула органического вещества СxHyOz.
Переведем объем углекислого газа и массу воды в моли по формулам:
n= m/М и n= V/Vm,
Молярный объем Vm = 22,4 л/моль
n(CO2) = 13,44/22,4= 0,6 моль, =>в исходном веществе содержалось n(C) =0,6 моль,
n(H2O) = 10,8/18 = 0,6 моль, => в исходном веществе содержалось в два раза больше n(H) = 1,2 моль,
Узнаем, содержался ли кислород в органическом соединении. Для этого от массы органического вещества отнимаем массу углерода и массу водорода: m(O)= 11,6 – 0,6* 12 – 1,2= 3,2 г,
Значит, искомое соединение содержит кислород количеством:
n(O)= 3,2/16 = 0,2 моль
Посмотрим соотношение атомов С, Н и О, входящих в состав исходного органического вещества:
n(C) : n(H) : n(O) = x : y : z = 0,6 : 1,2 : 0,2 = 3 : 6 : 1
Нашли простейшую формулу: С3H6О
Чтобы узнать истинную формулу, найдем молярную массу органического соединения по формуле:
М(СxHyOz) = Dвозд(СxHyOz) *M(возд)
Mист(СxHyOz) = 29*2 = 58 г/моль
Проверим, соответствует ли истинная молярная масса молярной массе простейшей формулы:
М (С3H6О) = 12*3 + 6 + 16 = 58 г/моль — соответствует, => истинная формула совпадает с простейшей.
Молекулярная формула: С3H6О
Из данных задачи: » это вещество взаимодействует с аммиачным раствором оксида серебра, каталитически восстанавливается водородом с образованием первичного спирта и способно окисляться подкисленным раствором перманганата калия до карбоновой кислоты» делаем вывод, что это альдегид.
2) При взаимодействии 18,5 г предельной одноосновной карбоновой кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
3) Некоторая предельная карбоновая одноосновная кислота массой 6 г требует для полной этерификации такой же массы спирта. При этом получается 10,2 г сложного эфира. Установите молекулярную формулу кислоты.
4) Определите молекулярную формулу ацетиленового углеводорода, если молярная масса продукта его реакции с избытком бромоводорода в 4 раза больше,чем молярная масса исходного углеводорода
5) При сгорании органического вещества массой 3,9 г образовались оксид углерода (IV) массой 13,2 г и вода массой 2,7 г. Выведите формулу вещества, зная, что плотность паров этого вещества по водороду равна 39.
6) При сгорании органического вещества массой 15 г образовались оксид углерода (IV) объемом 16,8 л и вода массой 18 г. Выведите формулу вещества, зная, что плотность паров этого вещества по фтороводороду равна 3.
7) При сгорании 0,45 г газообразного органического вещества выделилось 0,448 л (н.у.) углекислого газа, 0,63 г воды и 0,112 л (н.у.) азота. Плотность исходного газообразного вещества по азоту 1,607. Установите молекулярную формулу этого вещества.
8) При сгорании бескислородного органического вещества образовалось 4,48 л (н.у.) углекислого газа, 3,6 г воды и 3,65 г хлороводорода. Определите молекулярную формулу сгоревшего соединения.
9) При сгорании органического вещества массой 9,2 г образовались оксид углерода (IV) объёмом 6,72 л (н.у.) и вода массой 7,2 г. Установите молекулярную формулу вещества.
10) При сгорании органического вещества массой 3 г образовались оксид углерода (IV) объёмом 2,24 л (н.у.) и вода массой 1,8 г. Известно, что это вещество реагирует с цинком.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4 ) напишите уравнение реакции этого вещества с цинком.
himege.ru
ХИМИЯ-10 класс.Алгоритм рассчётов при решении задач на вывод химической формулы органического вещества по массам продуктов сгорания.
ОРГАНИЧЕСКАЯ ХИМИЯ. 10 класс. (В ПОМОЩЬ УЧАЩИМСЯ ДЛЯ РЕШЕНИЯ ЗАДАЧ)
АЛГОРИТМ решения задач на вывод формул органических веществ, содержащих кислород, по массам(объёмам) продуктов сгорания.
1.Обозначить формулу вещества с помощью индексов X,Y,Z и т.д. по числу элементов в молекуле. Если продуктами сгорания являются углекислый газ и вода, то вещество может содержать 3 элемента (CxHyOz). Частный случай: продуктом горения кроме углекислого газа и воды является азот(N2) для азотсодержащиx веществ (CxHyOzNm).
2.Составить уравнение реакции горения без коэффициентов.
3.Найти количество вещества каждого из продуктов сгорания.
4.Рассчитать количество вещества атомов углерода и водорода.
5.Если не сказано, что сгораемое вещество – углеводород, рассчитать массы атомов углерода и водорода в продуктах сгорания. Найти массу кислорода в веществе по разности массы исходного вещества и суммы масс атомов углерода и водорода. Вычислить количество вещества атомов элемента кислорода.
6.Найти индексы : соотношение индексов равно соотношения количеств веществ атомов элементов, приведённому к отношению целых чисел.
X:Y:Z=n(C):n(H):n(O) . .Вывести простейшую формулу вещества.
7.При необходимости по дополнительным данным в условии задачи привести полученную простейшую формулу к истинной. В задачах на нахождение формул органических веществ часто требуется сравнить относительную молекулярную массу простейшей формулы с истинной относительной молекулярной массой, найденной по условию задачи(по плотности по воздуху или по водороду).Отношение этих масс даёт число, на которое надо умножить индексы простейшей формулы.
infourok.ru
Решение задач на нахождение химической формулы органического вещества урок закрепления материала 10 класс химико-биологический профиль
РЕШЕНИЕ ЗАДАЧ НА НАХОЖДЕНИЕ ХИМИЧЕСКОЙ ФОРМУЛЫ ОРГАНИЧЕСКОГО ВЕЩЕСТВА
Урок закрепления материала
10 класс
химико-биологический профиль
Учитель химии
Тарасова Н.И.
Цель. Продолжить формирование навыков решения задач на нахождение химической формулы органического вещества, довести умения решения задач до оптимального уровня.
Задачи.
Закрепить знания о физических величинах: массе, объеме, количестве вещества, молярной массе, плотности и относительной плотности по газообразному веществу, массовой доле вещества.
Отработать умение пользоваться формулами определения физических величин для нахождения химической формулы органического вещества.
Довести умения решать задачи на нахождение химической формулы органического вещества до оптимального уровня.
Продолжить формировать умения логически мыслить.
Методы. Беседа, работа с формулами, решение задач, применение ИКТ, составление алгоритмов, самостоятельная работа.
Оборудование.
Интерактивная доска.
Таблица «Основные формулы для решения задач».
ПЛАН УРОКА
Организационный момент (тема и цели урока).
Повторение и обобщение изученного ранее материала
Решение задач, составление алгоритмов.
Индивидуальное задание.
ХОД УРОКА.
Организационный момент (тема и цели урока).
Повторение и обобщение изученного ренее материала.
Устный опрос:
Какие вещества органические вещества относят к кислородсодержащим углеводородам?
Что такое функциональная группа?
Как называют и каков состав функциональных групп спиртов, альдегидов, кетонов и карбоновых кислот?
Перечислить общие формулы кислородсодержащих углеводородов.
Как расчитывают молекулярны массы по общей формуле?
Повторение расчетных формул.
Вывод химической формулы вещества: | Расчетные формулы | Задачи для решения |
— ПЕРВЫЙ УРОВЕНЬ на основании массовых долей атомов элементов и относительной плотности его по другому газу | АхВу (А)/Аr(А): (В)/Аr(В) (В) = х Аr(В)/ М(АхВу) Dвод.( АхВу) = М(АхВу)/2 Dкисл.( АхВу) = М(АхВу)/32 | №1 Уровень А 1,2 В 1,2 С 1 |
— ВТОРОЙ УРОВЕНЬ по массе или объёму исходного вещества и продуктам горения или образования веществ | М =Vm·ρ V = m / ρ n = V/ Vm n = m / М Dвозд.( АхВу) = М(АхВу)/29 Dвод.( АхВу) = М(АхВу)/2 | №2 Уровень А 1,2 В 1,2 |
III. Решение задач учениками у доски и составление алгоритмов решения задач.
Задачи для решения:
ПЕРВЫЙ УРОВЕНЬ.
А.
1. Одноосновная карбоновая кислота имеет следующий состав: С – 26,1%, Н – 4,35%, О – 69,55%. Исходя из этих данных, найдите молекулярную формулу этой кислоты.
Решение:
СхНуОz
х : у : z = 26,1/12 : 4,35/1 : 69,55/16 = 2,175 : 4,35 : 4,35 = 1 : 2 : 2
Ответ: НСООН
2. По данным элементного анализа одноосновной карбоновой кислоты было установлено, что в ней 48,65% углерода, 8,11% водорода. Выведите молекулярную формулу этой кислоты. Напишите формулы строения изомерных соединений.
Решение:
СхНуОz
х : у : z = 48,65/12 : 8,11/1 : 43,24/16 = 4,05 : 8,11 : 2,7 = (1,5 : 3 : 1) 2 = 3 : 6 : 2
Ответ: С2Н5СООН
В.
1. При анализе вещества нашли, что в его состав входят 40% углерода, 6,66% водорода. 53,34% кислорода. Найдите молекулярную формулу и назовите это вещество, если известно, что плотность его паров по воздуху равна 2,07.
Решение:
СхНуОz
х : у : z = 40/12 : 6,66/1 : 53,34/16 = 3,33 : 6,66 : 3,33 = 1 : 2 : 1
Простейшая формула: СН2О
М(СхНуОz) = Dвозд.∙ М(возд.) = 2,07 ∙ 29 = 60г/моль
М(СН2О) = 30г/моль
М(СхНуОz)/ М(СН2О) = 60/30 = 2
СН2О ∙ 2 = С2Н4О2
Ответ: СН3 СООН
2. Плотность по водороду вещества, имеющего массовый состав: С – 54,55%, Н – 9,09%, О – 36,36%, равна 22. Выведите молекулярную формулу этого вещества.
Решение:
СхНуОz
х : у : z = 54,55/12 : 9,09/1 : 36,36/16 = 4.55 : 9,09 : 2,27 = 2 : 4 : 1
Простейшая формула: С2Н4О
М(СхНуОz) = Dвозд.∙ М(вод.) = 2∙ 22 = 44г/моль
М(С2Н4О) = 44г/моль
Ответ: СН3 СОН
С.
1. Установите молекулярную формулу предельной одноосновной карбоновой кислоты, натриевая соль которой содержит 33,82% металла.
Решение:
М(СnH2n+1COONa) = 14n + 68
0,3382 = 23/14n + 68
23 = 23 – 4,73 n
n = 0
С0Н1СООН
Ответ: НСООН
АЛГОРИТМ. Нахождение молекулярной формулы на основании массовых долей атомов элементов и относительной плотности его по другому газу.
Запишем формулу вещества, обозначив индексы х , у и z . СхНуОz
Найдем отношение х : у : z = (С)/Аr(С): (Н)/Аr(Н) : (О)/Аr(О)
Отношения находят до целых чисел: делят на наименьшее, если необходимо, учеличивают в 2 раза.
Полученные числа – это индексы в формуле.
ВТОРОЙ УРОВЕНЬ.
А.
1. При сгорании 4,6г органического вещества с плотностью его паров по воздуху 1,586 получено 5,4г воды и 4,48л углекислого газа (н.у.). определите формулу сгоревшего углеводорода.
Решение:
СхНуОz + О2 = х СО2 + у/2 Н2О
М(СхНуОz) = Dвозд.∙ М(возд.) = 1,586 ∙ 29 = 46г/моль
n = m / М
n = 4,6г :46г/моль = 0,1 моль
n = 5,4г :18г/моль = 0,3 моль
n = V/ Vm
n = 4,48л : 22,4 л/моль = 0,2 моль
0,1 : 0,2 : 0,3 = 1 : 2 : 3
х = 2 у = 6
С2Н6
М (С2Н6) = 30г/моль
М(СхНуОz) = 46г/моль — 30г/моль = 16 г/моль
Ответ: С2Н5ОН
2.При сжигании 7,5г органического вещества образуется 4,5г водяных паров и 11г оксида углерода (IV). Найдите молекулярную формулу вещества и назовите его, если известно, что плотность его паров по водороду равна 15.
Решение:
СхНуОz + О2 = х СО2 + у/2 Н2О
М(СхНуОz) = Dвод.∙ М(вод.) = 15 ∙ 2 = 30г/моль
n = m / М
n = 7,5г :30г/моль = 0,25 моль
n = 4,5г :18г/моль = 0,25моль
n = 11г :44г/моль = 0,25моль
0,25 : 0,25 : 0,25 = 1 : 1 : 1
х = 1 у = 2
СН2
М(СН2) = 14г/моль
М(СхНуОz) = 30г/моль — 14г/моль = 16 г/моль
Ответ: НСОН
В.
1. При взаимодействии предельного альдегида массой 5,8г с избытком гидроксида меди (II) при нагревании образовалось 14,4г осадка оксида меди (I). Установите молекулярную формулу альдегида.
Решение:
СnН2n+1 CОH + 2Cu(OH)2 = СnН2n+1 CОOH + Cu2O + 2H2O
n (СnН2n+1 CОH) = n (Cu2O) = 14,4/144 = 0,1 моль
М(СnН2n+1 CОH) = 5,8г/0,1моль = 58г/моль
М(СnН2n+1 CОH) = 14 n + 30
14 n + 30 = 58
n = 2
Ответ: С2Н5СОН
2.При обработке некоторого количества предельного одноатомного спирта натрием выделилось 2.24л газа (н.у.), а при окислении того же количества спирта образовалось 11,6г альдегида. Определите формулу спирта.
Решение:
2СnН2n+1 ОH+ 2Na → Н2 + 2 СnН2n+1 ОNa
n(Н2) = V(Н2) : Vm= 2,24 / 22,4 = 0,1моль
n(СnН2n+1 ОH) = n(Н2)∙2 = 2 ∙ 0,1 = 0,2 моль
СnН2n+1 ОH+ [О]→СnН2nО
n(СnН2nО) = n(СnН2n+1 ОH) =0,2 моль
М(СnН2nО) = 11,6/0,2 = 58г/моль
М(СnН2n+1 ОH) = М(СnН2nО) + 2 = 60г/моль
14 n + 18 = 60
n = 3
Ответ: С3Н7ОН
АЛГОРИТМ:Нахождение молекулярной формулы по наличию продуктов сгорания вещества.
1.Определить простейшую формулу вещества: CXHYOZ= ?C😕Н😕О.
2. Определить истинную молярную массу.
3. Определить молярный фактор – отношение истинной молярной массы к простейшей p = Мист/Мпрост.
4.Найти молекулярную формулу вещества. Умножить индексы простейшей формулы на молярный фактор.
5. Найти структурную формулу. Выписать структурные формулы всех изомеров и выбрать тот, который удовлетворяет условию задачи.
IV. Индивидуальное задание:
Первый уровень (А). Вещество имеет следующий элементный состав: С – 19,4%; Н – 3,2%; О – 77,4% (по массе). Определите его формулу.
Первый уровень (В). Относительная плотность паров органического кислородсодержащего соединения по кислороду равна 3, 125. Массовая доля углерода равна 72%, водорода – 12 %. Выведите молекулярную формулу этого соединения.
Второй уровень (А).Относительная плотность паров кислородсодержащего органического соединения по гелию равна 25,5. При сжигании 15,3 г. этого вещества образовалось 20,16 л. СО2 и 18,9 г. Н2О. Выведите молекулярную формулу этого вещества.
Ответы:
Ответ: Н2СО3
Ответ: С6Н12О
Ответ: С6Н14О
textarchive.ru
| Этап урока | Деятельность учителя | Деятельность ученика |
| Мотивационно-ориентированный этап Учитель создает проблемную ситуацию, подводит учащихся к определению темы и цели урока. |
Взаимное приветствие. Учитель
предлагает разбиться на группы (количество групп
определяется количеством детей в классе, в нашем
случае три группы), выносит поднос и создает
мотивацию к учебной деятельности. – Ребята, у меня на подносе несколько колб с растворами веществ. Колбы пронумерованы, а что в них находится мы не знаем. Лаборант забыл наклеить этикетки, но в журнале лаборанта есть элементный состав и описание этих веществ. Чтобы сформулировать тему урока, предлагаю ознакомиться с элементным составом неизвестных нам веществ. |
На столах учащихся представлены
инструкционные карты в виде фрагмента журнала
лаборанта (условия задач на вывод химической
формулы вещества c познавательной нагрузкой) Приложение 1 Учащиеся работают в группах, что определяет готовность к равноправному сотрудничеству, доброжелательному отношению друг к другу и адекватному межличностному восприятию. |
| Слайд 1 Тема, цель и задачи урока |
Как вы думаете, чем мы сегодня будем
заниматься? Учитель организует обсуждение, по результатам которого учащиеся формулируют тему и цель урока. Действительно, мы будем учиться решать задачи на вывод химической формулы вещества. |
Анализируют информацию, высказывают предположения, что будут учиться определять формулу вещества по массовым долям, т.е. решать задачи на вывод химической формулы. |
| Операционно-исполнительский этап Этап открытия нового знания Слайд 2 Условие задачи №1 |
Учитель предлагает первую задачу решить вместе. На доске записывается условие задачи, обращается внимание на порядок оформления и решения таких задач. | Учащиеся работают в группах, решают задачу вместе с учителем. |
| Слайд 3 Формула глицина, его биологическая роль, применение в промышленности |
Вещество, молекулярную формулу которого мы определили, называется глицин. Это вещество имеет широкое применение в медицине. Учитель на колбу под №1 наклеивает этикетку с названием вещества. | Используя слайды, учащиеся знакомятся с биологической ролью и применением в промышленности данного вещества. |
| Слайд 4 Алгоритм нахождения химической формулы вещества по массовым долям элементов |
Далее учитель подводит учащихся к построению алгоритма решения задач на вывод молекулярной формулы. | Учащиеся проговаривают вместе с
учителем этапы решения задачи, предлагают
алгоритм решения задач данного типа и записывают
его. Алгоритм нахождения химической формулы вещества по массовым долям элементов Прочитайте текст задачи. Запишите условия и требования задачи. Число атомов элементов обозначьте через Х,Y,Z. Примите массу вещества за 100 грамм. Найдите количества вещества исходных элементов. Найдите отношение количества вещества исходных элементов. Запишите химическую формулу вещества. |
| Слайд 5 Условия задач № 2,3,4 |
Учитель организует самостоятельную работу учащихся в группах и для закрепления данного алгоритма предлагает каждой группе решить свою задачу из журнала лаборанта (№ 2,3,4). | Ребята работают в группах, проводят необходимые самостоятельные действия и сверяются с ответами. Представитель группы наклеивает на колбу название своего вещества. |
| Слайды 6,7,8 Формулы и применение полученных веществ |
Формулы и применения данных веществ представлены на слайдах с комментариями учителя. | Учащиеся знакомятся с биологической ролью и применением в промышленности данных веществ (Слайды № 6,7,8). |
| Слайд 9 Условие задачи № 5 |
– Ребята, в журнале лаборанта для
вещества под № 5 дано, что молярная масса этого
вещества больше молярной массы воздуха. Эта
величина называется относительная плотность
одного газа по другому. Прочитайте, пожалуйста, в Приложении № 2, что это за
величина и в каких единицах она измеряется. Учитель: Если в задаче дано, что относительная плотность паров вещества по водороду равна 44, то в условии необходимо записать d(Н2) = 44, если по воздуху, то d(возд) ит.д. Скажите, пожалуйста, а что мы еще можем определить по этой формуле? Учитель предлагает решить данную задачу. Активизируя работу учащихся, учитель объясняет, что найдена только простейшая формула вещества и, чтобы определить ее истинную формулу, необходимо сравнить молярную массу истиной формулы с молярной массой простейшей формулы вещества. Если разница между молярными массами больше единицы, то необходимо увеличить число атомов каждого элемента в простейшей формуле на разницу масс, т.е. учитель подводит учащихся к построению алгоритма решения задач данного типа. |
Ученики изучают Приложение 2 “Количественная характеристика газов”, осуществляют совместную деятельность в группах. Отвечают на вопросы учителя, записывают формулу для нахождения относительной плотности одного газа по другому.
Анализируя информацию, учащиеся выводят формулу нахождения молярной массы неизвестного вещества. Ученики решают задачу по известному им алгоритму, но при ее решении у них возникают затруднения.
Используя подсказку учителя, ребята завершают решение задачи. Полученное вещество – уротропин. Один из учащихся наклеивает этикетку на колбу № 5. |
| Слайд 10 Формула и применение уротропина |
Учитель демонстрирует формулу
уротропина на слайде и объясняет применение его
в промышленности. – Скажите, пожалуйста, а чем решение задач данного типа отличается от предыдущего? Какой алгоритм решения данных задач вы могли бы предложить. |
Обсуждая данную проблему в группах, учащиеся проговаривают вместе с учителем этапы решения задачи, предлагают алгоритм решения задач данного типа и вместе с учителем записывают его. |
| Слайд 11 Алгоритм нахождения химической формулы вещества по массовым долям элементов и его плотности |
Алгоритм нахождения химической
формулы вещества по массовым долям элементов и
его плотности Прочитайте текст задачи. 2. Запишите условия и требования задачи. Число атомов элементов обозначьте через Х,Y,Z. Примите массу вещества за 100 грамм. Найдите количества веществ исходных элементов по формуле n=: Найдите отношение количества вещества исходных элементов. Выведите простейшую формулу вещества. Найдите молярную массу истинной формулы. Сравните молярную массу истинную и молярную массу простейшей формулы. Выведите истинную формулу, увеличив число атомов каждого элемента в простейшей формуле в n раз. Запишите ответ. |
|
| Слайд 12 | Для закрепления данного алгоритма
каждая группа учащихся получает свою задачу.
(А.М. Радецкий. Дидактический материал по химии
10-11 с 68 № 3, с 56 № 3, с 11 № 8) Учитель акцентирует
внимание учащихся на том, что часто для
нахождения молярной массы вещества в задачах
записывают: Относительная плотность паров одного газа по другому газу равна …; Молярная масса одного вещества в … раз больше молярной массы другого; 1 л паров этого вещества имеет массу … г. |
Учащиеся самостоятельно решают задачи из дидактического материала, сверяя ответы между собой. |
| Слайд 13 Условие задачи № 6 |
Учитель: Ребята, обратите
внимание на вещество, которое находится в колбе
под № 6. Здесь нам даны не массовые доли вещества,
а продукты его сгорания. Как вы думаете, чем
решение этой задачи будет отличаться от
предыдущих алгоритмов? Учитель объясняет, что через количество вещества продуктов сгорания можно выйти на количество вещества элементов, входящих в состав вещества, также учитель акцентирует внимание учащихся на том, что при решении таких задач необходимо проверить, содержит ли данное вещество кислород, т.к. в продуктах сгорания присутствует кислород. Учитель предлагает совместно с учащимися составить новый алгоритмом решения данного типа задач с использованием продуктов сгорания вещества. |
Учащиеся анализируют алгоритмы
предыдущих задач, работают в группах, учатся
ориентироваться в своей системе знаний решения
задач, отличают новое от уже известного с помощью
учителя, учатся преобразовывать информацию из
одного вида в другой. Обращают внимание на то, что
количество вещества можно найти только у
продуктов сгорания.
В ходе обсуждения, опираясь на уже полученные знания, учащиеся совместно с учителем записывают новый алгоритм решения задач с использованием продуктов сгорания |
| Слайд 14 Алгоритм нахождения химической формулы вещества по его плотности и продуктам сгорания |
Учитель совместно с учащимися решает задачу у доски, обращая внимание на порядок ее оформления. | Алгоритм нахождения химической
формулы вещества по его плотности и продуктам
сгорания: Прочитайте текст задачи. Запишите условия и требования задачи. Найдите количества вещества продуктов реакции. Найдите количества вещества элементов, входящих в состав сгоревшего вещества. Определите, входит ли в состав вещества кислород: сложите числовые значения масс элементов, входящих в состав вещества, сопоставьте с массой сгоревшего вещества. Найдите отношение количества вещества исходных элементов и предложите простейшую формулу вещества, приняв самое маленькое число за единицу. Найдите молярную массу истинной формулы вещества. Сравните молярную массу истинной и простейшей формул. Выведите истинную формулу вещества. Запишите ответ. |
| Слайд № 15 Условия задач для каждой группы |
Далее учитель предлагает для
закрепления данного алгоритма каждой группе
решить свою задачу. Учитель записывает домашнее задание, поясняет, на что обратить внимание, предлагает творческое задание: составить задачу на нахождение молекулярной формулы вещества по любому из пройденных алгоритмов. |
Ребята решают задачу, отрабатывая
алгоритм. Учащиеся по группам решают задачу, сверяя ответы между собой. Представители групп оформляют задачи у доски. Учащиеся записывают задание в дневник. Приложение 3 |
| Рефлексивно-оценочный этап Самооценка учащимися результатов своей учебной деятельности |
Учитель вновь привлекает внимание
учащихся к целям и задачам сегодняшнего урока,
предлагает им обобщить результаты и подвести
итоги урока. Для актуализации знаний учащихся
полезно напомнить, что задачи данного типа
встречаются в ЕГЭ в заданиях с развернутым
ответом. – Ребята, что нового вы узнали сегодня? – Можно ли считать, что цели урока достигнуты? – Оцените свою деятельность на уроке, дайте оценку полученным знаниям, их значимости в дальнейшей деятельности. |
Учащиеся формируют предметно-содержательные результаты урока. Отвечают на вопросы и проводят самооценку. |
xn--i1abbnckbmcl9fb.xn--p1ai
Задачи на вывод формул органических веществ 10 класс с решением
x -8y -17 =0 {3x+4y -23 = 0 |*2 { x -8y = 17 { 6x +8y = 46 x -8y +6x+8y = 17+46 7x = 63 x= 63/7 x= 9 9 — 8y = 17 -8y = 17-9 -8y= 8 y= 8 /(-8) y= -1 ответ : ( 9 ; -1) {15x + 11y — 47 = 0 { 5x — y + 17 = 0 |*11 { 15x + 11y = 47 { 55x — 11y = -187 15x + 11y + 55x — 11y = 47 + (-187) 70x = -140 x= -140/70 x = -2 15*(-2) +.
Урок химии в 10-м классе. Тема: «Решение задач на нахождение формулы органического вещества»
Цель: применение алгоритма при решении задач на вывод формул.
Задачи:
- расширить знания учащихся о способах решения задач; закрепить навыки работы с алгоритмами; показать взаимосвязь химии и математики.
Учитель знакомит класс с темой урока, целью и задачами урока.
2. Повторение общих формул органических веществ.
Учитель предлагает учащимся назвать общие формулы алканов, алкенов, алкинов, циклоалканов, алкадиенов, типы гибридицациии атомов углерода, характерные изомерии для каждого класса.
3. Составление алгоритма для решения задач на нахождение формулы вещества по продуктам сгорания вещества, если дана относительная плотность.
1. Вычисляем молярную массу вещества.
2. Вычисляем количество атомов С:
А) если СО2 дано по массе:
N(C) = (2)
Б) если СО2 дано в объеме:
N(C) = (3)
3. Вычисляем количество атомов Н:
Так как в молекуле Н2О 2 моля Н, тогда формулу умножаем на 2 (это применимо и к N)
N(Н) = 2 (4)
4. Вычисляем молярную массу полученного вещества.
5. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
При сгорании органического вещества массой 2, 37 г образовалось 3,36 г оксида углерода(IV) (н. у.), 1,35 г воды и азот. Относительная плотность этого вещества по воздуху равна 2,724. Выведите молекулярную формулу вещества.
М(возд) = 29 г/моль
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2,724 =79 г/моль.
Находим количество атомов С по формуле (3)
N(C) = = 5
2. Находим количество атомов Н по формуле (4)
N(Н) = 2 = 5
3. Вычисляем молярную массу С5Н5.
4. Вычисляем количество атомов азота (5)
79 – 65 = 14. т. к. атомная масса азота – 14, значит в данной формулу один атом N.
4. Составление алгоритма нахождение молекулярной формулы вещества по его относительной плотности и массовой доле элементов в соединении.
1. Вычисляем молярную массу вещества.
2. Вычисляем количество атомов элемента:
N(Э) = (2)
N(Э) = (3)
3. Вычисляем молярную массу полученного вещества.
4. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
Выведите формулу вещества, содержащего 82,75% углерода и 17,25 % водорода. Относительная плотность паров этого вещества по воздуху равна 2.
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2 =58 г/моль.
2. Находим количество атомов С по формуле (2)
N(С) = = 4
3. Находим количество атомов Н по формуле (2)
N(Н) = = 1
4. Вычисляем молярную массу С4Н10
5. Вычисленная молярная масса совпадает с (1), задача решена.
Учащиеся решают задачи самостоятельно, по необходимости консультируются с учителем.
Задача 1. При сгорании 11,2 г. Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 2. При сжигании 2.2 г. вещества получили 4,4 г оксида углерода и 1,8 г. воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 3. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 4. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Гара Н. Н., Горбусева Н. И. Сборник задач. – М.:Дрофа, 2010.
Задачи: 1.5; 1.17; 2.10; 2.27.
Свидетельство о регистрации средства массовой информации ЭЛ №ФС77-69741 от 5 мая 2017 г.
Задачи на вывод формул органических веществ 10 класс с решением
Как решить вывод химических формул органических веществ
Ответы и объяснения
Алгоритм решения задач на вывод формулы вещества
Найти молярную или молекулярную массу вещества по формуле: Мr = Dх· Мr(Х), Мr = ρ· Vm.
Если в условии не дана массовая доля одного элемента, вычислить ее как разность 100% и массовых долей всех остальных элементов.
Найти отношение индексов х : у : z как отношение частных от деления массовой доли элемента на его относительную атомную массу (W/Аr). Привести частные от деления к отношению целых чисел. Определить простейшую формулу вещества.
В задачах на нахождение формул органических веществ часто требуется сравнить относительную молекулярную массу М простейшей формулы с истинной, найденной по условию задачи (чаще всего плотности по воздуху или по водороду). Отношение этих масс дает число, на которое надо умножить индексы простейшей формулы.
Задачи на вывод формул органических веществ 10 класс с решением
Урок химии в 10-м классе. Тема: «Решение задач на нахождение формулы органического вещества»
Цель: применение алгоритма при решении задач на вывод формул.
Задачи:
- расширить знания учащихся о способах решения задач; закрепить навыки работы с алгоритмами; показать взаимосвязь химии и математики.
Учитель знакомит класс с темой урока, целью и задачами урока.
2. Повторение общих формул органических веществ.
Учитель предлагает учащимся назвать общие формулы алканов, алкенов, алкинов, циклоалканов, алкадиенов, типы гибридицациии атомов углерода, характерные изомерии для каждого класса.
3. Составление алгоритма для решения задач на нахождение формулы вещества по продуктам сгорания вещества, если дана относительная плотность.
1. Вычисляем молярную массу вещества.
2. Вычисляем количество атомов С:
А) если СО2 дано по массе:
N(C) = (2)
Б) если СО2 дано в объеме:
N(C) = (3)
3. Вычисляем количество атомов Н:
Так как в молекуле Н2О 2 моля Н, тогда формулу умножаем на 2 (это применимо и к N)
N(Н) = 2 (4)
4. Вычисляем молярную массу полученного вещества.
5. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
При сгорании органического вещества массой 2, 37 г образовалось 3,36 г оксида углерода(IV) (н. у.), 1,35 г воды и азот. Относительная плотность этого вещества по воздуху равна 2,724. Выведите молекулярную формулу вещества.
М(возд) = 29 г/моль
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2,724 =79 г/моль.
Находим количество атомов С по формуле (3)
N(C) = = 5
2. Находим количество атомов Н по формуле (4)
N(Н) = 2 = 5
3. Вычисляем молярную массу С5Н5.
4. Вычисляем количество атомов азота (5)
79 – 65 = 14. т. к. атомная масса азота – 14, значит в данной формулу один атом N.
4. Составление алгоритма нахождение молекулярной формулы вещества по его относительной плотности и массовой доле элементов в соединении.
1. Вычисляем молярную массу вещества.
2. Вычисляем количество атомов элемента:
N(Э) = (2)
N(Э) = (3)
3. Вычисляем молярную массу полученного вещества.
4. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
Выведите формулу вещества, содержащего 82,75% углерода и 17,25 % водорода. Относительная плотность паров этого вещества по воздуху равна 2.
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2 =58 г/моль.
2. Находим количество атомов С по формуле (2)
N(С) = = 4
3. Находим количество атомов Н по формуле (2)
N(Н) = = 1
4. Вычисляем молярную массу С4Н10
5. Вычисленная молярная масса совпадает с (1), задача решена.
Учащиеся решают задачи самостоятельно, по необходимости консультируются с учителем.
Задача 1. При сгорании 11,2 г. Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 2. При сжигании 2.2 г. вещества получили 4,4 г оксида углерода и 1,8 г. воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 3. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 4. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Гара Н. Н., Горбусева Н. И. Сборник задач. – М.:Дрофа, 2010.
Задачи: 1.5; 1.17; 2.10; 2.27.
Свидетельство о регистрации средства массовой информации ЭЛ №ФС77-69741 от 5 мая 2017 г.

poiskvstavropole.ru