Кислота формулы — Справочник химика 21
Азотная кислота Формула HNG . [c.156]Четырехвалентный азот также содержится в азотной кислоте, формула которой, может быть записана так [c.97]
Серная кислота Формула Н ЗО . [c.162]
Изофталевая кислота (формула — стр. 652) получается при окислении мета-ксилола перманганатом калия т. пл. 348° она не образует ангидрида, возгоняется без разложения, еще хуже растворяется Б воде, чем фталевая кислота, и не имеет промышленного значения. [c.655]
ТАБЛИЦА 25.1. Структуры, названия и источники получения некоторых жирных кислот Формула или структура Название Источник получения [c.460]
Кислота Формула Константа диссоциации К [c.242]
Как противоизносные присадки к смазочным маслам предложены [пат. США 4 019 991] производные ксантогеновых кислот формулы д
В качестве антиокислительных, противоизносных и противозадирных присадок к смазочным маслам рекомендуются [англ. пат. 1287331] эфиры ДТФ кислоты формулы [c.120]
Некоторые коллоидные системы являются переходными от гидрофильных к гидрофобным. Примером может служить золь кремниевой кислоты. Формула его мицеллы [c.174]
Название кислоты Формула /[c.240]
Кислота Формула Валентная стру шура [c.82]
Сила кислородсодержащих кислот, формула которых имеет общий вид Э » Оя(ОН)я, зависит как от природы элемента [c.271]
Для иллюстрации принципа построения названий по рациональной номенклатуре рассмотрим простой пример — вещество с тривиальным (несистематическим, случайным) названием пивалиновая кислота (СНз)зС—СООН. Структуру этого вещества можно связать с более простым представителем гомологического ряда карбоновых кислот — уксусной кислотой формулу пивалиновой кислоты можно получить из формулы уксусной кислоты, заменив в последней три атома водорода на метильные группы СН3. Такой подход и отражен в рационалыюм названии триметилуксусная кислота [c.57]
Металл не будет вытеснять водорода из кислот Формула окисла ЭО2 [c.215]
Кислота Формула Название солей [c.254]
Кислота Формула плавл., °с кип., С диссоциации [c.155]
В таблице на стр. ЗП приведен состав окислов, кислот и солей, отвечающих валентности галогенов от -Ы до -Ь7. Кислоты, формулы которых набраны жирным шрифтом, известны в свободном состоянии, остальные —только в растворах. [c.310]
На основании сопоставления пространственной конфигурации правовращающей винной кислоты (формула I) с конфигурацией 0(+)-глицеринового альдегида и ряда рассуждений, которые здесь не приводятся, ее относят к D-ряду (стр. 204) и называют Z)(+)-винной кислотой] соответственно левовращающую винную кислоту (формула II) называют L —)-винной кислотой. Оптически недеятельное рацемическое соединение D- и L-винных кислот называют виноградной кислотой, а мезоформу строения III — мезовинной кислотой.
В таблице на стр. 311 приведен состав окислов, кислот и солен, отвечающих валентности галогенов от +1 до +7. Кислоты, формулы которых набраны жирным шрифтом, известны в свобод- [c.312]
Название кислородных кислот Формула Название тио-серных кислот Формула Название солей тиокислот [c.276]
Обозначим условно индикатор, представляющий собой слабую кислоту, формулой НА. Его диссоциация НА Н++А , или, по теории Бренстеда, [c.334]
Выпадающий белый осадок при высущива] и постелс Но теряет воду, превращаясь в диоксид олова. Таким образом кислоты определен лого состава получить не удается. Поэтому приведенная выше формула а-оловянной кислоты является лишь простейшей из возможных. Правильнее было бы изобразить состав этой кислоты формулой тЗпОг-яНаО. [c.523]
Многие кислоты представляют собой вещества молекулярного строения. Большинство кислот имеет один или несколько атомов водорода, которые легко отщепляются в виде ионов Н . Обычно эти атомы водорода пишутся с левой стороны формулы кислоты (см. табл. 1.10). Некоторые из веществ, не имеющих таких характерных для кислот формул, также при растворении в воде образуют кислые растворы. Одним из таких веществ является хлорид аммония Nh5 I. [c.66]
В качестве противозадирных присадок к смазочным маслам получены [а. с. СССР 1 051 073, 1 074 866] ацетоксиметиловые и ацилоксиэтиловые эфиры ксантогеновых кислот формулы [c.106]
Для вывода пространствснных формул сахаров выберем в качестве стандарта яблочную кислоту и примем для Л-яблочной кислоты формулу 1, а для -яблочной кислоты — формулу 2 [c.427]
Терефталевая кислота (формула — стр. 652) получается, например, при окислении -и-толуиловой кислоты. Возгоняется, не плавясь, при 300°. Не способна образовать ангидрид. Из терефталевой кислоты и этиленгликоля получают волокно терилен [лавсан], построенное из звеньев гликолевого эфира терефталевой кислоты -СООСН2СН2О—) ,. [c.655]
Из трех кислот, формулы которых НСЮ3 НМОд НВгОз, укажите самую сильную и самую слабую. Ответ мотивируйте. [c.80]
II-77. Какая из кислот, формулы которых Н2СО3 Н ЗЮз и НаЗОз, самая сильная и почему Ответ поясните. [c.80]
Название кислот формула Названи г солей [c.33]
Составим код протона метиновой группы в диэтиловом эфире ацетилянтарной кислоты, формула которой следующая [c.161]
Ацетилцеллюлоза (лат. асе1ит — уксус) — сложный эфир целлюлозы и уксусной кислоты. Формула [СеН,02(— О — СНзСО)з] . В квадратных скобках — формула элементарного звена, в круглых— остаток-уксусной кислоты (ацетил -СН3СО-), присоединяющийся к остатку целлюлозы через кислородный мостик (эфирная [c.240]
Производные от метакремневой кислоты соответственно называют ДИ-, три-, тетра- и т. д. метакремневыми кислотами. Формулы их нетрудно запомнить, представив их соединением одной молекулы НаО с 1, [c.491]
Пазнапис кислоты Формула Молекулярная масса Число СН,-групп [c.165]
Практически растворы со значениями рН14 не встречаются. Для таких концентрированных растворов сильных кислот и щелочей соотношение для ионного произведения воды перестает быть точным вследствие значительного взаимного влияния ионов. Для определения pH используют так называемые кислотно-щелоч-ные индикаторы, которые представляют собой слабые органические кислоты и основания, имеющие различную окраску в диссоциированной и молекулярной формах. Так, индикатор фенолфталеин представляет собой слабую органическую кислоту, формулу которой в общем виде можно представить как Hind. В водном растворе фенолфталеин диссоциирует по схеме
Водородные соединения халькогенов отвечают формуле НгЭ Н2О, h3S, НгЗе, НгТе. Они называются хальководородами. При растворении их в воде образуются кислоты (формулы те же). Сила этих кислот возрастает с ростом порядкового номера элемента. Вода, диссоциирующая на ионы Н+ и ОН , является амфотерным электролитом. [c.240]
Водородные соединения элементов подгруппы кислорода отвечают формуле НаН (Е — символ элемента) НаО, НаЗ, НаЗе, НаТе. Они называются хальководородами. При растворении их в воде образуются кислоты (формулы те же). Сила этих кислот возрастает с ростом порядкового номера элемента, что объясняется уменьшением энергии связи Б ряду соединений НаН. Вода, диссоциируюш,ая на ионы Н+ и ОН , является амфотерным электролитом. [c.174]
Водорюдные соединения элементов подгруппы кислорода отвечают формуле НгК (К — символ элемента) Н2О, НгЗ, Н28е, Нг Ге. Они называются хальководородами. При растворении их в воде образуются кислоты (формулы те же). Сила этих кислот возрастает с рюстом порядкового номера элемента, что объ энергии связи в ряду соединений НгК. Вода, диссоциирующая на ионы И и ОН», является амфотерным электролит>зм. [c.209]
chem21.info
Тема 20. Кислоты. | 8 класс
Часть I
1. Признаки кислот:
— сложные вещества;
— состоят из атомов водорода и кислотного остатков;
— в растворе образуют простые ионы H+ и сложные или простые ионы кислотного остатка — Acd.
Общая формула кислот:
, где n — заряд кислотного остатка.
2. Классификация кислот.
1) По числу атомов водорода
2) По наличию кислорода в кислотном остатке
3) По растворимости
4) По стабильности
3. Способ образования названий кислот.
1) Бескислородных.
НСl — хлороводородная кислота, h3S — сероводородная кислота.
2) Кислородсодержащих.
HNO2 — азотистая кислота, HNO3 – азотная кислота.
4.
5. Каждой кислоте соответствует свой оксид. Дополните таблицу «Кислоты и соответствующие им оксиды».

6. Кислоты изменяют окраску индикаторов. Дополните таблицу «Изменение окраски индикатора в кислой среде».
Часть II
1. Поиграйте в «крестики-нолики». Покажите выигрышный путь, который составляют формулы одноосновных кислот.
Распределите все приведённые выше кислоты по группам. Запишите их названия.
2. Дайте характеристику фосфорной кислоты h4PO4 по всем признакам классификации.
1) Кислородсодержащая
2) Трёхосновная
3) Средней силы
4) Стабильная.
3. Напишите формулы кислот и соответствующих им оксидов, образованных неметаллами в следующих степенях окисления:
4. Определите заряды ионов, степени окисления элементов в кислотах.
5. Установите соответствие между опасной ситуацией и необходимыми действиями по оказанию первой помощи во избежание химического ожога.

6. В пробирках А и Б находятся растворы гидроксида калия и соляной кислоты. Какие качественные реакции необходимо провести, чтобы определить содержимое каждой из пробирок?
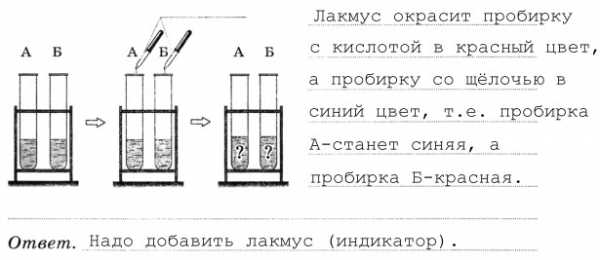
7. Установите соответствие между свойством или применением кислоты и её формулой. Из букв, соответствующих правильным ответам, вы составите название кислоты, которая широко распространена в природе и легко удаляет с тканей пятна ржавчины: лимонная.
8. Вычислите количество вещества, которое составляют 392 кг фосфорной кислоты. Сколько атомов водорода будет содержаться в этой порции кислоты?

superhimik.ru
Кислоты
Кислоты бывают:
-
бескислородные: хлороводородная (соляная) HCl, сероводородная H2S
-
кислородосодержащие: азотная HNO3, серная H2SO4 и т.д.
• По числу атомов водорода: одноосновные (HNO3), двухосновные (H2SO4) трехосновные (H3PO4).
• По растворимости: растворимые, нерстворимые (см. таблицу растворимости)
На рисунке слева представлена небольшая часть уже знакомой тебе таблицы растворимости. Под общим названием анионы расположены различные отрицательно заряженные ионы, кроме гидроксид иона ОН— все остальные – это ионы кислотных остатков.
При пересечении, например столбца иона водорода Н+ с ионом хлора Cl— мы видим ячейку в которой находится буква Р (растворяется). Это значит, что соляная кислота HCl растворяется в воде. Так определяют растворимость кислот.
Запомни: Оксид, которому соответствует кислота называется кислотный оксид: S > SO3 > H2SO4 . Кслотный оксид SO3, ему соотвествует серная кислота.
Вопрос: Как составить формулу оксида соответствующего данной кислоте?
Пример: Для серной кислоты составим соответствующий оксид. Для этого:
1. Определим степень окисления элементов в кислоте.
H2SO4 — формула серной кислоты
Степени окисления водорода и кислорода нам известны: водорода +1, кислорода -2. Неизвестна только степень окисления у серы. Обозначим её х. Подставим все степени окисления в формулу серной кислоты.
H2+1SхO4-2 т.к. для химического соединения в сумме все степени окисления равны 0, можно составить уравнение:
+1 • 2 + х + (-2) • 4 = 0
решим его:
2 + х – 8 = 0
Х = +6
все степени окисления известны: H2+1S+6O4-2
2. Степень окисления серы в серной кислоте +6. Составим оксид соответствующий серной кислоте: S+6O3-2или SO3.
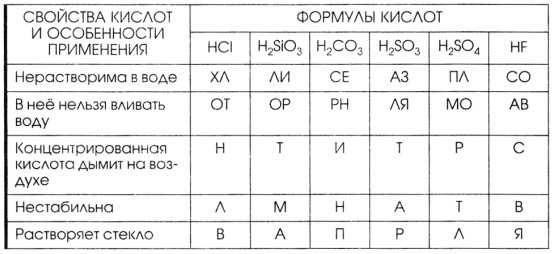
Таблица кислот и оксидов
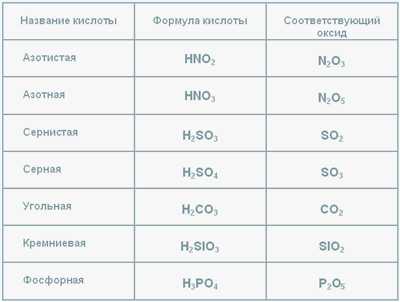
Табл.1
В таблице представленны формулы кислот, их названия и оксиды, соответствующие данной кислоте.
* * *
.
osievskaja.narod.ru
Внеклассный урок — Кислоты
Кислоты
Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода, способных замещаться, и кислотных остатков.
Кислотный остаток имеет отрицательный заряд.
По содержанию в молекуле атомов кислорода кислоты бывают бескислородные и кослородсодержащие.
Бескислородные кислоты: HCl, HBr, H2S и т.д.
Кислородсодержащие кислоты: HNO3, H2SO4, H3PO4 и т.д.
Элемент, который вместе с атомами водорода и кислорода образует молекулу кислородсодержащей кислоты, называют кислотообразующим.
По числу в молекуле атомов водорода кислоты подразделяют на одноосновные и многоосновные.
Одноосновные кислоты содержат один атом водорода: HCl, HNO3, HBr и т.д.
Многоосновные кислоты содержат два и более атомов водорода: H2SO4 (двухосновная), H3PO4 (трехосновная).
В бескислородных кислотах к названию элемента, который образует кислоту, прибавляют соединительную гласную «о» и слова «…водородная кислота». Например: HF – фтороводородная кислота.
В кислородсодержащих кислотах:
— если кислотообразующий элемент проявляет максимальную степень окисления (она соответствует номеру группы), то к названию элемента прибавляют «…ная кислота». Нопример:
+1+5-2
HNO3 – азотная кислота (потому что атом азота имеет максимальную степень окисления +5)
— если степень окисления элемента ниже максимальной, то прибавляют «…истая кислота»:
+1+3-2
HNO2 – азотистая кислота (т.к. кислотообразующий элемент N имеет минимальную степень окисления).
Кислота, содержащая наибольшее число атомов кислорода, имеет приставку «орто-»:
H3PO4 – ортофосфорная кислота.
Кислота, содержащая наименьшее число атомов кислорода, получает приставку «мета-»:
HPO3 – метафосфорная кислота.
Структурные формулы кислот.
В молекуле кислородсодержащей кислоты атом водорода связан с атомом кислотообразующего элемента через атом кислорода. Поэтому при составлении структурной формулы к атому кислотообразующего элемента в первую очередь нужно присоединить все гидроксид-ионы.
+1 +6 -2
Например, H2SO4 (рис.1):
Затем оставшиеся атомы кислорода двумя черточками соединить непосредственно с атомами кислотообразующего элемента (рис.2).
raal100.narod.ru
Формула — кислота — Большая Энциклопедия Нефти и Газа, статья, страница 1
Формула — кислота
Cтраница 1
Формула кислоты — СН3СООН; это этановая, или уксусная кислота. [1]
Формулы кислот расположены в порядке алфавита химических зна-i. [2]
Формулы кислот расположены в порядке алфавита химических знаков элементов, производными которых являются данные кислоты. [3]
Формула азотноладанной кислоты № 04) 04 отвечает двум молекулам нитробензойной кислоты. [4]
Составитьструктурную формулу кислоты и повторить ее столько раз, сколько кислотных остатков входит в состав молекулы соли. [5]
Сопоставляя формулы кислот камфолитической и — изолауронолевой, мы видим, что они отличаются друг от друга ( принимая формулу Тимана — Бредта для первой и Блана для второй): 1) положением одной метальной группы и 2) положением двойной связи. [6]
Какова формула кислоты, если плотность полученного газа в 1 037 раза больше плотности воздуха при тех же условиях, а масса углерода, вводящего в его состав, составляет 80 % от массы газа. [7]
Сравнивая формулы кислот, входящих в состав жиров, и высших жирных спиртов, легко обнаружить, что основная часть молекулы спиртов — их углеродная цепочка ( скелет) — уже имеется в кислотах в готовом виде. В различных жирах содержатся кислоты с набором углеродных атомов от 8 до 24, правда лишь с четным числом углеродных атомов. [8]
Какова формула кислоты, из натриевой соли которой может быть получен изобутан. [9]
Сравнивая формулы кислот, входящих в состав жиров, и высших жирных спиртов, легко обнаружить, что основная часть молекулы спиртов — их углеродная цепочка ( скелет) — уже имеется в кислотах в готовом виде. В различных жирах содержатся кислоты с набором углеродных атомов от 8 до 24, правда лишь с четным числом углеродных атомов. [10]
Сравнивая формулы кислоты R-СООН и эфира R — COORi, можно определить сложный эфир как производное кислоты, в молекуле которой водород карбоксила замещен углеводородным радикалом. [11]
Напишите формулы кислот: а) 2-метил-гексано — вой; б) 5-метил-гексановой; в) 2 3-диметил-пентановой; г) 3 3-диметил-пентановой. [12]
Напишите формулы кислот: а) диметил-малоно-вой; б) а, р-диметил-янтарной; в) а а-диметил-янтарной. [13]
Напишите формулы кислот: а) пентандиовой; б) гександиовой. [14]
Напишите формулы кислот: а) о-бензолдикар-боновой; б) ж-бензолдикарбоновой; в) л-бензолдикарбоно-вой. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Структурные формулы кислот
Documents войти Загрузить ×- Естественные науки
- Биология
- Биохимия
Related documents

Приложение №3. Разноуровневые задания: 1 уровень
Кислоты Электронное пособие для 8-го класса (по учебнику Рудзитис)

Разработка урока по химии для 8 класса по теме: «Кислоты»

Урок в 8 классе
Характеристика представителей карбоновых кислот
схемы метаболических путей
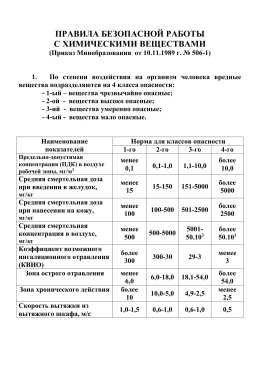
Работа с химическими веществами

10 класс ответы по химии

«Определение оптимального ряда индикаторов для титрования

Термохимическое определение теплот смешения карбоновых
Document 2395653

Муниципальное образовательное бюджетное учреждение

Урок-игра «Химическое лукошко» по теме «Урок- упражнение по теме «Кислоты. Классификация.
studydoc.ru
Формула азотистой кислоты в химии
Определение и формула азотистой кислоты

Химическая формула –
Молярная масса равна г/моль.
Физические свойства – существует в виде водного разбавленного раствора, который имеет слабый голубой оттенок, или в газовой фазе.
Химические свойства азотистой кислоты
Получение азотистой кислоты
Азотистая кислота образуется при взаимодействии оксида азота (III) с водой:
Также её можно получить при взаимодействии сильных неорганических кислот с нитритами:
Применение
Азотистая кислота используется при диазотирования первичных ароматических аминов и синтезе солей диазония.
Качественная реакция
Качественной реакцией на азотистую кислоту является образование тёмно-бурого раствора сульфата нитрозожелеза (II) при взаимодействии с в слабо кислой среде:
Примеры решения задач
ru.solverbook.com
