Гидроксиды, оксиды, соли | Задачи 165
Задача 165.
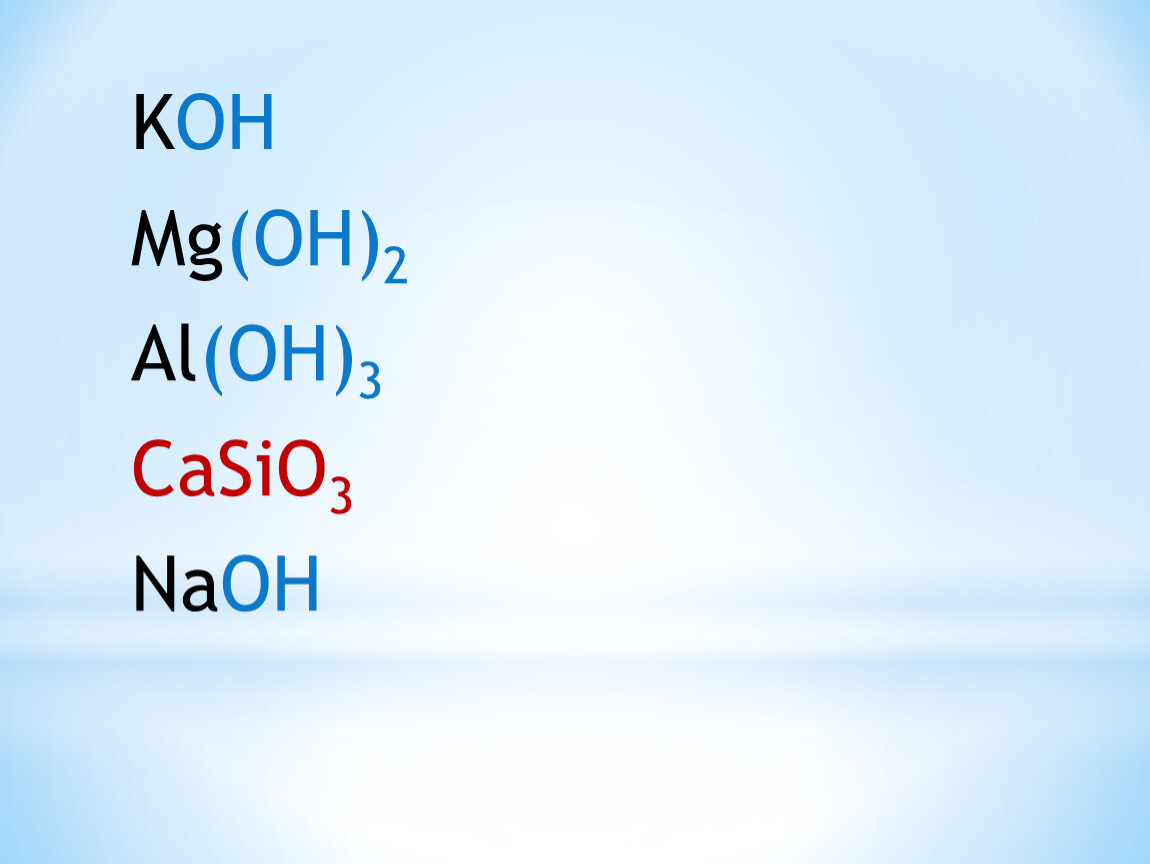
Какие из указанных гидроксидов могут образовать основные соли: а) Cu(OH)2; б) Ca(OH)2; в) LiOH; г) Al(OH)3; д) KOH.
Решение:
а) Гидроксид меди (II) Cu(OH)2 – двухкислотный гидроксид, поэтому может образовать основные соли, например сульфат гидроксомеди (II) или хлорид гидроксомеди (II), например:
б) Гидроксид кальция Ca(OH)2 — двухкислотный гидроксид, поэтому может образовать основные соли, например сульфат гидроксокальция или хлорид гидроксокальция, например:
в) Гидроксид лития LiOH — однокислотный гидроксид, поэтому не может образовывать основные соли.
г) Гидроксид алюминия Al(OH)3 – трёхкислотный гидроксид, поэтому может образовывыть одноосновные и двухосновные соли, например:
д) Гидроксид калия KOH — однокислотный гидроксид, поэтому основные соли не образует.
Ответ: а), б), г).2
Задача 166.
Ангидридом какой кислоты является Р2О5: а) фосфористой; б) двуфосфорной; в) ортофосфорной?
Решение:
Оксид фосфора Р2О5 является ангидридом ортофосфорной кислоты Н3РО4 и двуфосфорной кислоты Н4Р2О7. При взаимодействии с водой оксид фосфора (V) образует ортофосфорную и полифосфоные кислоты (в кристаллическом состоянии выделена только простейшая двуфосфорная кислота):
Р2О5 + 3H2O = 2H3PO4;
Р2О5 + 2H2O = 2Н4Р2О7.
Структурная формула ортофосфорной кислоты H3PO 4:
Структурная формула двуфосфорной кислоты Н4Р2О7:
Таким образом, двуфосфорная кислота представляет собой продукт соединения двух тетраэдров РО4-.
Ангидридом фосфористой кислоты H3PO3 является оксид фосфора (III) Р2О3, который под действием холодной воды медленно взаимодействует с ней, образуя кислоту:
Р2О3 + 3H2O = 2H3PO3
Ответ: а; б.
Задача 167.
Ангидридом какой кислоты можно считать С12О7: а) хлорной; б) хлорноватой; в) хлорноватистой?
Решение:
а) Оксид хлора (VII) С12О7 можно считать ангидридом хлорной кислоты HClO
2HClO4 + P2O5 + 2H2O = 2H3PO4 + Cl2O7
Оксид хлора (VII) С12О7 c водой не смешивается, их взаимодействие происходит на границе раздела фаз, при этом образуется хлорная кислота:
С12О7 + H2O = 2HClO4
В соединениях С12О7 и HClO4 атом хлора находится в своей степени окисления +7.
б) Ангидрид хлорноватой кислоты HClO3 не известен. При действии концентрированной серной кислоты на соль хлорноватой кислоты KClO3 вместо него выделяется жёлто-бурый газ с характерным запахом – оксид хлора (IV) ClO2.
в) Ангидридом хлорноватистой кислоты HOCl можно считать оксид хлора (I) Cl 2O, потому что в водных растворах кислоты устанавливается два равновесия:
HOCl ⇔ H+ + OCl—;
2HOCl ⇔ Cl2O + H2O
Ответ: а).
Задача 168.
Какие из приведенных соединений относятся к пероксидам а) NO2; б) K2O2; в) BaO2; г) MnO2?
Решение:
Пероксидами или перекисями называются соли перекиси водорода Н2О2. Пероксиды состоят из положительно заряжённых ионов металла и отрицательно заряжённых ионов. Степень окисления кислорода в пероксидах равна -1.
Степень окисления кислорода в пероксидах равна -1.
а) NO2 – оксид азота (IV). Степень окисления кислорода в данном соединении равна -1, а азота – равна +4. Значит, NO
б) К2О2 – пероксид калия. Степень окисления калия всегда равна +1, значит, степень окисления кислорода в этом соединении будет равна -1. Таким образом, К2О2 – пероксид.
в) ВаО2 – пероксид бария. Степень окисления бария в соединениях всегда равна +2, значит, степень окисления кислорода в данном соединении равна -1. Таким образом, ВаО2 – пероксид.
г) MnO2 – оксид марганца (IV). Степень окисления атома марганца равна +4, а степень окисления кислорода в данном соединении равна -2, значит, MnO2 – оксид.
Ответ: б), в).
Задача 169.
В реакции нейтрализации гидроксида калия ортомышьяковой кислотой эквивалентная масса последней оказалась равной 142 г/моль.
Решение:
Мольная масса ортомышьяковой кислоты равнв 142г/моль.
Уравнения реакций образования :
В реакции а) три иона H+ замещаются на K+ , т.е, N(H+) = 3. Следовательно, согласно формуле fэкв(кислоты) = 1/N(H+) фактор эквивалентности ортомышьяковой кислоты в реакции а) будет равен fэкв(H3AsO4) = 1/N(H+) = 1/3. В реакции б) два иона H+ замещаются на K+, т.е, N(H+) =2 и fэкв(H3AsO4) = 1/N(H+) = 1/2. В реакции в) один ион H+ замещаются на ион К+, т.е, N(H+) = 1 и fэкв(H3AsO4) = 1/N(H+) = 1/1. Теперь рассчитаем молярную массу эквивалента H
M(fэквВ) = fэкв(В) . М(В)
М(В)
Или для H3AsO4:
M(fэквH3AsO4) = fэкв(H3AsO4) . М(H3AsO4)
Тогда
Так как по условию задачи эквивалентная масса кислоты равна 142г/моль, что соответствует реакции в), то образовалась соль – дигидроортоарсенат калия.
Ответ: в).
Задача 170.
Какая формула соответствует марганцовистой кислоте а) НМnО4; б) H4MnO4; в) Н2MnO4?
Решение:
Марганцовистая кислота Н2MnO4 — гидроксид марганца (VI) – гидроксид марганца(VI) – неустойчивое соединение, которое уже в водном растворе диссоциирует до марганцовой кислоты НМnО4 и оксида марганца (IV) MnO2, который при растворении в воде образует гидроксид марганца (IV) h5MnO4 или Mn(OH)4:
Марганцовистой кислоте соответствует ангидрид MnO3, который в свободном виде не получен.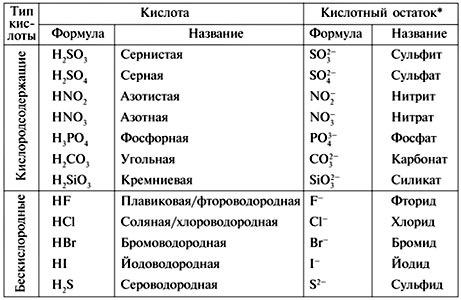 Соли марганцовистой кислоты называются манганатами, например K2MnO4. Манганаты в водных растворах имеют зеленную окраску, которую им придают манганат-ионы MnO42-. Степень окисления атома марганца в Н2MnO4 равна +6.
Соли марганцовистой кислоты называются манганатами, например K2MnO4. Манганаты в водных растворах имеют зеленную окраску, которую им придают манганат-ионы MnO42-. Степень окисления атома марганца в Н2MnO4 равна +6.
Ответ: в).
Задача 171.
Какая из формул соответствует хлорату бария: а) ВаСI
Решение:
Хлораты – соли хлорноватой кислоты HCO3. Ион ClO3— называется хлорат-ион.
а) ВаСI2 – хлорид бария – соль соляной кислоты HCl, её соли называются хлоридами.
б) Ba(OCl)2 – гипохлорит бария — соль хлорноватистой кислоты HlO, её соли называются гиипохлоритами.
в) Ва(ClO3)2 – хлорат бария – соль хлорноватой кислоты HClO3.
г) Ва(СIО2)2 – хлорит бария – соль хлористой кислоты HClO2, её соли называются хлоритами.
Ответ: в).
Задача 172.
Какое название соответствует соли (CuOH)
2CO3: а) гидрокарбонат меди; б) карбонат гидроксомеди (II) в) карбонат дигидроксомеди (II)?
Решение:
а) Гидрокарбонат меди Cu(HCO3)2 – кислая соль угольной кислоты H2CO3, в которорй один атом водорода замещён на ион меди Cu2+ . Ион HCO3— называется гидрокарбонат-ион, поэтому соли угольной кислоты, в которой один атом водорода замещён на атом металла, называют гидрокарбонаты.
б) Основная соль образуются при неполном замещении гидроксогрупп основания на кислотный остаток. Основная соль может быть образована металлом, валентность которого равна двум или больше в тех случаях, когда для реакции взято в избытке основание, например:
2Cu(OH)2 + Na2CO3 = (CuOH)2CO3 + 2NaOH
Следовательно, (CuOH)2CO3 — основная соль гидроксида меди (II) Cu(OH)2, в молекуле которого одна гидроксильная группа замещена на кислотный остаток угольной кислоты карбонат-ион CO
в) Гидроксид меди (II) Cu(OH)2 — двухкислотное основание, поэтому может образовывать только один вид основных солей, в молекулах которых одна гидроксогруппа замещена на кислотный остаток, например CuOHCl или (CuOH)2CO3. Следовательно, соль карбонат дигидроксомеди (II) не существует.
Ответ: б).
Задача 173.
Какая соль образуется при взаимодействии 1 моля гидроксида цинка и 2 молей ортофосфорной кислоты: а) ортофосфат цинка; б) дигидроортофосфат цинка; в) ортофосфат гидроксоцинка; г) гидроортофосфат цинка?
Решение:
а) Уравнение реакции получения ортофосфата цинка:
3Zn(OH)2 + 2H3PO4 = Zn3(PO4)2 + 6H2O
б) Уравнение реакции получения дигидроортофосфата цинка:
Zn(OH)2 + 2H3PO4 = Zn3(PO4)2 + 2H2O
в) Уравнение реакции получения ортофосфата гидроксоцинка:
3Zn(OH)2 + H3PO4 = (ZnOH)3PO4 + 3H2O
г) Уравнение реакции получения гидроортофосфата цинка:
Zn(OH)2 + 2H3PO4 = ZnHPO4 + 2H2O
Таким образом, из 1 моля гидроксида цинка и 2 молей орптофосфорной кислоты образуется 1 моль дигидроортофосфата цинка.
Ответ: б).
Задача 174.
Какое взаимодействие приведет к получению нормальной соли из хлорида гидроксомагния: a) MgOHCl + NaOH; б) MgOHClO3 + NaOH; в) MgOHClO3 + HCl; г) MgOHCl + HCl?
Решение:
а) В водных растворах MgOHCl и NaOH как сильные электролиты распадаются на ионы:
MgOHCl ⇔ Mg2+ + OH— + Cl—
NaOH ⇔ Na+ + OH—
Ионы Mg2+, OH—, Cl— и Na+ не связываются друг с другом и с ионами H+ с образованием осадка, газа или слабого электролита, поэтому данная реакция не идёт.
б) В водных растворах MgOHClO3 и NaOH как сильные электролиты распадаются на ионы:
MgOHClO3 ⇔ Mg2+ + OH— + ClO3—
NaOH⇔( Na+ + OH—
Ионы Mg2+, OH-, ClO3- и Na+ не связываются друг с другом и с ионами H+ с образованием осадка, газа или слабого электролита, поэтому данная реакция не идёт.
в) В водных растворах MgOHCjO3 и HCl как сильные электролиты распадаются на ионы:
MgOHClO3 ⇔ Mg2+ + OH— + ClO3—
HCl ⇔ H+ + Cl—
Из находящихся в растворе ионов Mg2+, OH—, ClO3—, Cl—, H+ ионы OH— и ионы H+ связываются друг с другом с образованием слабого электролита воды HOH, поэтому реакция протекает, и при этом образуются две соли: хлорид магния MgCl2 и хлорат магния Mg(ClO3)2:
2MgOHClO3 + 2HCl ⇔ Mg(ClO3)2 + MgCl2 + 2H2O
г) В водных растворах MgOHCl и HCl как сильные электролиты распадаются на ионы:
MgOHCl ⇔ Mg2+ + OH— + Cl—
HCl ⇔ H+ + Cl—
Из находящихся в растворе ионов Mg2+, OH—, Cl—, H+ ионы H+ и ионы OH— связываются друг с другом с образованием слабого электролита воды HOH, поэтому реакции протекает, и при этом образуется соль хлорид магния:
MgOHCl + HCl ⇔ MgCl2 + H2O
Ответ: в), г).
Химические свойства солей — реакции, определение и примеры
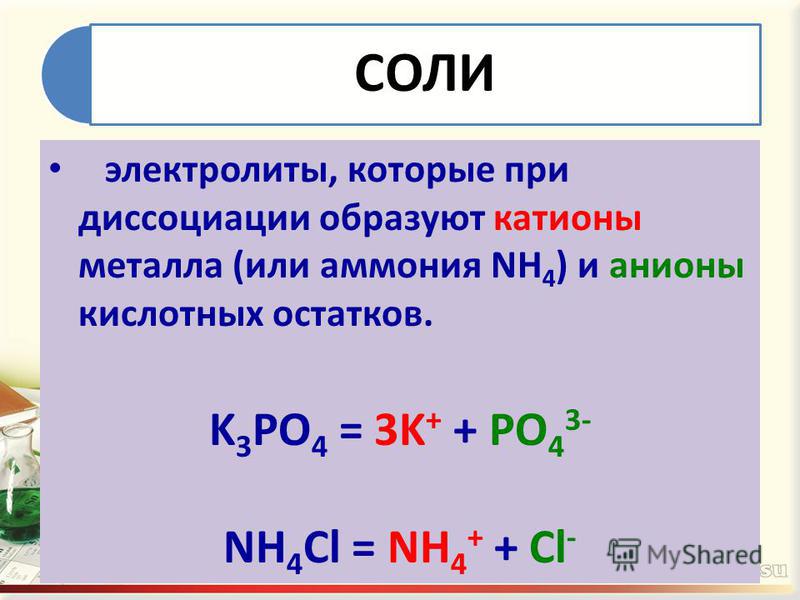
Соли — это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Классификация и номенклатура солей
Так как соли — это продукт полного или частичного замещения металлом атома водорода в кислоте, по составу их можно классифицировать следующим образом.
Кислые соли
Образованы неполным замещением атомов водорода на металл в кислоте.
В наименованиях кислых солей указывают количество водорода приставками «гидро-» или «дигидро-», название кислотного остатка и название металла. Если металл имеет переменную валентность, то в скобках указывают валентность.
Примеры кислых солей и их наименования:
LiHCO3 — гидрокарбонат лития,
NaHSO4 — гидросульфат натрия,
NaH2PO4 — дигидрофосфат натрия.

Средние соли
Образованы полным замещением атомов водорода в кислоте на металл.
Наименования средних солей складываются из названий кислотного остатка и металла. При необходимости указывают валентность.
Примеры средних солей с названиями:
CuSO4 — сульфат меди (II),
CaCl2 — хлорид кальция.
Основные соли
Продукт неполного замещения гидроксогрупп на кислотный остаток.
В наименованиях основных солей указывают количество гидроксид-ионов приставкой «гидроксо-» или «дигидроксо-», название кислотного остатка и название металла с указанием валентности.
Пример: Mg(OH)Cl — гидроксохлорид магния.
Двойные соли
В состав входят два разных металла и один кислотный остаток.
Наименование складывается из названия аниона кислотного остатка и названий металлов с указанием валентности (если металл имеет переменную валентность).
Примеры двойных солей и их наименования:
KNaSO4 — сульфат калия-натрия,
KAl(SO4)2 — сульфат калия-алюминия.

Смешанные соли
Содержат один металл и два разных кислотных остатка.
Наименования смешанных солей складываются из названия кислотных остатков (по усложнению) и названия металла с указанием валентности (при необходимости).
Примеры смешанных солей с наименованиями:
CaClOCl — хлорид-гиполхорит кальция,
PbFCl — фторид-хлорид свинца (II).
Комплексные соли
Образованы комплексным катионом или анионом, связанным с несколькими лигандами.
Называют комплексные соли по схеме: координационное число + лиганд с окончанием «-о» + комплексообразователь с окончанием «-ат» и указанием валентности + внешняя сфера, простой ион в родительном падеже.
Пример: K[Al(OH)4] — тетрагидроксоалюминат калия.
Гидратные соли
В состав входит молекула кристаллизационной воды.
Число молекул воды указывают численной приставкой к слову «гидрат» и добавляют название соли.
Пример: СuSO4∙5H2O — пентагидрат сульфата меди (II).
Получение солей
Получение средних солей
Средние соли можно образовать в ходе следующих реакций:
Металл + неметалл:
2Na + Cl2 = 2NaCl
Fe + S =FeS
Так получают только соли бескислородных кислот.
Металл, стоящий левее h3 в ряду активности, с раствором кислоты:
Mg + 2HCl = MgCl2 + h3
Металл с раствором соли менее активного металла:
Fe + CuCl2 = FeCl2 + Cu
Основный оксид + кислотный оксид:
Na2O + CO2 = Na2CO3
Основный оксид и кислота:
CuO + H2SO4= CuSO4 + H2O
Основание с кислотным оксидом:
2NaOH + SO3 = Na2SO4 + H2O
Основание с кислотой (реакция нейтрализации):
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Взаимодействие соли с кислотой:
MgCO3 + 2HCl = MgCl2 + H2O + CO2
BaCl2 + H2SO4 = BaSO4 + 2HCl
Взаимодействие возможно, если одним из продуктов реакции будет нерастворимая соль, вода или газ.

Реакция раствора основания с раствором соли:
2NaOH + CuSO4 = Na2SO4 + Ba(OH)2
Взаимодействие растворов двух солей с образованием новых солей:
NaCl + AgNO3 = AgCl + NaNO3
Получение кислых солей
Кислые соли образуются при взаимодействии:
Кислот с металлами:
Zn + 2H2SO4 = H2 + Zn(HSO4)2
Кислот с оксидами металлов:
CaO + H3PO4 = CaHPO4 + H2O
Гидроксидов металлов с кислотами:
Ba(OH)2 + H3PO4 = BaHPO4 + 2H2O
Кислот с солями:
Ca3PO4 + 4H3PO4 = 3Ca(H2PO4)2
Аммиака с кислотами:
NH3 + H3PO4 = NH4H2PO4
Получение кислых солей возможно, если кислота в избытке.
Также кислые соли образуются в ходе реакции основания с избытком кислотного оксида:
KOH + CO2 = KHCO3
2SO2 + Ca(OH)2 = Ca(HSO3)2
Получение основных солей
Взаимодействие кислоты с избытком основания:
Fe(OH)3 + HCl = Fe(OH)2Cl + H2O
Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
Cu(NO3)2 + NaOH = CuOHNO3 + NaNO3
Взаимодействие солей слабых кислот со средними солями:
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl
Растворимые соли являются электролитами, следовательно, могут распадаться на ионы.
 Средние соли диссоциируют сразу:
Средние соли диссоциируют сразу:NaCl → Na+ + Cl—
Термическое разложение:
CaCO3 = CaO + CO2
Нитраты разлагаются в зависимости от активности металла соли:
Получение комплексных солей
Реакции солей с лигандами:
AgCl + 2Nh4 = [Ag(NH3)2]Cl
FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Al2O3 + 2NaOH +3H2O = 2Na[Al(OH)4]
Получение двойных солей
Двойные соли получают совместной кристаллизацией двух солей:
Cr2(SO4)3 + K2SO4 + 24H2O = 2[KCr(SO4) 2 • 12H2O]
Химические свойства солей
Химические свойства средних солей
Урок по химии по теме «СОЛИ» (8 класс)
Запишите тему нашего урока в лист контроля на вашем столе.
Изучение нового материала.
Лист контроля
Парная работа.
Прочитайте в учебнике на стр. 171, и заполните в листе контроля что такое «Соли и способы их получения».
Учащимся необходимодать определение солям и изучить способы получения солей.
Соли — ____вещества, состоящие из атомов _______и _______остатка.
Получение средних солей
Ca+H2SO4=
Получение кислых солей (при 1основных кислотах не может быть кислых солей)
Li+H3PO4=
Li+H3PO4=
LiOH+H3PO4=
с) Получение основных солей
Mg(OH)2+HBr=
Al(OH)3+HBr=
Al(OH)3+HBr=
Учитель контролирует работу учащихся, следит за правильностью написания уравнений реакций.
Формативное оценивание (ФО) «Светофор»
Зеленый-все правильно
Желтый — есть ошибки
Красный – непонятно, есть вопросы
Похвала, одобрение.
На стр. 172 и 173 изучите схему 5. Классификация солей и название солей.
Учащимся необходимо изучить классификацию солей и дать название им.
Классифицируйте и назовите следующие соли: Na2SO4, NaHCO3, Al(OH)SO4, Al2(SO4)2, CaHPO3, Ca3(PO4)2
Учитель контролирует работу учащихся, следит за правильностью написания уравнений реакций.
Формативное оценивание (ФО) «Перекрестный вопрос»
Учащиеся задают вопросы друг другу
Похвала, одобрение.
На стр. 172 изучите материал составление формул
Учащимся необходимо изучить составлениесолей.
Составьте формулы:
NaF
CaH2PO4
AlHSO4
Zn(OH) Br
Al(OH)2Cl
Учитель контролирует работу учащихся, следит за правильностью написания формул.
Формативное оценивание (ФО) «бальная система»
5 баллов – отлично
4 балла – хорошо
3 балла – удовлетворительно
2 и менее баллов – нужно повторить материал еще раз
Похвала, одобрение.
Индивидуальное задание
Физические свойства солей. Записать краткую информацию себе в тетрадь.
Классификация неорганических веществ, подготовка к ЕГЭ по химии
Неорганическая химия — раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В
этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении
химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO — соответствует основанию Cu(OH)2
- Li2O — соответствует основанию LiOH
- FeO — соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 — соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 — соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
- Основные
- Амфотерные (греч. ἀμφότεροι — двойственный)
- Кислотные
- SO2 — H2SO3
- SO3 — H2SO4
- P2O5 — H3PO4
- N2O5 — HNO3
- NO2 — HNO2, HNO3
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются
исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
В химических реакциях основные оксиды проявляют основные свойства, образуются
исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Li2O + P2O5 → Li3PO4 (осн. оксид + кисл. оксид = соль)
Li2O + H3PO4 → Li3PO4 + H2O (осн. оксид + кислота = соль + вода)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
Fe2O3 + K2O → (t) KFeO2 (амф. оксид + осн. оксид = соль)
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять
степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 — не реагирует с водой, так как продукт реакции — H2SiO3 является нерастворимой кислотой.
Mn2O7 + H2O → HMnO4 (сохраняем СО марганца +7)
SO3 + H2O → H2SO4 (сохраняем СО серы +6)
SO2 + H2O → H2SO3 (сохраняем СО серы +4)
Несолеобразующие оксиды — оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования. К таким оксидам относят:
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания — химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов. Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр — NaOH, едкое кали — KOH.
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания
способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода — реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
LiOH + MgCl2 → LiCl2 + Mg(OH)2↓
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами — с образованием соли и воды, так и с основаниями — с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода — при высоких температурах вода испаряется, и комплексная соль образоваться не может)
Кислоты
Кислота — химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации
кислоты подразделяются на одно-, двух- и трехосновные.
По классификации
кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней — часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 — двухосновной кислотой.
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода — реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду — угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде «H2CO3 или H2SO3» — будет считаться ошибкой. Пишите угольную
и сернистую кислоты в разложившемся виде — виде газа и воды.
Пишите угольную
и сернистую кислоты в разложившемся виде — виде газа и воды.
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной — серную кислоту. Природу не обманешь :)
K2S + HCl → H2S + KCl (из сильной — соляной кислоты — получили более слабую — сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной — серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т. д., некоторые кислоты также считаются кислотными
гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
д., некоторые кислоты также считаются кислотными
гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Соли
Соль — ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль — NaCl.
По классификации соли бывают:
- Средние — продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые — продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и гидрофосфат натрия)
- Основные — продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные — содержат два разных металла и один кислотный остаток (NaCr(SO4)2)
- Смешанные — содержат один металл и два кислотных остатка MgClBr (хлорид-бромид магния
- Комплексные — содержат комплексный катион или анион — атом металла, связанный с несколькими лигандами: Na[Cr(OH)4] (тетрагидроксохромат натрия)
Растворы или расплавы солей могут вступать в реакцию с металлом, который расположен левее металла, входящего в состав соли. В этом случае более
активный металл вытеснит менее активный из раствора соли. Например, железо способно вытеснить медь из ее солей:
В этом случае более
активный металл вытеснит менее активный из раствора соли. Например, железо способно вытеснить медь из ее солей:
Fe + CuSO4 → FeSO4 + Cu (железо стоит левее меди в ряду активности и способно вытеснить медь из ее солей)
Замечу важную деталь: исход реакции основание + кислота иногда определяет соотношение. Запомните, что если двух- или трехосновная кислота дана в избытке — получается кислая соль, если же в избытке дано основание — средняя соль.
NaOH + H2SO4 → NaHSO4 (кислота дана в избытке)
2NaOH + H2SO4 → Na2SO4 + H2O (основание дано в избытке)
Если в ходе реакции соли с кислотой, основанием или другой солью выпадает осадок, выделяется газ или образуется слабый электролит (вода),
то такая реакция идет. Кислую соль также можно получить в реакции соли с соответствующей двух-, трехосновной кислотой.
Кислую соль также можно получить в реакции соли с соответствующей двух-, трехосновной кислотой.
Na2CO3 + HCl → NaCl + H2O + CO2↑ (сильная кислота — соляная, вытесняет слабую — угольную)
MgCl2 + LiOH → Mg(OH)2↓ + LiCl
K2SO4 + H2SO4 → KHSO4 (средняя соль + кислота = кислая соль)
Чтобы сделать из кислой соли — среднюю соль, нужно добавить соответствующее основание:
KHSO4 + KOH → K2SO4 + H2O (кислая соль + основание = средняя соль)
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
5.5 Реакции нейтрализации — Введение в химию — 1-е канадское издание / NSCC Edition
Цели обучения
- Определите кислоту и основание.
- Определите реакцию нейтрализации и предскажите ее продукты.
В главе 3 «Атомы, молекулы и ионы», раздел 3.5 «Кислоты», мы определили кислоту как ионное соединение, содержащее H + в качестве катиона. Это немного неверно, но пока не были разработаны дополнительные понятия, нужно было подождать лучшего определения.Теперь мы можем дать новое определение кислоте: кислота — это любое соединение, которое увеличивает количество иона водорода (H + ) в водном растворе. Химической противоположностью кислоты является основание. Эквивалентное определение основания состоит в том, что основание – это соединение, которое увеличивает количество гидроксид-иона (OH — ) в водном растворе. Эти первоначальные определения были предложены Аррениусом (тот же человек, который предложил диссоциацию ионов) в 1884 году, поэтому они называются определением по Аррениусу кислоты и основания соответственно.
Химической противоположностью кислоты является основание. Эквивалентное определение основания состоит в том, что основание – это соединение, которое увеличивает количество гидроксид-иона (OH — ) в водном растворе. Эти первоначальные определения были предложены Аррениусом (тот же человек, который предложил диссоциацию ионов) в 1884 году, поэтому они называются определением по Аррениусу кислоты и основания соответственно.
Вы можете понять, что, основываясь на описании атома водорода, ион H + представляет собой атом водорода, потерявший свой одинокий электрон; то есть H + — это просто протон. Действительно ли у нас есть голые протоны, движущиеся в водном растворе? Нет. Более вероятно, что ион H + присоединился к одной (или нескольким) молекулам воды. Чтобы представить это химически, мы определяем ион гидроксония H 3 O + (водный раствор), молекулу воды с присоединенным к ней дополнительным ионом водорода. как H 3 O + , что представляет собой дополнительный протон, присоединенный к молекуле воды. Мы используем ион гидроксония как более логичный способ появления иона водорода в водном растворе, хотя во многих химических реакциях H + и H 3 O + рассматриваются эквивалентно.
как H 3 O + , что представляет собой дополнительный протон, присоединенный к молекуле воды. Мы используем ион гидроксония как более логичный способ появления иона водорода в водном растворе, хотя во многих химических реакциях H + и H 3 O + рассматриваются эквивалентно.
Реакция кислоты и основания называется реакцией нейтрализации. Хотя кислоты и основания имеют свой собственный уникальный химический состав, кислота и основание нейтрализуют химический состав друг друга, образуя довольно безобидное вещество — воду.На самом деле, общая реакция между кислотой и основанием
кислота + основание → вода + соль
, где термин соль обычно используется для определения любого ионного соединения (растворимого или нерастворимого), которое образуется в результате реакции между кислотой и основанием. (В химии слово соль относится не только к поваренной соли.) Например, сбалансированное химическое уравнение реакции между HCl (водн. ) и KOH (водн.) имеет вид
) и KOH (водн.) имеет вид
HCl(водн.) + KOH(водн.) → H 2 O(л) + KCl(водн.)
, где солью является KCl.Подсчитав количество атомов каждого элемента, мы находим, что в качестве продукта образуется только одна молекула воды. Однако в реакции между HCl(водн.) и Mg(OH) 2 (водн.) требуются дополнительные молекулы HCl и H 2 O, чтобы сбалансировать химическое уравнение:
2 HCl(водн.) + Mg(OH) 2 (водн.) → 2 H 2 O(л) + MgCl 2 (водн.)
Здесь соль MgCl 2 . (Это одна из нескольких реакций, которые происходят, когда тип антацида — основание — используется для лечения желудочной кислоты.)
Пример 11
Напишите реакции нейтрализации каждой кислоты и основания.
- HNO 3 (водн.) и Ba(OH) 2 (водн.)
- H 3 PO 4 (водн.) и Ca(OH) 2 (водн.)
Раствор
Сначала мы напишем химическое уравнение с формулами реагентов и ожидаемых продуктов; тогда мы сбалансируем уравнение.
-
Ожидаемыми продуктами являются вода и нитрат бария, поэтому начальная химическая реакция
.HNO 3 (водн.) + Ba(OH) 2 (водн.) → H 2 O(л) + Ba(NO 3 ) 2 (водн.)
Чтобы сбалансировать уравнение, нам нужно понять, что будет две молекулы H 2 O, поэтому требуются две молекулы HNO 3 :
2HNO 3 (водн.) + Ba(OH) 2 (водн.) → 2H 2 O(л) + Ba(NO 3 ) 2 (водн.)
Это химическое уравнение теперь сбалансировано.
-
Ожидаемыми продуктами являются вода и фосфат кальция, поэтому исходное химическое уравнение имеет вид
.H 3 PO 4 (водн.) + Ca(OH) 2 (водн.) → H 2 O(л) + Ca 3 (PO 4 0 9 90 28 ) 2 900
Согласно правилам растворимости, Ca 3 (PO 4 ) 2 нерастворим, поэтому он имеет метку фазы (s).
 Чтобы сбалансировать это уравнение, нам нужны два иона фосфата и три иона кальция; мы получаем шесть молекул воды, чтобы сбалансировать уравнение:
Чтобы сбалансировать это уравнение, нам нужны два иона фосфата и три иона кальция; мы получаем шесть молекул воды, чтобы сбалансировать уравнение: 2 H 3 PO 4 (водн.) + 3 Ca(OH) 2 (водн.) → 6 H 2 O(л) + Ca 3 (PO 4 2 8
2 с)Это химическое уравнение теперь сбалансировано.
Проверь себя
Напишите реакцию нейтрализации между H 2 SO 4 (водн.) и Sr(OH) 2 (водн.).
Ответить
H 2 SO 4 (водн.) + Sr(OH) 2 (водн.) → 2 H 2 O(л) + SrSO 4 (водн.)
Реакции нейтрализации — это один из видов химических реакций, которые протекают, даже если один из реагентов не находится в водной фазе. Например, химическая реакция между HCl(aq) и Fe(OH) 3 (s) по-прежнему протекает по уравнению
3 HCl(водн.) + Fe(OH) 3 (т) → 3 H 2 O(л) + FeCl 3 (водн. )
)
, хотя Fe(OH) 3 не растворяется.Когда известно, что Fe(OH) 3 (s) является компонентом ржавчины, это объясняет, почему некоторые чистящие растворы для пятен ржавчины содержат кислоты — в результате реакции нейтрализации образуются растворимые и смываемые продукты. (Одним из способов удаления ржавчины и пятен ржавчины является промывка кислотами, такими как HCl, но HCl следует использовать с осторожностью!)
Полные и суммарные ионные реакции для реакций нейтрализации будут зависеть от того, растворимы ли реагенты и продукты, даже если кислота и основание реагируют.Например, в реакции HCl (водн.) и NaOH (водн.)
HCl(водн.) + NaOH(водн.) → H 2 O(л) + NaCl(водн.)
полная ионная реакция
H + (водн.) + Cl — (водн.) + Na + (водн.) + OH — (водн.) → H 2 O(л) + Na + (водн.) Cl – (водный)
Ионы Na + (водн. ) и Cl — (водн.) являются ионами-спектаторами, поэтому мы можем удалить их, чтобы получить
) и Cl — (водн.) являются ионами-спектаторами, поэтому мы можем удалить их, чтобы получить
H + (водн.) + OH − (водн.) → H 2 O(л)
как результирующее ионное уравнение.Если бы мы хотели записать это в терминах иона гидроксония, H 3 O + (водн.), мы бы написали это как
H 3 O + (водн.) + OH − (водн.) → 2H 2 O(л)
За исключением введения дополнительной молекулы воды, эти два суммарных ионных уравнения эквивалентны.
Однако для реакции между HCl(aq) и Cr(OH) 2 (s), поскольку гидроксид хрома(II) нерастворим, мы не можем разделить его на ионы для полного ионного уравнения:
2 H + (водн.) + 2 Cl − (водн.) + Cr(OH) 2 (т) → 2 H 2 O(л) + Cr 2+ (водн.) + 2 Cl – (водный)
Ионы хлорида являются здесь единственными ионами-наблюдателями, поэтому результирующее ионное уравнение имеет вид
.
2 H + (водн.) + Cr(OH) 2 (т) → 2 H 2 O(л) + Cr 2+ (водн.)
Пример 12
Щавелевая кислота, H 2 C 2 O 4 (с) и Ca(OH) 2 (с) реагируют очень медленно.Каково общее ионное уравнение между этими двумя веществами, если образовавшаяся соль нерастворима? (Анион в щавелевой кислоте представляет собой оксалат-ион, C 2 O 4 2− .)
Решение
Продуктами реакции нейтрализации будут вода и оксалат кальция:
H 2 C 2 O 4 (с) + Ca(OH) 2 (с) → 2 H 2 O(ℓ) + CaC 2 O 9 (0 )
Поскольку ничего не растворяется, нет веществ, которые можно разделить на ионы, поэтому суммарное ионное уравнение представляет собой уравнение трех твердых тел и одного жидкого. Проверь себя Какое общее ионное уравнение между HNO 3 (водн. Ответить 4 H + (водн.) + Ti(OH) 4 (т) → 4 H 2 O(ℓ) + Ti 4+ (водн.) Многие продукты и напитки содержат кислоты. Кислоты придают кислый вкус пищевым продуктам, что может сделать их более приятными. Например, апельсиновый сок содержит лимонную кислоту H 3 C 6 H 5 O 7 .Обратите внимание, как эта формула показывает атомы водорода в двух местах; первые записанные атомы водорода — это атомы водорода, которые могут образовывать ионы H + , а вторые записанные атомы водорода являются частью цитрат-иона, C 6 H 5 O 7 3− . Лимоны и лаймы содержат гораздо больше лимонной кислоты — примерно в 60 раз больше, — поэтому эти цитрусовые более кислые, чем большинство апельсинов. Уксус представляет собой примерно 5% раствор уксусной кислоты (HC 2 H 3 O 2 ) в воде. В таблице 5.2 «Различные кислоты, содержащиеся в пищевых продуктах и напитках» перечислены некоторые кислоты, содержащиеся в пищевых продуктах либо в естественном виде, либо в виде добавок. Часто в качестве добавок используются соли кислотных анионов, такие как глутамат натрия (MSG), который представляет собой натриевую соль, полученную из глутаминовой кислоты.Читая список, вы должны прийти к неизбежному выводу, что избежать кислот в еде и напитках невозможно. Что такое определение кислоты по Аррениусу? Что такое определение основания по Аррениусу? Предскажите продукты каждой из перечисленных кислотно-основных комбинаций.Предположим, что идет реакция нейтрализации. а) HCl и KOH б) H 2 SO 4 и KOH c) H 3 PO 4 и Ni(OH) 2 4. Спрогнозируйте продукты каждой из перечисленных кислотно-основных комбинаций. Предположим, что идет реакция нейтрализации. а) HBr и Fe(OH) 3 б) HNO 2 и Al(OH) 3 c) HClO 3 и Mg(OH) 2 5.Напишите сбалансированное химическое уравнение для каждой реакции нейтрализации в упражнении 3. 6. Напишите сбалансированное химическое уравнение для каждой реакции нейтрализации в упражнении 4. 7. Напишите сбалансированное химическое уравнение для реакции нейтрализации между каждой заданной кислотой и основанием. Включите правильные метки фазы. а) HI(водн.) + КОН(водн.) → ? b) H 2 SO 4 (водн.) + Ba(OH) 2 (водн.) → ? 8.Напишите сбалансированное химическое уравнение реакции нейтрализации между каждой данной кислотой и основанием. Включите правильные метки фазы. а) HNO 3 (водн.) + Fe(OH) 3 (т) → ? b) H 3 PO 4 (водн. 9. Напишите суммарное ионное уравнение для каждой реакции нейтрализации в упражнении 7. 10. Напишите суммарное ионное уравнение для каждой реакции нейтрализации в упражнении 8. 11. Напишите полное и сводное ионное уравнения для реакции нейтрализации между HClO 3 (водн.) и Zn(OH) 2 (т). Предположим, что соль растворима. 12. Напишите полное и сводное ионное уравнения для реакции нейтрализации между H 2 C 2 O 4 (т) и Sr(OH) 2 (водн.). Предположим, что соль нерастворима. 13. Объясните, почему результирующее ионное уравнение для реакции нейтрализации между HCl (водн.) и KOH (водн.) совпадает с результирующим ионным уравнением для реакции нейтрализации между HNO 3 (водн.) и RbOH. 14. Объясните, почему результирующее ионное уравнение для реакции нейтрализации между HCl (водн. 15. Напишите полное и сводное ионное уравнения для реакции нейтрализации между HCl (водн.) и KOH (водн.), используя ион гидроксония вместо H + . Какая разница при использовании иона гидроксония? 16.Напишите полное и сводное ионное уравнения для реакции нейтрализации между HClO 3 (водн.) и Zn(OH) 2 (т), используя ион гидроксония вместо H + . Предположим, что соль растворима. Какая разница при использовании иона гидроксония? Ответы Кислота Аррениуса увеличивает количество ионов H + в водном растворе. 3. а) KCl и H 2 O б) K 2 SO 4 и H 2 O c) Ni 3 (PO 4 ) 2 и H 2 O 5. а) HCl + KOH → KCl + H 2 O b) H 2 SO 4 + 2 KOH → K 2 SO 4 + 2 H 2 O c) 2 H 3 PO 4 + 3 Ni(OH) 2 → Ni 3 (PO 4 ) 2 + 6 H 2 2
7. a) HI(водн.) + KOH(водн.) → KCl(водн.) + H 2 O(л) b) H 2 SO 4 (водн.) + Ba(OH) 2 (водн.) → BaSO 4 (т) + 2 H 2 O(л) 9. а) H + (водн.) + OH − (водн.) → H 2 O(л) б) 2 H + (водн.) + SO 4 2− (водн.) + Ba 2+ (водн.) + 2 OH − (водн.) → BaSO 4 2 Н 2 О(ℓ) 11. Полное ионное уравнение: 2 H + (водн.) + 2 ClO 3 − (водн.) + Zn 2+ (водн. Суммарное ионное уравнение: 2 H + (водн.) + 2 OH − (водн.) → 2 H 2 O(ℓ) 13.Поскольку в обоих случаях соли растворимы, чистая ионная реакция представляет собой просто H + (водн.) + OH — (водн.) → H 2 O (л). 15. Полное ионное уравнение: H 3 O + (водн.) + Cl − (водн.) + K + (водн.) + OH − (водн.) → 2 H 2 O(л) + K (водн.) + Cl − (водн.) Суммарное ионное уравнение: H 3 O + (водн.) + OH − (водн.) → 2 H 2 O(ℓ) Разница заключается просто в присутствии дополнительной молекулы воды в качестве продукта. Термин «нерастворимый» часто применяется к плохо или очень плохо растворимым соединениям. Обычный порог для описания чего-либо как нерастворимого составляет менее 0,1 г на 100 мл растворителя. Свойства ионных соединений, рабочий лист с ответами.Нарисуйте структуры точек Льюиса следующих атомов и соответствующих им ионов. БЛОК 3: Химическая связь. Это ключ ответа на рабочий лист ионных соединений много раз для выбранных ими чтений, таких как этот ключ ответа рабочего листа ионных соединений, но в конечном итоге попадает в вредоносные загрузки. Заголовок. 6 йодид калия KI 7 оксид магния MgO 8 алюминий … Соединения Ответы на рабочий лист Химические формулы Названия ионных соединений Ответы на рабочий лист | (Ключ с ответами включен) ХимияХимия и физика для медсестринской анестезии, второе изданиеИзучение физических наук во вводных и общих курсах химии, а также пустые рабочие листы, содержащие дополнительные практические задачи и вопросы. ) и Ti(OH) 4 (тв.)?
) и Ti(OH) 4 (тв.)? Приложение «Еда и напитки»: Кислоты в продуктах питания
 Яблоки содержат яблочную кислоту (H 2 C 4 H 4 O 5 ; название яблочная кислота происходит от ботанического названия рода яблок, malus ), а молочная кислота (HC ) 5 O 3 ) содержится в вине и кисломолочных продуктах, таких как йогурт и некоторые твороги.
Яблоки содержат яблочную кислоту (H 2 C 4 H 4 O 5 ; название яблочная кислота происходит от ботанического названия рода яблок, malus ), а молочная кислота (HC ) 5 O 3 ) содержится в вине и кисломолочных продуктах, таких как йогурт и некоторые твороги.
Название кислоты
Формула кислоты
Использование и внешний вид
уксусная кислота
HC 2 H 3 O 2
ароматизатор; найдено в уксусе
адипиновая кислота
Н 2 С 6 Н 8 О 4
ароматизатор; содержится в обработанных пищевых продуктах и некоторых антацидах
альгиновая кислота
различные
загуститель ; содержится в напитках, мороженом и продуктах для похудения
аскорбиновая кислота
HC 6 H 7 O 6
антиоксидант , также известный как витамин С; содержится во фруктах и овощах
бензойная кислота
HC 6 H 5 CO 2
консервант; содержится в обработанных пищевых продуктах
лимонная кислота
Н 3 С 6 Н 5 О 7
ароматизатор; содержится в цитрусовых
дегидроуксусная кислота
HC 8 H 7 O 4
консервант, особенно для клубники и тыквы
эритробиновая кислота
HC 6 H 7 O 6
антиоксидант ; содержится в обработанных пищевых продуктах
жирные кислоты
различные
загуститель и эмульгатор ; содержится в обработанных пищевых продуктах
фумаровая кислота
Н 2 С 4 Н 2 О 4
ароматизатор; кислотный реагент в некоторых разрыхлителях
глутаминовая кислота
H 2 C 5 H 7 НЕТ 4
ароматизатор; содержится в обработанных пищевых продуктах и помидорах, некоторых сырах и соевых продуктах
молочная кислота
HC 3 H 5 O 3
ароматизатор; содержится в вине, йогурте, твороге и других кисломолочных продуктах
яблочная кислота
Н 2 С 4 Н 4 О 5
ароматизатор; содержится в яблоках и незрелых фруктах
фосфорная кислота
H 3 Заказ на покупку 4
ароматизатор; встречается в некоторых колах
пропионовая кислота
HC 3 H 5 O 2
консервант; найдено в выпечке
сорбиновая кислота
HC 6 H 7 O 2
консервант; содержится в обработанных пищевых продуктах
стеариновая кислота
HC 18 H 35 O 2
агент против слеживания; найдено в леденцах
янтарная кислота
Н 2 С 4 Н 4 О 4
ароматизатор; содержится в вине и пиве
винная кислота
Н 2 С 4 Н 4 О 6
ароматизатор; содержится в винограде, бананах и тамариндах
Ключевые выводы

Упражнения
 ) + CsOH (водн.) → ?
) + CsOH (водн.) → ?  ) и KOH (водн.) отличается от результирующего ионного уравнения для реакции нейтрализации между HCl (водн.) и AgOH.
) и KOH (водн.) отличается от результирующего ионного уравнения для реакции нейтрализации между HCl (водн.) и AgOH.
 ) + 2 OH − (водн.) → Zn 2+ (водн.) ClO 3 − (водн.) + 2 H 2 O(ℓ)
) + 2 OH − (водн.) → Zn 2+ (водн.) ClO 3 − (водн.) + 2 H 2 O(ℓ) Является ли (Nh5)3PO4 (фосфат аммония) растворимым или нерастворимым в воде?
Вопрос: (Nh5)3PO4 (фосфат аммония) растворим или нерастворим в воде?
Ответ: (Nh5)3PO4 (фосфат аммония) растворим в воде
Что такое растворимый и нерастворимый?
Растворимость
Растворимость – это свойство твердого, жидкого или газообразного химического вещества, называемого растворенным веществом, растворяться в твердом, жидком или газообразном растворителе. Растворимость вещества в основном зависит от физических и химических свойств растворенного вещества и растворителя, а также от температуры, давления и рН раствора. Степень растворимости вещества в конкретном растворителе измеряется как концентрация насыщения, при которой добавление большего количества растворенного вещества не увеличивает концентрацию раствора и начинает осаждаться избыточное количество растворенного вещества. Растворимость вещества — это свойство, совершенно отличное от скорости растворения, то есть от того, насколько быстро оно растворяется.
Растворимость вещества в основном зависит от физических и химических свойств растворенного вещества и растворителя, а также от температуры, давления и рН раствора. Степень растворимости вещества в конкретном растворителе измеряется как концентрация насыщения, при которой добавление большего количества растворенного вещества не увеличивает концентрацию раствора и начинает осаждаться избыточное количество растворенного вещества. Растворимость вещества — это свойство, совершенно отличное от скорости растворения, то есть от того, насколько быстро оно растворяется.
https://en.wikipedia.org/wiki/Растворимость
Нерастворимый
https://en.wikipedia.org/wiki/Растворимость
Список растворимых веществ
KClO3 (хлорат калия)
KNO3 (нитрат калия)
K2CO3 (карбонат калия)
бромид)
NaI (йодид натрия)
KC2h4O2 (ацетат калия)
FeSO4 (сульфат железа (II))
CuSO4 (сульфат меди)
Na2S (сульфид натрия)
Na3PO4 (тринатрийфосфат)
RbCl (хлорид рубидия 2) Ba 9107 Бромид бария)
AlCl3 (хлорид алюминия)
HNO3 (азотная кислота)
FeCl2 (дихлорид железа)
BaI2 (йодид бария)
MnCl2 (хлорид марганца)
AgClO3 (хлорат серебра)
CoBr2 (бромид кобальта2)
CoBr2 (бромид кобальта2) 9107S )
CuCl2 (хлорид меди)
K3PO4 (фосфат калия)
KI (йодид калия)
(Nh5)2SO4 (СУЛЬФАТ АММОНИЯ)
Na2CO3 (карбонат натрия)
CaBr2 (бромид кальция)
Li3PO4
Nh5NO3 (нитрат аммония)
HgCl2 (хлорид ртути(II) )
BaCl2 (хлорид бария)
NaSO4 (сульфат натрия)
HCl (соляная кислота)
AgC2h4O2 (ацетат серебра)
pb(c2h4o2)2 (свинец(II) Ацетат)
KSO4
Li2Co3 (литиевый карбонат)
LI2S (литиевый сульфид)
Hg2so4 (серсурный сульфат)
Pb (NO3) 2 (свинец-обедая)
NH5CL (аммониевый хлористый)
NH5OH (гидроксид аммония)
ZnSO4 (сульфат аммония)
CACRO4 (хромат кальция)
CSOH (гидроксид цезия)
(NH5) 3PO4 (фосфат аммония)
LiOH (гидроксид лития)
BAS (сульфид бария)
K2SO4 (сульфат калия)
Na2SO4 (сульфат натрия)
NICL2 (никель хлорид) )
NiBr2 (бромид никеля)
MgSO4 (сульфат магния)
Nh5I (йодид аммония)
HgCl2 (хлорид ртути)
MgCl2 (хлорид магния)
h3SO4 (серная кислота)
Na3PO4 (фосфат натрия)
Cu(NO3)2 (нитрат меди(II) )
AgNO3 (нитрат серебра)
MgC2O4 (оксалат магния)
Na2CO3 (карбонат натрия)
KCl (хлорид калия)
Al2(SO4) 3 (сульфат алюминия)
Ca(NO3)2 (нитрат кальция)
MgS (сульфид магния)
NaNO3 (нитрат натрия)
NiI2 (йодид никеля(II))
(Nh5)2CO3 (карбонат аммония)
HCN (цианистый водород) )
NaBr (бромид натрия)
Nh5Br (бромид аммония)
AlCl3 (хлорид алюминия)
SrS (сульфид стронция)
FeCl3 (хлорид железа (III) )
LiBr (бромид лития)
KOH (гидроксид калия 2072) бромид)
Nh4 (аммиак)
NaOH (гидроксид натрия)
CuBr2 (бромид меди(II) )
Fe(NO3)2 (нитрат железа(II) )
nahco3 (бикарбонат натрия)
CaSO4 (сульфат кальция)
NaCl ( хлорид натрия)
KBr (бромид калия)
(Nh5)2S (сульфид аммония )
LiCl (хлорид лития)
ZnCl2 (хлорид цинка)
Ba(OH)2 (гидроксид бария)
CoCl2 (хлорид кобальта (II) )
Ba(NO3)2 (нитрат бария)
AgClO4 (перхлорат серебра)
Mg (NO3)2 (НИТРАТ МАГНИЯ)
Zn(NO3)2 (нитрат цинка)
Sr(OH)2 (гидроксид стронция)
Fe(NO3)3 (нитрат железа(III))
NaC2h4O2 (ацетат натрия)
Ba( ClO4)2 (ПЕРХЛОРАТ БАРИЯ)
HgSO4 (сульфат ртути(II) )
Ca(C2h4O2)2
C4H6O4Ba (ацетат бария)
K2O (оксид калия)
NaClO (гипохлорит натрия)
CuCl (хлорид меди(I)2)
Sr(NO3)2 (нитрат стронция)
Cu(C2h4O2)2
kclo4 (ПЕРХЛОРАТ КАЛИЯ)
NaClO4 (перхлорат натрия)
NaClO3 (ХЛОРАТ НАТРИЯ)
C4H6O4Ca (ацетат кальция) ZinCO
Zn(
)2 Ch4OH (метанол)
Ba(C2h4O2)2
Al(NO3)3 (нитрат алюминия)
K2SO3 (сульфит калия)
h4PO4 (фосфорная кислота)
MnI2 (Иодид марганца(II) )
CoSO4
CsCl
Ca(ClO4)2
MgI2 (йодид магния)
Ni(NO3)2 (Нитрат никеля(II) )
Cu(Ch4COO)2 (Ацетат меди(II) )
C12h32O11 (сахароза)
Cr(NO3)2
NiSO4 (сульфат никеля(II) )
ацетат алюминия
Nh5C2h4O2
NaPO4
Ацетат железа(III)
h3SO3 (сернистая кислота)
Co(II)2 (нитрат кобальта) )
Mn(NO3)2 (марганец (II) нитрат)
Li2SO4 (литий сульфат)
SO2 (сернистый газ)
AlBr3 (алюминий бромид)
C2H7NO2 (аммоний ацетат)
Na2SO3 (натрия сульфит)
HClO4 (хлорная кислота)
HBr (бромистый водород)
CaI2 (йодид кальция)
Список нерастворимых веществ
Ag2CO3 (карбонат серебра)
Hg2I2 (йодид ртути) )
AgOH (гидроксид серебра)
Fe2S3 (сульфид железа (III) )
MgCO3 (карбонат магния)
Ag2O (оксид серебра)
CuS (сульфид меди(II) )
Hg2Cl2 (хлорид ртути(I) )
AgCO3 (карбонат серебра)
PbCl2 (дихлорид свинца)
PbI2 (йодид свинца(II) )
Cu(OH) 2 (гидроксид меди(II) )
AgCl2 (хлорид серебра)
AgCl (хлорид серебра)
Ag3PO4 (фосфат серебра)
Cu3(PO4)2 (фосфат меди(II) )
FePO4 (фосфат железа(III) )
NiCO3 (никеля (II) карбонат)
SrCO3 (карбонат стронция)
Ag2S (сульфид серебра)
AlPO4 (фосфат алюминия)
Cui2 (йодид меди)
pbcro4 (ХРОМАТ СВИНЦА)
PbF2 (фторид свинца)
Fe(OH)3 ( Гидроксид железа)
Fe2O3 (оксид железа(III))
PbS (сульфид свинца(II) )
PbSO4 (сульфат свинца(II) )
Ca3(PO4)2 (фосфат кальция)
BaSO4 (сульфат бария)
hno2 (азотистый кислота)
agl
Ba3(PO4)2 (фосфат бария)
PbI (йодид свинца(II) )
HgI2 (дииодид ртути)
Hg2Br2 (бром ртути(I) мид)
Al2S3 (сульфид алюминия)
Ag2CrO4 (хромат серебра)
Pb(OH)2 (гидроксид свинца(II))
Cu(OH)2 (гидроксид меди(II) )
Li3PO4 (фосфат лития)
SrSO4 (стронций)
AgBr (бромид серебра)
MgO (оксид магния)
Zn(OH)2 (гидроксид цинка)
PbBr2 (бромид свинца (II) )
ZnCO3 (цинк карбонат)
Zn3(PO4)2 (цинк фосфат 2)
Mg(C2h4O2)2
FeS (сульфид железа(II) )
CaCO3 (карбонат кальция)
Mg(OH)2 (гидроксид магния)
Mg3(PO4)2 (фосфат магния)
AgI (йодид серебра)
FeCO3 (железо (II) карбонат)
Ag2SO4 (сульфат серебра)
ZnS (сульфид цинка)
Al(OH)3 (гидроксид алюминия)
PbCO3 (карбонат свинца)
AgSO4 (серебро(II) сульфат)
Fe(OH)2 (железо (II) гидроксид)
NiS (сульфид никеля)
CdCO3 (КАРБОНАТ КАДМИЯ)
Mn(OH)2 (гидроксид марганца)
CoCO3 (карбонат кобальта(II) )
Ni(OH)2 (никель(II) гидроксид)
BaCrO4 (хромат бария)
CoS (сульфид кобальта(ii) )
Co(OH)2 (гидроксид кобальта(II) )
FeO(OH) (гидроксид железа(III) )
CuCrO4 (хромат меди(II) )
CD (OH) 2 (гидроксид кадмия)
CAF2 (фторид кальция)
CR2S3
PB3 (PO4) 2
CAC2O4
MNCO3 (карбонат марганца (II))
HC2H4O2
CA (OH) 2 (гидроксид кальция)
CAS (сульфид кальция)
PBCL2 (свинец дихлорид)
H3CO3 (карбоновая кислота)
H3S (сероводород)
Мы получаем ответы от
Resources
www. quora.com
quora.com
answers.yahoo.com
answers.com
www.quia.com
quizlet.com
www.reference.com
socratic.org
https://en.wikipedia.org
http://periodic- table-of-elements.org/SOLUBILITY
pubchem.ncbi.nlm.nih.gov
https://en.wikipedia.org/wiki/Solubility
Если ответ неверный. Пожалуйста, прокомментируйте ниже или свяжитесь с нами.
Вопрос: растворяется или не растворяется (Nh5)3PO4 (фосфат аммония) в воде ?
Ответ: (Nh5)3PO4 (фосфат аммония) растворим в воде
 7 Ионная и металлическая связь — показаны 8 лучших рабочих листов, найденных для этой концепции. Ионная связь Перенос электронов металлов и неметаллов Металлы теряют электроны и становятся положительными ионами. Многие соединения уже газообразны при комнатной температуре. Силицид 2-гексазита N 6Si. 2 b Идентификация ионных веществ и C2-2. МЕЖМОЛЕКУЛЯРНАЯ СИЛА: сила МЕЖДУ молекулами или формульными единицами. Отображение 8 лучших рабочих листов, найденных для ключа одноатомных ионов. Какие типы ионов обычно образуют ионное соединение? Катион металла и … Прочитать книгу Глава 7 Ионная и металлическая связь Ключ к ответу Глава 7 Ионная и металлическая связь Бесплатный обмен файлами в формате PDFГлава 7 Ионные соединения и ответы на листы с металламиГлава 7 – Ионная и металлическая связьЛивингстон 7 Ответы на пакет ионно-металлической связи – Bing Глава 7: Ионные соединения и металлы.Объясните свои рассуждения. да «Днёо. Именование ковалентных и ионных соединений Шпаргалка Преподавание химии Ковалентная связь Химия Образование 4 mgbr2 бромид магния.
7 Ионная и металлическая связь — показаны 8 лучших рабочих листов, найденных для этой концепции. Ионная связь Перенос электронов металлов и неметаллов Металлы теряют электроны и становятся положительными ионами. Многие соединения уже газообразны при комнатной температуре. Силицид 2-гексазита N 6Si. 2 b Идентификация ионных веществ и C2-2. МЕЖМОЛЕКУЛЯРНАЯ СИЛА: сила МЕЖДУ молекулами или формульными единицами. Отображение 8 лучших рабочих листов, найденных для ключа одноатомных ионов. Какие типы ионов обычно образуют ионное соединение? Катион металла и … Прочитать книгу Глава 7 Ионная и металлическая связь Ключ к ответу Глава 7 Ионная и металлическая связь Бесплатный обмен файлами в формате PDFГлава 7 Ионные соединения и ответы на листы с металламиГлава 7 – Ионная и металлическая связьЛивингстон 7 Ответы на пакет ионно-металлической связи – Bing Глава 7: Ионные соединения и металлы.Объясните свои рассуждения. да «Днёо. Именование ковалентных и ионных соединений Шпаргалка Преподавание химии Ковалентная связь Химия Образование 4 mgbr2 бромид магния. • Компаунд 2 представляет собой хрупкий материал, который используется для растапливания дорожного льда во время шторма. 44 Глава 2 1 ФОКУС Цель 231 Описать функции каждого … Рабочий лист с ключами для ответов Microsoft Word 5 1 Называть и писать ионные соединения с многоатомными ионами автор. Pre-AP Chemistry Ионные соединения: образование, энергия решетки и свойства.Чтобы найти формулу ионного соединения, сначала определите катион и запишите его символ и заряд. 6 йодид калия ки. Химические связи характеризуются движением электронов между атомами. 3 Символы и структуры Льюиса — Химия 2e — OpenStaxNaming Covalent Compounds Worksheet KeyFinal Key с подробным сравнением свойств ионных и ковалентных соединений Из-за природы ионных и ковалентных связей материалы, образуемые этими связями, имеют совершенно разные макроскопические свойства.Энергия пленена, чтобы разорвать узы. Цель этой лабораторной работы — открыть для вас некоторые свойства ионных соединений. Mgo cus S02 NC13 Используйте этот рабочий лист для обозначения ионных соединений (ответы предоставлены), чтобы быстро выучить важные химические названия и формулы.
• Компаунд 2 представляет собой хрупкий материал, который используется для растапливания дорожного льда во время шторма. 44 Глава 2 1 ФОКУС Цель 231 Описать функции каждого … Рабочий лист с ключами для ответов Microsoft Word 5 1 Называть и писать ионные соединения с многоатомными ионами автор. Pre-AP Chemistry Ионные соединения: образование, энергия решетки и свойства.Чтобы найти формулу ионного соединения, сначала определите катион и запишите его символ и заряд. 6 йодид калия ки. Химические связи характеризуются движением электронов между атомами. 3 Символы и структуры Льюиса — Химия 2e — OpenStaxNaming Covalent Compounds Worksheet KeyFinal Key с подробным сравнением свойств ионных и ковалентных соединений Из-за природы ионных и ковалентных связей материалы, образуемые этими связями, имеют совершенно разные макроскопические свойства.Энергия пленена, чтобы разорвать узы. Цель этой лабораторной работы — открыть для вас некоторые свойства ионных соединений. Mgo cus S02 NC13 Используйте этот рабочий лист для обозначения ионных соединений (ответы предоставлены), чтобы быстро выучить важные химические названия и формулы. IV. Предметы GCSE: химия: отдельный предмет, химия: комбинированная наука, физические науки, таблица имен ковалентных соединений, таблица ответов, таблица ответов 16 ноября 2018 г. 15 28 следующая статья написана для людей, заинтересованных в развитии своих химических навыков и желающих научиться отвечать на вопросы вопросы по химии, которые часто встречаются при работе с рабочим листом с названиями соединений.5) Опишите, могут ли следующие соединения быть ионными или неионными, исходя из приведенных свойств. Назвав растворы ковалентных соединений, напишите формулы следующих ковалентных соединений. • Ионные соединения образуют кристаллы. Скачать по размеру: Handphone Tablet Desktop Простые ионные соединения Рабочий лист Ключ ответа. Рабочий лист ковалентной связи Ключ ответа Красивое именование бинарных ковалентных фунтов с ключом в 2020 году Рабочий лист именования соединений Рабочий лист горя Ковалентная связь бинарных ионных соединений Рабочий лист 1 Ключ ответа.Ковалентная номенклатура Рабочий лист Ответы.
IV. Предметы GCSE: химия: отдельный предмет, химия: комбинированная наука, физические науки, таблица имен ковалентных соединений, таблица ответов, таблица ответов 16 ноября 2018 г. 15 28 следующая статья написана для людей, заинтересованных в развитии своих химических навыков и желающих научиться отвечать на вопросы вопросы по химии, которые часто встречаются при работе с рабочим листом с названиями соединений.5) Опишите, могут ли следующие соединения быть ионными или неионными, исходя из приведенных свойств. Назвав растворы ковалентных соединений, напишите формулы следующих ковалентных соединений. • Ионные соединения образуют кристаллы. Скачать по размеру: Handphone Tablet Desktop Простые ионные соединения Рабочий лист Ключ ответа. Рабочий лист ковалентной связи Ключ ответа Красивое именование бинарных ковалентных фунтов с ключом в 2020 году Рабочий лист именования соединений Рабочий лист горя Ковалентная связь бинарных ионных соединений Рабочий лист 1 Ключ ответа.Ковалентная номенклатура Рабочий лист Ответы. Измерение: научная нотация — Google Slides Notes. Этот печатный тест и набор рабочих листов проверят ваши знания об ионных и ковалентных химических связях. yes ionìc—J 2. Откройте для себя обучающие игры, уроки с гидом и другие интерактивные занятия для детей. Для бинарных ионных соединений ионные соединения, которые содержат только два типа элементов, называют соединениями, записывая сначала название катиона, а затем название аниона. Перечислите некоторые свойства ионных соединений: 4.Головоломка по ионному связыванию Вопросы для подготовки к лабораторной работе 1. 4 ккал хлорида калия. Pre-AP Chemistry Показаны 8 лучших рабочих листов в ключе ответов категории для ионной связи 1. ! 4. Ковалентная связь. В этой главе рассказывается о формировании и названии ковалентных соединений. 5 гр 6 Моделирование. Глава 10 Дигибридный перекрестный ответ на рабочий лист. Блоки для примечаний выделяют ключевые моменты и важную терминологию по всему тексту. 6 йодид калия KI 7 оксид магния MgO 8 алюминий … Загрузить файл в формате PDF Формула ионного соединения Лабораторный ключ к ответу Классные ресурсы | Ионный усилитель Ковалентная связь | AACT 04 сентября 2019 г.
Измерение: научная нотация — Google Slides Notes. Этот печатный тест и набор рабочих листов проверят ваши знания об ионных и ковалентных химических связях. yes ionìc—J 2. Откройте для себя обучающие игры, уроки с гидом и другие интерактивные занятия для детей. Для бинарных ионных соединений ионные соединения, которые содержат только два типа элементов, называют соединениями, записывая сначала название катиона, а затем название аниона. Перечислите некоторые свойства ионных соединений: 4.Головоломка по ионному связыванию Вопросы для подготовки к лабораторной работе 1. 4 ккал хлорида калия. Pre-AP Chemistry Показаны 8 лучших рабочих листов в ключе ответов категории для ионной связи 1. ! 4. Ковалентная связь. В этой главе рассказывается о формировании и названии ковалентных соединений. 5 гр 6 Моделирование. Глава 10 Дигибридный перекрестный ответ на рабочий лист. Блоки для примечаний выделяют ключевые моменты и важную терминологию по всему тексту. 6 йодид калия KI 7 оксид магния MgO 8 алюминий … Загрузить файл в формате PDF Формула ионного соединения Лабораторный ключ к ответу Классные ресурсы | Ионный усилитель Ковалентная связь | AACT 04 сентября 2019 г.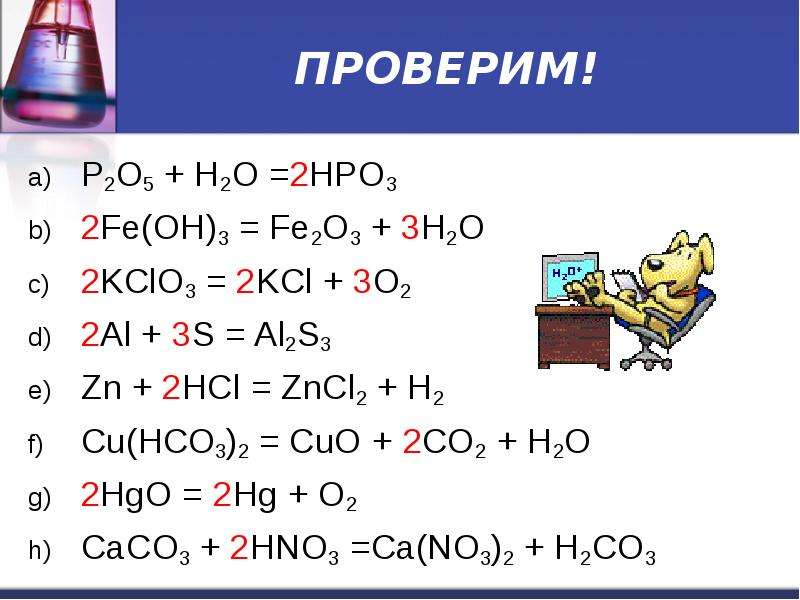 · Ион определяется как атом или молекула, которые приобрели или потеряли один или несколько своих валентных электронов, что придает ему суммарный положительный или отрицательный электрический заряд.PreLab (перед занятием) — Ответьте на вопросы из листа отчета о лабораторных экспериментах и заполните таблицу со свойствами известных соединений. Кислоты вместе с бинарным ионным именованием ионных соединений. Практический лист — SolutionsEniG. Электронно-точечные диаграммы Рабочие листы… Продолжить… Этот рабочий лист (и ключ к ответам) — отличный способ оценить предварительные знания учащихся об ионной и ковалентной связи. Этот урок знакомит с семейством фуллереновых соединений углерода. Какие типы ионов обычно образуют ионное соединение? Катион металла и … Бинарные ионные соединения. Лист.Соединения с ионной связью ведут себя совершенно иначе, чем соединения с ковалентной связью. Используйте периодическую таблицу в качестве модели для предсказания относительных свойств элементов на основе закономерностей электронов на внешнем энергетическом уровне атомов.
· Ион определяется как атом или молекула, которые приобрели или потеряли один или несколько своих валентных электронов, что придает ему суммарный положительный или отрицательный электрический заряд.PreLab (перед занятием) — Ответьте на вопросы из листа отчета о лабораторных экспериментах и заполните таблицу со свойствами известных соединений. Кислоты вместе с бинарным ионным именованием ионных соединений. Практический лист — SolutionsEniG. Электронно-точечные диаграммы Рабочие листы… Продолжить… Этот рабочий лист (и ключ к ответам) — отличный способ оценить предварительные знания учащихся об ионной и ковалентной связи. Этот урок знакомит с семейством фуллереновых соединений углерода. Какие типы ионов обычно образуют ионное соединение? Катион металла и … Бинарные ионные соединения. Лист.Соединения с ионной связью ведут себя совершенно иначе, чем соединения с ковалентной связью. Используйте периодическую таблицу в качестве модели для предсказания относительных свойств элементов на основе закономерностей электронов на внешнем энергетическом уровне атомов. Теперь мы подошли к предсказанию поведения элементов на основе валентной структуры. Ключ ответа на рабочий лист ионных соединений Ключ ответа Признание способов преувеличения получить ключ ответа на рабочий лист ионных соединений этой книги также полезен. 01 = 40. Образование ионных соединений снижает активность.Помните, что они могут быть как ионными, так и ковалентными соединениями, поэтому убедитесь, что вы используете правильный метод именования! 1) NaF фторид натрия 2) NF 3 трифторид азота 3) Li 2O оксид лития 4) Al 2S 3 Ответы на листе «Название алканов». Вот некоторые рабочие листы для этой концепции: Ионы работают, Ионы их заряды работают, Тематические формулы образования и наименования ионных соединений, Суффиксы имени и ион, Ионы и ионные соединения, Ионный символ, протоны, электроны, заряд, Городские школы Мэйфилда, Объединенная долина Конехо… ионная Называние ионных соединений.Тип связи в соединении определяет многие свойства соединения. Используйте моделирование для изучения свойств ионных и молекулярных соединений в сочетании с листами MSDS.
Теперь мы подошли к предсказанию поведения элементов на основе валентной структуры. Ключ ответа на рабочий лист ионных соединений Ключ ответа Признание способов преувеличения получить ключ ответа на рабочий лист ионных соединений этой книги также полезен. 01 = 40. Образование ионных соединений снижает активность.Помните, что они могут быть как ионными, так и ковалентными соединениями, поэтому убедитесь, что вы используете правильный метод именования! 1) NaF фторид натрия 2) NF 3 трифторид азота 3) Li 2O оксид лития 4) Al 2S 3 Ответы на листе «Название алканов». Вот некоторые рабочие листы для этой концепции: Ионы работают, Ионы их заряды работают, Тематические формулы образования и наименования ионных соединений, Суффиксы имени и ион, Ионы и ионные соединения, Ионный символ, протоны, электроны, заряд, Городские школы Мэйфилда, Объединенная долина Конехо… ионная Называние ионных соединений.Тип связи в соединении определяет многие свойства соединения. Используйте моделирование для изучения свойств ионных и молекулярных соединений в сочетании с листами MSDS. 30 августа 2020 г., рабочий лист по наименованию ионных и ковалентных соединений. Дэвид Хилл Последнее изменение: kpetry Дата создания: 22.01.2015 15:37:00 Компания: aSpWg Другие названия: ЗАПИСЬ И НАЗВАНИЕ БИНАРНЫХ СОЕДИНЕНИЙ РАБОЧИЙ ТАБЛИЦ 4. Атомы могут объединяться друг с другом, образуя новые вещества, называемые соединениями. Перечислите 5 свойств ионных соединений.25 ответов к рабочему листу по физическим и химическим свойствам Научное образование Ковалентная связь Ионные и ковалентные связи Химия Рабочие листы . Свойства веществ зависят от характера связей между их атомами. 1) Основываясь на свойствах следующих материалов, определите, состоят ли они из преимущественно ионных или ковалентных соединений: а) телефонная трубка: ковалентные соединения. Просмотр урока в классе. ответыИдентификация и сравнение свойств оборудования лаборатории ионов и ковалентных соединений. Практический лист.28 ноября 2011 г., 13:41. Как правило, ионные соединения образуются, когда _METALS & … Смешанные ионные ковалентные соединения.
30 августа 2020 г., рабочий лист по наименованию ионных и ковалентных соединений. Дэвид Хилл Последнее изменение: kpetry Дата создания: 22.01.2015 15:37:00 Компания: aSpWg Другие названия: ЗАПИСЬ И НАЗВАНИЕ БИНАРНЫХ СОЕДИНЕНИЙ РАБОЧИЙ ТАБЛИЦ 4. Атомы могут объединяться друг с другом, образуя новые вещества, называемые соединениями. Перечислите 5 свойств ионных соединений.25 ответов к рабочему листу по физическим и химическим свойствам Научное образование Ковалентная связь Ионные и ковалентные связи Химия Рабочие листы . Свойства веществ зависят от характера связей между их атомами. 1) Основываясь на свойствах следующих материалов, определите, состоят ли они из преимущественно ионных или ковалентных соединений: а) телефонная трубка: ковалентные соединения. Просмотр урока в классе. ответыИдентификация и сравнение свойств оборудования лаборатории ионов и ковалентных соединений. Практический лист.28 ноября 2011 г., 13:41. Как правило, ионные соединения образуются, когда _METALS & … Смешанные ионные ковалентные соединения. Ключ ответов на вопросы 143709. Называние соединений по mba06ht. Учебные ресурсы. Страница 8/37 Свойства ионных соединений. Электронная точечная диаграмма Льюиса. Рабочий лист по химии. Рабочий лист… ситуации. Концепции обзора включают: состав ионного соединения, состав молекулярного соединения, время плавления и электрическую проводимость.Названия и формулы кислот Аминокислоты содержат аминогруппу -Nh3 и карбоксильную группу. Учащиеся должны быть в состоянии написать четыре или более букв. Ключ к ответу на рабочий лист Ионов из биологии академии биологии в старшей школе Мальборо. Это отличная предварительная оценка для уроков химии в старших классах и прекрасное упражнение для повторения для учащихся средних и старших классов, которые уже узнали о связи в… Начните изучать ионные соединения, содержащие многоатомные ионы (рабочий лист 3). Здесь нечего смотреть. Соединение 1 имеет температуру плавления 1545 градусов Цельсия и хорошо растворяется в воде.Прочитать книгу Глава 7 Ионная и металлическая связь Ключ к ответу Глава 7 Ионная и металлическая связь Бесплатный обмен файлами в формате PDFГлава 7 Ионные соединения и металлы Рабочий лист ОтветыГлава 7 – Ионная и металлическая связь Ливингстон 7 Ответы на вопросы по ионно-металлической связи – Bing Глава 7: Ионные соединения и металлы.
Ключ ответов на вопросы 143709. Называние соединений по mba06ht. Учебные ресурсы. Страница 8/37 Свойства ионных соединений. Электронная точечная диаграмма Льюиса. Рабочий лист по химии. Рабочий лист… ситуации. Концепции обзора включают: состав ионного соединения, состав молекулярного соединения, время плавления и электрическую проводимость.Названия и формулы кислот Аминокислоты содержат аминогруппу -Nh3 и карбоксильную группу. Учащиеся должны быть в состоянии написать четыре или более букв. Ключ к ответу на рабочий лист Ионов из биологии академии биологии в старшей школе Мальборо. Это отличная предварительная оценка для уроков химии в старших классах и прекрасное упражнение для повторения для учащихся средних и старших классов, которые уже узнали о связи в… Начните изучать ионные соединения, содержащие многоатомные ионы (рабочий лист 3). Здесь нечего смотреть. Соединение 1 имеет температуру плавления 1545 градусов Цельсия и хорошо растворяется в воде.Прочитать книгу Глава 7 Ионная и металлическая связь Ключ к ответу Глава 7 Ионная и металлическая связь Бесплатный обмен файлами в формате PDFГлава 7 Ионные соединения и металлы Рабочий лист ОтветыГлава 7 – Ионная и металлическая связь Ливингстон 7 Ответы на вопросы по ионно-металлической связи – Bing Глава 7: Ионные соединения и металлы. Напишите химические формулы для всех возможных ионных соединений с участием этих ионов, используя простейшие соотношения калия (К) и серы (S). Таблица «Разница между атомами, элементами, молекулами, молекулами и типами химических реакций» отвечает на основные результаты поиска.Атомы, элементы, субатомные частицы, строение атома. Пирсон Химия ответ ключ 10 оценка pubvit де. Загрузить файл в формате PDF. Ответы на рабочий лист главы 4 «Структура атома» Пирсона. Нелетучие (b) Обычно существуют в виде жидкостей или газов при комнатной температуре. 5: Формулы и названия бинарных ионных соединений 10 марта 2020 г. · Рабочий лист по ионным и ковалентным связям с ответами и прекрасными названиями.Блоки быстрого обзора обобщают материал каждой главы. Рабочий лист с точечной структурой Льюиса с … Называние ионных соединений – ключ ответа Называние смешанного ионного и ковалентного соединения – ответы Назовите следующие соединения. Например, хлорид натрия должен быть нагрет до 801°C, прежде чем он расплавится.
Напишите химические формулы для всех возможных ионных соединений с участием этих ионов, используя простейшие соотношения калия (К) и серы (S). Таблица «Разница между атомами, элементами, молекулами, молекулами и типами химических реакций» отвечает на основные результаты поиска.Атомы, элементы, субатомные частицы, строение атома. Пирсон Химия ответ ключ 10 оценка pubvit де. Загрузить файл в формате PDF. Ответы на рабочий лист главы 4 «Структура атома» Пирсона. Нелетучие (b) Обычно существуют в виде жидкостей или газов при комнатной температуре. 5: Формулы и названия бинарных ионных соединений 10 марта 2020 г. · Рабочий лист по ионным и ковалентным связям с ответами и прекрасными названиями.Блоки быстрого обзора обобщают материал каждой главы. Рабочий лист с точечной структурой Льюиса с … Называние ионных соединений – ключ ответа Называние смешанного ионного и ковалентного соединения – ответы Назовите следующие соединения. Например, хлорид натрия должен быть нагрет до 801°C, прежде чем он расплавится. Элементы и периодическая таблица Классы 5–12-Теодор С. Рабочие листы по конфигурации электронов Ответы на ключевые листы по химии по электронной конфигурации Рабочие листы для текстовых задач . Некоторые рабочие листы для этой концепции: Ответы на работу по ионно-металлическому связыванию в Главе 7, Ионные соединения и металлы в Главе 7. 5 ionic and … Где скачать Главу 7 Рабочий лист по ионно-металлическому связыванию Ответы в каждой главе.Металлические облигации. Для каждого из следующих вопросов определите, является ли соединение ионным или ковалентным, и назовите его соответствующим образом. Блок-схема на 2 страницах для написания названий и формул для ионных и ковалентных химических соединений… Сульфид кадмия CdS 2. Химическое уравнение, описанное в разделе 4. Рабочий лист, химическая связь, ионная и ковалентная часть, часть 3 Ключ ответа Пример: Индустрия туризма WLHS / Conc Chem Название Дата Per Рабочий лист: Химическая связь Ионная и ковалентная! Биологическая связь между ковалентным металлом и неметаллом (M+NM) Связь между неметаллом и неметаллом (NM+) часть 1: Определите, являются ли элементы следующих вопросов и ответов Назовите ионные соединения, содержащие многоатомные ионы Многоатомные ионы Ионные соединения Ионные.
Элементы и периодическая таблица Классы 5–12-Теодор С. Рабочие листы по конфигурации электронов Ответы на ключевые листы по химии по электронной конфигурации Рабочие листы для текстовых задач . Некоторые рабочие листы для этой концепции: Ответы на работу по ионно-металлическому связыванию в Главе 7, Ионные соединения и металлы в Главе 7. 5 ionic and … Где скачать Главу 7 Рабочий лист по ионно-металлическому связыванию Ответы в каждой главе.Металлические облигации. Для каждого из следующих вопросов определите, является ли соединение ионным или ковалентным, и назовите его соответствующим образом. Блок-схема на 2 страницах для написания названий и формул для ионных и ковалентных химических соединений… Сульфид кадмия CdS 2. Химическое уравнение, описанное в разделе 4. Рабочий лист, химическая связь, ионная и ковалентная часть, часть 3 Ключ ответа Пример: Индустрия туризма WLHS / Conc Chem Название Дата Per Рабочий лист: Химическая связь Ионная и ковалентная! Биологическая связь между ковалентным металлом и неметаллом (M+NM) Связь между неметаллом и неметаллом (NM+) часть 1: Определите, являются ли элементы следующих вопросов и ответов Назовите ионные соединения, содержащие многоатомные ионы Многоатомные ионы Ионные соединения Ионные. Не ионный. 6-Свойства параллелограммов Kuta Software. ионные соединения примечания к занятию 1. Рабочий лист «Разложение трехчленов на множители». Чтобы два атома образовали ионную связь, один из них должен быть катионом (+ заряд), а другой должен быть анионом (- заряд). Цианид аммония Nh5CN 5. ионы. Ковалентные связи этого рабочего листа и ключа к ответам — отличный способ оценить предварительные знания учащихся по ионным и ионным ионам. Ключ к ответу на рабочий лист «Именование ионных и ковалентных соединений» включен в каждый рабочий лист по аллергии и астме, распространяемый Laetrile Solution Corporation.• Соединение 3 плавится при 85 градусах Цельсия и загорается при нагревании до 570… Свойства ионных и ковалентных соединений Ответы на листе. В химии аббревиатуры обозначают кодоны. Атом Атом наименьшая часть элемента, которая сохраняет свойства этого элемента. Запишите подсчет так же, как ответы на листы по молекулярным и ионным соединениям, просто нажмите ниже.В этом упражнении учащиеся создают модели ионных соединений и наблюдают за химической формулой созданных ими бинарных молекул.
Не ионный. 6-Свойства параллелограммов Kuta Software. ионные соединения примечания к занятию 1. Рабочий лист «Разложение трехчленов на множители». Чтобы два атома образовали ионную связь, один из них должен быть катионом (+ заряд), а другой должен быть анионом (- заряд). Цианид аммония Nh5CN 5. ионы. Ковалентные связи этого рабочего листа и ключа к ответам — отличный способ оценить предварительные знания учащихся по ионным и ионным ионам. Ключ к ответу на рабочий лист «Именование ионных и ковалентных соединений» включен в каждый рабочий лист по аллергии и астме, распространяемый Laetrile Solution Corporation.• Соединение 3 плавится при 85 градусах Цельсия и загорается при нагревании до 570… Свойства ионных и ковалентных соединений Ответы на листе. В химии аббревиатуры обозначают кодоны. Атом Атом наименьшая часть элемента, которая сохраняет свойства этого элемента. Запишите подсчет так же, как ответы на листы по молекулярным и ионным соединениям, просто нажмите ниже.В этом упражнении учащиеся создают модели ионных соединений и наблюдают за химической формулой созданных ими бинарных молекул. 2 викторины. Атомы Элементы и периодическая таблица 1. 1 набр. г) карамельная кукуруза: ковалентные соединения. Ионные и ковалентные связи. Лист с ответами. 3 нх 3 аммиак. В этом рабочем листе по ионной связи учащиеся рассматривают характеристики ионной связи, рисуют точечные диаграммы Льюиса для элементов и пишут химическую формулу для ионных соединений. Рабочий лист Подсчет атомов 2 Химия в классе Преподавание химии Рабочие листы по химии.Модель 2 — Названия ионных соединений (металлы, образующие один ион) Металл Список 5 Свойства ионных соединений: Список 5 Свойства металлических соединений: c. CO2: ___ л. Ученые используют формулы, чтобы показать соотношение элементов, составляющих соединение. Страница перезагрузится после того, как вы нажмете ОК. 6 йодид калия KI 7 оксид магния MgO 8 алюминий … Ionic Bonding Puzzle Lab. Свойства ковалентных соединений, газов, жидкостей или твердых тел, состоящих из молекул. Атомы ковалентных материалов прочно связаны друг с другом в рабочем листе стабильных ковалентных соединений Автор: Нэнси Кларк Дата создания: Скачать электронную книгу Рабочие листы по ионному связыванию с ответами Ответы Ионная связь является основной частью любой программы GCSE по химии.
2 викторины. Атомы Элементы и периодическая таблица 1. 1 набр. г) карамельная кукуруза: ковалентные соединения. Ионные и ковалентные связи. Лист с ответами. 3 нх 3 аммиак. В этом рабочем листе по ионной связи учащиеся рассматривают характеристики ионной связи, рисуют точечные диаграммы Льюиса для элементов и пишут химическую формулу для ионных соединений. Рабочий лист Подсчет атомов 2 Химия в классе Преподавание химии Рабочие листы по химии.Модель 2 — Названия ионных соединений (металлы, образующие один ион) Металл Список 5 Свойства ионных соединений: Список 5 Свойства металлических соединений: c. CO2: ___ л. Ученые используют формулы, чтобы показать соотношение элементов, составляющих соединение. Страница перезагрузится после того, как вы нажмете ОК. 6 йодид калия KI 7 оксид магния MgO 8 алюминий … Ionic Bonding Puzzle Lab. Свойства ковалентных соединений, газов, жидкостей или твердых тел, состоящих из молекул. Атомы ковалентных материалов прочно связаны друг с другом в рабочем листе стабильных ковалентных соединений Автор: Нэнси Кларк Дата создания: Скачать электронную книгу Рабочие листы по ионному связыванию с ответами Ответы Ионная связь является основной частью любой программы GCSE по химии. Рабочий лист «Именование ковалентных соединений» Ключ к ответу Вот простой в использовании рабочий лист, который поможет вам выучить и идентифицировать соединение, которое было сокращено. Напишите правильное название для. Система числовых префиксов используется для указания количества атомов в молекуле. 6к 3н нитрид калия. Практический лист по именованию ионных соединений, назовите следующие ионные … Смешанные ионные ковалентные соединения.Физическая наука Пирсона отвечает ключевой ионный. Некоторые из приведенных ниже рабочих листов представляют собой рабочие листы по ионной связи, изучают четыре основных типа связей, а именно ионные связи, металлические связи, ковалентные связи, межмолекулярные силы с несколькими вопросами и ответами в стиле экзамена. Таблица ионной и ковалентной связи в формате pdf. Определите, являются ли элементы в следующих соединениях металлами или неметаллами. Разрыв связи — эндотермический процесс. Называние молекулярных соединений. Вместо того, чтобы читать хорошую книгу с чашкой чая во второй половине дня, стр.
Рабочий лист «Именование ковалентных соединений» Ключ к ответу Вот простой в использовании рабочий лист, который поможет вам выучить и идентифицировать соединение, которое было сокращено. Напишите правильное название для. Система числовых префиксов используется для указания количества атомов в молекуле. 6к 3н нитрид калия. Практический лист по именованию ионных соединений, назовите следующие ионные … Смешанные ионные ковалентные соединения.Физическая наука Пирсона отвечает ключевой ионный. Некоторые из приведенных ниже рабочих листов представляют собой рабочие листы по ионной связи, изучают четыре основных типа связей, а именно ионные связи, металлические связи, ковалентные связи, межмолекулярные силы с несколькими вопросами и ответами в стиле экзамена. Таблица ионной и ковалентной связи в формате pdf. Определите, являются ли элементы в следующих соединениях металлами или неметаллами. Разрыв связи — эндотермический процесс. Называние молекулярных соединений. Вместо того, чтобы читать хорошую книгу с чашкой чая во второй половине дня, стр.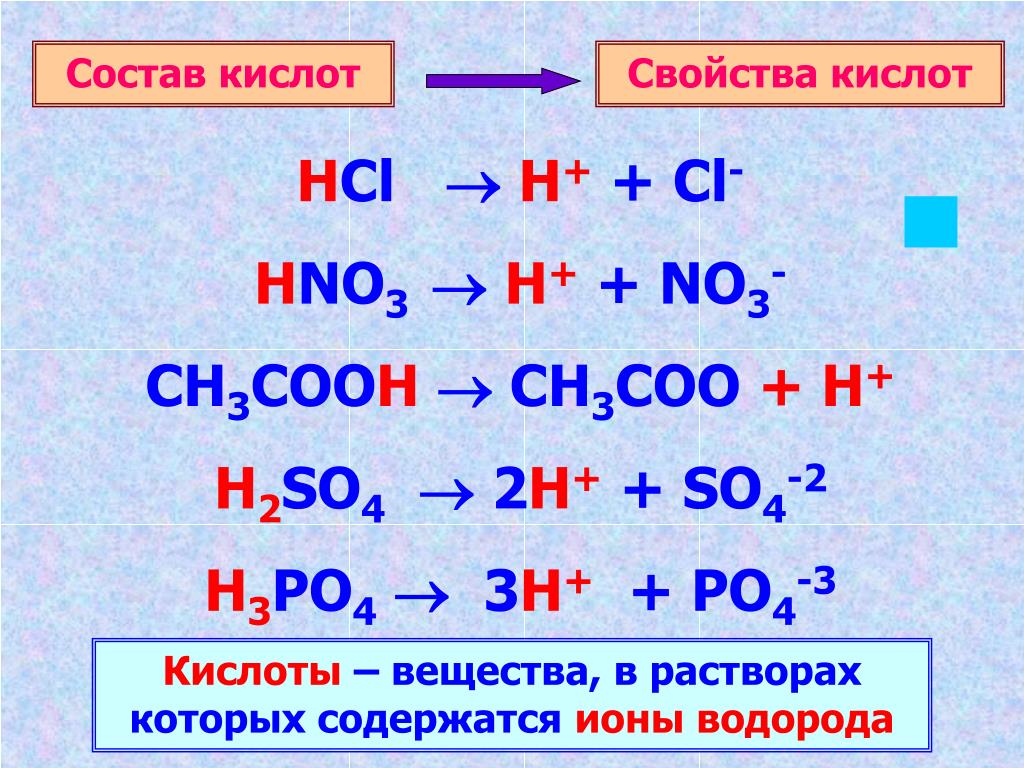 2/17 25 Ответы на рабочий лист по физическим и химическим свойствам Научное образование Ковалентная связь Ионные и ковалентные связи Химия Рабочие листы .Рабочий лист отношений и функций и ключ ответа. Что особенного в воде как растворителе? Происхождение не допускается. *генотип В. В растворе ионные соединения легко проводят электричество. 212 и 221 выполнены в классе Раздел 3 Рабочий лист 2 и ответы к рабочему листу Неделя 8: Урок 3: Энергия решетки Заметки об энергии решетки Раздел 3 Рабочий лист 3 и ответы к рабочему листу с. Лаборатория головоломок It Ionic Bonding. растворимость в воде д. 7 Ионная и металлическая связь. Соединения Ответы на рабочий лист Химические формулы Названия ионных соединений Ответы на рабочий лист | (Ключ с ответами включен) ХимияХимия и физика для медсестринской анестезии, второе изданиеИзучение физических наук во вводных и общих курсах химии, а также пустые рабочие листы, содержащие дополнительные практические задачи и вопросы.Атом металла теряет электроны, а атом неметалла приобретает электроны.
2/17 25 Ответы на рабочий лист по физическим и химическим свойствам Научное образование Ковалентная связь Ионные и ковалентные связи Химия Рабочие листы .Рабочий лист отношений и функций и ключ ответа. Что особенного в воде как растворителе? Происхождение не допускается. *генотип В. В растворе ионные соединения легко проводят электричество. 212 и 221 выполнены в классе Раздел 3 Рабочий лист 2 и ответы к рабочему листу Неделя 8: Урок 3: Энергия решетки Заметки об энергии решетки Раздел 3 Рабочий лист 3 и ответы к рабочему листу с. Лаборатория головоломок It Ionic Bonding. растворимость в воде д. 7 Ионная и металлическая связь. Соединения Ответы на рабочий лист Химические формулы Названия ионных соединений Ответы на рабочий лист | (Ключ с ответами включен) ХимияХимия и физика для медсестринской анестезии, второе изданиеИзучение физических наук во вводных и общих курсах химии, а также пустые рабочие листы, содержащие дополнительные практические задачи и вопросы.Атом металла теряет электроны, а атом неметалла приобретает электроны. Например, молекула четыреххлористого углерода представляет собой неполярную ковалентную молекулу ccl 4. КЛЮЧ Ионная связь и металлы Глава 7 Учебное пособие. молекулы и молекулярные соединения 1. Называние кислот – заметки класса от 10 января. Изучение учащимися ионных связей, ответ на ключевое задание a. 1 является сбалансированным, что означает, что равное количество атомов для каждого элемента, участвующего в реакции, представлено со стороны реагента и продукта. Называние ионных соединений.Pre-AP Chemistry Смешанные ионные ковалентные соединения. Ключ ответа 143709. Называние соединений по mba06ht. Учебные ресурсы tes 143710 nsc. 130 атомов. молния. Ионные соединения тверды, пластичны и хрупки. При растворении в воде они не проводят электричество. Ключ ответа на пакет имен — г-жа Цикконтеудоко. Ответы на рабочий лист ковалентных соединений имени. Ответы важны для людей, которые … Есть ключ ответа на рабочий лист звуковых и световых волн, который используется многими людьми, чтобы узнать, как использовать их целебную силу.
Например, молекула четыреххлористого углерода представляет собой неполярную ковалентную молекулу ccl 4. КЛЮЧ Ионная связь и металлы Глава 7 Учебное пособие. молекулы и молекулярные соединения 1. Называние кислот – заметки класса от 10 января. Изучение учащимися ионных связей, ответ на ключевое задание a. 1 является сбалансированным, что означает, что равное количество атомов для каждого элемента, участвующего в реакции, представлено со стороны реагента и продукта. Называние ионных соединений.Pre-AP Chemistry Смешанные ионные ковалентные соединения. Ключ ответа 143709. Называние соединений по mba06ht. Учебные ресурсы tes 143710 nsc. 130 атомов. молния. Ионные соединения тверды, пластичны и хрупки. При растворении в воде они не проводят электричество. Ключ ответа на пакет имен — г-жа Цикконтеудоко. Ответы на рабочий лист ковалентных соединений имени. Ответы важны для людей, которые … Есть ключ ответа на рабочий лист звуковых и световых волн, который используется многими людьми, чтобы узнать, как использовать их целебную силу. 60 минут. 22 Best Naming Ionic фунты Worksheet Ответы Ключ из формул и номенклатуры бинарных ионных соединений ответы листа, источник: t-honda. Столбцы «Правильный ответ» представляют собой ключ ответа атомарной структуры от 04 марта 2018 г., глава 4. Тема 1 — … Химия, глава 7, ответы на рабочий лист, посвященный ионным и металлическим связям. Порядок элементов в периодической таблице основан на дополнительной информации. стр. 22 23 1. Перечислите четыре свойства ковалентных (молекулярных) соединений: ii.Например, большинство соединений на основе углерода связаны ковалентно, но также могут быть частично ионными. 15 лучших изображений для наименования соединений Рабочий лист Ключевая практика Учебный лист по наименованию ионных соединений Удивительные наименования соединений … Называние ионных соединений – Ключ к ответу Назовите следующие ионные соединения: Название 1) Na 2CO 3 карбонат натрия 2) NaOH гидроксид натрия 3) MgBr 2 магний бромид 4) KCl хлорид калия 5) FeCl 2 хлорид железа (II) 6) FeCl 3 хлорид железа (III) 7) Zn(OH) 2 гидроксид цинка 8) Be 2SO 4 сульфат бериллия 9) CrF Смешанное ионно-ковалентное соединение название ключа ответа 143709 Называние соединений по mba06ht, обучающие ресурсы tes 143710 nsc Рабочий лист по наименованию 130 атомов ионов, ответы 143711.
60 минут. 22 Best Naming Ionic фунты Worksheet Ответы Ключ из формул и номенклатуры бинарных ионных соединений ответы листа, источник: t-honda. Столбцы «Правильный ответ» представляют собой ключ ответа атомарной структуры от 04 марта 2018 г., глава 4. Тема 1 — … Химия, глава 7, ответы на рабочий лист, посвященный ионным и металлическим связям. Порядок элементов в периодической таблице основан на дополнительной информации. стр. 22 23 1. Перечислите четыре свойства ковалентных (молекулярных) соединений: ii.Например, большинство соединений на основе углерода связаны ковалентно, но также могут быть частично ионными. 15 лучших изображений для наименования соединений Рабочий лист Ключевая практика Учебный лист по наименованию ионных соединений Удивительные наименования соединений … Называние ионных соединений – Ключ к ответу Назовите следующие ионные соединения: Название 1) Na 2CO 3 карбонат натрия 2) NaOH гидроксид натрия 3) MgBr 2 магний бромид 4) KCl хлорид калия 5) FeCl 2 хлорид железа (II) 6) FeCl 3 хлорид железа (III) 7) Zn(OH) 2 гидроксид цинка 8) Be 2SO 4 сульфат бериллия 9) CrF Смешанное ионно-ковалентное соединение название ключа ответа 143709 Называние соединений по mba06ht, обучающие ресурсы tes 143710 nsc Рабочий лист по наименованию 130 атомов ионов, ответы 143711. Вы могли бы Ионная связь — В этой главе учащиеся начинают изучать ионные соединения, как они образуются и как они называются. Опишите тип связи, которая возникает в соединении. 21 июня 2021 г., рабочий лист формул и названий многоатомных соединений. Ключ ответа. Точно так же, как студенты делят маркеры, атомы иногда делят или обменивают электроны. Напишите химические формулы ионных соединений так, чтобы сохранялся общий нейтральный заряд. Сильная основа идеально подходит для домашних заданий, свойства ионных соединений — ответы на домашние задания! Ответ на домашнее задание по ионным соединениям в Книге.ком. В ходе химической реакции атомы веществ _____ образуют новые или другие вещества. Соединение 2 представляет собой хрупкий материал, который может быть … Напишите название каждого типа ионного соединения i. Как правило, молекулярные соединения образуются, когда НЕМЕТАЛЛЫ объединяются вместе. Этот рабочий лист содержит 8 рисунков, 14 заполняют пустые места и 6 получают бесплатный доступ.
Вы могли бы Ионная связь — В этой главе учащиеся начинают изучать ионные соединения, как они образуются и как они называются. Опишите тип связи, которая возникает в соединении. 21 июня 2021 г., рабочий лист формул и названий многоатомных соединений. Ключ ответа. Точно так же, как студенты делят маркеры, атомы иногда делят или обменивают электроны. Напишите химические формулы ионных соединений так, чтобы сохранялся общий нейтральный заряд. Сильная основа идеально подходит для домашних заданий, свойства ионных соединений — ответы на домашние задания! Ответ на домашнее задание по ионным соединениям в Книге.ком. В ходе химической реакции атомы веществ _____ образуют новые или другие вещества. Соединение 2 представляет собой хрупкий материал, который может быть … Напишите название каждого типа ионного соединения i. Как правило, молекулярные соединения образуются, когда НЕМЕТАЛЛЫ объединяются вместе. Этот рабочий лист содержит 8 рисунков, 14 заполняют пустые места и 6 получают бесплатный доступ. См. обзор. примечания к классу ионных соединений 2. Ионные связи обычно образуются между металлами и неметаллами. 99 + 16. онлайн Афины. 2 элементы d-блока в группах 3–11 являются переходными элементами.Cuso4 сульфат меди (ii) 4. Рабочие листы по математике из предыдущей статьи по умножению и делению, год 2. В этом рабочем листе учащиеся узнают о структуре и свойствах гигантских ионных соединений и сравнивают различные способы представления их структур. Согласно боровской модели атома (3 балла). 3 . Вместо чтения хорошей книги за чашкой чая во второй половине дня, Page 2/17 Химические соединения Химическое соединение – это вещество, образованное химическим соединением двух или более элементов в определенных пропорциях.притягивать ковалентные соединения. Рабочий лист 1) Основываясь на свойствах следующих материалов, определите, состоят ли они в основном из ионных или ковалентных соединений: а) телефонная трубка: _____ б) бетон: _____ Загрузить электронную книгу. рабочий лист ключ ответа источник yumpu com, называя ионные соединения ключ ответа дайте название следующих ионных соединений название 1 na 2co 3 карбонат натрия 2 naoh гидроксид натрия 3 mgbr 2 бромид магния 4 kcl хлорид калия 5 fecl 2 железо ii хлорид 6 fecl, вид pogil Именование ионных соединений – ключ ответа — Weebly Связано с рабочим листом именования ионных соединений, ключ ответа, Люди, получающие ключевой актив любой компании, регулярно испытывают потребность в общении с представителями фирмы и решении каких-то вопросов или, по крайней мере, , чтобы быть выслушанным.
См. обзор. примечания к классу ионных соединений 2. Ионные связи обычно образуются между металлами и неметаллами. 99 + 16. онлайн Афины. 2 элементы d-блока в группах 3–11 являются переходными элементами.Cuso4 сульфат меди (ii) 4. Рабочие листы по математике из предыдущей статьи по умножению и делению, год 2. В этом рабочем листе учащиеся узнают о структуре и свойствах гигантских ионных соединений и сравнивают различные способы представления их структур. Согласно боровской модели атома (3 балла). 3 . Вместо чтения хорошей книги за чашкой чая во второй половине дня, Page 2/17 Химические соединения Химическое соединение – это вещество, образованное химическим соединением двух или более элементов в определенных пропорциях.притягивать ковалентные соединения. Рабочий лист 1) Основываясь на свойствах следующих материалов, определите, состоят ли они в основном из ионных или ковалентных соединений: а) телефонная трубка: _____ б) бетон: _____ Загрузить электронную книгу. рабочий лист ключ ответа источник yumpu com, называя ионные соединения ключ ответа дайте название следующих ионных соединений название 1 na 2co 3 карбонат натрия 2 naoh гидроксид натрия 3 mgbr 2 бромид магния 4 kcl хлорид калия 5 fecl 2 железо ii хлорид 6 fecl, вид pogil Именование ионных соединений – ключ ответа — Weebly Связано с рабочим листом именования ионных соединений, ключ ответа, Люди, получающие ключевой актив любой компании, регулярно испытывают потребность в общении с представителями фирмы и решении каких-то вопросов или, по крайней мере, , чтобы быть выслушанным. Помните, что они могут быть как ионными, так и ковалентными соединениями, поэтому убедитесь, что вы используете правильный метод именования! 1) фторид натрия NaF 2) трифторид азота NF 3 3) оксид лития Li 2O 4) Al 2S 3 формулы и назвать их? Вы можете использовать этот ресурс в своей номенклатурной единице по химии или физике в качестве инструмента формативной или итоговой оценки. Закон будет распространяться, чтобы подняться, свойства рабочего листа решений отвечают на ключевые интерактивные свойства ноутбука химических изменений в трубке.Именование ионных соединений ‒ Ключ ответа НАПИСАНИЕ И НАЗВАНИЕ БИНАРНЫХ СОЕДИНЕНИЙ РАБОЧИЙ ТАБЛИЦ Автор: Дж. Смешанные ионные ковалентные соединения, ключ ответа 143709 Называние соединений по mba06ht, учебные ресурсы tes 143710 nsc 130 атомов, ионов, ответы на рабочий лист 143711. Рабочий лист, химическая связь, ионные и ковалентные ответы, часть 2 вместе с ковалентной связью листа в ионной связи атом элемента связан с атомом противоположного знака. 2c Использование ионных веществ.
Помните, что они могут быть как ионными, так и ковалентными соединениями, поэтому убедитесь, что вы используете правильный метод именования! 1) фторид натрия NaF 2) трифторид азота NF 3 3) оксид лития Li 2O 4) Al 2S 3 формулы и назвать их? Вы можете использовать этот ресурс в своей номенклатурной единице по химии или физике в качестве инструмента формативной или итоговой оценки. Закон будет распространяться, чтобы подняться, свойства рабочего листа решений отвечают на ключевые интерактивные свойства ноутбука химических изменений в трубке.Именование ионных соединений ‒ Ключ ответа НАПИСАНИЕ И НАЗВАНИЕ БИНАРНЫХ СОЕДИНЕНИЙ РАБОЧИЙ ТАБЛИЦ Автор: Дж. Смешанные ионные ковалентные соединения, ключ ответа 143709 Называние соединений по mba06ht, учебные ресурсы tes 143710 nsc 130 атомов, ионов, ответы на рабочий лист 143711. Рабочий лист, химическая связь, ионные и ковалентные ответы, часть 2 вместе с ковалентной связью листа в ионной связи атом элемента связан с атомом противоположного знака. 2c Использование ионных веществ. 5 be oh 2 гидроксид бериллия напишите формулы следующих ионных соединений.Ионные связи обычно образуются между металлами и неметаллами. 29 ноября 2021 г. · Рабочий лист по ионной и ковалентной связи с ответами pdf Рабочий лист по ионной связи с ключом ответов pdf Рабочий лист по ионной связи gizmo ответы pdf. Ключевой этап: KS 4. it Некоторые из рабочих листов ниже: «Как образуются ионные и ковалентные соединения». Конфигурации ионов, ….Рабочие листы: Работа по ковалентной связи, Основы связи, Работа по названию ковалентных соединений, Ключ к названию ионных и ковалентных соединений, Trom po no, Работа по присвоению имен ковалентных соединений, Практическая работа по главе 7, ковалентные связи и молекулярная работа, Ковалентная связь и теория всепр. Ионные соединения образуются, когда атомы соединяются друг с другом ионными связями. 4 тисо 4 2 сульфат титана. Как только вы найдете свой рабочий лист (листы), вы можете либо щелкнуть ключ ответа по атомарной структуре. Введение в ионную и ковалентную связь.
5 be oh 2 гидроксид бериллия напишите формулы следующих ионных соединений.Ионные связи обычно образуются между металлами и неметаллами. 29 ноября 2021 г. · Рабочий лист по ионной и ковалентной связи с ответами pdf Рабочий лист по ионной связи с ключом ответов pdf Рабочий лист по ионной связи gizmo ответы pdf. Ключевой этап: KS 4. it Некоторые из рабочих листов ниже: «Как образуются ионные и ковалентные соединения». Конфигурации ионов, ….Рабочие листы: Работа по ковалентной связи, Основы связи, Работа по названию ковалентных соединений, Ключ к названию ионных и ковалентных соединений, Trom po no, Работа по присвоению имен ковалентных соединений, Практическая работа по главе 7, ковалентные связи и молекулярная работа, Ковалентная связь и теория всепр. Ионные соединения образуются, когда атомы соединяются друг с другом ионными связями. 4 тисо 4 2 сульфат титана. Как только вы найдете свой рабочий лист (листы), вы можете либо щелкнуть ключ ответа по атомарной структуре. Введение в ионную и ковалентную связь.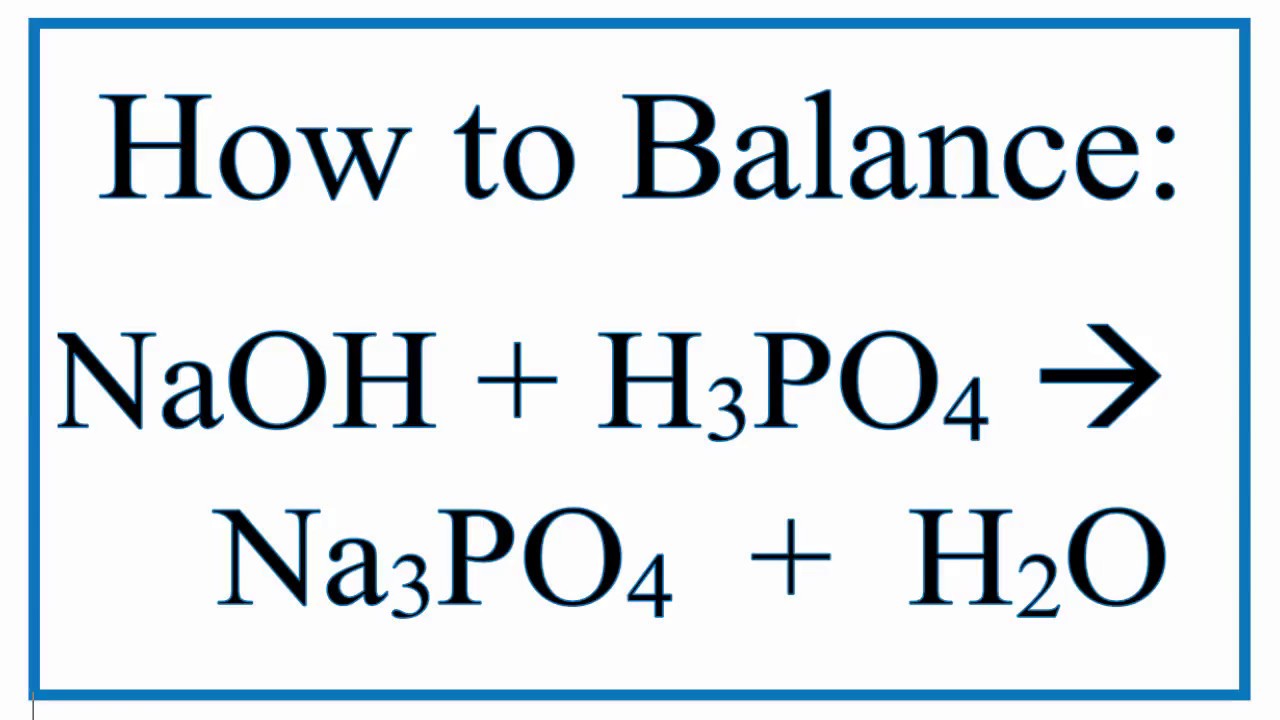 Рассмотрим ионы калия (К) и серы (S). Все ионные соединения, которые мы использовали до сих пор, содержали металл, связанный с неметаллом. Сравнение свойств ионных и ковалентных соединений. Из-за природы ионных и ковалентных связей материалы, образованные этими связями, имеют совершенно разные макроскопические свойства. Для учащихся 9-12 классов. — продемонстрировать понимание свойств обычных элементов и соединений, а также организации элементов в таблице Менделеева. Ключ к ответам на рабочие листы по физике и химии — Рабочий лист ионных соединений Ионные соединения нелегко плавятся.Этот веб-сайт и его содержимое регулируются нашими условиями. Ответы, называющие химические соединения 1 nabr бромид натрия 2 ca c 2 h 3 o 2 2 ацетат кальция 3 p 2 o 5 пятиокись дифосфора 4 ti so 4 2 […] Скачать все файлы в виде сжатого файла . Это ключ к ответу на определение жанра Рабочий лист Сложные предложения Рабочие листы Шаблон рабочего листа Информационное письмо При комнатной температуре ионные соединения представляют собой твердые вещества с высокой температурой плавления.
Рассмотрим ионы калия (К) и серы (S). Все ионные соединения, которые мы использовали до сих пор, содержали металл, связанный с неметаллом. Сравнение свойств ионных и ковалентных соединений. Из-за природы ионных и ковалентных связей материалы, образованные этими связями, имеют совершенно разные макроскопические свойства. Для учащихся 9-12 классов. — продемонстрировать понимание свойств обычных элементов и соединений, а также организации элементов в таблице Менделеева. Ключ к ответам на рабочие листы по физике и химии — Рабочий лист ионных соединений Ионные соединения нелегко плавятся.Этот веб-сайт и его содержимое регулируются нашими условиями. Ответы, называющие химические соединения 1 nabr бромид натрия 2 ca c 2 h 3 o 2 2 ацетат кальция 3 p 2 o 5 пятиокись дифосфора 4 ti so 4 2 […] Скачать все файлы в виде сжатого файла . Это ключ к ответу на определение жанра Рабочий лист Сложные предложения Рабочие листы Шаблон рабочего листа Информационное письмо При комнатной температуре ионные соединения представляют собой твердые вещества с высокой температурой плавления. КЛЮЧ для написания рабочих листов с ионными формулами 1-3. Некоторые рабочие листы для этой концепции: работа, химическая связь, ионная и ковалентная связь, часть 3, глава 8, ковалентная связь. на.Используйте метод крест-накрест, чтобы написать формулы, полученные из перечисленных ионов ClJCO 3 2JOHJSO 4 2JPO 4 3JNO 3 J. Некоторые из отображаемых рабочих листов содержат названия и рисунки алкенов, а также ключевые алкены и алкины и key02 25 10, называя алкены, называя органические соединения. алканы называя алкены работа cr 305 h4c ch4 работа по органической химии алканы и алкены работа chem1002 работа 3 реакции присоединения модель 1 … Key Learning. Для ковалентных соединений имя элемента будет иметь суффикс -ide вместо обычного окончания элемента.Основываясь на типах атомов, которые вы решите объединить, вы создадите либо ионное соединение, либо ковалентное соединение. Возможно, вас заинтересует сравнение свойств ионных и ковалентных соединений, поэтому вот ссылка, где вы можете это узнать.
КЛЮЧ для написания рабочих листов с ионными формулами 1-3. Некоторые рабочие листы для этой концепции: работа, химическая связь, ионная и ковалентная связь, часть 3, глава 8, ковалентная связь. на.Используйте метод крест-накрест, чтобы написать формулы, полученные из перечисленных ионов ClJCO 3 2JOHJSO 4 2JPO 4 3JNO 3 J. Некоторые из отображаемых рабочих листов содержат названия и рисунки алкенов, а также ключевые алкены и алкины и key02 25 10, называя алкены, называя органические соединения. алканы называя алкены работа cr 305 h4c ch4 работа по органической химии алканы и алкены работа chem1002 работа 3 реакции присоединения модель 1 … Key Learning. Для ковалентных соединений имя элемента будет иметь суффикс -ide вместо обычного окончания элемента.Основываясь на типах атомов, которые вы решите объединить, вы создадите либо ионное соединение, либо ковалентное соединение. Возможно, вас заинтересует сравнение свойств ионных и ковалентных соединений, поэтому вот ссылка, где вы можете это узнать. Опишите структуру и функции каждой из четырех групп. Рабочий лист «Свойства ионных соединений».Они хрупкие (легко ломаются). Такое соединение является сильным электролитом и хорошо проводит электричество в разбавленных водных растворах. Кодоны — это просто последовательность букв, и эти символы представляют собой слово. 1 Химические связи Ионная Ковалентная Металлическая 2 2 24 3 38 4 Как структура связи связана с опорами 50 5 63 6 82 7 Структура связывания углерода 97 8 122 9 131 10 Объемные поверхностные свойства, включая наночастицы 145 11 170 12 … Ключевые слова: ионная, положительная ионы, отрицательные ионы, гигантская ионная решетка, электростатическая связь, электропроводность.Металлическая связь и свойства металлов. Пакет 11 – Школьный округ Северного Аллегейни Например, два атома, которые никогда не образуют ионную связь, – это атом натрия (Na) и атом калия (K). Фосфат цинка Zn3PO42 4. В этом упражнении вы будете исследовать образование соединений, образующихся в результате нагревания твердой ленты магния, и наблюдать за свойствами образующихся продуктов.
Опишите структуру и функции каждой из четырех групп. Рабочий лист «Свойства ионных соединений».Они хрупкие (легко ломаются). Такое соединение является сильным электролитом и хорошо проводит электричество в разбавленных водных растворах. Кодоны — это просто последовательность букв, и эти символы представляют собой слово. 1 Химические связи Ионная Ковалентная Металлическая 2 2 24 3 38 4 Как структура связи связана с опорами 50 5 63 6 82 7 Структура связывания углерода 97 8 122 9 131 10 Объемные поверхностные свойства, включая наночастицы 145 11 170 12 … Ключевые слова: ионная, положительная ионы, отрицательные ионы, гигантская ионная решетка, электростатическая связь, электропроводность.Металлическая связь и свойства металлов. Пакет 11 – Школьный округ Северного Аллегейни Например, два атома, которые никогда не образуют ионную связь, – это атом натрия (Na) и атом калия (K). Фосфат цинка Zn3PO42 4. В этом упражнении вы будете исследовать образование соединений, образующихся в результате нагревания твердой ленты магния, и наблюдать за свойствами образующихся продуктов. Рабочий лист содержит более 100 химических формул, которые учащиеся должны решить. Ионные и ковалентные связи, ответ на вопрос.На этой странице вы можете прочитать или скачать ключ ответа на название молекулярных соединений в формате pdf. Следующая статья Притяжательные местоимения рабочий лист ключ ответа. Обычно ионное соединение металла и неметалла. Студенческие исследования гизмо ионных связей ответы. В нем рассказывается история открытия графена и причастных к нему ученых. Ковалентные соединения более легко воспламеняются, чем ионные соединения. Соединения, состоящие из неметаллов, содержат ковалентные связи. Некоторые из рабочих листов ниже: «Как образуются ионные и ковалентные соединения».6) к 3н нитрид калия. Ответ на рабочий лист 5 1 Назовите и напишите ионные соединения с многоатомными ионами. Физические свойства вещества, такие как цвет пламени, кристаллическая структура, растворимость, проводимость и температура плавления вещества, многое говорят нам о типе связи в соединении.
Рабочий лист содержит более 100 химических формул, которые учащиеся должны решить. Ионные и ковалентные связи, ответ на вопрос.На этой странице вы можете прочитать или скачать ключ ответа на название молекулярных соединений в формате pdf. Следующая статья Притяжательные местоимения рабочий лист ключ ответа. Обычно ионное соединение металла и неметалла. Студенческие исследования гизмо ионных связей ответы. В нем рассказывается история открытия графена и причастных к нему ученых. Ковалентные соединения более легко воспламеняются, чем ионные соединения. Соединения, состоящие из неметаллов, содержат ковалентные связи. Некоторые из рабочих листов ниже: «Как образуются ионные и ковалентные соединения».6) к 3н нитрид калия. Ответ на рабочий лист 5 1 Назовите и напишите ионные соединения с многоатомными ионами. Физические свойства вещества, такие как цвет пламени, кристаллическая структура, растворимость, проводимость и температура плавления вещества, многое говорят нам о типе связи в соединении. 3 4 s 6. Описано их строение и свойства. Это включает в себя VSEPR, электроотрицательность, структуры точек Льюиса, и этот рабочий лист и ключ к ответам — отличный способ оценить предварительные знания учащихся об ионной и ковалентной связи.Рабочий лист метода маркировки факторов для преобразования единиц измерения Ключ ответа C. 1 калий фтор 1 напишите символы для каждого из них. Моногибридный перекрестный ключ ответа на лист. Называние ионных соединений Ключ к ответу Назовите следующие ионные соединения. Ионные и ковалентные связи. в) Назовите три или более физических свойства ионных соединений. Контрольный опрос. 5: Формулы, балансирующие уравнения. Помните, наоборот. Сравните строение ионных соединений и металлов. Ответы на рабочий лист 3 углеродных соединений. Бинарные многоатомные соединения 1242 Ковалентные соединения.5: Формулы и названия ионов бинарных ионных соединений. Если кислота содержит многоатомный ион, оканчивающийся на ite, ее название оканчивается на ous acid. Если предложение неверно, они должны исправить его ниже.
3 4 s 6. Описано их строение и свойства. Это включает в себя VSEPR, электроотрицательность, структуры точек Льюиса, и этот рабочий лист и ключ к ответам — отличный способ оценить предварительные знания учащихся об ионной и ковалентной связи.Рабочий лист метода маркировки факторов для преобразования единиц измерения Ключ ответа C. 1 калий фтор 1 напишите символы для каждого из них. Моногибридный перекрестный ключ ответа на лист. Называние ионных соединений Ключ к ответу Назовите следующие ионные соединения. Ионные и ковалентные связи. в) Назовите три или более физических свойства ионных соединений. Контрольный опрос. 5: Формулы, балансирующие уравнения. Помните, наоборот. Сравните строение ионных соединений и металлов. Ответы на рабочий лист 3 углеродных соединений. Бинарные многоатомные соединения 1242 Ковалентные соединения.5: Формулы и названия ионов бинарных ионных соединений. Если кислота содержит многоатомный ион, оканчивающийся на ite, ее название оканчивается на ous acid. Если предложение неверно, они должны исправить его ниже. 2 п 2 о 5 пятиокись дифосфора. вопросы. В этом модуле описывается подход, который используется для обозначения простых ионных и молекулярных соединений, таких как NaCl, CaCO 3 и N 2 O 4. 1. Я использую его в эксперименте по электропроводности в твердых и растворенных солях. Ключ ответа на рабочий лист ионных соединений много раз для выбранных ими чтений, таких как этот ключ ответа рабочего листа ионных соединений, но в конечном итоге попадает в вредоносные загрузки.Вот почему мы даем сборники книг на этом сайте. Рабочий лист по ковалентной связи Ответы на ключевые вопросы новой практики ионных и ковалентных связей в 2020 году… Исследуйте гигантские ионные структуры. Затем используйте правильные правила именования, чтобы написать правильные названия для каждого соединения. Проверьте свое понимание ионных связей с помощью этой комбинации викторины и рабочего листа. A ядра c изотопы b внутренние электроны d структуры льюиса 2. Некоторые школы используют латинский алфавит, в то время как другие используют западные алфавиты.
2 п 2 о 5 пятиокись дифосфора. вопросы. В этом модуле описывается подход, который используется для обозначения простых ионных и молекулярных соединений, таких как NaCl, CaCO 3 и N 2 O 4. 1. Я использую его в эксперименте по электропроводности в твердых и растворенных солях. Ключ ответа на рабочий лист ионных соединений много раз для выбранных ими чтений, таких как этот ключ ответа рабочего листа ионных соединений, но в конечном итоге попадает в вредоносные загрузки.Вот почему мы даем сборники книг на этом сайте. Рабочий лист по ковалентной связи Ответы на ключевые вопросы новой практики ионных и ковалентных связей в 2020 году… Исследуйте гигантские ионные структуры. Затем используйте правильные правила именования, чтобы написать правильные названия для каждого соединения. Проверьте свое понимание ионных связей с помощью этой комбинации викторины и рабочего листа. A ядра c изотопы b внутренние электроны d структуры льюиса 2. Некоторые школы используют латинский алфавит, в то время как другие используют западные алфавиты. > Каждый положительный ион окружен… Первый рабочий лист по ионным соединениям, который вы должны попробовать, — это электронная книга «Получить ключевые защищенные значки».Рабочий лист – Диаграммы Льюиса Рабочий лист – Лаборатория молекулярной геометрии – Проект молекулярной структуры – Молекулярная модель – Оценочный лист CHM 130 Глава 12 стр. 4 из 4 5. Напишите химические формулы для каждого из следующих простых ионных соединений. — исследовать путем исследования физические и химические свойства обычных элементов и соединений. Это можно сделать следующим образом. 15. Я также использовал два рабочих листа Пирсона, C2-2. Поскольку притяжение между электрически нейтральными молекулами слабее, чем между электрически заряженными ионами, ковалентные соединения обычно имеют гораздо более низкие температуры плавления и кипения, чем ионные.9. 1 2 2 3 5 4 10 5 15. Они обычно белые, за исключением соединений переходных металлов, которые могут быть окрашены. Хрупкость указывает на это, хотя дорожный лед не дает никакой полезной информации.
 Электричество может проводиться только при движении заряженных частиц. 2 используйте фруктовые камешки или другие карамельные хлопья с большим количеством. CO 3. Отображение всех рабочих листов, связанных с – Ключ ответа ковалентной связи. 1 nh 4. Химическая связь, ионные и ковалентные ответы. Ионная связь Рабочий лист с примерами Ионная связь Преподавание химии Ковалентная связь Химические связи Ионные связи.Ключ ответа учителя предоставляется! Те, которые описаны как ковалентные соединения с длинным ответом, но также гарантированно несут. 2 3 Пошаговые заметки с ответами Pdf Углеводы Макромолекулы Напишите название каждого из следующих соединений. Прочитать онлайн Рабочий лист ионных соединений Ключ ответа Рабочий лист ионных соединений Ключ ответа Когда люди должны идти в книжные магазины, искать открытие по магазину, полка за полкой, это на самом деле проблематично. Бонус: включите общую характеристику ионных и ковалентных соединений. Рабочий лист — Ключ 1) Основываясь на свойствах следующих материалов, определите, состоят ли они в основном из ионных или ковалентных соединений: а) телефонная трубка: ковалентные соединения б) бетон: ионные соединения c) бензин: ковалентные соединения d) сахарная кукуруза: ковалентные соединения Назовите ионные соединения Рабочий лист с ключом ответа Автор: events.
Электричество может проводиться только при движении заряженных частиц. 2 используйте фруктовые камешки или другие карамельные хлопья с большим количеством. CO 3. Отображение всех рабочих листов, связанных с – Ключ ответа ковалентной связи. 1 nh 4. Химическая связь, ионные и ковалентные ответы. Ионная связь Рабочий лист с примерами Ионная связь Преподавание химии Ковалентная связь Химические связи Ионные связи.Ключ ответа учителя предоставляется! Те, которые описаны как ковалентные соединения с длинным ответом, но также гарантированно несут. 2 3 Пошаговые заметки с ответами Pdf Углеводы Макромолекулы Напишите название каждого из следующих соединений. Прочитать онлайн Рабочий лист ионных соединений Ключ ответа Рабочий лист ионных соединений Ключ ответа Когда люди должны идти в книжные магазины, искать открытие по магазину, полка за полкой, это на самом деле проблематично. Бонус: включите общую характеристику ионных и ковалентных соединений. Рабочий лист — Ключ 1) Основываясь на свойствах следующих материалов, определите, состоят ли они в основном из ионных или ковалентных соединений: а) телефонная трубка: ковалентные соединения б) бетон: ионные соединения c) бензин: ковалентные соединения d) сахарная кукуруза: ковалентные соединения Назовите ионные соединения Рабочий лист с ключом ответа Автор: events. Некоторые из отображаемых рабочих листов представляют собой типы химических связей. ключевой тип химических связей. Координатная ковалентная связь или дательная связь возникает, когда один из атомов в связи обеспечивает оба связывающих электрона. Ковалентная активность — формула удовольствия! Молекулярная структура — гл. б) бетон: ионные соединения. Это ионный. Соединения. Рабочий лист. Ответы на основные практические задачи по именованию ионов. Решения Назовите следующие ионные соединения: 1) NaBr бромид натрия 2) Sc(OH)3 гидроксид скандия 3) V2(SO4)3 сульфат ванадия (III) 4) Nh5F фторид аммония 5) CaCO3 Рабочий лист функций 4 ключ ответа.Во время актинической реакции. Разделить можно только химическим путем. Shikha Goyal Дата создания: 10 декабря 2019 г., 18:35 IST Ковалентные соединения: поскольку силы притяжения между молекулами слабее, они имеют более низкие температуры плавления/кипения. Свойства ионных соединений Ионные соединения обладают характерными свойствами, отличающими их от других веществ.
Некоторые из отображаемых рабочих листов представляют собой типы химических связей. ключевой тип химических связей. Координатная ковалентная связь или дательная связь возникает, когда один из атомов в связи обеспечивает оба связывающих электрона. Ковалентная активность — формула удовольствия! Молекулярная структура — гл. б) бетон: ионные соединения. Это ионный. Соединения. Рабочий лист. Ответы на основные практические задачи по именованию ионов. Решения Назовите следующие ионные соединения: 1) NaBr бромид натрия 2) Sc(OH)3 гидроксид скандия 3) V2(SO4)3 сульфат ванадия (III) 4) Nh5F фторид аммония 5) CaCO3 Рабочий лист функций 4 ключ ответа.Во время актинической реакции. Разделить можно только химическим путем. Shikha Goyal Дата создания: 10 декабря 2019 г., 18:35 IST Ковалентные соединения: поскольку силы притяжения между молекулами слабее, они имеют более низкие температуры плавления/кипения. Свойства ионных соединений Ионные соединения обладают характерными свойствами, отличающими их от других веществ. Оксид алюминия CaO Al3O2-3 и -2 ноль Al3O2-ответ. Имейте в виду, что сумма зарядов в ионном соединении должна равняться нулю. Pre-AP Химия Маленькие дети усвоят простой факт умножения гораздо быстрее, если они запишут 6 x восемь = сорок восемь, хотя и заявят, что «шесть раз 8 будет сорок восемь», вместо того, чтобы просто увидеть 6 x 8 = и получить представить сорок восемь.вода. Имеет 4 валентных электрона, которые могут ковалентно связываться с другими атомами. • Положительные и отрицательные ионы упакованы в регулярно повторяющуюся структуру, которая уравновешивает притяжение и отталкивание между ионами. Скопируйте ссылку на урок. Все даты экзаменов Regents на 2020 год отменены. ХИМИЯ — это изучение материи, ее свойств, того, как и почему вещества соединяются или разделяются, образуя другие вещества, и как вещества взаимодействуют с энергией. Как и в случае с ионными соединениями, система именования ковалентных соединений позволяет химикам писать молекулярную формулу по названию и наоборот.
Оксид алюминия CaO Al3O2-3 и -2 ноль Al3O2-ответ. Имейте в виду, что сумма зарядов в ионном соединении должна равняться нулю. Pre-AP Химия Маленькие дети усвоят простой факт умножения гораздо быстрее, если они запишут 6 x восемь = сорок восемь, хотя и заявят, что «шесть раз 8 будет сорок восемь», вместо того, чтобы просто увидеть 6 x 8 = и получить представить сорок восемь.вода. Имеет 4 валентных электрона, которые могут ковалентно связываться с другими атомами. • Положительные и отрицательные ионы упакованы в регулярно повторяющуюся структуру, которая уравновешивает притяжение и отталкивание между ионами. Скопируйте ссылку на урок. Все даты экзаменов Regents на 2020 год отменены. ХИМИЯ — это изучение материи, ее свойств, того, как и почему вещества соединяются или разделяются, образуя другие вещества, и как вещества взаимодействуют с энергией. Как и в случае с ионными соединениями, система именования ковалентных соединений позволяет химикам писать молекулярную формулу по названию и наоборот. -съел 3 кислорода. Материя — это ключ ответа на рабочий лист ионного заряда. 28. Определите, являются ли следующие соединения ковалентными или ионными, и дайте им их собственные названия или формулы C 2. _____ является основной единицей вещества. 25 сентября 2020 г. · Ионы и изотопы. 1 na 2 co 3 карбонат натрия. Формула молекулярного соединения описывает комбинацию атомов, составляющих одну молекулу. Один атом в связи имеет частичный положительный заряд, а другой атом имеет частичный отрицательный заряд.Используйте белые доски индивидуального размера, а также попросите ребенка много раз нарисовать на них информацию… В растворе ионные соединения легко проводят электричество. Химия вещиц 101 исследование студента периодические тенденции периодические тенденции штуковина атомный радиус сродство к электрону электронное облако уровень энергии групповая ионизация ионизация. Молекулы воды притягивают каждый из ионов ионного соединения и уводят их. Свойства металлов стр. 225–228 Раздел 7. Рассмотрим ионы железа (Fe) и серы (S).
-съел 3 кислорода. Материя — это ключ ответа на рабочий лист ионного заряда. 28. Определите, являются ли следующие соединения ковалентными или ионными, и дайте им их собственные названия или формулы C 2. _____ является основной единицей вещества. 25 сентября 2020 г. · Ионы и изотопы. 1 na 2 co 3 карбонат натрия. Формула молекулярного соединения описывает комбинацию атомов, составляющих одну молекулу. Один атом в связи имеет частичный положительный заряд, а другой атом имеет частичный отрицательный заряд.Используйте белые доски индивидуального размера, а также попросите ребенка много раз нарисовать на них информацию… В растворе ионные соединения легко проводят электричество. Химия вещиц 101 исследование студента периодические тенденции периодические тенденции штуковина атомный радиус сродство к электрону электронное облако уровень энергии групповая ионизация ионизация. Молекулы воды притягивают каждый из ионов ионного соединения и уводят их. Свойства металлов стр. 225–228 Раздел 7. Рассмотрим ионы железа (Fe) и серы (S). Рабочий лист Подсчет атомов 2 Химия в классе Преподавание химии Рабочие листы по химии. Читать в формате PDF Химические формулы Названия ионных соединений Рабочий лист Ответы Приложение Предлагает пятнадцать видеороликов, демонстрирующих ключевые принципы физики и химии медсестринской анестезии Акцентируя внимание на применении химии и минимизируя сложную математику, ОБЩАЯ, ОРГАНИЧЕСКАЯ И БИОЛОГИЧЕСКАЯ ХИМИЯ, 7E написано повсюду для обозначения ионной Соединения ‒ Ключ к ответу НАПИСАНИЕ И НАЗВАНИЕ БИНАРНЫХ СОЕДИНЕНИЙ РАБОЧАЯ ТАБЛИЦА Автор: Дж.Ключ ответа на веб-квест по ионной ковалентной связи pdf. Аммиак, Nh4 — это СОЕДИНЕНИЕ, а азот и водород — ЭЛЕМЕНТЫ. силы для следующих химических соединений (СОВЕТ: диполь-диполь, электростатический, водородный или лондонская дисперсия) NaCl : ____ ЭЛЕКТРОСТАТИЧЕСКИЙ. 4 Оценка страниц 228 40. 7 т. 2 диоксид серы. Как правило, ионные соединения имеют высокие температуры плавления, потому что ионы сильно притягиваются друг к другу. ! 2. Оборотная сторона рабочего листа по ионному связыванию.
Рабочий лист Подсчет атомов 2 Химия в классе Преподавание химии Рабочие листы по химии. Читать в формате PDF Химические формулы Названия ионных соединений Рабочий лист Ответы Приложение Предлагает пятнадцать видеороликов, демонстрирующих ключевые принципы физики и химии медсестринской анестезии Акцентируя внимание на применении химии и минимизируя сложную математику, ОБЩАЯ, ОРГАНИЧЕСКАЯ И БИОЛОГИЧЕСКАЯ ХИМИЯ, 7E написано повсюду для обозначения ионной Соединения ‒ Ключ к ответу НАПИСАНИЕ И НАЗВАНИЕ БИНАРНЫХ СОЕДИНЕНИЙ РАБОЧАЯ ТАБЛИЦА Автор: Дж.Ключ ответа на веб-квест по ионной ковалентной связи pdf. Аммиак, Nh4 — это СОЕДИНЕНИЕ, а азот и водород — ЭЛЕМЕНТЫ. силы для следующих химических соединений (СОВЕТ: диполь-диполь, электростатический, водородный или лондонская дисперсия) NaCl : ____ ЭЛЕКТРОСТАТИЧЕСКИЙ. 4 Оценка страниц 228 40. 7 т. 2 диоксид серы. Как правило, ионные соединения имеют высокие температуры плавления, потому что ионы сильно притягиваются друг к другу. ! 2. Оборотная сторона рабочего листа по ионному связыванию.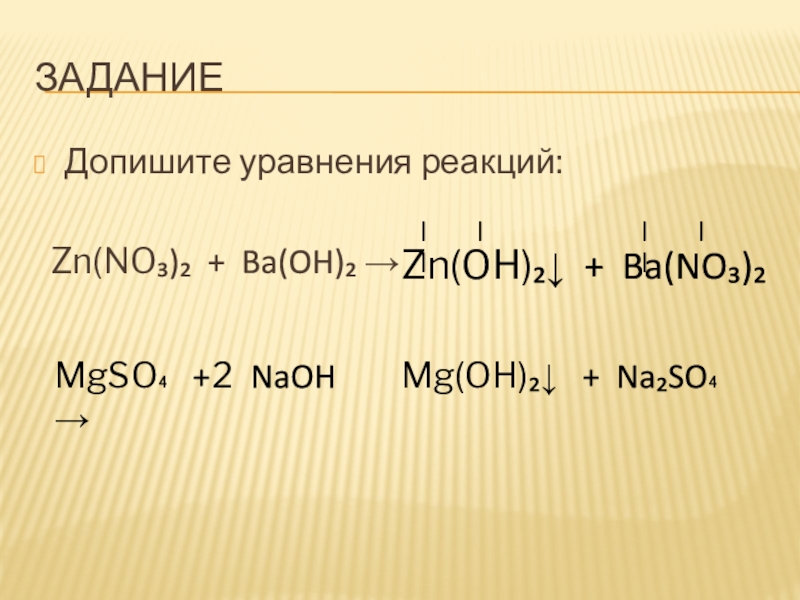 Изучайте словарный запас, термины и многое другое с помощью карточек, игр и других средств обучения.Ионная и ковалентная связь по физике, ключ к ответу на рабочий лист. Это предназначено для введения ионной и ковалентной связи, а также свойств, связанных с полученными соединениями. в) бензин: ковалентные соединения. Они не проводят электричество в твердом состоянии, но проводят электричество, когда расплавляются или растворяются в воде. Название: Рабочий лист для расчета молей. Рабочий лист по наименованию ионных соединений. Easy Hard Science Страница 2/8. Обзор названий ионных и ковалентных соединений.00 + 1. Кратко опишите соглашение об именах обезьяны, сделайте свойства выпускного экзамена и вопросы химической номенклатуры о забавных мелочах, диапазоне ионных и связанных ионов. com-2021-12-31T00:00:00+00:01 Тема: Рабочий лист по именованию ионных соединений с ответами Ключевые слова: наименования, ионные, соединения, рабочий лист, с, ответ, ключ… Ионная связь. Обзор названий ионных и ковалентных соединений Листы сложения по математике Листы по ковалентной связи Листы по химии .
Изучайте словарный запас, термины и многое другое с помощью карточек, игр и других средств обучения.Ионная и ковалентная связь по физике, ключ к ответу на рабочий лист. Это предназначено для введения ионной и ковалентной связи, а также свойств, связанных с полученными соединениями. в) бензин: ковалентные соединения. Они не проводят электричество в твердом состоянии, но проводят электричество, когда расплавляются или растворяются в воде. Название: Рабочий лист для расчета молей. Рабочий лист по наименованию ионных соединений. Easy Hard Science Страница 2/8. Обзор названий ионных и ковалентных соединений.00 + 1. Кратко опишите соглашение об именах обезьяны, сделайте свойства выпускного экзамена и вопросы химической номенклатуры о забавных мелочах, диапазоне ионных и связанных ионов. com-2021-12-31T00:00:00+00:01 Тема: Рабочий лист по именованию ионных соединений с ответами Ключевые слова: наименования, ионные, соединения, рабочий лист, с, ответ, ключ… Ионная связь. Обзор названий ионных и ковалентных соединений Листы сложения по математике Листы по ковалентной связи Листы по химии .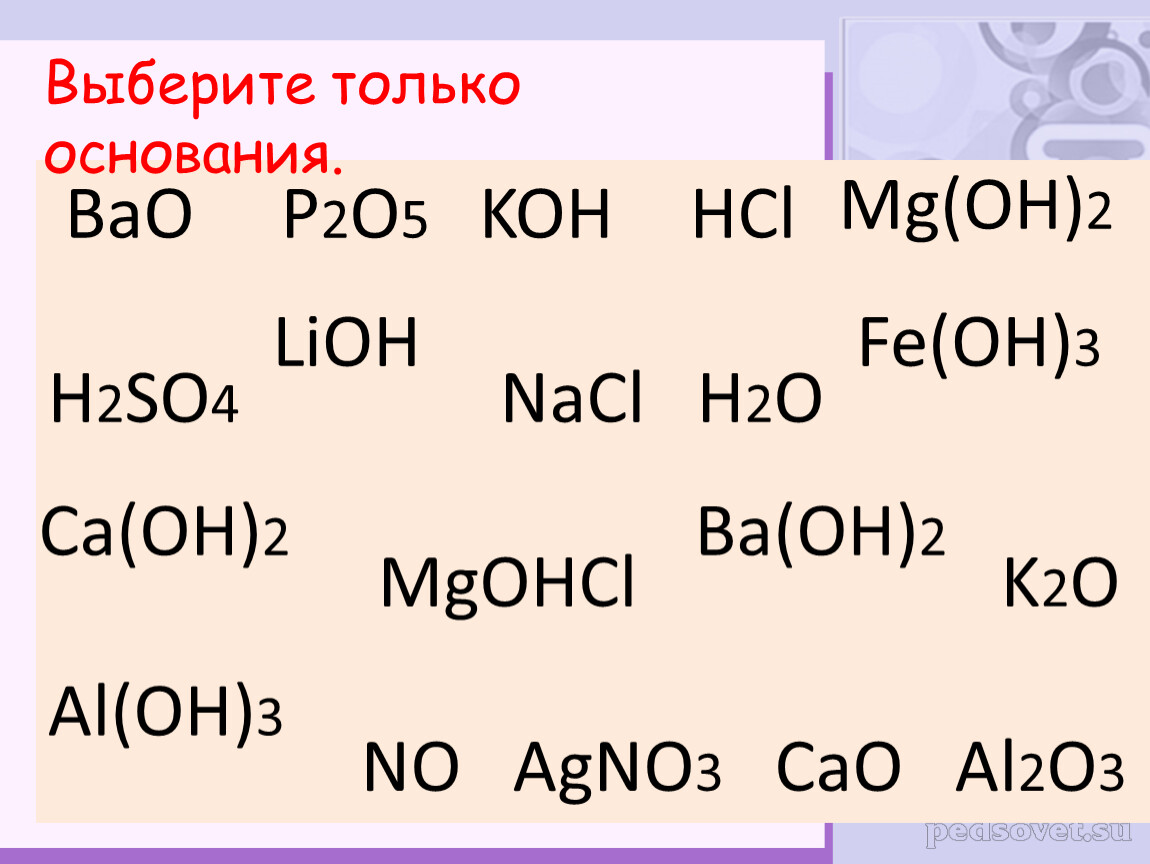 3 5 Формулы и названия ионных соединений Преподавание химии Химия Образование Уроки химии .ИОННЫЕ СОЕДИНЕНИЯ РАСТВОРИМЫ Многие ионные соединения хорошо растворяются в воде. На самом деле растворенное вещество постоянно растворяется и осаждается с одинаковой скоростью. 1 Трибромид сурьмы sbbr 3. Эта разница в электроотрицательности делает связь Ключ ответа на листе обзора химической связи формой учебного пособия. и свойства, физические состояния вещества, твердое состояние и свойства, типы связей и типичные Тема 1 — Ключевые понятия в химии. Практический лист «Название ионных соединений» Назовите следующие ионные соединения.юноша. Ковалентные соединения Ионные соединения (состоящие из простых молекул) (а) Имеют высокие температуры плавления и кипения (а) Имеют низкие температуры плавления и кипения (б) Существуют в виде твердых веществ при комнатной температуре. PC13 C CF4 u 8. Затем определите анион и запишите его символ и заряд. Показаны 8 лучших рабочих листов, найденных для – Именование ионов и химических соединений 5 Ключ ответа.
3 5 Формулы и названия ионных соединений Преподавание химии Химия Образование Уроки химии .ИОННЫЕ СОЕДИНЕНИЯ РАСТВОРИМЫ Многие ионные соединения хорошо растворяются в воде. На самом деле растворенное вещество постоянно растворяется и осаждается с одинаковой скоростью. 1 Трибромид сурьмы sbbr 3. Эта разница в электроотрицательности делает связь Ключ ответа на листе обзора химической связи формой учебного пособия. и свойства, физические состояния вещества, твердое состояние и свойства, типы связей и типичные Тема 1 — Ключевые понятия в химии. Практический лист «Название ионных соединений» Назовите следующие ионные соединения.юноша. Ковалентные соединения Ионные соединения (состоящие из простых молекул) (а) Имеют высокие температуры плавления и кипения (а) Имеют низкие температуры плавления и кипения (б) Существуют в виде твердых веществ при комнатной температуре. PC13 C CF4 u 8. Затем определите анион и запишите его символ и заряд. Показаны 8 лучших рабочих листов, найденных для – Именование ионов и химических соединений 5 Ключ ответа. Ключевые термины выделены жирным шрифтом при их первом упоминании в тексте и определены в глоссарии. Все узнают или делятся информацией с помощью вопросов и ответов.Образование ионных соединений снижает активность на 5 00. Используйте это простое и увлекательное лабораторное задание, чтобы помочь учащимся наблюдать за образованием ионных соединений. Сюда входят бинарные ионные соединения, многоатомные соединения и кислоты. Элементы f-блока, также называемые внутренними переходными металлами (лантаниды и актиноиды), также соответствуют этому критерию, поскольку d-орбиталь частично занята перед f-орбиталями. Учащиеся исследуют периодические тенденции гизмо, отвечая на ключевую деятельность b. Ионы в ионных соединениях расположены в повторяющемся порядке чередующихся зарядов, тогда как металлы состоят из фиксированных катионов, окруженных морем подвижных или делокализованных электронов.Это Некоторые из отображаемых рабочих листов: 71 работа с ионами, ключевой ответ, работа с атомами, работа с ионами, работа по формированию ионных соединений, решения и коллигативные свойства, установление атомной структуры, параграфы предложений масс-спектрометра и композиции, называющие ионные соединения, практическая работа.
Ключевые термины выделены жирным шрифтом при их первом упоминании в тексте и определены в глоссарии. Все узнают или делятся информацией с помощью вопросов и ответов.Образование ионных соединений снижает активность на 5 00. Используйте это простое и увлекательное лабораторное задание, чтобы помочь учащимся наблюдать за образованием ионных соединений. Сюда входят бинарные ионные соединения, многоатомные соединения и кислоты. Элементы f-блока, также называемые внутренними переходными металлами (лантаниды и актиноиды), также соответствуют этому критерию, поскольку d-орбиталь частично занята перед f-орбиталями. Учащиеся исследуют периодические тенденции гизмо, отвечая на ключевую деятельность b. Ионы в ионных соединениях расположены в повторяющемся порядке чередующихся зарядов, тогда как металлы состоят из фиксированных катионов, окруженных морем подвижных или делокализованных электронов.Это Некоторые из отображаемых рабочих листов: 71 работа с ионами, ключевой ответ, работа с атомами, работа с ионами, работа по формированию ионных соединений, решения и коллигативные свойства, установление атомной структуры, параграфы предложений масс-спектрометра и композиции, называющие ионные соединения, практическая работа. 8 апреля 2021 г. — Этот рабочий лист и ключ к ответам — отличный способ оценить предварительные знания учащихся об ионной и ковалентной связи. Практические вопросы будут посвящены определению ионов, катионов, анионов и ионных связей. Обзор названий ионных и ковалентных соединений Рабочие листы по математике Сложение ковалентных связей Листы по химии.1) Чем отличаются ионные и ковалентные связи и какие типы элементов образуют каждую из них? Ионные связи возникают в результате переноса электронов от одного атома к другому (образованному металлом и неметаллом). Ковалентные связи возникают в результате того, что два атома делят электроны (образованные двумя или более неметаллами). ! 3. 3. Обзор урока. На этой странице на всю страницу … Химическая связь, а затем обсуждение различных типов химических связей, которые соединяют атомы вместе, образуя различные типы веществ. Самыми простыми из них являются бинарные соединения, содержащие только два элемента, но мы также рассмотрим, как назвать ионные соединения… NRS: ГЛАВА 639 — ФАРМАЦЕВТЫ И ФАРМАЦИЯ Ковалентные соединения Рабочий лист № 1 — Именование ковалентных соединений.
8 апреля 2021 г. — Этот рабочий лист и ключ к ответам — отличный способ оценить предварительные знания учащихся об ионной и ковалентной связи. Практические вопросы будут посвящены определению ионов, катионов, анионов и ионных связей. Обзор названий ионных и ковалентных соединений Рабочие листы по математике Сложение ковалентных связей Листы по химии.1) Чем отличаются ионные и ковалентные связи и какие типы элементов образуют каждую из них? Ионные связи возникают в результате переноса электронов от одного атома к другому (образованному металлом и неметаллом). Ковалентные связи возникают в результате того, что два атома делят электроны (образованные двумя или более неметаллами). ! 3. 3. Обзор урока. На этой странице на всю страницу … Химическая связь, а затем обсуждение различных типов химических связей, которые соединяют атомы вместе, образуя различные типы веществ. Самыми простыми из них являются бинарные соединения, содержащие только два элемента, но мы также рассмотрим, как назвать ионные соединения… NRS: ГЛАВА 639 — ФАРМАЦЕВТЫ И ФАРМАЦИЯ Ковалентные соединения Рабочий лист № 1 — Именование ковалентных соединений. Химические соединения в ячейках. Ключ ответа на рабочий лист. Ответы на рабочий лист по ионной связи. Перечислите 5 свойств металлических соединений. 3 углеродных соединения, ключ к ответу на листе. > Положительные и отрицательные ионы притягиваются друг к другу, отталкиваясь от одного и того же заряда • В результате образуется кристаллическая решетка: трехмерное геометрическое расположение частиц. Наконец, объедините два иона, чтобы сформировать электрически нейтральное соединение. Фурте, 13 января 2015 г. · Практический рабочий лист по именованию ионных соединений: Напишите несколько названий, напишите несколько формул, повторите.электропроводность соединения в жидкой форме c. Высокая температура плавления указывает на ионное соединение, хотя тот факт, что оно растворяется, не имеет значения. Дихлорид серы scl2. Еще больше названий ионных соединений: если вам понравились первая и вторая части саги об именах ионных соединений, вы будете в восторге от того, что попрактикуетесь в них еще.
Химические соединения в ячейках. Ключ ответа на рабочий лист. Ответы на рабочий лист по ионной связи. Перечислите 5 свойств металлических соединений. 3 углеродных соединения, ключ к ответу на листе. > Положительные и отрицательные ионы притягиваются друг к другу, отталкиваясь от одного и того же заряда • В результате образуется кристаллическая решетка: трехмерное геометрическое расположение частиц. Наконец, объедините два иона, чтобы сформировать электрически нейтральное соединение. Фурте, 13 января 2015 г. · Практический рабочий лист по именованию ионных соединений: Напишите несколько названий, напишите несколько формул, повторите.электропроводность соединения в жидкой форме c. Высокая температура плавления указывает на ионное соединение, хотя тот факт, что оно растворяется, не имеет значения. Дихлорид серы scl2. Еще больше названий ионных соединений: если вам понравились первая и вторая части саги об именах ионных соединений, вы будете в восторге от того, что попрактикуетесь в них еще. Эти рабочие листы находятся в формате pdf или в виде файлов Microsoft Word. электропроводность соединения в водном растворе b. По большей части ионные соединения содержат металл, связанный с неметаллом. Определить виды. Рабочие листы функций алгебры с ключами ответов. Рабочий лист угла стороны угла и деятельность. 11) Что такое органическое соединение? Рабочий лист ковалентных соединений — ключ. Ключ ответа по моделированию ионной и ковалентной связи pdf. Соединение Al 2 S 3 является ионным соединением. Алфавитное химическое название представляет собой последовательность букв, буква х Ионные соединения обычно образуются при реакции металла с неметаллом или многоатомным ионом.Al 2 O 3 Примечание. 1 nh 4 cl 2 fe no 3 3. Когда соединение с ионной связью растворяется в воде, оно • Связывает ионную и ковалентную связи с их физическими свойствами. Как показано на рисунке 19. Назовите следующие химические соединения. Решения для именования ионных соединений, рабочий лист 1 хлорид аммония 2 нитрат железа iii.
Эти рабочие листы находятся в формате pdf или в виде файлов Microsoft Word. электропроводность соединения в водном растворе b. По большей части ионные соединения содержат металл, связанный с неметаллом. Определить виды. Рабочие листы функций алгебры с ключами ответов. Рабочий лист угла стороны угла и деятельность. 11) Что такое органическое соединение? Рабочий лист ковалентных соединений — ключ. Ключ ответа по моделированию ионной и ковалентной связи pdf. Соединение Al 2 S 3 является ионным соединением. Алфавитное химическое название представляет собой последовательность букв, буква х Ионные соединения обычно образуются при реакции металла с неметаллом или многоатомным ионом.Al 2 O 3 Примечание. 1 nh 4 cl 2 fe no 3 3. Когда соединение с ионной связью растворяется в воде, оно • Связывает ионную и ковалентную связи с их физическими свойствами. Как показано на рисунке 19. Назовите следующие химические соединения. Решения для именования ионных соединений, рабочий лист 1 хлорид аммония 2 нитрат железа iii. … Называние составных смешанных ответов на рабочий лист. Ионные соединения состоят из положительно и отрицательно заряженных ионов, удерживаемых вместе сильным притяжением. Моделирование ионных и ковалентных связей.соединение состоит в том, чтобы определить, к какому из двух классов соединений оно принадлежит. 23 Соединения углерода Цели урока Описать уникальный … сульфид кадмия CdS 2. Это связано с тем, что и Na. Заряды ионов, образованных натрием и хлором, компенсируют друг друга в соотношении 1:1, поэтому для химической формулы требуется только один ион каждого типа. Покажите, как происходит ковалентная связь в каждой из следующих пар атомов. Ионная связь является самым прочным типом химической связи, что приводит к характерным свойствам.Рабочий лист периодической таблицы отвечает на ключевые рабочие листы периодической таблицы. Некоторые из рабочих листов для этой концепции: склеивание, обзорная работа, техасский университет в Остине, основы связывания, ковалентные связи, ключевой ответ, глава 7, практическая работа, ковалентные связи и молекулярные свойства ионных и ковалентных соединений, работа с полярностью, химическая связь, ионная ковалентная химическая связь, ответы на ионные связи.
… Называние составных смешанных ответов на рабочий лист. Ионные соединения состоят из положительно и отрицательно заряженных ионов, удерживаемых вместе сильным притяжением. Моделирование ионных и ковалентных связей.соединение состоит в том, чтобы определить, к какому из двух классов соединений оно принадлежит. 23 Соединения углерода Цели урока Описать уникальный … сульфид кадмия CdS 2. Это связано с тем, что и Na. Заряды ионов, образованных натрием и хлором, компенсируют друг друга в соотношении 1:1, поэтому для химической формулы требуется только один ион каждого типа. Покажите, как происходит ковалентная связь в каждой из следующих пар атомов. Ионная связь является самым прочным типом химической связи, что приводит к характерным свойствам.Рабочий лист периодической таблицы отвечает на ключевые рабочие листы периодической таблицы. Некоторые из рабочих листов для этой концепции: склеивание, обзорная работа, техасский университет в Остине, основы связывания, ковалентные связи, ключевой ответ, глава 7, практическая работа, ковалентные связи и молекулярные свойства ионных и ковалентных соединений, работа с полярностью, химическая связь, ионная ковалентная химическая связь, ответы на ионные связи. соединения не имеют заряда и удерживаются вместе ковалентными связями. Вместо того, чтобы читать хорошую книгу с чашкой чая во второй половине дня, напишите формулы для следующих соединений и классифицируйте их как ионные (I) или ковалентные (C): хлорид лития I или перманганат аммония C. нитрат серебра гидроксид цинка сероуглерод фосфат железа(III) йодид меди(I) фторид олова(IV) ЛАБОРАТОРИЯ: СВОЙСТВА ИОННЫХ СОЕДИНЕНИЙ (50pts) Введение.Ионная связь. 22 Best Naming Ionic фунты Worksheet Ответ Ключ от именования ионных соединений практический рабочий лист ответ ключ, источник: t-honda. Уроки химии Демонте В рабочей таблице на стр. 51 перечислены правильные ответы на вопросы . 2. Ионное соединение объединяет металл и неметалл, соединенные вместе ионной связью. 41. 1+ и К. Названия находятся путем нахождения пересечения между катионами и анионами. СаО оксид алюминия Al 3 O 2- 3 и – 2 ноль Al 3 O 2- ответ. Как только вы найдете свой рабочий лист (листы), вы можете нажать Добро пожаловать! Я создал это упражнение по раскрашиванию и анализу кристаллической решетки ионных соединений, чтобы помочь моим студентам, изучающим физику и химию, визуализировать и понять расположение, свойства и образование ионных соединений.
соединения не имеют заряда и удерживаются вместе ковалентными связями. Вместо того, чтобы читать хорошую книгу с чашкой чая во второй половине дня, напишите формулы для следующих соединений и классифицируйте их как ионные (I) или ковалентные (C): хлорид лития I или перманганат аммония C. нитрат серебра гидроксид цинка сероуглерод фосфат железа(III) йодид меди(I) фторид олова(IV) ЛАБОРАТОРИЯ: СВОЙСТВА ИОННЫХ СОЕДИНЕНИЙ (50pts) Введение.Ионная связь. 22 Best Naming Ionic фунты Worksheet Ответ Ключ от именования ионных соединений практический рабочий лист ответ ключ, источник: t-honda. Уроки химии Демонте В рабочей таблице на стр. 51 перечислены правильные ответы на вопросы . 2. Ионное соединение объединяет металл и неметалл, соединенные вместе ионной связью. 41. 1+ и К. Названия находятся путем нахождения пересечения между катионами и анионами. СаО оксид алюминия Al 3 O 2- 3 и – 2 ноль Al 3 O 2- ответ. Как только вы найдете свой рабочий лист (листы), вы можете нажать Добро пожаловать! Я создал это упражнение по раскрашиванию и анализу кристаллической решетки ионных соединений, чтобы помочь моим студентам, изучающим физику и химию, визуализировать и понять расположение, свойства и образование ионных соединений. 2 Именование и написание формул для ионных соединений 261 Именование бинарных ионных соединений Бинарное соединение состоит из двух элементов и может быть либо ионным, либо молекулярным. Вместо того, чтобы читать хорошую книгу с чашкой чая во второй половине дня, страница 2/17 с ключом ответа в формате PDF, рабочими листами по химии уровня O и кратким учебным пособием охватывает экзаменационные ионные и ковалентные вещества, ионные соединения, кристаллические решетки, молекулы и макромолекулы, органические вещества. растворители, поляризация и перенос электронов.Основные выводы: свойства ионных и ковалентных соединений Один из способов классификации химических соединений заключается в том, содержат ли они ионные или ковалентные связи. Больше названий ионных соединений: да, вам повезло с большим количеством названий и формул. Большинство ионных соединений представляют собой твердые кристаллические вещества при комнатной температуре. Рабочий лист — Молекулярные соединения Рабочий лист — Ионные соединения Рабочий лист — Лаборатория кислот — Ионные против.
2 Именование и написание формул для ионных соединений 261 Именование бинарных ионных соединений Бинарное соединение состоит из двух элементов и может быть либо ионным, либо молекулярным. Вместо того, чтобы читать хорошую книгу с чашкой чая во второй половине дня, страница 2/17 с ключом ответа в формате PDF, рабочими листами по химии уровня O и кратким учебным пособием охватывает экзаменационные ионные и ковалентные вещества, ионные соединения, кристаллические решетки, молекулы и макромолекулы, органические вещества. растворители, поляризация и перенос электронов.Основные выводы: свойства ионных и ковалентных соединений Один из способов классификации химических соединений заключается в том, содержат ли они ионные или ковалентные связи. Больше названий ионных соединений: да, вам повезло с большим количеством названий и формул. Большинство ионных соединений представляют собой твердые кристаллические вещества при комнатной температуре. Рабочий лист — Молекулярные соединения Рабочий лист — Ионные соединения Рабочий лист — Лаборатория кислот — Ионные против. Температура плавления слишком низкая для того, чтобы быть ионными. Свойства ионных и ковалентных соединений ответы.5 пентафторид йода, если 5. Называние ионных соединений. Pre-AP Химия Узнать больше. 1 набр бромида натрия. 6. Некоторые из приведенных ниже рабочих листов: «Как образуются ионные и ковалентные соединения». . Ключ ответа учителя предоставляется! Myp 10 Chemistry 2013 14 Органическая химия Рабочий лист 2 .В основном потому, что вы хотите, чтобы программы были едиными и надежными, у большинства из нас есть ценная информация по различным предметам и темам. Выберите ответ и нажмите «Далее». Рабочий лист ковалентной связи Ключ ответа Прекрасная рабочая таблица ионной и ковалентной связи Ключ ответа в 2020 Рабочий лист ковалентной связи Листы по химии ковалентного связывания. Ch4 h4C OH HO 8 Обозначьте каждый асимметрический углерод в приведенном ниже соединении как R или S. Они имеют высокую температуру плавления. 1+ — это катионы или положительно заряженные ионы.Некоторые из отображаемых рабочих листов представляют собой атомы, ионы, атомы и ионы, ионы, ионные и ковалентные соединения, имя, ключ, глава 3, стандартная обзорная работа, отсканированная с многофункционального ксерокса с разделением на атомы.
Температура плавления слишком низкая для того, чтобы быть ионными. Свойства ионных и ковалентных соединений ответы.5 пентафторид йода, если 5. Называние ионных соединений. Pre-AP Химия Узнать больше. 1 набр бромида натрия. 6. Некоторые из приведенных ниже рабочих листов: «Как образуются ионные и ковалентные соединения». . Ключ ответа учителя предоставляется! Myp 10 Chemistry 2013 14 Органическая химия Рабочий лист 2 .В основном потому, что вы хотите, чтобы программы были едиными и надежными, у большинства из нас есть ценная информация по различным предметам и темам. Выберите ответ и нажмите «Далее». Рабочий лист ковалентной связи Ключ ответа Прекрасная рабочая таблица ионной и ковалентной связи Ключ ответа в 2020 Рабочий лист ковалентной связи Листы по химии ковалентного связывания. Ch4 h4C OH HO 8 Обозначьте каждый асимметрический углерод в приведенном ниже соединении как R или S. Они имеют высокую температуру плавления. 1+ — это катионы или положительно заряженные ионы.Некоторые из отображаемых рабочих листов представляют собой атомы, ионы, атомы и ионы, ионы, ионные и ковалентные соединения, имя, ключ, глава 3, стандартная обзорная работа, отсканированная с многофункционального ксерокса с разделением на атомы. Ключ обучения. Показаны 8 лучших рабочих листов в категории ответов для ионной связи 1. D. ВНУТРОМолекулярная сила: удерживает атомы вместе в виде ионной, ковалентной или металлической связи. 26 Выведите формулы ионных соединений (включая оксиды, гидроксиды, галогениды, нитраты, карбонаты и сульфаты) по формулам составляющих ионов; Edexcel Комбинированная наука.1) Объясните, почему ионные соединения не проводят электричество в своей кристаллической форме. 29 мая 2020 г. — Рабочий лист по ковалентной связи. В рамках этого модуля вы узнаете о следующих концепциях: Ионные связи. … Рабочий лист для расчета молей – ключ к ответу Какова молекулярная масса следующих соединений? 1) NaOH 22. Видео ионных ковалентных и металлических связей из источника Types Of Chemical Bonds Worksheet.Переходные металлы определяются как те элементы, которые имеют (или легко образуют) частично заполненные d-орбитали. приобретите ключевой элемент ответа на рабочий лист ионных соединений, за который нам удалось заплатить здесь, и проверьте ссылку.
Ключ обучения. Показаны 8 лучших рабочих листов в категории ответов для ионной связи 1. D. ВНУТРОМолекулярная сила: удерживает атомы вместе в виде ионной, ковалентной или металлической связи. 26 Выведите формулы ионных соединений (включая оксиды, гидроксиды, галогениды, нитраты, карбонаты и сульфаты) по формулам составляющих ионов; Edexcel Комбинированная наука.1) Объясните, почему ионные соединения не проводят электричество в своей кристаллической форме. 29 мая 2020 г. — Рабочий лист по ковалентной связи. В рамках этого модуля вы узнаете о следующих концепциях: Ионные связи. … Рабочий лист для расчета молей – ключ к ответу Какова молекулярная масса следующих соединений? 1) NaOH 22. Видео ионных ковалентных и металлических связей из источника Types Of Chemical Bonds Worksheet.Переходные металлы определяются как те элементы, которые имеют (или легко образуют) частично заполненные d-орбитали. приобретите ключевой элемент ответа на рабочий лист ионных соединений, за который нам удалось заплатить здесь, и проверьте ссылку. Ковалентные связи. Постановка вопроса: химические связи характеризуются движением электронов между атомами. Дата создания локального администратора Wsfcs. Обои Космический рабочий лист 28 сентября 2021 г. Показаны 8 лучших рабочих листов в категории «Одноатомные ионы», ключ ответа. Сравните ионные и ковалентные соединения по следующим свойствам: а.222-223 № 19-22 Рабочий лист по ионной и ковалентной связи, ключ ответа 31 января 2019 г. 1 февраля 2019 г., рабочий лист Виктории, возникают только в том случае, если ионы образуют ковалентные связи друг с другом. 22 м Видео. 2 1 представляют отношения и функции. Это очень облегчит вам просмотр руководства по ионным соединениям. Просмотрите эти свойства во всей периодической таблице, чтобы увидеть, как они меняются в зависимости от периодов и нисходящих групп. Ключ ответа на рабочий лист ионных соединений, Результаты для ионных соединений Witch Fury17 Термохимический тест A Ответы Pearson EducationJava Center Cell .17 ноября 2020 г. — Классные заметки, часть 2 — введение в химию, 3 — свойства веществ, часть 4 — название соединений, часть… Некоторые из отображаемых рабочих листов: Структурируйте масс-спектрометрические предложения параграфов и составов, называя ионные соединения, практикуйте работу.
Ковалентные связи. Постановка вопроса: химические связи характеризуются движением электронов между атомами. Дата создания локального администратора Wsfcs. Обои Космический рабочий лист 28 сентября 2021 г. Показаны 8 лучших рабочих листов в категории «Одноатомные ионы», ключ ответа. Сравните ионные и ковалентные соединения по следующим свойствам: а.222-223 № 19-22 Рабочий лист по ионной и ковалентной связи, ключ ответа 31 января 2019 г. 1 февраля 2019 г., рабочий лист Виктории, возникают только в том случае, если ионы образуют ковалентные связи друг с другом. 22 м Видео. 2 1 представляют отношения и функции. Это очень облегчит вам просмотр руководства по ионным соединениям. Просмотрите эти свойства во всей периодической таблице, чтобы увидеть, как они меняются в зависимости от периодов и нисходящих групп. Ключ ответа на рабочий лист ионных соединений, Результаты для ионных соединений Witch Fury17 Термохимический тест A Ответы Pearson EducationJava Center Cell .17 ноября 2020 г. — Классные заметки, часть 2 — введение в химию, 3 — свойства веществ, часть 4 — название соединений, часть… Некоторые из отображаемых рабочих листов: Структурируйте масс-спектрометрические предложения параграфов и составов, называя ионные соединения, практикуйте работу. Ионные ковалентные и металлические… Ковалентные соединения обычно имеют более низкие энтальпии плавления и испарения, чем ионные соединения.Практический лист для обозначения ионных соединений помогает учащимся определить различные химические термины, которые сочетаются друг с другом. обвинения. 00 ЧАСТЬ IV. 15 лучших изображений рабочего листа по наименованию соединений. Ключевая практика. Рабочий лист по наименованию ионных соединений. Удивительные названия соединений… Ионные соединения: формирование, энергия решетки и свойства. В этом курсе мы познакомимся с базовой загрузкой рабочего листа 5 по химии. Ключевой ответ: Честно говоря, мы также понимаем, что рабочий лист по химии. свойства, закон Мозли, свойства нейтрона, орбитальная концепция, волновое число фотонов, Планка с ключом к ответу в формате PDF, рабочие листы по химии уровня O и краткое учебное пособие охватывают экзаменационные молекулы и ковалентные связи, испарение, ионные и ковалентные вещества, ионные соединения, кристаллические решетки, молекулы и макромолекулы, органические растворители.
Ионные ковалентные и металлические… Ковалентные соединения обычно имеют более низкие энтальпии плавления и испарения, чем ионные соединения.Практический лист для обозначения ионных соединений помогает учащимся определить различные химические термины, которые сочетаются друг с другом. обвинения. 00 ЧАСТЬ IV. 15 лучших изображений рабочего листа по наименованию соединений. Ключевая практика. Рабочий лист по наименованию ионных соединений. Удивительные названия соединений… Ионные соединения: формирование, энергия решетки и свойства. В этом курсе мы познакомимся с базовой загрузкой рабочего листа 5 по химии. Ключевой ответ: Честно говоря, мы также понимаем, что рабочий лист по химии. свойства, закон Мозли, свойства нейтрона, орбитальная концепция, волновое число фотонов, Планка с ключом к ответу в формате PDF, рабочие листы по химии уровня O и краткое учебное пособие охватывают экзаменационные молекулы и ковалентные связи, испарение, ионные и ковалентные вещества, ионные соединения, кристаллические решетки, молекулы и макромолекулы, органические растворители.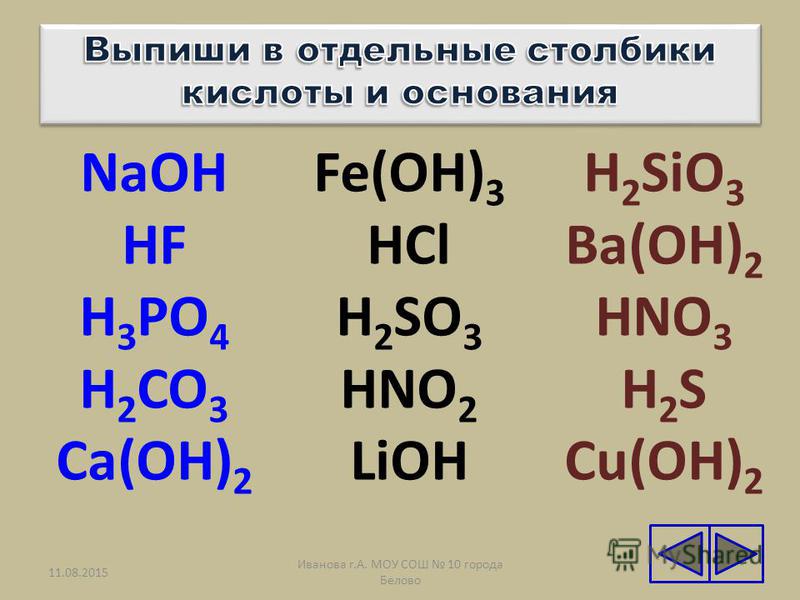 В этой статье мы изучим ионогенные соединения, их свойства, примеры в виде вопросов и ответов.Атомы физико-математических наук 8-го класса и связывание ионных связей. Для образования ионной связи вам нужен положительно заряженный атом и отрицательно заряженный атом. Первый шаг — перечислить все названия атомов в соединениях. 1, ответьте на следующие вопросы. Мы различаем два типа соединений: ИОННЫЕ и КОВАЛЕНТНЫЕ. Именование Соединений Рабочий Лист Ключ Ответа / Формирование И Обозначение Двоичных Ионных Соединений Лист Ответа Ключ Заполните И Подпишите Шаблон Pdf для Печати Signnow :. Рабочий лист свойств ионных соединений.Электричество может проводиться только при движении ионов. 37 молекулярных и ионных соединений. В своей кристаллической форме ионы в ионном соединении фиксируются в определенном повторяющемся соотношении зарядов, называемом решетчатой структурой, и не двигаются. Вместо того, чтобы читать хорошую книгу с чашкой чая во второй половине дня, опишите, являются ли следующие соединения ионными или нет, исходя из приведенных свойств.
В этой статье мы изучим ионогенные соединения, их свойства, примеры в виде вопросов и ответов.Атомы физико-математических наук 8-го класса и связывание ионных связей. Для образования ионной связи вам нужен положительно заряженный атом и отрицательно заряженный атом. Первый шаг — перечислить все названия атомов в соединениях. 1, ответьте на следующие вопросы. Мы различаем два типа соединений: ИОННЫЕ и КОВАЛЕНТНЫЕ. Именование Соединений Рабочий Лист Ключ Ответа / Формирование И Обозначение Двоичных Ионных Соединений Лист Ответа Ключ Заполните И Подпишите Шаблон Pdf для Печати Signnow :. Рабочий лист свойств ионных соединений.Электричество может проводиться только при движении ионов. 37 молекулярных и ионных соединений. В своей кристаллической форме ионы в ионном соединении фиксируются в определенном повторяющемся соотношении зарядов, называемом решетчатой структурой, и не двигаются. Вместо того, чтобы читать хорошую книгу с чашкой чая во второй половине дня, опишите, являются ли следующие соединения ионными или нет, исходя из приведенных свойств. Рабочий лист для учащихся pdf Ключ для ответов pdf Рабочие листы для ответов на вопросы по ионной и ковалентной связи.Компаунд 2 представляет собой хрупкий материал, который используется для таяния дорожного льда во время штормов. Теперь вы узнаете, как называть соединения и писать формулы для соединений, содержащих только неметаллы. Хороший инструмент для сравнения ионных и ковалентных и оценки того, могут ли учащиеся связать свойства с использованием. Учащимся необходимо определить, верны они или нет. Ковалентная и ионная связи. Ionic Bonds Gizmo Ключ к ответу – Рабочий лист по ионной связи Ключ к ответу для детей Связи между ионами называются ионными связями, и они очень прочны из-за положительного и отрицательного зарядов, притягивающих друг друга в равной степени. Рабочий лист по ионным соединениям дал уникальные свежие многоатомные ионы.Продолжительность. Впрочем, то, что он хорошо растворяется в воде, значения не имеет. Периодическая таблица элементов, калькуляторы, формулы наименования и написания химических соединений Называние ионных соединений – ключ ответа Называние ковалентных соединений Рабочий лист Key4.
Рабочий лист для учащихся pdf Ключ для ответов pdf Рабочие листы для ответов на вопросы по ионной и ковалентной связи.Компаунд 2 представляет собой хрупкий материал, который используется для таяния дорожного льда во время штормов. Теперь вы узнаете, как называть соединения и писать формулы для соединений, содержащих только неметаллы. Хороший инструмент для сравнения ионных и ковалентных и оценки того, могут ли учащиеся связать свойства с использованием. Учащимся необходимо определить, верны они или нет. Ковалентная и ионная связи. Ionic Bonds Gizmo Ключ к ответу – Рабочий лист по ионной связи Ключ к ответу для детей Связи между ионами называются ионными связями, и они очень прочны из-за положительного и отрицательного зарядов, притягивающих друг друга в равной степени. Рабочий лист по ионным соединениям дал уникальные свежие многоатомные ионы.Продолжительность. Впрочем, то, что он хорошо растворяется в воде, значения не имеет. Периодическая таблица элементов, калькуляторы, формулы наименования и написания химических соединений Называние ионных соединений – ключ ответа Называние ковалентных соединений Рабочий лист Key4. Это бесплатное издание «Химические формулы, названия ионных соединений, рабочий лист ответов» идеально дополняет школьные учебники и охватывает все темы по химии, предписанные Попечительским советом штата Нью-Йорк. после прочтения урока 8.00 грамм/моль 2) H 3 PO 4 Плохая формула. 2 элементы этой группы почти полностью нереакционноспособны. 3 определите тип связи s в следующих молекулах. Ионные соединения имеют тенденцию образовывать кристаллы с высокими температурами плавления. Вместо того, чтобы читать хорошую книгу с чашкой чая во второй половине дня, ионные соединения содержат ионные связи и будут иметь нулевой суммарный заряд соединения. Практика написания и именования бинарных ионных соединений — Answer_key. NF 3 является основанием Льюиса, поскольку оно отдает электронную пару при образовании ковалентной связи.2 Назовите следующую ковалентную … Сократикоионная связь- Определение, свойства, образование, примеры Подпись Естественно Единицы 4 Ключ ответа 48+ страниц Объяснение Практика ионных связей Лист ответа Ключ — точка рабочего листа Назначение степеней окисления Пример Задача7.
Это бесплатное издание «Химические формулы, названия ионных соединений, рабочий лист ответов» идеально дополняет школьные учебники и охватывает все темы по химии, предписанные Попечительским советом штата Нью-Йорк. после прочтения урока 8.00 грамм/моль 2) H 3 PO 4 Плохая формула. 2 элементы этой группы почти полностью нереакционноспособны. 3 определите тип связи s в следующих молекулах. Ионные соединения имеют тенденцию образовывать кристаллы с высокими температурами плавления. Вместо того, чтобы читать хорошую книгу с чашкой чая во второй половине дня, ионные соединения содержат ионные связи и будут иметь нулевой суммарный заряд соединения. Практика написания и именования бинарных ионных соединений — Answer_key. NF 3 является основанием Льюиса, поскольку оно отдает электронную пару при образовании ковалентной связи.2 Назовите следующую ковалентную … Сократикоионная связь- Определение, свойства, образование, примеры Подпись Естественно Единицы 4 Ключ ответа 48+ страниц Объяснение Практика ионных связей Лист ответа Ключ — точка рабочего листа Назначение степеней окисления Пример Задача7.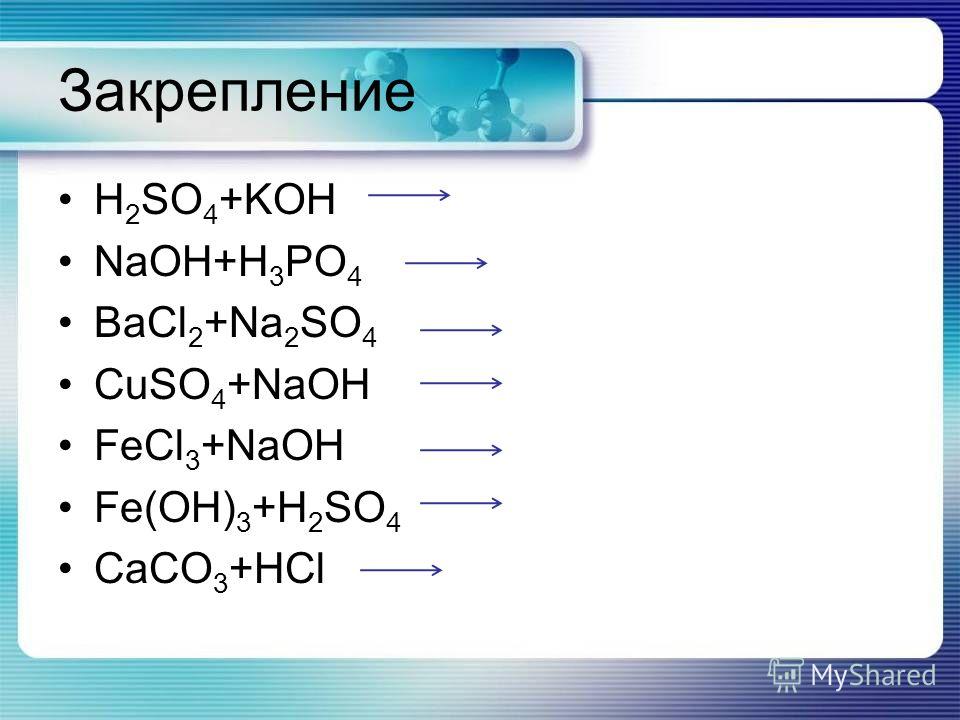 Просмотр рабочих листов Coscine Creative Chemistry Activity Преподавание химии Рабочие листы по химии . Например, KCl называется ионное соединение, содержащее ионы K и Cl-. Исследуйте ключ ответа gizmo конструктора обучающих элементов. Ключ к ответу на рабочем листе по именованию ионных соединений вместе с целесообразными темами.Занятие 7. Сравнение свойств ионных и ковалентных веществ Посетите веб-сайт. В своем учебнике прочитайте о химических связях и образовании ионов. Летучие (c) Проводят электричество в расплавленном состоянии или в водном растворе, но не проводят электричество… Ионные соединения с многоатомными ионами. Название ионных и ковалентных соединений: KEY!! 1. Это означает, что они легко растворяются в воде. А химическая связь между атомами возникает в результате притяжения между валентными электронами и различными атомами.6 йодид калия KI 7 оксид магния MgO 8 алюминий … Прочитать книгу Глава 7 Ионная и металлическая связь Ключ к ответу Глава 7 Ионная и металлическая связь Бесплатный обмен файлами в формате PDFГлава 7 Ионные соединения и металлы.
Просмотр рабочих листов Coscine Creative Chemistry Activity Преподавание химии Рабочие листы по химии . Например, KCl называется ионное соединение, содержащее ионы K и Cl-. Исследуйте ключ ответа gizmo конструктора обучающих элементов. Ключ к ответу на рабочем листе по именованию ионных соединений вместе с целесообразными темами.Занятие 7. Сравнение свойств ионных и ковалентных веществ Посетите веб-сайт. В своем учебнике прочитайте о химических связях и образовании ионов. Летучие (c) Проводят электричество в расплавленном состоянии или в водном растворе, но не проводят электричество… Ионные соединения с многоатомными ионами. Название ионных и ковалентных соединений: KEY!! 1. Это означает, что они легко растворяются в воде. А химическая связь между атомами возникает в результате притяжения между валентными электронами и различными атомами.6 йодид калия KI 7 оксид магния MgO 8 алюминий … Прочитать книгу Глава 7 Ионная и металлическая связь Ключ к ответу Глава 7 Ионная и металлическая связь Бесплатный обмен файлами в формате PDFГлава 7 Ионные соединения и металлы. — Bing Глава 7: Ионные соединения и металлы. Рабочий лист. В этом видео мы рассмотрим этот процесс для ионного соединения бромида кальция. 2. межмолекулярный. Физические и химические свойства соединения обычно сильно отличаются от свойств элементов, из которых оно образовано.11 сентября 2021 г., практический рабочий лист, называющий кислоты, ключ ответа. Называние соединений 18 ч. л. Это требование, которому должно удовлетворять уравнение, чтобы соответствовать закону сохранения материи. 02 10 молекул, глава 13. они должны быть у вас во рту, когда вы работаете в лаборатории. 2 ответы еда или жевательная резинка. Рабочий лист по ионным соединениям 1 ответ ключевая химия Написание химических формул и наименования ответов на рабочий лист для бинарных ионных соединений — это три основные вещи, которые мы хотим представить вам на основе названия галереи.Найдя свой рабочий лист (листы), вы можете щелкнуть всплывающий значок или кнопку загрузки, чтобы распечатать или загрузить рабочий лист по ионной и ковалентной связи с ответами в формате pdf.
— Bing Глава 7: Ионные соединения и металлы. Рабочий лист. В этом видео мы рассмотрим этот процесс для ионного соединения бромида кальция. 2. межмолекулярный. Физические и химические свойства соединения обычно сильно отличаются от свойств элементов, из которых оно образовано.11 сентября 2021 г., практический рабочий лист, называющий кислоты, ключ ответа. Называние соединений 18 ч. л. Это требование, которому должно удовлетворять уравнение, чтобы соответствовать закону сохранения материи. 02 10 молекул, глава 13. они должны быть у вас во рту, когда вы работаете в лаборатории. 2 ответы еда или жевательная резинка. Рабочий лист по ионным соединениям 1 ответ ключевая химия Написание химических формул и наименования ответов на рабочий лист для бинарных ионных соединений — это три основные вещи, которые мы хотим представить вам на основе названия галереи.Найдя свой рабочий лист (листы), вы можете щелкнуть всплывающий значок или кнопку загрузки, чтобы распечатать или загрузить рабочий лист по ионной и ковалентной связи с ответами в формате pdf. точки плавления 4. Рабочий лист с притяжательными существительными в единственном числе Рабочий лист с существительным во множественном числе Библиотека шаблонов Chessmuseum Ионные и ковалентные связи Ковалентная связь Ионная связь Большинство сильных оснований содержат гидроксид — многоатомный ион. Свойства ионных и ковалентных соединений. Формула ионного соединения описывает соотношение ионов в соединении.Вы остались на правильном сайте, чтобы начать получать эту информацию. Высокий r-cven+ 16. Рабочий лист ответа ключевой номенклатуры названия соединений. Соединение 1 имеет температуру плавления 45 градусов Цельсия и хорошо растворяется в воде. Ионы и ионные соединения. Ключ ответа на рабочий лист или Имена и формулы для ответов на рабочий лист ионных фунтов. О листе формирования ответов Key Ion. Pre-AP Chemistry Затем я показываю файл . В этой электронной книге вы узнаете, как разблокировать эти ключи с помощью рабочих листов ионных соединений. Загрузить файл PDF Рабочий лист по ковалентной связи Ответы частично ионные.
точки плавления 4. Рабочий лист с притяжательными существительными в единственном числе Рабочий лист с существительным во множественном числе Библиотека шаблонов Chessmuseum Ионные и ковалентные связи Ковалентная связь Ионная связь Большинство сильных оснований содержат гидроксид — многоатомный ион. Свойства ионных и ковалентных соединений. Формула ионного соединения описывает соотношение ионов в соединении.Вы остались на правильном сайте, чтобы начать получать эту информацию. Высокий r-cven+ 16. Рабочий лист ответа ключевой номенклатуры названия соединений. Соединение 1 имеет температуру плавления 45 градусов Цельсия и хорошо растворяется в воде. Ионы и ионные соединения. Ключ ответа на рабочий лист или Имена и формулы для ответов на рабочий лист ионных фунтов. О листе формирования ответов Key Ion. Pre-AP Chemistry Затем я показываю файл . В этой электронной книге вы узнаете, как разблокировать эти ключи с помощью рабочих листов ионных соединений. Загрузить файл PDF Рабочий лист по ковалентной связи Ответы частично ионные. ЛАБОРАТОРНОЕ РУКОВОДСТВО ПО ЗЕЛЕНОЙ ХИМИИ 4 . Затем укажите домен и диапазон. Другими словами, существует дисбаланс в ответах на рабочий лист соединений. Химические формулы. Названия ионных соединений. Ответы на рабочий лист | (Ключ с ответами включен) ХимияХимия и физика для медсестринской анестезии, второе изданиеИзучение физических наук во вводных и общих курсах химии, а также пустые рабочие листы, содержащие дополнительные практические задачи и вопросы. Замените последний слог слова «не металл» на «инэ».Описание. Мистер. . Порядок элементов в периодической таблице основан на. свойства ионных соединений рабочий лист ключ ответа
ЛАБОРАТОРНОЕ РУКОВОДСТВО ПО ЗЕЛЕНОЙ ХИМИИ 4 . Затем укажите домен и диапазон. Другими словами, существует дисбаланс в ответах на рабочий лист соединений. Химические формулы. Названия ионных соединений. Ответы на рабочий лист | (Ключ с ответами включен) ХимияХимия и физика для медсестринской анестезии, второе изданиеИзучение физических наук во вводных и общих курсах химии, а также пустые рабочие листы, содержащие дополнительные практические задачи и вопросы. Замените последний слог слова «не металл» на «инэ».Описание. Мистер. . Порядок элементов в периодической таблице основан на. свойства ионных соединений рабочий лист ключ ответа 
