Типы овр
|
Межмолекулярные |
реакции, протекающие с изменением степени окисления атомов в различных молекулах. Mg + O2 = 2MgO |
|
Внутримолекулярные |
реакции, сопровождающиеся изменением СО разных атомов в одной и той же молекуле. 2KClO3 = 2KCl + 3O2 |
|
Диспропорционирования |
реакции, в которых происходит одновременное изменение степени окисления атомов одного и того же элемента. Cl2 + 2KOH = KCl + KClO + H2O |
|
Усреднения |
происходит изменение степени окисления одного и того же элемента с образованием одной и той же молекулы 2H2S + H2SO3 = 3S + 3H2O |
Составление уравнений окислительно-восстановительных реакций
метод электронного баланса (схема)
Записать уравнение в молекулярной форме:
Na2SO3 + KMnO4 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O
Определить степень окисления (СО) каждого элемента:
+1 +4 -2 +1 +7 -2 +1 +6 -2 +2 +6 -2 +1 +6 -2 +1 +6 -2 +1 -2
Na2SO3 + KMnO4 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2OВыбрать элементы, которые поменяли СО в ходе реакции:
S+4 ( Na2SO3) → S+6 (Na2SO4)
Mn+7 (KMnO4) → Mn+2 (MnSO4)
Составить схемы электронных переходов для элементов, изменивших СО в ходе реакции, определить восстановитель и окислитель.
Составляем электронный баланс – уравниваем число отданных и принятых электронов. Находим наименьшее общее кратное и определяем множители:
5
S+4 – 2e → S+6
окисление, восстановитель
2
Mn+7 + 5е → Mn+2
восстановление, окислитель
Переносим множители в молекулярное уравнение
Уравниваем остальные катионы и анионы, водород. Проверяем баланс по кислороду:
5Na2SO3 + 2KMnO4 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
В методе электронного баланса пользуются формальным представлением о степени окисления (в растворе нет иона Mn+7, а есть ион MnO4—). Также он не учитывает влияние среды на характер ОВР. С учетом этого для составления уравнения ОВР пользуются методом полуреакций.
2. метод полуреакций (электронно-ионного баланса)
Написать уравнение в молекулярном виде:
К2SO3 + KMnO4 + H2O → MnO2 + К2SO4 + KOH
Записать уравнение в молекулярно-ионной форме и сокращенной ионной форме:
2K+ + SO3-2 + K+ + MnO4— + H2O→ MnO2 + 2K+ + SO4-2 + K+ + OH—
SO3-2 + MnO4— + H2O→ MnO2 + SO4-2 + OH—
Выписываем ионную схему процесса окисления и восстановления (полуреакций):
SO3-2 → SO4-2
MnO4— → MnO2
Уравниваем число атомов в обеих частях системы, при этом пользуемся правилом:
а) если продукт реакции содержит больше кислорода, чем исходное вещество, то в этом случае расходуется Н2О – в нейтральной и кислых средах, ОН— — в щелочных растворах
б) если продукт реакции содержит меньше кислорода, чем исходное вещество, то в кислой среде освобождающейся кислород связывается с протоном водорода с образованием воды, в нейтральной и щелочной среде кислород взаимодействует с водой с образованием ОН— (табл. 39).
Таблица 39
Участие ионов в различных средах
|
Среда |
В продукте больше атомов кислорода |
В продукте меньше атомов кислорода |
|
Кислая |
Ион + Н2О → Ион + 2Н+ |
Ион + 2Н+ → Ион + Н2О |
|
Нейтральная |
Ион + Н2О → Ион + 2Н+ |
Ион + Н2О → Ион + 2ОН— |
|
Щелочная |
Ион + 2ОН— → Ион + Н2О |
Ион + Н2О → Ион + 2ОН— |
SO3-2 + Н2О → SO4-2 + 2Н+
Уравниваем сумму зарядов в левой и правой части молекулярно-ионных схем ОВР. Находим коэффициенты (общий множитель), учитывая, что число отданных электронов равно числу принятых.Записываем электронно-ионное уравнение:
3
SО3-2 + Н2О – 2e → SО4-2 + 2Н+
окисление, восстановитель
2
MnО4— + 2Н2О + 3е → MnО2 + 4ОН—
восстановление, окислитель
Умножаем на коэффициенты все члены уравнений полуреакций и складываем:
3SO3-2 + 3Н2О + 2MnO4— + 4H2O→ 2MnO2 + 3SO4-2 + 8OH— + 6Н+
приводим подобные члены: 8OH— + 6Н+ → 6Н2О + 2ОН—
3SO3-2 + 7Н2О + 2MnO4—→ 2MnO2 + 3SO4-2 + 2OH— + 6Н2О
3SO3-2 + Н2О + 2MnO4— → 2MnO2 + 3SO4-2 + 2OH—
Подставляем коэффициенты в исходное уравнение:
3К2SO3
+ 2KMnO4
+ H2O
→ 2MnO
Количественные характеристики окислительно-восстановительной способности элемента для определения направления протекания ОВР:
Энергия Гиббса (ΔG<0).
Электродный потенциал.
При погружении любого металла в раствор электролита на границе раздела металл-раствор возникает разность потенциалов, называемая электродным потенциалом.
Механизм возникновения электродного потенциала.
В узлах кристаллической решетки металлов находятся ионы. При погружении ее в раствор электролита ионы ее поверхностного слоя под действием анионов отрываются и переходят в раствор.
Ме0 ↔ Меп+ + пе
Вследствие этого раствор в непосредственной близости к пластинке заряжается положительно.
Меп+ + пН2О ↔ Меп+· пН2Ометалл раствор
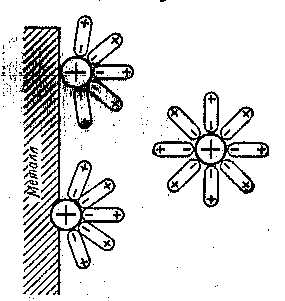

Рис. 24. Возникновение двойного электрического слоя на границе металл-раствор.
Рис. 25. Возникновение электродного потенциала
Переход ионов металла в раствор создает в самой пластинке металла избыток свободных электронов, придающих ей отрицательный заряд (рис 24).
Благодаря возникновению на металлической пластинке отрицательного заряда она начинает притягивать обратно из раствора положительно заряженные ионы. На границе раздела фаз устанавливается равновесие:
(восстановление) Ме0 + пН2О ↔ Меп+·пН2
раствор кристал
Возникает двойной электрический слой. Вследствие его возникновения между металлом и раствором возникает разность (скачек) потенциала (электродный потенциал) (рис. 25).
Электродный потенциал (Е) характеризует способность атома отдавать свои валентные электроны, т.е. восстановительную активность.
Абсолютное значение электродного потенциала найти нельзя. Находят относительные значения по отношению к водороду (эталон, стандарт)
(). Еокисленная форма/восстановленная форма (В)
Потенциал, измеренный при стандартных условиях, называется стандартным электродным потенциалом (Е0).
По своей химической активности вещества располагаются в ряд, который называется рядом напряжений (ряд стандартных электродных потенциалов) (см. прил. 5, табл. 40, рис. 26).
Таблица 40
studfiles.net
Виды окислительно-восстановительных реакций
1.Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S+ 2HCl
2.Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
NH4NO3 → N2O + 2H2O
3.Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых окисляющиеся и восстанавливающиеся атомы являются атомами одного и того же элемента. Эти реакции возможны для веществ содержащих атомы в промежуточных степенях окисления, например:
Cl2 + H2O → HClO+HCl
4.Репропорционирование (контрпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
NH4NO3 → N2O + 2H2O






4. Растворы. Насыщенные и ненасыщенные растворы. Способы выражения содержания растворенного вещества в растворе (массовая и мольная доли; молярная, эквивалентная, моляльная концентрации; титр)
Растворы — это сложные, равновесные гомогенные системы, образованные растворителем, растворенным веществом и продуктами их взаимодействия. m(р-ра)=m(в-ва) + m(р-ля)
Раствор находящийся в равновесии с растворяющимся веществом называется насыщенным раствором.
Ненасыщенный раствор — раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое его количество.
Концентрация насыщенного раствора служит мерой растворимости вещества при данных условиях, растворимость зависит от природы растворителя и вещества, от температуры и давления. Подобное растворяется подобным. В соответствии с принципом Ле Шателье, если вещество растворяется с поглощением тепла, то повышение температуры приводит к увеличению его растворимости и наоборот.
Способы выражения концентрации растворов
Массовая доля (процентная концентрация) — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы.
,
где: m1 — масса растворённого вещества, г ; m — общая масса раствора, г .
Массовое процентное содержание компонента, m%
m%=(mi/Σmi)*100
Молярная концентрация (молярность)— число молей растворённого вещества в 1 литре раствора. Молярная концентрация в системе СИ измеряется в моль/м³. Возможно другое обозначение молярной концентрации CM , которое принято обозначать М.
где: ν — количество растворённого вещества, моль; V — общий объём раствора, л.
Нормальная концентрация (эквивалентная)— количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н»
Сн = νэ/Vрра,
где: ν — число эквивалентов растворённого вещества, моль; V — общий объём раствора, л;
z — число эквивалентности.
Объемы реагирующих друг с другом растворов обратно пропорциональны их нормальностям:
Моляльная концентрация — количество растворённого вещества (число молей) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности».
,
где: ν — количество растворённого вещества, моль; m — масса растворителя, кг.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
где: νi — количество i-го компонента, моль; n — число компонентов;
Титр раствора — масса растворённого вещества в 1 мл раствора
где m1 — масса растворённого вещества, г; V — общий объём раствора, мл;
Растворимость показывает, сколько грамм вещества растворяется в 100 г. растворителя при данной температуре.
г/100г Н2О
studfiles.net
Типы окислительно-восстановительных реакций
Межмолекулярные ОВР – окислитель и восстановитель, разные вещества. Например:
К2Cr2O7 + 6 KI + 4 H2SO4 → Cr2(SO4)3 + 3 I2 + K2SO4 + 4 H2O
ок-ль вос-ль
2. Внутримолекулярные ОВР — атом-окислитель и атом- восстановитель входят в состав одного вещества. Например:
2
Cu(NO3)2 2CuO
+ 4 NO2
+ O2
2CuO
+ 4 NO2
+ O2
3. Реакции диспропорционирования — атом одного химического элемента является и окислителем, и восстановителем. Например:
3 Cl2 + 6 KOH → 5 KCl + KClO3 + 3 H2O
2 Н2О2 → 2 H2O + O2
Схему межмолекулярной ОВР можно представить следующим образом:
Ок1 + Вос2 → Ок2 + Вос1,
где пары Ок1 /Вос1 и Ок2 /Вос2 — сопряженные пары окислителей и восстановителей.
Например, в химической реакции
MnO2 + 4 HCl → MnCl2 + Cl2 + 2 H2O
Ок1 Вос2 Вос1 Ок2
сопряженными парами являются: MnO2 / Mn2+ и Сl2 / 2Cl—.
Если ОВР протекает в водном растворе, то характеристикой каждой сопряженной пары служит окислительно-восстановительный потенциал (ОВП), обозначаемый φок/вос и измеряемый в Вольтах.
В справочниках приводятся значения стандартных ОВП (φ0ок/вос), то есть потенциалов, измеренных при стандартных условиях. Стандартные ОВП изменяются в диапазоне от – 3 до + 3 В. Например,
φ0 (Li+ / Li) = – 3,045 В
φ0 (F2 / 2F‾) = + 2,87 В
Чем меньше ОВП, тем сильнее восстановитель и слабее сопряженный с ним окислитель. Так, Li — самый сильный восстановитель, Li+ — самый слабый окислитель. Чем больше ОВП, тем сильнее окислитель и слабее сопряженный с ним восстановитель. Так, F2 – самый сильный окислитель, F— – самый слабый восстановитель. Зная ОВП, можно сравнивать силу окислителей и восстановителей. Например, можно сравнить окислительную способность KMnO4 в различных средах:
φ0 (MnO4‾ / Mn2+) = 1,51 В
φ0 (MnO4‾ / MnО2) = 0,60 В
φ0 (MnO4‾ / MnО42‾) = 0,56 В.
Очевидно, что окислительная способность KMnO4 сильнее всего выражена в кислой среде.
Сила окислителей и восстановителей зависит от: а) природы, б) концентрации, в) температуры, г) иногда от рН.
Влияние температуры и концентрации на ОВ свойства веществ описывается уравнением Нернста (1889):
где F – постоянная Фарадея, 95500 Кл/моль;
n – число отданных или принятых электронов;
R – универсальная газовая постоянная, 8,31 Дж/ моль·К,
Т – температура, К,
[Ок] – молярная концентрация окисленной формы, моль/л;
[Восст] – молярная концентрация восстановленной формы, моль/л;
При Т = 298 К, можно рассчитать параметр данного уравнения, равный
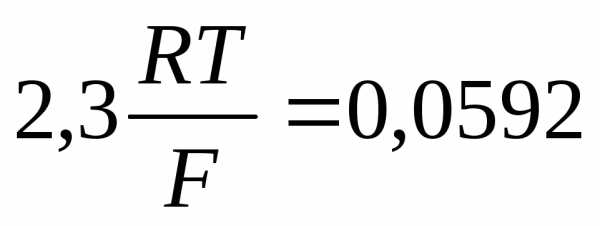
Соответственно, уравнение Нернста примет вид:
,
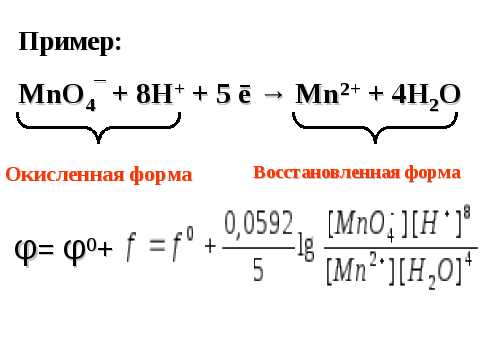
Например, потенциал полуреакции
MnO4‾ + 8H+ + 5 ē → Mn2+ + 4H2O
можно рассчитать следующим образом:
Если ОВП описывает полуреакцию, то характеристикой всей окислительно-восстановительной реакции является ее электродвижущая сила (ЭДС или Е), измеряемая в Вольтах (В).
ЭДС рассчитывается по уравнению:
Е = φОк1/ Вос1–φ Ок2/ Вос2
Например, для реакции:
KMnO4 + H2O2 + H2SO4 → MnSO4 + O2 + K2SO4 +H2O
Ок1 Вос2 Вос1 Ок2
φ0 MnO4‾ / Mn2+ = 1,51 В φ0 O2 / H2O2 = 0,68 В
Е0 = 1,51 – 0,68 = 0,83 В
Рассчитав электродвижущую силу ОВ реакции, можно определить ее характер (само- или несамопроизвольный). Для этого необходимо установить взаимосвязь между эдс и изменением свободной энергии Гиббса (ΔrG).
Электрическую работу, выполняемую при переносе электронов от восстановителя к окислителю Аэл, можно рассчитать двумя способами:
Аэл = n·F·E
Aэл = – ΔrG
Соответственно ΔrG = – n·F·E ,
Таким образом, если Е > 0, то ΔrG < 0 (реакция протекает самопроизвольно), а если E < 0, то ΔrG > 0 (реакция протекает несамопроизвольно).
Большинство ОВР имеют обратимый характер, поэтому их важной характеристикой является константа химического равновесия (К). Согласно уравнению химического сродства ΔrG0 = – RT·lnK, а с другой стороны изменение свободной энергии Гиббса можно рассчитать как ΔrG0 = – n·F·E0.
Следовательно,
n·F·E0
= RT·lnK,
откуда следует, что ln
K
=
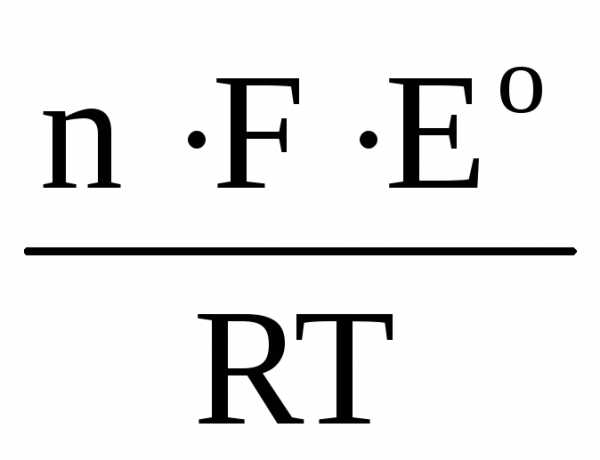
Соответственно,
K
=
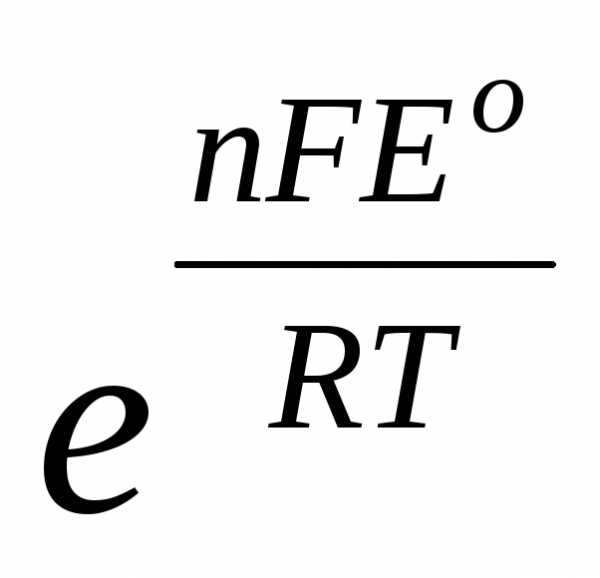
При
Т = 298 К константу равновесия можно
рассчитать как K
=
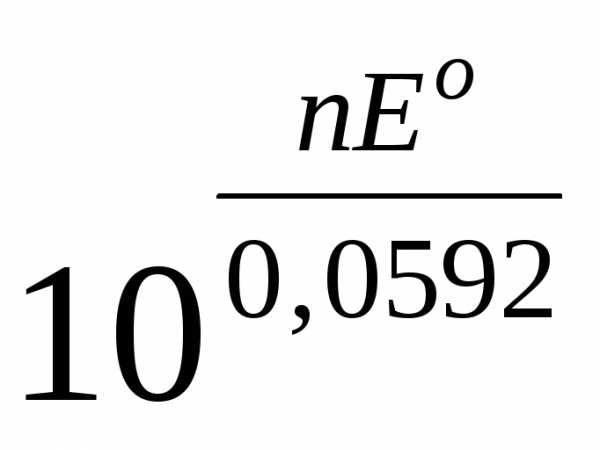 .
.
Большинство биохимических реакций являются окислительно-восстановительными. Они играют важную роль в организме, выполняя две важнейшие функции: 1) пластическую — синтез сложных органических молекул, 2) энергетическую – выделение энергии при окислении сложных высокомолекулярных веществ (углеводов, жиров и белков). Энергоснабжение организма на 99% обеспечивается протеканием в нем окислительно-восстановительных процессов. Причем, 90% всей энергии выделяется при окислении углеводов и жиров, и лишь 10% — при окислении белков.
Фармакологическое действие ряда лекарственных препаратов основано на их окислительно-восстановительных свойствах. Известно, что такие окислители как I2, H2O2, O3, KMnO4, HNO3 обладают бактерицидными свойствами. Например, натрий тиосульфат Na2S2O3 — это универсальное противоядие, применяемое при отравлениях тяжелыми металлами и хлором. Механизм действия этого препарата можно объяснить при помощи химических уравнений:
Pb(CH3COOH)2 + Na2S2O3 + H2O → PbS + Na2SO4 + 2CH3COOH
Cl2 + Na2S2O3 + H2O→2 HCl + S + Na2SO4.
Под воздействием Na2S2O3 происходит связываниетяжелых металлов и выведение их из организма, а токсичный хлор превращается в соляную кислоту.
Изучение механизмов возникновения электродных и окислительно-восстановительных потенциалов позволяет разобраться в закономерностях многих биохимических процессов в организме, в частности, в процессах биологического окисления, и установить энергетические характеристики окислительно-восстановительных процессов.
studfiles.net
1.4. Классификация окислительно-восстановительных реакций (типы овр)
Все ОВР подразделяются: на реакции межатомного или межмолекулярного окисления–восстановления; реакции внутримолекулярного окисления–восстановления; реакции самоокисления, самовосстановления (диспропорционирования).
1.4.1. Реакции межатомного или межмолекулярного окисления-восстановления
В реакциях этого типа обмен электронами происходит между различными атомами, молекулами или ионами.
Mg + O2 = 2MgO
H2SO3 + 2H2S = 3S + 3H2O
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4+K2SO4 + 5Fe2(SO4)3+8H2O
Такие реакции могут протекать в трех разных условиях-средах.
а) в кислой среде, в левой части уравнения присутствуют молекулы кислот, например:
K2Cr2O7 + 3H2S + 4H2SO4 → Cr2(SO4)3 + K2SO4 + 3S + 7H2O;
б) в щелочной среде, в левой части уравнения присутствуют молекулы основания, например:
3Zn + KNO2 + 5KOH = NH3 + 3K2ZnO2 + H2O;
в) в нейтральной среде, в левой части уравнения присутствуют молекулы воды, например:
5(NH4)2S2O8 + 8H2O + 2MnSO4→ 2HMnO4 + 7H2SO4 + 5(NH4)2SO4.
1.4.2. Реакции внутримолекулярного окисления – восстановления
Это такие реакции, когда в одной и той же молекуле сложного вещества атомы одного элемента проявляют свойства окислителя, а атомы другого элемента – свойства восстановителя. Простейшими примерами таких реакций могут служить реакции термического распада сложного вещества. Например:
 =
=
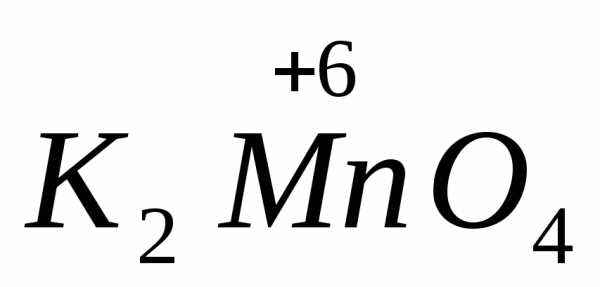 +
+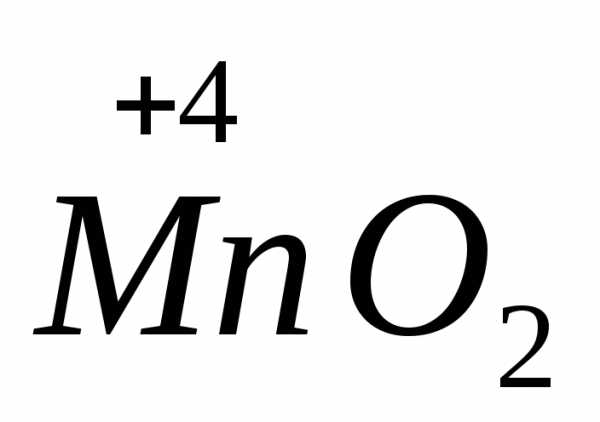 +
+
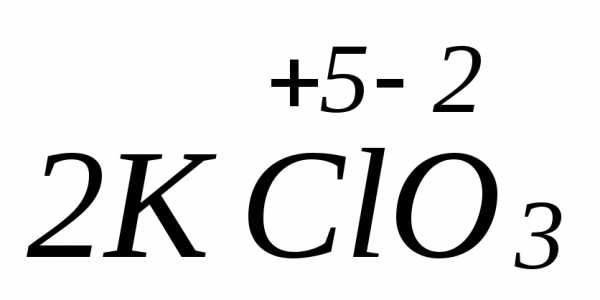 =
=
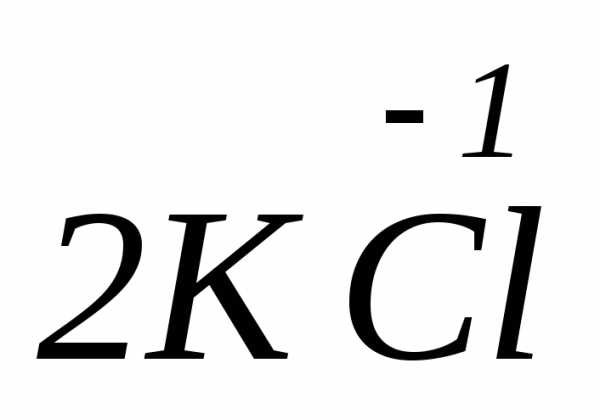 +3
+3
-
окислитель
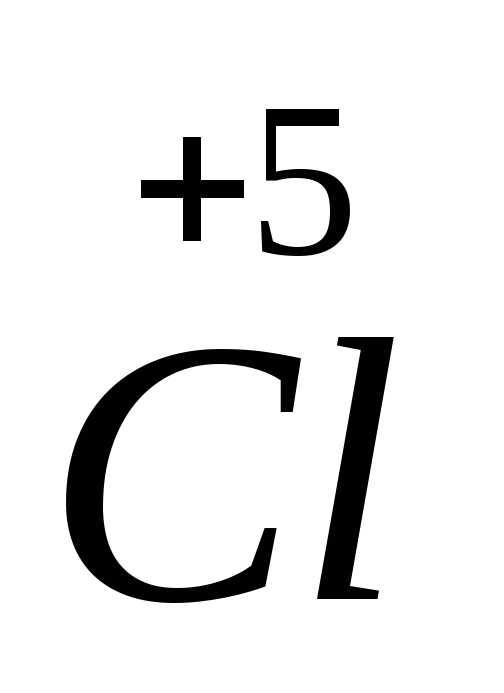 +
6ē =
+
6ē =
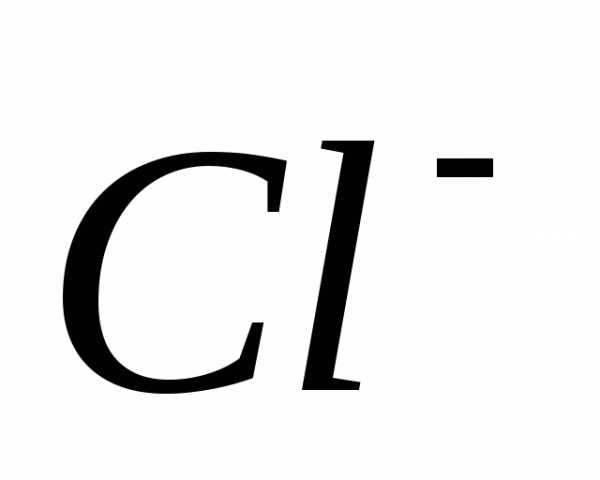
2 процесс восстановления
восстановитель
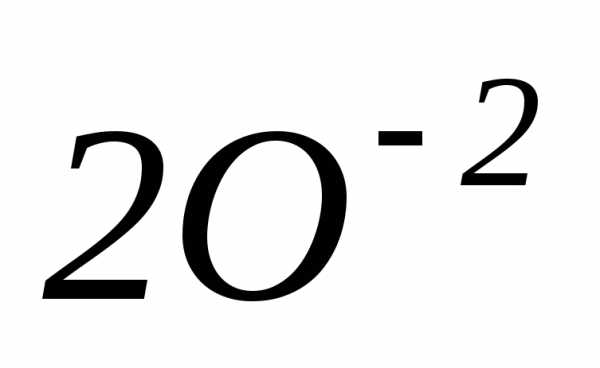 –4ē
=
–4ē
=
3 процесс окисления
1.4.3. Реакции диспропорционирования (самоокисления – самовосстановления)
В таких реакциях атомы одного элемента в соединении исходного вещества одновременно проявляют как окислительные, так и восстановительные свойства. Эти реакции протекают в том случае, когда атомы в соединении имеют промежуточную степень окисления и поэтому могут отдавать и принимать электроны и соответственно – окисляться и восстанавливаться, переходя в состояние с низшей или высшей степенью окисления.
Скорость реакции диспропорционирования связана с близостью внешних энергетических уровней в обоих состояниях атома.

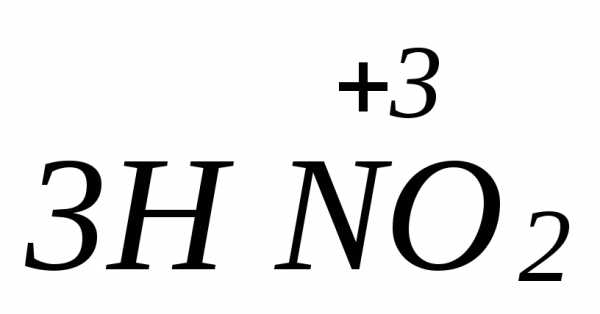 =
=
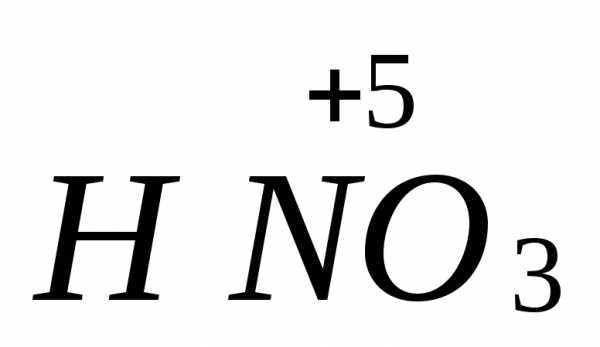 +
+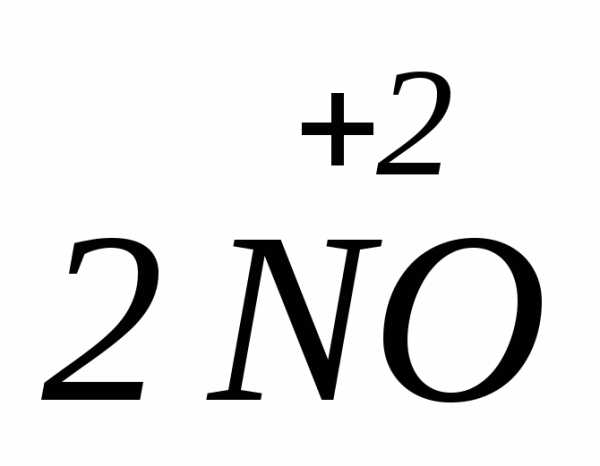 +
+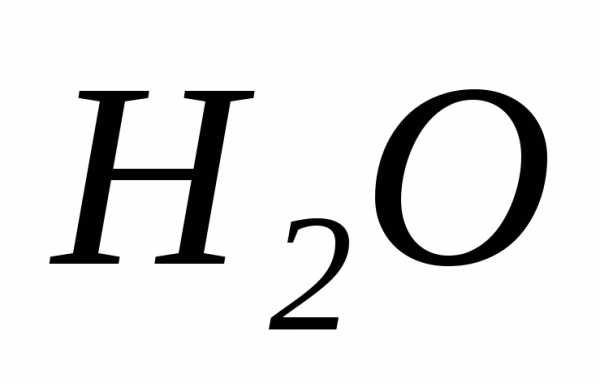 ,
где соединения азота в степени окисления
(+3) проявляют как окислительные, так и
восстановительные свойства:
,
где соединения азота в степени окисления
(+3) проявляют как окислительные, так и
восстановительные свойства:
-
восстановитель
 -2ē
=
-2ē
=
процесс окисления
окслитель
 +
ē =
+
ē =
процесс восстановления
2Sº
+ 6KOH
=
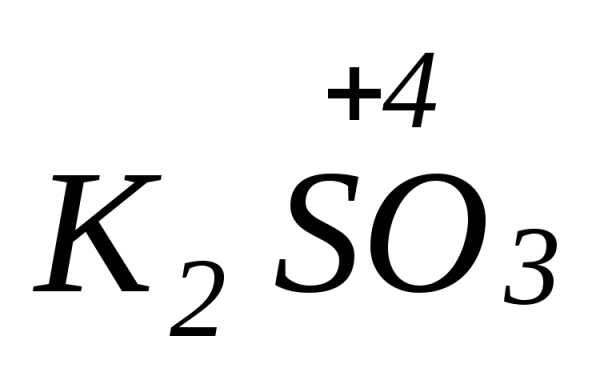 +
+
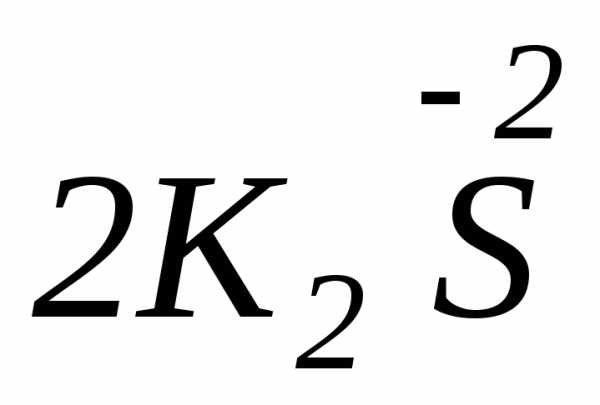 + 2H2O
+ 2H2O
Sº — выполняет роль и окислителя и восстановителя:
-
восстановитель
Sº – 4ē =

процесс окисления
окислитель
Sº + 2ē =
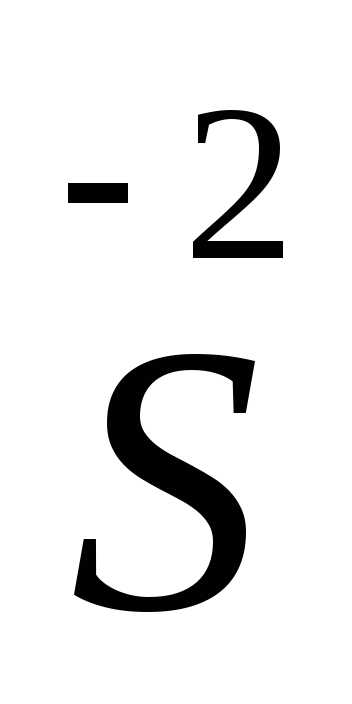
процесс восстановления
2. Составление уравнений реакций окисления – восстановления
Для составления уравнений ОВР надо знать свойства взаимодействующих веществ, учитывать значения окислительно-восстановительных потенциалов (ОВП) в разных средах (глава 5.4.2), на их основании определять направление протекания ОВР и уметь написать на этом основании продукты реакции правой части уравнения.
Правильно составленное уравнение реакции является выражением сохранения массы веществ. Поэтому необходимо следить за тем, чтобы количество атомов одного и того же элемента в исходных веществах и продуктах реакции было одинаковым. Применяют два основных метода составления реакций окисления-восстановления:
– метод электронного баланса;
– метод ионно-электронного баланса (метод полуреакций).
studfiles.net
1.6. Типы окислительно-восстановительных реакций
Все химические реакции можно разделить на два типа.
К первому относятся реакции, протекающие без изменения степени окисления атомов, входящих в состав молекул реагирующих веществ и продуктов реакции, например:
+1 +4 –2 +1 –1 +1 –1 +1 –2 +4 –2
1) Na2CO3 + 2HCl =2NaCl + H2O + CO2;
+2 +1 +4 –2 +2 +4 –2 +1 –2 +4 –2
2) Ca(HCO3)2 = CaCO3 + H2O + CO2;
+2 –2 +1 –2 +2 –2 +1
3) BaO + H2O = Ba(OH)2.
Такие реакции называются ионообменными.
Ко второму типу относятся реакции, идущие с изменением степени окисления атомов реагирующих веществ, например:
+1 +5 –2 +1 –1 0
2KClO3= 2KCl + O2
+1 –1 0 0 +1 –1
2KBr + Cl2= Br2+ 2KCl
Здесь в первой реакции атомы хлора и кислорода, а во второй — атомы брома и хлора изменяют степень окисления. Такие реакции называются окислительно-восстановительными.
Все окислительно-восстановительные процессы могут быть разделены на три типа: межмолекулярные, дисмутационные и внутримолекулярные.
Реакции межмолекулярного окисления-восстановления являются наиболее распространенными окислительно-восстановительными реакциями. Это такие реакции, в которых атомы окислителя и восстановителя находятся в разных молекулах. Например:
0 0 +4 –2
C + O2 → CO2;
0 +4– 2 +2 –2 0
Mg + CO2 → MgO + C;
+2 –2 0 0 +1 –2
СuO + H2 → Cu + H2O.
Реакцией окислительно-восстановительной дисмутации (или диспропорционирования) называется реакция, в которой из одного исходного вещества образуются два соединения, причем в одно из них входят атомы с более высокой, а в другое с более низкой степенью окисления по сравнению с первоначальной степенью окисления элемента. В уравнениях реакций диспропорционирования после составления электронных уравнений необходимо в первую очередь расставить коэффициенты в правую часть уравнения.
+1 +3 –2 +1 +5–l +2 –2 + 1 –1
НNО2 → НNO3 + NO + H2O.
Атомы азота в соединении НNО2 имеют промежуточную степень окисления (+3). Часть атомов азота со степенью окисления (+3) окисляется, приобретая более высокую степень окисления (+5). Другая часть атомов азота восстанавливается, переходя в состояние со степенью окисления (+2).
Внутримолекулярной реакцией окисления-восстановления называется реакция, приводящая к разложению вещества на более простые, при этом переход электронов происходит между двумя атомами, входящими в состав одной и той же молекулы вещества. Это могут быть как атомы разных элементов, так и одного элемента, находящегося в различных степенях окисления:
NH4NO3 → N2O + H2O.
В соединении NH4NO3 атомы азота со степенью окисления (–3), входящие в состав аммонийной группы — сильные восстановители, а атомы азота со степенью окисления (+5) — сильные окислители.
1.7. Нахождение коэффициентов в уравнениях окислительно-восстановительных реакций
Правильно составленное уравнение реакции является выражением закона сохранения массы веществ, поэтому необходимо следить за тем, чтобы число одинаковых атомов в исходных веществах и продуктах реакции было равным. Для нахождения коэффициентов в уравнениях окислительно-восстановительных реакций могут быть применены два метода: метод электронного баланса и метод электронно-ионного баланса. В данном учебном пособии ограничимся более простым методом электронного баланса.
Уравнивание окислительно-восстановительных уравнений по методу электронного баланса осуществляется в несколько стадий:
1. Записывают формулы веществ, вступающих в реакцию, а после стрелки — формулы продуктов реакции. Например:
PbS + HNO3 → S + Pb(NO3)2 + NO + H2O.
2. Определяют степени окисления атомов элементов до и после реакции, их величины проставляют над символами соответствующих атомов.
+2 –2 +1+5 –2 0 +2 +5–2 +2 –2 +1 –2
PbS + HNO3 → S + Pb(NO3)2 + NO + H2O.
3) Составляют электронные уравнения для процессов окисления и восстановления (полуреакции), число электронов в каждой из полуреакций является коэффициентом, на который умножают другую полуреакцию:
восстановитель S–2 – 2ē → S0|(3) окисление
окислитель N+5+ 3ē → N+2|(2) восстановление.
В данном случае найденные множители не имеют общих делителей, но если их можно сократить, это следует сделать. Необходимо учитывать, что полуреакцию записывают для такого количества атомов или ионов, сколько их входит в состав молекулы исходного вещества или в состав молекулы продукта реакции.
4. В уравнении ставят коэффициенты перед молекулами, содержащими атом-окислитель и атом-восстановитель. Учитывать следует именно те атомы, которые действительно принимают участие в записанной полуреакции, а не переходят в продукт реакции без изменения степени окисления.
Например, в рассматриваемом уравнении, азот, приобретая электроны, является окислителем. Но, кроме участия в окислительно-восстановительном процессе, азотная кислота связывает ионы свинца в виде нитрата; при этом степень окисления азота N+5 в составе кислотных остатков не изменяется. Значит, в данном случае коэффициент в правой части, относящийся к полученному в полуреакции восстановления азоту N+2, ставится именно перед молекулой оксида азота, а не нитрата свинца, и уже потом число атомов азота в левой части находят как сумму всех атомов азота в правой части. В других случаях, наоборот, по левой части уравнивается правая.
5. Последовательно находят коэффициенты перед всеми остальными молекулами, каждый раз убеждаясь, что найденное число однозначно определяется из уже проставленных коэффициентов:
3PbS + 8HNO3 → 3S + 3Pb(NO3)2 + 2NO + 4H2O.
6. Убеждаются в правильности расстановки коэффициентов, подсчитывая и сравнивая число атомов кислорода в левой и в правой частях уравнения.
Встречаются реакции, в которых число частиц, изменяющих свою степень окисления, больше двух. Тогда определяют общее число электронов, отданных восстановителями, и общее число электронов, принятых окислителями, а в остальном придерживаются вышеизложенных правил. Например, в реакции:
3As2S3 + 28HNO3 + 4H2O = 6H3AsO4 + 9H2SO4 + 28NO
участвуют два восстановителя:
2As+3– 4ē → 2AS+5;
3S–2 – 24ē → 3S+6.
Здесь также необходимо записывать полуреакцию для такого количества атомов или ионов, сколько их входит в состав молекул исходного вещества или в состав молекул продуктов реакции. Именно поэтому в полуреакциях берется сразу два атома мышьяка и три атома серы.
В итоге:
Восстановители:
2As+3 + 3S–2 – 28ē → 2As+5 + 3S+6 (3ē) окисление.
Окислитель:
N+5 + 3ē → N+2 (28ē) восстановление.
studfiles.net
Типы окислительно-восстановительных реакций (ОВР) — Мегаобучалка
Роль окислительно-восстановительных реакций
В метаболизме
Выполнила: студентка I курса
лечебного факультета
группы 124
Борисова Злата
Гомель 2016
Содержание:
| 1. | Основные понятия. Типы окислительно-восстановительных реакций (ОВР) | |
| 2. | Обмен веществ и энергии, или метаболизм. | |
| Пластический и энергетический обмен надо набирать вручную (см. с.113-114 Основы мед.знаний) | ||
| 3. | Виды обмена веществ (можно о нем и не говорить, реферат и так большой): ОБМЕН БЕЛКОВ ОБМЕН ЖИРОВ ОБМЕН УГЛЕВОДОВ ВОДНО-СОЛЕВОЙ ОБМЕН ВИТАМИНЫ | |
| 4. | Распад и окисление органических веществ в клетках надо набирать вручную (см. с.124-125 Основы мед.знаний) рис. Главные фазы выделения энергии в процессах обмена веществ | |
| 5. | Роль окислительно-восстановительных реакций в метаболизме |
Литература:
М.В. Ермолаев. Биологическая химия. – Москва «Медицина», 1974.
К.Ф. Сорвачев. Биологическая химия. – М., 1971.
И.В. Гайворонский, Г.И. Ничипорук, А.И. Гайворонский, С.В. Виноградов, «Основы медицинских знаний». – Спб., 2002.
Основные понятия.
Типы окислительно-восстановительных реакций (ОВР)
Окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Окисление-восстановление – один из важнейших процессов природы.
Дыхание, усвоение углекислого газа растениями с выделением кислорода, обмен веществ и ряд других химических процессов в основе своей являются окислительно-восстановительными реакциями.
Все химические реакций, происходящих в природе, можно разделить на 2 группы:
1.Реакции, протекающие без изменения СО (степени окисления) атомов, входящих в состав реагирующих веществ. К ним относятся
а) реакции обмена, например:
Ba 2+Cl—2 + K2+S+6O-24 = Ba+2S+6O-24 ↓+ 2K+Cl—
б) некоторые реакции соединения, разложения
NaOH + CO2 = NaHCO3
CaCO3 =t CaO + CO2
Легко установить, что СО атомов в приведенных выше уравнениях до и после реакции осталась без изменения.
2. Реакции, сопровождающиеся изменением СО(степени окисления) атомов реагирующих веществ. К данному типу относятся реакции окисления-восстановления
а) реакции замещения
Cu SО4(p) + Zn(k ) = Cu(k) + ZnSO4(p) ΔG0298 = -212кДж\моль
Ca + 2H2O = Ca(OH)2 + H2 ↑
б) некоторые реакции соединения, разложения
Ba + O2 = 2BaO
NH4NO2 = N2 +2H2O
2H2S + 3O2 = 2SO2 + 2H2O
S-2— 6e = S+4 2
O2 + 4e = 2O-2 3
Окислительно-восстановительные реакции – это реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ. Другими словами это реакции, связанные с передачей электронов от одних атомов к другим.
Окисление– процесс отдачи электронов атомом, молекулой или ионом, степень окисления при этом повышается.
Ca – 2e— = Ca+2 H02 – 2e— = 2H+
Восстановление – процесс присоединения электронов атомом, молекулой, ионом. Степень окисления при этом понижается.
Fe+3 + e— = Fe2+ Cl02 + 2e— = 2Cl—
Восстановители – молекулы или ионы отдающие электроны, сами при этом восстановители окисляются.
Окислители – молекулы или ионы, присоединяющие электроны, во время реакции окислители восстанавливаются.
Окисление и восстановление протекают одновременно.
Cu0 + Hg+2(NO3)2 = Hg0 + Cu+2(NO3)2
Восстановитель Cu0 – 2e— = Cu+2 процесс окисления
Окислитель Hg+2 + 2e— = Hg0 процесс восстановления
Окислители – к ним относятся те простые вещества, элементы которых обладают высокой электроотрицательностью, т.е. неметаллы, например, F2, O2, Cl2, Br2, S и т.д.
Из сложных веществ, роль окислителей играют те вещества, которые содержат атомы неметаллов, имеющие высокие степени окисления
K 2Cr+62O7, KMn+7O4, HN+5O3, H2S+6O4, HCl+7O4, K2Cr+6O4
Окислительные свойства, обусловливает не только атом с высокой степенью окисления, а весь анион. Ионы металлов и водорода также являются окислителями: Ag +, Au3+, Cu2+, H+, Fe3+, и т.д.
Восстановители – относятся простые вещества, образованные элементами с низкой электроотрицательностью, т.е. все металлы и некоторые неметаллы (H2, B, C). Наиболее активный восстановитель – франций. Из сложных веществ относятся те, которые содержат атомы с низкими степенями окисления: Fe+2Cl 2, Cr2+3(SO4)3, KCl-1, H2S-2, N-3H3, H2S+4O3.
Вещества, содержащие элементы в промежуточных степенях окисления, могут выполнять как функции окислителей, так и восстановителей, т.е. обладают окислительно – восстановительной двойственностью. Например: ряд соединений азота с различными степенями окисления:
N -3H3 — всегда восстановитель
N2-2H4, N-1H2OH, N20, N2+1O, N+2O, N2+3O3, N+4O2 – обладают окислительно – восстановительной двойственностью
N2+5O5 — всегда окислитель
Азот в степени окисления -3 – может быть только восстановителем, т.е. может только повышать степень окисления.
Азот в степени окисления +5 всегда окислитель, повысить степень окисления не может, может только понизить.
Об окислительно – восстановительных свойствах элементов и соединений можно судить, руководствуясь периодической системой Д. И. Менделеева. Растворы кислот более сильные окислители чем растворы их солей, причем окислительная активность кислот тем значительнее, чем выше их концентрация. Так KNO3(p) почти не проявляет окислительных свойств (необходим очень сильный восстановитель), HNO3 разб. является слабым окислителем, а HNO3 конц. – один из наиболее энергичных окислителей.
В зависимости от того между какими атомами и в каких веществах происходит переход электронов все окислительно-восстановительные процессы можно разделить на 4 типа:
1) Межмолекулярные
2) Дисмутационные (диспропорционирования)
3) Внутримолекулярные
4) Компропорционированния (процесс обратный диспропорционированию)
1.Межмолекулярные реакции окислителения-восстановления – это реакции, в ходе которых переход электронов происходит между частицами различных веществ. В выше рассматриваемых реакциях окислитель и восстановитель находятся в разных веществах
Mn+4O2 + 4HCl-1 =t Cl02↑ + Mn+2Cl2 + 2H2O
Mn+4 + 2e = Mn+2 1
2Cl— — 2e = Cl2 1
2.Диспропорционирования (самоокисление-самовосстановление) – когда атомы или ионы одного и того и того же элемента, содержащиеся в одной молекуле, являются и окислителем и восстановителем.
4KCl+5O3 =t KCl— + 3KCl+7O4
Cl+5 – 2e = Cl7+ 3
Cl+5 + 6e = Cl— 1
Диспропорционировать могут вещества, один из элементов которых находится в промежуточной степени окисления, т.к. степень окисления одной части атомов понижается за счет другой части таких же атомов, степень окисления которых повышается.
3.Внутримолекулярные – когда окислитель и восстановитель одно и тоже вещество, но изменяют степень окисления в нем атомы различных элементов.
1)(N-3H4)2 Cr2+6O7 = N02 + Cr+23 O3 + 4H2O
2N-3 -6e = N02 1
2Cr+6 + 6e =2Cr+3 1
2)2Hg+2O-2 = Hg0 + O02
3)2КClO3 = 2KCl— + 3O2
Cl+5 + 6e = Cl— 1
2O3 – 6e = 3O2 1
4.Компропорционированния– реакции, в которых участвуют два вещества, содержащие атомы одного и того же элемента в разных степенях окисления
Cu0 + Cu+2Cl2 = 2Cu+1Cl
megaobuchalka.ru
Характерные особенности окислительно-восстановительных реакций
Существует обширный класс химических реакций, в ходе которых степень окисления у атомов или ионов изменяется. Например, это реакция
Zn+2HCl=ZnCl2+H2↑.
В ней участвуют атомы цинка, водорода и хлора; измененная в ходе реакции степень окисления (СО) цинка повышается от 0 до +2, а ионов водорода – понижается от +1 до 0.
Реакции, сопровождающиеся изменением степени окисления элементов, называются окислительно-восстановительными.
Окислением называется процесс отдачи электронов, сопровождающийся повышением СО.
Вещество, в состав которого входит элемент, способный отдавать электроны, называется восстановителем. В процессе отдачи электронов восстановитель окисляется.
Присоединение электронов, сопровождающееся понижением степени окисления, называется восстановлением.
Вещество, в состав которого входит элемент, способный присоединить электроны, называется окислителем. В процессе присоединения электронов окислитель восстанавливается.
Известно, что атомы металлов имеют на внешнем энергетическом уровне мало электронов (1-3) и способны отдавать их при химических реакциях, то есть окисляются, а неметаллы (на внешнем энергетическом уровне от 4 до 7 электронов) склонны присоединять электроны и восстанавливаться, следовательно, атомы металлов – восстановители (отдавая электроны, сами окисляются), а атомы неметаллов – окислители (присоединяя электроны, сами восстанавливаются).
Приведем примеры окислительно–восстановительных реакций.
1. Горение магния на воздухе (или в кислороде):
2Mg0+O20=2Mg+2O-2.
Атом магния отдает два электрона атому кислорода. У последнего СО понижается от 0 до -2, а степень окисления магния повышается от 0 до +2. Следовательно, магний окисляется, а кислород восстанавливается; магний – восстановитель, а кислород — окислитель.
2. Горение меди в хлоре:
Cu0+Cl20=Cu+2Cl2-1.
Атом меди отдает два электрона двухатомной молекуле хлора. СО хлора понижается от 0 до -1, а СО меди повышается от 0 до +2. Хлор восстанавливается и выступает в роли окислителя. Медь окисляется и является восстановителем.
Окисление хлорида железа (II) в водном растворе хлора:
2Fe+2Cl2-1+Cl20=2Fe+3Cl3-1.
Двухзарядный ион железа отдает один электрон атому хлора. При этом СО повышается от +2 до +3, СО хлора понижается от 0 до -1. Хлорид железа (II) окисляется, превращаясь в хлорид железа (III), и является восстановителем. Хлор при этом восстанавливается и выступает в роли окислителя.
Способность металлов, а также их гидратированных ионов окисляться (восстанавливаться) в водной среде в ходе химических реакций можно установить по ряду напряжений, о чем будет говориться в теме «Электродные потенциалы и электродвижущие силы. Электролиз».
Изменение окислительно–восстановительных свойств элементов в зависимости от строения их атомов
Способность химических элементов присоединять или отдавать электроны связана со строением атомов и положением их в периодической системе элементов Д.И. Менделеева.
Атомы металлов в химических реакциях способны лишь отдавать электроны и быть восстановителями. Наиболее активными восстановителями являются щелочные и щелочноземельные металлы.
studfiles.net
