1) p → s → cl 2) se → s → o 3) c → si → ge 4) br → se → as 5) al → mg → na * помогите плз по химии тест- даю 99 баллов срочно очень — Знания.org
9. Сходство бора, углерода и азота проявляется в том, что 1) их атомы содержат одинаковое число протонов 2) во внешнем электронном слое их атомов находится одинаковое число электронов 3) образуемые ими простые вещества проявляют неметаллические свойства 4) во всех соединениях проявляют только положительные степени окисления 5) соответствующие им высшие оксиды относятся к кислотным оксидам *
10. В ряду химических элементов Si → Ge → Sn 1) увеличивается число электронных слоёв в атомах 2) усиливаются неметаллические свойства соответствующих им простых веществ 3) уменьшается значение электроотрицательности 4) усиливается кислотный характер их высших оксидов 5) увеличивается число электронов во внешнем слое атомов *
11. Общим для натрия и алюминия является 1) наличие 12 протонов в ядрах их атомов 2) нахождение валентных электронов в третьем электронном слое 3) образование простых веществ-металлов 4) существование в природе в виде двухатомных молекул 5) образование ими высших оксидов с общей формулой Э2О *
12. В ряду химических элементов Te → Se → S 1) увеличиваются радиусы атомов 2) усиливаются металлические свойства соответствующих им простых веществ 3) увеличивается значение электроотрицательности 4) усиливается кислотный характер их высших оксидов 5) увеличивается число электронов во внешнем электронном слое атомов *
В ряду химических элементов Te → Se → S 1) увеличиваются радиусы атомов 2) усиливаются металлические свойства соответствующих им простых веществ 3) увеличивается значение электроотрицательности 4) усиливается кислотный характер их высших оксидов 5) увеличивается число электронов во внешнем электронном слое атомов *
13. В ряду химических элементов S → Si → Mg происходит уменьшение (ослабление) 1) числа электронов на внешнем энергетическом уровне 2) числа электронных слоёв в атомах 3) радиуса атомов 4) металлических свойств 5) кислотного характера свойств высших гидроксидов *
14. В ряду химических элементов Al → Si → P 1) усиливаются металлические свойства 2) увеличивается электроотрицательность 3) усиливается кислотный характер их высших оксидов 4) увеличивается радиус атомов 5) усиливается основный характер их высших оксидов
16. В каких рядах химические элементы расположены в порядке уменьшения кислотных свойств их высших оксидов? 1) В → C → N 2) P → Si → Al 3) S → Se → Te 4) P → S → Cl 5) Ca → Mg → Be *
17. Значения высших степеней окисления элементов увеличиваются в рядах: 1) Al → P → Cl 2) Se → S → O 3) C → Si → Ge 4) Ge → As → Se 5) Be → Mg → Ca *
Значения высших степеней окисления элементов увеличиваются в рядах: 1) Al → P → Cl 2) Se → S → O 3) C → Si → Ge 4) Ge → As → Se 5) Be → Mg → Ca *
Это обязательный вопрос
18. Значения высших степеней окисления атомов возрастает в рядах элементов: 1) P → S → Cl 2) S → Se → Te 3) C → Si → Ge 4) Br → Se → As 5) B → С → N *
1
19. Значение высшей степени окисления возрастает в ряду: 1) P → S → Cl 2) Te → Se → S 3) C → Si → Ge 4) Be → B → C 5) B → Al → Ga *
Это обязательный вопрос
20. Значение электроотрицательности элемента возрастает в рядах: 1) P → S → Cl 2) Se → S → O 3) C → Si → Ge 4) Br → Se → As 5) Al → Mg → Na *
помогите плз по химии тест- даю 99 баллов срочно очень
Названия химических элементов
Названия химических элементовНазвания химических элементов
| Z | Символ | Name | Название |
| 1 | H | Hydrogen | Водород |
| 2 | He | Helium | Гелий |
| 3 | Li | Lithium | Литий |
| 4 | Be | Beryllium | Бериллий |
| 5 | B | Boron | Бор |
| 6 | C | Carbon | Углерод |
| 7 | N | Nitrogen | Азот |
| 8 | O | Oxygen | Кислород |
| 9 | F | Fluorine | Фтор |
| 10 | Ne | Neon | Неон |
| 11 | Na | Sodium | Натрий |
| 12 | Mg | Magnesium | Магний |
| 13 | Al | Aluminium | Алюминий |
| 14 | Si | Silicon | Кремний |
| 15 | P | Phosphorus | Фосфор |
| 16 | S | Sulfur | Сера |
| 17 | Cl | Chlorine | Хлор |
| 18 | Ar | Argon | Аргон |
| 19 | K | Potassium | Калий |
| 20 | Ca | Calcium | Кальций |
| 21 | Sc | Scandium | Скандий |
| 22 | Ti | Titanium | Титан |
| 23 | V | Vanadium | Ванадий |
| 24 | Cr | Chromium | Хром |
| 25 | Mn | Manganese | Марганец |
| 26 | Fe | Iron | |
| 27 | Co | Cobalt | Кобальт |
| 28 | Ni | Nickel | Никель |
| 29 | Cu | Copper | Медь |
| 30 | Zn | Zinc | Цинк |
| 31 | Ga | Gallium | Галлий |
| 32 | Ge | Germanium | Германий |
| 33 | As | Arsenic | Мышьяк |
| 34 | Se | Selenium | Селен |
| 35 | Br | Bromine | Бром |
| 36 | Kr | Krypton | Криптон |
| 37 | Rb | Rubidium | Рубидий |
| 38 | Sr | Strontium | Стронций |
| 39 | Y | Yttrium | Иттрий |
| 40 | Zr | Zirconium | Цирконий |
| 41 | Nb | Niobium | Ниобий |
| 42 | Mo | Molybdenum | Молибден |
| 43 | Tc | Technetium | Технеций |
| 44 | Ru | Ruthenium | Рутений |
| 45 | Rh | Rhodium | Родий |
| 46 | Pd | Palladium | Палладий |
| 47 | Ag | Silver | Серебро |
| 48 | Cd | Cadmium | Кадмий |
| 49 | In | Indium | Индий |
| 50 | Sn | Tin | Олово |
| 51 | Sb | Antimony | Сурьма |
| 52 | Te | Tellurium | Теллур |
| 53 | I | Iodine | Иод |
| 54 | Xe | Ксенон | |
| 55 | Cs | Caesium | Цезий |
| 56 | Ba | Barium | Барий |
| 57 | La | Lanthanum | Лантан |
| 58 | Ce | Cerium | Церий |
| 59 | Pr | Praseodymium | Празеодим |
| 60 | Nd | Neodymium | Неодим |
| 61 | Pm | Promethium | Прометий |
| 62 | Sm | Samarium | Самарий |
| 63 | Eu | Europium | Европий |
| 64 | Gd | Gadolinium | Гадолиний |
| 65 | Tb | Terbium | Тербий |
| 66 | Dy | Dysprosium | Диспрозий |
| 67 | Ho | Holmium | Гольмий |
| 68 | Er | Erbium | Эрбий |
| 69 | Tm | Thulium | Тулий |
| 70 | Yb | Ytterbium | Иттербий |
| 71 | Lu | Lutetium | Лютеций |
| 72 | Hf | Hafnium | Гафний |
| 73 | Ta | Tantalum | Тантал |
| 74 | W | Tungsten | Вольфрам |
| 75 | Re | Rhenium | Рений |
| 76 | Os | Osmium | Осмий |
| 77 | Ir | Iridium | Иридий |
| 78 | Pt | Platinum | Платина |
| 79 | Au | Gold | Золото |
| 80 | Hg | Mercury | Ртуть |
| 81 | Tl | Thallium | Таллий |
| 82 | Pb | Lead | Свинец |
| 83 | Bi | Bismuth | Висмут |
| 84 | Po | Polonium | Полоний |
| 85 | At | Astatine | Астат |
| 86 | Rn | Radon | Радон |
| 87 | Fr | Francium | Франций |
| 88 | Ra | Radium | Радий |
| 89 | Ac | Actinium | Актиний |
| 90 | Th | Thorium | Торий |
| 91 | Pa | Protactinium | Протактиний |
| 92 | U | Uranium | Уран |
| 93 | Np | Neptunium | Нептуний |
| 94 | Pu | Plutonium | Плутоний |
| 95 | Am | Americium | Америций |
| 96 | Cm | Curium | Кюрий |
| 97 | Bk | Berkelium | Берклий |
| 98 | Cf | Californium | Калифорний |
| 99 | Es | Einsteinium | Эйнштейний |
| 100 | Fm | Fermium | Фермий |
| 101 | Md | Mendelevium | Менделевий |
| 102 | No | Nobelium | Нобелий |
| 103 | Lr | Lawrencium | Лоуренсий |
| 104 | Rf | Rutherfordium | Резерфордий |
| 105 | Db | Dubnium | Дубний |
| 106 | Sg | Seaborgium | Сиборгий |
| 107 | Bh | Bohrium | Борий |
| 108 | Hs | Hassium | Хассий |
| 109 | Mt | Meitnerium | Мейтнерий |
| 110 | Ds | Darmstadtium | Дармштадтий |
| 111 | Rg | Roentgenium | Рентгений |
| 112 | Cn | Copernicium | Коперниций |
| 113 | Nh | Nihonium | Нихоний |
| 114 | Fl | Flerovium | Флеровий |
| 115 | Mc | Moscovium | Московий |
| 116 | Lv | Livermorium | Ливерморий |
| 117 | Ts | Tennessine | Теннессин |
| 118 | Og | Oganesson | Оганессон |
https://iupac. org/what-we-do/periodic-table-of-elements/
org/what-we-do/periodic-table-of-elements/
Задание 2
Задание 2.1
Из указанных в ряду химических элементов
1) Na; 2) K; 3) Si; 4) Mg; 5) C
выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Источник — Демонстрационный вариант КИМ ЕГЭ по химии 2019 года
Решение
По Периодической системе химических элементов Д.И. Менделеева определяем, что в одном периоде находятся натрий, кремний и магний.
Металлические свойства возрастают в периоде справа налево. Таким образом, наименьшими металлическими свойствами характеризуется кремний,
промежуточное положение в данном случае занимает магний, самыми сильными металлическими свойствами обладает натрий.
Ответ: 341
Задание 2.2
Из указанных в ряду химических элементов
1) Ca; 2) O; 3) Al; 4) Mg; 5) S
выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их атомных радиусов.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
По Периодической системе химических элементов Д.И. Менделеева определяем, что в одном периоде находятся алюминий, магний и сера. Атомные радиусы возрастают в периоде справа налево. Таким образом, наименьшим атомным радиусом характеризуется сера, промежуточное положение в данном случае занимает алюминий, самым большим атомным радиусом обладает магний.
Ответ: 534
Задание 2.3
Из указанных в ряду химических элементов
1) Li; 2) As; 3) B; 4) N; 5) Rb
выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке уменьшения энергии ионизации.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
По Периодической системе химических элементов Д.И. Менделеева определяем, что в одном периоде находятся литий, бор и азот. Энергия ионизации — энергия, необходимая для отрыва электрона от свободного атома в основном состоянии на бесконечность. Энергия ионизации уменьшается в периоде справа налево. Таким образом, наибольшей энергией ионизации характеризуется азот, промежуточное положение в данном случае занимает бор, самой малой энергией ионизации обладает литий.
Ответ: 431
Задание 2.4
Из указанных в ряду химических элементов
1) Cl; 2) F; 3) Se; 4) Ca; 5) Br
выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе.
Расположите выбранные элементы в порядке усиления окислительных свойств.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
По Периодической системе химических элементов Д.И. Менделеева определяем, что в одной группе находятся хлор, фтор и бром. Окислительные свойства усиливаются в группе снизу вверх. Таким образом, наименьшими окислительными свойствами характеризуется бром, промежуточное положение в данном случае занимает хлор, самыми сильными окислительными свйоствами обладает фтор.
Ответ: 512
Задание 2.5
Из указанных в ряду химических элементов
1) Se; 2) O; 3) H; 4) S; 5) Al
выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе.
Расположите выбранные элементы в порядке возрастания их электроотрицательности.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
По Периодической системе химических элементов Д.И. Менделеева определяем, что в одной группе находятся селен, кислород и сера. Электроотрицательность возрастает в группе снизу вверх. Таким образом, наименьшей электроотрицательностью характеризуется селен, промежуточное положение в данном случае занимает сера, самой большой электроотрицательностью обладает кислород.
Ответ: 142
Задание 2.6
Из указанных в ряду химических элементов
1) Cu; 2) Mg; 3) Cl; 4) Al; 5) Li
выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их валентности в высших оксидах.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
По Периодической системе химических элементов Д.И. Менделеева определяем, что в одном периоде находятся магний, хлор и алюминий. Валентность элементов в высших оксидах возрастает в периоде слева направо. Таким образом, наименьшим значением характеризуется
магний (MgO, валентность равна II), промежуточное положение в данном случае занимает алюминий (Al2O3, валентность равна III),
самым большим значением обладает хлор (Cl2O7, валентность равна VII).
Валентность элементов в высших оксидах возрастает в периоде слева направо. Таким образом, наименьшим значением характеризуется
магний (MgO, валентность равна II), промежуточное положение в данном случае занимает алюминий (Al2O3, валентность равна III),
самым большим значением обладает хлор (Cl2O7, валентность равна VII).
Ответ: 243
Задание 2.7
Из указанных в ряду химических элементов
1) Na; 2) N; 3) F; 4) Cu; 5) Be
выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке уменьшения их электроотрицательности.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Источник — Открытый банк заданий ЕГЭ
Решение
По Периодической системе химических элементов Д.И. Менделеева определяем, что в одном периоде находятся бериллий, азот и фтор. Электроотрицательность в периоде уменьшается справа налево. Таким образом, наибольшим значением характеризуется фтор, промежуточное
положение в данном случае занимает азот, самым малым значением обладает бериллий.
Электроотрицательность в периоде уменьшается справа налево. Таким образом, наибольшим значением характеризуется фтор, промежуточное
положение в данном случае занимает азот, самым малым значением обладает бериллий.
Ответ: 325
Задание 2.8
Из указанных в ряду химических элементов
1) O; 2) Se; 3) Si; 4) C; 5) N
выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке уменьшения их атомных радиусов.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Источник — Открытый банк заданий ЕГЭ
Решение
По Периодической системе химических элементов Д.И. Менделеева определяем, что в одном периоде находятся кислород, углерод и азот.
Атомные радиусы элементов в периоде уменьшаются слева направо. Таким образом, наибольшим значением характеризуется углерод, промежуточное
положение в данном случае занимает азот, самым малым значением обладает кислород.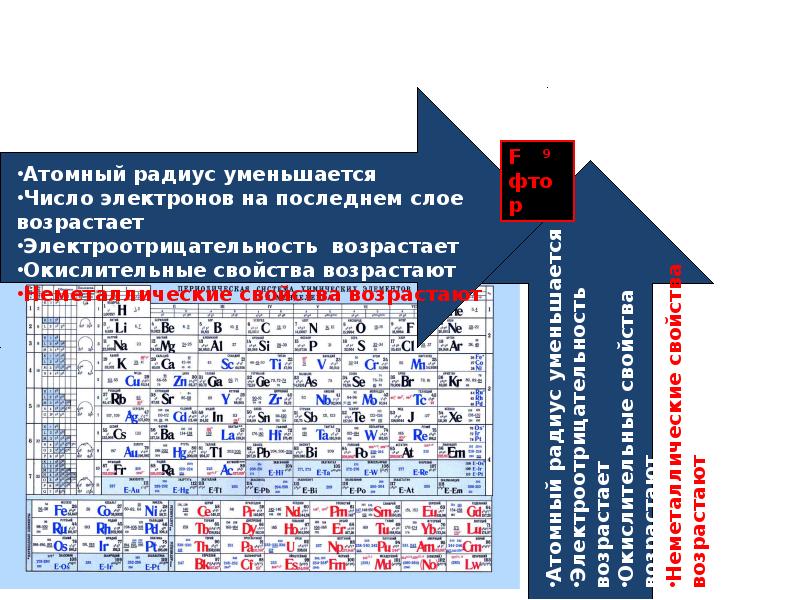
Ответ: 451
Задание 2.9
Из указанных в ряду химических элементов
1) Al; 2) N; 3) P; 4) B; 5) S
выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их атомных радиусов.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Источник — Открытый банк заданий ЕГЭ
Решение
По Периодической системе химических элементов Д.И. Менделеева определяем, что в одном периоде находятся алюминий, фосфор и сера. Атомные радиусы элементов в периоде возрастают справа налево. Таким образом, наименьшим значением характеризуется сера, промежуточное положение в данном случае занимает фосфор, самым большим значением обладает алюминий.
Ответ: 531
Задание 2.10
Из указанных в ряду химических элементов
1) P; 2) Na; 3) Cl; 4) Mn; 5) S
выберите три элемента-неметалла.
Расположите выбранные элементы в порядке ослабления кислотных свойств образуемых ими высших оксидов.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Источник — Открытый банк заданий ЕГЭ
Решение
Элементами-неметаллами являются фосфор, хлор и сера. Кислотные свойства высших оксидов в периоде ослабевают справа налево. Таким образом, наиболее сильными кислотными свойствами характеризуется высший оксид хлора, промежуточное положением в данном случае занимает высших оксид серы, самыми слабыми кислотными свойствами обладает высший оксид фосфора.
Ответ: 351
Задание 2.11
Из указанных в ряду химических элементов
1) O; 2) C; 3) Al; 4) Si; 5) P
выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их атомных радиусов.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Источник — Открытый банк заданий ЕГЭ
Решение
По Периодической системе химических элементов Д.И. Менделеева определяем, что в одном периоде находятся алюминий, кремний и фосфор. Атомные радиусы элементов в периоде возрастают справа налево. Таким образом, наименьшим значением характеризуется фосфор, промежуточное положение в данном случае занимает кремний, самым большим значением обладает алюминий.
Ответ: 543
Периодическая таблица элементов
Периодическая таблица элементовЭЛЕМЕНТЫ В ОДНОЙ КОЛОНКЕ (ГРУППЕ) ИМЕЮТ ПОДОБНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА
Название каждого элемента (коричневым цветом) сопровождается его химическим символом (красным),
, а также его атомным номером Z и его наиболее распространенным (или наиболее стабильный) массовое число А .
Z = атомный номер = количество протонов в ядре = количество электронов, вращающихся вокруг ядра;
A = массовое число = количество протонов и нейтронов в наиболее распространенном (или наиболее стабильном) ядре.
Группа I a | Группа II a | Группа III b | Группа IV b | Группа V b | Группа VI b | Группа VII b | Группа VIII | Группа I b | Группа II b | Группа III a | Группа IV a | Группа V a | Группа VI a | Группа VII a | Группа 0 | |||
| Водород H Z = 1, A = 1 | -> -> -> — > -> -> -> -> -> -> -> -> -> -> -> -> -> -> -> -> — -> -> -> — -> -> -> -> -> -> -> -> -> -> -> -> | Гелий He Z = 2, A = 4 | ||||||||||||||||
| Литий Li Z = 3, A = 6 | Берилий Be Z = 4, A = 10 | -> -> -> — -> -> -> -> -> -> -> -> -> -> -> -> -> -> -> -> -> -> -> | Бор B Z = 5, A = 11 | Углерод C Z = 6, A = 12 | Азот N Z = 7, A = 14 | Кислород O Z = 8, A = 16 | Фтор F Z = 9, A = 19 | Неон Ne 9 0006 Z = 10, A = 20 | ||||||||||
| Натрий Na Z = 11, A = 23 | Магний Mg Z = 12, A = 24 | — > -> -> -> -> -> -> -> -> -> -> -> -> -> -> -> -> — -> -> -> -> -> | Алюминий Al Z = 13, A = 27 | Кремний Si Z = 14, A = 28 | Фосфор P Z = 15, A = 31 | Сера S Z = 16, A = 32 | Хлор Cl Z = 17, A = 35.  5 5 | Аргон Ar Z = 18, A = 40 | ||||||||||
| Калий K Z = 19, A = 39 | Кальций Ca Z = 20, A = 40 | Скандий Sc Z = 21, A = 45 | Титан Ti Z = 22, A = 48 | Ванадий Va Z = 23, A = 51 | Хром Cr Z = 24, A = 52 | Марганец Mn Z = 25, A = 55 | Железо Fe Z = 26, A = 56 | Кобальт Co Z = 27, A = 59 | Никель Ni Z = 28, A = 59 | Медь Cu Z = 29, A = 63.5 | Цинк Zn Z = 30, A = 65 | Галлий Ga Z = 31, A = 70 | Германий Ge Z = 32, A = 73 | Мышьяк As Z = 33, A = 75 | Селен Se Z = 34, A = 79 | Бром Br Z = 35, A = 80 | Криптон Kr Z = 36, A = 84 | |
| Рубидий Rb Z = 37, A = 85.  5 5
| Стронций Sr Z = 38, A = 88 | Иттрий Y Z = 39, A = 89 | Цирконий Zr Z = 40, A = 91 | Ниобий Nb Z = 41, A = 93 | Молибден Mo Z = 42, A = 96 | Технеций Tc Z = 43, A = 97 | Рутений Ru Z = 44, A = 101 | Родий Rh Z = 45, A = 103 | Палладий Pd Z = 46, A = 106 | Серебро Ag Z = 47, A = 108 | Кадмий Cd Z = 48, A = 112 | Индий In Z = 49, A = 115 | Олово Sn Z = 50, A = 119 | Сурьма Sb Z = 51, A = 122 | Теллур Te Z = 52, A = 128 | Йод I Z = 53, A = 127 | Ксенон Xe Z = 54, A = 131 | |
| Цезий Cs Z = 55, A = 133 | Барий Ba Z = 56, A = 137 | Лантан La Z = 57, A = 139 | Лантанид Серия Z = 57-71 | Гафний Hf Z = 72, A = 178.  5 5
| Тантал Ta Z = 73, A = 181 | Вольфрам W Z = 74, A = 184 | Рений Re Z = 75, A = 186 | Осмий Os Z = 76, A = 190 | Иридий Ir Z = 77, A = 192 | Платина Pt Z = 78, A = 195 | Золото Au Z = 79, A = 197 | Меркурий Hg Z = 80, A = 201 | Таллий Tl Z = 81, A = 204 | Свинец Pb Z = 82, A = 207 | Висмут Bi Z = 83, A = 209 | Полоний Po Z = 84, A = 209 | Астатин При Z = 85, A = 210 | Радон Rn Z = 86, A = 222 |
| Франций Fr Z = 87, A = 223 | Радий Ra Z = 88, A = 226 | Актиний Ac Z = 89, A = 227 | Актинид Серия Z = 89-103 | Резерфорд Rf Z = 104, A = 261 | Дубний Дб Z = 105, A = 262 | Сиборгий Sg Z = 106, A = 263 | Бор Bh Z = 107, A = 262 | Калий Hs Z = 108, A = 265 | Мейтнерий Mt Z = 109, A = 266 | Дармштадций Ds Z = 110 | Рентген Rg Z = 111 | Copernicium Cn Z = 112 | Нихоний Nh Z = 113 | Флеровий Fl Z = 114 | Московий Mc Z = 115 | Ливерморий Ур. 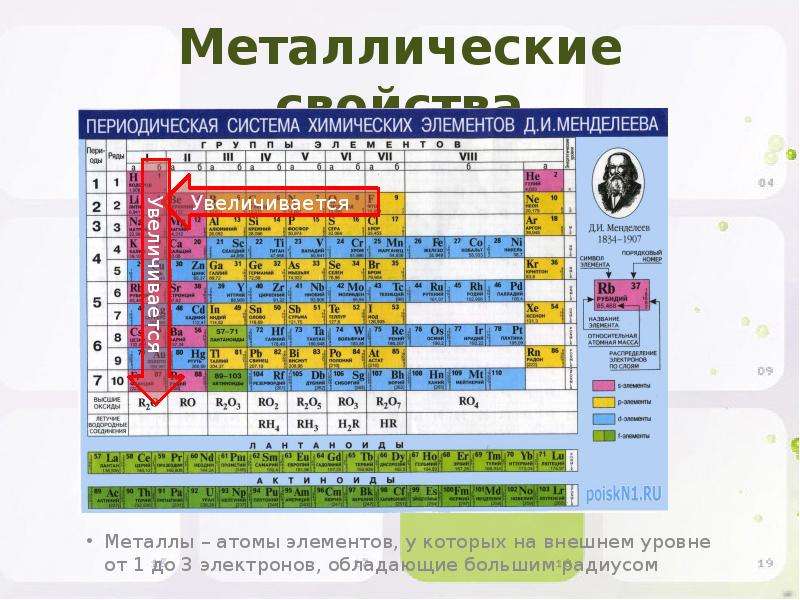 Z = 116 | Теннессин Ts Z = 117 | Оганессон Ог Z = 118 |
Группа I a | Группа II a | Группа III b | Группа IV b | Группа V b | Группа VI b | Группа VII b | Группа VIII | Группа I b | Группа II b | Группа III a | Группа IV a | Группа V a | Группа VI a | Группа VII a | Группа 0 | |||
| Серия лантанидов (редкоземельные элементы) | |||||||||||||||
| Лантан La Z = 57, A = 139 | Церий Ce Z = 58, A = 140 | Празеодим Pr Z = 59, A = 141 | Неодим Nd Z = 60, A = 144 | Прометий Pm Z = 61, A = 145 | Самарий Sm Z = 62, A = 150 | Европий Eu Z = 63, A = 152 | Гадолиний Gd Z = 64, A = 157 | Тербий Tb Z = 65, A = 159 | Диспрозий Dy Z = 66, A = 162.  5 5
| Гольмий Ho Z = 67, A = 165 | Эрбий Er Z = 68, A = 167 | Тулий Tm Z = 69, A = 169 | Иттербий Yb Z = 70, A = 173 | Лютеций Lu Z = 71, A = 175 | Вернуться в Periodic Table |
| Серия актинидов (радиоактивные редкоземельные элементы) | |||||||||||||||
| Актиний Ac Z = 89, A = 227 | Торий Th Z = 90, A = 232 | Протактиний Па Z = 91, A = 231 | Уран U Z = 92, A = 238 | Нептуний Np Z = 93, A = 237 | Плутоний Pu Z = 94, A = 244 | Америций Am Z = 95, A = 243 | Кюрий Cm Z = 96, A = 247 | Berkelium Bk Z = 97, A = 247 | Калифорний Cf Z = 98, A = 251 | Эйнштейний Es Z = 99, A = 254 | Фермий Fm Z = 100, A = 257 | Менделевий Md Z = 101, A = 256 | Нобелий № Z = 102, A = 254 | Лоуренсий Lr Z = 103, A = 256 | Вернуться в Периодический Таблица |
[Подкаталог урана] [Подкаталог плутония]
[ПОЛНЫЙ СПРАВОЧНИК]
по почте на
ccnr @ web. нетто
нетто
С 27 марта 1996 г. было более
100000 внешних посещений веб-сайта ЦКСР, плюс
(сброс счетчика 3 июня 1998 года в полночь)
Периодические свойства элементов
Элементы в периодической таблице расположены в порядке возрастания атомного номера. Все эти элементы демонстрируют несколько других тенденций, и мы можем использовать периодический закон и формирование таблицы, чтобы предсказать их химические, физические и атомные свойства.Понимание этих тенденций достигается путем анализа электронной конфигурации элементов; все элементы предпочитают формирование октетов и будут получать или терять электроны, чтобы сформировать эту стабильную конфигурацию.
Атомный радиус
Мы никогда не сможем определить атомный радиус атома, потому что никогда не бывает нулевой вероятности нахождения электрона и, следовательно, никогда не бывает четкой границы с атомом. Все, что мы можем измерить, — это расстояние между двумя ядрами (межъядерное расстояние). Ковалентный радиус — это половина расстояния между ядрами двух одинаковых атомов.Ионный радиус составляет половину расстояния между ядрами двух ионов в ионной связи. Расстояние должно быть распределено для меньшего катиона и большего аниона. Металлический радиус составляет половину расстояния между ядрами двух соседних атомов в кристаллической структуре. Благородные газы не учитываются в тенденциях изменения атомных радиусов, потому что экспериментальные значения их атомных радиусов вызывают большие споры. Единицами СИ для измерения атомных радиусов являются нанометр (нм) и пикометр (пм).{-12} \, m \).
Ковалентный радиус — это половина расстояния между ядрами двух одинаковых атомов.Ионный радиус составляет половину расстояния между ядрами двух ионов в ионной связи. Расстояние должно быть распределено для меньшего катиона и большего аниона. Металлический радиус составляет половину расстояния между ядрами двух соседних атомов в кристаллической структуре. Благородные газы не учитываются в тенденциях изменения атомных радиусов, потому что экспериментальные значения их атомных радиусов вызывают большие споры. Единицами СИ для измерения атомных радиусов являются нанометр (нм) и пикометр (пм).{-12} \, m \).
Чтобы объяснить эту тенденцию, необходимо понять концепцию скрининга и проникновения. Проникновение обычно известно как расстояние, на котором электрон находится от ядра. Экранирование определяется как концепция внутренних электронов, блокирующих внешние электроны от заряда ядра. В рамках этой концепции мы предполагаем, что между внешними электронами нет экранирования и что внутренние электроны экранируют внешние электроны от общего положительного заряда ядра.Чтобы понять степень экранирования и проникновения в атом, ученые придумали эффективный ядерный заряд , \ (Z_ {eff} \). Уравнение для расчета эффективного заряда ядра показано ниже.
В рамках этой концепции мы предполагаем, что между внешними электронами нет экранирования и что внутренние электроны экранируют внешние электроны от общего положительного заряда ядра.Чтобы понять степень экранирования и проникновения в атом, ученые придумали эффективный ядерный заряд , \ (Z_ {eff} \). Уравнение для расчета эффективного заряда ядра показано ниже.
\ [Z_ {eff} = Z — S \]
В уравнении S представляет количество внутренних электронов, экранирующих внешние электроны. Студенты могут легко найти S, используя атомный номер благородного газа, который находится на одну точку над элементом. Например, S, которое мы использовали бы для хлора, будет 10 (атомный номер неона).Z — общее количество электронов в атоме. Поскольку мы знаем, что нейтральный атом имеет одинаковое количество протонов и электронов, мы можем использовать атомный номер для определения Z. Например, для хлора значение Z будет равно 17 (атомный номер хлора). Продолжая использовать хлор в качестве примера, 10 внутренних электронов (S) будут экранировать положительный заряд десяти протонов. Следовательно, был бы и эффективный ядерный заряд 17-10 или +7. Эффективный заряд ядра показывает, что ядро притягивает внешние электроны с зарядом +7, и поэтому внешние электроны притягиваются ближе к ядру, и атомные радиусы меньше.Таким образом, чем больше заряд ядра, тем большее притяжение ядра оказывает на внешние электроны и тем меньше атомные радиусы. Напротив, чем меньше заряд ядра, тем меньшее притяжение ядра оказывает на внешние электроны и тем больше атомные радиусы. Кроме того, с увеличением атомного номера увеличивается и эффективный заряд ядра. На рисунке 3 показано влияние эффективного заряда ядра на атомные радиусы.
Следовательно, был бы и эффективный ядерный заряд 17-10 или +7. Эффективный заряд ядра показывает, что ядро притягивает внешние электроны с зарядом +7, и поэтому внешние электроны притягиваются ближе к ядру, и атомные радиусы меньше.Таким образом, чем больше заряд ядра, тем большее притяжение ядра оказывает на внешние электроны и тем меньше атомные радиусы. Напротив, чем меньше заряд ядра, тем меньшее притяжение ядра оказывает на внешние электроны и тем больше атомные радиусы. Кроме того, с увеличением атомного номера увеличивается и эффективный заряд ядра. На рисунке 3 показано влияние эффективного заряда ядра на атомные радиусы.
Теперь мы готовы описать тенденцию атомного радиуса в периодической таблице.Слева направо через период увеличивается атомный номер, а затем и эффективный заряд ядра. Поэтому, двигаясь слева направо по периоду, ядро сильнее притягивает внешние электроны, и атомные радиусы уменьшаются. При движении вниз по группе в периодической таблице количество заполненных электронных оболочек увеличивается. В группе валентные электроны сохраняют одинаковый эффективный заряд ядра, но теперь орбитали удалены от ядра. Следовательно, ядро меньше притягивает внешние электроны, а атомные радиусы больше.
При движении вниз по группе в периодической таблице количество заполненных электронных оболочек увеличивается. В группе валентные электроны сохраняют одинаковый эффективный заряд ядра, но теперь орбитали удалены от ядра. Следовательно, ядро меньше притягивает внешние электроны, а атомные радиусы больше.
. Теперь мы можем использовать эту концепцию для объяснения различий в атомных радиусах катионов и анионов. Катион — это атом, потерявший один из своих внешних электронов. Катионы имеют меньший радиус, чем атом, из которого они образовались. При потере электрона положительный ядерный заряд обесценивает отрицательный заряд, создаваемый электронами. Следовательно, положительное ядро притягивает электроны сильнее, а радиус меньше.Анион — это атом, который приобрел внешний электрон. Анионы имеют больший радиус, чем атом, из которого они образовались. Усиление электрона не изменяет заряд ядра, но добавление электрона вызывает уменьшение эффективного заряда ядра. Следовательно, электроны удерживаются более свободно, а радиус атома увеличивается.
Следовательно, электроны удерживаются более свободно, а радиус атома увеличивается.
Энергия ионизации (потенциал ионизации)
Чтобы вытолкнуть электрон из атома, требуется достаточно энергии, чтобы преодолеть магнитное притяжение положительного заряда ядра.{-}} \]
Энергия ионизации увеличивается относительно высокого эффективного заряда. Наивысшую энергию ионизации имеют благородные газы, потому что все они имеют высокий эффективный заряд из-за образования октетов и требуют большого количества энергии для разрушения этой стабильной конфигурации. Наибольшее количество энергии требуется для элементов в правом верхнем углу. Кроме того, элементы в левом углу имеют низкую энергию ионизации, потому что потеря электрона позволяет им иметь конфигурацию благородного газа.Следовательно, требуется меньше энергии для удаления одного из их валентных электронов
| Элемент | 1-й | 2-я | 3-й | 4-я | 5-я | 6-я | 7-я |
|---|---|---|---|---|---|---|---|
| Na | 496 | 4562 | |||||
| мг | 738 | 1451 | 7733 | ||||
| Al | 577 | 1817 | 2745 | 11580 | |||
| Si | 786 | 1577 | 3232 | 4356 | 16090 | ||
| П | 1060 | 1903 | 2912 | 4957 | 6274 | 21270 | |
| S | 999. 6 6 |
2251 | 3361 | 4564 | 7013 | 8496 | 27110 |
| Класс | 1256 | 2297 | 3822 | 5158 | 6542 | 9362 | 11020 |
| Ar | 1520 | 2666 | 3931 | 5771 | 7238 | 8781 | 12000 |
Это энергии ионизации для трех элементов периода. Обратите внимание, как Na после во втором I.E., Mg в третьем I.E., Al в четвертом I.E. и т. Д. — все имеют огромное увеличение энергии по сравнению с исходным. Это происходит из-за того, что текущая конфигурация находилась в стабильном формировании октетов; поэтому для ионизации требуется гораздо большее количество энергии.
Обратите внимание, как Na после во втором I.E., Mg в третьем I.E., Al в четвертом I.E. и т. Д. — все имеют огромное увеличение энергии по сравнению с исходным. Это происходит из-за того, что текущая конфигурация находилась в стабильном формировании октетов; поэтому для ионизации требуется гораздо большее количество энергии.
Энергия ионизации увеличивается слева направо в течение периода и увеличивается при движении вверх по группе. По мере того, как вы поднимаетесь на группу, энергия ионизации увеличивается, потому что меньше электронов защищает внешние электроны от притяжения ядра.Следовательно, требуется больше энергии, чтобы вывести ядро из строя и удалить электрон. Когда мы перемещаемся по периодической таблице слева направо, энергия ионизации увеличивается из-за увеличения эффективного заряда ядра. Это связано с тем, что чем больше эффективный заряд ядра, тем сильнее ядро удерживает электрон и тем больше энергии требуется для его высвобождения.
Рисунок \ (\ PageIndex {6} \): Предоставлено Джессикой Торнтон (UCD) Энергия ионизации — это лишь общее правило. Бывают случаи, когда эта тенденция не подтверждается. Обычно это можно объяснить их электронной конфигурацией. Например, магний имеет более высокую энергию ионизации, чем алюминий. Магний имеет электронную конфигурацию [Ne] 3s2. Магний обладает высокой энергией ионизации, потому что у него заполненная 3-секундная орбиталь, и ему требуется большее количество энергии, чтобы забрать электрон с заполненной орбитали.
Бывают случаи, когда эта тенденция не подтверждается. Обычно это можно объяснить их электронной конфигурацией. Например, магний имеет более высокую энергию ионизации, чем алюминий. Магний имеет электронную конфигурацию [Ne] 3s2. Магний обладает высокой энергией ионизации, потому что у него заполненная 3-секундная орбиталь, и ему требуется большее количество энергии, чтобы забрать электрон с заполненной орбитали.
Сродство к электрону
Сродство к электрону (E.A.) — это изменение энергии, которое происходит, когда электрон присоединяется к газообразному атому.{-}} \]
Труднее найти тенденции, описывающие сродство к электрону. Как правило, элементы в правой части таблицы Менделеева имеют большое отрицательное сродство к электрону. Сродство к электрону станет менее отрицательным по мере того, как вы переходите от вершины к основанию периодической таблицы. Однако азот, кислород и фтор не следуют этой тенденции. Электронная конфигурация благородных газов будет близка к нулю, потому что они не будут легко получать электроны.
Электроотрицательность
Электроотрицательность — это измерение атома, который борется за электроны в связи.Чем выше электроотрицательность, тем выше его способность приобретать электроны в связи. Электроотрицательность будет важна, когда мы позже определим полярные и неполярные молекулы. Электроотрицательность связана с энергией ионизации и сродством к электрону. Электроны с низкими энергиями ионизации имеют низкую электроотрицательность, поскольку их ядра не оказывают сильного притяжения на электроны. Элементы с высокой энергией ионизации обладают высокой электроотрицательностью из-за сильного притяжения, оказываемого положительным ядром на отрицательные электроны.Следовательно, электроотрицательность увеличивается снизу вверх и слева направо.
Рисунок \ (\ PageIndex {8} \): любезно предоставлено Джессией Торнтон (UCD)Металлический персонаж
Металлический знак используется для определения химических свойств металлических элементов. Обычно металлы теряют электроны с образованием катионов. Неметаллы стремятся получить электроны с образованием анионов. Они также обладают высоким окислительным потенциалом, поэтому легко окисляются и являются сильными восстановителями.Металлы также образуют основные оксиды; чем более щелочной является оксид, тем выше металлический характер.
Обычно металлы теряют электроны с образованием катионов. Неметаллы стремятся получить электроны с образованием анионов. Они также обладают высоким окислительным потенциалом, поэтому легко окисляются и являются сильными восстановителями.Металлы также образуют основные оксиды; чем более щелочной является оксид, тем выше металлический характер.
По мере того, как вы перемещаетесь по таблице слева направо, металлический характер уменьшается, потому что элементы легко принимают электроны, чтобы заполнить свои оболочки. Следовательно, эти элементы принимают неметаллический характер образования анионов. По мере продвижения вверх по таблице металлический характер уменьшается из-за того, что ядро сильнее притягивает внешние электроны.Это большее притяжение затрудняет потерю электронов атомами и образование катионов.
Другие тенденции
Точки плавления: Тенденции изменения точек плавления и молекулярной массы бинарных углерод-галогеновых соединений и галогенидов водорода обусловлены межмолекулярными силами. Плавление разрушает расположение атомов в твердом теле, поэтому количество тепла, необходимое для плавления, зависит от силы притяжения между атомами. Эта сила притяжения увеличивается с увеличением количества электронов.Увеличение количества электронов увеличивает связь.
Плавление разрушает расположение атомов в твердом теле, поэтому количество тепла, необходимое для плавления, зависит от силы притяжения между атомами. Эта сила притяжения увеличивается с увеличением количества электронов.Увеличение количества электронов увеличивает связь.
Пример: Точка плавления HF должна составлять приблизительно -145 ° C от точек плавления HCl, HBr и HI, но наблюдаемое значение составляет -83,6 ° C.
Показатели теплопроводности и электропроводности регулярно меняются в течение периода. Точки плавления могут постепенно увеличиваться или достигать пика внутри группы, а затем в обратном направлении.
Пример: элементы третьего периода Na, Mg и Al являются хорошими проводниками тепла и электричества, тогда как Si — только хороший проводник, а неметаллы P, S, Cl и Ar — плохие проводники.- \]
Используется для изучения периодических свойств элементов
- Прогнозирование большего или меньшего размера и радиального распределения атомов в нейтральных атомах и ионах
- Измерение и сравнение энергий ионизации
- Сравнение сродства к электрону и электроотрицательности
- Прогнозирование окислительно-восстановительного потенциала
- Сравнение металлического характера с другими элементами; его способность образовывать катионы
- Предсказание того, какая реакция может произойти или не произойти из-за тенденций
- Определение большего потенциала клеток (суммы окислительного и восстановительного потенциалов) между реакциями
- Завершение химических реакций в соответствии с тенденциями
Сводка периодических тенденций
В Периодической таблице элементов схожие элементы классифицируются вместе. Дмитрий Менделеев, русский ученый, был первым, кто создал общепринятое расположение элементов в 1869 году. Менделеев считал, что, когда элементы расположены в порядке увеличения атомной массы, определенные наборы свойств периодически повторяются. Хотя большинство современных периодических таблиц организовано в восемнадцать групп (столбцов) элементов, в первоначальной периодической таблице Менделеева элементы были организованы в восемь групп и двенадцать периодов (строк).
Дмитрий Менделеев, русский ученый, был первым, кто создал общепринятое расположение элементов в 1869 году. Менделеев считал, что, когда элементы расположены в порядке увеличения атомной массы, определенные наборы свойств периодически повторяются. Хотя большинство современных периодических таблиц организовано в восемнадцать групп (столбцов) элементов, в первоначальной периодической таблице Менделеева элементы были организованы в восемь групп и двенадцать периодов (строк).
В периодической таблице элементы с похожими свойствами находятся в одних и тех же группах (по вертикали).Слева направо атомный номер (z) элементов увеличивается от одного периода к следующему (по горизонтали). Группы пронумерованы вверху каждого столбца, а точки слева рядом с каждой строкой. Основными элементами группы являются группы 1, 2 и 13–18. Эти группы содержат элементы, наиболее богатые естественным образом, и являются наиболее важными для жизни. Элементы, заштрихованные в приведенной выше таблице светло-розовым цветом, известны как переходные металлы. Два ряда элементов, начинающихся с z = 58, иногда называют внутренними переходными металлами, и они были извлечены и помещены в нижнюю часть таблицы, потому что они сделали бы таблицу слишком широкой, если бы она оставалась непрерывной.14 элементов, следующих за лантаном (z = 57), называются лантаноидами, а следующие 14 элементов, следующие за актинием (z = 89), называются актинидами.
Элементы, заштрихованные в приведенной выше таблице светло-розовым цветом, известны как переходные металлы. Два ряда элементов, начинающихся с z = 58, иногда называют внутренними переходными металлами, и они были извлечены и помещены в нижнюю часть таблицы, потому что они сделали бы таблицу слишком широкой, если бы она оставалась непрерывной.14 элементов, следующих за лантаном (z = 57), называются лантаноидами, а следующие 14 элементов, следующие за актинием (z = 89), называются актинидами.
Элементы периодической таблицы можно разделить на две большие категории: металлы и неметаллы. Большинство металлов являются хорошими проводниками тепла и электричества, пластичны и пластичны, а их температура плавления составляет от умеренной до высокой. В общем, неметаллы не проводят тепла и электричества, представляют собой нелегкие твердые вещества, а многие из них являются газами при комнатной температуре. Как показано в таблице выше, металлы и неметаллы в периодической таблице часто разделены ступенчатой диагональной линией, а несколько элементов рядом с этой линией часто называют металлоидами (Si, Ge, As, Sb, Te и At). Металлоиды — это элементы, которые выглядят как металлы и в некотором смысле ведут себя как металлы, но также обладают некоторыми неметаллическими свойствами. Группа в самом дальнем правом углу таблицы, заштрихованная оранжевым цветом, известна как благородные газы. Благородные газы относятся к особой группе неметаллов.
Металлоиды — это элементы, которые выглядят как металлы и в некотором смысле ведут себя как металлы, но также обладают некоторыми неметаллическими свойствами. Группа в самом дальнем правом углу таблицы, заштрихованная оранжевым цветом, известна как благородные газы. Благородные газы относятся к особой группе неметаллов.
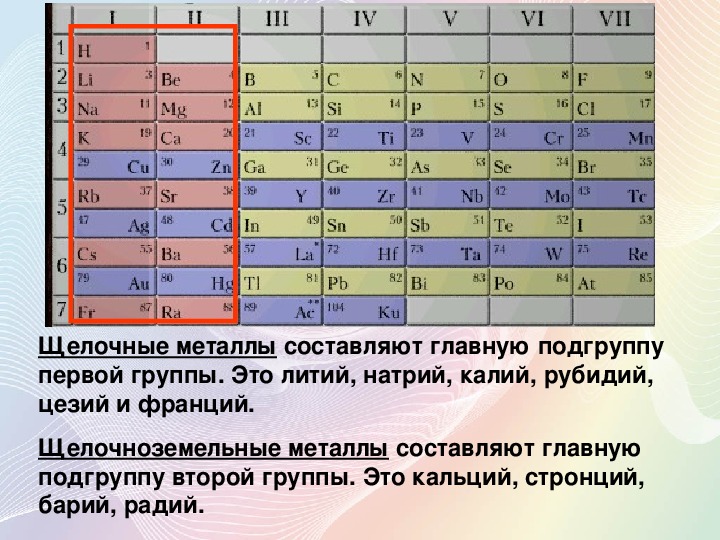
Щелочные металлы / Щелочноземельные металлы
Щелочные металлы входят в группу 1 периодической таблицы и состоят из лития, натрия, рубидия, цезия и франция. Эти металлы обладают высокой реакционной способностью и образуют ионные соединения (когда неметалл и металл объединяются), а также многие другие соединения.Все щелочные металлы имеют заряд +1 и самые большие размеры атомов, чем любые другие элементы, в каждый из своих периодов.
Щелочноземельные металлы находятся в группе 2 и состоят из бериллия, магния, кальция, стронция, бария и радия. В отличие от щелочных металлов, земные металлы имеют меньший размер атома и не обладают такой реакционной способностью. Эти металлы также могут образовывать ионные и другие соединения и иметь заряд +2.
Эти металлы также могут образовывать ионные и другие соединения и иметь заряд +2.
Переходные металлы
Переходные металлы варьируются от групп IIIB до XIIB в периодической таблице.Эти металлы образуют положительно заряженные ионы, очень твердые и имеют очень высокие температуры плавления и кипения. Переходные металлы также являются хорошими проводниками электричества и пластичны.
Лантаноиды и актиниды
Лантаноиды (показаны в строке ** на диаграмме выше) и актиниды (показаны в строке * на диаграмме выше) образуют блок из двух строк, которые помещены внизу периодической таблицы для проблем с пространством. Они также считаются переходными металлами. Лантаноиды составляют верхний ряд этого блока и представляют собой очень мягкие металлы с высокими температурами кипения и плавления.Актиниды образуют нижний ряд и являются радиоактивными. Они также образуют соединения с большинством неметаллов. Чтобы узнать, почему у этих элементов есть отдельный раздел, посетите страницу электронных конфигураций.
Металлоиды
Как упоминалось во введении, металлоиды расположены вдоль лестницы, отделяющей металлы от неметаллов в периодической таблице. Бор, кремний, германий, мышьяк, сурьма и теллур обладают металлическими и неметаллическими свойствами. Например, кремний имеет металлический блеск, но является хрупким и неэффективным проводником электричества, как неметалл.Поскольку металлоиды обладают сочетанием металлических и неметаллических характеристик, они являются промежуточными проводниками электричества или «полупроводниками».
Галогены
Галогены состоят из пяти неметаллических элементов: фтора, хлора, брома, йода и астата. Они расположены в 17-й группе периодической таблицы и имеют заряд -1. Термин «галоген» означает «солеобразователь», а соединения, содержащие один из галогенов, являются солями. Физические свойства галогенов значительно различаются, поскольку они могут существовать в виде твердых тел, жидкостей и газов при комнатной температуре. Однако в целом галогены очень реакционноспособны, особенно со щелочными и земельными металлами 1-й и 2-й групп, с которыми они образуют ионные соединения.
Однако в целом галогены очень реакционноспособны, особенно со щелочными и земельными металлами 1-й и 2-й групп, с которыми они образуют ионные соединения.
Благородные газы
Благородные газы состоят из группы 18 (иногда называемой группой O) периодической таблицы элементов. Благородные газы имеют очень низкие температуры кипения и плавления и являются газами при комнатной температуре. Они также очень неактивны, поскольку у них уже есть полная валентная оболочка с 8 электронами. Следовательно, благородные газы имеют небольшую тенденцию терять или приобретать электроны.
Полезные связи из периодической таблицы
Периодическая таблица элементов полезна для определения зарядов простых одноатомных ионов. Элементы основной группы, отнесенные к группам 1, 2 и 13-18, образуют ионы, они теряют то же количество электронов, что и соответствующий номер группы, в которую они попадают. Например, атомы K (группа 1) теряют один электрон, чтобы стать K + , а атомы Mg (группа 2) теряют два электрона, чтобы сформировать Mg 2 + . Другие элементы основной группы, входящие в группу 13 и выше, образуют более одного возможного иона.
Другие элементы основной группы, входящие в группу 13 и выше, образуют более одного возможного иона.
Элементы в группах 3–12 называются переходными элементами или переходными металлами. Подобно элементам основной группы, описанным выше, переходные металлы образуют положительные ионы, но из-за их способности образовывать более двух или более ионов разного заряда связь между номером группы и зарядом отсутствует.
Упражнение \ (\ PageIndex {1} \)
Расположите эти элементы по убыванию атомного размера: Na, C, Sr, Cu, Fr
- Ответ
-
Fr, Sr, Cu, Na, C
Упражнение \ (\ PageIndex {1} \)
Расположите эти элементы по возрастанию отрицательного E.А .: Ba, F, Si, Ca, O
- Ответ
-
Ba, Ca, Si, O, F
Упражнение \ (\ PageIndex {1} \)
Расположите эти элементы в соответствии с возрастающим металлическим характером: Li, S, Ag, Cs, Ge
- Ответ
-
Li, S, Ge, Ag, Cs
Упражнение \ (\ PageIndex {1} \)
Какая реакция, по вашему мнению, будет иметь больший клеточный потенциал?
- \ (\ ce {2Na (s) + Cl2 (g) → 2NaCl (s) или 2Cs (s) + Cl2 (g) → 2RbCl (s) \)
- \ (\ ce {2Na (s) + Cl2 (g) → 2NaCl (s) или Be (s) + Cl2 (g) → BeCl2 (s)} \)
- Ответ
-
Второе уравнение
Первое уравнение
Упражнение \ (\ PageIndex {1} \)
Какое уравнение вы ожидаете увидеть?
- \ (\ ce {I2 (s) + 2Br (водн.
 ) → Br2 (l) + 2I (водн.)} \)
) → Br2 (l) + 2I (водн.)} \) - \ (\ ce {Cl2 (g) + 2I (водн.) → I2 (s) + 2Cl (водн.)} \)
- Ответ
-
5.А) Да
Б) №
Проблемы
* Выделите ответ: _____, чтобы просмотреть ответы.
1. Элемент, который является примером металлоида, представляет собой (а) S; (б) Zn; (c) Ge; d) Re; (e) ни один из этих
Ответ: (c) Ge
2. В периодической таблице вертикальные (верхние и нижние) столбцы называются (а) периодами; (б) переходы; (c) семьи / группы; (г) металлоиды; (e) ничего из этого.
Ответ: (в) семьи / группы
3.Почему благородные газы инертны (инертны)?
Ответ: Благородные газы инертны, потому что они уже имеют полную валентную электронную оболочку и имеют небольшую тенденцию к получению или потере электронов.
4. Как называются соединения, содержащие галоген?
Ответ: Соли
5. Лантаноиды и актиниды: (а) щелочноземельные металлы; (б) переходные металлы; (в) металлоиды; (г) щелочные металлы; (e) ни один из этих
Ответ: (б) переходные металлы
Список литературы
- Хлопок, F.
 А .; Уилкинсон, Г. (1988). Продвинутая неорганическая химия (5-е издание). Нью-Йорк: Вили. ISBN 0-471-84997 стр. 1385.
А .; Уилкинсон, Г. (1988). Продвинутая неорганическая химия (5-е издание). Нью-Йорк: Вили. ISBN 0-471-84997 стр. 1385. - Хатчинсон, Джон. «Журнал химического образования». Исследования развития концепции в химии (2007). Распечатать. Внешние ссылки
- Веселый, Уильям Л. (1991). Современная неорганическая химия (2-е изд.). Нью-Йорк: Макгроу-Хилл. ISBN 0-07-112651-1.
- Петруччи, Ральф Х. Общая химия. 9 изд. Нью-Джерси: Пирсон Прентис Холл, 2005.
Почему некоторые элементы Периодической таблицы представлены буквами, которые не имеют четкой связи с их названиями?
Ответ
Некоторые элементы были известны в древности и поэтому имеют латинские названия.
Периодическая таблица. 2019. Фото Н. Ханачека. Национальный институт стандартов и технологий (NIST).
В периодической таблице одиннадцать элементов представлены буквами, не совпадающими с их названиями:
- Натрий (Na — Natrium)
- Калий (K — Kalium)
- Железо (Fe — Ferrum)
- Медь (Cu — Cuprum)
- Серебро (Ag — Argentum)
- Олово (Sn — Stannum)
- Сурьма (Sb — Stibium)
- Вольфрам (W — Wolfram)
- Золото (Au — Aurum)
- Ртуть (Hg — Hydragery) )
- Свинец (Pb — Plumbum)
Почти все эти элементы были известны в древние времена и поэтому имеют латинские названия. Некоторые из названий также привели к другим словам, которые распространены в английском языке. Например, от слова «plumbum», что по-латыни означает «свинец» (Pb), мы получили слова «сантехник» и «водопроводчик», потому что свинец веками использовался в водопроводных трубах.
Некоторые из названий также привели к другим словам, которые распространены в английском языке. Например, от слова «plumbum», что по-латыни означает «свинец» (Pb), мы получили слова «сантехник» и «водопроводчик», потому что свинец веками использовался в водопроводных трубах.
Другие имена имеют разное происхождение. Например, гидраргирум, латинское название ртути (Hg), произошло от оригинального греческого слова гидраргирос, что означало «водное серебро». Элементарная ртуть, также исторически известная как «ртуть», представляет собой блестящий серебряный металл, находящийся в жидком состоянии при комнатной температуре.
Таблица типов элементов и объяснение пластин с указанием различных химических элементов и их атомного веса. Между 1808-1827 гг. В г. появилась новая система химической философии г. Джона Далтона. Отдел эстампов и фотографий, Библиотека Конгресса. Вольфрам получил символ W от немецкого названия Wolfram. Вольфрам происходит из вольфрамита, который был одной из руд, в которой чаще всего находили вольфрам.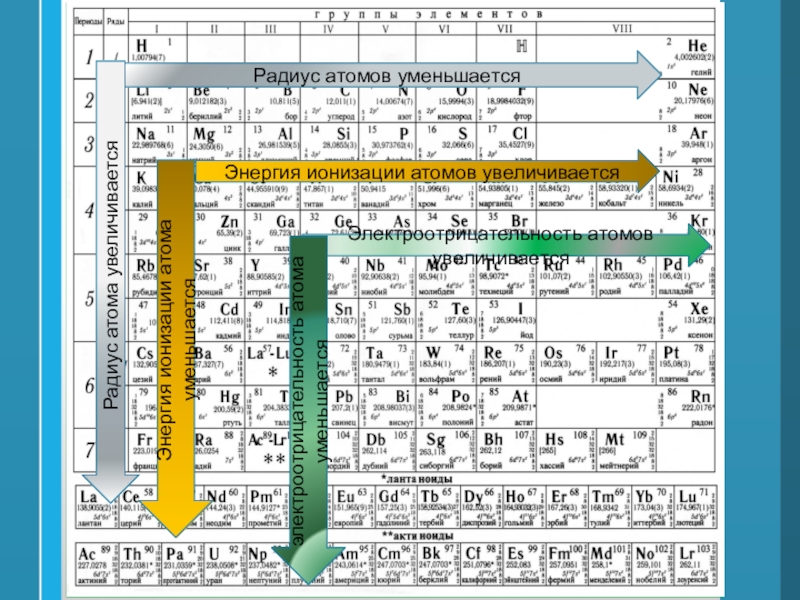 Само название Tungsten на самом деле шведское и переводится на английский как «тяжелый камень».»
Само название Tungsten на самом деле шведское и переводится на английский как «тяжелый камень».»
Слово« калий »происходит от английского« pot ash », которое использовалось для выделения солей калия. Мы получили K от названия калиум, данного немецким химиком Мартином Генрихом Клапротом, которое произошло от щелочи, происходящей от арабского al-qalyah, или «растительный пепел».
Этимология названий элементов может увести вас в фантастическое приключение, и вы можете быть удивлены тем, где вы оказались. В разделе для дальнейшего чтения можно найти книги по истории химических элементов.
Периодическая таблица элементов.PubChem, Национальная медицинская библиотека США (NLM), Национальный центр биотехнологической информации, Национальные институты здравоохранения.Опубликовано: 05.05.2020. Автор: Справочная секция по науке, Библиотека Конгресса
PhysicalGeology.lectures 3-4
Я могу представить себе, что в классе есть ученики, которые не изучали химию в старшей школе или не перевели ее из другого колледжа.
 Потребуются некоторые фундаментальные знания химии, а лекции и текст должны предоставить вам достаточный фон.Не паникуйте, если это новый материал. Читайте тексты, прочтите это резюме и задавайте вопросы! Обычно эти аннотации не содержат такого большого количества текста, как это. Это связано с тем, что прошлый опыт подсказывает, что в этом разделе необходим дополнительный материал, чтобы подвести всех примерно к одинаковому уровню понимания. Одна из целей — познакомить вас с некоторыми важными материалами Земли; Показанные выше кристаллы аметиста высоко ценились за их эстетическое качество. [Иллюстрация — http: // www.нет mil / planet_earth / photos.html]
Потребуются некоторые фундаментальные знания химии, а лекции и текст должны предоставить вам достаточный фон.Не паникуйте, если это новый материал. Читайте тексты, прочтите это резюме и задавайте вопросы! Обычно эти аннотации не содержат такого большого количества текста, как это. Это связано с тем, что прошлый опыт подсказывает, что в этом разделе необходим дополнительный материал, чтобы подвести всех примерно к одинаковому уровню понимания. Одна из целей — познакомить вас с некоторыми важными материалами Земли; Показанные выше кристаллы аметиста высоко ценились за их эстетическое качество. [Иллюстрация — http: // www.нет mil / planet_earth / photos.html] Состояния вещества
Все, что имеет массу и занимает пространство, является материей. Следующая классификация поможет определить состояния, в которых может находиться материя.
- Твердое вещество — твердое вещество, которое сохраняет свою форму, если оно не искажается силой.
- Кристаллическое твердое тело — как указано выше, а структура (распределение компонентов) очень регулярная и повторяющаяся — дальний порядок
- Некристаллическое твердое тело — как указано выше, но структура демонстрирует ближний порядок — стекло — некристаллическое или аморфное твердое тело
- Жидкость — легко течет и принимает форму своего сосуда — ближний порядок
- Газ — легко течет и расширяется, заполняя свой контейнер — неупорядоченный структура
Прочтите этот материал, пока не дойдете до раздела, посвященного скалам.
Минерал:
- — кристаллическое твердое вещество
- — встречается в природе
- — неорганическое — не образуется как часть жизненного процесса
- имеет фиксированный химический состав или состав, который варьируется в известной степени
Вся материя состоит из химических элементов, каждый из которых состоит из частиц, называемых атомами. Довольно грубая, но полезная картина атома — это жесткая сфера. Радиусы этих атомов составляют несколько Ангстрем (где Ангстрем составляет 10-10 см.Есть 92 так называемых естественных элемента, 89 из которых могут быть обнаружены на Земле в настоящее время. Вам остается подумать о том, что случилось с «пропавшей тройкой».
Эти сферы содержат центральное ядро, которое содержит два типа частиц:
- протонов, несущих положительный заряд, и
- нейтронов, нейтральных (без заряда)
Атомный номер — это количество протонов в ядре атома. Атомное массовое число — это количество протонов и нейтронов в ядре.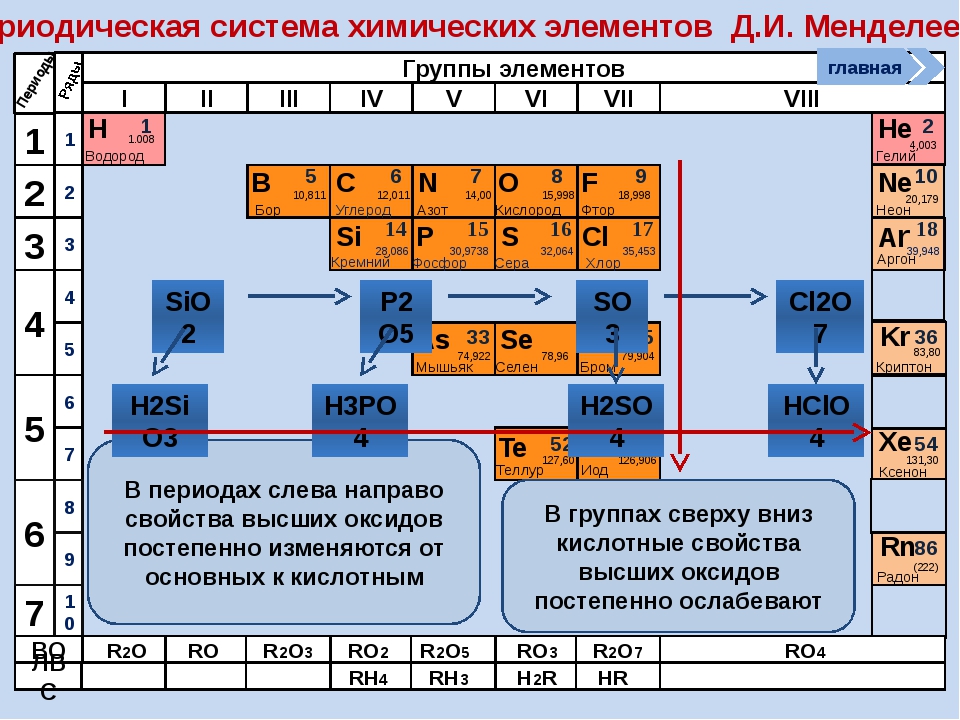 Все атомы элемента имеют одинаковое количество протонов — следовательно, один и тот же атомный номер; например, все атомы водорода имеют в ядре один протон. Каждому элементу присвоен символ — H для водорода. Вы должны выучить символы восьми самых распространенных элементов в земной коре (кислород (O), кремний (Si), алюминий (Al), кальций (Ca), железо (Fe), магний (Mg), натрий ( Na) и калий (K).
Все атомы элемента имеют одинаковое количество протонов — следовательно, один и тот же атомный номер; например, все атомы водорода имеют в ядре один протон. Каждому элементу присвоен символ — H для водорода. Вы должны выучить символы восьми самых распространенных элементов в земной коре (кислород (O), кремний (Si), алюминий (Al), кальций (Ca), железо (Fe), магний (Mg), натрий ( Na) и калий (K).
Если бы мы могли взвесить отдельные атомы водорода, мы бы обнаружили некоторое изменение их массы; это должно быть связано с вариациями количества атомов водорода. нейтроны в своем ядре, как и все, должны иметь одинаковое количество протонов.Атомы, которые имеют одинаковый атомный номер, но разные массовые числа, — это изотопов . Например, все атомы углерода имеют порядковый номер 6, но есть три изотопа углерода -12, 13 и 14. (Сколько нейтронов у каждого изотопа?)
Помимо частиц в ядре, есть отрицательно заряженные частицы — электронов и , которые «вращаются» вокруг центрального ядра. Признание того, что распределение электронов вокруг ядра не является случайным, было одним из величайших достижений физиков 1920-х годов — квантовой механики.Электроны занимают «уровни», которые отделены от каждого некоторым объемом пространства, через которое электроны могут проходить, но не оставаться. Фактически, большая часть объема атома состоит из пустого пространства. [Я помню, как Супермен мог проходить сквозь твердые объекты!] Электроны «притягиваются» к ядру (притягиваются положительные и отрицательные заряды).
Первичное деление этих уровней называется главным квантовым числом. Первый уровень (К) наиболее близок к ядру.
По мере увеличения главного числа 1…2 …. 3 …. 4 количество электронов, которые могут находиться на уровне, увеличивается.
Признание того, что распределение электронов вокруг ядра не является случайным, было одним из величайших достижений физиков 1920-х годов — квантовой механики.Электроны занимают «уровни», которые отделены от каждого некоторым объемом пространства, через которое электроны могут проходить, но не оставаться. Фактически, большая часть объема атома состоит из пустого пространства. [Я помню, как Супермен мог проходить сквозь твердые объекты!] Электроны «притягиваются» к ядру (притягиваются положительные и отрицательные заряды).
Первичное деление этих уровней называется главным квантовым числом. Первый уровень (К) наиболее близок к ядру.
По мере увеличения главного числа 1…2 …. 3 …. 4 количество электронов, которые могут находиться на уровне, увеличивается.
Уровень электронов 1 = К 2 2 = L 8 3 = М 18 4 = N 32Максимальная вместимость = 2n2 (дважды n в квадрате)
В нейтральном атоме количество отрицательных частиц равно
количество положительных частиц (электроны = протоны).
Полезное упражнение — начать с первого элемента (водорода) с одним протоном и одним электроном и добавить один протон и один электрон, чтобы создать оставшиеся химические элементы.Процесс наращивания работает следующим образом. Начнем с одного электрона — он занимает пустое место. ближайший к ядру уровень. второй электрон переходит на первый уровень (атомарный гелий) и оболочка К) заполнена. Собственно, внутри основного уровня есть подуровни (кроме К-оболочка).
Максимальное количество электронов субоболочки с 2 стр. 6 d 10 ж 14Для элемента 11 (Натрий — Na) есть 11 электронов и 11 протонов. Два электрона находятся в оболочке K, 8 — в оболочке L и один — в оболочке M.Самый дальний электрон (ы) называется валентными и электронами. Если бы один электрон был удален каков баланс между положительными и отрицательными зарядами? An ион — заряженный атом; то есть есть избыток положительного (катион , ) или отрицательный заряд (анион ).
 Если удалить электрон, катион
сформирован. Если добавлен электрон, образуется анион. Из восьми наиболее распространенных элементов в земной коре только кислород образует анионы; остальные образуют катионы, теряя один или несколько электронов.Когда есть 8 самых внешних электронов в s- и p-подоболочках,
атом имеет тенденцию сопротивляться изменениям, и ионы образуются с большим трудом, если вообще образуются.
Если удалить электрон, катион
сформирован. Если добавлен электрон, образуется анион. Из восьми наиболее распространенных элементов в земной коре только кислород образует анионы; остальные образуют катионы, теряя один или несколько электронов.Когда есть 8 самых внешних электронов в s- и p-подоболочках,
атом имеет тенденцию сопротивляться изменениям, и ионы образуются с большим трудом, если вообще образуются. Орбитали основного уровня K 1 с (макс. = 2) Всего = 2 L 2с (макс = 2), 2р (макс = 6) Всего = 8 M 3s (max = 2), 3p (max = 6), 3д (max = 10) Всего = 18Химическая связь — большинство элементов на Земле вступают в реакцию с образованием соединений, хотя некоторые из них стабильны как элементы (например, золото). Есть несколько «моделей склеивания», которые необходимо обобщить.
- Ионная связь — Элемент 11 (натрий) имеет единственный валентный электрон, который может быть относительно легко потерян, поскольку он относительно далеко от положительных зарядов в ядре.
 Потребность кислорода (атомный номер 8) требует двух электронов, чтобы дать ему полные s- и p-подоболочки. Соединение Na2O состоит из двух катионов натрия и одного аниона кислорода. Каждый натрий вносит один электрон в кислород, придавая ему заряд -2. Это соединение «скреплено» ионными связями.
Потребность кислорода (атомный номер 8) требует двух электронов, чтобы дать ему полные s- и p-подоболочки. Соединение Na2O состоит из двух катионов натрия и одного аниона кислорода. Каждый натрий вносит один электрон в кислород, придавая ему заряд -2. Это соединение «скреплено» ионными связями. - Ковалентная связь — Углерод содержит 6 электронов, 4 из которых находятся на самом внешнем уровне (L-уровень).Два атома углерода могут соединиться, поделившись своими четырьмя электронами, что создаст полные s- и p-подоболочки в L-основной оболочке. Ковалентная связь предполагает обмен электронами.
- Металлическое соединение — Металлы известны своей способностью проводить поток электронов. Металлическая связь включает в себя «размытие» валентных электронов атомов металла. Эти электроны легко перемещаются.
- Ван-дер-Ваальсова связь Атомы углерода в графите связаны между собой конвалентными связями, образуя слои из атомов углерода.Листы удерживаются вместе слабыми силами притяжения.

Признание того, что элементы могут быть организованы систематическим образом, чтобы подчеркнуть отношения между атомами, было крупным прорывом в истории химии.Например, все элементы в первом столбце (щелочные металлы) имеют один
внешний электрон в своей самой внешней подоболочке (s-подоболочке).
Все эти элементы могут потерять один электрон, образуя
катион с зарядом +1. Все элементы в крайнем правом столбце (инертные или нобелевские газы) имеют два s-электрона и восемь p-электронов на своем внешнем уровне (называемом валентным уровнем). Обратите внимание, что Периодическая таблица имеет форму искаженной буквы «H». Вертикальные полосы (стороны H) содержат элементы группы A.Центральная полоса содержит «переходные» элементы. Внизу страницы два ряда — «Лантаноиды» и «Актиниды». Посмотрите, где эти строки вписываются в букву «H». Если бы эти строки, которые показаны в правильном положении, Периодическая таблица была бы менее компактной.
Внизу страницы два ряда — «Лантаноиды» и «Актиниды». Посмотрите, где эти строки вписываются в букву «H». Если бы эти строки, которые показаны в правильном положении, Периодическая таблица была бы менее компактной.
Вопросы
- Что такое атом?
- Ничья поперечное сечение атома и найдите эти три частицы.
- 8 самых распространенных элементов, из которых состоит Земля корочка? Сколько здесь катионов? Сколько анионов? Какой самый большой? Какой самый маленький? Обратите внимание (из текста и из класса), что кислород и кремний составляют 75% веса земной коры.
- Как этот список соотносится с наиболее распространенными элементами в … Вселенная … атмосфера Земли … вся Земля.
- Опишите связывание … ионное … ковалентное … другие типы
Подумайте о утверждении, что кислород занимает 95% объема земной коры. Если бы кислород был кубиками, их можно было бы собрать вместе, чтобы заполнить пространство. Однако предполагается, что атомы кислорода являются сферами, и вы не можете упаковать сферы одинакового размера, чтобы заполнить все пространство; некоторые открытые пространства останутся внутри каркаса, созданного кислородом. В эти открытые пространства вписываются и другие ионы. В общем, эти пространства «правильные». Один из распространенных типов пространства — это пространство, которое создается, когда есть три атома кислорода внизу и один вверху. Это называется «четырехгранная пустота». (Тетраэдр — это правильное твердое тело, состоящее из четырех граней, каждая из которых представляет собой равносторонний треугольник.) Чем больше ион, тем больше предпочтительное место. Координационное число катиона — это число ближайших соседних анионов. Кремний, за одним исключением, предпочитает «сидеть» в тетраэдрической пустоте, образованной упаковкой анионов кислорода вместе.Таким образом, кремний обычно имеет координационное число 4. Координационные числа используются для получения структурной формулы.
Помните, что нижние индексы указывают количество ионов в одной формульной единице, а числа над химическими символами — координационные числа.
В эти открытые пространства вписываются и другие ионы. В общем, эти пространства «правильные». Один из распространенных типов пространства — это пространство, которое создается, когда есть три атома кислорода внизу и один вверху. Это называется «четырехгранная пустота». (Тетраэдр — это правильное твердое тело, состоящее из четырех граней, каждая из которых представляет собой равносторонний треугольник.) Чем больше ион, тем больше предпочтительное место. Координационное число катиона — это число ближайших соседних анионов. Кремний, за одним исключением, предпочитает «сидеть» в тетраэдрической пустоте, образованной упаковкой анионов кислорода вместе.Таким образом, кремний обычно имеет координационное число 4. Координационные числа используются для получения структурной формулы.
Помните, что нижние индексы указывают количество ионов в одной формульной единице, а числа над химическими символами — координационные числа.
Кварцевый 4 SiO2 Стишовит 6 SiO2Кварц и стишовит — это полиморфов (много форм).
 Они имеют одинаковый химический состав, но различаются по структуре и, следовательно, по физическим свойствам. Увеличение давления способствует большему координационному числу.Температура имеет обратный эффект. Если бы большой метеорит столкнулся с кварцем, то мог бы образоваться стишовит (если бы давление было достаточно высоким).
Они имеют одинаковый химический состав, но различаются по структуре и, следовательно, по физическим свойствам. Увеличение давления способствует большему координационному числу.Температура имеет обратный эффект. Если бы большой метеорит столкнулся с кварцем, то мог бы образоваться стишовит (если бы давление было достаточно высоким). Другие полиморфы
- алмаз и графит (оба углерода)
- кальцит и арагонит (оба карбонат кальция)
Форстерит 6 4 Mg2SiO4 Фаялит 6 4 Fe2SiO4
Обратите внимание, что два минерала различаются химически: один содержит Mg (магний), а другой — Fe (железо). В остальном химические формулы идентичны. Обратите внимание, что и Mg, и Fe находятся в 6-кратных сайтах (октаэдрических). Размеры этих двух ионов почти идентичны, заряд на обоих составляет +2, а связи Mg-O и Fe-O имеют преимущественно ионную природу.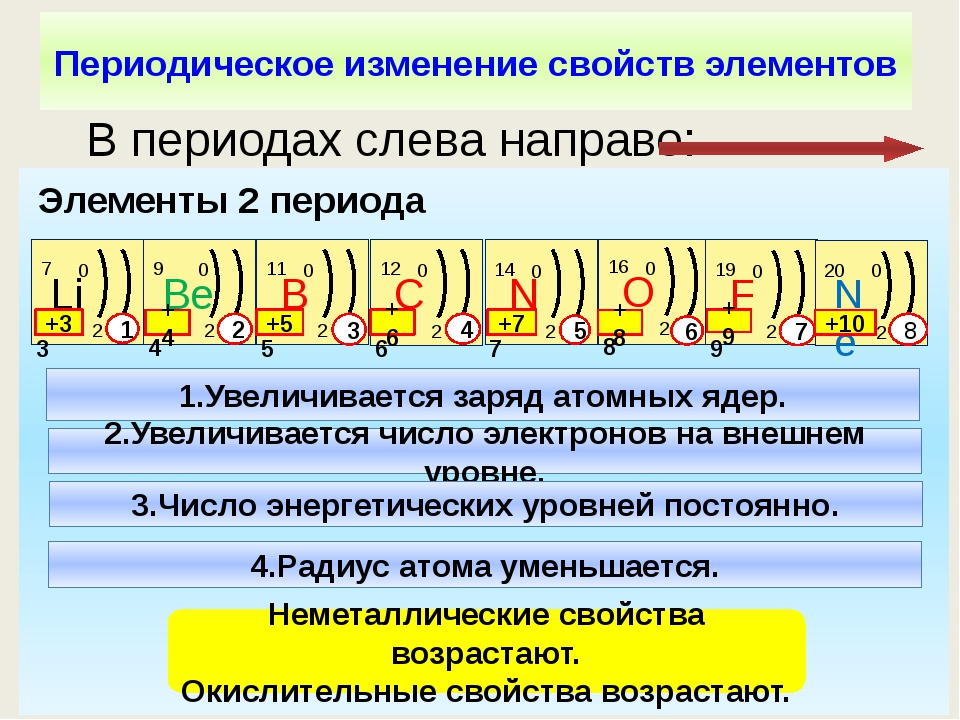 Когда происходит такое сходство, ионы могут замещать друг друга, образуя твердый раствор серии .Ряд между этими двумя концевыми элементами называется серией оливина . Составы варьируются от чистого форстерита до чистого фаялита.
Не все серии твердых растворов являются полными; некоторые демонстрируют ограниченное количество замещения.
Когда происходит такое сходство, ионы могут замещать друг друга, образуя твердый раствор серии .Ряд между этими двумя концевыми элементами называется серией оливина . Составы варьируются от чистого форстерита до чистого фаялита.
Не все серии твердых растворов являются полными; некоторые демонстрируют ограниченное количество замещения.
Практически все обычные минералы, с которыми мы будем работать, представляют собой твердые растворы. Кварц — заметное исключение.
Классификация минералов
Широчайшая классификация почти 3500 известных минералов основана на химическом составе.Таким образом, мы распознаем природные элементы (отдельные химические элементы), карбонаты (содержащие группу CO3, силикаты (содержащие кремний и кислород) и другие широкие химические группы.
Химически силикаты очень сложны, и не было достигнуто большого прогресса в понимании, пока не была разработана структурная классификация. Самый распространенный «структурный элемент» — кремний / кислородный тетраэдр. Простейший структурный класс силикатов состоит из тех соединений (минералов), которые состоят из отдельных одиночных тетраэдров — несосиликатов.Тетраэдры могут разделять между собой атомы кислорода. Два, три и четыре атома кислорода на тетраэдр могут быть общими, а в некоторых структурах существуют две или более схемы совместного использования. Ниже перечислены наиболее распространенные минералы. (имейте в виду, что все они содержат Si и О. многие также содержат Al).
Простейший структурный класс силикатов состоит из тех соединений (минералов), которые состоят из отдельных одиночных тетраэдров — несосиликатов.Тетраэдры могут разделять между собой атомы кислорода. Два, три и четыре атома кислорода на тетраэдр могут быть общими, а в некоторых структурах существуют две или более схемы совместного использования. Ниже перечислены наиболее распространенные минералы. (имейте в виду, что все они содержат Si и О. многие также содержат Al).
| Минерал | Структурный тип | Состав | Оливин | Изолированный | Fe и Mg с высоким содержанием |
|---|---|---|
| Пироксен | Одиночные цепи | Ca, Fe и Mg с высоким содержанием | Амфибол | Двойные цепи | Ca, Fe, Mg и K богатые (с «OH») | Слюда | Листовые силикаты | K, богатые Na (с «ОН») | Плагиоклаз | Тектозикаты | Ca и Na богатые | Щелочной полевой шпат | Тектосиликаты | Обогащенные Na и K | Кварц | Тектосиликаты | Si |
Кроме того, важны следующие группы минералов — особенно в осадочных породах
Карбонаты
Сульфаты
Соли
Силикатная структурная классификация . [затем вернитесь на эту страницу]
[затем вернитесь на эту страницу]
Вопросы
Используйте раздел Свойства , чтобы ответить на следующие вопросы.
- Различают трещину и скол
- Что такое блеск?
- Кварц имеет твердость 7, а тальк — 1. Кварц в семь раз тверже талька? Объясните, что это за весы Шкала Мооса и как ими пользоваться. Как алмаз «ограняется»?
- Что такое удельный вес? Удельный вес континентальной коры равен 2.6, тогда как удельный вес океанической коры равен 3,0.
- Кварц и полевой шпат — два самых распространенных минерала в земной коре. Как это согласуется со списком самых распространенных элементов в земной коре?
- Континентальная кора — щелочной полевой шпат
- Океаническая кора — плагиоклаз
- Континентальная кора — щелочной полевой шпат
Хороший индекс минералов и драгоценных камней доступен для студентов Университета Висконсина .
Если вам нравится смотреть на образцы минералов, вы, вероятно, захотите взглянуть на некоторые изображения из Смитсоновской коллекции минералов Smithsonian Minerals
Вернуться к списку литературы по Physical Geology
Вернуться на главную страницу Physical Geology
| Химический символ | Название элемента | Атомный N o | Происхождение символа |
| Ас | Актиний | 89 | |
| Ag | Серебро | 47 | От латинского Argentum , что первоначально означало сияющий металл |
| Al | Алюминий | 13 | |
| Am | Америций | 95 | |
| Ar | Аргон | 18 | |
| Как | Мышьяк | 33 | |
| при | Астатин | 85 | |
| Au | Золото | 79 | От латинского Aurum , что первоначально означало желтый |
| B | Бор | 5 | |
| Ba | Барий | 56 | |
| Be | Бериллий | 4 | |
| Bh | Борий | 107 | |
| Bi | висмут | 83 | |
| Bk | Беркелиум | 97 | |
| Br | Бром | 35 | |
| С | Углерод | 6 | |
| Ca | Кальций | 20 | |
| КД | Кадмий | 48 | |
| CE | Церий | 58 | |
| Cf | Калифорний | 98 | |
| Класс | Хлор | 17 | |
| см | Кюрий | 96 | |
| Co | Кобальт | 27 | |
| Cr | Хром | 24 | |
| CS | Цезий | 55 | |
| Cu | Медь | 29 | Из Cuprum , латинское название Кипра, римского источника меди |
| DS | Дармштадтиум | 110 | |
| ДБ | Дубний | 105 | |
| Dy | Диспрозий | 66 | |
| Er | Эрбий | 68 | |
| Es | Эйнштейний | 99 | |
| ЕС | Европий | 63 | |
| Ф | Фтор | 9 | |
| Fe | Утюг | 26 | Из Ferrum , латинское название железа |
| FM | Фермий | 100 | |
| Fr | Франций | 87 | |
| Ga | Галлий | 31 | |
| Gd | Гадолиний | 64 | |
| Ge | Германий | 32 | |
| H | Водород | 1 | |
| He | Гелий | 2 | |
| Hf | Гафний | 72 | |
| Hg | Меркурий | 80 | От латинского Hydragyrum , что означает жидкое серебро |
| Ho | Гольмий | 67 | |
| HS | Калий | 108 | |
| I | Йод | 53 | |
| дюйм | Индий | 49 | |
| Ir | Иридий | 77 | |
| К | Калий | 19 | От латинского Kalium , что означает щелочь |
| Кр | Криптон | 36 | |
| La | лантан | 57 | |
| Li | Литий | 3 | |
| Lr | Лоуренсий | 103 | |
| Лю | Лютеций | 71 | |
| Md | Менделевий | 101 | |
| мг | Магний | 12 | |
| Mn | Марганец | 25 | |
| Пн | молибден | 42 | |
| Мт | Мейтнерий | 109 | |
| N | Азот | 7 | |
| Na | Натрий | 11 | Из Natrium , латинское название карбоната натрия |
| Nb | Ниобий | 41 | |
| Nd | Неодим | 60 | |
| Ne | Неон | 10 | |
| Ni | Никель | 28 | |
| № | Нобелий | 102 | |
| НП | Нептуний | 93 | |
| О | Кислород | 8 | |
| Ос | Осмий | 76 | |
| П | фосфор | 15 | |
| Па | Протактиний | 91 | |
| Пб | Свинец | 82 | От латинского Plumbum , что означает мягкий белый металл |
| Pd | Палладий | 46 | |
| PM | Прометий | 61 | |
| Po | полоний | 84 | |
| Pr | празеодим | 59 | |
| Pt | Платина | 78 | |
| Pu | Плутоний | 94 | |
| Ra | Радий | 88 | |
| руб | Рубидий | 37 | |
| Re | Рений | 75 | |
| Rf | Резерфордий | 104 | |
| Rg | Рентген | 111 | |
| правый | Родий | 45 | |
| Rn | Радон | 86 | |
| Ру | Рутений | 44 | |
| S | сера | 16 | |
| Сб | Сурьма | 51 | От латинского Stibium , что означает косметическая пудра |
| SC | Скандий | 21 | |
| SE | Селен | 34 | |
| SG | Сиборгий | 106 | |
| Si | Кремний | 14 | |
| См | Самарий | 62 | |
| Sn | Олово | 50 | Из Stannum , латинское слово для олова |
| Sr | Стронций | 38 | |
| Ta | тантал | 73 | |
| ТБ | Тербий | 65 | |
| TC | Технеций | 43 | |
| Te | Теллур | 52 | |
| Вт | торий | 90 | |
| Ti | Титан | 22 | |
| Тл | Таллий | 81 | |
| TM | Тулий | 69 | |
| U | Уран | 92 | |
| В | Ванадий | 23 | |
| Вт | Вольфрам | 74 | Из Wolfram , старое название элемента, полученного из его руды, Wolframite |
| Xe | Ксенон | 54 | |
| Y | Иттрий | 39 | |
| Yb | Иттербий | 70 | |
| Zn | цинк | 30 | |
| Zr | Цирконий | 40 |
Дивергентные вариации концентраций химических элементов среди органов кустарников в пустыне с умеренным климатом
Ной-Меир, И.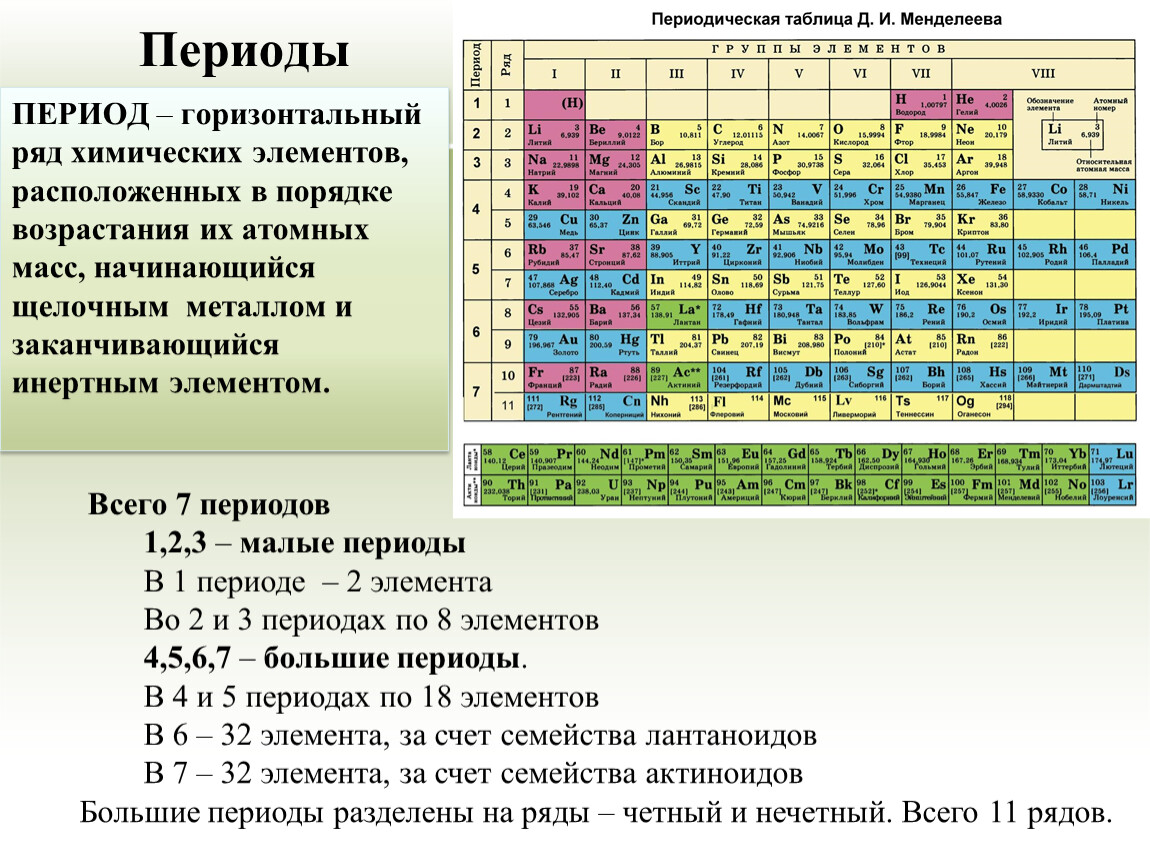 Экосистемы пустынь: окружающая среда и производители. Анну. Rev. Ecol. Syst. 4, 25–51 (1973).
Экосистемы пустынь: окружающая среда и производители. Анну. Rev. Ecol. Syst. 4, 25–51 (1973).
Артикул Google Scholar
Whitford, W.G. Экология пустынных систем. (Academic Press, 2002).
Хартли, А., Баргер, Н., Белнап, Дж. И Окин, Г.С. [Экосистемы засушливых земель] Круговорот питательных веществ в наземных экосистемах [Маршнер, П. и Ренгель, З. (ред.)] [271–307] (Спрингер, Гейдельберг, 2007).
Чарли, Дж.Л. и Уэст, Н. Э. Вызванные растениями химические структуры почвы в некоторых полупустынных экосистемах с преобладанием кустарников в Юте. J. Ecol. 63, 945–963 (1975).
Артикул CAS Google Scholar
Ли, X. Р. Влияние изменения пространственной неоднородности почвы на восстановление растительности. Sci. China Ser. D 48, 2020–2031 (2005).
Артикул Google Scholar
Pugnaire, F. I., Haase, P. & Puigdefabregas, J. Содействие между высшими видами растений в полузасушливой среде. Экология 77, 1420–1426 (1996).
I., Haase, P. & Puigdefabregas, J. Содействие между высшими видами растений в полузасушливой среде. Экология 77, 1420–1426 (1996).
Артикул Google Scholar
Aerts, R. Межвидовая конкуренция в естественных растительных сообществах: механизмы, компромиссы и обратная связь между растением и почвой. J. of Exp.Bot. 50, 29–37 (1999).
Артикул CAS Google Scholar
День, А.Д. и Кеннет, Л. [Питательные вещества для растений в почвах пустыни] Питательные вещества для растений в пустынях средах [Дэй, А. Д. и Кеннет, Л. (ред.)] [53–56] (Springer, Heidelberg, 1993).
Ламберс, Х., Чапин, Ф. С. и Понс, Т. Л. Физиологическая экология растений (2-е изд.), (Springer Science + Business Media, LLC, 2008).
Фарук, М., Хусейн, М., Вахид, А. и Сиддик, К. Х. М. [Засухающий стресс у растений: обзор] Реакция растений на стресс, вызванный засухой [Aroca R. (eds)] [1–33] (Springer-Verlag, Berlin Heidelberg, 2012).
(eds)] [1–33] (Springer-Verlag, Berlin Heidelberg, 2012).
Керкхофф, А. Дж., Фаган, У. Ф., Эльзер, Дж. Дж. И Энквист, Б. Дж. Филогенетические и ростовые вариации в изменении содержания азота и фосфора в семенных растениях. Являюсь. Nat. 168, E103 – E122 (2006).
Артикул PubMed Google Scholar
Янг, X. et al. Масштабирование азота и фосфора в органах растений в биомах кустарников в Северном Китае.Sci. Реп.4, 5448 (2014).
Артикул CAS PubMed PubMed Central Google Scholar
Маршнер, П. Маршнер Минеральное питание высших растений (3-е изд.) (Elsevier / Academic Press, 2012).
Менгель К. и Киркби Э. Принципы питания растений (5-е изд.) (Kluwer Academic Publishers, 2001).
Belnap, J. [Биологический круговорот фосфора в засушливых регионах] Фосфор в действии [Bünemann, E., Оберсон, А. и Фроссар, Э. (ред.)] [371–406] (Springer, Berlin Heidelberg, 2011).
(ред.)] [371–406] (Springer, Berlin Heidelberg, 2011).
He, M. Z. et al. Азот и фосфор листьев растений пустынь умеренного пояса в зависимости от климата и доступности питательных веществ в почве. Sci. Отчет 4, 6932 (2014).
Артикул CAS PubMed PubMed Central Google Scholar
Ли, А., Го, Д., Ван, З. и Лю, Х. Распределение азота и фосфора в листьях, веточках и тонких корнях 49 умеренных, субтропических и тропических видов деревьев: иерархическая структура.Функц. Эко. 24. С. 224–232 (2010).
Артикул Google Scholar
Хан, В. X., Фанг, Дж. Й., Райх, П. Б., Вудворд, Ф. И. и Ван, З. Х. Биогеография и изменчивость одиннадцати минеральных элементов в листьях растений в зависимости от градиентов климата, почвы и функционального типа растений в Китае. Ecol. Lett. 14. С. 788–796 (2011).
Артикул CAS PubMed Google Scholar
Менгель К. , Киркби, Э., Косегартен, Х. и Аппель, Т. [Питательные вещества для растений] Принципы питания растений [Менгель, К., Киркби, Э.А., Косегартен, Х. и Аппель, Т. (ред.)] [1–13 ] (Springer, Нидерланды, 2001).
, Киркби, Э., Косегартен, Х. и Аппель, Т. [Питательные вещества для растений] Принципы питания растений [Менгель, К., Киркби, Э.А., Косегартен, Х. и Аппель, Т. (ред.)] [1–13 ] (Springer, Нидерланды, 2001).
Rouphael, Y., Cardarelli, M., Schwarz, D., Franken, P. & Colla, G. [Влияние засухи на поглощение и ассимиляцию питательных веществ овощными культурами] Реакция растений на стресс, вызванный засухой [Aroca, R . (ред.)] [171–195] (Springer, Berlin Heidelberg, 2012).
Смарт, С.Дж., Гарвин, Д. Ф., Принс, Дж. П., Лукас, В. Дж. И Кочиан, Л. В. Молекулярные основы калиевого питания растений. Почва растений 187, 81–89 (1996).
Артикул CAS Google Scholar
Уайт, П. Дж. И Бродли, М. Р. Кальций в растениях. Аня. Бот. 92, 487–511 (2003).
Артикул CAS PubMed PubMed Central Google Scholar
Хан, Ф.X. & Singer, A. Химия раствора микроэлементов в почвах аридной зоны (Springer, Нидерланды, 2007).
Химия раствора микроэлементов в почвах аридной зоны (Springer, Нидерланды, 2007).
Флауэрс, Т. Дж., Троук, П. Ф. и Йео, А. Р. Механизм солеустойчивости у галофитов. Аня. Rev. Plant Physiol. 1977. Т. 28. С. 89–121.
Артикул CAS Google Scholar
Brownell, P. F. [Натрий как важный элемент микронутриентов для растений и его возможная роль в метаболизме] Достижения в ботанических исследованиях [Woolhouse, H.W. (ред.)] [117–224] (Academic Press, 1980).
Warembourg, F. R. и Roumet, C. [Почему и как оценить стоимость симбиотической фиксации N2? Прогрессивный подход, основанный на использовании изотопов 14 C и 15 N] Экология пахотных земель — перспективы и проблемы [Clarholm, M. & Bergström, L. (eds)] [31–41] (Springer, Нидерланды , 1989).
Хикосака К., Ханба Ю. Т., Хиросе Т. и Терашима И. Эффективность фотосинтетического использования азота в листьях древесных и травянистых видов. Функц. Ecol. 12. С. 896–905 (1998).
Функц. Ecol. 12. С. 896–905 (1998).
Артикул Google Scholar
Han, W. X., Fang, J. Y., Guo, D. L., Zhang, Y. Стехиометрия азота и фосфора в листьях 753 видов наземных растений в Китае. Новый Фитол. 168, 377–385 (2005).
Артикул CAS PubMed Google Scholar
He, M. et al. Влияние жизненной формы, таксономии, климата и свойств почвы на концентрацию 11 элементов в побегах и корнях травянистых растений в пустыне с умеренным климатом.Почва растений 10.1007 / s11104-015-2669-0 (2015).
Крейн, Дж. М., Ли, У. Г., Бонд, У. Дж., Уильямс, Р. Дж. И Джонсон, Л. С. Экологические ограничения на глобальную взаимосвязь между характеристиками листьев и корней трав. Экология 86, 12–19 (2005).
Артикул Google Scholar
Лю, Г. Ф. и др. Скоординированное изменение характеристик листьев и корней в различных пространственных масштабах в полузасушливых и засушливых экосистемах Китая.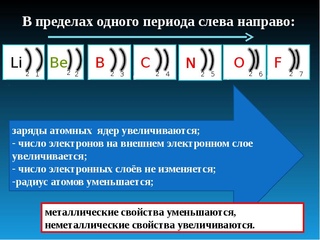 Новый Фитол. 188, 543–553, (2010).
Новый Фитол. 188, 543–553, (2010).
Артикул PubMed Google Scholar
Чжан, С. Б., Чжан, Дж. Л., Слик, Дж. В. Ф. и Цао, К. Ф. На концентрацию элементов в листьях наземных растений в Китае влияют таксономия и окружающая среда. Global Ecol. Биогеогр. 21. С. 809–818 (2012).
Артикул Google Scholar
Sardans, J. et al. Элементный состав листвы европейских лесных пород деревьев связан с эволюционными особенностями и текущими экологическими и конкурентными условиями.Global Ecol. Биогеогр. 24. С. 240–255, 2014.
Артикул Google Scholar
Редондо-Гомес, С., Матеос-Наранхо, Э., Фигероа, М. Э. и Дэви, А. Дж. Солевая стимуляция роста и фотосинтеза у крайнего галофита, Arthrocnemum macrostachyum. Биология растений 12, 79–87 (2010).
Артикул CAS PubMed Google Scholar
Niu, S.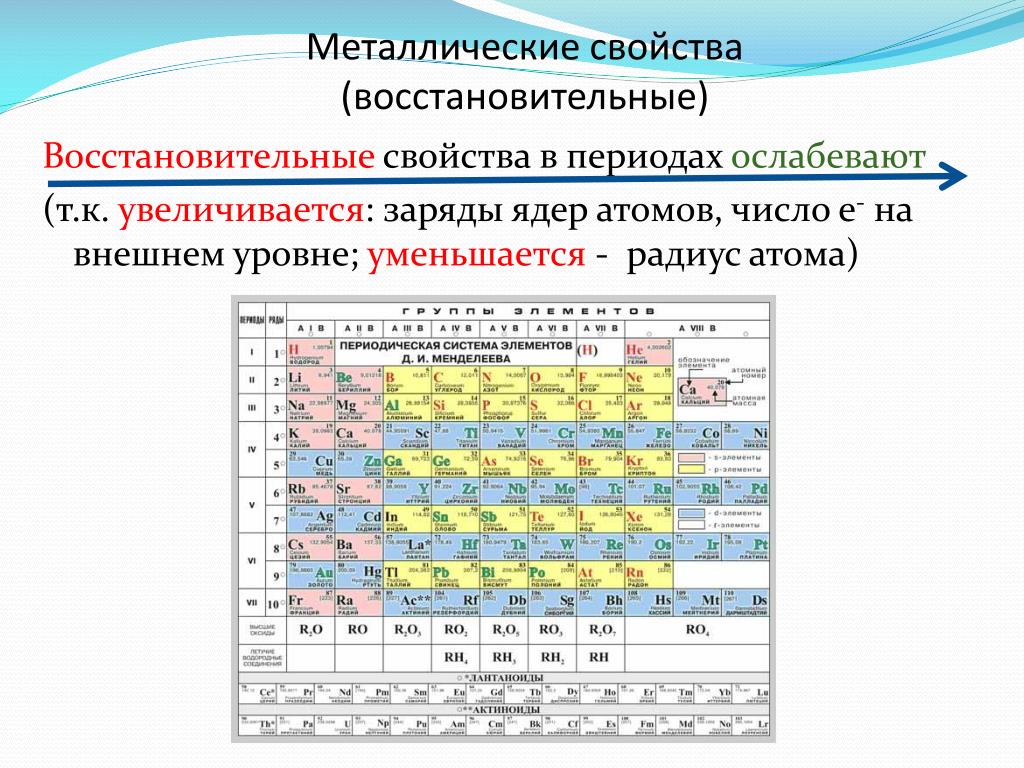 L. et al.Сравнение фотосинтетических признаков между двумя типичными кустарниками: бобовыми и небобовыми в Хуншандакских песках. Photosynthetica 41, 111–1169 (2003).
L. et al.Сравнение фотосинтетических признаков между двумя типичными кустарниками: бобовыми и небобовыми в Хуншандакских песках. Photosynthetica 41, 111–1169 (2003).
Артикул CAS Google Scholar
Бромфилд, С., Камминг, Р., Дэвид, Д. и Уильямс, К. Изменение pH почвы, содержания марганца и алюминия под подземным пастбищем клевера. Aust. J. Exp. Agr. 23. С. 181–191 (1983).
Артикул Google Scholar
Ehleringer, J.Р., Серлинг, Т. Э. и Хелликер, Б. Р. Фотосинтез C4, атмосферный CO2 и климат. Oecologia 112, 285–299 (1997).
ADS Статья PubMed Google Scholar
Сейдж Р.Ф. Эволюция фотосинтеза C4. Новый Фитол. 161, 341–370 (2004).
Артикул CAS Google Scholar
Brownell, P. F. & Wood, J. G. Натрий как важный элемент микронутриентов для Atriplex vesicaria , Heward. Nature 179, 635–636 (1957).
Nature 179, 635–636 (1957).
ADS Статья CAS Google Scholar
Брауэр Р. Питательные вещества влияют на распределение сухого вещества в растении. Нет. J. Agr. Sci. 10, 399–408 (1962).
Google Scholar
Garten, C. T. Корреляции между концентрациями элементов в растениях. Nature 261, 686–688 (1976).
ADS Статья CAS Google Scholar
Гартен, К.Т. Многомерные взгляды на экологию минерально-элементного состава растений. Являюсь. Nat. 112, 533–544 (1978).
Артикул CAS Google Scholar
Wright, I. J. et al. Оценка общности глобальных взаимосвязей признаков листа. Новый Фитол. 166. С. 485–496 (2005).
Артикул PubMed Google Scholar
Группа комплексных исследований растительности Внутренней Монголии. Растительность Внутренней Монголии (на китайском языке). (Science Press, Пекин, 1985).
Растительность Внутренней Монголии (на китайском языке). (Science Press, Пекин, 1985).
Куо С. [Фосфор] Методы анализа почвы. Часть 3. Химические методы. Американское общество почвоведов, Американское агрономическое общество [Бигхэм, Дж. М. (ред.)] [869–919] (Мэдисон, 1996).
Джон М.К. Колориметрическое определение фосфора в почве и растительных материалах с помощью аскорбиновой кислоты. Почвоведение 109, 214–220 (1970).
ADS Статья CAS Google Scholar
Хейккинен, Р., Луото, М., Кууссаари, М. и Пёйри, Дж. Новое понимание взаимоотношений бабочки и окружающей среды с использованием методов разделения. Proc. Биол. Sci. 272, 2203–2210 (2005).
Артикул PubMed PubMed Central Google Scholar
Назад & nbsp На главную & nbsp Далее
Элементы
Элементы — это чистые вещества. Атомы каждого элемента химически различны
и отличается от любого другого элемента.Примерно 110 элементов
теперь известно. К 1980 году 106 из них были однозначно охарактеризованы и признаны
Международным союзом теоретической и прикладной химии (IUPAC). С тех пор
время, элементы 107 и 109 были идентифицированы среди продуктов ядерного
реакция. Поиск новых элементов продолжается во многих лабораториях вокруг
мир; новые элементы могут быть объявлены в любое время.
Атомы каждого элемента химически различны
и отличается от любого другого элемента.Примерно 110 элементов
теперь известно. К 1980 году 106 из них были однозначно охарактеризованы и признаны
Международным союзом теоретической и прикладной химии (IUPAC). С тех пор
время, элементы 107 и 109 были идентифицированы среди продуктов ядерного
реакция. Поиск новых элементов продолжается во многих лабораториях вокруг
мир; новые элементы могут быть объявлены в любое время.
A. Названия и символы элементов
У каждого элемента есть имя.Многие из этих имен вам уже знакомы — золото, серебро, медь, хлор, платина, углерод, кислород и азот. Сами названия интересны. Многие ссылаются на свойство элемента. Латинское название золота — aurum, — «сияющий рассвет». Латинское название ртути, hydrargyrum, означает «жидкое серебро».
Продолжается практика именования элемента после одного из его свойств. Цезий был открыт в 1860 году немецким химиком Бунзеном (изобретателем бунзеновской горелки).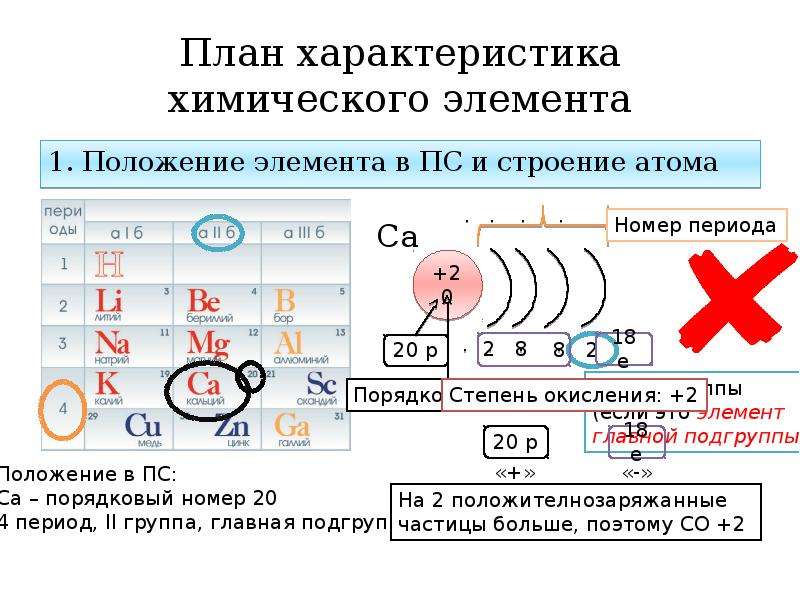 Поскольку этот элемент придает синий цвет пламени, Бунзен назвал его цезием от латинского слова caesius, , означающего «небесно-голубой».
Поскольку этот элемент придает синий цвет пламени, Бунзен назвал его цезием от латинского слова caesius, , означающего «небесно-голубой».
Остальные элементы названы в честь людей. Куриум назван в честь Марии Кюри (1867-1934), пионера в изучении радиоактивности. Мария Кюри, французский ученый польского происхождения, была удостоена Нобелевской премии по физике в 1903 году за свои исследования радиоактивности. Она также была удостоена Нобелевской премии по химии в 1911 году за открытие элементов полония (названного в честь Польши) и радия (латинское, радиус, «луч»).
Некоторые элементы названы по местам. В честь небольшого городка Иттерби в Швеции названы четыре элемента: тербий, иттрий, эрбий и иттербий. Калифорний — еще один пример элемента, названного в честь места, где он был впервые обнаружен. Этот элемент не встречается в природе. Впервые он был изготовлен в 1950 году в Радиационной лаборатории Калифорнийского университета в Беркли группой ученых во главе с Гленном Сиборгом. Сиборг был также первым, кто идентифицировал кюрий в металлургической лаборатории Чикагского университета (ныне Аргоннская национальная лаборатория) в 1944 году.Сам Сиборг был назван лауреатом Нобелевской премии в 1951 году в честь его новаторской работы по получению других неизвестных элементов.
Сиборг был также первым, кто идентифицировал кюрий в металлургической лаборатории Чикагского университета (ныне Аргоннская национальная лаборатория) в 1944 году.Сам Сиборг был назван лауреатом Нобелевской премии в 1951 году в честь его новаторской работы по получению других неизвестных элементов.
У каждого элемента есть символ, одна или две буквы, которые представляют элемент так же, как ваши инициалы представляют вас. Символ элемента представляет один атом этого элемента. Для 14 элементов символ состоит из одной буквы. За возможным исключением иттрия (Y) и ванадия (V), вы, вероятно, знакомы с названиями всех элементов, имеющими однобуквенные символы.Эти элементы перечислены в таблице 3.1. Для 12 из этих элементов символ — это первая буква названия.
Калий был открыт в 1807 году и назван в честь поташа, вещества, из которого впервые был выделен калий. Символ калия, K, происходит от kalium , латинского слова, обозначающего поташ. Вольфрам, открытый в 1783 году, имеет символ W, что означает вольфрамит, минерал, из которого вольфрам был впервые выделен.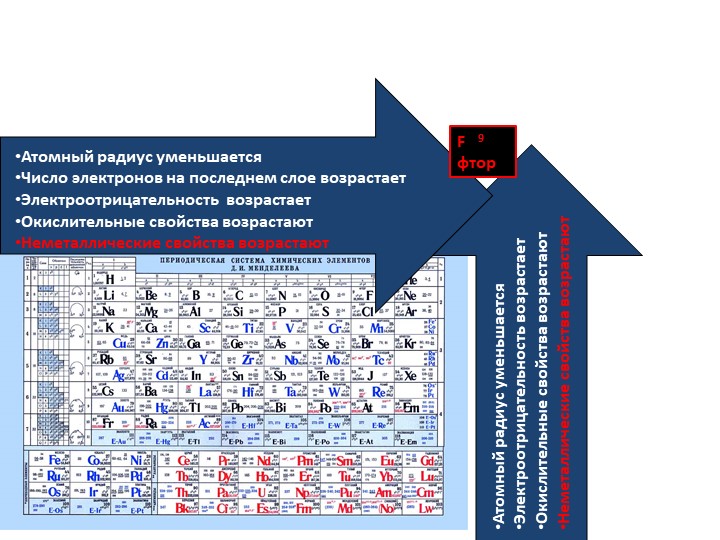
|
|
Большинство других элементов имеют двухбуквенные символы. В этих двухбуквенных символах первая буква всегда заглавная, а вторая — строчная. Одиннадцать элементов имеют имена (и символы), начинающиеся с буквы C. Один из них, углерод, имеет однобуквенный символ C. Остальные десять имеют двухбуквенные символы (см. Таблицу 3.2).
В этих двухбуквенных символах первая буква всегда заглавная, а вторая — строчная. Одиннадцать элементов имеют имена (и символы), начинающиеся с буквы C. Один из них, углерод, имеет однобуквенный символ C. Остальные десять имеют двухбуквенные символы (см. Таблицу 3.2).
|
|
Б. Списки элементов
Списки элементов
Когда вы изучаете химию, вам часто понадобится список элементов. К
просмотреть список элементов нажмите здесь. В списке есть символ,
атомный номер и атомный вес элемента. Значение атомной
числа и веса будут обсуждаться в главе 4. А пока достаточно
чтобы знать, что каждый элемент имеет номер от 1 до 110, называется его атомарным
номер. Этот номер уникален для элемента, как его имя или символ.
Во втором списке, называемом периодической таблицей, элементы располагаются в порядке возрастания атомного номера в строках различной длины. Значение длины строки и отношения между элементами в одной строке или столбце будет обсуждаться в главе 5.
Таблица Менделеева появляется при нажатии на внутреннюю сторону лицевой обложки этого текста. На протяжении всего текста мы будем ссылаться на таблицу Менделеева, потому что она содержит удивительный объем информации.На данный момент вам нужно только знать, что элементы в одном столбце имеют схожие свойства и что тяжелая ступенчатая линия, пересекающая таблицу по диагонали от бора (B) до астата (At), отделяет металлические элементы от неметаллических элементов. Таблица Менделеева также показана на Рисунке 3.3. Заштрихованные области отмечают элементы, с которыми вы чаще всего сталкиваетесь в этом тексте.
Таблица Менделеева также показана на Рисунке 3.3. Заштрихованные области отмечают элементы, с которыми вы чаще всего сталкиваетесь в этом тексте.
1. Металлы и неметаллы
Металлы появляются внизу и слева от жирной диагональной линии в периодической таблице.Характерные свойства металла:
- Он блестящий и блестящий.
- Проводит тепло и электричество.
- Он пластичный и податливый; то есть его можно втянуть в проволока и может быть забита в тонкий лист.
- Это твердое вещество при 20 ° C. Единственное исключение — Меркурий. правило; это жидкость при комнатной температуре. Два других металла, галлий и цезий, имеют температуры плавления, близкие к комнатной температуре (19.8 ° C и 28,4 ° С).
Неметаллы различаются по своим свойствам больше, чем металлы; некоторые могут даже иметь
одно или несколько из перечисленных металлических свойств. Некоторые неметаллы газообразны; хлор
и азот — газообразные неметаллы. При 20 ° C один неметалл, бром, является
жидкие, а другие — твердые, например углерод, сера и фосфор.
При 20 ° C один неметалл, бром, является
жидкие, а другие — твердые, например углерод, сера и фосфор.
| Бром | |
| Углерод | |
| сера | |
| Красный фосфор |
С.Распределение элементов
Известные элементы неравномерно распределены в мире. Только 91 обнаружен в земной коре, океанах или атмосфере; остальные были произведены в лабораториях. Следы некоторых, но не всех этих элементов были обнаружены на Земле или в звездах. Поиск остальных продолжается. Изучая этот текст, вы можете прочитать об его успехе или об обособлении новых элементов.
|
|
В таблице 3. 3 перечислены 18 элементов, которые наиболее распространены в земной коре, океанах и атмосфере, а также их относительный процент от общей массы Земли. Одним из наиболее ярких моментов в этом списке является чрезвычайно неравномерное распределение элементов (см. Рисунок 3.4). Кислород — безусловно, самый распространенный элемент. Он составляет 21% объема атмосферы и 89% массы воды. Кислород в воздухе, воде и других местах составляет 49,2% массы земной коры, океанов и атмосферы. Кремний — второй по распространенности элемент на Земле (25,7% по массе). Кремний не встречается в природе в свободном виде, но встречается в сочетании с кислородом, в основном в виде диоксида кремния (SiO 2 ), в песке, кварце, горном хрусте, аметисте, агате, кремне, яшме и опале, а также в различных силикатах. минералы, такие как гранит, асбест, глина и слюда.Алюминий — самый распространенный металл в земной коре (7,5%). В природе всегда встречается в сочетании. Большая часть алюминия, используемого сегодня, получается при переработке бокситов — руды, богатой оксидом алюминия.
3 перечислены 18 элементов, которые наиболее распространены в земной коре, океанах и атмосфере, а также их относительный процент от общей массы Земли. Одним из наиболее ярких моментов в этом списке является чрезвычайно неравномерное распределение элементов (см. Рисунок 3.4). Кислород — безусловно, самый распространенный элемент. Он составляет 21% объема атмосферы и 89% массы воды. Кислород в воздухе, воде и других местах составляет 49,2% массы земной коры, океанов и атмосферы. Кремний — второй по распространенности элемент на Земле (25,7% по массе). Кремний не встречается в природе в свободном виде, но встречается в сочетании с кислородом, в основном в виде диоксида кремния (SiO 2 ), в песке, кварце, горном хрусте, аметисте, агате, кремне, яшме и опале, а также в различных силикатах. минералы, такие как гранит, асбест, глина и слюда.Алюминий — самый распространенный металл в земной коре (7,5%). В природе всегда встречается в сочетании. Большая часть алюминия, используемого сегодня, получается при переработке бокситов — руды, богатой оксидом алюминия.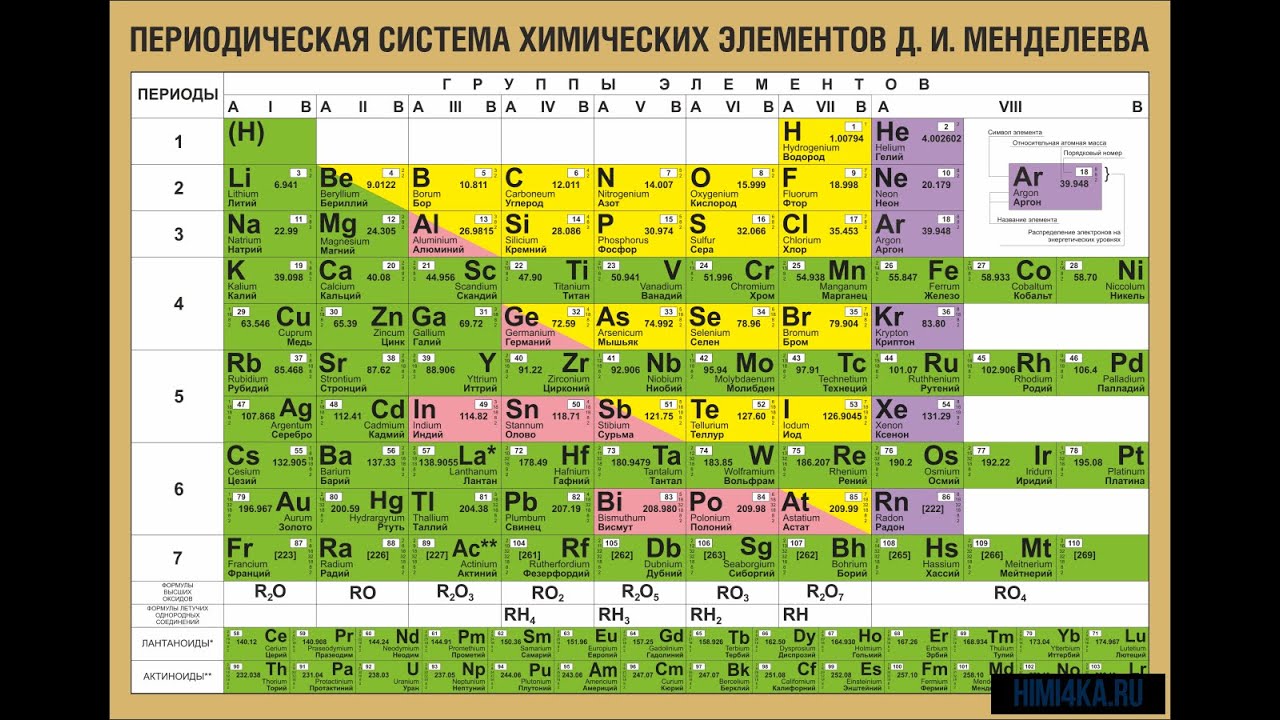 Эти три элемента (кислород, кремний и алюминий) плюс железо, кальций, натрий, калий и магний составляют более 97% массы земной коры, океанов и атмосферы. Еще одна удивительная особенность распределения элементов состоит в том, что некоторые из металлов, наиболее важных для нашей цивилизации, относятся к числу самых редких; эти металлы включают свинец, олово, медь, золото, ртуть, серебро и цинк.
Эти три элемента (кислород, кремний и алюминий) плюс железо, кальций, натрий, калий и магний составляют более 97% массы земной коры, океанов и атмосферы. Еще одна удивительная особенность распределения элементов состоит в том, что некоторые из металлов, наиболее важных для нашей цивилизации, относятся к числу самых редких; эти металлы включают свинец, олово, медь, золото, ртуть, серебро и цинк.
| РИСУНОК 3.4 Относительные массовые проценты элементов в земной коре, океанах и атмосфере. |
Распределение элементов в космосе сильно отличается от земного. Согласно современным знаниям, водород является самым распространенным элементом во Вселенной, составляя до 75% его массы. Гелий и водород вместе составляют почти 100% массы Вселенной.
В таблице 3.4 перечислены биологически важные элементы, которые содержатся в нормальном здоровом организме. Первые четыре из этих элементов — кислород, углерод, водород и азот — составляют около 96% от общей массы тела (см.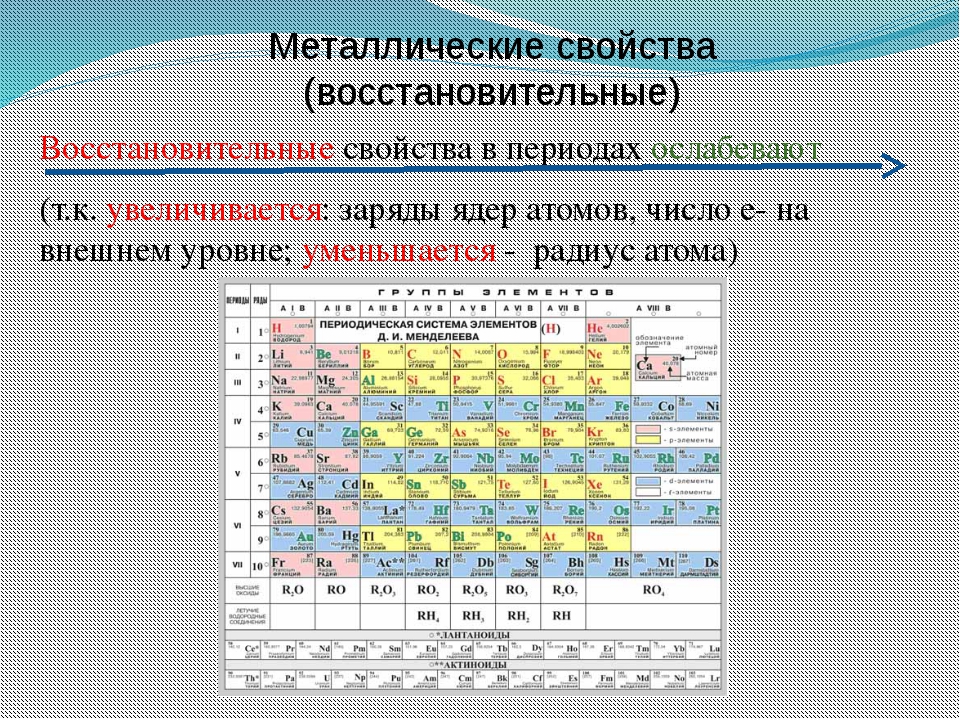 Рис. 3.5). Другие перечисленные элементы, хотя и присутствуют в гораздо меньших количествах, тем не менее необходимы для хорошего здоровья.
Рис. 3.5). Другие перечисленные элементы, хотя и присутствуют в гораздо меньших количествах, тем не менее необходимы для хорошего здоровья.
|
|
| РИСУНОК 3.5 Распределение элементов (по массе) в организме человека. |
D. Как элементы встречаются в природе
Как элементы встречаются в природе
Элементы встречаются как отдельные атомы или как группы атомов, химически связанных вместе. Природа этих химических связей будет обсуждаться в главе 7.
Группы атомов, связанных химически, называются молекулами.
или формульные единицы.
Молекулы могут содержать атомы одного элемента или они могут содержать атомы разных элементов (в этом случае молекула представляет собой соединение.) Так же, как атом — это наименьшая единица элемента, молекула — наименьшая единица соединения, то есть наименьшая единица, имеющая химическую идентичность этого соединения.
Давайте рассмотрим, как элементы можно классифицировать по тому, как они находятся во Вселенной.
1. Благородные газы
Лишь некоторые элементы встречаются в виде отдельных несвязанных атомов; В таблице 3.5 перечислены эти элементы. В нормальных условиях все эти элементы являются газами; вместе они известны как благородные газы.Их также называют одноатомными газами, что означает, что они существуют в несвязанном виде в виде отдельных атомов ( моно, означает «один»).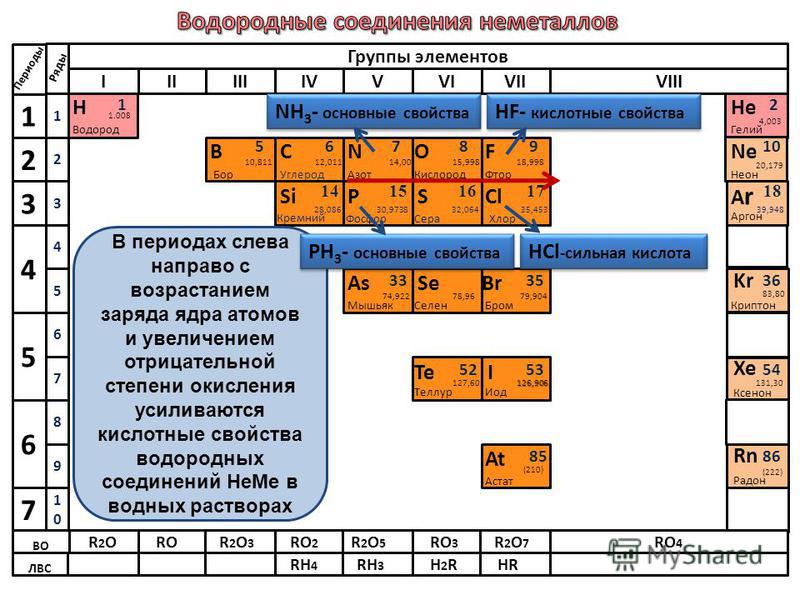 Формула каждого благородного газа — это просто его символ. Когда требуется формула гелия, используется символ He. Нижний индекс 1 понимается.
Формула каждого благородного газа — это просто его символ. Когда требуется формула гелия, используется символ He. Нижний индекс 1 понимается.
| Обозначение | Элемент |
|---|---|
| He | гелий |
| Ne | неон |
| Ар | аргон |
| Kr | криптон |
| Xe | ксенон |
| рн | радон |
2.Металлы
С чистыми металлами обращаются так, как если бы они существовали как отдельные несвязанные атомы даже
хотя образец чистого металла представляет собой совокупность миллиардов атомов. Таким образом, когда
требуется формула меди, ее символ Cu используется для обозначения одного атома
меди.
|
Медь металлическая |
3. Неметаллы
Неметаллы
Некоторые неметаллы существуют при нормальных условиях температуры и давления, как
молекулы, содержащие два, четыре или восемь атомов. Те неметаллы, которые встречаются как
двухатомные (двухатомные) молекулы перечислены в таблице 3.6. Таким образом, мы используем O 2
как формула для кислорода, N 2 для азота и т. д. Среди
неметаллы, сера существует как S 8 , а фосфор находится как P 4 .
Для других неметаллов (не указанных в таблице 3.5 или 3.6) одноатомная формула
используется — например, А для мышьяка и Se для селена.
| Формула | Имя | Нормальное состояние |
|---|---|---|
| H 2 | водород | газ бесцветный |
| № 2 | азот | газ бесцветный |
| О 2 | кислород | газ бесцветный |
| Факс 2 | фтор | бледно-желтый газ |
| Класс 2 | хлор | зеленовато-желтый газ |
| Br 2 | бром | темно-красная жидкость |
| I 2 | йод | фиолетовый черный сплошной |
4. Соединения
Соединения
Хотя многие элементы могут находиться в несоединенном состоянии, все элементы, за исключением некоторых благородных газов, также встречаются в соединениях с другими элементами. В разделе 3.1 мы определили соединение как вещество, которое можно разложить обычными химическими средствами. Соединение также можно определить как чистое вещество, содержащее два или более элементов. Состав соединения выражается формулой, в которой используются символы всех элементов в соединении.За каждым символом следует нижний индекс — число, показывающее, сколько атомов элемента входит в одну молекулу (простейшую единицу) соединения; индекс 1 не отображается. Вода — это соединение с формулой H 2 O, что означает, что одна молекула (или формульная единица) воды содержит два атома водорода и один атом кислорода. Соединение гидрокарбоната натрия имеет формулу NaHCO 3 , что означает, что одна формульная единица этого соединения содержит один атом натрия, один атом водорода, один атом углерода и три атома кислорода. Обратите внимание, что сначала пишутся символы металлов в гидрокарбонате натрия, затем неметаллы, а из неметаллов — кислород. Это обычный порядок.
Обратите внимание, что сначала пишутся символы металлов в гидрокарбонате натрия, затем неметаллы, а из неметаллов — кислород. Это обычный порядок.
Иногда формула может содержать группу символов, заключенных в круглые скобки. как, например, Cu (NO 3 ) 2 . Скобки означают, что заключенная в них группа атомов действует как единое целое. Нижний индекс после скобка означает, что группа берется дважды для каждого атома меди.
|
Нитрат меди |
Свойства соединения совершенно не похожи на свойства элементов, из которых
он сформирован. Этот факт становится очевидным, если мы сравним свойства углекислого газа,
CO 2 (бесцветный газ, используемый в огнетушителях), с углем
(черное горючее твердое вещество) и кислород (бесцветный газ, необходимый для горения).Более подробно свойства соединений обсуждаются в главе 6.

 Д.)
Д.)  71
71  24
24