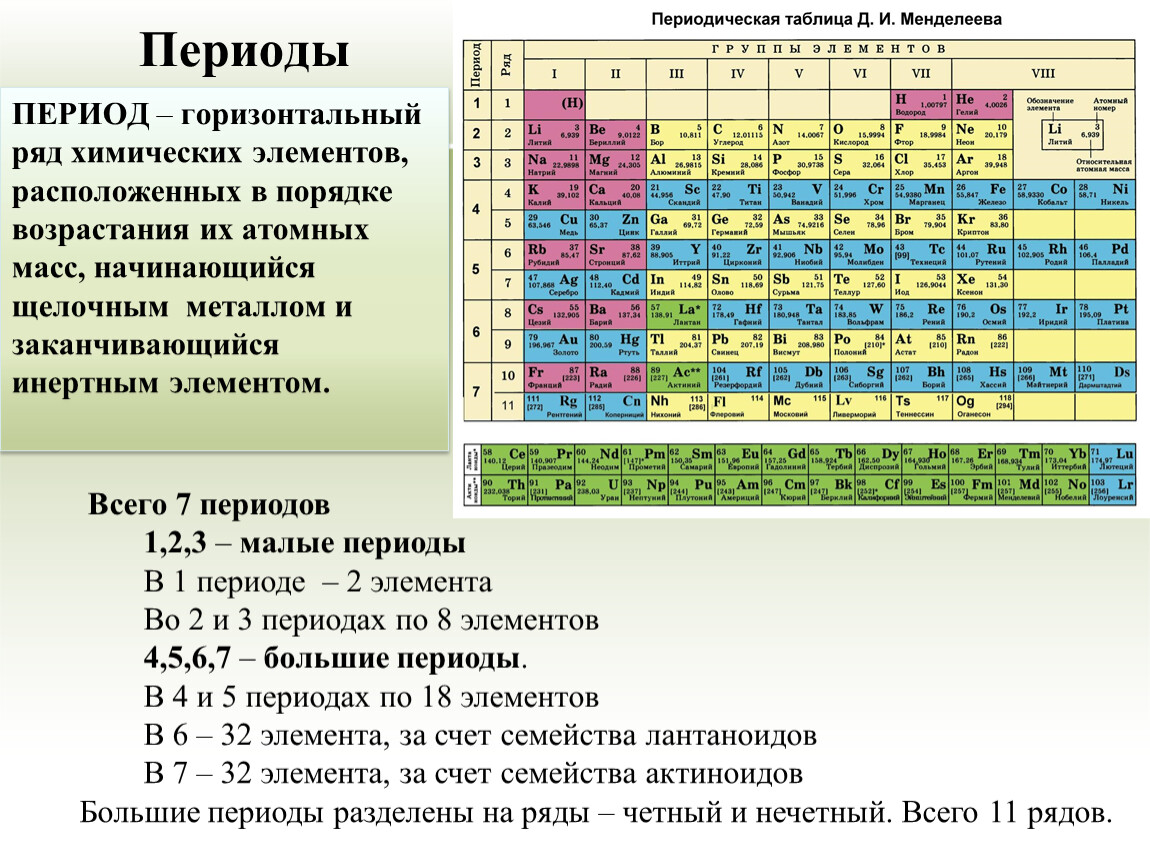
Итоговая контрольная работа по химии 9 класс
Итоговая контрольная работа 9 класс
Вариант 1
1. В ряду элементов О S Sе Те уменьшаются
1) радиусы атомов 3) неметаллические свойства
2) металлические свойства 4) число электронов на внешнем слое
2. Оксиду S(VI) соответствует кислота
1) H2SO4 2) H2S 3) H2SO3 4) K2SO4
3. Среди металлов Au, Hg, W, Na, Cu, Zn самым тугоплавким является
1) медь 2) натрий 3) золото 4) вольфрам
4. Вещества с молекулярной кристаллической решеткой
1) натрий и кислород 3)вода и кислород
2) водород и хлорид калия 4) графит и углекислый газ
5. Для взаимодействия 1 моль алюминия с
соляной кислотой потребуется ___ моль кислоты
Для взаимодействия 1 моль алюминия с
соляной кислотой потребуется ___ моль кислоты
1) 1 2) 2 3) 3 4) 4
6. Формула высшего оксида элемента, имеющего строение электронной оболочки 2,8,7
1) P2O3 2) SO3 3) Сl2O7 4) Al2O3
7. Ряд Zn(OH)2 , Н2СО3, NaOH соответственно представляет гидроксиды
1) основный, кислотный, амфотерный
2) основный, амфотерный, кислотный
3) амфотерный, кислотный, основный
4) кислотный, основный, амфотерный
8. Реакция водорода с оксидом меди (II) относится к реакциям
1) соединения 2) обмена 3) замещения 4) разложения
9. Наиболее энергично реагирует с водой
Наиболее энергично реагирует с водой
1) калий 2) литий 3) натрий 4) рубидий
10. Сумма коэффициентов в сокращённом ионном уравнении
Cu(OH)2 + HCl равна
1) 4 2) 5 3) 6 4) 8
11.Какой атом имеет такое же строение внешнего слоя как и ион Na+ ?
В ответе укажите русское название элемента, в именительном падеже.
12. И с соляной кислотой и с гидроксидом натрия будут взаимодействовать
1) KOH 2) H3PO4 3) Be(OH)2 4) SO3 5) ZnO 6) Al2O3
Ответ запишите в виде последовательности цифр.
13. Дополните
предложение. Продуктами взаимодействия калия с водой
являются гидроксид калия и _______________.
14. Восстановительными свойствами обладают
1) Na 0 2) Fe 3+ 3) Cu 0 4) F0 5) Ba2+
Ответ запишите в виде последовательности цифр.
15. Окислительно-восстановительными реакциями являются
1) 2Al(OH)3 Al2O3 + 3H2O
2) Fe2O3 + 3C 2Fе + 3CO
3) 2Na + H2 2NaH
4) LiOH + HCl LiCl + H2O
5) Zn + FeSO4 Fe + ZnSO4
Ответ запишите в виде последовательности цифр.
16. Объём водорода (н.у.), образовавшийся при взаимодействии 26 г цинка с раствором серной кислоты, составляет ______ л. В бланк ответа запишите число с точностью до сотых.
Итоговая контрольная работа 9 класс
Вариант 2
1. В ряду элементов Si P SCl
увеличиваются
В ряду элементов Si P SCl
увеличиваются
1) радиусы атомов 3) неметаллические свойства
2) металлические свойства 4) число энергетических уровней
2. Оксиду N(III) соответствует кислота
1) HNO2 2) HNO3 3) NH3 4) NaNO2
3. Среди металлов Au, Hg, W, Na, Cu, Zn очень мягкий, режется ножом
1) медь 2) натрий 3) золото 4) вольфрам
4. Вещества с металлической кристаллической решёткой
1) кремний и теллур 3) галлий и хлор
2) литий и азот 4) кальций и золото
5. При взаимодействии 3 моль цинка с серной кислотой образуется _____ моль водорода
1) 1 2) 2 3) 3 4) 4
6. Формула высшего оксида элемента, имеющего
строение электронной оболочки 2,8,5
Формула высшего оксида элемента, имеющего
строение электронной оболочки 2,8,5
1) P2O3 2) SO3 3) P2O5 4) Al2O3
7. Ряд Ве(ОH)2, Ba(OH)2, H3PO4 соответственно представляет гидроксиды
1) основный, амфотерный, кислотный
2) кислотный, основный, амфотерный
4) амфотерный, основный, кислотный
8. Необратимая химическая реакция произойдет при сливании растворов веществ, формулы которых:
1.KOH и NaCl 3.CuCl2 и KOH
2.MgCl2и HNO3 4.Al2(SO4)3и Сu(NO3)2
9. С разбавленной серной кислотой НЕ взаимодействует
1) ртуть 2) алюминий 3) цинк 4) железо
10. Сумма
коэффициентов в сокращённом ионном уравнении
Сумма
коэффициентов в сокращённом ионном уравнении
Fe(OH)3 + HNO3 равна
1) 4 2) 5 3) 6 4) 8
11.
Какой атом имеет такое же строение внешнего слоя как и ион Ca2+ ?В ответе укажите русское название элемента, в именительном падеже.
12. И с серной кислотой и с гидроксидом калия будут взаимодействовать
1) NaOH 2)Al(OH)3 3) HNO3 4) FeCl2 5) BeO 6) Zn(OH)2
Ответ запишите в виде последовательности цифр.
13. Дополните предложение. Продуктами взаимодействия натрия с водой являются водород и _______________ натрия.
14. Восстановительными свойствами обладают
1) Na + 2) Сu 0 3) Al 0 4) Ca0 5) Fe3+
Ответ запишите в виде последовательности цифр.
15. Окислительно-восстановительными реакциями являются
1) 4Li + O
2) 2Fe(OH)3 Fe2O3 + 3H2O
3) Mg + CuCl2 MgCl2 + Cu
4) ZnO + C Zn + CO
5) Ca(OH)2 + 2HNO3 Ca(NO3)2 + 2H2O
Ответ запишите в виде последовательности цифр.
16. Объём кислорода (н.у.), необходимый для окисления 25,6 г меди, составляет ______ л. В бланк ответа запишите число с точностью до сотых.
|
Отметки |
||
|
«3» |
«4» |
«5» |
|
Баллы |
||
|
7-10 |
11-20 |
21-23 |
Решение заданий
Часть 1
|
№ задания |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Вариант 1 |
3 |
1 |
4 |
3 |
3 |
3 |
3 |
3 |
4 |
3 |
|
Вариант 2 |
3 |
1 |
2 |
4 |
3 |
3 |
4 |
3 |
1 |
4 |
|
№ задания |
Вариант 1 | Вариант 2 |
|
11 |
НЕОН |
АРГОН |
|
12 |
356 |
256 |
|
13 |
ВОДОРОД |
ГИДРОКСИД |
|
14 |
13 |
234 |
|
15 |
235 |
134 |
|
16 |
89,6 |
4,48 |
В ряду o s se te уменьшается.
 Характеристика соединений элементов главной подгруппы VI группы
Характеристика соединений элементов главной подгруппы VI группы
химия, очень надо! как изменяются окислительные свойства в ряду элементов S—Se—Te—Po? ответ пояснить. и получил лучший ответ
Ответ от Џна Александровна Ткаченко[активный]
В подгруппе кислорода с возрастанием атомного номера увеличивается радиус атомов, уменьшается энергия ионизации, характеризующая металлические свойства элементов. Поэтому в ряду 0—S—Se—Te—Ро свойства элементов изменяются от неметаллических к металлическим. В обычных условиях кислород — типичный неметалл (газ) , а полоний — металл, похожий на свинец.
С увеличением атомного, номера элементов значение электроотрицательности элементов в подгруппе уменьшается. Отрицательная степень окисления становится все менее характерной. Окислительная степень окисления становится все менее характерной. Окислительная активность простых веществ в ряду 02—S-Se—Те снижается. Так, если сера и значительно слабее, селен непосредственно взаимодействует с водородом, то теллур с ним в реакцию не вступает.
По значению электроотрицательности кислород уступает только фтору, поэтому в реакциях со всеми остальными элементами проявляет исключительно окислительные свойства. Сера, селен и теллур по своим свойствам. относятся к группе окислителей-восстановителей. В реакциях с сильными восстановителями проявляют окислительные свойства, а при действии сильных окислителей. они окисляются, то есть проявляют восстановительные свойства.
Возможные валентности и степени окисления элементов шестой группы главной подгруппы с точки зрения строения атома.
Кислород, сера, селен, теллур и полоний составляют главную подгруппу VI группы. На внешнем энергетическом уровне атомов элементов данной подгруппы содержится по 6 электронов, которые имеют конфигурацию s2p4 и распределены по ячейкам следующим образом:
Ответ от 2 ответа
[гуру]
Привет! Вот подборка тем с ответами на Ваш вопрос: химия, очень надо! как изменяются окислительные свойства в ряду элементов S—Se—Te—Po? ответ пояснить.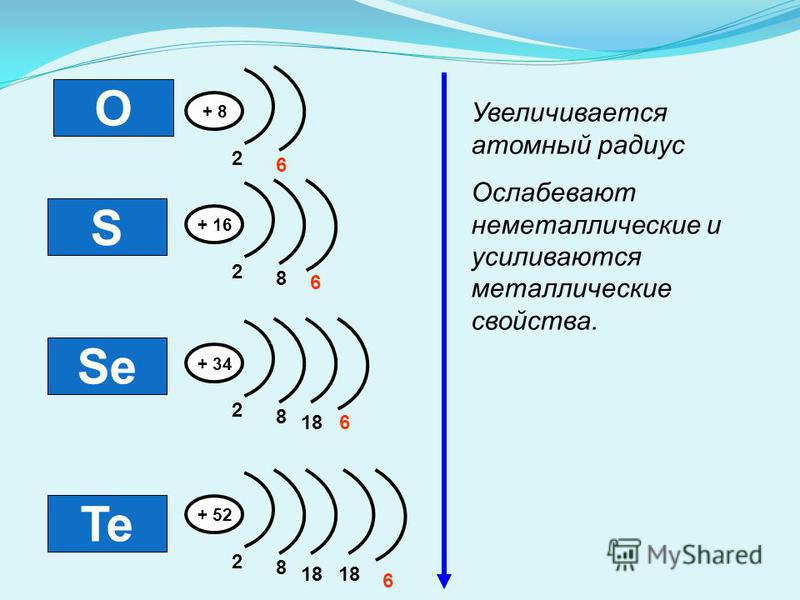
в ряду элементов O- S- Se с увеличением порядкового номера химического элемента электроотрицательность 1)увелич. 2)умен.
O-S-Se — уменьшается
С-N-O-F — увеличивается
Фтор — самый электроотрицательный элемент.
Задача 840.
Исходя из строения атомов серы, селена и теллура, указать, какие валентные состояния и степени окисленности характерны для этих элементов. Каковы формулы их высших гидроксидов? Ответ пояснить.
Решение:
Атомы S, Se и Te на внешнем энергетическом уровне содержат по шесть электронов (ns
2 р
4 )
– два на s-орбитали и четыре на р-орбитали. Графически это можно представить так:
Поэтому в стационарном состоянии эти элементы, имея по два неспаренных р-электрона, проявляют ковалентность
равную 2. У S, Se и Te число неспаренных электронов в атоме может быть увеличено путём перевода s- и р-электронов на d-подуровень внешнего слоя. В связи с этим, указанные элементы проявляют ковалентность
, равную не только 2, но также и 4, и 6. Так, при возбуждении атомов S, Se и Te р-электрон может быть переведён на свободную d-орбиталь и, тогда атом приобретает четыре неспаренных электрона. В связи с этим, указанные элементы проявляю ковалентность
равную 4. Графически это можно представить так:
Так, при возбуждении атомов S, Se и Te р-электрон может быть переведён на свободную d-орбиталь и, тогда атом приобретает четыре неспаренных электрона. В связи с этим, указанные элементы проявляю ковалентность
равную 4. Графически это можно представить так:
путём перевода, при возбуждении атома, р- и s-электронов на d-подуровень внешнего слоя, что приводит к образованию шести неспаренных электронов у атома во внешнем электронном слое. В связи с этим, указанные элементы проявляю ковалентность равную 6. Графически это можно представить так:
Таким образом, S, Se и Te в своих соединениях могут проявлять как отрицательную (-2), так и положительную степень окисления (+2, +4 и 6). В соединениях с металлами и водородом степень окисления равна -2, а в соединениях с неметаллами – она может быть +4 и +6. Поэтому в соединениях с кислородом данные элементы могут проявлять степень окисления равную как +4, так и +6, при этом образуются два вида оксидов с формулой.
Задача 841.
Дать сравнительную характеристику водородных соединений элементов главной подгруппы VI группы, указав и объяснив характер изменения: а) термической устойчивости; б) температур плавления и кипения; в) кислотно-основных и окислительно-восстановительных свойств. Какие из этих соединений могут быть получены взаимодействием водорода с соответствующим простым веществом?
Решение:
а) Прочность химической связи в молекулах водородных соединений элементов главной подгруппы VI группы падает в ряду
H
2 O — H
2 S — H
2 Se — H
2 Te
, что проявляется изменении энтальпии диссоциации молекул на атомы. Причины этого заключаются в том, что с увеличением размеров внешних электронных облаков атомов степень их перекрывания уменьшается. Поэтому при переходе от Н 2 О к Н 2 Те уменьшается степень перекрывания электронных облаков атомов водорода и атома элемента главной подгруппы VI группы, а область перекрывания располагается на большем расстоянии от ядра атома элемента (О, S, Se, Te) и сильнее экранируется возросшим числом промежуточных электронных слоёв. Кроме того, в ряду O — S — Se — Te электроотрицательность атома элемента уменьшается. Поэтому в молекуле Н 2 О электронное облако атома водорода смещается в сторону атома кислорода в наибольшей степени, а в молекулах Н 2 S. H 2 Se и Н 2 Те – всё меньше и меньше. Это также приводит к уменьшению перекрывания взаимодействующих электронных облаков и, тем самым, к ослаблению связи между атомами. С уменьшением прочности связи в молекулах водородных соединений элементов главной подгруппы VI группы падает устойчивость к нагреванию в ряду H 2 O — H 2 S — H 2 Se — H 2 Te.
Кроме того, в ряду O — S — Se — Te электроотрицательность атома элемента уменьшается. Поэтому в молекуле Н 2 О электронное облако атома водорода смещается в сторону атома кислорода в наибольшей степени, а в молекулах Н 2 S. H 2 Se и Н 2 Те – всё меньше и меньше. Это также приводит к уменьшению перекрывания взаимодействующих электронных облаков и, тем самым, к ослаблению связи между атомами. С уменьшением прочности связи в молекулах водородных соединений элементов главной подгруппы VI группы падает устойчивость к нагреванию в ряду H 2 O — H 2 S — H 2 Se — H 2 Te.
б) В ряду H 2 O — H 2 S — H 2 Se — H 2 Te температуры кипения и плавления изменяются весьма закономерно, они в данном ряду плавно возрастают, тогда как при переходе к Н 2 О – они резко возрастают. Это обусловлено ассоциацией молекул воды в результате возникновения между ними водородных связей.
Закономерное возрастание температур плавления и кипения в ряду H
2 O — H
2 S — H
2 Se — H
2 Te
объясняется увеличением радиусов атомов с возрастанием порядкового номера элемента. При этом возрастает поляризуемость молекул, что приводит к усилению межмолекулярного дисперсионного взаимодействия, т. е. к усилению их притяжения друг к другу (силы Ван-дер-ваальса
), что и обуславливает возрастание температур плавления и кипения (исключение составляет Н 2 О).
При этом возрастает поляризуемость молекул, что приводит к усилению межмолекулярного дисперсионного взаимодействия, т. е. к усилению их притяжения друг к другу (силы Ван-дер-ваальса
), что и обуславливает возрастание температур плавления и кипения (исключение составляет Н 2 О).
в) Кислотные свойства в ряду H 2 O — H 2 S — H 2 Se — H 2 Te закономерно усиливаются. Вода имеет очень маленькую степень диссоциации, потому что молекулы её образуют ассоциаты за счёт водородных связей, так что диссоциация молекулы Н 2 О требует значительной затраты в энергии. Поэтому вода типичный слабый электролит-амфолит , молекулы которого распадаются на ионы:
Н 2 О ↔ Н + + ОН —
H 2 O, H 2 S, H 2 Se, H 2 Te – типичные кислоты. Кислотные свойства в ряду закономерно усиливаются. Объясняется это тем, что в пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра. Такая закономерность объясняется увеличением числа электронных слоёв и растущим удалением внешних электронов от ядра. При переходе от H 2 S к H 2 Te уменьшается степень перекрывания электронных облаков атомов водорода с атомами S, Se и Те, а сама область перекрывания электронных облаков располагается на большем расстоянии от ядра атома элемента и сильнее экранируется возросшим числом промежуточных слоёв. Кроме того, в ряду S — Se — Te электроотрицательность атомов уменьшается. Это также приводит к уменьшению перекрывания взаимодействующих электронных облаков, и тем самым, к ослаблению связи между атомами. Таким образом, в ряду H
2 S — H
2 Se — H
2 Te
расстояние между атомами элемента и атомами водорода увеличивается, поэтому при растворении в воде их диссоциация по кислотному типу возрастает. Окислительная активность в ряду H
2 O — H
2 S — H
2 Se — H
2 Te
последовательно уменьшается, а восстановительные свойства – усиливаются. Объясняется это закономерным увеличением радиусов ионов ряду, что облегчает отдачу электронов. Поэтому кислород очень сильный окислитель, теллур – сильный восстановитель.
При переходе от H 2 S к H 2 Te уменьшается степень перекрывания электронных облаков атомов водорода с атомами S, Se и Те, а сама область перекрывания электронных облаков располагается на большем расстоянии от ядра атома элемента и сильнее экранируется возросшим числом промежуточных слоёв. Кроме того, в ряду S — Se — Te электроотрицательность атомов уменьшается. Это также приводит к уменьшению перекрывания взаимодействующих электронных облаков, и тем самым, к ослаблению связи между атомами. Таким образом, в ряду H
2 S — H
2 Se — H
2 Te
расстояние между атомами элемента и атомами водорода увеличивается, поэтому при растворении в воде их диссоциация по кислотному типу возрастает. Окислительная активность в ряду H
2 O — H
2 S — H
2 Se — H
2 Te
последовательно уменьшается, а восстановительные свойства – усиливаются. Объясняется это закономерным увеличением радиусов ионов ряду, что облегчает отдачу электронов. Поэтому кислород очень сильный окислитель, теллур – сильный восстановитель. В ряду H
2 O — H
2 S — H
2 Se — H
2 Te
усиливаются восстановительные свойства. При действии сильных окислителей они окисляются до диоксидов или до соответствующих кислот состава H 2 RO 3 или даже до H 2 RO 4 .
В ряду H
2 O — H
2 S — H
2 Se — H
2 Te
усиливаются восстановительные свойства. При действии сильных окислителей они окисляются до диоксидов или до соответствующих кислот состава H 2 RO 3 или даже до H 2 RO 4 .
Вода и сероводород могут быть получены непосредственным взаимодействием водорода с кислородом или серой при достаточно высоких температурах. H 2 Se и H 2 Te получают косвенным путём, например, действием на селениды или теллуриды сильными кислотами:
Na 2 Se + H 2 SO 4 = Na 2 SO 4 + H 2 Se;
Na 2 Te + H 2 SO 4 = Na 2 SO 4 + H 2 Te.
Задача 842.
Какое вещество легче окисляется: сульфид натрия или теллурид натрия? Ответ пояснить.
Решение:
В пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра. Такая закономерность объясняется увеличением числа электронных слоёв и растущим удалением внешних электронов от ядра. Поэтому ион Те 2- будет легче отдавать электроны, чем ион S 2- . Процесс отдачи электронов, сопровождающийся повышением степени окисления элемента, называется окислением. Вещество, в состав которого входит окисляющийся элемент, называется восстановителем. Таким образом, теллурид натрия будет легче окисляться, чем сульфид натрия.
Вещество, в состав которого входит окисляющийся элемент, называется восстановителем. Таким образом, теллурид натрия будет легче окисляться, чем сульфид натрия.
Дмитрий Иванович Менделеев открыл периодический закон, согласно которому свойства элементов и образуемых ими изменяются периодически. Данное открытие было графически отображено в таблице Менделеева. По таблице очень хорошо и наглядно видно, как свойства элементов изменяются по периоду, после чего повторяются в следующем периоде.
Для решения задания №2 ЕГЭ по химии нам всего лишь нужно понять и запомнить, какие свойства элементов в каких направлениях изменяются и как.
Всё это отображено на рисунке ниже.
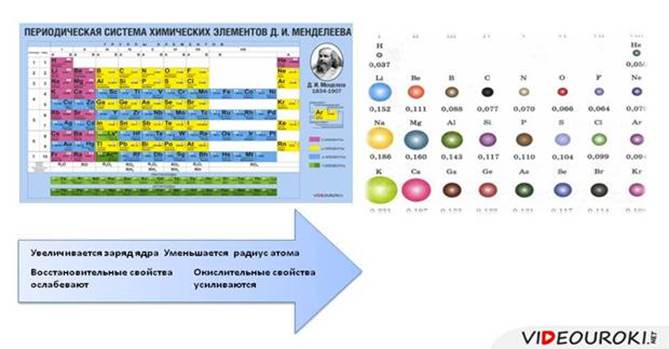
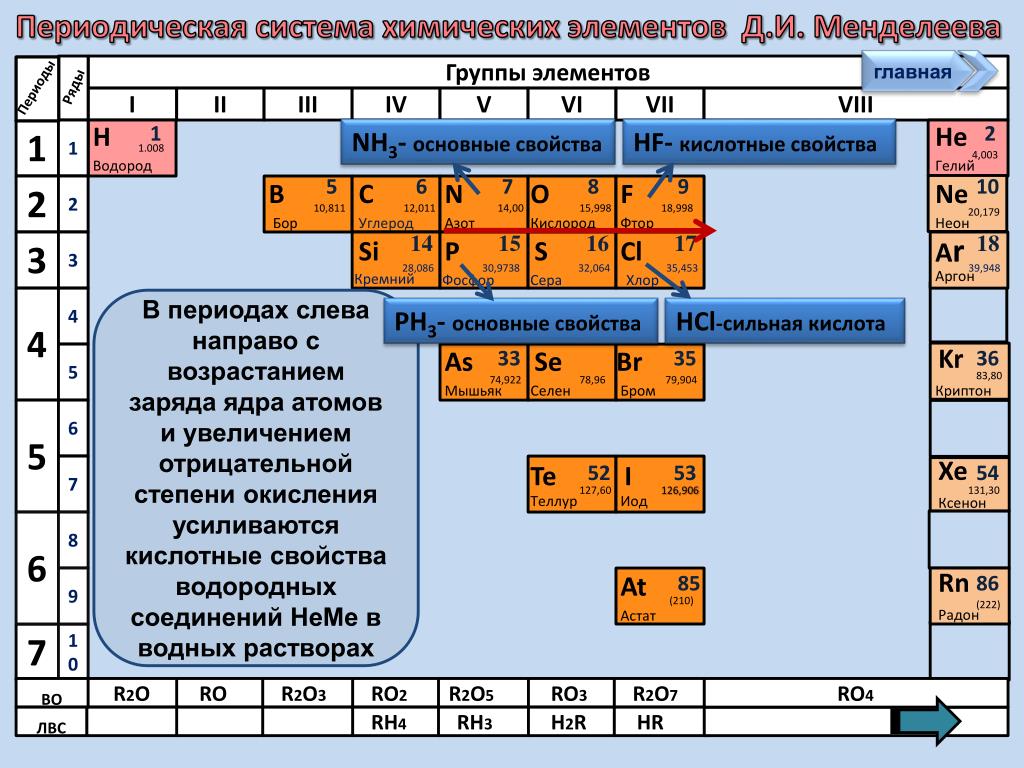
Слева направо растут электроотрицательность, неметаллические свойства, высшие степени окисления и т.д. А металлические свойства и радиусы уменьшаются.
Сверху вниз наоборот: растут металлические свойства и радиусы атомов, а электроотрицательность падает. Высшая степень окисления, соответствующая количеству электронов на внешнем энергетическом уровне, в этом направлении не меняется.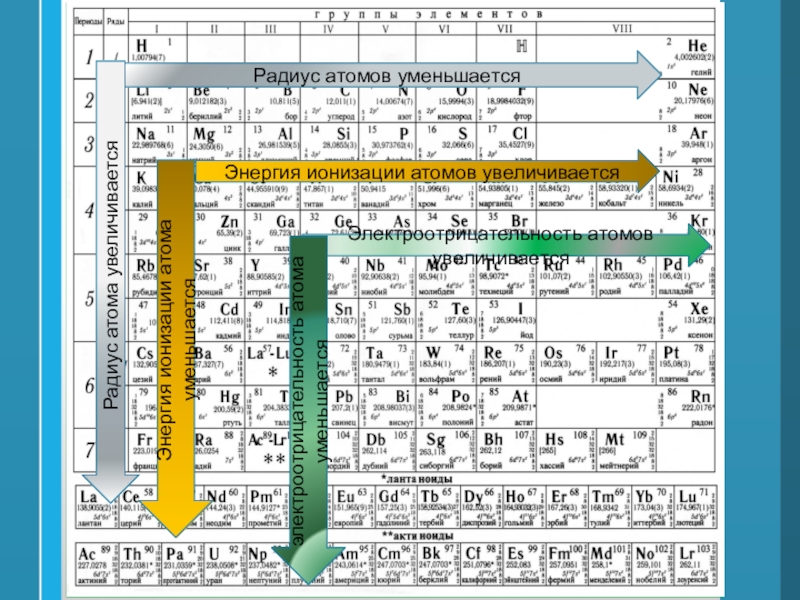
Разберём на примерах.
Пример 1.
В ряду элементов Na→Mg→Al→Si
А) уменьшаются радиусы атомов;
Б) уменьшается число протонов в ядрах атомов;
В) увеличивается число электронных слоёв в атомах;
Г) уменьшается высшая степень окисления атомов;
Если посмотреть в таблицу Менделеева, то мы увидим, что все элементы данного ряда находятся в одном периоде и перечислены в том порядке, как они стоят в таблице с лева направо. Что бы ответить на вопрос такого рода нужно просто знать несколько закономерностей изменений свойств в периодической таблице. Так слева направо по периоду металлические свойства падают, неметаллические растут, электроотрицательность растёт, энергия ионизации растёт, радиус атомов уменьшается. По группе сверху вниз металлические и восстановительные свойства растут, электроотрицательность падает, энергия ионизации уменьшается, радиус атомов растёт.
Если вы были внимательны, то уже поняли, что в данном случае уменьшаются радиусы атомов. Ответ А.
Ответ А.
Пример 2.
В порядке усиления окислительных свойств элементы расположены в ряду:
А. F→O→N
Б. I→Br→Cl
В. Cl→S→P
Г. F→Cl→Br
Как вы знаете, в периодической таблице Менделеева окислительные свойства растут слева направо по периоду и снизу вверх по группе. В варианте Б как раз приведены элементы одной группы в порядке снизу вверх. Значит Б подходит.
Пример 3.
Валентность элементов в высшем оксиде увеличивается в ряду:
А. Cl→Br→I
Б. Cs→K→Li
В. Cl→S→P
Г. Al→C→N
В высших оксидах элементы проявляют свою высшую степень окисления, которая будет совпадать с валентностью. А высшая степень окисления растёт слева направо по таблице. Смотрим: в первом и втором вариантах нам даны элементы, находящиеся в одних группах, там высшая степень окисления и соответственно валентность в оксидах не меняется. Cl→S→P – расположены справа налево, то есть у них наоборот валентность в высшем оксиде будет падать. А вот в ряду Al→C→N элементы расположены слева – направо, валентность в высшем оксиде увеличивается у них. Ответ: Г
Ответ: Г
Пример 4.
В ряду элементов S→Se→Te
А) увеличивается кислотность водородных соединений;
Б) увеличивается высшая степень окисления элементов;
В) увеличивается валентность элементов в водородных соединениях;
Г) уменьшается число электронов на внешнем уровне;
Сразу смотрим на расположение этих элементов в таблице Менделеева. Сера, селен и теллур находятся в одной группе, одной подгруппе. Приведены в порядке сверху вниз. Смотрим еще раз на диаграмму выше. Сверху вниз в периодической таблице растут металлические свойства, растут радиусы, падает электроотрицательность, энергия ионизации и неметаллические свойства, количество электронов на внешнем уровне не меняется. Вариант Г сразу исключаем. Если число внешних электронов не меняется, то валентные возможности и высшая степень окисления тоже не меняется, Б и В — исключаем.
Остаётся вариант А. Проверяем для порядка. По схеме Косселя сила безкислородных кислот возрастает с уменьшением степени окисления элемента и увеличением радиуса его иона.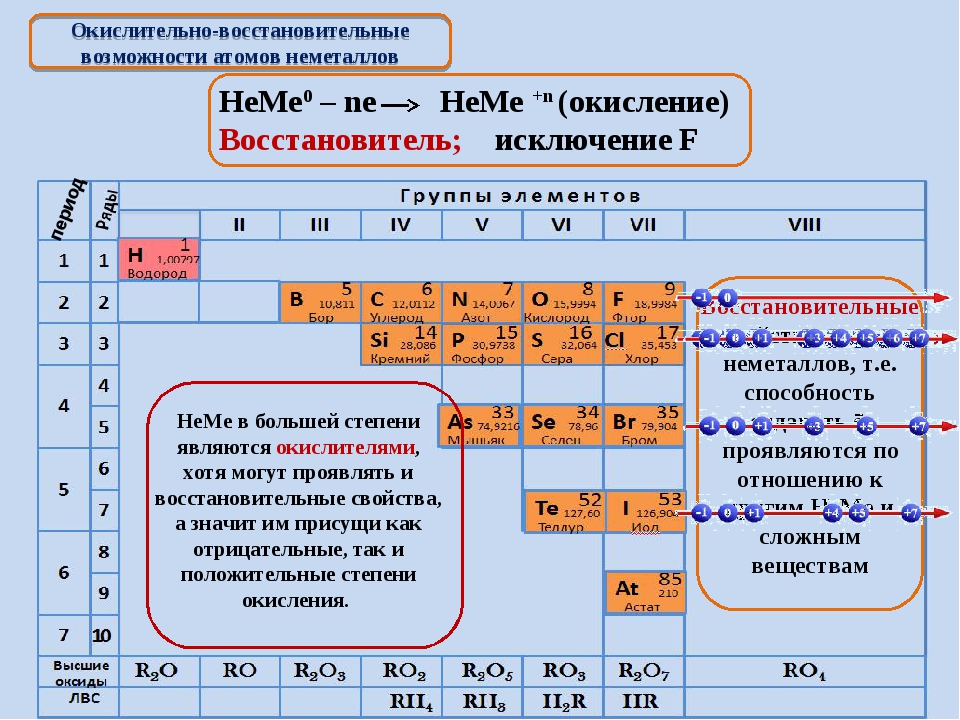 Степень окисления у всех трёх элементов одинаковая в водородных соединениях, а вот радиус сверху вниз растёт, значит и сила кислот растёт.
Степень окисления у всех трёх элементов одинаковая в водородных соединениях, а вот радиус сверху вниз растёт, значит и сила кислот растёт.
Ответ – А.
Пример 5.
В порядке ослабления основных свойств оксиды расположены в ряду:
А. Na 2 O→K 2 O→Rb 2 O
Б. Na 2 O→MgO→Al 2 O 3
В. BeO→BaO→CaO
Г. SO 3 →P 2 O 5 →SiO 2
Основные свойства оксидов ослабевают синхронно с ослабление металлических свойств элементов их образующих. А Ме- свойства ослабевают слева направо или снизу вверх. Na, Mg и Al как раз располагаются слева направо. Ответ Б.
В ряду элементов o s se te увеличивается. Общие закономерности изменения свойств простых веществ
Введение
Учебное пособие по химии халькогенов — второе в
серии, посвященной химии элементов главных
подгрупп периодической системы Д.И.Менделеева.
Оно написано на основе курса лекций по
неорганической химии, читаемого в МГУ на
протяжении последних 10 лет академиком
Ю.Д.Третьяковым и профессором В. П.Зломановым.
П.Зломановым.
В отличие от ранее выпущенных методических разработок в пособии представлен новый фактический материал (катенация, многообразие оксокислот халькогенов (VI) и т.д.), дано современное объяснение закономерностей изменения строения и свойств соединений халькогенов с использованием представлений квантовой химии, включая метод молекулярных орбиталей, релятивистский эффект и т.д. Материал пособия отобран с целью наглядной иллюстрации взаимосвязи теоретического курса и практических занятий по неорганической химии.
[предыдущий раздел] [содержание]§ 1. Общая характеристика халькогенов (Э).
К элементам VI главной подгруппы (или 16-ой группы
по новой номенклатуре ЮПАК) периодической
системы элементов Д.И.Менделеева относятся
кислород (О), сера (S), селен (Se), теллур (Te) и полоний
(Ро). Групповое название этих элементов — халькогены
(термин «халькоген»
происходит от
греческих слов «chalkos»-медь и «genos»-
рожденный), то есть «рождающие медные руды»,
обусловлено тем, что в природе они встречаются
чаще всего в форме соединений меди (сульфидов,
оксидов, селенидов и т. д.).
д.).
В основном состоянии атомы халькогенов имеют электронную конфигурацию ns 2 np 4 с двумя неспаренными р-электронами. Они принадлежат к четным элементам. Некоторые свойства атомов халькогенов представлены в табл.1.
При переходе от кислорода к полонию размер атомов и их возможные координационные числа увеличиваются, а энергия ионизации (Е ион) и электроотрицательность (ЭО) уменьшаются. По электроотрицательности (ЭО) кислород уступает лишь атому фтора, а атомы серы и селена также азоту, хлору, брому; кислород, сера и селен относятся к типичным неметаллам.
В соединениях серы, селена, теллура с кислородом и галогенами реализуются степени окисления +6, +4 и +2. С большинством других элементов они образуют халькогениды, где находятся в степени окисления -2.
Таблица 1.Свойства атомов элементов VI группы.
|
Свойства |
|||||
| Атомный номер | |||||
| Число стабильных изотопов | |||||
| Электронная конфигурация |
3d 10 4s 2 4p 4 |
4d 10 5s 2 5p 4 |
4f 14 5d 10 6s 2 6p 4 |
||
| Ковалентный радиус, Е | |||||
| Первая энергия ионизации, Е ион, кДж/моль | |||||
| Элекроотрицательность (Полинг) | |||||
| Сродство атома к электрону, кДж/моль |
Устойчивость соединений с высшей степенью
окисления уменьшается от теллура к полонию, для
которого известны соединения со степенью
окисления 4+ и 2+ (например, PoCl 4 , PoCl 2 , PoO 2). Это может быть связано с увеличением прочности
связи 6s 2 электронов с ядром из-за релятивистского
эффекта
. Суть его заключается в увеличении
скорости движения и соответственно массы
электронов у элементов с большим зарядом ядра
(Z>60). «Утяжеление» электронов приводит к
уменьшению радиуса и повышению энергии связи
6s-электронов с ядром. Более наглядно этот эффект
проявляется в соединениях висмута, элемента V
группы, и подробнее рассмотрен в соответствующем
пособии.
Это может быть связано с увеличением прочности
связи 6s 2 электронов с ядром из-за релятивистского
эффекта
. Суть его заключается в увеличении
скорости движения и соответственно массы
электронов у элементов с большим зарядом ядра
(Z>60). «Утяжеление» электронов приводит к
уменьшению радиуса и повышению энергии связи
6s-электронов с ядром. Более наглядно этот эффект
проявляется в соединениях висмута, элемента V
группы, и подробнее рассмотрен в соответствующем
пособии.
Свойства кислорода, как и других элементов 2-го
периода, отличаются от свойств своих более
тяжелых аналогов. Из-за высокой электронной
плотности и сильного межэлектронного
отталкивания сродство к электрону и прочность
связи Э- Э у кислорода меньше, чем у серы. Связи
металл-кислород (М- О) являются более ионными, чем
связи М- S, М- Se и т.д. В силу меньшего радиуса атом
кислорода в отличие от серы способен
образовывать прочные -связи (р — р) с другими
атомами — например, кислородом в молекуле озона,
углеродом, азотом, фосфором. При переходе от
кислорода к сере прочность одинарной -связи растет из-за уменьшения
межэлектронного отталкивания, а прочность -связи уменьшается, что связано с
ростом радиуса и уменьшением взаимодействия
(перекрывания) р-атомных орбиталей. Таким
образом, если для кислорода характерно
образование кратных ( +) связей, то для серы и ее аналогов —
образование одинарных цепных связей — Э- Э- Э (см. §
2.1).
При переходе от
кислорода к сере прочность одинарной -связи растет из-за уменьшения
межэлектронного отталкивания, а прочность -связи уменьшается, что связано с
ростом радиуса и уменьшением взаимодействия
(перекрывания) р-атомных орбиталей. Таким
образом, если для кислорода характерно
образование кратных ( +) связей, то для серы и ее аналогов —
образование одинарных цепных связей — Э- Э- Э (см. §
2.1).
В свойствах серы, селена и теллура прослеживается больше аналогий, чем с кислородом и полонием. Так, в соединениях с отрицательными степенями окисления от серы к теллуру увеличиваются восстановительные, а в соединениях с положительными степенями окисления — окислительные свойства.
Полоний — радиоактивный элемент. Наиболее стабильный изотоп получают в результате бомбардировки ядер нейтронами и последующего -распада :
( 1/2 = 138.4 дня).
Распад полония
сопровождается выделением большого количества
энергии. Поэтому полоний и его соединения
разлагают растворители и сосуды, в которых
хранятся, а изучение соединений Ро представляет
значительные трудности.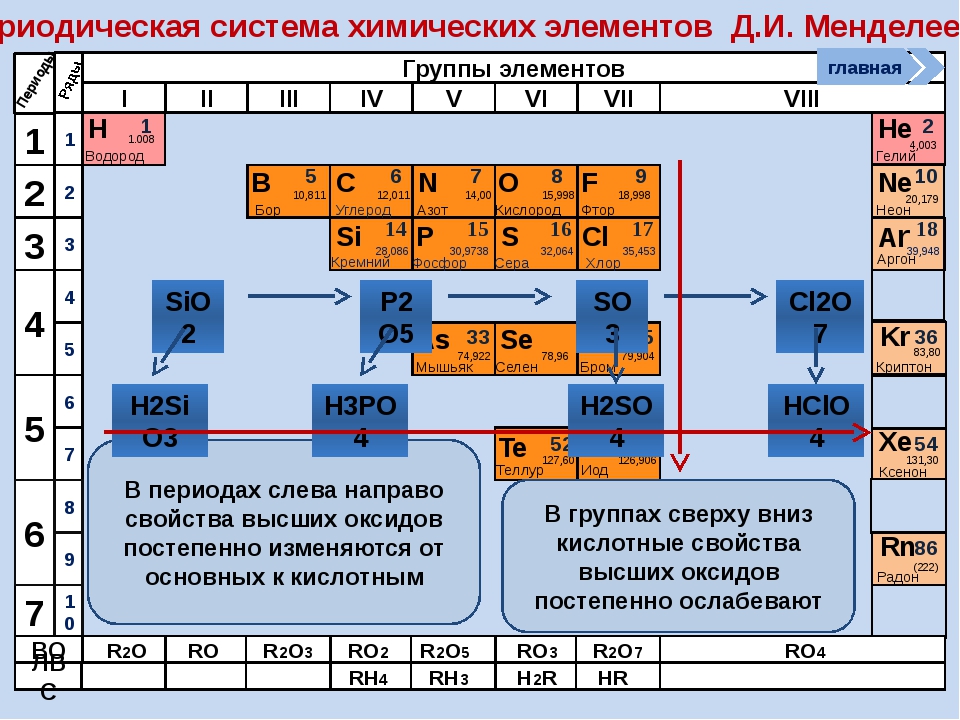
§ 2. Физические свойства простых
веществ.
Таблица 2. Физические свойства простых веществ.
Плотность |
Температуры, о С |
Теплота атомизации, кДж/моль |
Электрическое Сопротивление(25 о С), Ом. см |
|||
плавления |
||||||
| S | ||||||
| Sе | гекс. | |||||
1.3 . 10 5 (жидк. |
||||||
| Те гекс. | гекс. | |||||
| Ро | ||||||
С ростом ковалентного радиуса в ряду O- S- Se- Te- Po
межатомное взаимодействие и соответствующие
температуры фазовых переходов, а также энергии
атомизации
, то есть энергии перехода твердых
простых веществ в состояние одноатомного газа,
увеличиваются. Изменение свойств халькогенов от
типичных неметаллов к металлам связан с
уменьшением энергии ионизации (табл.1) и
особенностями строения. Кислород и сера —
типичные диэлектрики
, то есть вещества, не
проводящие электрический ток. Селен и теллур — полупроводники
[вещества, электрофизические свойства которых
являются промежуточным между свойствами
металлов и неметаллов (диэлектриков).
Элктропроводность металлов уменьшается, а
полупроводников увеличивается с повышением
температуры, что обусловлено особенностями их
электронного строения)] , а полоний — металл.
§ 2.1. Катенация халькогенов. Аллотропия и полиморфизм .
Одно из характерных свойств атомов халькогенов — их способность связываться друг с другом в кольца или цепи. Это явление называют катенацией . Причина его связана с различной прочностью одинарных и двойных связей. Рассмотрим это явление на примере серы (табл.3).
Таблица 3. Энергии одинарных и двойных связей (кДж/моль).
Из приведенных значений следует, что
образование двух одинарных
-связей
для серы вместо одной двойной ( +) связано с выигрышем в энергии (530 —
421 = 109 Дж/моль). Для кислорода, напротив, одна
двойная связь энергетически предпочтительнее
(494-292=202 кДж/моль), чем две одинарные. Уменьшение
прочности двойной связи при переходе от О к S
связано с увеличением размеров р-орбиталей и
уменьшением их перекрывания. Таким образом для
кислорода катенация ограничивается небольшим
числом нестойких соединений: O 3 озон, O 4 F 2 .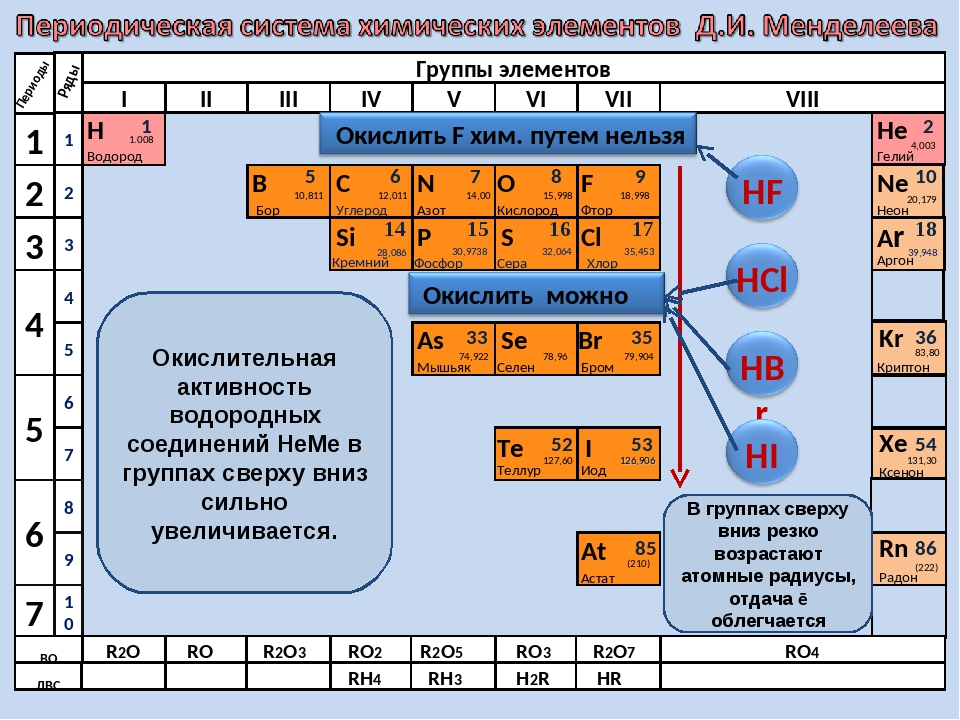
С катенацией сязаны аллотропия и полиморфизм простых веществ. Аллотропия — это способность одного и того же элемента существовать в разных молекулярных формах. Явление аллотропии относят к молекулам, содержащим разное количество атомов одного и того же элемента, например, О 2 и О 3 , S 2 и S 8 , Р 2 и Р 4 и т.д. Понятие полиморфизма относится только к твердым веществам. Полиморфизм — способность твердого вещества с одним и тем же составом иметь разное пространственное строение. Примерами полиморфных модификаций являются сера моноклинная и сера ромбическая, состоящие из одинаковых циклов S 8 , но размещенных в пространстве по-разному (см. § 2.3). Рассмотрим сначала свойства кислорода и его аллотропной формы — озона, а затем полиморфизм серы, селена и теллура.
Дмитрий Иванович Менделеев открыл периодический закон, согласно которому свойства элементов и образуемых ими изменяются периодически. Данное открытие было графически отображено в таблице Менделеева. По таблице очень хорошо и наглядно видно, как свойства элементов изменяются по периоду, после чего повторяются в следующем периоде.
Данное открытие было графически отображено в таблице Менделеева. По таблице очень хорошо и наглядно видно, как свойства элементов изменяются по периоду, после чего повторяются в следующем периоде.
Для решения задания №2 ЕГЭ по химии нам всего лишь нужно понять и запомнить, какие свойства элементов в каких направлениях изменяются и как.
Всё это отображено на рисунке ниже.
Слева направо растут электроотрицательность, неметаллические свойства, высшие степени окисления и т.д. А металлические свойства и радиусы уменьшаются.
Сверху вниз наоборот: растут металлические свойства и радиусы атомов, а электроотрицательность падает. Высшая степень окисления, соответствующая количеству электронов на внешнем энергетическом уровне, в этом направлении не меняется.
Разберём на примерах.
Пример 1.
В ряду элементов Na→Mg→Al→Si
А) уменьшаются радиусы атомов;
Б) уменьшается число протонов в ядрах атомов;
В) увеличивается число электронных слоёв в атомах;
Г) уменьшается высшая степень окисления атомов;
Если посмотреть в таблицу Менделеева, то мы увидим, что все элементы данного ряда находятся в одном периоде и перечислены в том порядке, как они стоят в таблице с лева направо. Что бы ответить на вопрос такого рода нужно просто знать несколько закономерностей изменений свойств в периодической таблице. Так слева направо по периоду металлические свойства падают, неметаллические растут, электроотрицательность растёт, энергия ионизации растёт, радиус атомов уменьшается. По группе сверху вниз металлические и восстановительные свойства растут, электроотрицательность падает, энергия ионизации уменьшается, радиус атомов растёт.
Что бы ответить на вопрос такого рода нужно просто знать несколько закономерностей изменений свойств в периодической таблице. Так слева направо по периоду металлические свойства падают, неметаллические растут, электроотрицательность растёт, энергия ионизации растёт, радиус атомов уменьшается. По группе сверху вниз металлические и восстановительные свойства растут, электроотрицательность падает, энергия ионизации уменьшается, радиус атомов растёт.
Если вы были внимательны, то уже поняли, что в данном случае уменьшаются радиусы атомов. Ответ А.
Пример 2.
В порядке усиления окислительных свойств элементы расположены в ряду:
А. F→O→N
Б. I→Br→Cl
В. Cl→S→P
Г. F→Cl→Br
Как вы знаете, в периодической таблице Менделеева окислительные свойства растут слева направо по периоду и снизу вверх по группе. В варианте Б как раз приведены элементы одной группы в порядке снизу вверх. Значит Б подходит.
Пример 3.
Валентность элементов в высшем оксиде увеличивается в ряду:
А. Cl→Br→I
Cl→Br→I
Б. Cs→K→Li
В. Cl→S→P
Г. Al→C→N
В высших оксидах элементы проявляют свою высшую степень окисления, которая будет совпадать с валентностью. А высшая степень окисления растёт слева направо по таблице. Смотрим: в первом и втором вариантах нам даны элементы, находящиеся в одних группах, там высшая степень окисления и соответственно валентность в оксидах не меняется. Cl→S→P – расположены справа налево, то есть у них наоборот валентность в высшем оксиде будет падать. А вот в ряду Al→C→N элементы расположены слева – направо, валентность в высшем оксиде увеличивается у них. Ответ: Г
Пример 4.
В ряду элементов S→Se→Te
А) увеличивается кислотность водородных соединений;
Б) увеличивается высшая степень окисления элементов;
В) увеличивается валентность элементов в водородных соединениях;
Г) уменьшается число электронов на внешнем уровне;
Сразу смотрим на расположение этих элементов в таблице Менделеева. Сера, селен и теллур находятся в одной группе, одной подгруппе. Приведены в порядке сверху вниз. Смотрим еще раз на диаграмму выше. Сверху вниз в периодической таблице растут металлические свойства, растут радиусы, падает электроотрицательность, энергия ионизации и неметаллические свойства, количество электронов на внешнем уровне не меняется. Вариант Г сразу исключаем. Если число внешних электронов не меняется, то валентные возможности и высшая степень окисления тоже не меняется, Б и В — исключаем.
Приведены в порядке сверху вниз. Смотрим еще раз на диаграмму выше. Сверху вниз в периодической таблице растут металлические свойства, растут радиусы, падает электроотрицательность, энергия ионизации и неметаллические свойства, количество электронов на внешнем уровне не меняется. Вариант Г сразу исключаем. Если число внешних электронов не меняется, то валентные возможности и высшая степень окисления тоже не меняется, Б и В — исключаем.
Остаётся вариант А. Проверяем для порядка. По схеме Косселя сила безкислородных кислот возрастает с уменьшением степени окисления элемента и увеличением радиуса его иона. Степень окисления у всех трёх элементов одинаковая в водородных соединениях, а вот радиус сверху вниз растёт, значит и сила кислот растёт.
Ответ – А.
Пример 5.
В порядке ослабления основных свойств оксиды расположены в ряду:
А. Na 2 O→K 2 O→Rb 2 O
Б. Na 2 O→MgO→Al 2 O 3
В. BeO→BaO→CaO
Г. SO 3 →P 2 O 5 →SiO 2
Основные свойства оксидов ослабевают синхронно с ослабление металлических свойств элементов их образующих. А Ме- свойства ослабевают слева направо или снизу вверх. Na, Mg и Al как раз располагаются слева направо. Ответ Б.
А Ме- свойства ослабевают слева направо или снизу вверх. Na, Mg и Al как раз располагаются слева направо. Ответ Б.
химия, очень надо! как изменяются окислительные свойства в ряду элементов S—Se—Te—Po? ответ пояснить. и получил лучший ответ
Ответ от Џна Александровна Ткаченко[активный]
В подгруппе кислорода с возрастанием атомного номера увеличивается радиус атомов, уменьшается энергия ионизации, характеризующая металлические свойства элементов. Поэтому в ряду 0—S—Se—Te—Ро свойства элементов изменяются от неметаллических к металлическим. В обычных условиях кислород — типичный неметалл (газ) , а полоний — металл, похожий на свинец.
С увеличением атомного, номера элементов значение электроотрицательности элементов в подгруппе уменьшается. Отрицательная степень окисления становится все менее характерной. Окислительная степень окисления становится все менее характерной. Окислительная активность простых веществ в ряду 02—S-Se—Те снижается. Так, если сера и значительно слабее, селен непосредственно взаимодействует с водородом, то теллур с ним в реакцию не вступает.
По значению электроотрицательности кислород уступает только фтору, поэтому в реакциях со всеми остальными элементами проявляет исключительно окислительные свойства. Сера, селен и теллур по своим свойствам. относятся к группе окислителей-восстановителей. В реакциях с сильными восстановителями проявляют окислительные свойства, а при действии сильных окислителей. они окисляются, то есть проявляют восстановительные свойства.
Возможные валентности и степени окисления элементов шестой группы главной подгруппы с точки зрения строения атома.
Кислород, сера, селен, теллур и полоний составляют главную подгруппу VI группы. На внешнем энергетическом уровне атомов элементов данной подгруппы содержится по 6 электронов, которые имеют конфигурацию s2p4 и распределены по ячейкам следующим образом:
Ответ от 2 ответа
[гуру]
Привет! Вот подборка тем с ответами на Ваш вопрос: химия, очень надо! как изменяются окислительные свойства в ряду элементов S—Se—Te—Po? ответ пояснить.
в ряду элементов O- S- Se с увеличением порядкового номера химического элемента электроотрицательность 1)увелич. 2)умен.
O-S-Se — уменьшается
С-N-O-F — увеличивается
Фтор — самый электроотрицательный элемент.
которых каждый атом селена связан с двумя другими ковалентными -связями.
Цепочки расположены параллельно друг другу. Между однотипными атомами соседних цепочек имеет место межмолекулярное взаимодействие. Температура плавления и кипения серого Se соответственно равны 219о С и 685о С. Фото-
проводимость серого селена можно объяснить тем, что под действие падающе-
го света, электроны приобретают энергию, позволяющую им преодолеть не-
большой барьер между валентной зоной и зоной проводимости, что и использу-
ется в фотоэлементах. Электропроводность селена в темноте очень мала, но сильно повышается на свету. Менее устойчивыми модификациями селена яв-
ляются: красный селен, который имеет в своей структуре восьмичленные коль-
ца, как у серы, и черный стекловидный селен, в котором спиральные цепи пе-
репутаны.
Теллур имеет две модификации: аморфную темно-коричневую и сереб-
ристо-серую, со структурой, похожей на структуру серого селена. Температура плавления и кипения Te – 450о С и 990о С.
Простые вещества способны проявлять восстановительные и окис-
лительные свойства.
В ряду S, Se, Te восстановительная способность простых веществ усиливается, а окислительная активность уменьшается.
Реакция S(т.) + h3 Se (г.) = h3 S (г.) + Se (серый) показывает, что сера бо-
лее сильный окислитель, чем селен.
С металлами селен и теллур реагируют при нагревании, образуя селени-
ды и теллуриды.
2Cu + Se = Cu2 Se,
2Ag + Te = Ag2 Te.
Селен и теллур окисляются кислородом с образованием диоксидов
ЭО 2 только при нагревании. На воздухе оба неметалла устойчивы.
При окислении Se и Te концентрированными азотной и серной кислотой получаются селенистая и теллуристая кислоты.
Э + 2h3 SO4 = h3 ЭO3 + 2 SO2 + h3 O
При кипячении в растворах щелочей селен и теллур диспропорционируют.
3Se + 6KOH = 2K2 Se + K2 SeO3 +3h3 O
Соединения селена и теллура
Селениды и теллуриды
Щелочные металлы, медь и серебро образуют селениды и теллуриды нормальной стехиометрии, и их можно рассматривать как соли селено- и тел-
луроводородных кислот. Известны природные селениды и теллуриды:
Cu2 Se, PbSe ,Cu2 Te, Ag2 Te, PbTe.
Соединения селена и теллура с водородом: h3 Sе и h3 Te – бесцветные токсичные газы с очень неприятным запахом. Растворяются в воде с образова-
нием слабых кислот. В ряду h3 S, h3 Se, h3 Te увеличивается сила кислот изза ослабления связи Н–Э, обусловленного увеличением размера атома. В этом же ряду усиливаются и восстановительные свойства. В водных растворах h3 Se и
h3 Te быстро окисляются кислородом воздуха.
2h3 Se + O2 = 2 Se + 2h3 O.
Оксиды и кислородные кислоты селена и теллура
Диоксиды селена и теллура – кристаллические вещества.
Оксид SeO2 – хорошо растворяется в воде, образуя селенистую кислоту
h3
SeO3
. Оксид TeO2
плохо растворяется в воде. Оба оксида хорошо растворя-
Оксид TeO2
плохо растворяется в воде. Оба оксида хорошо растворя-
ются в щелочи, например:
SeO2 + 2NaOH = Na2 SeO3 + h3 O
Кислота H 2 SeO 3 – твердое белое вещество.
Теллуристую кислоту описывают формулой TeO 2 . xH 2 O , указываю-
щую на ее переменный состав.
Селенистая и теллуристая кислоты – слабые, теллуристая проявляет амфотерность. Селенистая кислота хорошо растворима, а теллуристая сущест-
вует только в разбавленном растворе.
Селениты и теллуриты похожи на сульфиты. При действии на них сильных кислот получаются селенистая и теллуристая кислоты .
Степень окисления (+4) у селена и теллура устойчива, но сильные окислители могут окислить соединения Se (+4) и Te (+4) до степени окисления
5h3 SeO3 + 2KMnO4 + 3h3 SO4 = 5h3 SeO4 + 2MnSO4 + K2 SO4 +3h3 O
Восстановительные свойства соединений Se (+4) и Te (+4) выражены за-
метно слабее, чем у серы (+4). Поэтому возможны реакции типа: h3 ЭO3 + 2SO2 + h3 O = Э + 2h3 SO4
Этим способом можно выделить осадки красного селена и черного
Селеновая кислота H 2 SeO 4 в чистом виде – это бесцветное твердое ве-
щество, хорошо растворимое в воде. Селеновая кислота по силе близка к
Селеновая кислота по силе близка к
серной. а теллуровая — слабая кислота.
Теллуровая кислота имеет формулу H6 TeO6 . Все шесть водородных
атомов могут быть замещены на атомы металлов, как, например, в солях:
Ag6 TeO6 , Hg3 TeO6 . Это слабая кислота.
Селеновая и теллуровая кислоты медленно действующие, но силь-
ные окислители, более сильные, чем серная кислота.
В концентрированной селеновой кислоте растворяется золото: 2Au + 6 h3 SeO4 = Au2 (SeO4 )3 + 3 SeO2 +6 h3 O
Смесь концентрированных селеновой и соляной кислот растворяет пла-
Pt + 2 h3 SeO4 + 6HCl = h3 + 2 SeO2 +4 h3 O
Триоксид TeO 3 – твердое желтое вещество, не растворяется в воде, раз-
бавленных кислотах и основаниях. TeO3 получают разложением ортотеллуро-
вой кислоты при нагревании.
Триоксид SeO 3 – твердое белое вещество, образованное молекулами
тримера (SeO3 )3 . Триоксид селена хорошо растворяется в воде, обладает силь-
ными окислительными свойствами. SeO3
получают, вытесняя его из селеновой кислоты триоксидом серы.
SeO3
получают, вытесняя его из селеновой кислоты триоксидом серы.
Галогениды селена и теллура. Известно много галогенидов селена и теллура (ЭF6 , ЭF4 , SeF2 , TeCl2 ), их получают прямым синтезом из простых ве-
Заключение
VIА-подгруппу образуют р-элементы: O, S, Se, Te, Po.
Все они неметаллы, кроме Po.
Общая формула валентных электронов: ns 2 np 4 .
Элементы VIА-подгруппы часто объединяют под общим названием «халь-
когены» , что означает «образующие руды».
Наиболее характерные степени окисления у S, Se, Te: -2, +4, +6.
Минимальная степень окисления (–2) является устойчивой у всех эле-
У серы из положительных степеней окисления более устойчива +6.
У Se, Te – наиболее устойчивой является степень окисления +4.
Сера в природе встречается в виде простого вещества, в виде сульфидных и сульфатных минералов. В сульфидных рудах в незначительных количествах присутствуют селениды и теллуриды.
Простые вещества способны проявлять и окислительные и восстано-
вительные свойства.
В ряду S, Se, Te восстановительные свойства простых веществ усиливается,
а окислительная активность уменьшается.
Сера, селен и теллур реагируют с металлами с образованием сульфидов, се-
ленидов и теллуридов, выступая как окислители.
Сера селен и теллур окисляются кислородом с образованием диоксидов ЭО2 .
В степени окисления (–2) все элементы образуют слабые кислоты типа
Н2 Э.
В ряду h3 S, h3 Se, h3 Te увеличивается сила кислот.
Соединения халькогенов в степени окисления (–2) проявляют восста-
новительные свойства. Они усиливаются при переходе от S к Te.
Все оксиды и гидроксиды халькогенов проявляют кислотные свойства.
Сила кислот возрастает при увеличении степени окисления и падает при пере-
ходе от S к Te.
h3 SO4 и h3 SeO4 – сильные кислоты, кислота h3 TeO6 – слабая.
Кислоты элементов в степени окисления (+4) – слабые, а оксид Te(+4)
проявляет амфотерность.
Оксиды SO2
и SeO2
растворяются в воде. Оксид TeO2
плохо растворяется в воде. Все оксиды хорошо растворяются в щелочи.
Оксид TeO2
плохо растворяется в воде. Все оксиды хорошо растворяются в щелочи.
Триоксиды SO3 и SeO3 хорошо растворимы в воде, а TeO3 не растворим.
Серная кислота – это самая используемая кислота, как в химической прак-
тике, так и в промышленности.
Мировой объем производства h3 SO4 составляет 136 млн.т/год.
Соединения в степени окисления +4 могут быть и окислены, и восстановле-
Для соединений S(+4) более характерны восстановительные свойства.
Восстановительные свойства соединений Se (+4) и Te (+4) выражены
заметно слабее, чем у серы (+4).
Степень окисления (+4) у селена и теллура устойчива, но сильные окислители могут окислить Se (+4) и Te (+4) до степени окисления (+6).
Серная кислота имеет в своем составе два окислителя: ион водорода и
сульфат-ион.
В разбавленной серной кислоте окисление металлов осуществляется за счет водородных ионов.
В концентрированной серной кислоте окислителем выступает сульфат-ион,
который может быть восстановлен до SO2 , S, h3 S в зависимости от силы вос-
становителя.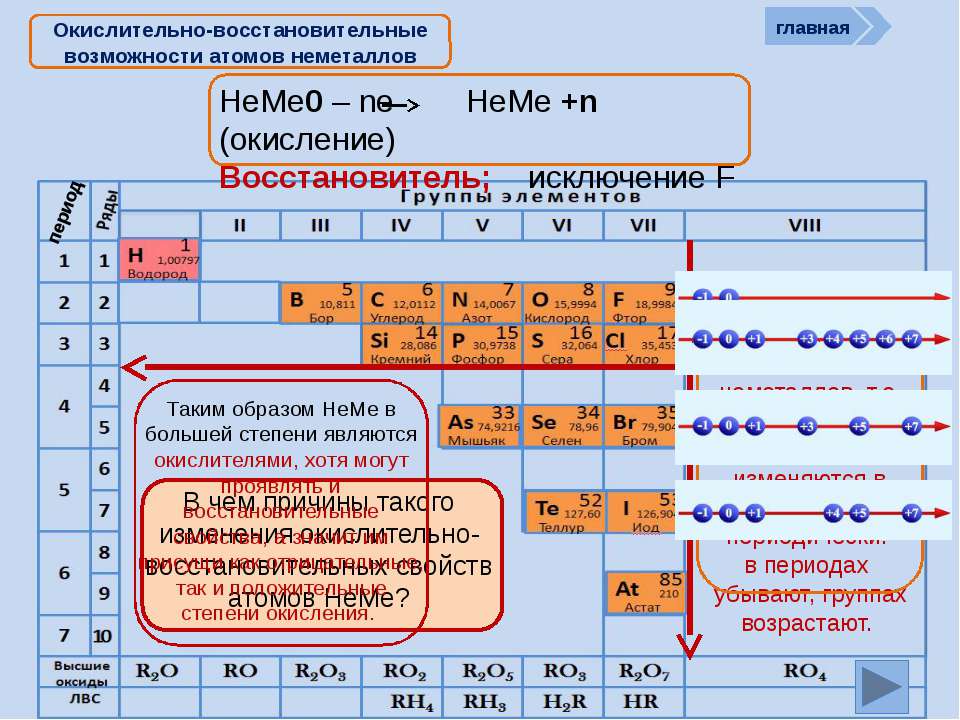
Селеновая и теллуровая кислоты медленно действующие, но сильные
окислители, более сильные, чем серная кислота.
1. Степин Б.Д., Цветков А.А. Неорганическая химия: Учебник для вузов / Б.Д.
Степин, А.А. Цветков.– М.: Высш. шк., 1994.- 608 с.: ил.
2. Карапетьянц М.Х. Общая и неорганическая химия: Учебник для студентов вузов / М.Х. Карапетьянц, С.И. Дракин. — 4-е изд., стер. — М.: Химия, 2000. —
3. Угай Я.А. Общая и неорганическая химия: Учебник для студентов вузов,
обучающихся по направлению и специальности «Химия» / Я.А. Угай. — 3-е
изд., испр. — М.: Высш. шк., 2007. — 527 с.: ил.
4. Никольский А.Б., Суворов А.В. Химия. Учебник для вузов /
А.Б. Никольский, А.В. Суворов.– СПб: Химиздат, 2001. — 512 с.: ил.
| 1. |
Названия соединений серы
Сложность: лёгкое |
1 |
2.
|
Физические свойства серы и соединений
Сложность: лёгкое |
2 |
| 3. |
Свойства серной кислоты
Сложность: лёгкое |
1 |
4.
|
Строение и физические свойства серы
Сложность: среднее |
1 |
| 5. |
Оксиды серы
Сложность: среднее |
2 |
6.
|
Различия разбавленной и концентрированной серной кислоты
Сложность: среднее |
2 |
| 7. |
Определи степени окисления серы
Сложность: среднее |
2 |
8.
|
Реакции серной кислоты
Сложность: сложное |
3 |
| 9. |
Установи соответствие
Сложность: сложное |
4 |
| 1. |
Какие утверждения правильно характеризуют особенности словосочетаний, а какие – ошибочно?
Сложность: лёгкое |
1,5 |
| 2. |
Продолжи утверждения
Сложность: лёгкое |
1,5 |
3.
|
Все ли слова являются словосочетаниями?
Сложность: лёгкое |
1,5 |
| 4. |
Выпиши из словосочетаний главные слова
Сложность: среднее |
3 |
5.
|
Какое слово в словосочетании является зависимым?
Сложность: среднее |
3 |
| 6. |
Установи очерёдность главного слова в словосочетании
Сложность: среднее |
3 |
7.
|
Какой частью речи является главное слово в словосочетании?
Сложность: сложное |
4 |
| 8. |
В каких словосочетаниях возможно переставить местами главное и зависимое слова, а в каких — нет?
Сложность: сложное |
4 |
9.
|
«Подружи» слова
Сложность: сложное |
4 |
Плотность, температура плавления и кипения простых веществ: таблицы для элементов
В таблице приводятся основные физические свойства простых веществ: плотность при температуре 20°С (в случае, если плотность измерена при другой температуре, последняя указана в скобках), температура плавления и температура кипения веществ в градусах Цельсия.
Указаны плотность и температуры плавления и кипения следующих простых веществ: азот N2, актиний Ac, алюминий Al, америций Am, аргон Ar, астат At, барий Ba, бериллий Be, бор B, бром Br, ванадий V, висмут Bi, водород H2, вольфрам W, гадолиний Gd, галлий Ga, гафний Hf, гелий He, германий Ge, гольмий Ho, диспрозий Dy, европий Eu, железо Fe, золото Au, индий In, йод (иод) J, иридий Ir, иттербий Yb, иттрий Y, кадмий Cd, калий K, кальций Ca, кислород O2, озон O3, кобальт Co, кремний Si, криптон Kr, ксенон Xe, кюрий Cm, лантан La, литий Li, лютеций Lu, магний Mg, марганец Mn, медь Cu, молибден Mo, мышьяк As, натрий Na, неодим Nd, неон Ne, нептуний Np, никель Ni, ниобий Nb, олово Sn, осмий Os, палладий Pd, платина Pt, плутоний Pu, полоний Po, празеодим Pr, прометий Pm, протактиний Pa, радий Ra, радон Rn, рений Re, родий Rh, ртуть Hg, рубидий Rb, рутений Ru, самарий Sm, свинец Pb, селен Se, сера S, серебро Ag, скандий Sc, стронций Sr, сурьма Sb, таллий Tl, тантал Ta, теллур Te, тербий Tb, технеций Tc, титан Ti, торий Th, тулий Tu, углерод C (алмаз, графит), уран U, фосфор P (белый, красный), франций Fr, фтор F, хлор Cl, хром Cr, цезий Cs, церий Ce, цинк Zn, цирконий Zr, эрбий Er.
Следует отметить, что плотность веществ в таблице выражена в размерности кг/м3 со множителем 103. В таблице можно выделить вещества (химические элементы) с минимальной и максимальной плотностью. Наименьшей плотностью из химических элементов обладают газы — например, плотность водорода равна всего 0,089 кг/м3 — это самый легкий газ на планете. Из тяжелых элементов высокой плотностью отличаются вольфрам — его плотность 19,3·103 кг/м3, уран, нептуний, осмий и другие металлы.
Цифры в скобках означают, что вещество при данной температуре разлагается. Сокращения: г. — газ, ж. — жидкость, тв. — твердое вещество, возг. — возгоняется, ромб. — ромбическая структура.
По данным таблицы можно выделить вещества, обладающие минимальной и максимальной температурой плавления и кипения. Самую низкую температуру плавления имеет химический элемент гелий — его температура плавления равна минус 272,2 °С.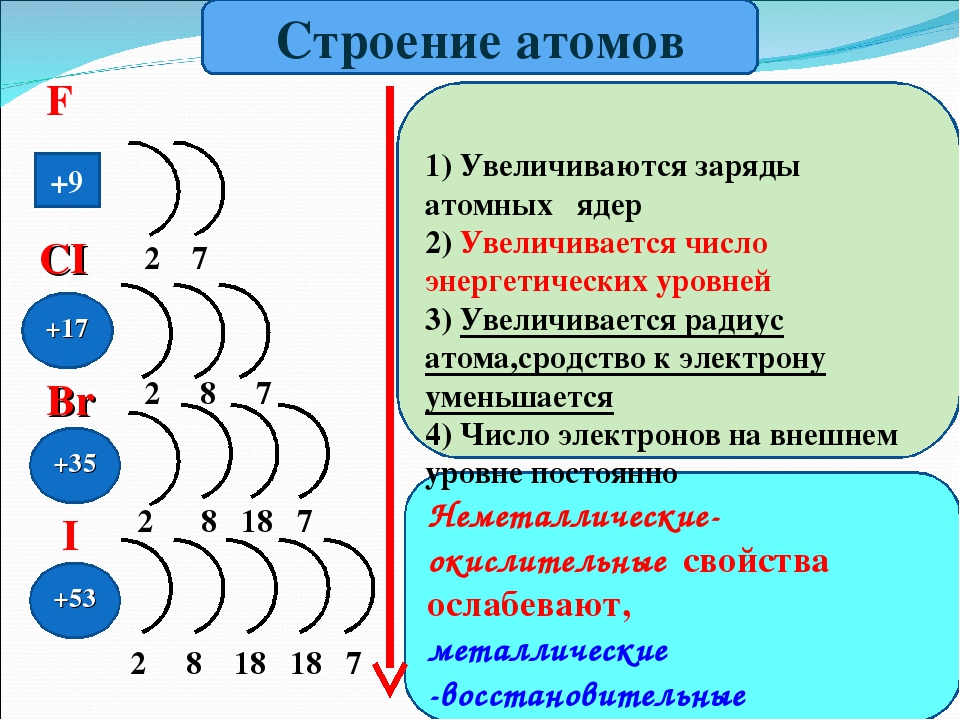 Гелий также обладает и самой низкой температурой кипения.
Гелий также обладает и самой низкой температурой кипения.
Самую высокую температуру плавления среди простых веществ имеет такой химический элемент, как углерод в виде графита. Он начинает плавиться при температуре 3600°С. Другая модификация углерода — алмаз также относится к тугоплавким веществам с температурой плавления 3500°С.
Самую высокую температуру кипения имеет элемент кадмий, он кипит при температуре не ниже 7670°С, хотя начинает плавиться всего лишь при 321°С.
Атомная масса и плотность простых веществ
В таблице приведена атомная масса и плотность следующих химических элементов: азот ,актиний, алюминий, америций, аргон, астат, барий, бериллий, берклий, бор, бром, ванадий, висмут, водород, вольфрам, гадолиний, галлий, гафний, гелий, германий, гольмий, диспрозий, европий, железо, золото, индий, йод, иридий, иттербий, иттрий, кадмий, калий, калифорний, кальций, кислород, кобальт, кремний, криптон, ксенон, кюрий, лантан, литий, лютеций, магний, марганец, медь, менделевий, молибден, мышьяк, натрий, неодим, неон, нептуний, никель, ниобий, олово, осмий, палладий, платина, плутоний, полоний, празеодим, прометий, протактиний, радий, радон, рений, родий, ртуть, рубидий, рутений, самарий, свинец, селен, сера, серебро, скандий, стронций, сурьма, таллий, тантал, теллур, тербий, технеций, титан, торий, тулий, углерод (графит, алмаз), уран, фермий, фосфор, франций, фтор, хлор, хром, цезий, церий, цинк, цирконий, эйнштейний, эрбий.
Указанные значения плотности соответствуют плотности веществ при температуре 20°С и атмосферном давлении, за исключением тех случаев, когда в скобках указана другая температура.
Плотность элементов дана в размерности тонна на кубометр. Например, плотность жидкого азота при температуре -195,8°С равна 0,808 т/м3 или 808 кг/м3; плотность хлора в газообразном состоянии равна 3,214 кг/м3, жидкого — 1557 кг/м3. Значения плотности веществ приведены для их естественного молекулярного и агрегатного состояний при указанной температуре.
Источники:
1. Писаренко В.В. Справочник лаборанта-химика. Справ. пособие для проф.-техн. учебн. заведений. М., «Высшая школа», 1970. — 192 стр. с илл.
2. Физические величины. Справочник. А.П. Бабичев, Н.А. Бабушкина, А.М. Братковский и др.; Под ред. И.С. Григорьева, Е.З. Мейлихова. — М.: Энергоатомиздат, 1991. — 1232 с.
В серии O S SE TE уменьшается. Характеристики соединений элементов главной подгруппы группы VI
химия, очень нужная! Как изменяются окислительные свойства в ряду элементов S — SE — TE — PO? Ответ уточнить.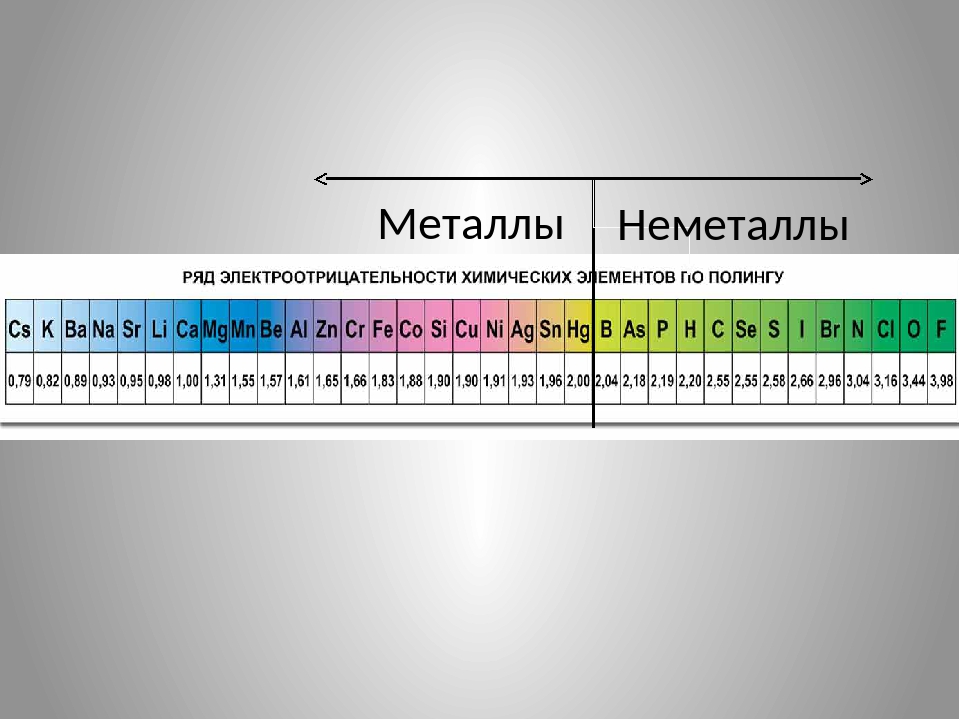 И получил лучший ответ
И получил лучший ответ
Ответ от џна Александровны Ткаченко [Активная]
В подгруппе кислорода с увеличением атомного номера увеличивается радиус атомов, уменьшается энергия ионизации, характеризующая металлические свойства элементов.Поэтому в ряду 0 — S — SE — TE — свойства элементов изменяются от неметаллических до металлических. При нормальных условиях кислород — типичный неметалл (газ), а полоний — металл, подобный свинцу.
С увеличением атомных номеров элементов значение электроперечислимости элементов в подгруппе уменьшается. Отрицательная степень окисления становится менее характерной. Окислительная степень окисления становится менее характерной. Окислительная активность простых веществ В ряду 02 — С-СЭ — снижается.Так, если сера и значительно слабее селена непосредственно взаимодействуют с водородом, то теллур в реакцию не вступает.
По значению электроотрицательности кислород уступает только Фектуру, поэтому в реакциях со всеми остальными элементами проявляют только окислительные свойства. Сера, селен и теллур в их свойствах. Ссылка на группу восстановителей. В реакциях с сильными восстановителями проявляются окислительные свойства, а при действии сильных окислителей. они окисляются, то есть проявляют восстанавливающие свойства.
Сера, селен и теллур в их свойствах. Ссылка на группу восстановителей. В реакциях с сильными восстановителями проявляются окислительные свойства, а при действии сильных окислителей. они окисляются, то есть проявляют восстанавливающие свойства.
Возможные валентность и степени окисления элементов шестой группы главной подгруппы с точки зрения строения атома.
Кислород, сера, селен, теллур и полоний составляют основную подгруппу группы VI. На внешнем энергетическом уровне атомы элементов этой подгруппы содержат 6 электронов, которые имеют конфигурацию S2P4 и распределяются по ячейкам следующим образом:
Ответ от 2 ответа [гуру]
Эй! Вот подборка тем с ответами на ваш вопрос: химия, очень нужная! Как изменяются окислительные свойства в ряду элементов S — SE — TE — PO? Ответ уточнить.
в ряду элементов О-СЭ, с увеличением порядкового номера химического элемента электроотрицательность 1) увеличивается. 2) умный.
O-S-SE — уменьшается
C-N-O-F — увеличивается
Фтор является электроотрицательным элементом.
Задание 840.
На основании строения атомов серы, селена и теллура укажите, какие валентные состояния и степени окисления характерны для этих элементов. Каковы формулы их высших гидроксидов? Ответ уточнить.
Решение:
Атомы S, SE и TE на внешнем энергетическом уровне содержат шесть электронов (NS 2 P 4) — два на S-орбиталях и четыре на p-орбиталях. Графически это можно представить:
Следовательно, в стационарном состоянии эти элементы, имеющие два неспаренных P-электрона, проявляют ковалентность Равную 2. в S, SE и TE количество неспаренных электронов в атоме можно увеличить путем перевода S и P -электронов в D-комплект внешнего слоя. В связи с этим указанные элементы проявляют ковалентность , равную не только 2, но и 4, и 6.Так, при возбуждении атомов S, SE и TE Р-электрон может быть переведен на свободную D-орбиталь и тогда атом приобретает четыре неспаренных электрона. В связи с этим указанные элементы показывают ковалентность Равно 4. Графически это можно представить как:
Графически это можно представить как:
за счет переноса при возбуждении атома p- и s-электронов внешним слоем, что приводит к образованию шести неспаренных электронов у атома во внешнем электронном слое. В связи с этим указанные элементы показывают ковалентно равными 6.Графически это можно представить:
Так, S, SE и TE в своих соединениях могут проявлять как отрицательную (-2), так и положительную степень окисления (+2, +4 и 6). В соединениях с металлами и водородом степень окисления равна -2, а в соединениях с неметаллами — может быть +4 и +6. Поэтому в соединениях с кислородом эти элементы могут проявлять степень окисления, равную как +4, так и +6, при этом образуются два типа оксидов с формулой.
Задача 841.
Дать сравнительную характеристику водородных соединений элементов главной подгруппы VI группы с указанием и объяснением характера изменения: а) термостойкости; б) температуры плавления и кипения; в) кислотно-основные и окислительно-восстановительные свойства. Какое из этих соединений можно получить взаимодействием водорода с соответствующим простым веществом?
Какое из этих соединений можно получить взаимодействием водорода с соответствующим простым веществом?
Решение:
а) Прочность химической связи В молекулах водородных соединений элементов главной подгруппы группы группа попадает в ряд
H 2 O — H 2 S — H 2 SE — H 2 TE , что проявляется изменением энтальпии диссоциации молекул на атомы.Причины этого в том, что с увеличением размеров внешних электронных облаков атомов степень перекрытия уменьшается. Поэтому при переходе от H 2 O к H 2 степень перекрытия электронных облаков атомов водорода и элемента элемента главной подгруппы VI группы уменьшается, а область перекрытия располагается на большем расстоянии от ядро атома элемента (о, S, SE, TE) и сильнее увеличено число промежуточных электронных слоев.Кроме того, в ряду O — S — SE — TE снижается электроотрицательность атома элемента. Поэтому в молекуле H 2 электронное облако атома водорода смещено в сторону атома кислорода в наибольшей степени, а в молекулах H 2 S. H 2 SE и H 2 все меньше и меньше. Это также приводит к уменьшению перекрывающихся взаимодействующих электронных облаков и, таким образом, к ослаблению связи между атомами. При уменьшении прочности связи в молекулах водородных соединений элементов главной подгруппы VI группы сопротивление нагреванию в ряду H 2 O — H 2 S — H 2 S — H 2 TE равно упавший.
Это также приводит к уменьшению перекрывающихся взаимодействующих электронных облаков и, таким образом, к ослаблению связи между атомами. При уменьшении прочности связи в молекулах водородных соединений элементов главной подгруппы VI группы сопротивление нагреванию в ряду H 2 O — H 2 S — H 2 S — H 2 TE равно упавший.
б) В ряду H 2 O — H 2 S — H 2 SE — H 2 TE температуры кипения и плавления изменяются очень естественно, в этом ряду они плавно возрастают, а при переходе к H 2 o — резко возрастают. Это связано с объединением молекул воды в результате возникновения между ними водородных связей.
Естественный рост температур плавления и кипения в ряду H 2 O — H 2 S — H 2 SE — H 2 TE объясняется увеличением радиусов атомов с увеличением порядкового номера элемента.При этом увеличивается поляризуемость молекул, что приводит к увеличению межмолекулярного дисперсионного взаимодействия, т. е. к усилению их притяжения друг к другу ( ван-дер-ваальсовых сил ), что вызывает повышение температур плавления и кипения (температуры плавления и кипения). исключение составляет H 2 O).
исключение составляет H 2 O).
в) Кислотные свойства в ряду H 2 O — H 2 S — H 2 SE — H 2 TE естественным образом усиливаются. Вода имеет очень малую степень диссоциации, так как молекулы образуют ассоциаты за счет водородных связей, так что диссоциация молекулы Н 2 требует значительных энергетических затрат.Поэтому для воды характерен слабый электролит-амфолит , молекулы которого распались на ионы:
H 2 O ↔ H + + он —
H 2 O, H 2 S, H 2 SE, H 2 TE — типичные кислоты. Кислотные свойства подряд естественным образом усиливаются. Это объясняется тем, что в пределах одной подгруппы радиусы ионов одного заряда увеличиваются с увеличением заряда ядра. Такая закономерность объясняется увеличением числа электронных слоев и возрастающим удалением внешних электронов от ядра.При переходе от H 2 S к H 2 TE степень перекрытия электронных облаков атомов водорода с атомами S, SE и тех, а сама область перекрытия электронных облаков уменьшается на большем расстоянии от ядра атома элемента и сильнее экранирован увеличенным числом промежуточных слоев.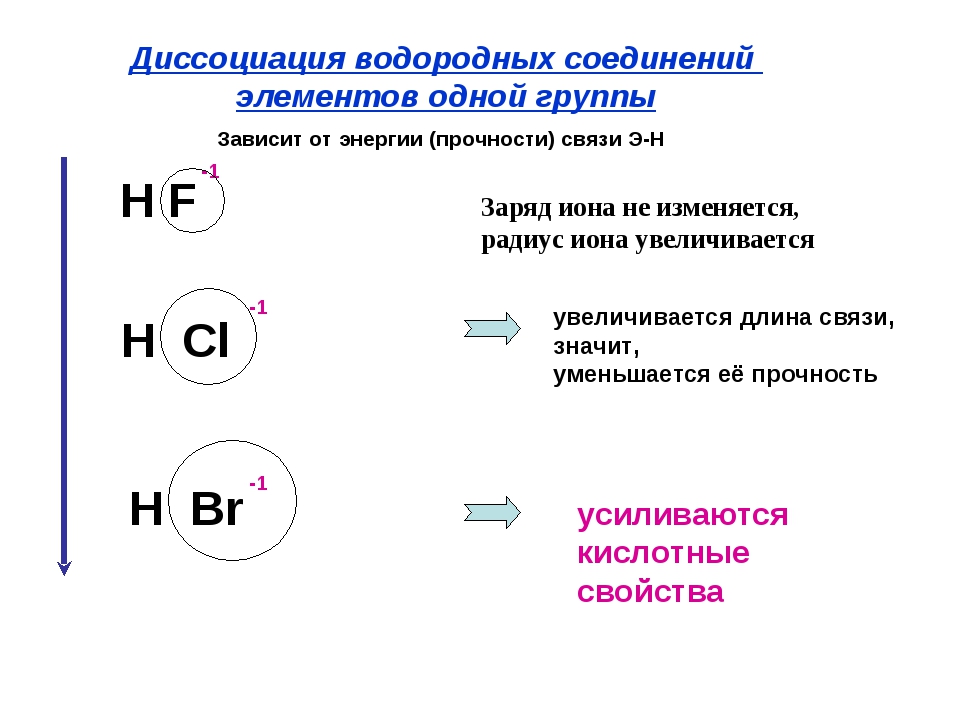 Кроме того, в ряду S — SE — TE снижается электросчитываемость атомов. Это также приводит к уменьшению перекрывающихся взаимодействующих электронных облаков и, таким образом, к ослаблению связи между атомами.Так, в ряду H 2 S — H 2 SE — H 2 TE увеличивается расстояние между атомами элемента и атомами водорода, поэтому при диссоциации диссоциации в воде возрастает диссоциация кислоты. Окислительная активность в ряду H 2 O — H 2 S — H 2 SE — H 2 TE последовательно снижается, а реабилитационные свойства усиливаются. Это объясняется естественным увеличением радиусов ионов ряда, что облегчает возврат электронов. Следовательно, кислород — очень сильный окислитель, теллур — сильный восстановитель.В ряду H 2 O — H 2 S — H 2 SE — H 2 TE усиливаются восстанавливающие свойства. Под действием сильных окислителей они окисляются до диоксидов или до соответствующих кислых кислот H 2 RO 3 или даже до H 2 RO 4.
Кроме того, в ряду S — SE — TE снижается электросчитываемость атомов. Это также приводит к уменьшению перекрывающихся взаимодействующих электронных облаков и, таким образом, к ослаблению связи между атомами.Так, в ряду H 2 S — H 2 SE — H 2 TE увеличивается расстояние между атомами элемента и атомами водорода, поэтому при диссоциации диссоциации в воде возрастает диссоциация кислоты. Окислительная активность в ряду H 2 O — H 2 S — H 2 SE — H 2 TE последовательно снижается, а реабилитационные свойства усиливаются. Это объясняется естественным увеличением радиусов ионов ряда, что облегчает возврат электронов. Следовательно, кислород — очень сильный окислитель, теллур — сильный восстановитель.В ряду H 2 O — H 2 S — H 2 SE — H 2 TE усиливаются восстанавливающие свойства. Под действием сильных окислителей они окисляются до диоксидов или до соответствующих кислых кислот H 2 RO 3 или даже до H 2 RO 4.
Воду и сероводород можно получить прямой реакцией водорода с кислородом или серой при достаточно высоких температурах.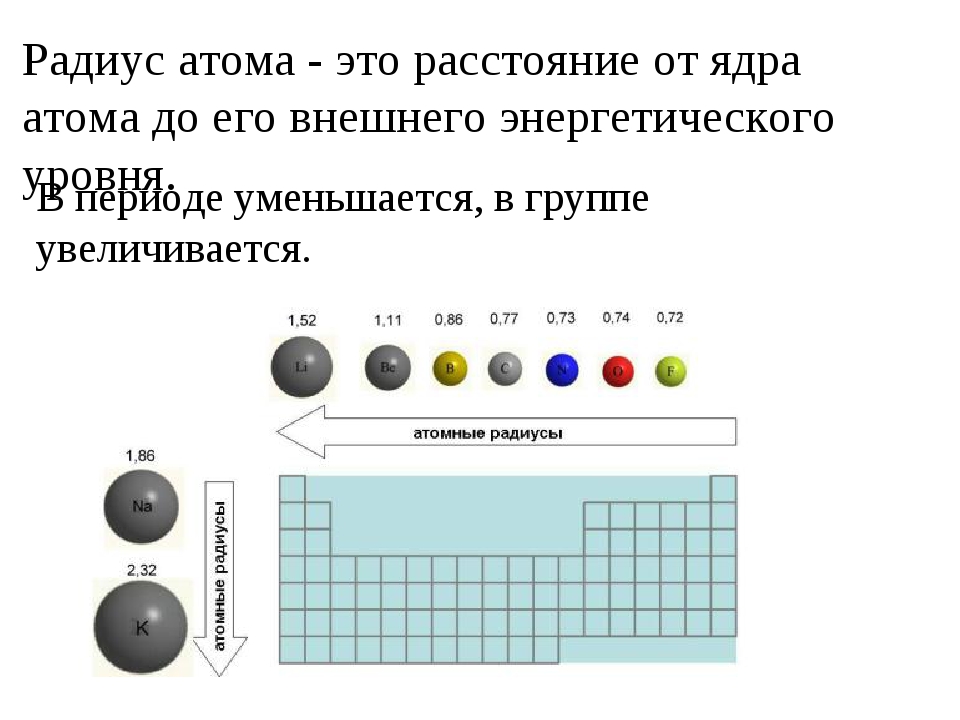 H 2 SE и H 2 TE получают косвенным путем, например, действием на селениды или телевурды сильными кислотами:
H 2 SE и H 2 TE получают косвенным путем, например, действием на селениды или телевурды сильными кислотами:
Na 2 SE + H 2 SO 4 = Na 2 SO 4 + H 2 SE;
Na 2 ТЭ + H 2 SO 4 = Na 2 SO 4 + Н 2 ТЭ.
Задача 842.
Какое вещество легче окисляется: сульфид натрия или телеварид натрия? Ответ уточнить.
Решение:
Внутри одной подгруппы радиусы ионов одного заряда увеличиваются с увеличением заряда ядра. Такая закономерность объясняется увеличением числа электронных слоев и растущим выносом внешних электронов из ядра. Поэтому иону ион 2 будет легче отдавать электроны, чем иону S 2-. Процесс отдачи электрона, сопровождающийся увеличением степени окисления элемента, называется окислением.Вещество, в состав которого входит окисляющий элемент, называется восстановителем. Таким образом, телеварид натрия будет легче окисляться, чем сульфид натрия.
Дмитрий Иванович Менделеев открыл периодический закон, согласно которому свойства элементов и образованные ими периодически изменяются. Это открытие было графически отображено в таблице Менделеева. Таблица очень хороша и хорошо видно, как свойства элементов изменяются по периоду, после чего они повторяются в следующем периоде.
Это открытие было графически отображено в таблице Менделеева. Таблица очень хороша и хорошо видно, как свойства элементов изменяются по периоду, после чего они повторяются в следующем периоде.
Чтобы решить задание №2 ЕГЭ по химии, нам достаточно понять и запомнить, какие свойства элементов в каких направлениях изменяются и как.
Все это отображено на рисунке ниже.
Слева направо растут электроемкость, неметаллические свойства, более высокие степени окисления и т.д. А свойства металла и радиусы уменьшаются.
Сверху вниз наоборот: свойства металлов и радиусы атомов растут, а электроэлектричность падает.Высшая степень окисления, соответствующая числу электронов на внешнем энергетическом уровне, не изменяется в этом направлении.
Разберем на примерах.
Пример 1. У ряда элементов Na → Mg → Al → Si
А) радиусы атомов уменьшаются;
Б) количество протонов в ядрах атомов уменьшено;
В) увеличивается число электронных слоев в атомах;
Г) высшая степень окисления атомов снижена;
Если посмотреть на таблицу Менделеева, то мы увидим, что все элементы этого ряда находятся в одном периоде и перечислены в том порядке, в каком они стоят в таблице слева направо. Чтобы ответить на вопрос такого рода, нужно всего лишь знать несколько закономерностей изменения свойств в таблице Менделеева. Так слева направо по периоду свойства металлов падают, неметаллические растут, электротрикативность растет, энергия ионизации растет, радиус атомов уменьшается. По группе сверху вниз растут металлические и реабилитационные свойства, падает электросчитываемость, уменьшается энергия ионизации, растет радиус атомов.
Чтобы ответить на вопрос такого рода, нужно всего лишь знать несколько закономерностей изменения свойств в таблице Менделеева. Так слева направо по периоду свойства металлов падают, неметаллические растут, электротрикативность растет, энергия ионизации растет, радиус атомов уменьшается. По группе сверху вниз растут металлические и реабилитационные свойства, падает электросчитываемость, уменьшается энергия ионизации, растет радиус атомов.
Если вы были внимательны, то уже поняли, что в этом случае радиусы атомов уменьшаются.Ответ А.
Пример 2. Для усиления окислительных свойств элементы располагаются в ряд:
А. F → О → N
Б. I → BR → CL
V. Cl → S → P
G. F → Cl → BR
Как известно, в периодической таблице Менделеева окислительные свойства возрастают слева направо по периоду и снизу вверх по группе. В варианте точно сокращаются элементы одной группы. Так что Б подходит.
Пример 3. Валентность элементов в высшем оксиде возрастает в ряду:
А. Cl → BR → I
Cl → BR → I
B. CS → K → Li
V. Cl → S → P
G. Al → C → N
В высших оксидах элементы проявляют наивысшую степень окисления, которая будет совпадать с валентностью. Причем высшая степень окисления растет слева направо по таблице. Смотрим: В первом и втором варианте нам даны элементы, находящиеся в каких-то группах, там степень окисления выше и соответственно валентность в оксидах не меняется. CL→S→P – расположены справа слева, то есть у них наоборот валентность в высшем оксиде будет падать.А вот в ряду Al→C→N элементы располагаются слева – справа, с ними увеличивается валентность в высшем оксиде. Ответ: Г.
Пример 4. В ряду элементов S → SE → TE
А) повышается кислотность водородных соединений;
Б) возрастает высшая степень окисления элементов;
В) валентность элементов в водородных соединениях;
Г) уменьшается количество электронов на внешнем уровне;
Сразу смотрим расположение этих элементов в таблице Менделеева.Сера, селен и теллур находятся в одной группе, одной подгруппе. Они даны в порядке сверху вниз. Смотрим снова на схему выше. Сверху вниз в таблице Менделеева растут свойства металлов, растут радиусы, электротрикаты, энергия ионизации и неметаллические свойства, число электронов на внешнем уровне не меняется. Вариант r сразу исключающий. Если число внешних электронов не меняется, то валентные возможности и высшая степень окисления также не меняются, б и в — исключают.
Они даны в порядке сверху вниз. Смотрим снова на схему выше. Сверху вниз в таблице Менделеева растут свойства металлов, растут радиусы, электротрикаты, энергия ионизации и неметаллические свойства, число электронов на внешнем уровне не меняется. Вариант r сразу исключающий. Если число внешних электронов не меняется, то валентные возможности и высшая степень окисления также не меняются, б и в — исключают.
Вариант А. остается под заказ. По схеме Косселя мощность кислородных кислот возрастает с уменьшением степени окисления элемента и увеличением радиуса его иона. Степень окисления у всех трех элементов одинакова в водородных соединениях, но радиус растет сверху вниз, значит, сила кислоты растет.
Ответ — А.
Пример 5. В порядке ослабления основные свойства оксидов располагаются в ряду:
А.Na 2 O → K 2 O → RB 2 O
B. Na 2 O → MGO → Al 2 O 3
B. Beo → BaO → Cao
SO 3 → P 2 O 5 → SiO 2
Основные свойства оксидов синхронно с ослаблением свойств металлов ослабевают элементы их формообразования. А Измерение Ослабляется слева направо или снизу вверх. Na, Mg и Al просто расположены слева направо. Ответ Б.
А Измерение Ослабляется слева направо или снизу вверх. Na, Mg и Al просто расположены слева направо. Ответ Б.
Части периодической таблицы
Разница в электроотрицательности между двумя связанными элементами
определяет, какой тип связи они образуют.Когда атомы с разницей электроотрицательностей больше
чем две единицы соединены вместе, связь, которая образуется,
ионная связь , в которой более электроотрицательный элемент
имеет отрицательный заряд, а менее электроотрицательный элемент имеет
положительный заряд. (В качестве аналогии вы можете думать об этом как
игра в перетягивание каната, в которой одна команда достаточно сильна, чтобы тянуть
веревку от другой команды.) Например, натрий
имеет электроотрицательность 0.93 и хлор имеет
электроотрицательность 3,16, поэтому, когда натрий и хлор образуют ионное
связь, при которой хлор отбирает электрон у натрия,
образуя катион натрия Na + и хлорид-анион,
Кл —. Отдельные ионы натрия и хлора не
«связаны» вместе, но очень сильно притягивают друг друга из-за
противоположные заряды и образуют прочную кристаллическую решетку.
Отдельные ионы натрия и хлора не
«связаны» вместе, но очень сильно притягивают друг друга из-за
противоположные заряды и образуют прочную кристаллическую решетку.
Когда атомы с разницей электроотрицательностей менее двух звенья соединяются вместе, образующаяся связь представляет собой ковалентных связей. связь , в которой электроны являются общими для обоих атомов. Когда два одинаковых атома делят электроны в ковалентной связи, между ними нет разницы в электроотрицательности, и электронов в ковалентной связи делят поровну — это то есть существует симметричное распределение электронов между связанными атомами.Эти связи неполярны. ковалентные связи . (В качестве аналогии вы можете думать об этом как игра в перетягивание каната между двумя одинаково сильными командами, в которой веревка не двигается.) Например, когда два хлора атомы соединены ковалентной связью, электроны проводят так же, как много времени близко к одним атомам хлора, как и к другим, и полученная молекула неполярна:
18.
 10: Элементы группы 6А
10: Элементы группы 6А
Общая химия Libretexts Textmap организована вокруг учебника
Химия: принципы, модели и приложения
Брюс А. Аверилл
I II III И.В. V В.И. VII VIII IX X XI XII XIII XIV Х V Х В.И. Х VII Х VIII Х IX Х Х Х XI Х XII Х XII Я Х XIV ● Домашнее задание
Цели обучения
- Чтобы понять тенденции в свойствах и реакционной способности элементов группы 16: халькогены.
Халькогены являются первой группой р-блока, не имеющей стабильных металлических элементов. Все изотопы полония (Po), единственного металла в группе 16, радиоактивны, и только один элемент в группе, теллур (Te), может даже быть описан как полуметалл. Как и в группах 14 и 15, самый легкий элемент группы 16, кислород, встречается в природе в виде свободного элемента.
Из элементов 16 группы в древности была известна только сера; другие не были обнаружены до конца 18-го и 19-го веков.Сера часто встречается в виде желтых кристаллических отложений практически чистого S 8 в районах интенсивной вулканической деятельности или вокруг горячих источников. Еще в 15 веке до нашей эры сера использовалась в качестве фумиганта в гомеровской Греции, поскольку при сжигании она выделяет пары SO 2 , токсичные для большинства организмов, включая паразитов, скрывающихся в стенах и под полами домов. Поэтому ссылки на серу часто встречаются в древней литературе, часто в контексте религиозного очищения. На самом деле ассоциация серы с божественным была настолько распространена, что префиксы тио- (что означает «сера») и тео- (что означает «бог») имеют один и тот же корень в древнегреческом языке. Хотя сера используется в основном в производстве серной кислоты, она также используется для производства пороха и в качестве сшивающего агента для каучука, который позволяет каучуку сохранять свою форму, но сохраняет свою гибкость.
На самом деле ассоциация серы с божественным была настолько распространена, что префиксы тио- (что означает «сера») и тео- (что означает «бог») имеют один и тот же корень в древнегреческом языке. Хотя сера используется в основном в производстве серной кислоты, она также используется для производства пороха и в качестве сшивающего агента для каучука, который позволяет каучуку сохранять свою форму, но сохраняет свою гибкость.
Группа 16 является первой группой в p-блоке без стабильных металлических элементов.
Кислород не был открыт до 1771 года, когда шведский фармацевт Карл Вильгельм Шееле обнаружил, что при нагревании такие соединения, как KNO 3 , Ag 2 CO 3 и HgO, образуют бесцветный газ без запаха, который поддерживает горение лучше, чем воздух.Однако результаты не были опубликованы сразу, поэтому работа Шееле оставалась неизвестной до 1777 года. К сожалению, это произошло почти через два года после публикации статьи английского химика Джозефа Пристли, в которой описывалось выделение того же газа с помощью увеличительного стекла. сфокусируйте солнечные лучи на образце HgO. Кислород используется главным образом в сталелитейной промышленности при превращении необработанного железа в сталь с использованием бессемеровского процесса. Еще одним важным промышленным применением кислорода является производство TiO 2 , который обычно используется в качестве белого пигмента в красках, бумаге и пластмассах.
сфокусируйте солнечные лучи на образце HgO. Кислород используется главным образом в сталелитейной промышленности при превращении необработанного железа в сталь с использованием бессемеровского процесса. Еще одним важным промышленным применением кислорода является производство TiO 2 , который обычно используется в качестве белого пигмента в красках, бумаге и пластмассах.
Теллур был случайно обнаружен в 1782 году австрийским химиком Францем Йозефом Мюллером фон Райхенштейном, главным инспектором рудников в Трансильвании, который также отвечал за анализ образцов руды. Серебристо-белый металл имел ту же плотность, что и сурьма, но совсем другие свойства. Поскольку его было трудно анализировать, Мюллер назвал его Metallum Problematicum (что означает «трудный металл»).Название теллур (от латинского tellus, что означает «земля») было придумано другим австрийским химиком, Мартином Клапротом, который в 1798 году продемонстрировал, что «трудный металл» Мюллера на самом деле был новым элементом. Теллур применяют для окрашивания стекла и керамики, при изготовлении капсюлей-детонаторов, в термоэлектрических устройствах.
Теллур применяют для окрашивания стекла и керамики, при изготовлении капсюлей-детонаторов, в термоэлектрических устройствах.
Йонс Якоб Берцелиус (1779–1848)
Берцелиус родился в хорошо образованной шведской семье, но оба родителя умерли, когда он был маленьким. Он изучал медицину в Университете Уппсалы, где его эксперименты с электрошоковой терапией заставили его интересоваться электрохимией.Берцелиус разработал систему химических обозначений, которую мы используем сегодня. Кроме того, он открыл шесть элементов (церий, торий, селен, кремний, титан и цирконий).
Рисунок \(\PageIndex{1}\): Химия фотокопирования. Поскольку аморфный селен является светочувствительным полупроводником, воздействие света на электростатически заряженную пленку Se приводит к разряду положительного заряда на пленке во всех областях, которые в оригинале белые. Темные области оригинала блокируют свет и создают невидимое положительно заряженное изображение.Для создания изображения на бумаге отрицательно заряженные частицы тонера притягиваются к положительному изображению, переносятся на отрицательно заряженный лист чистой бумаги и сплавляются с бумагой при высокой температуре для получения постоянного изображения.
Самый тяжелый халькоген, полоний, был выделен Марией Кюри после экстраординарных усилий. Хотя ей так и не удалось получить макроскопические количества элемента, который она назвала в честь своей родной страны Польши, она продемонстрировала, что его химический состав требует отнесения его к группе 16.Мария Кюри была удостоена второй Нобелевской премии по химии в 1911 году за открытие радия и полония.
Получение и общие свойства элементов группы 16
Кислород является самым распространенным элементом в земной коре и гидросфере (около 44% и 86% по массе соответственно). Тот же процесс, который используется для получения азота из атмосферы, дает чистый кислород. Кислород можно также получить электролизом воды, разложением пероксидов или супероксидов щелочных металлов или щелочноземельных металлов или термическим разложением простых неорганических солей, таких как хлорат калия, в присутствии каталитического количества MnO 2 :
\[\ mathrm{2KClO_3(s)\overset{MnO_2(s)}{\underset{\Delta}\rightleftharpoons}2KCl(s)+3O_2(g)} \label{22. 4.1}\]
4.1}\]
В отличие от кислорода, сера не очень распространена, но ее можно найти в виде элементарной серы в горных породах, лежащих над соляными куполами, которые часто сопровождают нефтяные месторождения (рис. \(\PageIndex{1}\)). Сера также извлекается из H 2 S и сероорганических соединений в сырой нефти и угле, а также из сульфидных руд металлов, таких как пирит (FeS 2 ).
Пирит (FeS 2 ). Из-за своих блестящих золотисто-желтых кубических кристаллов FeS 2 иногда ошибочно принимают за золото, отсюда и его общее название «золото дураков».Однако настоящее золото намного плотнее, чем FeS 2 , и золото скорее мягкое и податливое, чем твердое и хрупкое. Поскольку селен и теллур химически подобны сере, они обычно обнаруживаются в качестве незначительных загрязнителей в рудах сульфидов металлов и обычно выделяются как побочные продукты. Тем не менее, их так же много в земной коре, как серебра, палладия и золота. Одним из лучших источников селена и теллура является «шлам», образующийся при электролитической очистке меди. Оба эти элемента печально известны неприятным запахом многих своих соединений. Например, когда организм поглощает даже следовые количества теллура, вырабатывается диметилтеллур [(CH 3 ) 2 Te], который медленно высвобождается с дыханием и потом, что приводит к интенсивному чесночному запаху, который обычно называют « теллуровое дыхание».
Оба эти элемента печально известны неприятным запахом многих своих соединений. Например, когда организм поглощает даже следовые количества теллура, вырабатывается диметилтеллур [(CH 3 ) 2 Te], который медленно высвобождается с дыханием и потом, что приводит к интенсивному чесночному запаху, который обычно называют « теллуровое дыхание».
С их электронными конфигурациями ns 2 np 4 халькогенам не хватает двух электронов до заполненной валентной оболочки.Таким образом, в реакциях с металлами они имеют тенденцию приобретать два дополнительных электрона с образованием соединений в степени окисления -2. Эта тенденция больше всего проявляется у кислорода, халькогена с самой высокой электроотрицательностью. Более тяжелые, менее электроотрицательные халькогены могут терять либо четыре np-электрона, либо четыре np- и два ns-электрона с образованием соединений в степени окисления +4 и +6 соответственно, как показано в таблице \(\PageIndex{1}\). Как и в случае с другими группами, самый легкий член в группе, в данном случае кислород, сильно отличается от других по размеру, энергии ионизации, электроотрицательности и сродству к электрону, поэтому его химический состав уникален.Также, как и в других группах, второй и третий члены (сера и селен) обладают сходными свойствами из-за экранирующих эффектов. Только полоний является металлическим, образуя либо гидратированный ион Po 2 + , либо Po 4 + в водном растворе, в зависимости от условий.
Как и в случае с другими группами, самый легкий член в группе, в данном случае кислород, сильно отличается от других по размеру, энергии ионизации, электроотрицательности и сродству к электрону, поэтому его химический состав уникален.Также, как и в других группах, второй и третий члены (сера и селен) обладают сходными свойствами из-за экранирующих эффектов. Только полоний является металлическим, образуя либо гидратированный ион Po 2 + , либо Po 4 + в водном растворе, в зависимости от условий.
| Собственность | Кислород | Сера | Селен | Теллур | Полоний |
|---|---|---|---|---|---|
* Показанная конфигурация не включает заполненные подоболочки d и f. |
|||||
| † Значения, указанные для гексакатионов, относятся к шестикоординатным ионам и являются только оценочными значениями. | |||||
| атомная масса (а.е.м.) | 16.00 | 32.07 | «> 78,96 | 127,60 | 209 |
| атомный номер | 8 | «> 16 | 34 | 52 | 84 |
| атомный радиус (пм) | «> 48 | 88 | 103 | 123 | 135 |
| «> атомный символ | О | С | Se | Те | «> По |
| плотность (г/см 3 ) при 25°C | 1.31 (г/л) | 2,07 | 4,81 | †The values cited for the hexacations are for six-coordinate ions and are only estimated values.»> 6,24 | 9,20 |
| сродство к электрону (кДж/моль) | −141 | «> −200 | −195 | −190 | −180 |
| электроотрицательность | †The values cited for the hexacations are for six-coordinate ions and are only estimated values.»> 3,4 | 2,6 | 2,6 | 2.1 | 2,0 |
| †The values cited for the hexacations are for six-coordinate ions and are only estimated values.»> энергия первой ионизации (кДж/моль) | 1314 | 1000 | 941 | «> 869 | 812 |
| ионный радиус (пм) † | 140 (−2) | 184 (−2), 29 (+6) | †The values cited for the hexacations are for six-coordinate ions and are only estimated values.»> 198 (−2), 42 (+6) | 221 (−2), 56 (+6) | 230 (−2), 97 (+4) |
| температура плавления/кипения (°C) | «> −219/−183 | 115/445 | 221/685 | 450/988 | 254/962 |
| †The values cited for the hexacations are for six-coordinate ions and are only estimated values.»> нормальные степени окисления | −2 | +6, +4, −2 | +6, +4, −2 | «> +6, +4, −2 | +2 (+4) |
| продукт реакции с H 2 | Н 2 О | Н 2 Ю | †The values cited for the hexacations are for six-coordinate ions and are only estimated values.»> Н 2 Се | нет | нет |
| продукт реакции с N 2 | «> НЕТ, НЕТ 2 | нет | нет | нет | нет |
| †The values cited for the hexacations are for six-coordinate ions and are only estimated values.»> продукт реакции с O 2 | — | SO 2 | СеО 2 | «> ТеО 2 | PoO 2 |
| продукт реакции с X 2 | О 2 Ж 2 | SF 6 , S 2 Cl 2 , S 2 Br 2 | †The values cited for the hexacations are for six-coordinate ions and are only estimated values.»> СеФ 6 , Секс 4 | ТеФ 6 , ТеХ 4 | PoF 4 , PoCl 2 , PoBr 2 |
| стандартный восстановительный потенциал (E°, В) (E 0 → H 2 E в кислом растворе) | †The values cited for the hexacations are for six-coordinate ions and are only estimated values.»> +1.23 | +0,14 | −0,40 | −0,79 | −1,00 |
| †The values cited for the hexacations are for six-coordinate ions and are only estimated values.»> тип оксида | — | кислая | кислая | амфотерный | †The values cited for the hexacations are for six-coordinate ions and are only estimated values.»> базовый |
| конфигурация валентного электрона* | 2с 2 2п 4 | 3с 2 3п 4 | «> 4с 2 4п 4 | 5с 2 5п 4 | 6s 2 6p 4 |
Реакции и соединения кислорода
Как и в группах 14 и 15, самый легкий член группы 16 имеет наибольшую склонность к образованию множественных связей.Таким образом, элементарный кислород встречается в природе в виде двухатомного газа, содержащего чистую двойную связь: O=O. Как и в случае с азотом, электростатическое отталкивание между неподеленными парами электронов на соседних атомах не позволяет кислороду образовывать стабильные цепные соединения. Фактически, за исключением O 2 , все соединения, содержащие связи O–O, потенциально взрывоопасны. Озон, пероксиды и супероксиды потенциально опасны в чистом виде. Озон (O 3 ), один из самых сильных известных окислителей, используется для очистки питьевой воды, поскольку он не придает характерного вкуса, характерного для хлорированной воды.о = -119\; кДж/моль \метка{1}\]
Фактически, за исключением O 2 , все соединения, содержащие связи O–O, потенциально взрывоопасны. Озон, пероксиды и супероксиды потенциально опасны в чистом виде. Озон (O 3 ), один из самых сильных известных окислителей, используется для очистки питьевой воды, поскольку он не придает характерного вкуса, характерного для хлорированной воды.о = -119\; кДж/моль \метка{1}\]
Как и в группах 14 и 15, самый легкий элемент в группе 16 имеет наибольшую склонность к образованию кратных связей.
Несмотря на прочность связи O=O (\(D_\mathrm{O_2}\) = 494 кДж/моль), \(O_2\) чрезвычайно реакционноспособен, реагируя непосредственно почти со всеми другими элементами, кроме инертных газов. Некоторые свойства O 2 и родственных соединений, такие как пероксидные и супероксидные ионы, приведены в таблице \(\PageIndex{2}\). За немногими исключениями, химия кислорода ограничена отрицательными степенями окисления из-за его высокой электроотрицательности (χ = 3.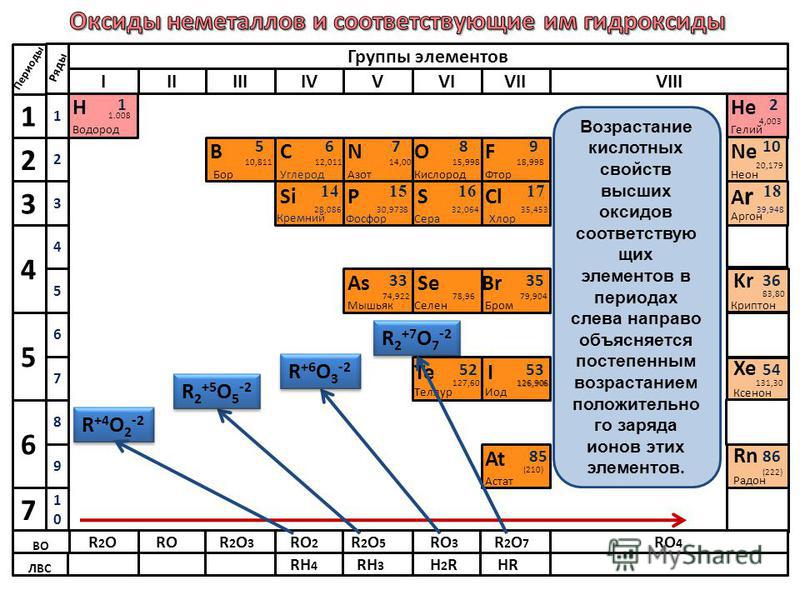 4). В отличие от других халькогенов кислород не образует соединений в степени окисления +4 или +6. Кислород уступает только фтору по способности стабилизировать высокие степени окисления металлов как в ионных, так и в ковалентных соединениях. Например, AgO — стабильное твердое вещество, содержащее серебро в необычном состоянии Ag(II), тогда как OsO 4 — летучее твердое вещество, содержащее Os(VIII). Поскольку кислород настолько электроотрицателен, связь O–H сильно полярна, создавая большой дипольный момент связи, что делает водородные связи гораздо более важными для соединений кислорода, чем для аналогичных соединений других халькогенов.
4). В отличие от других халькогенов кислород не образует соединений в степени окисления +4 или +6. Кислород уступает только фтору по способности стабилизировать высокие степени окисления металлов как в ионных, так и в ковалентных соединениях. Например, AgO — стабильное твердое вещество, содержащее серебро в необычном состоянии Ag(II), тогда как OsO 4 — летучее твердое вещество, содержащее Os(VIII). Поскольку кислород настолько электроотрицателен, связь O–H сильно полярна, создавая большой дипольный момент связи, что делает водородные связи гораздо более важными для соединений кислорода, чем для аналогичных соединений других халькогенов.
| Виды | Поручение на залог | Количество непарных e − | Расстояние O–O (м)* |
|---|---|---|---|
*Источник данных: Лаури Васька, «Микрокислород-металлические комплексы: к единому взгляду», Accounts of Chemical Research 9 (1976): 175. |
|||
| О 2 + | 2,5 | 1 | 112 |
| «> О 2 | 2 | 2 | 121 |
| О 2 − | «> 1,5 | 1 | 133 |
| О 2 2− | 1 | «> 0 | 149 |
Оксиды металлов обычно являются основными, а оксиды неметаллов — кислотными, тогда как оксиды элементов, лежащих на диагональной полосе полуметаллов или рядом с ней, обычно являются амфотерными.Некоторые оксиды, такие как CO и PbO 2 , нейтральны и не реагируют с водой, водной кислотой или водным основанием. Оксиды неметаллов обычно представляют собой ковалентные соединения, в которых связи между кислородом и неметаллом поляризованы (E δ + –O δ– ). Следовательно, неподеленная пара электронов на молекуле воды может атаковать частично положительно заряженный атом Е, в конечном итоге образуя оксокислоту. Примером может служить реакция триоксида серы с водой с образованием серной кислоты:
.\[H_2O_{(l)} + SO_{3(g)} \rightarrow H_2SO_{4(aq)} \label{2}\]
Оксиды полуметаллов и таких элементов, как Al, лежащие вблизи линии разделения металл/неметалл, как мы и ожидали, амфотерны:
\[Al_2O_{3(s)} + 6H^+_{(водн. -_{4(водн.)} \label{4}\]
-_{4(водн.)} \label{4}\]
Оксиды металлов имеют тенденцию быть основными, оксиды неметаллов имеют тенденцию быть кислыми, а оксиды элементов в диагональной полосе полуметаллов или рядом с ней обычно являются амфотерными.
Пример \(\PageIndex{1}\)
Для каждой реакции объясните, почему образуются данные продукты.
- Ga 2 O 3 (т) + 2OH − (водн.) + 3H 2 O(ж) → 2Ga(OH) 4 − (2водн.)
- 3H 2 O 2 O 2 (AQ) + 2MNO 4 — (AQ) + 2H + (AQ) → 3O 2 (G) + 2MNO 2 (ы) + 4H 2 О(л)
- KNO 3 (s) \(\xrightarrow{\Delta}\) KNO(s) + O 2 (g)
Дано: сбалансированное химическое уравнение
Вопрос: почему данные продукты формируют
Стратегия:
Классифицировать тип реакции.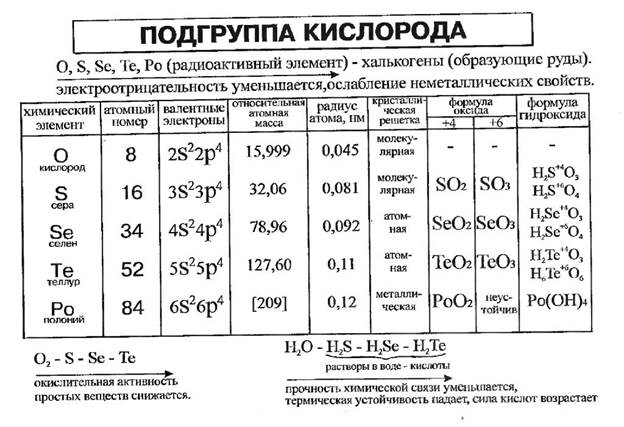 Используя периодические тенденции в атомных свойствах, термодинамике и кинетике, объясните, почему образуются наблюдаемые продукты реакции.
Используя периодические тенденции в атомных свойствах, термодинамике и кинетике, объясните, почему образуются наблюдаемые продукты реакции.
Решение:
- Галлий — это металл. Мы ожидаем, что оксиды металлических элементов будут основными и, следовательно, не будут реагировать с водным основанием. Однако при внимательном рассмотрении периодической таблицы видно, что галлий находится близко к диагональной линии полуметаллов. Более того, алюминий, элемент, находящийся непосредственно над галлием в группе 13, является амфотерным. Следовательно, мы предсказываем, что галлий будет вести себя как алюминий (уравнение \(\ref{4}\)).
- Перекись водорода — это окислитель, который может принять два электрона на молекулу, образуя две молекулы воды. Однако с сильным окислителем H 2 O 2 также может действовать как восстановитель, теряя два электрона (и два протона) с образованием O 2 . Поскольку другим реагентом является перманганат, который является сильным окислителем, единственной возможной реакцией является окислительно-восстановительная реакция, в которой перманганат является окислителем, а перекись водорода — восстановителем.
 Напомним, что восстановление перманганата часто дает MnO 2 , нерастворимое коричневое твердое вещество.Восстановление MnO 4 — до MnO 2 представляет собой трехэлектронное восстановление, тогда как окисление H 2 O 2 до O 2 представляет собой двухэлектронное окисление.
Напомним, что восстановление перманганата часто дает MnO 2 , нерастворимое коричневое твердое вещество.Восстановление MnO 4 — до MnO 2 представляет собой трехэлектронное восстановление, тогда как окисление H 2 O 2 до O 2 представляет собой двухэлектронное окисление. - Это реакция термического разложения. Поскольку KNO 3 содержит азот в высшей степени окисления (+5) и кислород в самой низкой степени окисления (-2), вероятна окислительно-восстановительная реакция. Окисление кислорода в нитрате до атомарного кислорода представляет собой двухэлектронный процесс, приходящийся на один атом кислорода.Азот, вероятно, принимает два электрона, потому что оксоанионы азота известны только в +5 (NO 3 — ) и +3 (NO 2 — ) степени окисления.
Упражнение \(\PageIndex{2}\)
Предскажите продукт(ы) каждой реакции и напишите сбалансированное химическое уравнение для каждой реакции.
- SiO 2 (т) + H + (водн.) →
- NO(г) + O 2 (г) →
- SO 3 (г) + H 2 O(ж) →
- H 2 O 2 (водн.) + I – (водн.) →
Ответить
- SiO 2 (т) + H + (водн.) → нет реакции
- 2NO(г) + O 2 (г) → 2NO 2 (г)
- SO 3 (г) + H 2 O(ж) → H 2 SO 4 (водн.)
- H 2 O 2 (водн.) + 2I − (водн.) → I 2 (водн.) + 2OH − (водн.)
Реакции и соединения более тяжелых халькогенов
Поскольку большинство более тяжелых халькогенов (группа 16) и пникогенов (группа 15) являются неметаллами, они часто образуют сходные соединения.Например, оба элемента третьего периода этих групп (фосфор и сера) образуют катенированные соединения и образуют множественные аллотропы. В соответствии с периодическими тенденциями тенденция к цепной связи уменьшается по мере продвижения вниз по колонке.
В соответствии с периодическими тенденциями тенденция к цепной связи уменьшается по мере продвижения вниз по колонке.
Сера и селен образуют довольно обширный ряд цепных соединений. Например, элементарная сера образует кольца S 8 , упакованные вместе в виде сложного «коленчатого вала» (рис. \(\PageIndex{2}\)), а расплавленная сера содержит длинные цепочки атомов серы, соединенных связями S–S.Более того, и сера, и селен образуют полисульфиды (S n 2− ) и полиселениды (Se n 2− ) с n ≤ 6. Единственным стабильным аллотропом теллура является серебристо-белое вещество, свойства которого и по структуре аналогичны одному из аллотропов селена. Полоний, напротив, не проявляет склонности к образованию катенированных соединений. Поразительное снижение структурной сложности от серы к полонию согласуется с уменьшением прочности одинарных связей и усилением металлического характера по мере продвижения вниз по группе.
Рисунок \(\PageIndex{2}\): Структуры известных фторидов серы. Известно пять устойчивых фторидов серы, содержащих серу в степенях окисления от +1 до +6. Все они представляют собой летучие молекулярные соединения, которые сильно различаются по стабильности и токсичности. Хотя и SF 6 , и S 2 F 10 очень стабильны, S 2 F 10 токсичен, а SF 6 – нет. Остальные три являются высокореактивными веществами.
Известно пять устойчивых фторидов серы, содержащих серу в степенях окисления от +1 до +6. Все они представляют собой летучие молекулярные соединения, которые сильно различаются по стабильности и токсичности. Хотя и SF 6 , и S 2 F 10 очень стабильны, S 2 F 10 токсичен, а SF 6 – нет. Остальные три являются высокореактивными веществами. Как и в группе 15, реакционная способность элементов в группе 16 уменьшается от самого легкого к самому тяжелому.Например, селен и теллур реагируют с большинством элементов, но не так легко, как сера. Как и ожидалось для неметаллов, сера, селен и теллур не реагируют с водой, водной кислотой или водным основанием, но все они растворяются в сильно окисляющих кислотах, таких как HNO 3 , с образованием оксокислот, таких как H 2 SO 4 . В отличие от других халькогенов полоний ведет себя как металл, растворяясь в разбавленной HCl с образованием растворов, содержащих ион Po 2 + .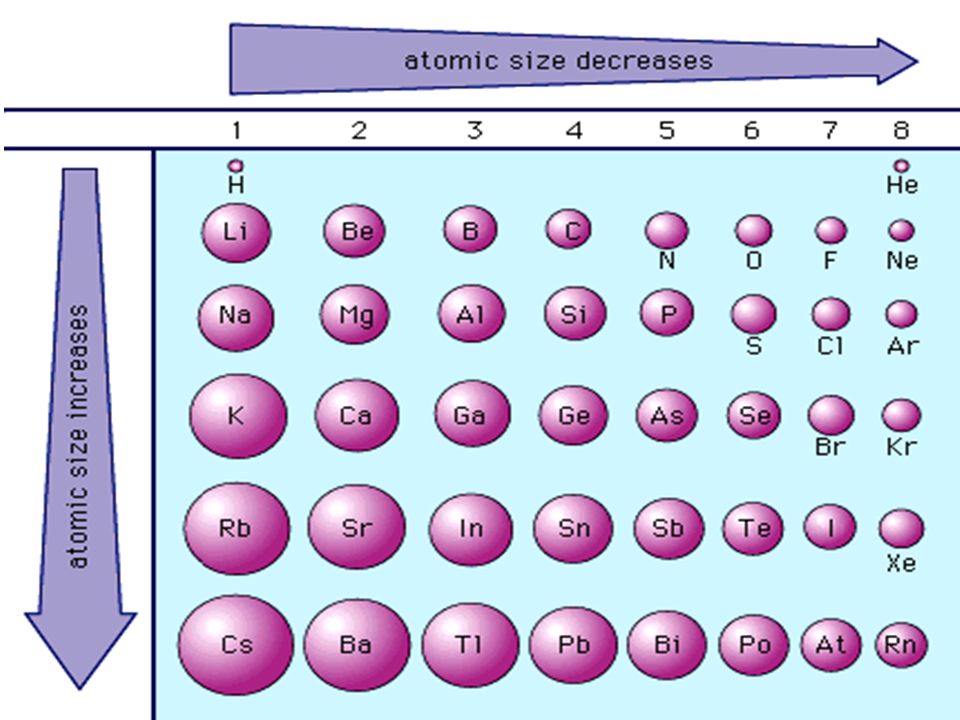
Так же, как и в других группах, склонность к катенированию, прочность одинарных связей и реакционная способность снижаются по группе.
Фтор непосредственно реагирует со всеми халькогенами, кроме кислорода, с образованием гексафторидов (YF 6 ), которые являются чрезвычайно стабильными и нереакционноспособными соединениями. Известны четыре дополнительных стабильных фторида серы; таким образом, степень окисления серы находится в диапазоне от +1 до +6 (рис. \(\PageIndex{2}\)). Напротив, только четыре фторида селена (SeF 6 , SeF 4 , FSeSeF и SeSeF 2 ) и только три фторида теллура (TeF 4 , TeF 6 8 7 8 10 ).
Прямая реакция более тяжелых халькогенов с кислородом при повышенных температурах дает диоксиды (YO 2 ), которые демонстрируют широкий спектр структур и свойств. Как и ожидалось, диоксиды приобретают все более металлический характер вниз по группе, а координационное число халькогена неуклонно увеличивается. Таким образом, SO 2 представляет собой газ, содержащий молекулы V-образной формы (как предсказывает модель отталкивания электронных пар валентной оболочки), SeO 2 представляет собой белое твердое вещество с бесконечной цепной структурой (каждый Se является трехкоординатным), TeO 2 представляет собой светло-желтое твердое вещество с сетчатой структурой, в котором каждый атом Te имеет четырехкоординатную структуру, а PoO 2 представляет собой желтое ионное твердое вещество, в котором каждый ион Po 4 + имеет восьмикоординатную структуру.
Таким образом, SO 2 представляет собой газ, содержащий молекулы V-образной формы (как предсказывает модель отталкивания электронных пар валентной оболочки), SeO 2 представляет собой белое твердое вещество с бесконечной цепной структурой (каждый Se является трехкоординатным), TeO 2 представляет собой светло-желтое твердое вещество с сетчатой структурой, в котором каждый атом Te имеет четырехкоординатную структуру, а PoO 2 представляет собой желтое ионное твердое вещество, в котором каждый ион Po 4 + имеет восьмикоординатную структуру.
Диоксиды серы, селена и теллура реагируют с водой с образованием слабых дипротонных оксокислот (H 2 YO 3 — сернистая, селенистая и теллуровая кислоты соответственно). И серная кислота, и селеновая кислота (H 2 SeO 4 ) являются сильными кислотами, но теллуровая кислота [Te(OH) 6 ] совершенно другая. Поскольку теллур больше, чем сера или селен, он образует более слабые π-связи с кислородом. В результате наиболее стабильной структурой теллуровой кислоты является Te(OH) 6 с шестью связями Te–OH, а не связями Te=O.Поэтому теллуровая кислота в водном растворе ведет себя как слабая трипротонная кислота, последовательно теряя атомы водорода, связанные с тремя атомами кислорода. Как и ожидалось для соединений, содержащих элементы в наиболее доступной степени окисления (в данном случае +6), серная, селеновая и теллуровая кислоты являются окислителями. Поскольку стабильность высшей степени окисления снижается с увеличением атомного номера, теллуровая кислота является более сильным окислителем, чем серная кислота.
В результате наиболее стабильной структурой теллуровой кислоты является Te(OH) 6 с шестью связями Te–OH, а не связями Te=O.Поэтому теллуровая кислота в водном растворе ведет себя как слабая трипротонная кислота, последовательно теряя атомы водорода, связанные с тремя атомами кислорода. Как и ожидалось для соединений, содержащих элементы в наиболее доступной степени окисления (в данном случае +6), серная, селеновая и теллуровая кислоты являются окислителями. Поскольку стабильность высшей степени окисления снижается с увеличением атомного номера, теллуровая кислота является более сильным окислителем, чем серная кислота.
Стабильность высшей степени окисления халькогенов снижается вниз по колонке.
Сера и, в меньшей степени, селен реагируют с углеродом, образуя обширный ряд соединений, структурно сходных с их кислородными аналогами. Например, CS 2 и CSe 2 являются летучими жидкостями, которые содержат связи C=S или C=Se и имеют ту же линейную структуру, что и CO 2 . Однако, поскольку эти двойные связи значительно слабее связи C=O, CS 2 , CSe 2 и родственные соединения менее стабильны и более реакционноспособны, чем их кислородные аналоги.Халькогены также реагируют непосредственно почти со всеми металлами с образованием соединений с широким диапазоном стехиометрии и разнообразной структурой. Халькогениды металлов могут содержать либо простой халькогенид-ион (Y 2-), как в Na 2 S и FeS, либо полихалькогенид-ионы (Y n 2-), как в FeS 2 7 8 и Na . 2 S 5 .
Однако, поскольку эти двойные связи значительно слабее связи C=O, CS 2 , CSe 2 и родственные соединения менее стабильны и более реакционноспособны, чем их кислородные аналоги.Халькогены также реагируют непосредственно почти со всеми металлами с образованием соединений с широким диапазоном стехиометрии и разнообразной структурой. Халькогениды металлов могут содержать либо простой халькогенид-ион (Y 2-), как в Na 2 S и FeS, либо полихалькогенид-ионы (Y n 2-), как в FeS 2 7 8 и Na . 2 S 5 .
Диоксиды элементов группы 16 становятся все более основными, и координационное число халькогена неуклонно увеличивается вниз по группе.
Ионные халькогениды, такие как Na 2 S, реагируют с водной кислотой с образованием бинарных гидридов, таких как сероводород (H 2 S). Поскольку прочность связи Y–H уменьшается с увеличением атомного радиуса, стабильность бинарных гидридов быстро снижается вниз по группе. Возможно, удивительно, что сероводород с его знакомым запахом тухлых яиц гораздо более токсичен, чем цианистый водород (HCN) — газ, которым казнили заключенных в «душегубках». Сероводород в относительно низких концентрациях ослабляет обонятельные рецепторы в носу, что позволяет ему достичь токсического уровня без обнаружения и делает его особенно опасным.
Возможно, удивительно, что сероводород с его знакомым запахом тухлых яиц гораздо более токсичен, чем цианистый водород (HCN) — газ, которым казнили заключенных в «душегубках». Сероводород в относительно низких концентрациях ослабляет обонятельные рецепторы в носу, что позволяет ему достичь токсического уровня без обнаружения и делает его особенно опасным.
Пример \(\PageIndex{2}\)
Для каждой реакции объясните, почему данный продукт образуется или реакция не происходит.
- SO 2 (г) + Cl 2 (г) → SO 2 Cl 2 (л)
- SF 6 (г) + H 2 O(ж) → нет реакции
- 2Se(т) + Cl 2 (г) → Se 2 Cl 2 (л)
Дано: сбалансированное химическое уравнение
Запрошено: почему данные продукты (или отсутствие продуктов) формируют
Стратегия:
Классифицировать тип реакции.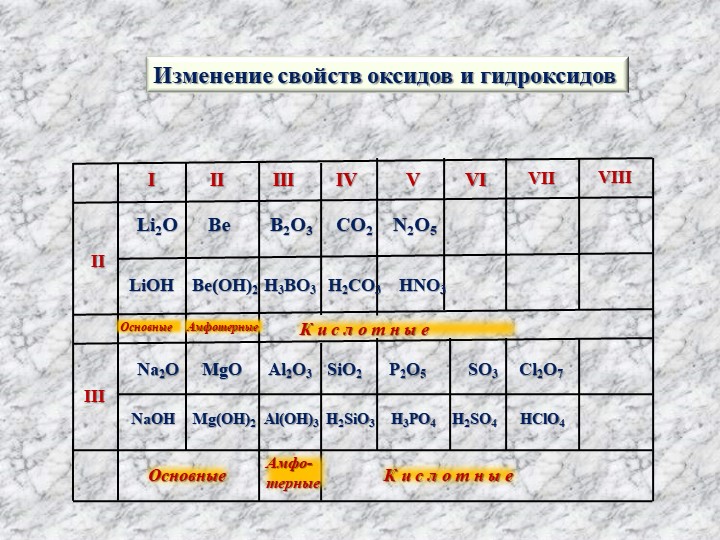 Используя периодические тенденции в атомных свойствах, термодинамике и кинетике, объясните, почему образуются продукты реакции или почему реакция не происходит.
Используя периодические тенденции в атомных свойствах, термодинамике и кинетике, объясните, почему образуются продукты реакции или почему реакция не происходит.
Решение:
- Один из реагентов (Cl 2 ) является окислителем. Если другой реагент может быть окислен, то вероятна окислительно-восстановительная реакция. Диоксид серы содержит серу в степени окисления +4, что на 2 меньше ее максимальной степени окисления. Также известно, что диоксид серы является мягким восстановителем в водном растворе, образуя серную кислоту в качестве продукта окисления.Следовательно, возможна окислительно-восстановительная реакция. Простейшей реакцией является образование SO 2 Cl 2 (сульфурилхлорид), представляющего собой тетраэдрическую форму с двумя связями S–Cl и двумя связями S=O.
- Гексафторид серы представляет собой галогенид неметалла. Такие соединения обычно энергично реагируют с водой с образованием оксокислоты неметалла и соответствующей галогеноводородной кислоты.
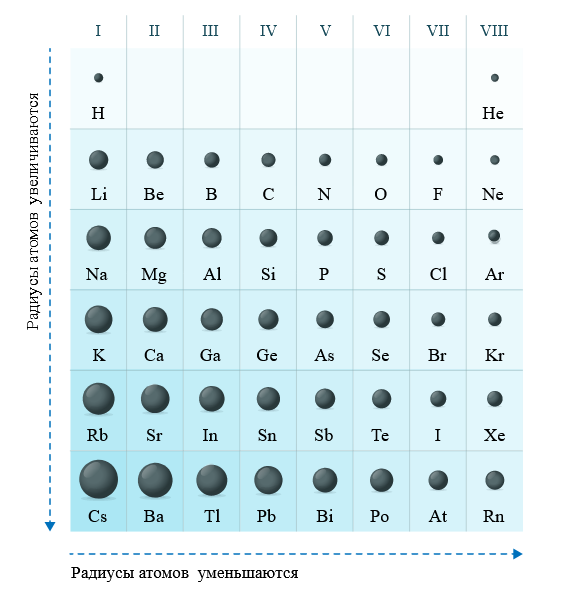 Однако в этом случае мы имеем очень стабильный вид, по-видимому, потому, что все доступные орбитали серы являются связывающими орбиталями.Таким образом, SF 6 вряд ли будет реагировать с водой.
Однако в этом случае мы имеем очень стабильный вид, по-видимому, потому, что все доступные орбитали серы являются связывающими орбиталями.Таким образом, SF 6 вряд ли будет реагировать с водой. - Здесь мы имеем реакцию халькогена с галогеном. Галоген является хорошим окислителем, поэтому мы можем ожидать, что произойдет окислительно-восстановительная реакция. Только фтор способен окислять халькогены до степени окисления +6, поэтому мы должны выбрать между SeCl 4 и Se 2 Cl 2 в качестве продукта. Стехиометрия реакции определяет, что из двух получится: SeCl 4 или Se 2 Cl 2 .
Упражнение \(\PageIndex{2}\)
Предскажите продукты каждой реакции и напишите сбалансированное химическое уравнение для каждой реакции.
- Te(s) + Na(s) \(\xrightarrow{\Delta}\)
- SF 4 (ж) + H 2 O(ж) →
- CH 3 SeSeCH 3 (раствор) + K(s) →
- Li 2 Se(s) + H + (водн.
 ) →
) →
Ответить
- Te(s) + 2Na(s) → Na 2 Te(s)
- SF 4 (г) + 3H 2 O(ж) → H 2 SO 3 (водн.) + 4HF (водн.)
- CH 3 SeSeCH 3 (раствор) + 2K(s) → 2KCH 3 Se(раствор)
- Li 2 Se(т) + 2H + (водн.) → H 2 Se(г) + 2Li + (водн.)
Резюме
В халькогенах нет стабильных металлических элементов.Склонность к катенированию, прочность одинарных связей и реакционная способность уменьшаются при движении вниз по группе. Поскольку электроотрицательность халькогенов уменьшается вниз по группе, уменьшается и их тенденция приобретать два электрона с образованием соединений в степени окисления -2. Самый легкий член, кислород, имеет наибольшую склонность к образованию множественных связей с другими элементами. Однако он не образует стабильных цепных соединений из-за отталкивания между неподеленными парами электронов на соседних атомах. Из-за его высокой электроотрицательности химия кислорода обычно ограничивается соединениями, в которых он имеет отрицательную степень окисления, а его связи с другими элементами имеют тенденцию быть сильно полярными.Оксиды металлов обычно являются основными, а оксиды неметаллов — кислотными, тогда как оксиды элементов, расположенных вдоль границы между металлами и неметаллами, являются амфотерными. Реакционная способность, прочность множественных связей с кислородом и склонность к образованию катенированных соединений снижаются вниз по группе, тогда как максимальные координационные числа увеличиваются. Поскольку связи Te=O сравнительно слабы, наиболее устойчивая оксокислота теллура содержит шесть связей Te–OH. Стабильность высшей степени окисления (+6) снижается вниз по группе.Двойные связи между S или Se и атомами второго ряда слабее, чем аналогичные связи C=O, из-за меньшего перекрытия орбиталей. Стабильность бинарных гидридов снижается вниз по группе.
Из-за его высокой электроотрицательности химия кислорода обычно ограничивается соединениями, в которых он имеет отрицательную степень окисления, а его связи с другими элементами имеют тенденцию быть сильно полярными.Оксиды металлов обычно являются основными, а оксиды неметаллов — кислотными, тогда как оксиды элементов, расположенных вдоль границы между металлами и неметаллами, являются амфотерными. Реакционная способность, прочность множественных связей с кислородом и склонность к образованию катенированных соединений снижаются вниз по группе, тогда как максимальные координационные числа увеличиваются. Поскольку связи Te=O сравнительно слабы, наиболее устойчивая оксокислота теллура содержит шесть связей Te–OH. Стабильность высшей степени окисления (+6) снижается вниз по группе.Двойные связи между S или Se и атомами второго ряда слабее, чем аналогичные связи C=O, из-за меньшего перекрытия орбиталей. Стабильность бинарных гидридов снижается вниз по группе.
[Решено] Правильный порядок уменьшения энтальпии электронного усиления с
Концепция:
- Изменение энтальпии сопровождает процесс, в котором электронов присоединяются к нейтральному газообразному атому с образованием отрицательных ионов , называется энтальпией усиления электронов.
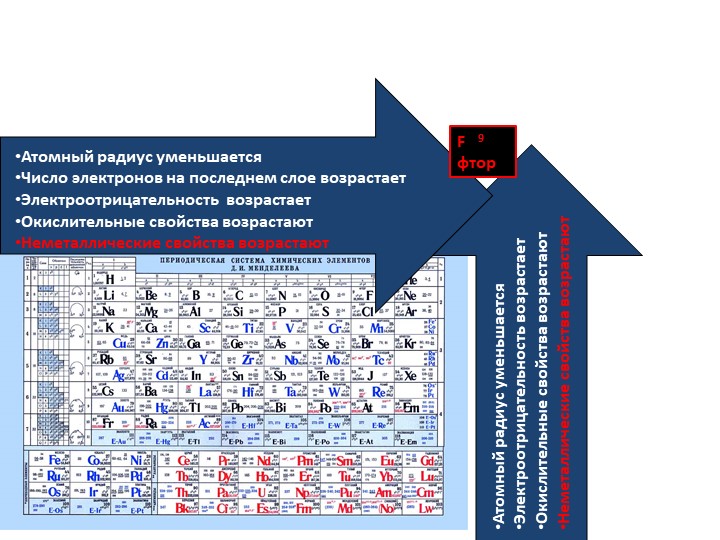
- В процессе присоединения электрона, так как свободный электрон связывается с атомом и попадает под влияние отрицательного заряда, его энергия становится меньше и, следовательно, выделяется тепло в основном в ходе этого процесса.
- Таким образом, значение энергии отрицательно, а Энтальпия усиления электронов имеет отрицательный знак .
- Знак минус указывает только на то, что происходит экзотермический процесс.
- Высокое сродство к электрону будет , обозначенным высокими отрицательными значениями энергии.
Тенденции вместе с периодической таблицей:
- При движении по периоду слева направо размер атома уменьшается, а заряд ядра увеличивается. это увеличивает сродство элементов к электрону, и энтальпия приращения электронов становится все более и более отрицательной. Таким образом, энтальпия приращения электронов становится более отрицательной при движении по периоду.
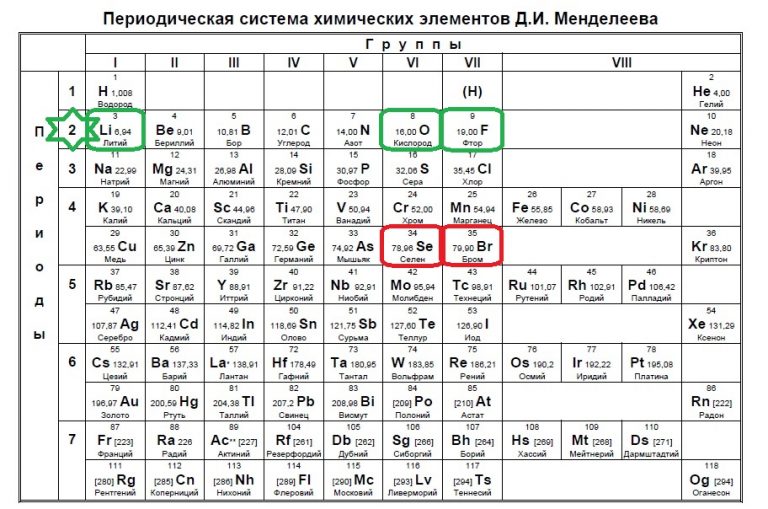
- При движении вниз по группе радиусы атомов увеличиваются, а сродство к электрону уменьшается.Это приводит к уменьшению энтальпии поглощения электронов по мере продвижения вниз по периоду. Следовательно, отрицательное значение энтальпии присоединения электронов уменьшается вниз по группе.
Металлы, имеющие высокое сродство к электрону, будут иметь большую склонность притягивать электроны и будут иметь высокую энтальпию поглощения электронов.
Объяснение:
Халькогены относятся к 16 группе периодической таблицы.
- Двигаясь вниз по группе 16, у нас есть O, S, Se, а затем Te.
- Мы знаем, что по мере продвижения вниз по группе энтальпия поглощения электронов уменьшается , поэтому тренд должен быть следующим: O > S > Se > Te.
- Но элементы периода 2 обычно имеют меньшую энтальпию поглощения электронов , потому что они имеют меньший, более компактный размер , что приводит к отталкиванию электронов с поступающими электронами.

- Таким образом, поскольку кислорода находится в периоде 2, у него будет на меньше энтальпия присоединения электронов, чем у всех других халькогенов.
Следовательно, правильный порядок: S > Se > Te > O.
Степени окисления элементов группы 16
Степени окисления элементов группы 16
Группа 16 принадлежит к p-блоку периодической таблицы, поскольку их последний электрон входит в p-орбиталь. Элементы группы 16 — это кислород (O), сера (S), селен (Se), теллур (Te) и полоний (Po). Эти элементы называются халькогенами/рудообразующими элементами. Полоний — радиоактивный элемент и нестабилен, селен и теллур — металлоиды, а остальные считаются неметаллами.Общая электронная конфигурация этих элементов, присутствующих в группе 16, представляет собой ns²np⁴. Валентность электронов элементов, присутствующих в группе 16, считается равной 6, что означает, что для достижения состояния октета требуется еще 2 электрона.
Степень окисления серы
Сера больше по размеру с пустой d-орбиталью 3d, что позволяет ей расширять свою валентность. В дополнение к степени окисления -2 сера проявляет степени окисления +2, +4 и +6 соответственно. Из них +4 и +6 являются обычными степенями окисления.
Степень окисления кислорода
Состояние кислорода относится к количеству электронов, полученных или потерянных элементом для достижения конфигурации благородного газа. Элемент может иметь только одну или несколько степеней окисления в зависимости от стабильности образующегося соединения. Состояние окисления элементов очень сильно зависит от электронной конфигурации элементов, а также от их электроотрицательности. Электроотрицательность – это способность элемента притягивать к себе электроны.Чем меньше элемент, тем больше будет его электроотрицательность.
Кислород обладает высокой электроотрицательностью и проявляет степень окисления -2 (приобретает 2 электрона) в большинстве оксидов металлов. В кислороде нет дополнительного места для размещения неспаренных электронов из-за его небольшого размера и отсутствия d-орбиталей. Но есть исключения. Кислород показывает степень окисления +2 в OF₂, степень окисления +1 в O₂F₂ и степень окисления -1 в перекиси водорода (H₂O₂).
В кислороде нет дополнительного места для размещения неспаренных электронов из-за его небольшого размера и отсутствия d-орбиталей. Но есть исключения. Кислород показывает степень окисления +2 в OF₂, степень окисления +1 в O₂F₂ и степень окисления -1 в перекиси водорода (H₂O₂).
Окисление Номер группы 16
| Element | Символ | Атомный номер | Электронная конфигурация | Электроотрицательность | ||
| Кислород | O | 8 | [He] 2s² 2p⁴ | 3.5 | ||
| Сера | S | 16 | [Н] 3s²3p⁴ | 2,44 | ||
| Селен | Se | 34 | [AR] 3D¹⁰4S²4P⁴ | 2. | ||
| TELLURIUM | TE | 52 | [KR] 4D¹⁰5S²5P⁴ | 2.01 | полоний | По | 84 | [Xe] 4f¹⁴, 5d¹⁰6s²6p⁴ | 1,76 |
Анализ приведенной выше таблицы важно, чтобы понять степени окисления элементов 16 группы.
По мере продвижения сверху вниз по группе периодической таблицы размер атомов увеличивается, а электроотрицательность уменьшается. Кроме того, когда мы движемся слева направо в периоде таблицы Менделеева, размер атома уменьшается.Электроотрицательность уменьшается от кислорода к теллуру, и, таким образом, их степень окисления увеличивается в одинаковой степени. Это также указывает на уменьшение ковалентности сверху вниз.
Кислород (O₂)
Кислород (O) — самый распространенный элемент на Земле. Считается, что его процент в атмосфере составляет около 23%. Кислород соединяется с большинством элементов, кроме благородных газов и металлов, таких как золото. Он также действует как хороший окислитель.
Он показывает аномальное поведение в группе 16 из-за его небольшого размера и высокой электроотрицательности.Кислород имеет самую высокую электроотрицательность после элемента фтора. Он считается парамагнитным с двумя неспаренными электронами, хотя у него четное число электронов (16). Кроме того, он все еще может увеличивать свою ковалентность до 4.
Степени окисления селена и теллура
Селен и теллур, по-видимому, проявляют степени окисления -2,+2,+4,+6 соответственно.
Степень окисления полония
Полоний проявляет степени окисления +4 и +2.
Полоний — радиоактивный металл с периодом полураспада всего 13. 8 дней, что означает, что его количество уменьшится до половины примерно за 14 дней. Полоний существует в природе как продукт распада минералов тория и урана.
8 дней, что означает, что его количество уменьшится до половины примерно за 14 дней. Полоний существует в природе как продукт распада минералов тория и урана.
При спуске сверху вниз вступает в действие эффект инертной пары, заставляющий пару электронов с самой внешней s-орбитали не принимать участия в связывании электронов. Таким образом, степень окисления +6 не является стабильной для низших элементов в группе 16. Кроме того, стабильность степени окисления -2 снижается вниз по группе из-за уменьшения электроотрицательности элементов.
В ряду элементов O S SE TE увеличивается. Общие закономерности изменения свойств простых веществ
Введение
Учебное пособие по химии халькогенов второе в серии по химии элементов основных подгрупп Периодической системы Д.И. Иметелеев. Она написана на основе курса лекций по неорганической химии, прочитанного в МГУ за последние 10 лет академиком Ю.Древякова и профессора В.П. Зломанов.
В отличие от ранее изданных методических разработок, в пособии представлен новый фактический материал (Кенация, разнообразие халькогенов оксокусов (VI) и др.), дано современное объяснение закономерностей изменения структуры и свойств халькогенов соединений с использованием представлений квантовой химии, включая молекулярные орбитали, релятивистский эффект и др. Материал пособия выбран с целью наглядной иллюстрации взаимосвязи между теоретическим курсом и практическими занятиями по неорганической химии.
[Предыдущий раздел] [Содержание]§ один. Общая характеристика халькогена (е).
К элементам VI главной подгруппы (или 16-й группы по новой номенклатуре УПАК) периодической системы элементов Д. И. Инделелеева относятся кислород (о), сера (S), селен (SE), теллур (TE ) и полоний (RO). Групповое название этих элементов — халькохеле (термин «халькоген» происходит от греческих слов «халкос» -мед и «генос» — рожденный), то есть «рожденные медные руды» связано с тем, что в природе они чаще всего находятся в виде соединений меди (сульфидов, оксидов, селенидов и др. ).
).
В основном состоянии атомы халькогенетов имеют электронную конфигурацию NS 2 NP 4 с двумя неспаренными P-электронами. Они принадлежат четным элементам. Некоторые свойства атомов халькогенов представлены в табл. 1.
При переходе от кислорода к полонию размеры атомов и их возможные координационные числа увеличиваются, а энергия ионизации (ион Е) и электроотрицательность (ЭО) уменьшаются. По электроотрицательности (ЭО) кислород уступает только атому фтора, а атомы серы и селена также уступают азоту, хлору, брому; Кислород, сера и селен относятся к типичным неметаллам.
В соединениях серы, селена, теллорура с кислородом и галогенами реализуются степени окисления +6, +4 и +2. С большинством других элементов они образуют халькогениды, где находятся в степени окисления -2.
Таблица 1. Стыковочные атомы элементов группы VI.
|
Свойства |
|||||
| Атомный номер | |||||
| Количество стабильных изотопов | |||||
| Электронная конфигурация |
3D 10 4S 2 4P 4 |
4D 10 5S 2 5P 4 |
4F 14 5D 10 6S 2 6P 4 |
||
| Ковалентный радиус, e | |||||
| Энергия первой ионизации, ион E, кДж/моль | |||||
| Электричество (полиэфир) | |||||
| Сродство атома к электрону, кДж/моль |
Устойчивость соединений с высшей степенью окисления снижается от теллура к полонию, для которого известны соединения со степенью окисления 4+ и 2+ (например, ПОКЛ 4, ПОКЛ 2, ПОО 2). Это может быть связано с увеличением прочности связи 6S 2 электронов с ядром из-за релятивистского эффекта . Суть его заключается в увеличении скорости движения и, соответственно, массы электронов в элементах с большим зарядом ядра (Z > 60). «Утяжеление» электронов приводит к уменьшению радиуса и увеличению энергии связи 6S-электронов с ядром. Более отчетливо этот эффект проявляется у соединений висмута, элементов V группы и других, рассмотренных в соответствующем руководстве.
Это может быть связано с увеличением прочности связи 6S 2 электронов с ядром из-за релятивистского эффекта . Суть его заключается в увеличении скорости движения и, соответственно, массы электронов в элементах с большим зарядом ядра (Z > 60). «Утяжеление» электронов приводит к уменьшению радиуса и увеличению энергии связи 6S-электронов с ядром. Более отчетливо этот эффект проявляется у соединений висмута, элементов V группы и других, рассмотренных в соответствующем руководстве.
Свойства кислорода, как и других элементов 2-го периода, отличаются от свойств их более тяжелых аналогов. Из-за высокой электронной плотности и сильного межэлектронного отталкивания сродство к электрону и прочность связи кислорода меньше, чем у серы. Связь Металл-кислород (М-о) более ионная, чем связи М-С, М-СЭ и т. д. В силу меньшего радиуса атома кислорода, в отличие от серы, способна образовывать твердо-связь ( Р — Р) с другими атомами — например, кислородом в молекуле озона, углеродом, азотом, фосфором.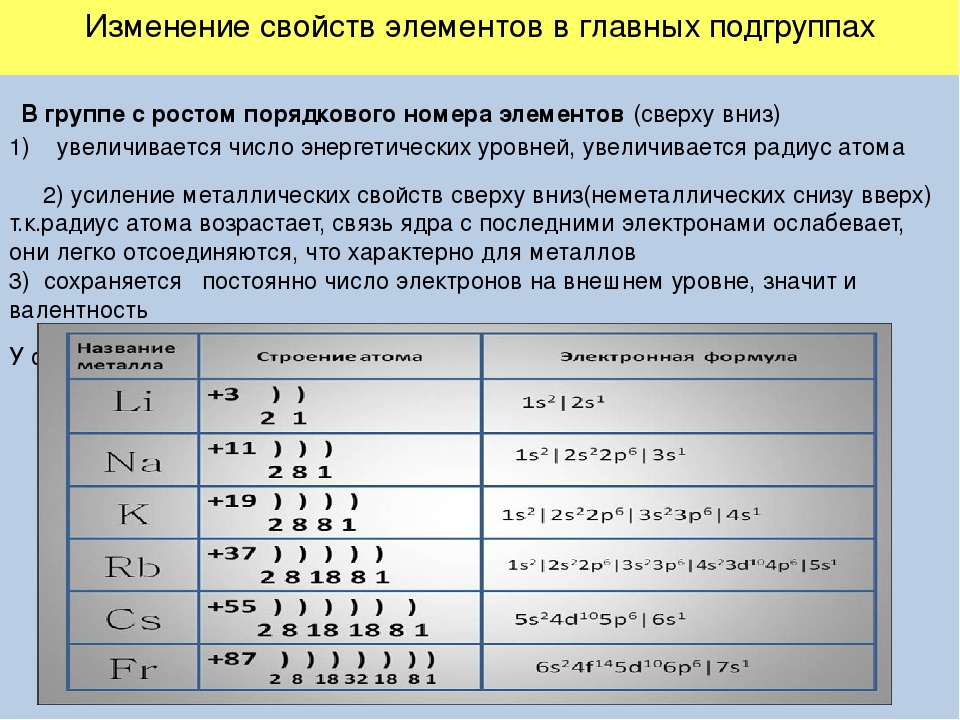 При переходе от кислорода к сере прочность одиночной связи растет за счет уменьшения межэлектронного отталкивания, а прочность — связи уменьшается, что связано с увеличением радиуса и уменьшением взаимодействия (перекрытия) Р-атомов. орбитали. Так, если для кислорода характерно образование кратных (+) связей, то для серы и ее аналогов — образование одноцепочечных связей — е-е (см. п. 2.1).
При переходе от кислорода к сере прочность одиночной связи растет за счет уменьшения межэлектронного отталкивания, а прочность — связи уменьшается, что связано с увеличением радиуса и уменьшением взаимодействия (перекрытия) Р-атомов. орбитали. Так, если для кислорода характерно образование кратных (+) связей, то для серы и ее аналогов — образование одноцепочечных связей — е-е (см. п. 2.1).
В свойствах серы, селена и теллура прослеживается больше аналогий, чем в свойствах кислорода и полония.Так, у соединений с отрицательными степенями окисления от серы до теллура восстановительные, а у соединений с положительными степенями окисления — окислительные свойства.
Полоний — радиоактивный элемент. Наиболее стабильный изотоп получается в результате бомбардировки ядерными нейтронами и последующей перетяжки:
(1/2 = 138,4 дня).
Распад полония сопровождается выделением большого количества энергии. Поэтому полоний и его соединения разлагают растворители и сосуды, в которых они хранятся, и исследование РО соединений представляет значительные трудности.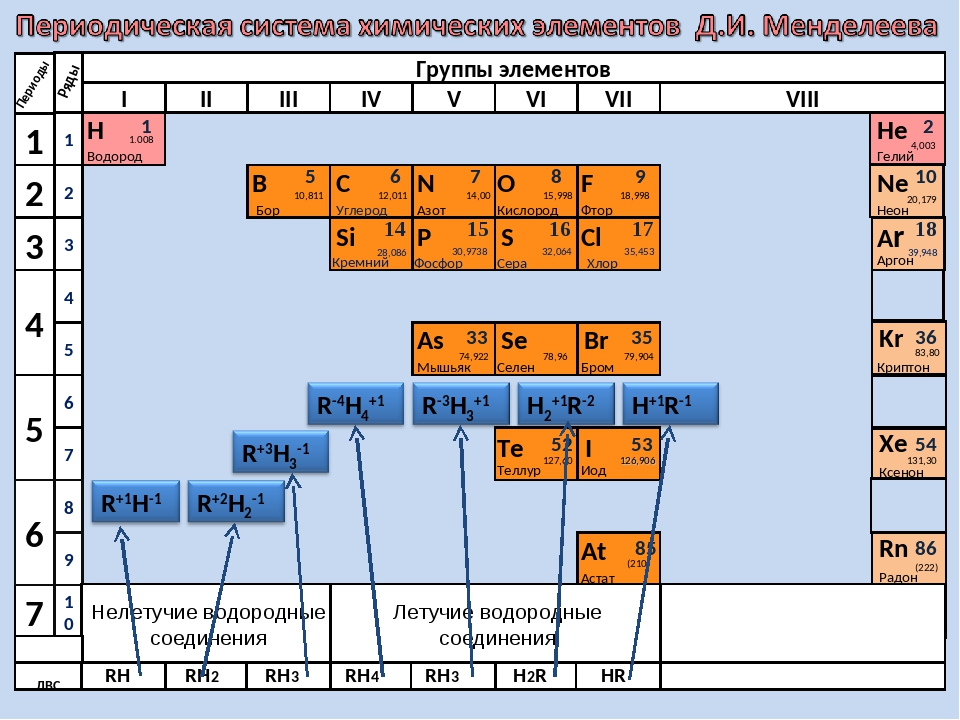
§ 2. Физические свойства простых веществ.
Таблица 2. Физические свойства простых веществ.
| Плотность |
Температуры, о С |
Теплота атомизации, кДж/моль |
Электрическое сопротивление (25 o C), ОМ. см |
|||
| плавка |
||||||
| С. | ||||||
| SE | шестн. | |||||
| 1. |
||||||
| Те шестн. | шестн. | |||||
| Только чтение | ||||||
С увеличением ковалентного радиуса в ряду межатомных взаимодействий O-SE-TE-PO и соответствующих температур фазовых переходов также энергии атомизации , то есть энергий перехода твердых простых веществ в состояние моноомного газа, увелич.Изменение свойств халькогенов от типичных неметаллов к металлам связано с уменьшением энергии ионизации (табл. 1) и особенностей структуры. Кислород и сера — типичные диэлектрики то есть неэлектрические вещества. Селен и теллур — полупроводники [Вещества, электрофизические свойства которых занимают промежуточное положение между свойствами металлов и неметаллов (диэлектрики). Электролюминесценция металлов уменьшается, а полупроводников увеличивается с повышением температуры, что связано с особенностями их электронной структуры)], а полония — металл.
Электролюминесценция металлов уменьшается, а полупроводников увеличивается с повышением температуры, что связано с особенностями их электронной структуры)], а полония — металл.
§ 2.1. Катетенация халькогенов. Аллотропия и полиморфизм .
Одним из характерных свойств атомов халькогена является их способность связываться друг с другом в виде колец или цепочек. Это явление называется kenation . Причина этого связана с разной прочностью одинарных и двойных связей. Рассмотрим это явление на примере серы (табл. 3).
Таблица 3.Энергия одинарных и двойных связей (кДж/моль).
Из приведенных значений следует, что образование двух одиночных
— Связь для серы вместо одного двойного (+), связанного с энергетическим выигрышем (530 — 421 = 109 Дж/моль). Для кислорода, наоборот, энергетически предпочтительнее одно двойное соединение (494-292 = 202 кДж/моль), чем два одинарных. Уменьшение прочности двойной связи при переходе от О к S связано с увеличением размера р-орбиталей и уменьшением их перекрывания.Так, по кислороду канодия ограничена небольшим количеством неустойчивых соединений: О 3 озон, О 4 F 2.
Уменьшение прочности двойной связи при переходе от О к S связано с увеличением размера р-орбиталей и уменьшением их перекрывания.Так, по кислороду канодия ограничена небольшим количеством неустойчивых соединений: О 3 озон, О 4 F 2.
С ценатом связаны аллотропия и полиморфизм простых веществ. Аллотропия — это способность одного и того же элемента существовать в разных молекулярных формах. Явление аллотропии относится к молекулам, содержащим разное количество атомов одного и того же элемента, например, О 2 и 3, S 2 и S 8, Р 2 и Р 4 и т. д.Понятие полиморфизма применимо только к твердым телам. Полиморфизм — Способность твердого тела с одинаковым составом иметь различную пространственную структуру. Примерами полиморфных модификаций являются моноклинная сера и ромбическая сера, состоящие из одних и тех же циклов S 8 , но размещенные в пространстве по-разному (см. п. 2.3). Рассмотрим сначала свойства кислорода и его аллотропной формы — озона, а затем полиморфизм серы, селена и теллура.
2.3). Рассмотрим сначала свойства кислорода и его аллотропной формы — озона, а затем полиморфизм серы, селена и теллура.
Дмитрий Иванович Менделеев открыл периодический закон, согласно которому свойства элементов и их периодически изменяются.Это открытие было графически отображено в таблице Менделеева. Таблица очень хороша и хорошо видно, как свойства элементов изменяются по периоду, после чего они повторяются в следующем периоде.
Чтобы решить задание №2 ЕГЭ по химии, нам достаточно понять и запомнить, какие свойства элементов в каких направлениях изменяются и как.
Все это отображено на рисунке ниже.
Слева направо: электроемкость, неметаллические свойства, высшие степени окисления и т. д.растут. А свойства металла и радиусы уменьшаются.
Сверху вниз наоборот: свойства металлов и радиусы атомов растут, а электроэлектричность падает. Высшая степень окисления, соответствующая числу электронов на внешнем энергетическом уровне, не изменяется в этом направлении.
Разберем на примерах.
Пример 1. У ряда элементов Na → Mg → Al → Si
А) радиусы атомов уменьшаются;
Б) количество протонов в ядрах атомов уменьшено;
В) увеличивается число электронных слоев в атомах;
Г) высшая степень окисления атомов снижена;
Если посмотреть на таблицу Менделеева, то мы увидим, что все элементы этого ряда находятся в одном периоде и перечислены в том порядке, в каком они стоят в таблице слева направо.Чтобы ответить на вопрос такого рода, нужно всего лишь знать несколько закономерностей изменения свойств в таблице Менделеева. Так слева направо по периоду свойства металлов падают, неметаллические растут, электротрикативность растет, энергия ионизации растет, радиус атомов уменьшается. По группе сверху вниз растут металлические и реабилитационные свойства, падает электросчитываемость, уменьшается энергия ионизации, растет радиус атомов.
Если вы были внимательны, то уже поняли, что в этом случае радиусы атомов уменьшаются.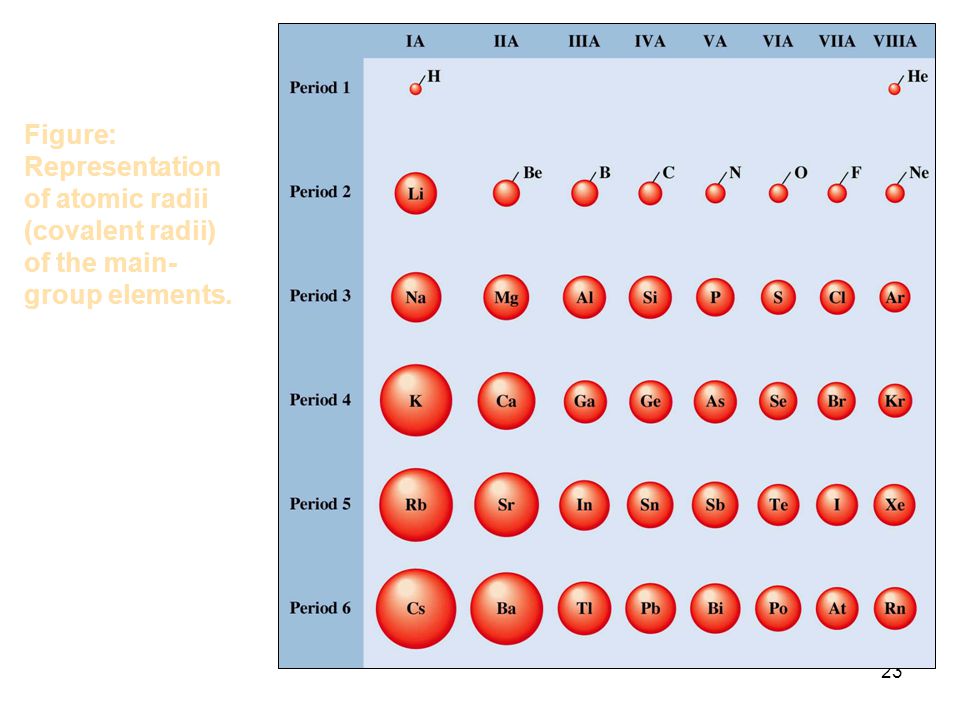 Ответ А.
Ответ А.
Пример 2. Для усиления окислительных свойств элементы располагаются в ряд:
А. F → О → N
Б. I → BR → CL
V. Cl → S → P
G. F → Cl → BR
Как известно, в периодической таблице Менделеева окислительные свойства возрастают слева направо по периоду и снизу вверх по группе. В варианте точно сокращаются элементы одной группы. Так что Б подходит.
Пример 3. Валентность элементов в высшем оксиде возрастает в ряду:
А.Cl → BR → I
B. CS → K → Li
V. Cl → S → P
G. Al → C → N
В высших оксидах элементы проявляют наивысшую степень окисления, которая будет совпадать с валентностью. Причем высшая степень окисления растет слева направо по таблице. Смотрим: В первом и втором варианте нам даны элементы, находящиеся в каких-то группах, там степень окисления выше и соответственно валентность в оксидах не меняется. CL→S→P – расположены справа слева, то есть у них наоборот валентность в высшем оксиде будет падать. А вот в ряду Al→C→N элементы располагаются слева – справа, с ними увеличивается валентность в высшем оксиде. Ответ: Г.
А вот в ряду Al→C→N элементы располагаются слева – справа, с ними увеличивается валентность в высшем оксиде. Ответ: Г.
Пример 4. В ряду элементов S → SE → TE
А) повышается кислотность водородных соединений;
Б) возрастает высшая степень окисления элементов;
В) повышается валентность элементов в водородных соединениях;
Г) уменьшается количество электронов на внешнем уровне;
Сразу смотрим расположение этих элементов в таблице Менделеева.Сера, селен и теллур находятся в одной группе, одной подгруппе. Они даны в порядке сверху вниз. Смотрим снова на схему выше. Сверху вниз в таблице Менделеева растут свойства металлов, растут радиусы, электротрикаты, энергия ионизации и неметаллические свойства, число электронов на внешнем уровне не меняется. Вариант r сразу исключающий. Если число внешних электронов не меняется, то валентные возможности и высшая степень окисления также не меняются, б и в — исключают.
Вариант А. остается под заказ. По схеме Косселя мощность кислородных кислот возрастает с уменьшением степени окисления элемента и увеличением радиуса его иона. Степень окисления у всех трех элементов одинакова в водородных соединениях, но радиус растет сверху вниз, значит, сила кислоты растет.
Степень окисления у всех трех элементов одинакова в водородных соединениях, но радиус растет сверху вниз, значит, сила кислоты растет.
Ответ — А.
Пример 5. В порядке ослабления основные свойства оксидов располагаются в ряду:
А.Na 2 O → K 2 O → RB 2 O
B. Na 2 O → MGO → Al 2 O 3
B. Beo → BaO → Cao
SO 3 → P 2 O 5 → SiO 2
Основные свойства оксидов ослабевают синхронно с ослаблением металлических свойств образующих их элементов. И метры ослабевают слева направо или снизу вверх. Na, Mg и Al просто расположены слева направо. Ответ Б.
химия, очень нужная! Как изменяются окислительные свойства в ряду элементов S — SE — TE — PO? Ответ уточнить.И получил лучший ответ
Ответ от џна Александровны Ткаченко [Активная]
В подгруппе кислорода с увеличением атомного номера увеличивается радиус атомов, уменьшается энергия ионизации, характеризующая металлические свойства элементов. Поэтому в ряду 0 — S — SE — TE — свойства элементов изменяются от неметаллических до металлических. При нормальных условиях кислород — типичный неметалл (газ), а полоний — металл, подобный свинцу.
При нормальных условиях кислород — типичный неметалл (газ), а полоний — металл, подобный свинцу.
С увеличением атомных номеров элементов значение электроперечислимости элементов в подгруппе уменьшается.Отрицательная степень окисления становится менее характерной. Окислительная степень окисления становится менее характерной. Окислительная активность простых веществ ряда 02 — С-СЭ — те снижается. Так, если сера и значительно слабее селена непосредственно взаимодействуют с водородом, то теллур в реакцию не вступает.
По значению электроотрицательности кислород уступает только Фектуру, поэтому в реакциях со всеми остальными элементами проявляют только окислительные свойства. Сера, селен и теллур в их свойствах.Ссылка на группу восстановителей. В реакциях с сильными восстановителями проявляются окислительные свойства, а при действии сильных окислителей. Они обладают окисляющими, то есть реабилитирующими свойствами.
Возможные валентность и степени окисления элементов шестой группы главной подгруппы с точки зрения строения атома.
Кислород, сера, селен, теллур и полоний составляют основную подгруппу группы VI. На внешнем энергетическом уровне атомы элементов этой подгруппы содержат 6 электронов, которые имеют конфигурацию S2P4 и распределяются по ячейкам следующим образом:
Ответ от 2 ответа [гуру]
Эй! Вот подборка тем с ответами на ваш вопрос: химия, очень нужная! Как изменяются окислительные свойства в ряду элементов S — SE — TE — PO? Ответ уточнить.
в ряду элементов О-СЭ, с увеличением порядкового номера химического элемента электроотрицательность 1) увеличивается. 2) умный.
O-S-SE — уменьшается
C-N-O-F — увеличивается
Фтор является электроотрицательным элементом.
, который из деревни Селена связан с двумя другими ковалентными связями.
Цепи расположены параллельно друг другу. Межмолекулярное взаимодействие происходит между однотипными соседними цепями. Температура плавления и кипения серого СЭ равны 219°С и 6850С. Фото
Фото
проводимость серого селена можно объяснить тем, что
света, электроны приобретают энергию, позволяющую преодолевать не-
большой барьер между валентной зоной и зоной проводимости, который используется
в фотоэлементах. Электропроводность селена в темноте очень мала, но сильно возрастает на свету. Менее устойчивые модификации селена
осень: красный селен, имеющий восьмиградусный цвет
ка, как сера, и черный стекловидный селен, в котором спиральные цепочки
уважаемый.
Теллур имеет две модификации: аморфный темно-коричневый и серебристый
.ристо-серый, со структурой, похожей на структуру серого селена. Температура плавления и кипения ТЕ — 450°С и 990°С.
Простые вещества способны проявлять восстановительные свойства и оксиды
тестовых свойства.
В ряду С, СЭ, ТЭ усиливается восстановительная способность простых веществ, снижается окислительная активность.
Реакция S (Т. ) + h3 СЭ (Г.) = h3 S (Г.) + SE (серый) показывает, что сера
) + h3 СЭ (Г.) = h3 S (Г.) + SE (серый) показывает, что сера
более сильный окислитель, чем селен.
С металлами селен и телевор реагируют при нагревании с образованием селена
dy и теллуриды.
2CU + SE = CU2 SE,
2АГ + ТЕ = АГ2 ТЕ.
Селен и теллур окисляются кислородом с образованием диоксидов
ЭО 2. Только при нагревании. На воздухе оба неметалла стабильны.
При окислении ЧЭ и ТЭ концентрированными азотной и серной кислотами получают селен и телевизионную кислоту.
Э + 2х3 SO4 = h3 ЭО3 + 2 SO2 + h3 О
При кипячении в щелочах селен и теллур непропорциональны.
3СЕ + 6КОН = 2К2 СЕ + К2 СЕО3 + 3х3 О
Связи Селены и Теллура
Селениды и теллуриды
Щелочные металлы, медь и серебро образуют селениды и соли нормальной стехиометрии, и их можно рассматривать как соли селена и тела
лудалогеновые кислоты. Известные природные селениды и теллуриды:
Cu2 SE, PBSE, CU2 TE, AG2 TE, PBTE.
Соединения селена и теллаура с водородом: h3 S и h3 TE — бесцветные ядовитые газы с очень неприятным запахом. Растворяется в воде с образованием
слабые кислоты. В ряду h3 S, h3 SE, h3 TE увеличивается сила кислот восстановления связи N-e, за счет увеличения размера атома. Прежде свойства улучшаются в той же строке. В водных растворах h3 SE и
h3 ТЭ быстро окисляется кислородом воздуха.
2х3 СЭ + О2 = 2 СЭ + 2х3 О.
Оксиды и кислородные кислоты Селена и Теллур
Диоксиды селена и теллура — Кристаллические вещества.
Оксид СЕ2 — хорошо растворим в воде, образуя селеновую кислоту
h3 SEO3. Оксид ТЭО2 плохо растворяется в воде. Оба оксида хорошо растворяются —
в щелочи, например:
СЕО2 + 2НАОН = НА2 СЕО3 + h3 О
Acid H 2 SEO 3 представляет собой твердое вещество белого цвета.
Теллиновая кислотаопишите формулу ТЭО 2. XH 2 O, что указывает на
по его переменному составу.
Селен и телевизионная кислота — слабые, Теллурист проявляет амфотерность.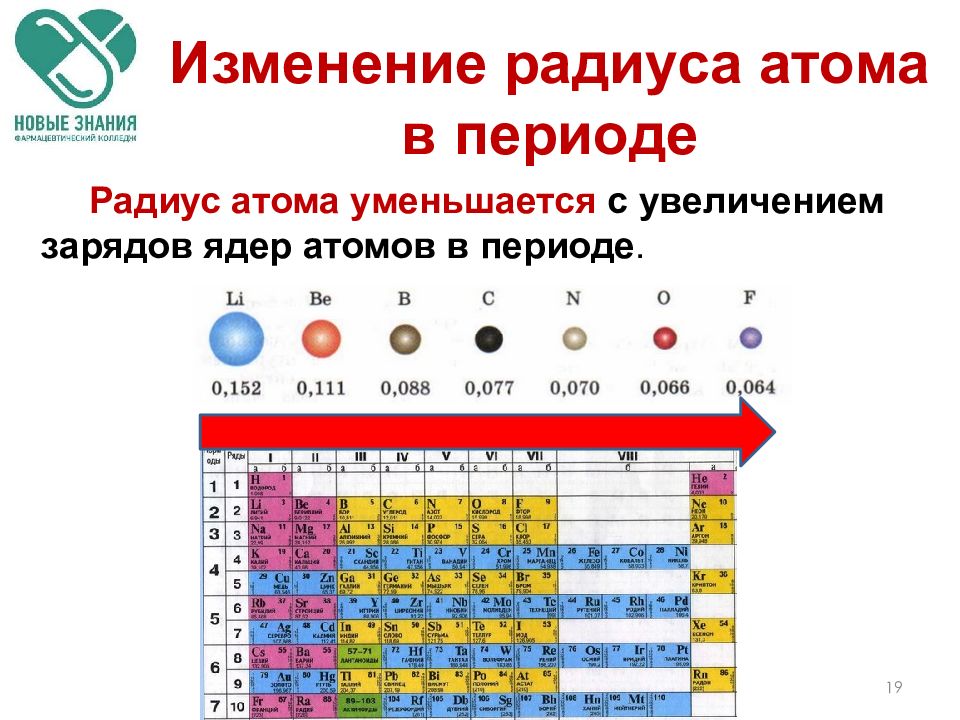 Селеновая кислота хорошо растворима, теллуровая эссенция
Селеновая кислота хорошо растворима, теллуровая эссенция
тянет только в разбавленном растворе.
Селениты и теллуритоподобные сульфиты. При действии на них сильных кислот получают селеновую и телевизионную кислоты.
Степень окисления (+4) в Selena и Tellur стабильна, но сильные окислители могут окислять соединения SE (+4) и TE (+4) до степени окисления
5х3 СЕО3 + 2КМnO4 + 3х3 SO4 = 5х3 СЕО4 + 2мнсО4 + К2 SO4 + 3х3 О
Восстановительные свойства соединений SE (+4) и TE (+4) выражены
справедливо слабее, чем в сере (+4).Следовательно, возможны реакции типа: h3 EO3 + 2SO2 + h3 O = E + 2h3 SO4
Таким образом можно выбрать красный селен и черный
Seleary Acid H.2 SEO 4 в чистом виде представляет собой бесцветное твердое вещество
.долевой, хорошо растворимый в воде. Тихая кислота близка к
сера. Теллуров — слабая кислота.
Теллуровая кислота имеет формулу H6 TEO6. Все шесть водорода
атома могут быть замещены атомами металлов, например, в солях:
АГ6 ТЭО6, ХГ3 ТЭО6.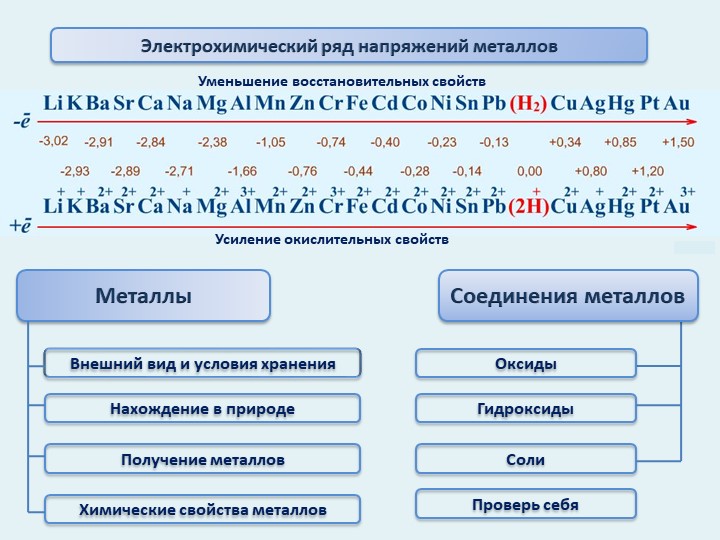 Это слабая кислота.
Это слабая кислота.
Селена и телевуровая кислота медленно действуют, но
окислителей, более сильных, чем серная кислота.
В концентрированной селеновой кислоте растворяется золото: 2au + 6 h3 SEO4 = AU2 (SEO4) 3 + 3 SEO2 +6 h3 O
Смесь концентрированного селена и соляной кислоты растворяет
ПТ + 2 h3 СЕО4 + 6HCl = h3 + 2 СЕО2 +4 h3 О
Триоксид ТЭО 3 — твердое вещество желтого цвета, не растворяющееся в воде,
ткачества и базы.ТЭО3 получают разложением ортотелуро-
маслянистая кислота при нагревании.
Триоксид СЕО 3 — твердое белое вещество, образованное молекулами
тример (SEO3) 3. Триоксид селена хорошо растворим в воде, обладает сильным
окислительные свойства. SEO3 получают путем выталкивания его из селениновой кислоты с триоксидом серы.
Галогениды селена и теллура. Известны многие галогениды селена и теллура (EF6, EF4, SEF2, TECL2), их получают прямым синтезом простых
Заключение
VIA-подгруппа формы р-элементов: O, S, SE, TE, PO.
Все они являются неметаллами, кроме Po.
Общая формула для валентных электронов: NS 2 NP 4.
Элементы ВИА-подгруппы часто объединяют под общим названием «Чал-
coans», что означает «образующие руды».
Наиболее характерные степени окисления в S, SE, TE: -2, +4, +6.
Минимальная степень окисления (-2) стабильна у всех эле-
Сера положительных степеней окисления более стабильна +6.
SE, TE наиболее стабилен при степени окисления +4.
Сера встречается в виде простого вещества, в виде сульфидных и сульфатных минералов. В сульфидных рудах в второстепенных количествах присутствуют селениды и телевизоры.
Простые вещества способны проявлять и окислительную и непокорную
жизненных свойства.
В ряду С, СЭ, ТЕ повышены восстановительные свойства простых веществ,
и снижается окислительная активность.
Сера, селен и телеур реагируют с металлами с образованием сульфидов,
лиденд и теллуриды, выступающие в качестве окислителей.
Sea Selenium и Tellur окисляются кислородом с образованием диоксидов EO2.
До степени окисления(-2) Все элементы образуют слабые кислые кислоты
h3 Э.
В ряду h3 S, h3 SE, h3 TE увеличивается сила кислот.
Соединения халькогена в степени окисления (-2) показывают
новых свойства. Они усиливаются при переходе с S на TE.
Все оксиды и гидроксиды халькогена обладают кислотными свойствами.
Сила кислот увеличивается с увеличением степени окисления и падает при
во время S до TE.
h3 SO4 и h3 SEO4 — сильные кислоты, h3 TEO6 кислота — слабая.
Кислотные элементы в степень окисления (+4) — слабая, и ТЭ оксид (+4)
показывает амфотерность.
Оксиды SO2 и SEO2 растворяются в воде. Оксид ТЭО2 плохо растворяется в воде. Все оксиды хорошо растворяются в щелочи.
ТриоксидыSO3 и SEO3 хорошо растворяются в воде, а TEO3 не растворяется.
Серная кислота является наиболее используемой кислотой, как и в химическом веществе
.тик и в промышленности.
Мировое производство h3SO4 составляет 136 млн т/год.
Соединения со степенью окисления +4 могут быть окислены и восстановлены
Для соединений S(+4) характерны восстанавливающие свойства.
Выражены восстановительные свойства соединений SE (+4) и TE (+4)
заметно слабее, чем в сере (+4).
Степень окисления (+4) у селена и телевора стабильна, но сильные окислители могут окислять СЭ (+4) и ТЭ (+4) до степени окисления (+6).
Серная кислота имеет в своем составе два окислителя: ион водорода и
сульфат-ион.
В разбавленной серной кислоте окисление металлов осуществляется за счет ионов водорода.
В концентрированной серной кислоте окислителем выступает сульфат-ион,
который можно восстановить до SO2, S, h3 S, в зависимости от прочности
смотрящий.
Селена и телевуровая кислота медленно действующие, но сильные
окислителей, более сильных, чем серная кислота.
1. Степин Б.Д., Цветов А.А. Неорганическая химия: Учебник для вузов / Б.Д.
Степин А.А. Цветы. — М.: Высшее. Шк., 1994.- 608 с.: ИЛ.
2. Карапетянц М.Х. Общая и неорганическая химия: Учебное пособие для студентов вузов / М.Х. Карапетянц, С.И. Дракин. -4-е изд., Чед. — М.: Химия, 2000. —
.3. Угай Я.А. Общая и неорганическая химия: Учебное пособие для студентов вузов,
студента по направлению и специальности «Химия» / Я.А. Угай. — 3-й
изд. — М.: Высшее. Шк., 2007. — 527 с.: ИЛ.
4. Никольский А.Б., Суворов А.В. Химия. Учебник для вузов /
А.Б. Никольский, А.В. Суворов.- СПБ: Химизма, 2001. — 512 с.: ил.
Соотношения S, Se и Te в силикатной Земле требуют богатого летучими веществами позднего покрытия
Уокер, Р. Дж. Высокосидерофильные элементы на Земле, Луне и Марсе: обновление и значение для планетарной аккреции и дифференциации. Химия . Эрде Геохим. 69 , 101–125 (2009)
КАС Статья Google Scholar
Манн, У., Фрост, Д.Дж., Руби, Д.К., Беккер, Х. и Одетат, А. Распределение Ru, Rh, Pd, Re, Ir и Pt между жидким металлом и силикатом при высоких давлениях и высокой температуры: значение для происхождения высокой концентрации сидерофильных элементов в мантии Земли. Геохим. Космохим. Acta 84 , 593–613 (2012)
АДС КАС Статья Google Scholar
Йи, В.и другие. Кадмий, индий, олово, теллур и сера в океанических базальтах: влияние на фракционирование халькофильных элементов в Земле. Ж. Геофиз. Рез. Твердая Земля 105 , 18927–18948 (2000)
CAS Статья Google Scholar
Rose-Weston, L., Brenan, JM, Fei, YW, Secco, RA & Frost, DJ Влияние давления, температуры и фугитивности кислорода на разделение металл-силикат Te, Se и S: последствия дифференциации Земли. Геохим. Космохим. Acta 73 , 4598–4615 (2009)
АДС КАС Статья Google Scholar
Дрейбус Г., Пальме Х., Шпеттель Б., Ципфель Дж. и Ванке Х. Сера и селен в хондритовых метеоритах. Метеоритика 30 , 439–445 (1995)
АДС КАС Статья Google Scholar
Лоддерс, К.Содержания Солнечной системы и температуры конденсации элементов. Астрофиз. J. 591 , 1220–1247 (2003)
АДС КАС Статья Google Scholar
Fischer-Gödde, M. & Becker, H. Изотоп осмия и высокосидерофильные элементы ограничивают возраст и природу метеоритных компонентов в древних лунных ударных породах. Геохим. Космохим. Acta 77 , 135–156 (2012)
АДС Статья Google Scholar
Марти Б.Происхождение и концентрация воды, углерода, азота и инертных газов на Земле. Планета Земля. науч. лат. 313–314 , 56–66 (2012)
АДС Статья Google Scholar
Абэ, Ю., Отани, Э., Окучи, Т., Райтер, К. и Дрейк, М. в Происхождение Земли и Луны (ред. Р. М. Канап и К. Райтер) 413–433 (Университет Аризоны Пресс, 2000)
Google Scholar
Вуд, Б.Дж., Уолтер, М.Дж. и Уэйд, Дж. Аккреция Земли и сегрегация ее ядра. Природа 441 , 825–833 (2006)
АДС КАС Статья Google Scholar
Шенбахлер, М., Карлсон, Р. В., Хоран, М. Ф., Мок, Т. Д. и Хаури, Э. Х. Гетерогенная аккреция и умеренно изменчивый баланс элементов Земли. Наука 328 , 884–887 (2010)
АДС Статья Google Scholar
Руби Д.С. и др. Гетерогенная аккреция, состав и ядро-мантийная дифференциация Земли. Планета Земля. науч. лат. 301 , 31–42 (2011)
АДС КАС Статья Google Scholar
Альбаред, Ф. История аккреции летучих планет земной группы и динамические последствия. Природа 461 , 1227–1233 (2009)
АДС Статья Google Scholar
Вуд, Б.J. & Halliday, AN. Изотопный возраст Земли по свинцу можно объяснить только формированием ядра. Природа 465 , 767–770 (2010)
АДС КАС Статья Google Scholar
Becker, H. et al. Высокосидерофильный элементный состав примитивной верхней мантии Земли: ограничения по новым данным о перидотитовых массивах и ксенолитах. Геохим. Космохим. Acta 70 , 4528–4550 (2006)
АДС КАС Статья Google Scholar
Фишер-Гёдде, М., Becker, H. & Wombacher, F. Родий, золото и другие высокосидерофильные элементы в орогенных перидотитах и ксенолитах перидотитов. Хим. геол. 280 , 365–383 (2011)
АДС Статья Google Scholar
Walker, R. J. et al. Сравнительная 187 Re- 187 Os систематика хондритов: последствия для ранних процессов Солнечной системы. Геохим. Космохим. Acta 66 , 4187–4201 (2002)
АДС КАС Статья Google Scholar
Майзель, Т., Уокер, Р.Дж., Ирвинг, А.Дж. и Лоранд, Дж.П. Изотопный состав осмия в ксенолитах мантии: глобальная перспектива. Геохим. Космохим. Acta 65 , 1311–1323 (2001)
АДС КАС Статья Google Scholar
Морган, Дж. В. Ультраосновные ксенолиты: ключи к поздней аккреционной истории Земли. Ж. Геофиз. Рез. Solid Earth 91 , 12375–12387 (1986)
Артикул Google Scholar
Макдонаф, В.Ф. и Сун С.С. Состав Земли. Хим. геол. 120 , 223–253 (1995)
АДС КАС Статья Google Scholar
Palme, H. & O’Neill, HSC в Treatise on Geochemistry Vol. 2 (редакторы HD Holland и KK Turekian) 1–38 (Pergamon, 2003)
Google Scholar
Лоранд, Дж. П. и Алард, О.Определение концентраций селена и теллура в пиренейских перидотитах (Арьеж, Франция): новый взгляд на систематику S/Se/Te верхних слоев мантии. Хим. геол. 278 , 120–130 (2010)
АДС КАС Статья Google Scholar
Wang, Z., Becker, H. & Gawronski, T. Частичное повторное уравновешивание высокосидерофильных элементов и халькогенов в мантии: тематическое исследование перидотитовых массивов Baldissero и Balmuccia (зона Ивреа, Итальянские Альпы) ). Геохим. Космохим. Acta 108 , 21–44 (2013)
АДС КАС Статья Google Scholar
Бодинье, Дж. Л. и Годар, М. в Трактат по геохимии Том. 2 (редакторы HD Holland и KK Turekian) 103–170 (Pergamon, 2003)
Google Scholar
Любецкая Т., Коренага Дж. Химический состав примитивной мантии Земли и его изменчивость: 1.Метод и результаты. Ж. Геофиз. Рез. Твердая земля 112 , B03211 (2007)
ОБЪЯВЛЕНИЕ Google Scholar
Александр, К.М.О.Д. и др. Происхождение астероидов и их вклад в запасы летучих планет земной группы. Наука 337 , 721–723 (2012)
АДС КАС Статья Google Scholar
Боттке, В.Ф., Уокер, Р.Дж., Дэй, Дж.М.Д., Несворни, Д. и Элкинс-Тантон, Л. Стохастическая поздняя аккреция на Землю, Луну и Марс. Наука 330 , 1527–1530 (2010)
АДС КАС Статья Google Scholar
Дженнер, Ф.Э. и О’Нил, Х.С.К. Анализ 60 элементов в 616 базальтовых стеклах океанского дна. Геохим. Геофиз. Геосист. 13 , Q02005 (2012)
ОБЪЯВЛЕНИЕ Google Scholar
Кениг, С., Луге А., Лоран Ж.-П., Вомбахер Ф. и Лисснер М. Систематика селена и теллура в мантии Земли на основе высокоточного анализа ультраистощенных орогенных перидотитов. Геохим. Космохим. Acta 86 , 354–366 (2012)
АДС Статья Google Scholar
Hertogen, J., Janssens, M.J. & Palme, H. Микроэлементы в базальтовых стеклах океанских хребтов: значение для фракционирования во время эволюции мантии и петрогенеза. Геохим. Космохим. Acta 44 , 2125–2143 (1980)
АДС КАС Статья Google Scholar
Фер, М. А., Рекампер, М. и Холлидей, А. Н. Применение MC-ICPMS для точного определения состава изотопов теллура в хондритах, железных метеоритах и сульфидах.

 , 400 о С)
, 400 о С)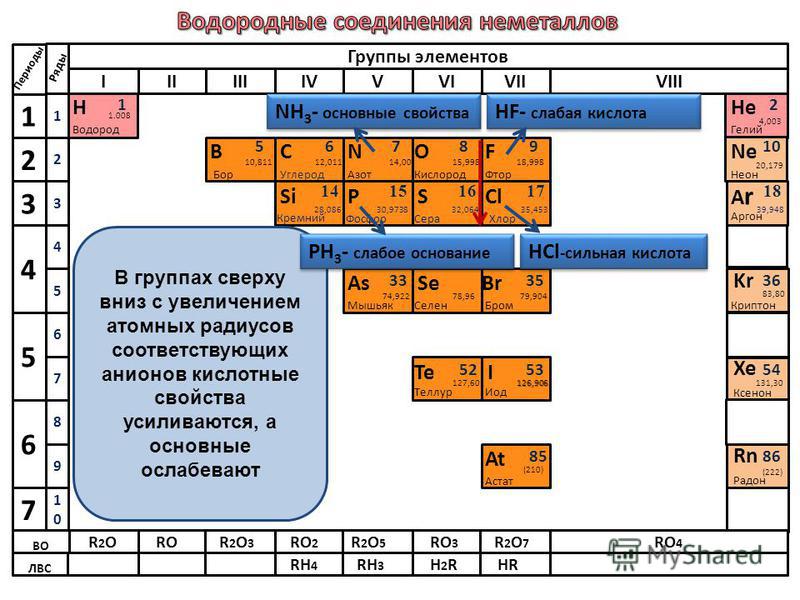 Главное и зависимое слово. Русский язык, 3 класс: уроки, тесты, задания.
Главное и зависимое слово. Русский язык, 3 класс: уроки, тесты, задания. 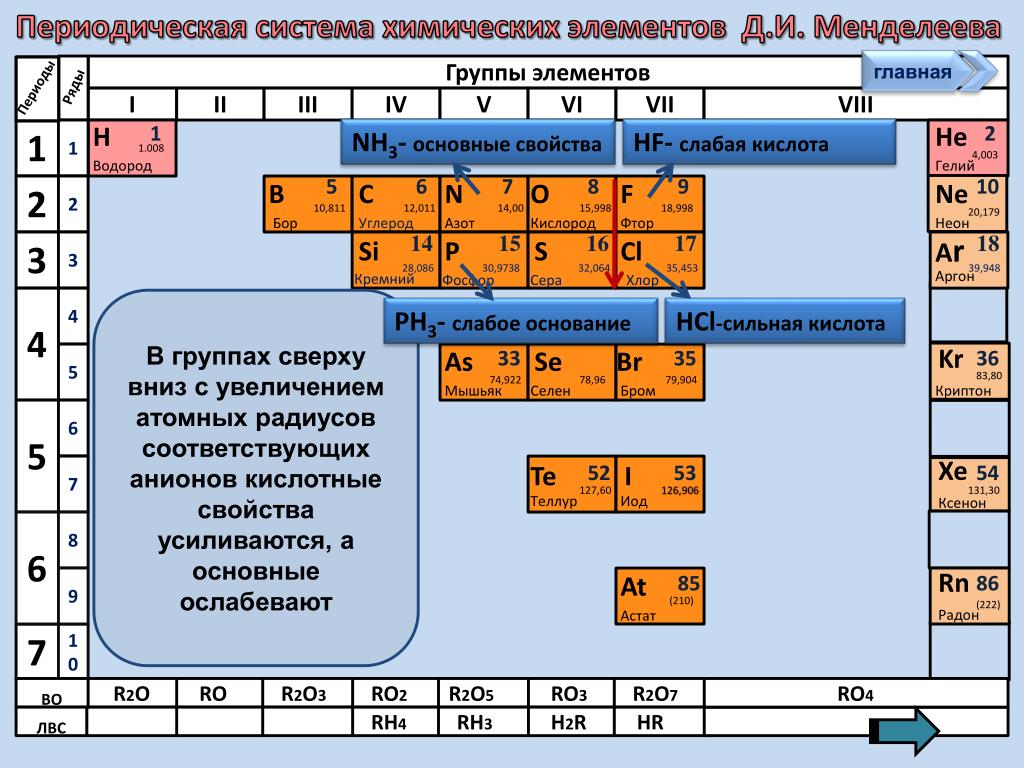 48
48 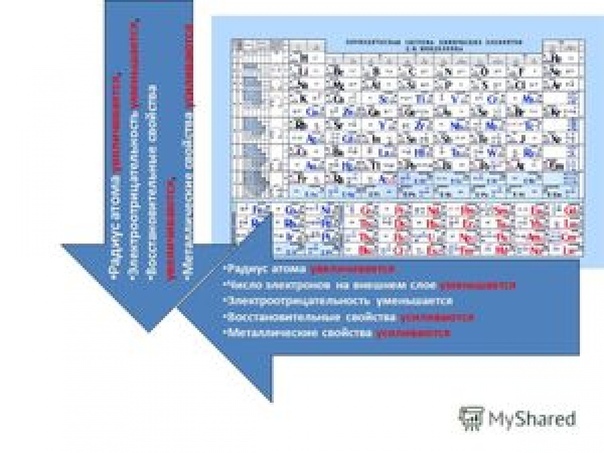 3. 10 5 (жидкость, 400 o C)
3. 10 5 (жидкость, 400 o C)