Женская грудь. Строение груди — ЕМЦ
Женская грудь — сложноорганизованный орган, построенных так, чтобы обеспечивать оптимальные условия для выполнения своих главных физиологических функций: образования молока и кормления ребенка. Грудь состоит из кожи, под которой скрывается собственно железа, как ее еще называют, железистая ткань — тот самый орган, в котором образуется молоко. Железистая ткань (железа) крепится с помощью соединительной ткани к мышцам грудной клеки. Вокруг железистой ткани, между ее долями лежит жир — жировая ткань.
Количество жира в женской груди варьирует в очень больших пределах. У некоторых женщин грудь состоит почти исключительно из жира. Как следствие, их грудь может сильно меняться в размерах при колебаниях массы тела.
У некоторых женщин железистой ткани намного больше, чем жира, и размер их груди от диет, от веса практически не зависит. Если рост жировой ткани можно форсировать обильным питанием, то рост железистой ткани частично управляется гормонами.
Под молочной железой лежит большая грудная мышца. Грудь как бы крепится к этой мышце, но в самой груди, вопреки распространенному убеждению, мышц нет, поэтому увеличить размер груди с помощью физических упражнений невозможно. Можно подтянуть вокруглежащие мышцы, но это приведет лишь к увеличению объема торса и не скажется на размере самой груди. Разумеется, и подтянуть отвисшую грудь с помощью физических упражнений невозможно.
Существует расхожее мнение, что после пластической операции грудь, как правило, теряет рефлекторную отзывчивость. Якобы при разрезе перерезаются нервы, вследствие чего грудь теряет чувствительность и перестает быть эрогенной (особенно чувствительной зоной). Это не совсем так. За чувствительность соска и ареолы отвечает 4 межреберный нерв. Он проходит на уровне подмышечной линии, разветвляется на две части и проходя по окружности груди входит в ткань железы.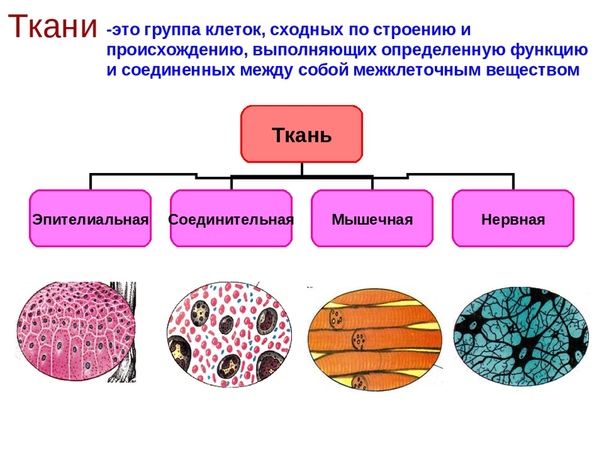
При операции этот нерв не перерезается, однако, если имплантат устанавливается неправильно, или устанавливается слишком большой имплантат, этот нерв может оказаться зажатым между протезом и грудной клеткой и защемиться. Если 4 межреберный нерв защемляется или повреждается, грудь может потерять чувствительность. Такое осложнение встречается у 21% женщин. Однако у первоклассных специалистов такого брака быть не должно.
Было бы неправильно, если б ученые остались в стороне от такого важного вопроса как правильные объем и форма женской груди. Среднестатистические параметры «идеальной» груди были рассчитаны путем долгих измерений классических и современных скульптур и живых моделей. За основу взяли женщину ростом 162 см, в возрасте 17 – 18 лет. После долгих споров большинство авторов признали следующие размеры: диаметр ареолы в среднем составляет 3.7 см (37 мм) и варьирует от 3.5 до 4.5 см. Расстояние между ключицей и соском в среднем составляет 21 см. Расстояние от подгрудной складки до соска составляет примерно 7 см.
Однако при анализе реального положения дел можно увидеть, как далеки мы от идеалов и как разноречивы вкусы различных авторов относительно размеров и объема молочных желез. Некоторые исследователи в качестве оптимального предлагают считать объем женской груди в 275 кубических сантиметров (размер С), а большие объемы считают гипертрофией, т.е. увеличением относительно средней нормы. Однако, в поиске идеала стоит обязательно учитывать такие особенности тела как рост, вес, особенности фигуры. Например, хрупкие женщины при росте 152 – 177 см и весе 45 — 54 кг выглядят гармонично развитыми, имея объем груди 150 – 200 куб. см. (размер В).
Имеются противопоказания. Ознакомьтесь с инструкцией или проконсультируйтесь у специалиста.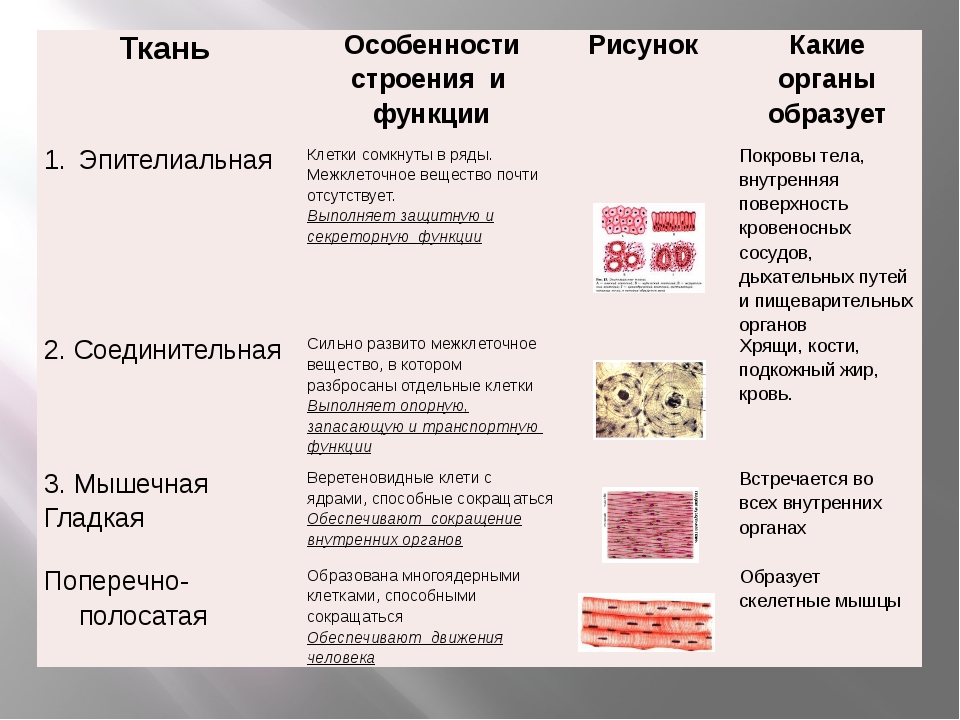
У дятлов обнаружили особое строение ткани черепа: Наука и техника: Lenta.ru
Китайские биологи установили, что череп дятла прочнее черепа жаворонка из-за различий в микроструктуре костной ткани. Работа опубликована в журнале Science China.
Когда дятел долбит дерево, его череп испытывает перегрузки до 1000 g, а скорость движений достигает 6-7 метров в секунду. Ученые заинтересовались тем, какие механические особенности лежат в основе прочности его черепа. Для этого они сравнили строение черепа и клюва большого пятнистого дятла Dendrocopos major с соответствующими органами жаворонка Melanocorypha mongolica. Работу проводили при помощи компьютерной томографии и сканирующей электронной микроскопии. Кроме того, ученые определили механические свойства черепа и клюва птиц.
Клювы жаворонка и дятла оказались сходны по механической прочности, но череп у дятла оказался более чем в десять раз прочнее черепа сородича. Ученые показали, что повышенная прочность коррелирует с иным строением трабекул — механических распорок между костными пластинами черепа. У жаворонка трабекулы оказались преимущественно линейные, палочковидные, в то время как у дятла они преимущественно пластинчатые. Кроме того, трабекулы были у дятла в целом толще, а промежутки между ними меньше.
У жаворонка трабекулы оказались преимущественно линейные, палочковидные, в то время как у дятла они преимущественно пластинчатые. Кроме того, трабекулы были у дятла в целом толще, а промежутки между ними меньше.
Ученые считают, что особое строение трабекул костной ткани черепа дятла делает его более устойчивым к деформациям, а следовательно — защищает мозг от повреждений.
В 2011 году эти же авторы уже опубликовали работу, в которой исследовали причины отсутствия у птиц черепно-мозговых травм при долблении деревьев. Ученые выяснили, что частично это связано с разной длиной верхней и нижней части клюва, а частично — с пористым строением отдельных участков черепа. Исследователи надеются, что проведенная ими работа пригодится при разработке противоударных шлемов для человека.
В 2006 похожие исследования были удостоены Шнобелевской премии (Ig Nobel Prize). Тогда авторы задавались вопросом о том, почему у птиц не болит голова и не отслаивается сетчатка глаза.
Особенности строения мышечной ткани, строение нервной клетки
Что такое ткань? Какие ткани животных вы знаете?
Ответ. Ткань — эволюционно сложившаяся система клеток и межклеточного вещества, объединенная общим происхождением, сходным строением и специализирующаяся на выполнении определенных функций в организме. Выделяют четыре основные группы животных тканей: эпителиальные, соединительные, мышечные и нервную.
Ткань — эволюционно сложившаяся система клеток и межклеточного вещества, объединенная общим происхождением, сходным строением и специализирующаяся на выполнении определенных функций в организме. Выделяют четыре основные группы животных тканей: эпителиальные, соединительные, мышечные и нервную.
Как особенности строения тканей зависят от их функций?
Ответ. Каждая ткань выполняет определенные функции, исходя из своего строения. Например, особенность мышечной ткани — это сокращение, следовательно, она выполняет функции движения. Нервная ткань — состоит из клеток, специализированных для проведения электрохимических импульсов и называемых нейронами, поэтому ее функция принимать раздражение и т. д
Думай, делай выводы, действуй
Проверь свои знания
1. Что такое ткань?
Ответ. Ткань — эволюционно сложившаяся система клеток и межклеточного вещества, объединенная общим происхождением, сходным строением и специализирующаяся на выполнении определенных функций в организме.
2. Какие ткани образуют тело человека?
Ответ. В организме человека выделяют 4 группы тканей: эпителиальную, соединительную, мышечную, нервную.
3. Каковы особенности строения мышечной ткани?
Ответ. Клетки мышечной ткани имеют вытянутую форму, но способны укорачиваться и утолщаться при сокращении. Сокращаться мышечные клетки могут благодаря наличию в них пучков особых нитевидных миофибрилл, состоящих из сократительных белков.
4. Каковы особенности строения нервной клетки?
Ответ. Нейрон — основная функциональная единица нервной ткани. Предположительно, в нашем организме более 80 млрд нейронов, причем их количество составляет не более 10% от всего числа клеток нервной ткани.
Нейроны состоят из тела, в котором находятся клеточные органоиды, и тонких выростов, которые называют отростками нервной клетки. У каждого нейрона есть два вида отростков: аксоны и дендриты.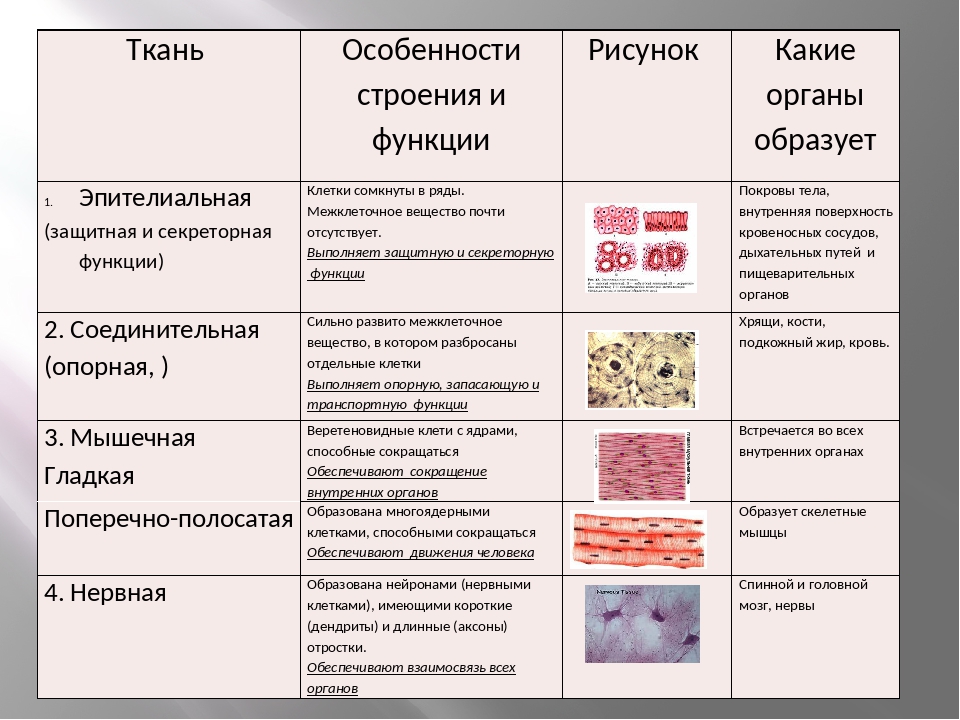
5. Что такое синапс?
Ответ. Место контакта нейрона с другой клеткой называется синапсом.
С. 29
Выполни задания
1. Перечислите особенности строения эпителиальной и соединительной тканей.
Ответ. Эпителиальные ткани (эпителий) образуют верхний слой кожи, выстилают внутренние полые органы (например, сердце, сосуды, мочевой пузырь) и стенки полостей нашего тела (рис. 22). Кроме того, эпителий образует ряд желез: поджелудочную, печень, потовые, слюнные, слезные и др. Эпителиальная ткань не имеет развитого межклеточного вещества, ее клетки плотно прилегают друг к другу. Эпителий быстро восстанавливается (регенерирует) при повреждениях.
Соединительная ткань содержит много межклеточного вещества, состав которого может существенно различаться в разных ее типах.
Связки и сухожилия образованы соединительной тканью, содержат множество волокон, обеспечивающих их прочность.
Костная ткань имеет твердое межклеточное вещество, хрящевая — упругое, а отдельные клетки находятся в полостях (лакунах). У клеток костной ткани есть отростки. Хрящевая и костная ткани входят в состав костей скелета.
Межклеточное вещество крови и лимфы — жидкость. Кровь и лимфа входят в состав внутренней среды организма, участвуют в транспорте веществ, выполняют защитные функции.
Разновидность соединительной ткани — рыхлая соединительная ткань очень распространена в организме и входит в состав всех органов человека.
2. Перечислите виды нейронов, входящих в состав нервной ткани.
Ответ. По выполняемым функциям различают нейроны трех видов. Чувствительные (центростремительные) нейроны воспринимают раздражение от рецепторов, возбуждающихся под действием раздражителей из внешней среды или из самого организма человека, и в форме нервного импульса передают возбуждение с периферии в ЦНС.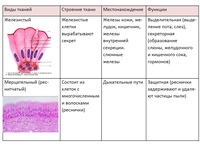
Обсуди с товарищами
Как строение тканей связано с выполняемыми ими функциями?
Ответ. Каждая ткань выполняет определенные функции, исходя из своего строения. Например, особенность мышечной ткани — это сокращение, следовательно, она выполняет функции движения. Нервная ткань — состоит из клеток, специализированных для проведения электрохимических импульсов и называемых нейронами, поэтому ее функция принимать раздражение и т. д
Выскажи мнение
Возбуждение по нейронам передается с помощью нервных импульсов.
Ответ. Нейроны легко возбуждаются, то есть реагируют на раздражение. При возбуждении они генерируют короткие электрические сигналы — нервные импульсы.
Работа с моделями, схемами, таблицами
1. Нарисуйте в тетради эпителиальную, мышечную и нервную ткань.
Ответ.
Эпителиальная ткань
Мышечная ткань
Нервная ткань
2. Заполните таблицу «Ткани и их функции».
Ответ.
Проводим исследование
Лабораторная работа. Выявление особенностей строения клеток разных тканей
Цель: познакомиться с особенностями строения разных групп тканей человека.
Материалы и оборудование: микроскоп, готовые микропрепараты (ткани эпителиальная, соединительная).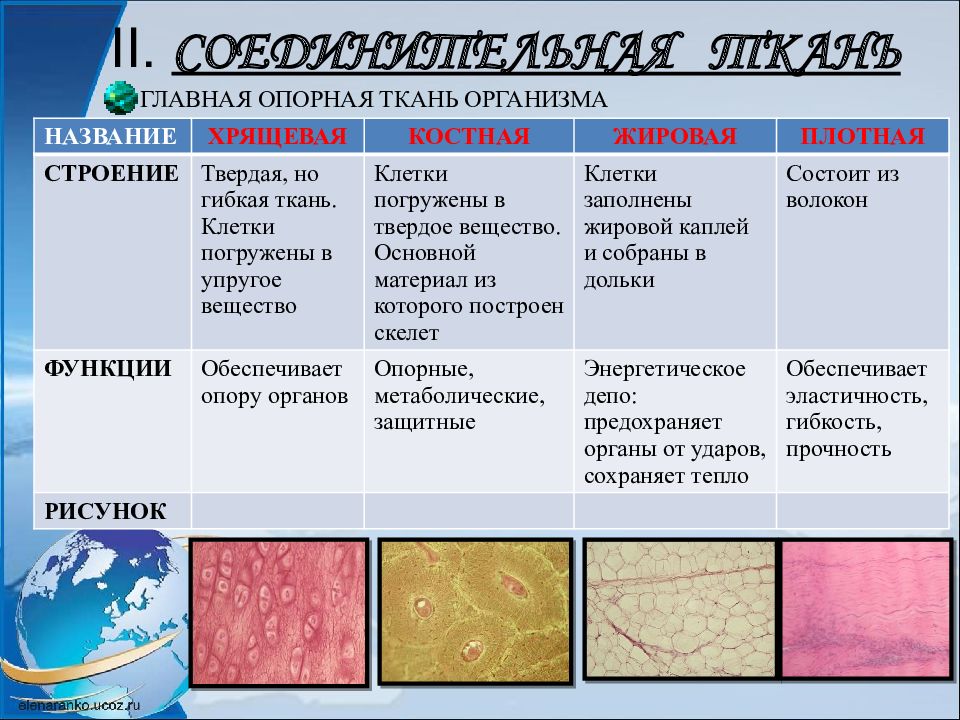
Ход работы
1. Изучите под микроскопом (при малом и большом увеличении) микропрепарат эпителиальной ткани: форму клеток, их расположение относительно друг друга, основные органоиды клетки.
2. Зарисуйте в тетрадь рассмотренный образец, подпишите его, запишите основные особенности.
Эпителиальная ткань.
Особенности эпителиальной ткани:
Поверхностные эпителии по количеству слоев клеток подразделяют на однослойные и многослойные, а по форме клеток — на плоские, кубические, призматические, реснитчатые и т. д. Многослойные эпителии относят также к ороговевающим и неороговевающим. Так, многослойный плоский ороговевающий эпителий покрывает наше тело и называется эпидермисом кожи, а неороговевающий выстилает, например, ротовую полость.
3. Изучите под микроскопом микропрепарат соединительной ткани (при малом и большом увеличении).
4. Зарисуйте в тетрадь рассмотренный образец, подпишите его название. Запишите основные особенности ткани.
Соединительная ткань
В рыхлой волокнистой соединительной ткани преобладает аморфное вещество. Ретикулярная ткань образует своеобразную сетку из волокон и отростчатых клеток, она играет важную роль в процессе кроветворения.
5. Сделайте вывод о причинах различия изученных тканей.
В эпителиальной ткани клетки располагаются очень плотно друг к другу, а межклеточное вещество совершенно не развито. Данные ткани выполняют роль своеобразного барьера, а так же выполняют секреторные и защитные функции.
Кроме того, мы узнали о соединительной ткани. Клетки в ней располагаются далеко друг от друга, а свойства ее полностью зависят от межклеточного вещества.
Структура ткани – обзор
IVIVE для очистки печени
Физиологическая структура млекопитающих (объемы тканей, кровоток, скорость вентиляции, скорость клубочковой фильтрации и т. д.) относительно хорошо охарактеризована; ключевыми данными, необходимыми для модели PBPK, являются химические параметры. Одним из наиболее важных аспектов параметризации моделей PBPK является оценка метаболического клиренса. В настоящее время для большинства химических веществ необходимо провести анализов in vitro для определения метаболического клиренса.В конце концов, по мере накопления данных для большего количества химических веществ, может стать возможным более широко прогнозировать метаболический клиренс с использованием подходов QSAR. Печеночный клиренс обычно вносит основной вклад в клиренс химического вещества из всего организма, хотя клиренс из других тканей (кишечник, легкие и кожа) может стать важным в зависимости от пути воздействия и свойств химического вещества. Для летучих химических веществ вентиляционный клиренс можно оценить по коэффициенту распределения кровь-воздух и частоте дыхания.Для большинства водорастворимых химических веществ клиренс с мочой можно оценить на основе свободной (несвязанной) фракции химического вещества в крови и скорости клубочковой фильтрации.
д.) относительно хорошо охарактеризована; ключевыми данными, необходимыми для модели PBPK, являются химические параметры. Одним из наиболее важных аспектов параметризации моделей PBPK является оценка метаболического клиренса. В настоящее время для большинства химических веществ необходимо провести анализов in vitro для определения метаболического клиренса.В конце концов, по мере накопления данных для большего количества химических веществ, может стать возможным более широко прогнозировать метаболический клиренс с использованием подходов QSAR. Печеночный клиренс обычно вносит основной вклад в клиренс химического вещества из всего организма, хотя клиренс из других тканей (кишечник, легкие и кожа) может стать важным в зависимости от пути воздействия и свойств химического вещества. Для летучих химических веществ вентиляционный клиренс можно оценить по коэффициенту распределения кровь-воздух и частоте дыхания.Для большинства водорастворимых химических веществ клиренс с мочой можно оценить на основе свободной (несвязанной) фракции химического вещества в крови и скорости клубочковой фильтрации.
Значительное улучшение качества препаратов тканей человека в последние годы привело к значительному прогрессу в стратегиях применения данных in vitro для прогнозирования кинетики in vivo . О качестве системы in vitro для получения метаболических констант судят по степени, в которой данная система поддерживает интактные и интегрированные метаболизирующие ферментные системы и демонстрирует другие биологические/биохимические функции, наблюдаемые in vivo .В настоящее время первичные суспензии гепатоцитов обычно считаются наилучшей доступной системой, обеспечивающей физиологические уровни кофакторов, естественную ориентацию связанных ферментов и интактные мембраны. Однако даже при криоконсервации, которая может снижать активность ферментов, доступность тканей человека для этой цели ограничивает применимость QIVIVE для среды высокопроизводительного скрининга (HTS).
Очистка основного химического вещества обычно используется для QIVIVE экологических химикатов. Этот простой подход к метаболической стабильности широко используется при скрининге фармацевтических соединений. Условия воздействия на человека, соответствующие воздействию окружающей среды, обычно достаточно низкие, поэтому нет необходимости характеризовать полную кинетику фермента, включая условия насыщения. Таким образом, внутренний клиренс in vitro можно использовать как в простых подходах QIVIVE для тестирования HTS, так и в более подробных подходах на основе отдельных химических веществ. Однако, в зависимости от роли метаболизма в токсичности соединения, может потребоваться отдельное определение нескольких метаболических стадий биоактивации и детоксикации. Для этой цели можно использовать системы In vitro , которые менее интегрированы, чем гепатоциты, включая микросомы, цитозоль и рекомбинантные CYP и UGT. В таких случаях взаимодействие между ферментами фазы I и II, возникающими in vivo , должно быть надлежащим образом учтено при экстраполяции.
Этот простой подход к метаболической стабильности широко используется при скрининге фармацевтических соединений. Условия воздействия на человека, соответствующие воздействию окружающей среды, обычно достаточно низкие, поэтому нет необходимости характеризовать полную кинетику фермента, включая условия насыщения. Таким образом, внутренний клиренс in vitro можно использовать как в простых подходах QIVIVE для тестирования HTS, так и в более подробных подходах на основе отдельных химических веществ. Однако, в зависимости от роли метаболизма в токсичности соединения, может потребоваться отдельное определение нескольких метаболических стадий биоактивации и детоксикации. Для этой цели можно использовать системы In vitro , которые менее интегрированы, чем гепатоциты, включая микросомы, цитозоль и рекомбинантные CYP и UGT. В таких случаях взаимодействие между ферментами фазы I и II, возникающими in vivo , должно быть надлежащим образом учтено при экстраполяции.
CYP и UGT были тщательно изучены для QIVIVE для фармацевтических соединений с использованием микросом и рекомбинантных ферментов. Одним из наиболее изученных CYP для биоактивации соединений окружающей среды является CYP2E1.QIVIVE биоактивации, опосредованной CYP2E1, был ключевым элементом в первых примерах экологических химических веществ QIVIVE для ЛОС. Другим метаболизирующим ферментам (или участкам метаболизма) уделялось меньше внимания по сравнению с CYP, несмотря на их потенциальную роль в детоксикации химических веществ окружающей среды. Важным примером являются эстеразы, гидролизующие ряд пестицидов и эндокринно-активных соединений. Для QIVIVE опосредованной эстеразой детоксикации химического вещества необходимо включить внепеченочный метаболизм, особенно метаболизм в крови, коже и кишечнике, из-за обильной экспрессии карбоксиэстераз и других типов ферментов эстераз в этих тканях.
Одним из наиболее изученных CYP для биоактивации соединений окружающей среды является CYP2E1.QIVIVE биоактивации, опосредованной CYP2E1, был ключевым элементом в первых примерах экологических химических веществ QIVIVE для ЛОС. Другим метаболизирующим ферментам (или участкам метаболизма) уделялось меньше внимания по сравнению с CYP, несмотря на их потенциальную роль в детоксикации химических веществ окружающей среды. Важным примером являются эстеразы, гидролизующие ряд пестицидов и эндокринно-активных соединений. Для QIVIVE опосредованной эстеразой детоксикации химического вещества необходимо включить внепеченочный метаболизм, особенно метаболизм в крови, коже и кишечнике, из-за обильной экспрессии карбоксиэстераз и других типов ферментов эстераз в этих тканях.
Во многих исследованиях используются субклеточные фракции или гепатоциты, собранные из большого числа отдельных тканей печени, при условии, что пул позволит оценить скорость химического метаболизма для среднего человека. Чтобы иметь дело с межиндивидуальной изменчивостью у людей, один из подходов заключается в использовании данных об изменчивости, наблюдаемой в субклеточных фракциях или изолированных клетках от отдельных доноров. Однако наличие большого количества доноров тканей человека является проблемой. Другой подход к изучению изменчивости метаболизма человека заключается в использовании рекомбинантных ферментов в сочетании с данными о распределении изобилия ферментов в популяции.Следует подчеркнуть, что все эти данные должны быть тщательно рассмотрены комплексно с использованием такого инструмента, как моделирование PBPK. Изменчивость, наблюдаемую в различных факторах in vitro или in vivo , которые могут влиять на метаболизм химического вещества, нельзя просто суммировать из-за влияния физиологических ограничений, таких как ограничение кровотока и компенсаторное взаимодействие между различными процессами клиренса.
Однако наличие большого количества доноров тканей человека является проблемой. Другой подход к изучению изменчивости метаболизма человека заключается в использовании рекомбинантных ферментов в сочетании с данными о распределении изобилия ферментов в популяции.Следует подчеркнуть, что все эти данные должны быть тщательно рассмотрены комплексно с использованием такого инструмента, как моделирование PBPK. Изменчивость, наблюдаемую в различных факторах in vitro или in vivo , которые могут влиять на метаболизм химического вещества, нельзя просто суммировать из-за влияния физиологических ограничений, таких как ограничение кровотока и компенсаторное взаимодействие между различными процессами клиренса.
Структура ткани, организация ядра и экспрессия генов в нормальной и злокачественной молочной железе
Поскольку каждая клетка в организме имеет одинаковую генетическую информацию, серьезной проблемой биологии является понимание того, как клетки в ткани избирательно экспрессируют гены.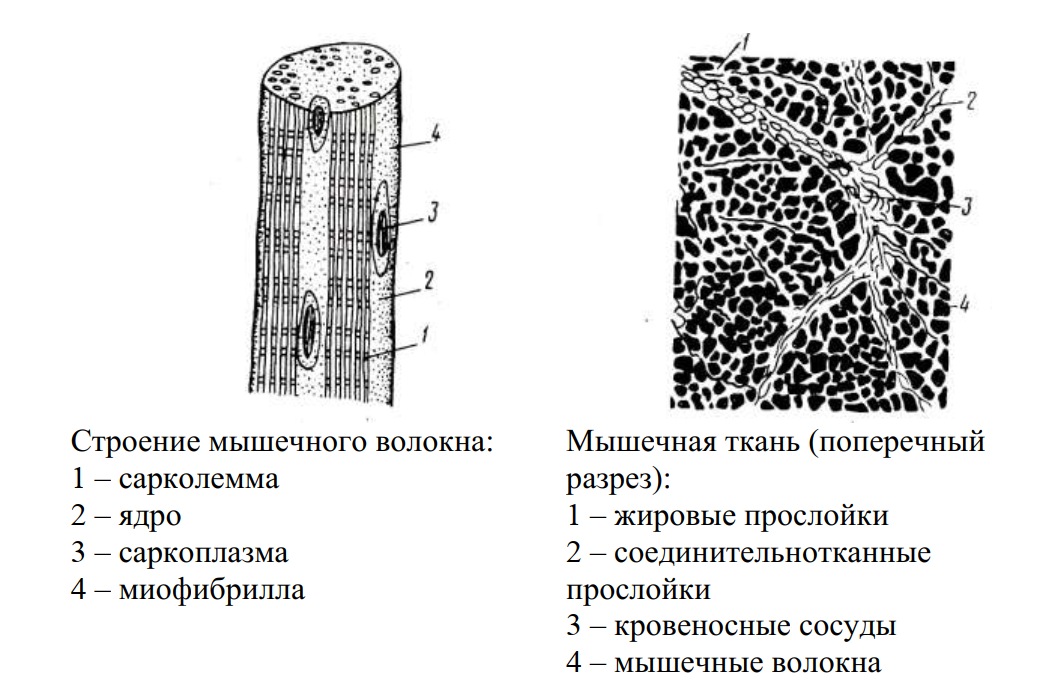 Сложная сеть физических и биохимических сигналов объединяется в высокоорганизованном порядке, чтобы обеспечить тонкую регуляцию, управляющую экспрессией генов в различных тканях. Таким образом, окончательное решение клетки пролиферировать, экспрессировать тканеспецифичные гены или апоптоз должно быть скоординированным ответом на ее адгезив, фактор роста и гормональную среду. Объединяющая гипотеза, рассмотренная в этом обзоре, состоит в том, что единицей функции высших организмов является не геном и не клетка в отдельности, а сложная трехмерная ткань.Это связано с наличием двунаправленных связей между компонентами клеточного микроокружения (факторами роста, гормонами и внеклеточным матриксом) и ядром. Эти связи осуществляются через связанные с мембраной рецепторы и передаются в ядро, где сигналы приводят к модификациям ядерного матрикса и структуры хроматина и приводят к селективной экспрессии генов. Таким образом, клетки необходимо изучать «в контексте», т. е. внутри соответствующей структуры ткани, если мы хотим понять двунаправленные пути, соединяющие клеточное микроокружение и геном.
Сложная сеть физических и биохимических сигналов объединяется в высокоорганизованном порядке, чтобы обеспечить тонкую регуляцию, управляющую экспрессией генов в различных тканях. Таким образом, окончательное решение клетки пролиферировать, экспрессировать тканеспецифичные гены или апоптоз должно быть скоординированным ответом на ее адгезив, фактор роста и гормональную среду. Объединяющая гипотеза, рассмотренная в этом обзоре, состоит в том, что единицей функции высших организмов является не геном и не клетка в отдельности, а сложная трехмерная ткань.Это связано с наличием двунаправленных связей между компонентами клеточного микроокружения (факторами роста, гормонами и внеклеточным матриксом) и ядром. Эти связи осуществляются через связанные с мембраной рецепторы и передаются в ядро, где сигналы приводят к модификациям ядерного матрикса и структуры хроматина и приводят к селективной экспрессии генов. Таким образом, клетки необходимо изучать «в контексте», т. е. внутри соответствующей структуры ткани, если мы хотим понять двунаправленные пути, соединяющие клеточное микроокружение и геном.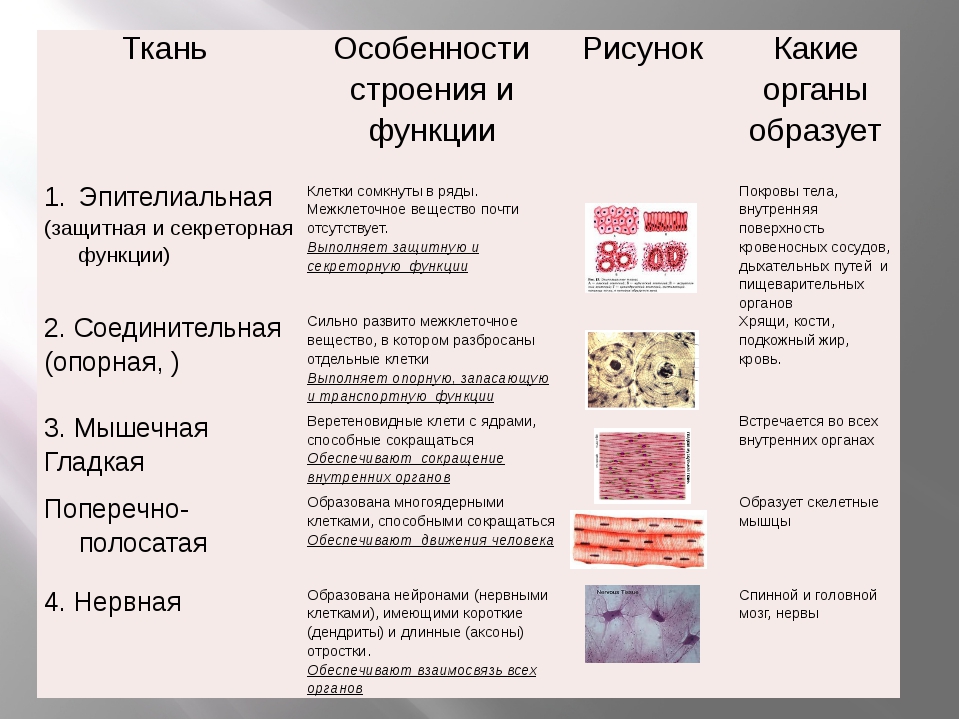 В последние десятилетия мы использовали хорошо охарактеризованные линии клеток молочной железы человека и мыши в «дизайнерской микросреде», чтобы создать соответствующий контекст для изучения экспрессии тканеспецифических генов. Использование трехмерного культурального анализа, разработанного с использованием реконструированной базальной мембраны, позволило нам легко и быстро отличить нормальные и злокачественные клетки молочной железы человека. В то время как рост нормальных клеток останавливается и образуются организованные «ацинусы», опухолевые клетки продолжают расти, накапливаться и, как правило, не реагируют на сигналы внеклеточного матрикса и микросреды.Путем коррекции передачи сигналов и баланса внеклеточного матриксного рецептора (интегрина) мы смогли обратить вспять злокачественный фенотип, когда клетки опухоли молочной железы человека культивируются в базальной мембране или на ней. Совсем недавно мы показали, что в то время как пути передачи сигнала интегрина бета1 и рецептора эпидермального фактора роста реципрокно интегрированы в трехмерных культурах, на пластике тканевой культуры (двумерные монослои) они не координируются.
В последние десятилетия мы использовали хорошо охарактеризованные линии клеток молочной железы человека и мыши в «дизайнерской микросреде», чтобы создать соответствующий контекст для изучения экспрессии тканеспецифических генов. Использование трехмерного культурального анализа, разработанного с использованием реконструированной базальной мембраны, позволило нам легко и быстро отличить нормальные и злокачественные клетки молочной железы человека. В то время как рост нормальных клеток останавливается и образуются организованные «ацинусы», опухолевые клетки продолжают расти, накапливаться и, как правило, не реагируют на сигналы внеклеточного матрикса и микросреды.Путем коррекции передачи сигналов и баланса внеклеточного матриксного рецептора (интегрина) мы смогли обратить вспять злокачественный фенотип, когда клетки опухоли молочной железы человека культивируются в базальной мембране или на ней. Совсем недавно мы показали, что в то время как пути передачи сигнала интегрина бета1 и рецептора эпидермального фактора роста реципрокно интегрированы в трехмерных культурах, на пластике тканевой культуры (двумерные монослои) они не координируются. Наконец, мы продемонстрировали, что вместо того, чтобы пассивно отражать изменения в экспрессии генов, сама ядерная организация может модулировать клеточный и тканевой фенотип.Мы пришли к выводу, что структура ткани доминирует над геномом и что нам может понадобиться новая парадигма того, как эпителиально-специфические гены регулируются in vivo. Мы также утверждаем, что если структура ткани не будет критически изменена, злокачественные новообразования не будут прогрессировать, даже при наличии множественных хромосомных мутаций.
Наконец, мы продемонстрировали, что вместо того, чтобы пассивно отражать изменения в экспрессии генов, сама ядерная организация может модулировать клеточный и тканевой фенотип.Мы пришли к выводу, что структура ткани доминирует над геномом и что нам может понадобиться новая парадигма того, как эпителиально-специфические гены регулируются in vivo. Мы также утверждаем, что если структура ткани не будет критически изменена, злокачественные новообразования не будут прогрессировать, даже при наличии множественных хромосомных мутаций.
3D-биопечать живых тканей
Прогресс в тестировании лекарств и регенеративной медицине мог бы значительно выиграть от лабораторно-инженерных тканей человека, построенных из различных типов клеток с точной трехмерной архитектурой.Но производство человеческих тканей размером более миллиметра было ограничено из-за отсутствия методов создания тканей со встроенными поддерживающими жизнь сосудистыми сетями.
. Многопрофильные исследования в Институте Висса привели к разработке метода трехмерной биопечати из нескольких материалов, позволяющего создавать васкуляризированные ткани, состоящие из живых клеток человека, которые почти в десять раз толще, чем ранее созданные ткани. и это может поддерживать их архитектуру и функционирование более шести недель. В этом методе используется настраиваемая силиконовая форма с печатным рисунком для размещения и размещения печатной ткани на чипе. Внутри этой формы печатается сетка более крупных сосудистых каналов, содержащих живые эндотелиальные клетки, силиконовыми чернилами, в которые в отдельном задании на печать наслаиваются самоподдерживающиеся чернила, содержащие живые мезенхимальные стволовые клетки (МСК).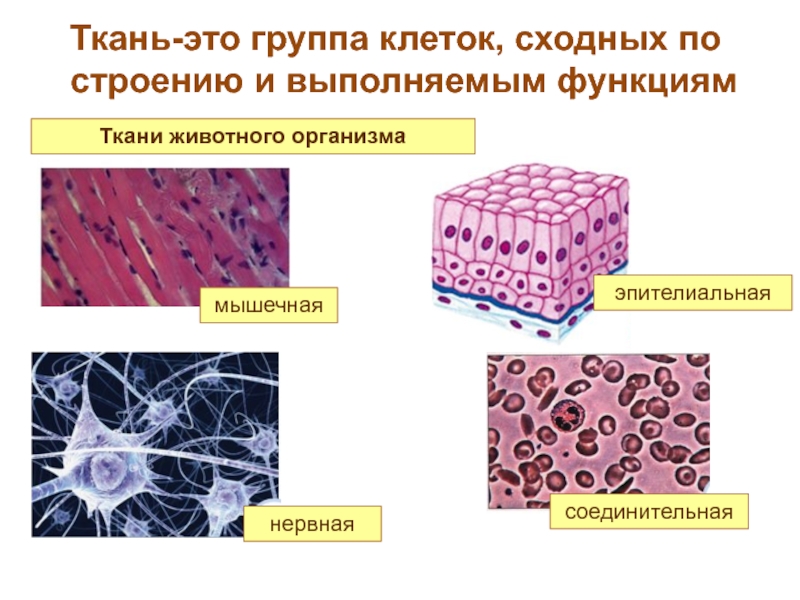 После печати жидкость, состоящая из фибробластов и внеклеточного матрикса, используется для заполнения открытых областей внутри конструкции, добавляя компонент соединительной ткани, который сшивает и дополнительно стабилизирует всю структуру.
После печати жидкость, состоящая из фибробластов и внеклеточного матрикса, используется для заполнения открытых областей внутри конструкции, добавляя компонент соединительной ткани, который сшивает и дополнительно стабилизирует всю структуру.
. Полученная структура мягких тканей может быть немедленно наполнена питательными веществами, а также факторами роста и дифференцировки через один вход и выход на противоположных концах чипа, которые соединяются с сосудистым каналом для обеспечения выживания. и созревание клеток. В экспериментальном исследовании биопринтированные тканевые конструкции толщиной один сантиметр, содержащие МСК костного мозга человека, окруженные соединительной тканью и поддерживаемые искусственной сосудистой оболочкой, выстланной эндотелием, обеспечивают циркуляцию факторов роста костей и, следовательно, индукцию развития костей. .
и созревание клеток. В экспериментальном исследовании биопринтированные тканевые конструкции толщиной один сантиметр, содержащие МСК костного мозга человека, окруженные соединительной тканью и поддерживаемые искусственной сосудистой оболочкой, выстланной эндотелием, обеспечивают циркуляцию факторов роста костей и, следовательно, индукцию развития костей. .
Этот инновационный подход к биопечати можно модифицировать для создания различных васкуляризированных трехмерных тканей для регенеративной медицины и тестирования лекарств. Команда Wyss также исследует возможность использования 3D-биопечати для изготовления новых версий органов Института на чипах, что делает их производственный процесс более автоматизированным и позволяет разрабатывать все более сложные микрофизиологические устройства. Результатом этих усилий стал первый полностью напечатанный на 3D-принтере орган на чипе — сердце на чипе — со встроенными мягкими датчиками деформации.
Трехмерная визуализация клеточных и тканевых структур в интактной мышце без использования меток с помощью микроскопии генерации второй и третьей гармоник Структуры интактной мышцы с помощью микроскопии генерации второй и третьей гармоник.
 ПЛОС ОДИН 6(11):
е28237.
https://doi.org/10.1371/journal.pone.0028237
ПЛОС ОДИН 6(11):
е28237.
https://doi.org/10.1371/journal.pone.0028237 Редактор: Paul McNeil, Медицинский колледж Джорджии, Соединенные Штаты Америки
Получено: 30 июня 2011 г.; Принято: 4 ноября 2011 г .; Опубликовано: 28 ноября 2011 г.
Авторское право: © 2011 Rehberg et al.Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Это исследование было поддержано Сетью биовизуализации Людвига-Максимилиана-Университета Мюнхена (www.bin.lmu.de) и Инициативой передового опыта Немецкого исследовательского сообщества (www.dfg.de) и Bundesministerium für Bildung und Forschung (www.bmbf.de). MR получил поддержку Friedrich-Baur-Stiftung (www. baur-stiftung.de). UP является членом Мюнхенского кардиологического альянса. Финансирующие учреждения не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
baur-stiftung.de). UP является членом Мюнхенского кардиологического альянса. Финансирующие учреждения не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Световая микроскопия является методом выбора для визуализации клеток в их биологическом или физиологическом контексте.Классические методы световой микроскопии, такие как освещение Келера и фазовый контраст, могут применяться без предварительной маркировки, что позволяет наблюдать за невозмущенными клетками или тканями. Однако эти методики не подходят для толстых тканей и не позволяют выполнять трехмерную реконструкцию объемов изображения с высоким разрешением, поскольку микроскопическое изображение также содержит данные выше и ниже фокальной плоскости. Это ограничение можно обойти, ограничив генерацию изображений фотонами, исходящими из фокальной плоскости, что достигается с помощью конфокальной лазерной сканирующей микроскопии или флуоресцентной микроскопии с двухфотонным возбуждением. Оба подхода требуют наличия флуоресцентной структуры, поэтому, за исключением нескольких аутофлуоресцентных структур, необходимо окрашивание структурно-специфическими флуоресцентными красителями, такими как красители ДНК или флуоресцентные антитела. Затем изображения из соседних фокальных плоскостей могут быть объединены для создания объемного трехмерного изображения. Однако при окрашивании живых клеток или тканей часто остается неясным, насколько окрашивание нарушает физиологические функции клеток или тканей. Например, экспрессия белков GFP или слитых белков GFP была связана с индукцией апоптоза [1], дилатационной кардиомиопатией у трансгенных мышей [2], нарушением актин-миозиновых взаимодействий [3], [4], ингибированием полиубиквитинирования [5]. и индукции цитокинов [6].
Оба подхода требуют наличия флуоресцентной структуры, поэтому, за исключением нескольких аутофлуоресцентных структур, необходимо окрашивание структурно-специфическими флуоресцентными красителями, такими как красители ДНК или флуоресцентные антитела. Затем изображения из соседних фокальных плоскостей могут быть объединены для создания объемного трехмерного изображения. Однако при окрашивании живых клеток или тканей часто остается неясным, насколько окрашивание нарушает физиологические функции клеток или тканей. Например, экспрессия белков GFP или слитых белков GFP была связана с индукцией апоптоза [1], дилатационной кардиомиопатией у трансгенных мышей [2], нарушением актин-миозиновых взаимодействий [3], [4], ингибированием полиубиквитинирования [5]. и индукции цитокинов [6].
Микроскопия второй и третьей гармоник (SHG и THG) [7], [8], [9] сочетает в себе преимущества оптических срезов и визуализации без меток: генерация сигнала ограничена фокусным пятном падающего лазера, в то время как необходимость для потенциально опасной флуоресцентной маркировки избегают. В процессе ГВГ два одновременно входящих фотона преобразуются в один испускаемый фотон с длиной волны ровно в два раза меньше. Сигналы ГВГ генерируются в плотных нецентросимметричных структурах.В мягких тканях млекопитающих это в основном миозин в поперечно-полосатых мышцах и толстые волокна коллагена I, II и III типов. В некоторых особых случаях также можно визуализировать плотные пучки микротрубочек [10], [11], [12]. Сравнительно широко распространена ГВГ-микроскопия, так как детектирование возможно с помощью стандартных двухфотонных микроскопов с длиной волны возбуждения, в два раза превышающей длину волны активного канала детектирования.
В процессе ГВГ два одновременно входящих фотона преобразуются в один испускаемый фотон с длиной волны ровно в два раза меньше. Сигналы ГВГ генерируются в плотных нецентросимметричных структурах.В мягких тканях млекопитающих это в основном миозин в поперечно-полосатых мышцах и толстые волокна коллагена I, II и III типов. В некоторых особых случаях также можно визуализировать плотные пучки микротрубочек [10], [11], [12]. Сравнительно широко распространена ГВГ-микроскопия, так как детектирование возможно с помощью стандартных двухфотонных микроскопов с длиной волны возбуждения, в два раза превышающей длину волны активного канала детектирования.
В ГТГ энергия трех одновременно поступающих фотонов объединяется для испускания одного фотона с одной третью длины волны.THG сложнее реализовать, поскольку для обнаружения сигнала в видимом диапазоне выше 400 нм требуется длина волны возбуждения выше 1200 нм, а этот диапазон не обеспечивается стандартными двухфотонными микроскопами. Обнаружение в видимом диапазоне не является абсолютным требованием, продиктованным физической теорией, а скорее оптическими элементами стандартных микроскопов, которые имеют ограниченное пропускание УФ-света.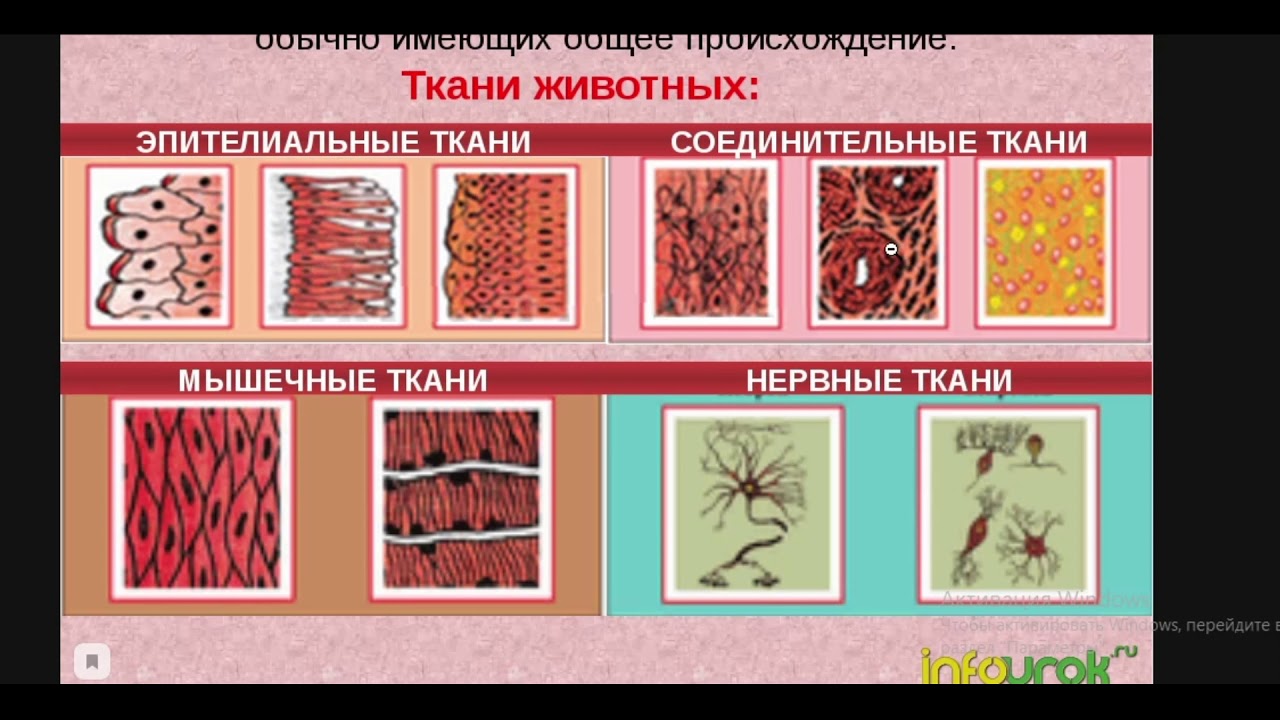 Кроме того, рэлеевское рассеяние с сопутствующими потерями света в тканях увеличивается в степени 4 th при более коротких длинах волн [13].Микроскопия ГТГ более универсальна, чем микроскопия ГВГ, поскольку ГТГ индуцируется на границах раздела, таких как изменения показателя преломления в пределах фокального объема возбуждающего лазера [8], [14]. Показатели преломления изменяются, например, между ядрами клеток и цитоплазмой или цитоплазмой и интерстициальной жидкостью. Они являются основой для классических методов микроскопии, таких как фазовый контраст и ДИК, которые, однако, менее подходят для трехмерного изображения глубоких тканей, поскольку процесс генерации контраста не ограничивается фокальной плоскостью.Дополнительным источником ГТГ, имеющим практическое значение в биологической микроскопии, является усиление резонанса светопоглощающими структурами. Например, гемоглобин индуцирует сильный сигнал ГТГ при освещении светом с длиной волны 1275 нм из-за его поглощения около 425 нм [14], [15], [16].
Кроме того, рэлеевское рассеяние с сопутствующими потерями света в тканях увеличивается в степени 4 th при более коротких длинах волн [13].Микроскопия ГТГ более универсальна, чем микроскопия ГВГ, поскольку ГТГ индуцируется на границах раздела, таких как изменения показателя преломления в пределах фокального объема возбуждающего лазера [8], [14]. Показатели преломления изменяются, например, между ядрами клеток и цитоплазмой или цитоплазмой и интерстициальной жидкостью. Они являются основой для классических методов микроскопии, таких как фазовый контраст и ДИК, которые, однако, менее подходят для трехмерного изображения глубоких тканей, поскольку процесс генерации контраста не ограничивается фокальной плоскостью.Дополнительным источником ГТГ, имеющим практическое значение в биологической микроскопии, является усиление резонанса светопоглощающими структурами. Например, гемоглобин индуцирует сильный сигнал ГТГ при освещении светом с длиной волны 1275 нм из-за его поглощения около 425 нм [14], [15], [16]. Таким образом, THG предлагает для немеченых препаратов то же, что конфокальная и двухфотонно-индуцированная флуоресценция сделала для флуоресцентных образцов, т. е. предоставляет метод с возможностью оптического секционирования, с исключением сигнала вне фокуса и с трехмерной визуализацией.
Таким образом, THG предлагает для немеченых препаратов то же, что конфокальная и двухфотонно-индуцированная флуоресценция сделала для флуоресцентных образцов, т. е. предоставляет метод с возможностью оптического секционирования, с исключением сигнала вне фокуса и с трехмерной визуализацией.
В то время как SHG и THG являются хорошо известными явлениями в оптических науках, биомедицинское сообщество менее осведомлено об их потенциале. Чтобы оценить возможности этих методов без меток, мы применили микроскопию THG и SHG к установленной модели ткани. Кремастерная мышца грызунов может быть получена из мошонки в виде тонкого светопроницаемого листа и, таким образом, стала широко использоваться для физиологических исследований in vivo с помощью обычной светлопольной микроскопии (например, [17], [18], [19], [20]. ).В этой хорошо охарактеризованной ткани мы исследовали, какие структуры были идентифицированы с помощью SHG и THG и какой уровень детализации может быть достигнут. Максимально достижимая глубина определялась в мышцах бедра.
Методы
Подготовка образцов
Извлечение ткани было выполнено в соответствии с немецким законодательством о защите животных. Самцов мышей линии C57BL/6 в возрасте 10–12 недель приобретали у компании Charles River (Зульцфельд, Германия). Животных содержали в обычных условиях со свободным доступом к пище и воде.Институциональный совет Walter-Brendel-Zentrum одобрил извлечение тканей после эвтаназии животных (разрешение ID K09) в соответствии с местным законом «Bayerisches Tierschutzgesetz, Paragraph 6 Abs. 1 Satz 2 Nr. 4». Животных подвергали эвтаназии путем внутрибрюшинной передозировки пентобарбитала (Narcoren, Merial, Germany). Впоследствии правую или левую кремастерную мышцу обнажали через вентральный разрез мошонки. Мышца была вскрыта вентрально, придатки яичка и яичка были отделены, после чего кремастер был эксплантирован.На протяжении всей процедуры, а также после хирургической подготовки во время микроскопии мышцу погружали в забуференный физиологический раствор или 0,9% раствор хлорида натрия.
Структуры и клетки в изолированных кремастерных мышцах исследовали без фиксации или другой дополнительной обработки, за исключением тех, которые были контрастно окрашены на ДНК. Для окрашивания DRAQ5 свежевырезанную нефиксированную ткань инкубировали в течение 15–60 мин при комнатной температуре в 0,9% NaCl с разбавлением 1∶1000 исходного раствора 5 мМ (Biostatus Ltd, Shepshed Leicestershire, UK).Микроскопическое исследование проводилось в 1∶10 разбавленном красящем растворе. Для окрашивания TO-PRO-3 (Invitrogen, Карлсруэ, Германия) иссеченную ткань фиксировали в течение 10 минут забуференным 4% параформальдегидом (Microcos, Garching, Германия). Окрашивание проводили в течение 1 часа в PBS с 2 мкМ TO-PRO-3 и 0,5% Triton X-100 (Sigma). Окрашенную TO-PRO-3 ткань помещали в PermaFluor (Beckman Coulter, Fullerton, CA) на предметные стекла.
Для визуализации неокрашенных, нефиксированных препаратов кремастера при комнатной температуре мышцу помещали на стандартное предметное стекло для микроскопа или на круглое покровное стекло и покрывали раствором хлорида натрия (0. 9%) раствор. Круглые покровные стекла помещали с помощью вакуумной смазки (Baysilone-Paste mittel-viskös, GE Bayer Silicones GmbH & Co. KG, Leverkusen) в пластиковую чашку Петри с отверстием на дне. По бокам края мышцы утяжеляли, чтобы избежать смещения ткани. Такие препараты кремастерных мышц имеют толщину 160 – 200 мкм. Для наблюдения за подвижностью лейкоцитов ткань помещали в специально изготовленное нагревательное устройство, погружали в сбалансированный солевой раствор Хенкса и поддерживали при физиологической температуре.
9%) раствор. Круглые покровные стекла помещали с помощью вакуумной смазки (Baysilone-Paste mittel-viskös, GE Bayer Silicones GmbH & Co. KG, Leverkusen) в пластиковую чашку Петри с отверстием на дне. По бокам края мышцы утяжеляли, чтобы избежать смещения ткани. Такие препараты кремастерных мышц имеют толщину 160 – 200 мкм. Для наблюдения за подвижностью лейкоцитов ткань помещали в специально изготовленное нагревательное устройство, погружали в сбалансированный солевой раствор Хенкса и поддерживали при физиологической температуре.
Для микроскопии мышц бедра был сделан продольный разрез длиной 10 мм через кожу правой задней конечности умерщвленной мыши, начиная с паховой складки. Кожу удаляли, обнажая большую приводящую мышцу. Мышцу либо непосредственно погружали в физиологический раствор, либо вырезали и помещали в чашку Петри, наполненную физиологическим раствором.
Микроскопия
Микроскопические наблюдения проводились с использованием имеющейся в продаже системы TriMScope (LaVision BioTec, Билефельд, Германия), созданной на основе микроскопа Olympus BX 51 (Olympus, Гамбург, Германия) и оснащенного перестраиваемым лазером Ultra II Titanium:Sapphire (Coherent, Dieburg , Германия) и оптический параметрический генератор (Chameleon OPO; APE, Берлин, Германия; типичная ширина импульса 200 фс, частота повторения 80 МГц), накачиваемый Ti:Sa. OPO генерировал свет с длиной волны 1270 нм или 1275 нм с выходной мощностью 640–700 мВт. Интенсивность без ослабления на образце (т.е. после объектива) составляла ~250 мВт. Сканирование кремастерной ткани с полной интенсивностью и высоким разрешением (400×400 мкм, 1680×1680 пикселей и 200 линий в секунду) не приводило к видимым повреждениям, за исключением случаев, когда в области наблюдения присутствовала светопоглощающая грязь, вызывающая образование плазмы. Использовался объектив Olympus XLUMPlanFl 20×/0,95 Вт (рабочее расстояние 2 мм). Использовались следующие каналы детектирования: обратное (эпи) детектирование синего (417–477 нм), красного (604–644 нм) и дальнего красного (645–695 нм), прямое детектирование синего и длиннопроходное 488 нм.Короткопроходные фильтры 700 нм блокировали свет возбуждения. Сбор света в прямом направлении осуществлялся конденсором Olympus WI-UCD с числовой апертурой 0,8. Фотоумножители (ФЭУ) были Hamamatsu H6780-01 для синих каналов и H6780-20 для остальных.
OPO генерировал свет с длиной волны 1270 нм или 1275 нм с выходной мощностью 640–700 мВт. Интенсивность без ослабления на образце (т.е. после объектива) составляла ~250 мВт. Сканирование кремастерной ткани с полной интенсивностью и высоким разрешением (400×400 мкм, 1680×1680 пикселей и 200 линий в секунду) не приводило к видимым повреждениям, за исключением случаев, когда в области наблюдения присутствовала светопоглощающая грязь, вызывающая образование плазмы. Использовался объектив Olympus XLUMPlanFl 20×/0,95 Вт (рабочее расстояние 2 мм). Использовались следующие каналы детектирования: обратное (эпи) детектирование синего (417–477 нм), красного (604–644 нм) и дальнего красного (645–695 нм), прямое детектирование синего и длиннопроходное 488 нм.Короткопроходные фильтры 700 нм блокировали свет возбуждения. Сбор света в прямом направлении осуществлялся конденсором Olympus WI-UCD с числовой апертурой 0,8. Фотоумножители (ФЭУ) были Hamamatsu H6780-01 для синих каналов и H6780-20 для остальных.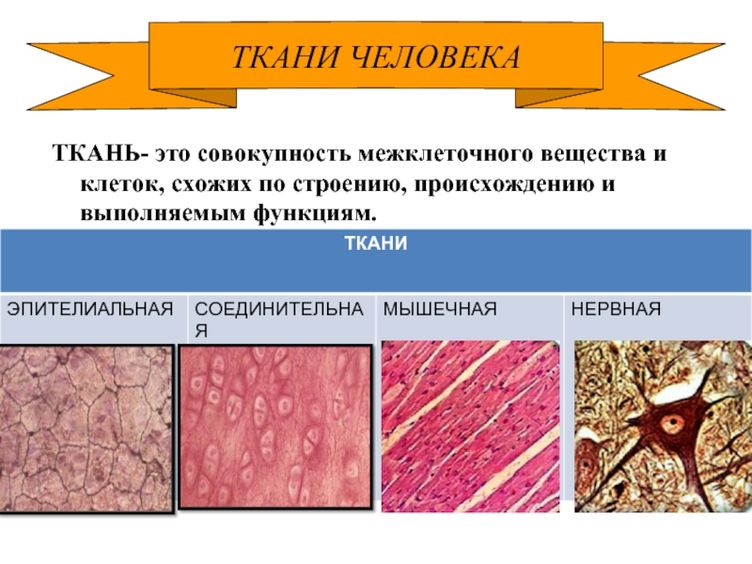 Там, где упоминалось (см. основной текст), для обратного обнаружения использовались более чувствительные детекторы арсенид-фосфида галлия (Hamamatsu H7422-40).
Там, где упоминалось (см. основной текст), для обратного обнаружения использовались более чувствительные детекторы арсенид-фосфида галлия (Hamamatsu H7422-40).
Чтобы охарактеризовать производительность системы, мы измерили полную ширину полувысоты (FWHM) сигналов от частиц с низким разрешением, встроенных в 1% агарозу, с возбуждением 1275 нм.Двухфотонное возбуждение флуоресценции темно-красных шариков (размер 175 нм, exc 633, em. 660, Invitrogen P7220) обеспечивало FWHM 1,1 мкм в поперечном направлении и 6,2 мкм в осевом направлении. Это сопоставимо с теоретическими значениями (0,51*λ) / ((√2)*NA) = 484 нм в поперечном направлении и (0,64* λ)/(n-√(n2-NA2)) = 1,7 мкм в осевом направлении [21], [ 22]. Латексные шарики не генерировали подходящий сигнал ГТГ. THG-FWHM измеряли с помощью наночастиц диоксида титана (конфигурация анатаза, <25 нм; Sigma-Aldrich 637254), которые диспергировали с помощью ультразвука в воде, как описано [23].Для полученных агрегатов частиц был описан средний размер около 0,5 мкм [23]. THG-FWHM был измерен с 0,9 мкм по xy и 4,5 мкм по z. В то время как функция рассеяния точки (ФРТ) двухфотонного возбуждения равна квадрату ФРТ освещения [24], ФРТ трехфотонного возбуждения равна кубу ФРТ освещения и, следовательно, меньше. Таким образом, меньшее измеренное значение THG-FWHM соответствует теоретическому предсказанию. Однако все значения были далеки от предела дифракции. Оптимизация оптики до 1275 нм должна обеспечить гораздо более узкие функции рассеяния точки и, следовательно, более высокие плотности фотонов, что приведет к более сильной генерации гармонического сигнала.
THG-FWHM был измерен с 0,9 мкм по xy и 4,5 мкм по z. В то время как функция рассеяния точки (ФРТ) двухфотонного возбуждения равна квадрату ФРТ освещения [24], ФРТ трехфотонного возбуждения равна кубу ФРТ освещения и, следовательно, меньше. Таким образом, меньшее измеренное значение THG-FWHM соответствует теоретическому предсказанию. Однако все значения были далеки от предела дифракции. Оптимизация оптики до 1275 нм должна обеспечить гораздо более узкие функции рассеяния точки и, следовательно, более высокие плотности фотонов, что приведет к более сильной генерации гармонического сигнала.
Обработка изображений
Изображения обработаны в ImageJ, Fiji и/или Imaris. ImageJ (W.S. Rasband, U.S. National Institutes of Health, Bethesda, Md, USA, http://imagej.nih.gov/ij/, 1997–2011) — общедоступный пакет 3D-визуализации. Fiji (http://pacific.mpi-cbg.de/wiki/index.php/Fiji) — это дистрибутив ImageJ с предустановленным рядом полезных плагинов. Imaris — это коммерческий пакет визуализации от Bitplane, Цюрих, Швейцария. Рисунки для публикации были собраны в программе Adobe Photoshop.Изображения были скорректированы по яркости, но, за исключением очевидных вещей (обрезка, масштабирование и т. д.), никаким другим образом не обрабатывались.
Рисунки для публикации были собраны в программе Adobe Photoshop.Изображения были скорректированы по яркости, но, за исключением очевидных вещей (обрезка, масштабирование и т. д.), никаким другим образом не обрабатывались.
Результаты и обсуждение
Коллагеновые волокна и саркомеры
Поперечнополосатые мышечные и коллагеновые волокна были индукторами ГВГ и ТГГ (рис. 1а, б), и прямые сигналы, как правило, были сильнее, чем обратные, как описано ранее [11], [25], [26], [27], [28]. . Как мы обнаружили ранее [28], в поперечно-полосатых мышцах сигналы ТГГ и ГВГ чередуются (рис. 1б), что свидетельствует о том, что ТГГ, индуцирующие изменения показателя преломления, наибольшие в тех частях саркомеров, которые содержат только актин.Кроме того, внешняя мембрана мышечных волокон индуцировала THG, как и ядра клеток мышечных волокон (рис. 1b, фильм S1). Мышечные волокна, идущие параллельно оптической оси, продуцировали точечные сигналы ГТГ внутри, окруженные сигналом ГТГ от клеточной мембраны (рис.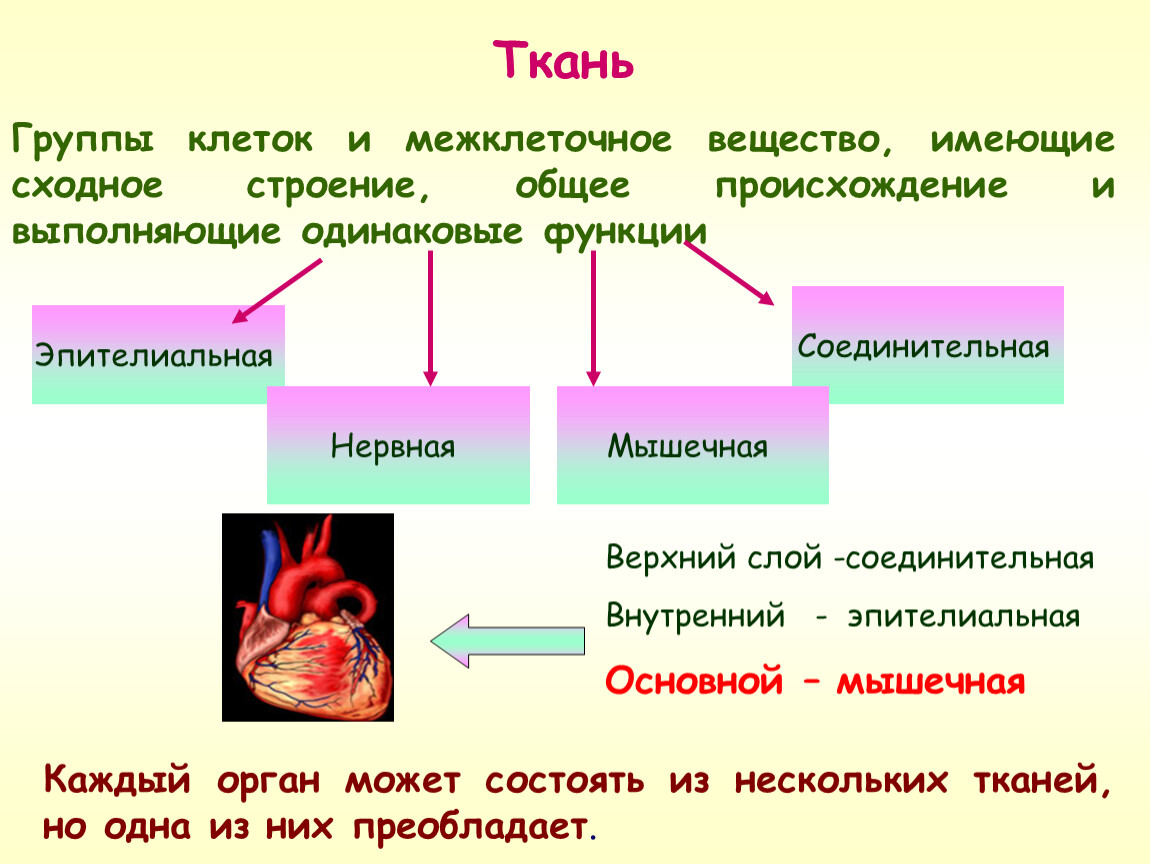 1с). Волокна в этой ориентации не давали детектируемого сигнала ГВГ, как и мышечные волокна, наклоненные к фокальной плоскости. Поскольку генерация более высоких гармоник зависит от относительной пространственной ориентации входящих световых волн к структуре образца, мы не можем сделать вывод, что одна и та же структура вызывает сигналы ГТГ в горизонтальных и вертикальных мышечных волокнах.
1с). Волокна в этой ориентации не давали детектируемого сигнала ГВГ, как и мышечные волокна, наклоненные к фокальной плоскости. Поскольку генерация более высоких гармоник зависит от относительной пространственной ориентации входящих световых волн к структуре образца, мы не можем сделать вывод, что одна и та же структура вызывает сигналы ГТГ в горизонтальных и вертикальных мышечных волокнах.
Рисунок 1. Коллагеновые волокна и поперечно-полосатые мышцы.
A) Относительное соотношение интенсивности сигнала ГВГ коллаген/миозин выше в обратном ГВГ (зеленый), чем в прямом ГВГ (красный). B) В то время как в поперечнополосатых мышцах SHG визуализирует миозин и, следовательно, A-полосы саркомеров, сигналы THG исходят от промежуточных I-полос, а также от границы мышечного волокна (b) и ядер мышечных клеток (n). C) Прямой сигнал THG мышечного волокна, идущего параллельно оптической оси, один оптический срез. Граница волокна очерчена окружающим сигналом THG.Небольшой пузырек на верхней границе волокна может принадлежать клеточному ядру.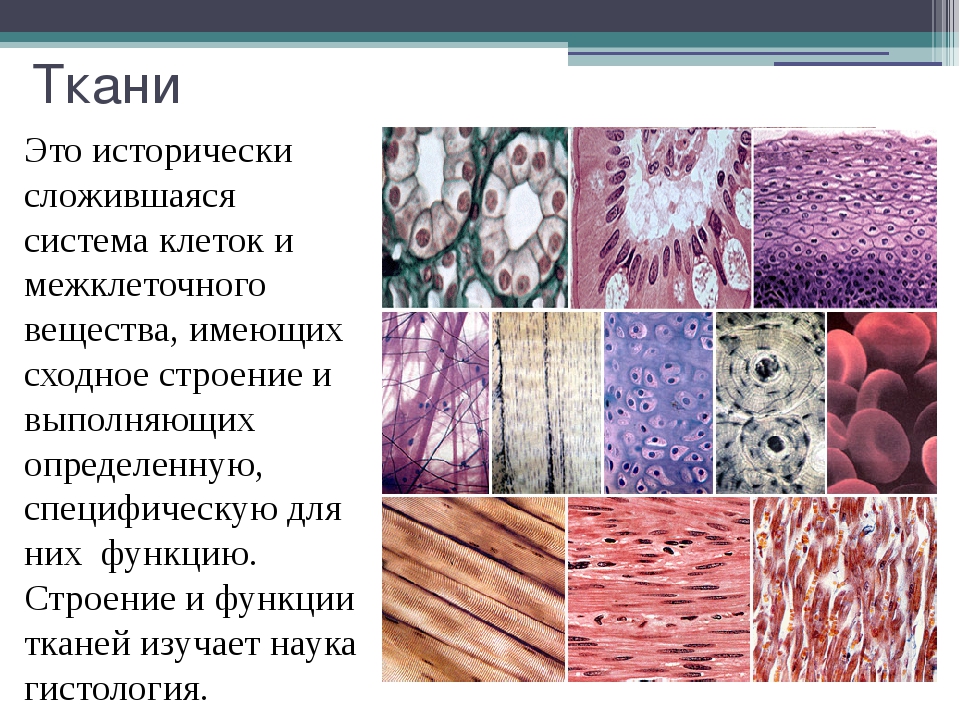 В этом случае сигнал ГВГ не обнаружен. D) Толстое коллагеновое волокно, создающее двойной сигнал в THG (слева, голубой на наложении), который заполнен сигналом SHG (в центре, красный на наложении). Шкала баров 20 мкм.
В этом случае сигнал ГВГ не обнаружен. D) Толстое коллагеновое волокно, создающее двойной сигнал в THG (слева, голубой на наложении), который заполнен сигналом SHG (в центре, красный на наложении). Шкала баров 20 мкм.
https://doi.org/10.1371/journal.pone.0028237.g001
Для некоторых коллагеновых волокон мы наблюдали двойной сигнал с полым ядром 1 – 1,5 мкм (рис. 1г). Эта сердцевина была заполнена сигналом ГВГ, утверждая, что волокно было достаточно широким для создания независимого сигнала ГВГ (вызванного несоответствием показателей преломления) с каждой стороны.Аналогичное явление наблюдалось другими исследователями в стенке аорты крыс, где аутофлуоресценция эластических волокон была окружена параллельными сигналами ГТГ [29].
Клетки крови и сосуды
Мы визуализировали эритроциты (эритроциты) в сосудах эксплантированных нефиксированных мышц кремастера, то есть без потока, с передними детекторами (рис. 2а). Эритроциты производили очень сильные сигналы, а пространственное разрешение было достаточным, чтобы выявить двояковогнутую форму, типичную для этого типа клеток, при отсутствии внешних сил сдвига в условиях отсутствия потока (рис. 2а, б, д).Отдельные эритроциты [14], [16], [30] или кровь [8], [31] ранее были визуализированы с помощью ГТГ, но только совсем недавно опубликованные изображения, записанные на системе, аналогичной нашей собственной, обеспечили достаточное оптическое разрешение, чтобы предположить типичная двояковогнутая форма [32]. В эксплантированной ткани эритроциты опускались на дно сосудов и были плотно упакованы в нижней половине сосуда (рис. 2g, стрелка, фильм S1). Иногда мы наблюдали лейкоциты, прилипшие к внутренней стенке сосуда (рис. 2в, г).
2а, б, д).Отдельные эритроциты [14], [16], [30] или кровь [8], [31] ранее были визуализированы с помощью ГТГ, но только совсем недавно опубликованные изображения, записанные на системе, аналогичной нашей собственной, обеспечили достаточное оптическое разрешение, чтобы предположить типичная двояковогнутая форма [32]. В эксплантированной ткани эритроциты опускались на дно сосудов и были плотно упакованы в нижней половине сосуда (рис. 2g, стрелка, фильм S1). Иногда мы наблюдали лейкоциты, прилипшие к внутренней стенке сосуда (рис. 2в, г).
Рис. 2.ГТГ кровеносных сосудов и клеток крови в эксплантированных нефиксированных кремастерных мышцах регистрируют в прямом направлении.
А) Проекция оптических секций. Без тока эритроциты (эритроциты) опускаются на дно сосуда, образуя плотно упакованную массу. Б) Визуализация типичной формы эритроцитов. C, D) Лейкоциты, прилипшие к внутренней стенке сосуда. E–G) Кровеносный сосуд с сильным сигналом THG от стенки сосуда. Диаметр сосудов составляет от 40 до 45 мкм. E показывает 3D-рендеринг с 2-кратным увеличением на вставке.Сечение, перпендикулярное оси сосуда, показано на F, и то же самое сечение увеличено на G. Стрелки указывают на заметный сигнал ГТГ от участков стенки, параллельных оптической оси, наконечник стрелки указывает на эритроциты на дне сосуда. Все масштабные линейки имеют размер 20 мкм.
E показывает 3D-рендеринг с 2-кратным увеличением на вставке.Сечение, перпендикулярное оси сосуда, показано на F, и то же самое сечение увеличено на G. Стрелки указывают на заметный сигнал ГТГ от участков стенки, параллельных оптической оси, наконечник стрелки указывает на эритроциты на дне сосуда. Все масштабные линейки имеют размер 20 мкм.
https://doi.org/10.1371/journal.pone.0028237.g002
Многие кровеносные сосуды в ткани можно было идентифицировать с помощью THG не только по содержанию эритроцитов, но и по сильным сигналам, исходящим от стенок сосудов (рис. 2e).Однако другие кровеносные сосуды показывали лишь слабый сигнал от стенок сосудов или отсутствовали (Видео S1). Связаны ли эти различия с локальными условиями визуализации или они отражают различия между артериальными и венозными сосудами, предстоит выяснить в будущих исследованиях in vivo . Если пристеночные сигналы ГТГ присутствовали, они сильно исходили от тех сегментов стенок, которые шли примерно параллельно оптической оси («боковые стенки»), в то время как сегменты, параллельные фокальной плоскости, генерировали едва различимые сигналы или не генерировали никаких сигналов (рис. 2д, г).
2д, г).
Тканевые лейкоциты
В ткани, вне кровеносных сосудов, мы наблюдали сигналы ТГГ, напоминающие сигналы лейкоцитов. Окрашивание ДНК после фиксации подтвердило, что это клетки с ядром, причем форма некоторых ядер напоминает многодольчатые ядра гранулоцитов (рис. 3а). Визуализация THG в нефиксированной ткани продемонстрировала движение на несколько десятков микрометров и клеточную динамику этих клеток с событиями растяжения и ретракции филоподий и ламеллиподий (рис. 3b, c; фильм S2, фильм S3).Хотя движение немеченых лейкоцитов также можно наблюдать с помощью обычной просвечивающей светлопольной микроскопии или, с повышенным контрастом, с помощью отраженного света с косой трансиллюминацией [33], насколько нам известно, здесь мы приводим первый случай движения живых немеченых клеток в тканях с помощью трехмерное разрешение. При хороших локальных условиях визуализации мы обнаружили, что даже ядерные субструктуры могут быть распознаны не только при прямом обнаружении THG, но и при обратном обнаружении THG (рис. 4c, см. следующий абзац).Таким образом, должна быть возможность наблюдать клеточную миграцию также и в солидных органах, которые нельзя исследовать с помощью просвечивающей микроскопии.
4c, см. следующий абзац).Таким образом, должна быть возможность наблюдать клеточную миграцию также и в солидных органах, которые нельзя исследовать с помощью просвечивающей микроскопии.
Рисунок 3. Мигрирующие лейкоциты.
A) Фиксированная кремастерная мышца, оптический срез около 50 мкм от поверхности. THG (слева, голубой) выявил формы, напоминающие мигрирующие лейкоциты глубоко в ткани. Контрастное окрашивание ДНК (справа, красный) подтвердило, что эти формы представляют собой ядросодержащие клетки. В некоторых случаях ядра были дольчатыми, что характерно для зрелых нейтрофильных гранулоцитов (Gr).Обратите внимание, что некоторые клетки, идентифицированные окрашиванием ДНК, не видны в THG. B) Проекции THG (голубой) и SHG (красный) во временном ряду только что эксплантированного кремастера, записанные в прямом направлении. В то время как большинство лейкоцитов были стационарными, один переместился примерно на 25 мкм за 385 секунд (стрелки). На изображении справа показан yz-срез (вид сбоку, в конце временного ряда), показывающий, что движущаяся клетка находится внутри ткани, а не на поверхности.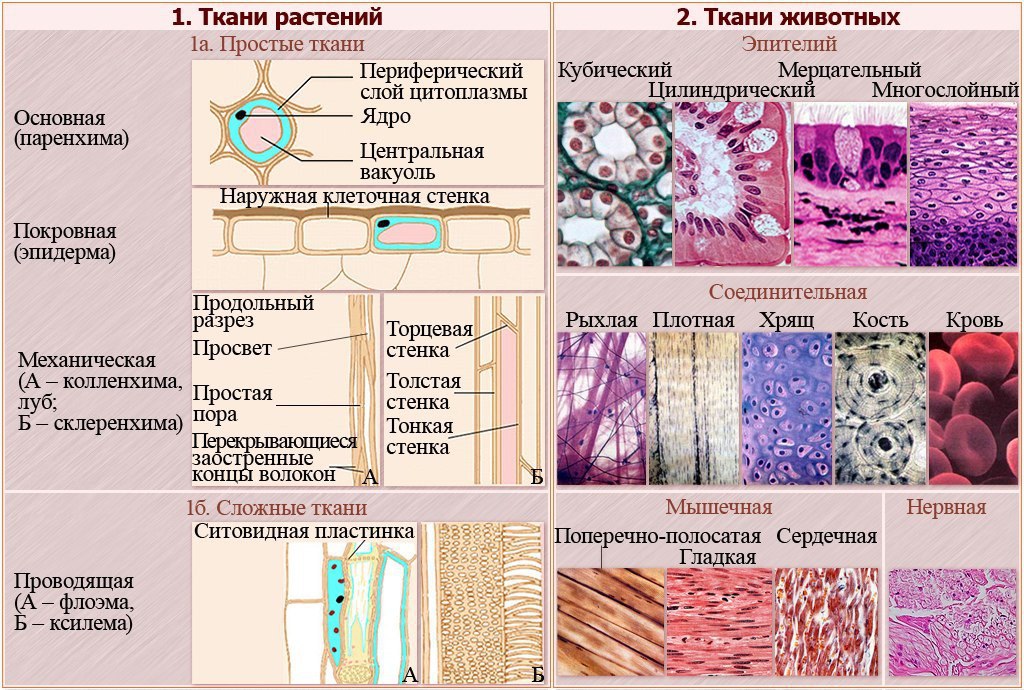 Соответствующий фильм показан в Movie S2. C) Мигрирующие лейкоциты в только что эксплантированном кремастере, формирующие и втягивающие псевдоподии.Единая оптическая секция. Соответствующий фильм показан в Movie S3. Шкала баров составляет 20 мкм.
Соответствующий фильм показан в Movie S2. C) Мигрирующие лейкоциты в только что эксплантированном кремастере, формирующие и втягивающие псевдоподии.Единая оптическая секция. Соответствующий фильм показан в Movie S3. Шкала баров составляет 20 мкм.
https://doi.org/10.1371/journal.pone.0028237.g003
Рис. 4. Структура ядер и хроматина.
A, B) Одиночные оптические передние срезы THG из неокрашенного эксплантированного кремастера. А — срез у поверхности, ядра, скорее всего, принадлежат макрофагам. Б. В более глубоких отделах помимо лейкоцитов можно наблюдать ядра мышечных волокон (m). C, D) Ядра кремастера после окрашивания ДНК Draq5.Хромоцентры колокализуются в каналах THG и при окрашивании ДНК. C, Одиночная оптическая секция. D, проекции пяти секций, расположенных на расстоянии 3 мкм друг от друга. Не все ядра, окрашенные ДНК, видны в THG. Масштабная линейка 20 мкм для всех изображений.
https://doi.org/10.1371/journal.pone.0028237.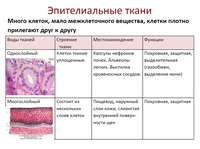 g004
g004
Ядерная организация
THG также визуализировал структуру ядерного хроматина в незафиксированной ткани (рис. 4а, б, фильм S1). Богатство деталей зависело от местных условий изображения и поэтому варьировалось.Условия с небольшим рассеянием и поглощением на пути луча были благоприятными, т.е. около поверхности ткани, но ядра в некоторых более глубоких местах также давали четкие сигналы (видео S1). Как и ожидалось, сигналы THG, записанные в прямом направлении, обычно обеспечивают лучшее отношение сигнал/шум. Однако для ядер мышечных волокон, идущих параллельно фокальной плоскости, структура хроматина была лучше различима в THG, записанном назад, поскольку сильный прямой сигнал THG от миозина скрывал детали (рис. 4c).Помимо сигнала ГТГ, генерируемого на границе ядра, мы обнаружили очень яркие внутренние структуры. Некоторые ядра отображали до восьми таких сигналов в одном оптическом срезе, напоминающих по форме и количеству хромоцентров (рис. 4а, в, г, фильм S1). Поэтому мы рассмотрели возможность того, что хромоцентры могут генерировать сигналы THG.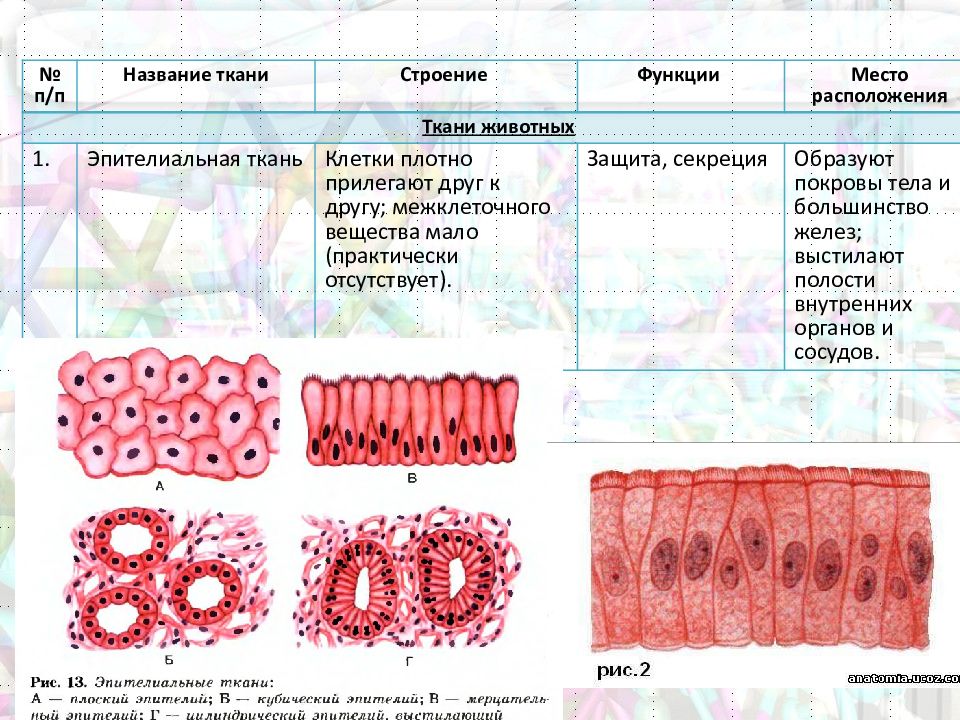 Хромоцентры представляют собой большие гетерохроматиновые кластеры, скопления повторяющихся ДНК, которые особенно заметны в ядрах клеток мыши (см. [34] и ссылки в ней).Ранее было показано, что они имеют более высокий показатель преломления, чем их ядерное окружение [35]. Окрашивание незафиксированной ткани кремастера ДНК-красителем Draq5 действительно показало, что внутриядерные сигналы THG колокализуются с хромоцентрами (рис. 4c, d).
Хромоцентры представляют собой большие гетерохроматиновые кластеры, скопления повторяющихся ДНК, которые особенно заметны в ядрах клеток мыши (см. [34] и ссылки в ней).Ранее было показано, что они имеют более высокий показатель преломления, чем их ядерное окружение [35]. Окрашивание незафиксированной ткани кремастера ДНК-красителем Draq5 действительно показало, что внутриядерные сигналы THG колокализуются с хромоцентрами (рис. 4c, d).
При возбуждении с длиной волны 266 нм ДНК проявляет автофлуоресценцию с максимумом около 350 нм и простирается примерно до 425 нм [36], [37]. Наши каналы THG оснащены детекторными фильтрами, пропускающими свет в диапазоне 417–477 нм. Чтобы проверить вклад мультифотонно-индуцированной автофлуоресценции ДНК в наблюдаемый сигнал хроматина, мы удалили фильтр обнаружения либо перед прямым детектором, либо перед обратным детектором, но не перед обоими.Затем мы уменьшили длину волны возбуждения с 1300 до 1200 нм с шагом 10 нм при записи обоими детекторами. С детектирующим фильтром сигнал хроматина резко уменьшался при 1240 нм и полностью исчезал при 1230 нм и более низких длинах волн, в то время как без фильтра сигнал оставался стабильным. Это наблюдение согласуется с сигналом ГТГ на одной трети длины волны возбуждения. Это несовместимо с заметным вкладом флуоресценции в сигнал хроматина, поскольку соотношение интенсивностей прямой и обратной интенсивности флуоресценции не должно меняться с длиной волны возбуждения.
С детектирующим фильтром сигнал хроматина резко уменьшался при 1240 нм и полностью исчезал при 1230 нм и более низких длинах волн, в то время как без фильтра сигнал оставался стабильным. Это наблюдение согласуется с сигналом ГТГ на одной трети длины волны возбуждения. Это несовместимо с заметным вкладом флуоресценции в сигнал хроматина, поскольку соотношение интенсивностей прямой и обратной интенсивности флуоресценции не должно меняться с длиной волны возбуждения.
Насколько нам известно, это первая визуализация немеченых хромоцентров или любой структуры гетерохроматина в живых клетках в 3D. Распределение хромоцентров изменяется во время дифференцировки клеток мыши на закономерности, характерные для каждого типа клеток (см. [34] и ссылки в ней), и перемещение центромерного гетерохроматина было описано в течение клеточного цикла, например. в лимфоцитах, вступающих в клеточный цикл из стадии покоя (G 0 ) при активации [38], [39], [40].Наше открытие, что хромоцентры индуцируют THG, открывает возможность изучения распределения этих структур в живых клетках без необходимости окрашивания ДНК, которое может мешать ядерной функции, проблема, которая возникла с несколькими соответствующими красителями [41].
Периферические нервные волокна
Самые сильные сигналы THG, которые мы наблюдали в кремастерной мышце мыши как в прямом, так и в обратном направлении, продуцировались периферическим нервным волокном (рис. 5). Сильный сигнал, записанный в обратном направлении, открывает возможность визуализации периферических нервных волокон даже в тканях, которые не позволяют собирать прямые или отраженные сигналы.Мы не обнаружили сопутствующих сигналов ГВГ, поскольку они были описаны для аксональных микротрубочек в центральной нервной системе (ЦНС) крысы [10], для нервных волокон в ЦНС рыбок данио [42] и в ЦНС мыши [32].
Рис. 5. Нервные волокна кремастера.
A) Нефиксированная, эксплантированная мышца, проекция нескольких оптических срезов на глубину 50 мкм. Периферический нерв (передний THG, голубой), окруженный коллагеновыми волокнами (передний SHG — красный, задний SHG — зеленый). Некоторые кровеносные сосуды и небольшие структуры также производят сигналы THG.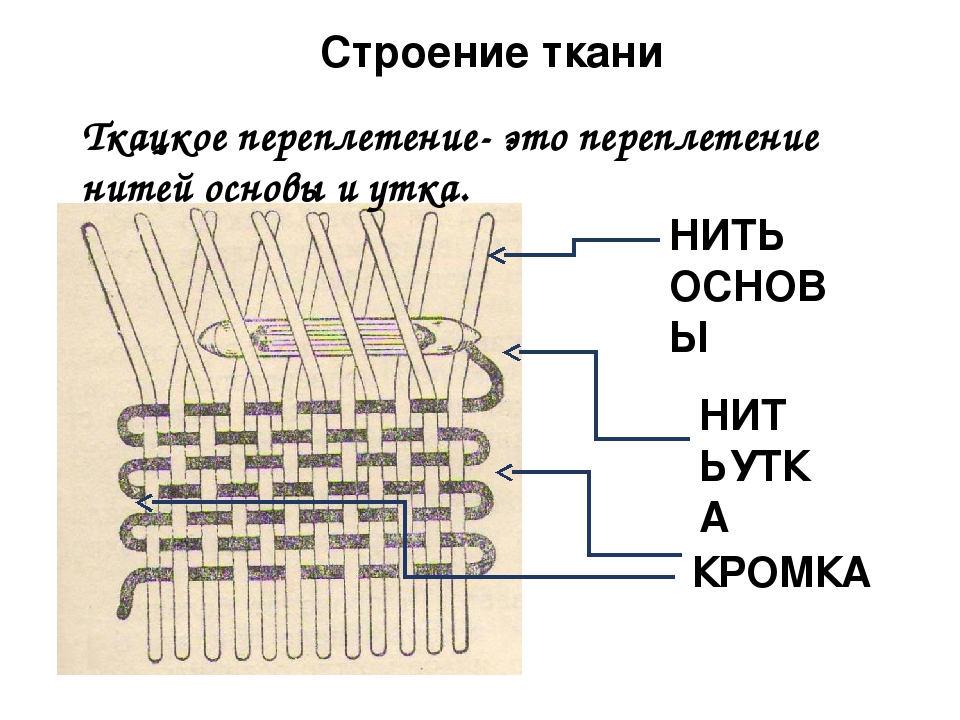 B-E) Одноканальные изображения A вблизи нервного соединения. Прямые изображения THG и SHG имеют гораздо лучшее отношение сигнал/шум, чем изображения назад. В то время как прямой и обратный сигналы SHG существенно отличаются в некоторых деталях изображения, обратный THG (не включенный в A) не содержит никакой информации в дополнение к более четкому прямому изображению THG. F, G) Фиксированный кремастер с флуоресцентным контрастным окрашиванием ДНК (красный) и прямым сигналом THG, визуализирующим нервы. Несколько клеточных ядер связаны с нервными волокнами.Масштабные линейки имеют размер 20 мкм, шкала в F действительна также для G.
B-E) Одноканальные изображения A вблизи нервного соединения. Прямые изображения THG и SHG имеют гораздо лучшее отношение сигнал/шум, чем изображения назад. В то время как прямой и обратный сигналы SHG существенно отличаются в некоторых деталях изображения, обратный THG (не включенный в A) не содержит никакой информации в дополнение к более четкому прямому изображению THG. F, G) Фиксированный кремастер с флуоресцентным контрастным окрашиванием ДНК (красный) и прямым сигналом THG, визуализирующим нервы. Несколько клеточных ядер связаны с нервными волокнами.Масштабные линейки имеют размер 20 мкм, шкала в F действительна также для G.
https://doi.org/10.1371/journal.pone.0028237.g005
В качестве потенциального источника сильного сигнала ТГГ в нервных волокнах на ум приходят упакованные мембраны миелиновой оболочки. Действительно, ранее в этом году было продемонстрировано, что нервные волокна в ЦНС мышей также продуцируют сильный сигнал THG и что этот сигнал колокализуется при специфическом окрашивании миелина [43]. Однако, в отличие от Farrar et al., мы не смогли визуализировать миелиновую оболочку сверху и снизу аксонов.Вместо этого, как и для кровеносных сосудов, мы обнаружили сильные сигналы от структур, ориентированных параллельно оптической оси. Учитывая большое рабочее расстояние 2 мм используемого объектива, ТГГ дает возможность визуализировать манипуляторы типа стеклянных игл [32] одновременно с огромными или мелкими нервами с высоким 3D-разрешением, обеспечивая прямой оптический контроль места пункции.
Однако, в отличие от Farrar et al., мы не смогли визуализировать миелиновую оболочку сверху и снизу аксонов.Вместо этого, как и для кровеносных сосудов, мы обнаружили сильные сигналы от структур, ориентированных параллельно оптической оси. Учитывая большое рабочее расстояние 2 мм используемого объектива, ТГГ дает возможность визуализировать манипуляторы типа стеклянных игл [32] одновременно с огромными или мелкими нервами с высоким 3D-разрешением, обеспечивая прямой оптический контроль места пункции.
Глубина проникновения
Для тканей, значительно толще кремастера мыши (150–200 мкм), обнаружение передаваемых вперед генерируемых сигналов SHG и THG невозможно.Вместо этого может быть получен только сигнал, обнаруженный в обратном направлении. В то время как обратное обнаружение затруднено более низким отношением сигнал/шум, чем прямое обнаружение, мы получили обратно обнаруженные сигналы SHG и THG по всей глубине кремастера. Чтобы оценить глубину, до которой могут быть зарегистрированы обратные сигналы от более толстой мышечной ткани, мы визуализировали мышцы бедра мыши. Поверх поперечно-полосатых мышечных волокон определялся слой соединительной ткани толщиной 100-250 мкм (рис. 6). С нашими стандартными детекторами максимальная глубина, на которой по крайней мере некоторая структурная информация, такая как мышечная исчерченность или коллагеновое волокно, все еще была распознаваема, варьировалась в зависимости от различных областей ткани и составляла от 150 до 400 мкм, при этом SHG в среднем на 20 мкм глубже, чем THG. (сравните рисунок 6).Мы воспользовались возможностью протестировать детекторы на основе арсенида галлия (GaAsP) вместо стандартных ФЭУ. При одинаковых условиях возбуждения эти более чувствительные детекторы позволяли получать изображения на глубине до 525 мкм для ГВГ и 550 мкм для ГВГ (рис. 6).
Поверх поперечно-полосатых мышечных волокон определялся слой соединительной ткани толщиной 100-250 мкм (рис. 6). С нашими стандартными детекторами максимальная глубина, на которой по крайней мере некоторая структурная информация, такая как мышечная исчерченность или коллагеновое волокно, все еще была распознаваема, варьировалась в зависимости от различных областей ткани и составляла от 150 до 400 мкм, при этом SHG в среднем на 20 мкм глубже, чем THG. (сравните рисунок 6).Мы воспользовались возможностью протестировать детекторы на основе арсенида галлия (GaAsP) вместо стандартных ФЭУ. При одинаковых условиях возбуждения эти более чувствительные детекторы позволяли получать изображения на глубине до 525 мкм для ГВГ и 550 мкм для ГВГ (рис. 6).
Рис. 6. Визуализация глубоких тканей бедренной мышцы мыши с обратными GaAsP-детекторами.
Первые 100 мкм состоят из соединительной ткани, затем идет плотная сеть коллагеновых волокон (150 и 200 мкм) и, наконец, поперечнополосатые мышечные волокна с вкраплениями коллагена. Для этого отображения на каждой глубине было выбрано другое положение x, y из исходного стека 200 × 200 мкм. Яркость каждой фокальной плоскости настраивалась индивидуально, чтобы компенсировать разницу в интенсивности. Масштабная линейка составляет 20 мкм.
Для этого отображения на каждой глубине было выбрано другое положение x, y из исходного стека 200 × 200 мкм. Яркость каждой фокальной плоскости настраивалась индивидуально, чтобы компенсировать разницу в интенсивности. Масштабная линейка составляет 20 мкм.
https://doi.org/10.1371/journal.pone.0028237.g006
Сигналы, обнаруженные в обратном направлении на заданном расстоянии от поверхности, могут на самом деле улучшаться с увеличением толщины ткани, поскольку увеличивающееся количество сигнала, генерируемого в прямом направлении, будет рассеиваться назад. в более глубоких слоях тканей.Это предположение подтверждается Легаре и его коллегами, показывающими, что интенсивность сигнала обратного рассеяния увеличивается, когда тонкий срез ткани помещается поверх сильно рассеивающей среды [44]. Недавний отчет об обратном THG-визуализации мозга мыши на глубину до 350 мкм в ткани также поддерживает эту точку зрения [32].
Связь прямого и обратного сигналов
Как и другие исследователи [45], мы обнаружили, что отношение интенсивностей прямой и обратной ГВГ варьировалось для разных структур. В частности, в нашем исследовании соотношение вперед/назад было намного выше для поперечно-полосатых мышечных волокон, чем для коллагеновых волокон (рис. 1).Это согласуется с теоретическими соображениями [46] и более ранними наблюдениями [12] о том, что паттерны, индуцирующие ГВГ, которые выровнены по падающему свету (вдоль оптической оси) на расстоянии большем, чем длина волны, создают в основном направленную ГВГ, в то время как более короткие структуры генерируют до 50% обратного ШГ. Соответственно, небольшое подмножество коллагеновых волокон с более сильным прямым сигналом можно интерпретировать как имеющее лучшее выравнивание с плоскостью поляризации падающего лазера или более толстое.
В частности, в нашем исследовании соотношение вперед/назад было намного выше для поперечно-полосатых мышечных волокон, чем для коллагеновых волокон (рис. 1).Это согласуется с теоретическими соображениями [46] и более ранними наблюдениями [12] о том, что паттерны, индуцирующие ГВГ, которые выровнены по падающему свету (вдоль оптической оси) на расстоянии большем, чем длина волны, создают в основном направленную ГВГ, в то время как более короткие структуры генерируют до 50% обратного ШГ. Соответственно, небольшое подмножество коллагеновых волокон с более сильным прямым сигналом можно интерпретировать как имеющее лучшее выравнивание с плоскостью поляризации падающего лазера или более толстое.
С помощью THG визуализированные структуры обычно не показывали относительных различий в интенсивности при прямом и обратном обнаружении. Обратный THG обычно выглядел как слабый прямой сигнал THG с уменьшенным отношением сигнал/шум (рис. 5b, c, данные не показаны). Предыдущее сравнение прямой и обратной ГТГ также не описывало структурных различий между изображениями [47]. Исключение из этого правила было выявлено при сравнении соотношения прямой/обратной интенсивности хромоцентров и исчерченности мышечных волокон.В то время как изображения, записанные в прямом направлении, показали мышечную исчерченность и хромоцентры с сопоставимой интенсивностью, изображения в обратном направлении показали относительно интенсивные хромоцентры, но слабую исчерченность (см. выше и рисунок 4c). Хотя долгое время считалось, что обратные ГТГ-сигналы состоят только из обратно рассеянного прямого сигнала, недавнее тщательное теоретическое и практическое исследование показало, что существует также прямая обратная составляющая. Для структур тоньше 100 нм этот обратный компонент относительно силен по сравнению с прямым сигналом.Однако общая величина сигнала ГТГ мала для такой тонкой структуры, поскольку в диапазоне нескольких сотен нанометров сигнал ГТГ экспоненциально уменьшается с уменьшением толщины [48]. Заманчиво предположить, что относительно сильный обратный ГТГ-сигнал хромоцентров может быть частично обусловлен высокой концентрацией оптически плотных волокон хроматина, погруженных в менее плотную кариоплазму.
Исключение из этого правила было выявлено при сравнении соотношения прямой/обратной интенсивности хромоцентров и исчерченности мышечных волокон.В то время как изображения, записанные в прямом направлении, показали мышечную исчерченность и хромоцентры с сопоставимой интенсивностью, изображения в обратном направлении показали относительно интенсивные хромоцентры, но слабую исчерченность (см. выше и рисунок 4c). Хотя долгое время считалось, что обратные ГТГ-сигналы состоят только из обратно рассеянного прямого сигнала, недавнее тщательное теоретическое и практическое исследование показало, что существует также прямая обратная составляющая. Для структур тоньше 100 нм этот обратный компонент относительно силен по сравнению с прямым сигналом.Однако общая величина сигнала ГТГ мала для такой тонкой структуры, поскольку в диапазоне нескольких сотен нанометров сигнал ГТГ экспоненциально уменьшается с уменьшением толщины [48]. Заманчиво предположить, что относительно сильный обратный ГТГ-сигнал хромоцентров может быть частично обусловлен высокой концентрацией оптически плотных волокон хроматина, погруженных в менее плотную кариоплазму.
THG как инструмент визуализации тканей
В ряде исследований было установлено, что ГВГ используется для визуализации коллагеновых волокон и миозина поперечнополосатых мышц.Совсем недавно стало ясно, что THG может иметь еще более широкий потенциал для безметочной трехмерной микроскопии тканей. Насколько нам известно, это исследование является первым, демонстрирующим трехмерное движение немеченых лейкоцитов в тканях (рис. 3b, c), оптическое сечение немеченой структуры хроматина (рис. 4), а также первую визуализацию немеченых периферических нервных волокон. Таким образом, применение микроскопии ТГГ является предпочтительным методом, когда окрашивание структур, индуцирующих ТГГ, невозможно или нежелательно, например.г. чтобы избежать неуверенности в нефизиологическом влиянии красителей. Кроме того, поскольку ГВГ и ГТГ являются когерентными процессами, они протекают без энерговклада в образец, в отличие от возбуждения флуоресценции. Поскольку ГВГ и ТГГ являются прямым следствием молекулярного состава образца, не происходит обесцвечивания флуорохромов с сопутствующим образованием свободных радикалов и результирующей фототоксичностью при условии, что одновременная генерация аутофлуоресценции незначительна [7], [8]. Вместо этого высокая интенсивность света, необходимая для генерации более высоких гармоник, создает риск образования плазмы, в частности, на сильно поглощающих структурах, таких как меланин или другие темные частицы. Другими важными отличиями от флуоресценции являются зависимость мощности сигнала от направления поляризации возбуждающего лазерного луча [27] и неравномерное пространственное распределение генерируемого света, генерируемого в основном в прямом направлении [48], [49], [50]. .
Вместо этого высокая интенсивность света, необходимая для генерации более высоких гармоник, создает риск образования плазмы, в частности, на сильно поглощающих структурах, таких как меланин или другие темные частицы. Другими важными отличиями от флуоресценции являются зависимость мощности сигнала от направления поляризации возбуждающего лазерного луча [27] и неравномерное пространственное распределение генерируемого света, генерируемого в основном в прямом направлении [48], [49], [50]. .
Несмотря на то, что мы показали, что микроскопия ГТГ обеспечивает разрешение на уровне одной клетки, ее применение к клеткам, культивируемым непосредственно на стекле или пластике, может оказаться затруднительным, поскольку поверхность раздела среда/субстрат генерирует сильный сигнал ГТГ, повышая фон для внутриклеточных наблюдений. (данные не показаны).
Местные условия визуализации важны и по другим причинам. Сила сигналов SHG и THG сильно зависит от относительной ориентации потенциально гармонической структуры по отношению к входящему поляризованному лазерному лучу и от оптических условий в окружающем образце, таких как несоответствие показателей поглощения, рассеяния и внутреннего преломления на пути луча. Например, мы наблюдали затенение заполненными кровью сосудами на участках под ними. Окрашивание ДНК выявило некоторые ядра клеток, которые не были визуализированы с помощью THG, в то время как другие были видны (рис. 3а, рис. 4d).Мы получили сильные сигналы ГТГ от тех сегментов стенок кровеносных сосудов и миелиновых оболочек, которые параллельны оптической оси, но не от тех, которые перпендикулярны, хотя известно, что они имеют одинаковый молекулярный состав. Таким образом, отсутствие структуры на ГТГ-изображении не обязательно равнозначно отсутствию структуры в образце, и соответствующие интерпретации следует проводить с осторожностью. Однако THG предоставляет обширную трехмерную информацию о немеченых образцах, которую невозможно получить другими доступными методами.
Например, мы наблюдали затенение заполненными кровью сосудами на участках под ними. Окрашивание ДНК выявило некоторые ядра клеток, которые не были визуализированы с помощью THG, в то время как другие были видны (рис. 3а, рис. 4d).Мы получили сильные сигналы ГТГ от тех сегментов стенок кровеносных сосудов и миелиновых оболочек, которые параллельны оптической оси, но не от тех, которые перпендикулярны, хотя известно, что они имеют одинаковый молекулярный состав. Таким образом, отсутствие структуры на ГТГ-изображении не обязательно равнозначно отсутствию структуры в образце, и соответствующие интерпретации следует проводить с осторожностью. Однако THG предоставляет обширную трехмерную информацию о немеченых образцах, которую невозможно получить другими доступными методами.
Две причины говорят в пользу обнаружения сигналов ГТГ в видимом диапазоне вместо генерации УФ-ГТГ, т.е. с длинами волн, доступными для Ti:Sa-лазеров (≤1060 нм): передача сигнала ГТГ через обычную стеклянную оптику лучше в видимом диапазоне, а сильное поглощение и сильное рассеяние УФ-света биологическими тканями исключено. В предыдущих исследованиях для достижения этой цели использовались самодельные хром-фостеритовые лазеры, излучающие свет с длиной волны 1230 нм (например, [51], [52]), или другие лазеры с фиксированной длиной волны [14], [53].Однако эти источники света не получили широкого распространения в биологических лабораториях. Таким образом, возможность выполнить микроскопию ГТГ была доступна только в очень немногих местах. Благодаря более широкому распространению коммерчески доступных оптических параметрических генераторов (ОПО) для многофотонной микроскопии этот настраиваемый источник света теперь также доступен для индукции ГТГ [48], [54]. Эти инструменты, обычно накачиваемые лазером Ti:Sa, настраиваются и обеспечивают импульсный когерентный луч с длиной волны от 1100 до 1300 нм и выше.В то время как большинство лабораторий приобретут OPO, чтобы обеспечить двухфотонное возбуждение флуоресценции красных флуорохромов, например. 1120 или 1180 нм, OPO также являются хорошими источниками света для визуализации ГТГ [55], как также показано в текущем исследовании.
В предыдущих исследованиях для достижения этой цели использовались самодельные хром-фостеритовые лазеры, излучающие свет с длиной волны 1230 нм (например, [51], [52]), или другие лазеры с фиксированной длиной волны [14], [53].Однако эти источники света не получили широкого распространения в биологических лабораториях. Таким образом, возможность выполнить микроскопию ГТГ была доступна только в очень немногих местах. Благодаря более широкому распространению коммерчески доступных оптических параметрических генераторов (ОПО) для многофотонной микроскопии этот настраиваемый источник света теперь также доступен для индукции ГТГ [48], [54]. Эти инструменты, обычно накачиваемые лазером Ti:Sa, настраиваются и обеспечивают импульсный когерентный луч с длиной волны от 1100 до 1300 нм и выше.В то время как большинство лабораторий приобретут OPO, чтобы обеспечить двухфотонное возбуждение флуоресценции красных флуорохромов, например. 1120 или 1180 нм, OPO также являются хорошими источниками света для визуализации ГТГ [55], как также показано в текущем исследовании.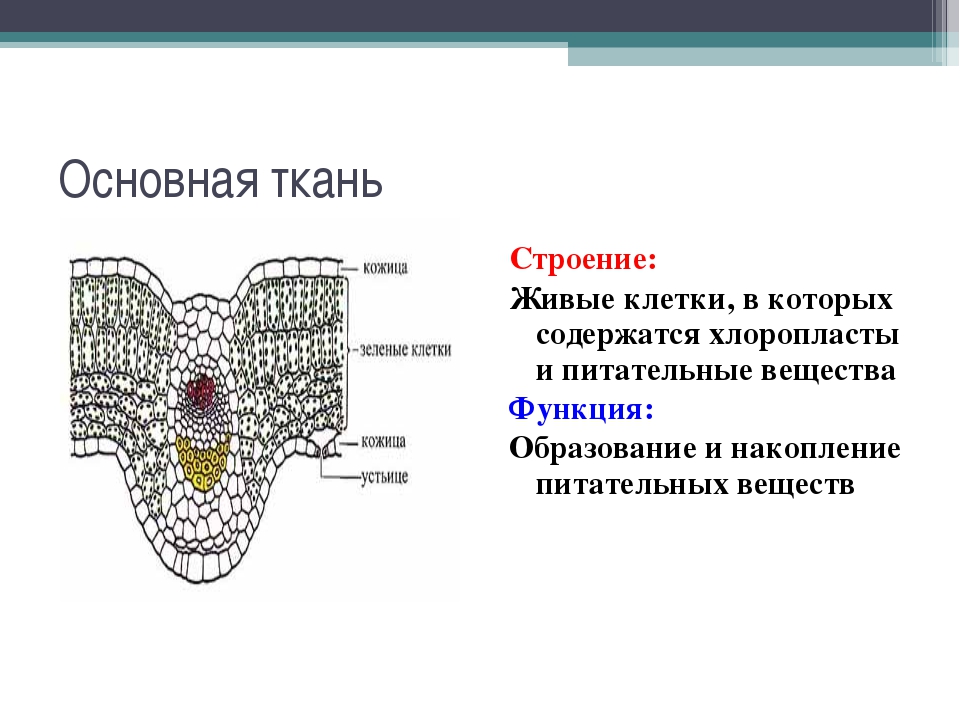 Учитывая преимущества трехмерной визуализации с высоким разрешением без меток, можно ожидать, что микроскопия THG вскоре станет более распространенным методом трехмерной визуализации тканей без меток.
Учитывая преимущества трехмерной визуализации с высоким разрешением без меток, можно ожидать, что микроскопия THG вскоре станет более распространенным методом трехмерной визуализации тканей без меток.
|
|
Глава 4 — Примечания
Глава 4 — ПримечанияГистология: изучение ткани
1. Определение
- ткань представляет собой группу подобных клеток с
межклеточный материал, которые вместе выполняют определенную функция.
- Четыре основные ткани и зародышевый листок
производная
1. Эпителиальная ткань: эктодерма, энтодерма, мезодерма
2. Соединительная ткань: мезодерма
3.Мышечная ткань: мезодерма
4. Нервная ткань: эктодерма
Эпителиальный Ткань
2. Характеристики
- Функция — защищать, поглощать, выделять
- Существовать в листах клеток (мембран)
- Нет кровоснабжения
- Содержат нижнюю базальную мембрану
— прикрепляет эпителиальную ткань к соединительная ткань ниже
— состоит из соединительной ткани волокна и
межклеточный вещество - Типы эпителиальных клеток
— Плоскоклеточный — плоские клетки неправильной формы
— Columnar — колоннообразный с овалом ядро в основании клетки
— кубовидный — относительно квадратный; центральное ядро - Метод классификации эпителиальной ткани
— по типу ячейки
— по количеству слоев клеток
простой — один слой ячеек
многослойный — несколько слоев клеток - Эпителиальный онлайн-сравнение тканей
3.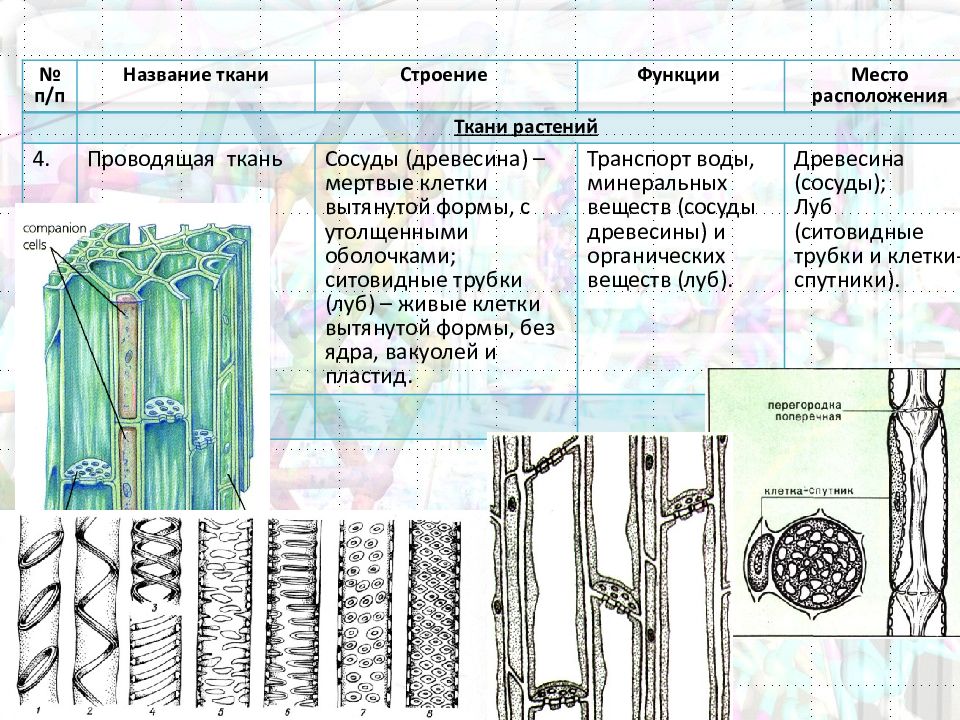 Типы эпителиальной ткани
Типы эпителиальной ткани
Простой плоский эпителий
ᙎ矵ᙪ矵»/>
- Структура — однослойная плоские, плоскоклеточные клетки
- Функция — сведена клетки подчеркивают способность поглощать
- Местоположение — воздух
мешок (альвеолы) легких , стенки капилляров
покрытие органов, часть почки, фильтрующая кровь
Простой кубический эпителий
- Структура — один слой кубических ячеек
- Функция — всасывание, секреция
- Расположение — почечные канальцы ,
линии роговицы и хрусталика глаза,
Щитовидная железа
Простой цилиндрический эпителий
- Структура – однослойная столбчатая
ячейки
— может содержать следующие специализированные структуры
а. Бокаловидные клетки — специализированы для секреции слизи
Бокаловидные клетки — специализированы для секреции слизи
б. Микроворсинки с перпендикулярными выступами для
абсорбция
в. Реснички в дыхательных путях - Функция — защита, секреция, абсорбция
- Местонахождение — слизистая оболочка пищеварительного тракта, желчь
камера и часть
маточных труб и дыхательных путей
ороговевший многослойный плоский эпителий
- Структура — несколько слоев по три
эпителиальная клетка
типы, поверхностные клетки, обезвоживание, плавление и
наполнитель кератин, желтый роговой материал
— базальный слой подвергается митозу - Функция — защита живых клеток
ниже
— первая линия обороны - Местоположение — поверхности, постоянно подвергающиеся воздействию воздуха; кожа
Некератинизированный многослойный плоский эпителий
- Структура — многослойная из трех
эпителиальная клетка
виды; содержит слизистые железы - Назначение — защита от истирания
- Расположение — слизистая оболочка рта, пищевод , влагалище
Псевдостратифицированный цилиндрический эпителий
- Структура – один слой столбчатых ячеек
с
появление нескольких слоев
— может содержать бокаловидные клетки и реснички - Функция — защита, улавливание частиц пыли
- Расположение — слизистая трахеи ,
мужской репродуктивный
протоки, протоки некоторых желез
Переходный эпителий
- Структура — все 3 типа ячеек с закругление внешнего слоя
- Функция — допускать растяжение (растяжение)
- Расположение — прокладка из мочевыводящих путей мочевой пузырь и мочеточники
Железистый эпителий
- Определение — специализированная группа эпителиальные клетки, функционирующие в секреции
- Формирование желез
— эпителиальные клетки прорастают вниз в поддерживающую ткань
— клетки пролиферируют и дифференцируются
— эндокринные сальники
— клетки, которые отделяются от эпителия
— без воздуховодов
— выделения попадают в кровоток
— экзокринные железы
— клетки, которые сохраняют связь с поверхностью эпителия
— воздуховод есть подарок
— секреция высвобождается на поверхность эпителия
-типы экзокринные железы
1. Галокрин — клетка умирает и высвобождает содержимое
Галокрин — клетка умирает и высвобождает содержимое
— сальная железа
2. Мерокрин – секрет высвобождается без повреждения ячейка
— потовая железа, поджелудочная железа, слюнные железы
3. Апокринный — от клетки
отщипывается секрет. — молочная железа
гистология онлайн-сайты
Соединительная ткань
4.Характеристики
- Функция — поддержка и крепление
- Клетки разбросаны по волокнам и матрица
- Сосудистый
- Возникает из эмбриональной мезенхимы
- Матрица варьируется от жидкой до твердой, удерживает
волокна и клетки
на месте при определении функции ткани - Волокна состоят из трех белков
- Типы волокон
а.Коллагеновая — содержит белок коллаген,
— волокна прочные и гибкие
б. Ретикулярный
волокна — тонкие разветвленные волокна форма
Ретикулярный
волокна — тонкие разветвленные волокна форма
несущий каркас
в. Эластичный волокна — белок эластин, волокна имеют
прочность и эластичность - Типы клеток соединительной ткани
а.Фибробласт — производит волокна и матрица
— самый многочисленный
— занимается ремонтом и ростом
б. Фиброцит — зрелый фибробласт
— техническое обслуживание
в. Макрофаги — защита, фагоцитоз
д.Плазма клетки — источник циркулирующих антител
е. Тучная ячейка — высвобождает гепарин, антикоагулянт
— высвобождает гистамин, расширяет мелкие кровеносные сосуды
ф. жировая клетка — запасает триглицериды
— форма кольца с печаткой
5. Типы соединительной ткани
Типы соединительной ткани
Ареолярная соединительная ткань (ареолярная)
- Структура – коллагеновая и
эластичные волокна
— все 6 типов клеток соединительной ткани
— жидкая матрица содержит гиалуроновая кислота
что способствует распространению - Функция — покрывает органы
— удерживает кровеносные сосуды и нервы на месте
— широко распространен
— питательная роль
— вторая линия обороны - Местоположение — слизистые оболочки
— между тканями органов тела
— с жировой тканью образует подкожный слой
Плотная соединительная ткань
- Структура – коллагеновые волокна
преобладать
— клетки фибробласты и макрофаги
— плотная матрица - Функция — обеспечивает прочность
- Расположение – волокна расположены
параллельные связки для прочности
— сухожилия (прикрепляет мышцу к кости)
— связки (удерживает кости в суставах)
— волокна неправильной формы для апоневрозов растяжения (фасций)
и капсулы органов
Эластическая соединительная ткань
- Структура – эластичная, свободно разветвляющаяся волокна, несколько фибробластов
- Функция — разрешает расширение и отдача
- Расположение – легкие, трахея, артерии, аорта
Ретикулярная соединительная ткань
- Структура преимущественно ретикулярная волокна, тонкая матрица
- Функция – содержит ячейки свободные органы вместе
- Расположение — печень, селезенка , кость костный мозг
Жировая соединительная ткань
- Структура – коллагеновая и эластичная
волокна
— все шесть клеток соединительной ткани
— фибробласты специализируются как жировые клетки
(центральная жировая вакуоль, тонкая цитоплазма)
— связанные с ареолярной соединительной тканью - Функция — запас еды для
энергия
— предотвращает потерю тепла тела - Расположение — вокруг большинства органов
— под кожу
— костный мозг длинных костей
Хрящ
- Общие характеристики
1.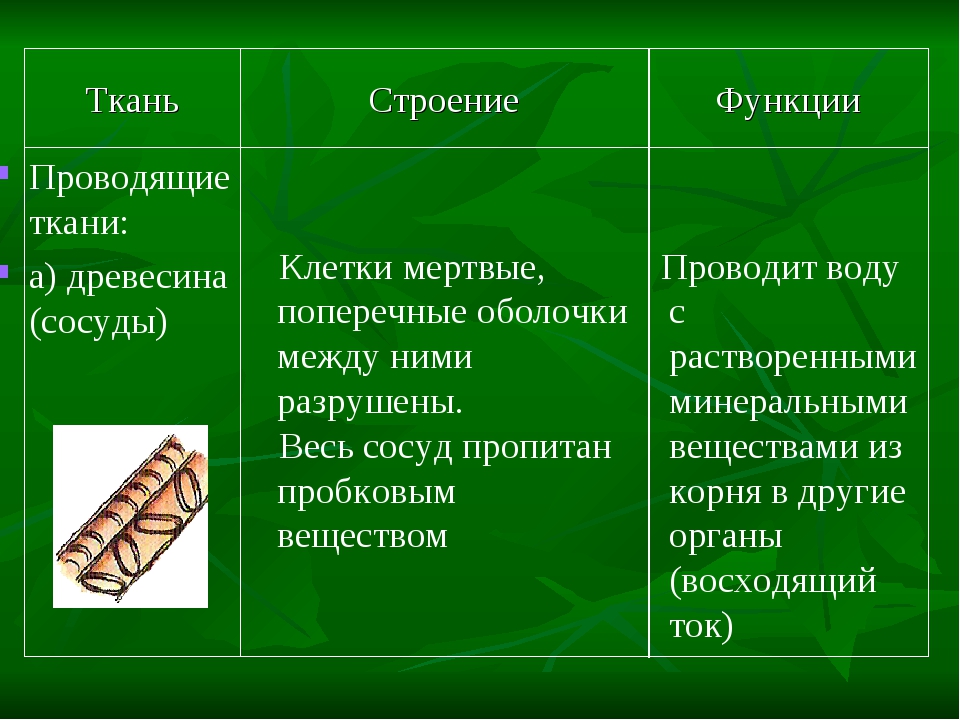 клетки хондроциты
клетки хондроциты
2. матрица полутвердая, содержащая хондроитин
3. лакуна — углубление в матрице в котором находятся хондроциты
4. надхрящница — соединительная ткань мембрана вокруг хряща
5. нет кровоснабжения - Типы
Гиалиновый хрящ
- Структура — невидимый штраф
коллагеновые волокна
— по два хондроцита в каждой лакуне
— густое желеобразное основное вещество - Функция – действует как модель для
эмбриональная кость
образования, предотвращает повреждение тканей
от трения.Придает форму носу
и дыхательных путей - Расположение – покрытие концов костей в суставах
— кончик носа
— между ребром и грудиной (реберная)
— эпифизарная пластина
Волокнистый хрящ
- Структура – коллагеновые волокна
собраны в параллельные пучки
— хондроциты, зажатые между пучками - Функция — обеспечивает силу
- Местоположение — межпозвонковое диски, лобковый симфиз
Эластичный хрящ
- Структура – много эластичных волокон
- Функция – позволяет сгибать вернуться к исходной форме
- Расположение – наружное ухо, гортань и евстахиевы трубы
Костная ткань
- Общие характеристики
— органический материя — 35% (клетки и волокна)
— неорганический материал — 65% (матрица и соли кальция) - Типы костных клеток
1. остеоциты — поддержание межклеточного материала
(матрица)
остеоциты — поддержание межклеточного материала
(матрица)
2. остеобласты — периферические костеобразующие клетки
3. остеокласты — внутренние, активно разрушают костный матрикс - Классификация костей по к конструкции
-
1. Компактный кость
— расположены в виде концентрических колец, называемых гаверсовыми системами
— обеспечивает прочность
— внешний и твердый
— Гаверсова система состоит из: ламель — концентрическое кольцо матрицы
лакуна — отверстия между ламелями для остеоцитов
остеоциты — зрелая костная клетка
гаверсов канал — в центре пластинки; дома для судов
Canaliculi — лучистые каналы между лакунами
и Гаверсов канал для биогенных веществ и отходов
Канал Фолькмана — поперечные каналы от Гаверсова канала
наружу, содержащие кровеносные сосуды и нервы
2.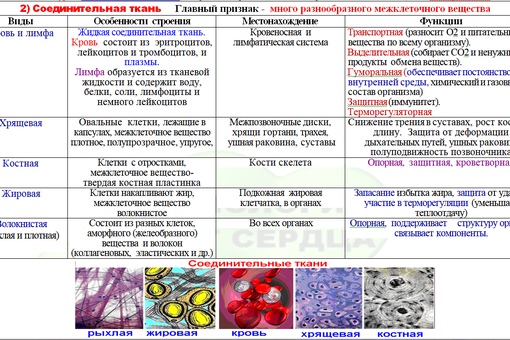 Губчатая кость
Губчатая кость
— неправильная решетчатая структура кости, называемая трабекулой
— пространства, заполненные красным костным мозгом
— остеоциты, захваченные кальциевой матрицей
Лаборатория соединительной ткани
Линия услуг по структурному тестированию и анализу тканей — основные исследовательские центры клиники Мэйо
Служба структурных испытаний и анализа тканей
Услуги структурного тестирования и анализа тканей в Mayo Clinic сосредоточены на физических материалах, необходимых для биомедицинских исследований.База гистоморфометрии биоматериалов дает исследователям новое понимание строения и структуры костей; ядро материалов и структурных испытаний сосредоточено на проектировании, моделировании, изготовлении и моделировании проектных материалов; и центр гистологии обрабатывает, встраивает, делает срезы и окрашивает ткани животных для проведения исследований.
Biomaterials Histomorphometry Core
Biomaterials Histomorphometry Core помогает исследователям оценить комплексные метаболические нарушения костей, оценить влияние скелетно-активных агентов и оценить новые лекарства от остеопороза и других метаболических заболеваний костей. Спектр услуг ядра позволяет исследователям оценивать формирование, минерализацию и обмен костей с использованием наиболее точных доступных методов. Услуги включают:
Спектр услуг ядра позволяет исследователям оценивать формирование, минерализацию и обмен костей с использованием наиболее точных доступных методов. Услуги включают:
- Пластиковые и парафиновые заливки
- Обработка и оценка тканей человека, крупных и мелких животных
- Характеристика биоматериалов
- МикроКТ сканирование
Узнайте больше о ядре для гистоморфометрии биоматериалов.
Центр биомеханики
Центр биомеханики предоставляет следующие услуги:
- Механические испытания
- Моделирование
- Анализ данных
- Инженерный проект
- Изготовление
- Моделирование
- Моделирование
Услуги применяются к проектам в широком спектре специальностей, включая стоматологию, кардиологию, гастроэнтерологию, акушерство и гинекологию и ортопедию.Сервисы помогают исследователям оценивать клинические вмешательства на скелетных суставах и тканевых структурах, моделировать работу медицинских устройств для лечения последствий дегенеративных заболеваний и травм, а также характеризовать механические свойства биомедицинских материалов.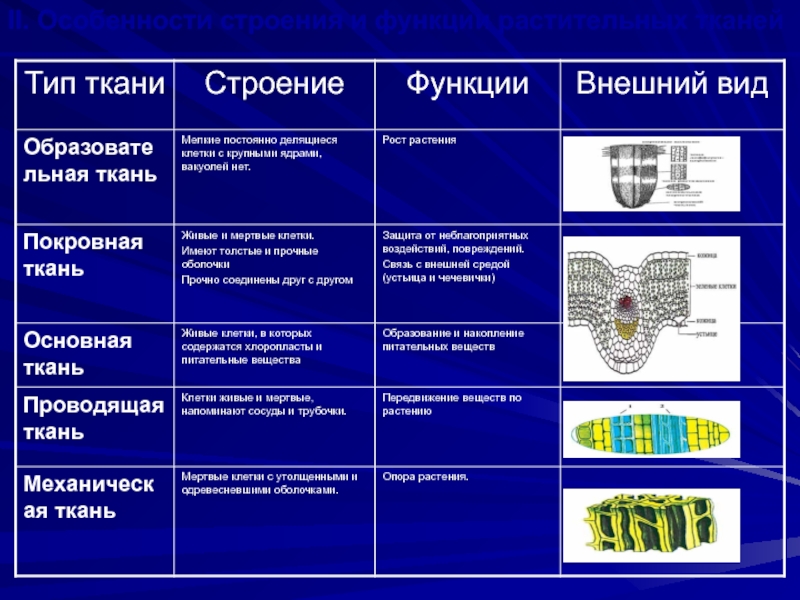


 Также сохраняются свободные жирные кислоты, холестерин, моно- и диглицериды.
Также сохраняются свободные жирные кислоты, холестерин, моно- и диглицериды. 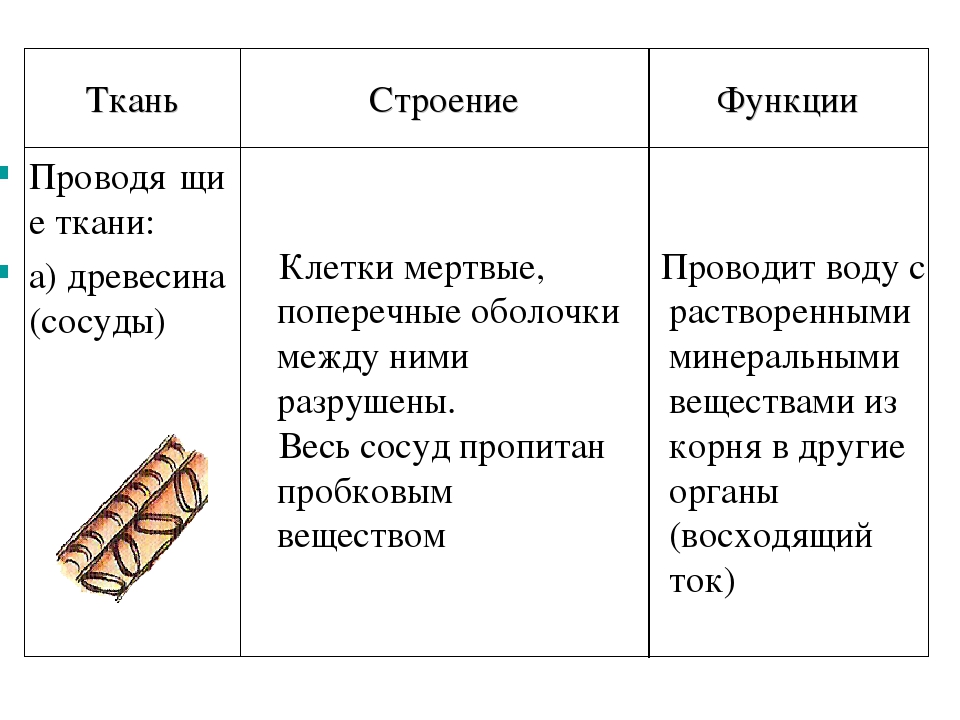 Излишки откладываются в жировой ткани. Избыток углеводов и белков, поступающих во время еды, также может быть преобразован в жир (обычно в печени), а затем перемещен в жировую ткань для более длительного хранения.
Излишки откладываются в жировой ткани. Избыток углеводов и белков, поступающих во время еды, также может быть преобразован в жир (обычно в печени), а затем перемещен в жировую ткань для более длительного хранения.