Покрытосеменные растения. Ткани растений. Строение и назначение органов растений
Все растения подразделяют на низшие и высшие. Высшие растения подразделяют на споровые и семенные. Покрытосеменные (или Цветковые) растения относятся к высшим семенным растениям.
Они, как и голосеменные, размножаются с помощью семян, которые образуются после отцветания. Однако семена их защищены околоплодником, т. е. они покрыты, что способствует их лучшему сохранению и распространению.
Отсюда и название этого отдела высших растений ― покрытосеменные.
Покрытосеменные очень разнообразны. Среди них имеются вечнозелёные и листопадные деревья, а также кустарники и полукустарники, однолетние и многолетние травы.
Однако,
как бы ни были разнообразны растения, все они сходны друг с другом. Сходство
это состоит в том, что любому растению присуще клеточное строение.
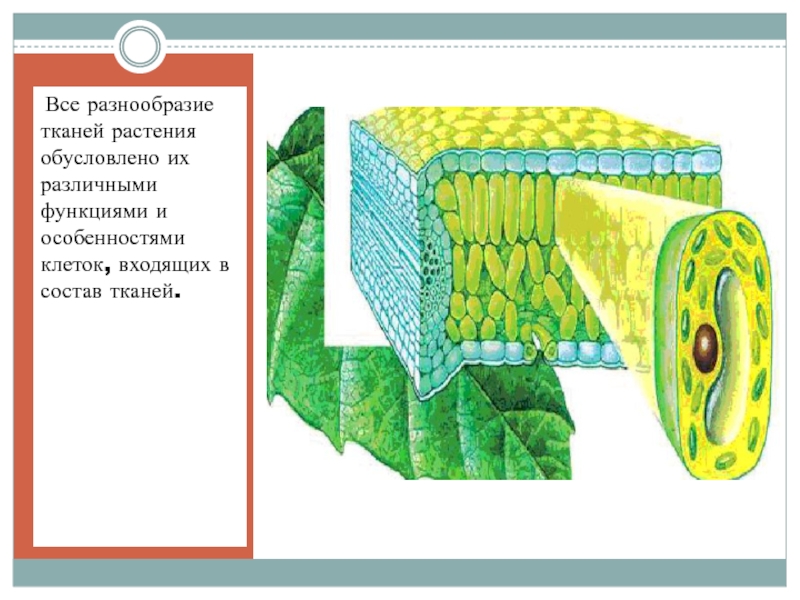
Клетки группируются в ткани. Ткань — это совокупность клеток и межклеточного вещества, имеющих общее происхождение, строение и выполняющих определённые функции.
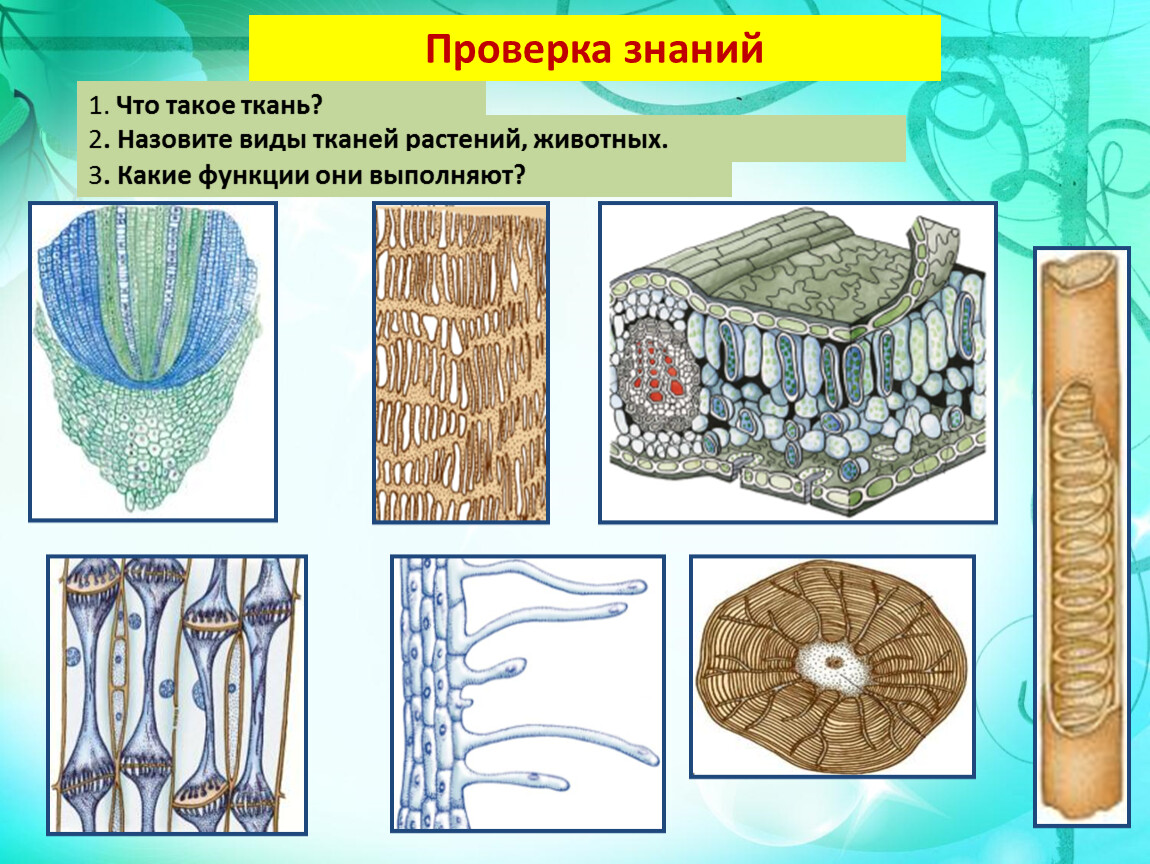
В организмах растений выделяют следующие виды тканей: образовательные, покровные, механические, проводящие, основные.
Образовательная (меристема) — это ткань, которая состоит из непрерывно делящихся клеток. Она обеспечивает непрерывное нарастание массы растения, а также предоставляет материал для образования других тканей.
Существует два основных типа меристем ─ апикальные, которые располагаются на верхушках побегов и корней и обеспечивают нарастание их в длину.
И боковые меристемы, или латеральные. Они располагаются параллельно боковым поверхностям осевых органов. Эти меристемы обеспечивают нарастание стволов в толщину.
Покровная
ткань — это наружная ткань, которая предохраняет
органы растения от различных неблагоприятных факторов внешней среды.
Покровная ткань состоит из живых или мёртвых клеток с плотно сомкнутыми оболочками. Эти ткани находятся на поверхности корней, стеблей, листьев.
Покровную ткань, состоящую из живых клеток, называют кожицей. Она имеет вид тонкой прозрачной плёнки, покрывающей органы растения. Со временем на некоторых органах растений вместо кожицы образуется пробка. Клетки пробки мёртвые, полые, имеют утолщённые оболочки. Они надёжно защищают органы растения от неблагоприятных условий среды.
Через покровные ткани стебля осуществляется газообмен. Во внешней покровной ткани газообмен происходит через устьица.
Часто покровная ткань растений имеет различные образования: шипы, кроющие и жел
Механическая ткань состоит из живых и мёртвых клеток, которые придают механическую прочность растению.
Механические
ткани присутствуют во всех органах растения, но наиболее они развиты снаружи
стебля и в центральной части корня.
Проводящая ткань — это ткань, которая служит для передвижения по организму растворённых питательных веществ.
Проводящие ткани имеют вид трубок. Проводящие ткани растений — это ксилема (древесина) и флоэма (луб).
По ксилеме (древесине) вода и растворенные в ней минеральные вещества передвигаются от корня к листьям — это восходящий ток.
В состав ксилемы входят: трахеиды (одиночные клетки), сосуды (длинные трубки, образованные при слиянии ряда клеток), древесинные волокна и паренхимные клетки.
По флоэме (лубу) осуществляется транспорт воды и продуктов фотосинтеза от листьев к местам их использования или отложения — это нисходящий ток.
В состав флоэмы входят:
Ситовидные элементы (ситовидные клетки, ситовидные трубки и клетки-спутницы), обеспечивающие основной транспорт.
Механические ткани, выполняющие опорную функцию.
И
паренхимные клетки, которые обеспечивают транспорт и запас питательных веществ.
Мягкие части листа, сердцевина стеблей и корней, мягкие части цветков и плодов образованы основной тканью. Она составляет большую часть всех органов растения. Основная ткань обычно богата межклетниками. Главная функция основной ткани — это синтез и запас различных веществ: крахмала, сахара, жира, белка.
Ткани группируются в органы.
Органы покрытосеменных подразделяют на репродуктивные, или генеративные (это цветок и плод с семенами), и вегетативные (это корень, стебель, лист).
Цветок — является органом полового размножения покрытосеменных растений.
Из него образуются плоды с семенами. Несмотря на внешнее разнообразие, все цветки имеют сходное строение.
Тоненький
стебелёк, на котором у большинства растений сидит цветок, называют цветоножкой,
а её верхнюю, расширенную часть, которая может принимать различную форму,
― цветоложем.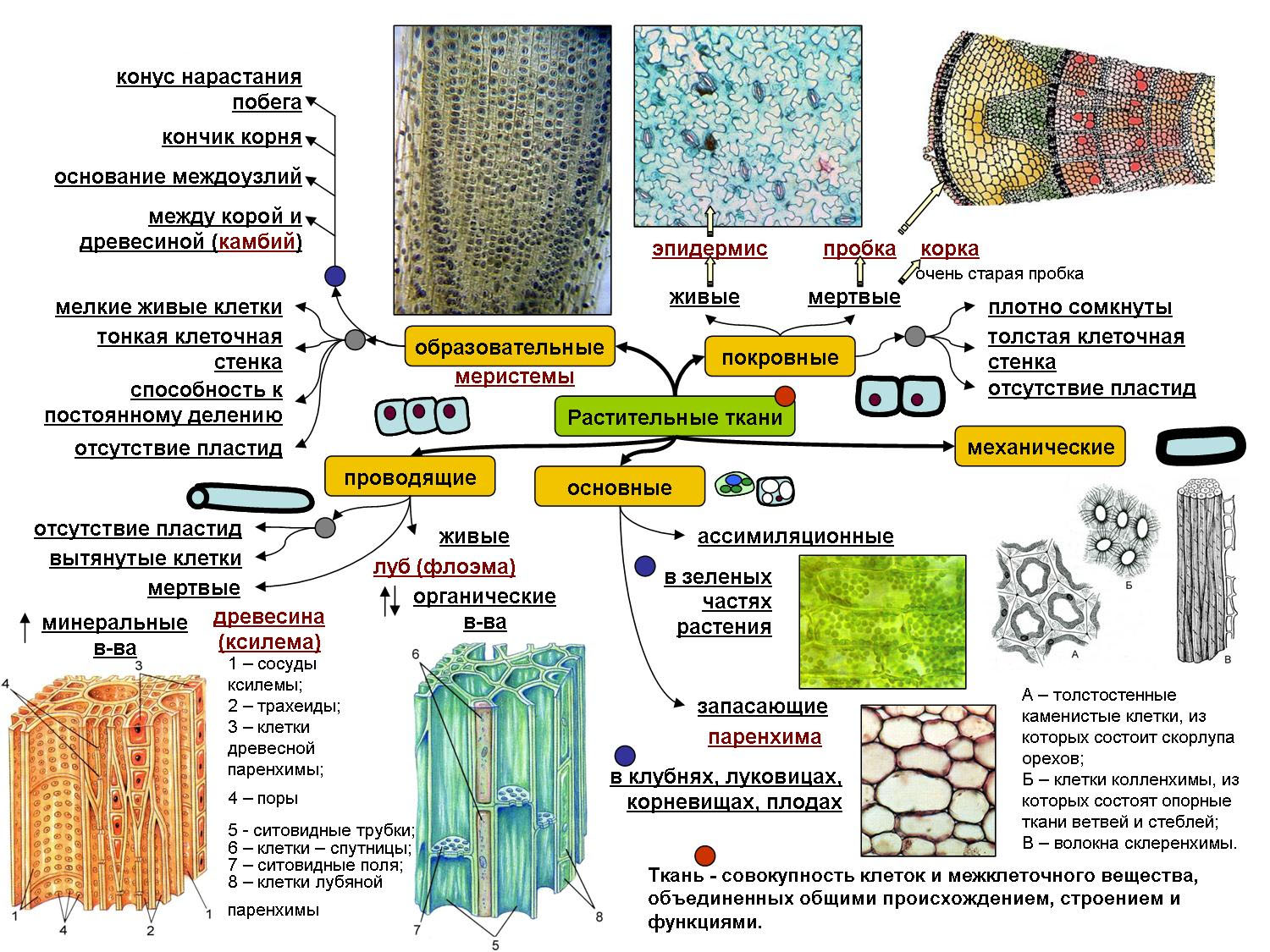 Наружные листочки ― чашелистики
― образуют чашечку. Внутренние листочки ― это лепестки,
которые составляют венчик цветка.
Наружные листочки ― чашелистики
― образуют чашечку. Внутренние листочки ― это лепестки,
которые составляют венчик цветка.
Многочисленные тычинки окружают пестик. Пестик и тычинки ― это главные части цветка. Вокруг тычинок и пестика расположен околоцветник.
У каждого семейства цветковых определённое строение цветка. Его можно изобразить формулой.
У многих растений цветки собраны в соцветия. Соцветия ― это группы цветков, расположенных близко один к другому в определённом порядке. В соцветия обычно собраны мелкие цветки, что делает их хорошо заметными для насекомых-опылителей.
Если цветки (сидячие или на цветоножках) находятся на главной оси, то такие соцветия называют простыми. Если цветки расположены на боковых осях — это сложные соцветия.
Число
цветков в соцветиях различно — от нескольких цветков до десятков тысяч.
После того как цветок отцвёл, наступает новый этап его развития ― образование
Плод состоит из околоплодника и семян. Околоплодник — это разросшиеся и видоизменившиеся стенки завязи.
Семена защищены околоплодником, т. е. они покрыты, что способствует их лучшему сохранению и распространению. Важнейшие функции плода — это защита и распространение семян.
При помощи семян происходит размножение покрытосеменных растений.
У фасоли зрелое семя состоит из семенной кожуры, зародыша — зачатка будущего растения ― семядолей. Семядоли — это первые листья зародыша растения.
Растения, имеющие в зародыше семени одну семядолю, называют однодольными. К однодольным относят пшеницу, кукурузу, лук и другие растения.
Растения,
имеющие в зародыше семени две семядоли, называют двудольные.
У фасоли запас питательных веществ находится в семядолях.
В семенах многих растений (например, пшеницы и лука) хорошо заметен и эндосперм — запасающая ткань, которая содержит питательные вещества для развития зародыша.
В зародыше пшеницы различают зародышевый корешок, стебелёк, почечку и семядолю.
После того как семя попало в почву оно начинает прорастать. Период прорастания состоит из последовательных этапов — фаз прорастания.
Важную роль в укоренении проростка играет корень.
У покрытосеменных растений различают:
1. Главный корень. Он образуется из зародышевого корешка и сохраняется на протяжении всей жизни. Всегда один.
2. Придаточные корни. Образуются в любой части растения (стебле, листьях).
3.
Боковые
корни. Ответвляются от корней (главного, дополнительных, боковых). Образуют при
ветвлении корни 1-го, 2-го, 3-го и т. д. порядка.
Образуют при
ветвлении корни 1-го, 2-го, 3-го и т. д. порядка.
Совокупность всех корней растения образует корневую систему. Корневая система формируется в течение всей жизни растения.
Различают два типа корневой системы: стержневую и мочковатую.
Стержневая корневая система характеризуется наличием хорошо выраженного главного корня, который образует стержень корневой системы с хорошо развитыми боковыми корнями.
Мочковатая корневая система, в отличие от стержневой, не имеет явно выраженного главного корня.
Корень по длине можно разделить на несколько участков, имеющих различное строение и выполняющих различные функции.
Эти участки называют зонами корня
.Стебель, как мы уже сказали, относится к вегетативным органам.
Это
осевой орган высших растений. Участки стебля, на которых развиваются листья,
называют узлами, а участки стебля между двумя ближайшими узлами одного
побега — междоузлиями.
Угол между листом и находящимся выше междоузлием носит название пазухи листа.
Стебель с листьями и почками называется побегом. Побег — это один из основных вегетативных органов высших растений.
Различают вегетативные побеги, которые выполняют функцию воздушного питания, и генеративные побеги — побеги, обеспечивающие размножение.
Некоторые побеги сильно изменились и приспособились к определённым условиям существования. Это видоизменённые побеги (корневище, луковица, клубень).
У многолетних растений побеги развиваются из почек. На вершине побега обычно имеется верхушечная почка, а в пазухах листьев ― пазушные почки.
Снаружи почки порыты плотными кожистыми почечными чешуями, защищающими их от воздействия неблагоприятных условий внешней среды.
На
продольном разрезе почки виден зачаточный стебель, на верхушке
которого находится конус нарастания, состоящий из клеток образовательной ткани.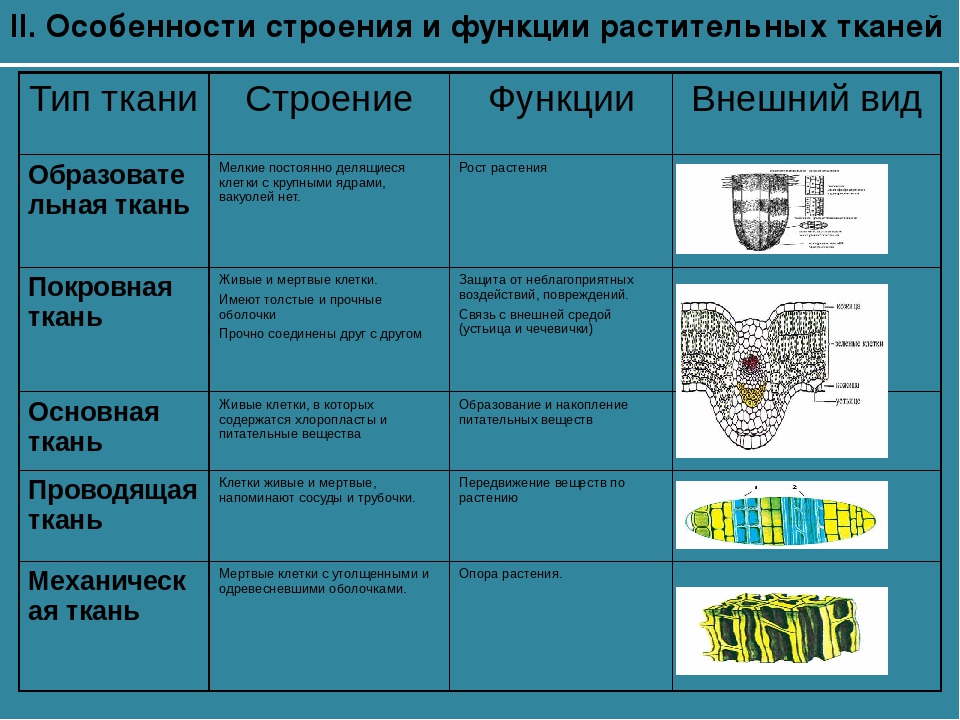 На стебле почки расположены очень мелкие зачаточные листья, такие почки
называют вегетативными или листовыми.
На стебле почки расположены очень мелкие зачаточные листья, такие почки
называют вегетативными или листовыми.
Генеративные, или цветочные, почки представляют собой зачаточные бутоны или соцветия, они крупнее вегетативных и имеют более округлую форму.
Для того чтобы из почек развились побеги, листья или цветы, необходимы питательные вещества. От стебля вода с растворенными минеральными веществами достигает листьев. Участвует в фотосинтезе. И испаряется через многочисленные поры — устьица, благодаря чему происходит охлаждение листа и защита его от перегрева.
Лист, в отличие от других органов растения, имеет форму пластинки. Это позволяет ему уловить большее количество солнечного света. Главная часть листа так и называется ― листовая пластинка.
Пластинка
переходит в стеблевидный черешок. Листовые черешки растений
способны изгибаться, поворачивая пластинку к свету. Черешок переходит в основание
— часть листа, посредством которой он присоединяется к стеблю.
Черешок переходит в основание
— часть листа, посредством которой он присоединяется к стеблю.
Листья разделяют на простые и сложные. Простые листья — это листья, которые состоят из одной листовой пластинки. Такие листья характерны для берёзы, дуба, черёмухи и других растений. Сложные листья — это листья, которые состоят из нескольких листовых пластинок, соединённых с общим черешком небольшими черешками. Такие листья характерны для ясеня, рябины и других растений.
Листовые пластинки в разных направлениях пронизаны проводящими пучками, которые называют жилками. Жилки не только проводят растворы питательных веществ, но и придают листу прочность. Различают листья с параллельным, дуговым, сетчатым и другими видами жилкования.
Органы растений. Семейства. Ткани — презентация онлайн
1. Органы растений. Семейства. Ткани.
2. Виды тканей
Образовательная (меристема)Состоит из живых клеток , способных делиться.

Из неё образуются все типы тканей.
Верхушечные (апексальные) меристемы –
располагаются на апексах стебля или корня и с
их помощью вегетативные органы растут в
длину.
Латеральные меристемы – характерны для
осевых органов. Образуются из апексальных и
дают начало всем тканям. У древесных
сохраняется в виде камбия.
Основная функция – рост растения.
4. Покровные ткани
Эпидермис – слой живых клеток,покрывающих растение. Покрыт слоем
кутикулы, который состоит из воска.
Также в эпидерме имеются устьица – группа
клеток, образующих устьичный аппарат.
Устьица регулируют обмен воды и газов.
Зависит от кутикулы: нет её – нет устьиц.
Устьица имеются в эпидерме только
высших растений.
Растут в основном на нижней стороне
листа.
Перидерма – приходит на смену эпидерме,
когда зелёный цвет сменяется на
коричневый. Состоит из феллогена, который
наружу откладывает клетки феллемы, а
внутрь феллодерму.

Кора – состоит из мёртвых клеток, служит
защитой от механических повреждений.
Основные функции покровной ткани:
1) Защита от высыхания, попадания вредных
микроорганизмов, солнечных ожогов, мех.
Повреждений.
2) Регуляция обмена веществ между
внутренней и внешней средой.
7. Паренхима
Группа тканей, которые заполняютпространство между проводящими и
механическими тканями.
Запасающая паренхима – вместилище
органических веществ, которые временно
не используются. Может быть обычный
орган (корень, побег), а также
специализированный (корневище, клубень,
луковицы).
8. Механические ткани
Волокна – имеют вытянутую форму,находятся во флоэме и ксилеме. Очень
эластичные. Придают прочность листьям.
9. Проводящие ткани
Ксилема (сосуды, древесина) – группамёртвых клеток, образующая сосуды, по
которым движутся вода и минеральные
соли. Весной по ксилеме движутся
органические вещества!!!
Флоэма (ситовидные трубки, луб) – группа
живых клеток, образующая маленькие
сосудики, по которым движутся
органические вещества от листьев к корню.

11. Органы растений. Корень
Функции:1) Опорная
2) Транспортная
3) Запасающая
Виды корней:
1) Главный – при прорастании семени
развивается зародышевый корешок, который
и превращается в главный корень
2) Придаточные – корни, образующиеся на
стебле и даже на листьях.
3) Боковые – отходят от главного и придаточных
Зоны корня:
1) Корневой чехлик – образован клетками
покровной ткани. Защищается участок,
образованный мелкими, плотно
прилегающими клетками. Выполняет
защитную функцию. Выделяет слизь,
благодаря которой происходит более лучшее
проникновение в почву.
2) Зона деления – происходит рост корня из-за
деления клеток.
3) Зона роста – происходит рост корня из-за
роста клеток
4) Зона всасывания – происходит всасывание
воды и минеральных солей корневыми
волосками
5) Зона проведения – появляется разделение на
ксилему и флоэму, где происходит транспорт
веществ
Видоизменение корней:
Корнеплод – утолщённый главный корень,
состоит из-за запасающих тканей.
 В
Восновном двулетние растения.
Воздушные корни – надземные корни,
впитывающие из воздуха воду и
минеральные соли.
Микориза – сожительство корней растений
и мицелия гриба.
15. Побег. Лист. Почки.
Побег – стебель, с расположенными на нёмлистьями с почкой.
Узел – участок между развивающимися
листьями.
Междоузлие – участок между 2мя узлами.
Пазуха листа – угол между листом и
междоузлием.
Листорасположение:
Очерёдное – когда листья чередуются по
сторонам
Супротивное – когда растут парой с двух
сторон
Мутовчатое – по 3 и более листьев из одной
точки.
На вершине побега обычно имеются
верхушечные почки, а в пазухах листьев –
пазушные почки. Почки, которые
развиваются не в пазухе – придаточные.
Если в почках только листья, то она
вегетативная.
Если в почках бутоны и соцветия, то она
генеративная.
Большинство листьев состоят из листовой
пластинки и черешка.
 Черешок соединяет
Черешок соединяетлист со стеблем. Такие листья называются
черешковыми.
Если черешков нет, то они сидячие.
Простые листья состоят из одного листа,
сложные из нескольких листочков.
Жилкование листьев
Видоизменение листьев:
1) Листовые колючки
2) Усики
3) Суккулентные листья (запасание воды).
Стебель – осевая часть побега, проводит
питательные вещества и выносит листья к
свету.
Виды:
1) Прямостоящий
2) Вьющийся
3) Лазающие
4) Ползающие
Побег — один из основных вегетативных
органов высших растений, состоящий
из стебля с расположенными на нём
листьями и почками.
Видоизменения побега:
1) Корневище — подземный побег с
чешуевидными листьями низовой формации,
почками и придаточными корнями.
2) Клубни – запасающий побег, образованный
столоном.
3) Столон – подземный побег.
4) Луковицы — подземный сильно укороченный
специализированный побег, в котором
запасные вещества откладываются в чешуях
листовой природы.

21. Цветок
– видоизменённый побег, служащий длясеменного размножения. Обычно развивается
из конца главного или бокового побега.
Стеблевая часть – цветоножка, цветоложе.
Видоизменённые листья – Чашечка, Венчик,
Тычинки, Пестики.
Простой околоцветник – все листочки
одинаковы, в основном у однодольных.
Двойной околоцветник – состоит из чашечки и
венчика. В основном у двудольных.
Если через цветок можно провести несколько
плоскостей симметрий, то он правильный,
иначе наоборот.
Формула цветка:
1) Ч – чашелистик.
2) Л – лепестки.
3) Т – тычинки.
4) П – пестик.
5) О – околоцветник.
6) * — правильный.
7) ↑ — неправильный.
8) Если элементы сросшиеся, то заключается
в()
9) Если элементы расположены кругами, то в
каждом круге ставится +
Соцветия – группа цветков, расположенных
близко друг к другу в определённом
порядке.
24. Плод
Состоит из околоплодника и семян.
Околоплодник – разросшиеся стенки завязи.
Семена – образуются из семязачатков.
Виды плодов:
1) Ягода – плод, с сочным околоплодником,
снаружи покрыт тонкой кожурой. Чаще
имеют много семян.
2) Яблоко – семена в пленчатой камере.
3) Тыквина – семена в мякоти, наружный
слой деревянистый.
4) Гесперидий (померанец) – у цитрусовых.
5) Костянка – сочный плод с мякотью, тонкой
кожицей и одревесневшим внутри слоем.
Имеется косточка.
6) Многокостянка – малина, ежевика и т.д.
7) Орех – деревянный околоплодник, семя
свободно.
8) Семянка – сухой плод, околоплодник
прилегает к нему.
9) Зерновка – сухой плод сросшийся с кожурой.
10) Боб – ну бобы.
11) Стручок – тоже как боб.
12) Коробочка – много семян.
4.4 Царство растений. Строение (ткани, клетки, органы), жизнедеятельность и размножение растительного организма
Видеоурок 1: Ткани растений
Видеоурок 2: Органы растений
Лекция: Царство растений. Строение (ткани, клетки, органы), жизнедеятельность и размножение растительного организма
Строение (ткани, клетки, органы), жизнедеятельность и размножение растительного организма
Растения – отдельное биологическое царство, состоящее из разнообразных организмов, обладающих определенными чертами:
клетки обладают толстыми клеточными стенками из целлюлозы;
имеют специфические органоиды — пластиды. Пластид три вида – хлоропласты содержат хлорофилл и осуществляют фотосинтез, хромопласты содержат красители и обеспечивают окраску плодов и цветков, в лейкопластах откладывается запасное вещество крахмал;
клетки обладают крупными вакуолями, в которых запасается клеточный сок;
ведут прикрепленный образ жизни;растут в течение всего жизненного цикла.
Ткани растений
У многоклеточных растений клетки специализированы и объединены в ткани. Растительная ткань обладает следующими отличительными особенностями:
нет межклеточного вещества, клетки плотно прилегают друг к другу;
в тканях может быть большое количество мертвых клеток, некоторые из тканей целиком представлены мертвыми клетками, например, механическая ткань (склеренхима) и пробка;
одна и та же ткань может состоять из клеток разных типов – древесина (ксилема) состоит из проводящих клеток, древесных волокон и мертвых клеток механической ткани паренхимы.

Важными видами ткани растений являются:
Образовательная ткань участвует в формировании всех тканей, а значит и самого растения. Располагаясь на верхушке корня и стебля, она обеспечивает длительный рост растения. Клетки меристемы мелкие округлой формы, имеют тонкие стенки. Цитоплазма в них густая, ядро крупное, вакуолей нет или они очень мелкие. Делятся они в разных направлениях.
Основная ткань размещает в себе другие ткани и составляет основу органов растений. Она выполняет ряд функций, от фотосинтеза до запаса питательных веществ. Клетки паренхимы округлой формы, средней и крупной величины, содержат хлоропласты. Ядро располагается у стенки, вакуоли крупные. Хорошо развито межклеточное вещество.
Механическая ткань словно каркас обеспечивает прочность органов растения, оберегая их от излома. Это жилки листа, волокна стебля, косточки. Клетки вытянутой формы, оболочка утолщена, одревесневела. Цитоплазма часто отсутствует.
Покровная ткань обеспечивает связь растения с окружающей средой и защиту. Она покрывает поверхность всех органов растения: кожицу листа, кору дерева. Клетки мелкие и средние, плотно прилегают друг к другу. Покровная ткань делится на три вида:
эпидермис (кожица), расположена на поверхности листьев и молодых зеленых побегов;
перидерма сменяет эпидермис и располагается на стеблях и корнях;
корка образуется у кустарников и деревьев.
Проводящая ткань находится в жилках листа, стебля, корня и обеспечивает передвижение воды и питательных веществ.
Растения могут иметь разную структуру тела – существуют:
талломные растения, у которых нет отдельных органов, например, некоторые мхи;
листостебельные – есть листья и стебли, но нет корней. Это — большинство мхов;
корнепобеговые – есть разделение на корневую и побеговую системы.
Органы растений
Органы растений разделяются на два типа:
вегетативные – листья, стебель, корень;
генеративные – плод, цветок, семя.

Корень – якорь растения, закрепляющий его в грунте. Он обеспечивает всасывание минеральных веществ и воды, в нем содержится запас питательных веществ, с его помощью осуществляются симбиотические связи, в нем синтезируются многие нужные вещества. Он может быть эволюционно видоизменен и представлять собой:
Существует два вида корневых систем растений – мочковатая, где главный корень незаметен среди придаточных и стержневая, где главный корень длинный и толстый, а остальные являются придаточными.
Стебель может быть заметным, а может представлять собой небольшое утолщение у розеточных форм. Это орган надземной части растения, его основной функцией является проводящая – обеспечение листьев водой и минеральными веществами, а корня – органическими. Также, он выполняет механическую функцию, поддерживает растение в вертикальном состоянии. Стебель с почками и листьями называют побегом.
Почка – это зачаток побега или цветка, прикрытый укрывными чешуйками. Многие растения имеют видоизмененные побеги:
Многие растения имеют видоизмененные побеги:
корневища;
клубни;
луковицы.
На свойстве стебля образовывать придаточные корни основывается способ черенкового размножения.
Лист является основным питающим органом растения – в нем происходит фотосинтез. Кроме того, лист регулирует испарение воды растением и газообмен. Листья тоже могут быть видоизмененными и представлять собой:
усики;
колючки;
ловчий орган.
При наступлении неблагоприятных условий растение впадает в состояние пониженного метаболизма и жертвует листьями – у древесной флоры при этом листья опадают, у трав – вянут с последующим разрушением, не отрываясь от стебля.
Цветок – это специализированный орган полового размножения, состоящий из:
чашечки, представляющей собой соединенные чашелистики и удерживающей лепестки и цветоложе;
венчика, состоящего из лепестков, обеспечивающего защиту от ветра и привлечение насекомых;
пестика – женского органа размножения;
тычинок, на которых образуется пыльца.

Если цветок содержит и тычинки, и пестик – он обоеполый. Если только пестик – женский. Цветок только с тычинками – мужской.
Размножение растений
Чтобы произошло оплодотворение, зернышко пыльцы должно оказаться на рыльце пестика. Яйцеклетка растения находится глубоко внутри пестика. После попадания на рыльце (верхнюю часть) пестика, зерно пыльцы быстро прорастает внутрь завязи, формируя тонкую полую трубочку. В этот момент в ней делится генеративное ядро, образуется два спермия. Когда трубка достигает дна завязи, один спермий сливается с яйцеклеткой, другой – с крупной центральной клеткой. Это называется двойным оплодотворением, уникальным явлением в живой природе. Результатом такого слияния становятся: семя,которое разовьется из яйцеклетки, и питательная ткань для него (эндосперм), который разовьется из триплоидной клетки, получившейся после слияния ее с другим спермием.
Цветковые могут быть двудомными – на одном растении появляются только мужские или только женские цветки или однодомными – тогда оба вида цветков развиваются на одном и том же растении.
Плод осуществляет функцию является защиты семян и обеспечение их распространения. Плоды могут быть односемянными и многосемянными, сухими и сочными. Сочные плоды имеют привлекательный и вкусный околоплодник, сухие – различные приспособления для разнесения их ветром или животными (летучки, пушинки, крючки).
Семя содержит в себе зародыш будущего нового растения и эндосперм для его питания на начальных стадиях развития. Семена состоят из одной или двух долей, на основании чего растения подразделяются на однодольные и двудольные, зародыша и плотной кожуры.
Для растений характерно и бесполое размножение:
спорами различных типов размножаются мхи и папоротники;
вегетативно размножается большинство цветковых растений, для этого используются различные его части – листья, побеги, корневища, клубни.
Низшие растения тоже способны к вегетативному размножению.
ТКАНИ РАСТЕНИЙ — это.
 .. Что такое ТКАНИ РАСТЕНИЙ?
.. Что такое ТКАНИ РАСТЕНИЙ?
- ТКАНИ РАСТЕНИЙ
- , группы или комплексы клеток, связанные общностью строения, происхождения, функций и местоположения. В соответствии с этим выделяют образовательные, покровные, основные, механические, проводящие и выделительные Т. р. Образовательные ткани, или меристемы, состоят из наиб. жизнедеятельных клеток, способных интенсивно делиться и преобразовываться в клетки пост. тканей. Меристема составляет конус нарастания, основания междоузлий побегов и периферийные слои осевых органов — камбий и феллоген. Покровные ткани — комплексы плотно сомкнутых клеток, покрывающие органы растений, служат для защиты (у листьев, стеблей), для поглощения воды и питат. р-ров из почвы (у корней). Основные ткани состоят, преим. из паренхимы и составляют основу осевых органов — сердцевину, сердцевинные лучи, в листьях — хлоренхиму (ассимиляц.
 ткань). Механические ткани составляют остов или каркас растения, предотвращая его излом или разрыв, благодаря сильно утолщённым одревесневшим клеточным стенкам. К ним относится колленхима (из живых клеток), склеренхима (из прозенхимных клеток), в т.ч. лубяные волокна и древесинные волокна (либриформ), а также склереиды (из каменистых и опорных клеток). Проводящие ткани — совокупность разнообразных клеток и их систем, по к-рым передвигаются вода и растворённые в ней минер. в-ва от корней к листьям (ксилема) и пластич. в-ва из листьев в др. органы, гл. обр. запасающие (флоэма). Выделительные ткани — разл. структурные внутрисекреторные образования, система особых вместилищ, где накапливаются дубильные в-ва, смолы, эфирные масла, а также внешнесекреторные — железистые волоски, нектарники и пр.
ткань). Механические ткани составляют остов или каркас растения, предотвращая его излом или разрыв, благодаря сильно утолщённым одревесневшим клеточным стенкам. К ним относится колленхима (из живых клеток), склеренхима (из прозенхимных клеток), в т.ч. лубяные волокна и древесинные волокна (либриформ), а также склереиды (из каменистых и опорных клеток). Проводящие ткани — совокупность разнообразных клеток и их систем, по к-рым передвигаются вода и растворённые в ней минер. в-ва от корней к листьям (ксилема) и пластич. в-ва из листьев в др. органы, гл. обр. запасающие (флоэма). Выделительные ткани — разл. структурные внутрисекреторные образования, система особых вместилищ, где накапливаются дубильные в-ва, смолы, эфирные масла, а также внешнесекреторные — железистые волоски, нектарники и пр.
Сельско-хозяйственный энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор: В. К. Месяц. 1989.
- ТКАНИ ЖИВОТНЫХ
- ТКЕМАЛИ
Смотреть что такое «ТКАНИ РАСТЕНИЙ» в других словарях:
Ткани растений — группы клеток, расположенные в теле растения известным порядком, имеющие определенное строение и служащие для различных жизненных отправлений растительного организма.
 Клетки почти всех многоклеточных растений не однородны, а собраны в Т. У низших … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Клетки почти всех многоклеточных растений не однородны, а собраны в Т. У низших … Энциклопедический словарь Ф.А. Брокгауза и И.А. ЕфронаТкани растений* — группы клеток, расположенные в теле растения известным порядком, имеющие определенное строение и служащие для различных жизненных отправлений растительного организма. Клетки почти всех многоклеточных растений не однородны, а собраны в Т. У низших … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ткани растений — ткани растений, группы или комплексы клеток, связанные общностью строения, происхождения, функций и местоположения. В соответствии с этим выделяют образовательные, покровные, основные, механические, проводящие и выделительные Т. р.… … Сельское хозяйство. Большой энциклопедический словарь
Механические ткани растений — арматура растений, стереометрическая система тканей, обеспечивающих прочность растений, т. е.
 их способность противостоять воздействию статических (например, сила тяжести) и динамических (например, порывы ветра) нагрузок. К М. т. р.… … Большая советская энциклопедия
их способность противостоять воздействию статических (например, сила тяжести) и динамических (например, порывы ветра) нагрузок. К М. т. р.… … Большая советская энциклопедияТКАНИ — (биологическое), системы клеток, сходных по происхождению, строению и функциям. В состав ткани входят также межклеточные структуры и продукты жизнедеятельности клеток. Ткани человека и животных эпителиальная, все виды соединительной, мышечная и… … Современная энциклопедия
Ткани — (биологическое), системы клеток, сходных по происхождению, строению и функциям. В состав ткани входят также межклеточные структуры и продукты жизнедеятельности клеток. Ткани человека и животных эпителиальная, все виды соединительной, мышечная и… … Иллюстрированный энциклопедический словарь
ТКАНИ — в биологии системы клеток, сходных по происхождению, строению и функциям. В состав тканей входят также тканевая жидкость и продукты жизнедеятельности клеток.
 Ткани животных эпителиальная, все виды соединительной, мышечная и нервная; ткани… … Большой Энциклопедический словарь
Ткани животных эпителиальная, все виды соединительной, мышечная и нервная; ткани… … Большой Энциклопедический словарьТкани — (биологические) системы клеток, сходных по происхождению, строению и функциям. В состав Т. входят также межклеточные вещества и структуры продукты клеточной жизнедеятельности. Т. животных. Выделяют 4 типа Т., соответствующие… … Большая советская энциклопедия
ткани — (биол.), системы клеток, сходных по происхождению, строению и функциям. В состав тканей входят также тканевая жидкость и продукты жизнедеятельности клеток. Ткани животных эпителиальная, все виды соединительной, мышечная и нервная; ткани… … Энциклопедический словарь
ткани — системы клеток, сходные по строению, происхождению и функциям, различаются по размерам, форме и расположению. В состав ткани входят тканевая жидкость (заполняет межклеточные пространства) и находящиеся между клетками вещества, напр.
 соли кальция… … Биологический энциклопедический словарь
соли кальция… … Биологический энциклопедический словарь
Занятие 2. Ботаника. Ткани растений. | ЕГЭ химия и биология, психология
В данной статье рассмотрим ткани растений. Что же необходимо знать по данной теме? Как показывает практика многие выпускники делают ошибки в этой теме.Обобщим:1) Названия тканей, строение клеток, выполняемые функции, их расположение в органах растения.
2) Необходимо уметь доказывать принадлежность отдельных тканей в простым и сложным тканям.
3) А также уметь находить эти ткани на рисунках.
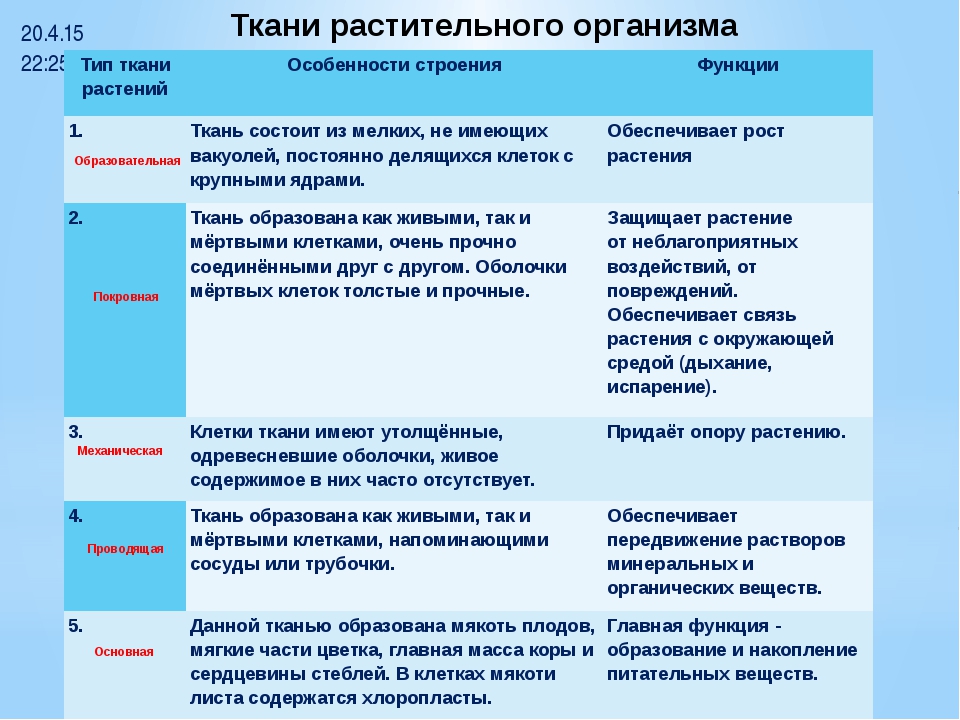
Различают пять основных групп растительных тканей:
1. Образовательная (меристема)
2. Основная (паренхима, мезофилл)
3. Покровная
4. Проводящая (ксилема и флоэма)
5. Механическая
Выделительная ткань пока не встречалась.
ПРОСТЫЕ ТКАНИ.
1.Образовательная ткань (меристема)
Особенности клеток: клетки с тонкими стенками, крупными ядрами, постоянно делятся. Образовательная ткань формирует все остальные виды тканей.
Функции: обеспечение роста побега и корней в длину и утолщение стебля.
Расположение: в конусе нарастания верхушечной почки, в зоне деления корней, в слое камбия, у основания междоузлий стебля злаковых растений.
2.Основные ткани (паренхима):
ассимиляционная (хлоренхима)-содержит хлоропласты и обеспечивает фотосинтез
запасающая- содержит лейкопласты и обеспечивает запасание веществ
воздухоносная (аэренхима)- имеет межклетники, заполненные воздухом, участвует в газообмене развита у водных растений
водоносная имеет крупные вакуоли и запасает воду (развита у растений засушливых мест-суккулентов)
Расположение: в зеленых частях растения, в семенах, плодах, корнях, корневищах, луковицах, корнеплодах, сердцевине стебля.
3. Механические ткани: волокна (склеренхима),каменистые клетки, колленхима (склереиды).
Особенности клеток: волокна – это мертвые удлиненные клетки с очень толстыми оболочками, пропитанными твердым веществом.
Каменистые клетки (склереиды) пока в ЕГЭ не встречались. Они придают прочность косточкам плодов, оболочкам орехов, обеспечивают сопротивление давлению в мякоти плода.
Среди механических тканей есть живые клетки – колленхима (пока в ЕГЭ не встречались). Они имеются в черешках листьев, в молодых стеблях. Клетки живые, имеют утолщенные клеточные стенки.
Склеренхима (это и есть волокна) – мертвые удлиненные клетки с толстыми стенками, которые чаще упоминаются в заданиях ЕГЭ. Функции: придают прочность органам, опорная функция.
Расположение: в составе луба (лубяные волокна) и древесины(древесные волокна), в составе сосудисто-волокнистых пучков по всему растению.
СЛОЖНЫЕ ТКАНИ
1. Покровные ткани: кожица (эпидермис): различные выросты эпидермиса (прозрачные и железистые волоски), пробка, корка, корневые волоски корня.
Особенности клеток — клетки плотно прилегают друг к другу.
Функции: защита от высыхания, повреждения и проникновения микробов, газообмен и испарение (транспирация через устьица). Прозрачные волоски препятствуют перегреву листовой пластинки, отражают солнечные лучи, железистые волоски могут выполнять защитную функцию. Корневые волоски обеспечивают всасывание минеральных веществ.
Расположение: на поверхности всех органов растения.
2. Проводящие ткани — сосуды, ситовидные трубки, ситовидные клетки и трахеиды (последние в основном у голосеменных и папоротникообразных).
Особенности клеток — клетки в виде трубок (мертвые — у сосудов, живые у ситовидных трубок с отверстиями в ситовидной пластинке).
Функции: сосуды (ксилема) – проводят неорганические вещества (воду и соли) от корней к листьям (восходящий ток). Сосуды расположены в древесине стебля, в зоне проведения корня, в составе жилок листа.
Ситовидные трубки (флоэма) — проводят органические вещества от листьев к органам (нисходящий ток). Хотя они живые, но в них отсутствует ядро. Рядом с ними располагаются клетки-спутницы, которые помогают передвижению тока органических веществ
Хотя они живые, но в них отсутствует ядро. Рядом с ними располагаются клетки-спутницы, которые помогают передвижению тока органических веществ
Ситовидные клетки имеют споровые растения и голосеменные. Эти клетки имеют ядро, но не имеют клеток-спутниц.
Расположение: сосуды (ксилема) – в древесине; ситовидные трубки (флоэма) – в лубе коры, но элементы ксилемы и флоэмы имеются по всему растению в составе сосудисто-волокнистых пучков.
Задания:
Задание 8.
Задание 9.
Задание 10.
Первые 9 заданий тестовая часть. Задание 10 линии №25. Нужно дать развернутый ответ, состоящий не менее, чем из 3х аргументов.
Ответы на задания будут 12.01. в 21.00 по Москве.
С условиями участия в марафоне можно ознакомиться здесь.
А также, первые две части марафона:
1) Переходные формы растений.
2) Переходные формы животных, часть 1.
3) Переходные формы животных, часть 2.
Удачи и успехов в подготовке!
Ткани растений — Биология. 6 класс. Костиков
Биология. 6 класс. Костиков
Вы узнаете об объединении клеток растений в ткани и об основных группах тканей.
Все ли растения имеют одинаковое строение? Какие функции могут выполнять клетки растений? Как клетки взаимодействуют между собой?
В предыдущих параграфах мы выяснили, что живые организмы состоят из клеток. Клетки многоклеточных организмов могут отличаться по форме, размерам, строению, функциям, но не существуют сами по себе, а объединяются в отдельные группы, образуя определённую ткань. Ткань растения — это совокупность клеток, выполняющих общую функцию или функции.
Объединение клеток в ткани происходит благодаря межклеточному веществу, склеивающему их, и заполняющему промежутки между оболочками соседних клеток.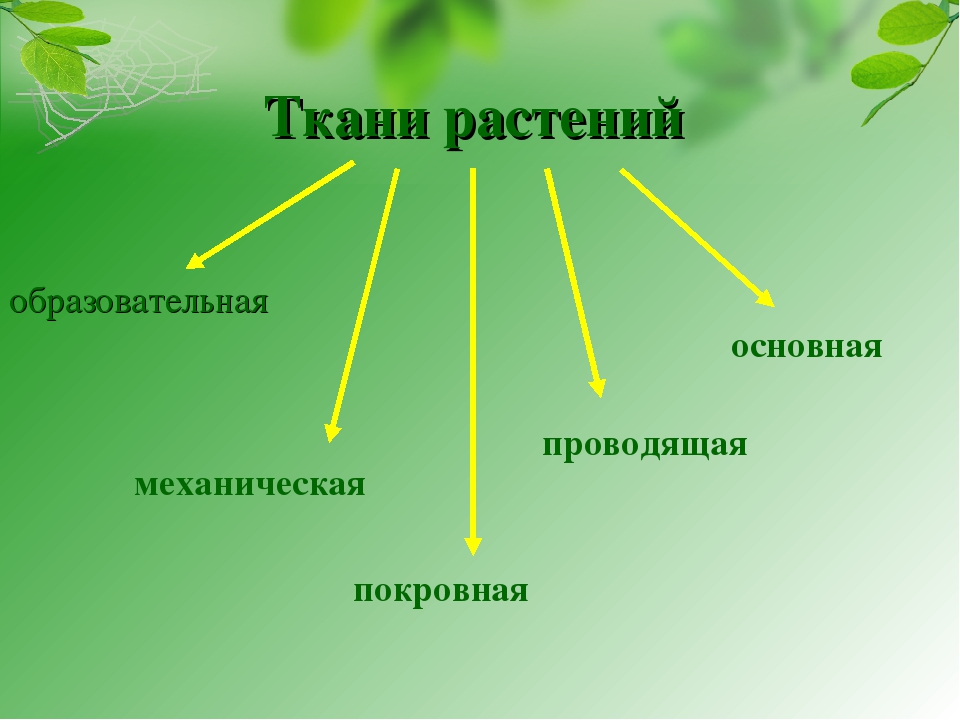 В месте контакта углов нескольких клеток расстояние между их оболочками самое большое. Поэтому остаются межклеточные пространства, заполненные воздухом, — система проветривания тела растения (рис. 61).
В месте контакта углов нескольких клеток расстояние между их оболочками самое большое. Поэтому остаются межклеточные пространства, заполненные воздухом, — система проветривания тела растения (рис. 61).
Рис. 61. Схема строения клетки растений в составе ткани
Некоторые растворённые в воде вещества могут двигаться от цитоплазмы одной клетки к цитоплазме другой через клеточные оболочки и межклеточное вещество (рис. 62). Участки клеточных оболочек, через которые проходит особенно много тяжей цитоплазмы, которые соединяют соседние клетки между собой, называются порами. Они хорошо видны под оптическим микроскопом. Итак, поры растений — не отверстия.
Рис. 62. Способы движения веществ от клетки к клетке
Классификация тканей. Ткани бывают образовательные и постоянные (рис. 63). Клетки образовательных тканей способны делиться. Поэтому образовательные ткани на протяжении всей жизни растения образуют новые ткани и органы. Этим обеспечивается рост и развитие растения.
Этим обеспечивается рост и развитие растения.
Рис. 63. Основные типы тканей растений
Основными группами образовательных тканей являются верхушечные и боковые (рис. 64). Верхушечные образовательные ткани расположены на верхушках корней и побегов. Благодаря им происходит рост растения в длину и образование новых частей корня и побега. Боковые образовательные ткани не образуют новых частей тела растения, но обеспечивают рост в толщину уже существующих корней и стеблей — так называемое утолщение.
Рис. 64. Расположение образовательных тканей в теле растения
Постоянные ткани возникают из клеток образовательных тканей. Когда клетка специализируется, она теряет способность делиться и превращается в клетку одной из постоянных тканей. Эти ткани обеспечивают все процессы жизнедеятельности растения, кроме роста.
Постоянные ткани различаются своими функциями. Для надземных растений особенно важны покровные ткани, регулирующие обмен веществ с внешней средой, а также проводящие ткани, осуществляющие транспортировку веществ между надземными и подземными органами растения. Между покровными и проводящими размещены разнообразные основные ткани, в частности фотосинтезирующие, запасающие и механические.
Между покровными и проводящими размещены разнообразные основные ткани, в частности фотосинтезирующие, запасающие и механические.
ВЫВОДЫ
- 1. Многоклеточное растение — это не только механическое объединение клеток, а система, работающая как единое целое благодаря обмену веществ между цитоплазмами разных клеток.
- 2. Клетки растений соединяются между собой и образуют разнообразные ткани, выполняющие определённые функции.
- 3. Образовательные ткани обеспечивают образование новых частей тела растения, а постоянные ткани — жизнедеятельность растительного организма.
- 4. Постоянные ткани в соответствии с особенностями их строения, размещения и функций делятся на покровные, проводящие и основные.
ТЕРМИНЫ И ПОНЯТИЯ, КОТОРЫЕ ВАЖНО ЗНАТЬ
Ткань растения, пора, образовательная ткань, постоянная ткань, покровная ткань, проводящая ткань, основная ткань.
КОНТРОЛЬНЫЕ ВОПРОСЫ
- 1.
 Что такое ткань?
Что такое ткань? - 2. Чем отличаются образовательные и постоянные ткани?
- 3. Каковы основные типы образовательных тканей и их функции?
ЗАДАНИЯ
Охарактеризуйте основные функции каждого типа постоянных тканей.
ГДЗ к учебнику можно найти тут. Ткани — Ткани и органы высших растений — Растения — СИСТЕМА, МНОГООБРАЗИЕ И ЭВОЛЮЦИЯ ЖИВОЙ ПРИРОДЫ
К высшим растениям относятся моховидные, плауновидные, хвощевидные, папоротниковидные, голосеменные и покрытосеменные (цветковые). В процессе эволюции в качестве приспособления к жизни в наземно-воздушной среде у растений произошла дифференциация клеток на ткани и формирование органов.
5.2.1. Ткани
Ткань — совокупность клеток, сходных по строению, происхождению и выполняющих одинаковые функции. У растений различают следующие ткани: образовательные, покровные, основные, механические, проводящие, выделительные. Ткани растений делят на временные (образовательные) и постоянные (все остальные ткани).
Образовательные ткани — единственный вид растительной ткани, клетки которой способны делиться. Из образовательной ткани в результате дифференциации образуются все остальные ткани. Покровные ткани располагаются на границе с внешней средой и защищают растение от неблагоприятных воздействий (механических повреждений, низких температур, чрезмерного испарения воды, проникновения микроорганизмов и др.). Покровные ткани образованы из плотно прилегающих друг к другу живых или, реже, мёртвых клеток. Проводящие ткани обеспечивают транспорт веществ в теле растений. Различают сосуды древесины (обеспечивает восходящий ток воды и минеральных солей от корней в стебель и листья) и ситовидные трубки луба (обеспечивает нисходящий ток продуктов фотосинтеза к местам их использования или отложения в запас — к корням, плодам, семенам и другим органам). Механические ткани обеспечивают прочность органов растения за счёт наличия утолщённых клеточных стенок. В стебле механические ткани входят в состав древесины и луба. Основные ткани (паренхимы) состоят из живых тонкостенных клеток. Они составляют большую часть всех органов растений и заполняют пространство между другими тканями. В зависимости от функций выделяют ассимиляционную паренхиму (содержит хлоропласты и осуществляет фотосинтез), запасающую (накапливает углеводы, белки, жиры), воздухоносную (накапливает воздух у водных растений) и водоносную (запасает воду у растений засушливых мест обитания). Выделительные (секреторные) ткани представлены различными образованиями, выделяющими из растения или изолирующими в его тканях продукты обмена веществ (нектарники, смоляные ходы и др.).
Основные ткани (паренхимы) состоят из живых тонкостенных клеток. Они составляют большую часть всех органов растений и заполняют пространство между другими тканями. В зависимости от функций выделяют ассимиляционную паренхиму (содержит хлоропласты и осуществляет фотосинтез), запасающую (накапливает углеводы, белки, жиры), воздухоносную (накапливает воздух у водных растений) и водоносную (запасает воду у растений засушливых мест обитания). Выделительные (секреторные) ткани представлены различными образованиями, выделяющими из растения или изолирующими в его тканях продукты обмена веществ (нектарники, смоляные ходы и др.).
Руководство по изучению тканей и органов растений
Паренхиматоз: Тип растительной клетки, которая выполняет фотосинтез, клеточное дыхание и / или функции хранения.
Колленхиматоз: Тип растительной клетки, которая поддерживает растение.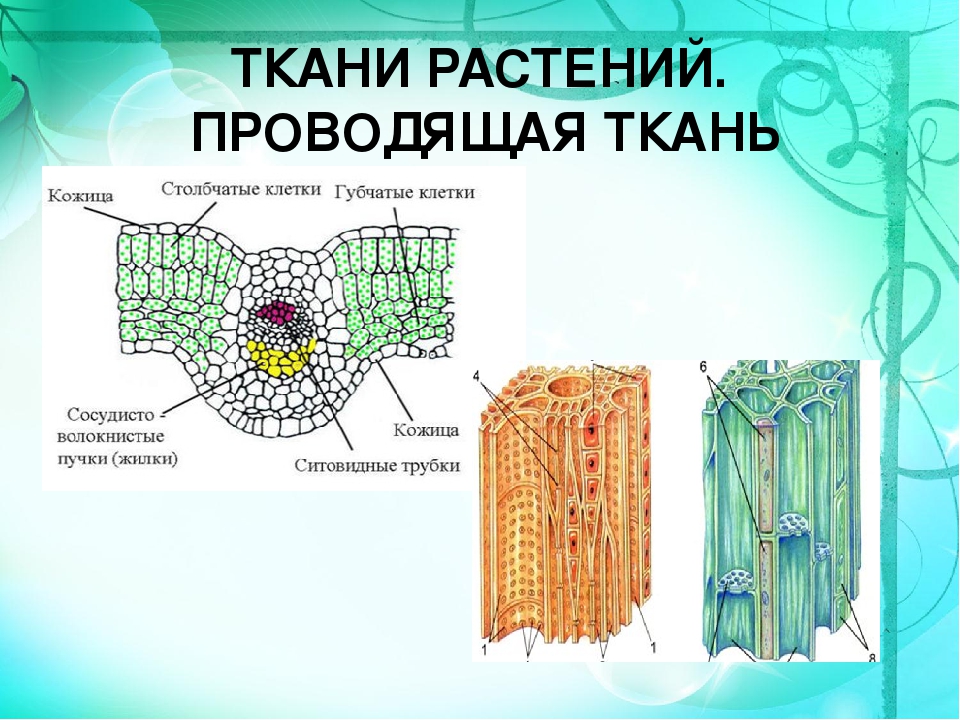
Склеренхиматоз: Тип растительной клетки, которая укрепляет и поддерживает растения.
Xylem: Тип сосудистой ткани растения, которая транспортирует воду и растворенные питательные вещества от корней к стеблям и листьям.
Флоэма: Тип сосудистой ткани растения, которая транспортирует пищу от фотосинтетических клеток к другим частям растения.
Meristem: Тип тканей растений, состоящих из недифференцированных клеток, которые могут продолжать делиться и дифференцироваться, и из которых растения растут в длину или ширину.
Первичный прирост: Рост растений в длину.
Вторичный прирост: Рост растений в ширину.
Главный корень: Одиночный толстый первичный корень корень, характеризующий корневую систему некоторых растений.
Волокнистый корень: Нитевидный корень, составляющий часть волокнистой корневой системы некоторых растений.
Корневая система: Все корни растения, включая первичные и вторичные корни.
Корневой волос: Крошечная волоскообразная структура, отходящая от корня растения.
Кора: Ткань, обеспечивающая грубое древесное внешнее покрытие стволов деревьев.
Устьица (единичное число, стома): Крошечная пора в эпидермисе листа растения, контролирующая транспирацию и газообмен с воздухом.
Мезофилл: Специализированная ткань внутри листьев растений, где происходит фотосинтез.
Кутикула: Воскообразное водонепроницаемое вещество, вырабатываемое клетками на поверхности листьев, побегов и других надземных частей растений.
Лиственное растение: Тип растения, которое сезонно теряет листья.
Вечнозеленое растение: Тип растения, которое сохраняет свои листья и остается зеленым круглый год.
Дифференциальный рост и формирование формы органов растений
Трехмерные формы длинных листьев растений и лепестков цветов.
Повышенный уровень фактора роста в краевой области листьев растений или лепестков цветов часто приводит к чрезмерной локальной скорости роста и несоответствию штамма роста.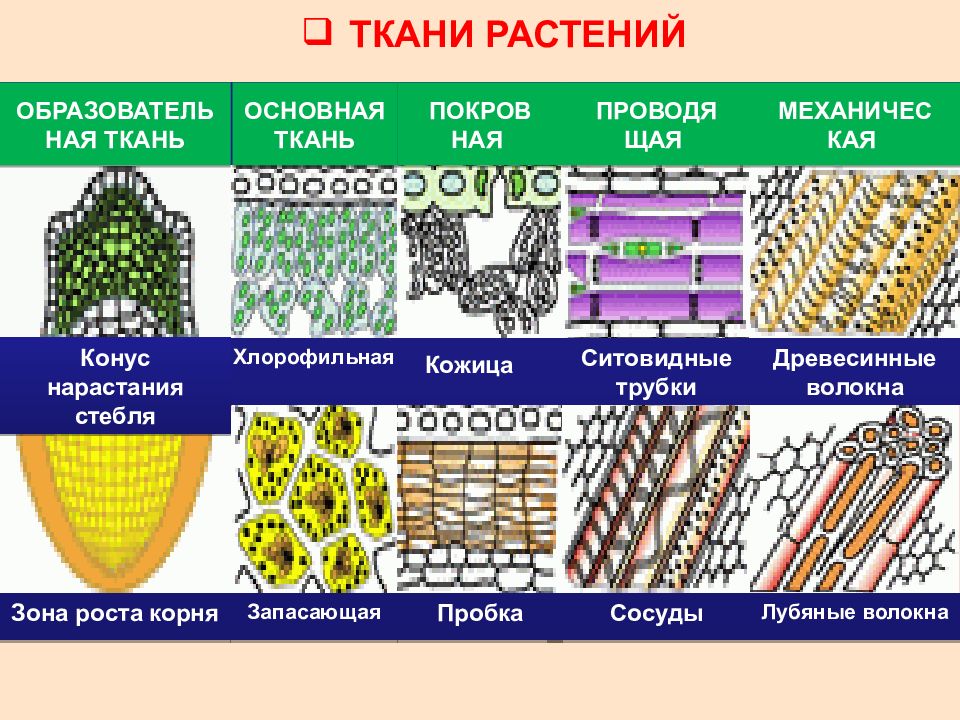 Накопленные остаточные напряжения в конечном итоге способствуют нестабильности деформации вне плоскости, что приводит к большому разнообразию трехмерных форм в природе. Рис. 1 A показывает изображения четырех типичных трехмерных форм длинных лепестков орхидей, из которых мы идентифицируем соответствующие четыре основные конфигурации. Конфигурация I показывает рост длинных лепестков спирали дендробия , центры которых остаются примерно прямыми от основания до дистального конца. Напротив, лепестки prosthechea cochleata демонстрируют морфологию спирального закручивания (конфигурация II), где центры лепестков следуют спиральному узору.Лепестки brassavola nodosa изгибаются в форме седла (конфигурация III), две основные кривизны которой имеют противоположные знаки. Длинные лепестки phragmipedium brasiliense имеют волнистые узоры по краям лепестков (конфигурация IV). Более сложные морфологии лепестков, возникающие в результате комбинации этих конфигураций, также присутствуют в природе ( SI Приложение , Рис.
Накопленные остаточные напряжения в конечном итоге способствуют нестабильности деформации вне плоскости, что приводит к большому разнообразию трехмерных форм в природе. Рис. 1 A показывает изображения четырех типичных трехмерных форм длинных лепестков орхидей, из которых мы идентифицируем соответствующие четыре основные конфигурации. Конфигурация I показывает рост длинных лепестков спирали дендробия , центры которых остаются примерно прямыми от основания до дистального конца. Напротив, лепестки prosthechea cochleata демонстрируют морфологию спирального закручивания (конфигурация II), где центры лепестков следуют спиральному узору.Лепестки brassavola nodosa изгибаются в форме седла (конфигурация III), две основные кривизны которой имеют противоположные знаки. Длинные лепестки phragmipedium brasiliense имеют волнистые узоры по краям лепестков (конфигурация IV). Более сложные морфологии лепестков, возникающие в результате комбинации этих конфигураций, также присутствуют в природе ( SI Приложение , Рис. S1).
S1).
Центральный вопрос этого исследования: как дифференцированный рост этих листьев влияет на их морфогенез? Мы собрали живые листья нескольких видов (из консерватории и ботанического сада Фиппса в Питтсбурге, штат Пенсильвания).Чтобы количественно оценить профиль растущей деформации листа, мы разрезали их на отдельные узкие полосы, параллельные стеблю, и измерили длину каждой полосы, как показано на рис. 1 B и C . Мы заметили, что рассечение половины листа приводит к изменению формы другой половины, что свидетельствует о существовании остаточных напряжений в его естественном состоянии. Мы определяем деформацию роста как εg = (l − l0) / l0, где l0 и l — длины центрального стержня и полосы на расстоянии y от стержня соответственно.Как показано на рис. 2 A , профили деформации роста в направлении ширины могут быть аппроксимированы степенной функцией asεg (y) = β (yW) n, [1] где y и W — расстояние от полосы до центра и полуширина полотна соответственно. Деформация роста монотонно увеличивается от нуля в центре до максимального значения β на краю, когда y = W . Показатель степени, n , характеризует крутизну профиля дифференциальной деформации роста.На рис.2 B показано, что листья с конфигурацией скручивания имеют параболический профиль деформации роста ( n ∼ 2), а листья с конфигурацией с волнистыми краями имеют более резкое увеличение деформации роста вблизи краевой области, что приводит к высшее значение n . По сравнению с листьями с конфигурацией скручивания или завивки краями, листья с конфигурацией изгиба седла имеют гораздо меньший максимальный уровень деформации роста ( β <0,1).
Деформация роста монотонно увеличивается от нуля в центре до максимального значения β на краю, когда y = W . Показатель степени, n , характеризует крутизну профиля дифференциальной деформации роста.На рис.2 B показано, что листья с конфигурацией скручивания имеют параболический профиль деформации роста ( n ∼ 2), а листья с конфигурацией с волнистыми краями имеют более резкое увеличение деформации роста вблизи краевой области, что приводит к высшее значение n . По сравнению с листьями с конфигурацией скручивания или завивки краями, листья с конфигурацией изгиба седла имеют гораздо меньший максимальный уровень деформации роста ( β <0,1).
Количественная экспериментальная характеристика профиля ростовых штаммов живых листьев растений.( A ) Типичные профили деформации роста листьев с конфигурациями скручивания и завивки краев, нормализованные по максимальной деформации роста. ( B ) График значений n- и β скручивания, завивки кромок и изгиба в седло. Листья с волнистыми краями взяты у двух разных видов: папоротникового дерева ( filicium decipiens ; волнистая кромка: B, s1 ) и кротона «interruptum» ( c. Variegatum ; волнистая кромка: B, s2 ). ).
Листья с волнистыми краями взяты у двух разных видов: папоротникового дерева ( filicium decipiens ; волнистая кромка: B, s1 ) и кротона «interruptum» ( c. Variegatum ; волнистая кромка: B, s2 ). ).
Механическое моделирование растущего листа.
Чтобы исследовать влияние растущей деформации на морфогенез, мы провели моделирование методом конечных элементов (МКЭ) длинного прямоугольного листа с неоднородной деформацией роста по его ширине (рис. 3 A ). Деформация роста увеличивается от нуля в центре до максимального значения на краю. Как показано на рис. 3 B , увеличение значения n увеличивает крутизну профиля деформации около края листа и снижает крутизну профиля деформации во внутренней области.В настоящем моделировании МКЭ мы моделировали процесс роста как эквивалентную задачу теплового расширения. Мы позволяем листу расти только в направлении оси x , задав равномерный ненулевой коэффициент теплового расширения, но неоднородное температурное поле, в то время как расширение в других направлениях предотвращается за счет исчезнувшего коэффициента теплового расширения. Температурное поле в ненапряженном состоянии приводит к полю деформации, которое совпадает с распределением деформации роста в уравнении. 1 .
Температурное поле в ненапряженном состоянии приводит к полю деформации, которое совпадает с распределением деформации роста в уравнении. 1 .
МКЭ растущего листа. ( A ) Типичное распределение деформации роста, нормализованное максимальной деформацией роста на краю длинного листа (деформация увеличивается от центра к краю, но остается однородной по длине). ( B ) Профили дифференциальной ростовой деформации с различными значениями n , нормализованные по максимальной ростовой деформации. ( C ) Возникновение закручивающей и спирально-закручивающей конфигураций при n = 2.Построены изолинии гидростатического напряжения при различных уровнях максимальной деформации. ( D ) Нормализованный угол закручивания на единицу длины как функция максимальной деформации при n = 2. Теоретический прогноз основан на формуле. 4 , а результаты моделирования взяты из МКЭ. ( E ) Появление конфигураций изгиба седла и изгиба кромок при n = 10. Построены цветные контуры гидростатического напряжения при различных уровнях максимальной деформации. ( F ) Длина волны краевых волн и максимальный уровень гидростатического напряжения как функция максимальной деформации при n = 10.
Построены цветные контуры гидростатического напряжения при различных уровнях максимальной деформации. ( F ) Длина волны краевых волн и максимальный уровень гидростатического напряжения как функция максимальной деформации при n = 10.
Во всех симуляциях деформация начинается плоской при небольшой деформации роста, а затем возникает нестабильность на критическом уровне. Подобно многим тонкопленочным системам при ограничениях, результирующая изогнутая конфигурация определяется полями локальных деформаций (24⇓ – 26). Здесь двумя критическими параметрами, контролирующими формы изогнутых конфигураций, являются β и n , которые для тонких органов растений зависят от вида и возраста. Следовательно, они могут варьироваться в большом диапазоне (рис.2 B ). Хотя растительные клетки демонстрируют вязкоупругие свойства в тестах на растяжение (27), мы смоделировали растущий лепесток как эластичный материал по следующим причинам. Во-первых, механический ответ растительных клеток фиксируется стандартной линейной моделью твердого материала (т. Е. Двумя элементами Максвелла, параллельными упругой пружине) с характерным временем релаксации порядка секунд (28). Однако полный процесс морфогенеза растущего листа занимает несколько дней.Поскольку морфогенез в первую очередь обусловлен пролиферацией и ростом клеток, деформация роста доминирует над общей деформацией растущего лепестка. Значения модуля Юнга и коэффициента Пуассона были установлены на уровне E = 350 МПа и ν = 0,25 соответственно (27). Мы рассмотрели полный диапазон экспоненты n и максимальной деформации β . На рис. 3 показаны результаты для n = 2 и n = 10.
Е. Двумя элементами Максвелла, параллельными упругой пружине) с характерным временем релаксации порядка секунд (28). Однако полный процесс морфогенеза растущего листа занимает несколько дней.Поскольку морфогенез в первую очередь обусловлен пролиферацией и ростом клеток, деформация роста доминирует над общей деформацией растущего лепестка. Значения модуля Юнга и коэффициента Пуассона были установлены на уровне E = 350 МПа и ν = 0,25 соответственно (27). Мы рассмотрели полный диапазон экспоненты n и максимальной деформации β . На рис. 3 показаны результаты для n = 2 и n = 10.
Для параболического распределения деформации роста с n = 2 первая нестабильность последовательно приводит к скручиванию (Конфигурация I) при промежуточной максимальной деформации роста. уровень ( β ∼ 0.15), представляющий начало начальной нестабильности от плоского к трехмерному режиму (рис. 3 C ). SI Приложение , рис. S2 A показывает общую энергию деформации, накопленную в листе, как функцию максимальной деформации. Как и ожидалось, когда деформация низкая, увеличение общей энергии деформации масштабируется с квадратом деформации, с наклоном м = 2,0 на графике логарифмический. Возникновение нестабильности четко фиксируется внезапным изменением наклона от квадратичной до почти линейной зависимости м = 1.0 (теоретические сведения см. В SI, приложение ). Как показано на рис. 3 C и SI, приложение , рис. S3, скрученная конфигурация при низком уровне деформации роста практически свободна от напряжений. Исключительно из геометрических соображений отметим, что изменение формы листа от плоской без напряжений к конфигурации скручивания без напряжений требует профиля деформации роста, задаваемого формулой εg (y) = 1 + (αy) 2−1, [2] где α — угол закручивания на единицу длины по штоку. Разложение Тейлора уравнения. 2 дает εg (y) = 12 (αy) 2−18 (αy) 4 + 116 (αy) 6 + ⋯ ≈12α2W2 (yW) 2, [3] когда член четвертого порядка на порядок меньше, чем член второго порядка, максимальная деформация на кромке β = (1/2) α2W2≤0.
S2 A показывает общую энергию деформации, накопленную в листе, как функцию максимальной деформации. Как и ожидалось, когда деформация низкая, увеличение общей энергии деформации масштабируется с квадратом деформации, с наклоном м = 2,0 на графике логарифмический. Возникновение нестабильности четко фиксируется внезапным изменением наклона от квадратичной до почти линейной зависимости м = 1.0 (теоретические сведения см. В SI, приложение ). Как показано на рис. 3 C и SI, приложение , рис. S3, скрученная конфигурация при низком уровне деформации роста практически свободна от напряжений. Исключительно из геометрических соображений отметим, что изменение формы листа от плоской без напряжений к конфигурации скручивания без напряжений требует профиля деформации роста, задаваемого формулой εg (y) = 1 + (αy) 2−1, [2] где α — угол закручивания на единицу длины по штоку. Разложение Тейлора уравнения. 2 дает εg (y) = 12 (αy) 2−18 (αy) 4 + 116 (αy) 6 + ⋯ ≈12α2W2 (yW) 2, [3] когда член четвертого порядка на порядок меньше, чем член второго порядка, максимальная деформация на кромке β = (1/2) α2W2≤0. 2. Ур. 3 указывает на то, что при низком уровне максимальной деформации (β≤0,2) формирование конфигурации скручивания является энергетически выгодным для n = 2. Угол скручивания на единицу длины как функция максимальной деформации роста рассчитывается из Уравнение 2 asα = 2β + β2W. [4] Рис. 3 D показывает, что α монотонно увеличивается с увеличением деформации. Результаты моделирования методом МКЭ хорошо согласуются с теоретическим предсказанием. При фиксированной максимальной деформации роста более широкие листья или лепестки скручиваются меньше, чем более узкие.
2. Ур. 3 указывает на то, что при низком уровне максимальной деформации (β≤0,2) формирование конфигурации скручивания является энергетически выгодным для n = 2. Угол скручивания на единицу длины как функция максимальной деформации роста рассчитывается из Уравнение 2 asα = 2β + β2W. [4] Рис. 3 D показывает, что α монотонно увеличивается с увеличением деформации. Результаты моделирования методом МКЭ хорошо согласуются с теоретическим предсказанием. При фиксированной максимальной деформации роста более широкие листья или лепестки скручиваются меньше, чем более узкие.
Интересно, что при низком уровне максимальной деформации роста ( β ∼ 0,05) и скручивающая, и седловидно-изгибная конфигурации возникают как два локальных состояния минимума энергии. Тщательный энергетический анализ показывает, что энергия деформации конфигурации седловидного изгиба относительно ниже, чем у конфигурации скручивания, но относительная разница в энергии между этими двумя конфигурациями составляет менее 10% ( SI Приложение , рис.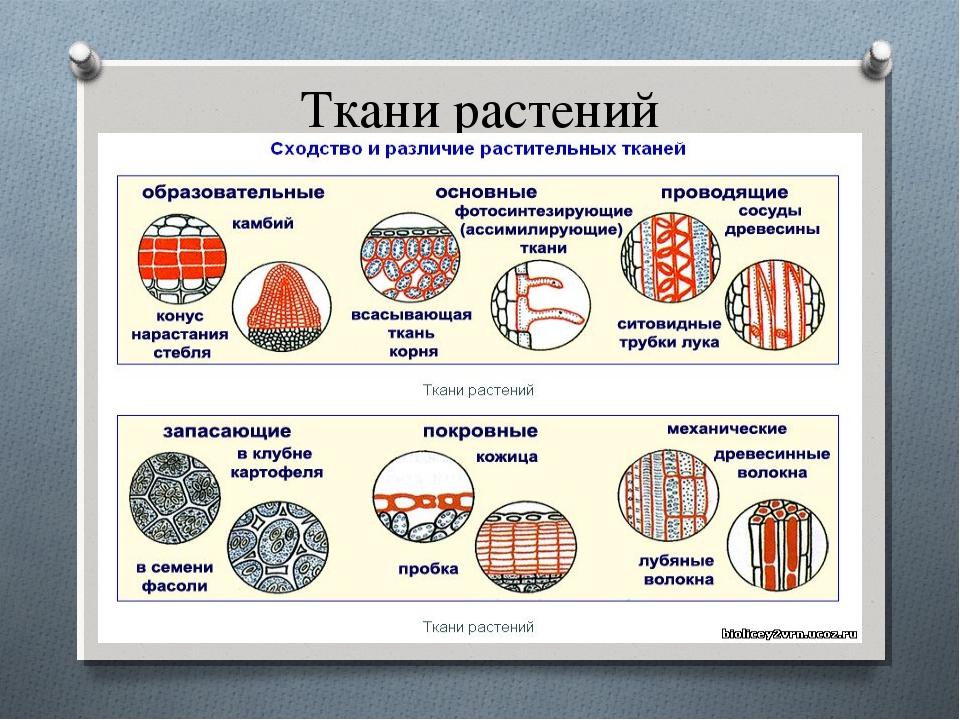 S4). На рис.3 C показано, что по мере увеличения штамма роста ( β > 0.15), остаточные напряжения из-за растяжения в плоскости постепенно нарастают как члены более высокого порядка в уравнении. 3 стали более важными. Таким образом, сохранение конфигурации скручивания становится энергетически более невыгодным. В соответствии с теорией, наше моделирование показывает переход от скручивания к спиральному скручиванию (конфигурации II), когда максимальная деформация роста приближается к критическому уровню около β = 0,2. Этот переход происходит при отклонении центральной оси от прямой и неравномерном распределении эффективного напряжения фон Мизеса ( SI Приложение , рис.S3). Внезапное высвобождение (падение) полной энергии деформации наблюдается в результате перехода режима, как ясно показано в приложении SI , рис. S2 B .
S4). На рис.3 C показано, что по мере увеличения штамма роста ( β > 0.15), остаточные напряжения из-за растяжения в плоскости постепенно нарастают как члены более высокого порядка в уравнении. 3 стали более важными. Таким образом, сохранение конфигурации скручивания становится энергетически более невыгодным. В соответствии с теорией, наше моделирование показывает переход от скручивания к спиральному скручиванию (конфигурации II), когда максимальная деформация роста приближается к критическому уровню около β = 0,2. Этот переход происходит при отклонении центральной оси от прямой и неравномерном распределении эффективного напряжения фон Мизеса ( SI Приложение , рис.S3). Внезапное высвобождение (падение) полной энергии деформации наблюдается в результате перехода режима, как ясно показано в приложении SI , рис. S2 B .
Для более резкого изменения деформации роста, n = 10 (рис. 3 B ), седло-изгибные конфигурации становятся энергетически более выгодными, чем скручивание, как показано на рис. 3 E . Это в основном связано с тем, что дифференциальный рост преимущественно концентрируется в краевой области листа при более высоких значениях n .Следовательно, скручивание вызывает значительные напряжения в плоскости и высокую энергию деформации во внутренней области. При низком уровне роста лист приобретает седловидную форму (конфигурация III). Дальнейшее увеличение деформации роста приводит к появлению волнистого волнистого рисунка. В конце концов, конкуренция между изгибом в краевой области и растяжением внутри приводит к волнообразным краям (Конфигурация IV). Наше моделирование (рис. 3 F ) показывает, что длина волны краевых волн уменьшается с увеличением максимального уровня деформации и следует степенному соотношению λ∼β − 0.2. Изолинии напряжений на рис. 3 E показывают, что самые высокие уровни гидростатического напряжения возникают на пиках и впадинах краевых волн, и что гидростатическое давление увеличивается с увеличением максимальной растущей деформации.
3 E . Это в основном связано с тем, что дифференциальный рост преимущественно концентрируется в краевой области листа при более высоких значениях n .Следовательно, скручивание вызывает значительные напряжения в плоскости и высокую энергию деформации во внутренней области. При низком уровне роста лист приобретает седловидную форму (конфигурация III). Дальнейшее увеличение деформации роста приводит к появлению волнистого волнистого рисунка. В конце концов, конкуренция между изгибом в краевой области и растяжением внутри приводит к волнообразным краям (Конфигурация IV). Наше моделирование (рис. 3 F ) показывает, что длина волны краевых волн уменьшается с увеличением максимального уровня деформации и следует степенному соотношению λ∼β − 0.2. Изолинии напряжений на рис. 3 E показывают, что самые высокие уровни гидростатического напряжения возникают на пиках и впадинах краевых волн, и что гидростатическое давление увеличивается с увеличением максимальной растущей деформации. Учитывая, что гидростатическое давление может изменять нормальный транспорт питательных веществ и факторов роста и / или ремоделирование клеточной стенки, необходимое для роста (29–31), ожидается, что повышение уровня давления повлияет на морфогенез листа.
Учитывая, что гидростатическое давление может изменять нормальный транспорт питательных веществ и факторов роста и / или ремоделирование клеточной стенки, необходимое для роста (29–31), ожидается, что повышение уровня давления повлияет на морфогенез листа.
С помощью параметрического моделирования мы разработали фазовую диаграмму морфогенеза растущего листа.Рис. 4 показывает пространство параметров ( n , β ) различных конфигураций морфогенеза (I, II, III и IV). Экспериментальные результаты, измеренные на живых листьях (рис. 2 B ), наложены в виде точек данных на фазовую диаграмму. Обратите внимание, что границы между разными зонами являются приблизительными. В частности, между областями седловидного изгиба (конфигурация III) и волнового движения краев (конфигурация IV) моделирование показывает широкую переходную зону с конфигурациями с изгибами по длине, но без регулярных периодических волн по краям.Возникновение перегиба из седло-изгибной конфигурации является результатом структурной нестабильности, сопровождающейся снятием остаточных напряжений в центральной области и внезапным падением энергии деформации, как показано в SI Приложение , рис. S2 D . Однако при более высоких значениях максимальной деформации β и более высоких значениях n эта переходная зона перегиба сменяется краевой зоной (рис. 4).
S2 D . Однако при более высоких значениях максимальной деформации β и более высоких значениях n эта переходная зона перегиба сменяется краевой зоной (рис. 4).
Фазовая диаграмма морфогенеза тонких органов растений в зависимости от n и β .Точки экспериментальных данных такие же, как и на рис. 2 B , где треугольники (синие), квадраты (черные) и круги (зеленые) обозначают листья с конфигурациями скручивания, завивки краев и изгиба седла, соответственно.
Хотя общая тенденция фазовой диаграммы, созданной с помощью моделирования, согласуется с измерениями на живых листьях, в деталях есть некоторые очевидные расхождения. Наше моделирование предсказывает, что скручивающийся лист переходит в конфигурацию спирального скручивания, когда β ≈ 0.2. Однако измерения на скрученных листьях «мамми» кротона показывают, что этот переход происходит при более высоких максимальных деформациях роста (один лист даже имеет максимальную деформацию β≈0,7, рис. 2 B ). Это очевидное несоответствие может быть легко объяснено рассмотрением жесткой средней жилки у листьев кротона мамми. Как показано на рис. 3 C , переход от скручивания к спиральному скручиванию требует изгиба центральной линии, таким образом увеличивая движущую силу для жесткой средней вены. Следовательно, ожидается, что переход от скручивания к спиральному скручиванию будет происходить при гораздо большей максимальной деформации роста в присутствии жесткой средней жилы.Точно так же наличие жесткой средней жилки на листьях папоротника объясняет, почему точки данных, полученные из листьев с колеблющимися краями, попадают в область «промежуточного состояния».
2 B ). Это очевидное несоответствие может быть легко объяснено рассмотрением жесткой средней жилки у листьев кротона мамми. Как показано на рис. 3 C , переход от скручивания к спиральному скручиванию требует изгиба центральной линии, таким образом увеличивая движущую силу для жесткой средней вены. Следовательно, ожидается, что переход от скручивания к спиральному скручиванию будет происходить при гораздо большей максимальной деформации роста в присутствии жесткой средней жилы.Точно так же наличие жесткой средней жилки на листьях папоротника объясняет, почему точки данных, полученные из листьев с колеблющимися краями, попадают в область «промежуточного состояния».
Инженерный морфогенез с направленной полимеризацией гидрогеля.
С вышеупомянутыми количественными знаниями о роли механики в морфогенезе растений, мы теперь исследуем синтетическое воспроизведение таких процессов и форм в инженерных системах. Мы прибегаем к нашей разработке гидрогеля полиакриламида (PA) (32), в котором мы контролируем концентрацию кислорода для модуляции полимеризации гидрогеля PA. Как показано на рис. 5 A , диффузия кислорода из окружающего воздуха в раствор геля предотвращает гелеобразование вблизи границы раздела жидкость-воздух. Полимеризация в области, удаленной от границы раздела жидкость-воздух, потребляет свободные мономеры и сшивающие агенты, что приводит к градиенту концентрации свободных мономеров и сшивающих агентов и способствует их диффузии из негеляционной области в сеть полимеризованного гидрогеля. Следовательно, непрерывная полимеризация приводит к непрерывному росту области постгелирования ( SI Приложение , рис.S5).
Как показано на рис. 5 A , диффузия кислорода из окружающего воздуха в раствор геля предотвращает гелеобразование вблизи границы раздела жидкость-воздух. Полимеризация в области, удаленной от границы раздела жидкость-воздух, потребляет свободные мономеры и сшивающие агенты, что приводит к градиенту концентрации свободных мономеров и сшивающих агентов и способствует их диффузии из негеляционной области в сеть полимеризованного гидрогеля. Следовательно, непрерывная полимеризация приводит к непрерывному росту области постгелирования ( SI Приложение , рис.S5).
Воспроизведение морфогенеза листа in vitro. ( A ) Схема принципов работы гидрогелевой системы in vitro. ( B ) Манипуляции с профилем штамма роста в гидрогеле PA.
Мы индуцируем дифференциальный рост гидрогеля, вводя геометрические ограничения. Примером такого ограничения является нить (например, хлопковая нить), размещенная параллельно центральной линии реакционной камеры. Нить является относительно нерастяжимой и оказывает ограниченное сопротивление деформации изгиба вне плоскости листа гидрогеля. Следовательно, локальный рост гидрогеля рядом с нитью подавляется по мере роста краев, что приводит к профилю деформации роста, аналогичному тому, который дается формулой. 1 . Профиль роста можно контролировать, регулируя расположение и жесткость ограничивающей проволоки в образце. Когда мы вводим пару хлопковых нитей, разделенных расстоянием 2 α 0 W , как показано на рис. 5 A , модифицированный профиль деформации роста можно аппроксимировать как εg (y) = β | y − α0WW − α0W | n, [5] когда | y | ≥α0W.Как показано на Рис. 5 B , увеличение разделительного расстояния по существу эквивалентно увеличению значения n . Экспериментально определить точное значение показателя сложно. Однако конфигурация гидрогеля в присутствии нити предполагает, что значение близко к n = 2, когда одна нить размещена вдоль средней линии. Рис. 6 A показывает, что гидрогель естественным образом превращается в конфигурацию скручивания (I), а затем превращается в спиралевидное скручивание (II) при более высоком уровне деформации.
Следовательно, локальный рост гидрогеля рядом с нитью подавляется по мере роста краев, что приводит к профилю деформации роста, аналогичному тому, который дается формулой. 1 . Профиль роста можно контролировать, регулируя расположение и жесткость ограничивающей проволоки в образце. Когда мы вводим пару хлопковых нитей, разделенных расстоянием 2 α 0 W , как показано на рис. 5 A , модифицированный профиль деформации роста можно аппроксимировать как εg (y) = β | y − α0WW − α0W | n, [5] когда | y | ≥α0W.Как показано на Рис. 5 B , увеличение разделительного расстояния по существу эквивалентно увеличению значения n . Экспериментально определить точное значение показателя сложно. Однако конфигурация гидрогеля в присутствии нити предполагает, что значение близко к n = 2, когда одна нить размещена вдоль средней линии. Рис. 6 A показывает, что гидрогель естественным образом превращается в конфигурацию скручивания (I), а затем превращается в спиралевидное скручивание (II) при более высоком уровне деформации.
Воспроизведение четырех трехмерных конфигураций листов: ( A ) скручивание и спиральное скручивание; ( B ) сгибание в седле и обработка кромок. ( Вставки ) Контурные графики нормализованного профиля деформации роста (εg / β) в различных конфигурациях: n = 2 в A и n = 8 в B . Этапы [1] и [2] представляют соответственно полимеризацию и гидратацию. (Масштаб: 1 см.)
Другие конфигурации морфогенеза растений также могут быть сконструированы путем управления степенью и местоположением ограничений.На рис. 6 B показано, что при размещении пары стягивающих нитей с разделительным расстоянием 0,68 W несоответствие дифференциальной деформации, вызванное полимеризацией, преобразует гидрогель в форму седловидного изгиба (III). Дальнейшее набухание гидрогеля приводит к образованию конфигурации с волнистыми краями (IV).
Уникальная особенность настоящего метода заключается в том, что непрерывный процесс полимеризации, контролируемый концентрацией кислорода, хотя и химически и механически различен, близко имитирует процесс роста клеток у растений, контролируемый уровнями фактора роста. Рис. 6 демонстрирует, что при правильном дизайне ограничений наша техника способна имитировать морфогенез листьев и цветов растений.
Рис. 6 демонстрирует, что при правильном дизайне ограничений наша техника способна имитировать морфогенез листьев и цветов растений.
Границы | Простой, быстрый и надежный протокол для локализации перекиси водорода в крупных органах растений с помощью DAB-опосредованной печати тканей
Введение
Активные формы кислорода (АФК) накапливаются, когда растения подвергаются различным биотическим (атака патогенов) и абиотическим (например, свет, засуха, жара, соль и тяжелые металлы) стрессам (Apel and Hirt, 2004; Suzuki et al., 2012; Choudhury et al., 2013). С одной стороны, чрезмерное количество АФК вызывает окислительное повреждение белков, ДНК и липидов. С другой стороны, АФК также действуют как сигнальные молекулы, регулирующие развитие и стрессовые реакции (Apel and Hirt, 2004). У растений есть различные виды АФК, включая синглетный кислород ( 1 O 2 ), супероксид (O2-), H 2 O 2 и гидроксильный радикал (OH — ). Среди них H 2 O 2 считается относительно стабильным (Bienert et al., 2007) и наиболее вероятно передающие сигналы ROS для регуляции онтогенетических и стрессовых реакций (Van Breusegem et al., 2008) и, таким образом, являются одним из наиболее изученных видов ROS.
Среди них H 2 O 2 считается относительно стабильным (Bienert et al., 2007) и наиболее вероятно передающие сигналы ROS для регуляции онтогенетических и стрессовых реакций (Van Breusegem et al., 2008) и, таким образом, являются одним из наиболее изученных видов ROS.
Перекись водорода может быть обнаружена количественно и качественно. Точная количественная оценка H 2 O 2 в органах растений, однако, труднодостижима из-за уникальных свойств H 2 O 2 , обладающего высокой метаболической активностью с периодом полураспада всего 1 мс в растениях. (Reth, 2002; Вельович-Йованович и др., 2002; Петров, Ван Брейзегем, 2012). Даже хранение растительных материалов при -80 ° C может привести к потере H 2 O 2 на целых 60% в течение 7 дней (Cheeseman, 2006). Более того, H 2 O 2 может реагировать со многими восстановленными соединениями, высвобождаемыми во время гомогенизации растительных материалов, такими как аскорбиновая кислота, что приводит к недооценке уровней H 2 O 2 . Уровень H 2 O 2 также мог быть завышен из-за наличия в тканях растений эндогенных фенолов (Veljovic-Jovanovic et al., 2002). Фактически, сообщалось, что содержание H 2 O 2 может охватывать более нескольких порядков даже для листьев одного и того же вида (от нМ до мМ; Cheeseman, 2006; Razem, 2008), что указывает на серьезные проблемы. в H 2 O 2 количественное определение.
Уровень H 2 O 2 также мог быть завышен из-за наличия в тканях растений эндогенных фенолов (Veljovic-Jovanovic et al., 2002). Фактически, сообщалось, что содержание H 2 O 2 может охватывать более нескольких порядков даже для листьев одного и того же вида (от нМ до мМ; Cheeseman, 2006; Razem, 2008), что указывает на серьезные проблемы. в H 2 O 2 количественное определение.
Перекись водорода также может быть качественно локализована на тканевом или клеточном уровне. По сравнению с измерением H 2 O 2 , экстрагированного из целых органов растения, этот подход имеет преимущество, заключающееся в локализации H 2 O 2 в определенных клеточных участках в многоклеточной ткани или органе, тем самым потенциально обеспечивая глубокое понимание в клеточное происхождение и функцию H 2 O 2 .Локализация H 2 O 2 основана на гистохимическом окрашивании органов растений. Наиболее часто используемые химические вещества для локализации H 2 O 2 в planta — это 3,3′-диаминобензидин (DAB), хлорид церия (CeCl 3 ) и 2 ‘, 7’-дихлорфлуоресцина диацетат (H 2 DCF-DA). Однако обнаружение H 2 O 2 с помощью DAB требует длительного времени инкубации с раствором DAB. Например, для локализации H 2 O 2 в оторванных листьях и нежных корнях проростков обычно требуется более 8 часов инкубации в растворе DAB (Thordal-Christensen et al., 1997; Salzer et al., 1999). Чтобы получить более высокое разрешение клеточной локализации H 2 O 2 , также был использован метод ПЭМ. В этом методе эндогенный H 2 O 2 реагирует с экзогенно поставленным CeCl 3 с образованием пергидроксида церия, который дает темные отложения под ПЭМ. Однако перед фиксацией образцов для ПЭМ листья необходимо инкубировать в растворе CeCl 3 не менее 1 часа, чтобы обеспечить проникновение CeCl 3 в ткань и образование пергидроксида церия (Bestwick et al.
Наиболее часто используемые химические вещества для локализации H 2 O 2 в planta — это 3,3′-диаминобензидин (DAB), хлорид церия (CeCl 3 ) и 2 ‘, 7’-дихлорфлуоресцина диацетат (H 2 DCF-DA). Однако обнаружение H 2 O 2 с помощью DAB требует длительного времени инкубации с раствором DAB. Например, для локализации H 2 O 2 в оторванных листьях и нежных корнях проростков обычно требуется более 8 часов инкубации в растворе DAB (Thordal-Christensen et al., 1997; Salzer et al., 1999). Чтобы получить более высокое разрешение клеточной локализации H 2 O 2 , также был использован метод ПЭМ. В этом методе эндогенный H 2 O 2 реагирует с экзогенно поставленным CeCl 3 с образованием пергидроксида церия, который дает темные отложения под ПЭМ. Однако перед фиксацией образцов для ПЭМ листья необходимо инкубировать в растворе CeCl 3 не менее 1 часа, чтобы обеспечить проникновение CeCl 3 в ткань и образование пергидроксида церия (Bestwick et al. , 1997; Romero-Puertas et al., 2004). Такой длительный период инкубации отделенных органов растения в растворе DAB и CeCl 3 неизбежно изменит характер распределения H 2 O 2 in vivo из-за быстрой деградации исходного H 2 O 2 из-за его короткого периода полураспада и de novo продуцирования индуцированного раной H 2 O 2 . Queval et al. (2008) предположили, что окрашивание DAB отражает только продукцию H 2 O 2 , а не его исходную концентрацию или распределение.Действительно, сообщалось, что H 2 O 2 быстро накапливается в месте разреза стебля Arabidopsis в течение 1 минуты после разрезания, и, кроме того, индуцированный раной сигнал H 2 O 2 может распространяться. со скоростью 8,4 см мин -1 и вызывает резкое увеличение H 2 O 2 в дистальных отделах семядолей в течение 2 минут (Miller et al.
, 1997; Romero-Puertas et al., 2004). Такой длительный период инкубации отделенных органов растения в растворе DAB и CeCl 3 неизбежно изменит характер распределения H 2 O 2 in vivo из-за быстрой деградации исходного H 2 O 2 из-за его короткого периода полураспада и de novo продуцирования индуцированного раной H 2 O 2 . Queval et al. (2008) предположили, что окрашивание DAB отражает только продукцию H 2 O 2 , а не его исходную концентрацию или распределение.Действительно, сообщалось, что H 2 O 2 быстро накапливается в месте разреза стебля Arabidopsis в течение 1 минуты после разрезания, и, кроме того, индуцированный раной сигнал H 2 O 2 может распространяться. со скоростью 8,4 см мин -1 и вызывает резкое увеличение H 2 O 2 в дистальных отделах семядолей в течение 2 минут (Miller et al. , 2009).
, 2009).
Хотя окрашивание H 2 DCF-DA занимает более короткое время инкубации (10 мин), чем окрашивание DAB и CeCl 3 , оно в основном используется для визуализации H 2 O 2 на поверхности органов растений например, эпидермис цитрусовых (Macarisin et al., 2007) и листья табака (Essmann et al., 2008). Насколько нам известно, не было сообщений об использовании вышеупомянутых трех химических веществ для локализации H 2 O 2 во внутренних частях крупных органов растений (например, стеблях и плодах). Наиболее вероятная причина этого сценария — трудности проникновения этих химических веществ в крупные органы растений. Это действительно имело место в наших предварительных исследованиях яичников томатов с использованием окрашивания DAB и H 2 DCF-DA.Только недавно о локализации H 2 O 2 в семенах было сообщено в исследовании риса с использованием H 2 DCF-DA (Nagasawa et al. , 2013), в котором семена были разделены пополам перед окрашиванием. Хотя секционирование способствовало реакции H 2 DCF-DA с H 2 O 2 , быстрое образование индуцированного раной H 2 O 2 могло резко изменить исходное распределение H 2 O 2 и дает артефакт завышения уровня H 2 O 2 , как описано выше.Таким образом, как избежать или минимизировать вмешательство индуцированного раной H 2 O 2 является предпосылкой для точной локализации H 2 O 2 в срезах органов.
, 2013), в котором семена были разделены пополам перед окрашиванием. Хотя секционирование способствовало реакции H 2 DCF-DA с H 2 O 2 , быстрое образование индуцированного раной H 2 O 2 могло резко изменить исходное распределение H 2 O 2 и дает артефакт завышения уровня H 2 O 2 , как описано выше.Таким образом, как избежать или минимизировать вмешательство индуцированного раной H 2 O 2 является предпосылкой для точной локализации H 2 O 2 в срезах органов.
Некоторые исследования пытались решить проблему индуцированного раной образования H 2 O 2 . Например, крахмал / KI-опосредованная печать на ткани была использована для локализации H 2 O 2 в стебле проростков различных видов растений, включая сою, горох, фасоль, подсолнечник и огурец (Schopfer, 1994).В этой процедуре срезы стебля проростков прессовали в течение 60 с сразу после срезания на нитроцеллюлозной бумаге, пропитанной раствором крахмала / KI. Окисление KI до I 2 под действием H 2 O 2 может дать сине-черный комплекс I 2 -крахмал (Olson and Varner, 1993), который можно сфотографировать под микроскопом. Вся процедура может быть завершена всего за 70 секунд, и, таким образом, можно в значительной степени избежать индуцированного раной H 2 O 2 (Schopfer, 1994).Однако интенсивность цвета увеличивается со временем после печати, поэтому сигнал необходимо немедленно наблюдать и записывать (Schopfer, 1994). Кроме того, имеется фоновый цвет из-за непрерывного автоокисления KI, который мешает и размывает результаты (Neves et al., 1998; Przymusiński et al., 2007).
Окисление KI до I 2 под действием H 2 O 2 может дать сине-черный комплекс I 2 -крахмал (Olson and Varner, 1993), который можно сфотографировать под микроскопом. Вся процедура может быть завершена всего за 70 секунд, и, таким образом, можно в значительной степени избежать индуцированного раной H 2 O 2 (Schopfer, 1994).Однако интенсивность цвета увеличивается со временем после печати, поэтому сигнал необходимо немедленно наблюдать и записывать (Schopfer, 1994). Кроме того, имеется фоновый цвет из-за непрерывного автоокисления KI, который мешает и размывает результаты (Neves et al., 1998; Przymusiński et al., 2007).
После абсорбции растительными клетками DAB реагирует с H 2 O 2 с образованием красновато-коричневого полимера в присутствии пероксидазы (Thordal-Christensen et al., 1997). DAB-опосредованная тканевая печать использовалась для локализации пероксидазы в растениях (Spruce et al. , 1987). Однако не было сообщений о DAB-опосредованной печати тканей для прямой локализации H 2 O 2 в растениях. Здесь мы описали такую новую процедуру. Новый протокол позволяет быстро и надежно локализовать H 2 O 2 на участках крупных органов томатов, а именно на стеблях и плодах. Вся процедура была завершена в течение 15 секунд, что позволило избежать вмешательства индуцированного раной H 2 O 2 .В то же время сигнал был очень стабильным в течение как минимум 1 часа с небольшим фоном.
, 1987). Однако не было сообщений о DAB-опосредованной печати тканей для прямой локализации H 2 O 2 в растениях. Здесь мы описали такую новую процедуру. Новый протокол позволяет быстро и надежно локализовать H 2 O 2 на участках крупных органов томатов, а именно на стеблях и плодах. Вся процедура была завершена в течение 15 секунд, что позволило избежать вмешательства индуцированного раной H 2 O 2 .В то же время сигнал был очень стабильным в течение как минимум 1 часа с небольшим фоном.
Материалы и методы
H
2 O 2 Локализация с помощью DAB-опосредованной печати на ткани Нитроцеллюлозную мембрану (размер пор 0,45 мкм, Hybond TM -C Extra, Amersham) пропитывали 5 мг мл раствора -1 DAB – HCl (pH 3,8) и затем сушили на воздухе при комнатной температуре в течение 30 мин в темнота. Пропитанную нитроцеллюлозную мембрану поместили на слой непропитанной нитроцеллюлозной мембраны, которая может поглощать избыточный растительный экссудат с места разреза во время печати ткани. Тканевая печать выполнялась при ∼20 ° C. Произвольные срезы толщиной 1,0 мм были приготовлены с помощью бритвенного лезвия. Срезы вырезали из верхнего, среднего и нижнего положения стеблей 50-дневных проростков или поперек середины плодов на 5 и 10 DAF. Срезы осторожно прижимали указательным пальцем к пропитанной нитроцеллюлозной мембране в течение 10 с, чтобы гарантировать, что H 2 O 2 в срезах успешно переносится на мембрану и в то же время срезы не раздавливаются прессом.Затем срезы были осторожно удалены щипцами. Это вместе с 5 секундами, необходимыми для резки секции, дает общее время для печати на ткани всего 15 секунд. Затем мембрану промывали 100% этанолом для удаления возможного мешающего вещества (например, хлорофилла) и фотографировали под микроскопом для препарирования через 5 мин при комнатной температуре, чтобы обеспечить завершение реакции между H 2 O 2 , полученным из клетки растений и ДАБ предварительно пропитаны мембраной.
Тканевая печать выполнялась при ∼20 ° C. Произвольные срезы толщиной 1,0 мм были приготовлены с помощью бритвенного лезвия. Срезы вырезали из верхнего, среднего и нижнего положения стеблей 50-дневных проростков или поперек середины плодов на 5 и 10 DAF. Срезы осторожно прижимали указательным пальцем к пропитанной нитроцеллюлозной мембране в течение 10 с, чтобы гарантировать, что H 2 O 2 в срезах успешно переносится на мембрану и в то же время срезы не раздавливаются прессом.Затем срезы были осторожно удалены щипцами. Это вместе с 5 секундами, необходимыми для резки секции, дает общее время для печати на ткани всего 15 секунд. Затем мембрану промывали 100% этанолом для удаления возможного мешающего вещества (например, хлорофилла) и фотографировали под микроскопом для препарирования через 5 мин при комнатной температуре, чтобы обеспечить завершение реакции между H 2 O 2 , полученным из клетки растений и ДАБ предварительно пропитаны мембраной.
Чтобы проверить специфичность реакции, отпечатки тканей также делали, как указано выше, на мембранах, предварительно пропитанных 5 мг мл раствора -1 DAB – HCl (pH 3,8), содержащего 100 мМ аскорбиновой кислоты. Чтобы проверить, есть ли образование индуцированного раной H 2 O 2 в наших экспериментальных условиях, печать на ткани была выполнена через 0, 1 и 2 минуты после разрезания. Чтобы проверить, достаточно ли эндогенной пероксидазы для поддержки реакции, H 2 O 2 вводили экзогенно путем замачивания нитроцеллюлозной мембраны в 5 мг мл раствора -1 DAB – HCl (pH 3.8), содержащего 20 мМ H 2 O 2 , и печать на ткани выполняли, как описано выше. Если эндогенной пероксидазы достаточно, можно ожидать, что печать ткани с экзогенно поставляемым H 2 O 2 будет давать более сильные сигналы.
H
2 O 2 Количественное определение стеблей томатов Экстракцию перекиси водорода проводили согласно Veljovic-Jovanovic et al. (2002). Вкратце, собирали 100 мг стебля из верхней, средней и нижней части проростков томатов, мгновенно замораживали в жидком азоте и немедленно анализировали.Образцы гомогенизировали в 1,5 мл 1 M HClO 4 со 100 мг нерастворимого поливинилпирролидона, который может удалять фенольные соединения. Гомогенаты центрифугировали при 13000 × g в течение 10 мин при 4 ° C. Затем определяли содержание H 2 O 2 в супернатанте, как описано Cheeseman (2006). Вкратце, 60 мкл экстракта смешивали с 600 мкл реагентов eFOX (содержащих 250 мкМ сульфата двухвалентного аммония, 100 мкМ сорбита, 100 мкМ ксиленола оранжевого и 1% этанола в 25 мМ H 2 SO 4 ).Затем разница в оптической плотности между 550 и 800 нм регистрировалась по крайней мере через 30 минут после смешивания супернатанта с реагентами eFOX. Содержание H 2 O 2 рассчитывали с использованием стандартной кривой H 2 O 2 .
(2002). Вкратце, собирали 100 мг стебля из верхней, средней и нижней части проростков томатов, мгновенно замораживали в жидком азоте и немедленно анализировали.Образцы гомогенизировали в 1,5 мл 1 M HClO 4 со 100 мг нерастворимого поливинилпирролидона, который может удалять фенольные соединения. Гомогенаты центрифугировали при 13000 × g в течение 10 мин при 4 ° C. Затем определяли содержание H 2 O 2 в супернатанте, как описано Cheeseman (2006). Вкратце, 60 мкл экстракта смешивали с 600 мкл реагентов eFOX (содержащих 250 мкМ сульфата двухвалентного аммония, 100 мкМ сорбита, 100 мкМ ксиленола оранжевого и 1% этанола в 25 мМ H 2 SO 4 ).Затем разница в оптической плотности между 550 и 800 нм регистрировалась по крайней мере через 30 минут после смешивания супернатанта с реагентами eFOX. Содержание H 2 O 2 рассчитывали с использованием стандартной кривой H 2 O 2 .
Статистический анализ
Односторонний дисперсионный анализ был выполнен с использованием IBM SPSS Statistics 20.
Результаты и обсуждение
DAB-опосредованная тканевая печать для локализации H
2 O 2 — это просто, быстро и надежно Если не указано иное, тканевая печать стебля томата всегда проводилась на срезах средней части саженца.Мы обнаружили, что тканевая печать срезов ствола на нитроцеллюлозной мембране в течение 10 с дает значительный красновато-коричневый цвет в области коры и сосудистых пучков (рис. 1A, B). Чтобы проверить, является ли цвет специфичным для H 2 O 2 , реакцию проводили в присутствии аскорбиновой кислоты, специфического поглотителя H 2 O 2 (Thordal-Christensen et al., 1997). Поскольку нитроцеллюлозную мембрану необходимо сушить на воздухе в течение 30 минут, прежде чем ее можно будет использовать для печати на ткани, возможно, что пропитанная аскорбиновая кислота может быть окислена.Поэтому, чтобы гарантировать наличие в мембране достаточной восстановленной формы аскорбиновой кислоты для конкретной реакции с H 2 O 2 , мы использовали более высокую концентрацию аскорбиновой кислоты (100 мМ), чем обычно используемую концентрацию (10 мМ; Thordal-Christensen et al. , 1997; Salzer et al., 1999). Было обнаружено, что при обработке аскорбиновой кислотой окраски не наблюдалось (рис. 1С), что указывает на то, что реакция была специфичной для H 2 O 2 . Тот же отпечаток на Рисунке 1A был снова сфотографирован через 1 час без значительных изменений в силе сигнала H 2 O 2 (Рисунок 1D).Кроме того, через 1 час при комнатной температуре не проявился явный цвет фона (рис. 1D). Таким образом, можно сделать вывод, что наш протокол локализации H 2 O 2 в стволе с помощью DAB-опосредованной печати тканей прост, быстр и надежен.
, 1997; Salzer et al., 1999). Было обнаружено, что при обработке аскорбиновой кислотой окраски не наблюдалось (рис. 1С), что указывает на то, что реакция была специфичной для H 2 O 2 . Тот же отпечаток на Рисунке 1A был снова сфотографирован через 1 час без значительных изменений в силе сигнала H 2 O 2 (Рисунок 1D).Кроме того, через 1 час при комнатной температуре не проявился явный цвет фона (рис. 1D). Таким образом, можно сделать вывод, что наш протокол локализации H 2 O 2 в стволе с помощью DAB-опосредованной печати тканей прост, быстр и надежен.
РИСУНОК 1. Локализация H 2 O 2 посредством DAB-опосредованной тканевой печати в стеблях проростков томатов. Произвольные секции (толщиной 1 мм) были вырезаны из середины стебля томата для печати на ткани (A) .Срезы прессовали в течение 10 с на нитроцеллюлозной мембране, пропитанной 5 мг мл раствора -1 DAB – HCl (ph4,8), и сразу же фотографировали (B) или через 1 час (D) . Чтобы проверить специфичность реакции, срезы также прижимали к мембране, пропитанной 5 мг мл раствора -1 DAB – HCl (ph4,8) плюс 100 мМ аскорбиновой кислоты (C) . Секции, использованные на этом рисунке, были последовательными секциями из одного ствола. с, кора; р, сердцевина; v, сосудистый пучок.Масштабная линейка = 1 мм для (A – D) .
Чтобы проверить специфичность реакции, срезы также прижимали к мембране, пропитанной 5 мг мл раствора -1 DAB – HCl (ph4,8) плюс 100 мМ аскорбиновой кислоты (C) . Секции, использованные на этом рисунке, были последовательными секциями из одного ствола. с, кора; р, сердцевина; v, сосудистый пучок.Масштабная линейка = 1 мм для (A – D) .
Рано-индуцированный H
2 O 2 избегается в реакции Предыдущие исследования показали, что H 2 O 2 может быстро индуцироваться ранением (Olson and Varner, 1993; Miller et al., 2009). Чтобы проверить возможное участие индуцированного раной H 2 O 2 в текущем протоколе, печать на ткани выполнялась через 0, 1 и 2 минуты после разделения с использованием последовательных срезов. Было обнаружено, что не было никакой разницы в распределении H 2 O 2 между 0 и 1 мин после сечения, и H 2 O 2 был в основном ограничен корой и сосудистыми пучками без сигнала в сердцевине (Рисунки 2A, B). Однако очевидный сигнал H 2 O 2 был произведен в сердцевине, когда печать ткани проводилась через 2 минуты после разреза (рис. 2C), что указывает на образование индуцированного раной H 2 O 2 . Эти результаты показывают, что хотя индуцированный раной H 2 O 2 накапливается очень быстро (в течение 2 минут после разрезания), быстрота нашего протокола (в течение 15 секунд, подробности см. В разделе «Материалы и методы») может полностью избежать вмешательства вызванная раной H 2 O 2 .
Однако очевидный сигнал H 2 O 2 был произведен в сердцевине, когда печать ткани проводилась через 2 минуты после разреза (рис. 2C), что указывает на образование индуцированного раной H 2 O 2 . Эти результаты показывают, что хотя индуцированный раной H 2 O 2 накапливается очень быстро (в течение 2 минут после разрезания), быстрота нашего протокола (в течение 15 секунд, подробности см. В разделе «Материалы и методы») может полностью избежать вмешательства вызванная раной H 2 O 2 .
РИСУНОК 2. Накопление индуцированного раной H 2 O 2 в стебле томата после разрезания. Срезы свободной руки (толщиной 1 мм) были вырезаны из середины стебля томата для печати на ткани на 0 (A) , 1 (B) и 2 (C) мин после разрезания. В (A, B) не было обнаружено различий в схеме распределения H 2 O 2 . Однако в (C) H 2 O 2 был обнаружен в области сердцевины (стрелки), где H 2 O 2 не был обнаружен в (A, B) , что указывает на накопление вызванная раной H 2 O 2 через 2 мин после разреза.Секции, использованные на этом рисунке, были последовательными секциями из одного ствола. Масштабная линейка = 1 мм в (A – C) .
Однако в (C) H 2 O 2 был обнаружен в области сердцевины (стрелки), где H 2 O 2 не был обнаружен в (A, B) , что указывает на накопление вызванная раной H 2 O 2 через 2 мин после разреза.Секции, использованные на этом рисунке, были последовательными секциями из одного ствола. Масштабная линейка = 1 мм в (A – C) .
Эндогенной пероксидазы достаточно для поддержки реакции
Реакция между DAB и H 2 O 2 зависит от активности пероксидазы (Thordal-Christensen et al., 1997). В нашем протоколе H 2 O 2 был локализован с использованием экзогенного DAB и эндогенной пероксидазы. Несомненно, экзогенно поставляемого DAB, используемого в нашем протоколе, было достаточно для поддержки реакции (Spruce et al., 1987; Thordal-Christensen et al., 1997). Однако неизвестно, достаточно ли активности эндогенной пероксидазы для реакции. Чтобы решить эту проблему, экзогенный H 2 O 2 был введен путем вымачивания нитроцеллюлозы в растворе DAB, содержащем 20 мМ H 2 O 2 . Если активности эндогенной пероксидазы из стеблевой секции более чем достаточно для реакции, интенсивность цвета H 2 O 2 на тканевой печати должна стать сильнее в присутствии экзогенно поставляемой H 2 O 2 .Как и ожидалось, H 2 O 2 был обнаружен в коре головного мозга, но не в сердцевине в отсутствие экзогенно поставляемого H 2 O 2 (рис. 3A). Однако сила сигнала H 2 O 2 увеличивалась не только в коре головного мозга, но также появлялась в сердцевине, когда нитроцеллюлозная мембрана была предварительно пропитана экзогенным H 2 O 2 (рис. 3B). Эти наблюдения показывают, что активность эндогенной пероксидазы была достаточной для поддержки реакции между эндогенным H 2 O 2 и экзогенно поставляемым DAB.
Если активности эндогенной пероксидазы из стеблевой секции более чем достаточно для реакции, интенсивность цвета H 2 O 2 на тканевой печати должна стать сильнее в присутствии экзогенно поставляемой H 2 O 2 .Как и ожидалось, H 2 O 2 был обнаружен в коре головного мозга, но не в сердцевине в отсутствие экзогенно поставляемого H 2 O 2 (рис. 3A). Однако сила сигнала H 2 O 2 увеличивалась не только в коре головного мозга, но также появлялась в сердцевине, когда нитроцеллюлозная мембрана была предварительно пропитана экзогенным H 2 O 2 (рис. 3B). Эти наблюдения показывают, что активность эндогенной пероксидазы была достаточной для поддержки реакции между эндогенным H 2 O 2 и экзогенно поставляемым DAB.
РИСУНОК 3. Влияние экзогенно применяемого H 2 O 2 на H 2 O 2 сила сигнала в стеблях проростков томатов. Тканевая печать проводилась на нитроцеллюлозных мембранах без (A) и с (B) , экзогенно поставляемым 20 мМ H 2 O 2 . Обратите внимание, что нанесение экзогенно поставляемого H 2 O 2 увеличивало интенсивность сигналов в коре головного мозга, и с дополнительными сигналами, явно обнаруженными в сердцевинной области стебля томата в (B) по сравнению с (A ) .с, кора; р, сердцевина; Масштабная линейка = 1 мм в (A, B) .
Тканевая печать проводилась на нитроцеллюлозных мембранах без (A) и с (B) , экзогенно поставляемым 20 мМ H 2 O 2 . Обратите внимание, что нанесение экзогенно поставляемого H 2 O 2 увеличивало интенсивность сигналов в коре головного мозга, и с дополнительными сигналами, явно обнаруженными в сердцевинной области стебля томата в (B) по сравнению с (A ) .с, кора; р, сердцевина; Масштабная линейка = 1 мм в (A, B) .
H
2 O 2 Изменения распределения в стеблях и плодах томатов Производство H 2 O 2 строго регулируется во время развития растений. Например, используя крахмал / KI-опосредованную печать на ткани, Schopfer (1994) показал, что уровень H 2 O 2 резко возрастает от области крючка к корню у 5-дневных проростков сои.Используя текущий протокол, мы изучили распределение H 2 O 2 вдоль стебля проростков томатов (рис.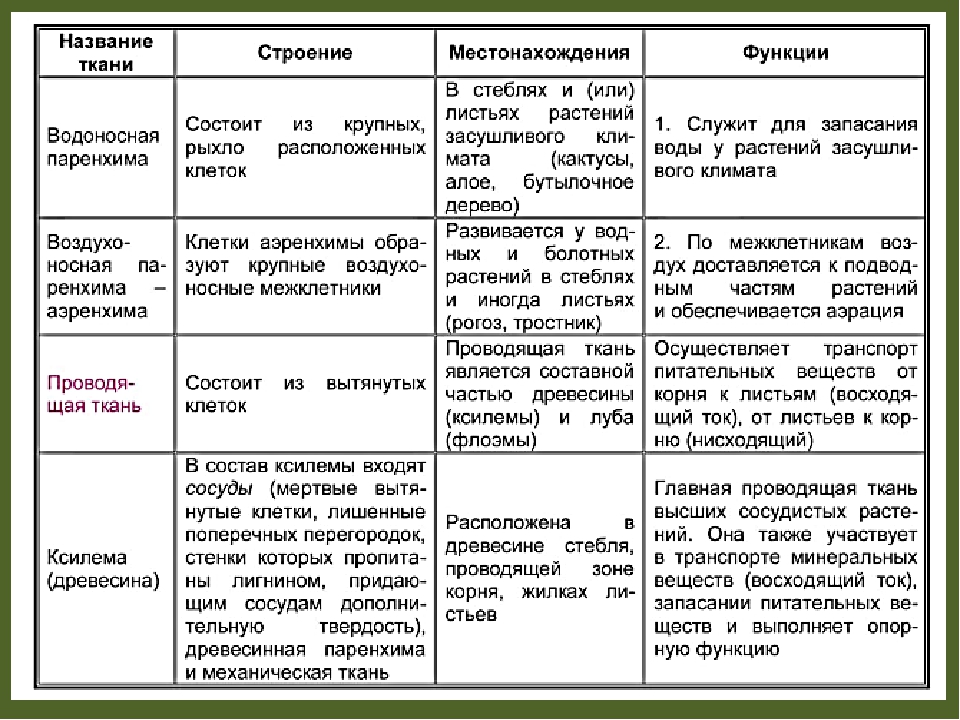 4A). Анализ показал, что модели распределения H 2 O 2 разительно различались в верхней, средней и нижней частях проростков томатов. H 2 O 2 был распределен по всей секции в верхней части проростков (рис. 4B). Однако сила сигнала H 2 O 2 в сердцевине уменьшилась в средней и нижней частях стебля (рисунки 4C, D), при этом H 2 O 2 обнаруживается только в коре головного мозга внизу. область стебля (рис. 4D).Сопровождая измененный характер распределения, содержание H 2 O 2 , по-видимому, уменьшалось вдоль стеблей сверху вниз. Это наблюдение градиента H 2 O 2 вдоль стеблей томатов противоречит наблюдениям, полученным для сои (Schopfer, 1994). Причина несоответствия может заключаться в разных условиях выращивания. Сеянцы сои выращивали в темноте (Schopfer, 1994), тогда как наши саженцы томатов выращивали в нормальных условиях (10/14 ч, день / ночь).
4A). Анализ показал, что модели распределения H 2 O 2 разительно различались в верхней, средней и нижней частях проростков томатов. H 2 O 2 был распределен по всей секции в верхней части проростков (рис. 4B). Однако сила сигнала H 2 O 2 в сердцевине уменьшилась в средней и нижней частях стебля (рисунки 4C, D), при этом H 2 O 2 обнаруживается только в коре головного мозга внизу. область стебля (рис. 4D).Сопровождая измененный характер распределения, содержание H 2 O 2 , по-видимому, уменьшалось вдоль стеблей сверху вниз. Это наблюдение градиента H 2 O 2 вдоль стеблей томатов противоречит наблюдениям, полученным для сои (Schopfer, 1994). Причина несоответствия может заключаться в разных условиях выращивания. Сеянцы сои выращивали в темноте (Schopfer, 1994), тогда как наши саженцы томатов выращивали в нормальных условиях (10/14 ч, день / ночь). Чтобы проверить надежность наших наблюдений, концентрация H 2 O 2 была измерена в экстрактах тканей в верхней, средней и нижней частях стеблей проростков томатов. Было обнаружено, что содержание H 2 O 2 действительно снижалось вниз по стволу. Содержание H 2 O 2 в верхней части стебля проростка было в один и два раза выше, чем в средней и нижней части соответственно (рис. 5). Согласованность между количественным значением (Рисунок 5) и локальной силой сигнала в срезах (Рисунок 4) является дополнительным доказательством того, что наша DAB-опосредованная печать тканей надежна и может полуколичественно отражать распределение H 2 O 2 в растении. органы.
Чтобы проверить надежность наших наблюдений, концентрация H 2 O 2 была измерена в экстрактах тканей в верхней, средней и нижней частях стеблей проростков томатов. Было обнаружено, что содержание H 2 O 2 действительно снижалось вниз по стволу. Содержание H 2 O 2 в верхней части стебля проростка было в один и два раза выше, чем в средней и нижней части соответственно (рис. 5). Согласованность между количественным значением (Рисунок 5) и локальной силой сигнала в срезах (Рисунок 4) является дополнительным доказательством того, что наша DAB-опосредованная печать тканей надежна и может полуколичественно отражать распределение H 2 O 2 в растении. органы.
РИСУНОК 4. Локализация H 2 O 2 в различных частях стеблей проростков томатов. Секции стержня были вырезаны из разных положений, как указано в (A) для H 2 O 2 локализация вверху (B) , в середине (C) и внизу (D) стебли томатов с использованием DAB-опосредованной тканевой печати. Масштабные линейки в (B – D) представляют 1, 1,2 и 1 мм соответственно.
Масштабные линейки в (B – D) представляют 1, 1,2 и 1 мм соответственно.
РИСУНОК 5.Количественное определение H 2 O 2 в верхней, средней и нижней частях стеблей проростков томатов. Каждое значение представляет собой среднее значение ± стандартная ошибка (SE) четырех биологических повторностей (четыре образца стебля от четырех отдельных проростков). Значения с разными буквами указывают на существенные различия ( P ≤ 0,01).
Чтобы проверить, применим ли метод к другим крупным органам, мы исследовали локализацию H 2 O 2 в плодах томатов на 5 и 10 DAF с использованием DAB-опосредованной печати тканей.На 5 DAF H 2 O 2 был обнаружен обильно и равномерно по всему разрезу (рис. 6A). Однако к 10 DAF H 2 O 2 оказался более тканеспецифичным, в котором H 2 O 2 был в изобилии в околоплоднике, семенах и перегородке, а не H 2 O 2 сигнал был обнаружен в областях колумеллы, локулы и плаценты (рисунки 6B, C). Эти результаты предполагают, что распределение H 2 O 2 также сильно регулируется во время развития плодов томата.
Эти результаты предполагают, что распределение H 2 O 2 также сильно регулируется во время развития плодов томата.
РИСУНОК 6. Локализация H 2 O 2 в молодых плодах томатов с использованием DAB-опосредованной печати на ткани. Поперечные срезы (толщиной 1 мм) были вырезаны поперек середины плодов томата на 5 (A) и 10 (B) DAF. (C) Показывает соответствующее изображение фруктовой секции, используемой в (B) . co, columella; l, локула; пэ, околоплодник; пл, плацента; с, семя; sp, перегородка. Масштабные линейки в (A – C) представляют 1, 2 и 2 мм соответственно.
Сообщалось, что ROS способствует делению клеток за счет ускорения ауксин-опосредованного входа в клеточный цикл люцерны ( Medicago sativa ; Fehér et al., 2008). АФК также участвуют в установлении и поддержании апикального доминирования корней у Arabidopsis (De Tullio et al., 2010) и в формировании боковых корней у риса (Chen et al. , 2013). Следовательно, более высокий уровень H 2 O 2 в верхней части стебля (рисунки 4A и 5) и более молодых плодах (5 DAF; рисунок 6A) может указывать на высокую активность деления клеток в этих органах.
, 2013). Следовательно, более высокий уровень H 2 O 2 в верхней части стебля (рисунки 4A и 5) и более молодых плодах (5 DAF; рисунок 6A) может указывать на высокую активность деления клеток в этих органах.
В заключение, локализация H 2 O 2 внутри крупных органов растения (например, стебля и крупных плодов), отличных от тонких и плоских листьев, является технически сложной задачей. В этой статье мы сообщаем о разработке DAB-опосредованного метода тканевой печати для локализации H 2 O 2 в стеблях томатов и плодах. Скорость нашего протокола (в течение 15 с) может эффективно избежать вмешательства индуцированного раной H 2 O 2 . Это представляет собой главное преимущество перед протоколом, описанным Thordal-Christensen et al.(1997), где полосы листьев инкубировали в растворах, содержащих DAB, в течение 8 часов, что неизбежно приводило к индуцированному раной H 2 O 2 (Miller et al. , 2009; Swanson et al., 2011). Другое преимущество состоит в том, что уровень сигнала H 2 O 2 от нашей печати на тканях стабильно сохранялся в течение по крайней мере 1 часа после печати на тканях без проявленного фона или с небольшим проявлением фона. Кроме того, благодаря высокой согласованности между интенсивностью сигнала локализованного H 2 O 2 и его количественной концентрацией, протокол также можно использовать для полуколичественного отражения распределения H 2 O 2 в органах растений.Таким образом, наш протокол представляет собой простой способ конкретно, быстро и надежно локализовать H 2 O 2 в крупных органах растений.
, 2009; Swanson et al., 2011). Другое преимущество состоит в том, что уровень сигнала H 2 O 2 от нашей печати на тканях стабильно сохранялся в течение по крайней мере 1 часа после печати на тканях без проявленного фона или с небольшим проявлением фона. Кроме того, благодаря высокой согласованности между интенсивностью сигнала локализованного H 2 O 2 и его количественной концентрацией, протокол также можно использовать для полуколичественного отражения распределения H 2 O 2 в органах растений.Таким образом, наш протокол представляет собой простой способ конкретно, быстро и надежно локализовать H 2 O 2 в крупных органах растений.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Работа частично финансировалась Университетом Ньюкасла, Австралия, в качестве поддержки Австралийско-китайского исследовательского центра по улучшению сельскохозяйственных культур. Юн-Хуа Лю является стипендиатом исследовательской стипендии Университета Ньюкасла. Мы также благодарим Джозефа Энрайта за его отличную работу по выращиванию растений.
Юн-Хуа Лю является стипендиатом исследовательской стипендии Университета Ньюкасла. Мы также благодарим Джозефа Энрайта за его отличную работу по выращиванию растений.
Список литературы
Бествик К. С., Браун И. Р., Беннетт М. Х. и Мэнсфилд Дж. У. (1997). Локализация накопления перекиси водорода при гиперчувствительной реакции клеток салата на Pseudomonas syringae pv phaseolicola. Растительная клетка 9, 209–221. DOI: 10,1105 / тпк.9.2.209
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Бинерт, Г. П., Мёллер, А. Л. Б., Кристиансен, К. А., Шульц, А., Мёллер, И. М., Шьёрринг, Дж. К. и др. (2007). Специфические аквапорины способствуют диффузии перекиси водорода через мембраны. J. Biol. Chem. 282, 1183–1192. DOI: 10.1074 / jbc.M603761200
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Эссманн, Дж., Шмитц-Том, И., Шен, Х., Зонневальд, С., Вайс, Э.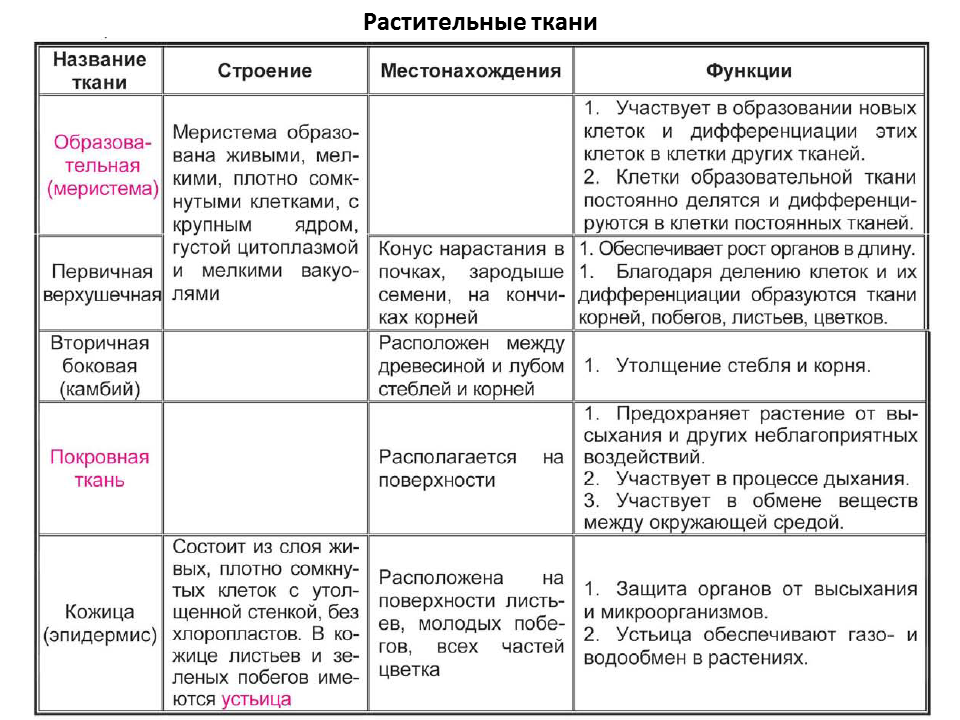 , и Шарте, Дж. (2008). Опосредованная РНК-интерференцией репрессия инвертазы клеточной стенки нарушает защиту исходных листьев табака. Plant Physiol. 147, 1288–1299. DOI: 10.1104 / стр.108.121418
, и Шарте, Дж. (2008). Опосредованная РНК-интерференцией репрессия инвертазы клеточной стенки нарушает защиту исходных листьев табака. Plant Physiol. 147, 1288–1299. DOI: 10.1104 / стр.108.121418
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Фехер, А., Отвеш, К., Пастернак, Т. П., и Сзандтнер, А. П. (2008). Участие активных форм кислорода (АФК) в активации клеточного цикла (переход от G0 к G1) растительных клеток. Завод Сигнал. Behav. 3, 823–826. DOI: 10.4161 / psb.3.10.5908
CrossRef Полный текст | Google Scholar
Macarisin, D., Cohen, L., Eick, A., Rafael, G., Belausov, E., Wisniewski, M., et al. (2007). Penicillium digitatum подавляет выработку перекиси водорода в тканях хозяина во время заражения цитрусовых. Фитопатология 97, 1491–1500. DOI: 10.1094 / PHYTO-97-11-1491
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Миллер, Г. , Schlauch, K., Tam, R., Cortes, D., Torres, M.A., Shulaev, V., et al. (2009). Растительная НАДФН-оксидаза RBOHD обеспечивает быструю системную передачу сигналов в ответ на различные стимулы. Sci. Сигнал. 2, ra45. DOI: 10.1126 / scisignal.2000448
, Schlauch, K., Tam, R., Cortes, D., Torres, M.A., Shulaev, V., et al. (2009). Растительная НАДФН-оксидаза RBOHD обеспечивает быструю системную передачу сигналов в ответ на различные стимулы. Sci. Сигнал. 2, ra45. DOI: 10.1126 / scisignal.2000448
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Нагасава Н., Хибара К. И., Хеппард Э. П., Вандер Фельден К. А., Лак С., Битти М. и др. (2013). ГИГАНТСКИЙ ЭМБРИОН кодирует CYP78A13, необходимый для правильного баланса размеров эмбриона и эндосперма в рисе. Plant J. 75, 592–605. DOI: 10.1111 / tpj.12223
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Невес, К., Са, М. К., и Амансио, С. (1998). Гистохимическое определение H 2 O 2 с помощью тканевой печати как раннего маркера ризогенеза в виноградной лозе. Plant Physiol. Bioch. 36, 817–824. DOI: 10.1016 / S0981-9428 (99) 80019-9
CrossRef Полный текст | Google Scholar
Олсон П. и Варнер Дж.(1993). Перекись водорода и лигнификация. Plant J. 4, 887–892. DOI: 10.1046 / j.1365-313X.1993.04050887.x
и Варнер Дж.(1993). Перекись водорода и лигнификация. Plant J. 4, 887–892. DOI: 10.1046 / j.1365-313X.1993.04050887.x
CrossRef Полный текст | Google Scholar
Przymusiński, R., Rucińska-Sobkowiak, R., Ilska, B., and Gwód, E.A. (2007). Органоспецифические ответы проростков люпина на локализацию перекиси водорода и пероксидазную активность. Acta Physiol. Завод 29, 411–416. DOI: 10.1007 / s11738-007-0049-y
CrossRef Полный текст | Google Scholar
Кеваль, Г., Хагер, Дж., Гакьер, Б., и Ноктор, Г. (2008). Почему литературные данные о содержании H 2 O 2 так разнообразны? Обсуждение потенциальных трудностей при количественном анализе экстрактов листьев. J. Exp. Бот. 59, 135–146. DOI: 10.1093 / jxb / erm193
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Разем Ф.А. (2008). Обзор производства перекиси водорода и клеточного определения в растениях. Hebron University Res. J. 3, 84–96.
J. 3, 84–96.
Google Scholar
Ромеро-Пуэртас, М. К., Родригес-серрано, М., Корпас, Ф. Дж., Гомес, М., Дель Рио, Л. А., и Сандалио, Л. М. (2004). Кадмий-индуцированное субклеточное накопление O2middot- и H 2 O 2 в листьях гороха. Plant Cell Environ. 27, 1122–1134. DOI: 10.1111 / j.1365-3040.2004.01217.x
CrossRef Полный текст | Google Scholar
Зальцер П., Корбьер Х. и Боллер Т. (1999). Накопление перекиси водорода в корнях Medicago truncatula , заселенных арбускулярным грибком, образующим микоризу Glomus intraradices . Planta 208, 319–325. DOI: 10.1007 / s004250050565
CrossRef Полный текст | Google Scholar
Шопфер П. (1994). Гистохимическая демонстрация и локализация H 2 O 2 в органах высших растений путем тканевой печати на нитроцеллюлозной бумаге. Plant Physiol. 104, 1269–1275.
Google Scholar
Спрус Дж., Майер А. М. и Осборн Д. Дж. (1987). Простой гистохимический метод определения местоположения ферментов в тканях растений с использованием нитроцеллюлозного блоттинга. Фитохимия 26, 2901–2903. DOI: 10.1016 / S0031-9422 (00) 84559-8
М. и Осборн Д. Дж. (1987). Простой гистохимический метод определения местоположения ферментов в тканях растений с использованием нитроцеллюлозного блоттинга. Фитохимия 26, 2901–2903. DOI: 10.1016 / S0031-9422 (00) 84559-8
CrossRef Полный текст | Google Scholar
Суонсон, С. Дж., Чой, В. Г., Чанока, А., и Гилрой, С. (2011). Визуализация in vivo Ca2 +, pH и активных форм кислорода с использованием флуоресцентных зондов в растениях. Annu. Rev. Plant Biol. 62, 273–297. DOI: 10.1146 / annurev-arplant-042110-103832
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Тордал-Кристенсен, Х., Чжан, З. Г., Вэй, Ю. Д., и Коллиндж, Д. Б. (1997). Субклеточная локализация H 2 O 2 в растениях. H 2 O 2 накопление в сосочках и гиперчувствительный ответ во время взаимодействия ячменя и мучнистой росы. Plant J. 11, 1187–1194. DOI: 10.1046 / j.1365-313X.1997.11061187. x
x
CrossRef Полный текст | Google Scholar
Вельович-Йованович, С., Ноктор, Г., и Фойе, К. Х. (2002). Часто ли завышается концентрация перекиси водорода в листьях? Возможное влияние артефактного вмешательства тканевых фенолов и аскорбата. Plant Physiol. Биохим. 40, 501–507. DOI: 10.1016 / S0981-9428 (02) 01417-1
CrossRef Полный текст | Google Scholar
Тело растения — Биология
OpenStaxCollege
[latexpage]
Цели обучения
К концу этого раздела вы сможете:
- Опишите систему органов побега и систему корневых органов
- Различать меристематическую ткань и постоянную ткань
- Определите и опишите три региона, где происходит рост растений
- Обобщите роли кожной ткани, сосудистой ткани и основной ткани
- Сравните простую растительную ткань со сложной растительной тканью
Как и животные, растения содержат клетки с органеллами, в которых происходит определенная метаболическая активность. Однако, в отличие от животных, растения используют энергию солнечного света для образования сахаров во время фотосинтеза. Кроме того, у растительных клеток есть клеточные стенки, пластиды и большая центральная вакуоль: структуры, которых нет в клетках животных. Каждая из этих клеточных структур играет определенную роль в структуре и функциях растений.
Однако, в отличие от животных, растения используют энергию солнечного света для образования сахаров во время фотосинтеза. Кроме того, у растительных клеток есть клеточные стенки, пластиды и большая центральная вакуоль: структуры, которых нет в клетках животных. Каждая из этих клеточных структур играет определенную роль в структуре и функциях растений.
Ссылка на обучение
Часы Ботаника без границ , видеоролик о важности растений, созданный Ботаническим обществом Америки.
У растений, как и у животных, похожие клетки, работая вместе, образуют ткань. Когда разные типы тканей работают вместе, чтобы выполнять уникальную функцию, они образуют орган; органы, работающие вместе, образуют системы органов. Сосудистые растения имеют две различные системы органов: систему побегов и корневую систему. Система побегов состоит из двух частей: вегетативных (не репродуктивных) частей растения, таких как листья и стебли, и репродуктивных частей растения, включая цветы и плоды.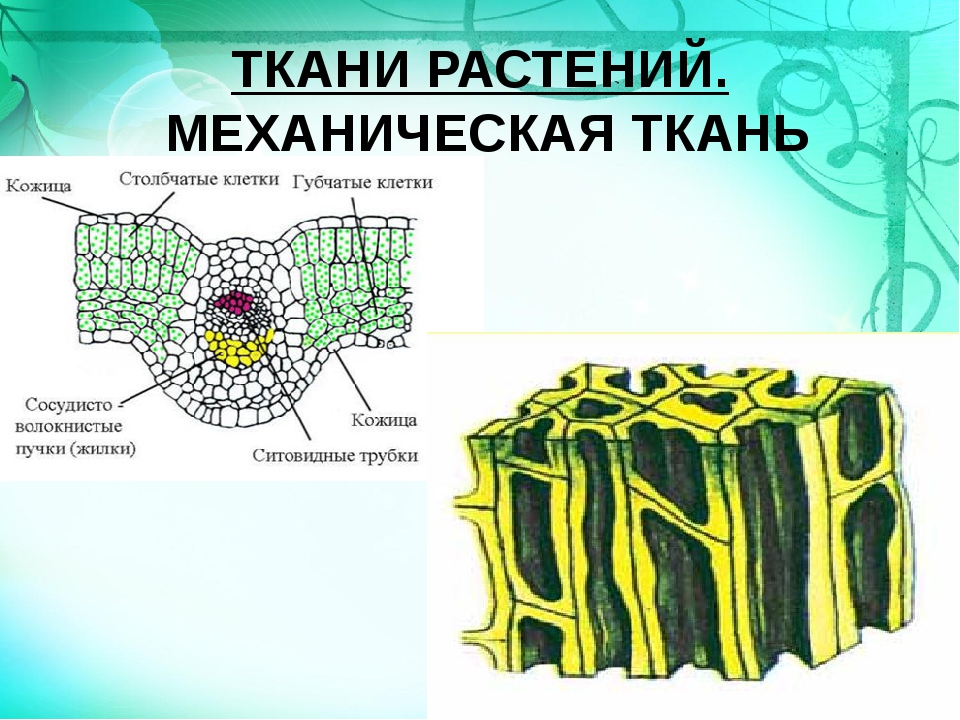 Система побегов обычно растет над землей, где она поглощает свет, необходимый для фотосинтеза. Корневая система, которая поддерживает растения и поглощает воду и минералы, обычно находится под землей. [ссылка] показывает системы органов типичного растения.
Система побегов обычно растет над землей, где она поглощает свет, необходимый для фотосинтеза. Корневая система, которая поддерживает растения и поглощает воду и минералы, обычно находится под землей. [ссылка] показывает системы органов типичного растения.
Побеговая система растения состоит из листьев, стеблей, цветов и плодов. Корневая система закрепляет растение, впитывая воду и минералы из почвы.
Растения — это многоклеточные эукариоты, тканевые системы которых состоят из различных типов клеток, выполняющих определенные функции.Системы тканей растений делятся на два основных типа: меристематическая ткань и постоянная (или немеристематическая) ткань. Клетки меристематической ткани находятся в меристемах, которые представляют собой участки растений, в которых происходит непрерывное деление и рост клеток. Клетки меристематической ткани либо недифференцированы, либо не полностью дифференцированы, и они продолжают делиться и вносить свой вклад в рост растения.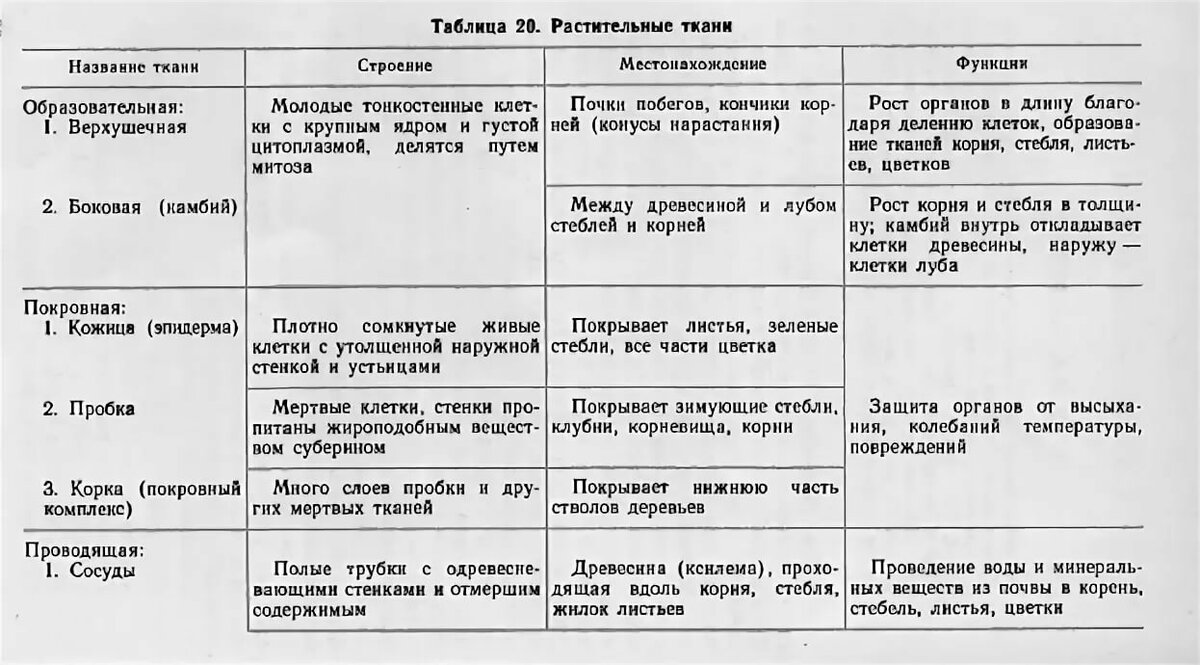 Напротив, постоянная ткань состоит из растительных клеток, которые больше не делятся активно.
Напротив, постоянная ткань состоит из растительных клеток, которые больше не делятся активно.
Меристематические ткани бывают трех типов в зависимости от их расположения в растении.Апикальные меристемы содержат меристематическую ткань, расположенную на концах стеблей и корней, которые позволяют растению увеличиваться в длину. Боковые меристемы способствуют увеличению толщины или обхвата созревающего растения. Вставочные меристемы встречаются только у однодольных, у оснований листовых пластинок и узлов (области прикрепления листьев к стеблю). Эта ткань позволяет листовой пластине однодольных увеличиваться в длину от основания листа; например, он позволяет листьям газонной травы удлиняться даже после многократного кошения.
Меристемы производят клетки, которые быстро дифференцируются или специализируются и становятся постоянной тканью. Такие клетки берут на себя определенные роли и теряют способность к дальнейшему делению. Их можно разделить на три основных типа: кожные, сосудистые и наземные.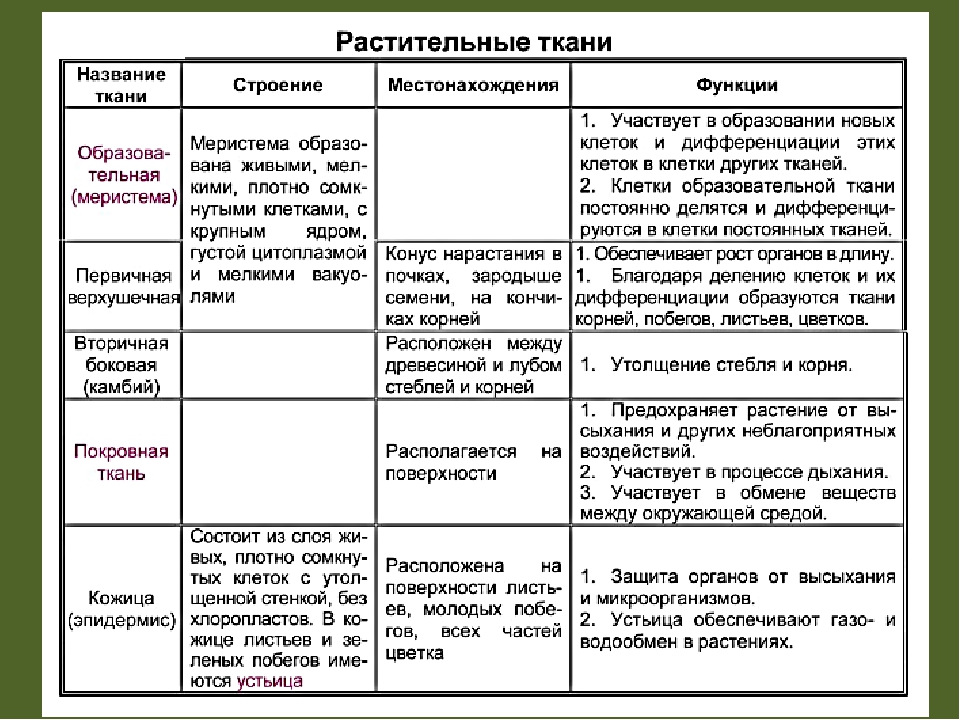 Кожная ткань покрывает и защищает растение, а сосудистая ткань транспортирует воду, минералы и сахар к различным частям растения. Земляная ткань служит местом фотосинтеза, обеспечивает поддерживающую матрицу для сосудистой ткани и помогает хранить воду и сахар.
Кожная ткань покрывает и защищает растение, а сосудистая ткань транспортирует воду, минералы и сахар к различным частям растения. Земляная ткань служит местом фотосинтеза, обеспечивает поддерживающую матрицу для сосудистой ткани и помогает хранить воду и сахар.
Вторичные ткани бывают простыми (состоящими из схожих типов клеток) или сложными (состоящими из разных типов клеток). Кожная ткань, например, представляет собой простую ткань, которая покрывает внешнюю поверхность растения и контролирует газообмен. Сосудистая ткань является примером сложной ткани и состоит из двух специализированных проводящих тканей: ксилемы и флоэмы. Ткань ксилемы переносит воду и питательные вещества от корней к различным частям растения и включает три разных типа клеток: элементы сосудов и трахеиды (оба из которых проводят воду) и паренхима ксилемы.Ткань флоэмы, которая транспортирует органические соединения от места фотосинтеза к другим частям растения, состоит из четырех различных типов клеток: ситчатых клеток (которые проводят фотосинтаты), клеток-компаньонов, паренхимы флоэмы и волокон флоэмы. В отличие от клеток, проводящих ксилему, клетки, проводящие флоэму, остаются живыми в зрелом возрасте. Ксилема и флоэма всегда прилегают друг к другу ([ссылка]). В стеблях ксилема и флоэма образуют структуру, называемую сосудистым пучком; в корнях это называется сосудистой стелой или сосудистым цилиндром.
На этой светлой микрофотографии показано поперечное сечение стебля кабачка ( Curcurbita maxima ). Каждый каплевидный сосудистый пучок состоит из крупных сосудов ксилемы внутрь и более мелких клеток флоэмы снаружи. Клетки ксилемы, которые переносят воду и питательные вещества от корней к остальным частям растения, мертвы при функциональной зрелости. Клетки флоэмы, которые переносят сахар и другие органические соединения из фотосинтезирующей ткани в остальную часть растения, являются живыми. Сосудистые пучки заключены в наземную ткань и окружены кожной тканью.(кредит: модификация работы «(biophotos)» / Flickr; данные шкалы от Мэтта Рассела)
Сосудистое растение состоит из двух систем органов: системы побегов и корневой системы. Система побегов включает надземные вегетативные части (стебли и листья) и репродуктивные части (цветы и плоды). Корневая система поддерживает растение и обычно находится под землей. Растение состоит из двух основных типов тканей: меристематической ткани и постоянной ткани. Меристематическая ткань состоит из активно делящихся клеток, находящихся в корнях и кончиках побегов.По мере роста меристематическая ткань дифференцируется на постоянную ткань, которая подразделяется на простую или сложную. Простые ткани состоят из подобных типов клеток; примеры включают кожную ткань и наземную ткань. Кожная ткань обеспечивает внешнее покрытие растения. Наземная ткань отвечает за фотосинтез; он также поддерживает сосудистую ткань и может накапливать воду и сахар. Сложные ткани состоят из разных типов клеток. Сосудистая ткань, например, состоит из клеток ксилемы и флоэмы.
Система побегов включает надземные вегетативные части (стебли и листья) и репродуктивные части (цветы и плоды). Корневая система поддерживает растение и обычно находится под землей. Растение состоит из двух основных типов тканей: меристематической ткани и постоянной ткани. Меристематическая ткань состоит из активно делящихся клеток, находящихся в корнях и кончиках побегов.По мере роста меристематическая ткань дифференцируется на постоянную ткань, которая подразделяется на простую или сложную. Простые ткани состоят из подобных типов клеток; примеры включают кожную ткань и наземную ткань. Кожная ткань обеспечивает внешнее покрытие растения. Наземная ткань отвечает за фотосинтез; он также поддерживает сосудистую ткань и может накапливать воду и сахар. Сложные ткани состоят из разных типов клеток. Сосудистая ткань, например, состоит из клеток ксилемы и флоэмы.
Области непрерывного роста растений состоят из ________.
- кожная ткань
- сосудистая ткань
- ткань меристемы
- постоянная ткань
Что из перечисленного является основным участком фотосинтеза?
- апикальная меристема
- измельченная ткань
- ксилемные клетки
- клетки флоэмы
Какой тип меристемы встречается только у однодольных, например газонных трав? Объясните, как этот тип меристематической ткани полезен для газонных трав, которые скашивают еженедельно.
Газонные травы и другие однодольные растения имеют вставочную меристему, которая представляет собой область меристематической ткани у основания листовой пластинки. Это полезно для растения, потому что оно может продолжать расти, даже если верхушка растения удалена путем выпаса скота или скашивания.
Какая часть растения отвечает за транспортировку воды, минералов и сахара к разным частям растения? Назовите два типа ткани, из которых состоит эта ткань, и объясните роль каждого из них.
Сосудистая ткань переносит воду, минералы и сахара по всему растению.Сосудистая ткань состоит из ткани ксилемы и ткани флоэмы. Ткань ксилемы переносит воду и питательные вещества от корней вверх. Ткань флоэмы переносит сахар от участков фотосинтеза к остальным частям растения.
Глоссарий
- апикальная меристема
- меристематическая ткань, расположенная на концах стеблей и корней; позволяет растению увеличиваться в длину
- кожная ткань
- защитная ткань растения, покрывающая внешнюю часть растения; контролирует газообмен
- наземная ткань
- растительная ткань, участвующая в фотосинтезе; обеспечивает поддержку и хранит воду и сахар
- интеркалярная меристема
- ткань меристемы, расположенная в узлах и основаниях листовых пластинок; встречается только в однодольных
- боковая меристема
- меристематическая ткань, позволяющая растению увеличиваться в толщине или обхвате
- ткань меристемы
- ткань, содержащая клетки, которые постоянно делятся; способствует росту растений
- меристема
- растение область непрерывного роста
- постоянная ткань
- ткань растения, состоящая из клеток, которые больше не делятся активно
- корневая система
- Подземная часть растения, поддерживающая растение и поглощающая воду и минералы
- стреляющая система
- надземная часть завода; состоит из непродуктивных частей растений, таких как листья и стебли, и репродуктивных частей, таких как цветы и плоды
- сосудистый пучок
- нитей стволовой ткани, состоящей из ксилемы и флоэмы
- сосудистая стела
- нити корневой ткани, состоящей из ксилемы и флоэмы
- сосудистая ткань
- ткань, состоящая из ксилемы и флоэмы, которая транспортирует пищу и воду по всему растению
Рост органов растений | Журнал экспериментальной ботаники
Коллекция
Статьи, отобранные Хильде Нелиссен и Натали Гонсалес
Введение
Этот виртуальный выпуск журнала Journal of Experimental Botany был составлен для сопровождения поддержки журналом Симпозиума по выращиванию органов в Бордо, Франция (24-26 апреля 2019 г.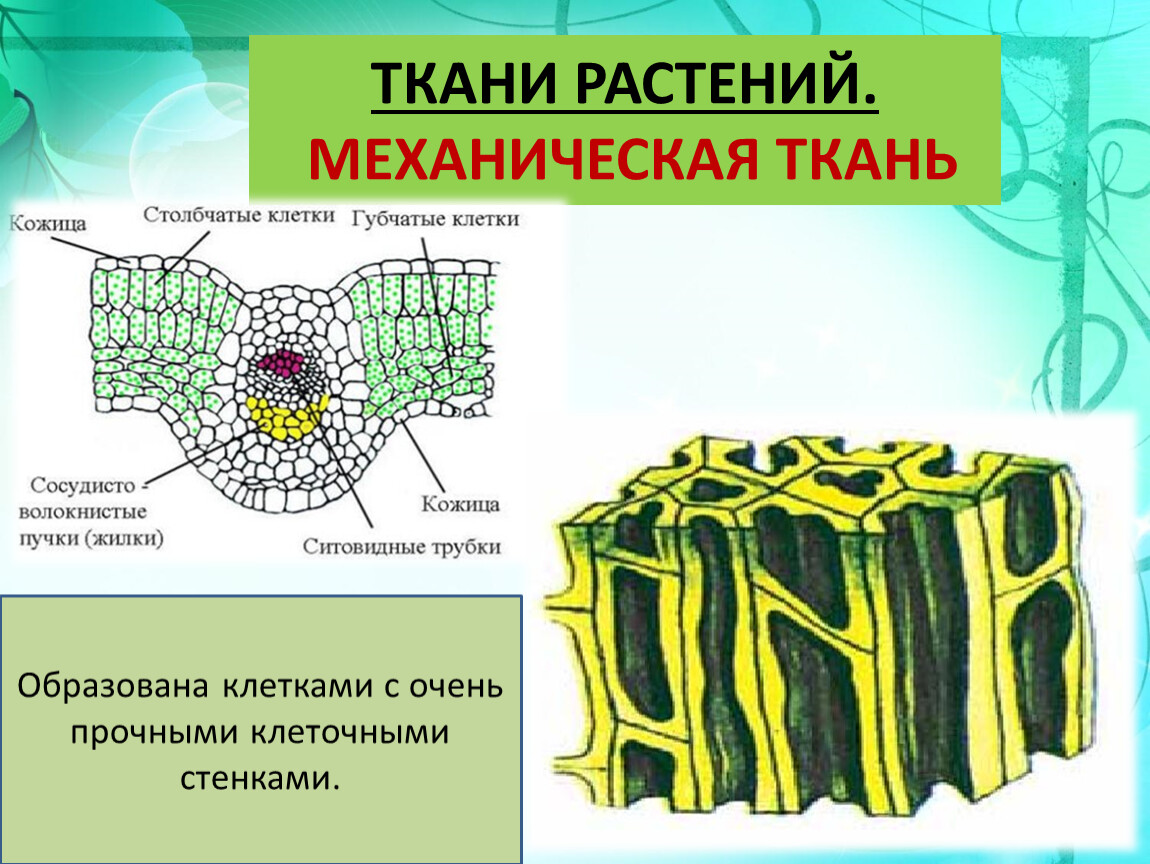 ).Это будет «живой» виртуальный выпуск — будущие рукописи JXB на тему роста органов растений, включая специальный выпуск, который будет опубликован в 2020 году, будут добавляться по мере их публикации.
).Это будет «живой» виртуальный выпуск — будущие рукописи JXB на тему роста органов растений, включая специальный выпуск, который будет опубликован в 2020 году, будут добавляться по мере их публикации.
Рост и развитие растений — это сложные, динамичные и многофакторные события, которые требуют разномасштабных и междисциплинарных подходов для выявления различных игроков, участвующих в их регулировании. Кроме того, рост не только регулируется внутренними сигналами, но также зависит от внешних сигналов, что подразумевает существование сложной и взаимосвязанной сети регуляторов, объединяющих все сигналы для стимулирования и / или адаптации роста.Этот виртуальный выпуск знакомит с активными исследованиями и техническими разработками, которые помогают создать целостное представление о регуляции роста органов растений, что представляет большой интерес с учетом растущей потребности в продуктах растительного происхождения.
Экстра ботаника
Редакция виртуального выпуска
Понимание роста органов растений: мультидисциплинарная область
Хильде Нелиссен, Натали Гонсалес
Рост и развитие растений — это сложные, динамичные и многофакторные события, которые требуют многомасштабных и междисциплинарных подходов для выявления различных игроков, участвующих в их регулировании. Кроме того, рост не только регулируется внутренними сигналами, но также зависит от внешних сигналов, что подразумевает …
Кроме того, рост не только регулируется внутренними сигналами, но также зависит от внешних сигналов, что подразумевает …
Общий рост органов
Отзывы
Математические принципы и модели механики роста растений: от динамики клеточной стенки к морфогенезу тканей
Euan T Smithers et al.
Исследование роста растений представляет собой каталог сложных открытых вопросов. Мы утверждаем, что рост растений — это в высшей степени механический процесс, и что математика дает основу для исследования его фундаментальных нераскрытых механизмов. Этот обзор служит для иллюстрации биологических открытий, сделанных …
Растения растут с небольшой помощью своих друзей-органелл
Джудит Ван Дингенен и др.
Хлоропласты и митохондрии незаменимы для развития растений. Они не только обеспечивают клетки энергией и углеродными источниками, но и превратились в основных участников различных процессов, таких как метаболизм аминокислот, биосинтез гормонов и передача клеточных сигналов. Как полуавтономные органеллы они …
Производство ауксина как интегратор сигналов окружающей среды для регулирования роста
Souad Mroue et al.
Будучи сидячими организмами, растения выработали механизмы, позволяющие им контролировать свой рост и развитие в ответ на изменения окружающей среды. Это происходит посредством сложных взаимодействующих сигнальных сетей, которые объединяют различные сигналы окружающей среды в скоординированные и строго регулируемые реакции. Ауксин — это …
Ауксин — это …
Освобождая тормоза роста растений: как GA останавливают белки DELLA
стр.Ахард, П. Генщик
Биоактивные гиббереллины (ГА) представляют собой тетрациклические дитерпеноидные гормоны растений, которые способствуют важным процессам роста и развития растений, таким как прорастание семян, рост за счет удлинения и переход цветков. Таким образом, мутантные растения, на которые влияют биосинтез или передача сигналов GA, демонстрируют измененное прорастание семян …
Регулирование роста и развития растений дуэтом ФАКТОРА, РЕГУЛИРУЮЩЕГО РОСТ и ВЗАИМОДЕЙСТВУЮЩИЙ с GRF ФАКТОР
Jeong Hoe Kim, Hirokazu Tsukaya
Факторы транскрипции являются ключевыми регуляторами экспрессии генов и играют решающую роль во всех аспектах жизни организмов. Следовательно, идентификация и функциональная характеристика факторов транскрипции является необходимым шагом к пониманию жизни. В этой статье рассматриваются молекулярные и биологические функции двух …
Следовательно, идентификация и функциональная характеристика факторов транскрипции является необходимым шагом к пониманию жизни. В этой статье рассматриваются молекулярные и биологические функции двух …
Последние достижения в исследованиях ауксина в рисе и их значение для улучшения сельскохозяйственных культур
Yidong Wang et al.
Ауксин необходим для различных аспектов развития растений, и модуляция путей ауксина имеет большой потенциал для улучшения сельскохозяйственных культур.Хотя текущее понимание биологии ауксина, включая биосинтез, транспорт и передачу сигналов ауксина, в основном возникло из исследований на Arabidopsis, несколько ключевых генов ауксина были …
Исследования
Функциональная характеристика фактора транскрипции Arabidopsis bZIP29 показывает его роль в развитии листьев и корней
Jelle Van Leene et al.
Факторы транскрипции bZIP группы I растений описаны в основном из-за их роли во время развития сосудов и осмосенсорных реакций. Интересно, что bZIP29 был идентифицирован во взаимодействии клеточного цикла, что указывает на дополнительные функции bZIP29 в развитии растений. Здесь bZIP29 функционально охарактеризован как …
БОЛЬШИЕ ОРГАНЫ и СЛОНОВЫЙ УХОПОДОБНЫЙ ЛИСТ1 контролируют размер органа и внутреннюю асимметрию цветкового органа у гороха
Xin Li et al.
Контроль размера и формы органов посредством клеточной пролиферации и размножения клеток является фундаментальным процессом во время развития растений, но молекулярные механизмы, которые определяют окончательный размер и форму определенных органов у растений, остаются неясными, особенно у бобовых. В этом исследовании мы охарактеризовали несколько мутантов, включая более крупные …
В этом исследовании мы охарактеризовали несколько мутантов, включая более крупные …
Рост корней
Отзывы
Эволюция ветвления корня: повышение уровня пластичности
Ханс Мотте, Том Бикман
Корни и корневые системы растений незаменимы для получения воды и питательных веществ и являются важным эволюционным достижением для растений, позволяющих им справляться с условиями суши.Способность корней ветвиться в значительной степени способствует их способности исследовать почву в поисках воды и питательных веществ, что привело ~ 400 миллионов лет назад к …
Формирование бокового корня и множественные роли ауксина
Yujuan Du, Бен Шерес
Корневые системы могут отображать изменяемую архитектуру, которая способствует стратегиям выживания растений. Модельное растение Arabidopsis thaliana обладает системой стержневого корня, в которой главный корень и боковые корни (LR) являются основными архитектурными детерминантами. Фитогормон ауксин выполняет несколько функций в LR …
Модельное растение Arabidopsis thaliana обладает системой стержневого корня, в которой главный корень и боковые корни (LR) являются основными архитектурными детерминантами. Фитогормон ауксин выполняет несколько функций в LR …
Переговоры по гормонам растений: стержень роста корней
Elena Pacifici et al.
Неопределенный рост корня и его выдающаяся способность к непрерывному образованию новых тканей делают этот орган высокодинамичной структурой, способной быстро реагировать на внешние раздражители.Следовательно, процессы развития должны быть точно настроены, и гормональные перекрестные помехи играют ключевую роль в регуляции корневых …
Подземный тюнинг: количественная регуляция роста корней
Сантош Б. Сатбхай и др.
Сатбхай и др.
Растения обладают высокой степенью фенотипической пластичности, что позволяет им адаптировать свою форму и функции к изменяющимся условиям окружающей среды.В корневой системе растения появились механизмы, позволяющие закрепить растение и эффективно исследовать почву в поисках почвенных ресурсов. Ключ к этому — огромная способность к пластичности, кратной …
Исследования
Линия фенотипирования выявила основной QTL роста корней проростков у гексаплоидной пшеницы
Джонатан А.Аткинсон и др.
Было показано, что признаки корней проростков пшеницы ( Triticum aestivum L.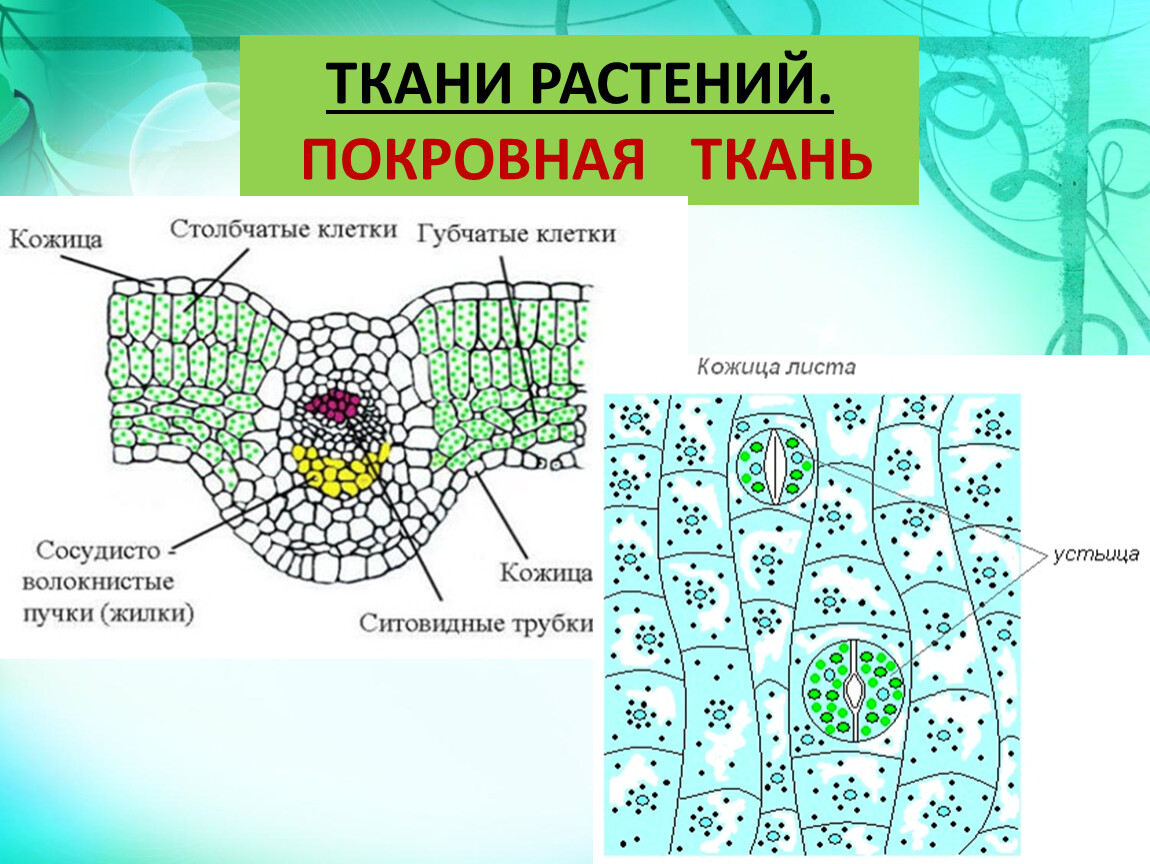 ) важны для эффективного укоренения и связаны с такими качествами зрелых растений, как высота и урожайность. Был разработан конвейер фенотипирования корней, состоящий из бумажного экрана прорастания в сочетании с программным обеспечением для сегментации и анализа изображений, и …
) важны для эффективного укоренения и связаны с такими качествами зрелых растений, как высота и урожайность. Был разработан конвейер фенотипирования корней, состоящий из бумажного экрана прорастания в сочетании с программным обеспечением для сегментации и анализа изображений, и …
Интенсивное полевое фенотипирование кукурузы (
Zea mays L.) корневые коронки идентифицируют фены и интеграцию фенов, связанную с ростом растений и поглощением азотаЛарри М. Йорк, Джонатан П. Линч
Корневая архитектура является важным регулятором поступления азота (N). Существующие методы фенотипирования корневой архитектуры зерновых культур обычно ограничиваются проростками или внешними корнями зрелых корневых венцов.Функциональная интеграция корневых фенолов изучена недостаточно. В этом исследовании интенсивное фенотипирование …
В этом исследовании интенсивное фенотипирование …
Количественное изучение вариаций скорости роста корней: вопрос пролиферации или размножения клеток?
Chvan Youssef et al.
Рост органов растения является результатом производства и размножения клеток.Расшифровка вклада каждого из этих процессов в скорость роста — важный вопрос биологии развития. Здесь мы исследовали клеточные процессы, определяющие скорость удлинения корня, учитывая два источника вариаций: генотип и …
Миозин XI-K участвует в органогенезе корней, полярном транспорте ауксина и делении клеток
Mohamad Abu-Abied et al.
Взаимодействие между процессами, опосредованными миозином и ауксином, было исследовано путем отслеживания развития корней у мутанта с тройным нокаутом миозина xi-k xi-1 xi-2 (3KO). Было обнаружено, что растения 3KO генерировали значительно больше боковых и придаточных корней, чем растения дикого типа или спасенная линия растений, экспрессирующих …
Было обнаружено, что растения 3KO генерировали значительно больше боковых и придаточных корней, чем растения дикого типа или спасенная линия растений, экспрессирующих …
Особая роль железа в стимулировании деления меристематических клеток во время формирования придаточных корней
Александр Хило и др.
Образование придаточных корней (AR) характеризуется последовательностью физиологических и морфологических процессов и определяется внешними факторами, в том числе минеральным питанием, влияние которых остается в значительной степени неуловимым. Морфолого-анатомическая оценка влияния минеральных элементов на формирование АО у листовых …
AtCSLD3 и GhCSLD3 опосредуют рост корней и удлинение клеток ниже пути этиленового ответа у Arabidopsis
Huizhen Hu et al.
CSLD3 , ген семейства D, подобного целлюлозосинтазе, влияет на удлинение корневых волосков, но его взаимодействия с передачей сигналов этилена и фосфатным голоданием плохо изучены. Здесь мы стремимся понять роль CSLD3 в контексте сигнальных путей этилена и фосфатного голодания у растений Arabidopsis …
Рост цветочных органов (включая рост фруктов и семян)
Обзор информационного бюллетеня о цветении
Рассмотрение роли генов MADS-бокса в развитии и разнообразии цветков однодольных растений
Синди Калленс и др.
Многие однодольные растения имеют высокую социальную и экономическую ценность. К ним относятся травы, такие как рис (Oryza sativa), пшеница ( Triticum aestivum ) и ячмень ( Hordeum vulgare ), из которых производят мягкие продукты для многих предприятий пищевой промышленности и производства напитков, а также декоративные цветы, такие как лилия ( Lilium longiflorum ). ) и орхидеи …
К ним относятся травы, такие как рис (Oryza sativa), пшеница ( Triticum aestivum ) и ячмень ( Hordeum vulgare ), из которых производят мягкие продукты для многих предприятий пищевой промышленности и производства напитков, а также декоративные цветы, такие как лилия ( Lilium longiflorum ). ) и орхидеи …
Отзывы
Засуха влияет на аборты репродуктивных органов, усугубляя процессы, обусловленные развитием, за счет экспансивного роста и гидравлики
Оливье Турк, Франсуа Тардье
Аборт репродуктивных органов является основным ограничивающим фактором урожайности в условиях дефицита воды, но также является признаком, выбранным эволюционными процессами. Самые молодые репродуктивные органы должны быть подвержены аборту, чтобы более старые органы могли завершить свое развитие в случае ограниченных ресурсов. Дефицит воды увеличивается естественный …
Самые молодые репродуктивные органы должны быть подвержены аборту, чтобы более старые органы могли завершить свое развитие в случае ограниченных ресурсов. Дефицит воды увеличивается естественный …
Гены, связанные с ростом плодов томата
Lamia Azzi et al.
Помидор ( Solanum lycopersicum Mill.) представляет собой модельный вид для всех мясистых плодов из-за своего биологического цикла и наличия многочисленных генетических и молекулярных ресурсов. Его важность в питании человека сделала его одним из самых ценных товаров во всем мире. Размер плодов томатов получается в результате комбинации …
Контроль формирования паттерна, роста и дифференциации с помощью генов идентичности цветочных органов
Роберт Сабловски
Несмотря на различную морфологию чашелистиков, лепестков, тычинок и плодолистиков, все эти цветочные органы считаются модифицированными версиями основного органа, подобного листу. Модификации основной программы развития управляются различными комбинациями транскрипции MADS-домена …
Модификации основной программы развития управляются различными комбинациями транскрипции MADS-домена …
Накормить мир: повышение эффективности фотосинтеза для устойчивого растениеводства
Эндрю Дж Симкин и др.
Ряд недавних исследований предоставили убедительную поддержку, демонстрирующую, что улучшение фотосинтетических процессов с помощью генной инженерии может обеспечить путь для повышения потенциала урожайности.Основное внимание в этом обзоре уделяется совершенствованию цикла Кальвина-Бенсона и транспорта электронов. Также учитывается …
Insight
Трансгенные решения для повышения урожайности и стабильности пшеницы: светлая надежда или вспышка в чаше?
José L Araus et al.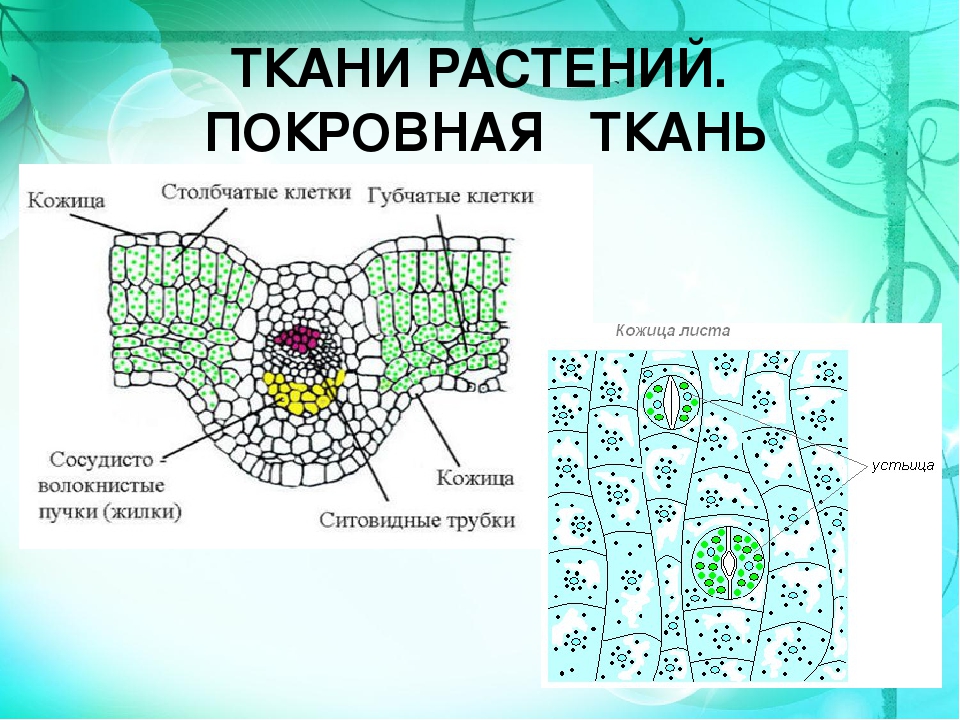
Трансгенные культуры второго поколения могут трансформировать сельское хозяйство, но прогресс был ограниченным, особенно в отношении пшеницы, для которой еще не утвержден трансгенный сорт.Приняв вызов, González et al. (2019) сообщают, что …
Исследования
Выращенная в полевых условиях трансгенная пшеница, экспрессирующая ген подсолнечника
HaHB4 , значительно превосходит урожай дикого типаФернанда Габриэла Гонсалес и др.
HaHB4 представляет собой фактор транскрипции подсолнечника, принадлежащий к семейству гомеодомена-лейциновой молнии I, эктопическая экспрессия которого у Arabidopsis вызывает засухоустойчивость. Использование ПЦР для клонирования кодирующей последовательности HaHB4 для трансформации пшеницы вызвало незапрограммированные мутации, вызывающие незначительные различия в ее активации …
Использование ПЦР для клонирования кодирующей последовательности HaHB4 для трансформации пшеницы вызвало незапрограммированные мутации, вызывающие незначительные различия в ее активации …
AINTEGUMENTA и циклин D-типа CYCD3; 1 независимо вносят вклад в контроль размера лепестков у Arabidopsis : свидетельство того, что компенсация размера органа является возникающей, а не определяемой характеристикой
Рикардо С.Randall et al.
Рост боковых надземных органов растений (LAO) определяется количеством и размером клеток, составляющих орган. Генетическое изменение одного параметра часто сопровождается изменениями другого, так что общее влияние на конечный размер LAO сводится к минимуму; предполагается, что это вызвано компенсацией на уровне активного органа . ..
..
Моделирование роста винограда в зависимости от потоков углерода и воды всего растения
Junqi Zhu et al.
Рост мясистых плодов все еще плохо изучен из-за сложной интеграции потоков воды и растворенных веществ, структурных свойств клеток и регуляции взаимоотношений источника-поглотителя в целом растения. Чтобы выяснить, как эти процессы влияют на рост ягод, мы создали биофизический виноград ( Vitis vinifera, л.) …
DORNRÖSCHEN, DORNRÖSCHEN-LIKE и PUCHI избыточно контролируют идентичность цветочной меристемы и инициацию органов у Arabidopsis
JW Chandler, W Werr
Двухфазный переход цветков у Arabidopsis thaliana включает в себя множество повторяющихся пересекающихся регуляторных сетей. Связанные факторы транскрипции AP2 DORNRÖSCHEN ( DRN ), DORNRÖSCHEN -LIKE ( DRNL ) и PUCHI индивидуально выполняют хорошо охарактеризованные функции в различных …
Связанные факторы транскрипции AP2 DORNRÖSCHEN ( DRN ), DORNRÖSCHEN -LIKE ( DRNL ) и PUCHI индивидуально выполняют хорошо охарактеризованные функции в различных …
FZP определяет размер зерна и судьбу стерильной леммы риса
Deyong Ren et al.
У травы колоск — это уникальная структура соцветия, которая напрямую определяет урожайность зерна.Несмотря на большое количество исследований, молекулярные механизмы развития колосков до конца не изучены. В исследовании FZP кодирует белок домена ERF и функционирует в размере зерна и идентичности стерильной леммы …
Высокие дневные и ночные температуры влияют на динамику роста зерна у контрастных генотипов риса
Wanju Shi et al.
По прогнозам, урожайность и качество зерна риса будут сильно уязвимы к глобальному потеплению.Пять генотипов, включая термостойкие и чувствительные чеки, теплостойкую, почти изогенную линию и два гибрида, подвергались контролю (31 ° C / 23 ° C, день / ночь), высокой ночной температуре (HNT; 31 ° C). / 30 ° C), дневной высокий …
AGAMOUS MADS-box белок, SlMBP3, регулирует скорость разжижения плаценты и контролирует образование семян в томате
Jianling Zhang et al.
AGAMOUS (AG) MADS-box факторы транскрипции, как было показано, играют решающую роль в развитии органов цветка и плодов у покрытосеменных. Здесь мы выделили ген AG MADS-box SlMBP3 томата ( Solanum lycopersicum ) и обнаружили, что он преимущественно экспрессируется в цветках и во время раннего развития плодов …
Здесь мы выделили ген AG MADS-box SlMBP3 томата ( Solanum lycopersicum ) и обнаружили, что он преимущественно экспрессируется в цветках и во время раннего развития плодов …
Рост листьев и стеблей
Отзывы
Интерактом клеточного цикла: источник регуляторов роста?
Джонас Бломм и др.
Когда растения развиваются, пролиферация и разрастание клеток строго контролируются для создания органов с определенным конечным размером, таких как листья. Несколько исследований продемонстрировали важность фазы пролиферации клеток для роста листа, демонстрируя, что регуляция клеточного цикла имеет решающее значение для правильного листа …
Рост и биомеханика органов побега
Эмили Эчевин и др.
Органы растений возникают в результате сложных взаимодействий между биологическими и физическими факторами, контролирующими морфогенез. Несмотря на огромный прогресс в понимании генетики, лежащей в основе развития, мы гораздо меньше знаем о том, как механические силы контролируют рост растений. За последние годы появилось новое …
Молекулярные системы, управляющие ростом листа: от генов к сетям
Натали Гонсалес, Дирк Инзе
Arabidopsis Рост листа состоит из сложной последовательности взаимосвязанных событий, включающих деление и размножение клеток, и требующих нескольких уровней генетической регуляции. С помощью классической генетики было идентифицировано множество регуляторов роста листьев, но картина далеко не полная. С учетом последних достижений …
С помощью классической генетики было идентифицировано множество регуляторов роста листьев, но картина далеко не полная. С учетом последних достижений …
Исследования
Белки Arabidopsis HD-Zip II регулируют выход из разрастания во время развития листьев в тени навеса.
Моника Карабелли и др.
Реакция избегания тени в основном проявляется в увеличении удлинения растения за счет расширения листьев и корней.Несмотря на успехи в понимании механизмов, лежащих в основе удлинения гипокотиля, вызванного оттенком, мало что известно о реакциях на моделирование тени в органах, отличных от гипокотиля. В …
HEADLESS , гомолог WUSCHEL , раскрывает новые аспекты регуляции меристемы побегов и развития листовых пластинок у Medicago truncatula
Журнал экспериментальной ботаники , том 70, выпуск 1, 1 января 2019 г. , страницы 149-163, https: // doi.org / 10.1093 / jxb / ery346
, страницы 149-163, https: // doi.org / 10.1093 / jxb / ery346
Формирование и поддержание апикальной меристемы побега (SAM) имеют решающее значение для развития растений. Однако лежащий в основе молекулярный механизм регуляции активности меристематических клеток плохо изучен в модельной бобовой Medicago truncatula . Используя прямые генетические подходы, мы идентифицировали HEADLESS ( HDL ), гомолог…
Сочетание высокопроизводительного фенотипирования микро-CT-RGB и общегеномного исследования ассоциации для анализа генетической архитектуры роста побегов риса
Di Wu et al.
Ручное фенотипирование возделывателей риса занимает много времени и трудозатратно и отстает от быстрого развития функциональной геномики риса.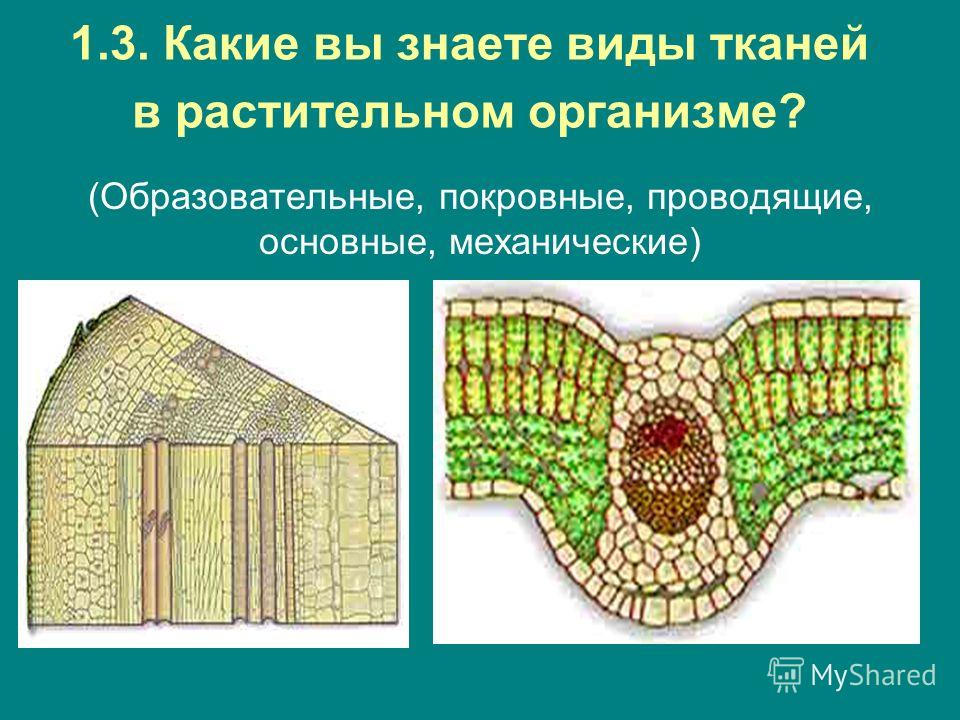 Таким образом, автоматизированные неразрушающие методы фенотипирования признаков побегов риса с высоким пространственным разрешением и высокой производительностью для крупномасштабной оценки образцов риса составляют …
Таким образом, автоматизированные неразрушающие методы фенотипирования признаков побегов риса с высоким пространственным разрешением и высокой производительностью для крупномасштабной оценки образцов риса составляют …
ScGAI — ключевой регулятор развития стебля сахарного тростника
Рафаэль Гарсия Таварес и др.
Сахарный тростник составляет более 70% производства сахара и является вторым по величине сырьем для производства этанола в мире.Поскольку сахар накапливается в стебле сахарного тростника, его биомасса и содержание сахарозы являются наиболее важными с коммерческой точки зрения характеристиками. Несмотря на обширное разведение, прогресс как в урожайности тростника, так и в содержании сахара …
Инструменты
Отзывы
Новые инструменты для количественной оценки вторичного роста
Анна Вундерлинг и др.
Вторичный рост происходит у двудольных и голосеменных растений, что приводит к увеличению обхвата органов растений. Его движет прежде всего сосудистый камбий, который производит тысячи клеток на протяжении всей жизни нескольких видов растений. Например, даже в небольшом модельном травянистом растении Arabidopsis ручной …
Новые стратегии фенотипирования на основе изображений для анализа перекрестных помех в развитии растений
Симон Фраас, Хартвиг Лютен
В эпоху геномики, протеомики и метаболомики доступно большое количество мутантов.Открытие их фенотипов быстро становится узким местом молекулярной физиологии растений. Этот кризис можно преодолеть с помощью фенотипирования на основе изображений, нового, быстро развивающегося и инновационного подхода, объединяющего растения …
Этот кризис можно преодолеть с помощью фенотипирования на основе изображений, нового, быстро развивающегося и инновационного подхода, объединяющего растения …
Фенотипирование корня: от лабораторного признака к селекции
René C.P. Kuijken et al.
За последнее десятилетие более дешевые и быстрые методы секвенирования привели к огромному увеличению геномных данных.Высокопроизводительное генотипирование, генотипирование путем секвенирования и геномная селекция становятся стандартом селекции растений. В результате сбор фенотипических данных становится все более ограничивающим фактором для …
Мнение эксперта
Функциональные феномены: развивающаяся область, объединяющая высокопроизводительное фенотипирование, физиологию и биоинформатику
Ларри М.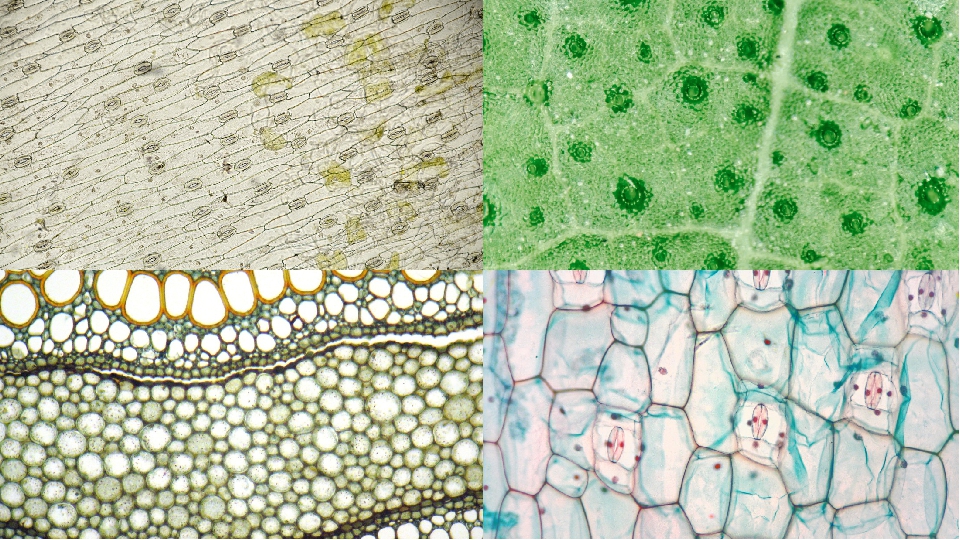 Йорк
Йорк
Появление функциональной феномики означает возрождение физиологии как науки 21 века за счет использования передовых сенсорных технологий и анализа больших данных.Функциональная феномена направлена на восполнение значительных пробелов в знаниях, которые все еще существуют в отношении отношения фенотипа растения к функции. Здесь …
Исследования
Макрооптическая проекционная томография для крупномасштабной трехмерной визуализации структур растений и активности генов
Карен Дж. И. Ли и др.
Оптическая проекционная томография (ОПТ) — это хорошо зарекомендовавший себя метод визуализации активности генов у растений и животных. Однако ограничение обычного OPT состоит в том, что верхний предел размера образца не позволяет его применить к более крупным конструкциям. Для решения этой проблемы мы создали макроверсию под названием Macro OPT …
Однако ограничение обычного OPT состоит в том, что верхний предел размера образца не позволяет его применить к более крупным конструкциям. Для решения этой проблемы мы создали макроверсию под названием Macro OPT …
Портативная система визуализации для флуоресцентной спектроскопии для автоматического фенотипирования корней в кернах почвы в поле
Антон Вассон и др.
Признаков корневой архитектуры — цель предварительных селекционеров.Включение признаков корневой архитектуры в новые сорта требует фенотипирования. Это привлекательно для быстрого и непосредственного фенотипирования корневой архитектуры в полевых условиях, избегая лабораторных исследований, которые могут не применяться в полевых условиях. Комбинация керна почвы с . ..
..
Внутренняя и внешняя регуляция стехиометрии органов растений
Внутренние различия между органами растений вызваны функциональной дифференциацией тканей растения, тогда как скорость поступления элементов извне ограничивает усвоение питательных веществ.Предыдущие исследования были сосредоточены на стехиометрической реакции листвы или всего растения на окружающую среду, в то время как исследование сравнений по органам все еще продолжается. Мы исследуем соотношение C: N: P стеблей, листьев, диаспор и подземных органов у болотных растений и оцениваем влияние ограничений окружающей среды с помощью стандартизированной регрессии по большой оси (SMA). Для объединенного набора данных SMA привела к различным образцам изометрических и анизометрических наклонов между органами растений. Аппарат двумерной линии для разделенного набора данных по четырем экологическим группам показал, что виды часто затопляемых болот имеют более высокие отношения N: C, чем виды редко затопляемых болот.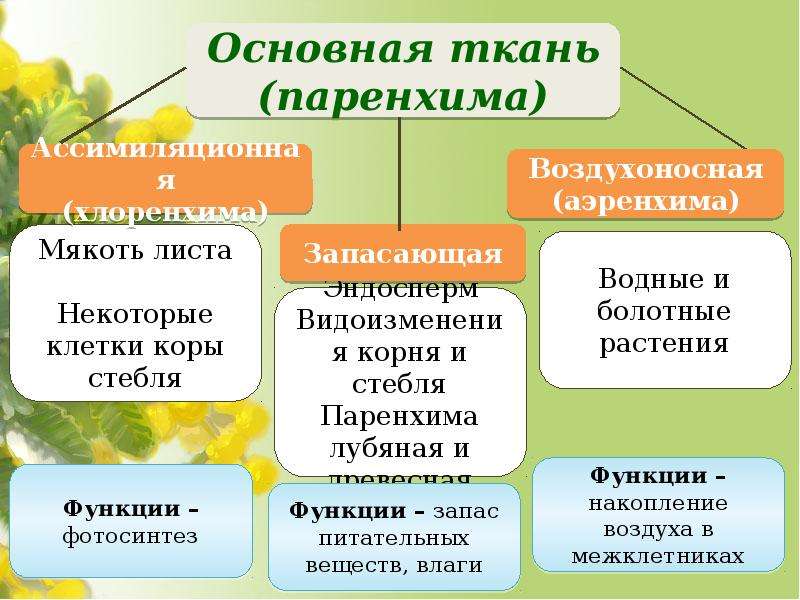 Влияние доступности питательных веществ было обнаружено в пониженном соотношении P: C и увеличении N: P на участках с низким содержанием фосфора. Во всех экологических группах листья и диаспоры показали более высокий элементарный гомеостаз, чем стебли и подземные органы. Любое изменение соотношения N: C подземных органов и диаспор в ответ на окружающую среду сопровождалось еще более сильным внутренним изменением соотношения N: C в стеблях, что указывает на ключевую роль стеблей травянистых растений в процессах экосистемы. Мы обнаружили различные закономерности соотношения C: N: P в органах растений, связанные с их внутренней функцией и внешними ограничениями окружающей среды.Листья и диаспоры показали более высокую степень гомеостаза, чем стебли и подземные органы. Мы обнаружили четкий внешний сигнал в соотношении элементов: элементов в органах растений, при этом низкий уровень фосфора в почве выражается в более низком соотношении фосфора и углерода в тканях и более сильном удерживании азота в листьях в ответ на солевой стресс.
Влияние доступности питательных веществ было обнаружено в пониженном соотношении P: C и увеличении N: P на участках с низким содержанием фосфора. Во всех экологических группах листья и диаспоры показали более высокий элементарный гомеостаз, чем стебли и подземные органы. Любое изменение соотношения N: C подземных органов и диаспор в ответ на окружающую среду сопровождалось еще более сильным внутренним изменением соотношения N: C в стеблях, что указывает на ключевую роль стеблей травянистых растений в процессах экосистемы. Мы обнаружили различные закономерности соотношения C: N: P в органах растений, связанные с их внутренней функцией и внешними ограничениями окружающей среды.Листья и диаспоры показали более высокую степень гомеостаза, чем стебли и подземные органы. Мы обнаружили четкий внешний сигнал в соотношении элементов: элементов в органах растений, при этом низкий уровень фосфора в почве выражается в более низком соотношении фосфора и углерода в тканях и более сильном удерживании азота в листьях в ответ на солевой стресс.
Ключевые слова: Двумерная подгонка линии; соотношение элементов; гипотеза скорости роста; гетеростаз; гомеостаз; стандартизированный анализ большой оси; концентрация питательных веществ в тканях.
Как устроены растения и животные — Живые организмы — Биология KS3 — BBC Bitesize
ГОЛОСОВАНИЕ: Многоклеточные организмы организованы во все более сложные части …
Клетки. Ткани. Органы. Системы органов. И сам организм.
Клетки — это строительные блоки жизни. Ткань образуется, когда специализированные клетки с одной и той же функцией группируются вместе.
Например, миллионы мышечных клеток составляют мышечную ткань.
Орган состоит из двух или более тканей, которые работают вместе для выполнения определенной работы, например, сердце у животных или лист у растения.
Система органов состоит из группы органов, которые работают вместе для выполнения определенной работы, например, носа, трахеи, бронхов и легких, составляющих систему газообмена.
Г-н Шрибман: Да, значит, одна из систем человеческого тела — пищеварительная система. Наш желудок проще, чем у некоторых других животных, например, у коров и оленей несколько желудков, у нас просто один.
Gethin: Итак, как видите, наша пищеварительная система состоит из множества тканей и органов, но в чем разница между ними?
Мистер Шрибман: Итак, да, это некоторые ключевые моменты в вашей школьной программе.
Во-первых, вам нужно знать, что ткань — это группа клеток в одном месте, выполняющих одно и то же. Во рту много клеток, вырабатывающих слюну. Представьте, если бы вся ткань, производящая слюну, исчезла — у вас был бы самый сухой рот в мире.
Gethin: Иногда я понимаю это, когда нервничаю по телевизору, но в любом случае, как насчет органа?
Мистер Шрибман: Итак, здесь есть органы, такие как желудок и печень. Они делают общую работу.Есть удивительный орган, называемый селезенкой, который поможет вам задерживать дыхание под водой дольше, если у вас действительно большой.
У пингвинов массивная селезенка.
В любом случае, вам нужно знать, что орган — это группа различных тканей, работающих вместе для достижения общей цели.
Gethin: Хорошо, понял. Итак, мы знаем, что такое ткань и орган. А как насчет системы?
Шрибман: Система — это группа органов, которые работают вместе для выполнения общей задачи.Итак, наша нервная система — это наш мозг и все наши нервы, и это позволяет нам думать, чувствовать, двигаться, танцевать и так далее.
Наша пищеварительная система позволяет нам есть вкусную пищу, переваривать ее, а значит, расщеплять и усваивать.
Кстати, во Франции есть парень, который однажды съел целый самолет, разбив его на мелкие кусочки, но я бы не советовал это вообще.
Gethin: Это правда? Это потрясающе! Ладно, я бы точно не стал этого делать. Хорошо, давайте подведем итоги по этому поводу.
Г-н Шрибман: Итак, резюмируя, клетки образуют ткани, ткани создают органы, а органы создают системы.
