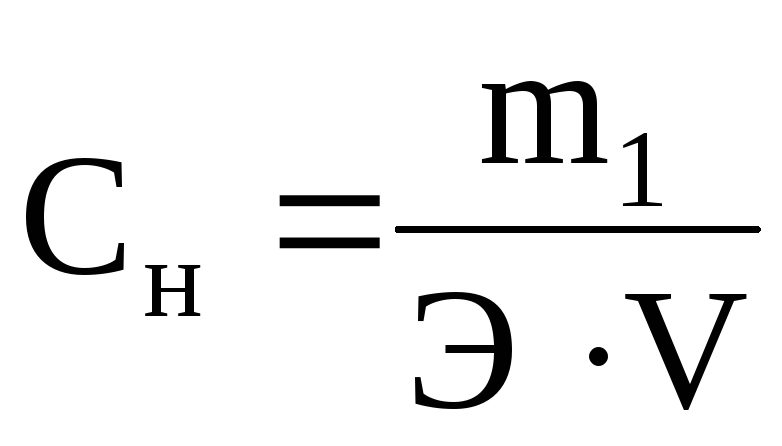Концентрация вещества нормальная — Справочник химика 21
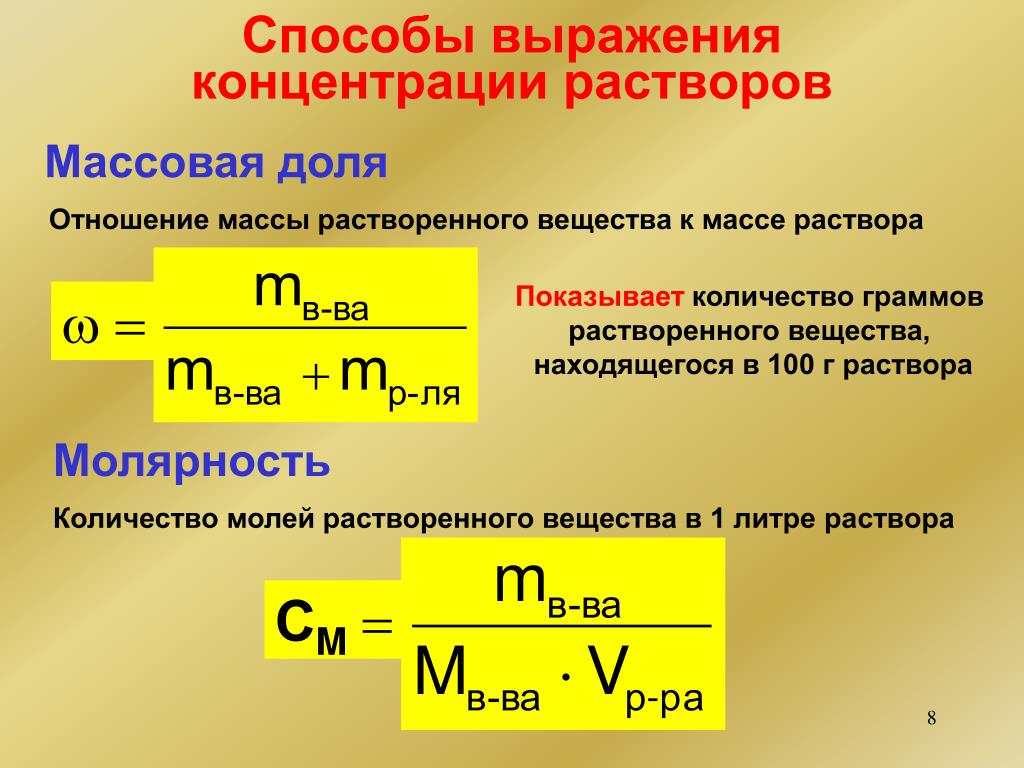
Молярная концентрация вещества эквивалента (1/г )Х в растворе (ранее — нормальность, нормальная концентрация) с[ /г ) X] — отношение количества вещества эквивалента /г )Х к объему раствора [c.117]Нормальной концентрацией (или нормальностью) раствора называют число грамм-эквивалентов растворенного вещества в 1 л раствора. [c.63]
Определите процентную концентрацию вещества в растворе, получившемся в результате электролиза 400 мл 10%-ного раствора едкого натра (плотность 1,1), если известно, что при этом выделилось 56 мл кислорода, измеренного при нормальных условиях. [c.37]
Нормальная концентрация, или нормальность (М), — количество грамм-эквивалентов растворенного вещества в 1 л раствора [c.34]
Основные формулы для вычислений. Число грамм-эквивалентов вещества, находящихся в 1 л раствора, называют нормальностью (или ъор-мальной концентрацией) раствора.
Таким образом, если известна концентрация одного из реагирующих веществ и объемы растворов обоих веществ, участвующих в реакции, можно определить нормальную концентрацию второго раствора, исиользуя формулу (5.8). Такие расчеты проводят при определении концентрации веществ методом титрования. [c.75]
При работах с растворами электролитов удобно пользоваться так называемыми нормальными концентрациями. Нормальным (1 и.) называется раствор, содержащий в литре один эквивалент растворенного вещества. Массу электрона, которую нужно растворить в 1 л, чтобы получить нормальный раствор, находят, умножая его мольную массу на эквивалент. Например, мольная масса Ва(0Н)2 равна 171,3 г/моль, а эквивалент — /г моля для получения 1 н.
При работе с окислителями и восстановителями потеря Получение удобно пользоваться их нормальными концентрация- Веществом [c.291]
Интересно отметить, что, несмотря на пиролиз, концентрация высокомолекулярных нормальных алканов в нефтях, полученных из асфальтенов, не уступает содержанию тех же углеводородов в нативных нефтях типа A . Можно предположить, что относительная величина содержания парафиновых цепей в асфальтенах различных нефтей (как продуктов, менее всего подвергшихся биодеградации) может быть использована в качестве дополнительного критерия определения фациального (генетического) типа нефтей.
Таким же способом можно изучить зависимость между аналитическими концентрациями вещества в двух смежных фазах, если вещество в одной из них ассоциирует, и найти количественный закон ассоциации. Так, например, бензойная кислота в воде имеет нормальный молекулярный вес и почти не диссоциирует на ионы, а в бензоле находится практически полностью в виде двойных молекул. [c.289]
Следует отметить, что применение эквивалентов и нормальной концентрации имеет ряд недостатков. Для нахождения эквивалентов определяемого вещества и реагента необходимо составить уравнение данной реакции титрования. Однако если это сделано, более удобно расчеты вести непосредственно по этому уравнению с помощью молярных концентраций молекул, формульных единиц, ионов определяемого вещества и реагента. Кроме того, для многих веществ эквивалент изменяется при изменении условий протекания взаимодействия, даже при изменении pH раствора. Так, например, для перманганат-ионов в кислой среде г = 5, в нейтральной г = 3 и в сильнощелочной г = 1. Поэтому одновременно с указанием эквивалента следует указывать также все условия, изменение которых может изменить величину эквивалента. К сожалению, не всегда это делается, и часто на практике пользуются найденным эквивалентом также для реакций с другими веществами, что приводит к неверным результатам. Вследствие этого в последнее время предпочитают пользоваться молярной концентрацией молекул, формульных единиц, ионов и не пользоваться молярной концентрацией эквивалентов (нормальной. концентрацией),
Однако если это сделано, более удобно расчеты вести непосредственно по этому уравнению с помощью молярных концентраций молекул, формульных единиц, ионов определяемого вещества и реагента. Кроме того, для многих веществ эквивалент изменяется при изменении условий протекания взаимодействия, даже при изменении pH раствора. Так, например, для перманганат-ионов в кислой среде г = 5, в нейтральной г = 3 и в сильнощелочной г = 1. Поэтому одновременно с указанием эквивалента следует указывать также все условия, изменение которых может изменить величину эквивалента. К сожалению, не всегда это делается, и часто на практике пользуются найденным эквивалентом также для реакций с другими веществами, что приводит к неверным результатам. Вследствие этого в последнее время предпочитают пользоваться молярной концентрацией молекул, формульных единиц, ионов и не пользоваться молярной концентрацией эквивалентов (нормальной. концентрацией),
В нормальной системе противоточной экстракции растворитель, можно насытить веществом В почти до состояния равновесия с составом исходного раствора. Но одновременно растворяется также и некоторое количество вещества А (рафината), что—особенно при низких концентрациях экстрагируемого компонента В в исходном растворе—вызывает большие потери рафината. Применение возврата на стороне отбора экстракта позволяет снизить концентрацию вещества А в конечном экстракте до любого заданного уровня. Поток возврата вымывает вещество А из экстракта и присоединяет его к рафинату, отчего количество рафината увеличивается [31, 61, 76].
[c.153]
Но одновременно растворяется также и некоторое количество вещества А (рафината), что—особенно при низких концентрациях экстрагируемого компонента В в исходном растворе—вызывает большие потери рафината. Применение возврата на стороне отбора экстракта позволяет снизить концентрацию вещества А в конечном экстракте до любого заданного уровня. Поток возврата вымывает вещество А из экстракта и присоединяет его к рафинату, отчего количество рафината увеличивается [31, 61, 76].
[c.153]
Зная, что объемы нормальных растворов веществ, вступивших в реакцию, обратно пропорциональны нормальным концентрациям веществ в растворах, запишем [c.114]
Удобство выражения концентраций через нормальность обусловлено тем, что вещества вступают в реакции в эквивалентных количествах. Поэтому если при смешении двух растворов с нормальностью соответственно Л ] и N2 содержащиеся в них вещества прореагируют без остатка, то справедливо соотношение [c.18]
Процесс любого измерения заключается в сравнении выбранного параметра объекта с аналогичным параметром эталона.
Отношение числа эквивалентов растворенного вещества к объему раствора, выраженному в литрах, или, что то же самое, число эквивалентов растворенного вещества в 1 л раствора называется нормальной концентрацией, или нормальностью. [c.99]
Нормальная концентрация, или нормальность, означает число грамм-эквивалентов вещества, содержащееся в 1 л раствора. [c.111]
На рис. У-28 наряду с сплошными линиями, отражающими изменения температуры и концентрации для нормального технологического режима, пунктирными линиями представлены изменения этих же параметров при уменьшении начальной концентрации основного реагирующего вещества на 5 (кривая с индексом [c. 139]
139]
Было установлено, что при нормальном режиме и подаче в реактор полупродукта, содержащего вещество А в количестве 500 кг/ч с относительной весовой концентрацией Хац= 1 при подаче полупродукта, содержащего вещество В в количестве 525 кг/ч с концентрацией = 0,92, и температуре процесса, равной 18° С, концентрация вещества А в реакционной массе составляла Ха к= 0,025 при рабочем объеме реактора Уд = [c.174]
Установлены нормы предельно допустимых концентраций (ПДК) различных вредных веществ в атмосферном воздухе населенных мест. Различают два вида ПДК — максимально разовую и среднесуточную. Непревышение максимально разовой ПДК при воздействии до 20 мин не вызывает у человека неприятных реакций непревышение среднесуточной предельной концентрации обеспечивает нормальное функционирование человеческого организма.
При тех же материальных потоках, что и в нормальном режиме, опытом было установлено, что концентрация вещества А в реакционной зоне в результате повышения температуры до 23° С понизилась до х д = 0,0154 и вследствие понижения до 15° С повысилась до х 0,0263. Таким образом, в этих опытах [c.175]
Таким образом, в этих опытах [c.175]
Эквивалентная концентрация или нормальность (С или н.) — отношение числа эквивалентов растворенного вещества к объему раствора например, 0,75 н. раствор нли С = 0,75 моль/л. [c.49]
Эквивалентная концентрация, или нормальность, показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора. [c.52]
При переходе от молярных концентраций к нормальным и наоборот следует учитывать число эквивалентов, образующих моль данного вещества. Для растворов соединений типа НС1, KNO3, КОН и др., для которых эквивалент совпадает с молем, молярность и нормальность растворов совпадают. [c.33]
На рис. 10.9 изображено изменение концентрации вещества С в одной из фаз (явления в другой фазе пока не рассматриваются взаимодействие фаз — предмет массопередачи). Примыкающая к границе (7) фазового раздела область, в которой наблюдается изменение С нормально к границе, называется диффузионным пограничным слоем.
 Изменение концентрации от значения на границе до С в ядре фазы происходит плавно. Для удобства анализа и расчета вводят понятие о модельной пограничной пленке с четкими границами и определенной толщиной 5д считают, что в этой пленке сосредоточено все изменение концентрации от С до С, а за пределами пленки (в ядре) концентрация постоянна. Диффузионная пограничная пленка аналогична тепловой (ее толщина т) и ламинарному пристеночному слою (5и) во всех этих пленках невелика роль турбулентного переноса (количества движения, теплоты, вещества), доминирует вклад молекулярного переноса — вязкость, кондукция, а в изучаемых здесь явлениях — диффузия. В общем случае толщина диффузионной пленки 5д не совпадает с и и 8р количественная оценка связи между ними дана в разд.
Изменение концентрации от значения на границе до С в ядре фазы происходит плавно. Для удобства анализа и расчета вводят понятие о модельной пограничной пленке с четкими границами и определенной толщиной 5д считают, что в этой пленке сосредоточено все изменение концентрации от С до С, а за пределами пленки (в ядре) концентрация постоянна. Диффузионная пограничная пленка аналогична тепловой (ее толщина т) и ламинарному пристеночному слою (5и) во всех этих пленках невелика роль турбулентного переноса (количества движения, теплоты, вещества), доминирует вклад молекулярного переноса — вязкость, кондукция, а в изучаемых здесь явлениях — диффузия. В общем случае толщина диффузионной пленки 5д не совпадает с и и 8р количественная оценка связи между ними дана в разд. Молярная концентрация эквивалента (нормальная концентрация) С(Х) — это отношение количества вещества эквивалента, содержащегося в растворе, к объему этого раствора [моль/м ]. На практике нормальную концентрацию по аналогии с молярной выражают в моль/л. Так, например, С(Н2504) = = 1 моль/л или С(КОН) = 0,01 моль/л. При С(В) = 1 моль/л раствор называют нормальным, при С (В) = 0,01 моль/л — санти-нормальным и т. п. Приняты и такие обозначения 1 н. раствор Н2504 0,01 н. раствор КОН. [c.147]
Так, например, С(Н2504) = = 1 моль/л или С(КОН) = 0,01 моль/л. При С(В) = 1 моль/л раствор называют нормальным, при С (В) = 0,01 моль/л — санти-нормальным и т. п. Приняты и такие обозначения 1 н. раствор Н2504 0,01 н. раствор КОН. [c.147]
Таким образом, для того чтобы решить гидродинамическую задачу о движении жидкости с учетом изменения 21 на межфазной поверхности, необходимо предварительно знать распределение концентрации вещества, температуры и заряда на поверхности. Их распределение, в свою очередь, связано с распределением гидродинамических параметров. Таким образом, решение этой задачи требует привлечения уравнений сохранения массы, количества движения, энергии и заряда с соответствующими граничными условиями, отражающими баланс сил на межфазной поверхности равенство тангенциальных сил и скачок нормальных сил, равный капиллярному давлению, а в случае модели Буссинеска — учет поверхностной вязкости слоя. В дальнейшем поверхностная вязкость учитываться не будет. [c.452]
[c.452]
Результаты анализа можно вычислять по титру растворенного вещества в тнтранте. oжнo также выражать концентрацию стандартного раствора через титр определяемого вещества, т, е. числом граммов определяемого вещества, соответствующим 1 мл стандартного раствора. Можно выражать все концентрации через нормальности реагирующих растворов. [c.352]
На практике во многих случаях расчет результатов титриметрических определений удобнее проводить на основе принципа эквивалентности. При этом стехиометрию ки-слотно-основных и окислительно-восстановительных реакций выражают в эквивалентной форме, а эталоном химического взаимодействия служит протон или электрон (см. раздел 2.1 и табл. 2.1 2.2). Все расчеты ведутся через число моль эквивалентов вещества, молярную массу эквивалента и молярную концентрацию эквивалента (нормальную концентрацию ). [c.575]
При обтекании гранулы катализатора потоком реагирующих веществ н продуктов реакции траиспорт вещества к поверхности и от нее в общем случае осуществляется путем мак диффузионного, так и конвекционного (массового) переноса. Первый связан с разными парциальными концентрациями веществ в направлении, нормальном к поверхности (или, иначе, с возникновением градиента концентраций а это М направлении), второй — с перепадом общего давления (с градиентом о бщего давления) в том же напр1авлении, с тепловым эффектом реакции и условиями теплоотвода. [c.6]
Первый связан с разными парциальными концентрациями веществ в направлении, нормальном к поверхности (или, иначе, с возникновением градиента концентраций а это М направлении), второй — с перепадом общего давления (с градиентом о бщего давления) в том же напр1авлении, с тепловым эффектом реакции и условиями теплоотвода. [c.6]
Технологический процесс определяется параметрами, обеспечивающими нормальное его течение. Технологическими параметрами называются измеримые величины, определяющие состояние веществ, образующихся в процессе, и их реакционную снособиэсть. К ним, например, относятся температура и концентрация веществ иа входе в аппарат и выходе из него, состав и дисперсность твердых материалов, давление жидких и газообразных продуктов, скорость движения и количество по-даваемь1х веществ, интенсивность их перемещивания и др. Наиболее важным в химико-технологических процессах являются так называемые интенсивные физико-химические параметры—давление, температура и концентрация веществ. Совокупность технологических параметров определяет технологический режим производства. [c.221]
Совокупность технологических параметров определяет технологический режим производства. [c.221]
Подставляя имеющиеся экспериментальные данные в приведенные уравнения, можно наР1ти один из неизвестных объемов (Уг или I/.). если известны концентрации, выраженные нормальностью (известны N1 и N2). Можно решить и обратную задачу — определить нормальность одного из растворов (Л 1 или N2), если известны объемы растворов реагирующих веществ (известны 1 и У2). [c.200]
При работах с растворами электролитов удобно пользоваться так называемыми нормальными концентрациями. Нормальным (1 н.) называется раствор, содержащий в литре один грамм-эквивалент растворенного вещества. В общем случае грамм-экви-валентные или, как их часто называют, нормальные веса находят, деля грамм-молекулярный вес электролита на число валентных связей между образующими его молекулу ионами. Например, нормальные веса HNO3, Ва(ОН)2, А12(504)з соответстйенно равняются М, М/2 и М/в. Основное преимущество такого способа выражения концентрации электролитов перед другими заключается в том, что при одинаковой нормальности растворов, например. Любая щелочь будет реагировать с любой кислотой в равных объемах. В отношении обозначения концентраций к нормальным растворам относится все сказанное ранее о молярных ( 2). [c.175]
Основное преимущество такого способа выражения концентрации электролитов перед другими заключается в том, что при одинаковой нормальности растворов, например. Любая щелочь будет реагировать с любой кислотой в равных объемах. В отношении обозначения концентраций к нормальным растворам относится все сказанное ранее о молярных ( 2). [c.175]
Молярная концентрация эквивалента (нормальная концентрация)—это отноитение количества вещества эквивалента к объему раствора [c.74]
Платиновый электрод, помещенный в раствор, содержащий хинон м гидрохинон, при определенной концентрации водородных ионов при-О бретает электрический потенциал, который можио измерить, соединив этот электрод через проводящую жидкость с нормальным полуэлемен-тоад, таким, как каломельный или водородный электрод. Потенциал Е электрода органического полуэлемента зависит от концентрации веществ, находящихся в равновесии, т. е. хинона, гидрохинона и водородных ионов, причем эта зависимость выр ажается уравиением [c. 411]
411]
Примерный ионный и солевой состав рассолов, применяемых на содовых заводах, приведен в Приложении. Концентрация солей выражена в так назьшаемых нормальных делениях (нд.). Это измерение концентраций принято на содовых заводах. Одно нормальное деление соответствует 1/20 г-экв вещества в 1 л раствора. Измерение концентраций веществ в грамм-эквивалентах упрощает вычисления, облегчает просмотр и сравнительную оценку технических отчетов и лабораторных сводок. Но во избежание большого количества десятичных знаков при этой системе подсчетов за единицу измерения концентраций раствора берут 1/20 часть грамм-эквивалента, или нормальное деление (нд.). [c.17]
Практически при решении задач теплопереноса весьма часто X к а можно считать не зависящими от температуры. Но вот при переносе импульса в движущейся среде встречаются ситуации, когда пренебрегать нелинейностью нельзя значения ц и V могут существенно зависеть от градиентов скоростей. Это происходит, когда нарущается связь и аи /Эл, заданная формулой Ньютона либо ц не является постоянной величиной из-за происходящих в жидкости структурных деформаций, так что ц зависит от градиента скоростей, либо осуществляется намеренная подмена задачи, когда нелинейные эффекты вихреоб-разования в жидкости выражают в терминах и символах нормального переноса импульса, т. е. в манере формулы (1.9). Такие случаи будут освещены в главе «Гидравлика». При переносе вещества коэффициенты диффузии О также нередко зависят от уровня концентраций С. С этим встречаются, например, при массопереносе в твердых телах (процессы адсорбции, сушки), когда с изменением концентрации вещества в твердом теле изменяются скоростные характеристики диффузии, а иногда и сам механизм массопереноса (по крайней мере, изменяется вклад различных механизмов в перенос вещества). Тогда вместо [c.97]
е. в манере формулы (1.9). Такие случаи будут освещены в главе «Гидравлика». При переносе вещества коэффициенты диффузии О также нередко зависят от уровня концентраций С. С этим встречаются, например, при массопереносе в твердых телах (процессы адсорбции, сушки), когда с изменением концентрации вещества в твердом теле изменяются скоростные характеристики диффузии, а иногда и сам механизм массопереноса (по крайней мере, изменяется вклад различных механизмов в перенос вещества). Тогда вместо [c.97]
Прежде чем молекулы какого-либо вещества адсорбируются из потока газа-носителя, они должны достичь наружной поверхности частиц адсорбента. Это происходит за счет нормальной диффузи11 молекул вещества с газом-носителем. С увеличением концентрации вещества на поверхности адсорбционный фронт проникает внутрь пористого вещества, адсорбент начинает равномерно насыщаться адсорбируемым компонентом из газа-носи-теля. [c.205]
Так как титры многих титрованных растворов не гут быть определены путем деления навески растворенного вещества на объем раствора из-за того, что многие вещества не удовлетворяют основным требованиям, предъявляемым к исходным веществам, то их титры устанавливают по соответствующим исходным веществам путем титрования.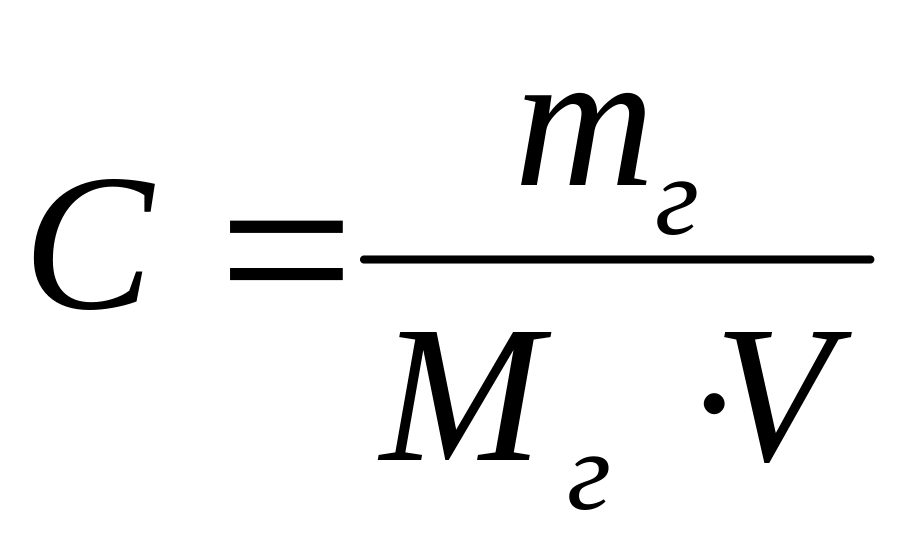 Поскольку объемы реагирующих веществ обратно пропорциональны их концентрациям, то нормальность определяют из отношения объемов. растворов VilV NilNy а поэтому N2= ViN jV2. [c.132]
Поскольку объемы реагирующих веществ обратно пропорциональны их концентрациям, то нормальность определяют из отношения объемов. растворов VilV NilNy а поэтому N2= ViN jV2. [c.132]
Пояснение. 1 мл титранта (титрующего раствора) оттитровы-вает с(/,и(К)К) Л/(/,и(А)А) мг определяемого вещества, где с(Лкв(1 -)Ю — молярная концентрация эквивалента (нормальная концентрация) титранта. Л/(/,ш(А)А) — молярная масса эквивалента определяемого вещества и — фактор эквивалентности приведены в таблице. Если g— навеска анализируемого материала (в мг), V— объем титранта, пошедшего на титрование, то содержание (массовая доля) определяемого вещества (в(А) в % равно [c.580]
На рис. 5.2 приведены кривые нормального распределения результатов определения для различных критериев предельно низких количеств (концентраций) вещества. Открываемому минимуму Х соответствует кривая 2, которая характеризуется доверительной вероятностью Р = 0,5, так как кривая распределения результатов холостого опыта Хыл (кривая /) перекрывает ее наполовину. В данном случае с вероятностью Р = 0,5 имеется риск переоткрыть определяемый компонент, приняв сигнал холостого опыта за аналитический сигнал (погрешность второго рода). Кривая рас-пред еиия результатов 3 соответствует пределу обнаружения Хпред данной аналитической реакции. Предел обнаружения — количество (концентрация) определяемого вещества, которое может быть обнаружено с достаточно большой вероятностью Р. В данном случае Р = 0,997 (трехсигмовый критерий). Так как кривая 3 все же перекрывается кривой / холостого опыта, можно принять сигнал определяемого [c.93]
В данном случае с вероятностью Р = 0,5 имеется риск переоткрыть определяемый компонент, приняв сигнал холостого опыта за аналитический сигнал (погрешность второго рода). Кривая рас-пред еиия результатов 3 соответствует пределу обнаружения Хпред данной аналитической реакции. Предел обнаружения — количество (концентрация) определяемого вещества, которое может быть обнаружено с достаточно большой вероятностью Р. В данном случае Р = 0,997 (трехсигмовый критерий). Так как кривая 3 все же перекрывается кривой / холостого опыта, можно принять сигнал определяемого [c.93]
Вычисление объема раствора серной кислоты через нормальную концентрацию
Сколько миллилитров 96%-ного (по массе): раствора серной кислоты (H2SO4) (р = 1,84 г/мл) нужно взять для приготовления 1 л раствора с молярной концентрацией эквивалента 0,25 моль-экв/л?
Решение задачи
Учитывая, что молярная масса серной кислоты (H2SO4) равна 98 г/моль, найдем молярную массу эквивалента серной кислоты (H2SO4) по формуле:
Напомню то, что молярная масса эквивалента – это масса одного моль эквивалента вещества, равная произведению фактора эквивалентности на молярную массу вещества.

Получаем:
Фактор эквивалентности (fэкв) – число, показывающее какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода (H+) в реакциях обмена или одному электрону в окислительно-восстановительных реакциях.
Найдем сколько серной кислоты (H2SO4) (в г) потребуется для приготовления 1 л раствора серной кислоты (H2SO4) с молярной концентрацией эквивалента 0,25 моль-экв/л. Для расчета будем использовать формулу нахождения нормальной концентрации раствора:
Напомню, что под нормальной концентрацией (молярной концентрацией эквивалента) понимают количество грамм-эквивалентов данного вещества, содержащегося в 1 л раствора. Нормальную концентрацию выражают в моль-экв/л или используют сокращение «н», «N».
Рассчитаем массу 0,25 н серной кислоты (H2SO4) по формуле:
Получаем:
m (H2SO4) = 0,25 ∙ 49 ∙ 1 = 12,25 (г).
Следовательно, в 1 л 0,25 н раствора серной кислоты (H2SO4) содержится 12,25 г серной кислоты (H2SO4).
Используя формулу нахождения массовой доли растворенного вещества:
выразим массу раствора серной кислоты (H2SO4):
Получаем:
m (раствора H2SO4) = 12,25 г/ 0,96 = 12,76 (г).
Если раствор 96-процентный, то массовая доля серной кислоты (H2SO4) в нем 0,96.
Вычислим объем раствора серной кислоты (H2SO4), который потребуется для приготовления 1 л раствора молярной концентрацией эквивалента 0,25 моль-экв/л. Будем использовать формулу, устанавливающую связь между объемом и массой раствора:
Получаем:
V (раствора H2SO4) = 12,76 /1,84 = 6,94 (мл).
Ответ:объем раствора серной кислоты равен 6,94 мл.
Растворы
3. Определяем объём исходного (первого) р-ра MgSO4 с ω = 10 %
Vр-ра = , Vр-ра (MgSO4) =
4. Определяем массу Н2О, которая необходима для разбавления исходного раствора MgSO4.
m (H2O) = 100 – 20 = 80 г или для чистой воды 80 мл.
Ответ: для приготовления 100 г раствора MgSO4 с массовой долей равной
2 % из раствора MgSO4 с массовой долей 10 % и ρ = 1,1 г/мл, необходимо отмерить из бюретки 18,2 мл 10 % р-ра MgSO4, поместить их в колбу, добавить туда цилиндром 80 мл воды и перемешать.
Посуда, применяемая в объемном анализе.
В объемном анализе применяется специальная мерная посуда: бюретки, пипетки и мерные колбы.
Бюретки. Это градуированные стеклянные
трубки, приспособленные для отмеривания
растворов небольшими порциями или отдельными
каплями. Бюретка укрепляется вертикально
в штативе, и отсчет делений ведется сверху
вниз. Нижняя часть бюретки сужена и соединяется
короткой резиновой трубкой с тонким стеклянным
носиком. Бюретки изготавливаются объемом
от 1 до 50мл. Раствор заливают в бюретку
через воронку.
Нижняя часть бюретки сужена и соединяется
короткой резиновой трубкой с тонким стеклянным
носиком. Бюретки изготавливаются объемом
от 1 до 50мл. Раствор заливают в бюретку
через воронку.
Пипетки. Это специальные стеклянные трубки, предназначенные для отмеривания и переноса заданного объема раствора из одного сосуда в другой. При выливании раствора из пипетки, наполненной до метки, объем раствора в точности соответствует маркировке. Наполнение пипетки производят всасыванием раствора резиновой грушей, плотно приставленной к верхнему концу пипетки. Пипетки изготавливаются различных объемов: от 0,1 до 10мл.
Дозаторы. Большое распространение получили более удобные и безопасные в обращении пипетки-дозаторы, гарантирующие высокую точность и воспроизводимость объема измеряемых жидкостей в пределах от 2 до 5000 мкл. Дозатор забирает из химического сосуда тот объем раствора, который предварительно механически установлен на нем.
Мерные колбы. Это колбы с длинным узким горлышком,
на котором наносится кольцевая метка. На колбе указывается объем, который реализуется
при наполнении колбы до метки. Объем мерной
колбы составляет 25, 50, 100, 200, 250, 500, 1000 или
2000мл.
На колбе указывается объем, который реализуется
при наполнении колбы до метки. Объем мерной
колбы составляет 25, 50, 100, 200, 250, 500, 1000 или
2000мл.
Мерные цилиндры. В объемном анализе они используются для приблизительного измерения объемов некоторых вспомогательных растворов или воды и имеют второстепенное значение при необходимости измерения объемов меньшей точности.
Упражнения и ситуационные задачи.
- В медицинской практике используются растворы с точной концентрацией, поэтому для приготовления растворов с нормальной концентрацией необходимо рассчитывать эквивалентные массы кислот, оснований и солей. Рассчитайте MЭ Н3РО4 в реакциях с КОН; МЭ АI(ОН)3 в реакциях с НNО3; МЭ солей Fе(SО4)3, NаНСО3, Fе(ОН)2СI, КАI(SО4)2 · 12Н2О.
- При коньюктивитах применяют в виде глазных капель раствор сульфата цинка. Рассчитайте сколько грамм сульфата цинка и воды необходимо для приготовления 25 мл 0,25% раствора (ρ = 1,02 г/мл)?
- При обезвоживании организма внутривенно вводится 5% раствор глюкозы.
 Рассчитайте как приготовить 400 г 5 % раствора глюкозы из раствора с массовой долей 15 % ?
Рассчитайте как приготовить 400 г 5 % раствора глюкозы из раствора с массовой долей 15 % ? - Для обтирания и компрессов применяют этиловый спирт. Как приготовить 300 мл 40 % раствора спирта из 96 %? (ρ = 0,8 г/мл).
- Для местной анестезии применяется 2% раствор новокаина Как приготовить 600 г 2 % раствора новокаина из раствора с массовой долей 10 % ?
- Для промывания при уретритах и вагинитах как антисептическое средство применяется 0,25 % раствор медного купороса. Рассчитайте сколько грамм CuSO4 · H2O и воды потребуется для приготовления 200 г 0,25 % раствора CuSO4, рассчитанного на безводную соль.
- При кожной практике для обработки эрозий, трещин, избыточных грануляциях используют 0,05% раствор AgNO3 Какую массу AgNO3 надо растворить в 250 г Н2О для получения 0,05 % раствора?
- Вычислите рН и рОН раствора мочи, если Сн+=5*10-7 моль-ион/л (рН 6.3, рОН 7.7)
- рН слюны позволяет быстро контролировать состояние органов пищеварения.
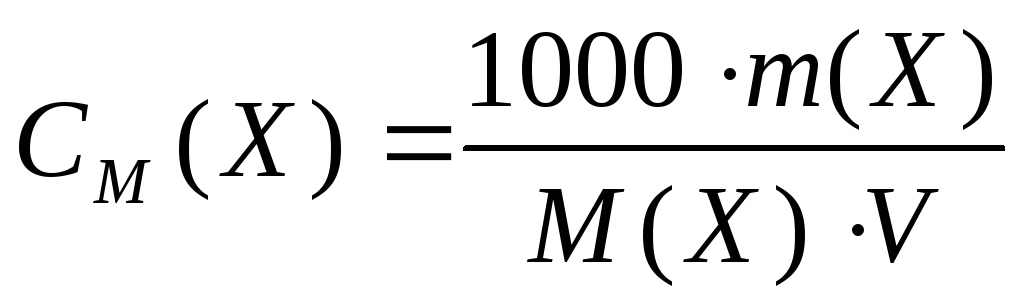 Определите рН слюны, если Сн+=1,9*10-7
моль-ион./ л (рН 6.72).
Определите рН слюны, если Сн+=1,9*10-7
моль-ион./ л (рН 6.72). - Кровь, биологическая жидкость, практически имеющая постоянное значение рН. Отклонение на 0,3 ведет к тяжелому состоянию. Определите рН крови, если Сн++4,4 ·10-8 моль/л. (рН 7.36)
.
Вопросы для самоконтроля
- Раствор как гомогенная система. Растворитель, растворённое вещество. Концентрированные и разбавленные растворы.
- Количественный состав раствора как одна из главных характеристик раствора.
- Роль воды и растворов в жизнедеятельности.
- Физико-химические свойства воды, обуславливающие ее уникальную роль как единственного биорастворителя.
- Способы выражения концентрации растворов: массовая доля вещества в растворе, молярная концентрация, молярная концентрация эквивалента (или нормальная концентрация), массовая концентрация (или титр).
- Химический эквивалент, закон эквивалентов.
- Эквивалентная масса вещества, её связь с молярной массой, фактор эквивалентности.
 Правила расчёта фактора эквивалентности для различных классов неорганических соединений.
Правила расчёта фактора эквивалентности для различных классов неорганических соединений. - Изменения эквивалента вещества (эквивалентной массы) в зависимости от реакций, в которых участвует вещество.
- Зависимость растворимости веществ в воде от соотношения гидрофильных и гидрофобных свойств.
- Растворимость веществ, растворы насыщенные, ненасыщенные и пересыщенные. Влияние на растворимость различных факторов: коэффициент растворимости как количественная характеристика растворимости веществ.
- Физический смысл понятия «идеальный раствор».
Тесты для самоконтроля
ТЕСТ 1
- Выражение ω (СаС12)= 5% означает:
а) 5 г СаС12 растворено в 95 г Н2О, б) 5 г СаС12 растворено в 100 г Н2О,
в) 5 г СаС12 растворено в 1000 г Н2О.
2. Эквивалентная масса меди в соединении СuSO4 равна:
а) 80,0 г/моль, б) 31,75 г/моль,
в) 79,5 г/моль, г) 16 г/моль.
3. Укажите истинный раствор:
а) мел + вода, б) вода + поваренная соль, в) вода + глина,
г) вода + масло.
4. Молярная концентрация показывает:
а) сколько г растворенного вещества содержится в 100 г воды;
б) сколько молей растворенного вещества содержится в 1 л раствора;
в) сколько моль-экв растворенного вещества содержится в 100 мл раствора;
г) сколько мл растворенного вещества содержится в 1000 мл раствора.
5. Эквивалентую массу щавелевой кислоты, вступающей в реакцию c гидроксидом натрия, рассчитывают по следующей формуле:
а) МЭкв=2М, б) МЭкв=М/2, в) МЭкв=М/4, г) МЭкв=М/n.
ТЕСТ 2
1. Нормальная концентрация
– это количество моль
а) 1 л раствора, б) 1 л растворителя, в) 100 г растворителя,
г) 100 г раствора.
2. Титр показывает сколько:
а) г вещества содержится в 1000 мл раствора,
б) г вещества содержится в 1 мл раствора,
в) г вещества содержится
в 100 г раствора.
3. Приведите основную
формулу для определения
а) С1V2= С2 V1, б) С1V1= С2 V2, в) V2= V1
4. Масса хлорида натрия количеством вещества 0,8 моль равна:
а) 58,5 г, б) 46,8 г, в) 29,25 г. г) 56,25г.
5. Массовая доля показывает количество:
а) моль-экв/л;
б) г растворенного вещества на 100 г воды;
в) 1 моль вещества в 1 л раствора;
г) г растворенного вещества в 100 г раствора.
ТЕСТ 3
1. Титр показывает сколько:
а) г вещества содержится в 1000 мл раствора,
б) г вещества содержится в 1 мл раствора,
в) г вещества содержится в 100 г раствора.
2. Эквивалентная масса меди в соединении СuSO4 равна:
а) 80,0 г/моль, б) 31,75 г/моль, в) 79,5 г/моль, г) 16 г/моль.
3. Молярная концентрация
показывает:
Молярная концентрация
показывает:
а) сколько г растворенного вещества содержится в 100 г воды;
б) сколько молей растворенного вещества содержится в 1 л раствора;
в) сколько моль-экв растворенного вещества содержится в 100 мл раствора;
г) сколько мл растворенного вещества содержится в 1000 мл раствора.
4. Приведите основную
формулу для определения
а) С1V2= С2 V1, б) С1V1= С2 V2, в) V2= V1
5. Укажите истинный раствор:
а) мел + вода, б) вода + поваренная соль, в) вода + глина,
г) вода + масло.
ТЕСТ 4
1. Массовая доля показывает количество:
а) моль-экв/л;
б) г растворенного вещества на 100 г воды;
в) 1 моль вещества в 1 л раствора;
г) г растворенного вещества в 100 г раствора.
2. Масса хлорида натрия
количеством вещества 0,8 моль равна:
Масса хлорида натрия
количеством вещества 0,8 моль равна:
а) 58,5 г, б) 46,8 г, в) 29,25 г. г) 56,25г.
3. Эквивалентую массу щавелевой кислоты, вступающей в реакцию c гидроксидом натрия, рассчитывают по следующей формуле:
а) МЭкв=2М, б) МЭкв=М/2, в) МЭкв=М/4, г) МЭкв=М/n.
4. Молярная концентрация показывает:
а) сколько г растворенного вещества содержится в 100 г воды;
б) сколько молей растворенного вещества содержится в 1 л раствора;
в) сколько моль-экв растворенного вещества содержится в 100 мл раствора;
г) сколько мл растворенного вещества содержится в 1000 мл раствора.
- Эквивалент Cu(NO3)2 равен:
а) 188 г/моль; б) 171 г/моль; в) 94 г/моль; г) 114 г/моль.
ТЕСТ 5
1. Приведите основную
формулу для определения
а) С1V2= С2 V1, б) С1V1= С2 V2, в) V2= V1
- Выражение ω (СаС12)= 5% означает:
а) 5 г СаС12 растворено в 95 г Н2О,
б) 5 г СаС12 растворено в 100 г Н2О,
в) 5 г СаС12 растворено в 1000 г Н2О.
- Массовая доля метилового спирта в растворе, содержащем 60 г спирта и 40 г воды равна:
а) 2, б) 0,6, в) 1,5, г) 0,5.
4. При полной нейтрализации Н3РО4 её эквивалент равен:
а) 49 г/моль, б) 98 г/моль, в) 32,6 г/моль, г) 196 г/моль.
5.Методом точной навески можно приготовить раствор:
а) Na2CO3, б) HCl, в) H2SO4, г) KOH.
Ответы к тестам
ТЕСТ 1
№ ВОПРОСА |
1 |
2 |
3 |
4 |
5 |
ОТВЕТ |
а |
а |
б |
б |
б |
ТЕСТ 2
№ ВОПРОСА |
1 |
2 |
3 |
4 |
5 |
ОТВЕТ |
а |
б |
б |
б |
г |
ТЕСТ 3
№ ВОПРОСА |
1 |
2 |
3 |
4 |
5 |
ОТВЕТ |
г |
а |
б |
б |
б |
ТЕСТ 4
№ ВОПРОСА |
1 |
2 |
3 |
4 |
5 |
ОТВЕТ |
г |
б |
б |
б |
в |
ТЕСТ 5
№ ВОПРОСА |
1 |
2 |
3 |
4 |
5 |
ОТВЕТ |
б |
а |
б |
б |
б |
Литература
ЛИТЕРАТУРА ОСНОВНАЯ
- Общая химия.
 Биофизическая химия. Химия биогенных элементов: Учебник для медицинских вузов. /Ю.А. Ершов, В.А. Попков, А.С. Берлянд и другие. Под ред. Ю.А. Ершова, 8 изд.,560 с. – М.: Высш. Шк., 2010.
Биофизическая химия. Химия биогенных элементов: Учебник для медицинских вузов. /Ю.А. Ершов, В.А. Попков, А.С. Берлянд и другие. Под ред. Ю.А. Ершова, 8 изд.,560 с. – М.: Высш. Шк., 2010. - Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учебное пособие для студентов медицинских вузов.(Ред. В.А. Попков).- М., Высшая школа, 4 изд., 239 с., 2008 г.
- Сборник задач и упражнений по общей химии. Учебное пособие. (С.А.Пузаков, В.А. Попков, А.А. Филиппова). М: Высшая школа, 4 изд., 255с., 2010г.
ЛИТЕРАТУРА ДОПОЛНИТЕЛЬНАЯ
- Общая химия. Учебник для медицинских вузов. (В.А. Попков, С.А. Пузаков), 976с.- ГЭОТАР Медиа, 2007г.
Контрольная работа по «Химии» — Контрольная работа
1. Определите массу растворенного вещества и растворителя в 300 г 10 %- ного раствора CaCl2.
Решение:
Масса растворенного вещества определяется по формуле:
[pic 1]
Исходя из того, что
[pic 2]
Рассчитываем массу растворителя:
[pic 3]
2.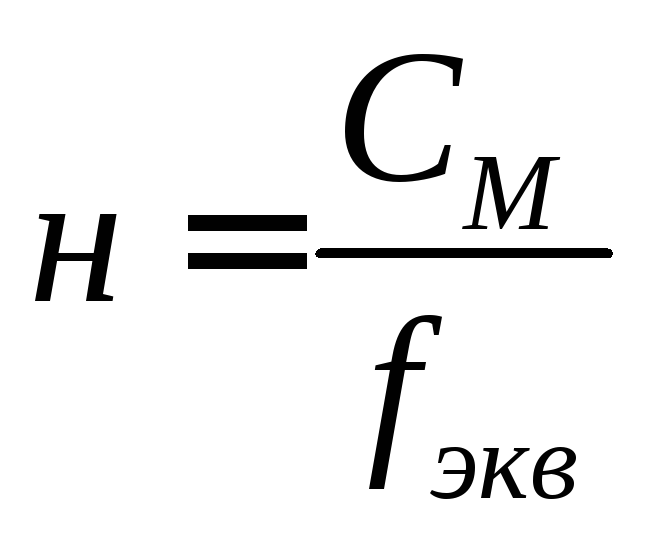 Какое количество соли Na2B4O7·10Н2О и сколько воды надо взять для приготовления 2,3кг 5% раствора Na2B4O7 (в расчете на безводную соль)?
Какое количество соли Na2B4O7·10Н2О и сколько воды надо взять для приготовления 2,3кг 5% раствора Na2B4O7 (в расчете на безводную соль)?
Решение:
Определяем массу растворенной безводной соли в растворе:
[pic 4]
Рассчитываем количество вещества, растворенной соли:
[pic 5]
Так как в состав кристаллогидрата входит одна молекула соли, то
[pic 6]
Рассчитываем массу кристаллогидрата:
[pic 7]
[pic 8]
3. Чему равна нормальная концентрация 18%-ного раствора соляной
кислоты (ρ = 1,09г/мл)?
Решение:
Выведем формулу, связывающую процентную и молярную концентрации:
[pic 9]
Рассчитываем молярную концентрацию соляной кислоты:
[pic 10]
Связь между между нормальной и молярной концентрацией определяется соотношением:
[pic 11]
где f — фактор эквивалентности,
z — число эквивалентности.
Для соляной кислоты z = 1.
Таким образом,
[pic 12]
4. Чему равна молярная концентрация 20,5%-ного раствора HCl (ρ = 1,11г/мл)?
Решение:
[pic 13]
5. Рассчитайте нормальность и титр 0,3 M раствора ортофосфорной кислоты.
Рассчитайте нормальность и титр 0,3 M раствора ортофосфорной кислоты.
Решение:
[pic 14]
Титр T – это масса растворенного вещества в 1мл раствора.
[pic 15]
Определим массу кислоты в 1л раствора:
[pic 16]
Рассчитываем титр:
[pic 17]
6. Рассчитайте молярность 0,1н раствора соляной кислоты.
Решение:
[pic 18]
7. Вычислите процентную концентрацию и молярность 1,9 н. раствора Ba(OH)2 (ρ = 1,25 г/см3).
Решение:
Рассчитываем молярную концентрацию раствора:
[pic 19]
Выведем формулу, связывающую процентную и молярную концентрации:
[pic 20]
[pic 21]
Рассчитываем процентную концентрацию:
[pic 22]
8. Плотность 40%-ного раствора азотной кислоты равна 1,25 г/мл. Рассчитать молярность и нормальность этого раствора.
Решение:
[pic 23]
[pic 24]
Рассчитываем молярность раствора:
[pic 25]
Рассчитываем нормальность раствора:
[pic 26]
9. Вычислите процентную и нормальную концентрации 1,9 M раствора Ba(OH)2 (ρ = 1,35 г/см3).
Вычислите процентную и нормальную концентрации 1,9 M раствора Ba(OH)2 (ρ = 1,35 г/см3).
Решение:
[pic 27]
[pic 28]
[pic 29]
10. Какой объём 20%-ной серной кислоты (ρ= 1,14 г/мл) надо прибавить к 100 мл воды, чтобы получить 5%-ный раствор.
Решение:
Масса растворенного вещества в начальном растворе определяется соотношением:
[pic 30]
[pic 31]
Так как новый раствор готовится разбавлением водой, то масса растворенного вещества не меняется. Меняется лишь общая масса раствора. Она увеличивается на массу добавленной воды:
[pic 32]
[pic 33]
Таким образом,
[pic 34]
[pic 35]
[pic 36]
[pic 37]
[pic 38]
Рассчитываем объем исходного раствора:
[pic 39]
11. Какой объём 20 M серной кислоты (ρ=1,14 г/мл) надо прибавить к 80мл воды, чтобы получить 5 M раствор.
Решение:
По закону эквивалентов (для раствора),
C1V1 + C2V2 = C3V3
Для разбавленных растворов, V1 + V2 = V3 (изменением объема в ходе смешения пренебрегаем)
C1V1 = C3(V1 + V2)
20V1 = 5(V1 + V2)
4V1 = V1 + V2
3V1 = 80
V1 =26,7мл
12. Какой объём 25 н серной кислоты (ρ = 1,14 г/мл) надо прибавить к 100 мл воды, чтобы получить 5 н раствор.
Какой объём 25 н серной кислоты (ρ = 1,14 г/мл) надо прибавить к 100 мл воды, чтобы получить 5 н раствор.
Решение:
По закону эквивалентов (для раствора),
C1V1 + C2V2 = C3V3
Для разбавленных растворов, V1 + V2 = V3 (изменением объема в ходе смешения пренебрегаем)
C1V1 = C3(V1 + V2)
25V1 = 5(V1 + V2)
Приготовление стандартынх растворов
ПРИГОТОВЛЕНИЕ СТАНДАРТЫНХ РАСТВОРОВ
1. Цель работы: научиться производить расчёты и экспериментально готовить растворы процентной. Молярной и нормальной концентрации.
2. Приборы, посуда, реактивы:
2.1. Весы аналитические ВЛА – 200
2.2. Весы технические
2.3. Бюксы, химические стаканы
2.4. Мерный цилиндры, пипетки, мерные колбы.
2.5. Ареометры.
2.6. Шпатели, воронки стеклянные.
2.7. Фильтрованная бумага.
2. 8.
Вода дистиллированная.
8.
Вода дистиллированная.
2.9. Концентрированная соляная кислота, азотная кислота.
2.10. Едкий натрий.
2.11. Электроплитка.
3. Теоретическая часть.
Растворы – то однородные гомогенные системы, состоящие из растворителя и растворённого вещества.
Концентрация растворов — это содержание определённого количества вещества в определённом количестве или объёме раствора или растворителя.
Процентная концентрация – весовая концентрация-это количества вещества в граммах в 100г. раствора.
Нормальная концентрация — объёмная концентрация – кол-во грамм-эквивалента вещества в 1 л. раствора.
Э S = 98/2 = 49; Э H= 63/1=63; Э = 93/3 = 32,7
Вещества в граммах в мл раствора 1Н-однонормальный раствор; 0,1Н-децинормальный раствор; 0,01-сантинормальный.
Молярная концентрация – это кол-во молей вещества в 1л. раствора.
1М –одномолярный раствор и т. д.
д.
Титр – это кол-во эквивалента вещества растворённое в 1мл раствора.
Т = ;
где N — нормальность раствора
Э — эквивалент вещества
V — объём раствора
Э NaOH= ,
Где Мм –молярная масса вещества
МмNaOH = 23+16+1=40
M NaOH=0,1 40 100/1000=0,4г.
Так как растворы щелочей являются установленными, т.е. изменяют свою концентрацию, то точную нормальность приготовленного раствора устанавливают титрованием его щавеливой кислотой. Поэтому на необходимость брать навеску NaOH с большой точностью, до четвёртого знака. Дистиллированную воду необходимо прокипятить 0,5 – 1,0ч для удаления диоксида углерода, а затем использовать для приготовления раствора.
2. Берём навеску Na OH
Разработка урока «Концентрация растворов»
Цели:
Обучающая – учить решать расчетные задачи с использованием понятия «растворы», «концентрация растворов», применять полученные знания на практике, закрепить знания о физических характеристиках растворов и растворенных веществ, умения рассчитывать молярные массы веществ, проверить способность к самостоятельной деятельности.
Развивающая: развивать логическое мышление, наблюдательность, способность к анализу и синтезу, коммуникативные навыки работы в группе, формировать навыки самоконтроля. Стимулировать познавательную деятельность
Воспитательные: способствовать формированию ответственного отношения к учению, готовности к мобилизации усилий и безошибочное выполнение заданий, проявить наибольшую активность в их выполнении; воспитывать культуру учебного труда, навыки экономного расходования времени, формировать гуманные качества личности учащихся, совершенствовать навыки общения.
Оценка результатов:
- полнота ответов
- правильность ответов
- логика изложения материала
- понимание изученного
- терминологическая грамотность
Методы обучения — информативно-прикладной с элементами фронтальной беседы, фронтальная беседа, решение химических задач.
Тип урока – закрепление знаний, умений навыков в трудящихся.
Прогнозируемые результаты знать способы выражения концентрации растворов, обозначения основных величин, связанных с растворами, формулы растворов.
Оборудование. Раздаточный материал, таблица Менделеева.
План урока.
1. Организационный момент: Приветствие. Класс разбит на группы по 4-6 человек, выбирается капитан.
Целеполагание – учащиеся должны в течении урока показать умение решать задачи., при необходимости помочь товарищам по команде; учитель- определить уровень знаний учащихся по теме, выявить пробелы в знаниях для последующей коррекции.
2. Опрос в виде интеллектуального тренинга.
| Чем является вода для многих твердых, жидких и газообразных веществ? | растворителем |
| Какие признаки растворов вы знаете? | Однородность и прозрачность |
| Что образует вода со многими веществами? | Растворы |
| Гомогенная система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия | растворы |
| Что происходит при упаривании растворов? | Кристаллизация |
| Какое понятие существует в химии между растворимым веществом и растворителем? | Концентрация растворов. |
Это надо знать
- раствор – это то же самое, что гомогенная смесь.
- растворителем называют жидкость, растворяющую вещество.
- «Подобное растворяется в подобном»
- На растворимость влияют площадь поверхности растворяемого вещества, давление и температура.
- Разбавлением называют процесс добавления дополнительного количества растворителя в раствор, чтобы уменьшить его концентрацию
Изучение нового материала.
Ребята выбирают задания, которые находятся в закрытых конвертах на которых написаны баллы. (на усмотрение учителя, можно разместить на доске разноцветные карточки)
Вопросы теоретического блока.
1 блок вопросов. Обозначение величин.
- Как обозначается массовая доля вещества в растворе? — 5 баллов
- Как обозначается молярная концентрация вещества? 10 баллов.

- Как обозначается растворимость вещества? 15 баллов
- Как обозначается объем раствора? 20 баллов
- Как обозначается количество вещества? 25 баллов
2 блок вопросов. Формулы расчетов.
- Как записывается формула для расчета объема раствора? -5 баллов
- Как определить молярную концентрацию? — 25 баллов
- Чему равна масса вещества в растворе? — 10 баллов
- Как определяется плотность растворов? — 15 баллов
- Чему равна массовая доля вещества в растворе? — 20 баллов
3 блок вопросов Единицы измерения.
- В каких единицах измеряется масса вещества? — 5 баллов
- В каких единицах измеряется объем раствора? -10 баллов
- В каких единицах измеряется плотность раствора? — 15 баллов
- В каких единицах измеряется молярная концентрация? – 20 баллов
- В каких единицах измеряется массовая доля вещества? — 25 баллов
4 блок вопросов. Определение характеристик растворов.
Определение характеристик растворов.
- Что называется растворимостью вещества? — 5 баллов
- Что называется молярной концентрацией раствора? -110 баллов
- Что показывает массовая доля вещества? -15 баллов
- Что такое плотность раствора? 20 баллов
- Что называется количеством вещества? 25 баллов
5 блок вопросов Связь между разными способами выражения концентрации.
- Вывести формулу, связывающую растворимость вещества с массовой долей. -5 баллов
- Вывести формулу, связывающую молярную массу с массовой долей. 10 баллов
- Вывести формулу, связывающую плотность раствора с массовой долей. -15 баллов
- Вывести формулу, связывающую массу вещества с объемом раствора.- 20 баллов
- Вывести формулу, связывающую массовую долю с молярной концентрацией.
 — 25 баллов
— 25 баллов
Задачи на приготовление растворов
- Какую массу сульфата калия и воды надо взять для приготовления 300г.20% раствора?- 10 Баллов
- Сколько граммов воды содержится в 200г.40%-ного раствора поваренной соли? — 20 баллов
- В 400г. Воды растворили11.2 л.сероводорода. Определите процентное содержание сероводорода в полученном растворе.- 30 баллов
- В каком объеме воды надо растворить 200г.хлорида железа (Ш) чтобы получить раствор с массовой долей растворенного вещества 15 %.? – 40 баллов.
- В 80г. воды растворили 7 г. Семиводного сульфата железа (II) Определите массовую долю в безводной соли в растворе? -50 баллов
Задачи на расчет молярной концентрации раствора.
- Какое количество вещества содержится в 1 л раствора с массовой долей нитрата натрия 4-% если его плотность равна 1.
 32 г/мл.? — 10 баллов.
32 г/мл.? — 10 баллов. - В 100 мл. раствора содержится 0.98 г серной кислоты. Определите молярную концентрацию -20 баллов
- Какая масса соли потребуется для приготовления раствора хлорида калия объемом 300 мл с концентрацией 0.15 моль/л — 20 баллов.
- Определите молярную концентрацию раствора с массовой долей гидроксида натрия 20% плотностью 1.22 г/мл. – 40 баллов.
- Какой объем раствора с массовой долей серной кислоты 9.3 % и плотностью 1,05 г/мл необходим для приготовления 0.35М серной кислоты объемом 40 мл – 50 баллов.
Задачи на смешивание растворов.
- Смешали 200г. 15% раствора хлорида натрия и 300 г. 10% раствора этого же вещества. Определите концентрацию полученного раствора? – 10 баллов.
- Сколько граммов воды необходимо взять для приготовления 200г. 25% раствора из 60% раствора серной кислоты? 20 баллов.
- В лаборатории имеются растворы с массовой долей хлорида натрия 10 и 20%.
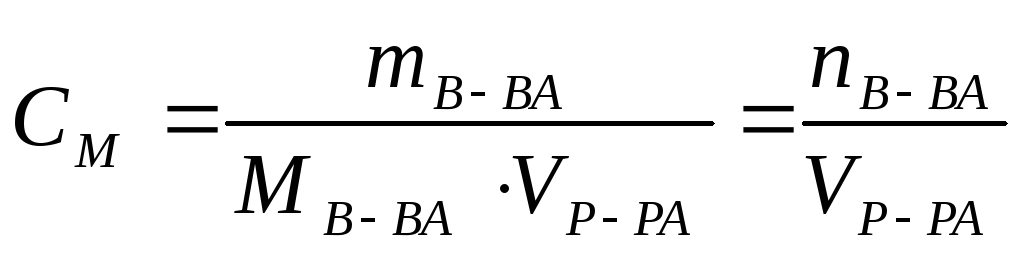 Какую массу каждого раствора надо взять для получения 300 г.раствора с массовой долей хлорида натрия 12 % — 30 баллов.
Какую массу каждого раствора надо взять для получения 300 г.раствора с массовой долей хлорида натрия 12 % — 30 баллов. - Какой объем 60%-ной серной кислоты (плотность 1,5 г/мл) и 30 % раствора (плотность 1.2 г/мл) серной кислоты надо взять для приготовления 240г. 50%-нного раствора? -40 баллов.
- Сколько граммов кристаллогидрата 18 водного сульфата хрома (III) с массовой долей 15 % необходимы для приготовления 795 г. 20%-ного раствора сульфата хрома (Ш)
Закрепление
Методы закрепления материала – решение задач различных типов на определение концентрации растворов, обсуждение, сравнение, анализ, соревнование между командами.
Выводы – оценка качества знаний и умений учащихся, причин проигрыша, победы, советы на будущее.
Домашнее задание – повторить состав, номенклатуру и свойства неорганических веществ, составить по две задачи на определение концентрации растворов.
Масса молярная эквивалента — Энциклопедия по машиностроению XXL
Молярная масса, молярная масса эквивалента [c. 73]
73]Произведение массовой, молярной или нормальной концентрации раствора и его массы, выраженной в килограммах, дает количество вещества, содержащегося в этой массе раствора (в граммах, молях или эквивалентах). [c.264]
Грамм-эквивалент (г-экв) — индивидуальная для каждого вещества единица массы. Равна эквивалентной массе, т. е. молярной массе данного вещества, деленной на валентность. 1 г-экв=Л1/л г=10- УИ/д кг. [c.203]
Понятия эквивалентный вес, нормальность раствора (обозначение ЛО применять не следует. Необходимо использовать понятия- молярная масса эквивалента, молярная концентрация эквивалента. Вместо грамм (килограмм)-эквивалента следует использовать моль. Молярная масса в молях численно совпадает с прежним грамм-эквивалентом. [c.51]
Молярная масса эквивалента — физическая величина M[( /z- )x] есть отношение молярной массы М х), отнесенной к частицам х, к числу эквивалентности 2 M [ lz )x] = М(х) г Размерность dim М [(1/2 )х] = MN . [c.37]
[c.37]
Числовое значение молярной массы эквивалента равно числовому значению ранее применявшегося грамм-эквивалента и уста-, ревшего эквивалентного веса. ч [c.37]
Вычислить молярную концентрацию Молярная масса эквивалента сульфат иона [c.38]
Вычислить молярность Эквивалентная масса сульфат-нона Эквивалент сульфат иона Вес эквивалента [c.38]
Следовательно, переход от прежних грамм-эквивалентов к молярной массе эквивалента не изменяет числовые значения. [c.72]
Килограмм на моль (кг/моль) — единица молярной массы и молярной массы эквивалента. [c.72]
Относительная молекулярная Мг (и атомная Ат) масса железа 55,847. Молярная масса М(Ре +) =55,847 мг/ммоль. Фактор эквивалентности экв(Рез+)= = 1/3. Отсюда молярная масса эквивалента Л1 (1/3 Ре +) = 1/3 Л1(Ре +) = = 18,615 7 мг/ммоль, а искомая концентрация С(1/3 Рез+) = 13,0/18,6157= = 0,70 ммоль/дм .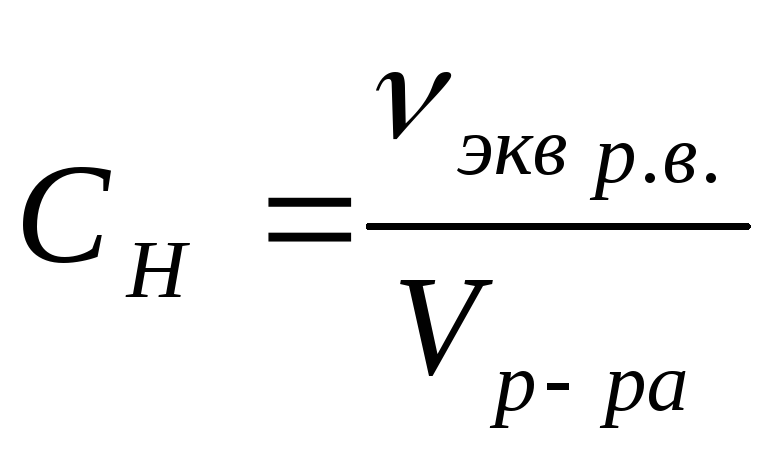 [c.42]
[c.42]
Второй закон электролиза второй закон Фарадея) электрохимические эквиваленты веществ прямо пропорциональны отношениям их атомных (молярных) масс А к валентности т [c.230]
Решение. Обозначив неизвестную нормальность раствора серной кислоты через х, составим пропорцию 40 24 = 0,2 л, откуда х = 24- 0,2/ 40 = = 0,12. Так как эквивалент серной кислоты (молярная масса 98) равняется 98/2 = 49, то в 1 л 0,12 н раствора содержится 49 0,12 = 5,88 г h3SO4. Количество серной кислоты, содержащейся в 40 см [c.264]
Примечание. Числовое значение молярной массы эквивалента равно числовому значению ранее применявшегося грамм-эквивалента и устаревшего эквивалеит-вого веса. Эти последние понятия- в будущем применять не рекомендуется, следует заменять 1ГХ нонятием молярная масса эквивалента , например, вместо [c.109]
Грамм-эквивалент — [г-экв g-equ] — устаревшая внесист. ед. массы, индивидуальная для каждого вещества. Г.-э. — число граммов вещества (хим. элемента или соединения), равное массе его химического эквивалента. X. э. — безразмерная величина, равная отношению массы хим. элемента к массе соединяющегося с ним водорода или к массе вещества, замещающего водород в соединениях. В зависимости от рода вещества Г,-э. опред. след, образом, Г.-э, хим, элемента равен его молярной массе в граммах (см. ф-лу V,2.1 в разд, V,2), деленной на валентность, Г,-э, кислоты — масса ее в граммах, содержащая один грамм-эквивалент водорода, способного замещаться металлом с образованием соли. Г.-э, основания — масса его в граммах, необходимая для полного взаимодействия с 1 г-экв кислоты. Г.-э сопи —масса ее в граммах, содержащая 1 г-экв металпа. Понятие грамм-эквивалента применяли в химии
[c.255]
Г.-э. — число граммов вещества (хим. элемента или соединения), равное массе его химического эквивалента. X. э. — безразмерная величина, равная отношению массы хим. элемента к массе соединяющегося с ним водорода или к массе вещества, замещающего водород в соединениях. В зависимости от рода вещества Г,-э. опред. след, образом, Г.-э, хим, элемента равен его молярной массе в граммах (см. ф-лу V,2.1 в разд, V,2), деленной на валентность, Г,-э, кислоты — масса ее в граммах, содержащая один грамм-эквивалент водорода, способного замещаться металлом с образованием соли. Г.-э, основания — масса его в граммах, необходимая для полного взаимодействия с 1 г-экв кислоты. Г.-э сопи —масса ее в граммах, содержащая 1 г-экв металпа. Понятие грамм-эквивалента применяли в химии
[c.255]
Концентрация веществ в течение многих лет выражалась в единицах масса/объем (г/л мг/л и т. п.) или моляртых или эквивалентных концентраций (грамм-моль/л мг-эквивалент/л и т.
 п.). Переход на единицы международной системы единиц 51 позволяет дать термину концентрации более четкое толкование. Концентрация вещества — отношение массы или количества этого вещества в системе к объему этой системы. Таким образом, концентрация не может быть выражена в процентах. Процентное выражение допустимо при рассмотрении относительного содержания вещества в системе, когда речь идет о массовой, молярной или объемной доле вещества.
[c.38]
п.). Переход на единицы международной системы единиц 51 позволяет дать термину концентрации более четкое толкование. Концентрация вещества — отношение массы или количества этого вещества в системе к объему этой системы. Таким образом, концентрация не может быть выражена в процентах. Процентное выражение допустимо при рассмотрении относительного содержания вещества в системе, когда речь идет о массовой, молярной или объемной доле вещества.
[c.38]Малярная масса Hg l равна 472 г/моль Молярная масса кальция (Са) равна 40 г-моль Массовая концентрация ионов составляет 10 мкг/мл Молярная концентрация составляет 0,13 моль/л Молярная концентрация эквивалента 0,2 моль/л [c.75]
Необходимо также сказать и о моле эквивалентов данного вещества в конкретной реакции, принимая, что эквивалент является некой условной частицей. Таким образом, можно говорить о количестве вещества эквивалента (в молях) и о молярной массе эквивалента, выраженной в единицах СИ и дольных от них (кг/моль, г/моль и т. п.). При этом переход от прежних грамм-эквивалентов к молярной массе эквивалента не вызывает изменений числовых значений. Так, молярная масса эквивалента Н2504 составляет 49 г/моль, что равно 49 г-эквивалентам Н2504.
[c.39]
п.). При этом переход от прежних грамм-эквивалентов к молярной массе эквивалента не вызывает изменений числовых значений. Так, молярная масса эквивалента Н2504 составляет 49 г/моль, что равно 49 г-эквивалентам Н2504.
[c.39]
Относительная молекулярная масса Мг(Х) сульфат-иона 96,061 6 его молярная масса ЛГ(504 ) =96,061 6 г/моль. Предположим, что сульфат-ион в природной воде двухвалейтен, и, следовательно, эквивалентен двум ионам водорода. Поэтому фактор эквивалентности /экв (804 ) = 1/2. Отсюда молярная масса эквивалента Л] (1/2 804 ) = 1/2 М(504 ) = 1/2-96,061 6 = 48,030 8 мг/ммоль, а искомая концентрация с(1/2 ЗО «) =96,0/48,030 = 2,0 ммоль/дм . [c.39]
Молярная масса эквивалента кг/моль г/моль мг/ммоль Молярная масса эквивалента вещества (X), равная произведению фактора эквивалентности [/вкв(Х)] иа молярную массу [М(Х)] вещества М[/ .,в(Х)Х] Л1(/ (Л)Х)= в вт-Л1(Х) М(1/2Са2+) = 1/2 М(Са2+) =20,04 г/моль (мг/ммоль)
[c. 41]
41]
КОНЦЕНТРАЦИЯ (от новолат. соп-сеп1га11о — сосредоточение), величина, определяюш ая содержание компонента в смеси, р-ре, сплаве. Способы выражения К. различны. Долевая К. по массе — процентное отношение массы компонента к общей массе смеси (весовые %). Атомная (мольная) долевая К.— процентное отношение содержащихся в смеси грамм-атомов компонента к общему кол-ву грамм-атомов смеси (атомные, или мольные, %). О б ъ ё м-ная долевая К.— процентное отношение объёма компонента к общему объёму системы (объёмные %). К. жидких систем часто выражают массой в-ва, растворённого в 100 г или в 1 л растворителя, а также числом молей в-ва в 1000 молей растворителя. В учении о р-рах пользуются понятиями молярности (число молей в-ва в 1 л р-ра) и м о л я л ь-ности (число молей в-ва в 1 кг растворителя). К способам выражения К. относится также нормальность (число грамм-эквивалентов в-ва в 1 л р-ра) и титр (масса в-ва в 1мл р-ра). В физике К. наз. кол-во ч-ц в ед. объёма.
[c. 311]
311]
Второй закон Фарадея устанавливает связь электрохим. эквивалента с химическим эквивалентом Л=[д,/д, где [Л — молярная (или атомная) масса, п — заряд иона (в ед. абс. величины заряда эл-на е) [c.871]
Молярная концентрация – обзор
3 Влияние добавления [
19 F]фторид-иона на радиохимический выход и молярную активностьСтандартные препараты RBF 3 обычно используют молярные концентрации фторида и борной кислоты. Поэтому было несколько неожиданно, что разумные (радио)химические выходы 10–30 % могут быть получены при использовании только 10–30 мМ общего фторида: для реакционного объема 10 мкл потребуется всего 100–300 нмоль общего фторида. Поскольку использование микрореакторов для радиосинтеза становится все более распространенным явлением, в ближайшем будущем должны стать доступными такие малообъемные реакционные коллекторы; примечательный пример сообщил об отлове> 0.8 Ки в 2–5 мкл [46,47].
Тем не менее, добавление иона-носителя [ 19 F]фторида, которое повышает химический выход в случае образования RBF 3 , обычно нарушает давние принципы радиохимической практики, поскольку снижает молярную активность [ 18 F]фторид. Действительно, в нашей работе мы поставили под сомнение эти принципы по двум причинам: (1) мы (и другие) обнаружили, что NCA [ 18 F]фторид содержит значительные количества [ 19 F]фторида, и (2) потому что три атомы фтора соединяются с одним атомом бора, молярная активность образующегося [ 18 F]RBF 3 должна быть в три раза больше, чем [ 18 F]фторида, используемого в реакции.Чтобы продемонстрировать благоприятное использование носителя и его влияние на молярную активность, требуется краткое обсуждение молярной активности.
Действительно, в нашей работе мы поставили под сомнение эти принципы по двум причинам: (1) мы (и другие) обнаружили, что NCA [ 18 F]фторид содержит значительные количества [ 19 F]фторида, и (2) потому что три атомы фтора соединяются с одним атомом бора, молярная активность образующегося [ 18 F]RBF 3 должна быть в три раза больше, чем [ 18 F]фторида, используемого в реакции.Чтобы продемонстрировать благоприятное использование носителя и его влияние на молярную активность, требуется краткое обсуждение молярной активности.
Молярная активность, определяемая Международным союзом теоретической и прикладной химии как трассер Ки/мкмоль, представляет собой независимую меру эффективности радиосинтеза, влияющую как на качество изображения, так и на одобрение регулирующих органов, согласно обзору [48–50]. Кроме того, считается, что высокая молярная активность способствует получению высококонтрастных изображений и, таким образом, может быть особенно важной для раннего обнаружения рака, когда целевая концентрация низка. Кроме того, регулирующие органы обычно требуют, чтобы концентрация индикатора была достаточно низкой (<0,1 × K d ), чтобы <10 % мишени связывались во избежание фармакологических эффектов [23].
Кроме того, регулирующие органы обычно требуют, чтобы концентрация индикатора была достаточно низкой (<0,1 × K d ), чтобы <10 % мишени связывались во избежание фармакологических эффектов [23].
Хотя максимальная теоретическая молярная активность [ 18 F]фторида без носителя составляет 1720 Ки/мкмоль, на практике NCA [ 18 F]фторид содержит значительных количеств [ 19 F]фторида в количестве . В подробном отчете показано, что NCA [ 18 F]фторид получается при средней молярной активности ∼20 Ки/мкмоль (n = 80): только один атом фтора из 86 является радиоактивным [51].Хотя окончательного объяснения источника загрязняющего [ 19 F]фторида представлено не было, в одном отчете предполагалось, что тефлон, который может присутствовать в прокладках циклотрона, может подвергаться радиолизу с выделением [ 19 F]фторида, тем самым снижая молярной активности до 2 Ки/мкмоль [52]. Эти значения наряду с относительно длительным временем радиоактивного мечения пептидов (2–3 ч) легко объясняют, почему большинство 18 F-меченых радиофармпрепаратов производятся при молярной активности <2 Ки/мкмоль и почему значения молярной активности составляют 2–4 Ки/мкмоль. были признаны высокими несколькими ведущими лабораториями [23,53,54].
были признаны высокими несколькими ведущими лабораториями [23,53,54].
Как уже отмечалось, уникальным аспектом маркировки [ 18 F]RBF 3 является то, что молярная активность [ 18 F]RBF 3 должна быть в три раза выше, чем у [ 18 F]фторида используется при маркировке, хотя статистически на меченый RBF 3 приходится только один атом [ 18 F] фтора (несмотря на экспериментальные ошибки измерения этих величин). Этот тройной эффект является просто функцией действия масс, возникающим из-за того, что пул [ 18 F]фторида, который всегда содержит значительное количество [ 19 F]фторида, конденсируется на одну треть меньшего количества молекулы боронатсодержащего пептида.В Таблице 14.1 представлены два примера в контексте значений, наблюдаемых на практике, для иллюстрации стехиометрического соотношения между молярной активностью и массопереносом, которые объясняют, что этот трюизм должен сохраняться для всех значений молярной активности.
Таблица 14.1. Взаимосвязь между молярной активностью исходного фторида без добавления носителя (NCA) [ 18 F] и молярной активностью образующегося [ 18 F]RBF 3 (предполагается 50% радиохимический выход [RCY] и Молярная активность представляет собой затухание с поправкой на начало синтеза [SOS])
| Молярная активность фторида NCA (Ки/мкмоль) | Начальная активность (Ки) | нмоль Общий фторид | Концентрация общего фторида в 10 MM) | Предполагается, что RCY (%) | активность, содержащаяся на [ 18 F] RBF 3 (CI) | NMOL общего фторида, передаваемого в боран | NMOL RBF 3 | молярная активность [ 18 F]RBF 3 (Ки/мкмоль) | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 5 | 0.6 | 120 | 120 | 12 | 50 | 0. 3 3 | 60116 | 9 | 2 | 52 | 0,9 | 450 | 45 | 50 9 | 225 | 75 | 6 |
Чтобы обеспечить экспериментальное доказательство этого эффекта, как при использовании NCA [ 18 F]фторида, так и при преднамеренном добавлении [ 19 F]фторида, нам потребовались (1) средства измерения массы связанный с [ 18 F]RBF 3 , и (2) независимая мера молярной активности NCA [ 18 F]фторида, которая включала количественную оценку количества [ 19 F]фторида в тот же образец NCA [ 18 F]фторида [55].Для достижения первой цели мы разработали однореакторный двухстадийный радиосинтез, посредством которого арилборимидин, связанный алкином, был преобразован в алкинил-[ 18 F]RBF 3 ( 6 , полученный из 2 , Рис. 14.4) в течение 15 минут, а затем, после гашения, конъюгировали с родамином, связанным азидом, с получением 7 , рис. 14.4.
14.4.
Мы выбрали родамин из-за его очень высокого коэффициента экстинкции, который обеспечивает однозначное и прямое считывание химической массы, связанной с данным пиком ВЭЖХ и в выделенной фракции, и, следовательно, значение для точной молярной активности после измерения связанной радиоактивности. во время элюирования.Были проведены две реакции мечения: одна с 10 мКи NCA [ 18 F]фторида, а другая с 10 мКи NCA [ 18 F]фторида, к которому было добавлено 2 нмоль [ 19 F]фторида; соответствующие радиохимические выходы составляли ~10% и ~30%, тогда как соответствующие молярные активности в конце синтеза были измерены при 15,5 Ки/мкмоль и 7,4 Ки/мкмоль. Как и ожидалось, при добавлении [ 19 F]фторида молярная активность падала, а радиохимический выход увеличивался, особенно потому, что для образования RBF 3 необходимо присутствие трех фторидов.
Затем мы попытались измерить молярную активность NCA [ 18 F]фторида.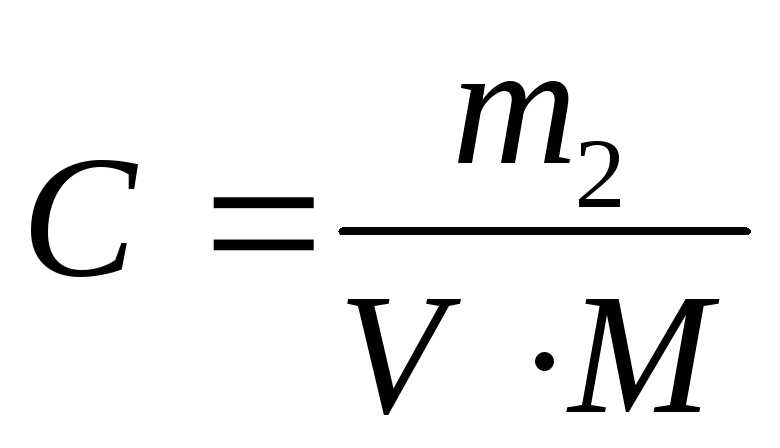 Для этого мы разложили оставшиеся 80 мКи NCA [ 18 F]фторида в течение нескольких дней, а затем использовали логометрический флуоресцентный датчик для фторида, чтобы измерить количество [ 19 F]фторида, оставшегося после распада [56]. Это обеспечило молярную активность 6,5 Ки/мкмоль в начале синтеза и 5,3 Ки/мкмоль для образца NCA [ 18 F]фторид-иона в конце синтеза, который был использован в производстве [ 18 Ф] 7 .Для реакции, в которую было добавлено 2 нмоль [ 19 F]фторида, молярная активность [ 18 F]фторида в конце синтеза была измерена на уровне 2,2 Ки/мкмоль. Несмотря на экспериментальные ошибки, связанные с фактическим измерением молярной активности или низкими уровнями концентрации, экспериментально было показано, что молярная активность [ 18 F] 7 (15,5 или 7–8 Ки/мкмоль) была в три раза выше, чем у используемого фторида. в реакции (5,3 или 2,2 Ки/мкмоль).
Для этого мы разложили оставшиеся 80 мКи NCA [ 18 F]фторида в течение нескольких дней, а затем использовали логометрический флуоресцентный датчик для фторида, чтобы измерить количество [ 19 F]фторида, оставшегося после распада [56]. Это обеспечило молярную активность 6,5 Ки/мкмоль в начале синтеза и 5,3 Ки/мкмоль для образца NCA [ 18 F]фторид-иона в конце синтеза, который был использован в производстве [ 18 Ф] 7 .Для реакции, в которую было добавлено 2 нмоль [ 19 F]фторида, молярная активность [ 18 F]фторида в конце синтеза была измерена на уровне 2,2 Ки/мкмоль. Несмотря на экспериментальные ошибки, связанные с фактическим измерением молярной активности или низкими уровнями концентрации, экспериментально было показано, что молярная активность [ 18 F] 7 (15,5 или 7–8 Ки/мкмоль) была в три раза выше, чем у используемого фторида. в реакции (5,3 или 2,2 Ки/мкмоль).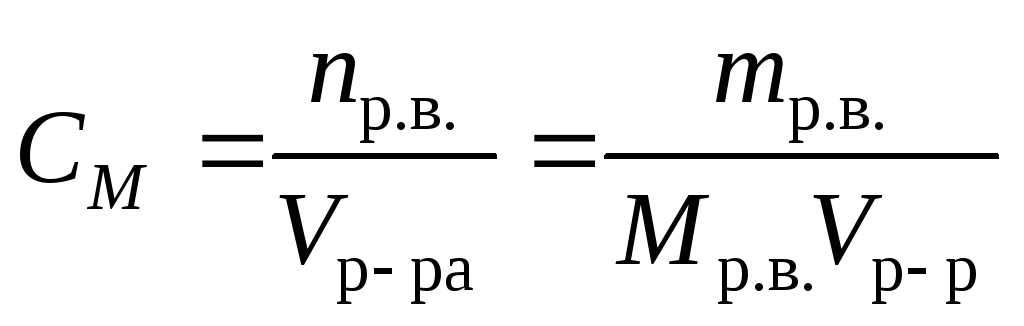 Кроме того, эта работа продемонстрировала, что фторид-носитель [ 19 F] можно добавлять для повышения радиохимического выхода при одновременном достижении молярной активности почти 8 Ки/мкмоль, что обычно выше, чем у большинства.
Кроме того, эта работа продемонстрировала, что фторид-носитель [ 19 F] можно добавлять для повышения радиохимического выхода при одновременном достижении молярной активности почти 8 Ки/мкмоль, что обычно выше, чем у большинства.
Хотя мы не исследовали добавление больших количеств [ 19 F]фторида, эти результаты показывают, что добавление еще больших количеств [ 19 F]фторида может еще больше увеличить радиохимический выход, сохраняя при этом молярную активность 1 Ки/мкмоль. Насколько нам известно, способность увеличивать эффективную молярную активность за счет использования стехиометрического соотношения 3:1 между [ 18 F]фторидом и RB(OR) 2 представляет собой новое преимущество, уникальное для RBF 3. радиопротезных групп.Этот эффект, наряду с очень коротким временем мечения (<30 мин), может обеспечить молярную активность, которая почти в 10 раз выше, чем обычно сообщается.
Какая связь между нормальностью и моляльностью?
Энергия связи: определение и уравнение
Энергия связи — это мера энергии, которая должна быть достигнута для разрыва химической связи. Узнайте, как рассчитать уравнения энергии связи с различной длиной связи и как это применяется для понимания химических реакций.
Узнайте, как рассчитать уравнения энергии связи с различной длиной связи и как это применяется для понимания химических реакций.
Растворы, растворенные вещества и растворители
Химический раствор состоит из смеси двух или более веществ, растворителем является вещество, которое растворяет, а растворенным веществом является растворяемое вещество.Узнайте больше об их функциях и процессах.
Почему вода является универсальным растворителем?
Вода известна как универсальный растворитель, поскольку она способна растворять в себе множество различных элементов. Узнайте, как это происходит, поняв свойства воды и то, как она ведет себя в действии.
Узнайте, как это происходит, поняв свойства воды и то, как она ведет себя в действии.
Кислотные растворы: свойства и примеры
Кислые растворы получают путем растворения кислого соединения в воде.Узнайте об основах кислотных растворов и свойствах кислотных растворов, а также изучите примеры кислотных растворов.
Определение фильтрации: урок для детей
Фильтрация используется для удаления примесей из жидкостей, таких как питьевая вода.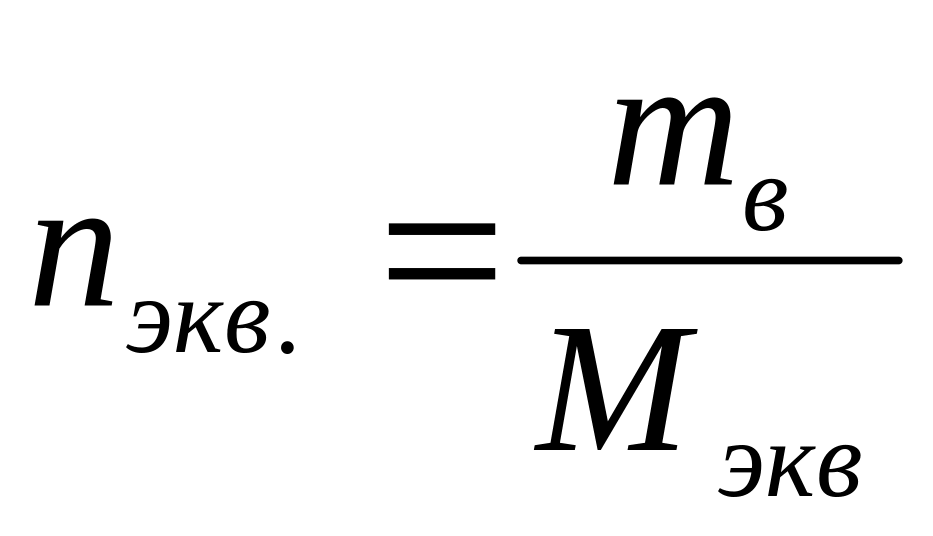 Узнайте о различных типах систем и процессов фильтрации, включая поверхностные и глубинные фильтры.
Узнайте о различных типах систем и процессов фильтрации, включая поверхностные и глубинные фильтры.
Внутренний стимул: определение и объяснение
Внутренние стимулы или внутренние чувства могут вызвать потребность что-то купить и начать процесс принятия решения о покупке.Узнайте о внутренних и внешних стимулах и найдите объяснение того, как они связаны с поведением покупателя на этапе осознания потребности.
Определение кислот и оснований по Аррениусу
Что такое Аррениусовы кислоты и основания? Изучите определения кислот и оснований по Аррениусу.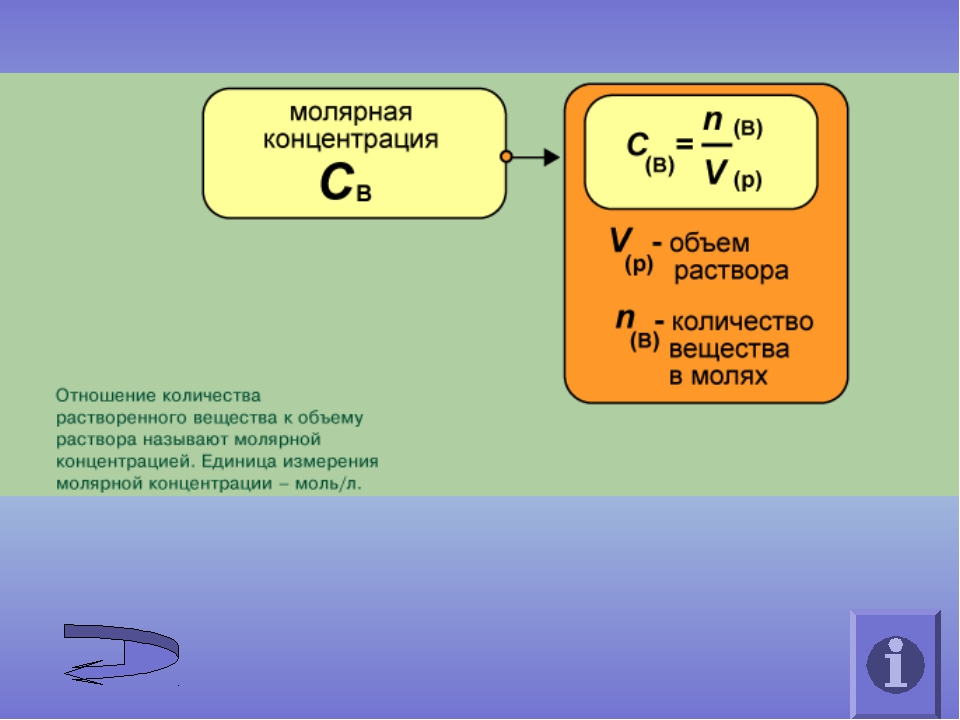 См. список кислот и оснований Аррениуса и ограничения модели Аррениуса.
См. список кислот и оснований Аррениуса и ограничения модели Аррениуса.
Урок растворимости для детей: определение и правила
Узнайте о растворимости и о том, как одно химическое вещество может растворяться в другом химическом веществе.Узнайте, какое химическое вещество является растворенным, а какое растворителем в растворе, как растворяются различные вещества, уровни растворимости и пределы растворимости.
Основные растворы в химии: свойства и примеры
Основные растворы или растворы с pH выше 7 широко распространены во многих аспектах жизни людей. Откройте для себя свойства и характеристики основных растворов и рассмотрите примеры этих распространенных веществ.
Откройте для себя свойства и характеристики основных растворов и рассмотрите примеры этих распространенных веществ.
Что такое углеродный скелет?
Углеродные скелеты представляют собой узоры, образующиеся при объединении атомов углерода.Узнайте об углеродных скелетах, исследуя соединения. Узнайте, как рисовать углеродный скелет, и поймите, почему это важно.
Окислитель: определение и примеры
Жестяное ведро, оставленное под дождем, не ржавеет само по себе; реакция начинается с окислителей. Научитесь определять окислители, функции полуреакций, рецепторы электронов, электроотрицательность и оксианионы, а также способы определения типичных примеров окислителей.
Научитесь определять окислители, функции полуреакций, рецепторы электронов, электроотрицательность и оксианионы, а также способы определения типичных примеров окислителей.
Амфипатические молекулы: определение и пример
Липиды (масла и жиры) известны как амфипатические молекулы и характеризуются тем, что одна сторона притягивает воду, а другая отталкивает ее.Исследуйте структуру, биологическую роль и различные примеры амфипатических молекул.
Молярность, моляльность и нормальность (EnvironmentalChemistry.com)
Количественное соотношение между химическими веществами в реакции известно как стехиометрия . Авогадро был пионером в этой области химии. Авогадро выдвинул гипотезу, что существует определенное число, которое будет представлять число атомов или молекул в молях этого атома или молекулы.Вес этой единицы, известной как моль , будет эквивалентен атомному или молекулярному весу атома или молекулы в граммах. Согласно этой теории, один моль углерода-12 будет иметь массу 12 граммов, потому что атомный вес углерода-12 равен 12 (6 нейтронов и 6 протонов). Один моль водорода будет весить один грамм и содержать такое же количество атомов, как один моль углерода. На самом деле было обнаружено, что магическое число равно 6,024E 23 . Он был назван числом Авогадро в честь отца стехиометрии, хотя на самом деле он не определил точное число.Современное определение моля выглядит следующим образом:
Авогадро был пионером в этой области химии. Авогадро выдвинул гипотезу, что существует определенное число, которое будет представлять число атомов или молекул в молях этого атома или молекулы.Вес этой единицы, известной как моль , будет эквивалентен атомному или молекулярному весу атома или молекулы в граммах. Согласно этой теории, один моль углерода-12 будет иметь массу 12 граммов, потому что атомный вес углерода-12 равен 12 (6 нейтронов и 6 протонов). Один моль водорода будет весить один грамм и содержать такое же количество атомов, как один моль углерода. На самом деле было обнаружено, что магическое число равно 6,024E 23 . Он был назван числом Авогадро в честь отца стехиометрии, хотя на самом деле он не определил точное число.Современное определение моля выглядит следующим образом:
Ровно один моль представляет количество атомов углерода ровно в 12 граммах изотопа углерода-12.
Для атома моль представляет собой 6,02E 23 атомов.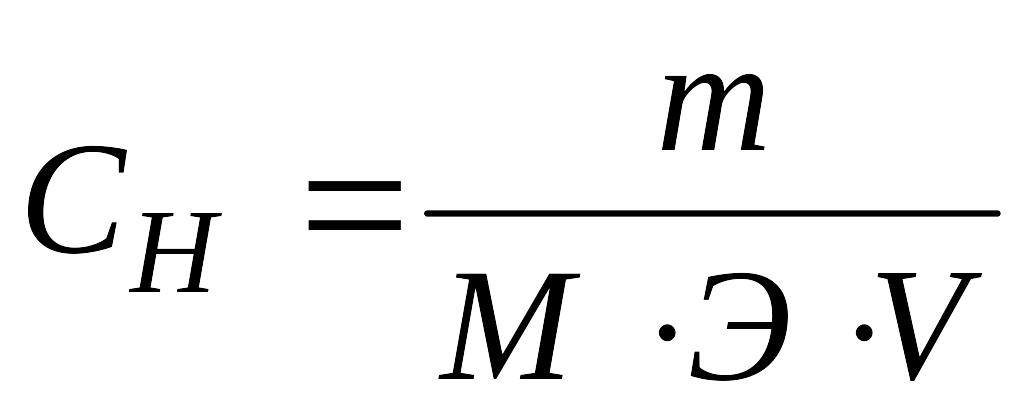 Для молекулярного соединения один моль соответствует 6,02E 23 молекул. Можно даже дойти до крайности и сказать, что один моль бананов равен 6,02E 23 бананов.
Для молекулярного соединения один моль соответствует 6,02E 23 молекул. Можно даже дойти до крайности и сказать, что один моль бананов равен 6,02E 23 бананов.
Теперь вы можете спросить: «Какое значение имеет для меня число Авогадро?» Ответ таков: почти все, когда вы работаете в химической лаборатории.С другой стороны, он совершенно бесполезен в качестве единицы измерения бананов.
Один атом или даже десять атомов слишком малы, чтобы их можно было измерить в лаборатории. Моль вещества равен грамм-формульная масса или грамм-молярная масса . Это равно сумме всех масс всех элементов в формуле вещества. По сути, если подсчитать все атомы углерода в одном моле углерода-12, получится 6,02E 23 атома, и он будет весить 12 граммов (помните, что атомный вес углерода равен 12).
Используя приведенную выше информацию, можно рассчитать концентрацию растворов и приготовить растворы нужной концентрации. Также можно использовать эту информацию, чтобы определить, сколько данного основания потребуется для нейтрализации определенной кислоты и достижения pH 7.
Существует пять единиц концентрации, которые особенно полезны для химиков. Первые три: моляльность, молярность и нормальность зависят от единицы моля. Последние два: процент по объему и процент по весу не имеют ничего общего с молями, только вес или объем растворенного вещества или разбавляемого вещества по сравнению с весом или объемом растворителя или вещества, в котором находится растворенное вещество. разбавленный.Процентное содержание также может быть определено для твердых тел внутри твердых тел.
Моляльность: Молярная единица используется не так часто, как молярная. Моляльность – это число молей растворенного вещества, растворенного в одном килограмме растворителя . Будьте осторожны, чтобы не перепутать моляльность и молярность. Моляльность представлена маленькой буквой «м», тогда как молярность представлена заглавной буквой «М». Обратите внимание, что растворитель должен быть взвешен, если это не вода. Один литр воды имеет удельный вес 1. 0 и весит один килограмм; так что можно отмерить один литр воды и добавить в него растворенное вещество. Большинство других растворителей имеют удельный вес больше или меньше единицы. Следовательно, один литр чего-либо, кроме воды, вряд ли займет литр пространства. Чтобы приготовить одномолярный водный (водный) раствор хлорида натрия (NaCl), отмерьте один килограмм воды и добавьте к нему один моль растворенного вещества NaCl. Атомный вес натрия равен 23, а атомный вес хлора равен 35. Следовательно, вес формулы для NaCl равен 58, и 58 граммов NaCl, растворенных в 1 кг воды, дадут 1-моляльный раствор NaCl.
0 и весит один килограмм; так что можно отмерить один литр воды и добавить в него растворенное вещество. Большинство других растворителей имеют удельный вес больше или меньше единицы. Следовательно, один литр чего-либо, кроме воды, вряд ли займет литр пространства. Чтобы приготовить одномолярный водный (водный) раствор хлорида натрия (NaCl), отмерьте один килограмм воды и добавьте к нему один моль растворенного вещества NaCl. Атомный вес натрия равен 23, а атомный вес хлора равен 35. Следовательно, вес формулы для NaCl равен 58, и 58 граммов NaCl, растворенных в 1 кг воды, дадут 1-моляльный раствор NaCl.
Молярность: Молярная единица, вероятно, является наиболее часто используемой химической единицей измерения. Молярность – это число молей растворенного вещества, растворенного в литре раствора . Молярный раствор хлорида натрия готовят, помещая 1 моль растворенного вещества в мерную колбу вместимостью 1 л. (Взяв данные из приведенного выше примера, мы будем использовать 58 граммов хлорида натрия). Затем в мерную колбу добавляют воду до отметки в один литр. В результате получается одномолярный раствор хлорида натрия.
Затем в мерную колбу добавляют воду до отметки в один литр. В результате получается одномолярный раствор хлорида натрия.
Нормальность: Существует связь между нормальностью и молярностью. Нормальность можно вычислить только тогда, когда мы имеем дело с реакциями, потому что нормальность есть функция эквивалентов.
В приведенном ниже примере для нейтрализации мышьяковой кислоты используется гидроксид калия (КОН). Изучая реакцию, можно определить число протонного обмена, чтобы определить нормальность мышьяковой кислоты.
Посмотрите на уравнение H 3 ASO 4 + 2KOH -> K 2 ASOH -> K 2 HASO 4 + 2H 2 O:
2 O:
Эквивалентный вес = молярная масса / (H + за моль)
эквивалент = масса соединения / эквивалентный вес
И нормальность = (эквиваленты X)/литр
И вас интересует то, что нормальность = молярность xn (где n = количество протонов, обмениваемых в реакции).
Вы, наверное, помните, что когда атом водорода ионизируется и теряет свой электрон, у вас остается только протон. Итак, ион водорода — это, по сути, протон.
Предположим, что у нас есть 0,25 М раствор H 3 AsO 4 и мы хотим определить его нормальность, если он участвует в реакции
H 3 AsO 4 + 2KOH —> K 2 Haso 4 + 2H 2 + 2H 2 O
, когда H 3 ASO 4 нейтрализуется KOH, H 3 ASO 4 обеспечивает два протона для формирования 2H 2 O.
Обратите внимание, что H 3 AsO 4 имеет три атома водорода, а K 2 HAsO 4 имеет только один водород. Это означает, что 2 протона были обменены,
Снова нормальность = молярность * n
Помните, что нормальность раствора равна 0,25 моль H 3 AsO 4 и было обменено два протона (2 эквивалента/моль)
Итак , короче говоря, хотя существует связь между нормальностью раствора и молярностью раствора, нормальность можно определить только путем изучения реакции, определения протонного обмена и умножения молярности на это число.
Нормальность особенно полезна при расчетах титрования.
- Где N = нормальность, V = объем, a = вещество в левой части уравнения, участвующее в протонном обмене, и b = вещество в правой части уравнения, участвующее в протонном обмене:
- NaVa = NbVb
Проценты по весу: Чтобы приготовить раствор в процентах по весу, нужно просто определить желаемый процент (например, 20% по весу водный раствор хлорида натрия) и общее количество, которое необходимо приготовить .
- Если общее необходимое количество составляет 1 кг, то нужно просто рассчитать 20% от 1 кг, что, конечно, равно:
- 0,20 NaCl * 1000 г/кг = 200 г NaCl/кг.
Проценты по объему: Растворы в процентах по объему рассчитываются так же, как и в процентах по массе, за исключением того, что расчеты основаны на объемах. Таким образом, можно было бы просто определить, какое процентное содержание требуется (например, 20% по объему водного раствора хлорида натрия) и общее количество, которое необходимо приготовить.
Таким образом, можно было бы просто определить, какое процентное содержание требуется (например, 20% по объему водного раствора хлорида натрия) и общее количество, которое необходимо приготовить.
- Если общее необходимое количество составляет 1 литр, то нужно просто вычислить 20% от 1 литра, что, конечно же, равно:
- 0.20 NaCl * 1000 мл/л = 200 мл NaCl/л.
Проценты больше используются в технологических областях химии (таких как экологические технологии), чем в чистой химии.
[Последнее обновление: 12 января 2006 г.: исправления]
Связанные ресурсы
Ссылка на эту страницу
Если вам нужно процитировать эту страницу, вы можете скопировать этот текст:
Roberta C. Barbalace. Молярность, моляльность и нормальность. Экологическаяхимия.com. 1999 г. Доступ онлайн: 25 января 2022 г.
https://EnvironmentalChemistry.com/yogi/chemistry/MolarityMolalityNormality.html
.
Ссылка на эту страницу
Если вы хотите сделать ссылку на эту страницу со своего веб-сайта, блога и т. д., скопируйте и вставьте этот код ссылки (красный) и измените его в соответствии с вашими потребностями:
д., скопируйте и вставьте этот код ссылки (красный) и измените его в соответствии с вашими потребностями:
echo Молярность, моляльность и нормальность (EnvironmentalChemistry.com) – вводит стехиометрию и объясняет различия между молярностью, моляльностью и нормальностью.
.
ВНИМАНИЕ: Ссылки на статьи приветствуются, НАШИ СТАТЬИ НЕ МОЖЕТ БЫТЬ КОПИИРОВАН ИЛИ ПЕРЕПУБЛИКОВАН НА ДРУГОМ ВЕБ-САЙТЕ НИ ПРИ КАКИХ ОБСТОЯТЕЛЬСТВАХ.
ПОЖАЛУЙСТА, если вам понравилась опубликованная нами статья, просто дайте ссылку на нее на нашем сайте, не публикуйте ее повторно.
В соответствии с международной единицей СИ используйте следующее уравнение:
Осмолярность, сокращенно __ осмол
Расчетная осмолярность = 2 Na + глюкоза + мочевина (все в ммоль/л).
или
Расчетная осмолярность = 2 Na + 2 K + глюкоза + мочевина (все в ммоль/л).
Большинство ковалентных соединений не диссоциируют и не ионизируются в воде. Однако ионное соединение при растворении распадается на катионы и анионы. В некоторых химических процессах важно знать концентрацию общего числа частиц, растворенных в растворе. Вот где единица концентрации осмолярность полезна. Осмолярность растворенного вещества в растворе относится к Молярность соединения х количество частиц, образующихся на моль соединения при его растворяется в воде.
Пример 8:
Какова осмолярность 1,0 М раствора этилового спирта (C2H6O) в воде? Этиловый спирт представляет собой ковалентное соединение, которое не ионизируется в воде. Каждый моль C2H6O, который растворяется, образуя только один моль частиц. Итак, осмолярность = 1,0 М x 1 моль частиц/моль соединение = 1,0 осмоль C2H6O.
Пример 9:
Какова осмолярность 1,0 М раствора CaCl2?
При 1 моль CaCl2;
CaCl2 —> Ca +2 + 2 Cl — .Таким образом, осмолярность = 1,0 М x 3 моля ионов/моль соединения = 3,0 осмоля CaCl2.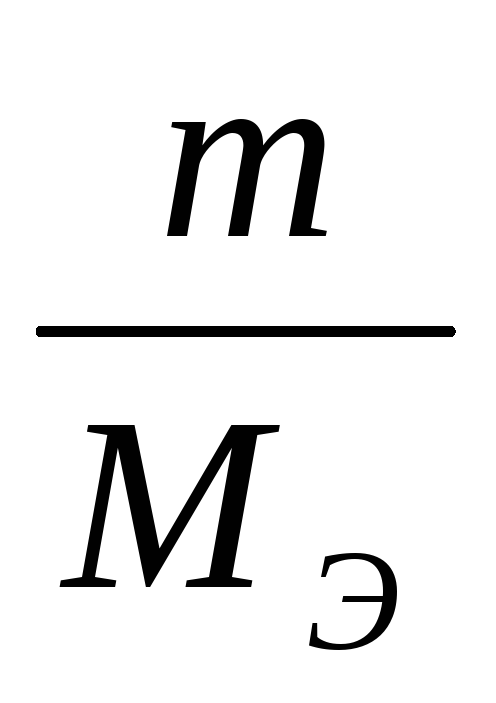
Используйте сахарозу (глюкозу) для повышения осмолярности и дистиллированную деионизированную воду (например, из системы MilliQ) для снижения осмолярности. Сахароза не заряжена, поэтому вам не нужно беспокоиться о том, что она испортит ваши реверсивные потенциалы и т. д. Это также не соль, поэтому 1 мМ сахарозы увеличивает осмолярность на 1 мОсмоль.
Для расчета осмолярности плазмы используйте следующее уравнение (обычное в США. Нормальные уровни осмоляльности сыворотки составляют 285-295 мОсм/л):
• = 2[Na + ] + [Глюкоза]/18 + [БУН]/2.8 [5] , где [Глюкоза] и [АМК] измеряются в мг/дл.
Иногда используются упрощения: [6]
• = 2[Na + ] + [Глюкоза]/20 + БУН/3 – 2
How_to_prepare_6N_NaOH (гидроксид натрия)
6N NaOH = 6M NaOH 6M NaOH — это 6 молей в 1 л MW (NaOH) = 39,88 г/моль, поэтому: m = n x MW = 6 x 39,88 = 239,28 г NaOH.
1 M HCl = 1 N HCl (36,5 г/л)
Расчеты с использованием молярности Страница 1 из 4
Расчеты с использованием молярности
Есть несколько типов расчетов, которые нужно уметь делать с молярностью.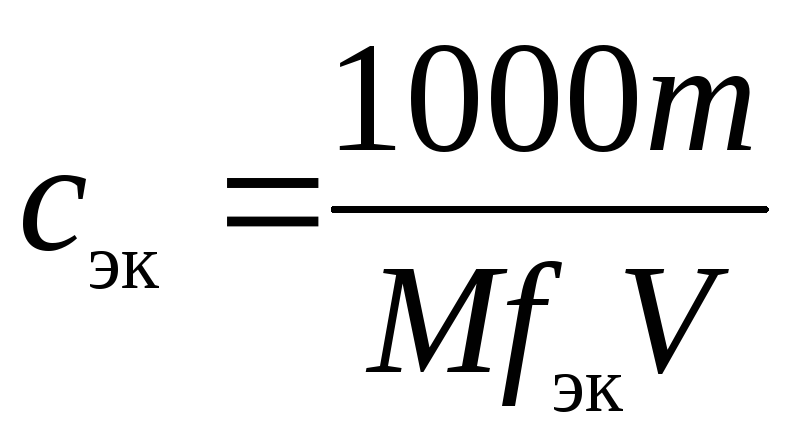
Во-первых, вы должны быть в состоянии рассчитать молярность, если вам дано компоненты раствора.
Во-вторых, вы должны быть в состоянии рассчитать количество растворенного вещества в (или необходимое для приготовления) определенного объема раствора.
В-третьих, вам может понадобиться рассчитать объем конкретного образца раствора.
В-четвертых, вам может понадобиться рассчитать концентрацию раствора, полученного путем разбавления другого раствора. Эти и связанные с ними расчеты будут рассмотрены на отдельной странице.
В любом из первых двух случаев количество растворенного вещества может быть выражено в молях или граммах, а количество раствора — в литрах или миллилитрах. Обратите внимание, что при молярности нас интересует количество растворенного вещества и количество раствора, а не количество растворителя.
Примеры (Пример 3)
Следующие примеры также показаны в примере 3 в вашей рабочей тетради. Вы можете самостоятельно просмотреть примеры из рабочей тетради и, если они кажутся вам понятными, проверить свое понимание, выполнив упражнение 4. Затем проверьте свои ответы ниже, прежде чем перейти к расчетам разбавления.
Затем проверьте свои ответы ниже, прежде чем перейти к расчетам разбавления.
Общие отношения (Пример 3a)
Вот общее отношение, которое вы
будет использовать снова и снова.
молярность равна количеству молей
растворенное вещество разделить на объем
раствор измеряется в литрах. Если вам нравится
думать о числах и единицах вместо
количество смотрите на вторую версию
уравнение.В этом уравнении x, y и z
представляют числа: 2, 6 и 3, например.
Расчет молярности по молям и объему (пример 3b)
http://dl.clackamas.edu/ch205-04/calculat.htm
Расчеты с использованием молярности Страница 2 из 4
Здесь нам дано кое-что выяснить. Чтобы получить молярность, нужно разделить количество молей NaCl на объем решение. В данном случае это 0,32 моля. NaCl разделить на 3,4 л и получить 0.094 М NaCl.
Расчет молярности по массе и объему (пример 3c)
Этот немного сложнее. Чтобы получить молярность, нам все равно нужно моль растворенного вещества разделить на объем раствора. Но на этот раз нам не дали моли растворенного вещества. Мы должны вычислить его из массы NaCl. Мы умножаем 2,5 г NaCl на коэффициент пересчета 1 моль NaCl на формульный вес NaCl, 58,5 г. Это говорит нам о том, что у нас есть 0,0427 моля NaCl. Я оставил здесь лишнюю цифру, потому что мы еще не закончили расчеты.Когда мы закончим, я округлю до двух цифр, как и в 2,5 г веса NaCl. Теперь, когда мы знаем моли, мы можем вычислить молярность. Моль растворенного вещества (0,0427), деленный на объем раствора (0,125 л), дает нам 0,34 М NaCl.
Чтобы получить молярность, нам все равно нужно моль растворенного вещества разделить на объем раствора. Но на этот раз нам не дали моли растворенного вещества. Мы должны вычислить его из массы NaCl. Мы умножаем 2,5 г NaCl на коэффициент пересчета 1 моль NaCl на формульный вес NaCl, 58,5 г. Это говорит нам о том, что у нас есть 0,0427 моля NaCl. Я оставил здесь лишнюю цифру, потому что мы еще не закончили расчеты.Когда мы закончим, я округлю до двух цифр, как и в 2,5 г веса NaCl. Теперь, когда мы знаем моли, мы можем вычислить молярность. Моль растворенного вещества (0,0427), деленный на объем раствора (0,125 л), дает нам 0,34 М NaCl.
Расчет массы растворенного вещества по молярности (пример 3d)
Этот вопрос касается того, как бы вы приготовили 400 мл 1,20 М раствора хлорида натрия. В этом случае вам нужно выяснить, сколько NaCl нужно растворить в 400 мл, чтобы получить указанную концентрацию.Это количество должно быть в граммах, потому что у нас нет весов, которые весят в молях. Так там
Так там
это больше, чем один шаг к этой проблеме.
Показанный здесь подход представляет собой подход с коэффициентом преобразования. Это включает в себя запоминание того, что молярность — это отношение между молями и литрами. 1,20 М NaCl означает, что на 1,00 л раствора приходится 1,2 моля NaCl. Мы можем использовать это в качестве коэффициента пересчета, чтобы настроить расчет, относящийся к
.400 мл (или .400 л) на соответствующее количество молей NaCl. Итак, берем 0,400 л и умножаем на коэффициент пересчета до
.http://dl.clackamas.edu/ch205-04/calculat.htm
Расчеты с использованием молярности
получить 0,480 моль NaCl. Следующим шагом будет узнать, сколько это граммов. Мы переходим от молей NaCl к граммам, используя формулу веса. Выходит
28,1 г NaCl. Таким образом, ответ заключается в том, что вы должны приготовить раствор, растворив 28,1 г NaCl в достаточном количестве воды, чтобы получилось 400 мл раствора.
Существует также более одного способа решения этой проблемы. Если вам нравится алгебраический подход, вы должны написать общее уравнение, показанное в части а, подставить известные значения, решить для молей NaCl, а затем преобразовать это в граммы.
Если вам нравится алгебраический подход, вы должны написать общее уравнение, показанное в части а, подставить известные значения, решить для молей NaCl, а затем преобразовать это в граммы.
Страница 3 из 4
= 0,480 моль NaCl
Расчет молей растворенного вещества по молярности (пример 3e)
Этот вопрос немного проще. Мы делаем это так же, как первый шаг предыдущей задачи, а затем останавливаемся.Чтобы узнать, сколько молей соли содержится в 300 мл 0,40 М раствора NaCl, начнем с объема в литрах (0,300 л) и умножим его на число молей в литре раствора, что на 0,40 моль больше. 1,00 л. Ответ: 0,12 моль NaCl. Это также можно было бы сделать с помощью алгебры, написав общее уравнение, связывающее молярность, моли и литры, подставив известные значения, а затем решив уравнение для молей.
Практика (Пример 4)
Теперь вы должны потратить некоторое время, чтобы просмотреть приведенные выше расчеты (напр.3). Если у вас есть
http://dl. clackamas.edu/ch205-04/calculat.htm 07.01.2011
clackamas.edu/ch205-04/calculat.htm 07.01.2011
Расчеты с использованием молярности Страница 4 из 4
вопросы уточняйте у преподавателя. Как только вы ознакомитесь с тем, как это делается, попробуйте ответить на следующие вопросы (упражнение 4 в рабочей тетради). Получите помощь от инструктора, если вам это нужно. Проверьте свои ответы ниже, прежде чем продолжить урок.
Расчеты молярности: Практика
- Как бы вы подготовили 100.мл 0,25 М раствора KNO 3 ?
- Химик растворяет 98,4 г FeSO 4 в воде, достаточном для получения 2000 л раствора.
Какова молярность раствора?
Сколько молей KBr содержится в 25,0 мл 1,23 М раствора KBr?
Аккумуляторная кислота обычно представляет собой 3 M H 2 SO 4 . Примерно сколько граммов H 2 SO 4 содержится в 400.
Ответы (Пример 4)
Вот ответы на упражнение 4.
- Как приготовить 100 мл 0,25 М раствора KNO 3 ? Растворить 2,53 г KNO 3
-
в достаточном количестве воды, чтобы сделать 100 мл раствора.

- Химик растворяет 98,4 г FeSO 4 в воде, достаточном для получения 2000 л раствора.
Какова молярность раствора? 0,324 М
Сколько молей KBr содержится в 25,0 мл 1,23 М раствора KBr?
Аккумуляторная кислота обычно представляет собой 3 M H 2 SO 4 .Примерно сколько граммов H 2 SO 4 содержится в 400.
мл этого раствора? 120 г
Начало страницы
Вернуться на главную страницу курса
07.01.2011
Электронная почта инструктора: Иден Фрэнсис
Общественный колледж Клакамаса ©1998, 2003 Общественный колледж Клакамаса, Хэл Бендер,
http://dl.clackamas.edu/ch205-04/calculat.htm
Концентрация видов Страница 1 из 2
Концентрация видов
Ионизация и концентрация частиц
Бывают случаи, когда вам нужно иметь дело с концентрацией химических веществ в растворе, а не с концентрацией химического соединения. Возможно, эти примеры покажут, почему это важно.
Возможно, эти примеры покажут, почему это важно.
Когда электролиты растворяются в воде, они
диссоциировать на ионы. Когда хлорид натрия
растворяется в воде, натрии и хлориде
образуются ионы. Когда хлорид кальция
растворяется в воде, кальции и хлориде
образуются ионы. Обратите внимание, что разные
образуется большое количество ионов хлора. Равно
концентрации NaCl и CaCl 2 генерируют
различные концентрации иона Cl — .
Со слабыми электролитами эта проблема осложняется тем, что часть химического вещества остается недиссоциированной. Например, при растворении HF в воде образуются HF(водн.), H + (водн.) и F (водн.), которые присутствуют в растворе. В зависимости от условий, при которых образуется раствор, концентрация каждого из этих химических веществ может быть разной.
Когда речь идет о концентрациях химических веществ, обычно формулу химического вещества заключают в скобки в качестве символа концентрации этого вещества. Например, [Cl — ] = 2 М означает, что концентрация иона хлорида составляет 2 М.
Например, [Cl — ] = 2 М означает, что концентрация иона хлорида составляет 2 М.
Позже в этом уроке (например, константы равновесия) и в следующих уроках (например, скорость реакции) нам нужно будет сосредоточиться на концентрации конкретных химических соединений, которые реагируют друг с другом или представляют для нас особый интерес по какой-либо другой причине. Для этого можно использовать молярность. Нужно просто указать, что концентрация относится к конкретному химическому виду, а не к химическому соединению.
http://dl.clackamas.edu/ch205-04/species.htm
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
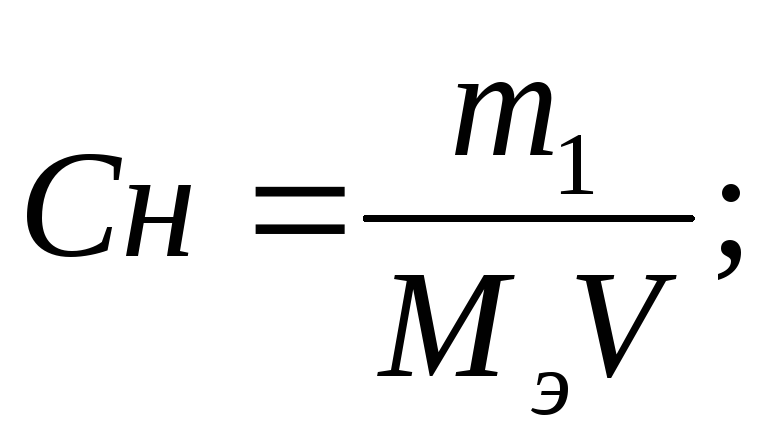
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Перевести единицы: наномолярный [нМ] в молярный [М] • Конвертер молярной концентрации • Гидравлика — жидкости • Компактный калькулятор • Онлайн-конвертеры единиц измерения КонвертерКонвертер энергии и работыПреобразователь мощностиПреобразователь силыПреобразователь времениПреобразователь линейной скорости и скоростиКонвертер углаПреобразователь топливной экономичности, расхода топлива и экономии топливаКонвертер чиселКонвертер единиц хранения информации и данныхКурсы обмена валютРазмеры женской одежды и обувиРазмеры мужской одежды и обувиПреобразователь угловой скорости и частоты вращенияПреобразователь ускоренияПреобразователь углового ускоренияПреобразователь плотностиПреобразователь удельного объема Конвертер инерцииКонвертер момента силыПреобразователь импульсаИмпульса крутящего моментаУдельная энергия, теплота сгорания (на массу) КонвертерУдельная энергия, тепло Конвертер температурного интервала Конвертер температурного интервала Конвертер коэффициента теплового расширения Конвертер теплового сопротивленияКонвертер теплопроводностиКонвертер удельной теплоемкостиПлотность теплоты, плотность пожарной нагрузкиКонвертер плотности теплового потокаКонвертер коэффициента теплопередачиКонвертер объемного расходаКонвертер массового расходаКонвертер молярного расходаКонвертер массового потокаКонвертер молярной концентрацииКонвертер массовой концентрации в раствореДинамический (динамический) Преобразователь абсолютной вязкостиПреобразователь кинематической вязкостиПреобразователь поверхностного натяженияПреобразователь проницаемости, проницаемости, паропроницаемостиПреобразователь скорости пропускания паров влагиПреобразователь уровня звукаПреобразователь чувствительности микрофонаПреобразователь уровня звукового давления (SPL)Преобразователь уровня звукового давления с выбираемым эталонным давлениемПреобразователь яркостиПреобразователь силы светаПреобразователь освещенностиПреобразователь разрешения цифрового изображенияПреобразователь частоты и длины волныОптическая мощность (диоп) в конвертер фокусного расстоянияOptical P Конвертер мощности (диоптрии) в увеличение (X)Конвертер электрического зарядаКонвертер линейной плотности зарядаКонвертер плотности поверхностного зарядаКонвертер объемной плотности зарядаКонвертер электрического токаКонвертер линейной плотности токаКонвертер поверхностной плотности токаКонвертер напряженности электрического поляКонвертер электрического потенциала и напряжения Конвертер манометровКонвертер уровней в дБм, дБВ, Ваттах и других единицахКонвертер магнитодвижущей силыКонвертер напряженности магнитного поляКонвертер магнитного потокаКонвертер плотности магнитного потокаМощность поглощенной дозы излучения, суммарная мощность дозы ионизирующего излучения Конвертер мощности дозы ионизирующего излученияРадиоактивность.
 Преобразователь радиоактивного распадаПреобразователь радиационного воздействияИзлучение. Конвертер поглощенной дозыКонвертер метрических префиксов Конвертер передачи данных Конвертер типографских и цифровых изображений Конвертер единиц измерения объема пиломатериаловКалькулятор молярной массыПериодическая таблица
Преобразователь радиоактивного распадаПреобразователь радиационного воздействияИзлучение. Конвертер поглощенной дозыКонвертер метрических префиксов Конвертер передачи данных Конвертер типографских и цифровых изображений Конвертер единиц измерения объема пиломатериаловКалькулятор молярной массыПериодическая таблица Обзор
Один моль — это количество вещества, которое имеет такое же количество атомов, как в 12 граммах углерода-12, или, точнее, 6 ×10²³ атомов.
Концентрацию раствора можно измерить разными способами, например, путем измерения отношения массы растворенного вещества к общему объему раствора.Здесь мы рассматриваем молярную концентрацию , которая измеряется как отношение количества вещества в молях к общему объему раствора. Веществом в нашем случае является растворенное вещество, а объем измеряется для всего раствора, даже если в нем есть другие растворенные вещества. Здесь количество вещества измеряется как количество элементарных объектов (например, атомов или молекул) вещества. Поскольку даже в небольшом объеме вещества существует огромное количество элементарных объектов, мы используем специальные единицы, называемые молями, для количества вещества.Один моль определяется как количество атомов в 12 граммах углерода-12, что составляет примерно 6×10²³ атомов.
Поскольку даже в небольшом объеме вещества существует огромное количество элементарных объектов, мы используем специальные единицы, называемые молями, для количества вещества.Один моль определяется как количество атомов в 12 граммах углерода-12, что составляет примерно 6×10²³ атомов.
Моли очень удобно использовать для веществ, находящихся в достаточно малых количествах, которые можно легко измерить с помощью бытовых или промышленных измерительных приборов. В противном случае нам пришлось бы использовать либо очень большие числа, либо очень малые величины (для массы или веса), с которыми трудно работать и которые невозможно измерить с помощью доступных в настоящее время измерительных устройств. Элементарными частицами, наиболее часто используемыми при работе с молями, являются атомы.Мы также можем использовать моли для измерения других частиц, таких как молекулы или электроны, но нам нужно указать, какие частицы используются в этом случае. Молярную концентрацию также иногда называют молярностью .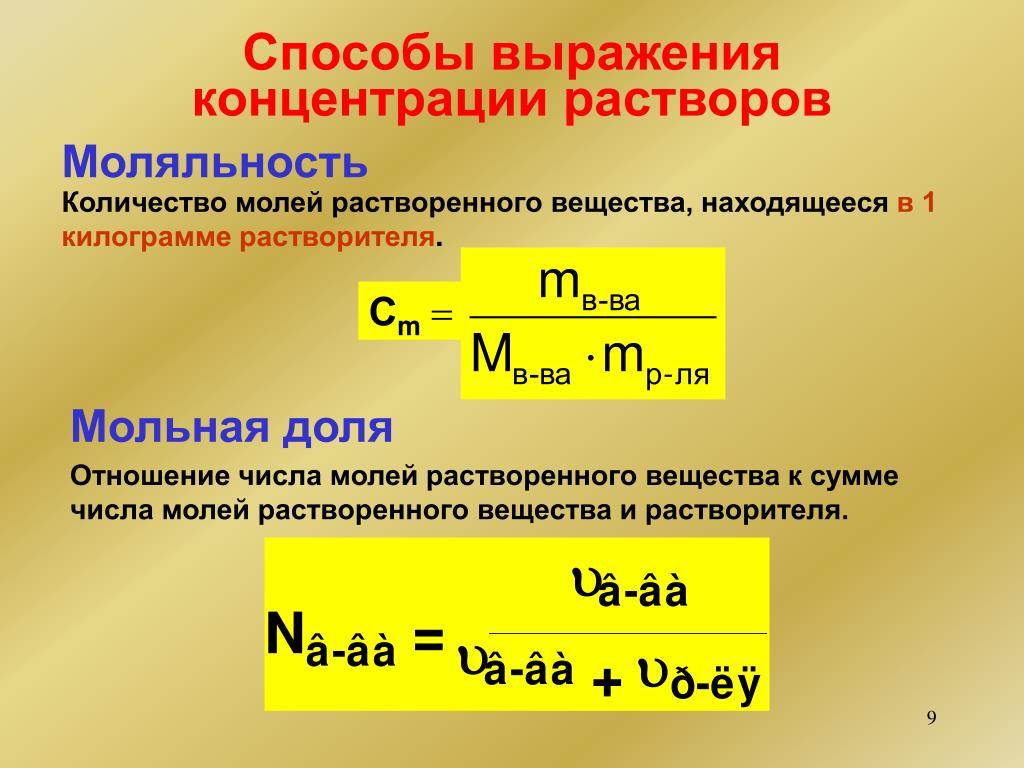
Мы должны быть осторожны, чтобы не спутать молярность с другим родственным свойством, моляльностью . В отличие от молярности, моляльность – это отношение количества вещества растворенного вещества к массе растворителя, а не к массе всего раствора. В некоторых случаях значения молярности и моляльности раствора очень близки.Это в том случае, если наш растворитель — вода, и если количество растворенного вещества достаточно мало, чтобы его масса и объем были незначительными — но это не всегда так.
Масса одного моля различных веществ. Его можно найти с помощью периодической таблицы.
Изменения молярной концентрации
Молярная концентрация может зависеть от температуры, хотя это зависит от веществ, присутствующих в этом растворе. Температура может вызвать расширение некоторых растворителей, и если растворенное вещество не расширяется вместе с растворителем, молярная концентрация уменьшается.Также возможно, что растворитель испарится, а количество растворенного вещества останется прежним при повышении температуры. В этом случае концентрация раствора увеличится. В некоторых случаях происходит обратное. Иногда повышение или понижение температуры изменяет растворимость. В результате растворитель полностью или частично перестает растворяться в растворе, а концентрация снижается.
В этом случае концентрация раствора увеличится. В некоторых случаях происходит обратное. Иногда повышение или понижение температуры изменяет растворимость. В результате растворитель полностью или частично перестает растворяться в растворе, а концентрация снижается.
Единицы
Молярная концентрация измеряется в молях на единицу объема, например, в молях на литр или в молях на кубический метр.Последняя является единицей СИ. Его также можно измерить в молях на другую единицу объема.
Определение молярной концентрации
Чтобы найти молярную концентрацию, нам нужно знать количество вещества и общий объем раствора. Для определения количества вещества мы могли бы использовать молекулярную формулу этого вещества и информацию о массе этого вещества, присутствующего в растворе. В частности, чтобы найти, сколько молей раствора у нас есть, мы можем найти атомную массу каждого атома, присутствующего в молекуле, в таблице Менделеева, а затем разделить общую массу вещества на общий атомный вес атомов в таблице Менделеева. молекула.Мы должны убедиться, что перед сложением атомных масс мы умножаем каждую из атомных масс для конкретного атома на число атомов этого типа, присутствующих в молекуле.
молекула.Мы должны убедиться, что перед сложением атомных масс мы умножаем каждую из атомных масс для конкретного атома на число атомов этого типа, присутствующих в молекуле.
Возможно и обратное. Если мы знаем молярную концентрацию нашего раствора и формулу растворенного вещества, то мы можем определить количество растворителя, присутствующего в растворе, как в молях, так и в граммах. Для этого нам нужно будет проверить периодическую таблицу атомных весов, как описано ранее.
Примеры
Рассчитаем молярность раствора, содержащего 3 столовые ложки пищевой соды, смешанные с 20 литрами воды. 1 столовая ложка составляет около 17 граммов, поэтому 3 столовые ложки составляют 51 грамм. Пищевая сода также известна как бикарбонат натрия, а ее химическая формула — NaHCO₃. В этом примере мы будем работать с атомами, поэтому давайте найдем атомные массы натрия (Na), водорода (H), углерода (C) и кислорода (O).
Na: 22.989769
H: 1.00794
C: 12.0107
O: 15.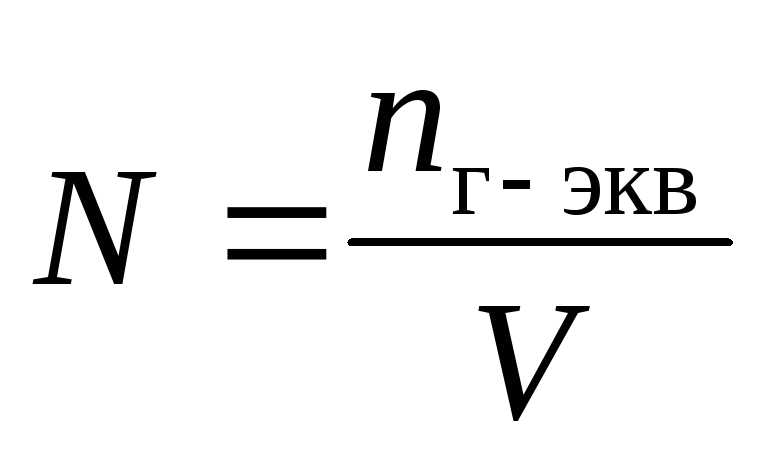 9994
9994
Молярная концентрация 1 кубика сахара в одной чашке чая составляет 0,049 моль/л.
У нас в формуле есть O₃, поэтому нам нужно умножить атомную массу кислорода на 3, получив 47,9982. Теперь добавим эти атомные массы. Мы получим 84.006609. Атомные массы в периодической таблице обычно указываются в атомных единицах массы. Это относится и к нашим данным. Эта атомная масса в атомных единицах массы соответствует массе 1 моля элемента в граммах.Это означает, что масса 1 моля NaHCO₃ составляет 84,006609 грамма. Нам дали 51 грамм соды. Найдем, сколько у нас молей, разделив общее количество 51 грамма на количество граммов в одном моле, или 84 грамма. Получаем около 0,6 моль.
Это означает, что мы разбавили 0,6 моля пищевой соды в 20 литрах воды. Разделим это количество пищевой соды на 20 литров, чтобы получить молярную концентрацию: 0,6 моль/20 л = 0,03 моль/л. Мы получили низкую концентрацию, потому что использовали такое небольшое количество соды и разводили ее в большом объеме воды.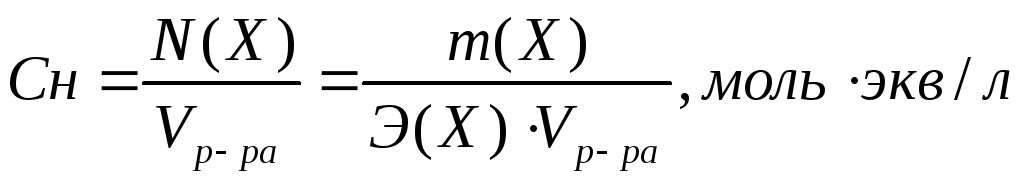
Возьмем другой пример и найдем молярную концентрацию 1 кубика сахара в одной чашке чая. Столовый сахар состоит из сахарозы. Сначала найдем вес одного моля сахарозы, формула которой C₁₂H₂₂O₁₁. Используя периодическую таблицу, находим, что масса одного моля равна 12×12 + 22×1 + 11×16 = 342 грамма. 1 куб сахара равен 4 граммам, что составляет 4/342 = 0,01 моля. 1 чашка — это 237 миллилитров, поэтому 1 кубик сахара, смешанный с одной чашкой чая, дает 0,01 моль/237 миллилитров × 1000 (для перевода в литры) = 0.049 моль/л.
Использование
Стехиометрия помогает определить количество веществ, которые реагируют друг с другом, а также количества веществ, которые образуются в результате этой реакции.
Молярная концентрация удобна в использовании. Если температура и давление одинаковы для всех газов, то один моль каждого газа занимает один и тот же объем, и мы можем использовать это свойство для различных расчетов.
Для удобства при работе с химическими реакциями часто используется молярная концентрация.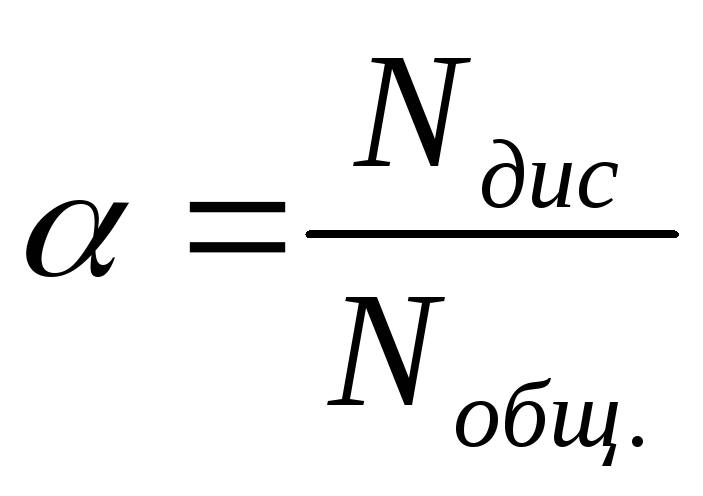 Раздел химии, занимающийся определением количества исходных веществ и продуктов химических реакций, стехиометрия , часто имеет дело с молярной концентрацией. Мы можем найти молярную концентрацию, используя химическую формулу конечного компонента, который становится растворенным, как мы сделали для пищевой соды, но мы также можем использовать химические уравнения, чтобы найти ее. Нам нужно будет знать формулы и количества веществ (реагентов), которые используются в нашей химической реакции для создания растворенного вещества в качестве конечного продукта.Затем нам нужно будет сбалансировать уравнение, чтобы узнать результирующий продукт, а затем использовать периодическую таблицу, как описано выше, чтобы найти необходимую информацию для расчета молярной концентрации. В этом случае мы можем сделать и обратное, если знаем молярную концентрацию.
Раздел химии, занимающийся определением количества исходных веществ и продуктов химических реакций, стехиометрия , часто имеет дело с молярной концентрацией. Мы можем найти молярную концентрацию, используя химическую формулу конечного компонента, который становится растворенным, как мы сделали для пищевой соды, но мы также можем использовать химические уравнения, чтобы найти ее. Нам нужно будет знать формулы и количества веществ (реагентов), которые используются в нашей химической реакции для создания растворенного вещества в качестве конечного продукта.Затем нам нужно будет сбалансировать уравнение, чтобы узнать результирующий продукт, а затем использовать периодическую таблицу, как описано выше, чтобы найти необходимую информацию для расчета молярной концентрации. В этом случае мы можем сделать и обратное, если знаем молярную концентрацию.
Когда мы начинаем с нескольких веществ, которые реагируют друг с другом, мы можем найти формулу конечного продукта, уравновешивая уравнение химической реакции между веществами. Если мы смешаем продукт этой реакции с раствором, мы сможем найти молярную концентрацию, как описано в предыдущих примерах.
Если мы смешаем продукт этой реакции с раствором, мы сможем найти молярную концентрацию, как описано в предыдущих примерах.
Давайте рассмотрим простой пример. Мы снова будем использовать пищевую соду и смешать ее с уксусом для интересной химической реакции. Вы можете легко найти эти вещества, возможно, они уже есть в вашей кладовой. Как мы упоминали ранее, формула пищевой соды — NaHCO₃. Уксус не является чистым соединением, это 5% смесь уксусной кислоты с водой. Химическая формула уксусной кислоты CH₃COOH. Концентрация может быть меньше, в зависимости от производителя и страны происхождения, потому что стандартными в разных странах считаются разные концентрации.Нам не нужно беспокоиться о воде в этой реакции, потому что вода и пищевая сода не реагируют друг с другом.
Запишем и составим уравнение реакции пищевой соды с уксусной кислотой:
NaHCO3 + CH3COOH → NaC₂H3O₂ + H₂CO₃
Один из продуктов этой реакции, H₂CO₃, нестабилен и вступит в другую реакцию:
H₂CO₃ → H₂O + CO₂
Итак, в итоге у нас есть вода (H₂O), углекислый газ (CO₂) и ацетат натрия (NaC₂H₃O₂). Затем мы можем смешать ацетат натрия с водой и приступить к расчету молярной концентрации, как мы сделали в предыдущем примере для пищевой соды. Мы должны быть осторожны при расчете объема воды, чтобы учесть воду, с которой смешивали уксусную кислоту, чтобы сделать уксус, и воду, которая была продуктом химической реакции. Ацетат натрия — интересное химическое соединение — его используют в грелках и грелках для рук.
Затем мы можем смешать ацетат натрия с водой и приступить к расчету молярной концентрации, как мы сделали в предыдущем примере для пищевой соды. Мы должны быть осторожны при расчете объема воды, чтобы учесть воду, с которой смешивали уксусную кислоту, чтобы сделать уксус, и воду, которая была продуктом химической реакции. Ацетат натрия — интересное химическое соединение — его используют в грелках и грелках для рук.
Когда мы используем стехиометрию для определения либо количества реагентов, либо количества конечного продукта, используемого позже при расчетах молярной концентрации, мы заметим, что только ограниченное количество одного реагента будет реагировать с другими реагентами.Это повлияет на выход нашего конечного продукта. Поскольку молярная концентрация может помочь нам выполнить расчеты «обратного инжиниринга», чтобы выяснить, с какого количества реагентов мы должны начать, это полезная концепция для практических приложений при работе с химическими реакциями.
Всякий раз, когда мы используем рецепт, будь то приготовление пищи, изготовление лекарств или даже создание условий для аквариумных рыбок, нам важна концентрация. В то время как в повседневной жизни мы можем предпочесть работать с граммами, в химии или фармации часто используется молярная концентрация.
В то время как в повседневной жизни мы можем предпочесть работать с граммами, в химии или фармации часто используется молярная концентрация.
При изготовлении лекарств, контактирующих с мембранами организма, таких как глазные лекарства, фармацевты должны привести осмотическую концентрацию лекарства в соответствие с осмотической концентрацией жидкости организма по другую сторону мембраны. Если этого не сделать, различия в осмотической концентрации могут вызвать перемещение жидкости через мембрану и привести к проблемам.
В аптеке
Молярная концентрация важна при смешивании соединений для создания лекарства, поскольку она влияет на то, как это лекарство действует на организм.Некоторые лекарства ядовиты, если их концентрация слишком высока, а многие не так эффективны, когда концентрация слишком мала. Кроме того, важна концентрация в обмене жидкости между оболочками организма. Здесь мы можем рассмотреть молярную концентрацию или рассчитать значение осмотической концентрации , используя молярную концентрацию. В этом контексте чаще используется осмотическая концентрация. Если вещество на одной стороне мембраны, например лекарство, имеет более высокую концентрацию, чем на другой стороне мембраны, например внутри глаза, то более концентрированный раствор будет поступать в область с меньшей концентрацией.Этот поток может создать проблемы. Например, если есть поток жидкости в клетку, такую как клетка крови, то клетка может достичь своей емкости для жидкости и разрушиться. Отток жидкости из клетки будет столь же проблематичным, поскольку будет мешать нормальному функционированию клетки. Поэтому, как правило, желательно, чтобы концентрация жидкости в целевой области тела, такой как кровь, соответствовала концентрации лекарства.
В этом контексте чаще используется осмотическая концентрация. Если вещество на одной стороне мембраны, например лекарство, имеет более высокую концентрацию, чем на другой стороне мембраны, например внутри глаза, то более концентрированный раствор будет поступать в область с меньшей концентрацией.Этот поток может создать проблемы. Например, если есть поток жидкости в клетку, такую как клетка крови, то клетка может достичь своей емкости для жидкости и разрушиться. Отток жидкости из клетки будет столь же проблематичным, поскольку будет мешать нормальному функционированию клетки. Поэтому, как правило, желательно, чтобы концентрация жидкости в целевой области тела, такой как кровь, соответствовала концентрации лекарства.
Пациент получает лекарство из капельницы на шесте.
Примечание по переводу молярности в осмотическую концентрацию: в некоторых случаях эти значения совпадают, но не всегда. Это будет зависеть от того, разделились ли растворенные в растворе вещества на ионы в процессе, называемом диссоциацией . Это связано с тем, что осмотическая концентрация рассматривает частицы в целом, а молярность рассматривает только определенный тип частиц, например, молекулы. Так, например, если мы рассматриваем молекулы для молярной концентрации, но наше вещество разделилось на ионы, то у нас было бы меньше молекул, чем общее количество частиц.В результате молярная концентрация будет ниже. Мы должны быть осторожны и знать физические свойства раствора, чтобы иметь возможность преобразовать молярную концентрацию в осмотическую концентрацию.
Это связано с тем, что осмотическая концентрация рассматривает частицы в целом, а молярность рассматривает только определенный тип частиц, например, молекулы. Так, например, если мы рассматриваем молекулы для молярной концентрации, но наше вещество разделилось на ионы, то у нас было бы меньше молекул, чем общее количество частиц.В результате молярная концентрация будет ниже. Мы должны быть осторожны и знать физические свойства раствора, чтобы иметь возможность преобразовать молярную концентрацию в осмотическую концентрацию.
Фармацевты также должны учитывать тоничность раствора. Тоничность является родственным свойством, зависящим от концентрации. В отличие от осмотической концентрации тоничность указывает на концентрацию веществ в растворе, которая не может пройти через мембрану в рассматриваемом организме.Эти вещества оказывают давление на мембрану из-за осмоса и их неспособности преодолевать барьер. Когда лекарство предназначено для попадания в кровоток или любую другую жидкость организма, фармацевты уравновешивают тоничность, чтобы гарантировать, что это лекарство не вызывает осмотического давления.
Для обеспечения правильного тонуса лекарство часто разводят в солевом растворе . Это раствор поваренной соли (NaCl) в воде, приготовленный в концентрации, обеспечивающей правильный тонус, соответствующий внутренней жидкости организма при смешивании с лекарством.Обычно он находится в стерильном контейнере при внутривенном введении или смешивается непосредственно с лекарством.
Справочная информация
Эта статья была написана Катериной Юрием
Вам трудно перевести единицу измерения на другой язык? Помощь доступна! Разместите свой вопрос в TCTerms и вы получите ответ от опытных технических переводчиков в считанные минуты.
6.3 Молярность – Общая химия 1 и 2
Цели обучения
К концу этого раздела вы сможете:
- Описать основные свойства растворов
- Расчет концентрации раствора с использованием молярности
- Выполнение расчетов разбавления с использованием уравнения разбавления
В предыдущих разделах мы сосредоточились на составе веществ: образцы вещества, которые содержат только один тип элемента или соединения.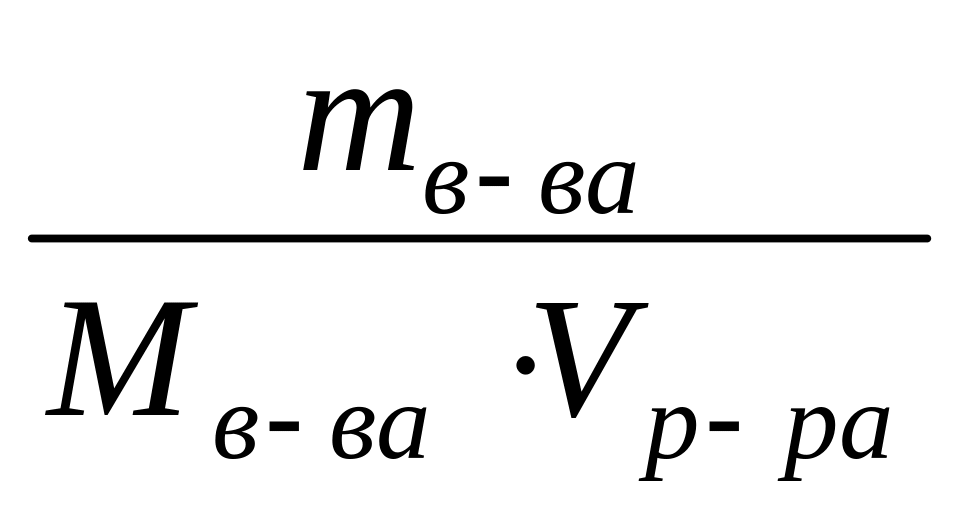 Однако смеси — образцы вещества, содержащие физически соединенные два или более вещества, — встречаются в природе чаще, чем чистые вещества. Подобно чистому веществу, относительный состав смеси играет важную роль в определении ее свойств. Относительное количество кислорода в атмосфере планеты определяет ее способность поддерживать аэробную жизнь. Относительное количество железа, углерода, никеля и других элементов в стали (смесь, известная как «сплав») определяет ее физическую прочность и устойчивость к коррозии.Относительное количество активного ингредиента в лекарстве определяет его эффективность в достижении желаемого фармакологического эффекта. Относительное количество сахара в напитке определяет его сладость (см. рис. 1). В этом разделе мы опишем один из наиболее распространенных способов количественной оценки относительного состава смесей.
Однако смеси — образцы вещества, содержащие физически соединенные два или более вещества, — встречаются в природе чаще, чем чистые вещества. Подобно чистому веществу, относительный состав смеси играет важную роль в определении ее свойств. Относительное количество кислорода в атмосфере планеты определяет ее способность поддерживать аэробную жизнь. Относительное количество железа, углерода, никеля и других элементов в стали (смесь, известная как «сплав») определяет ее физическую прочность и устойчивость к коррозии.Относительное количество активного ингредиента в лекарстве определяет его эффективность в достижении желаемого фармакологического эффекта. Относительное количество сахара в напитке определяет его сладость (см. рис. 1). В этом разделе мы опишем один из наиболее распространенных способов количественной оценки относительного состава смесей.
 (кредит: Джейн Уитни)
(кредит: Джейн Уитни)
Ранее мы определили растворы как однородные смеси, имея в виду, что состав смеси (и, следовательно, ее свойства) однородны по всему ее объему. Решения часто встречаются в природе и также были реализованы во многих формах искусственных технологий. Мы рассмотрим более подробно свойства растворов в главе о растворах и коллоидах, а здесь мы представим некоторые из основных свойств растворов.
Относительное количество данного компонента раствора известно как его концентрация .Часто, хотя и не всегда, раствор содержит один компонент с концентрацией, значительно превышающей концентрацию всех остальных компонентов. Этот компонент называется растворителем и может рассматриваться как среда, в которой другие компоненты диспергированы или растворены . Растворы, в которых вода является растворителем, конечно, очень распространены на нашей планете. Раствор, в котором вода является растворителем, называется водным раствором .
Растворенное вещество — это компонент раствора, который обычно присутствует в гораздо более низкой концентрации, чем растворитель.Концентрации растворенных веществ часто описываются качественными терминами, такими как разбавленный (относительно низкой концентрации) и концентрированный (относительно высокой концентрации).
Концентрации могут быть количественно оценены с использованием самых разных единиц измерения, каждая из которых удобна для конкретного применения. Молярность ( M ) — полезная единица концентрации для многих применений в химии. Молярность определяется как количество молей растворенного вещества ровно в 1 литре (1 л) раствора:
[латекс] M = \frac{\text{мол растворенного вещества}}{\text{L раствор}}[/latex]
Пример 1
Расчет молярных концентраций
Образец безалкогольного напитка объемом 355 мл содержит 0.133 моль сахарозы (сахар столовый).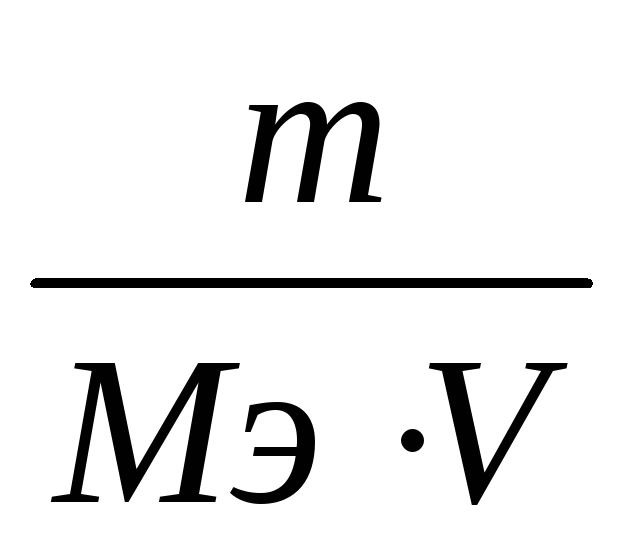 Какова молярная концентрация сахарозы в напитке?
Какова молярная концентрация сахарозы в напитке?
Раствор
Поскольку даны молярное количество растворенного вещества и объем раствора, молярность можно рассчитать, используя определение молярности. В соответствии с этим определением объем раствора необходимо преобразовать из мл в л:
[латекс] M = \ frac {\ text {моль растворенного вещества}} {\ text {L раствор}} = \ frac {0,133 \; \ text {mol}} {355 \; \ text {мл} \ times \ frac {1 \;\text{L}}{1000 \;\text{мл}}} = 0.375 \; М[/латекс]
Проверьте свои знания
Чайная ложка столового сахара содержит около 0,01 моль сахарозы. Какова молярность сахарозы, если чайная ложка сахара растворена в чашке чая объемом 200 мл?
Пример 2
Получение молей и объемов из молярных концентраций
Сколько сахара (моль) содержится в скромном глотке (~10 мл) безалкогольного напитка из примера 1?
Решение
В этом случае мы можем изменить определение молярности, чтобы выделить искомое количество молей сахара. Затем мы заменяем значение молярности, которое мы получили в примере 1, 0,375 M :
Затем мы заменяем значение молярности, которое мы получили в примере 1, 0,375 M :
[латекс] M = \frac{\text{мол раствор}}{\text{L раствор}}[/latex]
[латекс]\text{mol раствор} = M \times \text{L раствор}[/ латекс]
[латекс]\text{моль растворенного вещества} = 0,375 \;\frac{\text{моль сахара}}{\text{L}} \times (10 \;\text{мл} \times \frac{1 \text {L}}{1000 \;\text{мл}}) = 0,004 \;\text{моль сахара}[/latex]
Проверьте свои знания
Какой объем (мл) подслащенного чая, описанного в примере 1, содержит такое же количество сахара (моль), что и 10 мл безалкогольного напитка в этом примере?
Пример 3
Расчет молярных концентраций по массе растворенного вещества
Дистиллированный белый уксус (рис. 2) представляет собой раствор уксусной кислоты CH 3 CO 2 H в воде.В 0,500 л раствора уксуса содержится 25,2 г уксусной кислоты. Какова концентрация раствора уксусной кислоты в молярных единицах?
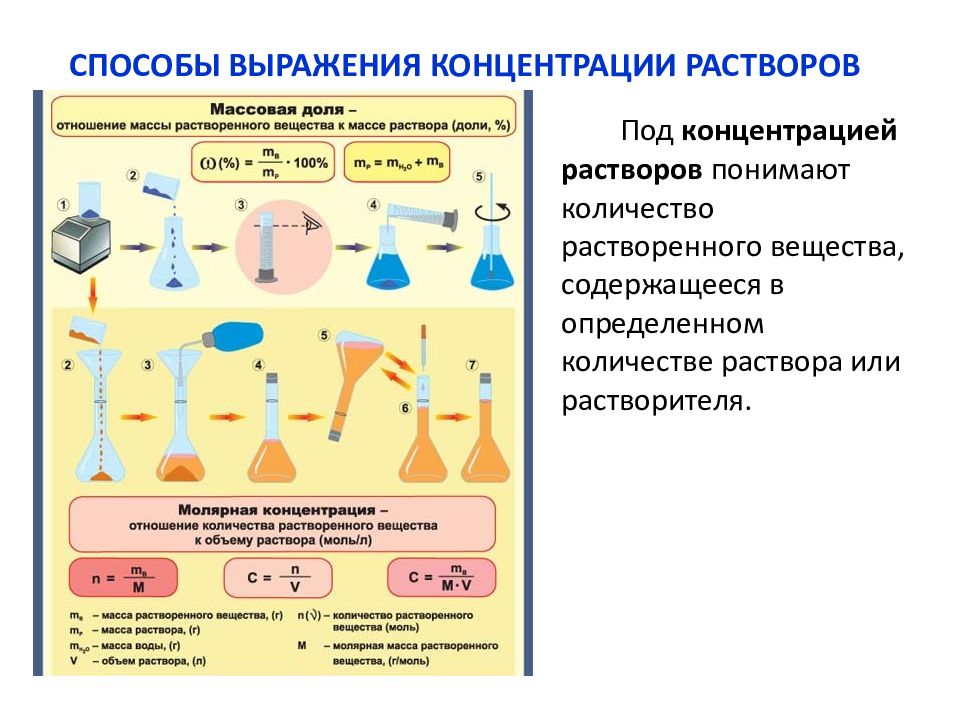 Дистиллированный белый уксус представляет собой раствор уксусной кислоты в воде.
Дистиллированный белый уксус представляет собой раствор уксусной кислоты в воде. Решение
Как и в предыдущем заштрихованном текстовом поле, определение молярности является основным уравнением, используемым для расчета искомого количества. В этом случае масса растворенного вещества предоставляется вместо его молярного количества, поэтому мы должны использовать молярную массу растворенного вещества, чтобы получить количество растворенного вещества в молях:
[латекс] M = \frac{\text{моль растворенного вещества}}{\text{L раствор}} = \frac{25.2 \;\text{г CH}_3\text{CO}_2\text{H} \times \frac{1 \;\text{моль CH}_2\text{CO}_2\text{H}}{60,052 \;\text{g CH}_2\text{CO}_2\text{H}}}{0,500 \;\text{L раствор}} = 0,839 \;M[/latex]
[латекс]\begin{array}{r @{{}={}} l} M & \frac{\text{mol раствор}}{\text{L раствор}} = 0,839\;M \\[1em ] M & \frac{0,839 \;\text{моль растворенного вещества}}{1,00 \;\text{L раствор}} \end{array}[/latex]
Проверьте свои знания
Рассчитайте молярность 6,52 г CoCl 2 (128. 9 г/моль) растворяют в водном растворе общим объемом 75,0 мл.
9 г/моль) растворяют в водном растворе общим объемом 75,0 мл.
Пример 4
Определение массы растворенного вещества в заданном объеме раствора
Сколько граммов NaCl содержится в 0,250 л раствора 5,30- М ?
Раствор
Указаны объем и молярность раствора, поэтому количество (моль) растворенного вещества легко вычисляется, как показано в Примере 2:
[латекс]\текст{моль растворенного вещества} = M \times \text{L раствор}[/latex]
[латекс]\текст{моль растворенного вещества} = 5.30 \;\frac{\text{моль NaCl}}{\text{L}} \times 0,250 \;\text{L} = 1,325 \;\text{моль NaCl}[/latex]
Наконец, это молярное количество используется для получения массы NaCl:
[латекс]1,325 \;\text{моль NaCl} \times \frac{58,44 \;\text{г NaCl}}{\text{моль NaCl}} = 77,4 \;\text{г NaCl}[/latex]
Check Your Learning
Сколько граммов CaCl 2 (110,98 г/моль) содержится в 250,0 мл 0,200- М раствора хлорида кальция?
При пошаговом выполнении расчетов, как в примере 4, важно воздерживаться от округления любых промежуточных результатов расчета, что может привести к ошибкам округления в конечном результате. В примере 4 молярное количество NaCl, вычисленное на первом этапе, 1,325 моль, было бы должным образом округлено до 1,32 моль, если бы его нужно было сообщить; однако, несмотря на то, что последняя цифра (5) не имеет значения, ее необходимо сохранить в качестве защитной цифры в промежуточных вычислениях. Если бы мы не сохранили эту защитную цифру, окончательный расчет массы NaCl составил бы 77,1 г, т. е. разница в 0,3 г.
В примере 4 молярное количество NaCl, вычисленное на первом этапе, 1,325 моль, было бы должным образом округлено до 1,32 моль, если бы его нужно было сообщить; однако, несмотря на то, что последняя цифра (5) не имеет значения, ее необходимо сохранить в качестве защитной цифры в промежуточных вычислениях. Если бы мы не сохранили эту защитную цифру, окончательный расчет массы NaCl составил бы 77,1 г, т. е. разница в 0,3 г.
Помимо сохранения защитной цифры для промежуточных вычислений, мы также можем избежать ошибок округления, выполняя вычисления за один шаг (см. пример 5).Это устраняет промежуточные шаги, так что округляется только окончательный результат.
Пример 5
Определение объема раствора, содержащего заданную массу растворенного вещества
В примере 3 мы обнаружили, что типичная концентрация уксуса составляет 0,839 M . В каком объеме уксуса содержится 75,6 г уксусной кислоты?
Раствор
Сначала используйте молярную массу для расчета молей уксусной кислоты по заданной массе:
[латекс]\текст{г растворенного вещества} \times \frac{\text{моль растворенного вещества}}{\текст{г растворенного вещества}} = \text{моль растворенного вещества}[/латекс]
Затем используйте молярность раствора для расчета объема раствора, содержащего это молярное количество растворенного вещества:
[латекс]\текст{моль растворенного вещества} \times \frac{\text{L раствор}}{\text{моль растворенного вещества}} = \text{L раствор}[/latex]
Объединение этих двух шагов в один дает:
[латекс]\текст{г растворенного вещества} \times \frac{\text{моль растворенного вещества}}{\text{г растворенного вещества}} \times \frac{\text{L раствор}}{\text{моль растворенного вещества}} = \text{L решение}[/latex][latex]75. 6 \;\text{g CH}_3\text{CO}_2\text{H} (\frac{\text{моль CH}_3\text{CO}_2\text{H}}{60,05 \;\text {g}}) (\frac{\text{L раствор}}{0,839 \;\text{моль CH}_3\text{CO}_2\text{H}}) = 1,50 \;\text{L раствор} [/латекс]
6 \;\text{g CH}_3\text{CO}_2\text{H} (\frac{\text{моль CH}_3\text{CO}_2\text{H}}{60,05 \;\text {g}}) (\frac{\text{L раствор}}{0,839 \;\text{моль CH}_3\text{CO}_2\text{H}}) = 1,50 \;\text{L раствор} [/латекс]
Проверьте свои знания
Какой объем раствора 1,50- М KBr содержит 66,0 г KBr?
Разбавление — это процесс, при котором концентрация раствора уменьшается путем добавления растворителя. Например, можно сказать, что стакан чая со льдом становится все более разбавленным по мере таяния льда.Вода из тающего льда увеличивает объем растворителя (воды) и общий объем раствора (чай со льдом), тем самым уменьшая относительные концентрации растворенных веществ, которые придают напитку его вкус (рис. 3).
Рисунок 3. Оба раствора содержат одинаковую массу нитрата меди. Раствор справа более разбавлен, потому что нитрат меди растворен в большем количестве растворителя. (кредит: Марк Отт) Разбавление также является обычным способом приготовления растворов желаемой концентрации. Добавляя растворитель к отмеренной порции более концентрированного исходного раствора , мы можем добиться определенной концентрации. Например, коммерческие пестициды обычно продаются в виде растворов, в которых концентрация активных ингредиентов намного выше, чем это необходимо для их применения. Прежде чем их можно будет использовать на сельскохозяйственных культурах, пестициды должны быть разбавлены. Это также очень распространенная практика для подготовки ряда обычных лабораторных реагентов (рис. 4).
Добавляя растворитель к отмеренной порции более концентрированного исходного раствора , мы можем добиться определенной концентрации. Например, коммерческие пестициды обычно продаются в виде растворов, в которых концентрация активных ингредиентов намного выше, чем это необходимо для их применения. Прежде чем их можно будет использовать на сельскохозяйственных культурах, пестициды должны быть разбавлены. Это также очень распространенная практика для подготовки ряда обычных лабораторных реагентов (рис. 4).
Можно использовать простое математическое соотношение, чтобы связать объемы и концентрации раствора до и после процесса разбавления. По определению молярности молярное количество растворенного вещества в растворе равно произведению молярности раствора на его объем в литрах:
[латекс]n = МЛ[/латекс]
Подобные выражения могут быть написаны для раствора до и после его разбавления:
[латекс]n_1 = M_1L_1[/латекс]
[латекс]n_2 = M_2L_2[/латекс]
, где индексы «1» и «2» относятся к раствору до и после разбавления соответственно. Поскольку процесс разбавления не меняет количество растворенного вещества в растворе, n 1 = n 2 . Таким образом, эти два уравнения можно приравнять друг другу:
Поскольку процесс разбавления не меняет количество растворенного вещества в растворе, n 1 = n 2 . Таким образом, эти два уравнения можно приравнять друг другу:
[латекс]M_1L_1 = M_2L_2[/латекс]
Это соотношение обычно называют уравнением разбавления. Хотя мы получили это уравнение, используя молярность в качестве единицы концентрации и литры в качестве единицы объема, другие единицы концентрации и объема могут использоваться, если единицы должным образом сокращаются в соответствии с методом метки фактора.Отражая эту универсальность, уравнение разбавления часто записывают в более общей форме:
.[латекс]C_1V_1 = C_2V_2[/латекс]
, где C и V — концентрация и объем соответственно.
Используйте симуляцию, чтобы исследовать взаимосвязь между количеством растворенного вещества, объемом раствора и концентрацией, а также подтвердить уравнение разбавления.
Пример 6
Определение концентрации разбавленного раствора
Если 0. 850 л 5,00- М раствора нитрата меди Cu(NO 3 ) 2 разбавляют до объема 1,80 л добавлением воды, какова молярность разбавленного раствора?
850 л 5,00- М раствора нитрата меди Cu(NO 3 ) 2 разбавляют до объема 1,80 л добавлением воды, какова молярность разбавленного раствора?
Раствор
Даны объем и концентрация исходного раствора V 1 и C 1 , а также объем полученного разбавленного раствора V
7 2 9 9. Нам нужно найти концентрацию разбавленного раствора,
C 2 .Таким образом, мы перестраиваем уравнение разбавления, чтобы выделить C 2 : [латекс]C_1V_1 = C_2V_2[/латекс]
[латекс]C_2 = \frac{C_1V_1}{V_2}[/латекс]
Поскольку исходный раствор разбавляется более чем в два раза (объем увеличивается с 0,85 л до 1,80 л), можно ожидать, что концентрация разбавленного раствора будет меньше половины 5 M . Мы сравним эту приблизительную оценку с расчетным результатом, чтобы проверить наличие грубых ошибок в вычислениях (например, таких как неправильная замена заданных величин). Подстановка данных значений для членов в правой части этого уравнения дает:
Подстановка данных значений для членов в правой части этого уравнения дает:
[латекс]C_2 = \frac{0,850 \;\text{L} \times 5,00 \frac{\text{mol}}{\text{L}}}{1,80 \;\text{L}} = 2,36 \ ;М[/латекс]
Этот результат хорошо согласуется с нашей приблизительной оценкой (это чуть меньше половины концентрации акций, 5 M ).
Проверьте свои знания
Какова концентрация раствора, полученного в результате разбавления 25,0 мл 2,04- М раствора CH 3 OH до 500.0 мл?
Пример 7
Объем разбавленного раствора
Какой объем 0,12 М HBr можно приготовить из 11 мл (0,011 л) 0,45 М HBr?
Раствор
Даны объем и концентрация маточного раствора V 1 и C 1 , а также концентрация полученного разбавленного раствора C
7 2 9 . Нам нужно найти объем разбавленного раствора,
V 2 . Таким образом, мы перестраиваем уравнение разбавления, чтобы выделить V 2 :
Таким образом, мы перестраиваем уравнение разбавления, чтобы выделить V 2 :
[латекс]C_1V_1 = C_2V_2[/латекс]
[латекс]V_2 = \frac{C_1V_1}{C_2}[/латекс]
Поскольку разбавленная концентрация (0,12 М ) составляет чуть более одной четверти исходной концентрации (0,45 М ), мы ожидаем, что объем разбавленного раствора будет примерно в четыре раза больше исходного объема, или около 44 мл. . Подстановка данных значений и решение неизвестного объема дает:
[латекс]V_2 = \frac{(0.45\;М)(0,011\;\текст{L})}{0,12\; M}[/латекс]
[латекс]V_2 = 0,041 \;\текст{L}[/латекс]
Объем 0,12- М раствора составляет 0,041 л (41 мл). Результат разумный и хорошо сравним с нашей приблизительной оценкой.
Проверьте свои знания
Для лабораторного эксперимента требуется 0,125 M HNO 3 . Какой объем 0,125 M HNO 3 можно приготовить из 0,250 л 1,88 M HNO 3 ?
Пример 8
Объем концентрированного раствора, необходимый для разбавления
Какой объем 1. 59 M KOH требуется для приготовления 5,00 л 0,100 M KOH?
59 M KOH требуется для приготовления 5,00 л 0,100 M KOH?
Раствор
Нам дана концентрация маточного раствора C 1 , а также объем и концентрация полученного разбавленного раствора V 2 и C 2 9 . Нам нужно найти объем стокового раствора, V 1 . Таким образом, мы перестраиваем уравнение разбавления, чтобы выделить V 1 :
[латекс]C_1V_1 = C_2V_2[/латекс]
[латекс]V_2 = \frac{C_2V_2}{C_2}[/латекс]
Так как концентрация разбавленного раствора 0.100 M составляет примерно одну шестнадцатую объема исходного раствора (1,59 M ), мы ожидаем, что объем исходного раствора составит примерно одну шестнадцатую объема разбавленного раствора, или около 0,3 литра. Подстановка данных значений и решение неизвестного объема дает:
[латекс]V_1 = \frac{(0,100\;M)(5,00 \;\text{L})}{1,59 \; M}[/латекс]
[латекс]V_1 = 0,314 \;\текст{L}[/латекс]
Таким образом, для приготовления нужного раствора нам потребуется 0,314 л раствора 1,59- М . Этот результат согласуется с нашей грубой оценкой.
Этот результат согласуется с нашей грубой оценкой.
Check Your Learning
Какой объем 0,575- М раствора глюкозы, C 6 H 12 O 6 , можно приготовить из 50,00 мл 3,09 М раствора глюкозы?
Пытаясь понять соединения в растворе, мы должны различать поведение ковалентных соединений и ионных соединений. Предполагая, что твердое вещество растворяется, ионные соединения диссоциируют на свои ионы.Напротив, для ковалентных соединений молекулы соединения остаются неповрежденными.
До сих пор в этом разделе мы рассматривали растворы сахара (C 6 H 12 O 6 ). Если бы мы могли видеть на уровне молекул, мы могли бы увидеть решение, подобное приведенному ниже, где треугольник представляет молекулу глюкозы. В то время как молекулы перемещаются в растворе, когда они растворяются в воде, атомы в молекуле не распадаются.Ковалентные связи не нарушены.
Напротив, когда ионное соединение растворяется в растворе, катионы и анионы разделяются (диссоциируют) и каждый ион окружен молекулами воды. Мы можем изобразить процесс диссоциации такого соединения, как NaCl, используя изображение ниже:
.
Если мы опустим молекулы воды (чтобы было легче увидеть ионы), ниже приведен пример раствора сульфата натрия Na 2 SO 4 . Сульфат-анионы будут иметь заряд -2, а катионы натрия — +1.
Обратите внимание, что когда ионное соединение диссоциирует, ковалентные связи любых многоатомных ионов (таких как сульфат) остаются нетронутыми. Также обратите внимание, что ионы в растворе присутствуют в том же соотношении, что и в твердом соединении. В этом случае на 1 ион SO 4 2- приходится 2 иона Na + .
Пример 9
Определение молей ионов в ионных соединениях :
Для каждого из следующих случаев, если 1 моль соединения растворится и диссоциирует, сколько молей ионов будет присутствовать в:
а) хлорид магния?
б) фосфат аммония?
Решение:
а) Формула хлорида магния: MgCl 2 .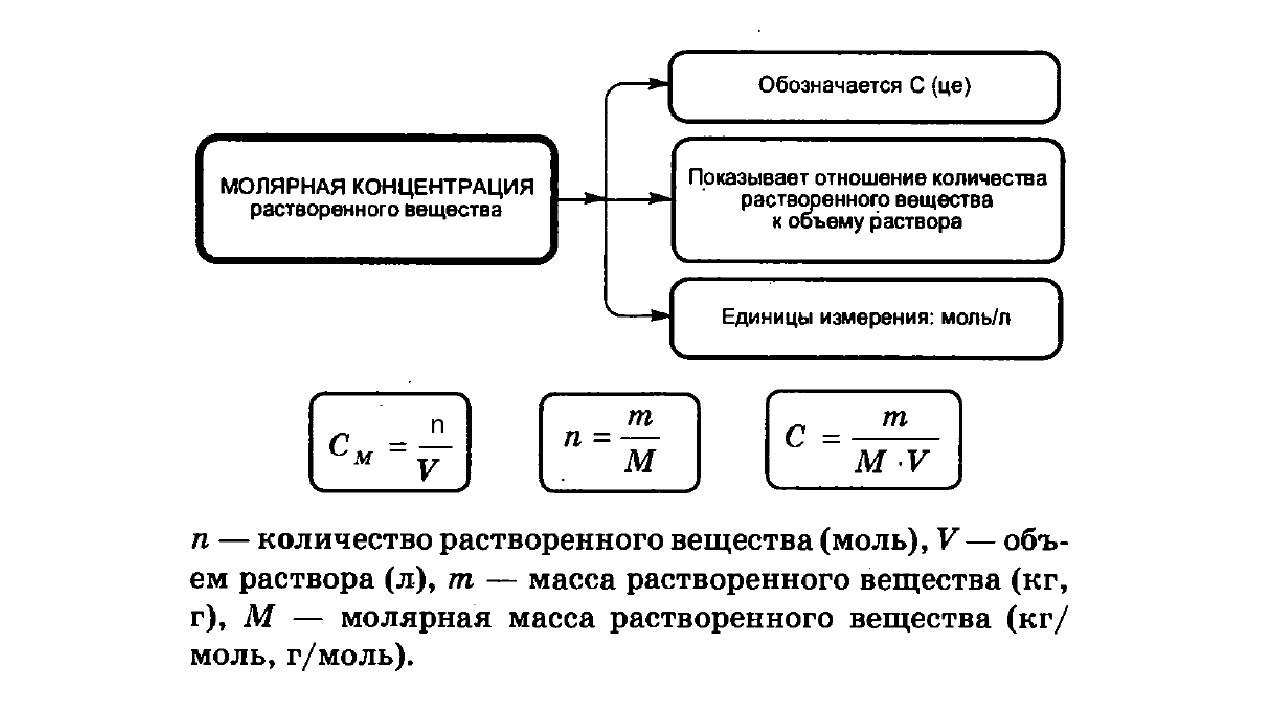 Он состоит из ионов Mg 2+ и ионов Cl – . Если в растворе диссоциирует моль MgCl 2 , то получится 1 моль ионов Mg 2+ и 2 моля ионов Cl – , всего 3 моля ионов.
Он состоит из ионов Mg 2+ и ионов Cl – . Если в растворе диссоциирует моль MgCl 2 , то получится 1 моль ионов Mg 2+ и 2 моля ионов Cl – , всего 3 моля ионов.
b) Формула фосфата аммония: (NH 4 ) 3 PO 4 . Он состоит из ионов NH 4 + и ионов PO 4 3-. Если 1 моль (NH 4 ) 3 PO 4 диссоциирует в растворе, то мы получим 3 моля ионов NH 4 + и 1 моль ионов PO 4 4-, всего 4 моля ионов.
Проверьте свои знания :
Сколько молей каждого иона получится из 1 моля сульфата аммония?
ОТВЕТ:
2 моля NH 4 + , 1 моль SO 4 2-
Поскольку ионное соединение диссоциирует в растворе, мы можем использовать наши знания о молярности для описания концентрации соединения в растворе ИЛИ концентрации ионов в растворе.
Пример 10
Отношение концентраций соединения к концентрациям его ионов в растворе
Если у вас есть раствор, содержащий 0,5 М сульфата калия, какова концентрация ионов калия в растворе? сульфат-ионов в растворе?
Раствор
Чтобы ответить на поставленные выше вопросы, нам нужно знать, сколько молей каждого иона содержится в литре раствора. Нам известно, что решение равно 0.{2-}_{4}[/латекс]
Имеет ли смысл этот результат? Мы видим, что концентрация ионов калия вдвое больше, чем сульфат-ионов. Учитывая, что при диссоциации ионов будет присутствовать в два раза больше ионов калия по сравнению с ионами сульфата, этот результат имеет смысл.
Check Your Learning
Если у вас есть 1,3 М раствор карбоната аммония (NH 4 ) 2 CO 3 , какова концентрация каждого иона?
Ответ:
2.6 M NH 4 + , 1,3 M CO 3 2-
Растворы — гомогенные смеси. Многие растворы содержат один компонент, называемый растворителем, в котором растворены другие компоненты, называемые растворенными веществами. Водный раствор – это раствор, для которого растворителем является вода. Концентрация раствора является мерой относительного количества растворенного вещества в данном количестве раствора. Концентрации могут быть измерены с использованием различных единиц, одной из очень полезных единиц является молярность, определяемая как количество молей растворенного вещества на литр раствора.Концентрация растворенного вещества в растворе может быть уменьшена путем добавления растворителя, процесс, называемый разбавлением. Уравнение разбавления представляет собой простое соотношение между концентрациями и объемами раствора до и после разбавления.
Многие растворы содержат один компонент, называемый растворителем, в котором растворены другие компоненты, называемые растворенными веществами. Водный раствор – это раствор, для которого растворителем является вода. Концентрация раствора является мерой относительного количества растворенного вещества в данном количестве раствора. Концентрации могут быть измерены с использованием различных единиц, одной из очень полезных единиц является молярность, определяемая как количество молей растворенного вещества на литр раствора.Концентрация растворенного вещества в растворе может быть уменьшена путем добавления растворителя, процесс, называемый разбавлением. Уравнение разбавления представляет собой простое соотношение между концентрациями и объемами раствора до и после разбавления.
- [латекс] M = \ frac {\ text {mol растворенного}} {\ text {L раствор}} [/latex]
- С 1 В 1 = С 2 В 2
Химия Упражнения в конце главы
- Объясните, что меняется, а что остается неизменным, когда 1.
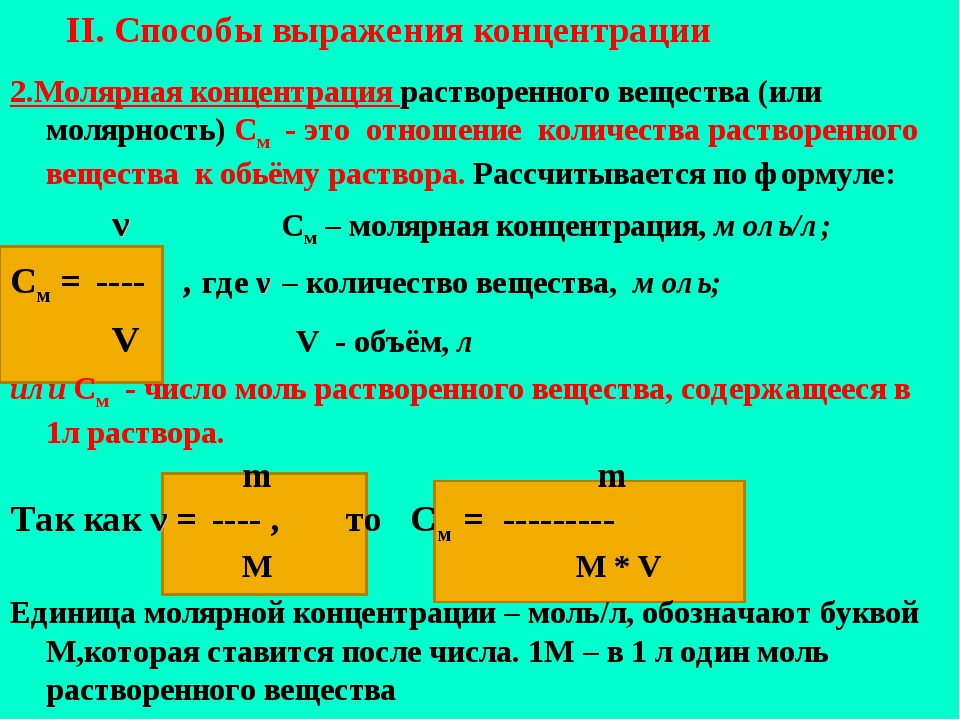 00 л раствора NaCl разбавляют до 1,80 л.
00 л раствора NaCl разбавляют до 1,80 л. - Какая информация нам нужна для расчета молярности раствора серной кислоты?
- Что имеется в виду, когда мы говорим, что образец раствора соли объемом 200 мл и образец раствора соли объемом 400 мл имеют одинаковую молярность? В чем сходство двух образцов? Чем отличаются эти два образца?
- Определите молярность каждого из следующих растворов:
(a) 0,444 моль CoCl 2 в 0,654 л раствора
(б) 98.0 г фосфорной кислоты, H 3 PO 4 , в 1,00 л раствора
(c) 0,2074 г гидроксида кальция, Ca(OH) 2 , в 40,00 мл раствора
(d) 10,5 кг Na 2 SO 4 ·10H 2 O в 18,60 л раствора
(д) 7,0 × 10 −3 моль I 2 в 100,0 мл раствора
(f) 1,8 × 10 4 мг HCl в 0,075 л раствора
- Определите молярность каждого из следующих растворов:
(а) 1.457 моль KCl в 1500 л раствора
(b) 0,515 г H 2 SO 4 в 1,00 л раствора
(c) 20,54 г Al(NO 3 ) 3 в 1575 мл раствора
(d) 2,76 кг CuSO 4 ·5H 2 O в 1,45 л раствора
(e) 0,005653 моль Br 2 в 10,00 мл раствора
(f) 0,000889 г глицина, C 2 H 5 NO 2 , в 1,05 мл раствора
- Рассмотрим этот вопрос: какова масса растворенного вещества в 0.
 500 л 0,30 M глюкозы, C 6 H 12 O 6 , используется для внутривенных инъекций?
500 л 0,30 M глюкозы, C 6 H 12 O 6 , используется для внутривенных инъекций?
(a) Опишите шаги, необходимые для ответа на вопрос.
(б) Ответьте на вопрос.
- Рассмотрим вопрос: какова масса растворенного вещества в 200,0 л 1,556- М раствора KBr?
(a) Опишите шаги, необходимые для ответа на вопрос.
(б) Ответьте на вопрос.
- Рассчитайте количество молей и массу растворенного вещества в каждом из следующих растворов:
(а) 2.00 л из 18,5 M H 2 SO 4 , концентрированная серная кислота
(б) 100,0 мл 3,8 × 10 −5 M NaCN, минимальная летальная концентрация цианида натрия в сыворотке крови
(c) 5,50 л из 13,3 M H 2 CO, формальдегид, используемый для «фиксации» образцов ткани
(d) 325 мл 1,8 × 10 −6 M FeSO 4 , минимальная концентрация сульфата железа, определяемая по вкусу в питьевой воде
- Рассчитайте количество молей и массу растворенного вещества в каждом из следующих растворов:
(а) 325 мл из 8.
 23 × 10 −5 M KI, источник йода в рационе
23 × 10 −5 M KI, источник йода в рационе (b) 75,0 мл 2,2 × 10 −5 M H 2 SO 4 , проба кислотного дождя
(c) 0,2500 л 0,1135 M K 2 CrO 4 , аналитический реагент, используемый для анализа железа
(d) 10,5 л 3.716 M (NH 4 ) 2 SO 4 , жидкое удобрение
- Рассмотрим этот вопрос: Какова молярность KMnO 4 в растворе 0.0908 г KMnO 4 в 0,500 л раствора?
(a) Опишите шаги, необходимые для ответа на вопрос.
(б) Ответьте на вопрос.
- Рассмотрим вопрос: какова молярность HCl, если 35,23 мл раствора HCl содержат 0,3366 г HCl?
(a) Опишите шаги, необходимые для ответа на вопрос.
(б) Ответьте на вопрос.
- Рассчитайте молярность каждого из следующих растворов:
(а) 0,195 г холестерина, C 27 H 46 O, в 0.
 100 л сыворотки, средняя концентрация холестерина в сыворотке человека
100 л сыворотки, средняя концентрация холестерина в сыворотке человека (b) 4,25 г NH 3 в 0,500 л раствора, концентрация NH 3 в аммиаке бытовом
(c) 1,49 кг изопропилового спирта, C 3 H 7 OH, в 2,50 л раствора, концентрация изопропилового спирта в медицинском спирте
(г) 0,029 г I 2 в 0,100 л раствора, растворимость I 2 в воде при 20 °C
- Рассчитайте молярность каждого из следующих растворов:
(a) 293 г HCl в 666 мл раствора, концентрированный раствор HCl
(б) 2.026 г FeCl 3 в 0,1250 л раствора, используемого в качестве неизвестного в лабораториях общей химии
(в) 0,001 мг Cd 2+ в 0,100 л, ПДК кадмия в питьевой воде
(d) 0,0079 г C 7 H 5 SNO 3 в одной унции (29,6 мл), концентрация сахарина в диетическом безалкогольном напитке.
- В 1,0 л молока содержится около 1,0 г кальция в виде Ca 2+ .
 Какова молярность Ca 2+ в молоке?
Какова молярность Ca 2+ в молоке? - Какой объем 1.00- M Fe(NO 3 ) 3 раствор можно развести для приготовления 1,00 л раствора с концентрацией 0,250 M ?
- Если 0,1718 л раствора 0,3556- M C 3 H 7 OH разбавить до концентрации 0,1222 M , каков объем полученного раствора?
- Если 4,12 л раствора 0,850 M -H 3 PO 4 разбавить до объема 10,00 л, какова будет концентрация полученного раствора?
- Какой объем 0.33- M C 12 H 22 O 11 раствор можно развести для приготовления 25 мл раствора с концентрацией 0,025 M ?
- Какова концентрация раствора NaCl, которая получается, когда 0,150 л раствора 0,556- М испаряют до тех пор, пока объем не уменьшится до 0,105 л?
- Какова молярность разбавленного раствора, когда каждый из следующих растворов разбавлен до заданного конечного объема?
(а) 1.
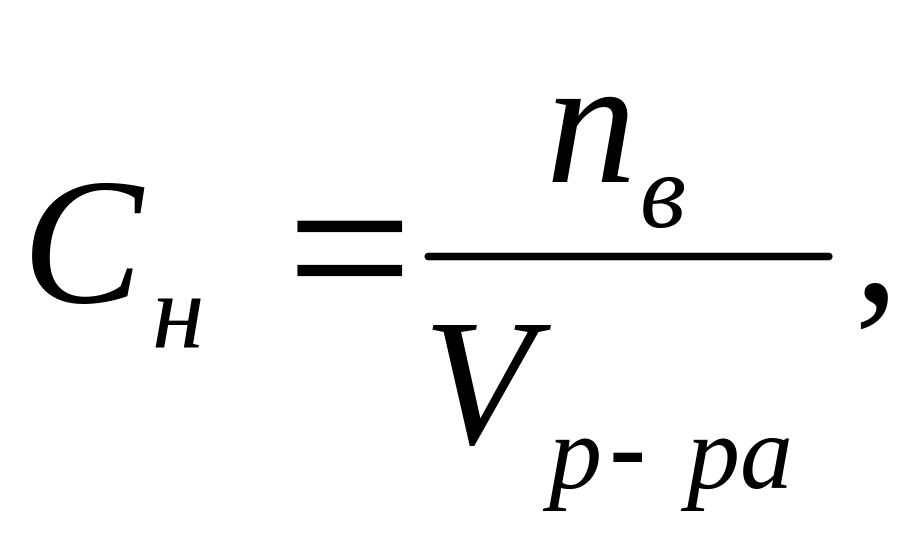 00 л 0,250- М раствора Fe(NO 3 ) 3 разбавляют до конечного объема 2,00 л
00 л 0,250- М раствора Fe(NO 3 ) 3 разбавляют до конечного объема 2,00 л (b) 0,5000 л 0,1222- M раствора C 3 H 7 OH разбавляют до конечного объема 1,250 л
(c) 2,35 л 0,350- М раствора H 3 PO 4 разбавляют до конечного объема 4,00 л
(d) 22,50 мл 0,025- М раствора С 12 Н 22 О 11 разбавляют до 100.0 мл
- Какова конечная концентрация раствора, полученного, когда 225,5 мл 0,09988- М раствора Na 2 CO 3 испаряют до тех пор, пока объем раствора не уменьшится до 45,00 мл?
- Для лаборатории общей химии приобретена бутыль с раствором концентрированной HCl объемом 2,00 л. Раствор содержал 868,8 г HCl. Какова молярность раствора?
- Эксперимент в лаборатории общей химии требует 2.00- М раствор HCl. Сколько мл 11,9 M HCl потребуется для получения 250 мл 2,00 M HCl?
- Какой объем раствора 0,20- M K 2 SO 4 содержит 57 г K 2 SO 4 ?
- Агентство по охране окружающей среды США (EPA) устанавливает ограничения на количество токсичных веществ, которые могут сбрасываться в канализационную систему.
 Пределы были установлены для различных веществ, включая шестивалентный хром, который ограничивается 0.50 мг/л. Если промышленность сбрасывает шестивалентный хром в виде дихромата калия (K 2 Cr 2 O 7 ), какова максимально допустимая молярность этого вещества?
Пределы были установлены для различных веществ, включая шестивалентный хром, который ограничивается 0.50 мг/л. Если промышленность сбрасывает шестивалентный хром в виде дихромата калия (K 2 Cr 2 O 7 ), какова максимально допустимая молярность этого вещества?
Глоссарий
- водный раствор
- раствор, для которого вода является растворителем
- концентрированный
- качественный термин для обозначения раствора, содержащего растворенное вещество в относительно высокой концентрации
- концентрация
- количественная мера относительных количеств растворенного вещества и растворителя, присутствующих в растворе
- разбавленный
- качественный термин для раствора, содержащего растворенное вещество в относительно низкой концентрации
- разбавление
- процесс добавления растворителя в раствор для снижения концентрации растворенных веществ
- распущен
- описывает процесс диспергирования растворенных компонентов в растворителе .

- молярность ( M )
- единица концентрации, определяемая как количество молей растворенного вещества, растворенного в 1 л раствора
- растворенное вещество Компонент раствора
- присутствует в концентрации меньшей, чем концентрация растворителя .
- растворитель
- компонент раствора присутствует в более высокой концентрации по сравнению с другими компонентами
Решения
Ответы на упражнения по химии в конце главы
2.Нам необходимо знать количество молей серной кислоты, растворенной в растворе, и объем раствора.
4. (а) 0,679 М ;
(б) 1,00 М ;
(в) 0,06998 М ;
(г) 1,75 М ;
(д) 0,070 М ;
(ж) 6,6 М
6. а) определить количество молей глюкозы в 0,500 л раствора; определить молярную массу глюкозы; определить массу глюкозы по числу молей и ее молярной массе; (б) 27 г
8. (а) 37,0 моль H 2 SO 4 ;
(а) 37,0 моль H 2 SO 4 ;
3,63 × 10 3 г H 2 SO 4 ;
(б) 3.8 × 10 –6 моль NaCN;
1,9 × 10 −4 г NaCN;
(в) 73,2 моль H 2 CO;
2,20 кг H 2 CO;
(г) 5.9 × 10 −7 моль FeSO 4 ;
8,9 × 10 −5 г FeSO 4
10. (а) Определите молярную массу KMnO 4 ; определить количество молей KMnO 4 в растворе; по числу молей и объему раствора определяют молярность; (б) 1.15 × 10 −3 М
12. (а) 5.04 × 10 −3 М ;
(б) 0,499 М ;
(в) 9,92 М ;
(г) 1,1 × 10 −3 М
14. 0,025 М
16. 0,5000 л
18. 1,9 мл
20. (а) 0,125 М ;
(б) 0,04888 М ;
(в) 0,206 М ;
(д) 0,0056 М
22.