Хром низшая степень окисления. Степень окисления хрома
Введение
Степень окисления (СО) — это условное обозначение в химии, служащее для того, чтобы определять заряд атома у какого-либо химического элемента (или группы элементов) . Без степеней окисления не решается ни одна задача, не составляется ни одно уравнение, но самое главное — без них мы не можем чётко определить свойства элемента и то, какую роль он будет играть в различных соединениях.
Знаменательно, что периодическая система (ПС) Д.И. Менделеева сгруппирована гениальнейшим образом: все элементы разделены по периодам, группам, подгруппам, их порядковые номера также соответствуют определённым показателям. Благодаря этому нам не приходится заучивать качества каждого химического элемента (ХЭ) наизусть, потому что легко можно найти его в таблице и определить всё, что требуется. Однако даже в таком случае некоторые люди, забывая школьные знания по курсу химии (или пренебрегая ими когда-то), вынуждены вернуться к изучению данной темы подробнее.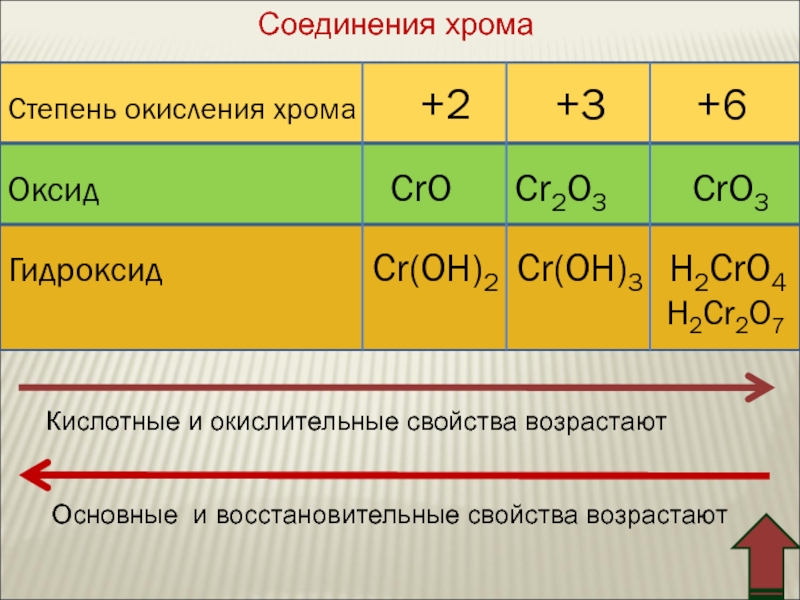
Итак, для начала необходимо сформировать верные объективные представления о хроме (Cr
), разобраться с его положением в ПС, а затем можно будет приступить к наиболее важной части — практике.
Хром
— Cr
, положение в таблице Менделеева, физические и химические свойства
Хром
— это твёрдое вещество, металл, блестящий, серебристо-белого (или голубоватого) цвета
. Он достаточно ломкий, но при этом имеет несравненный плюс по сравнению со многими другими металлами — устойчивость к заражению коррозией; именно поэтому он является важным компонентом при производстве нержавеющей стали, а также используется для нанесения на поверхность других металлов, более склонных к коррозии. Хром обладает плохой тепло- и электропроводностью.
ХЭ располагается в VI группе, 4 периоде, носит порядковый номер 24 и обладает атомной массой равной 52 г/моль. Благодаря пассивированию хром не взаимодействует с серной (
H 2 SO 4
) и азотной (HNO 3
) кислотами, проявляет устойчивость в воздухе.
Это амфотерный металл — значит, он может растворяться как в кислотах, так и в щелочах . Элемент растворяется в сильных разбавленных кислотах (например, соляная кислота HCl ), в нормальных условиях (н.у.) взаимодействует только с фтором (F ). При нагревании хром может осуществлять взаимодействие с элементами VII группы (галогены), кислородом O 2 , бором B, азотом N 2 , серой S 2 , кремнием Si . Если раскалить Cr , то способен вступить в реакцию с водяными парами.
Теперь поговорим непосредственно о том, какие степени окисления бывают у данного ХЭ: он может приобретать СО +4, +6, а также +2 в безвоздушном пространстве, +3 — в пространстве с воздухом. Хром, как любой другой металл, является сильным восстановителем.
Вещества с различными степенями окисления
- +2. Когда Cr
приобретает СО
+2, вещество демонстрирует основные и очень сильные восстановительные свойства. К примеру, оксид хрома (II) — CrO
, гидроксид хрома — Cr(OH) 2
, множество солей.
 Синтезируются соединения этого элемента с фтором(CrF 2
), хлором(CrCl 2
) и так далее.
Синтезируются соединения этого элемента с фтором(CrF 2
), хлором(CrCl 2
) и так далее. - +3. Эти вещества обладают амфотерными свойствами, могут быть разных цветов (но преимущественно зелёного H 2 O ). Для примера приведём оксид Cr 2 O 3 (это зеленоватый порошок, который не растворяется в), Cr(OH) 3 , хромиты NaCrO 2 .
- +4. Такие соединения встречаются очень редко: они не образуют солей, кислот, с ними почти не производятся какие-либо работы. Но из известных веществ существуют оксид CrO 2 , тетрагалогенид CrF 4 , CrCl 4 .
- +6. Хром с СО +6, образуя соли, имеет кислотный характер, очень ядовитый, гидроскопичный, а также имеющий сильные окислительные свойства. Примеры: CrO 3 (имеет вид кристаллов красного цвета), K 2 CrO 4 , H 2 CrO 4 , H 2 Cr 2 O 7 . Элемент способен образовывать два вида гидроксидов (уже перечислены).
Как определять СО в сложных веществах
С правилом «крест-накрест» вы наверняка уже знакомы.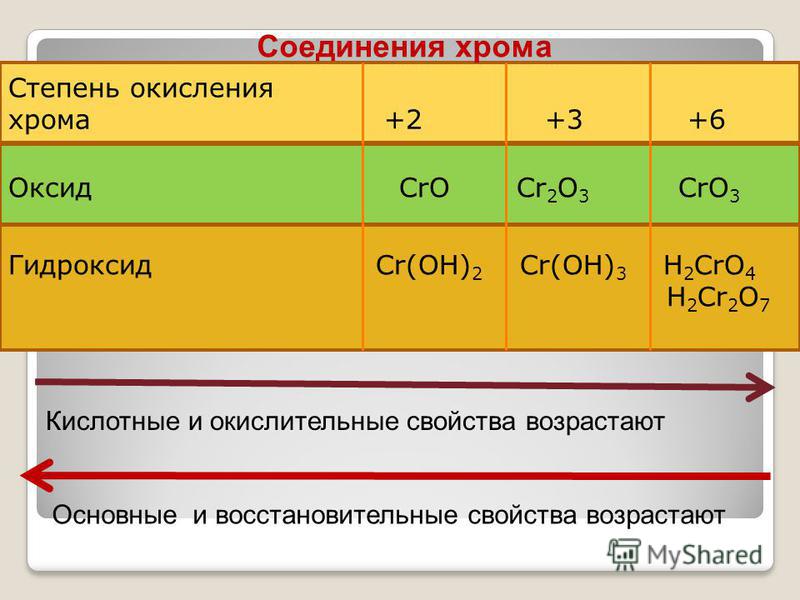 А что, если соединение имеет, например, целых три элемента
?
А что, если соединение имеет, например, целых три элемента
?
В этом случае мы смотрим на последний элемент вещества, определяем его степень окисления и умножаем на коэффициент, находящийся справа (конечно, если он есть). Мысленно отделяем последний элемент (с уже определённой степенью окисления) от двух других элементов. Нам требуется, чтобы СО двух первых и последнего элементов в сумме была равна нулю.
Рассмотрим пример:
- PbCrO 4
— хромат свинца (II), имеющий вид красной соли. На конце формулы находится кислород, степень окисления которого всегда (за исключением некоторых случаев) будет -2. -2*4=-8. Pb (свинец) имеет
 2+x-8=0;x=8-2;x=6
. Переменная равна 6, следовательно, степень окисления хрома становится +6.
2+x-8=0;x=8-2;x=6
. Переменная равна 6, следовательно, степень окисления хрома становится +6.
Степени окисления в следующих формулах попробуйте расставить сами:
- Na 2 CrO 4 ;
- BaCrO 4 ;
- Fe(CrO 2) 2 ;
- Cr 2 O 7 ;
- H 2 CrO 4 .
Хром — один из самых интересных химических элементов, соединения с которым — штука сложная, но необходимая для понимания
. Будет замечательно, если данные примеры помогут разобраться со столь кропотливой темой.Редакция «сайт»
Задание №1
Степень окисления +2 во всех соединениях проявляет
Ответ: 4
Пояснение:
Из всех предложенных вариантов степень окисления +2 в сложных соединениях проявляет только цинк, являясь элементом побочной подгруппы второй группы, где максимальная степень окисления равна номеру группы.
Олово – элемент главной подгруппы IV группы, металл, проявляет степени окисления 0 (в простом веществе), +2, +4 (номер группы).
Фосфор – элемент главной подгруппы главной группы, являясь неметаллом, проявляет степени окисления от -3 (номер группы – 8) до +5 (номер группы).
Железо – металл, элемент расположен в побочной подгруппе главной группы. Для железа характерны степени окисления: 0, +2, +3, +6.
Задание №2
Соединение состава KЭО 4 образует каждый из двух элементов:
1) фосфор и хлор
2) фтор и марганец
3) хлор и марганец
4) кремний и бром
Ответ: 3
Пояснение:
Соль состава KЭО 4 содержит кислотный остаток ЭО 4 — , где кислород обладает степенью окисления -2, следовательно, степень окисления элемента Э в этом кислотном остатке равна +7. Из предложенных вариантов подходят хлор и марганец – элементы главной и побочной подгруппы VII группы соответственно.
Фтор – также элемент главной подгруппы VII группы, однако, являясь самым электроотрицательным элементом, не проявляет положительных степеней окисления (0 и -1).
Бор, кремний и фосфор – элементы главных подгрупп 3, 4 и 5 групп соответственно, поэтому в солях проявляют соответствующие максимальные степени окисления +3, +4, +5.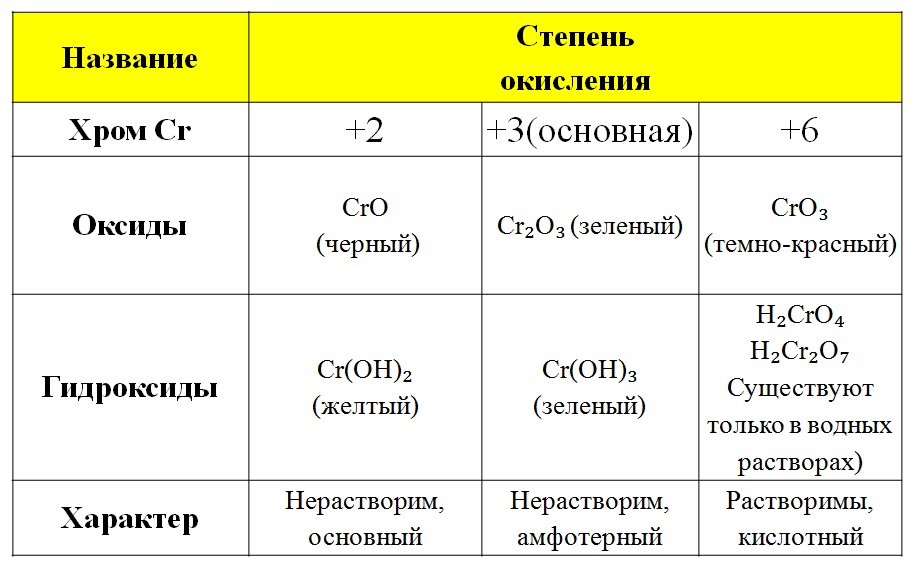
Задание №3
- 1. Zn и Cr
- 2. Si и B
- 3. Fe и Mn
- 4. P и As
Ответ: 4
Пояснение:
Одинаковую высшую степень окисления в соединениях, равную номеру группы (+5), проявляют P и As. Это элементы расположены в главной подгруппе V группы.
Zn и Cr – элементы побочных подгрупп II и VI групп соответственно. В соединениях цинк проявляет высшую степень окисления +2, хром — +6.
Fe и Mn – элементы побочных подгруппы VIII и VII групп соответственно. Высшая степень окисления у железа составляет +6, у марганца — +7.
Задание №4
Одинаковую высшую степень окисления в соединениях проявляют
- 1. Hg и Cr
- 2. Si и Al
- 3. F и Mn
- 4. P и N
Ответ: 4
Пояснение:
Одинаковую высшую степень окисления в соединениях, равную номеру группы (+5), проявляют P и N. Эти элементы расположены в главной подгруппе V группы.
Hg и Cr – элементы побочных подгрупп II и VI групп соответственно. В соединениях ртуть проявляет высшую степень окисления +2, хром – +6.
В соединениях ртуть проявляет высшую степень окисления +2, хром – +6.
Si и Al − элементы главных подгруппы IV и III групп соответственно. Следовательно, для кремния максимальная степень окисления в сложных соединениях равна +4 (номер группы, где расположен кремний), для алюминия − +3 (номер группы, где расположен алюминия).
F и Mn – элементы главной и побочной подгрупп VII групп соответственно. Однако фтор, являясь самым электроотрицательным элементом Периодической системы химических элементов, не проявляет положительных степеней окисления: в сложных соединения его степень окисления равна −1 (номер группы−8). Высшая степень окисления марганца составляет +7.
Задание №5
Степень окисления +3 азот проявляет в каждом из двух веществ:
- 1. HNO 2 и NH 3
- 2. NH 4 Cl и N 2 О 3
- 3. NaNO 2 и NF 3
- 4. HNO 3 и N 2
Ответ: 3
Пояснение:
В азотистой кислоте HNO 2 степень окисления кислорода в кислотном остатке равна -2, у водорода — +1, следовательно, чтобы молекула оставалась электронейтральной, степень окисления азота составляет +3. В аммиаке NH 3 азот является более электроотрицательным элементом, поэтому он оттягивает на себя электронную пару ковалентной полярной связи и обладает отрицательной степенью окисления -3, степень окисления водорода в аммиаке составляет +1.
В аммиаке NH 3 азот является более электроотрицательным элементом, поэтому он оттягивает на себя электронную пару ковалентной полярной связи и обладает отрицательной степенью окисления -3, степень окисления водорода в аммиаке составляет +1.
Хлорид аммония NH 4 Cl является аммонийной солью, поэтому степень окисления азота такая же, как в аммиаке, т.е. равна -3. В оксидах степень окисления кислорода всегда равна -2, поэтому у азота она составляет +3.
В нитрите натрия NaNO 2 (соли азотистой кислоты) степень окисления азота такая же, как в азота в азотистой кислоте, т.к. составляет +3. Во фториде азота степень окисления азота +3, поскольку фтор является самым электроотрицательным элементом Периодической системы и в сложных соединениях проявляет отрицательную степень окисления -1. Данный вариант ответа удовлетворяет условию задания.
В азотной кислоте азот обладает высшей степенью окисления, равной номеру группы (+5). Азот как простое соединение (поскольку состоит из атомов одного химического элемента) обладает степенью окисления 0.
Задание №6
Высшему оксиду элемента VI группы соответствует формула
- 1. Э 4 O 6
- 2. ЭO 4
- 3. ЭO 2
- 4. ЭО 3
Ответ: 4
Пояснение:
Высшим оксидом элемента является оксид элемента с его максимальной степени окисления. В группе наивысшая степень окисления элемента равна номеру группы, следовательно, в VI группе максимальная степень окисления элемента равна +6. В оксидах кислород проявляет степень окисления -2. Цифры, стоящие под символом элемента, называются индексами и указывает на количество атомов этого элемента в молекуле.
Первый вариант является неверным, т.к. элемент обладает степенью окисления 0-(-2)⋅6/4 = +3.
Во втором варианте элемент обладает степенью окисления 0-(-2) ⋅ 4 = +8.
В третьем варианте степень окисления элемента Э: 0-(-2) ⋅ 2 = +4.
В четвертом варианте степень окисления элемента Э: 0-(-2) ⋅ 3 = +6, т.е. это искомый ответ.
Задание №7
Степень окисления хрома в дихромате аммония (NH 4) 2 Cr 2 O 7 равна
Ответ: 1
Пояснение:
В бихромате аммония (NH 4) 2 Cr 2 O 7 в катионе аммония NH 4 + азот как более электроотрицательный элемент обладает низшей степенью окисления -3, водород заряжен положительно +1. Следовательно, весь катион обладает зарядом +1, но, поскольку этих катионов 2, то общий заряд составляет +2.
Следовательно, весь катион обладает зарядом +1, но, поскольку этих катионов 2, то общий заряд составляет +2.
Для того чтобы молекула оставалась электронейтральной, у кислотного остатка Cr 2 O 7 2− заряд должен быть -2. Кислород в кислотных остатках кислот и солей всегда обладает зарядом -2, поэтому 7 атомов кислорода, входящих в состав молекулы бихромата аммония, заряжены -14. Атомов хрома Cr в молекулы 2, следовательно, если заряд хрома обозначить за x, то имеем:
2x + 7 ⋅ (-2) = -2, где x = +6. Заряд хрома в молекуле бихромата аммония равен +6.
Задание №8
Степень окисления +5 возможна для каждого из двух элементов:
1) кислорода и фосфора
2) углерода и брома
3) хлора и фосфора
4) серы и кремния
Ответ: 3
Пояснение:
В первом предложенном варианте ответов только фосфор как элемент главной подгруппы V группы может проявлять степень окисления +5, которая является для него максимальной. Кислород (элемент главной подгруппы VI группы), являясь элементом с высокой электроотрицательностью, в оксидах проявляет степень окисления -2, как простое вещество – 0 и в соединении со фтором OF 2 – +1. Степень окисления +5 для него не характерна.
Степень окисления +5 для него не характерна.
Углерод и бром – элементы главных подгрупп IV и VII групп соответственно. Для углерода характерна максимальная степень окисления +4 (равна номеру группы), а бром проявляет степени окисления -1, 0 (в простом соединении Br 2), +1, +3, +5 и +7.
Хлор и фосфор – элементы главных подгрупп VII и V групп соответственно. Фосфор проявляется максимальную степень окисления +5 (равную номеру группы), для хлора аналогично брому характерны степени окисления -1, 0 (в простом соединении Cl 2), +1, +3, +5, +7.
Сера и кремний – элементы главных подгрупп VI и IV групп соответственно. Сера проявляет широкий спектр степеней окисления от -2 (номер группы − 8) до +6 (номер группы). Для кремния максимальная степень окисления равна +4 (номер группы).
Задание №9
- 1. NaNO 3
- 2. NaNO 2
- 3. NH 4 Cl
- 4. NO
Ответ: 1
Пояснение:
В нитрате натрия NaNO 3 натрий имеет степень окисления +1 (элемент I группы), атомов кислорода в кислотном остатке 3, каждый из которых имеет степень окисления −2, следовательно, чтобы молекула оставалась электронейтральной, азот должен иметь степень окисления: 0 − (+1) − (−2)·3 = +5.
В нитрите натрия NaNO 2 атом натрий также имеет степень окисления +1 (элемент I группы), атомов кислорода в кислотном остатке 2, каждый из которых имеет степень окисления −2, следовательно, чтобы молекула оставалась электронейтральной, азот должен обладать степенью окисления: 0 − (+1) − (−2)·2 = +3.
NH 4 Cl − хлорид аммония. В хлоридах атомы хлора имеют степень окисления −1, атомы водорода, которого в молекуле 4, заряжен положительно, следовательно, чтобы молекула оставалась электронейтральной, степень окисления азота: 0 − (−1) − 4 ·(+1) = −3. В аммиаке и катионах аммонийных солей азот имеет минимальную степень окисления −3 (номер группы, в которой расположен элемент, − 8).
В молекуле оксида азота NO кислород проявляет минимальную степень окисления −2, как во всех оксидах, следовательно, степень окисления азота равна +2.
Задание №10
Высшую степень окисления азот проявляет в соединении, формула которого
- 1. Fe(NO 3) 3
- 2. NaNO 2
- 3.
 (NH 4) 2 SO 4
(NH 4) 2 SO 4 - 4. NO 2
Ответ: 1
Пояснение:
Азот – элемент главной подгруппы V группы, следовательно, он может проявлять максимальную степень окисления, равную номеру группы, т.е. +5.
Одна структурная единица нитрата железа Fe(NO 3) 3 состоит из одного иона Fe 3+ и трех нитрат-ионов. В нитрат-ионах атомы азота независимо от типа противоиона имеют степень окисления +5.
В нитрите натрия NaNO 2 натрий имеет степень окисления +1 (элемент главной подгруппы I группы), атомов кислорода в кислотном остатке 2, каждый из которых имеет степень окисления −2, следовательно, чтобы молекула оставалась электронейтральной, азот должен обладать степенью окисления 0 − (+1) − (−2)⋅2 = +3.
(NH 4) 2 SO 4 – сульфат аммония. В солях серной кислоты анион SO 4 2− имеет заряд 2−, следовательно, каждый катион аммония заряжен 1+. На водороде заряд +1, поэтому на азоте −3 (азот более электроотрицателен, поэтому оттягивает на себя общую электронную пару связи N−H). В аммиаке и катионах аммонийных солей азот имеет минимальную степень окисления −3 (номер группы, в которой расположен элемент, − 8).
В аммиаке и катионах аммонийных солей азот имеет минимальную степень окисления −3 (номер группы, в которой расположен элемент, − 8).
В молекуле оксида азота NO 2 кислород проявляет минимальную степень окисления −2, как во всех оксидах, следовательно, степень окисления азота равна +4.
Задание №11
28910EВ соединениях состава Fe(NO 3) 3 и CF 4 степень окисления азота и углерода равна соответственно
Ответ: 4
Пояснение:
Одна структурная единица нитрата железа (III) Fe(NO 3) 3 состоит из одного иона железа Fe 3+ и трех нитрат-ионов NO 3 − . В нитрат-ионах азот всегда имеет степень окисления +5.
Во фториде углерода CF 4 фтор является более электроотрицательным элементом и оттягивает на себя общую электронную пару связи C-F, проявляя степень окисления -1. Следовательно, углерод C имеет степень окисления +4.
Задание №12
A32B0BСтепень окисления +7 хлор проявляет в каждом из двух соединений:
- 1.
 Ca(OCl) 2 и Cl 2 O 7
Ca(OCl) 2 и Cl 2 O 7 - 2. KClO 3 и ClO 2
- 3. BaCl 2 и HClO 4
- 4. Mg(ClO 4) 2 и Cl 2 O 7
Ответ: 4
Пояснение:
В первом варианте атомы хлора обладают степенями окисления +1 и +7 соответственно. Одна структурная единица гипохлорита кальция Ca(OCl) 2 состоит из одного иона кальция Ca 2+ (Ca — элемент главной подгруппы II группы) и двух гипохлорит-ионов OCl − , каждый из которых имеет заряд 1−. В сложных соединениях, кроме OF 2 и различных перекисей, кислород всегда имеет степень окисления −2, поэтому, очевидно, что хлор имеет заряд +1. В оксиде хлора Cl 2 O 7 , как и во всех оксидах, кислород обладает степенью окисления −2, следовательно, на хлор в этом соединении имеет степень окисления +7.
В хлорате калия KClO 3 атом калия имеет степень окисления +1, а кислород — −2. Для того чтобы молекула оставалась электронейтральной, хлор должен проявлять степень окисления +5. В оксиде хлора ClO 2 кислород, как и в любом другом оксиде, обладает степенью окисления −2, следовательно, для хлора его степень окисления равна +4.
В третьем варианте катион бария в сложном соединении заряжен +2, следовательно, на каждом анионе хлора в соли BaCl 2 сосредоточен отрицательный заряд −1. В хлорной кислоте HClO 4 общий заряд 4 атомов кислорода составляет −2⋅4 = −8, на катионе водорода заряд +1. Чтобы молекула оставалась электронейтральной, заряд хлора должен составлять +7.
В четвертом варианте в молекуле перхлората магния Mg(ClO 4) 2 заряд магния +2 (во всех сложных соединениях магний проявляет степень окисления +2), поэтому на каждый анион ClO 4 − приходится заряд 1−. В общем 4 иона кислорода, где каждый проявляет степень окисления −2, заряжены −8. Следовательно, чтобы общий заряд аниона составлял 1−, на хлоре должен быть заряд +7. В оксиде хлора Cl 2 O 7 , как было объяснено выше, заряд хлора составляет +7.
В 1766 году профессор химии и заведующий Химической лабораторией Петербургской АН И.Г. Леман описал новый минерал, найденный на Урале на Березовском руднике, который получил название «сибирский красный свинец», PbCrO 4 . Современное название — крокоит. В 1797 французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл.
Современное название — крокоит. В 1797 французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл.
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
Нахождение в природе и получение:
Наиболее распространённым минералом хрома является хромистый железняк FeCr 2 O 4 (хромит), богатые месторождения которого имеются на Урале и в Казахстане, вторым по значимости минералом является крокоит PbCrO 4 . Массовая доля хрома в земной коре составляет 0,03%. Природный хром состоит из смеси пяти изотопов c массовыми числами 50, 52, 53, 54 и 56; искусственно получены и другие, радиоактивные, изотопы.
Основные количества хрома получают и используют в виде сплава с железом, феррохрома, восстанавливая хромит коксом:
FeCr 2 O 4 + 4C = Fe + 2Cr + 4CO
Чистый хром получают, восстанавливая алюминием его оксид:
Cr 2 O 3 + 2Al = 2Cr + Al 2 O 3
или электролизом водных растворов соединений хрома.
Физические свойства:
Хром — серовато-белый блестящий металл, по внешнему виду похож на сталь, один из самых твердых металлов, r
= 7,19г/см 3 , Tпл=2130K, Tкип=2945K. Хром обладает всеми характерными для металлов свойствами — хорошо проводит тепло, электрический ток, имеет присущий большинству металлов блеск.
Хром обладает всеми характерными для металлов свойствами — хорошо проводит тепло, электрический ток, имеет присущий большинству металлов блеск.
Химические свойства:
Хром устойчив на воздухе за счёт пассивирования — образования защитной оксидной пленки. По этой же причине не реагирует с концентрированной серной и азотной кислотами. При 2000°C сгорает с образованием зелёного оксида хрома(III) Cr 2 O 3 .
При нагревании реагирует со многими неметаллами, часто образуя соединения нестехиометрического состава карбиды, бориды, силициды, нитриды и др.
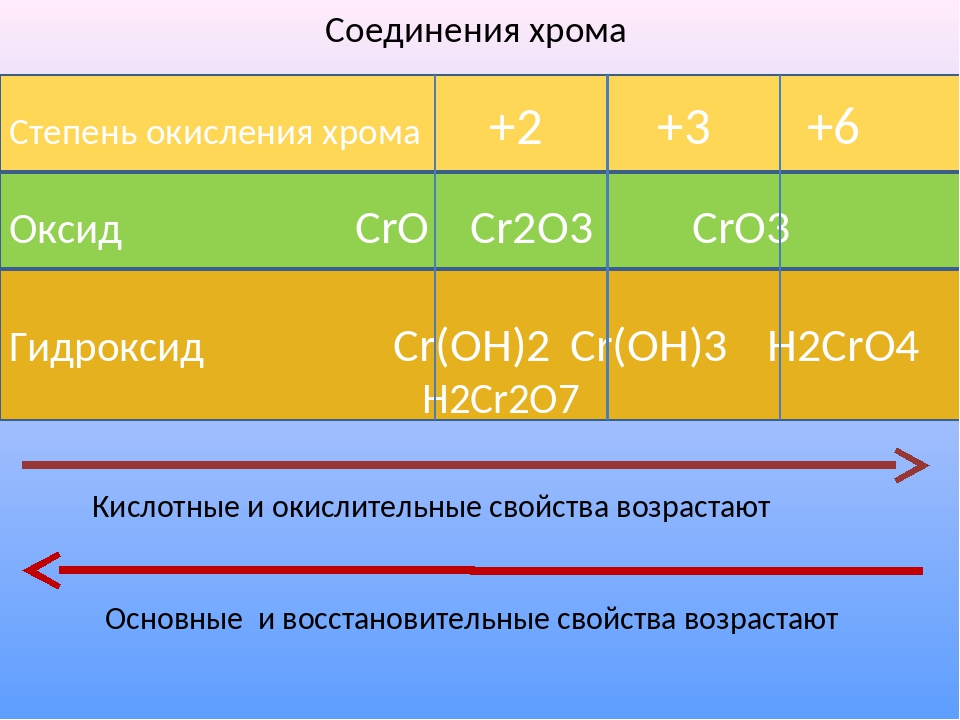
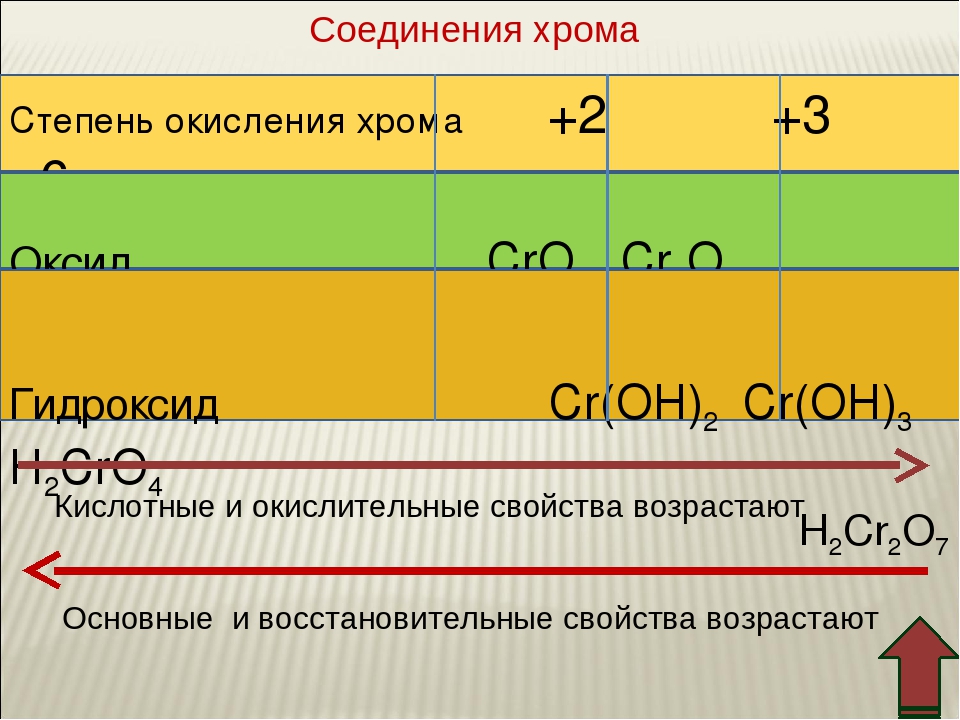
Хром образует многочисленные соединения в различных степенях окисления, в основном +2, +3, +6.
Важнейшие соединения:
Степень окисления +2 — основный оксид CrO (чёрный), гидроксид Cr(OH) 2 (желтый). Соли хрома(II) (растворы голубого цвета) получаются при восстановлении солей хрома(III) цинком в кислой среде. Очень сильные восстановители, медленно окисляются водой с выделением водорода.
Степень окисления +3
— наиболее устойчивая степень окисления хрома, ей соответствуют: амфотерный оксид Cr 2 O 3 и гидроксид Cr(OH) 3 (оба — серо-зелёного цвета), соли хрома(III) — серо-зеленого или фиолетового цвета, хромиты MCrO2, которые получаются при сплавлении оксида хрома со щелочами, тетра- и гексагидроксохроматы(III) получаемые при растворении гидроксида хрома(III) в растворах щелочей (зеленого цвета), многочисленные комплексные соединения хрома.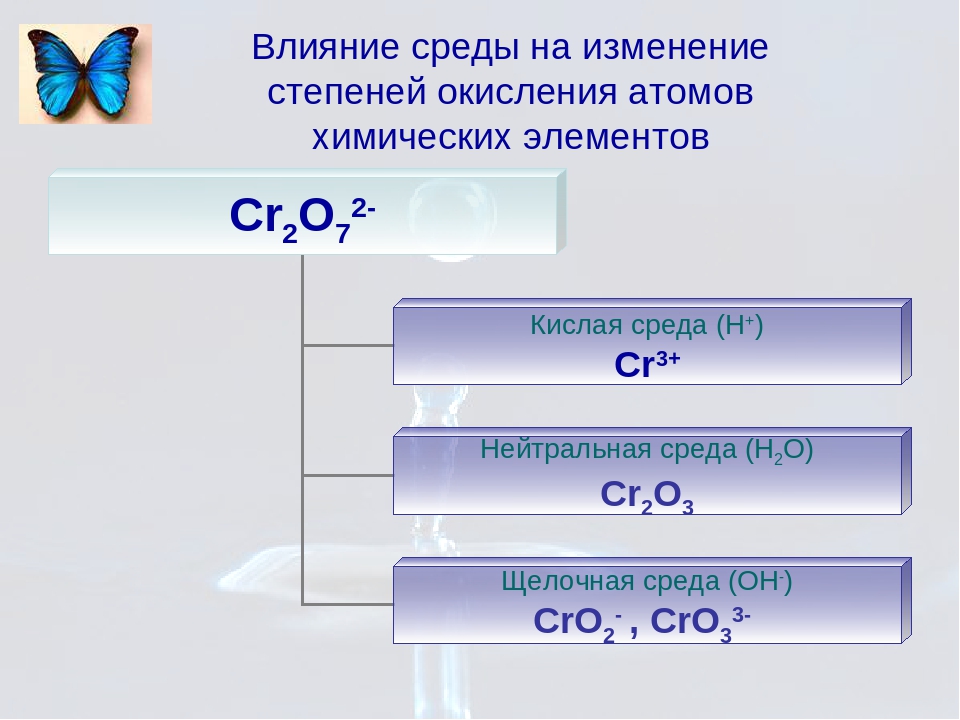
Степень окисления +6
— вторая характерная степень окисления хрома, ей отвечают соответствует кислотный оксид хрома(VI) CrO 3 (красные кристаллы, растворяется в воде, образуя хромовые кислоты), хромовая H 2 CrO 4 , дихромовая H 2 Cr 2 O 7 и полихромовые кислоты, соответствующие соли: желтые хроматы и оранжевые дихроматы. Соединения хрома(VI) сильные окислители, особенно в кислой среде, восстанавливаются до соединений хрома(III)
В водном растворе хроматы переходят в дихроматы при изменении кислотности среды:
2CrO 4 2- + 2H + Cr 2 O 7 2- + H 2 O, что сопровождается изменением окраски.
Применение
Хром, в виде феррохрома используется при производстве легированных видов стали (в частности, нержавеющих), и других сплавов. Сплавы хрома: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности, сплав с никелем (нихром) — для производства нагревательных элементов. Большие количества хрома используются в качестве износоустойчивых и красивых гальванических покрытий (хромирование).
Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В чистом виде хром довольно токсичен, металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты. Соединения хрома(VI) приводят к разным заболеваниям человека, в том числе и онкологическим. ПДК хрома(VI) в атмосферном воздухе 0,0015 мг/м 3
Кононова А.С., Наков Д.Д., ТюмГУ, 501(2) группа, 2013 г.
Источники:
Хром (элемент) // Википедия. URL: http://ru.wikipedia.org/wiki/Хром (дата обращения: 6.01.2014).
Популярная библиотека химических элементов:
Хром. // URL:
Окислительно-восстановительные свойства соединений хрома с различной степенью окисления.
Хром. Строение атома. Возможные степени окисления. Кислотно-основные свойства. Применение.
Строение атома. Возможные степени окисления. Кислотно-основные свойства. Применение.
Cr +24)2)8)13)1
Для хрома характерны степени окисления +2, +3 и +6.
C увеличением степени окисления возрастают кислотные и окислительные свойства. Хром Производные Сr2+ — очень сильные восстановители. Ион Сr2+ образуется на первой стадии растворения Хрома в кислотах или при восстановлении Сr3+ в кислом растворе цинком. Гидрат закиси Сr(ОН)2 при обезвоживании переходит в Сr2О3. Соединения Сr3+ устойчивы на воздухе. Могут быть и восстановителями и окислителями. Сr3+ можно восстановить в кислом растворе цинком до Сr2+ или окислить в щелочном растворе до СrО42- бромом и других окислителями. Гидрооксид Сr(ОН)3 (вернее Сr2О3·nН2О) — амфотерное соединение, образующее соли с катионом Сr3+ или соли хромистой кислоты НСrО2 — хромиты (например, КСrО2, NaCrO2). Соединения Сr6+: хромовый ангидрид СrО3, хромовые кислоты и их соли, среди которых наиболее важны хроматы и дихроматы — сильные окислители.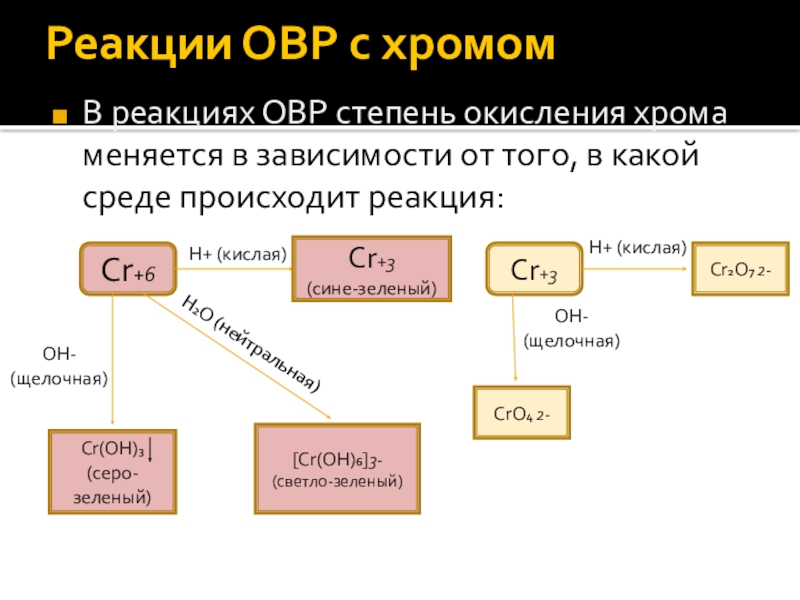 солей.
солей.
Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование). Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Хром химически малоактивен. В обычных условиях он реагирует только с фтором (из неметаллов), образуя смесь фторидов.
Хроматы и дихроматы
Хроматы образуются при взаимодействии СгО3, или растворов хромовых кислот со щелочами:
СгОз + 2NaOH = Na2CrO4 + Н2О
Дихроматы получаются при действии на хроматы кислот:
2 Na2Cr2O4 + h3SO4 = Na2Cr2O7 + Na2SO4 + Н2О
Для соединений хрома характерны окислительно — восстановительные реакции.
Соединения хрома (II) — сильные восстановители, они легкоокисляются
4(5гС12 + О2 + 4HCI = 4СгС1з + 2Н2О
Для соединений хрома (!!!) характерны восстановительные свойства. Под действием окислителей они переходят:
в хроматы — в щелочной среде,
в дихроматы — в кислой среде.
Cr(ОН)3. CrOH + HCl = CrCl + h3O, 3CrOH + 2NaOH = Cr3Na2O3 + 3h3O
Хроматы(III) (устар. назв. хромиты).
Для соединений хрома характерны восстановительные свойства. Под действием окислителей они переходят:
в хроматы — в щелочной среде,
в дихроматы — в кислой среде.
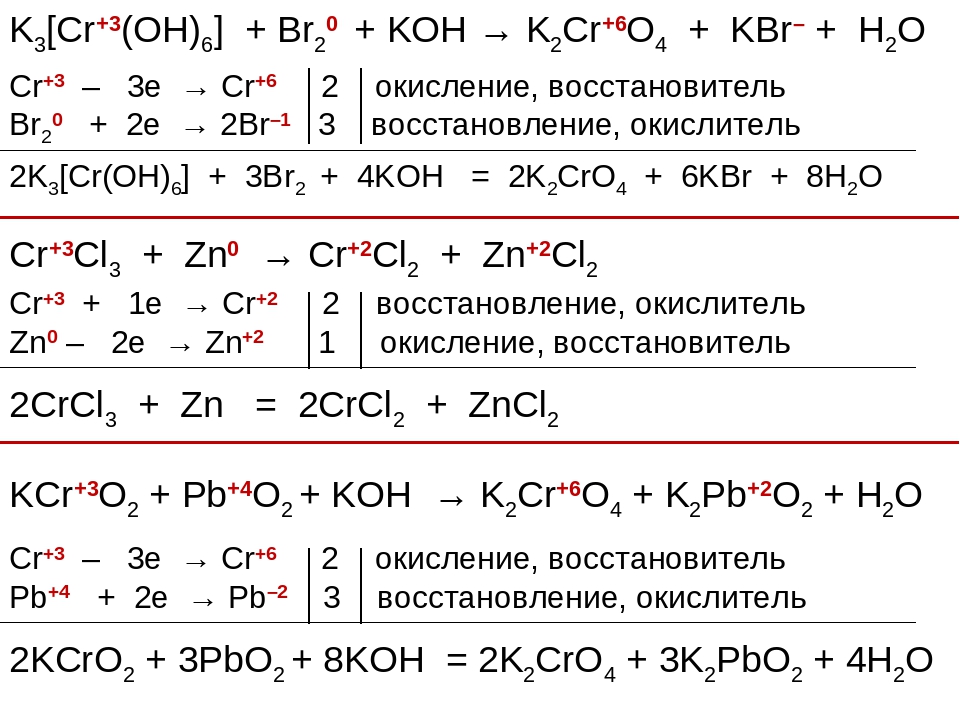
2Na3 [Сг(OH)6] + ЗВг2 + 4NaOH = 2Na2CrO4 + 6NaBr + 8Н2О
5Cr2(SO4)3 + 6KMnO4 + 11h3O = 3K2Cr2O7 + 2h3Cr2O7 + 6MnSO4 + 9h3SO4
Соли хромовых кислот в кислой среде — сильные окислители:
3Na2SO3 + К2Сг2О7 + 4h3SO4 = 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4h3O
ОПРЕДЕЛЕНИЕ
Хром расположен в четвертом периоде VI группы побочной (B) подгруппы Периодической таблицы. Обозначение – Cr. В виде простого вещества — серовато-белый блестящий металл.
Хром имеет структуру объемно-центрированной кубической решетки. Плотность — 7,2 г/см 3 . Температуры плавления и кипения равны 1890 o С и 2680 o С, соответственно.
Степень окисления хрома в соединениях
Хром может существовать в виде простого вещества — металла, а степень окисления металлов в элементарном состоянии равна нулю
, так как распределение электронной плотности в них равномерно.
Степени окисления (+2) и (+3) хром проявляет в оксидах (Cr +2 O, Cr +3 2 O 3), гидроксидах (Cr +2 (OH) 2 , Cr +3 (OH) 3), галогенидах (Cr +2 Cl 2 , Cr +3 Cl 3), сульфатах (Cr +2 SO 4 , Cr +3 2 (SO 4) 3) и др. соединениях.
Для хрома также характерна степень окисления (+6) : Cr +6 O 3 ,H 2 Cr +6 O 4 , H 2 Cr +6 2 O 7 , K 2 Cr +6 2 O 7 и т.д.
Примеры решения задач
ПРИМЕР 1
ПРИМЕР 2
| Задание | Одинаковую степень окисления фосфор имеет в соединениях:
а) Ca 3 P 2 и H 3 PO 3 ; б) KH 2 PO 4 и KPO 3 ; в) P 4 O 6 и P 4 O 10 ; г) H 3 PO 4 и H 3 PO 3 . |
| Решение | Для того, чтобы дать верный ответ на поставленный вопрос будем поочередно определять степень окисления фосфора в каждой паре предложенных соединений.
а) Степень окисления кальция равна (+2), кислорода и водорода — (-2) и (+1), соответственно. Примем значение степени окисления фосфора за «х» и «у» в предложенных соединениях: 3 ×2 + х ×2 = 0; 3 + у + 3×(-2) = 0; Ответ неверный. б) Степень окисления калия равна (+1), кислорода и водорода — (-2) и (+1), соответственно. Примем значение степени окисления хлора за «х» и «у» в предложенных соединениях: 1 + 2×1 +х + (-2)×4 = 0; 1 + у + (-2)×3 = 0; Ответ верный. |
| Ответ | Вариант (б). |
Окислительные свойства хрома. Задачи 1085
Задача 1085.
Для каких соединений хрома характерны окислительные свойства? Привести примеры реакций, в которых проявляются эти свойства.
Решение:
а) В соединениях хрома (II) атомы хрома находятся в своей степени окисления +2, поэтому они способны понижать степень окисления с +2 до 0, т.е. проявлять окислительные свойства.
Восстанавливается водородом до металлического хрома при 1000°С:
CrO + H2 ⇒ Cr + H2O
Также можно восстановить коксом:
CrO + C ⇒ Cr + CO
б) Соединения Cr3+ наиболее устойчивая степень окисления хрома. Для соединений хрома(III) характерны окислительные и восстановительные свойства, потому что он находится в своей промежуточной степени окисления +3. хром(III) способен уменьшать свою степень окисления с +3 до +2, например:
Для соединений хрома(III) характерны окислительные и восстановительные свойства, потому что он находится в своей промежуточной степени окисления +3. хром(III) способен уменьшать свою степень окисления с +3 до +2, например:
Реакция алюмотермии:
2Al + Сг2О3 ⇒ 2Cr + Al2O3
Силикотермическое восстановление основано на реакции:
2Cr2O3 + 3Si + 3CaO = 4Cr + 3CaSiO3
Восстановлением безводного хлорида хрома(III) водородом при 450° С:
2CrCl3 + H2 = 2CrCl2 + 2HCl
Восстановление хлорида хрома(III) цинком в присутствии соляной кислоты:
2CrCl3 + 3Zn + 4HCl = 2CrCl2 + 3ZnCl2 + 2H2↑
в) Соединения хрома(VI) — сильные окислители, например:
K2Cr2O7 + 14HCl = 3Cl2↑ + 2CrCl3 + 2KCl + 7H2O.
В кислой среде хром восстанавливается сульфитом натрия от хрома (VI) до хрома (III):
K2Cr2O7 + 3Na2SO3 + 4H2SO4 = K2SO4 + Cr2(SO4)3 + 3Na2SO4 + 4H2O.
Разложение дихромата аммония:
(NH4)2Cr2O7 ⇒ Cr2O3 + N2↑ + 4H2O
В кислотной среде соединения Сr+6 переходят в соединения Сr+3 под действием восстановителей: H2S, SO2, FeSO4
K2Cr2O7 + 3Н2S +4Н2SО4 = 3S + Сr2(SО4)3 + K2SO4 + 7Н2О
Оксид хрома (VI) – очень сильный окислитель, поэтому энергично взаимодействует с органическими веществами:
С2Н5ОН + 4СrО3 = 2СО2↑ + 2Сr2О3 + 3Н2О
Окисляет также иод, серу, фосфор, уголь:
3S + 4CrO3 = 3SO2↑ + 2Cr2O3
Задача 1086.
В какой среде — кислой или щелочной наиболее выражены окислительные свойства хрома (VI)? восстановительные свойства хрома (III)? Чем это объясняется?
Решение:
а) Соединения хрома (VI) в кислых растворах проявляют свойства сильных окислителей:
Сг2О72- + 14Н+ + 6 = 2Сг3+ + 7Н2О; Е° = -1,33 В
Хроматы в щелочной среде являются менее энергичными окислителями, чем бихроматы в кислой среде:
СгО42- + 4Н2О + 3 = Сг(ОН)3↓ + 5ОН− ; Е° = — 0,13 В
В щелочной среде образуются соединения хроматы (монохроматы), соли хромовой кислоты H2CrO4 в кислой среде — бихроматы (дихроматы) — соли H2Cr2O7.
С уменьшением рН (с изменением щелочной среды на кислую) хромат ион СгО42-переходит в бихромат-ион Сг2О72-, который обладает большей окислительной способностью.
б) Степень окисления хрома +3 является самой устойчивой, поэтому соединения хрома (III) являются слабыми окислителями и восстановителями, в щелочной среде — восстановительные свойства выражены сильнее:
Cr3+ + 4H2O -3 = СгО42- + 8H+
При взаимодействии с сильными окислителями соединения Сг3+ окисляются с образованием веществ, содержащих хром в степени окисления +6. Например, при сплавлении Сг2О3 с нитратом калия и карбонатом натрия образуется хромат натрия:
+3 +5 +6 +3
Сг2О3 + 3KNO3 + Na2CO3 ⇒ 2Na2СгО4 + 3KNO2 + 2СО2↑
При взаимодействии с сильными восстановителями соединения Сг3+ восстанавливаются в соединения Сг2+.
Таким образом, хром в своей промежуточной степени окисления +3 проявляет как окислительные, так и восстановительные свойства. Восстановительные свойства Сг2+ выражены сильнее в щелочной среде, потому что гидролиз его солей протекает с образованием кислой среды.
Восстановительные свойства Сг2+ выражены сильнее в щелочной среде, потому что гидролиз его солей протекает с образованием кислой среды.
Важнейшие соединения хрома и зависимость их свойств от степени окисления
Содержание:
Важнейшие соединения хрома и зависимость их свойств от степени окисления
- Зависимость важнейших соединений хрома и их свойств от степени окисления 4-2 По данным Государственной окисления, хром имеет 3 оксиды: Кро、 ФС 16 Cr203 и Кроу. Им соответствуют гидроксиды и соли. Оксид хрома (II) и его гидроксиды обладают основными свойствами, оксид хрома (III) и его гидроксиды амфотерны, а оксид хрома (VI) и его гидроксиды обладают кислотными свойствами.
- Это объясняется тем, что с увеличением положительного заряда центрального атома. В данном случае атома Cr). Все больше отрицательно заряженных атомов кислорода из гидроксо-группы притягиваются, а положительные ионы водорода все больше отталкиваются.
 Амфотерное соединение с умеренной степенью окисления и основание с более низкой степенью окисления.
Амфотерное соединение с умеренной степенью окисления и основание с более низкой степенью окисления.
Поэтому при взаимодействии оксидов металлов с высокой степенью окисления с водой образуется кислота Людмила Фирмаль
Рассмотрим эту закономерность более подробно, на примере соединений хрома. Соединения хрома со степенью окисления+2.Оксид хрома (II) и его гидроксиды вступают в реакцию с кислотами и проявляют только основные свойства. СГО+2НС1-я-СГС12+Н20СГО+2Н+ +2СГСг2+ + 2CI «+h30Cg0+2Н±*СД2+ +Н20 Cg (OH) 2 + 2HCI CgC12 + 2h30 Cg (OH)2 + 2H + 2C1 Cg2 + 2CI »+ 2h30 Cr (OH) 2 + 2H + Cr2 + + 2HzO Оксид хрома (II) не вступает в реакцию с водой.
Гидроксид в воде практически нерастворим. Соединения хрома со степенью окисления+2 в воздухе характеризуются быстрым окислением, со степенью окисления+3 соединения хрома. Соединения хрома со степенью окисления+ 3.Гидроксид хрома (III) реагирует как с кислотами, так и со щелочами. Cr (OH)s + ZNS1 ^ CrS13 4-ZN20 Cr (OH)z 4-ZN + + 3CI-Cr3 + + 3d » + ZN20 Cr (OH) z + ZN + ZN3 + + ZN20 Cr (OH)s + NaOH X NaCr02 + 2h30
- Хромит натрия В водных растворах образуется гидратированный хромит натрия NaCr02•h30.
 Это вещество может быть представлено формулой Nah3Cr03. Гидроксид хрома (III) в воде практически нерастворим. Оксид хрома (III) не вступает в реакцию с водой. Только свежеосажденный будет реагировать с кислотой, а при нагревании он будет взаимодействовать с щелочью: Сг203 + 2NaOH х 2NaCr02 + Н20
Это вещество может быть представлено формулой Nah3Cr03. Гидроксид хрома (III) в воде практически нерастворим. Оксид хрома (III) не вступает в реакцию с водой. Только свежеосажденный будет реагировать с кислотой, а при нагревании он будет взаимодействовать с щелочью: Сг203 + 2NaOH х 2NaCr02 + Н20
Хромит натрия Применение оксида хрома (III) отражено на схеме 44. Соединения хрома со степенью окисления+6.Из-за высокой степени окисления хрома в этих соединениях оксид хрома (VI) CrO3 обладает только кислотными свойствами. Cg03+Н20 — > — Н2Сг04 Хромовая кислота 2СЮ3 + Н20Н2Сг207
При взаимодействии оксида хрома (VI) с водой образуется хромовая или дихромовая кислота. Людмила Фирмаль
Ди-хромовой кислоты Хромовая кислота соответствует солям-хромату (хромат натрия Na2Cr04), а дихромат-дихромату (дихромат натрия Na2Cr207). Общий обзор соединений хрома приведен в таблице 70. Ответьте на вопрос 5 и выполните упражнение 6 (стр. 122). Решите задачу 2 (стр. 122). Таблица 70.Наиболее важные соединения хрома
Решите задачу 2 (стр. 122). Таблица 70.Наиболее важные соединения хрома
Соединения хрома (II) соединения хрома (III) соединения хрома (VI) Крои СГ(он) 2 CrClj файлов CR2 +синий Cr2Os и CR (ой)из основных характеристик холдингов, амфотерные характеристики CrClj ЗПР *зеленый цвет(от зеленого до фиолетового до гидратации)Н2СЮ4Н2Сг207К2СгО кислотные свойства только держать К2Сг2ОуСГО? Cr2Oy » желто-оранжевый цвет
Смотрите также:
Решение задач по химии
Хром | Химические свойства
Хром
Внешняя электронная конфигурация атома хрома 3d54s1. В соединениях обычно проявляет степени окисления +2, +3, +6, среди них наиболее устойчивы Сr3+; известны отдельные соединения, в которых хром имеет степени окисления +1, +4, +5. Хром химически малоактивен. При обычных условиях устойчив к кислороду и влаге, но соединяется с фтором, образуя CrF3. Выше 600 °С взаимодействует с парами воды, давая Сr2О3; азотом — Cr2N, CrN; углеродом — Сr23С6, Сr7С3, Сr3С2; серой — Cr2S3.
Пассивированный азотной кислотой хром, в отличие от металла без защитного слоя, не растворяется в разбавленных серной и соляной кислотах даже при длительном кипячении в растворах этих кислот, тем не менее, в определенный момент начинается быстрое растворение, сопровождающееся вспениванием от выделяющегося водорода – из пассивной формы хром переходит в активированную, не защищенную пленкой оксида:
Cr + 2HCl = CrCl2 + H2
Если в процессе растворения добавить азотной кислоты, то реакция сразу прекращается – хром снова пассивируется.
При нагревании металлический хром соединяется с галогенами, серой, кремнием, бором, углеродом и некоторыми другими элементами:
Cr + 2F2 = CrF4 (с примесью CrF5)
2Cr + 3Cl2 = 2CrCl3
2Cr + 3S = Cr2S3
При нагревании хрома с расплавленной содой на воздухе, нитратами или хлоратами щелочных металлов получаются соответствующие хроматы(VI):
2Cr + 2Na2CO3 + 3O2 = 2Na2CrO4 + 2CO2.
В зависимости от требуемой степени чистоты металла существует несколько промышленных способов получения хрома.
Возможность алюмотермического восстановления оксида хрома(III) была продемонстрирована еще Фридрихом Вёлером в 1859 однако в промышленном масштабе этот метод стал доступен, как только появилась возможность получения дешевого алюминия. Промышленное алюмотермическое получение хрома началось с работ Гольдшмидта, которому впервые удалось разработать надежный способ регулирования сильно экзотермического (а, следовательно, взрывоопасного) процесса восстановления:
Cr2O3 + 2Al = 2Cr + 2Al2O3.
В растворах наиболее устойчивы соединения хрома (III). В этой степени окисления хрому соответствуют как катионная форма, так и анионные формы, например, существующий в щелочной среде анион [Cr(OH)6]3-.
При окислении соединений хрома (III) в щелочной среде образуются соединения хрома (VI):
2Na3[Cr(OH)6] + 3H2O2 = 2Na2CrO4 + 2NaOH + 8H2O.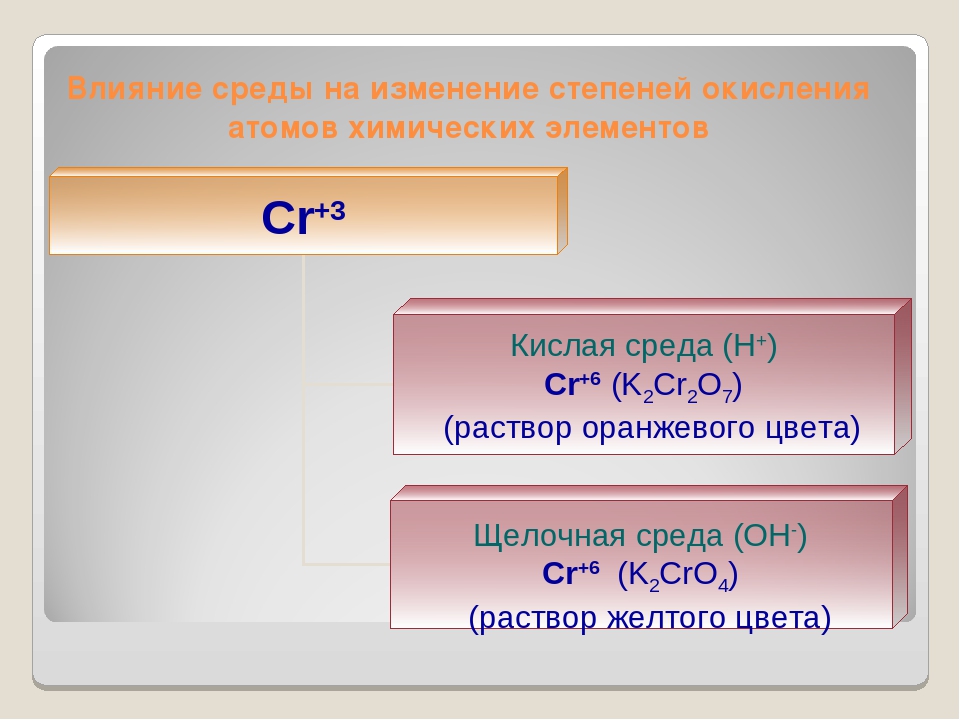
Хрому (VI) отвечает ряд существующих только в водных растворах кислот: хромовая h3CrO4, дихромовая H2Cr2O7, трихромовая H3Cr3O10 и другие, которые образуют соли — хроматы, дихроматы, трихроматы и т. д.
Соединения хрома (III) — сильные окислители, например:
K2Cr2O7 + 14НСl = 2CrCl3 + 2KCl + 3Cl2 + 7H2O.
Хром | ChemToday – химический портал
Хром — 24-й элемент таблицы Менделеева с атомной массой 51,996 а. е. м. По внешнему виду он представляет из себя металл серебристого цвета с характерным блеском.
Металлический хромПрименение
Металлический хром очень стоек к окислению на воздухе, так как его поверхность покрыта тончайшей и плотной плёнкой из оксидов, которая препятствует коррозии. При этом, будучи дополнительно пассивированным реакцией с концентрированными кислотами, хром становится чрезвычайно коррозионно устойчивым материалом, который можно использовать для покрытия металлических изделий (хромирования). )}$$
$$\ce{2Na2CrO4 + 2h3SO4 -> Na2Cr2O7 + 2NaHSO4 + h3O}$$
)}$$
$$\ce{2Na2CrO4 + 2h3SO4 -> Na2Cr2O7 + 2NaHSO4 + h3O}$$
Полученный дихромат подвергают восстановлению либо до соли хрома(III), либо до оксида хрома(III), и восстанавливают электролизом или алюмотермией соответственно:
$$\ce{Na_2Cr_2O_7 + 2C -> Cr_2O_3 + Na_2CO_3 + CO}$$ $$\ce{Cr_2O_3 + 2Al -> 2Cr + Al_2O_3}$$В случае использования солей хрома:
$$\ce{Na_2Cr_2O_7 + 3SO_2 + H_2SO_4 -> Na_2SO_4 + Cr_2(SO_4)_3 + H_2O}$$ $$\ce{2Cr_2(SO_4)_3 + 6H_2O ->[электролиз][раствора] 4Cr + 6H_2SO_4 + 3O_2}$$Полученный алюмотермически хром требует очистки, которую можно провести с помощью перегонки в вакууме (температура кипения при нормальном давлении 2680 градусов Цельсия) или электролитическим методом.
Кусочки металлического хрома, полученные алюмотермией в лабораторииХимические свойства
Хром, как было сказано ранее, стоек к воздействию воздуха, воды и CO2 в стандартных условиях и имеет тончайшую плёнку продуктов окисления, которая, однако, не препятствует растворению металла в разбавленных кислотах.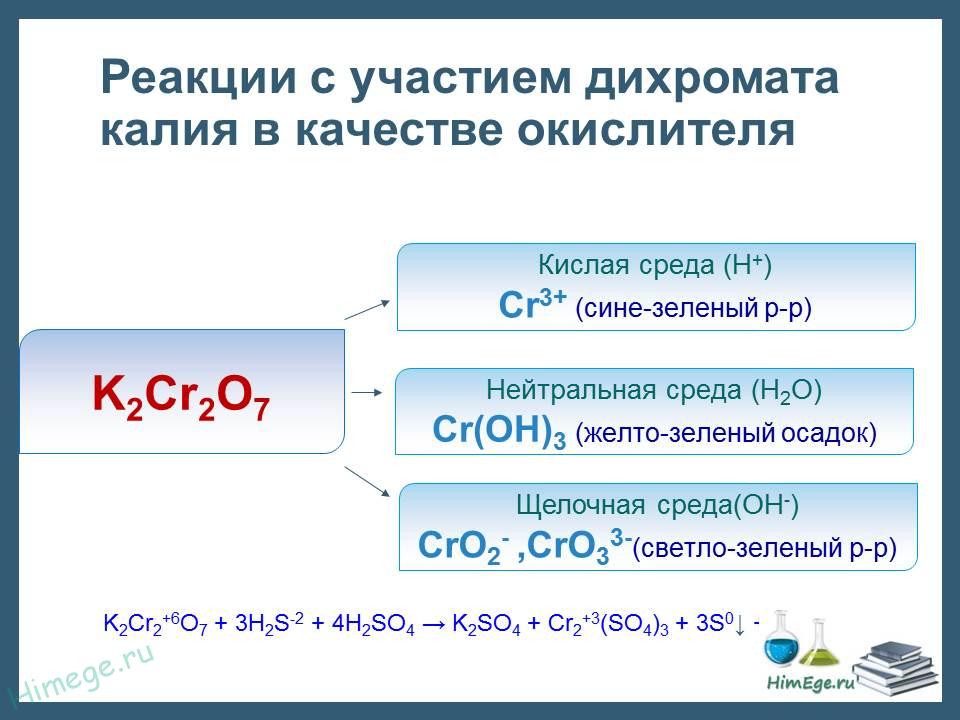 {o}C] Cr_2S_3}$$
$$\ce{Cr + 2HCl -> CrCl_2 + H_2}$$
$$\ce{2Cr + 3Cl_2 -> 2CrCl_3}$$
$$\ce{2Cr + 2NH_3 -> 2CrN (Cr_2N) + 3H_2}$$
$$\ce{Cr + 2F_2 -> CrF_4}$$
{o}C] Cr_2S_3}$$
$$\ce{Cr + 2HCl -> CrCl_2 + H_2}$$
$$\ce{2Cr + 3Cl_2 -> 2CrCl_3}$$
$$\ce{2Cr + 2NH_3 -> 2CrN (Cr_2N) + 3H_2}$$
$$\ce{Cr + 2F_2 -> CrF_4}$$
Степень окисления +2
Соли
В степени окисления +2 хром является сильным восстановителем и может быть стабилизирован только в восстановительной среде (например, в растворе CrCl2/Zn/HCl, где выделяется атомарный водород).
Синего цвета растворы солей хрома(II) содержат комплексный катион гексааквахрома(II), который может обменивать аква-лиганды на амминные по реакции с аммиачным раствором:
$$\ce{[Cr(H_2O)_6]Cl_2 + 6NH_3 -> [Cr(NH_3)_6]Cl_2 + 6H_2O}$$ В верхней части раствора — амминный комплекс, на дне пробирки — хлорид аммония для насыщения раствора хлорид-ионамиПри пропускании через данный раствор (с добавленным NH4Cl) воздуха образуется соединение фиолетового цвета — родохромхлорид, содержащий биядерный комплексный катион с атомами хрома(III):
$$\ce{4[Cr(NH_3)_6]Cl_2 + O_2 + 2NH_4Cl ->2[(NH_3)_5Cr(OH)Cr(NH_3)_5]Cl_5 + 6NH_3}$$ Родохромхлорид, полученный по реакции вышеОдно из интересных соединений хрома(II) — ацетат, который получается при действии растворимых ацетатов на растворы, полученные восстановлением Cr(III):
$$\ce{2CrCl_2 + 4CH_3COONa ->Cr_2(CH_3COO)_4 * 2H_2O(v) + 4NaCl}$$Оно представляет из себя соединение ярко-красного цвета со структурой типа «китайского фонарика»:
Структура ацетата хрома(II)Здесь два атома хрома связаны между собой четырёхкратной связью, и к каждому из них присоединено 4 атома кислорода мостиковых ацетатных групп и одна молекула воды, дополняющая координационный полиэдр каждого атома хрома до правильного октаэдра.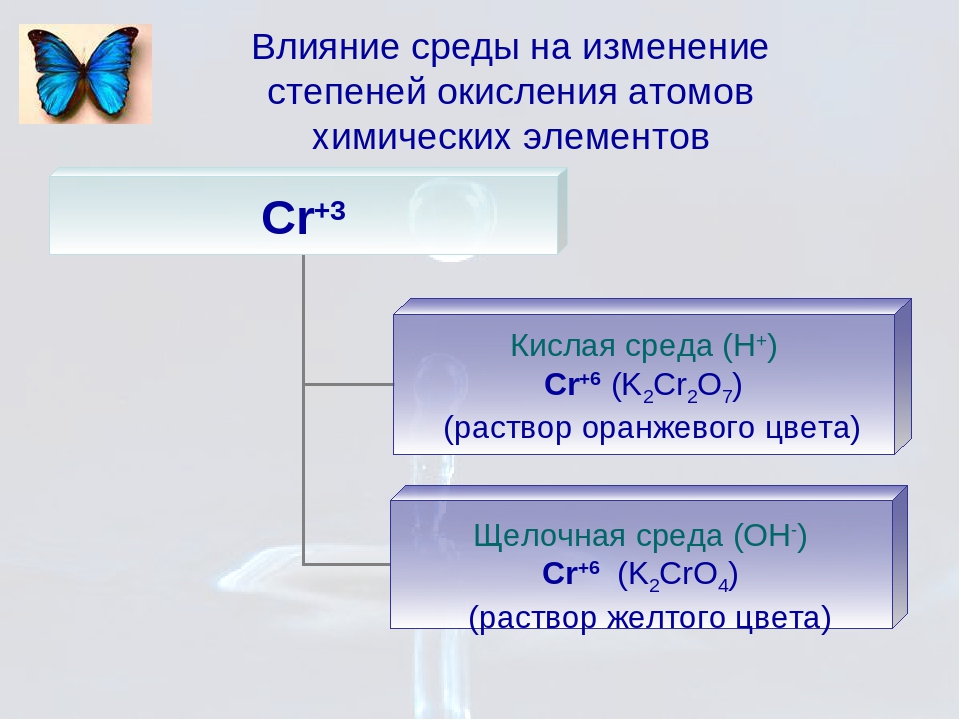
Оксид и гидроксид
При действии щёлочи на растворы солей Cr(II) образуется (в первый момент) жёлтый гидроксид Cr(OH)2, который мгновенно окисляется до коричневых оксидов хрома большей степени окисления (CrO(OH), Cr2O3 и других, так как наибольшую восстановительную активность хром(II) имеет именно в щелочной среде. Поэтому для препаративного получения соединений Cr(II) необходимо вести работу в инертных боксах (шкафах), продувая все растворы аргоном до полного удаления растворённого кислорода.
Оксид хрома(II) чёрного цвета (CrO) так же трудно получить в чистом виде, однако он довольно инертен и диспропорционирует на оксид хрома(III) и хром при нагревании до 700оС.
Степень окисления +3
Соли и комплексы
Степень окисления +3 для хрома — самая термодинамически устойчивая и характерная. Стоит отметить, что электронная конфигурация хрома(III) с точки зрения теории кристаллического поля — t2g3eg0, что даёт максимальную энергию стабилизации кристаллическим полем; также катион Cr3+ имеет маленький размер и высокий заряд, что обеспечивает большую силу притяжения Cr3+-лиганд, и из-за всех этих факторов Cr3+ очень склонен к образованию комплексных частиц.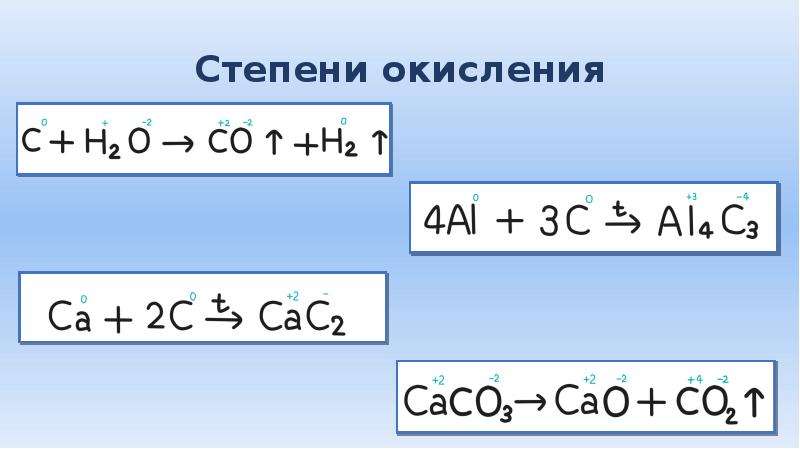
Растворимые соли хрома(III) в растворе имеют окраску от фиолетовой до зелёной, зависящей от структуры и состава комплексного катиона. Если в растворе в основном присутствует октаэдрический ион гексааквахрома(III), то раствор и кристаллы имеют фиолетовый цвет. Это наблюдается, например, в хромокалиевых квасцах:
$$\ce{[K(H_2O)_6][Cr(H_2O)_6](SO_4)_2}$$ Кристаллы хромокалиевых квасцов на стеклянном фильтре ШоттаТакже такая комплексная частица присутствует в гидратах нитрата и сульфата хрома Cr(NO3)3 * 9H2O, Cr2(SO4)3 * 18H2O и других.
Однако, часто анионы соли могут перемещаться внутрь координационной сферы катиона, из-за чего может меняться видимый цвет соединения.
При сгорании хрома в атмосфере хлора образуется безводный хлорид хрома(III) CrCl3ярко-малинового цвета, который трудно растворить в воде из-за довольно прочной кристаллической структуры.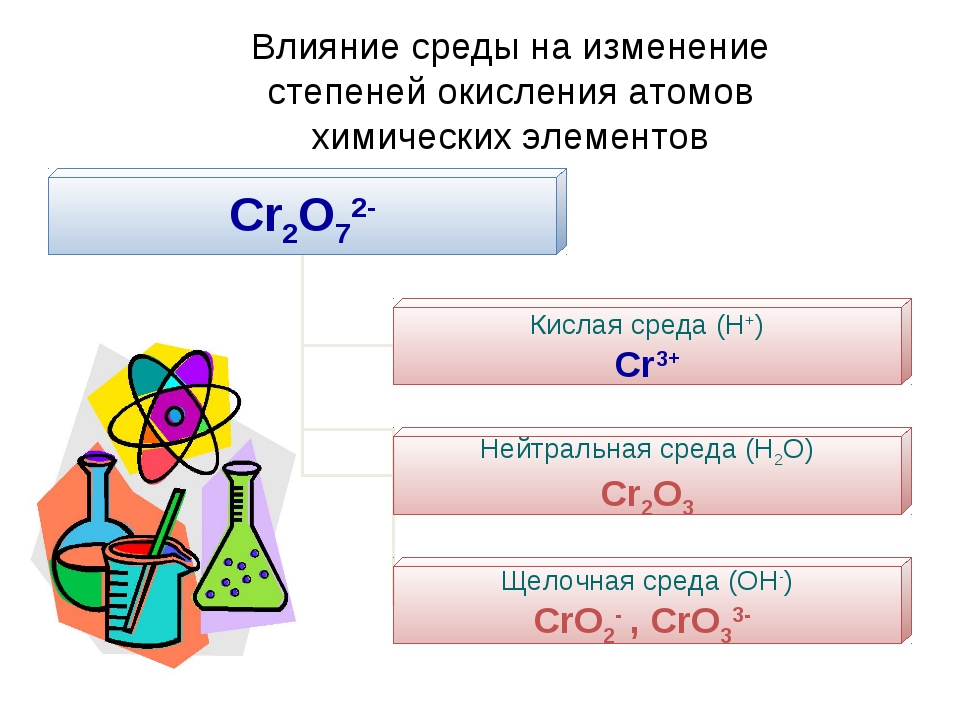 Однако в виде гидрата трихлорид хрома имеет зелёный цвет и хорошо растворим в воде, в которой он может испытывать несколько переходов цвета. Зелёный цвет хлорида хрома вызван присутствием ионов [Cr(H2O)5Cl]2+ светло-зелёного и [Cr(H2O)4Cl2]+ тёмно-зелёного цветов, а при дальнейшем замещении аква-лигандов на хлорид-лиганды образуется катион [Cr(H2O)3Cl3]0 красного цвета. Аналогичные процессы происходят и с другими анионами, например, сульфатом, ацетатом и т. д.
Однако в виде гидрата трихлорид хрома имеет зелёный цвет и хорошо растворим в воде, в которой он может испытывать несколько переходов цвета. Зелёный цвет хлорида хрома вызван присутствием ионов [Cr(H2O)5Cl]2+ светло-зелёного и [Cr(H2O)4Cl2]+ тёмно-зелёного цветов, а при дальнейшем замещении аква-лигандов на хлорид-лиганды образуется катион [Cr(H2O)3Cl3]0 красного цвета. Аналогичные процессы происходят и с другими анионами, например, сульфатом, ацетатом и т. д.
Ещё одним примером комплексного соединения хрома(III) является трис(ацетилацетонат)хрома(III), структура которого представляет собой правильный тетраэдр, а по внешнему виду — это порошок фиолетового цвета:
- Внешний вид Cr(acac)3
- Структура Cr(acac)3
Подобную структуру также имеет анион зелёного триоксалатохромата(III) калия, который можно получить восстановлением дихромата калия щавелевой кислотой в присутствии оксалата калия:
$$\ce{K_2Cr_2O_7 + 2K_2C_2O_4 + 7H_2C_2O_4 ->2K_3[Cr(C_2O_4)_3] + 7H_2O + 6CO_2(^)}$$Оксид и гидроксид
При действии на соли хрома(III) щёлочи вначале образуется зелёный осадок гидроксида хрома(III), который можно записать упрощённой формулой (в реальности соединение имеет переменный состав Cr2O3 * nH2O):
$$\ce{CrCl_3 + 3NaOH ->3NaCl + Cr(OH)_3(v)}$$Который в избытке щёлочи растворяется, образуя комплексный гексагидроксохромат(III)-анион:
$$\ce{Cr(OH)_3 + 3NaOH ->Na_3[Cr(OH)_6]}$$Оксид хрома(III), Cr2O3, полученный твердофазно (разложением дихромата аммония или сжиганием хрома) представляет из себя чрезвычайно устойчивое соединение, не реагирующее ни с кислотами, ни со щелочами в водных растворах. )}$$
)}$$
Оно используется как основной компонент пасты ГОИ, которая из-за высокой твёрдости оксида хрома(III) используется как полировочное средство.
Брусок пасты ГОИСтепень окисления +6
Оксид, кислоты и соли
Высшая степень окисления для хрома — +6, в которой ему присущи кислотные и окислительные свойства. Все соединения хрома(VI) являются очень токсиными и канцерогенными.
Существует оксид хрома(VI), CrO3 — соединение фиолетово-красного цвета, состоящее из бесконечных цепей октаэдров [CrO6]. Его также называют хромовый ангидрид, так как при растворении в воде он образует различные хромовые кислоты.
Чешуйки CrO3При добавлении воды могут образоваться четыре кислоты, отличающихся количеством соединённых (конденсированных) групп [CrO3] — хромовая, дихромовая, трихромовая и тетрахромовая кислоты:
$$\ce{CrO_3 + H_2O -> H_2CrO_4}$$ $$\ce{2CrO_3 + H_2O -> H_2Cr_2O_7}$$ $$\ce{3CrO_3 + H_2O ->H_2Cr_3O_{10}}$$ $$\ce{4CrO_3 + H_2O -> H_2Cr_4O_{13}}$$Все вещества представляют собой сильные кислоты, образующие устойчивые соли с многими катионами: хромат, дихромат, трихромат и тетрахромат соответственно. + -> 4CrO_3(v) + H_2O}$$
+ -> 4CrO_3(v) + H_2O}$$
Также могут быть получены и выделены соли с замещёнными хромат-анионами, например, хлорохромат калия:
$$\ce{K_2Cr_2O_7 + 2HCl_{(24\%)} -> 2KCrO_3Cl + H_2O}$$Солеобразные соединения
Хром(VI), помимо кислотных свойств, может проявлять и основные, образуя катион CrO22+ — катион хромила, который в растворе не существует, однако формально присутствует в некоторых ковалентных солеобразных производных хрома(VI).
Ковалентный хлорид хромила CrO2Cl2 можно получить, нагревая смесь порошков хлорида (например, натрия или калия) и дихромата в присутствии концентрированной серной кислоты. Последняя вызывает реакцию получения CrO3 из дихромата и HCl — из хлорида, которые взаимодействуют и образуется летучая красная жидкость — хлорид хромила, которая при нагреве отгоняется в виде паров (температура кипения 117oC):
$$\ce{K_2Cr_2O_7 + 4KCl + 3H_2SO_4 ->[\Delta] 2CrO_2Cl_2(^) + 3K_2SO_4 + 3H_2O}$$ Демонстрационная установка для получения хлорида хромила. Бурые пары — CrO2Cl2Жидкий хлорид хромила в пробирке
Бурые пары — CrO2Cl2Жидкий хлорид хромила в пробиркеПри добавлении в воду тяжёлые капли хлорида хромила опускаются на дно и постепенно гидролизуются:
$$\ce{2CrO_2Cl_2 + 3H_2O ->[\ce{h3O}] H_2Cr_2O_7 + 4HCl}$$ Капли CrO2Cl2, постепенно гидролизующиеся в воде. Раствор окрашивается в оранжевый цвет из-за присутствия дихромовой кислотыИз хлористого хромила в растворе хлорида сульфурила действием оксида серы(VI) можно получить оксосульфат хрома(VI):
$$\ce{CrO_2Cl_2 + 3SO_3 -> CrO(SO_4)_2(v)+ SO_2Cl_2}$$Пероксиды
При добавлении к дихроматам пероксида водорода в кислой среде степень окисления хрома не меняется и образуется васильково-синее соединение, отвечающее составу K[CrO(O2)2OH] — соль надхромовой кислоты:
$$\ce{K_2Cr_2O_7 + 4H_2O_2 -> 2K[CrO(O_2)_2OH] + 3H_2O}$$ Пентагонально-пирамидальная структура пероксидаКомплекс пероксида хрома с диэтиловым эфиромОднако при добавлении эфира, пиридина или другого органического растворителя, в органический слой экстрагируется стабилизированная этим лигандом форма пероксида хрома. )+ Cr_2O_3 + 4H_2O}$$
Реакция дихроматного вулканчика в химической лаборатории
)+ Cr_2O_3 + 4H_2O}$$
Реакция дихроматного вулканчика в химической лаборатории
Реакция является экзотермической (то есть происходит с выделением тепла), однако требует первоначального нагрева (на видео — горячей стеклянной палочкой) для преодоления энергетического барьера. После преодоления барьера реакция становится самоподдерживающейся (тип СВС — самораспространяющийся высокотемпературный синтез).
Отношение к человеку и токсичность
Среднее содержание хрома в организме взрослого человека может достигать 6 мг. Большие же количества становятся опасными. Все соединения хрома(VI) — хроматы, дихроматы, летучие соединения (хлорид хромила) — чрезвычайно токсичные соединения, вызывающие онкологические заболевания (канцерогены) лёгких, астму и другие последствия.
Однако, хром в организме ускоряет и усиливает процессы обмена углеводов, что помогает плохо усваивающим углеводы пожилым, диабетикам, а также беременным и кормящим женщинам.
Хром
История
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
История
Открыт на Среднем Урале, в Березовском золоторудном месторождении. Впервые упоминается в труде М. В. Ломоносова «Первые основания металлургии» (1763 год), как красная свинцовая руда, PbCrO4. Современное название — крокоит. В 1797 году французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего, Воклен получил карбид хрома).
Нахождение в природе
Хром является довольно распространённым элементом в земной коре (0,012 % по массе). Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Месторождения
Самые большие месторождения хрома находятся в ЮАР (1-е место в мире), Казахстане, России, Зимбабве, Мадагаскаре. Также есть месторождения на территории Турции, Индии, Армении, Бразилии, на Филиппинах.
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2-е место в мире).
Геохимия и минералогия
Среднее содержание хрома в различных изверженных породах резко непостоянно. В ультраосновных породах (перидотитах) оно достигает 2 кг/т, в основных породах (базальтах и др.) — 200 г/т, а в гранитах десятки г/т. Кларк хрома в земной коре 83 г/т. Он является типичным литофильным элементом и почти весь заключен в минералах типа хромшпинелидов. Хром вместе с железом, титаном, никелем, ванадием и марганцем составляют одно геохимическое семейство.
Различают три основных минерала хрома: магнохромит (Mg, Fe)Cr2O4, хромпикотит (Mg, Fe)(Cr, Al)2O4 и алюмохромит (Fe, Mg)(Cr, Al)2O4. По внешнему виду они неразличимы, и их неточно называют «хромиты». Состав их изменчив:
- Cr2O3 18—62 %,
- FeO 1—18 %,
- MgO 5—16 %,
- Al2O3 0,2 — 0,4 (до 33 %),
- Fe2O3 2 — 30 %,
- примеси TiO2 до 2 %,
- V2O5 до 0,2 %,
- ZnO до 5 %,
- MnO до 1 %; присутствуют также Co, Ni и др.

Собственно, хромит, то есть FeCr2O4 сравнительно редок. Помимо различных хромитов, хром входит в состав ряда других минералов — хромовой слюды (фуксита), хромового хлорита, хромвезувиана, хромдиопсида, хромтурмалина, хромового граната (уваровита) и др., которые нередко сопровождают руды, но сами промышленного значения не имеют. В экзогенных условиях хром, как и железо, мигрирует в виде взвесей и может накапливаться в глинах. Наиболее подвижной формой являются хроматы.
Получение
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
- Fe(CrO2)2 + 4C → Fe + 2Cr + 4CO
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
- 4Fe(CrO2)2 + 8Na2CO3 + 7O2 → 8Na2CrO4 + 2Fe2O3 + 8CO2
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём:
- Na2Cr27 + 2C → Cr2O3 + Na2CO3 + CO
5) с помощью алюминотермии получают металлический хром:
- Cr2O3 + 2Al → Al2O3 + 2Cr + 130kcal
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
При этом на катодах совершаются в основном 3 процесса:
- восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
- разряд ионов водорода с выделением газообразного водорода;
- разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
- Cr2O72− + 14H+ + 12e− → 2Cr + 7H2O
Физические свойства
В свободном виде — голубовато-белый металл с кубической объёмноцентрированной решёткой, a = 0,28845 нм. Ниже температуры 38 °C является антиферромагнетиком, выше переходит в парамагнитное состояние (точка Нееля).
Хром имеет твёрдость по шкале Мооса 5, один из самых твёрдых чистых металлов (уступает только иридию, бериллию, вольфраму и урану). Очень чистый хром достаточно хорошо поддаётся механической обработке.
Изотопы
Основная статья: Изотопы хрома
Природный хром состоит из четырех стабильных изотопов (50Cr (изотопная распространённость 4,345 %), 52Cr (83. 789 %), 53Cr (9.501 %), 54Cr (2.365 %)).
789 %), 53Cr (9.501 %), 54Cr (2.365 %)).
Химические свойства
Характерные степени окисления
Для хрома характерны степени окисления +2, +3 и +6 (см. табл.). Практически все соединения хрома окрашены.
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
|---|---|---|---|---|---|
| +2 | CrO (чёрный) | Cr(OH)2 (жёлтый) | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
| +3 | Cr2O3 (зелёный) | Cr(OH)3 (серо-зелёный) | Амфотерный | Cr3+ (зелёные или лиловые соли) [Cr(OH)4]− (зелёный) | |
| +4 | CrO2 | не существует | Несолеобразующий | — | Встречается редко, малохарактерна |
| +6 | CrO3 (красный) | H2CrO4 H2Cr2O7 | Кислотный | CrO42− (хроматы, желтые) Cr2O72− (дихроматы, оранжевые) | Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. Сильнейший окислитель, гигроскопичен, очень ядовит. |
Простое вещество
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
- [H]
- 2Cr3+ → Zn,HCl 2Cr2+
Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или жёлтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (в водных растворах ион Cr3+ существует в виде аквакомплексов [Cr(H2O)6]3+) до зелёного (в координационной сфере присутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
- Cr3+ + 3NH3 + 3H2O → Cr(OH)3↓ + 3NH4+
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
- Cr3+ + 3OH− → Cr(OH)3↓
- Cr(OH)3 + 3OH− → [Cr(OH)6]3−
Сплавляя Cr2O3 со щелочами, получают хромиты:
- Cr2O3 + 2NaOH → 2NaCrO2 + H2O
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
- Cr2O3 + 6HCl → 2CrCl3 + 3H2O
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
- 2Na3[Cr(OH)6] + 3H2O2 → 2Na2CrO4 + 2NaOH + 8H2O
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):
- 2Cr2O3 + 8NaOH + 3O2 → 4Na2CrO4 + 4H2O
Соединения хрома (+4)
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие изополикислоты с общей формулой H2CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
- 2CrO42− + 2H+ → Cr2O72− + H2O
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую, так как снова образуется хромат K2CrO4:
- Cr2O72− + 2OH− → 2CrO42− + H2O
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
- H2CrnO3n+1 → H2O + nCrO3
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, жёлтый хромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:
В частности, жёлтый хромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:
- Ba2+ + CrO42− → BaCrO4↓
- 2Ba2+ + Cr2O72− + H2O → 2BaCrO4↓ + 2H+
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
- K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего монопероксида хрома(VI) CrO5 (CrO(O2)2), который экстрагируется в органический слой; данная реакция используется как аналитическая.
Применение
Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Добавка хрома существенно повышает твердость и коррозийную стойкость сплавов.
Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование).
Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В чистом виде хром довольно токсичен, металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты.
Пример соединения хрома (VI): Оксид хрома (VI)Соединения хрома в степени окисления +6 особо токсичны. Практически вся хромовая руда обрабатывается через преобразование в дихромат натрия. В 1985 году было произведено примерно 136 000 тонн шестивалентного хрома. Другими источниками шестивалентного хрома являются триоксид хрома и различные соли — хроматы и дихроматы. Шестивалентный хром используется при производстве нержавеющих сталей, текстильных красок, консервантов для дерева, при хромировании и пр.
Практически вся хромовая руда обрабатывается через преобразование в дихромат натрия. В 1985 году было произведено примерно 136 000 тонн шестивалентного хрома. Другими источниками шестивалентного хрома являются триоксид хрома и различные соли — хроматы и дихроматы. Шестивалентный хром используется при производстве нержавеющих сталей, текстильных красок, консервантов для дерева, при хромировании и пр.
Шестивалентный хром является признанным канцерогеном при вдыхании. На многих рабочих местах сотрудники подвержены воздействию шестивалентного хрома, например, при гальваническом хромировании или сварке нержавеющих сталей. В Европейском союзе использование шестивалентного хрома существенно ограничено директивой RoHS.
Шестивалентный хром транспортируется в клетки человеческого организма с помощью сульфатного транспортного механизма благодаря своей близости к сульфатам по структуре и заряду. Трёхвалентный хром, более часто встречающийся, не транспортируется в клетки.
Внутри клетки Cr(VI) восстанавливается до метастабильного пятивалентного хрома (Cr(V)), затем до трехвалентного хрома (Cr(III)). Трехвалентный хром, присоединяясь к протеинам, создает гаптены, которые включают иммунную реакцию. После их появления чувствительность к хрому не пропадает. В этом случае даже контакт с текстильными изделиями, окрашенными хромсодержащими красками или с кожей, обработанной хромом, может вызвать раздражение кожи. Витамин C и другие агенты реагируют с хроматами и образуют Cr(III) внутри клетки.
Трехвалентный хром, присоединяясь к протеинам, создает гаптены, которые включают иммунную реакцию. После их появления чувствительность к хрому не пропадает. В этом случае даже контакт с текстильными изделиями, окрашенными хромсодержащими красками или с кожей, обработанной хромом, может вызвать раздражение кожи. Витамин C и другие агенты реагируют с хроматами и образуют Cr(III) внутри клетки.
Продукты шестивалентного хрома являются генотоксичными канцерогенами. Хроническое вдыхание соединений шестивалентного хрома увеличивает риск заболеваний носоглотки, риск рака лёгких. (Лёгкие особенно уязвимы из-за большого количества мелких капилляров). Видимо, механизм генотоксичности запускается пяти- и трёхвалентным хромом.
В США предельно допустимая концентрация шестивалентного хрома в воздухе составляет 5 мкг/м³ (0,005 мг/м³). В России предельно допустимая концентрация хрома (VI) существенно ниже — 1,5 мкг/м³ (0,0015 мг/м³).
Одним из общепризнанных методов избежания шестивалентного хрома является переход от технологий гальванического хромирования к газотермическому и вакуумному напылению.
Основанный на реальных событиях фильм «Эрин Брокович» режиссёра Стивена Содерберга рассказывает о крупном судебном процессе, связанном с загрязнением окружающей среды шестивалентным хромом, в результате которого у многих людей развились серьёзные заболевания.
Хром
| Хром / Chromium (Cr) | |
|---|---|
| Атомный номер | 24 |
| Внешний вид простого вещества |
твёрдый металл голубовато-белого цвета |
| Свойства атома | |
|
Атомная масса (молярная масса) |
51,9961 а. е. м. (г/моль) |
| Радиус атома | 130 пм |
|
Энергия ионизации (первый электрон) |
652,4 (6,76) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d5 4s1 |
| Химические свойства | |
| Ковалентный радиус | 118 пм |
| Радиус иона | (+6e)52 (+3e)63 пм |
|
Электроотрицательность (по Полингу) |
1,66 |
| Электродный потенциал |
-0. 74 74 |
| Степени окисления | 6, 3, 2, 0 |
| Термодинамические свойства простого вещества | |
| Плотность | 7,18 г/см³ |
| Молярная теплоёмкость | 23,3 Дж/(K·моль) |
| Теплопроводность | 93,9 Вт/(м·K) |
| Температура плавления | 2130 K |
| Теплота плавления | 21 кДж/моль |
| Температура кипения | 2945 K |
| Теплота испарения | 342 кДж/моль |
| Молярный объём | 7,23 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая объёмноцентрированая |
| Параметры решётки | 2,885 Å |
| Отношение c/a | — |
| Температура Дебая | 460 K |
| Cr | 24 |
| 51,9961 | |
| [Ar]3d54s1 | |
| Хром | |
Хром —элемент побочной подгруппы шестой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 24. Обозначается символом Cr (Chromium). Простое вещество хром (CAS-номер: 7440-47-3) — твёрдый металл голубовато-белого цвета.
И. Менделеева, атомный номер 24. Обозначается символом Cr (Chromium). Простое вещество хром (CAS-номер: 7440-47-3) — твёрдый металл голубовато-белого цвета.
История
Схема атома хрома
В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO4. Современное название — крокоит. В 1797 французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего Воклен получил карбид хрома).
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
Добыча
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 млн. т (или 1 место в мире)
Получение
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
Из него получают феррохром восстановлением в электропечах коксом (углеродом):
- FeO · Cr2O3 + 4C → Fe + 2Cr + 4CO↑
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата углём:
- Na2Cr2O7 + 2C → Cr2O3 + Na2CO3 + CO↑
5) с помощью алюминотермии получают металлический хром:
- Cr2O3+ 2Al → Al2O3 + 2Cr + 130 ккал
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
При этом на катодах совершаются в основном 3 процесса:
- восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
- разряд ионов водорода с выделением газообразного водорода;
- разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
- Cr2O72− + 14Н+ + 12е− = 2Cr + 7H2O
Физические и химические свойства
В свободном виде — голубовато-белый металл с кубической объемно-центрированной решеткой, а = 0,28845 нм. При температуре 39 °C переходит из парамагнитного состояния в антиферромагнитное (точка Нееля).
Хром является самым твердым металлом (твердость по шкале Мооса 8.5).
Устойчив на воздухе. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.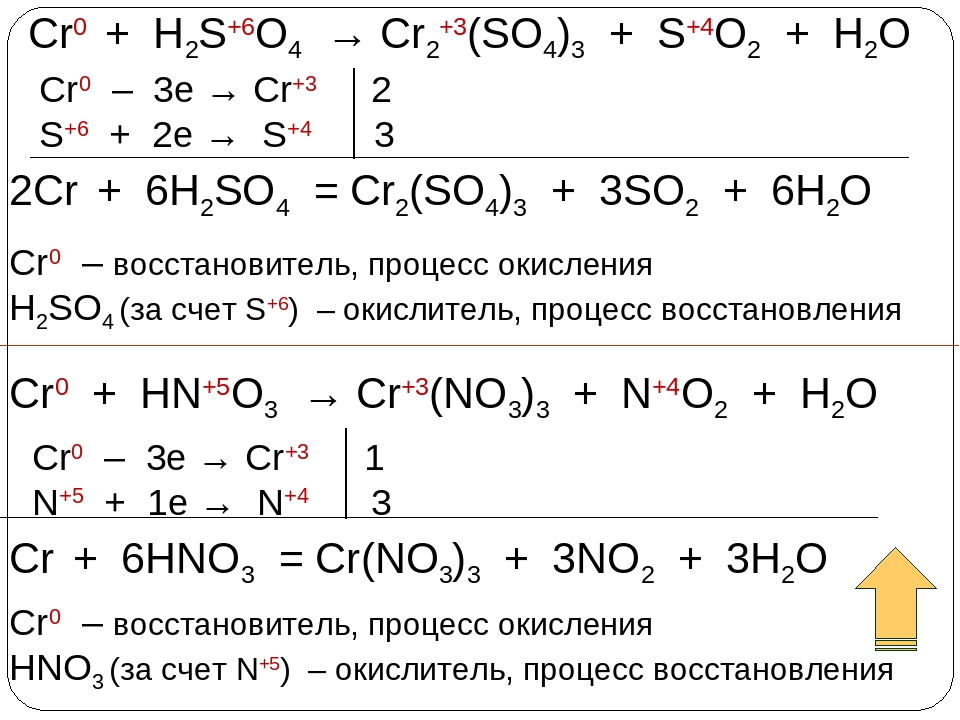 Сплавляя Cr2O3 со щелочами получают хромиты:
Сплавляя Cr2O3 со щелочами получают хромиты:
- Cr2O3 + 2NaOH → 2NaCrO2 + H2O.
Непрокаленный оксид хрома(III) легко растворяется в щелочных растворах и в кислотах:
- Cr2O3 + 6HCl → 2CrCl3 + 3Н2О.
При термическом разложении карбонила хрома Cr(СО)6 получают красный основной оксид хрома(II) CrO. Коричневый или желтый гидроксид Cr(OH)2 со слабоосновными свойствами осаждается при добавлении щелочей к растворам солей хрома(II).
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
При взаимодействии концентрированной серной кислоты с растворами дихроматов образуются красные или фиолетово-красные кристаллы оксида хрома(VI) CrO3.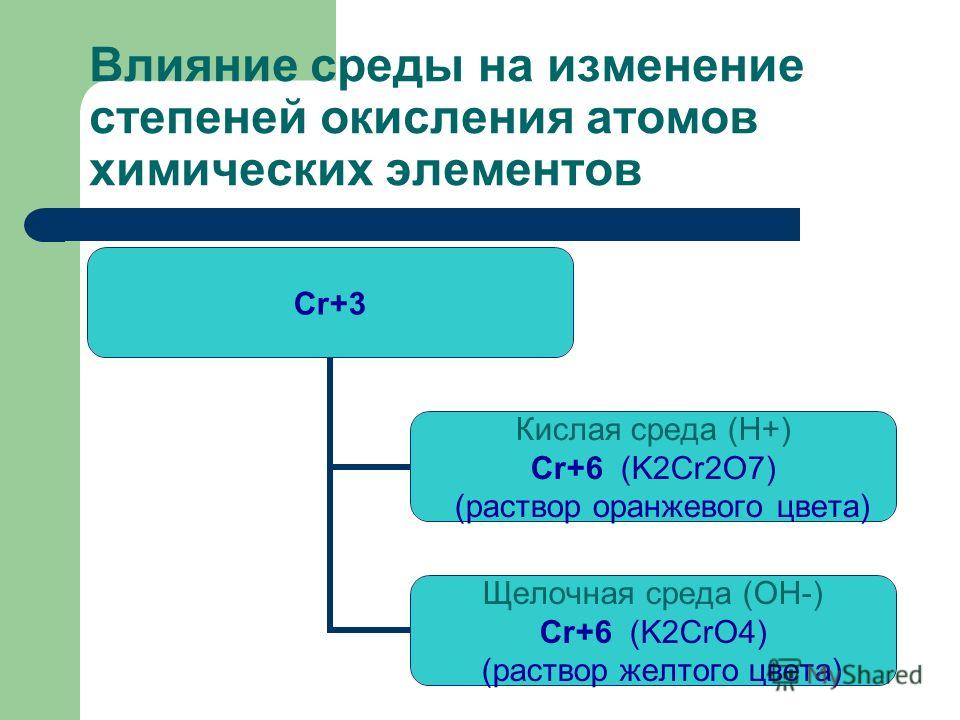 Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие.
Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие.
Известны галогениды, соответствующие разным степеням окисления хрома. Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2 и тригалогениды CrF3, CrCl3, CrBr3 и CrI3. Однако, в отличие от аналогичных соединений алюминия и железа, трихлорид CrCl3 и трибромид CrBr3 хрома нелетучи.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах. Известен гексафторид хрома CrF6.
Получены и охарактеризованы оксигалогениды хрома CrO2F2 и CrO2Cl2.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
В растворах наиболее устойчивы соединения хрома(III). В этой степени окисления хрому соответствуют как катионная форма, так и анионные формы, например, существующий в щелочной среде анион [Cr(OH)6]3−.
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
- 2Na3[Cr(OH)6] + 3H2O2 → 2Na2CrO4 + 2NaOH + 8H2O.
Хрому(VI) отвечает ряд существующих только в водных растворах кислот: хромовая H2CrO4, дихромовая H2Cr2O7, трихромовая H3Cr3O10 и другие, которые образуют соли — хроматы, дихроматы, трихроматы и т. д.
В зависимости от кислотности среды анионы этих кислот легко превращаются друг в друга. Например, при подкислении жёлтого раствора хромата калия K2CrO4 образуется оранжевый дихромат калия K2Cr2O7:
-
2K2CrO4 + 2HCl → K2Cr2O7 + 2KCl + Н2О.
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую так как снова образуется хромат калия K2CrO4:
- K2Cr2O7 + 2KOH → 2K2CrO4 + Н2О.
При добавлении к жёлтому раствору, содержащему хромат-ионы, раствора соли бария выпадает жёлтый осадок хромата бария BaCrO4:
- Ba2+ + CrO42- → BaCrO4↓.
Соединения хрома(VI) — сильные окислители, например:
- K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O.
Применение
Хром важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование). Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
Металлический хром практически нетоксичен, но металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты. Соединения хрома(VI) приводят к разным заболеваниям человека, в том числе и онкологическим. ПДК хрома(VI) в атмосферном воздухе 0,0015 мг/м³.
Соединения хрома
Хромтау
Химия хрома и некоторые вытекающие из нее аналитические задачи.

Environ Health Perspect. 1991 май; 92: 7–11.
Исследовательская статья
Химический факультет Университета Вилланова, Пенсильвания, 19085.
Эта статья цитировалась в других статьях PMC.Abstract
Хром, названный в честь его разноцветных соединений, существует в степенях окисления от -2 до +6 включительно. Соединения демонстрируют широкий спектр геометрических форм, включая квадратно-плоские, тетраэдрические, октаэдрические и различные искаженные геометрические формы.Хром встречается в природе главным образом в виде хромитовой руды FeCr2O4, в которой хром находится в состоянии +3. Существование определенной степени окисления зависит от многих факторов, включая pH, окислительно-восстановительный потенциал и кинетику. Термодинамически наиболее стабильными состояниями являются +3 и +2, тогда как степени окисления +3 и +6 наиболее распространены в водном растворе. Кинетически хром +3 инертен замещению: для водообмена k(сек-1) = 2,5 х 10(-6) из-за наличия наполовину заполненного d(t2g)3. 4A2g состояние. С другой стороны, протонирование/депротонирование происходит довольно быстро. Полимеризация протекает очень медленно, но ускоряется при более высоких значениях pH; кислотное расщепление протонированных олигомеров также происходит довольно медленно. Хром +6 как ион хромата сильно окисляется при низких значениях pH и в меньшей степени в щелочном растворе. Ион хромата действительно образует некоторые поликислоты и полианионы. Эти факторы необходимо учитывать при анализе образцов на содержание общего хрома и количество каждой степени окисления.
4A2g состояние. С другой стороны, протонирование/депротонирование происходит довольно быстро. Полимеризация протекает очень медленно, но ускоряется при более высоких значениях pH; кислотное расщепление протонированных олигомеров также происходит довольно медленно. Хром +6 как ион хромата сильно окисляется при низких значениях pH и в меньшей степени в щелочном растворе. Ион хромата действительно образует некоторые поликислоты и полианионы. Эти факторы необходимо учитывать при анализе образцов на содержание общего хрома и количество каждой степени окисления.
Полный текст
Полный текст доступен в виде отсканированной копии оригинальной печатной версии.Получите копию для печати (файл PDF) полной статьи (972K) или щелкните изображение страницы ниже, чтобы просмотреть страницу за страницей. Ссылки на PubMed также доступны для Selected References .
Изображения в этой статье
Нажмите на изображение, чтобы увеличить его.
Избранные ссылки
Эти ссылки находятся в PubMed. Это может быть не полный список ссылок из этой статьи.
Это может быть не полный список ссылок из этой статьи.
- Андерсон Р.А., Козловский А.С.Потребление, всасывание и выведение хрома субъектами, придерживающимися самостоятельно выбранной диеты. Am J Clin Nutr. 1985 г., июнь; 41 (6): 1177–1183. [PubMed] [Google Scholar]
- Witmer CM, Park HS, Shupack SI. Мутагенность и утилизация хрома. Sci Total Environ. 1989 г., 1 октября; 86 (1-2): 131–148. [PubMed] [Google Scholar]
- Дебетто П., Лучани С. Токсическое влияние хрома на клеточный метаболизм. Sci Total Environ. 1988 г., 1 июня; 71 (3): 365–377. [PubMed] [Google Scholar]
Статьи из журнала Environmental Health Perspectives предоставлены здесь National Institute of Health Health Sciences
Степень окисления +2 Cr, включенного в кристаллическую решетку UO2
Расчетное UO, легированный Cr
2 Для проведения расчетов DFT+ U мы сначала получили параметр Хаббарда U для элементов d и f в рассматриваемых соединениях (оксиды Cr и U, см.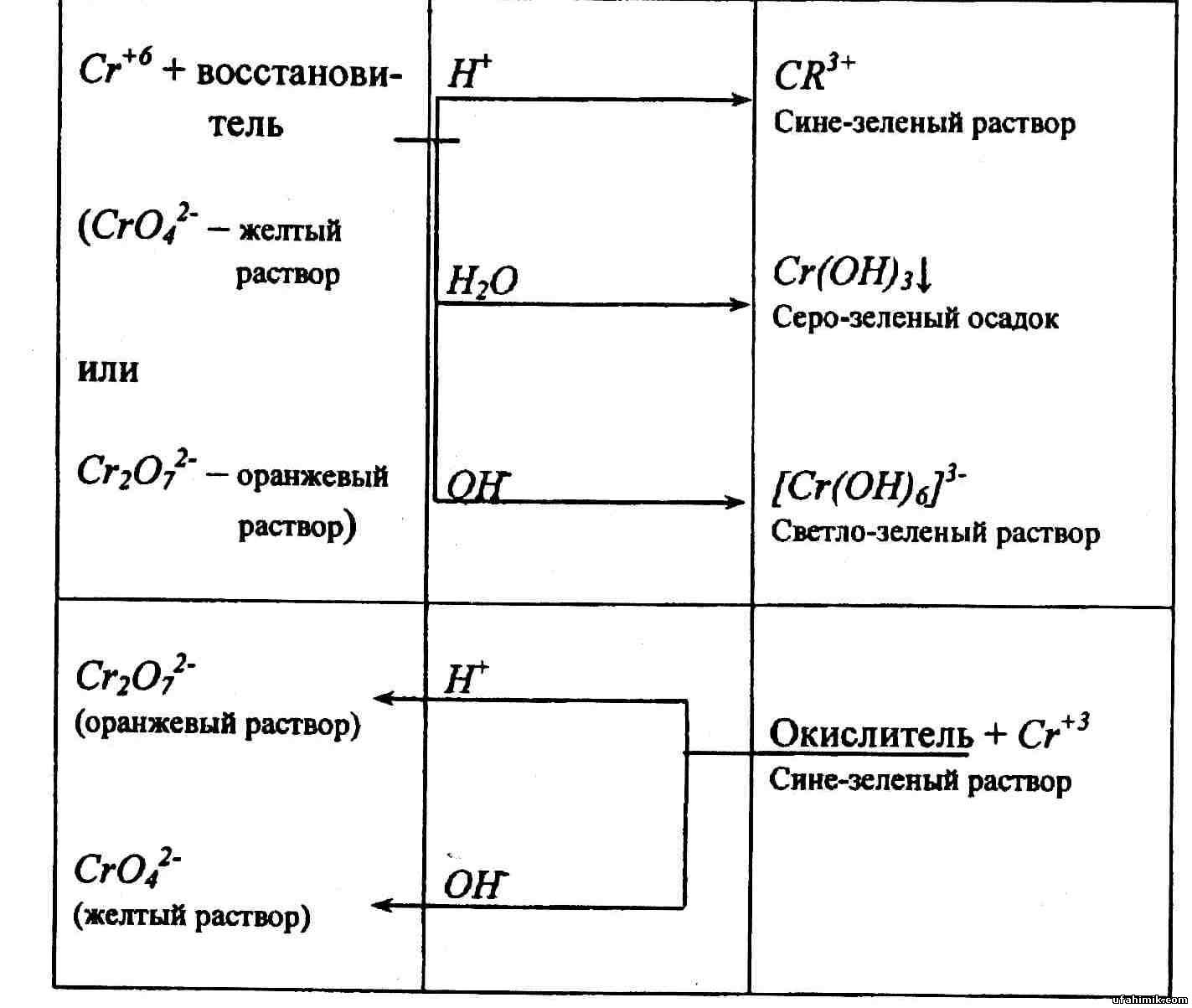 Инжир.1 для расчетной структуры UO 2 ). Вычисленное значение параметра Хаббарда U для Cr в Cr 2 O 3 (т.е. Cr 3+ ) составляет 4,0 эВ, что согласуется с тем, что использовалось в предыдущих исследованиях Cr-содержащих систем (~ 3,5 эВ, например, ссылки 6,18,19,20,21 ). Для Cr 2+ мы использовали значение 6,5 эВ, полученное нами для CrO. Такое же значение мы получили для Cr 2+ в UO 2 , и мы заметили, что полученный параметр Хаббарда U сильно зависит от степени окисления Cr, но слабо зависит от местного окружения Cr.Поэтому мы решили использовать значения, зависящие от степени окисления, полученные для оксидов хрома, во всех расчетах легированного хромом UO 2 . Для UO 2 мы использовали значение 1,7 эВ, полученное для UO 2 Беридзе и Ковальски 22 , которое также является репрезентативным для U 4+ видов 15,22,23 .
Инжир.1 для расчетной структуры UO 2 ). Вычисленное значение параметра Хаббарда U для Cr в Cr 2 O 3 (т.е. Cr 3+ ) составляет 4,0 эВ, что согласуется с тем, что использовалось в предыдущих исследованиях Cr-содержащих систем (~ 3,5 эВ, например, ссылки 6,18,19,20,21 ). Для Cr 2+ мы использовали значение 6,5 эВ, полученное нами для CrO. Такое же значение мы получили для Cr 2+ в UO 2 , и мы заметили, что полученный параметр Хаббарда U сильно зависит от степени окисления Cr, но слабо зависит от местного окружения Cr.Поэтому мы решили использовать значения, зависящие от степени окисления, полученные для оксидов хрома, во всех расчетах легированного хромом UO 2 . Для UO 2 мы использовали значение 1,7 эВ, полученное для UO 2 Беридзе и Ковальски 22 , которое также является репрезентативным для U 4+ видов 15,22,23 .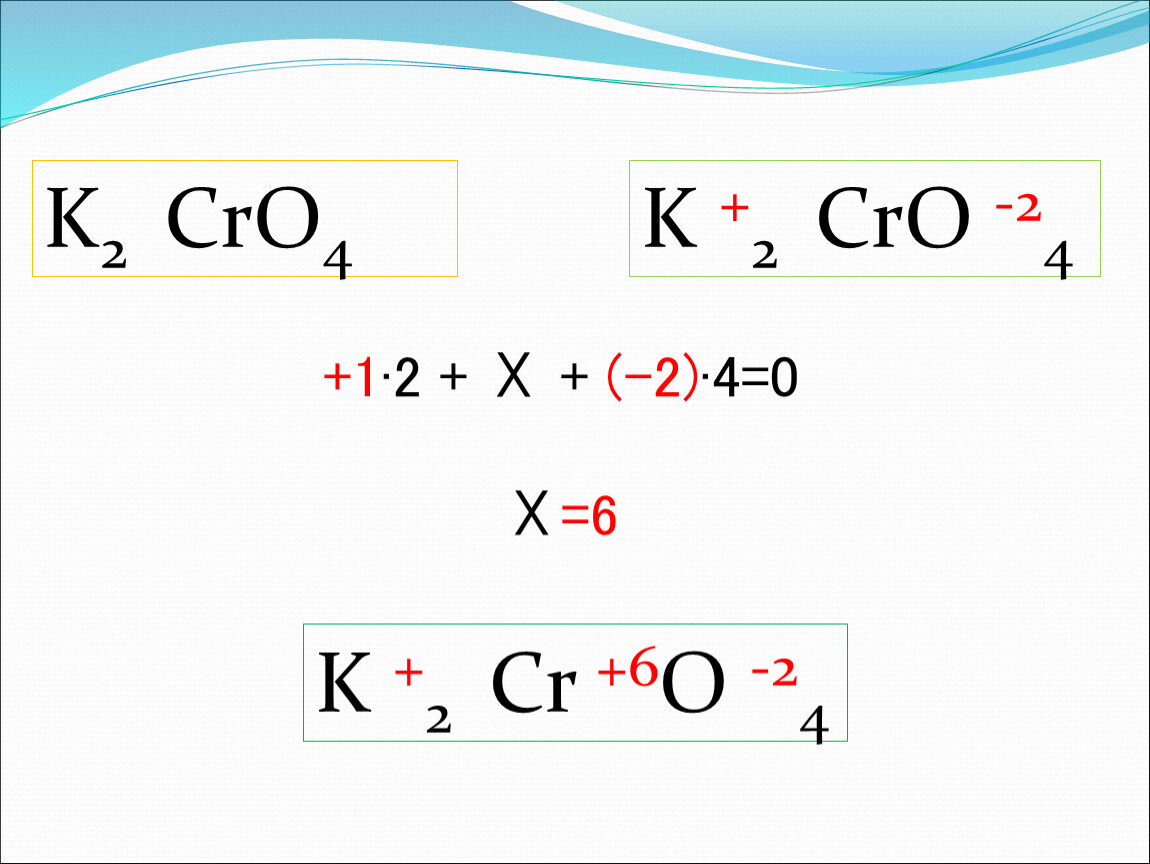 Подробная информация и обсуждение параметра решетки, ширины запрещенной зоны и спектральных характеристик, связанных с рентгеновским излучением, полученных для UO 2 , а также других оксидов урана с применением применяемой вычислительной методологии, представлены в предыдущих исследованиях 15,22 .
Подробная информация и обсуждение параметра решетки, ширины запрещенной зоны и спектральных характеристик, связанных с рентгеновским излучением, полученных для UO 2 , а также других оксидов урана с применением применяемой вычислительной методологии, представлены в предыдущих исследованиях 15,22 .
Стрелки указывают рассчитанное поперечное расположение 1k антиферромагнитных спинов, найденное Pegg et al. 52 в качестве предпочтительной магнитной структуры в UO 2 и принята в наших исследованиях.
Первоначально мы рассчитали два наиболее вероятных случая легированного хромом UO 2 , а именно: (1) катионный обмен с образованием частиц U 5+ и (2) катионный обмен двух соседних участков с образование O-вакансии на мостиковом участке кислорода, присоединенном к атомам Cr, как было предложено Guo et al. 11 . Обе конфигурации визуализированы на рис. 2 и отмечены как 1Cr и 2Cr + 1Ov соответственно. После интерпретации измерений XANES Riglet-Martial et al. 4 , в обоих случаях мы исходно предполагали образование форм Cr 3+ . В случае (1) мы предполагали баланс заряда за счет образования одного U 5+ на один атом Cr. Кроме того, для случая (1) мы попытались вычислить системы с видами Cr 2+ и Cr 4+ , обеспечив начальное заполнение d -орбиталей Cr (4, 3 и 2 d электрона для Cr 2+ , Cr 3+ и Cr 4+ соответственно).Удивительно, но во всех расчетах результирующая электронная конфигурация всегда была Cr 2+ (т.е. четыре электрона), с зарядом, уравновешенным образованием частиц U 5+ . Например, в случае (2) при образовании двух частиц Cr 2+ мы получили пару U 5+ .
Обе конфигурации визуализированы на рис. 2 и отмечены как 1Cr и 2Cr + 1Ov соответственно. После интерпретации измерений XANES Riglet-Martial et al. 4 , в обоих случаях мы исходно предполагали образование форм Cr 3+ . В случае (1) мы предполагали баланс заряда за счет образования одного U 5+ на один атом Cr. Кроме того, для случая (1) мы попытались вычислить системы с видами Cr 2+ и Cr 4+ , обеспечив начальное заполнение d -орбиталей Cr (4, 3 и 2 d электрона для Cr 2+ , Cr 3+ и Cr 4+ соответственно).Удивительно, но во всех расчетах результирующая электронная конфигурация всегда была Cr 2+ (т.е. четыре электрона), с зарядом, уравновешенным образованием частиц U 5+ . Например, в случае (2) при образовании двух частиц Cr 2+ мы получили пару U 5+ .

В случаях 1Cr+1Ov (a) и 2Cr+2Ov (a) Cr смещен в сторону пустого катионного междоузлия, и две структуры получены в результате классического молекулярного моделирования.
Такой неожиданный теоретический результат требует серьезного обоснования и подтверждения экспериментальными данными. Самое простое, что можно сделать при рассмотрении степени окисления соединения, замещающего другой матричный элемент-хозяин, в нашем случае хрома, замещающего атом урана, – это проверить размеры вовлеченных катионов. Это связано с тем, что катионы одинакового размера легче обменивать из-за минимизации связанной деформации, возникающей в результате несоответствия размеров. В таблице 1 мы перечисляем ионные радиусы и объемы рассматриваемых частиц 24 .Cr 3+ значительно меньше U 4+ (на 66% по объему) и даже U 5+ (на 51% по объему). Размер Cr 2+ очень похож на размер U 4+ (меньше всего на 32 % по объему) и почти такой же, как у U 5+ . Поскольку эффекты избыточной деформации возникают как квадратичная функция несоответствия объема (например, Ковальски и Li 25 ), с учетом размеров катионов более вероятен сценарий с Cr 2+ . Однако, даже имея в руках привлекательные теоретические аргументы, нельзя легко пренебречь результатами исследований XANES Riglet-Martial et al. 4 , которые, по-видимому, достаточно убедительно указывают на образование Cr 3+ в легированном Cr UO 2 . Поэтому мы решили провести повторный анализ этих данных, используя эталон XANES для Cr 2+ , случай, который отсутствует в анализе Riglet-Martial et al. 4 .
Поскольку эффекты избыточной деформации возникают как квадратичная функция несоответствия объема (например, Ковальски и Li 25 ), с учетом размеров катионов более вероятен сценарий с Cr 2+ . Однако, даже имея в руках привлекательные теоретические аргументы, нельзя легко пренебречь результатами исследований XANES Riglet-Martial et al. 4 , которые, по-видимому, достаточно убедительно указывают на образование Cr 3+ в легированном Cr UO 2 . Поэтому мы решили провести повторный анализ этих данных, используя эталон XANES для Cr 2+ , случай, который отсутствует в анализе Riglet-Martial et al. 4 .
Повторная оценка экспериментального XANES
Степень окисления атома в твердой матрице обычно измеряется с помощью метода XANES 26 .С этой целью измеренные данные сравниваются с набором эталонных данных о веществах в различной степени окисления.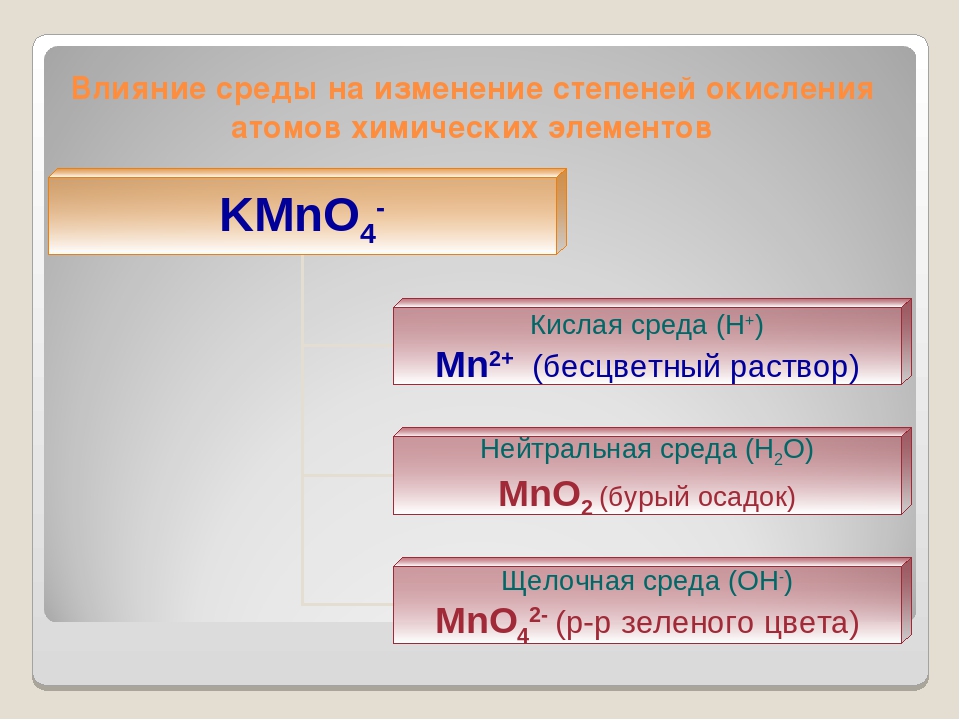 В предыдущих исследованиях Riglet-Martial et al. 4 , ссылки на Cr 0 (металл Cr), Cr 3+ (Cr 2 O 3 , FeCrO 4 ) и Cr 6+ 8 используется для анализа XANES легированного хромом UO 2 . Авторы пришли к выводу, что их XANES легированного хромом UO 2 лучше всего напоминает эталон для Cr 3+ , который они используют в качестве окончательного доказательства существования Cr 3+ в UO 2 .Вывод в основном подтверждается наилучшим совпадением положения двух предкраев, что следует из подробной характеристики спектров XANES различных Cr-содержащих соединений Farges 27 . Однако соответствие эталону XANES не идеально, что предполагает возможную другую интерпретацию. В аналогичных исследованиях Mieszczynski et al. 7 , хотя предполагается Cr 3+ , также обсуждается возможность существования состояния Cr 2+ , на которое может указывать наличие плеча при 5996 Å, отмеченное стрелкой на рис.
В предыдущих исследованиях Riglet-Martial et al. 4 , ссылки на Cr 0 (металл Cr), Cr 3+ (Cr 2 O 3 , FeCrO 4 ) и Cr 6+ 8 используется для анализа XANES легированного хромом UO 2 . Авторы пришли к выводу, что их XANES легированного хромом UO 2 лучше всего напоминает эталон для Cr 3+ , который они используют в качестве окончательного доказательства существования Cr 3+ в UO 2 .Вывод в основном подтверждается наилучшим совпадением положения двух предкраев, что следует из подробной характеристики спектров XANES различных Cr-содержащих соединений Farges 27 . Однако соответствие эталону XANES не идеально, что предполагает возможную другую интерпретацию. В аналогичных исследованиях Mieszczynski et al. 7 , хотя предполагается Cr 3+ , также обсуждается возможность существования состояния Cr 2+ , на которое может указывать наличие плеча при 5996 Å, отмеченное стрелкой на рис. 3. Чтобы подтвердить или отвергнуть возможный сценарий состояния Cr 2+ , они заявили о необходимости проведения расчетов ab initio. Поскольку такое моделирование, проведенное здесь, определенно показывает состояние Cr 2+ , мы провели обширный литературный поиск соответствующей ссылки на состояние Cr 2+ . Такие данные мы нашли по Cr 2+ в синтетическом энстатите (Mg 0,9 Cr 0,1 SO 3 ) 28 . С их помощью на рис. 3 мы отображаем XANES легированного хромом UO 2 Riglet-Martial et al. 4 , которые согласуются с данными Mieszczynski et al. 7 вместе со справочными данными для Cr 3+ (Cr 2 O 3 ) и для вышеупомянутого Cr 2+ . Сравнение всех спектров показывает, что XANES, измеренный Riglet-Martial et al. 4 так же близко напоминает Cr 3+ , как и ссылки Cr 2+ . Это относится к форме спектра и распределению пиков и провалов, которые, так или иначе, не полностью воспроизводятся эталонами.
3. Чтобы подтвердить или отвергнуть возможный сценарий состояния Cr 2+ , они заявили о необходимости проведения расчетов ab initio. Поскольку такое моделирование, проведенное здесь, определенно показывает состояние Cr 2+ , мы провели обширный литературный поиск соответствующей ссылки на состояние Cr 2+ . Такие данные мы нашли по Cr 2+ в синтетическом энстатите (Mg 0,9 Cr 0,1 SO 3 ) 28 . С их помощью на рис. 3 мы отображаем XANES легированного хромом UO 2 Riglet-Martial et al. 4 , которые согласуются с данными Mieszczynski et al. 7 вместе со справочными данными для Cr 3+ (Cr 2 O 3 ) и для вышеупомянутого Cr 2+ . Сравнение всех спектров показывает, что XANES, измеренный Riglet-Martial et al. 4 так же близко напоминает Cr 3+ , как и ссылки Cr 2+ . Это относится к форме спектра и распределению пиков и провалов, которые, так или иначе, не полностью воспроизводятся эталонами. Эта «несовершенство» вполне ожидаема и, как поясняет Farges 27 , связана с различным локальным окружением Cr во всех рассматриваемых фазах. После анализа Farges 27 , примененного также Riglet-Martial et al. 4 , это положения двух предкраев или взвешенных центроидов (пиков, расположенных при ~5991 эВ и ~5994 эВ в случае Cr 2 O 3 , рис. 3), которые различают между различными степенями окисления Cr. Существует значительный и прогрессивный сдвиг во втором пике перед краем (пик с более высокой энергией) и положениях центроида в зависимости от степени окисления Cr (~ 1 эВ на увеличение степени окисления).Для разных видов Cr центроид должен располагаться следующим образом: ~5993 эВ (Cr 2+ ), ~5994 эВ (Cr 3+ ), ~5995 эВ (Cr 4+ ), ~5995,7 эВ (Cr 4+ ), Cr 5+ ) и ~5996,7 эВ (Cr 6+ ) (см. рис. 4 Farges 27 ). Таким образом, мы проверили положение этого центроида в XANES легированного хромом UO 2 и сравнили его с эталонами для Cr 2+ и Cr 3+ .
Эта «несовершенство» вполне ожидаема и, как поясняет Farges 27 , связана с различным локальным окружением Cr во всех рассматриваемых фазах. После анализа Farges 27 , примененного также Riglet-Martial et al. 4 , это положения двух предкраев или взвешенных центроидов (пиков, расположенных при ~5991 эВ и ~5994 эВ в случае Cr 2 O 3 , рис. 3), которые различают между различными степенями окисления Cr. Существует значительный и прогрессивный сдвиг во втором пике перед краем (пик с более высокой энергией) и положениях центроида в зависимости от степени окисления Cr (~ 1 эВ на увеличение степени окисления).Для разных видов Cr центроид должен располагаться следующим образом: ~5993 эВ (Cr 2+ ), ~5994 эВ (Cr 3+ ), ~5995 эВ (Cr 4+ ), ~5995,7 эВ (Cr 4+ ), Cr 5+ ) и ~5996,7 эВ (Cr 6+ ) (см. рис. 4 Farges 27 ). Таким образом, мы проверили положение этого центроида в XANES легированного хромом UO 2 и сравнили его с эталонами для Cr 2+ и Cr 3+ . Положения первого предкраевого пика с более низкой энергией очень похожи для обеих степеней окисления Cr 7,27 (см.3 и дополнительный рис. 1). Отметим, что сравнение с эталоном Cr 2+ не проводилось Riglet-Martial et al. 4 .
Положения первого предкраевого пика с более низкой энергией очень похожи для обеих степеней окисления Cr 7,27 (см.3 и дополнительный рис. 1). Отметим, что сравнение с эталоном Cr 2+ не проводилось Riglet-Martial et al. 4 .
a Спектры легированного Cr UO 2 (толстая сплошная синяя линия) 4 и (тонкая сплошная синяя линия) 7 и эталонные фазы для Cr 2+ 3+ 4 ; б предкраевая область спектров.Черные сплошные и пунктирные линии в b представляют собой линейные базовые линии, используемые для выделения второго пика перед краем, и положения двух пиков перед краем, как указано Riglet-Martial et al. 4 (их рис. 2б). Отметим очень хорошее согласие между двумя независимыми измерениями спектров XANES легированного хромом UO 2 4,7 . Стрелка указывает на предкраевую особенность 5996 Å, предполагаемую Mieszczynski et al. 7 быть подписью Cr 2+ .
Стрелка указывает на предкраевую особенность 5996 Å, предполагаемую Mieszczynski et al. 7 быть подписью Cr 2+ .
Как показано на рис. 3, второй пик перед краем, который различает различные виды Cr, расположен при ~ 5993 эВ для Cr 2+ и ~ 5994 эВ для Cr 3+ , а смещение ~ 0,7 эВ хорошо видно. С другой стороны, этот пик едва виден, но отчетливо обнаруживается (рис. 3) в спектрах легированного хромом UO 2 Риглет-Мартиал и др. 4 . Чтобы проверить правильное положение этого пика перед краем, мы выделили соответствующий пик из спектров, вычитая линейную базовую линию, которая охватывает основание функции.Полученные профили пиков для эталонов Cr 2+ и Cr 3+ и спектров XANES UO 2 , легированных Cr, сравниваются на рис. 4. Три пика, извлеченные из XANES, симметричны, что демонстрируется. с хорошим соответствием по Гауссу (см. Дополнительную таблицу 1 для подобранных параметров).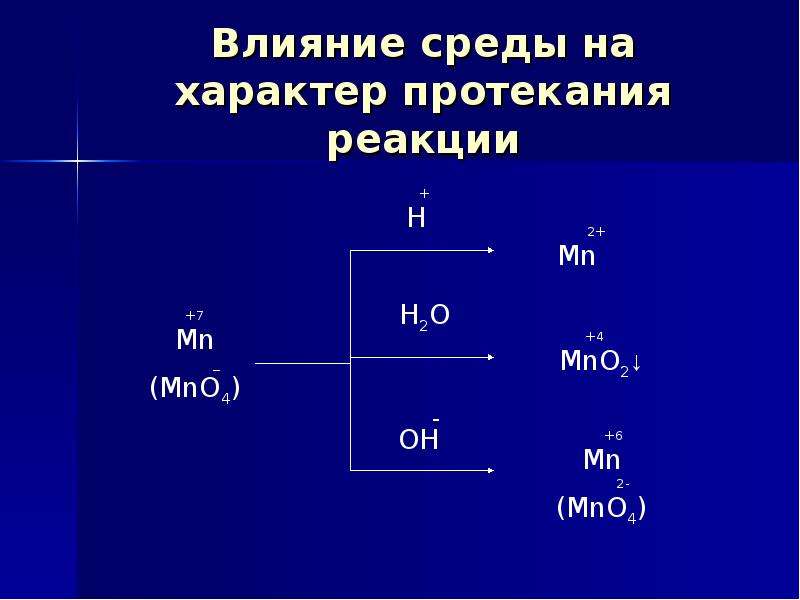 Это также подтверждает применяемую процедуру обработки данных. Хорошо видно, что положение и высота пиков Cr 2+ и легированного Cr UO 2 близки, а положение пика в случае Cr 3+ значительно сдвинуто вправо на ~ 0.7 эВ. Полученные таким образом положения вторых передних краев, полученные путем подгонки с помощью функции Гаусса, приведены в таблице 2. Здесь мы также сообщаем положения центроида (т. е. средневзвешенное значение всех пиков перед краем), полученные с использованием подгонки нескольких пиков. процедура, предложенная Farges 27 и Wilke et al. 29 (подробности см. в дополнительном примечании 1 и дополнительных таблицах 2 и 3).
Это также подтверждает применяемую процедуру обработки данных. Хорошо видно, что положение и высота пиков Cr 2+ и легированного Cr UO 2 близки, а положение пика в случае Cr 3+ значительно сдвинуто вправо на ~ 0.7 эВ. Полученные таким образом положения вторых передних краев, полученные путем подгонки с помощью функции Гаусса, приведены в таблице 2. Здесь мы также сообщаем положения центроида (т. е. средневзвешенное значение всех пиков перед краем), полученные с использованием подгонки нескольких пиков. процедура, предложенная Farges 27 и Wilke et al. 29 (подробности см. в дополнительном примечании 1 и дополнительных таблицах 2 и 3).
Затем полученные положения центроида перед краем сравнивали с результатами, полученными Farges 27 для набора Cr-материалов, содержащих Cr в различных степенях окисления в диапазоне от «+2» до «+6». Результаты представлены на рис. 5, который напоминает рис. 4 Farges 27 . Положения центроидов, полученные нами для эталонов Cr 2+ и Cr 3+ (таблица 2), попали в заданные диапазоны Farges 27 , что свидетельствует о согласии с этими данными.Положение центроида в случае легированного хромом UO 2 попадает в диапазон, соответствующий Cr 2+ . Таким образом, тщательный анализ спектра XANES перед краем UO 2 , легированного Cr, довольно четко показывает степень окисления «2+» хрома в легированном Cr UO 2 .
Результаты представлены на рис. 5, который напоминает рис. 4 Farges 27 . Положения центроидов, полученные нами для эталонов Cr 2+ и Cr 3+ (таблица 2), попали в заданные диапазоны Farges 27 , что свидетельствует о согласии с этими данными.Положение центроида в случае легированного хромом UO 2 попадает в диапазон, соответствующий Cr 2+ . Таким образом, тщательный анализ спектра XANES перед краем UO 2 , легированного Cr, довольно четко показывает степень окисления «2+» хрома в легированном Cr UO 2 .
Данные, представленные черными треугольниками, взяты из ссылки. 27 .Голубой ромб — это результат для легированного хромом UO 2 , а зеленый кружок и красный квадрат — результат для эталонов Cr 3+ и Cr 2+ .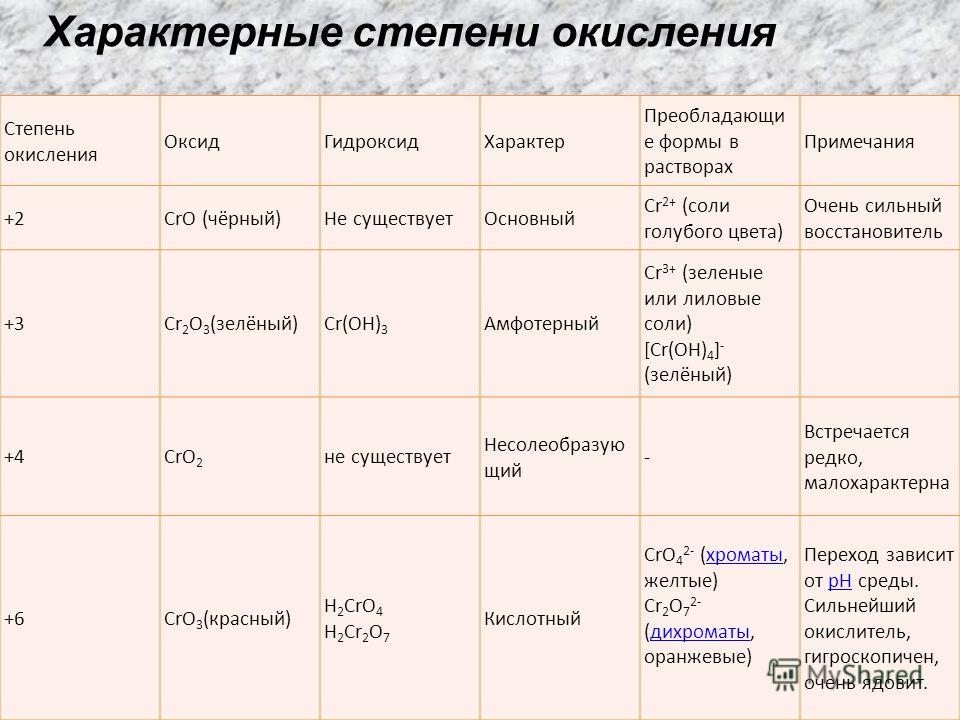
Как обсуждавшееся выше атомистическое моделирование, так и экспериментальные данные XANES, таким образом, ясно указывают на включение хрома в матрицу UO 2 в виде частиц Cr 2+ . Это должно быть связано с образованием частиц U 5+ или вакансий O. Это может повлиять на общие характеристики такого материала, в том числе на скорость его растворения, которая сильно зависит от степени окисления U 30,31 .Чтобы предсказать наиболее вероятное структурное расположение Cr в матрице UO 2 , мы рассчитали набор простых, различных схем включения Cr, включающих одиночные, а также парные легирующие примеси с уравновешиванием заряда за счет образования кислородных вакансий (Ov) или U 5+ видов. Восемь рассчитанных конфигураций визуализированы на рис. 2, и некоторые из них (например, 1Cr+1Ov (а) и 2Cr+2Ov (а)) были получены с помощью моделирования классической молекулярной динамики. Затем все построенные суперячейки были тщательно проанализированы в отношении энтальпии и свободной энергии соответствующей реакции катионного обмена, а также изменения параметра решетки матрицы. Полученные результаты были проанализированы с имеющимися экспериментальными данными по максимальной растворимости (в качестве параметров требуется энтальпия реакции и свободная энергия) 1,4,9,32,33 и изменению параметра решетки легированного хромом UO 2 1,9 .
Полученные результаты были проанализированы с имеющимися экспериментальными данными по максимальной растворимости (в качестве параметров требуется энтальпия реакции и свободная энергия) 1,4,9,32,33 и изменению параметра решетки легированного хромом UO 2 1,9 .
Предел растворимости Cr в UO
2 Riglet-Martial et al. 4 получил простую термодинамическую модель максимальной растворимости Cr в UO 2 , которая при подгонке к измеренной максимальной растворимости Cr в зависимости от температуры в UO 2 4,9,32,33 привела к оценке раствора Cr энтальпия и энтропия (таблица 5 Riglet-Martial et al. 4 ). Результат зависит от эталонной фазы оксида хрома, и для Cr 2 O 3 они получили энтальпию реакции 92,4 кДж моль -1 , предполагая включение Cr 3+ в UO 2 . В таблице 3 мы приводим энтальпию раствора с одним атомом Cr, рассчитанную ab initio, предполагая следующие реакции катионного обмена (имея расчетный размер суперячейки как 32 UO 2 единиц), реализуя восемь рассмотренных структурных схем Cr в UO 2 (Инжир. 2):
2):
$$\frac{{\rm{1}}}{{\rm{2}}}{\rm{C}}{{\rm{r}}}_{{\rm{2} }}}{{\rm{O}}}_{{\rm{3}}}+{({\rm{U}}{{\rm{O}}}_{{\rm{2}} })} _ {{\ rm {32}}} \ to {(({\ rm {Cr}}: {\ rm {U}}) {{\ rm {O}}} _ {{\ rm {2 }}})}_{{\rm{32}}}+{\rm{U}}{{\rm{O}}}_{{\rm{2}}}+q{{\rm{O }}}_{{\rm{2}}}$$
(1)
Таблица 3 Расчетная энтальпия растворения Δ H и свободная энергия Δ G Cr в UO 2 .Кроме того, в таблице 3 мы приводим оценку свободной энергии раствора Cr (Δ G ), которую мы получили путем добавления/вычитания высокотемпературной энтропии газообразного молекулярного кислорода ( S (O 2 ) = 270 Дж моль −1 K −1 , Chase 34 ) и вклад парциального давления кислорода в свободную энергию.В зависимости от участия молекулярного кислорода в качестве продукта или реагента свободная энергия оценивается по формуле:
$${\rm{\Delta}}G={\rm{\Delta}}HT{\rm{\Delta}} S + q (RT {\ mathrm {ln}} \, 10) {\ mathrm {log} \,} _ {10} {P} _ {{{\ rm {O}}} _ {{\ rm {2 }}}},$$
(2)
где Δ S ≃ q S (O 2 ) и Δ H — энтальпия реакции одиночного катионообмена (уравнение (1)). Парциальное давление кислорода, зависящее от температуры, оценивали с использованием модели Toker et al. 35 , а значения, использованные в расчетах, приведены в заголовке Таблицы 3.
Парциальное давление кислорода, зависящее от температуры, оценивали с использованием модели Toker et al. 35 , а значения, использованные в расчетах, приведены в заголовке Таблицы 3.
Полученные энтальпии реакции предполагают, что механизм включения 2Cr+1Ov является наиболее предпочтительным, что соответствует предсказанию Guo et al. 11 . Однако свободная энергия реакции — более важный параметр — указывает на сценарии 1Cr+1Ov и 2Cr+2Ov, причем наиболее предпочтительным является 1Cr+1Ov. Таким образом, мы предполагаем, что Cr включает как ассоциированную пару Cr и Ov, и сосредоточимся на проверке характеристик двух структур (1Cr+1Ov (а) и 1Cr+1Ov (б), рис.-}> {(({\rm{Cr}}:{\rm{U}}){{\rm{O}}}_{{\rm{2}}})}_{{\rm{32 }}}+{\rm{U}}{{\rm{O}}}_{{\rm{2}}}+\frac{1}{4}{{\rm{O}}}_{ {\rm{2}}}.$$
(3)
Активность a Cr в UO 2 связана с парциальным давлением газообразного кислорода и энтальпией и энтропией реакции катионного обмена как (Riglet-Martial et al. 4 , уравнение (6)) :
4 , уравнение (6)) :
$${\mathrm{log}\,}_{10}(a({\rm{Cr}}:{\rm{U}}{{\rm{O}}}_{{\rm {2}}}}} = q \, {\ mathrm {log} \,} _ {10} {P} _ {{{\ rm {O}}} _ {{\ rm {2}}}} + \ frac {1} {Rln10} ({\ rm {\ Delta}} S — {\ rm {\ Delta}} H / T).$$
(4)
Структура 1Cr+1Ov представляет собой пару атомов Cr и связанных с ними Ov. В этом случае для кубической структуры флюорита активность Cr в UO 2 равна a(Cr:UO 2 ) = ( y ∕8), где y – концентрация Cr в UO 2 . Это связано с тем, что ассоциированный Ov имеет восемь возможностей расположиться вокруг атома Cr (случай куба с атомом Cr в центре и восемью атомами кислорода по углам). Это дает следующее уравнение для максимальной растворимости Cr в случае структурных схем 1Cr+1Ov:
$${\mathrm{log}\,}_{10}(y)=-\frac{1}{4}{\mathrm{log}\,}_{10} {P}_{{{\rm{O}}}_{{\rm{2}}}}+\frac{1}{R \, ln10}({\rm{\Delta}}S-{\ rm{\Delta}}H/T)+{\mathrm{log}\,}_{10}8. $$
$$
(5)
Структура 2Cr+2Ov представляет собой пару ассоциированных атомов Cr с удаленными двумя атомами кислорода, которые соединяют атомы Cr. В этом случае для кубической структуры флюорита активность Cr в UO 2 равна a(Cr:UO 2 ) = ( y ∕12) 1/2 . Это связано с тем, что для пары ассоциированных атомов Cr второй атом Cr имеет 12 возможностей расположения вокруг первого атома Cr (два атома Cr соединены ребром куба, и существует 12 таких расположений (ребер)), а активность одного атома — это просто квадратный корень из активности пары.Это дает следующее уравнение для максимальной растворимости Cr в случае структурной схемы 2Cr+2Ov:
$${\mathrm{log}\,}_{10}(y)=-\frac{1}{2 }{\mathrm{log}\,}_{10}{P}_{{{\rm{O}}}_{{\rm{2}}}}+\frac{2}{Rln10}({ \rm{\Delta}}S-{\rm{\Delta}}H/T)+{\mathrm{log}\,}_{10}12,$$
(6)
Полученная растворимость Cr, y , оцененная для условий различных измерений, описанных в литературе, путем применения двух обсуждаемых моделей структурного устройства и рассчитанных энтальпий реакции катионного обмена (таблица 3) вместе с экспериментальными парциальными давлениями кислорода, приведены в таблице 4. Заметим, что такая оценка в случае предпочтительной модели 1Cr+1Ov с рассчитанным здесь Δ H лишь немного завышает измеренные значения растворимости и что полное совпадение может быть получено при увеличении энтальпии реакции всего на ~21 кДж. моль -1 . Это отличное совпадение, если принять во внимание расчетную погрешность 50 кДж моль −1 22 . С другой стороны, в случае модели 2Cr+2Ov вычисленное значение Δ H на ~90 кДж моль −1 больше значения, соответствующего данным о максимальной растворимости.Хорошее описание данных о растворимости Cr с помощью модели 1Cr+1Ov является еще одним аргументом в поддержку сценария Cr 2+ , обнаруженного в наших исследованиях атомистического моделирования и переоценки данных XANES, указывающих на структурные схемы 1Cr+1Ov. как реальный случай. На следующем этапе мы проверим, насколько эта структура соответствует измеренным параметрам решетки легированного хромом UO 2 .
Заметим, что такая оценка в случае предпочтительной модели 1Cr+1Ov с рассчитанным здесь Δ H лишь немного завышает измеренные значения растворимости и что полное совпадение может быть получено при увеличении энтальпии реакции всего на ~21 кДж. моль -1 . Это отличное совпадение, если принять во внимание расчетную погрешность 50 кДж моль −1 22 . С другой стороны, в случае модели 2Cr+2Ov вычисленное значение Δ H на ~90 кДж моль −1 больше значения, соответствующего данным о максимальной растворимости.Хорошее описание данных о растворимости Cr с помощью модели 1Cr+1Ov является еще одним аргументом в поддержку сценария Cr 2+ , обнаруженного в наших исследованиях атомистического моделирования и переоценки данных XANES, указывающих на структурные схемы 1Cr+1Ov. как реальный случай. На следующем этапе мы проверим, насколько эта структура соответствует измеренным параметрам решетки легированного хромом UO 2 .
Параметр решетки легированного Cr UO
2 Экспериментально установлено, что матрица UO 2 , легированная Cr, испытывает сжатие. Два доступных экспериментальных исследования Leenaers et al. 9 и Cardinaels et al. 1 показывают линейное уменьшение параметра решетки с содержанием Cr, с количеством внедренного хрома до 1000 мкг г −1 . Измеренное относительное уменьшение параметра решетки, представленное в таблице 5, различается в 2 раза между двумя экспериментальными исследованиями, но в обоих случаях меньше ожидаемого с учетом размеров вовлеченных частиц 9 .В таблице 5 мы также сообщаем смоделированное изменение параметра решетки, полученное для всех рассмотренных структур (рис. 2). Интересно, что структуры 1Cr+1Ov (а) и 2Cr+2Ov (а) дают очень небольшой сдвиг, и результат, полученный для структуры 1Cr+1Ov (а), совпадает с измеренными данными. Другие структуры, включая конфигурацию 2Cr+1Ov, приводят к значительному, по крайней мере, на порядок большему изменению. Отметим, однако, что большинство конфигураций, кроме случаев 2Cr+1Uv и 2Cr+2Ov (а), предсказывают уменьшение параметра решетки.Таким образом, небольшое и хорошо согласующееся с измерениями сжатие решетки со структурой 1Cr+1Ov (a) является еще одним аргументом в пользу того, что это правильная модель включения Cr.
Другие структуры, включая конфигурацию 2Cr+1Ov, приводят к значительному, по крайней мере, на порядок большему изменению. Отметим, однако, что большинство конфигураций, кроме случаев 2Cr+1Uv и 2Cr+2Ov (а), предсказывают уменьшение параметра решетки.Таким образом, небольшое и хорошо согласующееся с измерениями сжатие решетки со структурой 1Cr+1Ov (a) является еще одним аргументом в пользу того, что это правильная модель включения Cr.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Степень окисления хрома в базальтосиликатных расплавах
Cr 3+ /Cr 2+ в расплавах в системах CaO-MgO-Al 2 O 3 -SiO 2 9040 O ± K 2 O, легированный Cr, добавленным как 0.5 мас.% Cr 2 O 3 определяли как функцию летучести кислорода ( f O 2 ) при 1400°C методом XANES-спектроскопии их закаленных стекол, используя интенсивность плеча на Cr K -край из-за перехода 1s→4s. Добавление Na и K в систему CMAS увеличивает Cr 3+ /Cr 2+ при постоянной температуре и f O 2 , что хорошо согласуется с предсказаниями «идеальной оптической основности». Новые результаты были объединены с предыдущими результатами для калибровки модели Cr 3+ /Cr 2+ в силикатных расплавах в зависимости от температуры, давления и состава расплава:
log 10 (Cr 3+ /Cr 2+ ) = 1/4 ΔQFM+3031/T — 2. 26 + (843P – 158 P 2 )/T + ∑c Z X Z.
26 + (843P – 158 P 2 )/T + ∑c Z X Z.
где X Z – мольные доли оксидных компонентов Z, определенные на основе монокатионов, а ∑c Z X Z =2,00 X NaO0,5 +1,00 (X MgO +X Fe2+O )+0,37 (X AlO1,5 +X Fe3+47) 2,12 X KO0,5 +2,44 X CaO +3,69 X TiO2 , T – температура в K, P – давление в ГПа, ΔQFM – разница между f O 2 силикатного расплава и кварц-фаялит-магнетитовый буфер при 10 5 Па, полученный по формуле 10 f O 2 (QFM)=8.58–25050/T относительно обычного стандартного состояния чистого O 2 при 10 5 Па. Влияние давления заметно нелинейно, поэтому модель не следует экстраполировать выше 4 ГПа. Объединение этой модели с аналогичной моделью для Fe 3+ /Fe 2+ в силикатных расплавах дает: 3+ /Fe 2+ )+3031/T − 0,9 + (1317P – 219 P 2 )/T + ∑j Z X Z.
где ∑j Z X Z =1,00 (X MgO +X Fe2+O )+0,37 (X AlO1,5 +X Fe3) KO0,5 +0,04 X CaO +3,69 X TiO2 .
Высокому Cr 2+ /∑Cr в силикатных расплавах способствуют высокая температура и низкое давление, а также низкому Fe 3+ /∑Fe. Для исходного состава расплава MORB при 1250 °С (1523 К) 10 5 Па, с Fe 3+ /∑Fe=0.10 модель предсказывает Cr 2+ /ΣCr=0,27. Влияние давления очень велико: Cr 2+ /ΣCr в приведенном выше примере упадет до 0,03 при 2 ГПа и 1250°C. Содержание Cr 2+ в расплавах, содержащих Fe 3+ , при магматических температурах уменьшается при охлаждении за счет реакции электронного обмена: Cr 2+ + Fe 3+ = Cr 3+ + Fe 2 + .
| |
Водные растворы и осадки хром В водных растворах хром может находиться в +2, +3,
+5 и +6 степени окисления. На этой странице представлены все 5 степеней окисления. Решения показаны различные виды и, где это уместно, преципитаты показано.
Степень окисления +2 Эта степень окисления хрома настолько сильно восстановительна,
что действительно трудно получить решение этого и сохранить это для
разумный срок.Еще труднее выделить осадок гидроксида хрома (II). Ниже показаны четыре изображения. На верхнем левом изображении показано цвет водных растворов ионов хрома (II), получаемых путем растворения некоторого количества металлического хрома в довольно концентрированной соляной кислоте, убедившись, что свежий воздух не может достигают реакционной смеси. Верхний правый рисунок показывает, что произойдет, если некоторые из
голубую жидкость, содержащую ионы хрома (II), добавляют к избыточному количеству
раствор гидроксида натрия. Хорошо видны пузырьки водорода,
образуется в осадке. Там, где образуются пузырьки водорода,
осадок становится серовато-зеленым, в других местах он выглядит более ярко-зеленым,
но не уверен, что это настоящий цвет гидроксида хрома (II).
Зеленый цвет также может быть связан с тем, что осадок наблюдается
через какую-то зелено-голубую жидкость. Нижнее левое изображение показывает осадок, сразу после небольшого встряхивания. Хорошо видно, что цвет уже стал гораздо более серовато-зеленый. Четвертое изображение показывает осадок после более длительного время встряхивания. Весь хром (II) был окислен до хрома (III) и осадок просто выглядит как осадок гидроксида хрома (III), как показано далее ниже в разделе для степени окисления +3.
Степень окисления +3 Как уже говорилось, это наиболее стабильное окисление.
государство.В кислых и нейтральных растворах соединения Cr 3+ (водн.)
присутствует в растворе. Цвет этого иона очень трудно описать.
сильно зависит от света, используемого для просмотра раствора. В норме
при дневном свете цвет несколько голубоватый/зеленый/серый. Когда гидроксид
при добавлении выпадает серо-зеленый осадок с голубоватым оттенком. Когда
добавляют избыточное количество гидроксида, после чего образуется темно-зеленый раствор. Цвет ионов хрома в степени окисления +3 довольно крепкие, поэтому даже умеренно концентрированный раствор уже выглядит темно.Ниже приведены две серии фотографий. Верхний ряд показывает несколько более концентрированный раствор (небольшой шпатель с твердым веществом, растворенным примерно в 4 мл воды). Нижняя серия показывает очень разбавленный раствор, всего лишь щепотку твердой соли хрома. Обе серии показывают нейтральный раствор калия хрома. квасцы слева, что дает простой водный раствор Cr 3+ (водн.) в растворе. На средних рисунках показан осадок хрома (III) гидроксид.На правых рисунках видно, что осадок снова растворяется, образуя зеленый хромат (III), который можно приблизительно записать как CrO(OH) 4 3- (водн.). Другие составы для зеленого иона иногда представляют собой CrO 2 (водн.) и CrO 3 3- (водн.).
Хром в степени окисления +3 может существовать в многих
комплексы, которые могут иметь множество различных цветов.
Степень окисления +4 Из водного раствора можно легко приготовить хромовую
(IV) соединение.Если к раствору
хромовые квасцы, затем ион дихромата медленно окисляет водный раствор хрома (III)
ионы. Полученное соединение представляет собой диоксид CrO 2 , который осаждается в виде
бурый осадок на дне пробирки. Реакция довольно медленная и
занимает несколько дней. Ниже образец оксида хрома (IV), приготовленный в этой
образом, и несколько раз промыл водой, чтобы удалить большую часть
дихромат, показан здесь.Желтая окраска над осадком обусловлена
остатки дихромата. На картинке хорошо виден коричневый осадок. Один также
легко увидеть, что изначально уровень жидкости был ниже.
Степень окисления +5 Это очень нестабильная степень окисления хрома. В твердом состоянии, эта степень окисления может быть получена для соединения калий тетрапероксохромат (V).В водный растворе ион тетрапероксохромата (V) стабилен только в щелочной среде. среды. В нейтральной среде медленно разлагается, в кислой средах быстро разлагается. Водный раствор тетрапероксохромата калия (V), содержащий ионы Cr(O 2 ) 4 3-, желто-коричневый. В несколько выше концентрация коричневого цвета. На фото нейтральный раствор этого соединения, которое содержит еще некоторое количество твердого тетрапероксохромата калия (V).Также отчетливо видно медленное частичное разложение твердого, мелкого образуются пузырьки кислорода. Если такой коричневый раствор подкислить умеренно
концентрированная сильная кислота, то она быстро разлагается. Последовательность ниже показывает результат после добавления большого избыток соляной кислоты.
Когда
к коричневому раствору добавляют очень небольшое количество кислоты. |
Степень окисления +6 После степени окисления +3 это наиболее стабильный степень окисления хрома. В кислых средах хром при этом окислении состояние образует ярко-оранжевый дихромат-ион Cr 2 O 7 2- а в щелочной среде ярко-желтый хромат-ион CrO 4 2- сформирован.Дихромат-ион является довольно сильным окислителем, хромат-ион ион гораздо меньше. Две картинки ниже показывают раствор дихромата и раствор хромата приблизительно одинаковая концентрация хрома по массе в объеме.
Хорошо известный и очень чувствительный тест на дихромата или перекиси водорода – образование темно-синего цвета. пероксид CrO 5 , лучше записывать как CrO(O 2 ) 2 . Ниже показано изображение очень разбавленного раствор, содержащий синюю перекись хрома (VI). Это было подготовлено взяв несколько капель оранжевого раствора, показанного выше, и добавив очень разбавленный раствор H 2 O 2 и HCl к этому (менее не более 0,5% каждого).
Как видно на картинке, цвет очень глубокий и насыщенный. очень интенсивный для такой низкой концентрации. Синий цвет быстро тускнеет.Чем больше
концентрированный и чем выше температура, тем быстрее он исчезает. А
Здесь дана последовательность картинок, на которых видно выцветание цвета.
Окончательный цвет светло-зеленый. Слабость окончательный зеленый цвет также показывает, насколько интенсивен синий цвет. То зеленая окраска хрома (III) уже достаточно интенсивна, как показано выше в разделе о хроме (III).
Хром в степени окисления +6 также может существовать в виде очень летучая жидкость с оранжево-коричневым паром. Эта жидкость называется хромилхлоридом и имеет формулу CrO 2 Cl 2 . На картинке ниже показаны пары хлористого хрома. Картина также показывает часть жидкости темно-красного цвета с пурпурным оттенком.
Это оранжево-коричневое соединение чрезвычайно токсично и
коррозионный.С большинством органических соединений реагирует бурно, а с некоторыми
органические соединения воспламеняются при контакте с хлористым хромом. Тем не мение,
действительно замечательно иметь соединение металла, являющееся окрашенным газом. |
Практическая задача 14
Практическая задача 14Практическая задача 14
Определить степень окисления хрома в неизвестном соли при электролизе расплавленного образца этой соли в течение 1.50 часов при силе тока 10,0 ампер откладывает 9,71 грамма хрома металла на катоде.
Раствор
Начнем, как и раньше, с вычисления количества молей электронов, прошедших через ячейку в процессе электролиза.
Поскольку мы не знаем сбалансированного уравнения реакции при катод в этой ячейке, не кажется очевидным, как мы собирается использовать эту информацию.Поэтому мы записываем это привести к заметному месту и вернуться к исходному постановка вопроса, чтобы посмотреть, что еще можно сделать.
Задача говорит нам о массе хрома, осажденного на
катод. К настоящему времени должно быть очевидно, что нам нужно преобразовать
эту информацию в число молей металлического хрома
сгенерировано.
Теперь мы знаем количество молей произведенного металлического хрома и число молей электронов, необходимое для получения этого металла.Поэтому мы могли бы рассмотреть взаимосвязь между родинками электронов, потребляемых в этой реакции, и молей хрома произведен.
На каждый моль вещества расходуется три моля электронов. производится металлический хром. Единственный способ объяснить это — предположим, что результирующая реакция на катоде включает восстановление Cr 3+ до металлического хрома.
| Катод (-): | Cr 3+ + 3 e — Cr |
Таким образом, степень окисления хрома в неизвестной соли должно быть +3.
Экспериментальные исследования степеней окисления оксидов хрома в шлаковых системах
Приложение А
В отношении реакций с чистым Cr 2 O 3 считается, что происходят три реакции, которые приведут к образованию паров Cr, CrO и CrO 2 , как показано в уравнениях.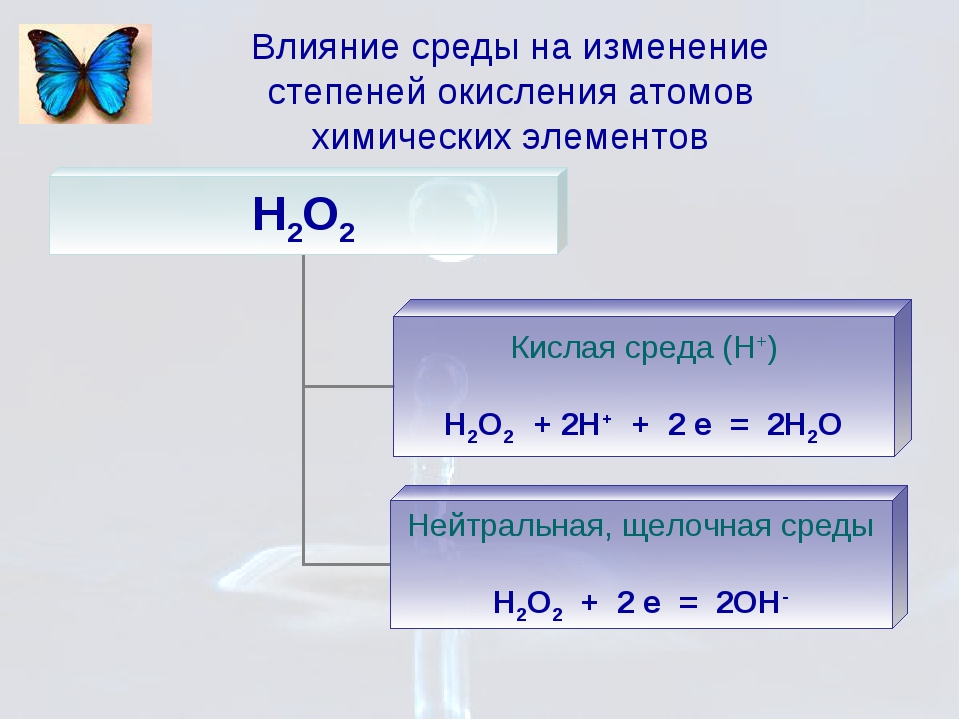 [3] и [4]. Основываясь на нескольких измерениях чистого Cr 2 O 3 , отношение соответствующих парциальных давлений CrO 2 , CrO и Cr составляет примерно 3:6:100 [12,13] в широком диапазоне температур. .Для настоящих шлаков парциальное давление CrO приписывается двум разновидностям в конденсированной фазе, , а именно. CrO 1,5 и CrO, тогда как парциальное давление CrO 2 создается исключительно CrO 1,5 в соответствии с реакцией [3] и следующим образом:
[3] и [4]. Основываясь на нескольких измерениях чистого Cr 2 O 3 , отношение соответствующих парциальных давлений CrO 2 , CrO и Cr составляет примерно 3:6:100 [12,13] в широком диапазоне температур. .Для настоящих шлаков парциальное давление CrO приписывается двум разновидностям в конденсированной фазе, , а именно. CrO 1,5 и CrO, тогда как парциальное давление CrO 2 создается исключительно CrO 1,5 в соответствии с реакцией [3] и следующим образом:
$$ \left( {\text{CrO}} \ right) _{\text{шлак}} \Rightarrow {\text{Cr}}_{\left(g \right)} ,{\text{CrO}}_{\left(g \right)} $$
(А1)
$$ \left( {{\text{CrO}}_{ 1.5} } \right) _ {\ text {шлак}} \ Rightarrow {\ text {Cr}} _ {\ left ( g \ right)} , {\ text {CrO}} _ {\ left ( g \ right) } ,{\text{CrO}}_{ 2\влево(г\вправо)} $$
(A2)
В настоящем анализе предполагается, что способность к испарению CrO в шлаке такая же, как у CrO 1,5 при образовании газообразных частиц CrO и Cr, что можно считать приемлемым при высоких температурах, используемых в измерения.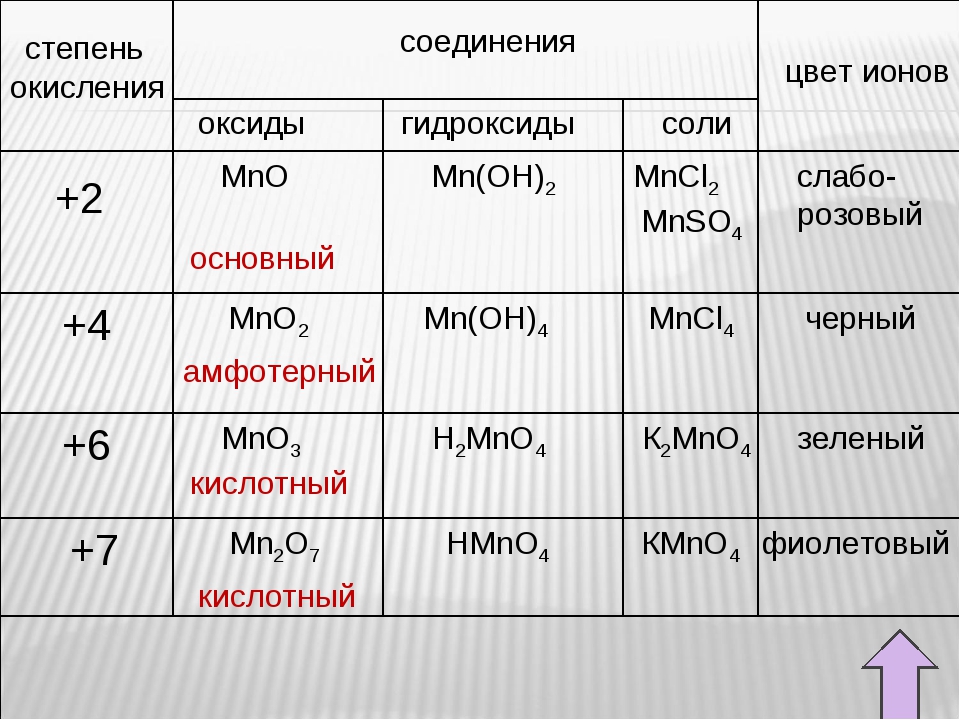 Вклады CrO и CrO 1.5 к парциальному давлению CrO(g) отражает X
CrO / X
Соотношение CrO1.5 в конденсированной фазе. Кроме того, для Cr 2 O 3 в нашем образце отношение парциальных давлений трех видов хрома должно подчиняться поведению чистого Cr 2 O 3 . По соотношению парциальных давлений CrO 2 и CrO в чистом Cr 2 O 3 можно получить долю парциального давления CrO, вносимую Cr 2 O 3 в конденсированной фазе. из следующей реакции как 2pCrO 2 :
Вклады CrO и CrO 1.5 к парциальному давлению CrO(g) отражает X
CrO / X
Соотношение CrO1.5 в конденсированной фазе. Кроме того, для Cr 2 O 3 в нашем образце отношение парциальных давлений трех видов хрома должно подчиняться поведению чистого Cr 2 O 3 . По соотношению парциальных давлений CrO 2 и CrO в чистом Cr 2 O 3 можно получить долю парциального давления CrO, вносимую Cr 2 O 3 в конденсированной фазе. из следующей реакции как 2pCrO 2 :
$$ {\ frac {{X \left ( {\ text {CrO}} \right) _ {\ text {шлак}}}} {{X \ left( { {\text{CrO}}_{ 1.5} } \right)_{\text{шлак}} }}} = {\frac{{p_{\text{CrO}} \left( {\text{из CrO}} \right)}}{{p_ {\text{CrO}} \left( {\text{из CrO}}{}_{1,5}} \right)}}} = {\frac{{p_{\text{CrO}} — 2p_{\ text{CrO2}} }}{{2p_{\text{CrO2}} }}} $$
(A3)
.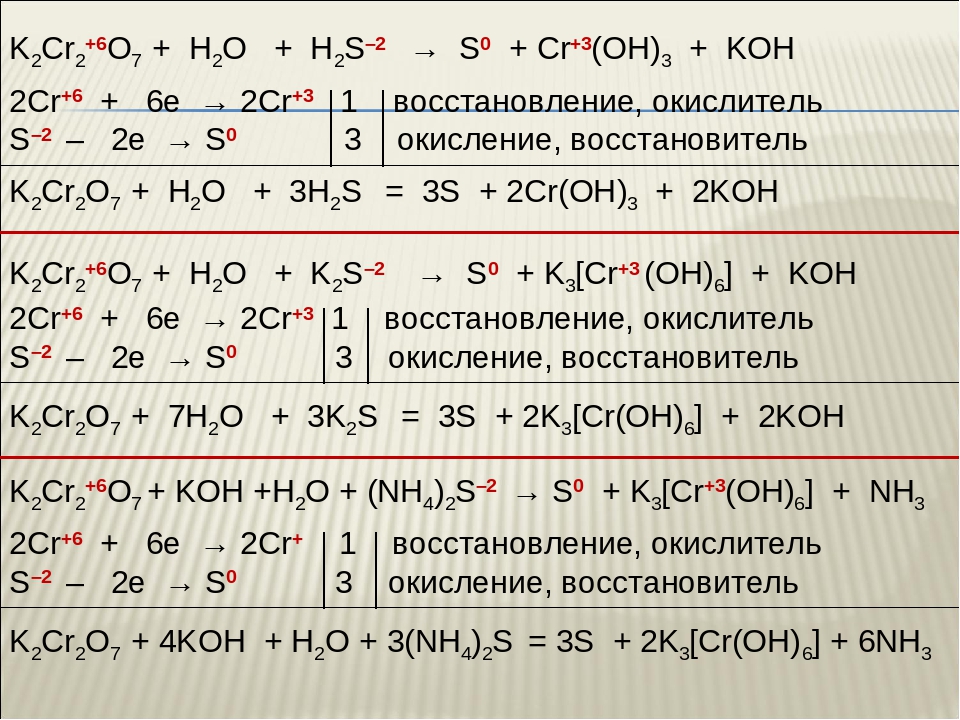


 В твердом состоянии хром также может находиться в
степень окисления +4. Степень окисления +2 очень сильно восстанавливает и
который может существовать лишь короткое время, он очень быстро окисляется до +3
степень окисления. Степень окисления +3 наиболее стабильна как в кислой, так и в
щелочной
решения. Степень окисления +5 является редкой степенью окисления хрома. Это
только стабильны, с пероксолигандами и в щелочных средах. Наконец, степень окисления
+6 также достаточно стабилен, пока не присутствуют восстановители.Большинство
примечательно то, что эта степень окисления существует и в газообразном состоянии.
В твердом состоянии хром также может находиться в
степень окисления +4. Степень окисления +2 очень сильно восстанавливает и
который может существовать лишь короткое время, он очень быстро окисляется до +3
степень окисления. Степень окисления +3 наиболее стабильна как в кислой, так и в
щелочной
решения. Степень окисления +5 является редкой степенью окисления хрома. Это
только стабильны, с пероксолигандами и в щелочных средах. Наконец, степень окисления
+6 также достаточно стабилен, пока не присутствуют восстановители.Большинство
примечательно то, что эта степень окисления существует и в газообразном состоянии.  поддерживать. Как только к раствору соли хрома (II) добавляют гидроксид,
затем образуется газообразный водород и серо-зеленый осадок хрома (III)
образуется гидроксид.
поддерживать. Как только к раствору соли хрома (II) добавляют гидроксид,
затем образуется газообразный водород и серо-зеленый осадок хрома (III)
образуется гидроксид. 

 Хром (III), вместе
с кобальтом (III) являются металлами, которые имеют наиболее обширную водную
координационная химия всех металлов. Невозможно показать все разные
цвета, в которых хром (III) может находиться в своих координационных комплексах. Немного
цвета фиолетовый, зеленый, коричневый и даже серый.
Хром (III), вместе
с кобальтом (III) являются металлами, которые имеют наиболее обширную водную
координационная химия всех металлов. Невозможно показать все разные
цвета, в которых хром (III) может находиться в своих координационных комплексах. Немного
цвета фиолетовый, зеленый, коричневый и даже серый.  Несколько из
коричневый осадок также оседал на стенке стекла, а не только на дне.
Несколько из
коричневый осадок также оседал на стенке стекла, а не только на дне.  Разложение вполне
быстро, это занимает всего несколько секунд. Ниже приведена последовательность изображений, на которых
быстрое разложение иона тетрапероксохромата (V). Незамедлительно после
добавляют кислоту, жидкость становится темно-синей, но через несколько секунд ее
цвет меняется на бледно-зеленый или бледно-фиолетовый, причем окончательный цвет определяется некоторыми
формы хрома (III).Окончательный цвет зависит от добавленной кислоты и
обусловлено образованием различных комплексов хрома (III) при разложении
тетрапероксохромат (V). Сразу после добавления кислоты темно-синий
Образуется CrO 5 , который, в свою очередь, быстро разлагается, давая кислород и хром.
(III) виды. Мутность на фотографиях ниже вызвана образованием многих
маленькие пузырьки кислорода в жидкости.
Разложение вполне
быстро, это занимает всего несколько секунд. Ниже приведена последовательность изображений, на которых
быстрое разложение иона тетрапероксохромата (V). Незамедлительно после
добавляют кислоту, жидкость становится темно-синей, но через несколько секунд ее
цвет меняется на бледно-зеленый или бледно-фиолетовый, причем окончательный цвет определяется некоторыми
формы хрома (III).Окончательный цвет зависит от добавленной кислоты и
обусловлено образованием различных комплексов хрома (III) при разложении
тетрапероксохромат (V). Сразу после добавления кислоты темно-синий
Образуется CrO 5 , который, в свою очередь, быстро разлагается, давая кислород и хром.
(III) виды. Мутность на фотографиях ниже вызвана образованием многих
маленькие пузырьки кислорода в жидкости.  тетрапероксохромата (V), то соединение также разлагается, но конечный результат
совсем другое. Синий переходный цвет существует еще короче, а окончательный
цвет гораздо ярче зеленого. Конечный продукт разложения в этом
ситуация содержит значительное количество шестивалентного хрома в виде
дихромат. Смесь дихромата и хрома (III) имеет более яркий зелено-желтый цвет.
цвет.На картинке показан результат аналогичного эксперимента, как это было сделано выше, но
теперь к разбавленному раствору калия добавляется только одна капля 2% HCl.
тетрапероксохромат (V).
тетрапероксохромата (V), то соединение также разлагается, но конечный результат
совсем другое. Синий переходный цвет существует еще короче, а окончательный
цвет гораздо ярче зеленого. Конечный продукт разложения в этом
ситуация содержит значительное количество шестивалентного хрома в виде
дихромат. Смесь дихромата и хрома (III) имеет более яркий зелено-желтый цвет.
цвет.На картинке показан результат аналогичного эксперимента, как это было сделано выше, но
теперь к разбавленному раствору калия добавляется только одна капля 2% HCl.
тетрапероксохромат (V).  Снимки делались с интервалом от 30 до 60 секунд между
сделать две картинки.
Снимки делались с интервалом от 30 до 60 секунд между
сделать две картинки. 