Фосфор. Фосфин | АЛХИМИК
ФосфорСледующий за азотом элемент пятой группы, фосфор, был открыт на несколько столетий раньше своего предшественника по подгруппе. По иронии судьбы фосфор открывали несколько раз, причём всякий раз получали его из мочи. Есть упоминания о том, что арабский алхимик Альхильд Бехиль открыл фосфор при перегонке мочи в смеси с глиной, известью и углём. Однако достоверное открытие и описание свойств этого вещества принадлежит немецкому алхимику-любителю Хеннигу Бранду. В 1669 г. Бранд был занят поиском магической жидкости, с помощью которой можно превращать неблагородные металлы в золото. В одном из экспериментов он пытался получить ее из большого количества мочи, предварительно собранной в солдатских казармах. При её нагревании Бранду удалось выделить тяжелое красное масло, которое перегонялось с образованием твёрдого остатка. Нагревая последний без доступа воздуха, он заметил образование белого дыма, оседавшего на стенках сосуда и ярко светившегося в темноте.
Несколько лет «рецепт приготовления» фосфора хранился в строжайшей тайне и был известен лишь нескольким алхимикам. В 1680 г. это вещество независимо от Бранда выделил Р.Бойль.
В несколько модифицированном виде старинный метод получения фосфора использовали и в XVIII столетии: нагреванию подвергались смесь мочи с оксидом свинца, поваренной солью, поташом и углем. Лишь в 1774 г. К. В. Шееле разработал способ получения фосфора из рога и костей животных.
В наши дни фосфор производят в электрических печах, восстанавливая апатит углём в присутствии кремнезёма:
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 5CO↑ + P2↑
Пары фосфора при этой температуре почти полностью состоят из молекул Р2, которые при охлаждении конденсируются в молекулы Р 4.
При конденсации паров образуется белый (желтый) фосфор, который состоит из молекул Р4, имеющих форму тетраэдра. Это очень реакционноспособное мягкое воскообразное вещество бледно-желтого цвета, растворимое в сероуглероде и бензоле. На воздухе фосфор воспламеняется при 34 оС. Он обладает уникальной способностью светиться в темноте за счет медленного окисления до низших оксидов. Именно белый фосфор и был в своё время выделен Брандом.
Это очень реакционноспособное мягкое воскообразное вещество бледно-желтого цвета, растворимое в сероуглероде и бензоле. На воздухе фосфор воспламеняется при 34 оС. Он обладает уникальной способностью светиться в темноте за счет медленного окисления до низших оксидов. Именно белый фосфор и был в своё время выделен Брандом.
Если белый фосфор нагревать без доступа воздуха, он переходит в красный (впервые его получили лишь в 1847 г.). Название красный фосфор относится сразу к нескольким модификациям, различающихся по плотности и окраске: она колеблется от оранжевой до тёмно-красной и даже фиолетовой. Все разновидности красного фосфора нерастворимы в органических растворителях, по сравнению с белым фосфором они менее реакционноспособны (воспламеняются на воздухе при t>200 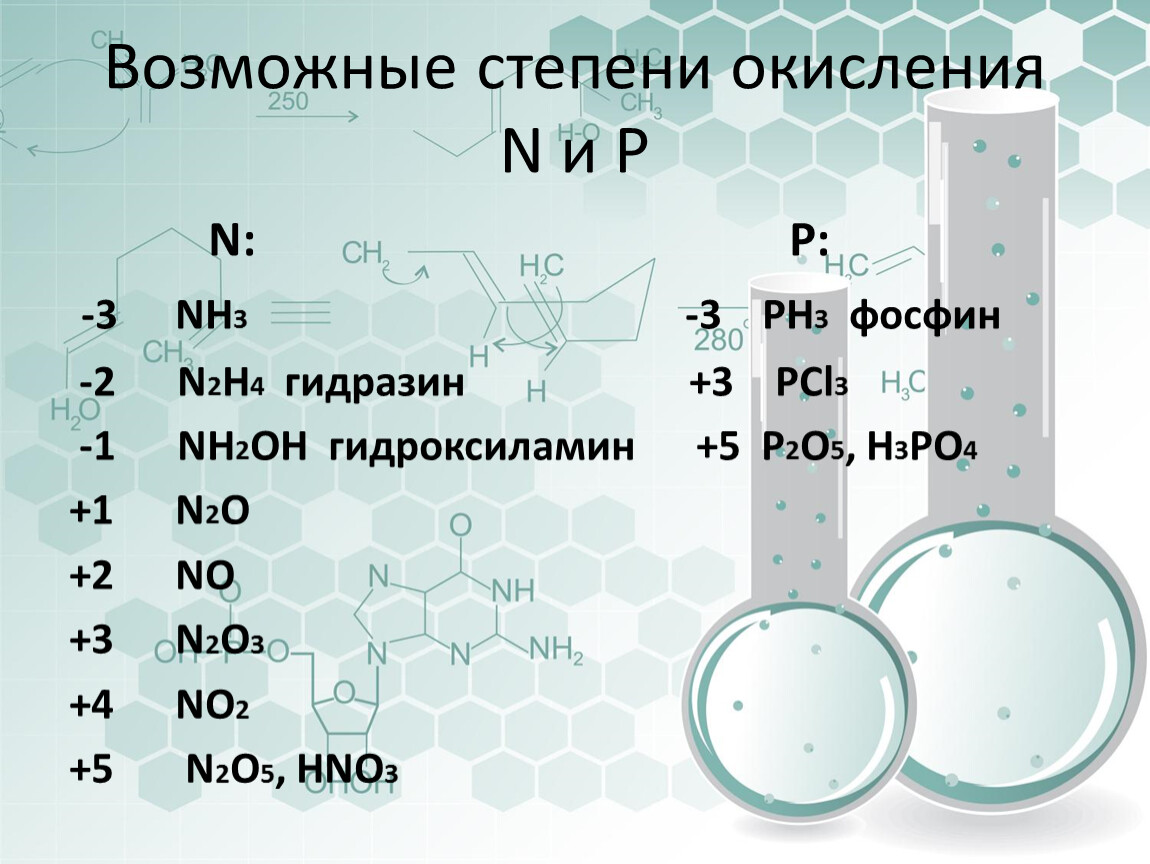
При повышенном давлении белый фосфор переходит в чёрный фосфор, построенный из объёмных шестиугольников с атомами фосфора в вершинах, связанных друг с другом в слои. Впервые это превращение осуществил в 1934 г. американский физик Перси Уильямс Бриджмен. Структура чёрного фосфора напоминает графит, с той лишь разницей, что слои, образованные атомами фосфора, не плоские, а «гофрированные». Черный фосфор – это наименее активная модификация фосфора. При нагревании без доступа воздуха он, как и красный, переходит в пар, из которого конденсируется белый фосфор.
Белый фосфор очень ядовит: смертельная доза около 0,1 г. Из-за опасности самовоспламенения на воздухе его хранят под слоем воды. Красный и чёрный фосфор менее ядовиты, так как нелетучи и практически нерастворимы в воде.
Аллотропные модификации фосфора Химические свойстваНаиболее химически активным является белый фосфор (в уравнениях реакций с участием белого фосфора для простоты записывают как Р, а не Р4, тем более, что аналогичные реакции возможны и с участием красного фосфора, молекулярный состав которого неопределен). Фосфор непосредственно соединяется со многими простыми и сложными веществами. В химических реакциях фосфор, как и азот, может быть и окислителем, и восстановителем.
Фосфор непосредственно соединяется со многими простыми и сложными веществами. В химических реакциях фосфор, как и азот, может быть и окислителем, и восстановителем.
Как окислитель фосфор взаимодействует со многими металлами с образованием фосфидов, например:
2P + 3Ca = Ca
P + 3Na = Na3P
Обратите внимание, что непосредственно с водородом фосфор практически не соединяется.
Как восстановитель фосфор взаимодействует с кислородом, галогенами, серой (т.е. с более электроотрицательными неметаллами). При этом в зависимости от условий проведения реакций могут образовываться как соединения фосфора (III), так и соединения фосфора (V).
а) при медленном окислении или при недостатке кислорода фосфор окисляется до оксида фосфора (III), или фосфористого ангидрида Р2О3:
4Р + 3О2 = 2Р2О3
При сгорании фосфора в избытке кислорода (или воздуха) образуется оксид фосфора (V), или фосфорный ангидрид Р2О5:
4Р + 5О2 = 2Р2О5
б) в зависимости от соотношения реагентов при взаимодействии фосфора с галогенами и серой образуются соответственно галогениды и сульфиды трех- и пятивалентного фосфора; например:
2Р + 5Cl2(изб. ) = 2PCl5
) = 2PCl5
2P + 3Cl2(недост.) = 2PCl3
2P + 5S(изб.) = P2S5
2P + 3S(недост.) = P2S3
Следует отметить, что с йодом фосфор образует только соединение PI3.
Роль восстановителя фосфор играет в реакциях с кислотами-окислителями:
— с разбавленной азотной кислотой:
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑
— с концентрированной азотной кислотой:
P + 5HNO3 = H3PO4 + 5NO2↑ + H2O
— с концентрированной серной кислотой:
2P + 5H2SO4 = 2H3PO4 + 5SO2↑ + 2H2O
При нагревании с водными растворами щелочей фосфор подвергается диспропорционированию, например:
4P + 3KOH + 3H2O = PH3↑ + 3KH2PO2
8P + 3Ba(OH)2 + 6H2O = 2PH3↑ + 3Ba(H2PO2)2
Кроме фосфина РН3 в результате этих реакций образуются соли фосфорноватистой кислоты Н3РО2 – гипофосфиты, в которых фосфор имеет характерную степень окисления +1.
Основная часть производимого в мире фосфора расходуется на производство фосфорной кислоты, из которой получают удобрения и другие продукты. Красный фосфор используется при изготовлении спичек, он содержится в массе, которая наносится на спичечную коробку.
ФосфинНаиболее известным водородным соединением фосфора является фосфин РН 3. Фосфин – бесцветный газ с чесночным запахом, очень ядовит. Хорошо растворимый в органических растворителях. В отличие от аммиака малорастворим в воде. Практического значения фосфин не имеет.
Получение
Выше был рассмотрен способ получения фосфина при взаимодействии фосфора с водными растворами щелочей. Другой способ – действие соляной кислоты на фосфиды металлов, например:
Zn3P2 + 6HCl = 2PH3↑ + 3ZnCl2
Химические свойства
- Кислотно – основные свойства
Будучи малорастворим в воде, фосфин образует с ней неустойчивый гидрат, который проявляет очень слабые основные свойства:
PH3 + H2O ⇄ PH3∙H2O ⇄ PH4+ + OH—
Соли фосфония образуются только с сильными кислотами:
PH3 + HCl = PH4Cl
PH3 + HClO4
- Окислительно – восстановительные свойства
Как и азот в аммиаке, фосфор в молекуле фосфина имеет низшую степень окисления – 3. Однако для фосфора эта степень окисления менее устойчива, чем для азота, поэтому фосфин проявляет более ярко выраженные восстановительные свойства, чем аммиак. Так, фосфин при температуре около 150 оС самовоспламеняется на воздухе:
Однако для фосфора эта степень окисления менее устойчива, чем для азота, поэтому фосфин проявляет более ярко выраженные восстановительные свойства, чем аммиак. Так, фосфин при температуре около 150 оС самовоспламеняется на воздухе:
2PH3 + 4O2 = P2O5 + 3H2O
Фосфин восстанавливает соли некоторых малоактивных металлов до свободных металлов, например:
PH3 + 8AgNO3 + 4H2O = H3PO4 + 8Ag + 8HNO3
Скачать:
Скачать бесплатно реферат на тему: «Фосфор» Фосфор.doc (272 Загрузки)
а также на тему: «Фосфор и его соединения»
Фосфор-и-его-соединения.doc (279 Загрузок)Весь список рефератов можно посмотреть здесь
*на изображении записи фотография белого фосфора
Похожее
Соединения фосфора
Фосфин (PH
3)Способы получения фосфина
Прямым синтезом PH3 получить нельзя.
- Фосфин получают путем водного или кислотного гидролиза фосфидов:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3↑
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
- Реакция диспропорционирования фосфора в щелочах:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑
- Разложение солей фосфония (Температура выше 80ºС):
P4
Физические свойства фосфина
При нормальной температуре фосфин является бесцветным газом с резким чесночным запахом. В воде малорастворим, хорошо растворим в органических растворителях
Фосфин — Яд!
Химические свойства фосфина
- PH3не реагирует с водой, щелочами, аммиаком.

PH3— Проявляет свойства сильного восстановителя.
- Вступает в реакции с кислотами – окислителями:
PH3 + 8H2SO4(конц) = H3PO4 + 8SO2↑ + 3H2O
PH3 + 8HNO3(конц. гор) = H3PO4 + 8NO2↑ + 4H2O
- С безводными кислотами образует соли:
HI+ PH3↑ = P4I
- Окисляется кислородом. При Т ~ 150ºС самовозгорается:
РН3 + 2О2 = P2O5 + H2O (Н3РО4)
Практического значения фосфин не имеет.
Фосфиды
Способы получения
Взаимодействие фосфора с металлами:
2P + 3Mg → Mg3P2
2P + 3Ca → Ca3P2
P + 3Na → Na3P
Физические свойства, строение фосфидов
Фосфиды – представляют собой продукты взаимодействия
фосфора с металлами.
Фосфиды щелочных и щелочноземельных металлов имеют ионное строение.
Химические свойства фосфидов
Фосфиды крайне неустойчивы и легко подвергаются необратимому гидролизу с образованием РН3:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3↑
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
Оксид фосфора (III), триоксид фосфора (P
2O3)Способы получения оксида фосфора (III)
- Р2О3 образуется при горении фосфора в недостатке кислорода или его медленном окислении:
4Р + 3О2 = 2Р2О3
Физические свойства оксида фосфора (III)
При комнатной температуре Р2О3 — белая воскообразная масса с неприятным запахом. Легко испаряется, его Тпл = 23,5°С
Пары существует в виде
димеров Р4О6.
!Очень ядовит
Химические свойства оксида фосфора (III)
- Р2О3 как кислотный оксид при взаимодействии с водой образует фосфористую кислоту:
Р2О3 + ЗН2О =2H3PO3
- Реакция диспропорционирования происходит очень бурно при растворении Р2О3вгорячей воде:
2Р2О3 + 6Н2О = РН3 + ЗH3PO4
- При взаимодействии Р2О3 с щелочами образуются соли фосфористой кислоты:
Р2О3 + 4NaOH = 2Na2HPO3 + Н2О
- При взаимодействии с окислителями P2O3 проявляет восстановительные свойства:
Окисление кислородом воздуха:
Р2О3 + О2 = Р2О5
Окисление галогенами:
Р2О3 + 2Cl2 + 5Н2О = 4HCl + 2H3PO4
Оксид фосфора (V), пентаоксид фосфора, фосфорный ангидрид (Р
2О5)Способы получения фосфорного ангидрида
Сжигание фосфора в избытке воздуха:
4Р + 5О2 = 2Р2О5
Физические свойства фосфорного ангидрида
При комнатной
температуре Р2О5 — белые стеклообразные хлопья без запаха. Существует в виде
димеров Р4О10.
Существует в виде
димеров Р4О10.
Очень гигроскопична, при соприкосновении с воздухом расплывается в сиропообразную жидкость (НРO3). Р2О5 — самое эффективное осушающее средство и водоотнимающий агент. Применяется для осушения нелетучих веществ и газов.
Химические свойства фосфорного ангидрида
Р2О5проявляет кислотные свойства.
Как кислотный оксид Р2О5 взаимодействует:
- с водой, с образованием различных кислот:
Р2О5 + Н2О = 2HPO3 метафосфорная
Р2О5 + 2Н2О = Н4Р2О7 пирофосфориая (дифосфорная)
Р2О5 + ЗН2О = 2H3PO4 ортофосфорная
- с основными оксидами, с образованием фосфатов
Р2О5 + ЗВаО = Ва3(PO4)2
- с щелочами, с образованием средних и кислых солей
Р2О5 + 6NaOH = 2Na3PO4 + ЗН2О
Р2О5 + 4NaOH = 2Na2HPO4 + Н2О
Р2О5 + 2NaOH = 2NaH2PO4 + Н2О
- Фосфорный ангидрид способен отнимать у других веществ не только гигроскопическую влагу, но и химически связанную воду.
 Например, он дегидратирует оксокислоты, что широко используется для получения ангидридов кислот:
Например, он дегидратирует оксокислоты, что широко используется для получения ангидридов кислот:
Р2О5 + 2HNО3 = 2HPO3 + N2О5
Р2О5 + 2НСlО4 = 2HPO3 + Сl2О7
P2O5 + H2SO4 → 2HPO3 + SO3
P2O5 + 2CH3COOH → 2HPO3 + (CH3CO)2O
Видеоопыт Взаимодействие оксида фосфора с водой
Фосфорные кислоты
Фосфор образует только 2 устойчивых оксида, в которых он находится в степенях окисления +5 и +3. Однако существует большое число кислот, в которых фосфор имеет валентность равную V (пять ковалентных связей) и степени окисления +5, +4, +3, +1.
Строение наиболее известных кислот выражается следующими формулами:
Наибольшее
практическое значение имеют ортофосфорная (фосфорная) и ортофосфористая
(фосфористая) кислоты.
Фосфористая кислота (
H3PO3)Способы получения фосфористой кислоты
- Реакция Р2О3 с водой:
Р2О3 + ЗН2О =2H3PO3
- Гидролиз галогенидов фосфора (III):
PCl3 + ЗН2О = H3PO3+ 3HCl
- Окисление белого фосфора хлором:
2Р + 3Cl2 + 6Н2О = 2H3PO3+ 6HCl
Физические свойства, строение фосфористой кислоты
Для молекулы фосфористой кислоты H3PO3 известны 2 таутомерные формы. В одной из них 2 атома водорода молекулы связаны с кислородом, а один атом водорода связан непосредственно с атомом фосфора. Такой атом водорода не может быть замещен атомами металлов, поэтому кислота является двухосновной.
В другой таутомерной форме – все три атома водорода связаны с кислородом.
Формула фосфористой кислоты выглядит следующим образом: Н2[НРО3]
При комнатной температуре H3PO3 – кристаллическое вещество без цвета, хорошо растворимое в воде, Тпл = 74°С.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Химические свойства фосфористой кислоты
Является слабой кислотой.
- Для нее характерны все свойства кислот — взаимодействие с металлами с выделением Н2; с оксидами металлов и с щелочами. При этом образуются одно — или двухзамещенные фосфиты:
Н2[НРО3] + NaOH = NaH[HРО3] + Н2О
Н2[НРО3] + 2NaOH = Na2[HРО3] + 2Н2О
- Кислота является и окислителем и восстановителем, при нагревании вступая в реакции диспропорционирования:
H2HPO3 + H2HPO3 = H3PO4 + PH3
Кислота и ее соли являются сильными восстановителями:
- Реагируют с сильными окислителями:
H3PO3 + Cl2 + Н2О = H3PO4 + 2HCl
5H3PO3 + 2KMnO4 + 3H2SO4 → 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
H3PO3 + HgCl2 + H2O → H3PO4 + Hg + 2HCl
- Реагируют с более слабыми окислителями:
H3PO3 + 2AgNO3 + Н2О = H3PO4 + 2Ag↓ + 2HNO3
- В реакции с сильными восстановителями, например, с щелочными и щелочно-земельными металлами, цинковой пылью, кислота восстанавливается до фосфина:
H2HPO3 + 3Zn + 3H2SO4 = 3ZnSO4 + PH3 + 3Н2О
- При нагревании водного раствора Н3РO3окисляется до H3PO4 с выделением водорода:
H3PO3 + Н2О = H3PO4 + Н2
Соли фосфористой кислоты (Фосфиты)
Способы получения фосфитов
- Взаимодействие фосфористой кислоты с щелочами:
Н2[НРО3] + NaOH = NaH[HРО3] + Н2О
Н2[НРО3] + 2NaOH = Na2[HРО3] + 2Н2О
- взаимодействие фосфористой кислоты с металлами с выделением Н2
Н2[НРО3] + Ca = Ca[HРО3] + Н2
- взаимодействие фосфористой кислоты с оксидами металлов
Н2[НРО3] + CaO = Ca[HРО3] + Н2O
- диспропорционирование фосфора в горячем, концентрированном растворе щелочи:
P4 + 8NaOH(конц) + 4H2O = Na2[HРО3] + 6H2
- Взаимодействие трихлорида фосфора с разбавленным раствором щелочи:
PCl3 + 5NaOH(разб) = Na2[HРО3] + 3NaCl + 2H2O
Физические свойства фосфитов
Двухосновная фосфористая кислота образует два типа солей:
а) однозамещенные фосфиты (кислые соли), в молекулах которых атомы металлов связаны с анионами Н2РО3, например: NaH2PO3, Са(H2PO3)
б) двухзамещенные фосфиты (средние соли), в молекулах которых атомы металлов связаны с 2 или 1 анионом HPO3, например: Na2HPO3, СаHPO3.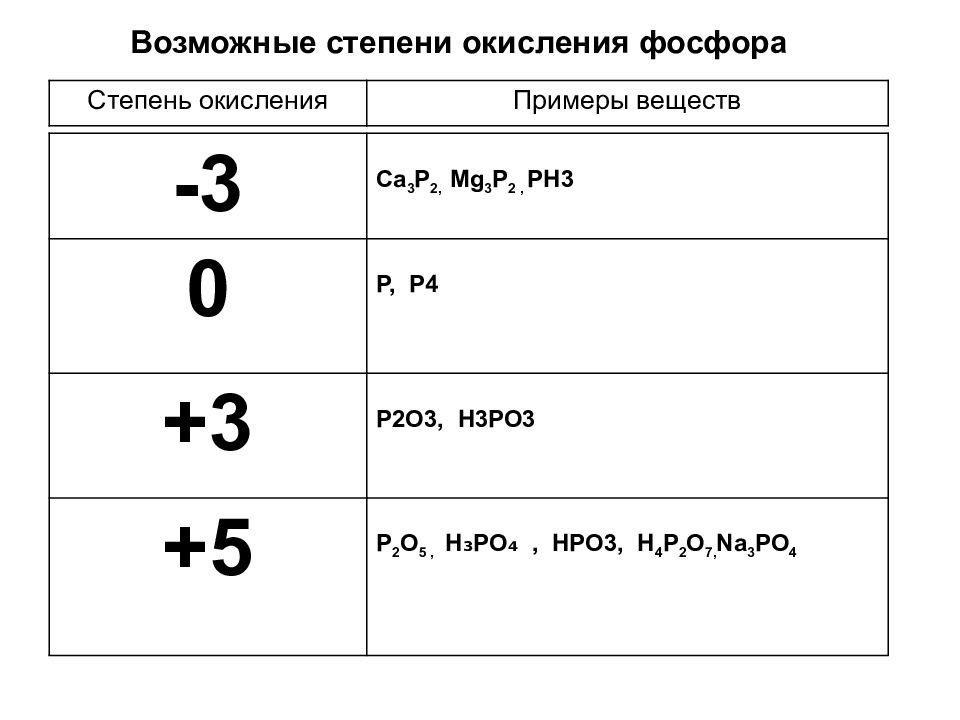
Хорошо растворимы в воде только фосфиты щелочных металлов и кальция, остальные фосфиты плохо растворимы.
Химические свойства фосфитов
Имеют химические свойства, характерные для солей
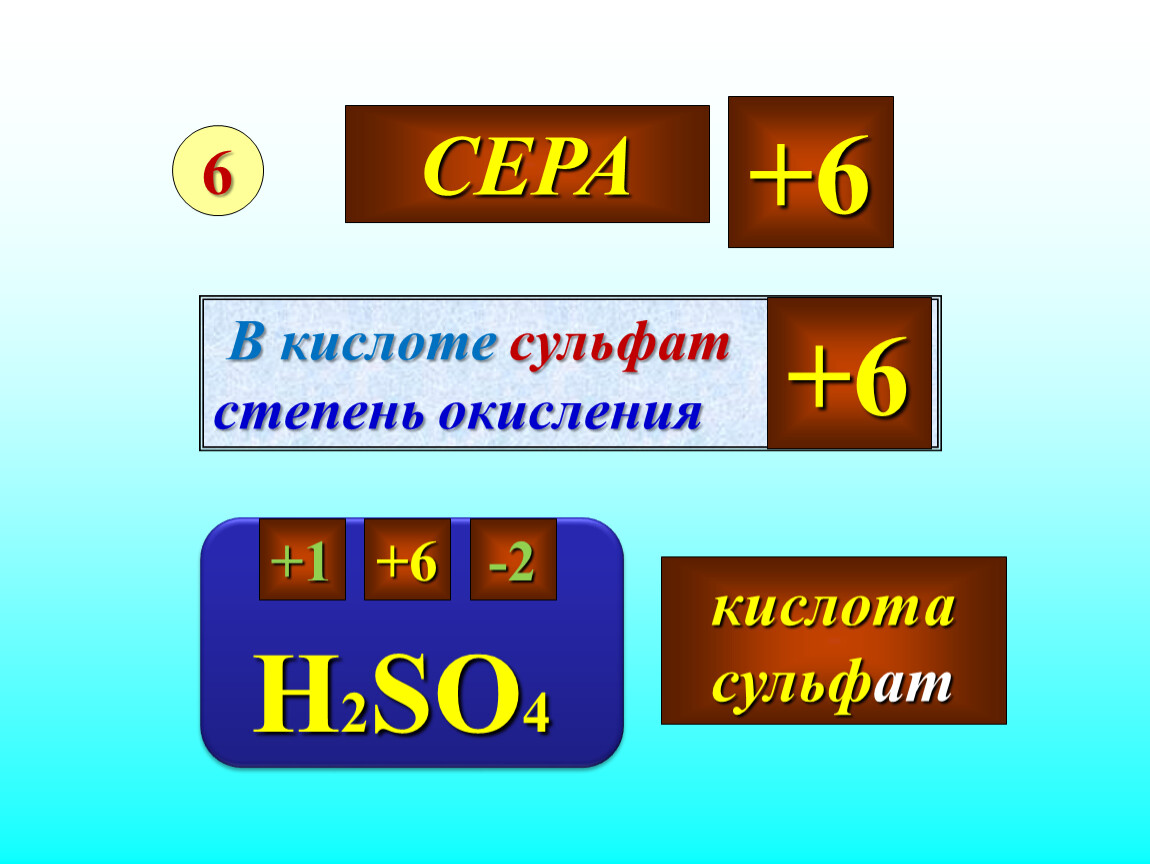
Ортофосфорная кислота, фосфорная кислота (Н
3РO4)Способы получения фосфорной кислоты
В промышленности Н3РO4 получают двумя способами:
- Разложением природного соединения – фосфата кальция Са3(РO4)2 серной кислотой:
Са3(РO4)2 + 3H2SO4 = 2Н3РO4 + 3CaSO4↓
- Доменный (термический) 3х-стадийный способ:
1 стадия — восстановление природных фосфоритов коксом
2 стадия – окисление получающихся паров свободного фосфора кислородом воздуха
3 стадия – орошение водой получающейся окиси фосфора:
Лабораторный способ
- Н3РO4 получают окислением фосфора азотной кислотой:
ЗР + 5HNO3 + 2Н2О = ЗН3РO4 + 5NO↑
- Взаимодействием фосфорного ангидрида с водой:
Р2О5 + ЗН2О = 2H3PO4
Физические свойства, строение фосфорной кислоты
При обычной
температуре безводная Н3РO4 – прозрачное, легкоплавкое (Тпл = 42°С)
кристаллическое вещество. Н3РO4 -очень гигроскопичное вещество и смешивается с
водой в любых соотношениях. Н3РO4 с небольшим количеством воды образует
сиропообразную, вязкую жидкость.
Н3РO4 -очень гигроскопичное вещество и смешивается с
водой в любых соотношениях. Н3РO4 с небольшим количеством воды образует
сиропообразную, вязкую жидкость.
Степень окисления фосфора в фосфорной кислоте равна +5, валентность равна V.
При нагревании орто-фосфорной кислоты выше +213 °C, она переходит в пирофосфорную H4P2O7.
При нагревании выше 700°С переходит в метафосфорную кислоту HPO3:
Качественные реакции для обнаружения фосфат-иона
Для обнаружения анионов фосфорной кислоты используют раствор AgNO3, при помощи которого также можно различить мета-, пиро- и ортофосфорные кислоты друг от друга.
При добавлении AgNO3 к кислотам образуются осадки различного цвета:
- метафосфат серебра AgPO3— белый
- пирофосфат серебра Ag4P2O7 – также белый, но он не свертывает яичного белка
- ортофосфат серебра Ag3PO4— желтый:
Н3PO4 + 3AgNO3 → Ag3PO4↓ + 3НNO3
Видео Качественная реакция на фосфат-ион
Химические свойства фосфорной кислоты
Фосфорная кислота H3PO4 – это электролит средней силы
и представляет собой трехосновную кислоту.
Диссоциация протекает в основном по 1-й ступени:
Н3РO4 → Н+ + Н2РO4—
По 2-й и 3-й ступеням диссоциация протекает в ничтожно малой степени:
Н2РO4— → Н+ + НРO42-
НРO42- → Н+ + РO43-
- Н3РO4 проявляет все общие свойства кислот — взаимодействует с активными металлами:
2Н3РO4 + 6Na = 2Na3РO4 + 3H2
- с основными оксидами:
2Н3РO4 + ЗСаО = Са3(РO4)2 + ЗН2О
2H3PO4 + 3MgO = Mg3(PO4)2 + 3H2O
- с основаниями образует три ряда солей – одно-, двух- и трехзамещенные (кислые и средние соли):
Н3РO4 + NaOH = NaH2PO4 + Н2О
Н3РO4 + 2NaOH = Na2HPO4 + 2Н2О
Н3РO4 + 3NaOH = Na3PO4 + ЗН2О
- с аммиаком образует соли аммония:
Н3РO4 + NH3 = NH4H2PO4
Н3РO4 + 2NH3 = (NH4)2HPO4
- Вытесняет более слабые кислоты из их солей
(карбонатов, сульфидов и др.
 ). Также вступает в обменные реакции с солями:
). Также вступает в обменные реакции с солями:
Н3PO4 + 3NaHCO3 → Na3PO4 + CO2 + 3H2O
- При нагревании H3PO4 выше 200°С происходит отщепление молекулы воды с образованием пирофосфорной кислоты H2P2O7:
2H3PO4 → H2P2O7 + H2O
В отличие от аниона NO3— в азотной кислоте, анион РO43- окисляющим действием не обладает.
Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
Способы получения фосфатов
Получают кислоты с металлами, оксидами металлов, гидроксидами (см. Химические свойства ортофосфорной кислоты)
Физические свойства фосфатов
Н3РO4 является 3х-основной кислотой, поэтому образует 3 типа солей:
| Анион соли | Название | Растворимость в воде | Примеры солей |
| PO43- | Фосфат (ортофосфат) | большинство нерастворимы (кроме фосфатов щелочных металлов и аммония) | Na3РO4; Са3(РO4)2 |
| HPO42- | Гидрофосфат | растворимы | Na2НРO4; СаНРО4 |
| Н2РO4— | Дигидрофосфат | очень хорошо растворимы | NaH2PO4; Са(Н2РO4)2 |
Химические свойства фосфатов
- Имеют свойства, характерные для солей.

Na3РO4 + Н2О = Na2HPO4 + NaOH
- Характерная особенность ортофосфатов – отношение к прокаливанию: однозамещенные соли переходят в метафосфаты, двухзамещенные – в пирофосфаты, из трехзамещенных изменяются только соли аммония:
NaH2PO4 = NaPO3 + H2O
Na2HPO4 = Na4P2O7 + H2O
(NH4)3PO4 = 3NH3 + H2O
Фосфорные удобрения
Фосфаты и гидрофосфаты кальция и аммония используются в качестве фосфорных удобрений.
При достаточном количестве фосфора растения быстро растут и хорошо плодоносят. Внесение фосфорных удобрений благоприятствует росту корневой системы растения и повышению урожайности. В связи с этим такие удобрения важны при выращивании овощных, зерновых и плодово-ягодных культур.
В таблице ниже приведены основные виды фосфорных удобрений.
ГЛАВНАЯ ПОДГРУППА V ГРУППЫ. СОЕДИНЕНИЯ ФОСФОРА
ПРЕДМЕТ: Общая и неорганическая химия.
СПЕЦИАЛЬНОСТЬ: 060301
РАЗДЕЛ: 2
ЛЕКЦИЯ № 17
ТЕМА: 2.1.3 «ГЛАВНАЯ ПОДГРУППА V ГРУППЫ. СОЕДИНЕНИЯ ФОСФОРА »
МОТИВАЦИЯ ЗАНЯТИЯ:
Академик А.Е.Ферсман называю фосфор «элементом жизни и мысли», и это определение вряд ли можно отнести к категории литературных преувеличений. Фосфор обнаружен буквально во всех органах зеленых растений: в стеблях, корнях, листьях, но больше всего его в плодах и семенах.
Растения накапливают фосфор и снабжают им животных.
В организме животных фосфор сосредоточен главным образом в скелете, мышцах и нервной ткани. Из продуктов питания человека особенно богат фосфором желток куриного яйца.
По содержанию в организме человека фосфор относится к макроэлементам (0,95%). Это элемент – органоген, который играет исключительную роль в обмене веществ.
Фосфор входит в состав белков, нуклеиновых кислот, нуклеотидов и других биологически активных веществ.
Знания данной темы необходимы для изучения курса аналитической химии (т. «Качественные реакции на анионы»), фармацевтической химии (лек. средство — кодеина фосфат) и других специальных предметов.
ЦЕЛИ:
1. В ходе лекции студенты должны получить представления об аллотропических изменениях фосфора, оксидах фосфора, фосфористой и фосфорной кислотах и их солях.
2. Обеспечить в ходе занятия усвоение следующих знаний: – характеристика элементов группы главной п/группы по положению в ПС Д.И. Менделеева;
— физические и химические свойств фосфора.
ВПС:
Темы: «Классы неорганических соединений»,
«ПЗ и ПС Д.И. Менделеева»
« Теория электролитической диссоциации»
«Окислительно-восстановительные реакции»
МПС: аналитическая химия т. «Качественные реакции на анионы»
ВОПРОСЫ ДЛЯ АКТУАЛИЗАЦИИ ОПОРНЫХ ЗНАНИЙ:
1. Какое количество электронов содержит атом фосфора?
Какое количество электронов содержит атом фосфора?
2. Чему равна высшая валентность фосфора? Почему?
3. Назовите высшую и низшую степени окисления фосфора?
4. Какую степень окисления проявляет фосфор в соединениях с водородом, кислородом?
5. Фосфор — это металл или неметалл?
6. Что такое аллотропия?
7. Какие из уже изученных элементов имеют аллотропические
модификации?
8. Какие аллотропические формы фосфора Вы знаете?
ТРЕБОВАНИЯ К РЕЗУЛЬТАТАМ ОСВОЕНИЯ темы;
Фармацевт должен обладать общими компетенциями,включающими в себя способность (по базовой подготовке):
ОК 1. Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес.
ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
ОК 3. Принимать решения в стандартных и. нестандартных
ситуациях и нести за них ответственность. .
.
ОК 4. Осуществлять поиск и. использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
ОК 5. Использовать информационно-коммуникационные технологии в профессиональной деятельности.
ОК 6. Работать в коллективе и в команде, эффективно общаться
с коллегами, руководством, потребителями.
ОК 8. Самостоятельно определять задачи профессионального и
личностного развития, заниматься’ самообразованием, осознанно
планировать повышение своей квалификации.
— .
Фармацевт должен’ обладать профессиональными
компетенциями, соответствующими основным видам профессиональной деятельности (по базовой подготовке):
.
ПК 1.6. Соблюдать правила санитарно-гигиенического режима, охраны труда, техники безопасности и противопожарной безопасности.
ПК 2.3. Владеть обязательными видами внутриаптечного контроля
лекарственных средств.
ПК 2. 4. Соблюдать правила санитарно-гигиенического режима, охраны труда, техники безопасности и противопожарной безопасности.
4. Соблюдать правила санитарно-гигиенического режима, охраны труда, техники безопасности и противопожарной безопасности.
ПЛАН ЛЕКЦИИ:
1. Фосфор. Аллотропия. Физические и химические свойства (знать)
2. Биологическая роль фосфора (самостоятельно)
3.Оксиды фосфора. Фосфористая кислота и ее соли. Фосфорная кислота и ее соли. Качественные реакции на фосфат-анион.
4. Применение в медицине и народном хозяйстве фосфора и их соединений. (самостоятельно)
Вопросы для самостоятельного изучения и конспектирования:
1. Биологическая роль фосфора.
2. Применение в медицине и народном хозяйстве фосфора и его соединений.
I. ФОСФОР. АЛЛОТРОПИЯ. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА.
Фосфор (P) – открыт в 1669 г. алхимиком Брандом.
Нахождение в природе:
В силу своей высокой химической активности фосфор в природе в свободном виде не встречается. Он встречается главным образом в виде производных фосфорной кислоты: апатитов − Ca5Hal(PO4)3, где На1 — F, реже Cl или ОН; фосфоритов — Ca3(PO4)2
Он встречается главным образом в виде производных фосфорной кислоты: апатитов − Ca5Hal(PO4)3, где На1 — F, реже Cl или ОН; фосфоритов — Ca3(PO4)2
ФИЗИЧЕСКИЕ СВОЙСТВА ФОСФОРА:
Фосфор образует три аллотропические модификации: белый, красный, черный.
Белый фосфор имеет молекулярную кристаллическую решетку
и формулу Р4.
Он очень ядовит, светится в темноте, не растворяется в воде, но растворяется в сероуглероде. Белый фосфор на воздухе легко окисляется и в порошке даже самовоспламеняется.
Хранят его под водой.
Смертельная доза для человека составляет 0,15 г.
Красный фосфор имеет вид темно-малинового порошка.
Он не ядовит, не светится в темноте, не растворяется ни в воде, ни в сероуглероде, на воздухе окисляется медленно и не самовоспламеняется
Получается при длительном нагревании белого фосфора без доступа воздуха при t0 = 250 – 3500С. Применяется в спичечном производстве.
Применяется в спичечном производстве.
Черный фосфор получают нагреванием белого фосфора при 2000С и очень высоком давлении.
По внешнему виду и некоторым физическим свойствам похож графит. Он проводит электрический ток, жирный на ощупь. Черный фосфор весьма инертен и воспламеняется только при 4900С.
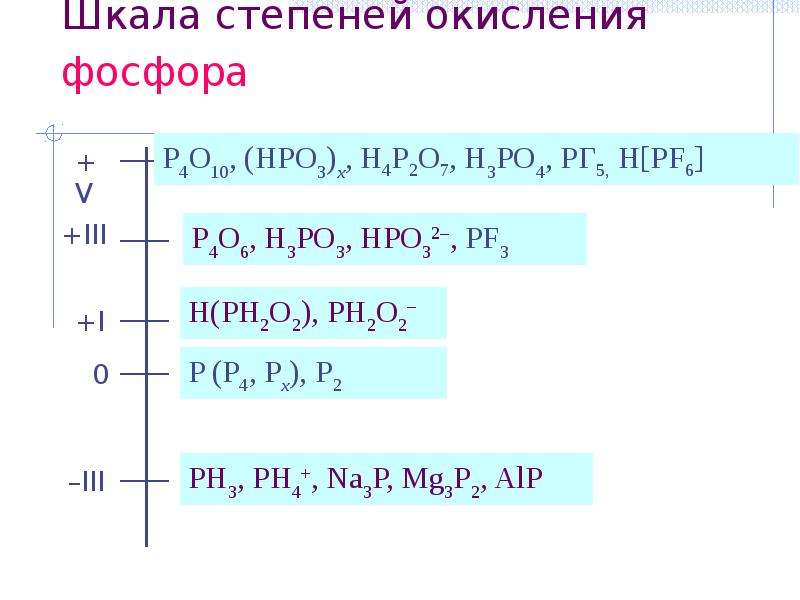
Р … 3s23p3 Степени окисления -3, 0, +3 +5.
ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРА :
Фосфор обладает большим радиусом атома, чем азот, вследствие чего обладает меньшим сродством к электрону.
Кислородные соединения фосфора более устойчивы по сравнению с таковыми азота. Наоборот, водородные соединения фосфора менее прочные по сравнению с аммиаком. Химическая активность фосфора как восстановителя значительно выше, чем у азота. Наибольшей реакционной способностью обладает белый фосфор.
Фосфор — активный неметалл. Фосфор легче всего взаимодействует с кислородом и хлором. При избытке кислорода или хлора образуется соединения фосфора (V) , а при недостатке — соединения фосфора (III).
Фосфор легче всего взаимодействует с кислородом и хлором. При избытке кислорода или хлора образуется соединения фосфора (V) , а при недостатке — соединения фосфора (III).
1) 4 Р + 3О2 = 2 Р2О3 4Р + 5О2 = 2Р2О5
недостаток избыток
2) 2Р + 3Cl2 = 2PCl3 2P + 5 Cl2= 2PCl5
недостаток избыток
3) С активными металлами при нагревании:
t0
3Ca + 2P = Ca3P2
фосфид кальция
4) Взаимодействует с серой при нагревании:
2Р + 3S = P2S3 2P +5S + P2S5
недост. сульфид изб. сульфид
фосфора (III) фосфора (V)
5) Взаимодействие с азотной кислотой:
P + 5 HNO3 H3PO4 + 5 NO2 + H2O
0 +5
1 4 H2O + P0 − 5 ē PO43− + 8H восстановитель
+1
5 NO3− + 2H+ +1 ē NO20 + H2O окислитель
0
4 H2O + P0 + 5 NO3− + 10 H+ PO43− +8H+ + 5NO2 + 5 H2O
2 1 1
6) С водородом фосфор не реагирует, но косвенно получено
соединение РН3 (фосфин).
Фосфин — бесцветный ядовитый газ с запахом гнилой рыбы. Он самовоспламеняется на воздухе. Этим свойством объясняется появление болотных, блуждающих или могильных огней. В теплые темные ночи на свежих могилах иногда наблюдаются бледно-голубоватые, слабо-мерцающие огоньки вспыхнувшего фосфина, который образовался при разложении трупов.
Выводы:
1.В силу своей высокой химической активности фосфор в природе в свободном виде не встречается.
2.Фосфор образует три аллотропические модификации: белый, красный, черный.
3. Р … 3s23p3 Степени окисления -3, 0, +3 +5.
4.Фосфор — активный неметалл. Фосфор легче всего взаимодействует с кислородом и хлором.
5. С водородом фосфор не реагирует, но косвенно получено
соединение РН3 (фосфин).
2.Биологическая роль.
Фосфор является жизненно необходимым макроэлементом организма.
Аденозинтрифосфорная кислота (АТФ), содержащая фосфор, является аккумулятором химической энергии в организме. Так при отщеплении одного остатка фосфорной кислоты от молекулы АТФ происходит освобождение 10000 кал тепла на 1 моль вещества.
Наиболее интенсивно АТФ расходуется в активно работающих Органах тела: в печени, в мышцах, в мозгу. Недаром замечательный ученый, один из основоположников науки геохимии, академик А.Е. Ферсман называл фосфор «элементом жизни и мысли».
Фосфор входит в состав фосфатидов и фосфопротеидов имеющих важное значение в функциях нервной ткани и в обмене веществ.
Значительные количества фосфора содержатся в костной ткани.
Для отложения кальция в костях необходимо, чтобы организм получал достаточное количество фосфора.
Недостаточное поступление фосфора в организм влечет за собой ряд различных заболеваний, вплоть до остеопороза («разрежения костной ткани»).
Соли ортофосфорной кислоты, содержащиеся в плазме крови в виде дигидро – и гидрофосфатов в соотношении 4 : 1 поддерживают постоянное значение pH крови,
Фосфор поступает в организм человека с пищей — яйцами, мясом, молоком, хлебом. Суточная потребность — 2,0 − 4,0.
Суточная потребность — 2,0 − 4,0.
Фосфор получил свое название за способность белого фосфора светиться в темноте (греч. «фосфор» — светоносный ).
Выводы:
1.Фосфор является жизненно необходимым макроэлементом организма.
2.Аденозинтрифосфорная кислота (АТФ), содержащая фосфор, является аккумулятором химической энергии в организме.
3.Фосфор входит в состав фосфатидов и фосфопротеидов имеющих важное значение в функциях нервной ткани и в обмене веществ.
4.Значительные количества фосфора содержатся в костной ткани.
5.Недостаточное поступление фосфора в организм влечет за собой ряд различных заболеваний, вплоть до остеопороза («разрежения костной ткани»).
6.Соли ортофосфорной кислоты, содержащиеся в плазме крови в виде дигидро – и гидрофосфатов в соотношении 4 : 1 поддерживают постоянное значение pH крови,
3.Оксиды фосфора. Фосфористая кислота и ее соли. Фосфорная кислота и ее соли. Качественные реакции на фосфат-анион.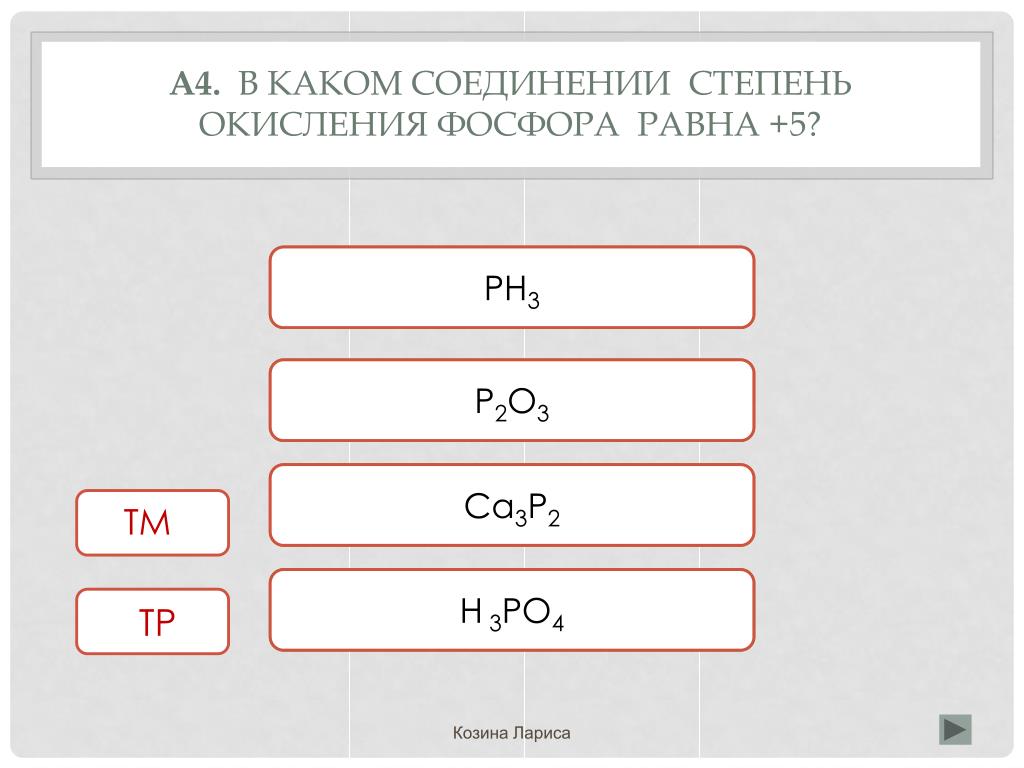
КИСЛОРОДОСОДЕРЖАЩИЕ СОЕДИНЕНИЯ ФОСФОРА.
Оксид фосфора (III) Р2О3 — белое кристаллическое вещество, очень ядовитое. На воздухе при нагревании он окисляется в оксид фосфора (V), в воде растворяется с образованием фосфористой кислоты:
Р2O3 + 3 Н20 = 2 НЗРО3
Фосфористая кислота НЗРО3— бесцветное кристаллическое вещество, расплывающееся на воздухе и хорошо растворимое в воде. В химических реакциях она выступает как средней силы двухосновная кислота:
H OH
H−O−P HO − P
| | O −H И OH
O
Соли её называются фосфитами;
кислота является сильным восстановителем
Оксид фосфора (V) Р2O5 — белые гигроскопические кристаллы.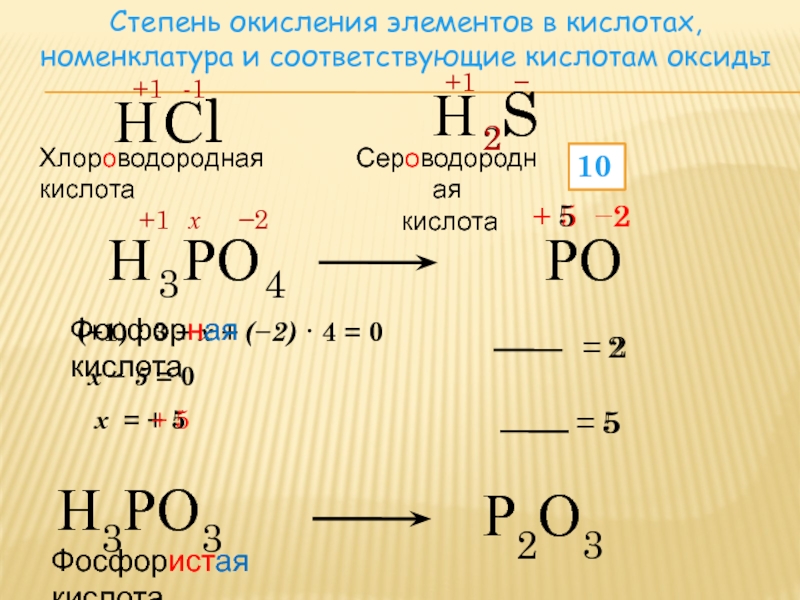 Используется для осушки газов и жидкостей, а в отдельных случаях для отщепления от веществ химическиcвязанной воды.
Используется для осушки газов и жидкостей, а в отдельных случаях для отщепления от веществ химическиcвязанной воды.
Ему соответствуют три кислоты: мета-, орто-, пирофосфорная.
При растворении Р2O5 в воде вначале образуется метафосфорная кислота
Р2O5 + Н2O = 2 НРО3
а при длительном кипячении Р2O5 с водой — ортофосфорная кислота
Р2O5 + 3 Н2O = 2 НЗРО4
При осторожном прокаливании ортофосфорной кислоты образуется пирофосфорная кислота:
2 Н3РО4 = Н2О + Н4Р2О7
Все три кислоты можно представить как соединения молекулы Р2О5 с различным количеством молекул воды.
Наибольшее применение находит ортофосфорная кислота (или просто фосфорная кислота). Она не ядовита и поэтому применяется
в пищевой промышленности для изготовления сиропов.
фосфорная кислота
НРО4− (NaH2PO4) − соли растворимы в воде
P2O5 H3PO4 HPO4 2−(Na2HPO4) − соли мало растворимы в воде
средней силы,
нелетучая PO43− (Na3PO4) − соли нерастворимы в воде,
кроме солей щелочных металлов
СОЛИ ФОСФОРНОЙ КИСЛОТЫ — ФОСФАТЫ.
Фосфор в НЗРО4 находится в высшей степени окисления, однако это состояние является самой устойчивой формой. Поэтому НЗРО4 является устойчивой кислотой, не обладающей в отличие от азотной и серной кислот сколько-нибудь значительными окислительно-восстановительными свойствами. Восстановление НЗРО4 и ее солей до фосфора возможно только при высоких температурах.
КАЧЕСТВЕННЫЕ PEAKЦИИ на ФОСФАТ- ИОН:
1. С раствором нитрата серебра:
Na2HPO4 + 3 AgNO3 = 2 NaNO3 + HNO3 + Ag3PO4↓
Избыток желт. цвет
/легко растворим в азотной кислоте и растворе аммиака/
HPO4 2− + 3Ag+ = Ag3PO4↓ + H+
или Na3PO4 + 3 AgNO3 = Ag3PO4↓ + 3 NaNO3
PO4 3− + 3Ag− = Ag3PO4↓
Полное осаждение возможно только в нейтральной или щелочной среде.
2. С магнезиальной смесью (водный раствор NH3, NH4Cl, MgCl2),
которая выделяет даже из разбавленных растворов белый кристаллический осадок фосфата магния-аммония:
Na2HPO4 + MgCl2 + HN4OH = MgNH4PO4↓ + 2NaCl + H2O
HPO42- + Mg 2+ + NH4OH = MgNH4PO4↓ + H2O
Осадок легко растворим даже в очень слабых кислотах.
Техника выполнения: В пробирку помещают 2 капли раствора Na2HP04, добавляют 2капли раствора NН4Сl, 2 капли раствора NH3 и затем 2капли раствора MgCl2.
Проверяют растворение полученного осадка в разбавленных HCl и HNO3.
MgCl2 + 2 NH4OH = Mg(OH)2↓ + 2 NH4Cl
белый
Mg(OH)2 + 2 NH4Cl = MgCl2 + 2 NH4OH
магнезиальная смесь
NH4Cl
MgCl2 + NH4OH + Na2HPO4 ═ MgNH4PO4↓ + 2 NaCl + H2O
белый кристаллический
Выводы:
1. Оксид фосфора (III) Р2О3 — белое кристаллическое вещество, очень ядовитое. На воздухе при нагревании он окисляется в оксид фосфора (V), в воде растворяется с образованием фосфористой кислоты:
Оксид фосфора (III) Р2О3 — белое кристаллическое вещество, очень ядовитое. На воздухе при нагревании он окисляется в оксид фосфора (V), в воде растворяется с образованием фосфористой кислоты:
Р2O3 + 3 Н20 = 2 НЗРО3
2.Фосфористая кислота НЗРО3— бесцветное кристаллическое вещество, расплывающееся на воздухе и хорошо растворимое в воде.
Соли её называются фосфитами;
3.Оксид фосфора (V) Р2O5 — белые гигроскопические кристаллы. Ему соответствуют три кислоты: мета-, орто-, пирофосфорная.
4.
фосфорная кислота
НРО4− (NaH2PO4) − соли растворимы в воде
P2O5 H3PO4 HPO4 2−(Na2HPO4) − соли мало растворимы в воде
средней силы,
нелетучая PO43− (Na3PO4) − соли нерастворимы в воде,
кроме солей щелочных металлов
5. СОЛИ ФОСФОРНОЙ КИСЛОТЫ — ФОСФАТЫ.
СОЛИ ФОСФОРНОЙ КИСЛОТЫ — ФОСФАТЫ.
6.КАЧЕСТВЕННЫЕ PEAKЦИИ на ФОСФАТ- ИОН:
А) С раствором нитрата серебра:
Na2HPO4 + 3 AgNO3 = 2 NaNO3 + HNO3 + Ag3PO4↓
Избыток желт. цвет
/легко растворим в азотной кислоте и растворе аммиака/
HPO4 2− + 3Ag+ = Ag3PO4↓ + H+
или Na3PO4 + 3 AgNO3 = Ag3PO4↓ + 3 NaNO3
PO4 3− + 3Ag− = Ag3PO4↓
Полное осаждение возможно только в нейтральной или щелочной среде.
Б) С магнезиальной смесью (водный раствор NH3, NH4Cl, MgCl2),
которая выделяет даже из разбавленных растворов белый кристаллический осадок фосфата магния-аммония:
Na2HPO4 + MgCl2 + HN4OH = MgNH4PO4↓ + 2NaCl + H2O
HPO42- + Mg 2+ + NH4OH = MgNH4PO4↓ + H2O
Осадок легко растворим даже в очень слабых кислотах.
4.ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ФОСФОРА В МЕДИЦИНЕ
Радиоактивный фосфор Р- 32 применяется при изучении фосфорного обмена в костях, служит меткой «для эритроцитов крови», применяется при злокачественном заболевании красной крови.
Na2HPO4 • 12 Н2О — антацидное средство при повышенной кислотности желудочного сока, при отравлении кислотами, входят в состав уродана.
Глицерофосфат кальция используется как общеукрепляющее, тонизирующее средство при рахите, истощении нервной системы.
АТФ применяется при мышечной дистрофии, стенокардии, легкой форме гипертонической болезни и т.д.
Выводы:
1.Радиоактивный фосфор Р- 32 применяется при изучении фосфорного обмена в костях, служит меткой «для эритроцитов крови», применяется при злокачественном заболевании красной крови.
2.Na2HPO4 • 12 Н2О — антацидное средство при повышенной кислотности желудочного сока, при отравлении кислотами, входят в состав уродана.
3. Глицерофосфат кальция используется как общеукрепляющее, тонизирующее средство при рахите, истощении нервной системы.
Глицерофосфат кальция используется как общеукрепляющее, тонизирующее средство при рахите, истощении нервной системы.
4.АТФ применяется при мышечной дистрофии, стенокардии, легкой форме гипертонической болезни и т.д.
ВОПРОСЫ ДЛЯ самоконтроля:
1. Какие кислородные соединения образует фосфор?
2. Образует ли фосфор соединения с водородом?
3. Чему равна степень окисления фосфора в фосфине РН3?
4. К каким типам оксидов относятся оксиды фосфора (III) и (V)?
5. Какие кислоты им соответствуют?
6. Перечислите реактивы на фосфат-ион?
7. Укажите эффекты качественных реакций на фосфат-ион?
Тестовые задания для самоконтроля:
1. Кислая соль, которая может быть образована гидроксидом железа (III) и ортофосфорной кислотой, – это:
А. FeHPO4
Б. Fe(H2PO4)3
В. FeHPO3
Г. [Fe(OH)2]3PO4
[Fe(OH)2]3PO4
2. Степень окисления фосфора в соединении, имеющем формулу H4P2O7:
А. +7
Б. +5
В. -3
Г. +3
3. В молекульном уравнении реакции FeCl3 + Na3PO4 →
сумма коэффициентов равна:
А. 6
Б. 5
В. 4
Г. 8
4. Ионному уравнению реакции 3Ca2+ + 2PO43 = Ca3(PO4)2 соответствует воздействие:
А. кальция с фосфорной кислотой
Б. оксида кальция с фосфорной кислотой
В. хлорида кальция с фосфатом калия
Г. гидроксида кальция с фосфорной кислотой
5. Реактивом на фосфат-ион является:
А. раствор хлороводородной кислоты
раствор хлороводородной кислоты
Б. раствор хлорида бария
В. раствор нитрата серебра
Г. раствор гидроксида аммония
6. Кислотные остатки одновалентны в солях:
А. гидрофосфат натрия
Б. гидроксохлорид алюминия
В. сульфид натрия
Г. карбонат бария
7. Кислую реакцию среды имеет раствор соли:
А. NH4Cl
Б. (NH4)2CO3
В. Na2HPO4
Г. KNO2
8. Заряд кислотного остатка равен (2 – ) в солях:
А. ортофосфат кальция
Б. дигидроортофосфат бария
В. сульфид аммония
Г. нитрат натрия
9. Раствор какого вещества окрашивает лакмус в синий цвет:
А. оксид фосфора (V)
Б. аммиак
В. оксид фосфора (III)
Г. хлорид аммония
10. Какая кислота соответствует оксиду фосфора (III):
А. H4P2O7
Б. H3PO4
H3PO4
В. HPO3
Г. H3PO3
11. Строение внешнего энергетического уровня3s23p5 соответствует атому элемента :
А. магний
Б. серы
В. фосфора
Г. хлора
12. Элемент с наиболее ярко выраженными неметаллическими
свойствами :
А. кремний
Б. магний
В. сера
Г. фосфор
13. Степень окисления фосфора в ряду веществ, формулы которых Са3Р2 – Р – Р2О3— Р2О5
А. повышается от 0 до +5
Б. повышается от –3 до +5
В. понижается от +6 до -2
Г. повышается от –4 до +4
14. Минимальная степень окисления фосфора в соединении
с формулой :
А. Р4
Б. РН3
РН3
В. Р2О3
Г. Н3РО4
15. Степень окисления фосфора в соединении, имеющем формулу H4P2O7
А. +7
Б. +3
В. +5
Г. –3
Ключевые понятия темы:
1.Фосфор образует три аллотропические модификации: белый, красный, черный.
2.Белый фосфор имеет молекулярную кристаллическую решетку
и формулу Р4.
3.Красный фосфор имеет вид темно-малинового порошка.
4.Черный фосфор получают нагреванием белого фосфора при 2000С и очень высоком давлении.
5. Р … 3s23p3 Степени окисления -3, 0, +3 +5.
6.Фосфин РН3 — бесцветный ядовитый газ с запахом гнилой рыбы. Он самовоспламеняется на воздухе.
Он самовоспламеняется на воздухе.
7.Оксид фосфора (III) Р2О3 — белое кристаллическое вещество, очень ядовитое.В воде растворяется с образованием фосфористой кислоты НЗРО3
8.Соли фосфористой кислоты НЗРО3 называются фосфитами;
9.Оксид фосфора (V) Р2O5 — белые гигроскопические кристаллы.
10. Оксиду фосфора (V) Р2O5 соответствуют три кислоты: метафосфорная кислота НРО3; ортофосфорная кислота НЗРО4; пирофосфорная кислота Н4Р2О7.
11. фосфорная кислота
НРО4− (NaH2PO4) − соли растворимы в воде
P2O5 H3PO4 HPO4 2−(Na2HPO4) − соли мало растворимы в воде
средней силы,
нелетучая PO43− (Na3PO4) − соли нерастворимы в воде,
кроме солей щелочных металлов
Домашнее задание:
ЛИТЕРАТУРА основная:
1. Э. Т. Оганесян, М. З. Книжник «Неорганическая химия», М., «Медицина», 2001 г., стр. . 261-268.
Э. Т. Оганесян, М. З. Книжник «Неорганическая химия», М., «Медицина», 2001 г., стр. . 261-268.
1. Пустовалова Л.М., Никанорова И.Е.Неорганическая химия. Ростов-на-Дону. Феникс. 2005. Стр. 230-232;249-262
3. Вопросы для самостоятельного изучения и конспектирования:
1. Биологическая роль фосфора.
2. Применение в медицине и народном хозяйстве фосфора
и его соединений.
4.. Конспект лекций
Литература дополнительная:
1. Ахметов Н.С. Общая и неорганическая химия. М.: Высшая школа, 2009.
2. Глинка Н.Л. Общая химия. КноРус, 2009.
3. Егоров А.С. и др. Химия. Пособие репетитор для поступающих в ВУЗы. Ростов-на-Дону. Феникс,2003.
4. Кузьменко Н.Е., Еремин В.В. Начала химии. Современный курс для поступающих в вузы. М.: Экзамен, 2002.
5.Хомченко Г.П. Химия для поступающих в вуз. М.: Новая Волна, 2007.
6.Аликберова Л. Занимательная химия. М., «Арт – пресс», 2002 г.
М., «Арт – пресс», 2002 г.
7. Врублевский А. И. Химия. 6000 новых тестов для старшеклассников и абитуриентов. Минск. ЧУП «Издательство Юнипресс», 2007
8.Габриелян О. С, Остроумов И. Г. Химия. Пособие для школьников старших классов и поступающих в ВУЗы. М., Дрофа, 2005.
9.Тамаров М. А. Неорганическая химия. М.: Медицина, Феникс, 2001.
10. Пугачева О. А. Методические рекомендации по самоподготовке к практическим и семинарским занятиям. /учебное пособие: Калуга, 2008.
11.Химия. Пособие-репетитор для поступающих в ВУЗы. Под редакцией профессора В. Н. Чернышова и доцента А. С. Егорова, Ростов-на-Дону, «Феникс», 1997г
ЛИТЕРАТУРА
1. Э.Т. Оганесян, М.З.Книжник «Неорганическая химия», М. Медицина
1981 г стр.
2. Химия. Пособие – репетитор для поступающих в ВУЗы. Под редакцией проф. З.Н. Чернышова и доц. А.С.Егорова, Ростов-на-Дону «Феникс», 1997г., стр.
3. М.М.Петров, Л.А.Михилев, Ю.Н.Кукушкин «Неорганическая химия», Ленинград. «Химия», 1981 г., стр.
«Химия», 1981 г., стр.
4. М.Э. Полиес, И.Н. Душечкина
«Аналитическая химия», М.»Медицина» 1994 г., стр.
5. М.Д. Машковский Лекарственные средства Харьков,Форсинг, 2006г.,
стр.
ПРИЛОЖЕНИЕ № 2
ВОПРОСЫ ДЛЯ АКТУАЛИЗАЦИИ ЗНАНИЙ:
1. Какое количество электронов содержит атом фосфора?
2. Чему равна высшая валентность фосфора? Почему?
3. Назовите высшую и низшую степени окисления фосфора?
4. Какую степень окисления проявляет фосфор в соединениях с водородом, кислородом?
5. Фосфор — это металл или неметалл?
6. Что такое аллотропия?
7. Какие из уже изученных элементов имеют аллотропические
модификации?
8. Какие аллотропические формы фосфора Вы знаете?
ПРИЛОЖЕНИЕ № 3
ВОПРОСЫ ДЛЯ ВЫЯВЛЕНИЯ УРОВНЯ ПЕРВИЧНОГО ЗАПОМИНАНИЯ.
1. Какие кислородные соединения образует фосфор?
2. Образует ли фосфор соединения с водородом?
3. Чему равна степень окисления фосфора в фосфине РН3?
Чему равна степень окисления фосфора в фосфине РН3?
4. К каким типам оксидов относятся оксиды фосфора (III) и (V)?
5. Какие кислоты им соответствуют?
6. Перечислите реактивы на фосфат-ион?
7. Укажите эффекты качественных реакций на фосфат-ион?
формула расчета, получение, физические и химические свойства
Фосфин — это ядовитый газ, который в чистом виде не имеет цвета и запаха. С химической точки зрения, является летучим водородным соединениям фосфора. В химии формула фосфина имеет вид — PH3. По своим свойствам имеет некоторые схожести с аммиаком. Вещество очень опасно, так как имеет высокую токсичность и склонность к самовоспламенению.
Получение
Самый хорошо изученный способ получения фосфина — это реакция взаимодействия белого фосфора с раствором сильной щелочи при нагревании. В данном случае фосфор диспропорционирует на метафосфат и фосфин. Побочными продуктами этой реакции является дифосфин (P2H4) и водород, поэтому выход данной реакции небольшой и составляет не более 40 %.
Образующийся дифосфин в реакционной среде вступает во взаимодействие со щелочью, в результате чего образуется фосфин и водород.
А полученный в этих реакциях гипофосфит, при взаимодействии со щелочью, переходит в фосфат с выделением водорода.
NaH2PO2 + 2NaOH = 2H2 + Na3PO4
После завершения всех реакций, в результате взаимодействия щелочи на фосфор образуется фосфин, водород и фосфат. Данный способ получения можно также провести со щелочными оксидами вместо щелочей. Этот опыт является очень красивым, так как образующийся дифосфин сразу же воспламеняется и сгорает в виде искр, образуя нечто похожее на фейерверк.
При воздействии воды или кислоты на фосфиды металлов также получается фосфин.
При термическом разложении фосфористой кислоты или ее восстановлении водородом в момент выделения также образуется фосфин.
Соли фосфония при разложении или в реакции с некоторыми веществами дают фосфин.
Физические свойства
Фосфин представляет собой бесцветный газ без запаха. Но технический фосфин (с некоторыми примесями) может иметь характерный неприятный запах, который описывают по-разному. Немного тяжелее воздуха, при температуре -87,42 °C сжижается, а при -133,8 °C становится твердым веществом. Такие низкие температуры кипения и плавления обусловлены довольно слабыми водородными связями. Вещество практически нерастворимо в воде, но при определенных условиях образует с водой неустойчивые гидраты. Хорошо растворим в этаноле и диэтиловом эфире. Плотность фосфина при нормальных условиях составляет 0,00153 г/см3.
Химические свойства
Как уже было сказано, химическая формула фосфина — PH3. Хоть фосфин и похож на аммиак, он имеет ряд отличий во взаимодействиях с другими веществами. Эти особенности обусловлены тем, что химические связи в фосфине (по формуле это становится ясно) ковалентные слабополярные. Они менее полярные, чем в аммиаке, и поэтому более прочные.
При сильном нагревании (примерно 450 °C) без доступа кислорода фосфин разлагается на простые вещества.
2PH3 → 2P + 3H2
При температуре свыше 100 °C PH3 самовоспламеняется, вступая в реакцию с кислородом воздуха. Температурный порог можно снизить ультрафиолетовым светом. По этой причине, выделяющийся на болотах фосфин, часто самовоспламеняется, вызывая появление так называемых «блуждающих огней».
PH3 + 2O2 → H3PO4
Но может происходить и простое горение. Тогда образуется фосфорный ангидрид и вода.
2PH3 + 4O2 → P2O5 + 3H2O
Как и аммиак, фосфин может образовывать соли, взаимодействуя с галогеноводородами.
PH3 + HI→ PH4I
PH3 + HCl→ PH4Cl
Исходя из формулы фосфина, можно сказать, что фосфор в нем имеет низшую степень окисления. По этой причине он является хорошим восстановителем.
PH3 + 2I2+ 2H2O → H3PO2 + 4HI
PH3 + 8HNO3→ H3PO4 + 8NO2 + 4H2O
Применение
Ввиду своей высокой токсичности, фосфин нашел применение в фумигации, т. е. уничтожении различного рода вредителей (насекомых, грызунов) при помощи газа. Для этих процедур существуют специальные устройства — машины-фумигаторы, с использованием которых распыляют газ в помещениях. Обычно фосфином или препаратами на его основе обрабатывают склады зерновых культур, готовых пищевых продуктов, мебели, а также библиотеки, заводские помещения, вагоны поездов и другой транспорт. Преимущество такой обработки в том, что фосфин даже в небольших концентрациях легко проникает в труднодоступные места и никак не взаимодействует с металлами, древесиной и тканью.
Помещение обрабатывают фосфином, в герметичном состоянии его держат в течение 5-7 суток. После этого не менее двух суток нужно осуществлять проветривание, иначе находится человеку в нем опасно. После этого фосфин не оставляет никаких следов даже на продуктах, зерне и других товарах.
После этого фосфин не оставляет никаких следов даже на продуктах, зерне и других товарах.
Еще фосфин используется в синтезе некоторых веществ, особенно органических. Также из него может получаться химически чистый фосфор, с использованием фосфина производят легирование полупроводников.
Токсикология
Фосфин крайне токсичное соединение. Он быстро проходит через дыхательные пути и взаимодействует со слизистыми оболочками организма. Это может вызвать нарушения работы нервной системы, а также обмена веществ в целом. Признаками отравления могут служить головокружение, тошнота, рвота, головная боль, усталость, иногда даже конвульсии. В тяжелых случаях отправления человек может потерять сознание или произойти остановка дыхания и сердцебиения. Предельно допустимая концентрация фосфина в воздухе — 0.1 мг/м3. Концентрация 10 мг/м3 сразу приводит к летальному исходу.
Первое, что необходимо сделать с пострадавшим от отравления фосфина, — вынести на свежий воздух и освободить от загрязненной одежды. Также рекомендуется окатить пострадавшего водой, чтобы быстрее убрать остатки токсичного газа. Стационарное лечение подразумевает использование кислородной маски, контроль сердечного ритма и состояния печени, лечение отека легких. За больным необходимо следить минимум 2-3 суток, даже если видимых признаков отравления уже нет. Некоторые симптомы могут проявляться лишь через несколько суток после контакта с фосфином.
Также рекомендуется окатить пострадавшего водой, чтобы быстрее убрать остатки токсичного газа. Стационарное лечение подразумевает использование кислородной маски, контроль сердечного ритма и состояния печени, лечение отека легких. За больным необходимо следить минимум 2-3 суток, даже если видимых признаков отравления уже нет. Некоторые симптомы могут проявляться лишь через несколько суток после контакта с фосфином.
Тема №7248 Характерные химические свойства простых веществ — неметаллов
Тема №7248
Характерные химические свойства простых веществ — неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
Элементы с неметаллическими свойствами находятся в IIIA—VIIA группах Периодической системы:
|
Период |
Группа |
|||||
|
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
|
|
1 |
|
|
|
|
H |
He |
|
2 |
B |
C |
N |
O |
F |
Ne |
|
3 |
|
Si |
P |
S |
Cl |
Ar |
|
4 |
|
|
As |
Se |
Br |
Kr |
|
5 |
|
|
|
Te |
I |
Xe |
|
6 |
|
|
|
|
At |
Rn |
У большинства неметаллов на внешнем электронном уровне находится от трех до семи электронов, у водорода — один электрон, у гелия — два электрона.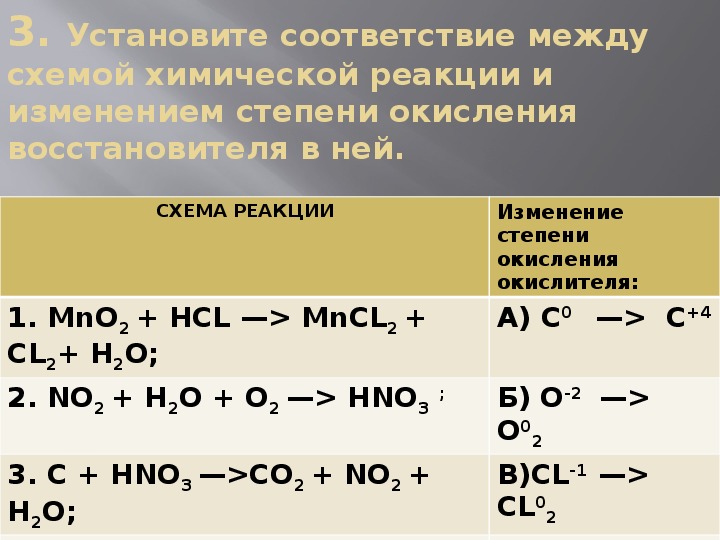 Атомы инертных газов имеют завершенный внешний электронный уровень: атом гелия содержит два электрона, остальные инертные газы — восемь электронов. Среди неметаллов водород Н и гелий Не относятся к s-элементам, остальные — к р-элементам.
Атомы инертных газов имеют завершенный внешний электронный уровень: атом гелия содержит два электрона, остальные инертные газы — восемь электронов. Среди неметаллов водород Н и гелий Не относятся к s-элементам, остальные — к р-элементам.
Характерной особенностью неметаллов является большее по сравнению с металлами число электронов на внешнем энергетическом уровне их атомов и высокие значения электроотрицательности. Это определяет их большую способность к присоединению электронов и проявлению высокой окислительной активности.
Другой характерной особенностью неметаллов является их стремление образовывать ковалентные связи с атомами других неметаллов. Поэтому атомы неметаллов в простых веществах и соединениях с другими неметаллами связаны ковалентными связями.
При нормальных условиях в газообразном состоянии находятся водород, азот, фтор, хлор и инертные газы. Бром — единственный жидкий неметалл, остальные неметаллы — твердые вещества. Атомы инертных газов не соединены в молекулы, двухатомные молекулы простых веществ образуют водород h3, азот N2, кислород О2и галогены: фтор F2, хлор Cl2, бром Br2, иод I2, астат At2.
Среди неметаллов распространено явление аллотропии. Аллотропные видоизменения, сильно отличающиеся по своим физическим свойствам, образуют кислород, углерод, кремний, сера, фосфор, бор и другие неметаллы.
Неметаллы сильно отличаются по своим химическим свойствам, однако обладают и рядом общих свойств. Так, элементы-неметаллы, кроме фтора, могут проявлять как окислительные, так и восстановительные свойства. Атомы самого электроотрицательного элемента — фтора — не способны отдавать электроны, поэтому он всегда проявляет только окислительные свойства. Наиболее сильными окислителями являются фтор, кислород и хлор, преимущественно восстановительные свойства проявляют водород, бор, углерод, кремний, фосфор, мышьяк и теллур. Окислительные и восстановительные свойства примерно в одинаковой мере проявляют азот, сера, йод.
В соединениях атомы неметаллов могут проявлять как положительные, так и отрицательные степени окисления, значения которых определяются положением неметалла в периодической системе элементов. Фтор является самым электроотрицательным элементом, его атомам до завершения внешнего электронного уровня не хватает одного электрона. Поэтому в сложных соединениях фтор может иметь только отрицательную степень окисления, равную —1.
Фтор является самым электроотрицательным элементом, его атомам до завершения внешнего электронного уровня не хватает одного электрона. Поэтому в сложных соединениях фтор может иметь только отрицательную степень окисления, равную —1.
Наиболее типичные степени окисления неметаллов в соединениях представлены в табл. 19.
Наиболее типичные степени окисления неметаллов
Таблица 19
|
Период |
Группа |
|||||
|
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
|
|
1 |
|
|
|
|
H |
He |
|
2 |
B -3, 0, +3 |
C -4, -2, 0, +2, +4 |
N -3, -2, -1, 0, +1, +2, +3, +4, +5 |
O -2, -1, 0, +2 |
F -1, 0 |
Ne 0 |
|
3 |
|
Si -4, -2, 0, +2, +4 |
P -3, 0, + 1, +3, +5 |
S -2, -1, 0, +2, +4, +6 |
Cl -1, 0, +1, +3, +5, +7 |
Ar 0 |
|
4 |
|
|
As -3, 0, + 1, +3, +5 |
Se -2, 0, +4, +6 |
Br -1, 0, + 1, +5, +7 |
Kr +2 |
|
5 |
|
|
|
Te 0, +4, +6 |
I -1, 0, + 1, +5, +7 |
Xe +2, +4,+6, +8 |
|
6 |
|
|
|
|
At -1, 0, + 1, +5, +7 |
Rn +2, +4,+6 |
Водород
Водород — химический элемент с порядковым номером 1. В периодической системе водород занимает особое место: подобно щелочным металлам водород обладает способностью отдавать один электрон, поэтому он может быть помещен в главную подгруппу I группы; однако, как и галогены, водород способен присоединять один электрон, поэтому его можно поместить в главную подгруппу VII группы. В соединениях водород всегда одновалентен. Для него характерны две степени окисления: + 1 и —1.
В периодической системе водород занимает особое место: подобно щелочным металлам водород обладает способностью отдавать один электрон, поэтому он может быть помещен в главную подгруппу I группы; однако, как и галогены, водород способен присоединять один электрон, поэтому его можно поместить в главную подгруппу VII группы. В соединениях водород всегда одновалентен. Для него характерны две степени окисления: + 1 и —1.
Водород является самым распространенным элементом во Вселенной. На Земле водород находится только в составе сложных веществ. В виде простого вещества водород практически не встречается.
Простое вещество водород представляет собой двухатомную молекулу Н2, в которой атомы связаны между собой ковалентной неполярной связью.
При обычных условиях водород — бесцветный, не имеющий запаха газ, почти не растворяется ни в каких растворителях, но хорошо растворимый в некоторых металлах, например, в никеле, платине и палладии. Водород — самый легкий газ, легче воздуха в 14,5 раз.
1) Взаимодействие с галогенами
При обычных условиях водород из-за большой прочности молекулы малоактивен. При обычной температуре водород реагирует лишь со фтором с образованием фтороводорода HF:
h3 + F2 = 2HF
С хлором водород реагирует только на свету, реакция протекает со взрывом. С бромом реакция протекает менее энергично, с йодом реакция обратима и не идет до конца даже при высоких температурах:
h3 + Cl2 = 2HC1 хлороводород
h3 + Br2 = 2HBr бромоводород
h3 + I2 < > 2HI йодоводород
2) Взаимодействие с кислородом
При нормальных условиях водород не реагирует с кислородом, при поджигании реакция протекает со взрывом:
2h3 + O2 = 2h3O
Водород горит в кислороде с выделением большого количества тепла, температура водородно-кислородного пламени достигает 2800 0С.
3) Взаимодействие с серой
При нагревании водород обратимо реагирует с серой с образованием сероводорода:
h3 + S <=» h3S
4) Взаимодействие с азотом
С азотом водород обратимо реагирует при высокой температуре и в присутствии катализатора (например, железа) с образованием аммиака Nh4:
3h3 + N2 <=> 2Nh4
5) Взаимодействие со сложными веществами (оксидами металлов и неметаллов)
При взаимодействии со сложными веществами водород проявляет восстановительные свойства, например, он восстанавливает многие металлы из их оксидов:
CuO + h3 1 Cu + h3O
Fe3O4 + 4h3 = 3Fe + 4h3O
Эти реакции используются в металлургии для получения металлов.
Важное значение имеет взаимодействие водорода с оксидом азота (II), используемое в очистительных системах при производстве азотной кислоты:
2NO + 2h3 = N2 + 2h3O
Смесь водорода с оксидом углерода (II) СО называется «синтез-газом». Синтез-газ широко используется в органическом синтезе, например, для получения метанола:
СО + 2Н2 ‘-—-«г > СН3ОН метанол
Сильным восстановителем является атомарный водород, который образуется из молекулярного в электрическом разряде в условиях низкого давления. Высокой восстановительной активностью обладает водород в момент выделения, образующийся при восстановлении металла кислотой.
6) Взаимодействие с активными металлами (окислительные
свойства)
При нагревании водород взаимодействует с активными металлами, образуя белые кристаллические вещества — гидриды металлов:
2Na + h3 = 2NaH Ca + h3 = Cah3
В этих реакциях водород проявляет окислительные свойства: атом водорода присоединяет электрон и превращается в отрицательно заряженный гидрид-ион Н-.
Галогены
Галогены — элементы главной подгруппы VII группы. К галогенам относятся фтор F, хлор Cl, бром Br, иод I и астат At.
Астат — редкий и радиоактивный элемент, его свойства плохо изучены. Фтор, хлор и бром чрезвычайно токсичны, являются отравляющими веществами.
Галогенам не хватает до устойчивой 8-электронной оболочки одного электрона. Присоединяя один электрон до завершения внешнего электронного уровня, галогены проявляют при этом окислительные свойства и превращаются в галогенид-ионы Hal.
Галогены проявляют очень высокую химическую активность, которая уменьшается в ряду F2 — Cl2 — Br2 — I2.
Наибольшей химической активностью обладает фтор. Это сильнейший окислитель, который окисляет практически все металлы и неметаллы. Многие реакции со фтором протекают со взрывом. Фтор реагирует даже с инертными газами, например:
F2 + Kr = KrF2
F2 + Xe = XeF2
2F2 + Xe = XeF4
1) Взаимодействие с металлами
Галогены взаимодействуют практически со всеми простыми веществами, наиболее энергично протекает реакция с металлами. + Q2 = CuCl2 хлорид меди (II)
2Fe + 3Cl2 = 2FeCl3 хлорид железа (III)
Са + Br2 = CaBr2 бромид кальция 2Fe + 3Br2 = 2FeBr3 бромид железа (III)
Fe + I2 = FeI2 йодид железа (II)
Реакция иода с алюминием начинается после добавления к реакционной смеси воды в качестве катализатора и протекает с выделением большого количества теплоты:
-> 2AlI3 йодид алюминия
и,р
2) Взаимодействие с водородом
При обычных условиях фтор реагирует с водородом в темноте со взрывом, взаимодействие с хлором протекает на свету, бром и йод реагируют только при нагревании, причем реакция с йодом обратима:
Н2 + F2 = 2BF фтороводород
h3 + Cl2 = 2HCl хлороводород
h3 + Br2 = 2HBr бромоводород
h3 + I2 < * 2HI йодоводород
Галогены в этой реакции проявляют окислительные свойства.
3) Взаимодействие с неметаллами
Единственный из всех галогенов фтор взаимодействует с кислородом:
O2 + F2 O2F2
Остальные галогены с кислородом непосредственно не взаимодействуют.
Хлор и бром менее активны, чем фтор, но реагируют со многими неметаллами, кроме углерода, азота и кислорода.
В атмосфере хлора и в жидком броме самопроизвольно загорается белый фосфор:
2P + 3Cl2 = 2PCl3 хлорид фосфора (III)
2P + 5Cl2 (избыток) = 2PCl5 хлорид фосфора (V)
2P + 3Br2 = 2PBr3 бромид фосфора (III)
Фтор, хлор и йод взаимодействуют с серой с образованием галогенидов серы:
3F2 + S = SF6 фторид серы (VI)
Cl2 + 2S = S2Cl2 хлорид серы (I)
Br2 + 2S = S2Br2 бромид серы (I)
4) Вытеснение свободных неметаллов
Ослабление окислительной активности галогенов от фтора к йоду проявляется в том, что хлор вытесняет бром Br2 и йод I2 из бромидов и йодидов, а бром — только йод I2 из йодидов:
Cl2 + 2KBr = 2KCl + Br2 Cl2 + 2KI = 2KCl + I2 Br2 + 2KI = 2KBr+ I2
Бром способен вытеснять серу S из сероводорода и сульфидов:
Br2 + h3S = 2HBr + Si
Хлор, как более сильный по сравнению с бромом окислитель, не вытесняет серу из сероводорода, а окисляет его до серной кислоты:
4Cl2 + h3S + 4h3O = h3SO4 + 8HCl
5) Взаимодействие с водой
Фтор бурно реагирует с водой, вытесняя из нее кислород О2:
2F2 + 2h3O = 4HF + O2
Остальные галогены довольно плохо растворяются в воде и диспро-порционируют в ней с образованием двух кислот — галогеноводородной и кислородсодержащей:
Hal20 + h3O <=> HHal- + HHal+O
6) Взаимодействие со щелочами
В растворах щелочей галогены подвергаются диспропорционированию, образуя галогенид ионы Hal- и соли кислородсодержащих кислот:
Cl2 + 2KOH = KCl + KClO + Н2О (на холоде) гипохлорит калия
3CI2 + 6KOH = 5KCl + KCIO3 + ЗН2О (при нагревании) хлорат калия
ВГ2 + 2KOH = KBr + KBrO + Н2О (на холоде) гипобромит калия
ЗВГ2 + 6KOH = 5KBr + КВГО3 + ЗН2О (при нагревании) хлорат калия
При пропускании хлора через суспензию гидроксида кальция получают «хлорную известь»:
2Cl2 + 2Са(0^ = СаС^ + Са(CЮ)2 + 2^О
хлорная известь
Йод взаимодействует со щелочами с образованием йодида и йодата:
3I2 + 6KOH = 5К + KIO3 + 3Н2О
йодат
калия
Гипойодит-ион IO- в растворах не существует.
При быстром пропускании фтора через 2%-й раствор щелочи получается дифторид кислорода:
2F2 + 2NaOH = OF2 + 2NaF + h3O
7) Восстановительные свойства галогенов
В некоторых реакциях хлор, бром и йод могут проявлять восстановительные свойства. Так, фтор может окислять их до фторидов, в которых хлор, бром и йод имеют положительную степень окисления:
F2 + Cl2 = 2ClF фторид хлора (I)
F2 + I2 = 2IF фторид йода (I)
F2 + I2 = 2IF фторид йода (I)
Хлор окисляет в водных растворах бром Вг2 и йод I2 до бромноватой и йодноватой кислот:
5Cl2 + Br2 + 6h3O = 2HBrO3 + 10HCl
бромноватая
кислота
5Cl2 + I2 + 6h3O = 2HIO3 + 10HC1
йодноватая
кислота
В отличие от остальных галогенов, йод взаимодействует с концентрированной азотной кислотой, которая окисляет его до йодноватой кислоты HIO3:
3I2 + 10HNO3 (конц.) = 6HIO3 + 10NO + 2h3O
8) Взаимодействие с органическими веществами
Хлор и бром широко используют в органическом синтезе. Ch3C1-Ch3C1
Ch3C1-Ch3C1
СбНб + 3C12 СбНбС1б
Кислород
Кислород находится во II периоде в главной подгруппе VI группы Периодической системы элементов. Электронная конфигурация атома кислорода в невозбужденном состоянии 1s22s22p4. По электроотрицательности кислород уступает только фтору. До завершения внешнего электронного уровня атому кислорода не хватает двух электронов, поэтому наиболее типичная степень окисления кислорода в соединениях равна -2. Только в соединении со фтором — фториде кислорода OF2 — кислород проявляет положительную степень окисления, равную +2.
По распространенности на Земле кислород занимает первое место. В виде простого вещества кислород находится в воздухе (21% по объему), в связанном состоянии входит в состав воды, минералов, многих органических веществ. Многие процессы в природе (гниение, ржавление, дыхание) протекают при участии кислорода.
Кислород образует две аллотропных модификации — кислород О2 и озон О3. Химическая активность озона значительно выше, чем кислорода.
Кислород О2 — бесцветный газ, не имеет запаха, плохо растворим в воде. Химическая связь между атомами кислорода в молекуле О2 — ковалентная неполярная.
Кислород отличает высокая реакционная способность, он окисляет многие вещества уже при комнатной температуре. При нагревании, освещении или в присутствии катализатора реакции с кислородом протекают очень бурно и сопровождаются выделением большого количества тепла.
♦ Горение — взаимодействие кислорода с веществами, при которых
выделяется теплота и свет.
Особенно сильным окислителем является жидкий кислород: пропитанная им вата при поджигании мгновенно сгорает. Некоторые летучие органические вещества самопроизвольно воспламеняются на расстоянии нескольких метров от открытого сосуда с жидким кислородом.
Кислород образует соединения со всеми химическими элементами, кроме гелия, неона и аргона. С большинством элементов он взаимодействует непосредственно.
1) Взаимодействие c металлами
При комнатной температуре кислород окисляет щелочные и щелочно-земельные металлы. Литий и кальций при взаимодействии с кислородом образуют оксиды, натрий — пероксид, калий, рубидий и цезий — суперпероксиды (надпероксиды) МО2; при горении бария образуется смесь оксида ВаО и пероксида ВаО2, например:
Литий и кальций при взаимодействии с кислородом образуют оксиды, натрий — пероксид, калий, рубидий и цезий — суперпероксиды (надпероксиды) МО2; при горении бария образуется смесь оксида ВаО и пероксида ВаО2, например:
4Li + O2 = 2Li2O-2 оксид лития 2Са + О2 = 2СаО-2 оксид кальция 2Ва + О2 = 2ВаО-2 оксид бария Ва + О2 = ВаО2-1 пероксид бария 2Na + O2 = Na2O2-1 пероксид натрия K + O2 = KO2-1/2 надпероксид калия
При нагревании кислород реагирует практически со всеми остальными металлами, кроме золота, образуя оксиды, например:
4Al + 3O2 = 2Al2O3 2Mg + O2 = 2MgO
3Fe + 2O2 = Fe3O4 (Fe3O4 — смешанный оксид Fe+2O-Fe2+3O3)
2) Взаимодействие с неметаллами
Кислород взаимодействует практически со всеми простыми веществами-неметаллами, кроме хлора, брома, йода и инертных газов. При этом образуется оксид этого неметалла.
Сера взаимодействует с кислородом с образованием оксида серы (IV):
S + O2 = SO2
Фосфор горит в кислороде с образованием оксида фосфора (V):
4Р + 5О2 = 2Р2О5
Углерод в зависимости от условий реагирует с кислородом с образованием оксида углерода (IV) СО2 или оксида углерода (II) СО:
С + О2 = СО2 (в избытке кислорода)
2С + О2 = 2СО (в недостатке кислорода)
Кислород образует взрывоопасные смеси с водородом. Смесь двух объемов водорода с одним объемом кислорода называется «гремучим газом». Продуктом взаимодействия водорода с кислородом является вода:
Смесь двух объемов водорода с одним объемом кислорода называется «гремучим газом». Продуктом взаимодействия водорода с кислородом является вода:
2Н2 + О2 = 2Н2О
Только при взаимодействии со фтором кислород проявляет восстановительные свойства:
O20 + F20 <=> O2+1F2-1
3) Взаимодействие с некоторыми сложными веществами
Кислород взаимодействует со многими сложными веществами. Так, при обжиге сульфидов металлов образуются оксиды металлов и оксид серы (IV):
2CuS + ЗО2 = 2CuO + 2SO2 2ZnS + 3O2 = 2ZnO + 2SO2 4Fe+2S + 7O2 = 2Fe+3O3 + 4SO2
При обжиге сульфида ртути (II) образуется не оксид металла, а металлическая ртуть в виде паров:
HgS + O2 = Hg + SO2
При полном сгорании органических веществ образуются углекислый газ и вода:
СН4 + 2О2 = СО2 + 2Н2О С2Н5ОН + 3О2 = 2СО2 + 3Н2О
Азотсодержащие органические вещества сгорают с выделением азота:
4Ch4Nh3 + 9O2 = 4CO2 + 10h3O + 2N2
Сера
Сера — элемент VI группы главной подгруппы III периода. Электронная конфигурация внешнего уровня атома серы в невозбужденном состоянии 3s23p4. На внешнем энергетическом уровне атома серы содержится 6 электронов, 2 из которых неспаренные. По сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому сера при взаимодействии с кислородом проявляет восстановительные свойства.
Электронная конфигурация внешнего уровня атома серы в невозбужденном состоянии 3s23p4. На внешнем энергетическом уровне атома серы содержится 6 электронов, 2 из которых неспаренные. По сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому сера при взаимодействии с кислородом проявляет восстановительные свойства.
В реакциях сера может проявлять как окислительные, так и восстановительные свойства. По отношению к менее электроотрицательным элементам (металлы, водород, фосфор, углерод) сера проявляет окислительные свойства и в реакциях с образованными ими простыми веществами приобретает степень окисления —2. Проявляя восстановительные свойства, сера образует соединения со степенями окисления +2, +4, +6. Для серы характерны также реакции диспропорционирования.
При комнатной температуре сера вступает в реакции только с ртутью. С повышением температуры активность серы значительно повышается. При нагревании сера непосредственно реагирует со многими простыми веществами, за исключением инертных газов, азота, селена, теллура, золота, платины, иридия и йода. Сульфиды азота и золота получены косвенным путем.
Сульфиды азота и золота получены косвенным путем.
Сера-окислитель
1) Взаимодействие с металлами
В результате взаимодействия серы с металлами образуются сульфиды:
Hg + S = HgS (при комнатной температуре)
Cu + S = CuS Fe + S = FeS 2Al + 3S = Al2S3
2) Взаимодействие с водородом
Расплавленная сера обратимо взаимодействует с водородом:
Н2 + S <=> h3S
3) Взаимодействие с фосфором и углеродом
При нагревании без доступа воздуха сера реагирует с фосфором и углеродом, проявляя окислительные свойства:
2P + 3S = P2S3 2S + C = CS2
Сера-восстановитель
4) Взаимодействие с кислородом
Сера сгорает в кислороде с образованием оксида серы (IV):
S + O2 = SO2
Оксид серы (VI) получается в результате каталитического окисления оксида серы (IV) кислородом:
2SO2 + O2 <=» 2SO3
5) Взаимодействие с галогенами (кроме йода)
В атмосфере фтора сера воспламеняется с образованием фторида серы (VI) SF6:
S + 3F2 = SF6
Хлор взаимодействует с серой с образованием дихлорида серы (I) S2Cl2:
2S + Cl2 = S2Cl2
При дальнейшем хлорировании может быть получен хлорид серы (II) SCl2:
S2Cl2 + Cl2 = 2SCl2
При взаимодействии с жидким бромом сера образует неустойчивое соединение бромид серы (I) S2Br2:
2S + Br2 = S2Br2
Как уже отмечалось, с йодом сера не взаимодействует.
6) Взаимодействие с концентрированными азотной и серной кислотами
При нагревании с концентрированной азотной кислотой сера окисляется до степени окисления +6 с образованием серной кислоты:
S + 2HNO3 = 2NO f + h3SO4 (возможно образование NO2)
При взаимодействии с концентрированной серной кислотой сера окисляется до степени окислении+4, образуя SO2:
S + 2h3SO4 (конц.) = 3SO2f + 2h3O
7) Реакция диспропорционирования
В горячих концентрированных растворах щелочей сера диспропор-ционирует с образованием сульфидов и сульфитов:
3S0 + 6KOH = K2S+4O3 + 2K2S-2 + 3h3O
Азот
Азот — элемент V группы главной подгруппы II периода. Электронная конфигурация внешнего уровня атома азота 1s22s22p3. Атом азота на внешнем уровне содержит пять электронов: два спаренных s-электрона и три неспаренных р-электрона. В соединениях азот проявляет степени окисления от —3 до +5.
Большая часть азота находится в атмосфере Земли в виде простого вещества N2. Азот входит в состав селитр: чилийской NaNO3 и индийской KNO3. Кроме того, азот содержат в своем составе все белки.
Азот входит в состав селитр: чилийской NaNO3 и индийской KNO3. Кроме того, азот содержат в своем составе все белки.
При обычных условиях азот — газ, без цвета и запаха, плохо растворяется в воде. Газообразный азот состоит из двухатомных молекул. Атомы азота в молекуле N2 связаны между собой прочной тройной связью N=N.
Аллотропных видоизменений азот не образует.
Из-за наличия прочной тройной связи молекулярный азот малоактивен, а соединения азота термически малоустойчивы и относительно легко разлагаются при нагревании.
В химических реакциях азот может проявлять как окислительные, так и восстановительные свойства.
Азот-окислитель
1) Взаимодействие с металлами
При обычных условиях молекулярный азот реагирует только с литием с образованием нитрида лития Li3N:
6Li + N2 = 2Li3N
Для образования нитрида других металлов (бериллия, магния, алюминия, щелочно-земельных) требуется нагревание:
3Mg + N2 i Mg3N2 2Al + N2 = 2AlN 3Ca + N2 = Ca3N2
Нитриды активных металлов представляют собой ионные соединения, которые гидролизуются водой с образованием аммиака, например:
Ca3N2 + 6h3O = 3Ca(OH)2 + 2Nh4
Азот может также образовывать нитриды при взаимодействии с неметаллами, например, при температуре около 1000 0С азот реагирует с кремнием с образованием нитрида кремния (IV):
2N2 + 3Si = Si3N4
2) Взаимодействие с водородом
Реакция с водородом протекает обратимо при высоких температуре и давлении в присутствии катализатора — металлического железа:
3h3 + N2 <=> 2Nh4
Азот-восстановитель
3) Взаимодействие со фтором и кислородом
Восстановительные свойства азот проявляет в реакциях со фтором и кислородом. Эти реакции идут при температуре выше 1000 0С или в электрическом разряде:
Эти реакции идут при температуре выше 1000 0С или в электрическом разряде:
N2 + 3F2 = 2NF3 фторид азота (III)
N2 + O2 = 2NO оксид азота (II)
Азот непосредственно не взаимодействует с галогенами и серой, но галогениды и сульфиды могут быть получены косвенным путем. С водой, кислотами и щелочами азот не взаимодействует.
Фосфор
Фосфор — химический элемент V группы главной подгруппы III периода Периодической системы. Электронная конфигурация внешнего электронного уровня атома фосфора в невозбужденном состоянии 3s23p3. Характерные степени окисления фосфора в соединениях —3, +3, +5. Наиболее устойчивой является степень окисления +5.
Химическая активность фосфора значительно выше, чем у азота, поэтому в свободном состоянии в природе фосфор не встречается. Фосфор находится в земной коре в основном в виде фосфатов, входящих в состав апатитов.
В отличие от азота, фосфор образует несколько аллотропных видоизменений: белый, красный, черный фосфор. Белый фосфор состоит из молекул Р4 и имеет молекулярное строение. Белый фосфор имеет чесночный запах, в воде не растворяется, но растворяется в сероуглероде CS2 и бензоле. Белый фосфор чрезвычайно ядовит. Белый фосфор постепенно переходит в другую модификацию — красный фосфор. При нагревании белого фосфора под высоким давлением получают черный фосфор. Красный и черный фосфор имеют атомную структуру. В воде и органических растворителях они не растворяются, в отличие от белого фосфора не токсичны.
Белый фосфор состоит из молекул Р4 и имеет молекулярное строение. Белый фосфор имеет чесночный запах, в воде не растворяется, но растворяется в сероуглероде CS2 и бензоле. Белый фосфор чрезвычайно ядовит. Белый фосфор постепенно переходит в другую модификацию — красный фосфор. При нагревании белого фосфора под высоким давлением получают черный фосфор. Красный и черный фосфор имеют атомную структуру. В воде и органических растворителях они не растворяются, в отличие от белого фосфора не токсичны.
Химические свойства аллотропных модификаций фосфора различны. Наибольшей химической активностью обладает белый фосфор. Белый фосфор на воздухе светится в темноте вследствие окисления, самовоспламеняется при трении и ударе.
В химических реакциях фосфор может проявлять как окислительные, так и восстановительные свойства. Окислительные свойства выражены у фосфора слабее, чем у азота, и проявляются при взаимодействии фосфора с металлами.
1) Взаимодействие с простыми веществами
Фосфор проявляет восстановительные свойства в реакциях с кислородом, галогенами и серой. Фосфор легко окисляется кислородом, образуя в недостатке кислорода оксид фосфора (III), а в избытке — оксид фосфора (V):
Фосфор легко окисляется кислородом, образуя в недостатке кислорода оксид фосфора (III), а в избытке — оксид фосфора (V):
4P + 3O2 = 2P2O3 оксид фосфора (III)
4P + 5O2 = 2P2O5 оксид фосфора (V)
В реакциях с галогенами и серой фосфор так же, как и с кислородом, образует соединения, в которых проявляет степень окисления +3 и +5, причем последние образуются в избытке галогенов и серы, например:
2P + 3S = P2S3 сульфид серы (III)
2P + 5S (избыток) = P2S5 сульфид серы (V)
2P + 3Cl2 = 2PCl3 хлорид фосфора (III)
2P + 5Cl2 (избыток) = 2PCl5 хлорид фосфора (V)
Йодом фосфор окисляется только до PI3:
2P + 3I2 = 2PI3 йодид фосфора (III)
При нагревании с металлами фосфор проявляет окислительные свойства и образует фосфиды, в которых имеет степень окисления —3:
2P + 3Ca = Ca3P2
Фосфиды гидролизуются водой с образованием фосфина РН3:
Ca3P2 + 6h3O = 3Ca(OH)2 + 2Ph4f
В отличие от азота, фосфор непосредственно не взаимодействует с водородом.
2) Взаимодействие с сильными окислителями
Фосфор окисляется концентрированными азотной и серной кислотами до ортофосфорной кислоты:
Р + 5HNO3 = h4PO4 + 5NO2 f + h3O 2P + 5h3SO4 = 2h4PO4 + 5SO2 + 2h3O
Фосфор может окисляться также бертолетовой солью KClO3. Эта реакция происходит при поджигании спичек:
6P + 5KClO3 = 5KCl + 3P2O5
3) Реакции диспропорционирования
Белый фосфор может вступать в реакции диспропорционирования с водой и с горячими растворами щелочей. При взаимодействии с водой образуется фосфин РН3 и фосфорноватистая кислота Н3РО2, а при взаимодействии со щелочами — фосфин и соли фосфорноватистой кислоты гипофосфиты:
4Р0 + 6Н2О = Р-3Н3 + 3Н3Р+1О2 фосфорноватистая кислота
4Р0 + 3KOH + 3Н2О = Р-3Н3 + 3КН2Р+1О2 гипофосфит калия
В результате диспропорционирования фосфор приобретает степень окисления —3 в фосфине РН3 и +1 в фосфорноватистой кислоте Н3РО2 и гипофосфите КН2РО2.
Углерод
Углерод находится в IV группе главной подгруппы во II периоде. Электронная конфигурация атома углерода в невозбужденном состоянии 1s22s22p2. В соединениях углерод проявляет устойчивые степени окисления, равные —4, +2 и +4.
Электронная конфигурация атома углерода в невозбужденном состоянии 1s22s22p2. В соединениях углерод проявляет устойчивые степени окисления, равные —4, +2 и +4.
Углерод образует несколько аллотропных видоизменений: алмаз и графит имеют атомную кристаллическую решетку, карбин образует цепочечные полимеры, фуллерены являются молекулярными веществами.
Древесный уголь и сажу называют аморфным углеродом. Аморфный углерод имеет неупорядоченную структуру, состоящую из мельчайших разрушенных слоев графита. После специальной обработки аморфного углерода образуется активированный уголь, обладающий адсорбционной способностью.
В природе углерод встречается в виде простых веществ — алмаза и графита, он входит в состав углекислого газа, карбонатов (доломита СаМ§(С03)2, мрамора СаСО3) природного газа, нефти, каменного угля.
При обычных условиях углерод химически инертен, при нагревании его активность увеличивается. Самой активной формой является аморфный углерод, менее активен графит, самый инертный — алмаз. , например:
, например:
С + 2F2 = CF4 фторид углерода (IV)
При нагревании углерода с серой образуется сульфид углерода (IV)
CS2:
С + 2S = CS2
2) Взаимодействие с оксидами металлов
Углерод способен восстанавливать многие металлы из их оксидов:
2ZnO + C = 2Zn + CO2
При взаимодействии углерода с оксидами щелочно-земельных металлов и алюминия образуются карбиды:
СаО + 3С = СаС2 + СО f
2Al2O3 +9C = Al4C3 + 6CO f
3) Взаимодействие с оксидами неметаллов
При пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород:
C + h3O = CO + h3
При нагревании углерода с углекислым газом образуется оксид углерода (II):
C + ТО2 = 2CO
Нагревание углерода с оксидом кремния (IV) в электрических печах используется для получения кремния:
2С + SiO2 = Si + 2CO f
4) Взаимодействие с концентрированными серной и азотной кислотами
При нагревании углерод окисляется концентрированными серной и азотной кислотами до оксида углерода (IV):
C + 2h3SO4 = CO2f + 2SO2 f + 2h3O
C + 4HNO3 = CO2f + 4NO2f + 2h3O
Углерод-окислитель
5) Взаимодействие с металлами
При высокой температуре углерод реагирует с металлами, образуя карбиды:
2C + Ca = CaC2 3С + 4Al = Al4C3 Карбиды подвергаются гидролизу:
СаС2 + 2h3O = Ca(OH)2 + C2h3 f
ацетилен
Al4C3 + 12h3O = 4Al(OH)3 + 3Ch5 f
метан
6) Взаимодействие с неметаллами: водородом, кремнием
В присутствии никелевого катализатора углерод взаимодействует с водородом, образуя метан Ch5:
C0 + 2h30 = C-4h5+1
При взаимодействии с кремнием при высокой температуре углерод образует карбид кремния SiC, называемый также карборундом:
С + Si = SiC
Карбид кремния имеет кристаллическую решетку, подобную решетке алмаза, и по твердости лишь незначительно уступает ему.
Кремний
Кремний находится в главной подгруппе IV группы Периодической системы. Электронная конфигурация атома кремния в невозбужденном состоянии 1s22s22p63s23p2. В соединениях кремний проявляет степени окисления —4, +2 и +4.
Кремний является одним из самых распространенных элементов. Он входит в состав различных минералов, составляющих основу земной коры. К их числу относятся кварц SiO2, различные силикаты и алюмосиликаты.
Простое вещество кремний — твердое хрупкое вещество серого цвета, образует атомную кристаллическую решетку, подобную решетке алмаза. Обладает полупроводниковыми свойствами, что обусловливает его широкое использование в промышленности.
В химическом отношении кремний малоактивен. В реакциях он может проявлять как окислительные, так и восстановительные свойства, но восстановительные выражены у него сильнее.
Кремний-восстановитель
1) Взаимодействие с неметаллами
При обычных условиях кремний довольно инертен, при комнатной температуре непосредственно взаимодействует только с фтором:
Si + 2F2 = SiF4 фторид кремния (IV)
С хлором реагирует только при нагревании до 400—600 0С:
Si + 2Cl2 = SiCl4 хлорид кремния (IV)
Галогениды кремния в водных растворах гидролизуются:
SiF4 + 3h3O = h3SiO3 + 4HF f SiCl4 + 3h3O = h3SiO3 + 4HCl f
Измельченный кремний при нагревании до 400—600 0С реагирует с кислородом с образованием оксида кремния (IV):
Si + O2 = SiO2
При очень высокой температуре кремний реагирует с углеродом с образованием карбида кремния SiC, называемого карборундом:
Si + C = SiC
При температуре около 1000 0С кремний реагирует с азотом с образованием нитрида кремния (IV):
3Si + 2N2 = Si3N4
С водородом кремний непосредственно не взаимодействует.
2) Взаимодействие с водой
Кремний вытесняет водород из перегретого пара, окисляясь до оксида кремния (IV):
Si + 2h3O = SiO2 + 2h3 f
3) Взаимодействие с кислотами
Кремний устойчив к действию кислот, он взаимодействует только с фтороводородом, а также со смесью плавиковой и азотной кислот:
Si + 4HF = SiF4f + 2h3 f
3Si + 18HF + 4HNO3 = 3h3[SiF6] + 4NO f + 8h3O
4) Взаимодействие со щелочами
Кремний энергично взаимодействует со щелочами с выделением водорода и образованием силиката:
Si + 2NaOH + h3O = Na2SiO3 + h3 f
Кремний-окислитель
5) Взаимодействие с металлами
Окислительные свойства для кремния менее характерны, но они проявляются в реакциях с металлами, при этом образует силициды:
2Ca + Si = Ca2Si 2Mg + Si = Mg2Si
Флициды легко гидролизуются с образованием силана Sih5 — соединения, подобного метану СН4:
Ca2Si + 4HCl = 2CaCl2 + Sih5 f
Mg2Si + 4HCl = 2MgCl2 + Sih5 f
Силан представляет собой бесцветный газ, самовоспламеняющийся на воздухе, сгорающий при этом с образованием оксида кремния (IV) и воды:
Sih5 + 2O2 = SiO2 + 2h3O
Степень окисления фосфора максимальна в фосфине класса 11 химии CBSE
Подсказка: Мы должны помнить, что в отличие от других элементов фосфор имеет особое свойство, когда речь идет о степени окисления. Мы знаем, что это элемент с атомным номером $15$ и валентностью $5$. Этот элемент, когда образует соединение с другими элементами, может образовывать соединения, связываясь с различными состояниями валентности.
Мы знаем, что это элемент с атомным номером $15$ и валентностью $5$. Этот элемент, когда образует соединение с другими элементами, может образовывать соединения, связываясь с различными состояниями валентности. Полный пошаговый ответ:
Мы знаем, что фосфор имеет валентность числа $5$.Но у него есть отчетливое свойство расширенной валентности. Число валентности $5$ означает, что он может либо потерять $5$ электронов, либо получить $3$ электронов, чтобы удовлетворить свою валентность (чтобы завершить октет). Следовательно, его валентность колеблется от $-3$ до $+5$.
Рассмотрим фосфин $P{H_3}$ .
В этой химической формуле один атом фосфора связан с $3$ атомами водорода. Мы знаем, что атомы водорода имеют степень окисления $+1$. Таким образом, для $3$ атомов водорода степень окисления $+3$.Для удовлетворения этой степени окисления фосфор проявляет окисление на $-3$, то есть принимает $3$ электронов от водорода. Следовательно, в фосфине степень окисления фосфора $—3$.
Рассмотрим дифосфин ${P_2}{H_4}$.
В этой химической формуле два атома фосфора связаны с четырьмя атомами водорода. Степень окисления водорода $+1$, следовательно, для 4 атомов водорода это $+4$. Теперь есть два связанных атома фосфора, таким образом, два атома будут иметь общую валентность $ — 4$ в равной степени как степень окисления -2 для каждого фосфора, чтобы удовлетворить валентность атомов водорода.Так, в дифосфине степень окисления фосфора $-2$.
Рассмотрим метафосфорную кислоту $HP{O_3}$
В этой химической формуле один атом фосфора связан с одним атомом водорода и тремя атомами кислорода. Мы знаем, что степень окисления водорода $+1$, а кислорода $-2$. Так, для водорода степень окисления равна 1, а для трех атомов кислорода степень окисления равна $-6$. Таким образом, $1 — 6 = — 5$. Теперь этой валентности должен удовлетворять один атом фосфора, следовательно, фосфор будет демонстрировать нам рассматриваемую степень окисления $+5$.
Рассмотрим фосфорную кислоту ${H_3}P{O_3}$.
В этой химической формуле один атом фосфора связан с тремя атомами водорода и тремя атомами кислорода. Следовательно, степень окисления водорода $ + 3$, а кислорода $-6$, всего $-3$. Следовательно, чтобы удовлетворить эту валентность, атом фосфора будет проявлять степень окисления $ + 3$.
Таким образом, из вышеприведенной оценки видно, что высшим состоянием фосфора является $ + 5$, которое находится в метафосфорной кислоте $HP{O_3}$ .
Следовательно, правильный ответ на вопрос — вариант C.
Примечание:
Мы должны помнить, что фосфор — это элемент, который не существует в естественном состоянии в атмосфере Земли, потому что он очень реактивен. Он встречается в двух разных типах: красный фосфор и белый фосфор. Фосфор необходим для жизни, поскольку он входит в состав ДНК, РНК и АТФ в живых организмах. Он также используется в промышленности в моющих средствах и пестицидах. Он легко образует связи с другими элементами, так как он очень реакционноспособен, а также потому, что он обладает особым свойством расширенной степени окисления от $-3$ до $+5$.
Фосфорорганические соединения — wikidoc
Обзор
Фосфорорганические соединения представляют собой химические соединения, содержащие углерод-фосфорные связи. Фосфорорганическая химия — соответствующая наука, изучающая свойства и реакционную способность фосфорорганических соединений. Фосфор делит группу 15 в таблице Менделеева с азотом и соединениями фосфора, а соединения азота имеют много общего. [1] [2]
Фосфор может принимать степени окисления -3, -1, 1, 3 и 5.В химической литературе очень часто соединения со степенью окисления +3 или -3 группируются вместе как имеющие степень окисления (III) независимо от знака. В официальной и более описательной номенклатуре соединения фосфора идентифицируются по их координационному числу δ и их валентности λ. В этой системе фосфин представляет собой соединение δ 3 λ 3 .
Фосфаны и фосфины
Исходным соединением фосфана является PH 3 , называемое фосфином в США и Великобритании и фосфаном в других странах. [3] Замена одного или нескольких протонов органическим остатком дает Ph4-xR x , органофосфин или органофосфан, опять же в зависимости от страны. Атом фосфора в фосфанах/фосфинах имеет формальную степень окисления -3 (δ 3 λ 3 ) и является фосфорным аналогом простых аминов.
[3] Замена одного или нескольких протонов органическим остатком дает Ph4-xR x , органофосфин или органофосфан, опять же в зависимости от страны. Атом фосфора в фосфанах/фосфинах имеет формальную степень окисления -3 (δ 3 λ 3 ) и является фосфорным аналогом простых аминов.
Часто используемым органическим фосфином является трифенилфосфин. Как и амины, фосфины имеют треугольную пирамидальную молекулярную геометрию, хотя и с большими углами.Валентный угол С-Р-С составляет 98,6° для триметилфосфина, увеличиваясь до 109,7° при замене метильных групп на трет- -бутильных групп. Обычно размер этих лигандов описывается параметром, называемым углом конуса.
Барьер для инверсии также намного выше, чем у аминов, для процесса, подобного инверсии азота, поэтому фосфины с тремя разными заместителями могут проявлять оптическую изомерию.
Основность фосфинов меньше, чем у соответствующих аминов, например, сам ион фосфония имеет pKa -14 по сравнению с 9.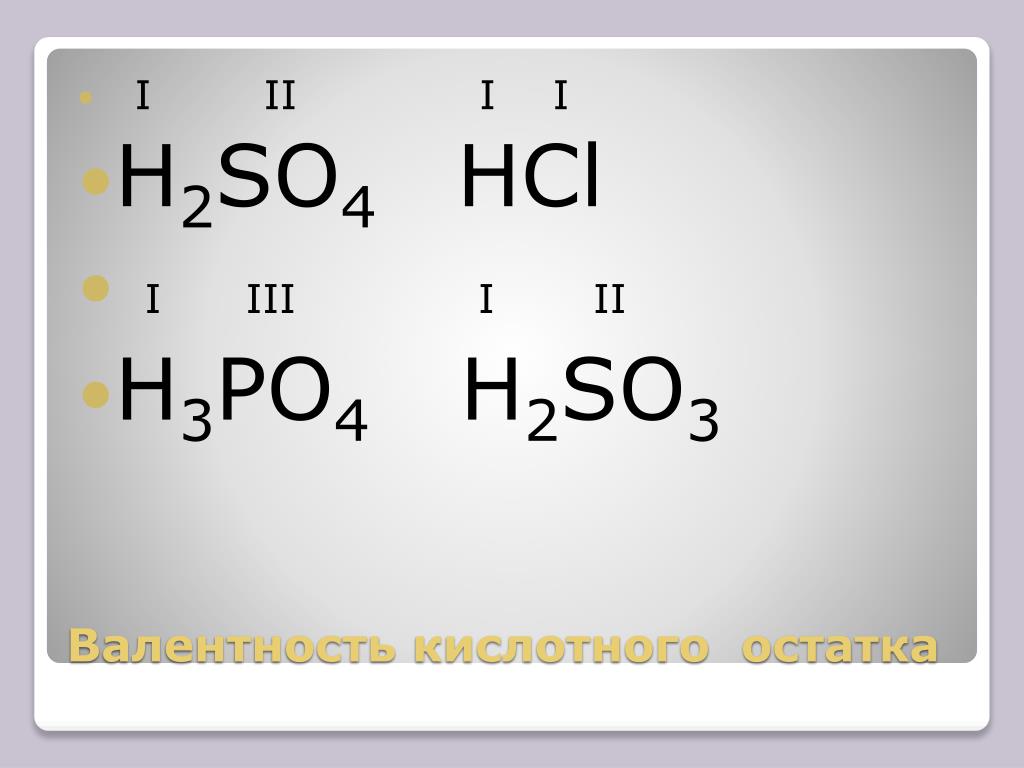 21 для иона аммония; триметилфосфоний имеет p K a 8,65 по сравнению с 9,76 у триметиламина; и трифенилфосфоний (p K a 11.2) является менее основным, чем трифениламмоний (p K a 19).
21 для иона аммония; триметилфосфоний имеет p K a 8,65 по сравнению с 9,76 у триметиламина; и трифенилфосфоний (p K a 11.2) является менее основным, чем трифениламмоний (p K a 19).
Амины и фосфины имеют неподеленную пару электронов, но с разницей. В то время как неподеленная пара в амине делит свои электроны при каждой возможности делокализации, например, в пиридине, атом фосфора в аналогичной конфигурации этого не делает.По этой причине фосфорный эквивалент пиррола, называемый фосфолом, вовсе не является ароматическим.
Реакционная способность фосфинов соответствует реакционной способности аминов в отношении нуклеофильности при образовании солей фосфония общей структуры PR 4 + X − . Это свойство используется в реакции Аппеля, превращающей спирты в алкилгалогениды.
Отличие в реакционной способности аминов заключается в легкости окисления фосфинов до оксидов фосфинов.
Синтез
Синтетические продукты для фосфинов:
- Радикальное присоединение фосфинов к алкенам с ДАК или органическими пероксидами с образованием антимарковниковских аддуктов.
- Нуклеофильное присоединение фосфина и фосфинов к алкинам в присутствии основания. Вторичные фосфины реагируют с электронодефицитными алкинами, такими как фенилцианоацетилен без основания.
- Органическое восстановление оксидов фосфина, например, хлорсиланом.
Реакции
Основными типами реакции фосфинов являются:
- Фосфины являются восстановителями в реакции Штаудингера, превращающей азиды в амины, и в реакции Мицунобу, превращающей спирты в сложные эфиры.В этих процессах фосфин окисляется до оксида фосфина. Также было обнаружено, что фосфины восстанавливают активированные карбонильные группы, например, восстановление α-кетоэфира до α-гидроксиэфира на схеме 2 . [5] В предложенном механизме реакции первый протон заимствован из метильной группы триметилфосфина (трифенилфосфин не вступает в реакцию).

- При модификации подходящими заместителями, как в некоторых диазафосфоленах ( схема 3 ), полярность связи PH может быть фактически инвертирована (см.: умполунг), и полученный гидрид фосфина может восстанавливать карбонильную группу, как в примере бензофенона еще одним способом. [6]
- Мультидентатные фосфины, такие как BINAP, являются важными лигандами в металлоорганической химии.
Фосфаны
Первичные фосфаны недостаточно используются в химии из-за их общей неустойчивости по отношению к кислороду. В одном исследовании [7] сообщается о нескольких новых стабильных на воздухе ароматических первичных фосфанах, полученных органическим восстановлением соответствующего фосфоната:
Стабильность объясняется конъюгацией между ароматическим кольцом и неподеленной парой фосфора.
Оксиды фосфина
Оксиды фосфина (обозначение δ 3 λ 3 ) имеют общую структуру R 3 P=O с формальной степенью окисления −1. Фосфины образуют водородные связи, поэтому многие фосфины растворимы в воде. Связь P = O очень полярна с дипольным моментом 4,51 D для трифенилфосфина.
Фосфины образуют водородные связи, поэтому многие фосфины растворимы в воде. Связь P = O очень полярна с дипольным моментом 4,51 D для трифенилфосфина.
Природа двойной связи фосфора с кислородом является предметом споров. Пятивалентный фосфор, как и азот, несовместим с правилом октета.В более старой литературе связь представлена как дательная связь, как оксид амина. Преобладает мнение о полной двойной связи с обратной связью между заполненной парой электронов кислорода и пустой d-орбиталью фосфора (отсутствующей в азоте). Проблема в том, что связь P=O не реагирует как любая двойная связь C=C, поскольку реакции присоединения отсутствуют, а участие d-орбитали фосфора в связывании не поддерживается in silico. Альтернативные теории отдают предпочтение ионной связи P + -O — , что само по себе должно объяснить короткую длину связи.Молекулярно-орбитальная теория предполагает, что короткая длина связи объясняется передачей электронов неподеленной пары от кислорода разрыхляющим фосфор-углеродным связям. Это предложение поддерживается расчетами ab initio и получило консенсус в химическом сообществе.
Это предложение поддерживается расчетами ab initio и получило консенсус в химическом сообществе.
Фосфины легко окисляются до фосфиноксидов, что видно на примере направленного синтеза фосфакраун, фосфорного аналога азакраун [8] , где невозможно выделить сам фосфин. [9]
Фосфонаты
Фосфонаты имеют общую структуру R−P(=O)(OR) 2 . В реакции Хорнера-Уодсворта-Эммонса и гомологизации Зейферта-Гилберта фосфонаты используются в качестве стабилизированных карбанионов в реакциях с карбонильными соединениями. Фосфонаты имеют множество технических применений, а бисфосфонаты относятся к классу лекарств.
Фосфиты и сложные эфиры фосфорной кислоты
Сложные эфиры фосфитов или фосфиты имеют общую структуру P(OR) 3 со степенью окисления +3.Фосфиты используются в реакциях Перкова и Арбусова. Фосфатные эфиры с общей структурой P(=O)(OR) 3 и степенью окисления +5 имеют большое технологическое значение в качестве антипиренов и пластификаторов. Без связи Р-С эти соединения технически не являются фосфорорганическими соединениями.
Без связи Р-С эти соединения технически не являются фосфорорганическими соединениями.
Фосфораны
Фосфораны имеют степень окисления -5 (δ 5 λ 5 ) с исходным соединением нестабильный фосфоран PH 5 или λ 5 -фосфан (лямбда).Илиды фосфора представляют собой ненасыщенные фосфораны, используемые в реакции Виттига.
Фосфор множественные связи
Многие соединения существуют с кратными углерод-фосфорными связями (P=C), такими как фосфаалкены (R 2 C::PR) и фосфаалкины (RC:::PR). В соединении фосфорина один атом углерода у бензола замещен фосфором. Реакционную способность фосфаалкенов часто сравнивают с реакционной способностью алкенов, а не с иминами. Причина в том, что ВЗМО фосфаалкенов — это не неподеленная пара фосфора (как в иминах — неподеленная пара амина), а двойная связь.Поэтому, как и алкены, фосфаалкены участвуют в реакциях Виттига, реакциях Петерсона, перегруппировках Коупа и реакциях Дильса-Альдера.
Первый фосфаалкен был синтезирован в 1974 году Беккером как кето-енольная таутомерия, похожая на перегруппировку Брука:
, где R = метил или фенил, а tms означает триметилсилил.
В том же году Гарольд Крото спектроскопически установил, что термолиз Me 2 PH дает CH 2 = PMe.
Общий метод синтеза фосфаалкенов заключается в 1,2-элиминировании подходящих прекурсоров, инициированном термически или основанием, таким как DBU, DABCO или триэтиламин:
Метод Беккера используется для синтеза фосфорной подвески поли(п-фениленвинилена): [10]
Дифосфены представляют собой соединения, содержащие двойные связи фосфора P=P.Фосфазены имеют двойную связь P=N.
См. также
Шаблон:ChemicalBondsToCarbon
Внешние ссылки
Каталожные номера
- ↑ Диллон, К. Б.; Мэти, Ф .; Никсон, Дж. Ф. Фосфор. Копия под копирку ; Джон Вили и сыновья, 1997. ISBN 0-471-97360-2
- ↑ Quin, LD Руководство по фосфорорганической химии ; Джон Вили и сыновья, 2000.
 ISBN 0-471-31824-8
ISBN 0-471-31824-8
- ↑ Золотая книга: Ссылка
- ↑ Арбузова С.Н.; Гусарова, Н. К.; Трофимов Б. А. «Нуклеофильные и свободнорадикальные присоединения фосфинов и фосфинхалькогенидов к алкенам и алкинам». Аркивок 2006 , часть v, 12–36 (EL-1761AR). Статья
- ↑ Чжан, В.; Ши, М. «Восстановление активированных карбонильных групп алкилфосфинами: образование α-гидроксиэфиров и кетонов». Хим. коммун. 2006 , 1218–1220. дои: 10.1039/b516467b
- ↑ Берк, С.; Гудат, Д.; Нигер, М.; Дю Мон, В.-В. « P -Замещенные водородом 1,3,2-диазафосфолены: молекулярные гидриды». Дж. Ам. хим. соц. 2006 , 128 , 3946–3955. дои: 10.1021/ja057827j
- ↑ Укрощение функциональной группы: создание стабильных на воздухе хиральных первичных фосфанов Рэйчел М. Хайни, Ли Дж. Хайэм, Хельге Мюллер-Бунц, Деклан Г. Гилхиани Angewandte Chemie International Edition, том 45, выпуск 43, страницы 7248–7251 2006 doi:10.
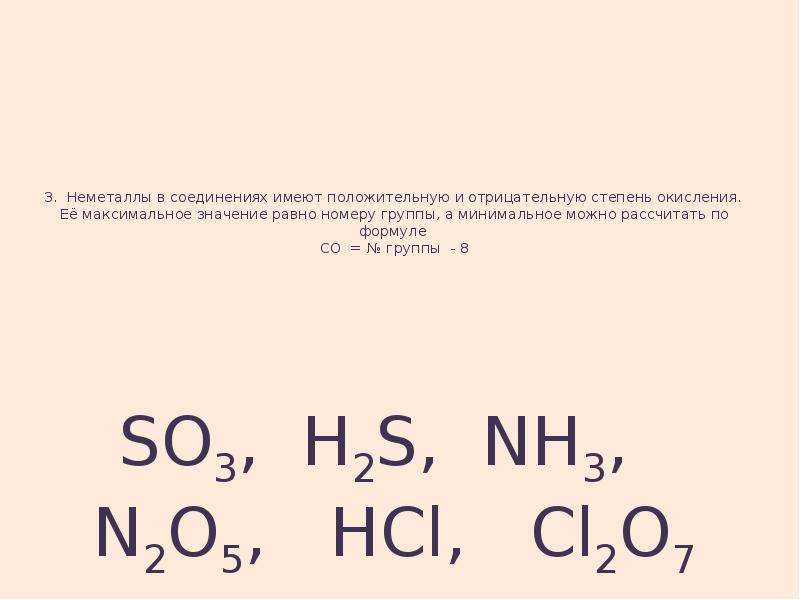 1002/anie.200602143
1002/anie.200602143
- ↑ Эдвардс, П.Г.; Хей Р.; Ли, Д.; Ньюман, П. Д. «Матричный синтез 1,4,7-трифосфациклононанов». Варенье. хим. соц. 2006 , 128 , 3818–3830. дои: 10.1021/ja0578956
- ↑ На этапе 1 дифосфиноэтан координируется с ферроценом, содержащим дополнительные лиганды монооксида углерода и ацетонитрильный лиганд. Следующим этапом является гидрофосфинирование тривинилфосфином с последующим алкилированием этилбромидом и гидрированием водородом над палладием на угле. На последнем этапе шаблон железа удаляется бромом, но окисление фосфиновых групп неизбежно.
- ↑ Фосфор Копии PPV: сопряженные полимеры и молекулы, состоящие из чередующихся фениленовых и фосфалкеновых фрагментов Винсент А.Райт, Брайан О. Патрик, Селин Шнайдер и Дерек П. Гейтс J. Am. хим. соц.; 2006 ; 128(27), стр. 8836-8844; (Статья) doi:10.1021/ja060816l
Шаблон: Исходники WikiDoc
Взаимодействие фосфина с металлами с высокой степенью окисления
Фосфины и родственные лиганды (PE 3 ) являются одними из наиболее универсальных и хорошо изученных в арсенале химиков. Подавляющее большинство исследований этих лигандов было сосредоточено на их взаимодействии с низковалентными переходными металлами.На основании этих исследований в настоящее время широко признано, что существуют два основных электронных взаимодействия между лигандом PE 3 и низковалентным металлом: σ-донорная связь между металлом и фосфором и π-акцепторное взаимодействие, при котором фосфор принимает плотность электронов из металла. π-акцепторное взаимодействие представляет собой форму отрицательной гиперконъюгации, которая становится более значимой для электроноакцепторных групп E, например, в фосфитах, P(OR) 3 . В этом исследовании изучалась связь между высоковалентным переходным металлом, хромом (VI), и множеством различных лигандов PE 3 .Кислотность по Льюису фрагмента NCr(N i Pr 2 ) 2 + была количественно определена с использованием метода Гутмана, и было обнаружено, что число акцепторов равно 100, аналогично сильно кислотному по Льюису SbCl 5 .
Подавляющее большинство исследований этих лигандов было сосредоточено на их взаимодействии с низковалентными переходными металлами.На основании этих исследований в настоящее время широко признано, что существуют два основных электронных взаимодействия между лигандом PE 3 и низковалентным металлом: σ-донорная связь между металлом и фосфором и π-акцепторное взаимодействие, при котором фосфор принимает плотность электронов из металла. π-акцепторное взаимодействие представляет собой форму отрицательной гиперконъюгации, которая становится более значимой для электроноакцепторных групп E, например, в фосфитах, P(OR) 3 . В этом исследовании изучалась связь между высоковалентным переходным металлом, хромом (VI), и множеством различных лигандов PE 3 .Кислотность по Льюису фрагмента NCr(N i Pr 2 ) 2 + была количественно определена с использованием метода Гутмана, и было обнаружено, что число акцепторов равно 100, аналогично сильно кислотному по Льюису SbCl 5 . С помощью расчетов (DFT, Natural Resonance Theory) установлено, что для некоторых фосфинов важны редко обсуждаемые резонансные формы на центрах металлов d 0 . Эти альтернативные резонансные формы включали отрицательные гиперконъюгативные формы, которые появляются, когда арильные или гетероатомные заместители помещаются на атом фосфора, что приводит к увеличению электронной плотности в кислом металлическом центре Льюиса.Однако были предприняты попытки экспериментального исследования следствий результатов расчетов с системой [NCr(N i Pr 2 ) 2 PE 3 ] + X − из-за экспериментальных трудностей с ионное спаривание и эффекты растворителя, экспериментальная количественная оценка донорной способности различных серий фосфинов была невозможна. Однако триалкилфосфины соответствовали простой двухпараметрической модели, которая показала, что в системе чрезвычайно важны как стерические, так и электронные эффекты.
С помощью расчетов (DFT, Natural Resonance Theory) установлено, что для некоторых фосфинов важны редко обсуждаемые резонансные формы на центрах металлов d 0 . Эти альтернативные резонансные формы включали отрицательные гиперконъюгативные формы, которые появляются, когда арильные или гетероатомные заместители помещаются на атом фосфора, что приводит к увеличению электронной плотности в кислом металлическом центре Льюиса.Однако были предприняты попытки экспериментального исследования следствий результатов расчетов с системой [NCr(N i Pr 2 ) 2 PE 3 ] + X − из-за экспериментальных трудностей с ионное спаривание и эффекты растворителя, экспериментальная количественная оценка донорной способности различных серий фосфинов была невозможна. Однако триалкилфосфины соответствовали простой двухпараметрической модели, которая показала, что в системе чрезвычайно важны как стерические, так и электронные эффекты. Хотя мы не могли достоверно количественно оценить это наблюдение, было отмечено, что арил- и гетероатомзамещенные PE 3 , P(OEt) 3 и PMePh 2 , например, имеют более быстрое вращение амида при более низких температурах, чем многие из триалкилфосфинов. . Несмотря на экспериментальные сложности, эти исследования предполагают, что связывание с высоковалентными металлами может быть более сложным, чем простое донорство неподеленных пар, и кажется, что несколько резонансных форм могут иметь значение, когда металлы d 0 связываются с арил- и гетероатомзамещенными фосфинами.
Хотя мы не могли достоверно количественно оценить это наблюдение, было отмечено, что арил- и гетероатомзамещенные PE 3 , P(OEt) 3 и PMePh 2 , например, имеют более быстрое вращение амида при более низких температурах, чем многие из триалкилфосфинов. . Несмотря на экспериментальные сложности, эти исследования предполагают, что связывание с высоковалентными металлами может быть более сложным, чем простое донорство неподеленных пар, и кажется, что несколько резонансных форм могут иметь значение, когда металлы d 0 связываются с арил- и гетероатомзамещенными фосфинами.
Какова степень окисления P в PF3? — Ответы на все
Какова степень окисления P в PF3?
3
Из чего состоит PF3?
Трифторид фосфора
Какова степень окисления фосфора в po4 3?
+5
Какова степень окисления фосфора?
3-
В каком соединении р находится в высшей степени окисления?
Степени окисления фосфора в фосфине, дифосфине, метафосфорной кислоте и фосфористой кислоте равны −3, −2, +5 и +3 соответственно. Следовательно, она максимальна в метафосфорной кислоте.
Следовательно, она максимальна в метафосфорной кислоте.
Какова степень окисления фосфора в h3po2?
+2
Является ли h3po2 перекисью?
Поскольку ClO4- не является ни пероксидом, ни супероксидом, степень окисления каждого атома кислорода равна –2.
Какова степень окисления Р в БК h3po2 2 ?
+1
Что означают степени окисления?
Степень окисления, также называемая степенью окисления, общее количество электронов, которое атом либо приобретает, либо теряет, чтобы образовать химическую связь с другим атомом.- это 4 , + 6 и + 7 соответственно.
Какова степень окисления Cr в Cr2O72?
х = +5. 18. В бихромат-ионе степень окисления хрома равна +6. Сумма степеней окисления Cr2O72-, многоатомного иона, равна -2, заряду иона.
Является ли cr2o72 восстановителем?
Fe 2+ — восстановитель, Cr 2O 7 2- — окислитель.
Является ли Na восстановителем?
Например, среди Na, Cr, Cu+ и Cl- Na является самым сильным восстановителем, а Cl- — самым слабым. Обычные восстановители включают металлы калий, кальций, барий, натрий и магний, а также соединения, содержащие ион H-, такие как NaH, LiH, LiAlh5 и Cah3.
Обычные восстановители включают металлы калий, кальций, барий, натрий и магний, а также соединения, содержащие ион H-, такие как NaH, LiH, LiAlh5 и Cah3.
%PDF-1.4
%
1 0 объект
>
эндообъект
5 0 объект
/Заголовок
/Автор
/Режиссер
/Ключевые слова
/CreationDate (D:20211220101844-00’00’)
/ModDate (D:20100413131836-04’00’)
/СПДФ (1112)
>>
эндообъект
2 0 объект
>
эндообъект
3 0 объект
>
эндообъект
4 0 объект
>
эндообъект
6 0 объект
>
эндообъект
7 0 объект
>
эндообъект
8 0 объект
>
эндообъект
9 0 объект
>
эндообъект
10 0 объект
>
эндообъект
11 0 объект
>
эндообъект
12 0 объект
>
эндообъект
13 0 объект
>
эндообъект
14 0 объект
>
эндообъект
15 0 объект
>
эндообъект
16 0 объект
>
эндообъект
17 0 объект
>
эндообъект
18 0 объект
>
эндообъект
19 0 объект
>
эндообъект
20 0 объект
>
эндообъект
21 0 объект
>
эндообъект
22 0 объект
>
эндообъект
23 0 объект
>
эндообъект
24 0 объект
>
эндообъект
25 0 объект
>
эндообъект
26 0 объект
>
эндообъект
27 0 объект
>
эндообъект
28 0 объект
>
эндообъект
29 0 объект
>
эндообъект
30 0 объект
>
эндообъект
31 0 объект
>
эндообъект
32 0 объект
>
эндообъект
33 0 объект
>
эндообъект
34 0 объект
>
эндообъект
35 0 объект
>
эндообъект
36 0 объект
>
эндообъект
37 0 объект
>
эндообъект
38 0 объект
>
эндообъект
39 0 объект
>
эндообъект
40 0 объект
>
эндообъект
41 0 объект
>
эндообъект
42 0 объект
>
эндообъект
43 0 объект
>
эндообъект
44 0 объект
>
эндообъект
45 0 объект
>
эндообъект
46 0 объект
>
эндообъект
47 0 объект
>
эндообъект
48 0 объект
>
эндообъект
49 0 объект
>
эндообъект
50 0 объект
>
эндообъект
51 0 объект
>
эндообъект
52 0 объект
>
эндообъект
53 0 объект
>
эндообъект
54 0 объект
>
эндообъект
55 0 объект
>
эндообъект
56 0 объект
>
эндообъект
57 0 объект
>
эндообъект
58 0 объект
>
эндообъект
59 0 объект
>
эндообъект
60 0 объект
>
эндообъект
61 0 объект
>
эндообъект
62 0 объект
>
эндообъект
63 0 объект
>
эндообъект
64 0 объект
>
эндообъект
65 0 объект
>
эндообъект
66 0 объект
>
эндообъект
67 0 объект
>
эндообъект
68 0 объект
>
эндообъект
69 0 объект
>
эндообъект
70 0 объект
>
эндообъект
71 0 объект
>
эндообъект
72 0 объект
>
эндообъект
73 0 объект
>
эндообъект
74 0 объект
>
эндообъект
75 0 объект
>
эндообъект
76 0 объект
>
/ProcSet [/PDF /Text /ImageC /ImageB /ImageI]
>>
эндообъект
77 0 объект
>
ручей
xڝXɎ7+&Y\A [Zr )ZX$Ć0ͭX»oSrSeeb/eNࣛ^dt
&!O/?c1v5Ƨ Roqw]8l+dcR_oD 6&1*&K,():FZ,m*c’lE4(A#Dǽ(?lv5s1Ų#z?&4:ٻPU7*FH?wU+Z@~y >| U@C`Tͱ`DĈ} Ya%^˯gQ,NNHzO. R6%SQiS18˼D|&x,
FrZ xb
R6%SQiS18˼D|&x,
FrZ xb
[Решено] Три важные степени окисления фосфора:
Концепция:
- Фосфор является элементом группы 15 или группы V A .
- Имеет внешнюю электронную конфигурацию ns 2 np 3 . 90–100 Фосфор, в отличие от азота, существует во многих формах, таких как красный фосфор, белый фосфор и т. д., каждая из которых имеет различную структуру решетки.
- Фосфор в основном существует как P 4 и представляет собой тетраэдрическую молекулу, в которой каждый атом фосфора связан с другим атомом фосфора одинарными ковалентными связями.
- Это делает фосфор гораздо более реакционноспособным, чем азот, поскольку одинарные связи гораздо легче разорвать.
- Разрыв связи PP требует гораздо меньше энергии.
- Это делает фосфор весьма реактивным по своей природе.

Объяснение:
- Элемент t P имеет пять электронов на самой внешней оболочке , и ему не хватает трех электронов для завершения своего октета.
- Один случай может быть таким, что P может принять три электрона от других элементов и быть анионом P 3-, , что непросто, учитывая энергию энтальпии приращения электронов.
- Таким образом, они образуют в основном ковалентные соединения, разделяя три электрона в большинстве случаев, а P 3- образуются в очень редких случаях.
- Поскольку у фосфора есть вакантная 3d орбиталь, которая может принимать электроны, он может расширять свой октет и иногда проявляет ковалентность 5 в таких соединениях, как PCl 5 .
- В PCl 5 степень окисления P равна +5 , в этом случае в связывании принимают участие все 5 валентных электронов.

- В PCl 3 степень окисления P равна +3.
- В P 2 O 5 также степень окисления P +5.
- Фосфор показывает степень окисления -3 в таких соединениях, как фосфин, PH 3 .
Следовательно, три важные степени окисления фосфора: -3, +3 и +5.
Межзвездный синтез оксокислот фосфора.
Инфракрасная спектроскопия. K (дополнительные таблицы 1 и 2)
25 .Эти полосы включают валентные моды одинарных и двойных связей фосфор–кислород [ν(P–O) (800–950 см –1 ), ν(P=O) (1140–1300 см –1 )], форма деформации функциональной группы OPOH [δ(O=P–OH) (1550–1710 см –1 )] и фрагмента P–OH [ν(O–H) (2170 и 2700 см –1 ) ). Эти данные свидетельствуют о том, что функциональные группы, связанные с оксокислотами фосфора, являются результатом воздействия на льды таких низких температур, как 5 K. Эксперименты с 18 O-мечеными компонентами льда (H 2 18 O и C 18 O 2 ) соответствуют изотопическим сдвигам, определенным для мод ν(P–O) и ν(P=O) с красным смещением на ~30 см −1 26,27 .Следовательно, инфракрасный анализ показывает наличие функциональных групп [P–O, P=O и O=P–OH], присутствующих в оксокислотах фосфора; однако, учитывая, что фундаментальные и, следовательно, поглощения функциональных оксокислот, таких как фосфоновая и фосфорная кислоты, попадают в один и тот же диапазон, инфракрасная спектроскопия не позволяет идентифицировать ни отдельные оксокислоты, ни их изомеры. Другими словами, функциональные группы не являются уникальными для конкретных оксокислот фосфора и, следовательно, не идентифицируют какую-либо конкретную молекулу.Поэтому альтернативные аналитические методы имеют решающее значение.
Эксперименты с 18 O-мечеными компонентами льда (H 2 18 O и C 18 O 2 ) соответствуют изотопическим сдвигам, определенным для мод ν(P–O) и ν(P=O) с красным смещением на ~30 см −1 26,27 .Следовательно, инфракрасный анализ показывает наличие функциональных групп [P–O, P=O и O=P–OH], присутствующих в оксокислотах фосфора; однако, учитывая, что фундаментальные и, следовательно, поглощения функциональных оксокислот, таких как фосфоновая и фосфорная кислоты, попадают в один и тот же диапазон, инфракрасная спектроскопия не позволяет идентифицировать ни отдельные оксокислоты, ни их изомеры. Другими словами, функциональные группы не являются уникальными для конкретных оксокислот фосфора и, следовательно, не идентифицируют какую-либо конкретную молекулу.Поэтому альтернативные аналитические методы имеют решающее значение. PI-ReTOF-MS
Для исследования отдельных молекулярных частиц мы использовали времяпролетную масс-спектрометрию фотоионизационного отражения (PI-ReTOF-MS) во время отжига облученных льдов.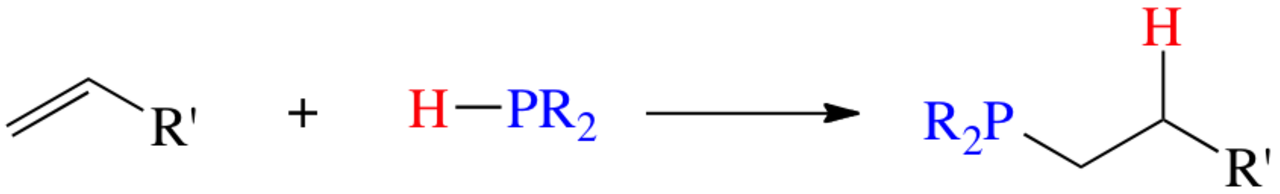 Этот метод представляет собой уникальный подход к селективной идентификации молекул газовой фазы по изомерам после фотоионизации на основе их различных энергий ионизации 28 . Здесь продукты возгонки фотоионизировались в отдельных экспериментах с 10.86 и 9,93 эВ, чтобы выяснить природу синтезированного изомера (ов) оксокислоты. С учетом адиабатических энергий ионизации (IE) оксокислот (H 3 PO x ; x = 1–4) (таблица 1) энергия фотона 10,86 эВ выше IE каждой оксокислоты; следовательно, в случае образования и возгонки все оксокислоты могут быть ионизированы при этой энергии фотоионизации. Использование PI-ReTOF-MS потребовало меченных изотопами реагентов H 2 18 O и C 18 O 2 , чтобы различать продукты, образующиеся при одинаковых массах.Фосфиновая кислота и фосфорноватистая кислота (H 3 PO 2 ) вместе с дифосфином (P 2 H 4 ) имеют молекулярную массу 66 а.
Этот метод представляет собой уникальный подход к селективной идентификации молекул газовой фазы по изомерам после фотоионизации на основе их различных энергий ионизации 28 . Здесь продукты возгонки фотоионизировались в отдельных экспериментах с 10.86 и 9,93 эВ, чтобы выяснить природу синтезированного изомера (ов) оксокислоты. С учетом адиабатических энергий ионизации (IE) оксокислот (H 3 PO x ; x = 1–4) (таблица 1) энергия фотона 10,86 эВ выше IE каждой оксокислоты; следовательно, в случае образования и возгонки все оксокислоты могут быть ионизированы при этой энергии фотоионизации. Использование PI-ReTOF-MS потребовало меченных изотопами реагентов H 2 18 O и C 18 O 2 , чтобы различать продукты, образующиеся при одинаковых массах.Фосфиновая кислота и фосфорноватистая кислота (H 3 PO 2 ) вместе с дифосфином (P 2 H 4 ) имеют молекулярную массу 66 а. е.м.; с другой стороны, 18 O-замещенная фосфиновая кислота и фосфорноватистая кислота (H 3 P 18 O 2 ) сдвигают массу на 4–70 а.е.м., таким образом отличая эти кислоты от дифосфина. При энергии фотоионизации 10,86 эВ профили температурно-программированной десорбции (ТПД) показывают, что H 3 P 18 O и H 3 P 18 O 2 оксокислоты, которые связаны с сигналом на 9006 m/z = 52 и 70 соответственно образуются как в системах РН 3 ‒H 2 18 O, так и в системах PH 3 ‒C 18 O 2 (рис.1). При увеличении тока облучения от 100 нА до 1000–5000 нА количество ионов при m/z = 52 (H 3 P 18 O + ) уменьшается примерно в восемь раз в PH . 3 ‒H 2 18 Система О; одновременно появляется сигнал на m/z = 70 (H 3 P 18 O 2 + ), который отсутствует при 100 нА.
е.м.; с другой стороны, 18 O-замещенная фосфиновая кислота и фосфорноватистая кислота (H 3 P 18 O 2 ) сдвигают массу на 4–70 а.е.м., таким образом отличая эти кислоты от дифосфина. При энергии фотоионизации 10,86 эВ профили температурно-программированной десорбции (ТПД) показывают, что H 3 P 18 O и H 3 P 18 O 2 оксокислоты, которые связаны с сигналом на 9006 m/z = 52 и 70 соответственно образуются как в системах РН 3 ‒H 2 18 O, так и в системах PH 3 ‒C 18 O 2 (рис.1). При увеличении тока облучения от 100 нА до 1000–5000 нА количество ионов при m/z = 52 (H 3 P 18 O + ) уменьшается примерно в восемь раз в PH . 3 ‒H 2 18 Система О; одновременно появляется сигнал на m/z = 70 (H 3 P 18 O 2 + ), который отсутствует при 100 нА. Это открытие может свидетельствовать о том, что фосфиновая/гипофосфористая кислота (H 3 P 18 O 2 ) образуется из оксида фосфина (H 3 P 18 O), вероятно, в результате реакции с атомарным кислородом.Анализ систем PH 3 ‒C 18 O 2 подтверждает этот вывод: фосфиновая/гипофосфорная кислота (H 3 P 18 O 2 ; 70≀am) 1000 и 5000 нА. С другой стороны, PI-ReTOF-MS не удалось обнаружить фосфор/фосфоновую кислоту (H 3 P 18 O 3 ; P( 18 OH) 3 /HP 18 O( 18 OH) 2 ) или фосфорной кислоты (H 3 P 18 O 4 ) из-за их низкой летучести, что ограничивает их сублимацию с субстрата.
Это открытие может свидетельствовать о том, что фосфиновая/гипофосфористая кислота (H 3 P 18 O 2 ) образуется из оксида фосфина (H 3 P 18 O), вероятно, в результате реакции с атомарным кислородом.Анализ систем PH 3 ‒C 18 O 2 подтверждает этот вывод: фосфиновая/гипофосфорная кислота (H 3 P 18 O 2 ; 70≀am) 1000 и 5000 нА. С другой стороны, PI-ReTOF-MS не удалось обнаружить фосфор/фосфоновую кислоту (H 3 P 18 O 3 ; P( 18 OH) 3 /HP 18 O( 18 OH) 2 ) или фосфорной кислоты (H 3 P 18 O 4 ) из-за их низкой летучести, что ограничивает их сублимацию с субстрата.
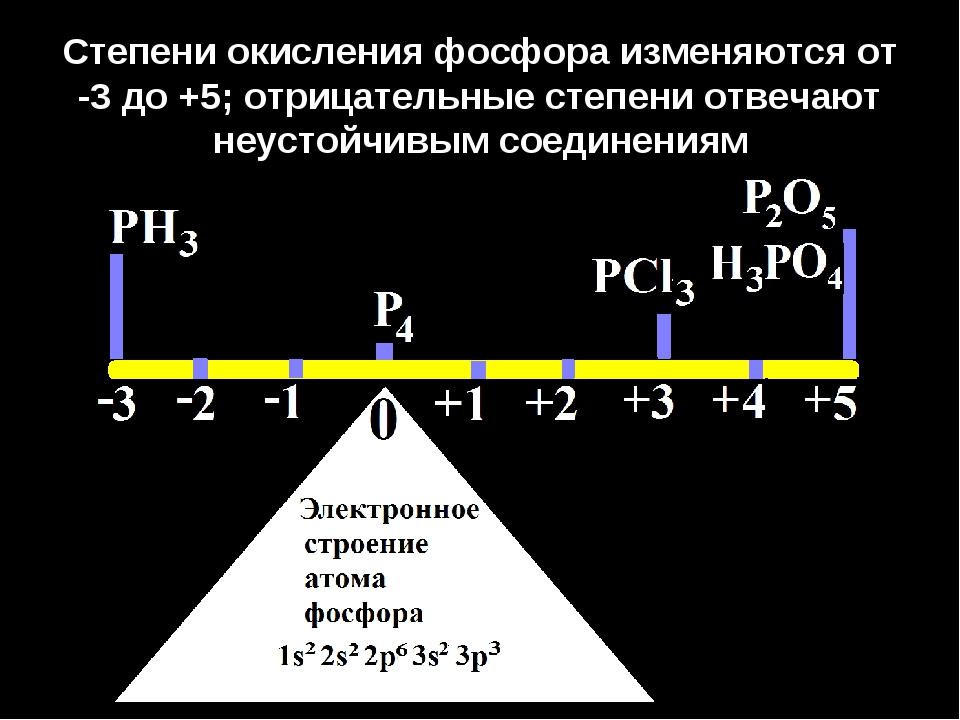 Верхнее: Ликос фосфина (рН 3 ) — гарактерный диоксид (C 18 o 2 ) при облучении токов A 100 Na, 9.93 EV Энергия фотоионизации, B 100 NA, 10,86 эВ. Энергия фотоионизации, c 1000 нА, энергия фотоионизации 10,86 эВ, и d 5000 нА, энергия фотоионизации 10,86 эВ. Внизу: льды фосфин (PH 3 )–вода (H 2 18 O) при токах облучения a 100 нА, энергии фотоионизации 9,93 эВ, b 90 103 нА.энергия фотоионизации 86 эВ, c 1000 нА, энергия фотоионизации 9,93 эВ, d 1000 нА, энергия фотоионизации 10,86 эВ и e 5000 нА, 10,86 Данные PI-ReTOF-MS для пустых экспериментов показаны на дополнительном рис. 2
Верхнее: Ликос фосфина (рН 3 ) — гарактерный диоксид (C 18 o 2 ) при облучении токов A 100 Na, 9.93 EV Энергия фотоионизации, B 100 NA, 10,86 эВ. Энергия фотоионизации, c 1000 нА, энергия фотоионизации 10,86 эВ, и d 5000 нА, энергия фотоионизации 10,86 эВ. Внизу: льды фосфин (PH 3 )–вода (H 2 18 O) при токах облучения a 100 нА, энергии фотоионизации 9,93 эВ, b 90 103 нА.энергия фотоионизации 86 эВ, c 1000 нА, энергия фотоионизации 9,93 эВ, d 1000 нА, энергия фотоионизации 10,86 эВ и e 5000 нА, 10,86 Данные PI-ReTOF-MS для пустых экспериментов показаны на дополнительном рис. 2 С учетом сигналов, обнаруженных при m/z = 52 (H 3 P 18 O + ) и 70 (H 3 P 18 O 2 + ) в эксперименте на 10,86 эВ нас интересовало распутывание природы образовавшегося структурного изомера(ов). Поскольку энергии ионизации H 3 P 18 P 18 P 18 OH и H 2 P ( 18 O) ( 18 OH) -HP ( 18 О ) 2 пары изомеров разделены более чем на 1,5 эВ (таблица 1), вторая серия экспериментов была проведена при энергии фотоионизации 9,93 эВ. Эта энергия ниже энергии ионизации изомеров оксида фосфина (H 3 P 18 O) и фосфиновой кислоты (H 2 P( 18 O) 18 OH), но выше энергии ионизации изомеры гидроксифосфина (H 2 P 18 OH) и фосфорноватистой кислоты (HP( 18 OH) 2 ).Тщательное рассмотрение профилей ТПД m/z = 52 (рис. 1) показывает, что профили ТПД почти идентичны при 10,86 и 9,93 эВ, что позволяет предположить, что по крайней мере термодинамически менее стабильный изомер гидроксифосфина (H 2 P 18 OH) образуется; поскольку абсолютные сечения фотоионизации обоих изомеров неизвестны, наличие оксида фосфина не может быть доказано.
Поскольку энергии ионизации H 3 P 18 P 18 P 18 OH и H 2 P ( 18 O) ( 18 OH) -HP ( 18 О ) 2 пары изомеров разделены более чем на 1,5 эВ (таблица 1), вторая серия экспериментов была проведена при энергии фотоионизации 9,93 эВ. Эта энергия ниже энергии ионизации изомеров оксида фосфина (H 3 P 18 O) и фосфиновой кислоты (H 2 P( 18 O) 18 OH), но выше энергии ионизации изомеры гидроксифосфина (H 2 P 18 OH) и фосфорноватистой кислоты (HP( 18 OH) 2 ).Тщательное рассмотрение профилей ТПД m/z = 52 (рис. 1) показывает, что профили ТПД почти идентичны при 10,86 и 9,93 эВ, что позволяет предположить, что по крайней мере термодинамически менее стабильный изомер гидроксифосфина (H 2 P 18 OH) образуется; поскольку абсолютные сечения фотоионизации обоих изомеров неизвестны, наличие оксида фосфина не может быть доказано. Однако Витналл и Эндрюс в предыдущих экспериментах по матричной изоляции исследовали химию образцов фосфина и молекулярного кислорода 26,27 и обнаружили образование гидроксифосфина (H 2 POH) с меньшим вкладом изомера оксида фосфина (H 3 ). ПО).Наконец, мы сравниваем профили TPD m/z = 70, зарегистрированные при 10,86 и 9,93 эВ. При понижении энергии фотона до 9,93 эВ сигнал на m/z = 70 исчезает; следовательно, можно сделать вывод, что образуется только термодинамически предпочтительный изомер фосфиновой кислоты (H 2 P( 18 O) 18 OH), но не образуется фосфорноватистая кислота (HP( 18 OH) 2 ). Более высокая молекулярная масса фосфиновой кислоты (70 а.е.м.) по сравнению с гидроксифосфином (52 а.е.м.) также связана с повышением температуры сублимации в диапазоне 260–300 К по сравнению с 160–240 К.
Однако Витналл и Эндрюс в предыдущих экспериментах по матричной изоляции исследовали химию образцов фосфина и молекулярного кислорода 26,27 и обнаружили образование гидроксифосфина (H 2 POH) с меньшим вкладом изомера оксида фосфина (H 3 ). ПО).Наконец, мы сравниваем профили TPD m/z = 70, зарегистрированные при 10,86 и 9,93 эВ. При понижении энергии фотона до 9,93 эВ сигнал на m/z = 70 исчезает; следовательно, можно сделать вывод, что образуется только термодинамически предпочтительный изомер фосфиновой кислоты (H 2 P( 18 O) 18 OH), но не образуется фосфорноватистая кислота (HP( 18 OH) 2 ). Более высокая молекулярная масса фосфиновой кислоты (70 а.е.м.) по сравнению с гидроксифосфином (52 а.е.м.) также связана с повышением температуры сублимации в диапазоне 260–300 К по сравнению с 160–240 К.
TOF-SIMS
Установив синтез по крайней мере двух простейших оксокислот фосфора (гидроксифосфина и фосфиновой кислоты) и, возможно, оксида фосфина с помощью PI-ReTOF-MS, мы провели поиск оксокислот с более высокой молекулярной массой в остатках отожженные образцы с использованием времяпролетной масс-спектрометрии вторичных ионов (TOF-SIMS). TOF-SIMS облегчает распыление твердых остатков и обнаруживает ионы в режимах обнаружения как положительных, так и отрицательных ионов (рис.2). Поскольку распыление может также фрагментировать оксокислоты фосфора, необходимо определить эти закономерности фрагментации. Это помогает идентифицировать четко определенные отношения массы к заряду, уникальные для каждой из оксокислот, а также позволяет количественно определить образовавшиеся оксокислоты. Результаты калибровки фосфоновой кислоты (H 3 PO 3 ), фосфорной кислоты (H 3 PO 4 ) и пирофосфорной кислоты (H 4 P 2 O 7) скомпилировано в дополнительных таблицах 3 и 4.Спектры отрицательных ионов очень чувствительны к зондированию оксокислот через их депротонированные исходные молекулы. Здесь пирофосфорная (H 4 P 2 18 O 7 ) и фосфоновая кислота (H 3 P 18 O 3 ) могут быть идентифицированы в 2 18 18 O 6 — / H 3 P 2 18 O 7 — и H 2 P 18 O 3 — , соответственно.
TOF-SIMS облегчает распыление твердых остатков и обнаруживает ионы в режимах обнаружения как положительных, так и отрицательных ионов (рис.2). Поскольку распыление может также фрагментировать оксокислоты фосфора, необходимо определить эти закономерности фрагментации. Это помогает идентифицировать четко определенные отношения массы к заряду, уникальные для каждой из оксокислот, а также позволяет количественно определить образовавшиеся оксокислоты. Результаты калибровки фосфоновой кислоты (H 3 PO 3 ), фосфорной кислоты (H 3 PO 4 ) и пирофосфорной кислоты (H 4 P 2 O 7) скомпилировано в дополнительных таблицах 3 и 4.Спектры отрицательных ионов очень чувствительны к зондированию оксокислот через их депротонированные исходные молекулы. Здесь пирофосфорная (H 4 P 2 18 O 7 ) и фосфоновая кислота (H 3 P 18 O 3 ) могут быть идентифицированы в 2 18 18 O 6 — / H 3 P 2 18 O 7 — и H 2 P 18 O 3 — , соответственно. В то время как пирофосфорная кислота имеет фрагмент небольшой интенсивности для H 2 P 18 O 4 − , низкое количество H 4 P 2 15 O 90 незначительное количество умеренно интенсивного сигнала H 2 P 18 O 4 − , который можно отнести к фосфорной кислоте (H 3 P 18 O 4 ). Как правило, выход каждой из этих оксокислот увеличивается с дозой облучения; во льдах, содержащих углекислый газ, наблюдается значительное увеличение выхода по сравнению со льдами, богатыми водой, особенно при более высоких дозах.Хотя фосфиновая кислота сублимируется при 260–300 K, что подтверждено анализом PI-ReTOF-MS, анализ SIMS выявил сильный пик для H 2 P 18 O 2 — ; этот ион не наблюдается как фрагмент какого-либо калибровочного соединения, но может быть формально связан с фосфиновой кислотой (H 3 P 18 O 2 ).
В то время как пирофосфорная кислота имеет фрагмент небольшой интенсивности для H 2 P 18 O 4 − , низкое количество H 4 P 2 15 O 90 незначительное количество умеренно интенсивного сигнала H 2 P 18 O 4 − , который можно отнести к фосфорной кислоте (H 3 P 18 O 4 ). Как правило, выход каждой из этих оксокислот увеличивается с дозой облучения; во льдах, содержащих углекислый газ, наблюдается значительное увеличение выхода по сравнению со льдами, богатыми водой, особенно при более высоких дозах.Хотя фосфиновая кислота сублимируется при 260–300 K, что подтверждено анализом PI-ReTOF-MS, анализ SIMS выявил сильный пик для H 2 P 18 O 2 — ; этот ион не наблюдается как фрагмент какого-либо калибровочного соединения, но может быть формально связан с фосфиновой кислотой (H 3 P 18 O 2 ). При внимательном рассмотрении данных PI-ReTOF-MS (рис. 1) видно, что интенсивность m/z = 70 (H 3 P 18 O 2 + ) не приводит полностью к ноль при 300 К; следовательно, фракция фосфиновой кислоты (H 3 P 18 O 2 ), вероятно, находится в твердом остатке.Несмотря на более низкую чувствительность, спектры положительных ионов подтверждают отнесения, полученные из режима отрицательных ионов. Пирофосфорная кислота (H 4 P 2 7 o 7 ), Фосфоновая кислота (H 3 P 18 o 3 ) и фосфорная кислота (H 3 P 18 O 4 ) Может быть обнаружен через их протонированные аналоги, то есть H 5 P 2 18 O 7 + , H 4 P 18 O 3 + H 4 P 18 O 4 + .
При внимательном рассмотрении данных PI-ReTOF-MS (рис. 1) видно, что интенсивность m/z = 70 (H 3 P 18 O 2 + ) не приводит полностью к ноль при 300 К; следовательно, фракция фосфиновой кислоты (H 3 P 18 O 2 ), вероятно, находится в твердом остатке.Несмотря на более низкую чувствительность, спектры положительных ионов подтверждают отнесения, полученные из режима отрицательных ионов. Пирофосфорная кислота (H 4 P 2 7 o 7 ), Фосфоновая кислота (H 3 P 18 o 3 ) и фосфорная кислота (H 3 P 18 O 4 ) Может быть обнаружен через их протонированные аналоги, то есть H 5 P 2 18 O 7 + , H 4 P 18 O 3 + H 4 P 18 O 4 + .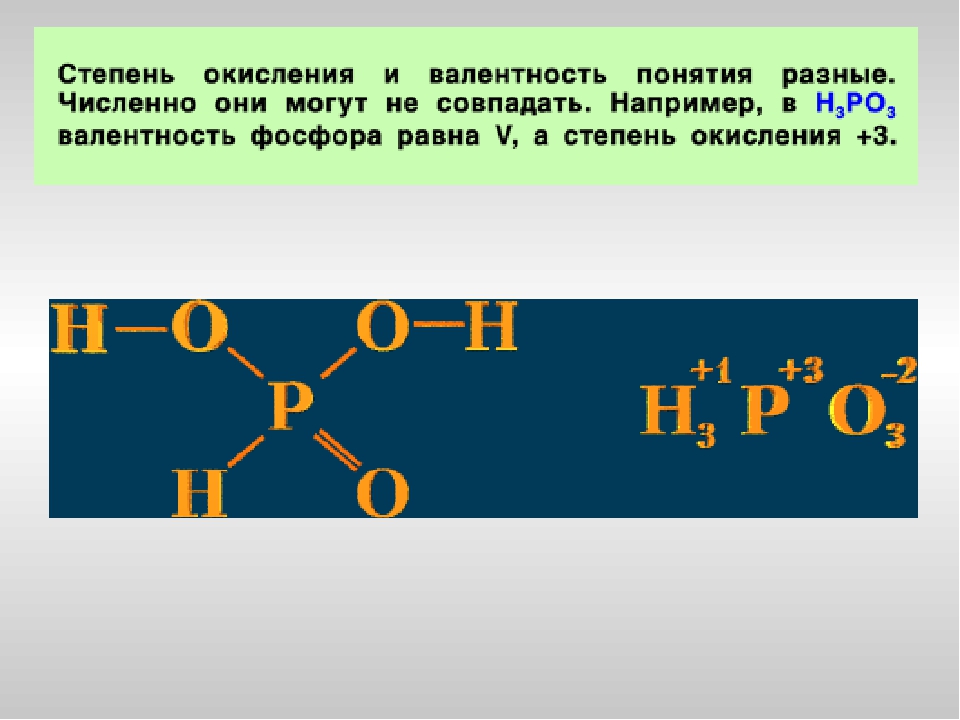
Данные SIMS для остатков облученных льдов, легированных фосфином. Спектры регистрировали в режиме отрицательных (вверху) и положительных ионов (внизу), коррелирующих с образованием 18 O-замещенных оксокислот, образующихся в облученном фосфине (PH 3 )–вода (H 2 18 O ) (справа) и фосфин (PH 3 )–диоксид углерода (C 18 O 2 ) (слева) льды
Газовая хроматография
Наконец, оксокислоты фосфора в остатках также экстрагировали, дериватизировали как триметилсилил (TMS) сложные эфиры (–OSi(CH 3 ) 3 ) и проанализированы с помощью двумерной газовой хроматографии и времяпролетной масс-спектрометрии.TOF-MS использовали для записи времени удерживания вместе с масс-спектрами (дополнительная таблица 5). Этот протокол привел к обнаружению трех оксокислот фосфора (рис. 3): фосфорной кислоты (H 3 P 18 O 4 ), фосфоновой кислоты (HP 18 O( 18 OH) 2 2 5 ) и фосфиновая кислота (H 2 P 18 O( 18 OH)). Фосфорную кислоту можно идентифицировать по молекулярному иону трис(триметилсилил)эфира ( 18 OP( 18 Osi (CH 3 ) 3 ) 3 ) при m/z ( ) = 322 и его фрагмент, происходящий от потери метильной группы при m/z (M + -15) = 307 29 .Фосфоновую кислоту определяли по молекулярному иону дериватизированного таутомера фосфористой кислоты в виде ее трис(триметилсилил)эфира (P( 18 OSi(CH 3 ) 3 ) 3 ) при m/z. (M + ) = 304 и его фрагмент с потерей метильной группы при m/z (M + -15) = 304 30 . Наконец, фосфиновая кислота может быть отобрана через ее таутомер фосфорноватистой кислоты в виде ее бис(триметилсилил)эфира (HP( 18 OSi(CH 3 ) 3 ) 2 ) при m/z (M ) = 214, а также его фрагментом отщепления метильной группы при m/z (M + −15) = 199.
Фосфорную кислоту можно идентифицировать по молекулярному иону трис(триметилсилил)эфира ( 18 OP( 18 Osi (CH 3 ) 3 ) 3 ) при m/z ( ) = 322 и его фрагмент, происходящий от потери метильной группы при m/z (M + -15) = 307 29 .Фосфоновую кислоту определяли по молекулярному иону дериватизированного таутомера фосфористой кислоты в виде ее трис(триметилсилил)эфира (P( 18 OSi(CH 3 ) 3 ) 3 ) при m/z. (M + ) = 304 и его фрагмент с потерей метильной группы при m/z (M + -15) = 304 30 . Наконец, фосфиновая кислота может быть отобрана через ее таутомер фосфорноватистой кислоты в виде ее бис(триметилсилил)эфира (HP( 18 OSi(CH 3 ) 3 ) 2 ) при m/z (M ) = 214, а также его фрагментом отщепления метильной группы при m/z (M + −15) = 199. Дериватизация в виде сложных эфиров триметилсилила (ТМС) смещает таутомерное равновесие фосфоново-фосфорной и фосфиновой-гипофосфористой кислот к эфирам фосфористой и гипофосфорноватистой кислоты (дополнительный рисунок 1) 31 . Калибровочные эксперименты показывают, что производное ТМС пирофосфорной кислоты, обнаруженное в небольших количествах с помощью ВИМС, оказалось термически нестабильным и разлагалось на колонках ГХ 32 . Следовательно, за исключением пирофосфорной кислоты, анализ ГХ×ГХ-ВП-МС исключительно хорошо коррелирует с данными ВИМС, обнаруживающими ключевые оксокислоты фосфора в остатках облученных межзвездных аналогов льдов, легированных фосфином.
Дериватизация в виде сложных эфиров триметилсилила (ТМС) смещает таутомерное равновесие фосфоново-фосфорной и фосфиновой-гипофосфористой кислот к эфирам фосфористой и гипофосфорноватистой кислоты (дополнительный рисунок 1) 31 . Калибровочные эксперименты показывают, что производное ТМС пирофосфорной кислоты, обнаруженное в небольших количествах с помощью ВИМС, оказалось термически нестабильным и разлагалось на колонках ГХ 32 . Следовательно, за исключением пирофосфорной кислоты, анализ ГХ×ГХ-ВП-МС исключительно хорошо коррелирует с данными ВИМС, обнаруживающими ключевые оксокислоты фосфора в остатках облученных межзвездных аналогов льдов, легированных фосфином.
Многомерная газовая хроматограмма, показывающая 18 О-меченые оксокислоты фосфора, экстрагированные из остатков. Для этого многомерного хроматографического представления были выбраны единицы атомной массы 214 (×100) и 304 (×150). Частичная хроматограмма ГХ × ГХ разделения двух младших оксокислот фосфора показана вверху слева. Неназначенные пики возникают из-за того, что агент силилирования (BSTFA: TMCS 1%), который был введен в избытке по сравнению с контрольным анализом (дополнительная рис.3) во избежание потери образца
Неназначенные пики возникают из-за того, что агент силилирования (BSTFA: TMCS 1%), который был введен в избытке по сравнению с контрольным анализом (дополнительная рис.3) во избежание потери образца
Обсуждение
Идентифицированы четыре монофосфорные оксокислоты [гидроксифосфин (H 3 PO: PH 2 OH(-I)), фосфиновая кислота (H 3 PO 2 900) 2 P(O)OH(+I)), фосфоновая кислота (H 3 PO 3 : HP(O)(OH) 2 (+III)), фосфорная кислота (фосфорная кислота (H 3 PO 4 (+V))] вместе с пирофосфорной кислотой (H 4 P 2 O 7 (+V)) с фосфором в четырех различных степенях окисления от –I до +V, мы обсуждаем сейчас возможные пути формирования.Для простоты в последующем обсуждении метка 18 O опущена. Следует отметить, что хотя ИК-Фурье-анализ свидетельствовал о появлении функциональных групп, связанных с оксокислотами фосфора, даже при 5 К, данные ИК-Фурье не позволили идентифицировать отдельные оксокислоты из-за перекрывающихся поглощений функциональных групп. Поэтому кинетические профили, связанные с образованием отдельных оксокислот фосфора, не могли быть получены. Однако можно сделать несколько важных выводов.Во-первых, на основе данных PI-ReTOF-MS, зарегистрированных при 100, 1000 и 5000 нА, выходы PH 2 OH(-I) и H 2 P(O)OH(+I) зависят от ток облучения и, следовательно, доза. Напомним, что в системе PH 3 ‒H 2 O H 2 P(O)OH(+I) отсутствует в эксперименте 100 нА, но появляется при 1000 нА. Это наблюдение предполагает последовательное образование оксокислот фосфора посредством ступенчатой реакции атомов кислорода, начиная с фосфина (PH 3 ). Принимая во внимание льды, богатые водой и углекислым газом, радиолиз воды и углекислого газа может генерировать электронно-возбужденные атомы кислорода в сильно эндоэргических реакциях 5,33,34,35 ; вода также может разлагаться с образованием атомарного водорода и гидроксильных радикалов (ОН) (уравнение2 {\ mathrm {S}}} \right) {\ mathrm {\ Delta}} _ {\ mathrm {R}} {\ mathrm {G}} = 3,51 \, {\ mathrm {eV}} $ $
Поэтому кинетические профили, связанные с образованием отдельных оксокислот фосфора, не могли быть получены. Однако можно сделать несколько важных выводов.Во-первых, на основе данных PI-ReTOF-MS, зарегистрированных при 100, 1000 и 5000 нА, выходы PH 2 OH(-I) и H 2 P(O)OH(+I) зависят от ток облучения и, следовательно, доза. Напомним, что в системе PH 3 ‒H 2 O H 2 P(O)OH(+I) отсутствует в эксперименте 100 нА, но появляется при 1000 нА. Это наблюдение предполагает последовательное образование оксокислот фосфора посредством ступенчатой реакции атомов кислорода, начиная с фосфина (PH 3 ). Принимая во внимание льды, богатые водой и углекислым газом, радиолиз воды и углекислого газа может генерировать электронно-возбужденные атомы кислорода в сильно эндоэргических реакциях 5,33,34,35 ; вода также может разлагаться с образованием атомарного водорода и гидроксильных радикалов (ОН) (уравнение2 {\ mathrm {S}}} \right) {\ mathrm {\ Delta}} _ {\ mathrm {R}} {\ mathrm {G}} = 3,51 \, {\ mathrm {eV}} $ $
(4)
В системе вода–фосфин образование PH 2 OH может происходить путем безбарьерной рекомбинации фосфинового (PH 2 ) радикала с гидроксильным (OH) радикалом (уравнение 5). Альтернативно, электронно-возбужденные атомы кислорода могут без барьера встраиваться в связь фосфор-водород, что также приводит к PH 2 OH (уравнение6). Важно отметить, что электронно-возбужденные атомы кислорода также могут без барьера присоединяться к атому фосфора фосфина с образованием оксида фосфина (H 3 PO) (уравнение 7), который затем может подвергаться миграции водорода с образованием PH 2 OH. 26,27,37 . Шмидт и др. предположил, что барьер между 3,01 и 3,73 эВ разделяет оба изомера 38 ; эта энергия также может быть обеспечена энергичными электронами. Напомним, что в нашем исследовании не удалось ни доказать, ни опровергнуть образование оксида фосфина.1A\prime} \right){\mathrm{\Delta}}_{\mathrm{R}}{\mathrm{G}} = 0,03\,{\mathrm{eV}}$$
Альтернативно, электронно-возбужденные атомы кислорода могут без барьера встраиваться в связь фосфор-водород, что также приводит к PH 2 OH (уравнение6). Важно отметить, что электронно-возбужденные атомы кислорода также могут без барьера присоединяться к атому фосфора фосфина с образованием оксида фосфина (H 3 PO) (уравнение 7), который затем может подвергаться миграции водорода с образованием PH 2 OH. 26,27,37 . Шмидт и др. предположил, что барьер между 3,01 и 3,73 эВ разделяет оба изомера 38 ; эта энергия также может быть обеспечена энергичными электронами. Напомним, что в нашем исследовании не удалось ни доказать, ни опровергнуть образование оксида фосфина.1A\prime} \right){\mathrm{\Delta}}_{\mathrm{R}}{\mathrm{G}} = 0,03\,{\mathrm{eV}}$$
(7)
После образования PH 2 OH добавление другого электронно-возбужденного атома кислорода к атому фосфора дает H 2 P(O)OH (уравнение 8). Последовательные внедрения электронно-возбужденных атомов кислорода в связи фосфор-водород могут привести через HP(O)(OH) 2 (уравнение 9) к H 3 PO 4 (уравнение 10). По сути, в этой последовательности реакций требуется до четырех атомов кислорода для окисления фосфина до фосфорной кислоты посредством ступенчатого окисления.1 {\ mathrm {A}}} \right) {\ mathrm {\ Delta}} _ {\ mathrm {R}} {\ mathrm {G}} = — 7,62 \, {\ mathrm {eV}} $ $
Последовательные внедрения электронно-возбужденных атомов кислорода в связи фосфор-водород могут привести через HP(O)(OH) 2 (уравнение 9) к H 3 PO 4 (уравнение 10). По сути, в этой последовательности реакций требуется до четырех атомов кислорода для окисления фосфина до фосфорной кислоты посредством ступенчатого окисления.1 {\ mathrm {A}}} \right) {\ mathrm {\ Delta}} _ {\ mathrm {R}} {\ mathrm {G}} = — 7,62 \, {\ mathrm {eV}} $ $
(10)
Что касается степени превращения, инфракрасный анализ показывает, что 76 ± 8% фосфина прореагировало во льду 10:1 CO 2 :PH 3 ; это было определено с использованием сравнительной площади полос ν 2 и ν 4 фосфина. Аналогично, ν 2 , 2ν 2 , 2ν 2 , и ν 3 + ν 1 + ν 3 полосы углекисшеродного диоксида показывают, что 28 ± 1% CO 2 были разрушены после облучения. Это соответствует разрушению облучением 8 ± 2 × 10 16 молекул фосфина и 3 ± 1 × 10 17 молекул углекислого газа. Поскольку каждая облученная молекула углекислого газа высвобождает только один атом кислорода, отношение доступных реакционноспособных атомов фосфора к кислороду, таким образом, составляет 1,0:3,4 ± 0,8. Если весь прореагировавший фосфин был включен в состав одной из трех простейших оксокислот, то 8 ± 2 × 10 16 молекул предполагает, что на эВ облучения было образовано 2,1 ± 0,8 × 10 −4 молекул.Образование H 3 PO 4 ограничено числом образующихся атомов кислорода, и может образоваться не более 7 ± 2 × 10 16 молекул H 3 PO 4 , что соответствует генерации 1,7 ± 0,6 × 10 -4 H 3 PO 4 молекул эВ -1 . Полосы ν 2 и ν L воды были проанализированы для льда 10:1 H 2 O:PH 3 , и было обнаружено, что 62 ± 2% фосфина прореагировало, в то время как только 37 ± 5 % воды было уничтожено.
Это соответствует разрушению облучением 8 ± 2 × 10 16 молекул фосфина и 3 ± 1 × 10 17 молекул углекислого газа. Поскольку каждая облученная молекула углекислого газа высвобождает только один атом кислорода, отношение доступных реакционноспособных атомов фосфора к кислороду, таким образом, составляет 1,0:3,4 ± 0,8. Если весь прореагировавший фосфин был включен в состав одной из трех простейших оксокислот, то 8 ± 2 × 10 16 молекул предполагает, что на эВ облучения было образовано 2,1 ± 0,8 × 10 −4 молекул.Образование H 3 PO 4 ограничено числом образующихся атомов кислорода, и может образоваться не более 7 ± 2 × 10 16 молекул H 3 PO 4 , что соответствует генерации 1,7 ± 0,6 × 10 -4 H 3 PO 4 молекул эВ -1 . Полосы ν 2 и ν L воды были проанализированы для льда 10:1 H 2 O:PH 3 , и было обнаружено, что 62 ± 2% фосфина прореагировало, в то время как только 37 ± 5 % воды было уничтожено. Это эквивалентно 6 ± 2 × 10 16 молекул фосфина и 8 ± 3 × 10 17 молекул воды. В этом случае было доступно гораздо больше кислорода по сравнению с фосфором при соотношении атомов фосфора к кислороду 1:12, и, таким образом, фосфор всегда будет ограничивающим атомом при образовании оксокислот. Здесь верхние выходы 6 ± 2 × 10 16 молекул оксокислот фосфора образуются при 1,6 ± 0,6 × 10 –4 молекул эВ −1 .
Это эквивалентно 6 ± 2 × 10 16 молекул фосфина и 8 ± 3 × 10 17 молекул воды. В этом случае было доступно гораздо больше кислорода по сравнению с фосфором при соотношении атомов фосфора к кислороду 1:12, и, таким образом, фосфор всегда будет ограничивающим атомом при образовании оксокислот. Здесь верхние выходы 6 ± 2 × 10 16 молекул оксокислот фосфора образуются при 1,6 ± 0,6 × 10 –4 молекул эВ −1 .
Используя стандарты реагентов, количество фосфорной кислоты (H 3 PO 4 ) в остатках можно определить с помощью ГХ×ГХ-ВП-МС и сравнить с инфракрасными спектрами для определения выхода реакции.Лед CO 2 :PH 3 произвел 5 нмоль (3 × 10 15 молекул) фосфорной кислоты, в то время как только 1 нмоль (6 × 10 14 молекул) был обнаружен из H 2 9 PH 3 Ice, который приводит к 7 ± 3 × 10 -6 молекулы H 3 PO 4 PO 4 на EV в CO 2 : PH 3 ICE и 2 ± 1 × 10 — 6 H 3 PO 4 молекул эВ −1 в H 2 O:PH 3 лед. Так, фосфорная кислота составляет 4% от прореагировавшего фосфина в СО 2 :PH 3 , тогда как в системе H 2 O:PH 3 выход 1%. Поскольку фосфорная кислота была наиболее распространенным соединением, обнаруженным в остатках, это указывает на то, что большая часть фосфора возгонялась во время ТПД, например, в виде дифосфана, как это было обнаружено экспериментально.
Так, фосфорная кислота составляет 4% от прореагировавшего фосфина в СО 2 :PH 3 , тогда как в системе H 2 O:PH 3 выход 1%. Поскольку фосфорная кислота была наиболее распространенным соединением, обнаруженным в остатках, это указывает на то, что большая часть фосфора возгонялась во время ТПД, например, в виде дифосфана, как это было обнаружено экспериментально.
В заключение, путем воздействия ионизирующего излучения на межзвездные аналоги льдов, легированных фосфином (PH 3 ), и использования набора дополнительных аналитических инструментов in situ и ex situ настоящее исследование предлагает убедительные доказательства легкого образования различных оксокислот фосфор: фосфиновая кислота (H 3 PO 2 ) P(I), фосфоновая кислота (H 3 PO 3 ) P(III), фосфорная кислота (H 3 PO 4 P ) V) и пирофосфорную кислоту (H 4 P 2 O 7 ) P(V). Образование этих оксокислот может быть инициировано радикально-радикальной рекомбинацией между гидроксильным (ОН) и фосфиновым (PH 2 ) радикалами (уравнение 5) или внедрением электронно-возбужденного атомарного кислорода, высвобождающегося при мономолекулярном распаде воды и диоксид углерода с фосфинобразующей фосфиновой кислотой (PH 2 OH) (уравнение 6). После образования фосфиновой кислоты (PH 2 OH) последовательное присоединение и внедрение электронно-возбужденного атома кислорода к атому фосфора дает фосфоновую кислоту (H 3 PO 3 ) и фосфорную кислоту (H 3 PO 4 ). ) (реакции 8–10).Всего для окисления фосфина до фосфорной кислоты необходимо до четырех атомов кислорода; для этого требуется примерно до 30 эВ. Следовательно, термические реакции не могут образовывать оксокислоты при 5 K, но требуется неравновесная химия, запускаемая космическими лучами, для обеспечения необходимых атомов кислорода (и, возможно, гидроксильных радикалов) для процесса окисления.
Образование этих оксокислот может быть инициировано радикально-радикальной рекомбинацией между гидроксильным (ОН) и фосфиновым (PH 2 ) радикалами (уравнение 5) или внедрением электронно-возбужденного атомарного кислорода, высвобождающегося при мономолекулярном распаде воды и диоксид углерода с фосфинобразующей фосфиновой кислотой (PH 2 OH) (уравнение 6). После образования фосфиновой кислоты (PH 2 OH) последовательное присоединение и внедрение электронно-возбужденного атома кислорода к атому фосфора дает фосфоновую кислоту (H 3 PO 3 ) и фосфорную кислоту (H 3 PO 4 ). ) (реакции 8–10).Всего для окисления фосфина до фосфорной кислоты необходимо до четырех атомов кислорода; для этого требуется примерно до 30 эВ. Следовательно, термические реакции не могут образовывать оксокислоты при 5 K, но требуется неравновесная химия, запускаемая космическими лучами, для обеспечения необходимых атомов кислорода (и, возможно, гидроксильных радикалов) для процесса окисления. Обратите внимание, что наши исследования проводились в конденсированной (ледяной) фазе, а не в условиях однократного столкновения в газовой фазе 41 . Поэтому ни в настоящих исследованиях, ни в какой-либо другой лаборатории невозможно определить эффективность каждой элементарной реакции (стадии окисления), участвующей в образовании отдельных оксокислот.Для этого потребуются эксперименты с импульсным зондом с фемтосекундными (несколько импульсов длительностью 10 фс) электронными импульсами, проникающими в образец льда. Этих экспериментов пока нет.
Обратите внимание, что наши исследования проводились в конденсированной (ледяной) фазе, а не в условиях однократного столкновения в газовой фазе 41 . Поэтому ни в настоящих исследованиях, ни в какой-либо другой лаборатории невозможно определить эффективность каждой элементарной реакции (стадии окисления), участвующей в образовании отдельных оксокислот.Для этого потребуются эксперименты с импульсным зондом с фемтосекундными (несколько импульсов длительностью 10 фс) электронными импульсами, проникающими в образец льда. Этих экспериментов пока нет.
В то время как на Земле фосфин классифицируется как высокотоксичный и мало растворимый в воде, в настоящей работе показано, что межзвездный фосфин является важным предшественником в синтезе хорошо растворимых в воде оксокислот фосфора, распространенных в современной биохимии. Фосфорная кислота (H 3 PO 4 ), в частности, представляет собой растворимый источник фосфора в степени окисления фосфора (V), обнаруженной в РНК/ДНК и АДФ/АТФ. Идентификация пирофосфорной кислоты (H 4 P 2 O 7 ) — формального продукта конденсации фосфорной кислоты — важна, поскольку наши исследования показывают, что полифосфаты, такие как дифосфаты, содержащиеся в АДФ, могут образовываться в межзвездных льдах при взаимодействии с ионизирующим излучением, имитирующим типичное время жизни молекулярных облаков в несколько 10 6 лет. Неудачное обнаружение трифосфорной кислоты (H 5 P 3 O 10 ) — предшественника фосфорного скелета АТФ — может указывать на то, что химия фосфора в межзвездных льдах прекращается с синтезом пирофосфорной кислоты в течение жизни молекулярное облако, таким образом определяя молекулярную сложность фосфорсодержащих оксокислот, образующихся во внеземной среде.
Идентификация пирофосфорной кислоты (H 4 P 2 O 7 ) — формального продукта конденсации фосфорной кислоты — важна, поскольку наши исследования показывают, что полифосфаты, такие как дифосфаты, содержащиеся в АДФ, могут образовываться в межзвездных льдах при взаимодействии с ионизирующим излучением, имитирующим типичное время жизни молекулярных облаков в несколько 10 6 лет. Неудачное обнаружение трифосфорной кислоты (H 5 P 3 O 10 ) — предшественника фосфорного скелета АТФ — может указывать на то, что химия фосфора в межзвездных льдах прекращается с синтезом пирофосфорной кислоты в течение жизни молекулярное облако, таким образом определяя молекулярную сложность фосфорсодержащих оксокислот, образующихся во внеземной среде.
Наконец, синтез фосфоновой кислоты (H 3 PO 3 ) может поддерживать альтернативный путь получения фосфора (III), обнаруженный в алкилфосфоновых кислотах в метеорите Мерчисон. Поскольку эти алкилфосфоновые кислоты представляют постоянный интерес для сообщества «Происхождение жизни», включение метана (CH 4 ) или более сложных углеводородов в межзвездные льды может дать сложную смесь алкилфосфоновых кислот, обнаруженную в Мерчисоне и , с производными фосфорной кислоты, биологически значимыми эфирами фосфорной кислоты.В то время как другие межзвездные фосфорсодержащие молекулы, такие как CP или HCP 42 , рассматривались в качестве источника фосфора для алкилфосфоновых кислот посредством реакций в газовой или водной фазе, фосфин (PH 3 ) представляет собой идеальное соединение для межзвездных соединений на основе фосфора. эксперименты со льдом, чего не хватает в литературе по астрохимии и фосфору, изобилующей исследованиями газовой и минеральной фаз. Оксокислоты фосфора, обнаруженные в наших экспериментах, могли образоваться во льдах таких комет, как 67P/Чурюмова-Герасименко, источником фосфора которых, как полагают, является фосфин 16 .
Поскольку эти алкилфосфоновые кислоты представляют постоянный интерес для сообщества «Происхождение жизни», включение метана (CH 4 ) или более сложных углеводородов в межзвездные льды может дать сложную смесь алкилфосфоновых кислот, обнаруженную в Мерчисоне и , с производными фосфорной кислоты, биологически значимыми эфирами фосфорной кислоты.В то время как другие межзвездные фосфорсодержащие молекулы, такие как CP или HCP 42 , рассматривались в качестве источника фосфора для алкилфосфоновых кислот посредством реакций в газовой или водной фазе, фосфин (PH 3 ) представляет собой идеальное соединение для межзвездных соединений на основе фосфора. эксперименты со льдом, чего не хватает в литературе по астрохимии и фосфору, изобилующей исследованиями газовой и минеральной фаз. Оксокислоты фосфора, обнаруженные в наших экспериментах, могли образоваться во льдах таких комет, как 67P/Чурюмова-Герасименко, источником фосфора которых, как полагают, является фосфин 16 . Поскольку кометы хотя бы частично содержат остатки материала протопланетного диска, сформировавшего нашу Солнечную систему, эти соединения можно проследить до межзвездной среды везде, где имеется достаточное количество фосфина в межзвездных льдах. После доставки на Землю метеоритами или кометами эти оксокислоты фосфора были бы доступны для пребиотической химии фосфора Земли. Например, недавние исследования показали, что фосфорная кислота 43 и диамидофосфат — возможное производное триметафосфата 44 — могут абиотически фосфорилировать различные пребиотические соединения, такие как сахара, аминокислоты и нуклеотиды, в водном растворе с образованием биологически значимых молекул более высокого порядка. .Хотя в будущем необходимо провести исследования основных механизмов образования этих оксокислот, настоящее исследование воплощает в себе шаг к выяснению возможных абиотических путей образования оксокислот фосфора, напоминающих ключевые молекулярные строительные блоки в современной биохимии на Земле, что приближает нас к тому, чтобы в конечном итоге предсказать, где в возможно, были синтезированы молекулярные предшественники галактик, связанные с происхождением жизни.
Поскольку кометы хотя бы частично содержат остатки материала протопланетного диска, сформировавшего нашу Солнечную систему, эти соединения можно проследить до межзвездной среды везде, где имеется достаточное количество фосфина в межзвездных льдах. После доставки на Землю метеоритами или кометами эти оксокислоты фосфора были бы доступны для пребиотической химии фосфора Земли. Например, недавние исследования показали, что фосфорная кислота 43 и диамидофосфат — возможное производное триметафосфата 44 — могут абиотически фосфорилировать различные пребиотические соединения, такие как сахара, аминокислоты и нуклеотиды, в водном растворе с образованием биологически значимых молекул более высокого порядка. .Хотя в будущем необходимо провести исследования основных механизмов образования этих оксокислот, настоящее исследование воплощает в себе шаг к выяснению возможных абиотических путей образования оксокислот фосфора, напоминающих ключевые молекулярные строительные блоки в современной биохимии на Земле, что приближает нас к тому, чтобы в конечном итоге предсказать, где в возможно, были синтезированы молекулярные предшественники галактик, связанные с происхождением жизни.
