Химические свойства серы — Справочник химика 21
Химические свойства серы. Сера — типичный активный неметалл. Она реагирует с простыми и сложными веществами. В химических реакциях сера может Сыть как окислителем, так и восстановителем. Это зависит от окислительно-восстановительных свойств веществ, с которыми она реагирует. Сера проявляет свойства окислителя при взаимодействии с простыми веществами — восстановителями (металлами, водородом, некоторыми неметаллами, имеющими меньшую ЭО). Восстановителем сера является по отношению к более сильным окис/штелям (кислороду, галогенам и кислотам-окислителям). [c.363]Химические свойства серы [c.296]
Химические свойства серы……………… [c.274]
Физико-химические свойства серы и сульфидов железа [c.35]
По химическим свойствам сера — типичный неметалл.
Химические свойства. Сера — типичный неметалл, ло своей электроотрицательности она уступает только галогенам, кислороду и азоту и поэтому окисляется ими. В своих соединениях она проявляет степени окисления —2, -(-4, +6 и редко +2. [c.242]
Каковы химические свойства серы Приведите примеры уравнений реакций, показывающих окислительно-восстановительные свойства серы. [c.228]
Химические свойства серы, селена и теллура во многом отличаются от свойств кислорода. Одно из важнейших отличий заключается в существовании у этих элементов положительных степеней окисления вплоть до -1- 6, которые встречаются, напри-
[c. 305]
305]
Физические и химические свойства серы, Сера образует несколько аллотропических модификаций (рис. 56). При комнатной температуре устойчива ромбическая а-сера. Она желтого цвета, нерастворима в воде, но хорошо растворяется в сероуглероде. При 95,4 °С а-сера переходит в моноклинную Р Серу с температурой плавления П9,3 °С. Обе модификации состоят из циклических коронообразных молекул Se. а- и Р-Модификации серы отличаются взаимным расположением молекул Se в кристалле. Атомы серы в молекуле Se находятся в sp -гибридном состоянии и связаны между собой кова- [c.316]
Охарактеризуйте химические свойства серы. Приведите примеры уравнений реакций, в которых сера играет роль окислителя, восстановителя.
Химические свойства серы. В химическом отношении сера — типичный неметалл, активно взаимодействует со многими металлами, образуя сульфиды. Реагирует сера и с некоторыми неметаллами кислородом, водородом (при нагревании), галогенами. Например, пропуская хлор в расплавленную серу, получают хлорид серы, в котором она проявляет степень окисления -М. Относительная молекулярная масса хлорида серы, определенная по относительной плотности пара, соответствует формуле Это жидкость с температурой кипения [c.382]
Например, пропуская хлор в расплавленную серу, получают хлорид серы, в котором она проявляет степень окисления -М. Относительная молекулярная масса хлорида серы, определенная по относительной плотности пара, соответствует формуле Это жидкость с температурой кипения [c.382]
Физико-химические свойства серы, требования ГОСТа на качество серы. [c.266]
Так, например, при проведении в IX классе урока на тему Химические свойства серы главная ключевая идея заключается в том, чтобы на основе этого материала расширить, углубить, конкретизировать теоретические знания учащихся о строении вещества, об окислительно-восстановительных процессах, о тепловом эффекте химических реакций, о связи химических свойств простого вещества серы с положением элемента в таблице Д. И. Менделеева. Вокруг этой стержневой идеи и строят урок, определяют его содержание и его структуру. Таким образом, учащихся учат определенному, характерному для химии методологическому подходу к изучению химических объектов, который способствует формированию специальных учебных умений в процессе освоения химического содержания.
По своим химическим свойствам сера во многом аналогична кислороду, хотя химическая активность ее значительно слабее, чем кислорода. С повышением температуры реакционная способность серы сильно возрастает она легко вступает в соединения с галогенами (за исключением иода), водородом, фосфором, мышьяком, сурьмой и почти со всеми металлами.
Обмен обусловлен структурными особенностями получаемого соединения и его физико-химическими свойствами. Сера-35 хоро- [c.137]
По химическим свойствам сера типичный металлоид. При нагревании она легко окисляется, с атомарным водородом легко реагирует при комнатной температуре, а с хлором и фтором — при нагревании до 100°. Нагревание способствует также образованию [c.81]
Физические и химические свойства серы. В процессе плавления серы наблюдается интересная особенность при 113° С она представляет собой [c.212]
По химическим свойствам сера—типичный металлоид. Атом ее на внешнем слое содержит 6 электронов, в связи с чем сера может образовать отри- [c.213]
Атом ее на внешнем слое содержит 6 электронов, в связи с чем сера может образовать отри- [c.213]
Опишите химические свойства серы в связи со строением его атомов и местом, занимаемым в периодической системе. Укажите, в отношении каких элементов сера является а) неполным аналогом, б) полным аналогом. [c.137]
По химическим свойствам сера — типичный неметалл. Соединяясь с водородом лишь при нагревании, она образует ядовитое газообразное соединение — сероводород, растворимый в воде. При 20° 1 объем воды растворяет 2,5 объема сероводорода. Сероводородная вода обладает свойствами очень слабой кислоты. Диссоциация ее протекает главным образом по уравнению [c.164]
Если искусство вопрошать природу во времена Агриколы находилось еше в зачаточном состоянии, то в умении наблюдать природу он не был одинок. Неизвестный автор примерно той же эпохи, прикрывшийся псевдонимом легендарного арабского алхимика Гебера, приводит следующее описание физических и химических СВОЙСТВ серы Сера есть жирная земля, сгущающаяся в копях путем кипения, пока она не затвердеет и не сделается сухой.
Химические свойства серы. Соответственно своему местоположению в периодической таблицу, ниже кислорода и левее галогенов сера лишь этим элементам уступает в степени проявления электроотрицательных, свойств. [c.271]
По химическим свойствам сера является активным неметаллом, в некоторых отношениях она сходна с кислородом и, подобно последнему, соединяется почти со всеми металлами и неметаллами. [c.164]
Периодический закон. Изучая свойства важнейших химических элементов и их соединений, мы уже видели, что можно выделить отдельные группы элементов, сходных между собой по химическим свойствам.
При обычной температуре сера находится в твердом состоянии. Она существует в двух кристаллических формах ромбической и моноклинной. Ниже приведены основные физико-химические свойства серы [c.24]
По химическим свойствам сера является типичным неметаллом. Она непосредственно соединяется почти со всеми металлами. С некоторыми из них сера взаимодействует при обыкновенной температуре. Например, при растирании [c.171]
В табл. 12 приведены некоторые физико-химические свойства серы, пирита и сульфида железа (РеЗ), продукта, который образуется приЗ терлгическом разложении пирита
Химические свойства. Сера находится в VI группе третьего периода периодической системы. Значит, на внешнем электронном слое у атома серы шесть электронов. Формула элек- [c.188]
Формула элек- [c.188]
По химическим свойствам сера — типичный неметалл. Энергично реагирует со многими металлами и металлоидами соединяется с железом, цинком, водородом, кислородом, фосфором, хлором и т. д. В реакциях с металлами и водородом сера играет роль окислителя (электроноакцентора), проявляя при этом валентность, рав- [c.502]
Проведено изучение физических и физико-химических свойств серы, ее превращений под воздействием физических (механических) и химических воздействий, рассмотрены возможности получения новых модификаций, смесей, композиций, препаративных форм серы и разработка путей применения их в народном хозяйстве. Для этих целей использована интенсивная механическая обработка в дезинтеграторе, исследованы свойства механически активированной серы (реакционная способность, растворимость и структурных характеристик), изучены возможности композиционного сочетания серы с материалами различной химической природы.
 Установлена эффек-тивносгь кратковременной ударной механической обработки серы в дезинте1 раторе, 1юзволяющей проводить интенсивно процессы растворения и концентрирования ее в водных щелочных растворах. [c.37]
Установлена эффек-тивносгь кратковременной ударной механической обработки серы в дезинте1 раторе, 1юзволяющей проводить интенсивно процессы растворения и концентрирования ее в водных щелочных растворах. [c.37]В монографии рассмотрены химические свойства серы, методы идентификопределения элементов (химические, физико-химические и физичес Большое внимание уделено определению серы в различных природных и промышле объектах, приведена обширная библиография по этому вопросу. [c.272]
Общая характеристика элементов главной подгруппы VI группы периодической системы. Кислород, строение атома, аллоторопия. Промышленные и лабораторные способы получения. Физические и химические свойства. Роль кислорода в природе и применение в технике. Озон, строение молекулы. Получение и химические свойства озона. Сравнительная характеристика окислительных свойств кислорода и озона. Роль атмосферного озонного слоя для развития жизни на Земле. Сера, строение атома, возможные степени окисления.
По своим химическим свойствам сера занимает п-ро межуточное Me to между кислородом и селеном все три элемента 1При адлежат к шестой группе периодической системы. В своей низшей валентности сера находится в сернистом водороде —2) и в высшей — в верной кислоте (+6). [c.393]
Во многом химия серы похожа на химию кислорода, особенно это относится к химическим свойствам серы в степенях окисления —2 и —1. Сульфиды, подобно окислам, обычно нераствори- [c.47]
Сера, ее физические и химические свойства. – УчМет
учитель химии высшей категории
Овчинникова С.М.
МОУ Обшаровская СОШ № 2
Цель
урока: Дать общую характеристику
халькогенов. Охарактеризовать серу в
свете трех форм существования этого
химического элемента: в форме атомов,
простых веществ, а следовательно, и
аллотропию ее, а также в форме некоторых
соединений серы.
Сегодня на уроке мы должны:
-
Повторить и закрепить положение элементов, строение их атомов на основании их положения в Периодической Системе Д.И. Менделеева.
-
Познакомиться с месторождениями и соединениями серы. Более полно изучить физические и химические свойства её.
-
Закрепить навыки окислительно-восстановительных процессов и совершенствовать свои знания в умении делать выводы. Т.е. вы будете думать, решать, обобщать, поэтому пытайтесь, осмеливайтесь делать то, чего ещё никто не пытался делать до вас.
А для этого мы с вами немного повторим.
Назовите мне, пожалуйста, современную формулировку Периодического закона.
А каков же физический смысл закона?
Как изменяются неметаллические свойства в главных подгруппах сверху вниз?
Слайд
1. Периодическая система Д.И.М.
Периодическая система Д.И.М.
Итак, VI группа, главная подгруппа. Давайте дадим характеристику и сравним строения атомов этих элементов на основании положения в Периодической системе Д.И. Менделеева.
Что общего можно выделить в строении атома этих элементов?
Как вы догадались, сегодняшний урок посвящен одному из самых интересных химических элементов, соединения которого известны с глубокой древности.
В средние века считалось, что это обязательная составная часть всех веществ.
В жизни современного человека, соединения этого элемента играют заметную роль, что нашло отражение в художественной литературе.
Тема нашего урока «Сера и ее свойства»
Слайд №2. Сера и ее свойства.
Свойства серы можно прогнозировать по положению химического элемента.
Слайд
№3. Сера в П. С.
С.
Мы выяснили, сера в П.С., находясь в одной подгруппе с О имеет сходное с ним строение внешнего электронного слоя.
Попытаемся узнать, какова же внутренняя структура кристаллической S.
Слайд № 4. Молекулы серы.
Оказывается, что каждый атом S соединяется с 2 другими, а 8 атомов S замыкаясь в кольцо, образуют молекулу S8.
Физические свойства серы.
Исследуем основные физические свойства S;
Опыт №1.
Прочные на вид кристаллы легко разламываются.
Опыт №2.
Хотя р S больше р воды, сера в воде не тонет, разгадка- в несмачиваемости S. Она хорошо растворима в органических растворителях и практически и практически нерастворима в воде.
Опыт №3.
Удивительно
необычные свойства проявляет сера при
плавлении.
Сначала разрушаются кристаллы, изменяется цвет вещества, при t=1120С S превращается в легко подвижную жидкость, при дальнейшем нагревании, жидкость начинает терять подвижность.
Слайд № 5. Цепочки.
Кристаллы S построены из 8-членных молекул, при t выше 150 кольцевые молекулы рвутся, отдельные цепочки соединяются друг с другом в цепи.
При 250 0 C длина цепей максимальна.
Вязкость серы постоянно повышается, что она не выливается из сосуда, но если продолжить нагревание, цепи рвутся и S опять становится жидкой.
Постараемся этот расплав быстро охладить и вылить его в стакан с водой.
Слайд № 6. сера-пластическая.
И вновь неожиданность, получилось вещество по свойствам не похожее на серу. Это аллотропная модификация серы –пластическая сера,
Слайд
№ 7. График.
График.
но пластическая сера неустойчива и она опять через некоторое время превращается в кристаллическую.
Так вы убедились, что свойства серы связаны с ее строением.
Химические свойства серы.
Слайд № 8.
Строение атома серы доказывает, что она может отдавать или принимать электроны, играя роль восстановителя или окислителя.
Рисунок.
Реакции при которых атом серы принимает электроны, это взаимодействие серы с металлами.
Обычно они идут с выделением тепла и света.
Опыт.
Бурно соединяется сера с натрием.
Опыт.
Обратите внимание на условия реакции взаимодействия S с медью.
Каковы признаки этой реакции.?
Соединения
которые образуются при взаимодействии
S с металлами называются
— сульфиды.
Слайд № 9. Ртуть.
Эта капля ртути принесет нам новую неожиданность, взаимодействие S с Hg проходят при обычных условиях.
Так можно связать в химическое соединение случайно пролитую Hg. Этот процесс лежит в основе удаления в основе удаления и обезвреживания разлитой ртути, например, из разбитого термометра и называется — Демеркуризацией.
В этих реакциях мы наблюдаем окислительные свойства серы, а в каких же случаях сера ведет себя как восстановитель.
Сера сгорает в кислороде с образованием
оксида серы ( IV), взаимодействует с F с образованием фторида серы.
Вывод.
Сера при химических реакциях может быть и окислителем и восстановителем, как ярко выраженный типичный неметалл.
А в каком же виде сера встречается в природе?
Слайд
№ 10. Сера самородная.
Она встречается в природе как в самородном виде, так и в виде соединений.
В фантастическом романе В.А. Обручева «Плутония» об экспедиции ученых в неведомый мир под земной поверхностью, читаем: «…За площадкой круто поднималась противоположная стена, густо покрытая белыми, желтыми и красными налетами и натеками.
В желтых налетах нетрудно было узнать самородную серу в виде мелких и крупных кристаллов сидевших в пустотах лавы или покрывавших ее поверхность нетолстым слоем».
-У вас на столах образцы разных минералов, найдите среди них серу.
-Помог ли вам только что зачитанный отрывок?.
-По каким признакам вы ее узнали.?
Слайд № 11. Таблица минералов.
Еще чаще сера встречается в виде соединений.
Слайд № 12 . Пирит.
Среди
них большое значение имеет минерал
–пирит.
Пирит -огненный камень, и именно в этой роли он был известен еще на заре человечества.
Кусок пирита выполнял функцию огнива.
Этот достаточно распространенный минерал стал для наших далеких предков ступенькой к цивилизации.
Мы сегодня с вами познакомились со строением атома серы, с ее аллотропными модификациями, и напрашивается вопрос
А зачем, с какой целью мы это изучаем?
-
Чтобы узнать о применении серы в настоящее время.
-
Какие области применения серы вам известны?
-
Кто может назвать?
-
Откройте учебник стр._____ абзац _____________
Дополните!
«В
полночный час с горящего вулкана возьми
немного серы, смерть дарящей, и мелкий
порошок её смешав с составом чудотворным,
для ран бальзам получишь, краски для
картин, а дымом едким нечисть всю убьешь…»
-, так писал античный поэт Лукреций Кар
об удивительном веществе сере.
Шло время, эти жёлтые кристаллы находили всё новые и новые области применения.
Слад № 13. Области применения.
Их используют для чернения оружия и изготовления пороха. Тысячелетия жизнь людей связана с серой. И каждый из нас связан с этим обычным и необычным веществом – серой.
Д/з §21 стр. 96-99. Задание 1 и 5 для всех, 3 – кто увлекается химией.
Я обращаю ваше внимание, на дополнительную литературу по данной теме.
1-ая книга для чтения по химии расскажет об атомах S. Стр.____
2-ая книга «Химия жизни».
В этой книге вы прочитаете о влиянии S на наш организм, потому что она входит в состав белков, и эта книга вам поможет более полно раскрыть функцию белков на уроках биологии. Стр. _______.
У нас
осталось с вами время, и мне хотелось
бы знать степень усвоения данного
материала.
Тесты
Всего вам доброго!
Сера, химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.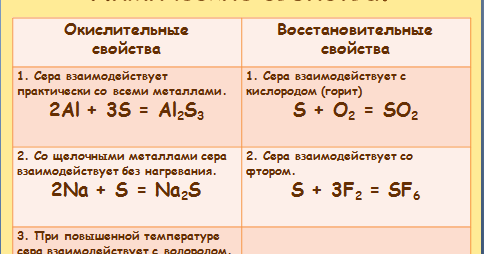
Чтобы получить подробное описание элемента, кликните по его названию.
Сера, подготовка к ЕГЭ по химии
Сера — элемент VIa группы 3 периода периодической таблицы Д.И. Менделеева. Относится к группе халькогенов — элементов VIa группы.
Сера — S — простое вещество имеет светло-желтый цвет. Использовалась еще до нашей эры в составе священных курений при религиозных обрядах.
Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.
Природные соединения
- FeS2 — пирит, колчедан
- ZnS — цинковая обманка
- PbS — свинцовый блеск (галенит), Sb2S3 — сурьмяный блеск, Bi2S3 — висмутовый блеск
- HgS — киноварь
- CuFeS2 — халькопирит
- Cu2S — халькозин
- CuS — ковеллин
- BaSO4 — барит, тяжелый шпат
- CaSO4 — гипс
В местах вулканической активности встречаются залежи самородной серы.
Получение
В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S, SO2.
H2S + O2 = S + H2O (недостаток кислорода)
SO2 + C = (t) S + CO2
Серу можно получить разложением пирита
FeS2 = (t) FeS + S
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
H2S + H2SO4 = S + H2O
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
На воздухе сера окисляется, образуя сернистый газ — SO2. Реагирует со многими неметаллами, без нагревания —
только со фтором.
S + O2 = (t) SO2
S + F2 = SF6
S + Cl2 = (t) SCl2
S + C = (t) CS2
При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
K + S = (t) K2S
Al + S = (t) Al2S3
Fe + S = (t) FeS
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
S + H2SO4 = (t) SO2 + H2O
S + HNO3 = (t) H2SO4 + NO2 + H2O
Сера вступает в реакции диспропорционирования с щелочами.
S + KOH = (t) K2S + K2SO3 + H2O
Сера вступает в реакции с солями. Например, в кипящем водном растворе сера может реагировать с сульфитами с образованием тиосульфатов.
Na2SO3 + S → (t) Na2S2O3
Сероводород — H
2SБесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные ванны).
Получение
Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.
Al2S3 + H2O = (t) Al(OH)3↓ + H2S↑
FeS + HCl = FeCl2 + H2S↑
Химические свойства
- Кислотные свойства
- Восстановительные свойства
- Качественная реакция
Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит
от соотношения основания и кислоты).
Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит
от соотношения основания и кислоты).
MgO + H2S = (t) MgS + H2O
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
2KOH + H2S = K2S + 2H2O
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Ca + H2S = (t) CaS + H2
Сероводород — сильный восстановитель (сера в минимальной степени окисления S2-). Горит в кислороде синим пламенем, реагирует с кислотами.
H2S + O2 = H2O + S (недостаток кислорода)
H2S + O2 = H2O + SO2 (избыток кислорода)
H2S + HClO3 = H2SO4 + HCl
Качественной реакцией на сероводород является реакция с солями свинца, при котором образуется сульфид свинца.
H2S + Pb(NO3)2 = PbS↓ + HNO3
Оксид серы — SO
2Сернистый газ — SO2 — при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся спички).
Получение
В промышленных условиях сернистый газ получают обжигом пирита.
FeS2 + O2 = (t) FeO + SO2
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота, распадающаяся на сернистый газ и воду.
K2SO3 + H2SO4 = (t) K2SO4 + H2O + SO2↑
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
Cu + H2SO4(конц.) = (t) CuSO4 + SO2 + H2O
- Кислотные свойства
- Восстановительные свойства
- Как окислитель
С основными оксидами, основаниями образует соли сернистой кислоты — сульфиты.
K2O + SO2 = K2SO3
NaOH + SO2 = NaHSO3
2NaOH + SO2 = Na2SO3 + H2O
Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
Fe2(SO4)3 + SO2 + H2O = FeSO4 + H2SO4
SO2 + O2 = (t, кат. — Pt) SO3
— Pt) SO3
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
CO + SO2 = CO2 + S
H2S + SO2 = S + H2O
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Получение
SO2 + H2O ⇄ H2SO3
Химические свойства
- Диссоциация
- Кислотные свойства
- Окислительные свойства
- Восстановительные свойства
Диссоциирует в водном растворе ступенчато.
H2SO3 = H+ + HSO3—
HSO3— = H+ + SO32-
В реакциях с основными оксидами, основаниями образует соли — сульфиты и гидросульфиты.
CaO + H2SO3 = CaSO3 + H2O
H2SO3 + 2KOH = 2H2O + K2SO3 (соотношение кислота — основание, 1:2)
H2SO3 + KOH = H2O + KHSO3 (соотношение кислота — основание, 1:1)
С сильными восстановителями сернистая кислота принимает роль окислителя.
H2SO3 + H2S = S↓ + H 2O
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.
H2SO3 + Br2 = H2SO4 + HBr
Оксид серы VI — SO
3
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
Бесцветная летучая жидкость с удушающим запахом. Ядовит.
Получение
В промышленности данный оксид получают, окисляя SO2 кислородом при нагревании и присутствии катализатора (оксид ванадия — Pr, V2O5).
SO2 + O2 = (кат) SO3
В лабораторных условиях разложением солей серной кислоты — сульфатов.
Fe2(SO4)3 = (t) SO3 + Fe2O3
Химические свойства
- Кислотные свойства
- Окислительные свойства
Является кислотным оксидом, соответствует серной кислоте. При реакции с основными оксидами и основаниями образует ее соли — сульфаты и гидросульфаты. Реагирует с водой с образованием серной кислоты.
SO3 + 2KOH = K2SO4 + 2H2O (основание в избытке — средняя соль)
SO3 + KOH = KHSO4 + H2O (кислотный оксид в избытке — кислая соль)
SO3 + Ca(OH)2 = CaSO4 + H2O
SO3 + Li2O = Li2SO4
SO3 + H2O = H2SO4
SO3 — сильный окислитель. Чаще всего восстанавливается до SO2.
Чаще всего восстанавливается до SO2.
SO3 + P = SO2 + P2O5
SO3 + H2S = SO2 + H2O
SO3 + KI = SO2 + I2 + K2SO4
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
«Сера. Аллотропия. Свойства и применение».
Выполнил: учитель химии Канаев Семен Иванович МБОУ Джебарики-Хаинская СОШ, п.Джебарики-Хая, Республика Саха/Якутия Учитель химии Канаев Семен Иванович МБОУ Джебарики-Хаинская СОШ, Республика Саха/Якутия
Сера. Аллотропия. Свойства и применение.
Сера — элемент III периода, VI группы, главной подгруппы. Заряд ядра атома серы равен +16. В ядре атома серы 16 протонов, 16 нейтронов. В атоме серы 16 электронов. Электронное строение атома серы На внешнем уровне в атоме 6 электронов. Степень окисления атома серы низшая равна -2 , высшая равна +6 Простое вещество сера являетcя неметаллом. Формула высшего оксида серы SO3 , его характер кислотный . Формула гидроксида серы h3SO4 , его характер кислотный . Поставьте пропущенные слова 1s2 2s2 3s2 3p4 2p6
Валентные состояния атома серы
Валентность IV,
Ст. окисления +4
Валентность VI,
Ст. окисления +6
Валентность II,
ст. окисления -2, +2
3s
3p
3d0
3s
3p
3d
3s
3p
3d
окисления +4
Валентность VI,
Ст. окисления +6
Валентность II,
ст. окисления -2, +2
3s
3p
3d0
3s
3p
3d
3s
3p
3d
Задание. Задание. Определите степени окисления серы в следующих соединениях: S, h3S, Na2S, SO2, SO3, h3SO3, h3SO4, Na2SO3, Na2SO4 и запишите их в таблицу. Характерная степень окисления Примеры веществ — 2 0 + 4 + 6
! В природе сера встречается очень часто, она входит в состав многих органических и минеральных веществ, а также в самородном виде. Нахождение серы в природе ! Сера является шестнадцатым по химической распространённости элементом в земной коре — 0,052 % Самородная сера Сульфидная сера Сульфатная сера Ромбическая сера S8 Сероводород h3S, киноварь HgS, свинцовый блеск PbS, пирит FeS2 Гипс CaSO4 · 2h3O, глауберовая соль Na2SO4 ·10h3O
сфалерит
Сфалерит, цинковая обманка -ZnS Химический состав содержание (в %): Zn— 67,1; S — 32,9; из примесей наиболее характерно железо Из сфалерита выплавляют металлический Zn. Сфалерит используют в лакокрасочном производстве для изготовления цинковых белил. Большое значение имеет получение из природного сфалерита химически чистого ZnS, применяемого как люминофор.
Сфалерит используют в лакокрасочном производстве для изготовления цинковых белил. Большое значение имеет получение из природного сфалерита химически чистого ZnS, применяемого как люминофор.
Пирит Пирит — FeS2, Химический состав содержание (в %): Fe— 46,6; S — 53,4; отмечаются незначительные примеси кобальта, никеля, мышьяка, сурьмы, меди, золота, серебра, селена. один из самых распространённых в Земной коре сульфидов. Является сырьём для получения серной кислоты, серы и железного купороса.
Галенит Галенит, свинцовый блеск -PbS. Химический состав—содержание (в %): Pb— 86,6; S — 13,4; обычны примеси серебра, селена, висмута, мышьяка, сурьмы, меди, цинка.
Аллотропия серы Аллотропные модификации серы Ромбическая Моноклинная Пластическая При нормальных условиях все модификации серы с течением времени превращаются в ромбическую Опыт
Сера ромбическая
Сера моноклинная
Цвет – лимонно-желтый;
tпл. = 112,8ºС; ρ = 2,07г/см3
Цвет – медово-желтый; tпл. = 119,3ºС; ρ = 1,96г/см3
сера пластическая
Цвет – темно-коричневый; tпл. = 444,6ºС; ρ = 1,96г/см3
= 119,3ºС; ρ = 1,96г/см3
сера пластическая
Цвет – темно-коричневый; tпл. = 444,6ºС; ρ = 1,96г/см3
Аллотропные модификации серы. Аллотропные модификации серы. Аллотропная модификация Строение молекулы Формула Физические свойства Кристаллическая сера Пластическая сера
с сложными веществами с неметаллами металлами Химические свойства cеры S
Химические свойства серы Взаимодействие с металлами (искл. золото, платина ) 2Na0 + S0 = Na2+1S-2 Na 0 — 1е → Na+1 восстановитель S 0 + 2е → S-2 окислитель демеркуризация Нg + S = HgS Образуются сульфиды 1 группа
Взаимодействие Взаимодействие с водородом h30 + S0 = h3+1 S-2 h3 0 — 2е → 2H+1 восстановитель S0 + 2е → S-2 окислитель Химические свойства cеры 2 группа
Взаимодействие Взаимодействие с кислородом O20 + S0 = S+4 O2-2 S0 — 4е → S+4 восстановитель O2 0 + 4е → 2О-2 окислитель Химические свойства серы Взаимодействие серы с кислородом 3 группа
Применение серы Медицина Производство серной кислоты Сельское хозяйство Производство спичек Производство резины Производство взрывчатых веществ Красители
Проверка знаний Тест «Сера»
Используемые источники
Учебниках Рудзитиса Г. Е., Фельдмана Ф.Г. «Химия 9».- М.: «Просвещение», 2010г
М.Фримантл «Химия в действии», 2 часть, М,, Мир, 1991 г, стр191-192;
http://ru.wikipedia.org/wiki/
http://www.catalogmineralov.ru/1.html
http://webelements.narod.ru/elements/S.htm
http://www.uchmarket.ru/n_2237_9.htm
http://archive.businesskomi.ru/rk/branches/4887/
http://www.mtodelta.ru/?id=histal1
Е., Фельдмана Ф.Г. «Химия 9».- М.: «Просвещение», 2010г
М.Фримантл «Химия в действии», 2 часть, М,, Мир, 1991 г, стр191-192;
http://ru.wikipedia.org/wiki/
http://www.catalogmineralov.ru/1.html
http://webelements.narod.ru/elements/S.htm
http://www.uchmarket.ru/n_2237_9.htm
http://archive.businesskomi.ru/rk/branches/4887/
http://www.mtodelta.ru/?id=histal1
Соединения серы (IV)
SO
2 — оксид серы (IV). Физические свойства.SO2 — диоксид серы, сернистый газ, сернистый ангидрид. При обычной температуре — бесцветный газ с резким запахом, хорошо растворим в воде (в 1 л воды при 20°С растворяется — 40 л SO2).
Способы получения
1. Окисление кислородом серы, сероводорода, сульфидов
2. Термическое разложение сульфитов
CaSO3 = СаО + SO2↑
3.Действие сильных кислот на сульфиты
Na2SO3 + 2HCl = SO2 + Н2O + 2NaCI
4. Взаимодействие конц. H2SO4 с восстановителями, например:
Взаимодействие конц. H2SO4 с восстановителями, например:
2H2SO4 + Си = SO2↑ + CuSO4 + 2Н2O
Химические свойства
При растворении SO2 в воде происходит его частичное соединение с молекулами воды — об разуется слабая сернистая кислота.
SO2 + СаО = CaSO3 сульфит кальция
SO2 + NaOH = NaHSO3 гидросульфит натрия
SO2 + 2NaOH = Н2O + Na2SO3 сульфит натрия
Диоксид серы окисляется в газовой фазе до SO3:
2SO2 + O2 = SO3
SO2 + O3 = SO3+ O2
SO2+ NO2 = SO3 + NO
На свету легко окисляется хлором:
SO2 + Cl2 — SO2Cl2 хлористый сульфурил
В водных растворах при окислении SO2 образуется серная кислота H2SO4:
SO2 + 2HNO3 = H2SO4 + 2NO2
SO2 + Н2O2 = H2SO4
Обесцвечивание окрашенных окислителей (КМпO4 и Вr2) — качественная реакция для распознавания SO2 (например, отличие его от СO2, СО, СН4 и многих других газов):
SO2 + Вr2 + 2Н2О = H2SO4 + 2НВr
3SO2 + 2КМпO4 + 4Н2О = 3H2SO4 + 2MnO2↓ + 2КОН
Продуктом восстановления SO2 чаще всего является свободная сера.
SO2 + 2Н2S = 3S↓ + 2Н2О
SO2 + 2СО = S + 2CO2
H
2SO3 — сернистая кислотаВ свободном состоянии не выделена. Очень непрочное соединение. Образуется при растворении SO2 в воде. Обладает свойствами слабой кислоты.
Сульфиты и гидросульфиты
2-х основная сернистая кислота образует при взаимодействии со щелочами 2 ряда солей: нормальные (средние) — сульфиты Mex(SO3)y и кислые — гидросульфиты Me(HSO3)x.
Сульфиты щелочных Me и аммония растворимы в воде. Сульфиты остальных Me нерастворимы в воде (или не существуют).
Гидросульфиты Me хорошо растворимы в Н2O, некоторые из них существуют только в растворе, например, Ca(HSO3)2.
Водные растворы сульфитов вследствие гидролиза имеют щелочную среду (окрашивают лакмус в синий цвет).
SO3— + Н2O = HSO3— + ОН—
Na2SO3 + Н2O = NaHSO3 + NaOH
Химические свойства сульфитов
1. Взаимодействие с сильными кислотами:
Взаимодействие с сильными кислотами:
Na2SO3 + 2HCl = 2NaCl + SO2↑ + Н2O
NaHSO3 + HCl = NaCl + SO2↑ + Н2O
Оба типа солей разлагаются сильными кислотами, при этом слабая сернистая кислота вытесняется в виде SO2 и Н2O.
2. Термическое разложение сульфитов:
CaSO3 = СаО + SO2↑
3. Нормальные сульфиты в водных растворах, содержащих избыток SO2, превращаются в гидросульфиты
CaSO3 + SO2 + Н2O = Ca(HSO3)sub>2
Благодаря этой реакции нерастворимые в воде сульфиты превращаются в растворимые гидросульфиты
4. Ионно-обменные реакции с другими солями, приводящие к образованию нерастворимых сульфитов:
Na2SO3 + ZnCl2 = ZnSO3↓ + 2NaCl
I. Сульфиты как восстановители.
Сульфиты, подобно SO2, могут быть и восстановителями, и окислителями, поскольку атомы серы в анионах SO3 находятся в промежуточной С. О. +4
О. +4
В водных растворах и сульфиты, и гидросульфиты легко окисляются до сульфатов. Примеры реакций:
Na2SO3 + Вr2 + Н2O = Na2SO4 + 2НВr
5K2SO3 + 2КМпO4 + 3H2SO4 = 6K2SO4 + 2MnSO4 + 3Н2O
Даже твердые сульфиты при хранении на воздухе медленно окисляются до сульфатов:
2Na2SO3 + O2 = 2Na2SO4
II. Сульфиты как окислители.
Эти реакции не столь многочисленны. При нагревании сухих сульфитов с такими активными восстановителями, как С, Mg, Al, Zn, они переходят в сульфиды:
Na2SO3 + ЗС = Na2S + ЗСО
III. Диспропорционирование сухих сульфитов.
При нагревании до высоких температур сульфиты медленно превращаются в смесь сульфатов и сульфидов:
4K2SO3 = 3K2SO4 + K2S
| Металл характеризуется спектром, содержащим две яркие линии синего цвета (отсюда его название). Области применения Цезий используется в промышленности в качестве активатора катализатора, повышающего эффективность других оксидов металлов в емкости и для гидрирования органических соединений. Нитрат цезия используется для изготовления оптических стекол.Цезий иногда используется для удаления следов кислорода из вакуумных трубок и лампочек. Соли цезия используются для упрочнения различных видов стекла. Цезий в окружающей среде Хотя цезия гораздо меньше, чем других щелочных металлов, он все же более распространен, чем такие элементы, как мышьяк, йод и уран.Минералов цезия известно немного, основным является поллюцит: это силикатные магмы, остывшие от гранитов.
Назад к периодическим элементам диаграммы . | |
Осмий (Os) – химические свойства, влияние на здоровье и окружающую среду
Осмий
Осмий – блестящий серебристый металл, один из металлов так называемой платиновой группы. Это самый плотный из известных металлов, хотя и очень узкий. Осмий не действует на воду и кислоты, но растворяется в расплавленных щелочах. Порошок осмия медленно реагирует с кислородом воздуха и выделяет заметное количество паров четырехокиси осмия.
Применение
Металл используется в некоторых сплавах и в промышленности в качестве катализатора. Когда-то его можно было встретить в перьях высококачественных перьевых ручек, иглах компаса, долговечных иглах граммофонов и подшипниках часов благодаря его исключительной твердости и коррозионной стойкости.
Осмий в окружающей среде
Осмий в основном встречается в сплавах с другими платиновыми металлами, из которых он извлекается в промышленных масштабах. Наиболее важными рудами являются иридосмин и осмиридий.Иридосмин — редкий минерал, встречающийся в России, Северной и Южной Америке. Ежегодно производится менее 100 кг. Спрос на металл, который трудно изготовить, невелик.
Воздействие осмия на здоровье
Четырехокись осмия OsO 4 высокотоксична. Даже такие низкие концентрации в воздухе, как 10 -7 г·м -3 , могут вызвать застой в легких, повреждение кожи и серьезное повреждение глаз. В частности, с оксидом должен работать только квалифицированный химик.
Четырехокись осмия может всасываться в организм при вдыхании его паров, при вдыхании аэрозоля и при приеме внутрь.
Риск при вдыхании: При испарении этого вещества при 20°C очень быстро может быть достигнуто опасное загрязнение воздуха.
Вдыхание: Ощущение жжения. Кашель. Головная боль. Свистящее дыхание. Одышка. Зрительные расстройства. Симптомы могут проявиться позже. Кожа: Покраснение.Кожа горит. Боль. Изменение цвета кожи. волдыри. Глаза: Покраснение. Боль. Затуманенное зрение. Потеря зрения. Тяжелые глубокие ожоги. Проглатывание: Спазмы в животе. Обжигающее ощущение. Шок или коллапс.
Химическая опасность: Вещество разлагается при нагревании с образованием паров осмия. Вещество является сильным окислителем и реагирует с горючими материалами и восстановителями. Реагирует с соляной кислотой с образованием токсичного газообразного хлора.Со щелочами образует нестойкие соединения.
Последствия кратковременного воздействия: Слезоточивость. Вещество разъедает глаза, кожу и дыхательные пути. Вдыхание этого вещества может вызвать отек легких. Воздействие высоких концентраций может привести к смерти. Эффекты могут быть отсрочены.
Воздействие высоких концентраций может привести к смерти. Эффекты могут быть отсрочены.
Последствия длительного или многократного воздействия: Повторяющийся или продолжительный контакт с кожей может вызвать дерматит. Вещество может оказывать действие на почки.
Воздействие осмия на окружающую среду
Информация не найдена в наших избранных ссылках. Однако мы ожидаем, что экотоксичность осмия будет очень низкой из-за его силы в качестве окислителя, что позволяет легко превращать его в диоксид, форму металла, которая является достаточно безвредной.
Вернуться к периодическим элементам диаграммы.
| Свойства серы — Каковы физические свойства серы?
*Аллотропные — Аллотропы — это формы элемента с разными физическими и химическими свойствами, встречающиеся в двух или более кристаллических формах в одном и том же физическом состоянии. Свойства серы. Каковы химические свойства серы?
Факты и информация о свойствах серы | |||
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера для приема файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.
 Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
18.10 Наличие, получение и свойства серы – химия
Глава 18.Типичные металлы, металлоиды и неметаллы
Цели обучения
К концу этого раздела вы сможете:
- Описать свойства, получение и использование серы
Сера существует в природе в виде элементарных отложений, а также в виде сульфидов железа, цинка, свинца и меди, а также сульфатов натрия, кальция, бария и магния. Сероводород часто является компонентом природного газа и встречается во многих вулканических газах, подобных газам, показанным на рисунке 1.Сера входит в состав многих белков и необходима для жизни.
Сероводород часто является компонентом природного газа и встречается во многих вулканических газах, подобных газам, показанным на рисунке 1.Сера входит в состав многих белков и необходима для жизни.
Процесс Frasch , показанный на рис. 2, играет важную роль в добыче свободной серы из огромных подземных месторождений в Техасе и Луизиане. Перегретая вода (170 °C и давление 10 атм) подается по крайней из трех концентрических труб в подземное месторождение. Горячая вода плавит серу.Самая внутренняя труба направляет сжатый воздух в жидкую серу. Воздух заставляет жидкую серу, смешанную с воздухом, течь вверх через выпускную трубу. Перенос смеси в большие отстойники позволяет отделить твердую серу при охлаждении. Эта сера имеет чистоту от 99,5% до 99,9% и не требует очистки для большинства применений.
Рисунок 2. Процесс Фраша используется для добычи серы из подземных месторождений.
Большие количества серы также поступают из сероводорода, извлеченного при очистке природного газа.
Сера существует в нескольких аллотропных формах. Стабильная форма при комнатной температуре содержит восьмичленные кольца, поэтому истинная формула S 8 . Однако химики обычно используют S для упрощения коэффициентов в химических уравнениях; мы будем следовать этой практике в этой книге.
Подобно кислороду, который также входит в группу 16, сера проявляет отчетливо неметаллические свойства. Он окисляет металлы, давая множество бинарных сульфидов, в которых сера проявляет отрицательную степень окисления (2-).{\;\;2-}(водный раствор)\;+\;6\text{NO}_2(g)[/latex]
Химический состав серы со степенью окисления 2- аналогичен химическому составу кислорода. Однако, в отличие от кислорода, сера образует множество соединений, в которых она проявляет положительные степени окисления.
Сера (группа 16) реагирует почти со всеми металлами и легко образует сульфид-ион S 2-, в котором она имеет степень окисления 2-. Сера реагирует с большинством неметаллов.
Сера реагирует с большинством неметаллов.
Химия Упражнения в конце главы
- Объясните, почему сероводород при комнатной температуре представляет собой газ, тогда как вода с более низкой молекулярной массой является жидкостью.
- Укажите степень гибридизации и окисления серы в SO 2 , в SO 3 и в H 2 SO 4 .
- Какая кислота сильнее, NaHSO 3 или NaHSO 4 ?
- Определите степень окисления серы в SF 6 , SO 2 F 2 и KHS.
- Какая кислота сильнее, серная кислота или серная кислота? Почему?
- Кислород образует двойные связи в O 2 , а сера образует одинарные связи в S 8 .Почему?
- Назовите структуру Льюиса каждого из следующих элементов:
(а) СФ 4
(б) К 2 СО 4
(с) SO 2 Cl 2
(г) Н 2 SO 3
(д) СО 3
- Напишите два сбалансированных химических уравнения, в которых серная кислота действует как окислитель.

- Объясните, почему ковалентная молекула серной кислоты H 2 SO 4 растворяется в воде и образует раствор, содержащий ионы.
- Сколько граммов английской соли (MgSO 4 ⋅7H 2 O) образуется из 5,0 кг магния?
Глоссарий
- Процесс Фраша
- важное значение при добыче свободной серы из огромных подземных месторождений
Решения
Ответы на упражнения по химии в конце главы
2. СО 2 , сп 2 4+; SO 3 , сп 2 , 6+; H 2 SO 4 , sp 3 , 6+
4.SF 6 : S = 6+; SO 2 F 2 : S = 6+; KHS: S = 2−
6. Сера способна образовывать двойные связи только при высоких температурах (в основном эндотермических условиях), чего нельзя сказать о кислороде.
8. Существует много возможных ответов, включая:
Существует много возможных ответов, включая:
[латекс]\текст{Cu}(s)\;+\;2\text{H}_2\text{SO}_4(l)\;{\longrightarrow}\ ;\text{CuSO}_4(водн.)\;+\;\text{SO}_2(g)\;+\;2\text{H}_2\text{O}(l)[/latex]
[ латекс]\текст{C}(s)\;+\;2\text{H}_2\text{SO}_4(l)\;{\longrightarrow}\;\text{CO}_2(g)\; +\;2\text{SO}_2(g)\;+\;2\text{H}_2\text{O}(l)[/latex]
10.5,1 × 10 4 г
Диоксид серы | Национальный реестр загрязнителей
Описание
В качестве консерванта для фруктов и в качестве пищевого консерванта или добавки.
На стадии ферментации виноделия.
Для отбеливания текстильных волокон.
При производстве бумаги.
В качестве дезинфицирующего средства на пивоваренных и пищевых предприятиях.
В качестве фумиганта для зерна, винограда и цитрусовых.
Информация о веществе
Название вещества: Диоксид серы
Номер CASR: 7446-09-5
Молекулярная формула: SO 2
Синонимы: оксид серы, оксид серы, сернистый ангидрид, диоксид серы
Физические свойства
Бесцветный газ. Сильный, удушающий запах.
Сильный, удушающий запах.
Температура плавления: -75,51°C
Температура кипения: -10,06°C
Удельный вес: 0,00293
Плотность пара: 2,26
Химические свойства
Невоспламеняющийся газ. Диоксид серы может окисляться до триоксида серы, который затем растворяется в воде с образованием серной кислоты.
Дополнительная информация
Национальный реестр загрязнителей ( NPI ) содержит данные обо всех источниках диоксида серы в Австралии.
Описание
Воздействие концентраций от 10 до 50 частей на миллион в течение 5-15 минут вызывает раздражение глаз, носа и горла, удушье и кашель.
Попадание в глаза жидкого диоксида серы (например, в результате промышленной аварии) может вызвать сильные ожоги, приводящие к потере зрения. На коже вызывает ожоги. Другие последствия для здоровья включают головную боль, общий дискомфорт и беспокойство. Люди с нарушениями функции сердца или легких и астматики подвергаются повышенному риску. Повторяющееся или продолжительное воздействие умеренных концентраций может вызвать воспаление дыхательных путей, свистящее дыхание и повреждение легких. Также оказалось, что он вреден для репродуктивной системы экспериментальных животных и вызывает изменения в развитии их новорожденных.
Повторяющееся или продолжительное воздействие умеренных концентраций может вызвать воспаление дыхательных путей, свистящее дыхание и повреждение легких. Также оказалось, что он вреден для репродуктивной системы экспериментальных животных и вызывает изменения в развитии их новорожденных.
Вход в тело
Двуокись серы попадает в организм, если мы вдыхаем загрязненный воздух. При проникновении могут быть поражены нос, горло и легкие. Диоксид серы также может попасть в наш организм, когда мы едим или пьем пищу или напитки (вино), которые содержат диоксид серы в качестве консерванта.Диоксид серы может попасть в организм при контакте с кожей.
Воздействие
Двуокись серы является распространенным загрязнителем, которому мы ежедневно подвергаемся в очень малых количествах при вдыхании воздуха в городах и некоторых промышленных зонах. Более высокие уровни воздействия, скорее всего, будут обнаружены на рабочем месте, где он производится в качестве побочного продукта, например, при плавке и сжигании угля или нефти. Воздействие также может происходить при производстве фумигантов, пищевых консервантов, отбеливателей и виноделия.Его можно проглотить, съев консервированные продукты, и вдохнуть, что представляет риск для астматиков и других людей, чувствительных к его воздействию.
Воздействие также может происходить при производстве фумигантов, пищевых консервантов, отбеливателей и виноделия.Его можно проглотить, съев консервированные продукты, и вдохнуть, что представляет риск для астматиков и других людей, чувствительных к его воздействию.
Стандарты воздействия на рабочем месте
Safe Work Australia устанавливает стандарт воздействия диоксида серы на рабочем месте посредством стандартов воздействия на рабочем месте переносимых по воздуху загрязнителей:
- Максимальное восьмичасовое средневзвешенное значение (TWA): 2 части на миллион (5,2 мг/м 3 )
- Максимальный предел кратковременного воздействия (STEL): 5 частей на миллион (13 мг/м 3 )
Эти стандарты подходят только для использования на рабочих местах и не ограничиваются какой-либо конкретной отраслью или операцией.Убедитесь, что вы понимаете, как интерпретировать стандарты, прежде чем использовать их.
Руководство по питьевой воде
В Австралийских рекомендациях по питьевой воде нет рекомендаций по диоксиду серы.
Описание
Даже низкие концентрации диоксида серы могут нанести вред растениям и деревьям и снизить урожайность сельскохозяйственных культур. Более высокие уровни, и особенно кислотные отложения от кислотных дождей, будут неблагоприятно влиять как на наземные, так и на водные экосистемы.
Вход в среду
Промышленные выбросы диоксида серы могут создавать повышенные, но все же низкие концентрации в атмосфере вокруг источника.Извержения вулканов, хотя и спорадические, вносят значительный вклад в выбросы двуокиси серы в своей местности и вносят вклад в глобальные фоновые уровни двуокиси серы.
Где он заканчивается
Диоксид серы в атмосфере поглощается почвой и растениями. Он также улавливается внутри и под облаками и при определенных обстоятельствах может повышать кислотность вытекающего дождя. Это известно как кислотные дожди, которые происходят в Европе и Северной Америке, но кислотные дожди из диоксида серы не зарегистрированы в Австралии.
Руководство по охране окружающей среды
—
Промышленные источники
Места сжигания ископаемого топлива, особенно электростанции, работающие на угле; промышленные процессы, такие как варка древесины, производство бумаги, переработка нефти и металлов, а также выплавка металлов, особенно из сульфидсодержащих руд, т.е. свинцовые, серебряные и цинковые руды выделяют в воздух диоксид серы.
Диффузные источники и промышленные источники, включенные в данные о диффузных выбросах
Небольшие предприятия по отбеливанию текстиля и консервированию пищевых продуктов, а также винодельни, фумигация – все они выбрасывают в воздух диоксид серы.
Природные источники
Геотермальная деятельность, включая горячие источники и вулканическая деятельность; диоксид серы образуется в результате естественного разложения растительности на суше, водно-болотных угодьях и в океанах — все они выделяют диоксид серы в воздух.
Источники транспорта
Выхлоп автомобиля.
Потребительские товары
Некоторые растворители, средства дехлорирования, отбеливатели и продукты фумигации.
Источники, использованные при подготовке этой информации
- Совет Австралии и Новой Зеландии по окружающей среде и охране природы (ANZECC) (1992), Австралийские рекомендации по качеству пресной и морской воды.
- ChemFinder WebServer Project (1995) (по состоянию на декабрь 1998 г.)
- Мигер, Д. (1991), Словарь австралийской окружающей среды Macmillan, Macmillan Education Australia Pty Ltd.
- Messer MG Industries (1997), Паспорта безопасности материалов (MSDS) (по состоянию на декабрь 1998 г.)
- Micromedex (1995), Базы знаний по здравоохранению, безопасности и окружающей среде (по состоянию на декабрь 1998 г.)
- Национальная академия наук (1995 г.), Лабораторная безопасность: диоксид серы (по состоянию на декабрь 1998 г.)
- Национальный совет по охране окружающей среды (1998 г.), Национальная мера по охране окружающей среды для национального кадастра загрязнителей.
 (по состоянию на декабрь 1998 г.)
(по состоянию на декабрь 1998 г.) - Национальный совет по охране окружающей среды (1998b), Национальная мера по охране окружающей среды в отношении качества атмосферного воздуха.
- Национальная медицинская библиотека (1997 г.), Специализированные информационные службы (по состоянию на декабрь 1998 г.)
- Ричардсон, М. (1992), Словарь веществ и их эффектов, Королевское химическое общество, Clays Ltd, Англия.
- Ситтиг, М. (1991), Справочник по токсичным и опасным химическим веществам и канцерогенам, 3-е издание, Noyes Publications, США.
- Техническая консультативная группа (1999 г.), Заключительный отчет Национальному совету по охране окружающей среды.
- Министерство здравоохранения и социальных служб США (1990), Карманный справочник NIOSH по химическим опасностям, публикация № 90-117.
- Worksafe Australia (1996), Опасное вещество диоксид серы (по состоянию на март 1999 г.)
- Safe Work Australia, Стандарты воздействия переносимых по воздуху загрязнителей на рабочем месте, по состоянию на февраль 2019 г.

- Национальный совет по здравоохранению и медицинским исследованиям (NHMRC), Австралийские рекомендации по питьевой воде (2011 г.) — обновлено в октябре 2017 г., по состоянию на май 2018 г.
Возникновение, получение и свойства серы – химия
OpenStaxCollege
[латексная страница]
Цели обучения
К концу этого раздела вы сможете:
- Описать свойства, получение и использование серы
Сера существует в природе в виде элементарных отложений, а также в виде сульфидов железа, цинка, свинца и меди, а также сульфатов натрия, кальция, бария и магния. Сероводород часто является компонентом природного газа и встречается во многих вулканических газах, подобных показанным на [ссылка].Сера входит в состав многих белков и необходима для жизни.
Вулканические газы содержат сероводород. (кредит: Дэниел Джули/Wikimedia Commons)
Процесс Фраша, показанный в [ссылка], играет важную роль в добыче свободной серы из огромных подземных месторождений в Техасе и Луизиане. Перегретая вода (170 °C и давление 10 атм) подается по крайней из трех концентрических труб в подземное месторождение. Горячая вода плавит серу. Самая внутренняя труба направляет сжатый воздух в жидкую серу.Воздух заставляет жидкую серу, смешанную с воздухом, течь вверх через выпускную трубу. Перенос смеси в большие отстойники позволяет отделить твердую серу при охлаждении. Эта сера имеет чистоту от 99,5% до 99,9% и не требует очистки для большинства применений.
Перегретая вода (170 °C и давление 10 атм) подается по крайней из трех концентрических труб в подземное месторождение. Горячая вода плавит серу. Самая внутренняя труба направляет сжатый воздух в жидкую серу.Воздух заставляет жидкую серу, смешанную с воздухом, течь вверх через выпускную трубу. Перенос смеси в большие отстойники позволяет отделить твердую серу при охлаждении. Эта сера имеет чистоту от 99,5% до 99,9% и не требует очистки для большинства применений.
Процесс Фраша используется для добычи серы из подземных месторождений.
Большие количества серы также поступают из сероводорода, извлеченного при очистке природного газа.
Сера существует в нескольких аллотропных формах.Стабильная форма при комнатной температуре содержит восьмичленные кольца, поэтому истинная формула S 8 . Однако химики обычно используют S для упрощения коэффициентов в химических уравнениях; мы будем следовать этой практике в этой книге.
Подобно кислороду, который также входит в группу 16, сера проявляет отчетливо неметаллические свойства. Он окисляет металлы, давая множество бинарных сульфидов, в которых сера проявляет отрицательную степень окисления (2-). Элементарная сера окисляет менее электроотрицательные неметаллы, а более электроотрицательные неметаллы, такие как кислород и галогены, окисляют ее.{2-} \ влево (вода \ вправо) + 6 {\ текст {NO}} _ {2} \ влево (г \ вправо) \)
Он окисляет металлы, давая множество бинарных сульфидов, в которых сера проявляет отрицательную степень окисления (2-). Элементарная сера окисляет менее электроотрицательные неметаллы, а более электроотрицательные неметаллы, такие как кислород и галогены, окисляют ее.{2-} \ влево (вода \ вправо) + 6 {\ текст {NO}} _ {2} \ влево (г \ вправо) \)
Химический состав серы со степенью окисления 2- аналогичен химическому составу кислорода. Однако, в отличие от кислорода, сера образует множество соединений, в которых она проявляет положительные степени окисления.
Сера (группа 16) реагирует почти со всеми металлами и легко образует сульфид-ион S 2-, в котором она имеет степень окисления 2-. Сера реагирует с большинством неметаллов.
Объясните, почему сероводород при комнатной температуре представляет собой газ, тогда как вода с более низкой молекулярной массой является жидкостью.
Укажите степень гибридизации и окисления серы в SO 2 , в SO 3 и в H 2 SO 4 .
SO 2 , sp 2 4+; SO 3 , сп 2 , 6+; H 2 SO 4 , sp 3 , 6+
Какая кислота сильнее, NaHSO 3 или NaHSO 4 ?
Определить степень окисления серы в SF 6 , SO 2 F 2 и KHS.
SF 6 : S = 6+; SO 2 F 2 : S = 6+; KHS: S = 2−
Какая кислота сильнее, серная кислота или серная кислота? Почему?
Кислород образует двойные связи в O 2 , а сера образует одинарные связи в S 8 . Почему?
Сера способна образовывать двойные связи только при высоких температурах (преимущественно в эндотермических условиях), чего нельзя сказать о кислороде.
Назовите структуру Льюиса каждого из следующих:
(а) СФ 4
(б) К 2 СО 4
(с) SO 2 Cl 2
(г) Н 2 SO 3
(д) СО 3
Напишите два сбалансированных химических уравнения, в которых серная кислота действует как окислитель.
Есть много возможных ответов, включая:
\(\ text{Cu}\left(s\right)+2{\text{H}}_{2}{\text{SO}}_{4}\left(l\right)\phantom{\ правило {0.2em} {0ex}} ⟶ \ phantom {\ правило {0.2em} {0ex}} {\ text {CuSO}} _ {4} \ влево (вода \ вправо) + {\ текст {SO}} _ {2} \ влево (г \ вправо) + 2 {\ текст {H}} _ {2} \ текст {O} \ влево (л \ вправо) \)
\(\ text{C}\left(s\right)+2{\text{H}}_{2}{\text{SO}}_{4}\left(l\right)\phantom{\ правило {0.2em} {0ex}} ⟶ \ phantom {\ правило {0.2em} {0ex}} {\ text {CO}} _ {2} \ влево (г \ вправо) + 2 {\ текст {SO}} _ {2} \ влево (г \ вправо) + 2 {\ текст {H}} _ {2} \ текст {O} \ влево (л \ вправо) \)
Объясните, почему серная кислота, H 2 SO 4 , представляющая собой ковалентную молекулу, растворяется в воде и образует раствор, содержащий ионы.
Сколько граммов английской соли (MgSO 4 ⋅7H 2 O) образуется из 5,0 кг магния?
Глоссарий
- Процесс Фраша
- важное значение при добыче свободной серы из огромных подземных месторождений


 Это серебристо-золотой, мягкий и пластичный. Это самый электроположительный и самый щелочной элемент. Цезий, галлий и ртуть — единственные три металла, которые находятся в жидком состоянии при комнатной температуре или около нее. Цезий взрывоопасно реагирует с холодной водой и реагирует со льдом при температуре выше -116°С.Гидроксид цезия является сильным основанием и разъедает стекло. Цезий реагирует с галогенами с образованием фторида, хлорида, бромида и йодида. Металлический цезий быстро окисляется на воздухе и может образовывать опасный супероксид на своей поверхности.
Это серебристо-золотой, мягкий и пластичный. Это самый электроположительный и самый щелочной элемент. Цезий, галлий и ртуть — единственные три металла, которые находятся в жидком состоянии при комнатной температуре или около нее. Цезий взрывоопасно реагирует с холодной водой и реагирует со льдом при температуре выше -116°С.Гидроксид цезия является сильным основанием и разъедает стекло. Цезий реагирует с галогенами с образованием фторида, хлорида, бромида и йодида. Металлический цезий быстро окисляется на воздухе и может образовывать опасный супероксид на своей поверхности.  Хлорид используется в фотоэлементах, в оптических приборах и для повышения чувствительности электронных ламп. Цезий используется в атомных часах, а в последнее время — в ионных двигательных установках.
Хлорид используется в фотоэлементах, в оптических приборах и для повышения чувствительности электронных ламп. Цезий используется в атомных часах, а в последнее время — в ионных двигательных установках.  Эти аварии не происходили после Чернобыльской катастрофы в 1986 году. Люди, работающие в атомной энергетике, могут подвергаться воздействию более высоких уровней цезия, но для предотвращения этого можно принять множество мер предосторожности.
Эти аварии не происходили после Чернобыльской катастрофы в 1986 году. Люди, работающие в атомной энергетике, могут подвергаться воздействию более высоких уровней цезия, но для предотвращения этого можно принять множество мер предосторожности.  Он также попадает в воздух, воду и почву при добыче и измельчении руды.
Он также попадает в воздух, воду и почву при добыче и измельчении руды. 
 Физические свойства серы следующие:
Физические свойства серы следующие:  Вязкость уменьшается выше 190°С, а при 300°С сера снова становится текучей жидкостью
Вязкость уменьшается выше 190°С, а при 300°С сера снова становится текучей жидкостью  При нагревании сера вступает в реакцию с металлами, образуя соответствующие сульфиды
При нагревании сера вступает в реакцию с металлами, образуя соответствующие сульфиды