Генетический код. Ген и его роль в биосинтезе белков
В ходе реакций матричного синтеза на основании генетического кода синтезируется полипептид с наследственно обусловленной структурой. Отрезок ДНК, содержащий информацию о структуре определенного полипептида, называется ген.
Однако, ген – это не просто участок ДНК, а единица наследственной информации, носителем которой являются нуклеиновые кислоты. Установлено, что ген имеет сложную структуру.
В большинстве случаев кодирующие участки
(экзоны) разделены некодирующими
(интронами). В то же время, благодаря
альтернативному сплайсингу, деление
участка ДНК на кодирующие и некодирующие
оказывается условным. Некоторые участки
ДНК могут перемещаться относительно
друг друга – их называют мобильными
генетическими элементами (МГЭ). Многие
гены представлены несколькими копиями
– тогда один и тот же белок кодируется
разными участками ДНК.
Процесс экспрессии генов обладает гибкостью: одному участку ДНК может соответствовать несколько полипептидов; один полипептид может кодироваться разными участками ДНК. Окончательная модификация белков происходит с помощью ферментов, которые кодируются различными участками ДНК.
Общие свойства генетического кода.Отражение одних объектов с помощью других называется кодированием. Отражение структуры белков в виде триплетов ДНК называетсякодом ДНК, илигенетическим кодом. Благодаря генетическому коду устанавливается однозначное соответствие между нуклеотидными последовательностями нуклеиновых кислот и аминокислотами, входящими в состав белков. Генетический код обладает следующими основными свойствами:
1. Генетический код триплетен: каждая
аминокислота кодируется триплетом
нуклеотидов ДНК и соответствующим
триплетом иРНК.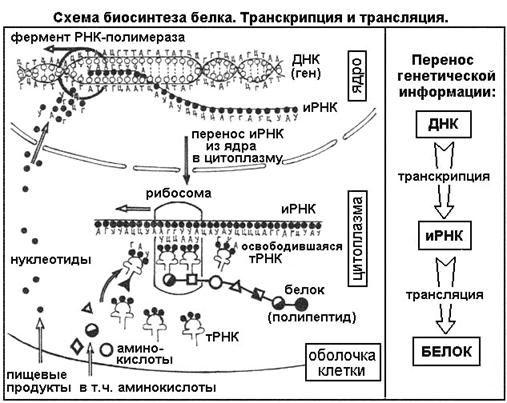 При этом кодоны ничем
не отделены друг от друга (отсутствуют
«запятые»).
При этом кодоны ничем
не отделены друг от друга (отсутствуют
«запятые»).
2. Генетический код является избыточным(вырожденным): почти все аминокислоты могут кодироваться разными кодонами. Только двум аминокислотам соответствует по одному кодону: метионину (АУГ) и триптофану (УГГ). Зато лейцину, серину и аргинину соответствует по 6 разных кодонов.
3. Генетический код является неперекрывающимся: каждая пара нуклеотидов принадлежит только одному кодону (исключения обнаружены у вирусов).
4. Генетический код един для подавляющего большинства биологических систем. Однако имеются и исключения, например, у инфузорий и в митохондриях разных организмов. Поэтому генетический код называют
2. Регуляция экспрессии генов
Все гены организма можно разделить на две большие группы: конститутивные и индуцибельные.
Конститутивные
гены – это гены с постоянной экспрессией,
они постоянно включены, то есть
функционируют на всех стадиях онтогенеза
и во всех тканях.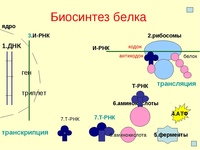 К конститутивным
относятся гены, кодирующие тРНК, рРНК,
ДНК-полимеразы, РНК-полимеразы,
белки-гистоны, белки рибосом и т.д. Иначе
говоря, это «гены домашнего хозяйства»,
без которых клетки не могут существовать.
К конститутивным
относятся гены, кодирующие тРНК, рРНК,
ДНК-полимеразы, РНК-полимеразы,
белки-гистоны, белки рибосом и т.д. Иначе
говоря, это «гены домашнего хозяйства»,
без которых клетки не могут существовать.
Индуцибельные гены («гены роскоши») – это гены с регулируемой экспрессией, они могут включаться и выключаться. У многоклеточных организмов индуцибельные гены их называют тканеспецифичными, потому что они по-разному функционируют в разных тканях на разных этапах онтогенеза. Регуляция активности генов осуществляется и на уровне транскрипции, и на уровне трансляции. Включение генов называется индукцией, а выключение – репрессией. Регуляцию активности генов производят молекулярно-генетические системы управления, в состав которых входят различные эффекторы: индукторы и репрессоры – вещества, осуществляющие индукцию и репрессию.
Роль генов в биосинтезе белка
Информационный модуль посвящен теме «Роль генов в биосинтезе белка» средней школы. Помимо иллюстрированных гипертекстовых материалов в него входят интерактивные модели «Транскрипция и-РНК», «Синтез инсулина методами клеточной инженерии» и «Клонирование». Модуль относится ко II уровню интерактивности
Помимо иллюстрированных гипертекстовых материалов в него входят интерактивные модели «Транскрипция и-РНК», «Синтез инсулина методами клеточной инженерии» и «Клонирование». Модуль относится ко II уровню интерактивности
Категория пользователей
Обучаемый, Преподаватель
Дисциплины
Естествознание
/ Структуры белка. Денатурация
/ Синтез белка. Генетический код
/ Генные мутации
Уровень образования
Профессионально-техническая подготовка, повышение квалификации
Статус
Завершенный вариант (готовый, окончательный)
Тип ИР сферы образования
информационный модуль
Издатель
ЗАО «Фирма «АйТи»
АйТи
ул. Кржижановского, д. 21А,
Тел. — +7-495-974-79-79, +7-495-974-79-79
— +7-495-974-79-79, +7-495-974-79-79
Сайт —
http://www.it.ru
Правообладатель
Федеральное агентство по образованию
Федеральное агентство по образованиюВнимание! Для воспроизведения модуля необходимо установить на компьютере проигрыватель ресурсов.
Характеристики информационного ресурса
Тип используемых данных:
text/plain, text/html
Объем цифрового ИР
2 595 101 байт
Проигрыватель
Категория модифицируемости компьютерного ИР
Признак платности
бесплатный
Наличие ограничений по использованию
нет ограничений
Рубрикация
Ступени образования
Основное общее образование
Целевое назначение
Учебное
Тип ресурса
Открытая образовательная модульная мультимедийная система (ОМС)
Классы общеобразовательной школы
11
Уровень образовательного стандарта
Федеральный
Характер обучения
Базовое
Роль генов в определении строения белка
Данные, полученные при изучении биохимических эффектов мутаций, убедительно показывают, что отдельные гены контролируют биосинтез отдельных белков.
В ряде случаев удалось установить связь между отсутствием или изменением того или иного фермента и мутацией одного определенного гена. Изучение подобных биохимических нарушений не только у микроорганизмов (например, у нейроспоры или у Escherichia coli), но также у человека и других высших организмов привело к созданию концепции «один ген — один фермент».
Еще совсем недавно термин ген в этом контексте служил лишь для обозначения чисто абстрактной единицы наследственности. Ген представляли себе как квант генетической информации, который каким-то путем контролирует биосинтез какого-либо одного белка, или, выражаясь более осторожно, биосинтез какой-либо «функциональной единицы». Достигнутые за последнее время успехи в изучении биохимии хромосом и ДНК, а также в составлении карт «тонкой генетической структуры», которые мы обсуждали в связи с генетикой фагов, позволяют сейчас рассуждать о действии генов не в абстрактной форме, а в терминах химии. Исследования Бензера, Стрейсингера, Демереца и его сотрудников, а также Понтекорво и многих других показали, что, по всей вероятности, идею о линейно-расположенных «генах», разъединяемых при генетической рекомбинации, можно довести до молекулярного уровня.
Если мы в основном примем концепцию «один ген — один фермент» и если мы согласимся с современными воззрениями на роль ДНК как основного вещества, определяющего наследственность, то возникает необходимость серьезно разобрать данные, свидетельствующие о том, что информация, определяющая детали строения белка, заключена в химической структуре молекулы ДНК. Очень соблазнительно также предположить, что точковая мутация представляет собой весьма локальное изменение в последовательности компонентов внутри поли нуклеотидной цепи или в ее пространственной конфигурации и что такое локальное изменение, вероятно, отражается на последовательности аминокислот и свертывании цепи соответствующего белка. Многие исследователи принимают эти допущения в качестве рабочей гипотезы, однако в настоящее время все это главным образом плоды фантазии при весьма скудном фактическом материале.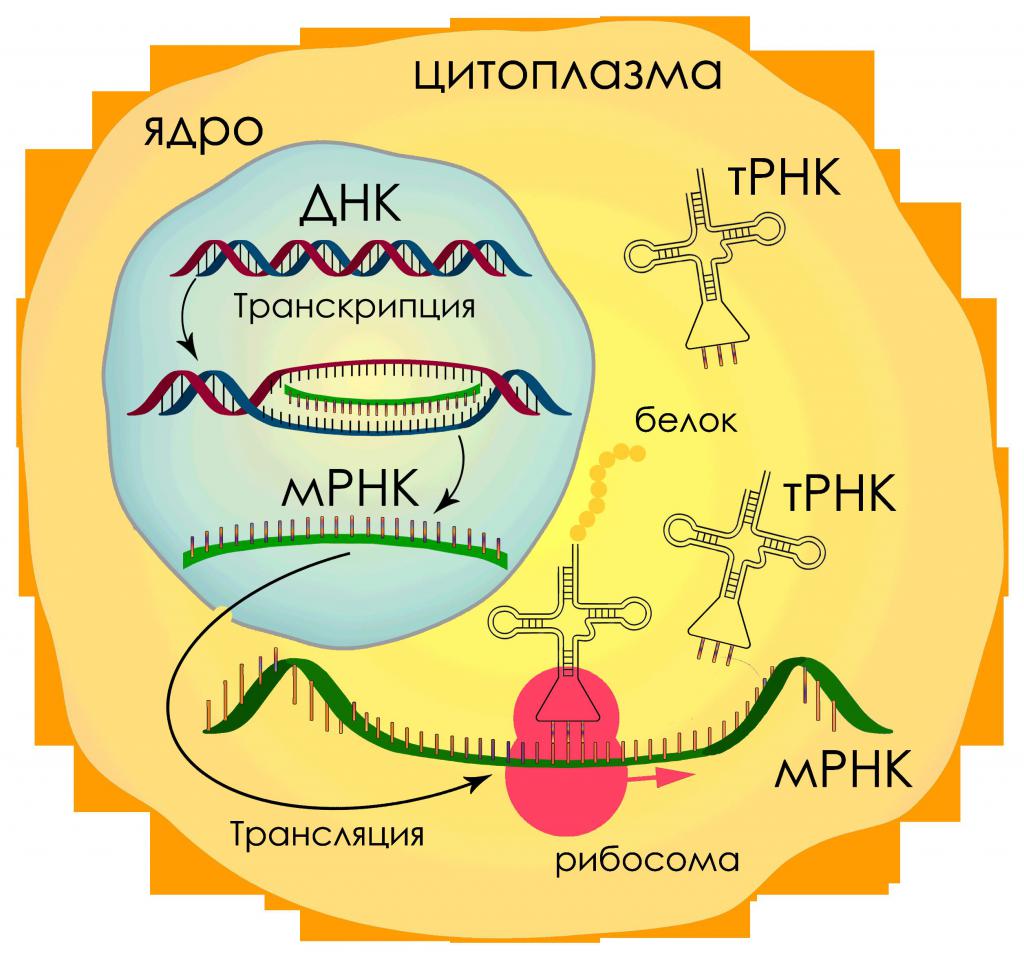
Однако если эта гипотеза приблизительно верна, то мы должны были бы, как указал Горовиц, наблюдать мутации, вызывающие качественные, а также количественные изменения в ферментах и других белках. Например, следовало бы показать, что различные мутации в пределах данного участка генетического материала, определяющего синтез белка, могут привести к образованию «мутантных» форм биологически активного белка, у которых соответствующая функция будет выражена в различной степени. Мутации, вызывающие изменение в тех участках молекулы белка, которые важны для его функции, должны быть летальными, тогда как мутации, оказывающие влияние на менее существенные части молекулы, могут остаться незамеченными, или же, пользуясь генетической терминологией, относиться к типу «растекающихся».
Несмотря на то что известны сотни примеров связи между генами и белками, корреляцию между мутацией отдельного гена и химическими и физическими свойствами какой-либо гомогенной молекулы белка удалось продемонстрировать лишь в небольшом числе случаев. Многие из этих положительных корреляций были обнаружены при изучении белков высших организмов по той простой причине, что достаточно чистые образцы белков легче получить из эритроцитов, молока или плазмы, чем из микроорганизмов. Однако достигнутые в настоящее время: успехи в составлении генетических карт микроорганизмов сильно стимулируют исследования связи между генами и химией белка, и весьма возможно, что объектами, обеспечивающими дальнейшее развитие этой области, послужат именно белки микроорганизмов. Если бы, например, удалось идентифицировать и выделить в чистом виде белок, биосинтез которого контролируется тем участком генетического материала бактериофага Т4, карта которого с таким изяществом составлена Бензером, то, несомненно, удалось бы очень подробно исследовать вопрос о существовании корреляции между «цистроном» и белком. Такой детальный анализ белков человека невозможен, поскольку построение детальных генетических карт человека затруднено по ряду причин.
Такой детальный анализ белков человека невозможен, поскольку построение детальных генетических карт человека затруднено по ряду причин.
Во всех случаях, за исключением гемоглобина человека, различия между нормальным белком и белком, полученным от мутанта, затрагивали подвижность при электрофорезе, устойчивость к высокой температуре и серологические признаки. Заряд, устойчивость и серологические свойства белка представляют собой весьма четко выраженные признаки; поэтому можно считать, что белки, изученные по этим признакам, существуют в виде форм, различия между которыми определяются аллеломорфными генами. Следует, однако, помнить, что мелкие органические молекулы, тесно связанные с белком, могут изменить его заряд, а полисахариды и другие вещества-гаптены — вызвать изменения антигенных свойств. По этим причинам гемоглобин человека представляет собой особенно благоприятный объект, поскольку установлено, что различия в поведении при электрофорезе и в растворимости, наблюдаемые у мутантных форм, действительно связаны с изменениями в последовательности чередования аминокислот.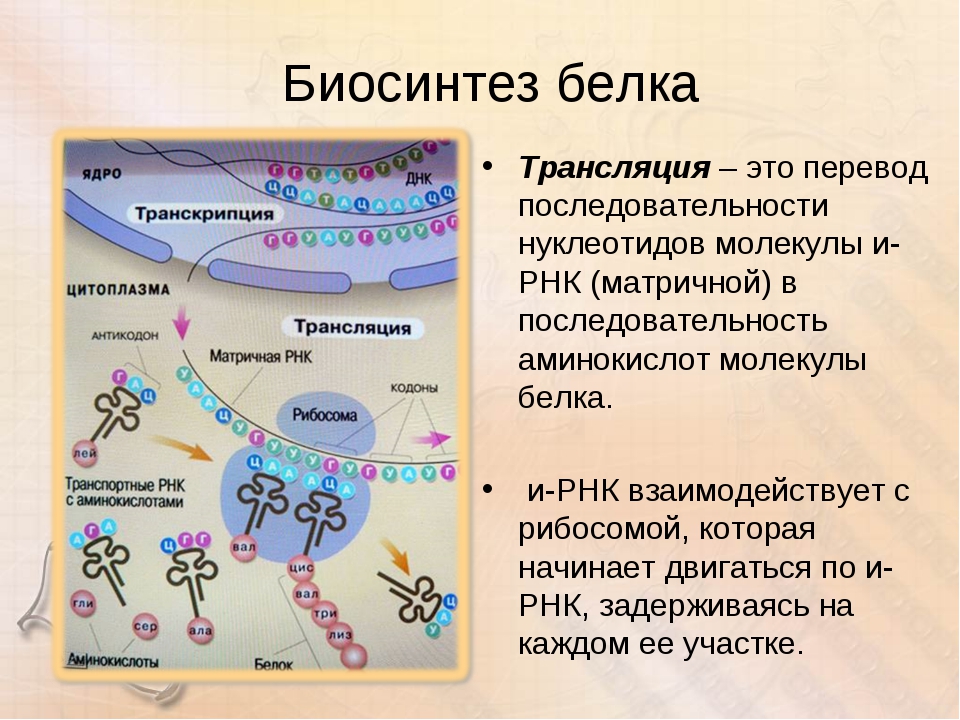
В 1949 г. Полинг, Итано, Сэнджер и Уэллс сделали важное наблюдение. Они установили, что гемоглобин больных серповидноклеточной анемией ведет себя необычно при электрофорезе и что у людей с серповидноклеточностью (бессимптомное состояние) можно обнаружить смесь аномальных серповидных и нормальных клеток. Подробное изучение родословных семей с серповидноклеточной анемией показало, что это часто смертельное заболевание наследуется по Менделю. Путем анализа генетических взаимоотношений между серповидноклеточной анемией и серповидноклеточностью Ниль установил, что образование аномального гемоглобина определяется одним мутантным геном. Генетически анемию можно охарактеризовать как гомозиготное состояние соответствующего гена сиклемии, тогда как серповидноклеточность наблюдается при гетерозиготном его состоянии.
Работы Полинга и Итано с сотрудниками, а также открытие Хейрлейном и Вебером наследственной метгемоглобинемии, связанной с аномальным глобиновым компонентом, стимулировали поиски других генетических изменений в синтезе гемоглобина. В настоящее время известно выше десятка аномальных гемоглобинов, которые можно различать благодаря их необычным физическим свойствам. Кроме того, известен ряд патологических состояний, при которых ненормальность гемоглобина обнаруживается путем гематологических исследований, но изменений в его физических свойствах не наблюдается. При этом в крови обнаруживаются либо очень мелкие эритроциты, либо какие-нибудь другие изменения морфологии эритроцитов. Подобные случаи торможения синтеза нормального гемоглобина объединяют под общим названием талассемии. Поскольку, согласно наблюдениям, локус, контролирующий эффект талассемии, не аллеломорфен гену нормального гемоглобина HbА, Аллисон предложил для локуса талассемии обозначение Th; нормальный: аллель этого локуса обозначают ThN, а аллель талассемии — ThT. Приведены клинические названия и генотипические обозначения для ряда аномалий, связанных с молекулой гемоглобина. Этот перечень взят из прекрасного обзора Итано, в котором читатель может найти более подробные данные.
В настоящее время известно выше десятка аномальных гемоглобинов, которые можно различать благодаря их необычным физическим свойствам. Кроме того, известен ряд патологических состояний, при которых ненормальность гемоглобина обнаруживается путем гематологических исследований, но изменений в его физических свойствах не наблюдается. При этом в крови обнаруживаются либо очень мелкие эритроциты, либо какие-нибудь другие изменения морфологии эритроцитов. Подобные случаи торможения синтеза нормального гемоглобина объединяют под общим названием талассемии. Поскольку, согласно наблюдениям, локус, контролирующий эффект талассемии, не аллеломорфен гену нормального гемоглобина HbА, Аллисон предложил для локуса талассемии обозначение Th; нормальный: аллель этого локуса обозначают ThN, а аллель талассемии — ThT. Приведены клинические названия и генотипические обозначения для ряда аномалий, связанных с молекулой гемоглобина. Этот перечень взят из прекрасного обзора Итано, в котором читатель может найти более подробные данные. Для наших целей достаточно сказать, что, во-первых, синтез некоторых аномальных гемоглобинов (С, S и т. п.) контролируется рядом генов, которые, по-видимому, аллельны (возможно, это псевдоаллели), во-вторых, некоторые другие аномалии, включенные в группу талассемии, связаны с генетическими аномалиями, которые не отражаются на физических и химических свойствах молекулы гемоглобина и которые, по-видимому, связаны с иными генетическими локусами, а не с локусом HbА.
Для наших целей достаточно сказать, что, во-первых, синтез некоторых аномальных гемоглобинов (С, S и т. п.) контролируется рядом генов, которые, по-видимому, аллельны (возможно, это псевдоаллели), во-вторых, некоторые другие аномалии, включенные в группу талассемии, связаны с генетическими аномалиями, которые не отражаются на физических и химических свойствах молекулы гемоглобина и которые, по-видимому, связаны с иными генетическими локусами, а не с локусом HbА.
Теперь перейдем к имеющимся химическим данным. Различия в электрофоретической подвижности гемоглобина из нормальной крови и из крови людей с серповидноклеточной анемией, которые наблюдали Полинг, Итано и их сотрудники, можно связать с изменением в последовательности аминокислот, приводящим к увеличению или уменьшению числа заряженных групп боковых цепей. Вместе с тем, возможно, что эти различия в величине заряда лишь кажущиеся и зависят от способа свертывания полипептидных цепей белка; при этом в зависимости от изменений конфигурации заряженные группы выявляются или, наоборот, маскируются.
Непосредственная проверка правильности этих двух гипотез была-произведена Ингрэмом, который детально изучил последовательность аминокислот в молекуле при помощи чувствительного метода «дактилографии». Его исследования показали, что, по-видимому, как гемоглобин S, так и гемоглобин С отличаются от нормального гемоглобина лишь одним-единственным аминокислотным остатком. Измененный участок молекулы показан. Остаток глутаминовой кислоты, имеющийся в гемоглобине HbА, в гемоглобинах S и С заменен соответственно валином и лизином. Изменения величины заряда на 1 моль (плюс 2 для S и плюс 4 для С по сравнению с гемоглобином А) согласуются с теми, которых следовало ожидать на основании электрофоретического анализа; никаких данных об изменениях последовательности аминокислотных остатков в других частях молекулы белка получено не было. Таким образом, в этом случае возможна прямая проверка предположения, что мутация в специфическом генетическом локусе вызывает специфическое изменение в ковалентной структуре белка, связанного с этим локусом.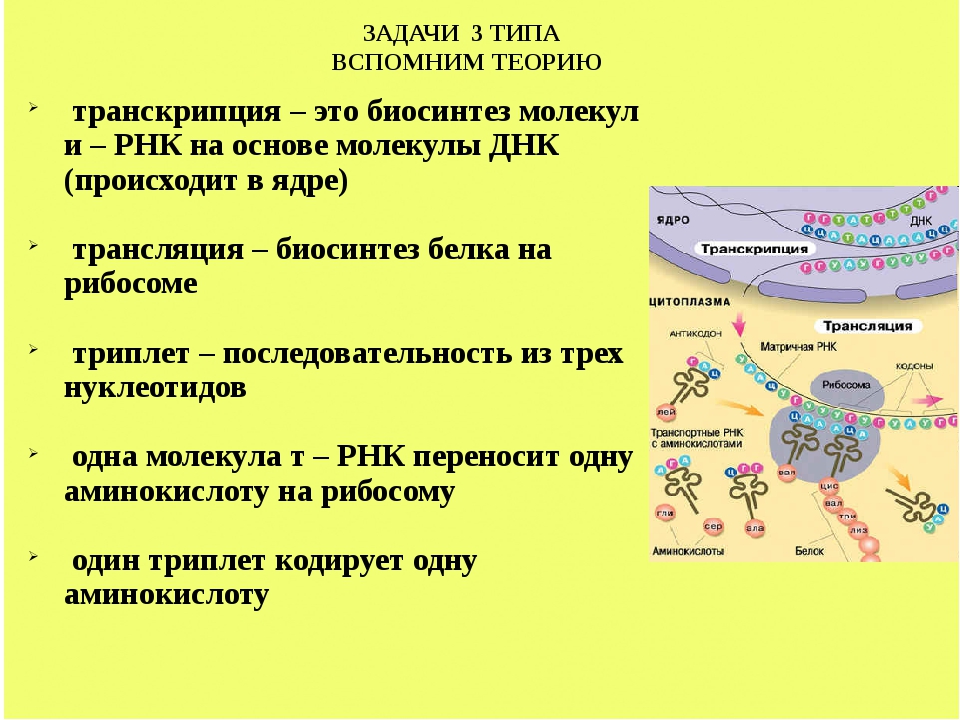 И действительно, опыт Ингрэма представляет собой проверку «с пристрастием». Менделирующие гены HbA, Hbs и HbС контролируют не только весьма ограниченный участок структуры, но, по-видимому, также одну и ту же его особенность, а именно последовательность остатков в этом участке. Если последовательность нуклеотидов в полинуклеотидной цепи ДНК определяет последовательность остатков в полипептиде, то как же объяснить, что эти три расщепляющихся локуса влияют на один и тот же участок полипептида?
И действительно, опыт Ингрэма представляет собой проверку «с пристрастием». Менделирующие гены HbA, Hbs и HbС контролируют не только весьма ограниченный участок структуры, но, по-видимому, также одну и ту же его особенность, а именно последовательность остатков в этом участке. Если последовательность нуклеотидов в полинуклеотидной цепи ДНК определяет последовательность остатков в полипептиде, то как же объяснить, что эти три расщепляющихся локуса влияют на один и тот же участок полипептида?
Результаты, полученные Ингрэмом, можно объяснить по аналогии с гипотезой, предложенной Уотсоном и Криком. Неизбежное попарное соединение гетероциклических оснований, которого требует эта гипотеза, как уже упоминалось ранее, выдвигалось для объяснения точного самоудвоения нитей ДНК. Специфическая последовательность оснований в комплементарных нитях двойной спирали рассматривалась как комплекс закодированной генетической информации, которая, по-видимому, служит главной матрицей для синтеза белка. Наиболее вероятным был признан код, основанный на «тройках», в котором различные наборы нуклеотидов (по три в каждом) соответствуют одной специфической аминокислоте. Используя эту идею, мы можем перевести различную последовательность аминокислот у трех разных форм гемоглобина в соответствующий нуклеотидный код. Замена лишь одного нуклеотида другим в критической «тройке» нуклеотидов создает необходимое изменение в закодированной в этой тройке информации. Читатель вряд ли примет всерьез все эти рассуждения. Однако не следует забывать, что самые невероятные научные гипотезы иногда оказывались верными, и эта гипотеза, во всяком случае, заслуживает некоторого внимания из-за своей новизны и последовательности.
Наиболее вероятным был признан код, основанный на «тройках», в котором различные наборы нуклеотидов (по три в каждом) соответствуют одной специфической аминокислоте. Используя эту идею, мы можем перевести различную последовательность аминокислот у трех разных форм гемоглобина в соответствующий нуклеотидный код. Замена лишь одного нуклеотида другим в критической «тройке» нуклеотидов создает необходимое изменение в закодированной в этой тройке информации. Читатель вряд ли примет всерьез все эти рассуждения. Однако не следует забывать, что самые невероятные научные гипотезы иногда оказывались верными, и эта гипотеза, во всяком случае, заслуживает некоторого внимания из-за своей новизны и последовательности.
Существование трех форм гемоглобина, различие между которыми определяется одним «локусом», поставило очень интересный вопрос: почему случайная мутация трижды возникла в одном и том же месте, тогда как в мономере гемоглобина имеется примерно 300 аминокислотных остатков?
Это явление качественно напоминает результаты, полученные Бензером при изучении мутаций в участке rII бактериофага Т4.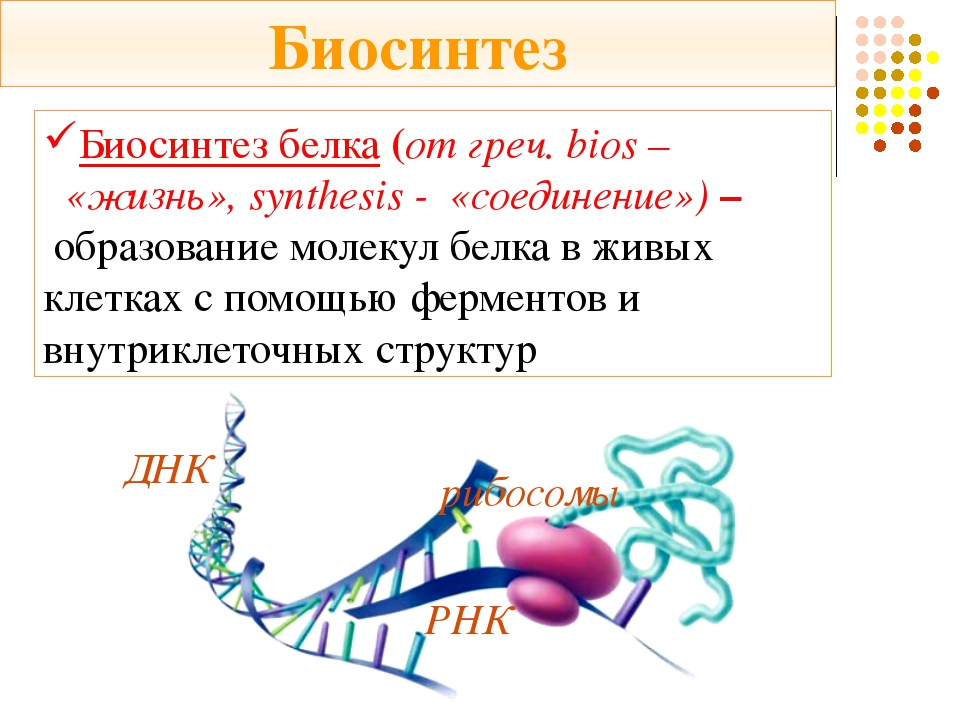 Бензер наблюдал, что среди многих сотен отобранных мутантных колоний непропорционально большое число было связано с мутацией одного и того же локуса, тогда как другие локусы мутировали очень редко. Неслучайное распределение мутирующих локусов, как у генетически хорошо изученных бактериофагов, так и в случае гемоглобина человека, о котором, к сожалению, мы знаем очень мало, позволяет предполагать, что лишь некоторые мутации «допустимы» и что в большей части генетического материала степень допустимости очень мала. Однако в равной мере можно предположить, что какие-то неизвестные особенности в строении ДНК больше благоприятствуют изменениям одних участков в последовательности нуклеотидов, чем других.
Бензер наблюдал, что среди многих сотен отобранных мутантных колоний непропорционально большое число было связано с мутацией одного и того же локуса, тогда как другие локусы мутировали очень редко. Неслучайное распределение мутирующих локусов, как у генетически хорошо изученных бактериофагов, так и в случае гемоглобина человека, о котором, к сожалению, мы знаем очень мало, позволяет предполагать, что лишь некоторые мутации «допустимы» и что в большей части генетического материала степень допустимости очень мала. Однако в равной мере можно предположить, что какие-то неизвестные особенности в строении ДНК больше благоприятствуют изменениям одних участков в последовательности нуклеотидов, чем других.
Весьма вероятно, что мутантные гены гемоглобина сохранились благодаря тому, что они связаны с каким-либо благоприятным влиянием (например, серповидноклеточная анемия связана с пониженной восприимчивостью к малярии).
Поскольку никаких других химических данных, подобных данным по гемоглобину человека, у нас нет, мы считаем целесообразным провести несколько более подробный анализ ряда ведущихся в настоящее время исследований, которые, быть может, позволят разрешить некоторые из поставленных здесь вопросов.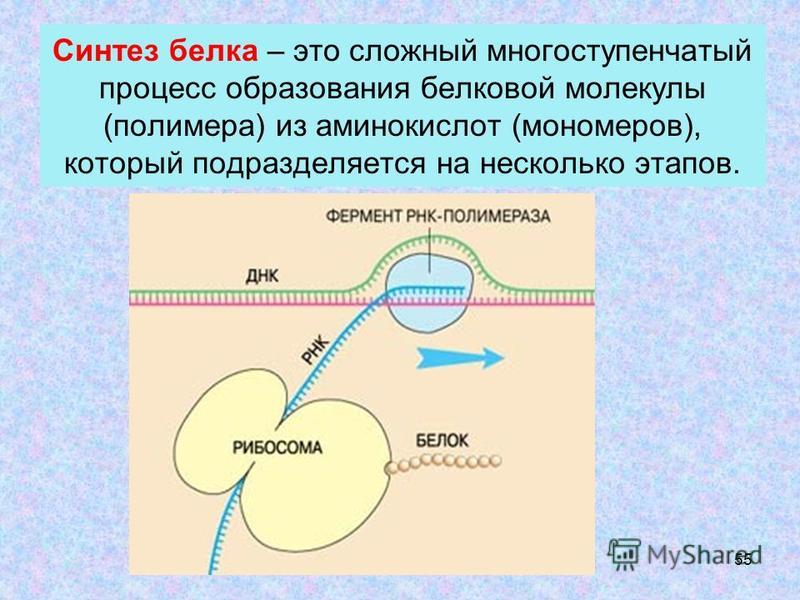 Многие ученые в настоящее время ведут интенсивные исследования, пытаясь выделить и охарактеризовать определенные белки из организмов, генотипы которых различаются лишь по одному гену. Мы уже упоминали об изученных Горовицем и Флинтом тирозиназах мутантов нейроспоры, различающихся по устойчивости к высокой температуре и по энергии активации процесса их тепловой инактивации. Возможно, что после тщательной очистки этих тирозиназ и детального изучения их химического строения в этом случае, так же как и для гемоглобинов, удастся показать прямую связь химических изменений с мутацией. Изучение других белковых систем также обещает дать интересные сведения, особенно в тех случаях, когда белок легко выделить (как, например, β-лактоглобулины молока). Однако наибольшее внимание приковано к бактериям и бактериофагам, поскольку они дают возможность провести тонкий генетический анализ. По крайней мере три лаборатории работают над проблемой выяснения влияния мутаций в участке h фага Т2 на химическую природу фаговой частицы.
Многие ученые в настоящее время ведут интенсивные исследования, пытаясь выделить и охарактеризовать определенные белки из организмов, генотипы которых различаются лишь по одному гену. Мы уже упоминали об изученных Горовицем и Флинтом тирозиназах мутантов нейроспоры, различающихся по устойчивости к высокой температуре и по энергии активации процесса их тепловой инактивации. Возможно, что после тщательной очистки этих тирозиназ и детального изучения их химического строения в этом случае, так же как и для гемоглобинов, удастся показать прямую связь химических изменений с мутацией. Изучение других белковых систем также обещает дать интересные сведения, особенно в тех случаях, когда белок легко выделить (как, например, β-лактоглобулины молока). Однако наибольшее внимание приковано к бактериям и бактериофагам, поскольку они дают возможность провести тонкий генетический анализ. По крайней мере три лаборатории работают над проблемой выяснения влияния мутаций в участке h фага Т2 на химическую природу фаговой частицы.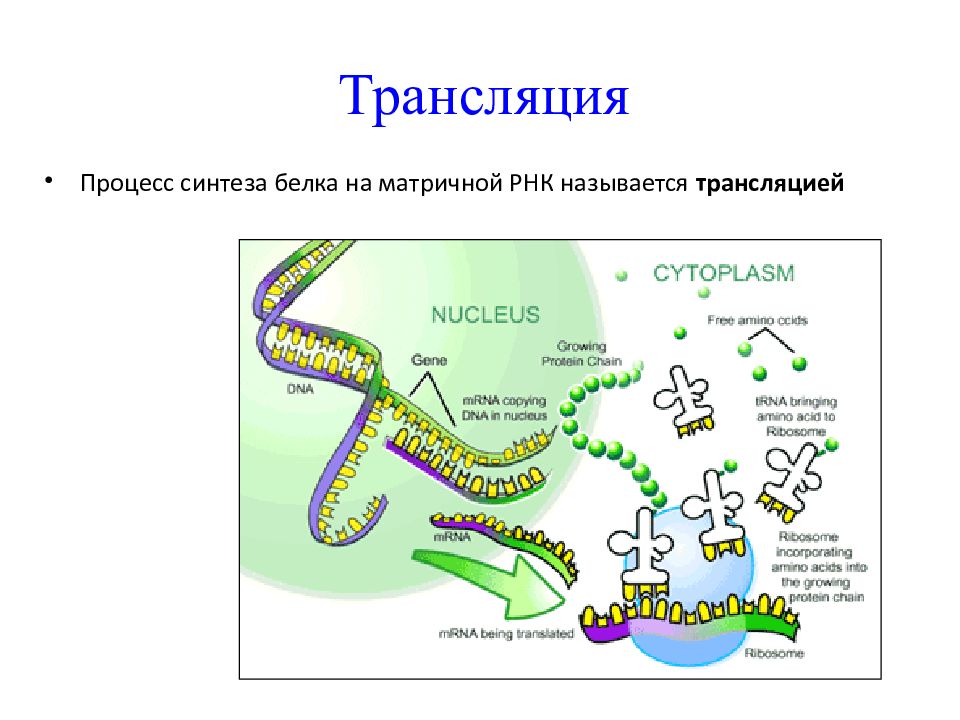
Участок h генетического материала фага Т2 определяет специфическую реакцию по отношению к бактерии-хозяину, а именно способность частицы фага адсорбироваться стенкой определенной бактериальной клетки. Так, фаг дикого типа T2h+ способен адсорбироваться на клетках Escherichia coli штамма В и заражать их, но не адсорбируется на клетках штамма В/2, а мутанты h способны заражать оба штамма (В и В/2). Таким образом, частицы дикого типа (h+) при выращивании на агаре, на поверхность которого равномерно нанесена смесь из бактерий Е. coli штаммов В и В/2, лизируют только клетки штамма В с образованием мутного стерильного пятна. Что же касается мутантов h, то они заражают клетки обоих штаммов, В и В/2, с образованием совершенно прозрачных стерильных пятен. (В дальнейшем удобно представлять себе мутацию h+ как «дефект» в «нормальном» участке h генетической нити.) Подобное различие в фенотипическом поведении можно использовать для подсчета числа частиц h и h+.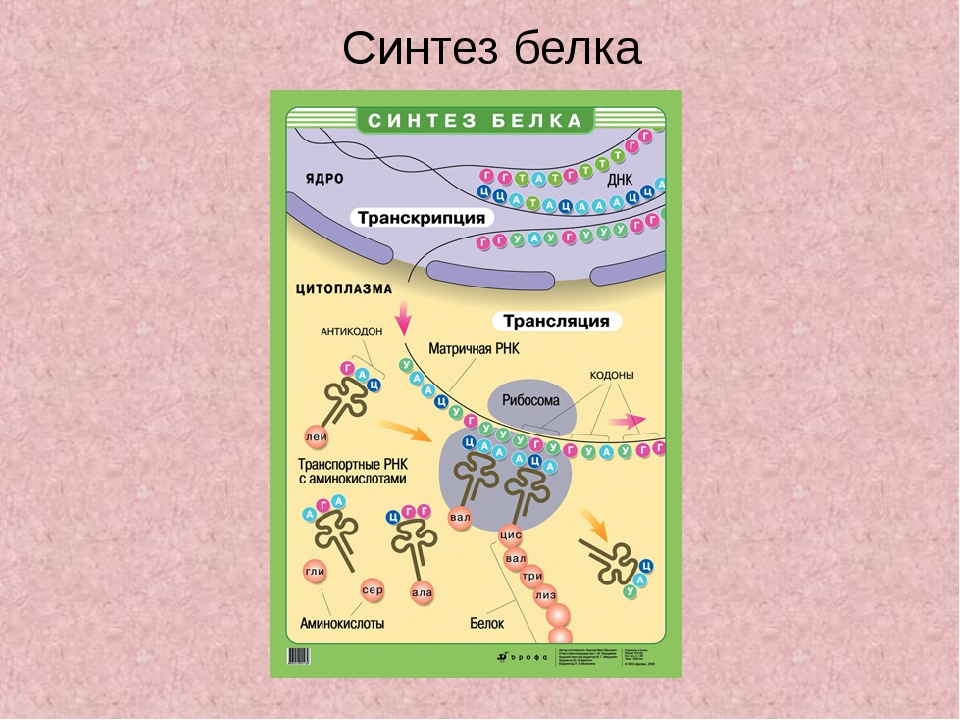 Этот прием был использован Стрейсингером и Франклином для локализации различных мутаций h на линейной генетической карте, подобно тому как Бензер наносил на карту мутации r бактериофага Т4.
Этот прием был использован Стрейсингером и Франклином для локализации различных мутаций h на линейной генетической карте, подобно тому как Бензер наносил на карту мутации r бактериофага Т4.
Поскольку методика нанесения на карту тонких генетических структур фага будет применяться все шире и шире, полезно еще раз кратко рассмотреть этот метод в общем виде на примере составления карты для участка h.
Фаг типа h, обозначаемый h00, наносили на чашку Петри, содержащую смесь клеток Е. coli штаммов В и В/2. Мутные пятна отбирали как пример обратных мутаций к генотипу h+. Таким образом был получен ряд мутантов типа h+. Затем 14 мутантов h+ с низким «индексом реверсии» скрещивали друг с другом, а также с исходным штаммом h+ путем смешанного заражения ими Е. coli.
У всех мутантов h+ была изучена способность давать спонтанный возврат к фенотипу h. Мутанты, имеющие высокий «индекс реверсии», не изучались, поскольку такие мутанты создали бы технические трудности при исследовании способности двух мутантов h+ давать фенотипы h в результате генетической рекомбинации.
Потомство фагов изучали (по характеру стерильных пятен) и подсчитывали процент фенотипов h, возникших в результате рекомбинации. Было обнаружено, что каждая пара рекомбинантов h+ дает рекомбинантов h с определенной воспроизводимой частотой. Однако во всех случаях эта частота была низкой (менее 1 %), свидетельствуя о том, что все изученные мутации h+ возникли на участке генетической карты протяженностью менее двух единиц рекомбинации (общая «длина» генетического материала у фага Т2, возможно, равна 800 таких единиц).
После того как было установлено, что все различные мутации h+ произошли в пределах короткого участка карты, возникла необходимость определить порядок их расположения по отношению друг к другу. Это было сделано при помощи скрещиваний фагов, различающихся по трем факторам; этот прием станет ясным, если его изобразить в виде простой схемы. Скрещивания производили путем смешанного заражения бактерий штамма В фагами, содержащими, помимо одного из локусов h+, еще либо локус r+, либо мутантный локус r22 (который принадлежит к числу локусов, влияющих на тип пятна, и нанесен на карту Бензером). Методика получения таких мутантов, меченных по двум факторам, очень сложна (она связана, в частности, с многократными возвратными скрещиваниями и отбором), и мы не станем ее описывать подробно. Достаточно указать, что были получены штаммы бактериофагов, которые позволили произвести скрещивания; локус r22 расположен на расстоянии 22 единиц рекомбинации от участка А, что было определено в скрещиваниях с участием двух факторов.
Методика получения таких мутантов, меченных по двум факторам, очень сложна (она связана, в частности, с многократными возвратными скрещиваниями и отбором), и мы не станем ее описывать подробно. Достаточно указать, что были получены штаммы бактериофагов, которые позволили произвести скрещивания; локус r22 расположен на расстоянии 22 единиц рекомбинации от участка А, что было определено в скрещиваниях с участием двух факторов.
Относительное расположение двух локусов h+ по отношению к локусу r22 можно определить, учитывая частоту форм А, возникших путем рекомбинации и несущих признак r+. Все эти рассуждения требуют, конечно, ряда допущений, о которых мы упоминали ранее, в том числе линейного расположения генетических локусов у фагов и наличия механизма перекреста, хотя бы аналогичного механизму, обеспечивающему рекомбинации у высших организмов. Эти допущения, по-видимому, в данном случае применимы. Порядок расположения локусов h+ на карте, который был определен на основании данных скрещиваний фагов, различающихся по трем факторам, соответствует расстояниям между локусами, определенным на основе предварительных данных, которые были получены в опытах по скрещиванию фагов, различающихся по двум факторам.
Прежде чем рассмотреть эти данные с точки зрения генетического контроля химического состава у фагов, необходимо обратить внимание на одно наблюдение, касающееся выяснения функционального единства участка А. Принадлежат ли все мутации А+, показанные на карте, к одной функциональной единице (к одному цистрону), или же они, быть может, принадлежат к разным группам, которые, действуя совместно, определяют специфическую реакцию по отношению к хозяину? Это можно решить, применив цис-транс-тест, описанный ранее для мутаций г. Стрейсингер показал, что все мутации А принадлежат к одной функциональной единице; это было сделано путем сравнения частоты появления фагов фенотипа h (т. е. адсорбирующихся на бактериях как штамма В, так и штамма В/2) при скрещиваниях цис-(АхА+) и транс-(h+1 х h+2) — типов. Если каждый из участков генетической нити действует самостоятельно и они вместе обусловливают нормальный фенотип h, то все потомки при подобной смешанной инфекции должны иметь фенотип h. Однако оказалось, что фенотипом h обладала лишь незначительная часть потомства (около 3%), что соответствует частоте, ожидаемой на основе перекреста и других последствий рекомбинации.
Однако оказалось, что фенотипом h обладала лишь незначительная часть потомства (около 3%), что соответствует частоте, ожидаемой на основе перекреста и других последствий рекомбинации.
В случае цис-конфигурации наблюдался высокий процент частиц с фенотипом h (около 60%).
Таким образом, можно сделать вывод, что лишь функционально «полноценный» участок h может обеспечить проявление признака h.
Теперь мы можем рассмотреть, какое влияние оказывает участок h генетической карты на фаговую частицу. Мы должны, конечно, сосредоточить свое внимание на тех химических и морфологических признаках фага Т2, которые имеют отношение к его прикреплению к бактериальной клетке. Частицы фага прикрепляются к бактериальной клетке концами своих отростков. Так же прикрепляются и «тени» фагов, которые можно получить, если внезапно подвергнуть интактные частицы фага осмотическому шоку. Поскольку «тень» фага состоит почти из одного белка (если не считать следов углеводов, которые присутствуют в таких малых количествах, что их функциональное значение маловероятно), можно заключить, что процесс прикрепления обусловлен каким-то специфическим белковым компонентом. Предположение о белковой природе вещества, обеспечивающего адсорбцию, подтверждается также наблюдениями, показавшими, что процесс утраты способности фага к адсорбции под влиянием таких веществ, как мочевина, по своей кинетике очень сходен с процессом денатурации белков. Установлено также, что при блокировании аминогрупп фагов они утрачивают способность прикрепляться к бактериям.
Предположение о белковой природе вещества, обеспечивающего адсорбцию, подтверждается также наблюдениями, показавшими, что процесс утраты способности фага к адсорбции под влиянием таких веществ, как мочевина, по своей кинетике очень сходен с процессом денатурации белков. Установлено также, что при блокировании аминогрупп фагов они утрачивают способность прикрепляться к бактериям.
Можно подойти к проблеме выделения и описания белкового компонента, ответственного за специфическую реакцию на бактерий-хозяев, двумя путями. Первый путь состоит в выделении отдельных фрагментов из разрушенных фаговых частиц. Такие исследования проводили Бреннер и его сотрудники в Кавендишской лаборатории Кембриджского университета. Эти исследователи пришли к выводу, что специфичность к бактерии-хозяину определяется тонкими нитями, которые прикреплены к отростку вирусной частицы и обволакивают бактериальную клетку; они получили высокоочищенные концентраты одних этих нитей для химического анализа.
Второй путь связан с фракционированием всей смеси белков, входящих в состав «теней» фагов, причем для этого применяют те же методы, что и для выделения фермента из неочищенного экстракта тканей.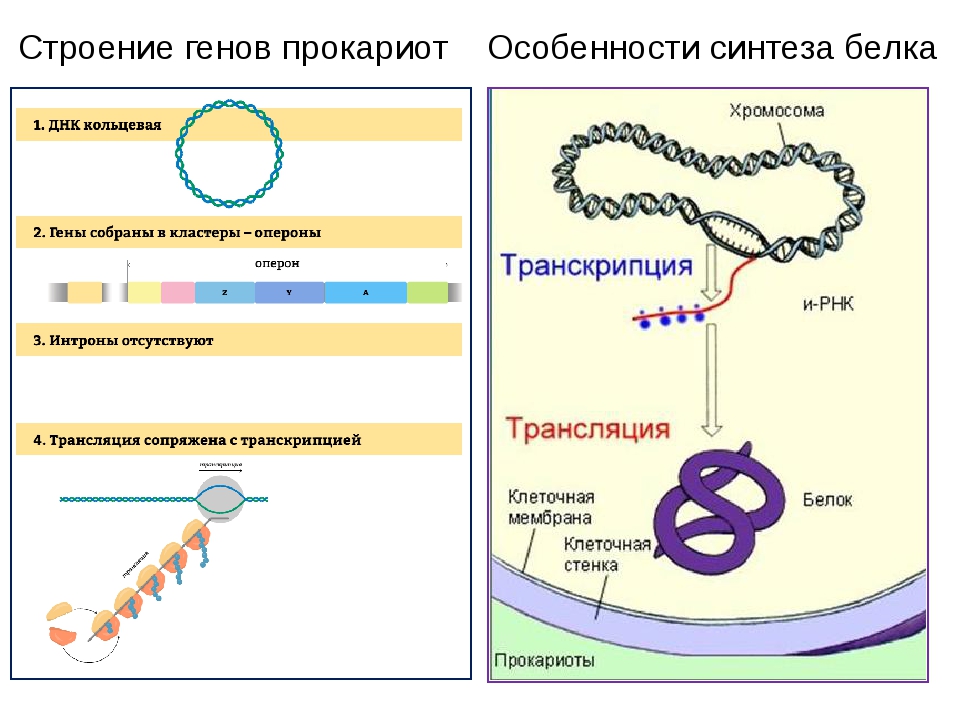 «Тени» фагов можно растворить различными способами, не вызывающими изменений ковалентной структуры входящих в их состав белков. При использовании для растворения таких веществ, как мочевина и гуанидин, растворы, по-видимому, можно изучать методами хроматографии, электрофореза и ультрацентрифугирования.
«Тени» фагов можно растворить различными способами, не вызывающими изменений ковалентной структуры входящих в их состав белков. При использовании для растворения таких веществ, как мочевина и гуанидин, растворы, по-видимому, можно изучать методами хроматографии, электрофореза и ультрацентрифугирования.
Как при морфологическом, так и при химическом подходе к проблеме фракционирования необходимо производить пробу на функциональную активность. Такая проба, хотя и косвенная, была разработана. Она основана на том, что антигенные свойства Т-четных фагов, обнаруживаемые по их реакции с кроличьей антифаговой сывороткой, контролируются тем же генетическим локусом, который определяет специфичность по отношению к бактерии-хозяину. Стрейсингер показал, что между локусами, определяющими специфичность к хозяину и серотип рекомбинаций уловить не удается.
Таким образом, можно испытать любую белковую или морфологическую фракцию, определив ее способность блокировать, нейтрализующую фагов активность препарата, содержащего инактивирующие антитела.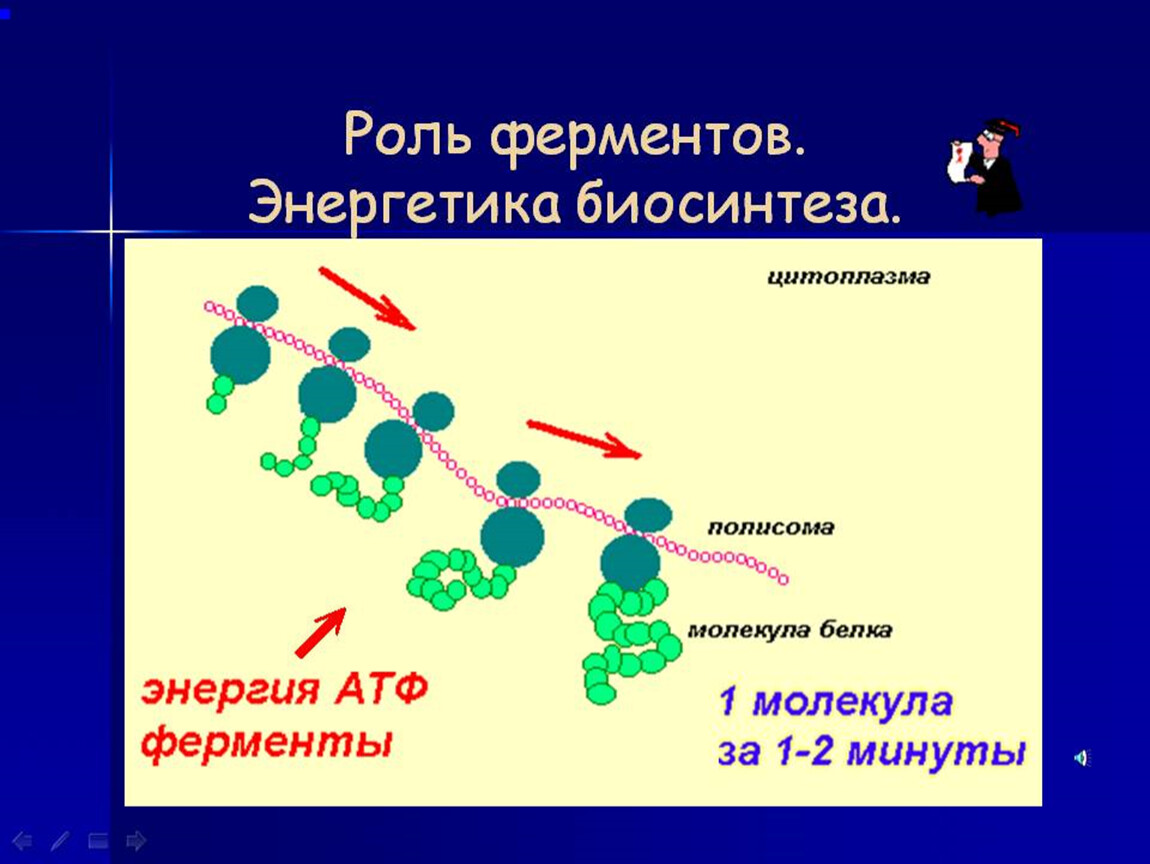
Исследование химических изменений, вызываемых мутациями в участке А фагов, только начато. Сначала необходимо разрешить проблему выделения белка. Однако можно надеяться, что эти работы, так же как и другие исследования, касающиеся иных участков генетической карты фага, дадут нам в конечном счете возможность непосредственно сопоставить генетические изменения со структурными модификациями в молекулах белка. Преимущество использования для таких исследований фагов и других микроорганизмов состоит в том, что для этих «организмов» можно составить очень точные генетические карты.
Например, Левинталь и Герен из Массачусетского технологического института недавно начали работу по нанесению на карту цистрона, контролирующего синтез щелочной фосфатазы у Е. Coli. Этот фермент синтезируется в больших количествах, если ограничить содержание фосфатов в культуральной среде. Микроорганизмы выращивают на чашках, содержащих среду с низким содержанием фосфатов. Затем эти чашки опрыскивают нитрофенил-фосфатом.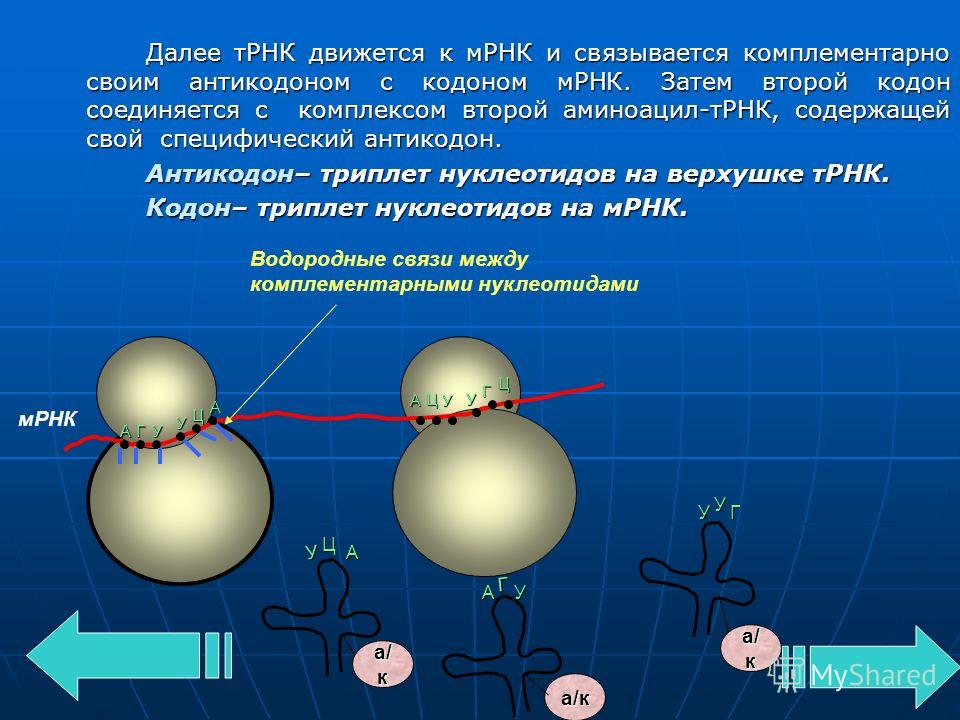 Клетки, содержащие щелочную фосфатазу, расщепляют фосфатный эфир, и при этом выделяется желтый нитрофенол. При этом колонии бактерий, содержащих фермент, желтеют, некоторые мутанты остаются белыми, а другие мутанты, содержащие фермент средней активности, приобретают слабую окраску. Из разных штаммов можно выделить активные или неактивные ферменты. В настоящее время проводят анализ их структуры.
Клетки, содержащие щелочную фосфатазу, расщепляют фосфатный эфир, и при этом выделяется желтый нитрофенол. При этом колонии бактерий, содержащих фермент, желтеют, некоторые мутанты остаются белыми, а другие мутанты, содержащие фермент средней активности, приобретают слабую окраску. Из разных штаммов можно выделить активные или неактивные ферменты. В настоящее время проводят анализ их структуры.
Если расчеты Бензера, выражающего длину рекона в отдельных нуклеотидах, входящих в состав цепи ДНК, верны, то можно надеяться, что удастся генетически разделить локусы, расположенные так близко друг к другу, что контролирующие структуру гемоглобинов, исследованных Ингрэмом. Например, в участке h расстояние между локусами h+37 и h+0 составляет, по-видимому, лишь 0,004 единицы рекомбинации. Если выразить это, следуя Бензеру, в нуклеотидах, то получится величина, соответствующая одной паре нуклеотидов. Во всех этих рассуждениях генетическая сторона недостаточно обоснована, а между тем химик всегда стремится к максимальной достоверности.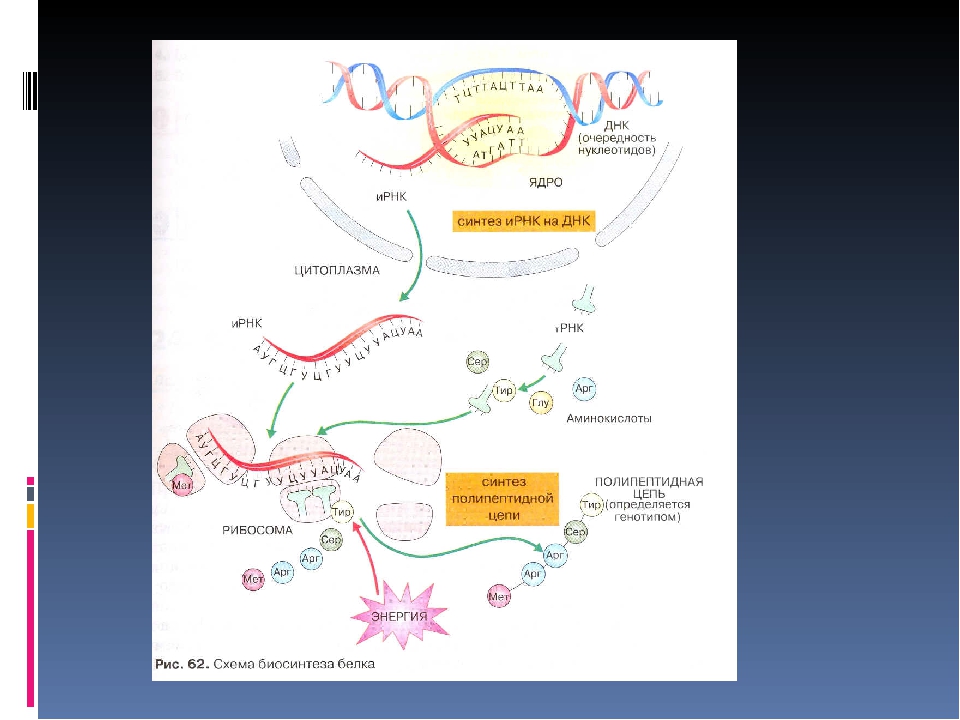 Поэтому биохимики охотно готовы затратить время и силы на проверку правильности общей гипотезы. В случае успеха это даст возможность начать разрешение некоторых из наиболее важных проблем биологии.
Поэтому биохимики охотно готовы затратить время и силы на проверку правильности общей гипотезы. В случае успеха это даст возможность начать разрешение некоторых из наиболее важных проблем биологии.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Ген и его роль в биосинтезе — Студопедия
В молекуле нитевидной ДНК заключена информация о первичной структуре белков данной клетки. Отрезок молекулы ДНК, содержащий информацию о первичной структуре одного определенного белка, называется – геном. В молекуле ДНК содержится несколько сотен генов, которые ответственны за синтез каждый своего определенного белка.
Код ДНК. Биологическая наследственная информация зашифрована (закодирована) в молекулах ДНК с помощью химического кода. В клетках всех живых существ один и тот же код. В его основе лежит последовательность соединения в нитях ДНК четырех азотистых оснований: А, Г, Т, Ц.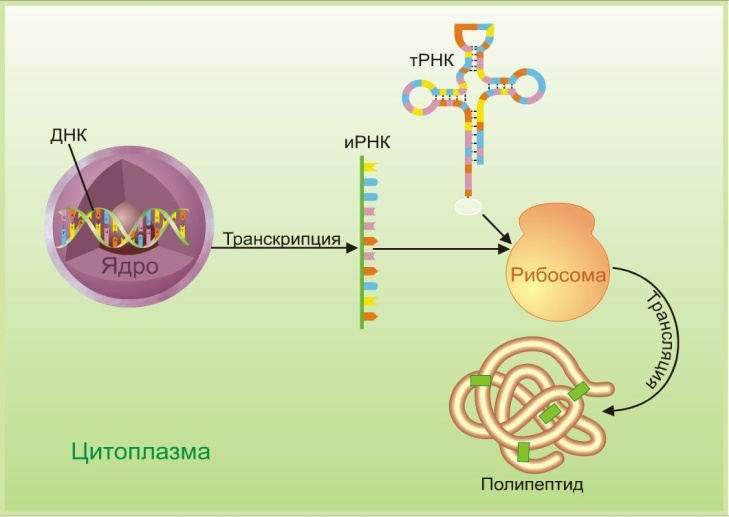 Различные комбинации трех смежных нуклеотидов образуют триплеты или кодоны. Например, триплеты: АГТ, ТСГ, ГТА и т.д.
Различные комбинации трех смежных нуклеотидов образуют триплеты или кодоны. Например, триплеты: АГТ, ТСГ, ГТА и т.д.
Каждому триплету соответствует 1 из 20 аминокислот. Последовательность триплетов ДНК определяет в свою очередь последовательность расположения аминокислот в полипептидной цепи белка.
Соседние кодоны в процессе считывания информации не перекрываются, считывается тройка тех нуклеотидов и в той последовательности, в какой они представлены в данном конкретном кодоне.
Из четырех азотистых оснований – А, Г, Т, Ц в каждый триплет входит только три, в различном сочетании. Подсчитано, что таких сочетаний будет: 43 = 64. Число же аминокислот – 20. Было установлено, что некоторые аминокислоты кодируются (им соответствует) не одним триплетом, а несколькими (от 2 до 6). Эта «избыточность» кода имеет большое значение для повышения надежности хранения и передачи наследственной информации.
Сейчас расшифрованы триплеты всех аминокислот, входящих в состав белков. Записанная таким образом в цепи ДНК генетическая информация о построении белковой молекулы представляет собой генетический код.
Генетический код – универсален – един для всех живущих на Земле существ, растений.
Помимо триплетов (кодонов), определяющих АК, в молекуле ДНК есть специальные триплеты, ответственные за запуск (инициирующие) и остановку (терминирующие). Они выполняют функцию знаков препинания. Начало и конец РНК-синтеза на матрице ДНК строго фиксированы ими. В одной молекуле ДНК может быть закодирована последовательность АК для многих белков.
Свойства кода (обобщение):
1. Триплетен.
2. Непрерывен.
3. Специфичен.
4. Неперекрываем.
5. Избыточен.
6. Есть «знаки препинания».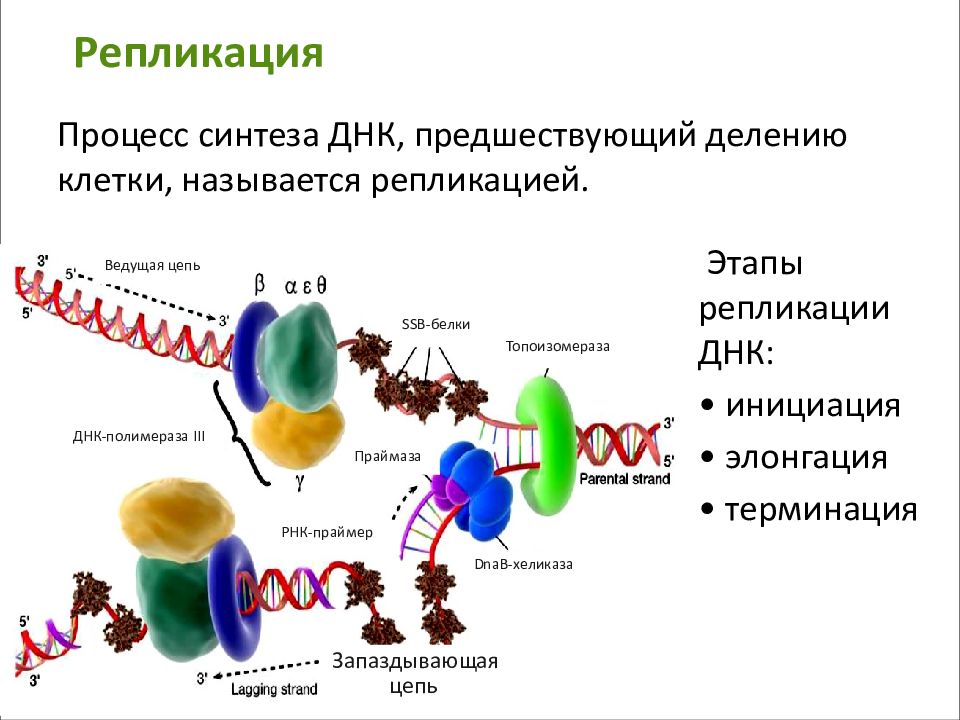
7. Универсален.
Синтез белка
Синтез белка протекает в 5 этапов:
1. Активация аминокислот.
2. Инициация.
3. Элонгация.
4. Терминация.
5. Сворачивание и процессинг.
1. Синтез белков в клетке
Каждая клетка содержит тысячи белков. Свойства белков определяются их первичной структурой, т. е. последовательностью аминокислот в их молекулах.
В свою очередь наследственная информация о первичной структуре белка заключена в последовательности нуклеотидов в молекуле ДНК. Эта информация получила название генетической, а участок ДНК, в котором содержится информация о первичной структуре одного белка, называется ген.
Ген — это участок ДНК, в котором содержится информация о первичной структуре одного белка.
Ген — это единица наследственной информации организма.
Каждая молекула ДНК содержит множество генов. Совокупность всех генов организма составляет его генотип.
Совокупность всех генов организма составляет его генотип.
Биосинтез белка
Биосинтез белка — это один из видов пластического обмена, в ходе которого наследственная информация, закодированная в генах ДНК, реализуется в определённую последовательность аминокислот в белковых молекулах.
Процесс биосинтеза белка состоит из двух этапов: транскрипции и трансляции.
Каждый этап биосинтеза катализируется соответствующим ферментом и обеспечивается энергией АТФ.
Биосинтез происходит в клетках с огромной скоростью. В организме высших животных в одну минуту образуется до \(60\) тыс. пептидных связей.
Транскрипция
Транскрипция — это процесс снятия информации с молекулы ДНК синтезируемой на ней молекулой иРНК (мРНК).
Носителем генетической информации является ДНК, расположенная в клеточном ядре.
В ходе транскрипции участок двуцепочечной ДНК «разматывается».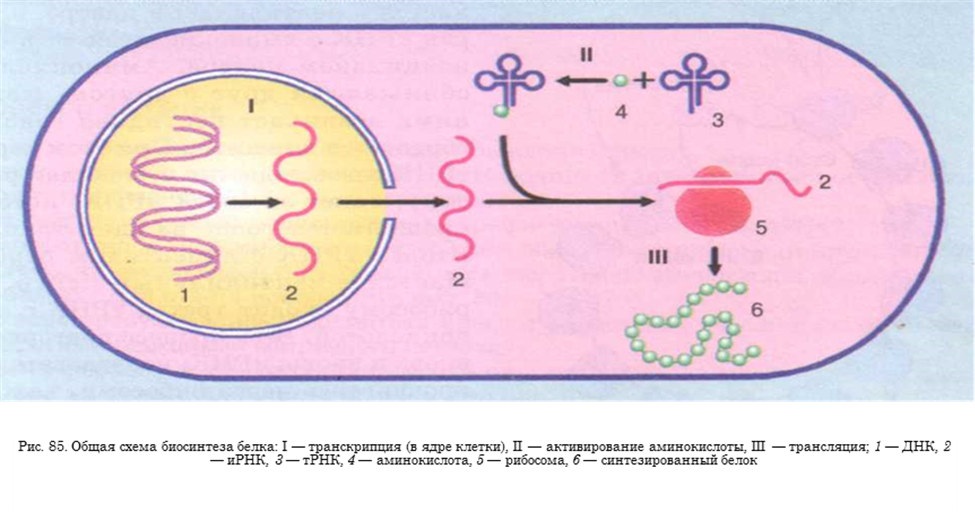 На одной из цепочек синтезируется молекула иРНК.
На одной из цепочек синтезируется молекула иРНК.
Информационная (матричная) РНК состоит из одной цепи и синтезируется на ДНК в соответствии с правилом комплементарности.
Образуется молекула иРНК, которая является копией второй цепочки ДНК, только в ней тимин заменён на урацил. Закодированная в ДНК информация о первичной структуре белка переписывается на иРНК.
Как и в любой другой биохимической реакции, в этом процессе участвует фермент — РНК-полимераза.
Молекула ДНК содержит большое количество генов. В начале каждого гена располагается промотором — особая последовательность нуклеотидов ДНК, которую определяет РНК-полимераза, и с этого места начинает сборку молекулы иРНК.
Синтез иРНК продолжается до очередного «знака препинания» — терминатора. Эта последовательность нуклеотидов указывает на завершение синтеза иРНК.
В клетках прокариот иРНК образуется в цитоплазме, поэтому образовавшиеся молекулы могут сразу участвовать в синтезе белков.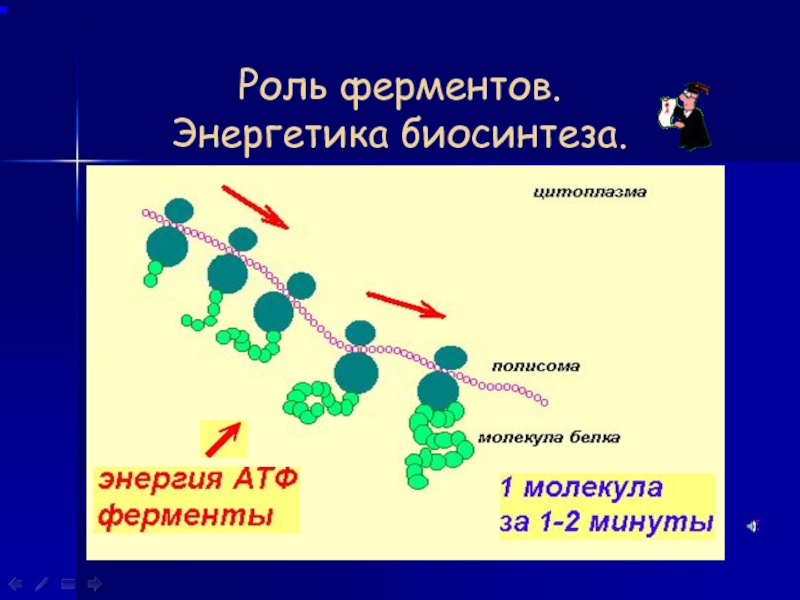
У эукариот иРНК синтезируется в ядре, поэтому сначала она взаимодействует со специальными ядерными белками и переносится через ядерную мембрану в цитоплазму.
Трансляция
Трансляция — это перевод последовательности нуклеотидов молекулы иРНК в последовательность аминокислот молекулы белка.
В цитоплазме клетки обязательно должен иметься полный набор аминокислот, необходимых для синтеза белков. Эти аминокислоты образуются в результате расщепления белков, получаемых организмом с пищей, а некоторые могут синтезироваться в самом организме.
Обрати внимание!
Аминокислоты доставляются к рибосомам транспортными РНК (тРНК). Любая аминокислота может попасть в рибосому, только прикрепившись к специальной тРНК.
На тот конец иРНК, с которого нужно начать синтез белка, нанизывается рибосома. Она движется вдоль иРНК прерывисто, «скачками», задерживаясь на каждом триплете приблизительно \(0,2\) секунды.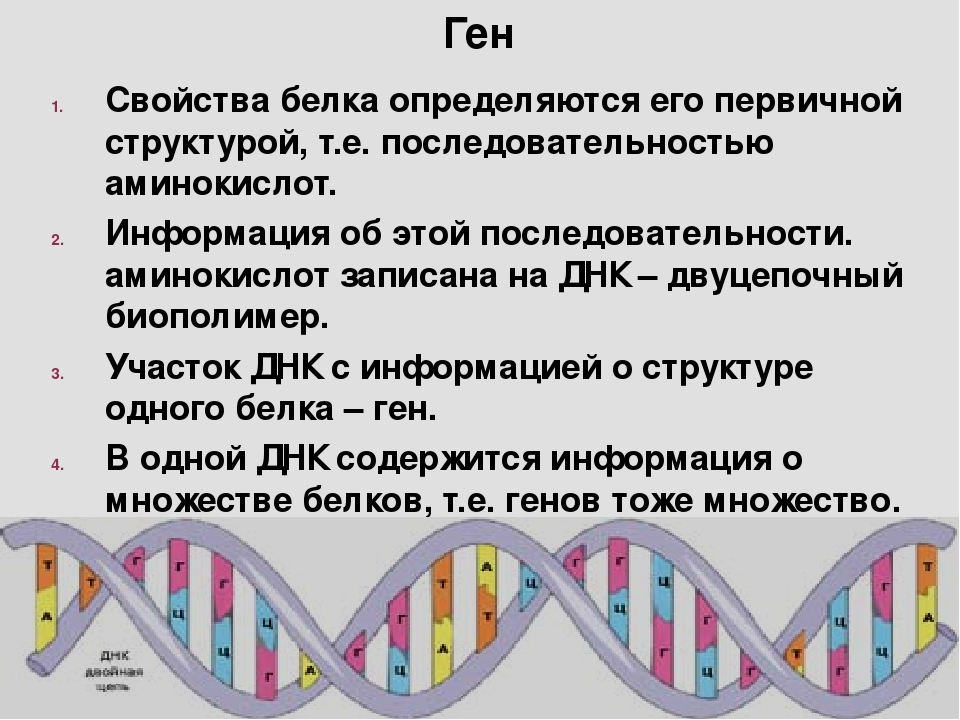
За это время молекула тРНК, антикодон которой комплементарен кодону, находящемуся в рибосоме, успевает распознать его. Аминокислота, которая была связана с этой тРНК, отделяется от «черешка» тРНК и присоединяется с образованием пептидной связи к растущей цепочке белка. В тот же самый момент к рибосоме подходит следующая тРНК (антикодон которой комплементарен следующему триплету в иРНК), и следующая аминокислота включается в растущую цепочку.
Аминокислоты, доставленные на рибосомы, ориентированы по отношению друг к другу так, что карбоксильная группа одной молекулы оказывается рядом с аминогруппой другой молекулы. В результате между ними образуется пептидная связь.
Рибосома постепенно сдвигается по иРНК, задерживаясь на следующих триплетах. Так постепенно формируется молекула полипептида (белка).
Синтез белка продолжается до тех пор, пока на рибосоме не окажется один из трёх стоп-кодонов (УАА, УАГ или УГА). После этого белковая цепочка отсоединяется от рибосомы, выходит в цитоплазму и формирует присущую этому белку вторичную, третичную и четвертичную структуры.
Так как клетке необходимо много молекул каждого белка, то как только рибосома, первой начавшая синтез белка на иРНК, продвинется вперёд, за ней на ту же иРНК нанизывается вторая рибосома. Затем на иРНК последовательно нанизываются следующие рибосомы.
Все рибосомы, синтезирующие один и тот же белок, закодированный в данной иРНК, образуют полисому. Именно на полисомах и происходит одновременный синтез нескольких одинаковых молекул белка.
Когда синтез данного белка окончен, рибосома может найти другую иРНК и начать синтезировать другой белок.
Общая схема синтеза белка представлена на рисунке.
Пример:
последовательность нуклеотидов матричной цепи ДНК: ЦГА ТТА ЦАА.
На информационной РНК (иРНК) по принципу комплементарности будет синтезирована цепь ГЦУ ААУ ГУУ, в результате чего выстроится цепочка аминокислот: аланин — аспарагин — валин.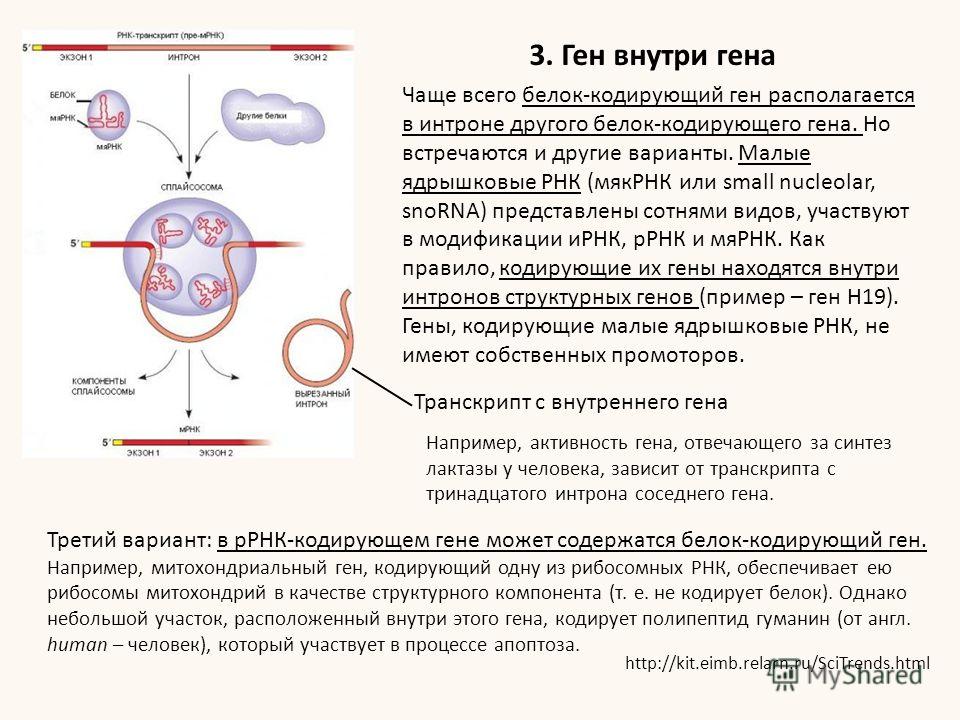
При замене нуклеотидов в одном из триплетов или их перестановке этот триплет будет кодировать другую аминокислоту, а следовательно, изменится и белок, кодируемый данным геном.
Изменения в составе нуклеотидов или их последовательности называются мутациями.
Источники:
http://distant-lessons.ru/molekula-rnk.html
http://900igr.net
http://tonpix.ru/biosintez_belka_translyaciya_47725/
процессы, этапы и последовательность синтеза клеточных белков
В клетках непрерывно идут процессы обмена веществ — процессы синтеза и распада веществ. Каждая клетка синтезирует необходимые ей вещества. Этот процесс называется биосинтезом.
Биосинтез — это процесс создания сложных органических веществ в ходе биохимических реакций, протекающих с помощью ферментов. Биосинтез необходим для выживания — без него клетка умрёт.
Одним из важнейших процессов биосинтеза в клетке является процесс биосинтеза белков, который включает в себя особые реакции, встречающиеся только в живой клетке — это реакции матричного синтеза.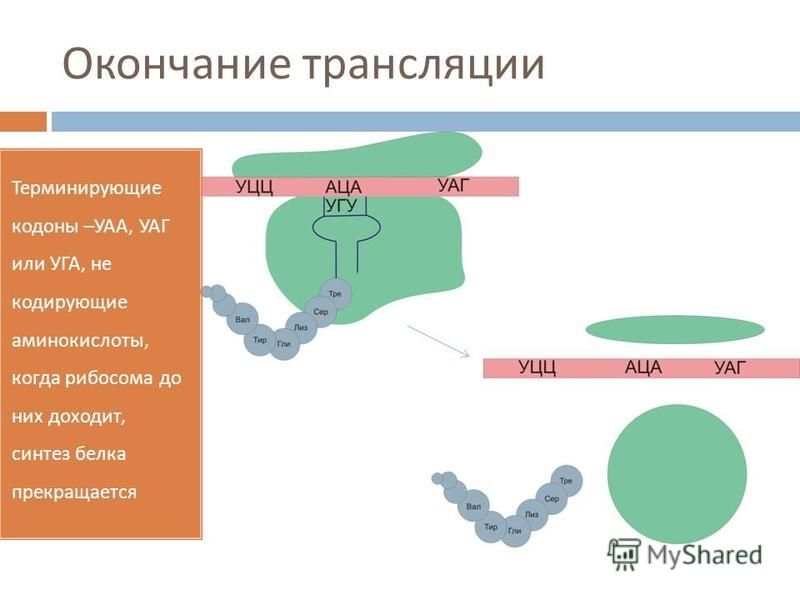 Матричный синтез — это синтез новых молекул в соответствии с планом, заложенным в других уже существующих молекулах.
Матричный синтез — это синтез новых молекул в соответствии с планом, заложенным в других уже существующих молекулах.
Синтез белка в клетке протекает при участии специальных органелл — рибосом. Это немембранные органеллы, состоящие из рРНК и рибосомальных белков.
Последовательность аминокислот в каждом белке определяется последовательностью нуклеотидов в гене — участке ДНК, кодирующем именно этот белок. Соответствие между последовательностью аминокислот в белке и последовательностью нуклеотидов в кодирующих его ДНК и иРНК определяется универсальным правилом — генетическим кодом.
Информация о белке может быть записана в нуклеиновой кислоте только одним способом — в виде последовательности нуклеотидов. ДНК построена из 4 видов нуклеотидов: аденина (А), тимина (Т), гуанина (Г), цитозина (Ц), а белки — из 20 видов аминокислот. Таким образом, возникает проблема перевода четырёхбуквенной записи информации в ДНК в двадцатибуквенную запись белков. Генетический код — соотношения нуклеотидных последовательностей и аминокислот, на основе которых осуществляется такой перевод.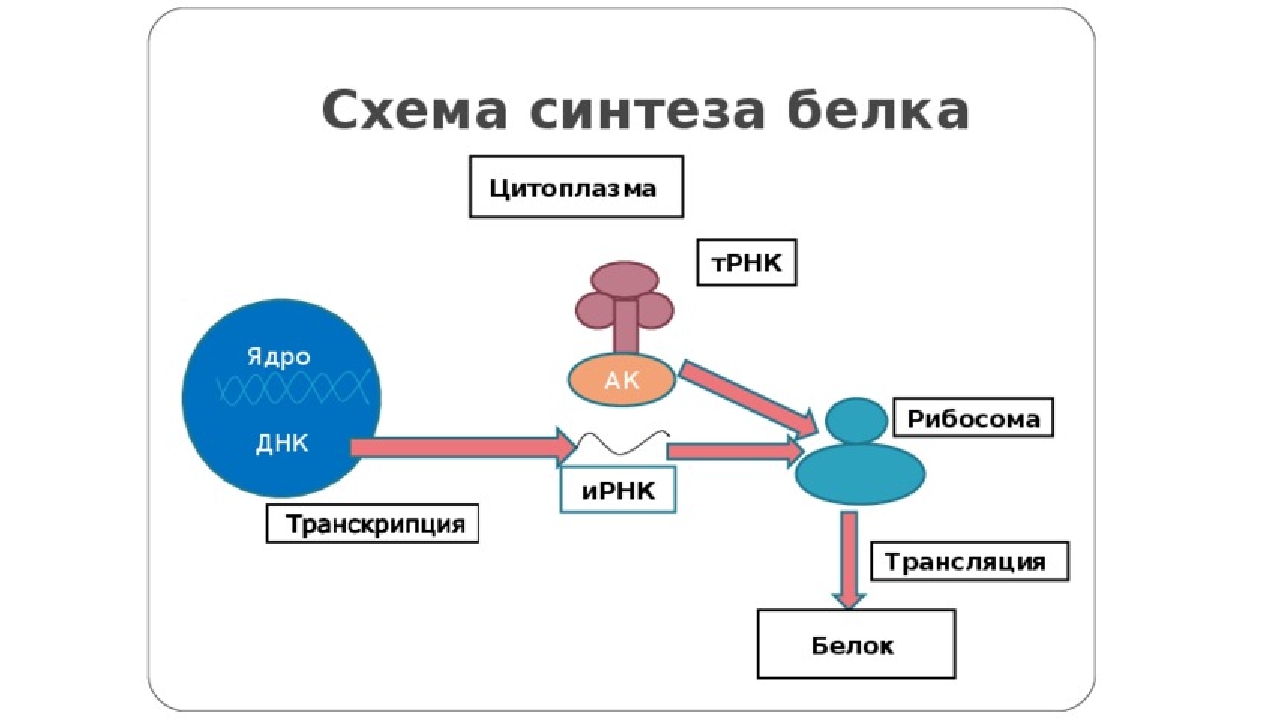
Процесс синтеза белка в клетке можно разделить на два этапа: транскрипция и трансляция.
Этапы синтеза белка в клетке
Транскрипция — первый этап биосинтеза белка
Транскрипция — это процесс синтеза молекулы иРНК на участке молекулы ДНК.
Транскрипция (с лат. transcription — переписывание) происходит в ядре клетки с участием ферментов, основную работу из которых осуществляет транскриптаза. В этом процессе матрицей является молекула ДНК.
Специальный фермент находит ген и раскручивает участок двойной спирали ДНК. Фермент перемещается вдоль цепи ДНК и строит цепь информационной РНК в соответствии с принципом комплементарности. По мере движения фермента растущая цепь РНК матрицы отходит от молекулы, а двойная цепь ДНК восстанавливается. Когда фермент достигает конца копирования участка, то есть доходит до участка, называемого стоп-кодоном, молекула РНК отделяется от матрицы, то есть от молекулы ДНК. Таким образом, транскрипция — это первый этап биосинтеза белка. На этом этапе происходит считывание информации путём синтеза информационной РНК.
Копировать информацию, хотя она уже содержится в молекуле ДНК, необходимо по следующим причинам: синтез белка происходит в цитоплазме, а молекула ДНК слишком большая и не может пройти через ядерные поры в цитоплазму. А маленькая копия её участка — иРНК — может транспортироваться в цитоплазму.
После транскрипции громоздкая молекула ДНК остаётся в ядре, а молекула иРНК подвергается «созреванию» — происходит процессинг иРНК. На её 5’ конец подвешивается КЭП для защиты этого конца иРНК от РНКаз — ферментов, разрушающих молекулы РНК. На 3’ конце достраивается поли(А)-хвост, который также служит для защиты молекулы. После этого проходит сплайсинг — вырезание интронов (некодирующих участков) и сшивание экзонов (информационных участков). После процессинга подготовленная молекула транспортируется из ядра в цитоплазму через ядерные поры.
Транскрипция пошагово:
- РНК полимераза садится на 3’ конец транскрибируемой цепи ДНК.
- Начинается элонгация — полимераза «скользит» по ДНК в сторону 5’ конца и строит цепь иРНК, комплементарную ДНК.
- Полимераза доходит до конца гена, «слетает» с ДНК и отпускает иРНК.
- После этого происходит процесс созревания РНК — процессинг.
Трансляция — второй этап биосинтеза белка
Трансляция — это перевод информации с языка нуклеотидов на язык аминокислот.
Что же происходит в клетке? Трансляция представляет собой непосредственно процесс построения белковой молекулы из аминокислот. Трансляция происходит в цитоплазме клетки. В трансляции участвуют рибосомы, ферменты и три вида РНК: иРНК, тРНК и рРНК. Главным поставщиком энергии при трансляции служит молекула АТФ — аденозинтрифосфорная кислота.
Во время трансляции нуклеотидные последовательности информационной РНК переводятся в последовательность аминокислот в молекуле полипептидной цепи. Этот процесс идёт в цитоплазме на рибосомах. Образовавшиеся информационные РНК выходят из ядра через поры и отправляются к рибосомам. Рибосомы — уникальный сборочный аппарат. Рибосома скользит по иРНК и выстраивает из определённых аминокислот длинную полимерную цепь белка. Аминокислоты доставляются к рибосомам с помощью транспортных РНК. Для каждой аминокислоты требуется своя транспортная РНК, которая имеет форму трилистника. У неё есть участок, к которому присоединяется аминокислота и другой триплетный антикодон, который связывается с комплементарным кодоном в молекуле иРНК.
Цепочка информационной РНК обеспечивает определённую последовательность аминокислот в цепочке молекулы белка. Время жизни информационной РНК колеблется от двух минут (как у некоторых бактерий) до нескольких дней (как, например, у высших млекопитающих). Затем информационная РНК разрушается под действием ферментов, а нуклеотиды используются для синтеза новой молекулы информационной РНК. Таким образом, клетка контролирует количество синтезируемых белков и их тип.
Трансляция пошагово:
- Рибосома узнаёт КЭП, садится на иРНК.
- На Р-сайт рибосомы приходит первая тРНК с аминокислотой.
- На А-сайт рибосомы приходит вторая тРНК с аминокислотой.
- АК образуют пептидную связь.
- Рибосома делает шаг длиною в один триплет.
- На освободившийся А-сайт приходит следующая тРНК.
- АК образуют пептидную связь.
- Процессы 5–7 продолжаются, пока рибосома не встретит стоп-кодон.
- Рибосома разбирается, отпускает полипептидную цепь.
По промокоду
BIO92020 вы получите бесплатный доступ к курсу биологии 9 класса. Выберите нужный раздел и изучайте биологию вместе с домашней онлайн-школой «Фоксфорда»!Резюме
Теперь вы знаете, что биосинтез необходим для выживания — без него клетка умрёт. Процесс биосинтеза белков включает в себя особые реакции, встречающиеся только в живой клетке, — это реакции матричного синтеза.
Синтез белка состоит из двух этапов: транскрипции (образование информационной РНК по матрице ДНК, протекает в ядре клетки) и трансляции (эта стадия проходит в цитоплазме клетки на рибосомах). Эти этапы сменяют друг друга и состоят из последовательных процессов.
Урок 7. генетическая информация её реализация в клетке. ген. геном. реакции матричного синтеза — Биология — 10 класс
В живых системах встречаются химические реакции, неизвестные в неживой природе – реакции матричного синтеза.
Термином «матрица» в технике обозначают форму, употребляемую для отливки монет, медалей, типографского шрифта: затвердевший металл в точности воспроизводит все детали формы, служившей для отливки. Матричный синтез напоминает отливку на матрице: новые молекулы синтезируются в точном соответствии с планом, заложенным в структуре уже существующих молекул.
Матричный принцип лежит в основе важнейших синтетических реакций клетки, таких, как синтез нуклеиновых кислот и белков. В этих реакциях обеспечивается точная, строго специфичная последовательность мономерных звеньев в синтезируемых полимерах.
Роль матрицы в матричных реакциях играют макромолекулы нуклеиновых кислот ДНК или РНК.
Матричный тип реакций – специфическая особенность химизма живых систем. Они являются основой фундаментального свойства всего живого – его способности к воспроизведению себе подобного.
К реакциям матричного синтеза относятся:
1. репликация ДНК – процесс самоудвоения молекулы ДНК, осуществляемый под контролем ферментов. На каждой из цепей ДНК, образовавшихся после разрыва водородных связей, при участии фермента ДНК-полимеразы синтезируется дочерняя цепь ДНК. Материалом для синтеза служат свободные нуклеотиды, имеющиеся в цитоплазме клеток.
Биологический смысл репликации заключается в точной передаче наследственной информации от материнской молекулы к дочерним, что в норме и происходит при делении соматических клеток.
2. транскрипция – синтез иРНК на ДНК, процесс снятия информации с молекулы ДНК, синтезируемой на ней молекулой иРНК.
иРНК состоит из одной цепи и синтезируется на ДНК в соответствии с правилом комплементарности при участии фермента – РНК-полимеразы. Готовая молекула иРНК выходит в цитоплазму на рибосомы, где происходит синтез полипептидных цепей.
3. трансляция – синтез белка на иРНК; процесс перевода информации, содержащейся в последовательности нуклеотидов иРНК, в последовательность аминокислот в полипептиде.
Биосинтез белка – это один из видов пластического обмена, в ходе которого наследственная информация, закодированная в генах ДНК, реализуется в определённую последовательность аминокислот в белковых молекулах. Рибосома представляет собой как бы конвейер для сборки цепочки белка из поступающих в него различных аминокислот. Каждой аминокислоте соответствует строго специфическая тРНК, которая находит «свою» аминокислоту и переносит её в рибосому.
Одновременно с тРНК, на которой «сидит» своя аминокислота, в рибосому поступает «сигнал» от ДНК, содержащейся в ядре. В соответствии с этим сигналом в рибосоме синтезируется тот или иной белок.
Направляющее влияние ДНК на синтез белка осуществляется не непосредственно, а с помощью особого посредника – матричной или информационной РНК (мРНК или иРНК), которая синтезируется в ядре под влиянием ДНК, поэтому её состав отражает состав ДНК. Молекула РНК представляет собой как бы слепок с формы ДНК. Синтезированная иРНК поступает в рибосому и передаёт ей план – в каком порядке должны соединяться друг с другом поступившие в рибосому аминокислоты, чтобы синтезировался определённый белок. Иначе, генетическая информация, закодированная в ДНК, передаётся на иРНК и далее на белок.
Молекула иРНК поступает в рибосому и соединяется с ней. Тот её отрезок, который находится в данный момент в рибосоме, состоит из двух триплетов (кодонов) . Каждый триплет взаимодействует совершенно специфично с подходящим к нему по строению триплетом (антикодоном) в транспортной РНК, которая принесла в рибосому аминокислоту.
Транспортная РНК со своей аминокислотой подходит к определённому кодону иРНК и соединяется с ним; к следующему, соседнему участку иРНК присоединяется другая тРНК с другой аминокислотой. Между аминокислотами образуется пептидная связь. Затем рибосома перемещается на он триплет, первая тРНК освобождается от своей аминокислоты и выходит из рибосомы, а на освободившееся место приходит следующая тРНК. Процесс продолжается до тех пор, пока не будет считана вся цепочка и-РНК до стоп-кодона.
В процессе синтеза белка как правило одновременно участвуют несколько рибосом , образующих комплекс полирибосому.
Основные этапы передачи генетической информации:
синтез на ДНК как на матрице иРНК (транскрипция)
синтез в рибосомах полипептидной цепи по программе, содержащейся в иРНК (трансляция).
Этапы универсальны для всех живых существ, но временные и пространственные взаимоотношения этих процессов различаются у про- и эукариотов.
У эукариот транскрипция и трансляция строго разделены в пространстве и времени: синтез различных РНК происходит в ядре, после чего молекулы РНК должны покинуть пределы ядра, пройдя через ядерную мембрану. Затем в цитоплазме РНК транспортируются к месту синтеза белка – рибосомам. Лишь после этого наступает следующий этап – трансляция.
У прокариот транскрипция и трансляция идут одновременно.
Таким образом,
местом синтеза всех белков, в том числе ферментов в клетке являются рибосомы – это как бы «фабрики» белка, сборочный цех, куда поступают все материалы, необходимые для сборки полипептидной цепочки белка из аминокислот. Природа синтезируемого белка зависит от строения иРНК, от порядка расположения в ней нуклеоидов, а строение иРНК отражает строение ДНК, так что в конечном итоге специфическое строение белка, т. е. порядок расположения в нём различных аминокислот, зависит от порядка расположения нуклеотидов в ДНК, от строения ДНК.
Изложенная теория биосинтеза белка получила название матричной теории. Матричной эта теория называется потому, что нуклеиновые кислоты играют роль матриц, в которых записана вся информация относительно последовательности аминокислотных остатков в молекуле белка.
Создание матричной теории биосинтеза белка и расшифровка аминокислотного кода является крупнейшим научным достижением XX века, важнейшим шагом на пути к выяснению молекулярного механизма наследственности.
генов и синтез белков — обновление нашего понимания | Американский учитель биологии
Три десятилетия назад было обнаружено, что кодирующая функция некоторых эукариотических генов разбита на более мелкие дискретные кодирующие сегменты, называемые экзонами, которые отделены друг от друга длинными участками некодирующей ДНК, называемыми интронами. Нуклеотиды как интрона, так и экзона транскрибируются, что дает первичный транскрипт мРНК или молекулу пре-мРНК, из которой вырезаются нуклеотиды РНК, комплементарные нуклеотидам интрона, что составляет сплайсинг РНК.РНК-нуклеотиды, комплементарные , некоторые экзонных нуклеотида также могут быть сплайсированы из первичной молекулы мРНК; эти нуклеотиды РНК, однако, могут различаться, например, в зависимости от типа клетки, составляющей AS. Экзоны первичного транскрипта, попадающие во все функциональные мРНК, полученные из конкретного первичного транскрипта, обычно называют конститутивными экзонами. Excisable экзоны обычно называют альтернативными экзонами. Имеющиеся данные свидетельствуют о том, что 95% генов человека подвергаются альтернативному сплайсингу (Chen & Manley, 2009, стр.741). Конечный результат процессинга РНК — РНК, которая покидает ядро для трансляции — называется зрелой или функциональной мРНК.
Чтобы проиллюстрировать сплайсинг РНК и AS, 1 представьте себе структурный ген A эукариот, состоящий из 10 экзонов и 9 интронов. (С этого момента я буду использовать «интрон» и «экзон» также в контексте молекул РНК.) В одном типе клеток удаление интрона и селективное удаление экзона может дать функциональную мРНК, содержащую экзоны 1, 2, 3. , 4, 7, 8 и 10, причем все интроны и экзоны 5, 6 и 9 были удалены из первичного транскрипта.В клетках другого типа функциональная мРНК может содержать экзоны 1, 4, 5, 6, 7 и 9. Несколько очевидно, что эти две разные мРНК будут транслироваться в две разные изоформы белка (далее именуемые изоформами), которые могут иметь разные функции, как было предложено Янгом и др. (2016). Эти авторы определили количество партнеров по связыванию, общих для членов пары изоформ. В большинстве случаев члены пары имели менее 50% партнеров по связыванию, Yang et al.в заключение: «В глобальном контексте сетевых карт интерактомов альтернативные изоформы имеют тенденцию вести себя как отдельные белки, а не второстепенные варианты друг друга» (стр. 805).
AS, следовательно, в той степени, в которой изоформы функционально различны, допускает расширенный протеом относительно фиксированного генома, но также, схема AS, представленная до сих пор, может уже вызвать сомнения в том, что информация для синтеза белка находится исключительно в генах.Структурный ген, безусловно, следует рассматривать как матрицу для связанной первичной мРНК. Однако должен ли структурный ген также считаться матрицей для функциональной мРНК, возникающей только после значительного процессинга первичного транскрипта, если этот процессинг включает удаление переменных экзонов? Первичный транскрипт действительно содержит структурные признаки, идентифицирующие вырезаемые экзоны, и эта информация необходима для функционального синтеза мРНК. Кроме того, каждый экзон, обнаруженный в любой из функциональных мРНК, полученных из определенного первичного транскрипта , изначально был частью этого первичного транскрипта .Однако есть одна категория информации, критически важная для результатов сплайсинга, которую, по-видимому, не содержит первичный транскрипт и, соответственно, ген. Сам по себе первичный транскрипт, по-видимому, не содержит информации для , какие эксцизируемых экзона нужно оставить, и , какие эксцизируемых экзона нужно сплайсировать во время конкретного события сплайсинга . Информация, хранящаяся в структурном гене, столь необходимая для первичной аминокислотной последовательности белка, оказывается в то же время недостаточной для определения этой последовательности в той степени, в которой более одной такой последовательности может быть результатом сплайсинга первичного транскрипта.Информация только в первичном транскрипте может указывать только на то, какие экзоны могут быть вырезаны , а не какие экзоны будут вырезаны , в результате события сплайсинга, когда может возникнуть более одной изоформ. Далее представлены доказательства того, что факторы, отличные от ассоциированного гена, могут влиять на результаты сплайсинга, но что такие факторы должны существовать , кажется уже подразумеваемым в самом факте AS; любое влияние, не являющееся прямым продуктом гена, будет называться негенетическим.
генов и синтез белков — обновление нашего понимания | Американский учитель биологии
Три десятилетия назад было обнаружено, что кодирующая функция некоторых эукариотических генов разбита на более мелкие дискретные кодирующие сегменты, называемые экзонами, которые отделены друг от друга длинными участками некодирующей ДНК, называемыми интронами. Нуклеотиды как интрона, так и экзона транскрибируются, что дает первичный транскрипт мРНК или молекулу пре-мРНК, из которой вырезаются нуклеотиды РНК, комплементарные нуклеотидам интрона, что составляет сплайсинг РНК.РНК-нуклеотиды, комплементарные , некоторые экзонных нуклеотида также могут быть сплайсированы из первичной молекулы мРНК; эти нуклеотиды РНК, однако, могут различаться, например, в зависимости от типа клетки, составляющей AS. Экзоны первичного транскрипта, попадающие во все функциональные мРНК, полученные из конкретного первичного транскрипта, обычно называют конститутивными экзонами. Excisable экзоны обычно называют альтернативными экзонами. Имеющиеся данные свидетельствуют о том, что 95% генов человека подвергаются альтернативному сплайсингу (Chen & Manley, 2009, стр.741). Конечный результат процессинга РНК — РНК, которая покидает ядро для трансляции — называется зрелой или функциональной мРНК.
Чтобы проиллюстрировать сплайсинг РНК и AS, 1 представьте себе структурный ген A эукариот, состоящий из 10 экзонов и 9 интронов. (С этого момента я буду использовать «интрон» и «экзон» также в контексте молекул РНК.) В одном типе клеток удаление интрона и селективное удаление экзона может дать функциональную мРНК, содержащую экзоны 1, 2, 3. , 4, 7, 8 и 10, причем все интроны и экзоны 5, 6 и 9 были удалены из первичного транскрипта.В клетках другого типа функциональная мРНК может содержать экзоны 1, 4, 5, 6, 7 и 9. Несколько очевидно, что эти две разные мРНК будут транслироваться в две разные изоформы белка (далее именуемые изоформами), которые могут иметь разные функции, как было предложено Янгом и др. (2016). Эти авторы определили количество партнеров по связыванию, общих для членов пары изоформ. В большинстве случаев члены пары имели менее 50% партнеров по связыванию, Yang et al.в заключение: «В глобальном контексте сетевых карт интерактомов альтернативные изоформы имеют тенденцию вести себя как отдельные белки, а не второстепенные варианты друг друга» (стр. 805).
AS, следовательно, в той степени, в которой изоформы функционально различны, допускает расширенный протеом относительно фиксированного генома, но также, схема AS, представленная до сих пор, может уже вызвать сомнения в том, что информация для синтеза белка находится исключительно в генах.Структурный ген, безусловно, следует рассматривать как матрицу для связанной первичной мРНК. Однако должен ли структурный ген также считаться матрицей для функциональной мРНК, возникающей только после значительного процессинга первичного транскрипта, если этот процессинг включает удаление переменных экзонов? Первичный транскрипт действительно содержит структурные признаки, идентифицирующие вырезаемые экзоны, и эта информация необходима для функционального синтеза мРНК. Кроме того, каждый экзон, обнаруженный в любой из функциональных мРНК, полученных из определенного первичного транскрипта , изначально был частью этого первичного транскрипта .Однако есть одна категория информации, критически важная для результатов сплайсинга, которую, по-видимому, не содержит первичный транскрипт и, соответственно, ген. Сам по себе первичный транскрипт, по-видимому, не содержит информации для , какие эксцизируемых экзона нужно оставить, и , какие эксцизируемых экзона нужно сплайсировать во время конкретного события сплайсинга . Информация, хранящаяся в структурном гене, столь необходимая для первичной аминокислотной последовательности белка, оказывается в то же время недостаточной для определения этой последовательности в той степени, в которой более одной такой последовательности может быть результатом сплайсинга первичного транскрипта.Информация только в первичном транскрипте может указывать только на то, какие экзоны могут быть вырезаны , а не какие экзоны будут вырезаны , в результате события сплайсинга, когда может возникнуть более одной изоформ. Далее представлены доказательства того, что факторы, отличные от ассоциированного гена, могут влиять на результаты сплайсинга, но что такие факторы должны существовать , кажется уже подразумеваемым в самом факте AS; любое влияние, не являющееся прямым продуктом гена, будет называться негенетическим.
генов и синтез белков — обновление нашего понимания | Американский учитель биологии
Три десятилетия назад было обнаружено, что кодирующая функция некоторых эукариотических генов разбита на более мелкие дискретные кодирующие сегменты, называемые экзонами, которые отделены друг от друга длинными участками некодирующей ДНК, называемыми интронами. Нуклеотиды как интрона, так и экзона транскрибируются, что дает первичный транскрипт мРНК или молекулу пре-мРНК, из которой вырезаются нуклеотиды РНК, комплементарные нуклеотидам интрона, что составляет сплайсинг РНК.РНК-нуклеотиды, комплементарные , некоторые экзонных нуклеотида также могут быть сплайсированы из первичной молекулы мРНК; эти нуклеотиды РНК, однако, могут различаться, например, в зависимости от типа клетки, составляющей AS. Экзоны первичного транскрипта, попадающие во все функциональные мРНК, полученные из конкретного первичного транскрипта, обычно называют конститутивными экзонами. Excisable экзоны обычно называют альтернативными экзонами. Имеющиеся данные свидетельствуют о том, что 95% генов человека подвергаются альтернативному сплайсингу (Chen & Manley, 2009, стр.741). Конечный результат процессинга РНК — РНК, которая покидает ядро для трансляции — называется зрелой или функциональной мРНК.
Чтобы проиллюстрировать сплайсинг РНК и AS, 1 представьте себе структурный ген A эукариот, состоящий из 10 экзонов и 9 интронов. (С этого момента я буду использовать «интрон» и «экзон» также в контексте молекул РНК.) В одном типе клеток удаление интрона и селективное удаление экзона может дать функциональную мРНК, содержащую экзоны 1, 2, 3. , 4, 7, 8 и 10, причем все интроны и экзоны 5, 6 и 9 были удалены из первичного транскрипта.В клетках другого типа функциональная мРНК может содержать экзоны 1, 4, 5, 6, 7 и 9. Несколько очевидно, что эти две разные мРНК будут транслироваться в две разные изоформы белка (далее именуемые изоформами), которые могут иметь разные функции, как было предложено Янгом и др. (2016). Эти авторы определили количество партнеров по связыванию, общих для членов пары изоформ. В большинстве случаев члены пары имели менее 50% партнеров по связыванию, Yang et al.в заключение: «В глобальном контексте сетевых карт интерактомов альтернативные изоформы имеют тенденцию вести себя как отдельные белки, а не второстепенные варианты друг друга» (стр. 805).
AS, следовательно, в той степени, в которой изоформы функционально различны, допускает расширенный протеом относительно фиксированного генома, но также, схема AS, представленная до сих пор, может уже вызвать сомнения в том, что информация для синтеза белка находится исключительно в генах.Структурный ген, безусловно, следует рассматривать как матрицу для связанной первичной мРНК. Однако должен ли структурный ген также считаться матрицей для функциональной мРНК, возникающей только после значительного процессинга первичного транскрипта, если этот процессинг включает удаление переменных экзонов? Первичный транскрипт действительно содержит структурные признаки, идентифицирующие вырезаемые экзоны, и эта информация необходима для функционального синтеза мРНК. Кроме того, каждый экзон, обнаруженный в любой из функциональных мРНК, полученных из определенного первичного транскрипта , изначально был частью этого первичного транскрипта .Однако есть одна категория информации, критически важная для результатов сплайсинга, которую, по-видимому, не содержит первичный транскрипт и, соответственно, ген. Сам по себе первичный транскрипт, по-видимому, не содержит информации для , какие эксцизируемых экзона нужно оставить, и , какие эксцизируемых экзона нужно сплайсировать во время конкретного события сплайсинга . Информация, хранящаяся в структурном гене, столь необходимая для первичной аминокислотной последовательности белка, оказывается в то же время недостаточной для определения этой последовательности в той степени, в которой более одной такой последовательности может быть результатом сплайсинга первичного транскрипта.Информация только в первичном транскрипте может указывать только на то, какие экзоны могут быть вырезаны , а не какие экзоны будут вырезаны , в результате события сплайсинга, когда может возникнуть более одной изоформ. Далее представлены доказательства того, что факторы, отличные от ассоциированного гена, могут влиять на результаты сплайсинга, но что такие факторы должны существовать , кажется уже подразумеваемым в самом факте AS; любое влияние, не являющееся прямым продуктом гена, будет называться негенетическим.
генов и синтез белков — обновление нашего понимания | Американский учитель биологии
Три десятилетия назад было обнаружено, что кодирующая функция некоторых эукариотических генов разбита на более мелкие дискретные кодирующие сегменты, называемые экзонами, которые отделены друг от друга длинными участками некодирующей ДНК, называемыми интронами. Нуклеотиды как интрона, так и экзона транскрибируются, что дает первичный транскрипт мРНК или молекулу пре-мРНК, из которой вырезаются нуклеотиды РНК, комплементарные нуклеотидам интрона, что составляет сплайсинг РНК.РНК-нуклеотиды, комплементарные , некоторые экзонных нуклеотида также могут быть сплайсированы из первичной молекулы мРНК; эти нуклеотиды РНК, однако, могут различаться, например, в зависимости от типа клетки, составляющей AS. Экзоны первичного транскрипта, попадающие во все функциональные мРНК, полученные из конкретного первичного транскрипта, обычно называют конститутивными экзонами. Excisable экзоны обычно называют альтернативными экзонами. Имеющиеся данные свидетельствуют о том, что 95% генов человека подвергаются альтернативному сплайсингу (Chen & Manley, 2009, стр.741). Конечный результат процессинга РНК — РНК, которая покидает ядро для трансляции — называется зрелой или функциональной мРНК.
Чтобы проиллюстрировать сплайсинг РНК и AS, 1 представьте себе структурный ген A эукариот, состоящий из 10 экзонов и 9 интронов. (С этого момента я буду использовать «интрон» и «экзон» также в контексте молекул РНК.) В одном типе клеток удаление интрона и селективное удаление экзона может дать функциональную мРНК, содержащую экзоны 1, 2, 3. , 4, 7, 8 и 10, причем все интроны и экзоны 5, 6 и 9 были удалены из первичного транскрипта.В клетках другого типа функциональная мРНК может содержать экзоны 1, 4, 5, 6, 7 и 9. Несколько очевидно, что эти две разные мРНК будут транслироваться в две разные изоформы белка (далее именуемые изоформами), которые могут иметь разные функции, как было предложено Янгом и др. (2016). Эти авторы определили количество партнеров по связыванию, общих для членов пары изоформ. В большинстве случаев члены пары имели менее 50% партнеров по связыванию, Yang et al.в заключение: «В глобальном контексте сетевых карт интерактомов альтернативные изоформы имеют тенденцию вести себя как отдельные белки, а не второстепенные варианты друг друга» (стр. 805).
AS, следовательно, в той степени, в которой изоформы функционально различны, допускает расширенный протеом относительно фиксированного генома, но также, схема AS, представленная до сих пор, может уже вызвать сомнения в том, что информация для синтеза белка находится исключительно в генах.Структурный ген, безусловно, следует рассматривать как матрицу для связанной первичной мРНК. Однако должен ли структурный ген также считаться матрицей для функциональной мРНК, возникающей только после значительного процессинга первичного транскрипта, если этот процессинг включает удаление переменных экзонов? Первичный транскрипт действительно содержит структурные признаки, идентифицирующие вырезаемые экзоны, и эта информация необходима для функционального синтеза мРНК. Кроме того, каждый экзон, обнаруженный в любой из функциональных мРНК, полученных из определенного первичного транскрипта , изначально был частью этого первичного транскрипта .Однако есть одна категория информации, критически важная для результатов сплайсинга, которую, по-видимому, не содержит первичный транскрипт и, соответственно, ген. Сам по себе первичный транскрипт, по-видимому, не содержит информации для , какие эксцизируемых экзона нужно оставить, и , какие эксцизируемых экзона нужно сплайсировать во время конкретного события сплайсинга . Информация, хранящаяся в структурном гене, столь необходимая для первичной аминокислотной последовательности белка, оказывается в то же время недостаточной для определения этой последовательности в той степени, в которой более одной такой последовательности может быть результатом сплайсинга первичного транскрипта.Информация только в первичном транскрипте может указывать только на то, какие экзоны могут быть вырезаны , а не какие экзоны будут вырезаны , в результате события сплайсинга, когда может возникнуть более одной изоформ. Далее представлены доказательства того, что факторы, отличные от ассоциированного гена, могут влиять на результаты сплайсинга, но что такие факторы должны существовать , кажется уже подразумеваемым в самом факте AS; любое влияние, не являющееся прямым продуктом гена, будет называться негенетическим.
генов и синтез белков — обновление нашего понимания | Американский учитель биологии
Три десятилетия назад было обнаружено, что кодирующая функция некоторых эукариотических генов разбита на более мелкие дискретные кодирующие сегменты, называемые экзонами, которые отделены друг от друга длинными участками некодирующей ДНК, называемыми интронами. Нуклеотиды как интрона, так и экзона транскрибируются, что дает первичный транскрипт мРНК или молекулу пре-мРНК, из которой вырезаются нуклеотиды РНК, комплементарные нуклеотидам интрона, что составляет сплайсинг РНК.РНК-нуклеотиды, комплементарные , некоторые экзонных нуклеотида также могут быть сплайсированы из первичной молекулы мРНК; эти нуклеотиды РНК, однако, могут различаться, например, в зависимости от типа клетки, составляющей AS. Экзоны первичного транскрипта, попадающие во все функциональные мРНК, полученные из конкретного первичного транскрипта, обычно называют конститутивными экзонами. Excisable экзоны обычно называют альтернативными экзонами. Имеющиеся данные свидетельствуют о том, что 95% генов человека подвергаются альтернативному сплайсингу (Chen & Manley, 2009, стр.741). Конечный результат процессинга РНК — РНК, которая покидает ядро для трансляции — называется зрелой или функциональной мРНК.
Чтобы проиллюстрировать сплайсинг РНК и AS, 1 представьте себе структурный ген A эукариот, состоящий из 10 экзонов и 9 интронов. (С этого момента я буду использовать «интрон» и «экзон» также в контексте молекул РНК.) В одном типе клеток удаление интрона и селективное удаление экзона может дать функциональную мРНК, содержащую экзоны 1, 2, 3. , 4, 7, 8 и 10, причем все интроны и экзоны 5, 6 и 9 были удалены из первичного транскрипта.В клетках другого типа функциональная мРНК может содержать экзоны 1, 4, 5, 6, 7 и 9. Несколько очевидно, что эти две разные мРНК будут транслироваться в две разные изоформы белка (далее именуемые изоформами), которые могут иметь разные функции, как было предложено Янгом и др. (2016). Эти авторы определили количество партнеров по связыванию, общих для членов пары изоформ. В большинстве случаев члены пары имели менее 50% партнеров по связыванию, Yang et al.в заключение: «В глобальном контексте сетевых карт интерактомов альтернативные изоформы имеют тенденцию вести себя как отдельные белки, а не второстепенные варианты друг друга» (стр. 805).
AS, следовательно, в той степени, в которой изоформы функционально различны, допускает расширенный протеом относительно фиксированного генома, но также, схема AS, представленная до сих пор, может уже вызвать сомнения в том, что информация для синтеза белка находится исключительно в генах.Структурный ген, безусловно, следует рассматривать как матрицу для связанной первичной мРНК. Однако должен ли структурный ген также считаться матрицей для функциональной мРНК, возникающей только после значительного процессинга первичного транскрипта, если этот процессинг включает удаление переменных экзонов? Первичный транскрипт действительно содержит структурные признаки, идентифицирующие вырезаемые экзоны, и эта информация необходима для функционального синтеза мРНК. Кроме того, каждый экзон, обнаруженный в любой из функциональных мРНК, полученных из определенного первичного транскрипта , изначально был частью этого первичного транскрипта .Однако есть одна категория информации, критически важная для результатов сплайсинга, которую, по-видимому, не содержит первичный транскрипт и, соответственно, ген. Сам по себе первичный транскрипт, по-видимому, не содержит информации для , какие эксцизируемых экзона нужно оставить, и , какие эксцизируемых экзона нужно сплайсировать во время конкретного события сплайсинга . Информация, хранящаяся в структурном гене, столь необходимая для первичной аминокислотной последовательности белка, оказывается в то же время недостаточной для определения этой последовательности в той степени, в которой более одной такой последовательности может быть результатом сплайсинга первичного транскрипта.Информация только в первичном транскрипте может указывать только на то, какие экзоны могут быть вырезаны , а не какие экзоны будут вырезаны , в результате события сплайсинга, когда может возникнуть более одной изоформ. Далее представлены доказательства того, что факторы, отличные от ассоциированного гена, могут влиять на результаты сплайсинга, но что такие факторы должны существовать , кажется уже подразумеваемым в самом факте AS; любое влияние, не являющееся прямым продуктом гена, будет называться негенетическим.
Как гены направляют производство белков? — Биология муниципального колледжа Маунт-Худ 102
Информация для производства белков хранится в ДНК организма. Каждый белок кодируется определенным участком ДНК, который называется геном . Ген — это участок ДНК, необходимый для производства одного белка. Гены обычно состоят из сотен или тысяч пар оснований, потому что они кодируют белки, состоящие из сотен или тысяч аминокислот.
Большинство генов содержат информацию, необходимую для создания функциональных молекул, называемых белками.Некоторые гены производят другие молекулы, которые помогают клетке собирать белки. Путь от гена к белку сложен и строго контролируется в каждой клетке. Он состоит из двух основных этапов: транскрипции и перевода. Вместе транскрипция и трансляция известны как экспрессия генов.
В процессе транскрипции информация, хранящаяся в ДНК гена, передается аналогичной молекуле, называемой РНК (рибонуклеиновая кислота), в ядре клетки. И РНК, и ДНК состоят из цепочки нуклеотидных оснований, но имеют несколько разные химические свойства.Тип РНК, которая содержит информацию для создания белка, называется информационной РНК (мРНК), потому что она несет информацию или сообщение от ДНК из ядра в цитоплазму.
Трансляция, второй этап перехода от гена к белку, происходит в цитоплазме. МРНК взаимодействует со специализированным комплексом, называемым рибосомой, который «считывает» последовательность оснований мРНК. Каждая последовательность из трех оснований, называемая кодоном, обычно кодирует одну конкретную аминокислоту.Помните, что аминокислоты — это строительные блоки белков. Тип РНК, называемый транспортной РНК (тРНК), собирает белок, по одной аминокислоте за раз. Сборка белка продолжается до тех пор, пока рибосома не встретит «стоп-кодон» (последовательность из трех оснований, которая не кодирует аминокислоту).
Рисунок 1: Центральная догма — ДНК используется для создания РНК, используется для создания белка.Поток информации от ДНК к РНК и белкам — один из фундаментальных принципов молекулярной биологии.Это настолько важно, что его иногда называют «центральной догмой».
Рисунок 2: Подробнее о центральной догме. («Обзор синтеза белков» Бекки Бун находится под лицензией CC BY-SA 2.0)
Если не указано иное, изображения на этой странице лицензированы OpenStax в соответствии с CC-BY 4.0.
«Что такое белки и для чего они нужны?» Национальной медицинской библиотеки США находится в общественном достоянии
Синтез белка — Основные концепции генетики — Образование и образование Génome Québec
Синтез белка — Основные концепции генетики — Génome Québec Образование и образованияОт ДНК к белку — 3D , ваш геном.org, Wellcome Genome Campus (Великобритания) — 2:42 мин.
Белки — это большие молекулы, которые могут выполнять множество различных задач. Они могут облегчать химические реакции (например, ферменты), обеспечивать структурную поддержку (например, цитоскелет), передавать сигналы с поверхности клетки (например, мембранные рецепторы) и многое другое. Но откуда они?
Гены в нашей ДНК похожи на рецепты, используемые для производства белков. Но поскольку рецепты кодируются с использованием азотистых оснований (ATCG), их сначала нужно перевести.Многие белки работают вместе над этой задачей перевода. Нити двойной спирали ДНК должны сначала уступить место, чтобы можно было получить доступ к целевому гену. Затем белки производят идентичную копию целевой последовательности ДНК: информационную РНК.
Эта копия рецепта, теперь транскрибируемая как мессенджер РНК, затем отправляется за пределы ядра клетки, поскольку белки производятся в другом месте клетки. Оттуда рибосомы, мелкие частицы, присутствующие в большом количестве вокруг ядра, будут служить поварами, читая рецепт приготовления белка.Аминокислоты являются основными ингредиентами, которые входят в рецепт белка, и рибосомы используют план, предоставляемый информационной РНК, чтобы расположить аминокислоты в правильном порядке и сформировать длинную цепочку. Аминокислоты — это органические молекулы, которые содержат амин, химическое соединение, полученное из аммиака. Химики знают сотни аминокислот, но только 20 из них образуют белки. Но белки в этой линейной форме еще не готовы. Чтобы функционировать, он должен складываться в стиле оригами. Это когда он превращается из единой цепи в сложную трехмерную структуру.
