Таблица «Немембранные органоиды» (для учащихся 9-10 классов)
МКОУ «Новокаякентская СОШ»
с. Новокаякент
Каякентский район Республика Дагестан
Таблица «Немембранные органоиды»
(для учащихся 9-10 классов)
Автор: учитель биологии
МКОУ «Новокаякентская СОШ»
Умалатова Равганият Бийбулатовна
с.Новокаякент
2017 г.
Пояснительная записка
Данная таблица «Немембранные органоиды» рекомендуется для учащихся 9-10 классов. Материал можно использовать при прохождении главы «Строение и функции клетки» в 9-10 классах. Таблица включает изображения немембранных органоидов эукариотической клетки: рибосомы, клеточного центра, цитоскелета, жгутиков и ресничек, с их строением и функциями.
Задачи: ознакомление учащихся с немембранными органоидами эукариотической клетки: рибосомой, клеточным центром, цитоскелетом, жгутиком и ресничками, с их строением и функциями.
Таблица «Немембранные органоиды»
Немембранные органоидыНемембранные органоиды клетки:
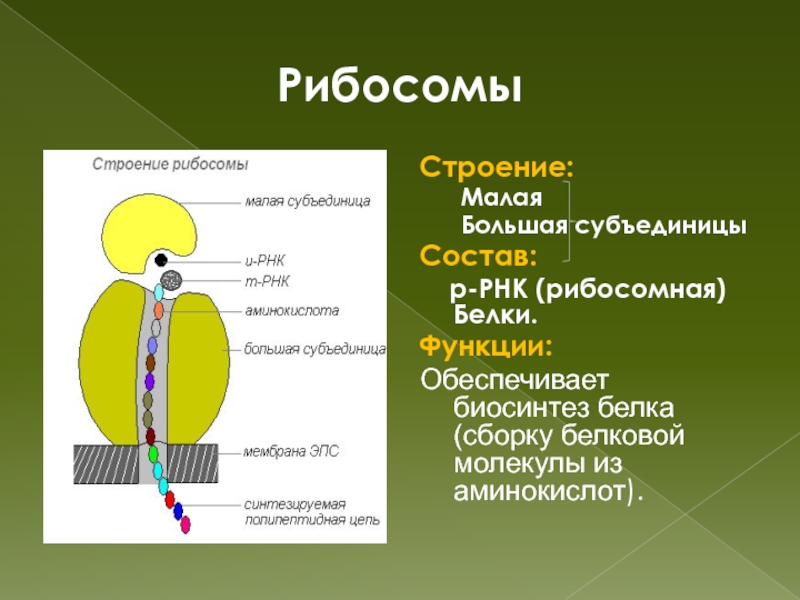
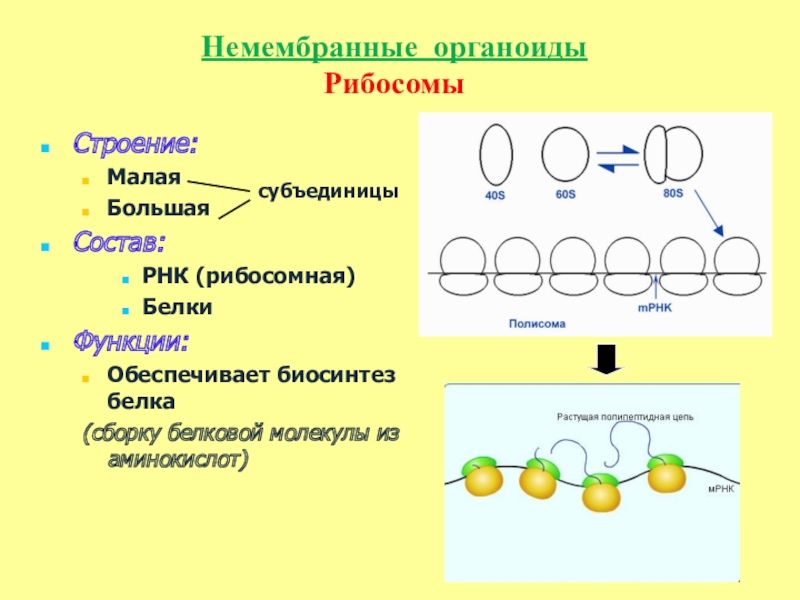
1.Рибосомы
2.Клеточный центр
3. Цитоскелет
4.Жгутики и реснички
Органоид
Строение
Функции
Рибосомы
Органеллы, состоящие из двух частей, происходит синтез белка
Клеточный центр
1.Образует веретено деления клетки, участвует в делении клетки.
2.Принимает участие в развитии жгутиков и ресничек.
Цитоскелет
Внутренний скелет клетки образованный сетью белковых волокон.
1.Придает клеткам форму и обеспечивает структурную поддержку.
2.Закрепление органелл в определенном положении.
3.Помогает в образовании вакуолей.
Жгутики и реснички
Реснички и жгутики выполняют функцию движения.
Источники информации:
1. Биология в таблицах и схемах/ А.Ю. Ионцева, А.Б. Торгалов.-М.:Эксмо,2012.-352с.
Биология в таблицах и схемах/ А.Ю. Ионцева, А.Б. Торгалов.-М.:Эксмо,2012.-352с.
2.Биология 10 класс: поурочные планы. Автор-составитель
О. Л.Ващенко,2007. Издательство «Учитель»
3.https://pda.litres.ru/static/bookimages/18/31/19/18311935.bin.dir/h/image15_5660778a0f9be1bc0d92b3fc_jpg.jpeg
4.http://poznayka.org/baza1/1790333800230.files/image028.jpg
5.https://konspekta.net/infopediasu/baza14/274819828919.files/image030.png
6.http://mypresentation.ru/documents/af079ac9678e6c648dc1068047247143/img27.jpg
Ответ § 8. Органоиды клетки и их функции
Особенностью эукариотических клеток является общий и единый мембранный принцип строения их структурных образований.
1) Какое общее название имеют разные структурные компоненты эукариотических клеток?
Используя текст § 8, выпишите:
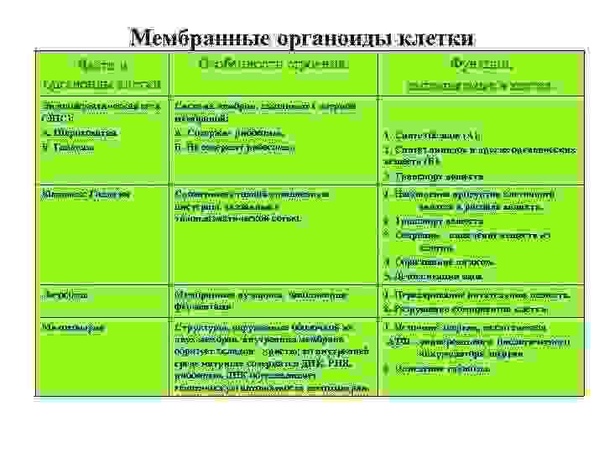
Органоиды мембранные:
-
Ответ: эндоплазматическая сеть, комплекс Гольджи, лизосома, митохондрия, Пластиды
Органоиды немембранные:
Найдите эти органоиды на рисунке 9 учебника.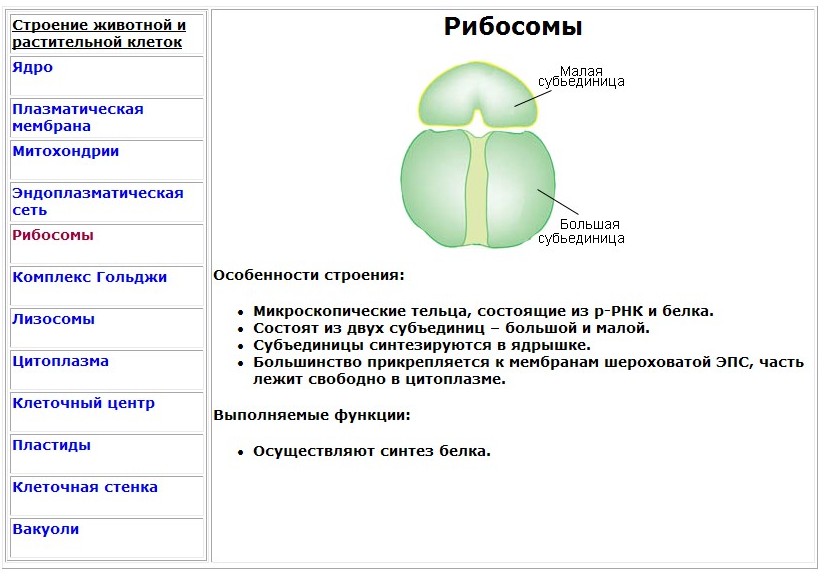
2) Объясните, почему цитоплазматическая мембрана выполняет роль барьера, обеспечивающего избирательное проникновение веществ из внешней и внутренней среды.
3) Заполните таблицу «Характерные признаки эндоплазматической сети».
-
Ответ:
Признаки Эндоплазматическая сеть гладкая шероховатая Особенности строения Рибосомы отсутствуют Многочисленные рибосомы, усеивающие поверхгность мембран Функции Производит различные липиды и углеводы Процесс синтеза белков
4) Отметьте особенности строения комплекса Гольджи. Какова его роль в клетке?
5) Заполните пропуски в предложениях.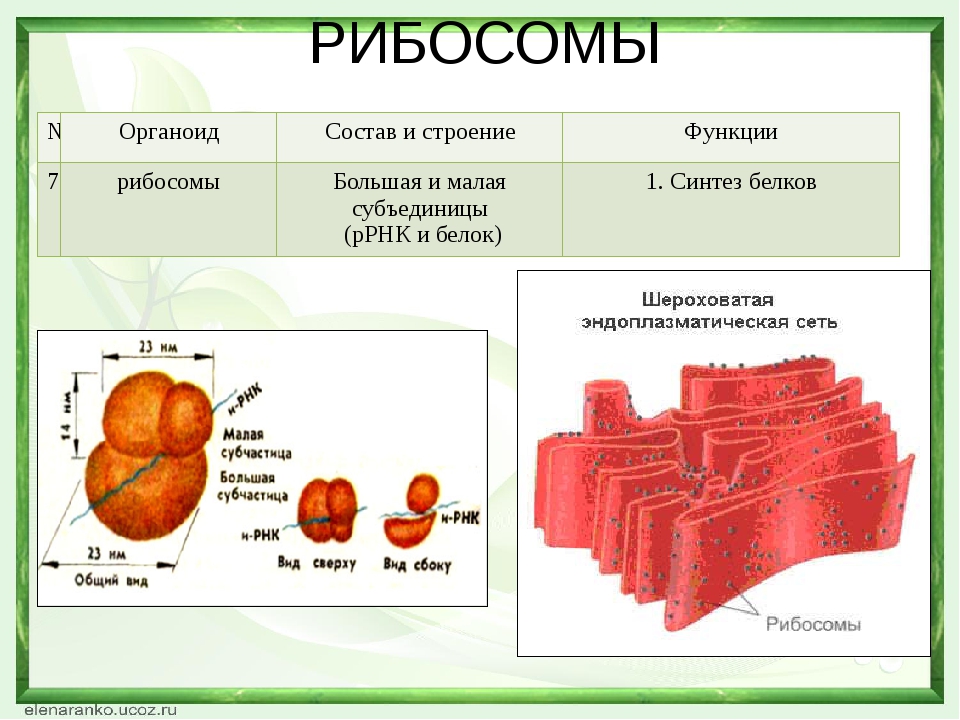
-
Ответ: Лизосома — это округлый органоид, который имеется только в клетках растений и грибов. Главная ее функция — внутриклеточное пищеварение. Лизосомы учавствуют в удалении отмирающих клеток и в удалении чужеродных веществ, проникающих в клетку.
6) Прочитайте текст учебника о митохондриях и хлоропластах. Сравните их между собой. Отметьте черты сходства и различия.
-
Ответ: Черты сходства: Окружены двойной мембраной, образуя тилакоиды, ДНК, способность к делению.
Черты различия: Митохондрии учавствуют в дыхании; митохондрия имеется в живой и растительной клетке, а хлоропласты только в растительной.
Как повлияет на жизнедеятельность клетки уменьшение в ней количества митохондрий?
7) Какие органоиды характерны только для растительных клеток? Каково их общее название? От чего зависит их окраска? Опишите главный фотосинтезирующий органоид.
-
Ответ: Пластида — органоид, свойственный только растительным клеткам. Различают три вида пластид: зеленые — хлоропласты, желтые и оранжевые — храмопласты, бесцветные — лейкопласты. Хлорофилл — главный фотосинтезирующий пигмент,
Впервые создана искусственная рибосома
В ИзбранноеБиологи создали первый в истории человечества искусственный аналог рибосомы – ключевой части клетки, отвечающей за сборку молекул белков, и научили ее реагировать на не существующие в природе сигналы.
Международный коллектив молекулярных биологов впервые в истории человечества создал искусственный аналог рибосомы – ключевой части клетки, отвечающей за сборку молекул белков, и научил ее использовать не существующие в природе аминокислоты.
Рибосомы – главная внутриклеточная фабрика белка. Структура этих органоидов в общих чертах была известна давно, однако никто не знал, как можно заменить их молекулярной машиной. Создать специализированную рибосому с нуля для производства экзотических полипептидов – и вовсе казалось задачей отдалённого будущего. Каждая рибосома состоит из двух субъединиц, имеющих различную массу. Для синтеза белка обе субъединицы объединяются и скользят вдоль матричной РНК, выполняя сборку полипептида по записанной на ней программе.
Создать специализированную рибосому с нуля для производства экзотических полипептидов – и вовсе казалось задачей отдалённого будущего. Каждая рибосома состоит из двух субъединиц, имеющих различную массу. Для синтеза белка обе субъединицы объединяются и скользят вдоль матричной РНК, выполняя сборку полипептида по записанной на ней программе.
В ролике ниже мРНК представлена жёлтой нитью. Она выделяется через поры ядра в цитоплазму клетки. Там к ней сначала присоединяется малая субъединица рибосомы (светло-синяя), а затем – большая (фиолетовая). К образовавшемуся комплексу поступают молекулы аминоацил-тРНК (зелёные) поставляющие разные аминокислоты для синтеза белка. Вскоре от рибосомы отделяется красная нить – синтезированный полипептид.
Искусственная рибосома, получившая название Ribo-T, устроена немного иначе. Если бы её сделали также состоящей из двух частей, то синтетические субъединицы смогли бы перемещаться по матриксу эндотелия и вступать в конкурентные отношения с естественными, блокируя их.
Поэтому авторы исследования решили заранее объединить субъединицы искусственной рибосомы, оставив между ними пространство, достаточное для скольжения матричной РНК. Такая иммобилизованная структура демонстрирует менее впечатляющие результаты по скорости, но главное – она работает внутри живой клетки E.coli. Бактерии выживают и продолжают синтезировать заданный белок даже после замены всех исходных рибосом синтетическими.
«Скорость биосинтеза белка на Ribo-T получается примерно вдвое ниже, чем у естественных рибосом, но структура последних совершенствовалась на протяжении миллиардов лет эволюции, а нашей разработке всего год», – комментирует соавтор исследования Александр Мэнкин (Alexander Mankin).
С начала восьмидесятых годов прошлого века для промышленного синтеза инсулина, соматотропина, интерферонов и других сложных белков используются бактерии (преимущественно E. Coli) с модифицированным геномом. При помощи искусственной рибосомы авторы рассчитывают изготавливать любые белки ещё проще.
При помощи искусственной рибосомы авторы рассчитывают изготавливать любые белки ещё проще.
Пока каждая Ribo-T способна синтезировать только протеины определённого класса, но для уровня доказательства концепции этого более чем достаточно. Следующим этапом развития биотехнологий будет создание универсальной синтетической рибосомы, способной выполнять сборку любых белков на заказ. Это могут быть компоненты с любой биологической активностью – не содержащие возбудителя безопасные вакцины, пептидные гормоны, компоненты селективных лекарств, новых косметических средств и пищевых продуктов.
«В своей работе авторы преодолели основное препятствие для создания полностью синтетических рибосом с заданными свойствами, – отмечает научный сотрудник Лос-Аламосской национальной лаборатории Карисса Санбонмацу (Karissa Sanbonmatsu). – они заложили основу для драматических изменений».
Схожую оценку даёт и биолог Йельского университета Фаррен Айзекс (Farren Isaacs): «Это исследование станет ключом для производства совершенно новых классов экзотических протеинов», – говорит он в интервью изданию The Verge.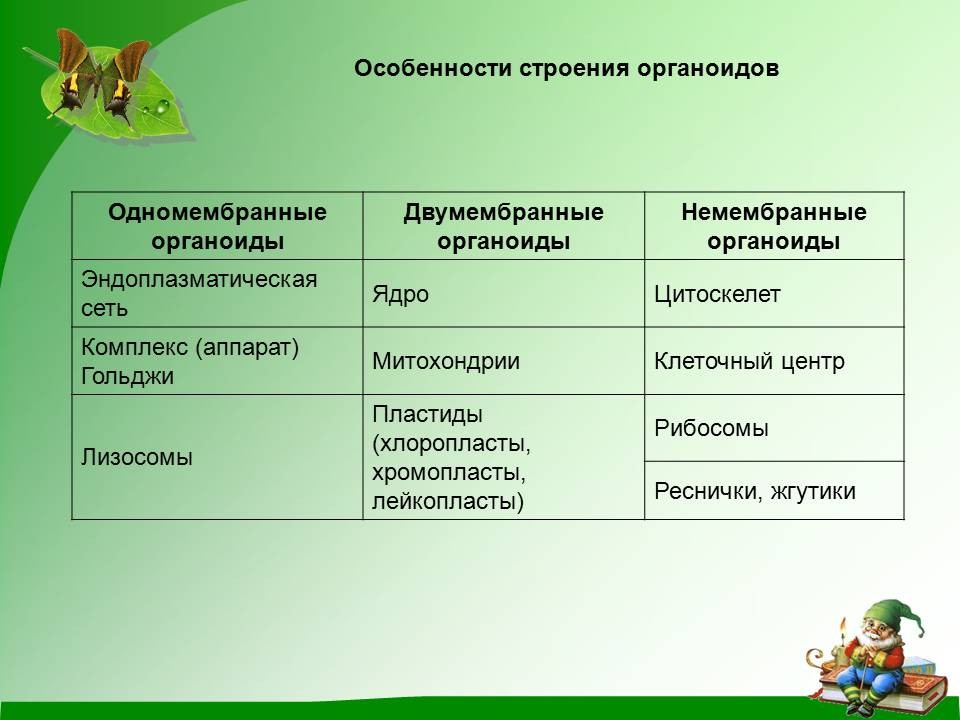
Год назад в научно-исследовательском институте Скриппса (TSRI) был создан новый генетический алфавит с парой дополнительных кодирующих молекул, не встречающихся в природе. Теперь его можно опробовать на искусственной рибосоме.
Получаемые до сегодняшнего дня рекомбинантные белки были полностью идентичны образующимся естественным путём. Они всегда содержали остатки стандартного набора из двадцати или менее L-альфа-аминокислот. Сочетая дополненный генетический код с возможностями искусственных рибосом, теоретически можно запустить биосинтез 172 аминокислот и создавать в промышленных масштабах абсолютно другие белки.
Как и любая научная разработка, искусственные рибосомы могут стать технологией двойного назначения. Если решить задачу их доставки в клетки живого организма, то Ribo-T можно будет использовать для лечения отравлений рицином. Этот белковый яд не имеет специфических антидотов. Он разобщает субъединицы рибосом, блокируя биосинтез белка. Искусственная рибосома уже сейчас устойчива к воздействию рицина, поскольку её субъединицы изначально связаны между собой.
С другой стороны, с помощью Ribo-T могут быть синтезированы новые токсины – абсолютно неизвестные потенциальному противнику и гораздо более подходящие для диверсий, чем рицин и другие природные яды.
Исследование опубликовано в Nature
Определение, структура, размер, расположение и функция
Определение, структура, размер, расположение и функция
Определение
Изучая животную и растительную клетку под микроскопом, вы могли видеть многочисленные органеллы, которые работают вместе, чтобы выполнять клеточную деятельность. Одними из основных клеточных органелл являются рибосомы, отвечающие за синтез белка.
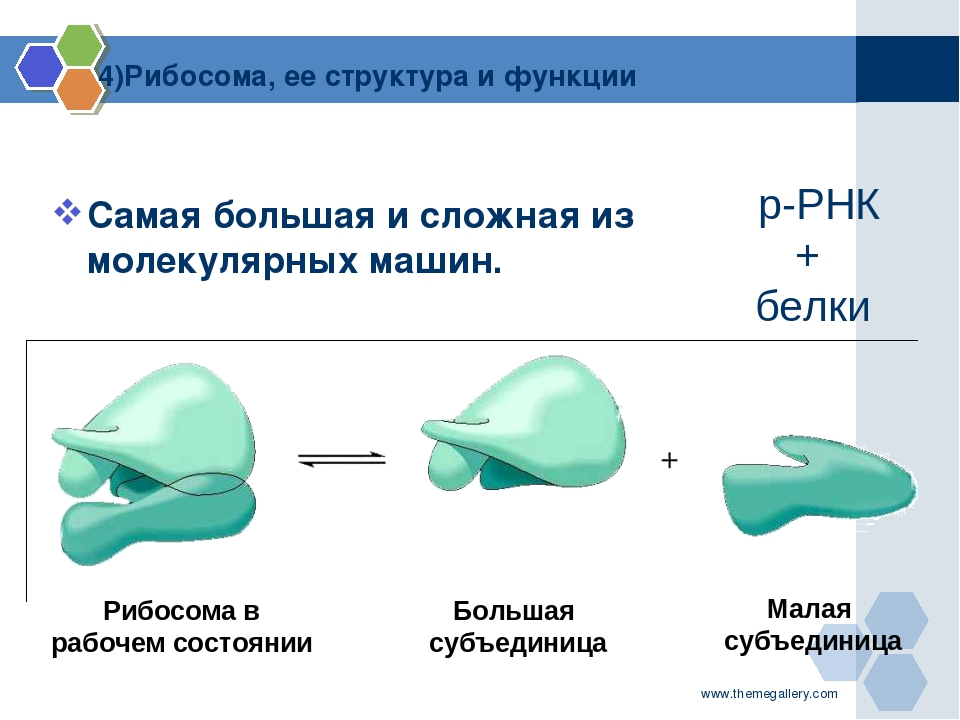
Рибосома представляет собой комплекс, состоящий из белка и РНК, размер которого составляет несколько миллионов дальтон и играет важную роль в процессе декодирования генетического сообщения, зарезервированного в геноме, в белок.
Важным химическим этапом синтеза белка является перенос пептидила, когда развивающийся или формирующийся пептид перемещается от одной молекулы тРНК к аминокислоте вместе с другой тРНК. Аминокислоты включаются в развивающийся полипептид в соответствии с расположением кодонов мРНК. Таким образом, рибосома имеет необходимые участки для одной мРНК и не менее двух тРНК.
Аминокислоты включаются в развивающийся полипептид в соответствии с расположением кодонов мРНК. Таким образом, рибосома имеет необходимые участки для одной мРНК и не менее двух тРНК.
Состоит из двух субъединиц, большой и малой субъединиц, которые состоят из пары молекул рибосомной РНК (рРНК) и нерегулярного количества рибосомных белков.Многочисленные белковые факторы катализируют четкое представление о синтезе белка. Трансляция генетического кода имеет существенное значение для производства полезных белков и для роста клетки.
Структура
Рибосомы состоят из белков и рибонуклеиновой кислоты (сокращенно РНК) почти в равных количествах. Он состоит из двух разделов, известных как субъединицы. Меньшая субъединица — это место, где мРНК связывается и расшифровывается, тогда как большая субъединица — это место, где включаются аминокислоты.
Обе субъединицы состоят как из рибонуклеиновой кислоты, так и из белковых компонентов и связаны друг с другом взаимодействиями между белками в одной субъединице и рРНК в другой субъединице. Рибонуклеиновая кислота получается из ядрышка, в месте расположения рибосом в клетке.
Рибонуклеиновая кислота получается из ядрышка, в месте расположения рибосом в клетке.
Структуры рибосомы включают:
- Расположены в двух участков цитоплазмы.
- Рассеянные в цитоплазме и некоторые связаны с эндоплазматическим ретикулумом.
- Всякий раз, когда присоединяются к ER они называются шероховатой эндоплазматической сетью.
- Свободные и связанные рибосомы очень очень похожи по строению и связаны с синтезом белка.
- Примерно от 37 до 62% РНК состоит из РНК а остальное белки.
- Прокариоты имеют рибосомы 70S соответственно субъединицы, состоящие из малой субъединицы 30S и большей субъединицы 50С. У эукариот есть рибосомы 80S. соответственно, состоящий из малых (40S) и существенных (60S) субъединиц.
- Рибосомы в хлоропластах митохондрии эукариот состоят из больших и малых субъединиц, состоящих из белки внутри частицы 70S.
- Общая центральная структура
который очень похож на все рибосомы, несмотря на изменения в его размере.
- РНК расположены в различных третичных структурах. РНК в более крупных рибосомах находится в многочисленных непрерывных вливаниях, поскольку они создавайте петли из центра структуры, не нарушая и не изменяя Это.
- Контраст между эукариотическими и бактерии используются для производства антибиотиков, которые могут подавлять бактериальные заболевания. без повреждения клеток человека.
Размер рибосом
Рибосомы состоят из двух субъединиц, которые надлежащим образом составлены и функционируют как одна для трансляции мРНК в полипептидную цепь в процессе синтеза белка. Из-за того, что они состоят из двух субъединиц разного размера, в шарнире они немного длиннее, чем в диаметре.Они различаются по размеру у прокариотических клеток и эукариотических клеток.
Прокариот состоит из субъединицы 30s (Сведберга) и субъединицы 50s (Сведберга), что означает 70s для всей органеллы, равной молекулярной массе 2,7×106 дальтон. Прокариотические рибосомы имеют диаметр около 20 нм (200 Å) и состоят на 35% из рибосомных белков и на 65% из рРНК.
Тем не менее, эукариотические имеют диаметр от 25 до 30 нм (250–300 Å). Они состоят из субъединицы 40 (Сведберг) и субъединицы 60 (Сведберг), что означает 80 (Сведберг) для всей органеллы, что равно молекулярной массе 4 × 106 Дальтон.
Местоположение
Рибосомы представляют собой органеллы, расположенные внутри клеток животных, человека и растений. Они расположены в цитозоле, некоторые связаны и свободно плавают на мембране грубого эндоплазматического ретикулума.
Они используются для расшифровки ДНК (дезоксирибонуклеиновой кислоты) в белки, и ни одна рРНК не навсегда связана с RER, они высвобождают или связывают в соответствии с указаниями типа белка, который они объединяют. В клетке животного или человека может быть до 10 миллионов рибосом, и множество рибосом могут быть связаны с эквивалентной цепью мРНК, эта структура известна как ПОЛИСОМА .
Функция
Когда дело доходит до основных функций рибосом, они берут на себя роль объединения аминокислот для образования определенных белков, которые важны для завершения деятельности клетки.
Белок необходим для многих функций клеток, например, для управления химическими процессами или устранения повреждений. Еще можно обнаружить рибосомы, плавающие внутри цитоплазмы или присоединенные к эндоплазматическому ретикулуму.
Другие функции включают в себя:
- Процедура создания белков, дезоксирибонуклеиновая кислота образует мРНК на этапе транскрипции ДНК.
- Наследственная информация из мРНК преобразуется в белки в процессе трансляции ДНК.
- Механизмы сборки белка в процессе синтеза белка указаны в мРНК.
- мРНК располагается в ядре и перемещается в цитоплазму для дополнительной операции синтеза белка.
- Белки, которые расположены рибосомами в настоящее время в цитоплазме, используются внутри цитоплазмы сами по себе. Белки, созданные связанными рибосомами, перемещаются за пределы клетки.
Принимая во внимание их основную функцию в развитии белков, ясно, что клетка не может функционировать без рибосом.
Те, что живут внутри бактерий, паразитов и разных существ, например, существ низшего и микроскопического уровня, называются прокариотическими рибосомами. В то время как те, которые живут внутри людей и других, таких как существа более высокого уровня, мы называем эукариотическими рибосомами.
В то время как те, которые живут внутри людей и других, таких как существа более высокого уровня, мы называем эукариотическими рибосомами.
Другие основные отличия включают в себя:
- Прокариоты имеют 70S рибосомы, состоящие по отдельности из 30S и 50S субъединиц.В то время как у эукариот есть рибосомы 80S, состоящие по отдельности из субъединиц 40S и 60S.
- Рибосомы 70S относительно меньше, чем рибосомы 80S, а рибосомы 80S относительно больше, чем рибосомы 70S.
- Прокариоты имеют 30S субъединицу с 16S субъединицей РНК и состоят из 1540 нуклеотидов, связанных с 21 белком. Субъединица 50S образуется из субъединицы 5S РНК, состоящей из 120 нуклеотидов, и субъединицы 23S РНК, состоящей из 2900 нуклеотидов и 31 белка.
- Эукариоты имеют 40S субъединицу с 18S РНК, а также 33 белка и 1900 нуклеотидов.Большая субъединица содержит 5S РНК, а также 120 нуклеотидов, 4700 нуклеотидов, а также 28S РНК, 5,8S РНК, а также субъединицы 160 нуклеотидов и 46 белков.

- Эукариотические клетки имеют митохондрии и хлоропласты в качестве органелл, и эти органеллы дополнительно имеют рибосомы 70S. Следовательно, эукариотические клетки имеют разные типы рибосом (70S и 80S), а прокариотические клетки имеют только 70S рибосомы.
См. также: Эукариоты и прокариоты,
Полный обзор можно найти на главной странице Органелл.
Различия между цитозолом и цитоплазмой
цитоплазма
Ядро
, обсуждающих Mitochondria
Golgi Applatus
Lysosomes
Chloroplasts
Возвращение из рибсомов до клеточной биологии
Возвращение от Ribsomes до микроскопемастера дома
сообщить об этом объявленииНажмите здесь, чтобы узнать, как размещать рекламу на MicroscopeMaster!
Рибосомы – определение, структура, функции и схема
Home » Клеточная биология » Рибосомы – определение, структура, функции и схема
Рибосомы Определение
- Слово «рибосома» происходит от «рибо» от рибонуклеиновой кислоты и «сомы» от греческого слова «сома», что означает «тело».

- Рибосомы представляют собой крошечные сфероидальные плотные частицы (от 150 до 200 A 0 в диаметре), которые в основном обнаруживаются у большинства прокариот и эукариот.
- Они являются сайтами синтеза белка .
- Они представляют собой структуры, содержащие приблизительно равные количества РНК и белков и служащие каркасом для упорядоченного взаимодействия многочисленных молекул, участвующих в синтезе белка.
- Рибосомы встречаются в клетках как прокариотических, так и эукариотических.
- В прокариотических клетках рибосомы часто свободно располагаются в цитоплазме.
- В эукариотических клетках рибосомы либо свободно находятся в цитоплазме, либо остаются прикрепленными к внешней поверхности мембраны эндоплазматического ретикулума.
- Расположение рибосом в клетке определяет, какой белок она производит.
- Если рибосомы свободно плавают по клетке, они будут производить белки, которые будут использоваться внутри самой клетки.

- Когда рибосомы прикреплены к эндоплазматическому ретикулуму, это называется шероховатый эндоплазматический ретикулум или шероховатый ЭПР.
- Белки, полученные на шероховатой ЭР, используются для использования внутри клетки или вне клетки.
- Количество рибосом в клетке зависит от активности клетки.
- В среднем в клетке млекопитающих может быть около 10 миллионов рибосом.
Рисунок: Схема рибосом
Структура рибосом
- Рибосома состоит из комплексов РНК и белков и, следовательно, является рибонуклеопротеином.
- Примерно от 37 до 62% РНК состоит из РНК, а остальное — из белков.
- Каждая рибосома делится на две субъединицы:
- Меньшая субъединица , которая связывается с большей субъединицей и структурой мРНК, и
- Большая субъединица , которая связывается с тРНК, аминокислотами и меньшей субъединицей.
- Прокариоты имеют 70S рибосомы, соответственно субъединицы, состоящие из малой субъединицы 30S и большей субъединицы 50S.
- Их малая субъединица имеет субъединицу 16S РНК (состоящую из 1540 нуклеотидов), связанную с 21 белком.
- Большая субъединица состоит из субъединицы 5S РНК (120 нуклеотидов), субъединицы 23S РНК (2900 нуклеотидов) и 31 белка.
- Эукариоты имеют 80S рибосомы, состоящие соответственно из малых (40S) и существенных (60S) субъединиц.
- Меньшая 40S рибосомная субъединица имеет форму вытянутого эллипса и состоит из одной молекулы 18S рибосомной РНК (или рРНК) и 30 белков (обозначенных как S1, S2, S3 и т. д.).
- Более крупная 60S рибосомная субъединица имеет круглую форму и содержит канал, через который выходит растущая полипептидная цепь.
- Он состоит из трех типов молекул рРНК, то есть 28S рРНК, 5,8 рРНК и 5S рРНК, и 40 белков (названных L1, L2, L3 и т. д.).
- Различия между рибосомами бактерий и эукариот используются для создания антибиотиков, способных уничтожать бактериальную инфекцию, не повреждая клетки человека.

- Рибосомы, наблюдаемые в хлоропластах митохондрий эукариот, состоят из больших и малых субъединиц, состоящих из белков внутри 70S-частицы.
- Рибосомы имеют общую структуру ядра, которая похожа на все рибосомы, несмотря на различия в ее размере.
- Две субъединицы сочетаются друг с другом и работают как единое целое, транслируя мРНК в полипептидную цепь во время синтеза белка.
- Поскольку они образованы двумя субъединицами разного размера, они немного длиннее по оси, чем в диаметре.
- Во время синтеза белка, когда несколько рибосом присоединяются к одной и той же цепи мРНК, эта структура известна как полисома.
- Существование рибосом носит временный характер, после синтеза полипептида две субъединицы разделяются и повторно используются или распадаются.
Функции рибосом
- Рибосома — это сложная молекулярная машина, присутствующая во всех живых клетках и служащая местом биологического синтеза белка (трансляции).

- Рибосомы связывают аминокислоты вместе в порядке, определяемом молекулами информационной РНК (мРНК).
- Рибосомы действуют как катализаторы в двух чрезвычайно важных биологических процессах, называемых переносом пептидила и гидролизом пептидила.
Каталожные номера
- Верма, П.С., и Агравал, В.К. (2006). Клеточная биология, генетика, молекулярная биология, эволюция и экология (1-е изд.). С.Чанд и компания ООО
- Альбертс, Б. (2004). Основная клеточная биология. Нью-Йорк, штат Нью-Йорк: научный паб Garland.
- Кар, Д.К. и Гальдер, С. (2015). Клеточная биология, генетика и молекулярная биология. Колката, Новое центральное книжное агентство
- https://biology.tutorvista.com/animal-and-plant-cells/ribosomes.html
- https://alevelbiology.co.uk/notes/ribosomes-structure-and-functions/
- https://biologywise.com/ribosomes-функция
- https://biologydictionary.net/ribosome/
Рибосомы — определение, структура, функции и схема
рибосом | цитология | Британика
рибосома , частица, присутствующая в большом количестве во всех живых клетках и служащая местом синтеза белка. Рибосомы встречаются как в виде свободных частиц в прокариотических и эукариотических клетках, так и в виде частиц, прикрепленных к мембранам эндоплазматического ретикулума в эукариотических клетках.Небольшие частицы, которые стали известны как рибосомы, были впервые описаны в 1955 году американским клеточным биологом румынского происхождения Джорджем Э. Паладом, который обнаружил, что они часто связаны с эндоплазматическим ретикулумом в эукариотических клетках.
Рибосомы встречаются как в виде свободных частиц в прокариотических и эукариотических клетках, так и в виде частиц, прикрепленных к мембранам эндоплазматического ретикулума в эукариотических клетках.Небольшие частицы, которые стали известны как рибосомы, были впервые описаны в 1955 году американским клеточным биологом румынского происхождения Джорджем Э. Паладом, который обнаружил, что они часто связаны с эндоплазматическим ретикулумом в эукариотических клетках.
Рибосомы чрезвычайно многочисленны в клетках. Одна активно реплицирующаяся эукариотическая клетка, например, может содержать до 10 миллионов рибосом. У бактерии Escherichia coli (прокариот) число рибосом может достигать 15 000, что составляет четверть общей массы клетки.Размер рибосом внутри клеток варьируется в зависимости от типа клетки и таких факторов, как состояние покоя клетки или ее репликация. Средняя рибосома E. coli , наиболее характерного примера, имеет диаметр около 200 ангстрем (около 20 нм).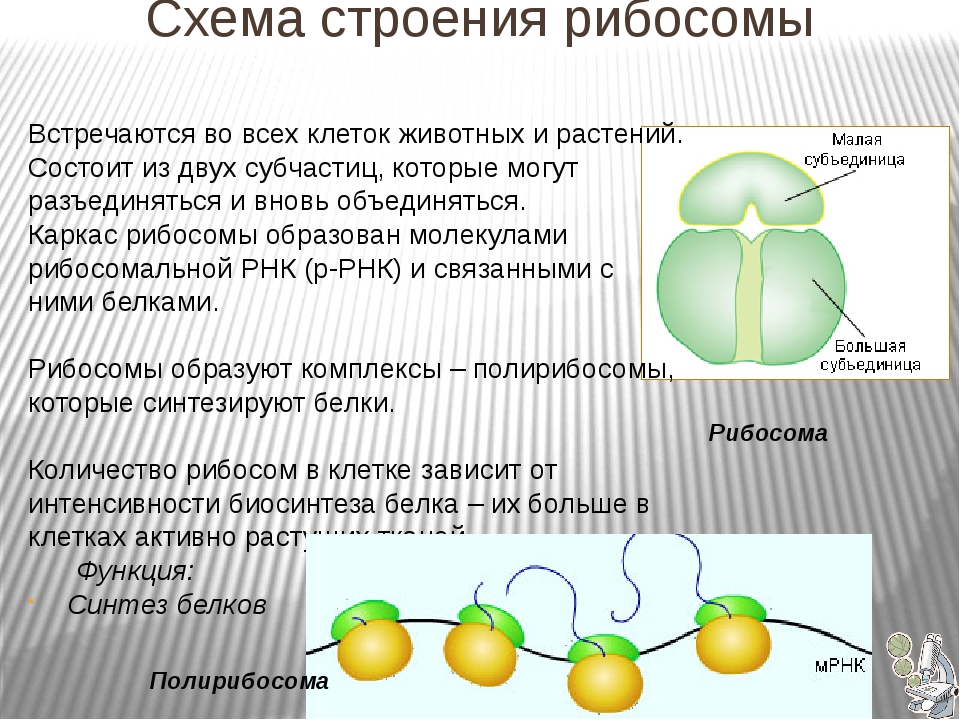
ДНК в ядре клетки несет генетический код, состоящий из последовательностей аденина (А), тимина (Т), гуанина (Г) и цитозина (С) (рис. 1). РНК, которая содержит урацил (U) вместо тимина, переносит код к участкам синтеза белка в клетке.Чтобы создать РНК, ДНК соединяет свои основания с основаниями «свободных» нуклеотидов (рис. 2). Затем информационная РНК (мРНК) перемещается к рибосомам в цитоплазме клетки, где происходит синтез белка (рис. 3). Триплеты оснований транспортной РНК (тРНК) спариваются с триплетами мРНК и в то же время откладывают свои аминокислоты на растущей белковой цепи. Наконец, синтезированный белок высвобождается для выполнения своей задачи в клетке или в другом месте тела.
Британская энциклопедия, Inc.Британская викторина
Части клеточной викторины
Какой тонкий слой образует внешнюю границу клетки? Где находится место фотосинтеза в растительной клетке? Проверьте свои знания.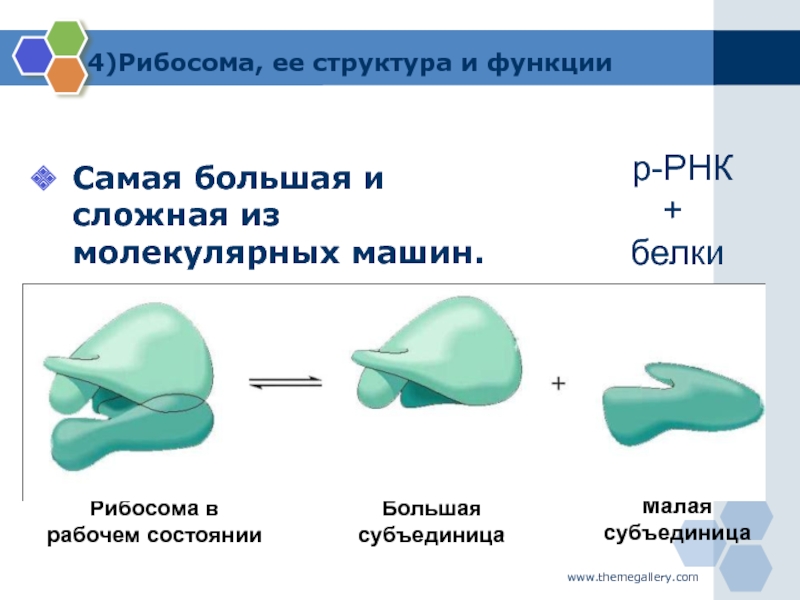 Пройдите этот тест.
Пройдите этот тест.
Рибосомы состоят из рибосомных белков и рибосомной РНК (рРНК). У прокариот рибосомы примерно на 40 процентов состоят из белка и на 60 процентов из рРНК. У эукариот рибосомы состоят примерно наполовину из белка и наполовину из рРНК. Рибосомы обычно состоят из трех или четырех молекул рРНК и примерно от 40 до 80 различных рибосомных белков.
Каждая рибосома состоит из двух субъединиц, большей и меньшей, каждая из которых имеет характерную форму.Субъединицы обычно обозначаются с точки зрения их скорости седиментации, которая измеряется в единицах Сведберга (S) в центробежном поле. Малая и большая субъединицы эукариот обозначаются 40S и 60S соответственно, тогда как прокариоты содержат малую субъединицу 30S и большую субъединицу 50S.
Рибосомы представляют собой участки, в которых информация, содержащаяся в генетическом коде, преобразуется в белковые молекулы. Молекулы рибосом матричной РНК (мРНК) определяют порядок следования молекул транспортной РНК (тРНК), которые связываются с триплетами нуклеотидов (кодонами). Порядок молекул тРНК в конечном итоге определяет последовательность аминокислот в белке. Молекулы рРНК катализируют пептидилтрансферазную реакцию, которая образует пептидные связи между аминокислотами, связывая их вместе с образованием белков. Новообразованные белки отделяются от участка рибосомы и мигрируют в другие части клетки для использования.
Порядок молекул тРНК в конечном итоге определяет последовательность аминокислот в белке. Молекулы рРНК катализируют пептидилтрансферазную реакцию, которая образует пептидные связи между аминокислотами, связывая их вместе с образованием белков. Новообразованные белки отделяются от участка рибосомы и мигрируют в другие части клетки для использования.
Рибосомы — обзор | ScienceDirect Topics
Инактивация рибосом.
Ингибирующие рибосомы белки (RIP) являются противовирусными веществами, поскольку они ингибируют синтез белка, блокируя заключительные фазы внутриклеточного развития вируса. RIP специфически инактивируют рибосомы, что приводит к блокированию синтеза белка в фазе элонгации. Первичная структура RIP, выделенных из разных источников, в высокой степени гомологична, что позволяет сделать вывод о том, что ингибирующая активность данных пептидов в определенной степени коррелирует с первичной структурой их активных центров, ответственных за связывание рибосом.
Первоначально предполагалось, что RIP неактивны в гомологичных рибосомах. Тем не менее, низкая рибосомная активность лаконоса ( Phytolacca americana ) в экспериментах по внеклеточной трансляции привела к открытию, что рибосомы лакоса на самом деле инактивируются RIP лакома (PAP-1) во время их высвобождения. Другие растительные рибосомы также блокируются действием собственного RIP в сходных условиях. Однако следует отметить, что рибосомы лаконоса еще достаточно устойчивы к добавлению собственных РИП (РАР-1) и гораздо более восприимчивы к действию РИП, выделенных из других растений.Однако тритин, RIP пшеницы, не инактивирует рибосомы пшеницы, поэтому изолированные рибосомы пшеницы сохраняют высокую активность.
Полученные к настоящему времени экспериментальные данные позволяют заключить, что РИП обладают специфической активностью по отношению к рибосомам, выделенным из разных видов растений. По-видимому, рибосомы обладают определенными структурными особенностями, которые могут распознаваться или не распознаваться различными РИП. Однако механизмы функционирования этих белков не так просты: имеются данные, что РАР-С (РИП из семян лакомства) ингибирует рост клеток моркови в жидкой культуре, тогда как та же концентрация РАР-1 стимулирует рост клеток риса.
Однако механизмы функционирования этих белков не так просты: имеются данные, что РАР-С (РИП из семян лакомства) ингибирует рост клеток моркови в жидкой культуре, тогда как та же концентрация РАР-1 стимулирует рост клеток риса.
Временной интервал противовирусной активности достаточно узок, поэтому противовирусную активность большинства РИП проверяют путем инокуляции растений смесью этих белков и вирусным препаратом или препаратом вирусной РНК. Обработка растений РИП через некоторое время после инокуляции не предотвратит развитие вирусной инфекции. Например, защитный эффект не может быть обнаружен, если применять РИП лакки (РАП-1) через 30–50 минут после инокуляции протопластов табака вирусом табачной мозаики (ВТМ).Следовательно, RIP активны только на очень ранних стадиях жизненного цикла вируса. Хорошо известно, что рибосомы хозяина могут связывать вирусную РНК практически сразу после того, как РНК-вирус потерял свою оболочку. Возможно, комплекс трансляции (вирусная РНК–рибосома) уже невосприимчив к действию РИП, и пока этот комплекс существует, РИП неактивны.
2.4D: Рибосомы — Биология LibreTexts
Рибосомы состоят из рибосомной РНК (рРНК) и белка. Прокариотические клетки имеют три типа рРНК: 16S рРНК, 23S рРНК и 5S рРНК.Подобно транспортным РНК (тРНК), рРНК используют внутрицепочечные Н-связи между комплементарными нуклеотидными основаниями для образования сложных складчатых структур. Рибосомы состоят из двух субъединиц с плотностью 50S и 30S («S» относится к единице плотности, называемой единицей Сведберга). Субъединица 30S содержит 16S рРНК и 21 белок; субъединица 50S содержит 5S и 23S рРНК и 31 белок. Две субъединицы объединяются во время синтеза белка, образуя полную рибосому 70S диаметром около 25 нм. Типичная бактерия может иметь до 15 000 рибосом.
Плотность рибосомных субъединиц
Рибосомы состоят из двух субъединиц, которые объединяются для трансляции информационной РНК (мРНК) в полипептиды и белки во время трансляции и обычно описываются с точки зрения их плотности. Плотность представляет собой массу молекулы или частицы, деленную на ее объем, и измеряется в единицах Сведберга (S), единице плотности, соответствующей относительной скорости осаждения при сверхвысокоскоростном центрифугировании.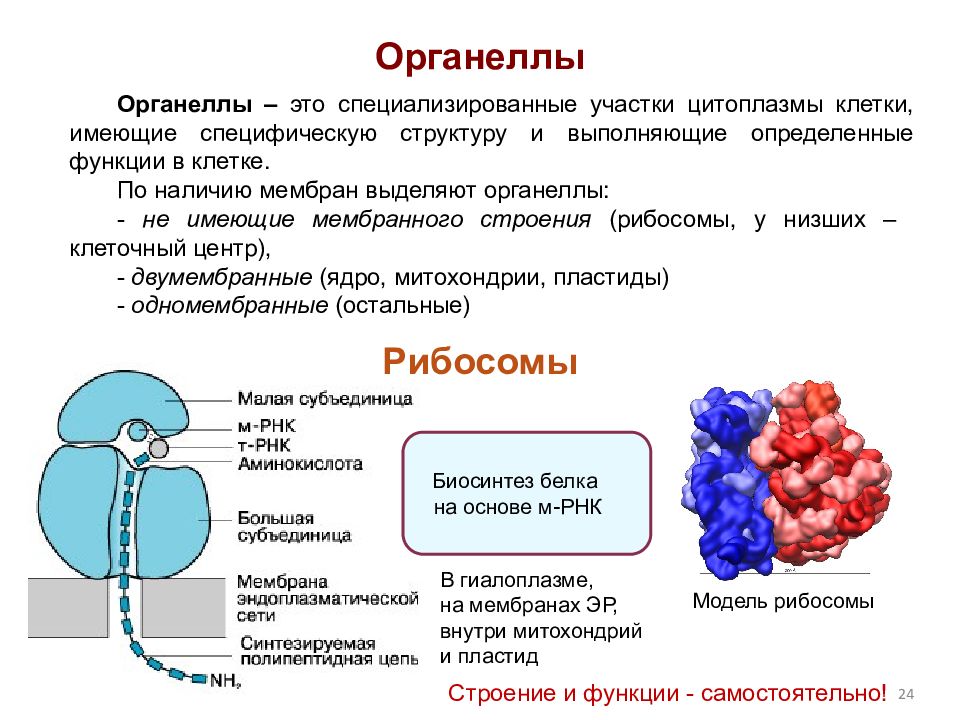 Чем больше значение S, тем плотнее частица.
Чем больше значение S, тем плотнее частица.
Рибосомные субъединицы состоят из рибосомной РНК (рРНК) и белков. Субъединицы рибосомы с разными значениями S состоят из разных молекул рРНК, а также из разных белков. Помните, что РНК представляет собой полимер рибонуклеотидов, содержащий азотистое основание аденин, урацил, гуанин или цитозин. Разные молекулы рРНК имеют разную длину и разный порядок расположения этих рибонуклеотидных оснований. Поскольку рРНК является одноцепочечной, многие нуклеотидные основания рРНК участвуют во внутрицепочечных водородных связях, что придает молекуле рРНК особую форму (см. рисунок \(\PageIndex{1}\)).Форма, в свою очередь, помогает определить его функцию — так же, как взаимодействия между аминокислотами в белке определяют форму и функцию этого белка (см. рисунок \(\PageIndex{2}\)).
Иллюстрация 16S рРНК в Escherichia coli
Анимация 16S рРНК
Иллюстрация фермента каталазы
Прокариотические рибосомы, например, состоят из двух субъединиц с плотностью 50S и 30S. Субъединица 30S содержит 16S рРНК длиной 1540 нуклеотидов и 21 белок; субъединица 50S содержит 5S рРНК длиной 120 нуклеотидов, 23S рРНК длиной 2900 нуклеотидов и 31 белок.Две субъединицы объединяются во время синтеза белка, образуя полную рибосому 70S.
Субъединица 30S содержит 16S рРНК длиной 1540 нуклеотидов и 21 белок; субъединица 50S содержит 5S рРНК длиной 120 нуклеотидов, 23S рРНК длиной 2900 нуклеотидов и 31 белок.Две субъединицы объединяются во время синтеза белка, образуя полную рибосому 70S.
Субъединицы рибосом эукариот имеют плотность 60S и 40S, потому что они содержат другие молекулы рРНК и белки, чем субъединицы прокариотических рибосом. У большинства эукариот субъединица 40S содержит 18S рРНК длиной 1900 нуклеотидов и примерно 33 белка; субъединица 60S содержит 5S рРНК длиной 120 нуклеотидов, 5,8S рРНК длиной 160 нуклеотидов, 28S рРНК длиной 4700 нуклеотидов и примерно 49 белков.Две субъединицы объединяются во время синтеза белка, образуя полную рибосому 80S диаметром около 25 нм.
Из-за этой разницы в специфических рРНК и белках, образующихся в результате «формы», существуют лекарства, которые могут связываться либо с 30S, либо с 50S рибосомной субъединицей прокариотической рибосомы и впоследствии блокировать ее функцию, но не могут связываться с эквивалентными 40S или 60S рибосомами. субъединица эукариотической рибосомы.
субъединица эукариотической рибосомы.
ВведениеРибосома представляет собой комплекс, состоящий из РНК и белка, который в сумме имеет размер в несколько миллионов дальтон и играет решающую роль в процессе расшифровки генетической информации, хранящейся в геноме, в белок, как описано в так называемой Центральной догме. молекулярной биологии.В частности, рибосома осуществляет процесс трансляции, расшифровывая генетическую информацию, закодированную в матричной РНК, по одной аминокислоте за раз, во вновь синтезированные полипептидные цепи. Лауреаты Нобелевской премии и другие участники Венкатраман Рамакришнан из M.R.C. Лаборатория молекулярной биологии в Кембридже, Англия; Томас А. Стейц из Йельского университета; и Ада Э. Йонат из Научного института Вейцмана в Реховоте, Израиль, были удостоены Нобелевской премии по химии 2009 года [1] за их знаменательную работу, раскрывающую атомные детали молекулярной машины, которая производит белки во всех клетках, рибосома. Перед Нобелевским комитетом стоит непростая задача ограничиться тремя лауреатами каждой премии.Несколько других давних получателей грантов NIGMS, которые также внесли большой вклад в наше понимание структуры и функции рибосомы, включают Питера Мура, Гарри Ноллера и Иоахима Франка. Американское общество биохимии и молекулярной биологии опубликовало объявление о присуждении премии, отражающее это мнение. Влияние структуры рибосом Рибосома входит в число известных структур с наибольшим воздействием. Представьте себе удивление и трепет от внезапного осознания того, как десятки белков, больших и малых РНК объединяются в элегантные машины, которые служат белковыми фабриками в каждой клетке и органелле каждого организма на планете. Компоненты рибосом Малая субъединица прокариотической рибосомы откладывается на 30S [4] . Он состоит из цепи РНК 16S длиной около 1500 оснований (~ 500 кДа) плюс около 20 белковых цепей. Белки в первой определенной малой субъединице находятся в диапазоне примерно от 3 кДа до 29 кДа. Большая субъединица прокариотической рибосомы откладывается на 50S. Митохиндриальная рибосома или миторибосома меньше цитоплазматической рибосомы с малой субъединицей, которая оседает на 28S, и большой субъединицей, которая осаждается на 39S. Вся миторибосома оседает при 55°С. Другие макромолекулы в функционирующей рибосоме включают три молекулы транспортной РНК, информационную РНК и зарождающуюся белковую цепь. Таким образом, полностью функционирующая прокариотическая рибосома содержит 7 цепей РНК (включая три тРНК и одну мРНК), 47 рибосомных белковых цепей и одну зарождающуюся белковую цепь. Общая молекулярная масса составляет несколько миллионов дальтон. Цитоплазматические рибосомы эукариот крупнее и содержат больше РНК и белков. Пептидилтрансфераза представляет собой рибозимМалая субъединица рибосомы является основным местом декодирования, направляя взаимодействие кодона матричной РНК с антикодоновыми стеблями-петлями собственной транспортной РНК. Образование пептидных связей происходит в большой субъединице, к которой пристыкованы акцепторные стержни тРНК. Однако важно иметь в виду, что в активной рибосоме две субъединицы контактируют посредством мостиков, и действия одной субъединицы влияют на другую по мере того, как процесс трансляции проходит стадии инициации, элонгации и терминации. Первоначальное определение структур атомарного разрешения субъединиц неожиданно показало, что РНК, а не белок, вносит непосредственный вклад в формирование сайта как декодирования, так и катализа синтеза пептидной связи, при этом рибосомные белки действуют только в вспомогательной роли см. Первые рибосомные структуры с атомарным разрешением Конкретные структуры, за которые была присуждена Нобелевская премия, были опубликованы в 2000 году и впоследствии были усовершенствованы или улучшены.
Малая субъединица рибосомы Thermus thermophilus состоит из 16S-цепи РНК длиной около 1522 оснований (494 кДа) и 20 белковых цепей (S2-S20, THX).
Тематические страницы Proteopedia, посвященные рибосомам и субъединицамРибосомные трехмерные структурыРибосомные трехмерные структуры См. такжеСсылки
Дополнительная литература и ресурсы
|
Структура бактериальной рибосомы с разрешением 2 Å
Крио-ЭМ-карты с высоким разрешением в настоящее время находятся на пороге соответствия или превосходства по качеству карт, созданных с помощью рентгеновской кристаллографии, открывая дверь к более глубокому пониманию химии, управляющей структурно-функциональными отношениями, и раскрывая новые биологические явления. Вопросы о рибосомах, которые состоят из двух наиболее распространенных классов биологических макромолекул и необходимы для жизни, затрагивают самые разные вопросы.Структурная информация о компонентах рибосом может иметь значение, начиная от фундаментальной химии и заканчивая механизмами, лежащими в основе трансляции и эволюционных тенденций в различных областях жизни. Например, в наших крио-ЭМ-реконструкциях мы наблюдали неожиданный уровень детализации модификаций азотистых оснований и белков, которые нельзя было увидеть в предшествующих рентгеновских кристаллографических структурах. Самым неожиданным из них является наличие двух ранее неизвестных посттрансляционных модификаций в скелетах рибосомных белков, которые было бы трудно подтвердить без узконаправленных аналитических химических подходов.Точная информация о связывании антибиотиков, контактах белок-РНК и сольватации являются дополнительными примерами того, что может быть запрошено в этом разрешении. Помимо чисто структурного понимания, эти результаты порождают новые вопросы о синтезе белка, сборке рибосом, а также о механизмах действия антибиотиков и резистентности, обеспечивая основу для будущих экспериментов.
Например, в наших крио-ЭМ-реконструкциях мы наблюдали неожиданный уровень детализации модификаций азотистых оснований и белков, которые нельзя было увидеть в предшествующих рентгеновских кристаллографических структурах. Самым неожиданным из них является наличие двух ранее неизвестных посттрансляционных модификаций в скелетах рибосомных белков, которые было бы трудно подтвердить без узконаправленных аналитических химических подходов.Точная информация о связывании антибиотиков, контактах белок-РНК и сольватации являются дополнительными примерами того, что может быть запрошено в этом разрешении. Помимо чисто структурного понимания, эти результаты порождают новые вопросы о синтезе белка, сборке рибосом, а также о механизмах действия антибиотиков и резистентности, обеспечивая основу для будущих экспериментов.
Замечательная находка тиоамидной модификации в белке uL16, только второй такой пример в белке (Mahanta et al., 2019), является прекрасным примером возможностей работы с разрешением <2 Å.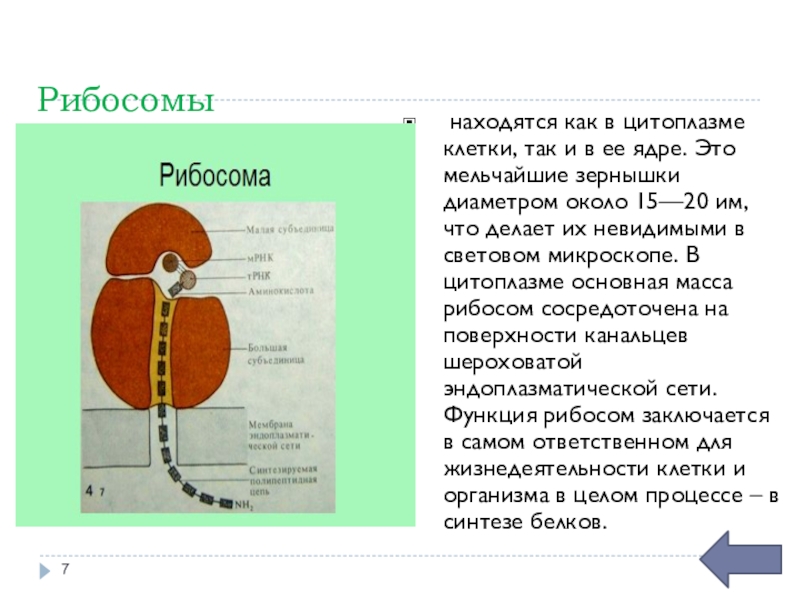 Разница в длине связи тиокарбонила по сравнению с типичным карбонилом пептида составляет ~ 0,4 Å при неизменной в остальном геометрии и слишком тонка, чтобы ее можно было идентифицировать при более низком разрешении (рис. 8 — дополнение к рисунку 1). Кроме того, плотность серы не так выражена на картах с более низким разрешением. Анализ ранее опубликованных данных масс-спектрометрии с достаточной точностью массы, чтобы отличить модификации O в S от более распространенного события окисления +O (Dai et al., 2017; Рисунок 8) подтверждает вывод. Возможную роль тиопептидной связи в рибосоме E. coli , которая расположена вблизи ПТЦ и включает контакт между тиокарбонильным атомом серы и гидроксильной группой в β-гидроксиаргинине в положении 81 в uL16, еще предстоит показать. Механизм, посредством которого катализируется его образование, также остается открытым вопросом. Одним из ферментов-кандидатов для этой цели является белок YcaO E. coli , фермент, который, как известно, осуществляет тиоамидирование и другие превращения амидов (Burkhart et al.
Разница в длине связи тиокарбонила по сравнению с типичным карбонилом пептида составляет ~ 0,4 Å при неизменной в остальном геометрии и слишком тонка, чтобы ее можно было идентифицировать при более низком разрешении (рис. 8 — дополнение к рисунку 1). Кроме того, плотность серы не так выражена на картах с более низким разрешением. Анализ ранее опубликованных данных масс-спектрометрии с достаточной точностью массы, чтобы отличить модификации O в S от более распространенного события окисления +O (Dai et al., 2017; Рисунок 8) подтверждает вывод. Возможную роль тиопептидной связи в рибосоме E. coli , которая расположена вблизи ПТЦ и включает контакт между тиокарбонильным атомом серы и гидроксильной группой в β-гидроксиаргинине в положении 81 в uL16, еще предстоит показать. Механизм, посредством которого катализируется его образование, также остается открытым вопросом. Одним из ферментов-кандидатов для этой цели является белок YcaO E. coli , фермент, который, как известно, осуществляет тиоамидирование и другие превращения амидов (Burkhart et al. , 2017). Хотя этот фермент был отмечен как возможно участвующий с RimO в модификации uS12 Asp89 (Strader et al., 2011), генетические доказательства специфической функции YcaO отсутствуют. Например, E. coli , лишенные YcaO, чувствительны к холоду и имеют фенотипы, наиболее сходные по характеру с теми, которые наблюдаются при нокауте UspG, универсального стрессового белка 12 (Nichols et al., 2011). Кроме того, нокаут YcaO имеет фенотипы, не коррелирующие с фенотипами нокаута YcfD, β-гидроксилазы для Arg81 в uL16 рядом с тиоамидом (Nichols et al., 2011). YcaO -подобные гены в геномах Gammaproteobacteria совместно локализуются с опероном focA-pfl , общим набором генов, участвующих в анаэробном метаболизме и метаболизме формиата (рис. 8 — приложение к рисунку 1; Sawers and Suppmann, 1992). Поскольку используемые здесь рибосомы были получены из аэробно выращенных культур и оперон focA-Pfl транскрибируется независимо от гена YcaO в E. coli (Sawers, 2005), вполне вероятно, что ген YcaO и оперон YcaO Оперон focA-Pfl кодирует белки с несвязанными функциями.
, 2017). Хотя этот фермент был отмечен как возможно участвующий с RimO в модификации uS12 Asp89 (Strader et al., 2011), генетические доказательства специфической функции YcaO отсутствуют. Например, E. coli , лишенные YcaO, чувствительны к холоду и имеют фенотипы, наиболее сходные по характеру с теми, которые наблюдаются при нокауте UspG, универсального стрессового белка 12 (Nichols et al., 2011). Кроме того, нокаут YcaO имеет фенотипы, не коррелирующие с фенотипами нокаута YcfD, β-гидроксилазы для Arg81 в uL16 рядом с тиоамидом (Nichols et al., 2011). YcaO -подобные гены в геномах Gammaproteobacteria совместно локализуются с опероном focA-pfl , общим набором генов, участвующих в анаэробном метаболизме и метаболизме формиата (рис. 8 — приложение к рисунку 1; Sawers and Suppmann, 1992). Поскольку используемые здесь рибосомы были получены из аэробно выращенных культур и оперон focA-Pfl транскрибируется независимо от гена YcaO в E. coli (Sawers, 2005), вполне вероятно, что ген YcaO и оперон YcaO Оперон focA-Pfl кодирует белки с несвязанными функциями. Интересно, что четкое филогенетическое разделение между геном YcaO у Gammaproteobacteria и генами YcaO , которые, как известно, участвуют во вторичном метаболизме на филогенетическом дереве, предполагает, что, если YcaO отвечает за тиоамидирование uL16, эта модификация может сохраняться только у Gammaproteobacteria. .
Интересно, что четкое филогенетическое разделение между геном YcaO у Gammaproteobacteria и генами YcaO , которые, как известно, участвуют во вторичном метаболизме на филогенетическом дереве, предполагает, что, если YcaO отвечает за тиоамидирование uL16, эта модификация может сохраняться только у Gammaproteobacteria. .
Карты 30S-субъединицы, разрешенные до несколько более низкого разрешения ~ 2,0–2,1 Å (рис. 1 — дополнение к рисунку 3, табл. 2), позволили идентифицировать единственную известную изопептидную связь в рибосомном белке, изоАсп в положении 119 в США11.В то время как было высказано предположение, что остатки изоаспартила в основном являются формой повреждения белка, требующего репарации, предыдущая работа идентифицировала существование изоАсп в uS11 на уровне, близком к стехиометрическому, предполагая, что он может быть функционально важным (David et al., 1999). Известно, что определенные горячие точки в белковых последовательностях особенно склонны к образованию изоаспартата (Reissner and Aswad, 2003), включая Asn-Gly, который кодируется почти во всех бактериальных последовательностях uS11 (рис. 4С). Однако период полураспада перегруппировки исчисляется днями (Robinson and Robinson, 2001; Stephenson and Clarke, 1989).У архей и эукариот образование изоаспартата в этом положении потребует дегидратации кодируемого аспартата, что происходит даже медленнее, чем дезамидирование аспарагина (Stephenson and Clarke, 1989). Важно отметить, что остаток после аспартата почти всегда представляет собой серин у эукариот и обогащен глицином, серином и треонином у архей (рис. 4C, рис. 4 — дополнение к рисунку 1), что согласуется с более высокой скоростью обезвоживания, которая возникает при использовании аспартата. глицином и серином в пептидных моделях (Stephenson and Clarke, 1989).Эти результаты указывают на то, что модификация isoAsp может почти повсеместно сохраняться во всех сферах жизни. В соответствии с этой гипотезой моделирование isoAsp обеспечивает лучшее соответствие крио-ЭМ-картам uS11 в рибосомах архей и эукариот (рис. 4 — дополнение к рисунку 2). Хотя возможно, что образование изоаспартата может быть ускорено в специфических структурных контекстах (Reissner and Aswad, 2003), неясно, происходит ли модификация isoAsp в uS11 спонтанно или требуется фермент для катализа реакции.
4С). Однако период полураспада перегруппировки исчисляется днями (Robinson and Robinson, 2001; Stephenson and Clarke, 1989).У архей и эукариот образование изоаспартата в этом положении потребует дегидратации кодируемого аспартата, что происходит даже медленнее, чем дезамидирование аспарагина (Stephenson and Clarke, 1989). Важно отметить, что остаток после аспартата почти всегда представляет собой серин у эукариот и обогащен глицином, серином и треонином у архей (рис. 4C, рис. 4 — дополнение к рисунку 1), что согласуется с более высокой скоростью обезвоживания, которая возникает при использовании аспартата. глицином и серином в пептидных моделях (Stephenson and Clarke, 1989).Эти результаты указывают на то, что модификация isoAsp может почти повсеместно сохраняться во всех сферах жизни. В соответствии с этой гипотезой моделирование isoAsp обеспечивает лучшее соответствие крио-ЭМ-картам uS11 в рибосомах архей и эукариот (рис. 4 — дополнение к рисунку 2). Хотя возможно, что образование изоаспартата может быть ускорено в специфических структурных контекстах (Reissner and Aswad, 2003), неясно, происходит ли модификация isoAsp в uS11 спонтанно или требуется фермент для катализа реакции. Были идентифицированы ферменты O -метилтрансферазы, которые встраивают β-пептид в лантипептид (Acedo et al., 2019) или выполняют функцию контроля качества для удаления спонтанно образующихся изоаспартатов (David et al., 1999). Деамидазы, которые катализируют образование isoAsp из аспарагина, недостаточно подробно описаны в литературе, хотя примеры были идентифицированы у вирусных патогенов, возможно, перепрофилируя глутаминамидотрансферазы хозяина (Zhao et al., 2016). Будущая работа будет необходима для определения механизмов, с помощью которых isoAsp в uS11 генерируется в клетках.Его биологическое значение, будь то сборка малой рибосомной субъединицы или другие этапы трансляции, также еще предстоит определить.
Были идентифицированы ферменты O -метилтрансферазы, которые встраивают β-пептид в лантипептид (Acedo et al., 2019) или выполняют функцию контроля качества для удаления спонтанно образующихся изоаспартатов (David et al., 1999). Деамидазы, которые катализируют образование isoAsp из аспарагина, недостаточно подробно описаны в литературе, хотя примеры были идентифицированы у вирусных патогенов, возможно, перепрофилируя глутаминамидотрансферазы хозяина (Zhao et al., 2016). Будущая работа будет необходима для определения механизмов, с помощью которых isoAsp в uS11 генерируется в клетках.Его биологическое значение, будь то сборка малой рибосомной субъединицы или другие этапы трансляции, также еще предстоит определить.
Достигнутое здесь разрешение также имеет большой потенциал для лучшего информирования взаимосвязей структура-активность в будущих исследованиях антибиотиков, особенно потому, что рибосомы так часто являются мишенями. Например, нам удалось идентифицировать гипомодифицированные основания в 16S рРНК (m 7 G527 и m 6 2 A1519) и возможную гипомодификацию Asp89 (β-метилтио-Asp) в uS12 (рис.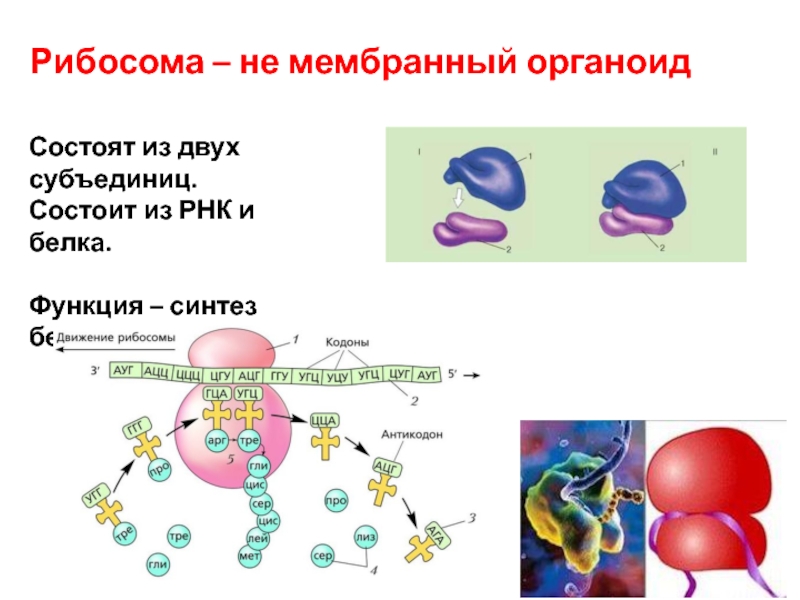 1 — приложение к рисунку 5). , рис. 1—дополнение к рисунку 6).Эти гипомодификации могут в некоторых случаях придавать резистентность к антибиотикам казугамицину и стрептомицину. Кроме того, мы также смогли более четко увидеть преобладающее положение кольца IV паромомицина в сайте декодирования субъединицы 30S (рис. 5). Предполагаемая основная роль кольца IV заключалась в увеличении положительного заряда лекарственного средства для обеспечения связывания (Hobbie et al., 2006) в соответствии с его неоднозначным моделированием в предыдущих структурах (Kurata et al., 2008; Selmer et al. , 2006; Висенс и Вестхоф, 2001).Хотя особенности кольца IV на текущей карте слабее по сравнению с кольцами I-III, мы смогли идентифицировать взаимодействия кольца IV с окружающими нуклеотидами 16S рРНК и упорядоченными молекулами растворителя, которые ранее не моделировались. Важно отметить, что наблюдаемые взаимодействия между аминогруппой N6’’’ и фосфатным остовом нуклеотидов G1489-U1490, в частности, вероятно, ответственны за известную восприимчивость PAR к модификации N6’’’ (Sati et al.
1 — приложение к рисунку 5). , рис. 1—дополнение к рисунку 6).Эти гипомодификации могут в некоторых случаях придавать резистентность к антибиотикам казугамицину и стрептомицину. Кроме того, мы также смогли более четко увидеть преобладающее положение кольца IV паромомицина в сайте декодирования субъединицы 30S (рис. 5). Предполагаемая основная роль кольца IV заключалась в увеличении положительного заряда лекарственного средства для обеспечения связывания (Hobbie et al., 2006) в соответствии с его неоднозначным моделированием в предыдущих структурах (Kurata et al., 2008; Selmer et al. , 2006; Висенс и Вестхоф, 2001).Хотя особенности кольца IV на текущей карте слабее по сравнению с кольцами I-III, мы смогли идентифицировать взаимодействия кольца IV с окружающими нуклеотидами 16S рРНК и упорядоченными молекулами растворителя, которые ранее не моделировались. Важно отметить, что наблюдаемые взаимодействия между аминогруппой N6’’’ и фосфатным остовом нуклеотидов G1489-U1490, в частности, вероятно, ответственны за известную восприимчивость PAR к модификации N6’’’ (Sati et al.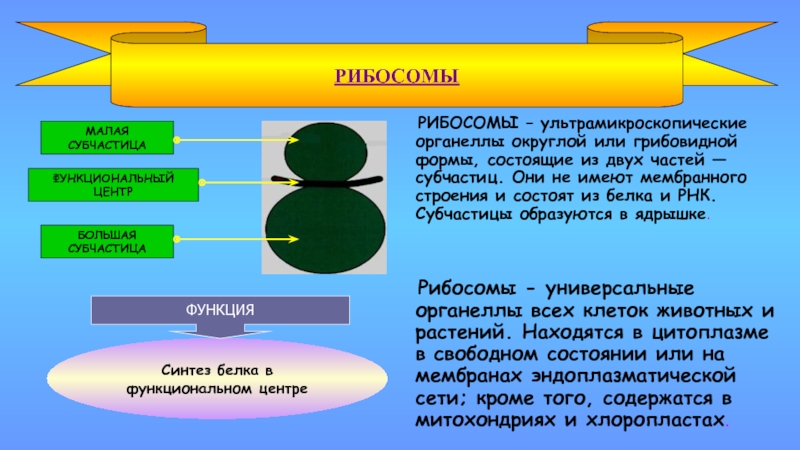 , 2017). В то время как такая же потеря взаимодействий ожидается для неомицина, который отличается от паромомицина только наличием 6′-гидрокси, а не 6′-амина в кольце I, штраф за модификацию N6»’ в неомицине, вероятно, компенсируется дополнительным положительным зарядом и более сильными водородными связями, наблюдаемыми в кольце I неомицина (Sati et al., 2017). Таким образом, уровень детализации способов связывания аминогликозидов, который теперь можно получить с помощью крио-ЭМ, должен способствовать использованию химической биологии для продвижения разработки АГА.
, 2017). В то время как такая же потеря взаимодействий ожидается для неомицина, который отличается от паромомицина только наличием 6′-гидрокси, а не 6′-амина в кольце I, штраф за модификацию N6»’ в неомицине, вероятно, компенсируется дополнительным положительным зарядом и более сильными водородными связями, наблюдаемыми в кольце I неомицина (Sati et al., 2017). Таким образом, уровень детализации способов связывания аминогликозидов, который теперь можно получить с помощью крио-ЭМ, должен способствовать использованию химической биологии для продвижения разработки АГА.
Крио-ЭМ-карты субъединицы 30S также выявили новую структурную информацию о белке bS21 с более низким разрешением, особенно на его С-конце. Расположение bS21 рядом с сайтом связывания рибосом предполагает, что он может играть роль в инициации трансляции. Консервация мотива RLY (или KLY) и его контактов с головным доменом 30S субъединицы также указывает на то, что bS21 может играть роль в модуляции конформационной динамики головного домена относительно тела и платформы 30S субъединицы. Перестройки головного домена 30S субъединицы наблюдаются на каждой стадии цикла трансляции (Javed and Orlova, 2019). Хотя мы смогли сопоставить предполагаемые гомологи S21 из огромных фагов (Al-Shayeb et al., 2020) со специфическими бактериальными кладами и показать, что многие из них также обладают KLY-подобными мотивами, не было четких взаимосвязей между предсказанными консенсусными сайтами связывания рибосом в этих бактерии и эти фаги. Возможно, что bS21 и гомологи фага взаимодействуют с соседними последовательностями мРНК 5′ спирали Шайна-Дальгарно, влияя таким образом на инициацию трансляции.В совокупности структурная и филогенетическая информация о bS21 и гомологах фага S21 поднимает новые вопросы об их роли в трансляции и жизненном цикле фага, то есть способствуют ли они специализированной трансляции и/или помогают фагу уклоняться от бактериальной защиты.
Перестройки головного домена 30S субъединицы наблюдаются на каждой стадии цикла трансляции (Javed and Orlova, 2019). Хотя мы смогли сопоставить предполагаемые гомологи S21 из огромных фагов (Al-Shayeb et al., 2020) со специфическими бактериальными кладами и показать, что многие из них также обладают KLY-подобными мотивами, не было четких взаимосвязей между предсказанными консенсусными сайтами связывания рибосом в этих бактерии и эти фаги. Возможно, что bS21 и гомологи фага взаимодействуют с соседними последовательностями мРНК 5′ спирали Шайна-Дальгарно, влияя таким образом на инициацию трансляции.В совокупности структурная и филогенетическая информация о bS21 и гомологах фага S21 поднимает новые вопросы об их роли в трансляции и жизненном цикле фага, то есть способствуют ли они специализированной трансляции и/или помогают фагу уклоняться от бактериальной защиты.
Ротамерная природа скелетов нуклеиновых кислот исторически была проблемой для моделирования конформации сахар-фосфат, в отличие от обычно хорошо упорядоченных оснований (Murray et al.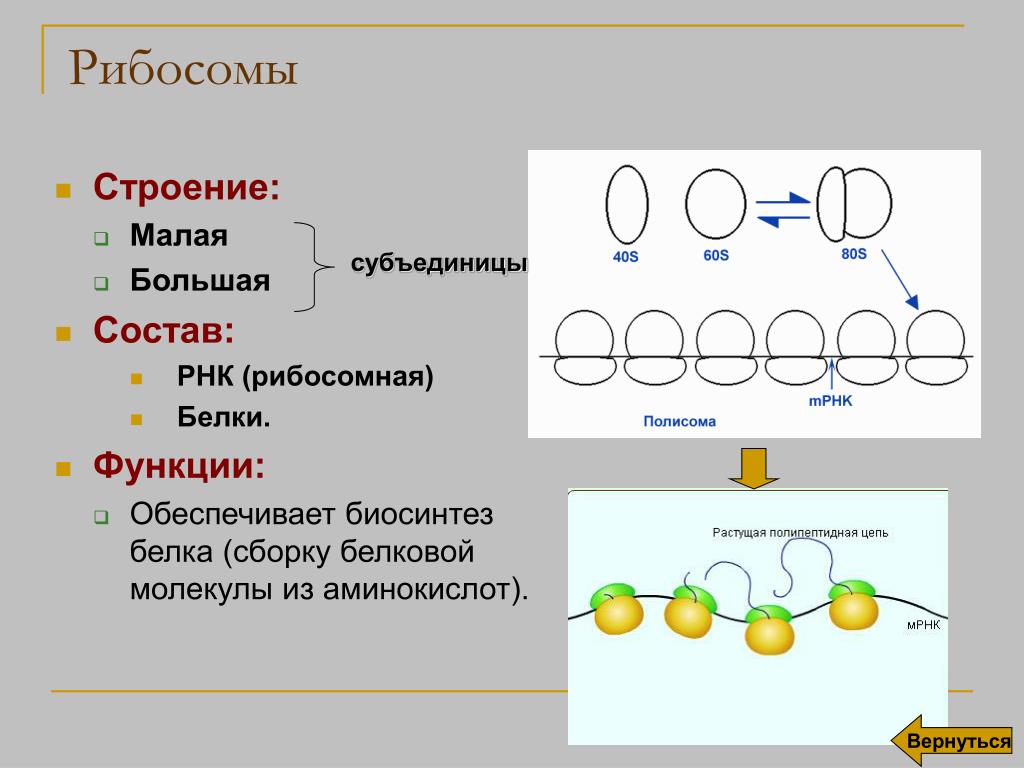 , 2003). Складки рибозы, например, непосредственно визуализируются только при разрешении выше ~2 Å, но существенно влияют на оставшиеся диэдры остова (Richardson et al., 2018). Была проделана большая работа, чтобы упростить многомерную проблему моделирования конформеров РНК, учитывая дефицит структур РНК высокого разрешения (RNA Ontology Consortium et al., 2008). В то время как некоторые области настоящей структуры очень четко демонстрируют детали скелета (рис. 1C), некоторый уровень беспорядка наблюдается в конформациях многих других остатков (рис. 1 — дополнение к рисунку 7). Наше первоначальное впечатление было, что это может быть связано с радиационным повреждением. Однако реконструкции с первых 2-3 кадров экспозиции обнаруживают такие же, а иногда и новые изломы плотности ЭМ.Предыдущая работа показала, что при этой дозе должны лучше сохраняться аминокислотные остатки, хорошо известные как высокочувствительные к радиационному повреждению (Hattne et al., 2018). Кроме того, известно, что нуклеиновые кислоты имеют тенденцию быть более устойчивыми к повреждению рентгеновскими лучами по сравнению с наиболее чувствительными к лучу фрагментами в белках (Bury et al.
, 2003). Складки рибозы, например, непосредственно визуализируются только при разрешении выше ~2 Å, но существенно влияют на оставшиеся диэдры остова (Richardson et al., 2018). Была проделана большая работа, чтобы упростить многомерную проблему моделирования конформеров РНК, учитывая дефицит структур РНК высокого разрешения (RNA Ontology Consortium et al., 2008). В то время как некоторые области настоящей структуры очень четко демонстрируют детали скелета (рис. 1C), некоторый уровень беспорядка наблюдается в конформациях многих других остатков (рис. 1 — дополнение к рисунку 7). Наше первоначальное впечатление было, что это может быть связано с радиационным повреждением. Однако реконструкции с первых 2-3 кадров экспозиции обнаруживают такие же, а иногда и новые изломы плотности ЭМ.Предыдущая работа показала, что при этой дозе должны лучше сохраняться аминокислотные остатки, хорошо известные как высокочувствительные к радиационному повреждению (Hattne et al., 2018). Кроме того, известно, что нуклеиновые кислоты имеют тенденцию быть более устойчивыми к повреждению рентгеновскими лучами по сравнению с наиболее чувствительными к лучу фрагментами в белках (Bury et al. , 2016). Поскольку те же самые общие тенденции в специфическом радиационном повреждении, по-видимому, сохраняются для крио-ЭМ (Hattne et al., 2018), и отмечая, что глобальное разрешение реконструкций с низкой дозой 70S остается разрешенным до ~ 2.1–2,2 Å, сохранение нарушенной плотности при низких дозах, скорее всего, является результатом структурного нарушения в позвоночнике. Наше наблюдение о том, что более слабая связанность в остове РНК, по-видимому, более характерна для областей, не имеющих тесных контактов с другими областями структуры, согласуется с этим выводом, в то время как меньшинство случаев, когда только одинарная связь в рибозе, по-видимому, разорвана, является более вероятным. загадка. Более тщательное изучение этих особенностей может дать больше количественной информации о предпочтениях ротамеров нуклеотидов.
, 2016). Поскольку те же самые общие тенденции в специфическом радиационном повреждении, по-видимому, сохраняются для крио-ЭМ (Hattne et al., 2018), и отмечая, что глобальное разрешение реконструкций с низкой дозой 70S остается разрешенным до ~ 2.1–2,2 Å, сохранение нарушенной плотности при низких дозах, скорее всего, является результатом структурного нарушения в позвоночнике. Наше наблюдение о том, что более слабая связанность в остове РНК, по-видимому, более характерна для областей, не имеющих тесных контактов с другими областями структуры, согласуется с этим выводом, в то время как меньшинство случаев, когда только одинарная связь в рибозе, по-видимому, разорвана, является более вероятным. загадка. Более тщательное изучение этих особенностей может дать больше количественной информации о предпочтениях ротамеров нуклеотидов.
Что касается разрешения, в этой работе мы дополнили отчеты FSC «золотого стандарта» кривыми FSC «карта-модель» для наших карт и для сравнения с предыдущей работой.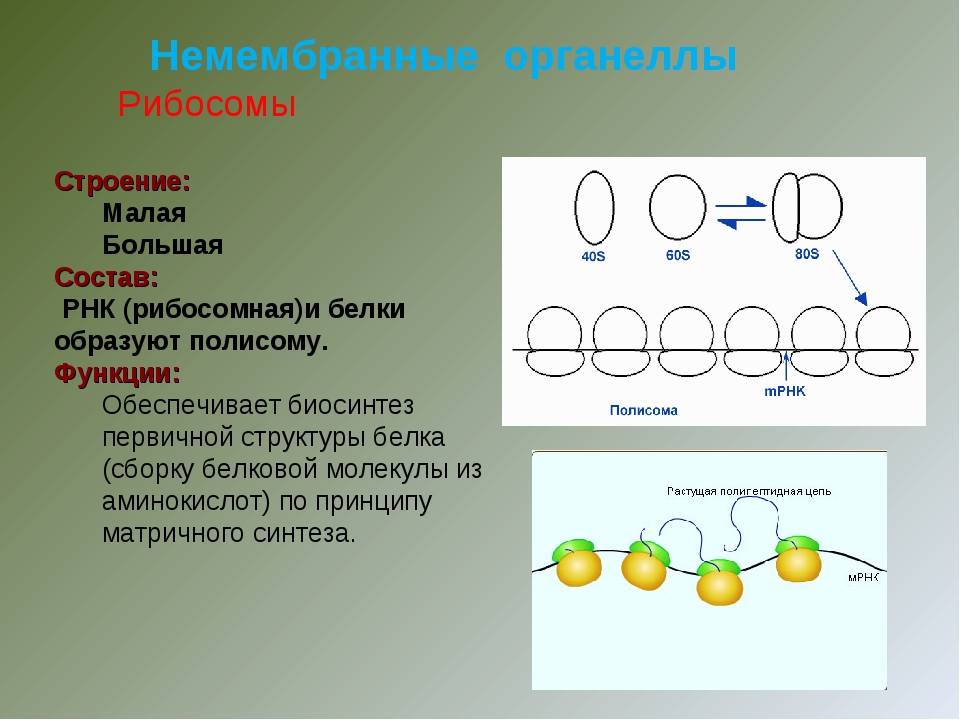 Хотя метрика FSC «от карты к модели» была описана в течение некоторого времени, она обычно не используется в области рибосом (Halfon et al., 2019; Loveland et al., 2020; Nürenberg-Goloub et al., 2020; Pichkur). и др., 2020; Стойкович и др., 2020; Тесина и др., 2020). Признавая, что ничто не заменит визуальный осмотр карты для определения ее качества, необходимо также рассмотреть, какие метрики полезны в масштабе вопросов, на которые нужно ответить.Суб-ангстремные различия в разрешении, о которых сообщают FSC с половинной картой, имеют существенное влияние на химические взаимодействия в номинальном выражении, но могут оказаться бесполезными, если корреляция карты с окончательной атомной моделью не соответствует аналогичному разрешению. Например, карты из недавних крио-ЭМ-реконструкций бактериальной рибосомной субъединицы 50S сообщают о разрешении ~ 2,1–2,3 Å, но депонированные модели достигают глобального разрешения ~ 2,3–2,5 Å по критерию FSC «карта-модель» (Halfon и др., 2019; Пичкур и др.
Хотя метрика FSC «от карты к модели» была описана в течение некоторого времени, она обычно не используется в области рибосом (Halfon et al., 2019; Loveland et al., 2020; Nürenberg-Goloub et al., 2020; Pichkur). и др., 2020; Стойкович и др., 2020; Тесина и др., 2020). Признавая, что ничто не заменит визуальный осмотр карты для определения ее качества, необходимо также рассмотреть, какие метрики полезны в масштабе вопросов, на которые нужно ответить.Суб-ангстремные различия в разрешении, о которых сообщают FSC с половинной картой, имеют существенное влияние на химические взаимодействия в номинальном выражении, но могут оказаться бесполезными, если корреляция карты с окончательной атомной моделью не соответствует аналогичному разрешению. Например, карты из недавних крио-ЭМ-реконструкций бактериальной рибосомной субъединицы 50S сообщают о разрешении ~ 2,1–2,3 Å, но депонированные модели достигают глобального разрешения ~ 2,3–2,5 Å по критерию FSC «карта-модель» (Halfon и др., 2019; Пичкур и др. ., 2020; Стойкович и др., 2020 г.; см. Материалы и методы; Рисунок 7—дополнение к рисунку 1). Примечательно, что для карты 2,1 Å субъединицы E. coli 50S, основанной на значениях FSC половинной карты (Pichkur et al., 2020), сопоставление карты и модели FSC нашей модели субъединицы 50S с этой картой имеет более высокое разрешение (2,07 Å) по сравнению с депонированной моделью (2,29 Å, запись в PDB 6xz7; рис. 7 — дополнение к рисунку 1). Таким образом, хотя FSC с половинной картой сообщает нам кое-что о наилучшей модели, которую можно получить, FSC «от карты к модели» фиксирует новую информацию, которая заключается в том, как модель была создана и уточнена.Кроме того, в то время как расчеты FSC между картой и моделью несут внутреннее смещение из-за зависимости модели от карты, процедуры уточнения модели используют четко определенные химические свойства (т. е. длины связей, углы, двугранные углы и стерические ограничения), которые полностью независимы от карта и должна обеспечивать реалистичность.
., 2020; Стойкович и др., 2020 г.; см. Материалы и методы; Рисунок 7—дополнение к рисунку 1). Примечательно, что для карты 2,1 Å субъединицы E. coli 50S, основанной на значениях FSC половинной карты (Pichkur et al., 2020), сопоставление карты и модели FSC нашей модели субъединицы 50S с этой картой имеет более высокое разрешение (2,07 Å) по сравнению с депонированной моделью (2,29 Å, запись в PDB 6xz7; рис. 7 — дополнение к рисунку 1). Таким образом, хотя FSC с половинной картой сообщает нам кое-что о наилучшей модели, которую можно получить, FSC «от карты к модели» фиксирует новую информацию, которая заключается в том, как модель была создана и уточнена.Кроме того, в то время как расчеты FSC между картой и моделью несут внутреннее смещение из-за зависимости модели от карты, процедуры уточнения модели используют четко определенные химические свойства (т. е. длины связей, углы, двугранные углы и стерические ограничения), которые полностью независимы от карта и должна обеспечивать реалистичность.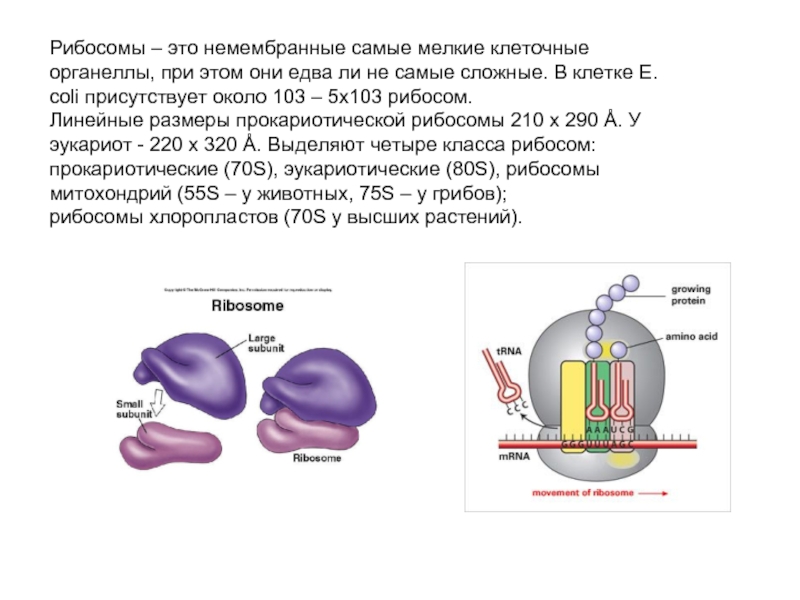 Возможно, это причина, по которой в недавних работах FSC «карта-модель» больше сосредоточена на методах и разработке инструментов (Nakane et al., 2020; Terwilliger et al., 2020a, Terwilliger et al., 2020b).
Возможно, это причина, по которой в недавних работах FSC «карта-модель» больше сосредоточена на методах и разработке инструментов (Nakane et al., 2020; Terwilliger et al., 2020a, Terwilliger et al., 2020b).
Помимо глобального высокого разрешения, конформационная гетерогенность рибосомы также привлекает внимание к инструментам, используемым для работы с комплексами с переменным разрешением. Широко распространены методы уточнения разнородных карт, в том числе уточнение нескольких тел (Nakane et al., 2018) и трехмерный анализ изменчивости (Punjani and Fleet, 2020), но способы работы и создания модели из множества карт одного и того же комплекс еще не стандартизирован и требует существенного ручного вмешательства.Например, мы построили и уточнили области рибосомы отдельно в карты с уточнением фокуса, используя уточнение в реальном пространстве в Chimera (Pettersen et al., 2004) и Coot (Casañal et al., 2020), чтобы «восстановить» точки разрыва между сегменты модели. Создание составных карт из нескольких уточнений также страдает от несовершенного сшивания между уточнениями отдельных доменов, и на нашей составной карте мы наблюдаем, что компоненты с самым высоким разрешением несколько ухудшаются в процессе.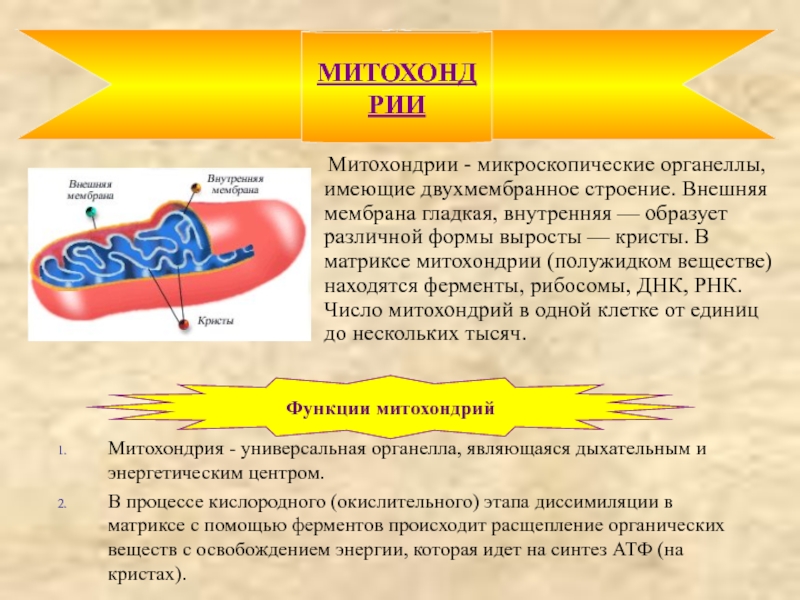 Также отметим, что B — фактор доработки в phenix.real_space_refinement все еще находится в стадии разработки, например, позволяет уточнять только сгруппированные B факторы для нуклеотидов и аминокислот. Уточнение B -factor в phenix.real_space_refine также приводит к нереалистичным значениям для частей модели, например, из-за связи с глобальным B фактором, примененным к карте, используемой при уточнении. Другие стратегии получения аналога фактора B , подходящего для крио-ЭМ, все еще находятся в разработке (Zhang et al., 2020).
Также отметим, что B — фактор доработки в phenix.real_space_refinement все еще находится в стадии разработки, например, позволяет уточнять только сгруппированные B факторы для нуклеотидов и аминокислот. Уточнение B -factor в phenix.real_space_refine также приводит к нереалистичным значениям для частей модели, например, из-за связи с глобальным B фактором, примененным к карте, используемой при уточнении. Другие стратегии получения аналога фактора B , подходящего для крио-ЭМ, все еще находятся в разработке (Zhang et al., 2020).
Кроме того, поскольку наиболее удобно разрабатывать инструменты с максимально возможным разрешением, для новых методов обычно используют карты апоферритина с очень высоким разрешением в качестве стандарта, который является высокосимметричным и хорошо упорядоченным. Образцы, которые не обладают этими характеристиками, могут потребовать новых инструментов, выходящих за рамки этих предположений. Инструменты моделирования для РНК также обычно отстают от инструментов для белков. Здесь мы смогли использовать карты и сильно сольватированную природу вторичной и третичной структуры РНК для решения параметризации моделирования растворителей в PHENIX (phenix.обливание) (Liebschner et al., 2019). Для настоящей карты 70S полукарта FSC ≥0,97 с разрешением до 3,3 Å, что, по оценкам, представляет собой теоретическую корреляцию с «идеальной» картой до 0,99 (Terwilliger et al., 2020a). Структурная информация с достоверностью вплоть до так называемого «почти атомарного» разрешения потенциально может быть использована для сравнительного анализа новых инструментов и может сделать наши результаты особенно ценными при решении проблем с целенаправленным или множественным уточнением. Эта структура также имеет потенциальное применение для помощи в будущей разработке инструментов моделирования РНК de novo, которые исторически менее развиты по сравнению с аналогичными инструментами для белков и часто полагаются на информацию, полученную из структур РНК с более низким разрешением (Watkins and Das, 2019).
Здесь мы смогли использовать карты и сильно сольватированную природу вторичной и третичной структуры РНК для решения параметризации моделирования растворителей в PHENIX (phenix.обливание) (Liebschner et al., 2019). Для настоящей карты 70S полукарта FSC ≥0,97 с разрешением до 3,3 Å, что, по оценкам, представляет собой теоретическую корреляцию с «идеальной» картой до 0,99 (Terwilliger et al., 2020a). Структурная информация с достоверностью вплоть до так называемого «почти атомарного» разрешения потенциально может быть использована для сравнительного анализа новых инструментов и может сделать наши результаты особенно ценными при решении проблем с целенаправленным или множественным уточнением. Эта структура также имеет потенциальное применение для помощи в будущей разработке инструментов моделирования РНК de novo, которые исторически менее развиты по сравнению с аналогичными инструментами для белков и часто полагаются на информацию, полученную из структур РНК с более низким разрешением (Watkins and Das, 2019).

 Их находки — славная поучительная кульминация многолетней работы [2] , впервые провозглашенной докладом Ады Йонат о кристаллах в 1980 [3] . Другие внесли значительный вклад в детальную структуру этой машины, как остроумно резюмировал Джереми Берг, нынешний директор Национального института общих медицинских наук, в своем заявлении.
Их находки — славная поучительная кульминация многолетней работы [2] , впервые провозглашенной докладом Ады Йонат о кристаллах в 1980 [3] . Другие внесли значительный вклад в детальную структуру этой машины, как остроумно резюмировал Джереми Берг, нынешний директор Национального института общих медицинских наук, в своем заявлении.
 Огромный размер рибосомы и каждой из двух отдельных рибосомных субъединиц, которые собираются вместе, чтобы сформировать полную рибосому, которая активна в трансляции, усложняет задачу определения структуры. Эти структуры были в то время, когда они были впервые определены, и остаются (в 2009 г.) крупнейшими асимметричными молекулами, решенными кристаллографически. В дополнение к тому, что мы получили огромное представление об общих молекулярных и атомных деталях синтеза белка в каждом организме на Земле, разработка новых антибиотиков, вероятно, будет опираться на эту новаторскую работу.
Огромный размер рибосомы и каждой из двух отдельных рибосомных субъединиц, которые собираются вместе, чтобы сформировать полную рибосому, которая активна в трансляции, усложняет задачу определения структуры. Эти структуры были в то время, когда они были впервые определены, и остаются (в 2009 г.) крупнейшими асимметричными молекулами, решенными кристаллографически. В дополнение к тому, что мы получили огромное представление об общих молекулярных и атомных деталях синтеза белка в каждом организме на Земле, разработка новых антибиотиков, вероятно, будет опираться на эту новаторскую работу.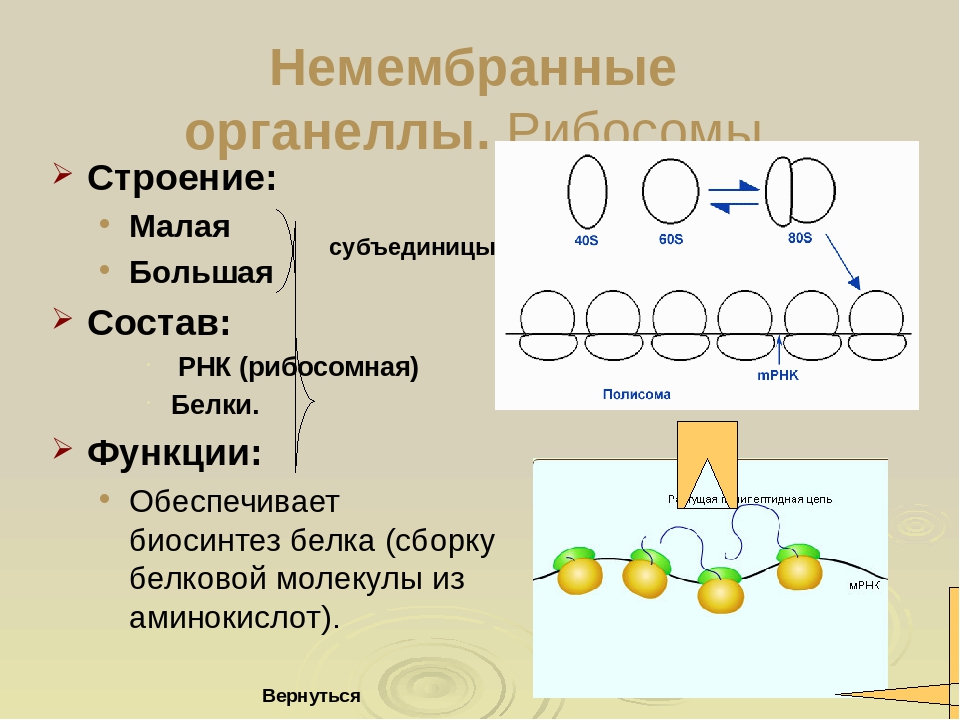 Он состоит из двух цепей РНК: цепи 23S (длина ~ 3000 оснований, 946 кДа) и цепи 5S (длина ~ 120 оснований, 39 кДа).В сборе с РНК находится около 30 белковых цепей. Белки в первой большой субъединице определены в диапазоне от 6 кДа до 37 кДа. См. также Большая рибосомная субъединица Haloarcula. Большая субъединица содержит несколько мотивов Kink-turn.
Он состоит из двух цепей РНК: цепи 23S (длина ~ 3000 оснований, 946 кДа) и цепи 5S (длина ~ 120 оснований, 39 кДа).В сборе с РНК находится около 30 белковых цепей. Белки в первой большой субъединице определены в диапазоне от 6 кДа до 37 кДа. См. также Большая рибосомная субъединица Haloarcula. Большая субъединица содержит несколько мотивов Kink-turn.
 Эукариотические цитоплазматические рибосомы также имеют дополнительную РНК в большой субъединице, 5.8S рРНК, которая составляет около 150 нуклеотидов и связана с 5′-концом прокариотической рРНК. Что касается размера, рибосомные субъединицы почкующихся дрожжей и человека осаждаются при 40S и 60S; полная рибосома оседает при 80°С, и обычно она примерно еще на миллион дальтон больше, чем прокариотическая.
Эукариотические цитоплазматические рибосомы также имеют дополнительную РНК в большой субъединице, 5.8S рРНК, которая составляет около 150 нуклеотидов и связана с 5′-концом прокариотической рРНК. Что касается размера, рибосомные субъединицы почкующихся дрожжей и человека осаждаются при 40S и 60S; полная рибосома оседает при 80°С, и обычно она примерно еще на миллион дальтон больше, чем прокариотическая. рибозим. (Изучите здесь структурные данные, касающиеся синтеза пептидной связи.) Во время стадии элонгации трансляции новые пептиды добавляются к карбокси-концу растущей зарождающейся цепи, которая связана с акцепторным концом тРНК в пептидильном или Р-сайте. .По мере роста зарождающейся цепи она продвигается в туннель, который проходит через большую субъединицу, называемый выходным туннелем полипептида. Несколько факторов могут взаимодействовать в месте экструзии формирующейся полипептидной цепи, чтобы обеспечить надлежащую укладку или транспорт через мембрану. Кроме того, во время синтеза белка многие дополнительные факторы, такие как факторы элонгации (EF-Tu и EF-G), взаимодействуют с рибосомой, точно и эффективно вызывая декодирование и синтез пептидной связи. Структуры некоторых из этих факторов в комплексе с рибосомой, а также промежуточные состояния в этом процессе наблюдаются сейчас, опираясь на первые атомные структуры.
рибозим. (Изучите здесь структурные данные, касающиеся синтеза пептидной связи.) Во время стадии элонгации трансляции новые пептиды добавляются к карбокси-концу растущей зарождающейся цепи, которая связана с акцепторным концом тРНК в пептидильном или Р-сайте. .По мере роста зарождающейся цепи она продвигается в туннель, который проходит через большую субъединицу, называемый выходным туннелем полипептида. Несколько факторов могут взаимодействовать в месте экструзии формирующейся полипептидной цепи, чтобы обеспечить надлежащую укладку или транспорт через мембрану. Кроме того, во время синтеза белка многие дополнительные факторы, такие как факторы элонгации (EF-Tu и EF-G), взаимодействуют с рибосомой, точно и эффективно вызывая декодирование и синтез пептидной связи. Структуры некоторых из этих факторов в комплексе с рибосомой, а также промежуточные состояния в этом процессе наблюдаются сейчас, опираясь на первые атомные структуры. Все эти структуры были определены с использованием белков экстремофилов. Вот ссылки на записи Proteopedia :
Все эти структуры были определены с использованием белков экстремофилов. Вот ссылки на записи Proteopedia :
 Белковые цепи содержат от 26 (THX, 3 кДа) до 256 аминокислот (S2, 29 кДа).
Белковые цепи содержат от 26 (THX, 3 кДа) до 256 аминокислот (S2, 29 кДа).
 Наука. 2009 16 октября; 326 (5951): 346-7. PMID: 19833925 doi: 326/5951/346
Наука. 2009 16 октября; 326 (5951): 346-7. PMID: 19833925 doi: 326/5951/346  Природа. 2000 г., 21 сентября; 407 (6802): 327-39. PMID: 11014182 doi: http://dx.doi.org/10.1038/35030006
Природа. 2000 г., 21 сентября; 407 (6802): 327-39. PMID: 11014182 doi: http://dx.doi.org/10.1038/35030006 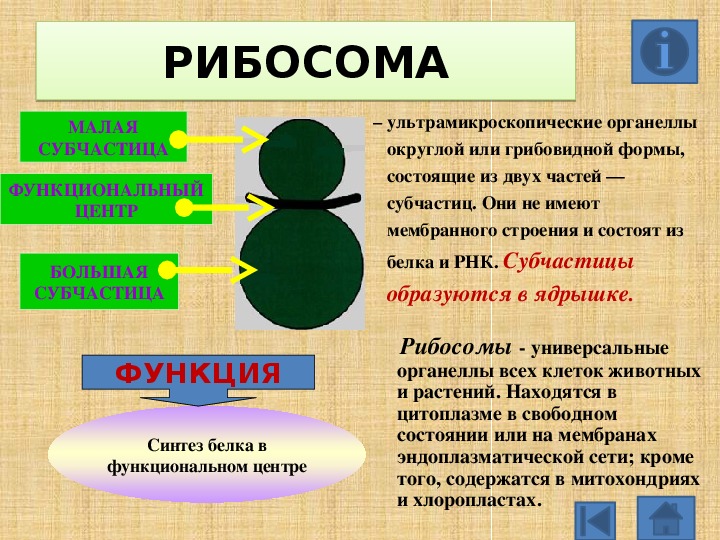 Epub 2008, 8 апреля. PMID: 18455733 doi: http://dx.doi.org/10.1016/j.jmb.2008.03.075
Epub 2008, 8 апреля. PMID: 18455733 doi: http://dx.doi.org/10.1016/j.jmb.2008.03.075  1016/j.tibs.2009.11.003
1016/j.tibs.2009.11.003  PMID:19089882 doi:10.1002/cbic.200800554
PMID:19089882 doi:10.1002/cbic.200800554