Что такое закон постоянства состава. Основные законы химии
Данный урок посвящен изучению закона постоянства состава вещества. Из материалов урока вы узнаете, кто открыл этот закон.
I. Открытие закона постоянства состава вещества
К основным законам химии относится закон постоянства состава:
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен.
Закон постоянства состава впервые сформулировал французский ученый-химик Ж.Пруст в 1808 г.
Он писал: «От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании.
В этой формулировке закона, как и в приведенной выше, подчеркивается постоянство состава соединения независимо от способа получения и места нахождения.
Чтобы получить сульфид железа (II) FeS, мы смешиваем железо и серу в соотношении 7:4.
Если смешать их в другой пропорции, например 10:4, то химическая реакция произойдет, но 3 г железа в реакцию не вступит. Почему наблюдается такая закономерность? Известно, что в сульфиде железа (II) на каждый один атом железа приходится один атом серы
. Следовательно, для реакции нужно брать вещества в таких массовых соотношениях, чтобы сохранялось соотношение атомов железа и серы (1:1). Поскольку численные значения атомных масс Fe, S и их относительных атомных масс A r (Fe), A r (S)совпадают, можно записать: A r (Fe) : A r (S) = 56:32 = 7:4.Отношение 7:4 сохраняется постоянно, в каких бы единицах массы ни выражать массу веществ (г, кг, т, а.
 е.м.). Большинство химических веществ обладает постоянным составом.
е.м.). Большинство химических веществ обладает постоянным составом.
Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава.
Вещества, имеющие переменный состав существуют, их назвали в честь Бертолле – бертоллидами.
Бертоллиды — соединения переменного состава, не подчиняющиеся законам постоянных и кратных отношений. Бертоллиды являются нестехиометрическими бинарными соединениями переменного состава, который зависит от способа получения. Многочисленные случаи образования бертоллидов открыты в металлических системах, а также среди оксидов, сульфидов, карбидов, гидридов и др. Например, оксид ванадия(II) может иметь в зависимости от условий получения, состав от V0,9 до V1,3.
По предложению Н.С. Курнакова первые названы дальтонидами
(в память английского химика и физика Дальтона), вторые — бертоллидами
(в память французского химика Бертолле, предвидевшего такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например Н 2 О, НCl, ССl 4 , СO 2 . Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.
Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например Н 2 О, НCl, ССl 4 , СO 2 . Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.
В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение.
Cостав соединений молекулярной структуры, т.е. состоящих из молекул, — является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
II. Решение задач
На основе закона постоянства состава можно производить различные расчёты.
Задача №1
В каких массовых отношениях соединяются химические элементы в серной кислоте, химическая формула которой H 2 SO 4 ?
Решение:
Ar(H)=1, Ar(S)=32, Ar(O)=16.
Определим массовые отношения этих элементов в формуле H 2 SO 4
m(H) : m(S) : m(O) = 2Ar(H) : Ar(S) : 4Ar(O) = 2: 32: 64 = 1: 16: 32
Таким образом, чтобы получить 49 г серной кислоты (1+16+32=49), необходимо взять 1 г — Н, 16 г — S и 32 г — О.
Задача №2
Водород соединяется с серой в массовых отношениях 1: 16. Используя данные об относительных атомных массах этих элементов, выведите химическую формулу сероводорода.
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(H)=1, Ar(S)=32.
Обозначим количество атомов водорода в формуле — х, а серы — у: Н х S у
m(H) : m(S) = хAr(H) : уAr(S)= х1: у32 = (2*1) : (1*32) = 2: 32 = 1: 16
Следовательно, формула сероводорода Н 2 S
Задача №3
Выведите формулу сульфата меди, если массовые отношения в нём меди, серы и кислорода соответственно равны 2:1:2?
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(Cu)=64, Ar(S)=32, Ar(O)=16.
Обозначим количество атомов меди в формуле — х, серы — у, а кислорода — z: Cu x S y O z
III. Контрольные задачи
Контрольные задачи
№1. Применяя сведения об относительных атомных массах химических элементов, вычислите массовые отношения элементов в угольной кислоте, химическая формула которой H 2 CO 3 .
№2. Определите массу кислорода, реагирующего без остатка с 3 г водорода, если водород и кислород в данном случае соединяются соответственно в соотношении 1: 8?
№3. Углерод и кислород в углекислом газе соединяются в массовых отношениях 3: 8.
Выведите химическую формулу углекислого газа
№4. Определите массу водорода, реагирующего без остатка с 48 г кислорода, если водород и кислород в данном случае соединяются в соотношеннии 1:8.
I. НОВЫЙ МАТЕРИАЛ
К основным законам химии относится закон постоянства состава:
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Атомно-молекулярное учение позволяет объяснить закон
постоянства состава. Поскольку атомы имеют постоянную массу, то и массовый
состав вещества в целом постоянен.
Закон постоянства состава впервые сформулировал французский ученый-химик Ж.Пруст в 1808 г
Он писал: «От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь».
В этой формулировке закона, как и в приведенной выше, подчеркивается постоянство состава соединения независимо от способа получения и места нахождения.
Чтобы получить сульфид железа(II), мы смешивали железо и серу в соотношении 7:4. . Если смешать их в другой пропорции, например 10:4, то химическая реакция произойдет, но 3 г железа в реакцию не вступит. Почему наблюдается такая закономерность? Известно, что в сульфиде железа(II) на каждый один атом железа приходится один атом серы
(демонстрация кристаллической решетки, рис.). Следовательно, для реакции нужно брать вещества в таких массовых соотношениях, чтобы сохранялось соотношение атомов железа и серы (1:1). Поскольку численные
значения атомных масс
Fe, S и их относительных атомных масс A r
(Fe),
A r
(S) совпадают, можно записать:A r
(Fe):A r
(S)
= 56:32 = 7:4.
Поскольку численные
значения атомных масс
Fe, S и их относительных атомных масс A r
(Fe),
A r
(S) совпадают, можно записать:A r
(Fe):A r
(S)
= 56:32 = 7:4.Отношение 7:4 сохраняется постоянно, в каких бы единицах массы ни выражать массу веществ (г, кг, т, а.е.м.). Большинство химических веществ обладает постоянным составом.
Рис. Кристаллическая решетка сульфида железа(II)
Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава. По предложению Н.С. Курнакова первые названы дальтонидами (в память английского химика и физика Дальтона), вторые — бертоллидами (в память французского химика Бертолле, предвидевшего такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например Н 2 О, НCl, ССl 4 , СO 2 . Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.
В связи с наличием соединений переменного состава в современную
формулировку закона постоянства состава следует внести уточнение.
Cостав соединений молекулярной структуры, т.е. состоящих из молекул, — является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
II. На основе закона постоянства состава можно производить различные
расчёты.
Задача №1
В каких массовых отношениях соединяются химические элементы в серной кислоте,
химическая формула которой H 2 SO 4 ?
Решение:
Ar(H)=1, Ar(S)=32, Ar(O)=16.
Определим массовые отношения этих элементов в формуле H
2 SO
4
m(H) : m(S) : m(O) = 2Ar(H) : Ar(S) : 4Ar(O) = 2: 32: 64 = 1: 16: 32
Таким образом, чтобы получить 49 г серной кислоты (1+16+32=49), необходимо взять 1 г — Н, 16 г — S и 32 г — О.
Задача №2
Водород соединяется с серой в массовых отношениях 1: 16. Используя данные об
относительных атомных массах этих элементов, выведите химическую формулу
сероводорода.
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(H)=1, Ar(S)=32.
m(H) : m(S) = хAr(H) : уAr(S)= х1: у32 = (2*1) : (1*32) = 2: 32 = 1: 16
Следовательно, формула сероводорода Н 2 S
Задача №3
Выведите формулу сульфата меди, если массовые отношения в нём меди, серы и
кислорода соответственно равны 2:1:2?
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(Cu)=64, Ar(S)=32, Ar(O)=16.
Обозначим количество атомов меди в формуле — х, серы — у, а кислорода — z: Cu
x S
y O
z
m(Cu) : m(S) : m(O) = хAr(Cu) : уAr(S) : zAr(O) = x64: y32: z16 = (1*64) :
(1*32) : (4*16) = 64:32:64 = 2:1:2
III. РЕШИТЕ
ЗАДАЧИ
№1. Применяя сведения об относительных атомных
массах химических элементов, вычислите массовые отношения элементов в угольной
кислоте, химическая формула которой H 2 CO 3 .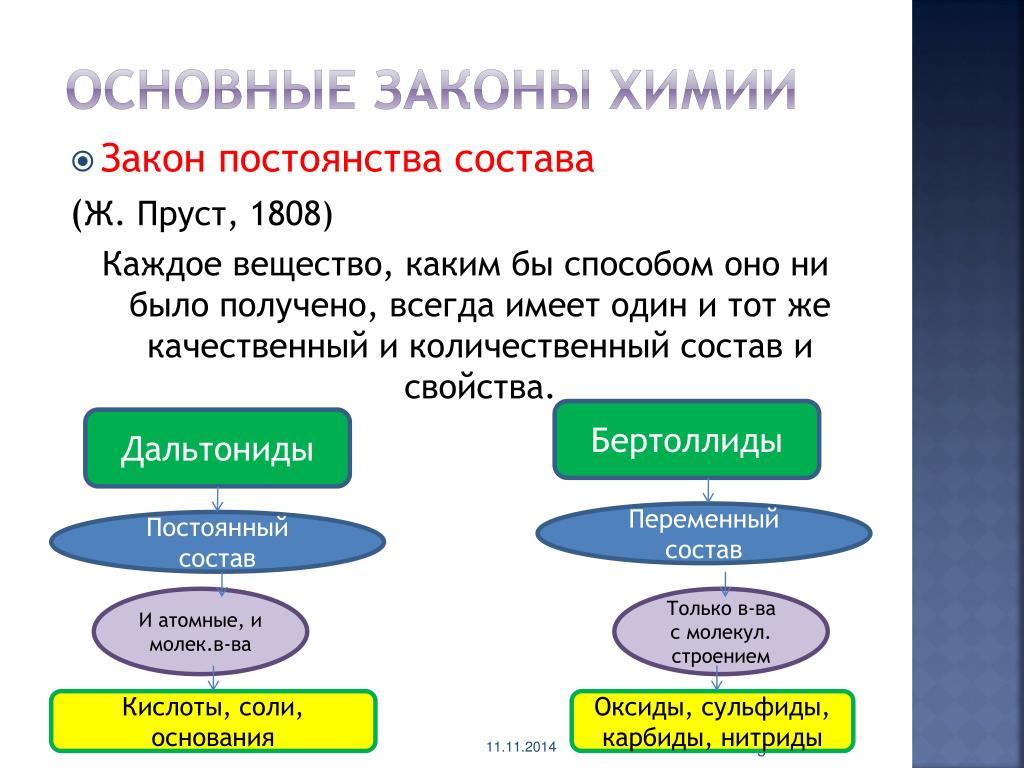
№2. Определите массу кислорода, реагирующего без остатка с 3 г водорода, если водород и кислород в данном случае соединяются соответственно в соотношении 1: 8?
№3. Углерод и кислород в углекислом газе соединяются
в массовых отношениях 3: 8.
Выведите химическую формулу углекислого газа
№4. Определите массу водорода, реагирующего без остатка с 48 г кислорода, если водород и кислород в данном случае соединяются в соотношеннии 1:8.
На прошлом уроке вы познакомились с понятием массовой доли химического элемента в веществе и заметили, что эта величина не зависит от массы самого вещества. Данный урок посвящен изучению закона постоянства состава вещества. Из материалов урока вы узнаете, кто открыл этот закон.
Тема: Первоначальные химические представления
Урок: Постоянство состава вещества
Ученые XVII-XVIII вв. проводили множество количественных измерений, в т.ч. по определению элемента в веществе. Но результаты их опытов были неточными, и как следствие, не совпадали.
Французский химик Клод Луи Бертолле пытался доказать, что состав веществ зависит от пропорций, в которых находятся реагирующие вещества.
Рис. 1. Клод Луи Бертолле
В отличие от него другой французский химик Жозеф Луи Пруст провел много экспериментов по исследованию состава различных веществ и сделал вывод о постоянстве состава вещества.
Рис. 2. Жозеф Луи Пруст
В 1808 г. Пруст сформулировал закон постоянства состава веществ : «Вещества имеют постоянный состав независимо от способа и места их получения».
В своей работе «Исследование меди» в 1799 г. Пруст показал, что природный карбонат меди и карбонат меди, полученный химиками в лаборатории, имеют один и тот же состав.
Ничем не различаются вода, текущая из нашего крана, вода из родника, или вода, полученная синтетическим путем (имеется в виду состав — воды, а не состав смеси). Вода всегда будет содержать по массе 11,1 % водорода и 88,9 % кислорода.
Но природа гораздо разнообразнее, чем любая теория, созданная человеком. И из закона постоянства состава веществ есть исключения. В XX веке было обнаружено, что некоторые соединения не имеют постоянного состава.
И из закона постоянства состава веществ есть исключения. В XX веке было обнаружено, что некоторые соединения не имеют постоянного состава.
Таким образом, нельзя сказать, что Клод Бертолле был абсолютно неправ. Закон постоянства состава веществ имеет ограничения.
Вещества, имеющие переменный состав существуют, их назвали в честь Бертолле — бертоллидами.
Бертоллиды — соединения переменного состава, не подчиняющиеся законам постоянных и кратных отношений. Бертоллиды являются нестехиометрическими бинарными соединениями переменного состава, который зависит от способа получения. Многочисленные случаи образования бертоллидов открыты в металлических системах, а также среди оксидов, сульфидов, карбидов, гидридов и др. Например, оксид ванадия(II) может иметь в зависимости от условий получения, состав от V 0,9 до V 1,3 .
1. Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. — М.: АСТ: Астрель, 2006. (с. 25-28)
— М.: АСТ: Астрель, 2006. (с. 25-28)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.21-23)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§9)
4. Химия: неорг. химия: учеб. для 8 кл. общеобр. учреждений / Г.Е. Рудзитис, ФюГю Фельдман. — М.: Просвещение, ОАО «Московские учебники», 2009. (§§10,14)
5. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. — М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов ().
2. Электронная версия журнала «Химия и жизнь» ().
Домашнее задание
с. 22-23 №№ 3,7
из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
Один из основных законов химии, открытый в 1799 г. Ж. Л. Прустом; согласно этому закону определённое химически чистое соединение независимо от способа его получения состоит из одних и тех же хим. элементов, имеющих постоянные состав и свойства,… … Большая политехническая энциклопедия
закон постоянства состава — pastoviųjų santykių dėsnis statusas T sritis fizika atitikmenys: angl. law of constant proportions; law of definite composition vok. Gesetz der konstanten Gewichtsverhältnisse, n; Gesetz der konstanten Proportionen, n; Gesetz der konstanten… … Fizikos terminų žodynas
закон постоянства состава — закон паёв … Cловарь химических синонимов I
ПОСТОЯНСТВА СОСТАВА ЗАКОН: каждое химическое соединение независимо от способа его получения, состоит из одних и тех же элементов, причем отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллических… … Большой Энциклопедический словарь
Состав кристаллических… … Большой Энциклопедический словарь
ПОСТОЯНСТВА СОСТАВА ЗАКОН: каждое химическое соединение, независимо от способа его получения, состоит из одних и тех же элементов, причем отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллических… … Энциклопедический словарь
В каждом определенном хим. соед., независимо от способа его получения, соотношения масс составляющих элементов постоянны. Сформулирован в нач. 19 в. Ж. Прустом: Соединение есть привилегированный продукт, которому природа дала постоянный состав.… … Химическая энциклопедия
Один из основных законов химии: каждое определённое химическое соединение, независимо от способа его получения, состоит из одних и тех же элементов, причём отношения их масс постоянны, а относительные количества их атомов выражаются… … Большая советская энциклопедия
Один из осн. законов химии, заключающийся в том, что каждое хим. соединение, независимо от способа его получения, состоит из одних и тех же хим. элементов, соединённых друг с другом в одних и тех же отношениях (по массе). П. с. з. был установлен… … Большой энциклопедический политехнический словарь
элементов, соединённых друг с другом в одних и тех же отношениях (по массе). П. с. з. был установлен… … Большой энциклопедический политехнический словарь
Каждое химическое соединение, независимо от способа его получения, состоит из одних и тех же элементов, причём отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллических соединений может быть и… … Энциклопедический словарь
Каждое хим. соединение, независимо от способа его получения, состоит из одних и тех же элементов, причём отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллич. соед. может быть и неременным (см.… … Естествознание. Энциклопедический словарь
Всякое вещество – от самого
простого
до самого сложного – имеет три различные,
но взаимосвязанные стороны:
свойство, состав, строение…
Б.М.Кедров
Цели
.
Дидактическая
– рассмотреть понятия
«химический элемент», «сложное вещество», а
также состав сложных веществ, его постоянство,
что обозначает химическая формула вещества,
назначение коэффициентов и индексов.
Психологическая
– вызвать интерес к
предмету, выработать умения логически
рассуждать, грамотно выражать свои мысли.
Воспитательная
– развивать умения работать
коллективно, оценивать ответы своих товарищей.
Оборудование . Кристаллическая решетка сульфида железа(II), модели молекул воды, индивидуальные карточки для проверки домашнего задания, таблички-анаграммы для химической разминки, шкала для определения эмоционального состояния ученика.
ХОД УРОКА
В начале и в конце урока проводится психологическая разминка . Ее цель – определить эмоциональное состояние учащихся. У каждого ученика на внутренней стороне обложки тетради приклеена табличка с шестью лицами – шкала для определения эмоционального состояния (рис. 1). Каждый ученик ставит галочку под той рожицей, чье выражение отражает его настроение.
УЧИТЕЛЬ
. Было бы
замечательно, если бы к концу урока каждому
удалось переместить галочку хотя бы на одну
клетку влево. Для этого нужно задуматься над
вопросами: может ли человек полюбить
неинтересный ему учебный предмет? Что для этого
нужно сделать?
Для этого нужно задуматься над
вопросами: может ли человек полюбить
неинтересный ему учебный предмет? Что для этого
нужно сделать?
Статья опубликована при поддержке мобильного онлайн переводчика «m-translate.ru ». Удобный и быстрый онлайн перевод с десятка языков, тысячи направлений перевода. Не требует установки, перевод слов, предложений и текстов, бесплатно. Чтобы начать пользоваться сервисом онлайн перевода перейдите на сайт: http://www.m-translate.ru/.
Химическая разминка
.
УЧЕНИК
. Вася и Петя любят составлять и
разгадывать слова-анаграммы (обычно
фантастические), в которых порядок букв
переставлен. Попробуйте разгадать некоторые из
химических анаграмм.
Переставив буквы в каждом слове, надо получить
название химического элемента.
Леодруг
– без этого элемента в печке не будет
огня,
сликодор
– без этого элемента не проживете и
десяти минут,
цинвес
– у этого элемента действительно
большой удельный вес,
мникрей
– этот элемент ищите среди камней,
орребес
– блестит, а не золото.
УЧИТЕЛЬ.
Если вы легко справились с
этим заданием, скажите себе: «Я – умница».
Проверка домашнего задания по теме
«Химические знаки».
Повторить знаки
химических элементов и значения их
относительных атомных масс. Обратить внимание на
различие массы атома (в атомных единицах массы) и
относительной атомной массы (безразмерной
величины) на их общий признак – одинаковое
численное значение. Затем провести фронтальную
самостоятельную работу по индивидуальным
карточкам в течение 5–10 мин.
Карточка 1
. Назовите элементы по их
химическим знакам: N, S, Ag, Al, O, I.
Карточка 2
. Напишите химические знаки
элементов: железо, водород, натрий, бром, цинк,
хлор.
УЧИТЕЛЬ.
Сегодня мы познакомимся с
одним из основных законов химии – это закон
постоянства состава вещества. Мне хочется, чтобы
вы за строгой формулировкой закона увидели
живого, трудолюбивого и любознательного
человека из Франции – Жозефа Луи Пруста. Он в
течение семи лет исследовал множество веществ,
чтобы доказать утверждение, которое в
современной формулировке умещается в три
строчки. Об этом очень красиво сказал в своих
стихах его земляк, малоизвестный у нас
французский поэт Арман Сюлли-Прюдом, лауреат
Нобелевской премии, современник Д.И.Менделеева.
Он в
течение семи лет исследовал множество веществ,
чтобы доказать утверждение, которое в
современной формулировке умещается в три
строчки. Об этом очень красиво сказал в своих
стихах его земляк, малоизвестный у нас
французский поэт Арман Сюлли-Прюдом, лауреат
Нобелевской премии, современник Д.И.Менделеева.
УЧЕНИЦА
«Взор химика пытлив, ему порядок мил,
Среди своих реторт, мензурок и приборов,
Таких загадочных для любопытных взоров,
Стремится он постичь капризы тайных сил.
Он многое из них уже установил,
Следя за их игрой, участник их раздоров,
И скоро он велит, властитель этих споров,
Признать и чтить закон, который он открыл.
Завидую тебе, взыскательный ученый,
Чьи зоркие глаза мир видят обнаженный,
Как в день творения, исток всех прочих дней.
Веди ж меня в загадочное царство!
Я верю: только в нем отыщется лекарство
От всех бесчисленных печалей и скорбей».
УЧИТЕЛЬ.
Чтобы получить сульфид
железа(II), мы смешивали железо и серу в
соотношении 7:4. Если смешать их в другой
пропорции, например 10:4, то химическая реакция
произойдет, но 3 г железа в реакцию не вступит.
Почему наблюдается такая закономерность?
Известно, что в сульфиде железа(II) на каждый один
атом железа приходится один атом серы
(демонстрация
кристаллической решетки, рис. 2). Следовательно,
для реакции нужно брать вещества в таких
массовых соотношениях, чтобы сохранялось
соотношение атомов железа и серы (1:1). Поскольку
численные значения атомных масс
Fe, S и их
относительных атомных масс A r
(Fe), A r
(S)
совпадают, можно записать:
A r
(Fe):A r
(S)
= 56:32 = 7:4.
Если смешать их в другой
пропорции, например 10:4, то химическая реакция
произойдет, но 3 г железа в реакцию не вступит.
Почему наблюдается такая закономерность?
Известно, что в сульфиде железа(II) на каждый один
атом железа приходится один атом серы
(демонстрация
кристаллической решетки, рис. 2). Следовательно,
для реакции нужно брать вещества в таких
массовых соотношениях, чтобы сохранялось
соотношение атомов железа и серы (1:1). Поскольку
численные значения атомных масс
Fe, S и их
относительных атомных масс A r
(Fe), A r
(S)
совпадают, можно записать:
A r
(Fe):A r
(S)
= 56:32 = 7:4.
Отношение 7:4 сохраняется постоянно, в каких бы
единицах массы ни выражать массу веществ
(г, кг, т, а.е.м.). Большинство химических веществ
обладает постоянным составом.
Закон постоянства состава веществ
был
открыт французским ученым Прустом в 1808 г. Вот как
этот закон звучал в его изложении: «От одного
полюса Земли до другого соединения имеют
одинаковый состав и одинаковые свойства. Никакой
разницы нет между оксидом железа из Южного
полушария и Северного. Малахит из Сибири имеет
тот же состав, как и малахит из Испании. Во всем
мире есть лишь одна киноварь».
Никакой
разницы нет между оксидом железа из Южного
полушария и Северного. Малахит из Сибири имеет
тот же состав, как и малахит из Испании. Во всем
мире есть лишь одна киноварь».
Современная формулировка закона
:
каждое химически чистое вещество с молекулярным
строением независимо от места нахождения и
способа получения имеет один и тот же постоянный
качественный и количественный состав.
Учащиеся записывают определение в тетрадь.
Затем они выполняют самостоятельную работу
.
Текст заданий заранее написан на доске. Двое
учащихся решают задачи на обратной стороне
доски, остальные решают в тетрадях. После
выполнения работы ученики обмениваются
тетрадями, происходит взаимопроверка. Учитель
может выборочно проверить некоторые тетради.
Вариант 1
. Для получения сульфида железа(II)
взяли 3,5 г железа и 4 г серы. Какое вещество
останется неизрасходованным и какова его масса?
Вариант 2
. Чтобы получить сульфид железа(II),
взяли 15 г железа и 8 г серы. Какое вещество взято в
избытке и какова масса этого избытка?
Какое вещество взято в
избытке и какова масса этого избытка?
УЧИТЕЛЬ.
А сейчас послушайте
выступление о знаменитом споре между
французскими учеными Ж.Л.Прустом и К.Л.Бертолле,
который длился около 10 лет на страницах
французских журналов в начале XIX в.
УЧЕНИК.
Да, спор двух французских
химиков длился с 1799 по 1809 г., а затем был продолжен
химиками Англии, Швеции, Италии, России и других
стран. Этот спор можно с полным правом назвать
первой научной дискуссией такого масштаба и по
времени возникновения, и по стратегической
важности обсуждаемых проблем. Эта дискуссия
определила пути развития химии на столетия
вперед.
В 1799 г. профессор Королевской лаборатории в
Мадриде, француз по происхождению, Жозеф Луи
Пруст опубликовал статью «Исследования меди». В
статье подробно освещены анализы соединений
меди и сделан вполне обоснованный вывод, что
химически индивидуальное соединение всегда,
независимо от способа его образования, обладает
постоянным составом. К такому же выводу Пруст
пришел и позже, в 1800–1806 гг., исследуя химические
соединения свинца, кобальта и других металлов.
К такому же выводу Пруст
пришел и позже, в 1800–1806 гг., исследуя химические
соединения свинца, кобальта и других металлов.
В 1800–1803 гг. английский химик Джон Дальтон
обосновал этот закон теоретически, установив
атомное строение молекул и наличие определенных
атомных масс элементов. Чисто теоретически
Дальтон пришел к открытию еще одного основного
закона химии – закона кратных отношений,
находящегося в единстве с законом постоянства
состава.
В то же самое время профессор Нормальной школы в
Париже Клод Луи Бертолле, уже знаменитый химик,
опубликовал ряд статей, в которых отстаивал
вывод о том, что состав химических соединений
зависит от способа их получения и часто бывает не
постоянным, а переменным. Бертолле выступил
против законов Пруста и Дальтона, аргументируя
это все новыми и новыми опытами по получению
сплавов, твердых оксидов металлов. Он
воспользовался и данными самого Пруста, указав
на то, что в природных сульфидах и оксидах
металлов содержится избыток серы и кислорода по
сравнению с полученными в лаборатории.
Развитие химии показало, что обе стороны были
правы. Точка зрения Пруста и Дальтона для химии
1800-х гг. была понятна, конкретна и почти очевидна.
Пруст и Дальтон заложили основы атомно-
молекулярного учения о составе и строении
химических соединений. Это была магистральная
линия развития химии. Точка зрения Бертолле была
практически неприемлема для тогдашней химии, т.
к. она отражала химизм процессов, изучение
которых началось в основном лишь
с 1880-х гг. И только будущее показало, что и
Бертолле был прав!
По предложению академика Н.С.Курнакова вещества
постоянного состава были названы дальтонидами (в
честь английского химика и физика Дальтона), а
вещества переменного состава – бертоллидами (в
память о французском химике Бертолле). (Более
подробно об этом можно прочитать в работах .)
УЧИТЕЛЬ.
Подведем итоги сообщения.
Во-первых, известны вещества немолекулярного
строения с переменным составом. Во-вторых, закон
постоянства состава веществ справедлив для
веществ молекулярного строения. В-третьих,
существует категория веществ молекулярного
строения, для которых закон постоянства состава
неверен. Это полимеры, с ними мы познакомимся на
уроках химии позднее.
В-третьих,
существует категория веществ молекулярного
строения, для которых закон постоянства состава
неверен. Это полимеры, с ними мы познакомимся на
уроках химии позднее.
Что же подразумевается под количественным и
качественным составами веществ? На основе закона
Пруста можно записать химические формулы
веществ при помощи химических знаков.
Рассмотрим в качестве примера состав молекулы
воды. Она состоит из атомов водорода и кислорода
(качественный состав), причем по массе в воде
содержится водорода – 11,19%, а кислорода – 88,81%
(количественный состав). Есть несколько способов
выражения состава воды.
1-й способ
. В состав молекулы воды входят два
атома водорода и один атом кислорода (используем
слова).
2-й
способ
. Эту же мысль можно выразить рисунком
(используем условные обозначения):
3-й способ
. Формула воды –
Н 2 О (используем
химические знаки и индексы).
Индекс
показывает количество атомов
данного элемента в молекуле.
Итак, состав дальтонидов выражается простыми
формулами с целочисленными стехиометрическими
индексами, например
Н 2 О, НСl, СН 4 . Состав
бертоллидов непостоянен, у них дробные
стехиометрические индексы. Так, оксид титана(II)
ТiO в действительности имеет состав от
ТiO 0,7
до ТiO 1,3 .
Ответьте мне на вопрос: что показывает
коэффициент? (Ответ учащихся: число молекул
данного вещества.)
Рассмотрим пример: 3Н 2 О. Какое количество
молекул воды отображает эта запись? Сколько
атомов водорода в одной молекуле воды, в трех
молекулах воды? Сколько атомов кислорода в одной
молекуле воды, в трех молекулах воды?
(Демонстрация моделей молекул воды.) Читаем
формулу: «три-аш-два-о».
Демонстрация увеличенного рисунка 15 на с. 24
учебника «Химия-8» , представляющего запись: 3CuCl 2 ,
5Al 2 O 3 , 3FeCl 2 .
УЧИТЕЛЬ.
Как прочитать формулы
указанных веществ? Сколько молекул данного
вещества отображает химическая формула? Сколько
атомов каждого элемента входит в одну молекулу
данного вещества? Сколько атомов каждого
элемента в трех (пяти) молекулах данного
вещества?
Химическая формула
– это условная
запись состава вещества посредством химических
знаков и индексов.
Ученики записывают определение в тетрадь.
Беседа с учащимися по вопросам.
1. Кем и когда был открыт закон постоянства
состава веществ?
2. Дайте определение этого закона.
3. В чем состояла суть спора между химиками
Прустом, Дальтоном и Бертолле?
4. Что отображает химическая формула вещества?
5. Что показывают коэффициент и индексы в
химической формуле?
6. Есть ли разница в составе веществ, имеющих
формулы: СО и СО 2 , Н 2 О и Н 2 О 2 ?
7. Используя химические знаки, индексы и
коэффициенты, запишите обозначения
двух молекул воды,
трех молекул оксида азота (если известно, что в
молекуле оксида азота на один атом азота
приходится два атома кислорода),
трех молекул сероводорода (в его молекуле на два
атома водорода приходится один атом серы),
четырех молекул оксида фосфора (в каждой
молекуле этого оксида на два атома фосфора
приходится пять атомов кислорода).
Ученики делают записи в тетради, один ученик – на
обратной стороне доски. Проверка: обмен
тетрадями с соседом по парте, сверка по ответу на
доске, анализ ошибок.
Проверка: обмен
тетрадями с соседом по парте, сверка по ответу на
доске, анализ ошибок.
Задание на дом.
Учебник «Химия-8» , § 9,
с. 22–23; § 10, с. 24–25. Двум учащимся дается задание
подготовить небольшие сообщения по биографии
Пруста.
Итоги урока
. Объявить оценки за урок
отвечавшим ученикам, поблагодарить всех за
работу на уроке. Провести оценку эмоционального
состояния по шкале (см. рис. 1). Учитель еще раз
напоминает вопросы, над которыми необходимо
подумать для эффективной работы на уроках.
ЛИТЕРАТУРА
1. Соловейчик С.Л.
Час ученичества. М.:
Педагогика, 1986.
2. Леенсон И.А.
Химические элементы и
химические законы. Рабочая тетрадь. М.: Изд-во
гимназии «Открытый мир», 1995.
3. Кузнецов В.И., Рахимбекова X.
Дискуссии в
развитии науки и диалоговая форма обучения.
Химия в школе, 1991, № 6.
4. Кузнецов В.И.
Эволюция представлений об
основных законах химии. М.: Наука, 1967.
5. Рудзитис Г. Е., Фельдман Ф.Г.
Химия-8. М.:
Просвещение, 1991.
Е., Фельдман Ф.Г.
Химия-8. М.:
Просвещение, 1991.
Закон постоянства состава — Справочник химика 21
Эквивалент. Закон эквивалентов. Из закона постоянства состава следует, что элементы соединяются друг с другом в стро.го определенных количественных соотношениях. Поэтому в химию были введены понятия эквивалента и эквивалентной массы (слово эквивалентный в переводе означает равноценный ). [c.31]Наряду с соединениями, для которых справедливы законы постоянства состава и кратных отношений, существуют соединения переменного состава — многие твердые оксиды, сульфиды, нитриды, карбиды и пр. [c.260]
Стехиометрия — умение о составе веществ, основанное па законах постоянства состава, эквивалентов и кратных отношений (законы стехиометрии), [c.152]
Более того, Пруст установил, что постоянство соотношений компонентов наблюдается и в ряде других соединений. Он сформулировал общее правило, согласно которому все соединения содержат элементы в строго определенных пропорциях (а не в любых сочетаниях) вне зависимости от условий получения этих соединений. Это правило называется законом постоянства состава, или иногда законом Пруста. (Пруст также показал, что Бертолле, пытаясь доказать, что состав определенных соединений меняется в зависимости от метода их получения, пришел к ошибочным выводам из-за неточности анализов и использования недостаточно чистых исходных соединений.) [c.54]
Он сформулировал общее правило, согласно которому все соединения содержат элементы в строго определенных пропорциях (а не в любых сочетаниях) вне зависимости от условий получения этих соединений. Это правило называется законом постоянства состава, или иногда законом Пруста. (Пруст также показал, что Бертолле, пытаясь доказать, что состав определенных соединений меняется в зависимости от метода их получения, пришел к ошибочным выводам из-за неточности анализов и использования недостаточно чистых исходных соединений.) [c.54]
Закон постоянства состава. Следующим шагом в развитии химии явилось установление положения о постоянстве состава вещества [c.14]
ВИДНО, что Пруст прав. Закон постоянства состава был уточнен и стал краеугольным камнем химии . [c.55]
Другими словами, если признать атомное строение материи, то из этого положения закон постоянства состава вытекает как естественное следствие. Более того, поскольку справедливость закона постоянства состава — неоспоримый факт, то, следовательно, атомы действительно являются неделимыми частицами. [c.55]
[c.55]
В честь Дальтона, широко применявшего молекулярно-атомную теорию к химическим явлениям, и Бертолле, впервые высказавшего предположение о существовании соединений, не подчиняющихся законам постоянства состава и кратных отношений. [c.261]
И тем не менее с момента открытия закона Пруста существовали серьезные сомнения в его справедливости. В конце концов, почему закон постоянства состава всегда должен быть справедлив Почему какое-то соединение всегда должно содержать 4 части л и 1 часть у, и почему оно не может содержать, например, 4,1 или 3,9 части х и 1 часть у Если допустить, что материя является сплошной (а не дискретной), то понять это трудно. Почему элементы не могут смешиваться в несколько иных пропорциях [c.55]
Выводы Канниццаро были последним звеном в цепи логических рассуждений, которая вела свое начало от Пруста и его закона постоянства состава. Спор был окончен, настало время расчетов. Ученые могли находить точную атомную массу любого элемента, входящего в соединения, плотность паров которых удавалось измерить. Зная атомные массы элементов, можно было вычислять процентный состав новых соединений, что давало возможность однозначно устанавливать их химические формулы. На этой основе было введено понятие моля, которое мы уже сформулировали в гл. 1. Моль определялся как количество вещества в граммах, численно равное его молекулярной массе в шкале Канниццаро (которой мы пользуемся и сегодня разумеется, к нашему времени точность ее стала значительно выше). Отсюда ясно, что моль любого вещества должен содержать одинаковое число молекул. Хотя значение этого числа сначала было неизвестным, ему присвоили название числа Авогадро N в знак запоздалой признательности ученому, внесшему столь большой вклад в развитие химии. [c.289]
Зная атомные массы элементов, можно было вычислять процентный состав новых соединений, что давало возможность однозначно устанавливать их химические формулы. На этой основе было введено понятие моля, которое мы уже сформулировали в гл. 1. Моль определялся как количество вещества в граммах, численно равное его молекулярной массе в шкале Канниццаро (которой мы пользуемся и сегодня разумеется, к нашему времени точность ее стала значительно выше). Отсюда ясно, что моль любого вещества должен содержать одинаковое число молекул. Хотя значение этого числа сначала было неизвестным, ему присвоили название числа Авогадро N в знак запоздалой признательности ученому, внесшему столь большой вклад в развитие химии. [c.289]
В отличие от закона сохранения массы, справедливость которого полностью подтверждена открытиями, сделанными после его установления, законы постоянства состава и кратных отношений оказались не столь всеобщими.
 В связи с открытием изотопов ( 35) выяснилось, что соотношение между массами элементов, входящих в состав данного вещества, постоянно лишь при условии постоянства изотопного состава этих элементов. При изменении изотопного состава элемента меняется и массовый состав соединения. Например, тяжелая вода 72) содержит около 2Ь% (масс.) водорода, а обычная вода лишь 11%. [c.24]
В связи с открытием изотопов ( 35) выяснилось, что соотношение между массами элементов, входящих в состав данного вещества, постоянно лишь при условии постоянства изотопного состава этих элементов. При изменении изотопного состава элемента меняется и массовый состав соединения. Например, тяжелая вода 72) содержит около 2Ь% (масс.) водорода, а обычная вода лишь 11%. [c.24]В действительности состав некоторых соединений может колебаться в определенных пределах, но это особые случаи. Состав тех простых соединений, которыми занимались химики до 1800 г,, строго соответствует требованиям закона постоянства состава. [c.55]
Это утверждение получило название закона постоянства состава Пруста. Спор между Бертолле и Прустом принес большую пользу, потому что многие химики отправились в свои лаборатории доказывать идеи, приверженцами которых они были, а результатом явилось быстрое накопление большого объема знаний о составе химических соединений. Конечно, прав оказался Пруст и все же существуют твердые кристаллические вещества, в которых из-за наличия дефектов кристаллической структуры подлинное отношение атомов не совпадает с предсказываемым идеальной химической формулой. Например, состав сульфида железа может варьировать от Fe, (S до FeS,, в зависимости от способа получения образца. [c.275]
Например, состав сульфида железа может варьировать от Fe, (S до FeS,, в зависимости от способа получения образца. [c.275]
Закон постоянства состава. Закон кратных отношений 23 [c.23]
Закон постоянства состава формулируется таким образом [c.14]
Имеет ли соединение постоянный состав Закон постоянства состава. Эквивалентные отношения и соединительные веса. [c.267]
Д. Дальтон (1776—1844 гг.) в дальнейшем, используя открытый им закон кратных отношений, закон эквивалентов и закон постоянства состава, создал новую версию атомистической теории, основанную на количественных соотношениях, возникающих при взаимодействии между химическими элементами. [c.15]
Клод Бертолле (1748-1822). Французский химик, противник закона постоянства состава соединений. [c.66]
Примечание значения х У1 у — чрезвычайно а-лы, знаки равенства в некоторых случаях поставлены условно. Предложите, как следует дополнить закон постоянства состава или дайте новую его формулировку. [c.18]
Предложите, как следует дополнить закон постоянства состава или дайте новую его формулировку. [c.18]
В заключение еще раз отметим, что сформулированный Прустом закон постоянства состава Пропорции, в которых два элемента соединяются при образовании определенного химического вида, не способны к непрерывным изменениям — действителен лишь для молекул, состоящих из небольшого числа атомов и настолько мало взаимодействующих между собой, что этим можно пренебречь. Любое кристаллическое вещество, не имеющее молекулярного строения, в большей или меньшей степени должно иметь переменный состав. Причина этого лежит в энергетических закономерностях—проявлении энтропийного фактора (см. с. 124). Полное структурное упорядочение может реализоваться лишь при абсолютном нуле, О К. [c.107]
Закон постоянства состава. Из представлений, лежащих в основе современной химии, вторым по значимости после принципа сохранения массы и энергии является закон постоянства состава химических соединений. [c.13]
[c.13]
I видимому, Л. Больцман. Тем не менее, большинство моделей этих систем детерминистские по своей сути. Другой недостаток, препятствующий моделированию сложных систем — стремление к описанию их на уровне взаимодействия элементарных частей системы. В сложных системах процессы являются стохастическими. Детерминированность таких систем кажущаяся. Квантовая теория изменила представления об атомах и молекулах. Одно из крупнейших достижений физики и химии XX века — теория гибридизации Л. Полинга, обычно понимается довольно узко как образование сложных электронных оболочек, хотя истинный смысл этой теории в том, что реальный атом в молекуле и изолированный атом таблицы Менделеева — разные вещества. То же относится к молекулам молекула в почве, лаборатории и организме — разные объекты. Состояние вещества зависит от среды. Природные геохимические и биогеохимические системы — почвы, нефти, водные биоценозы состоят из бесконечного числа компонентов. В природе нет и не может быть абсолютно чистого вещества. Понятие чистого вещества противоречит понятию памяти сред. В дальнейшем будет показано непостоянство закона постоянства состава. Кроме того, для таких систем характерны законы квантовой. логики. В конечном счете, это приводит к замыканию макромира таких систем [c.22]
Понятие чистого вещества противоречит понятию памяти сред. В дальнейшем будет показано непостоянство закона постоянства состава. Кроме того, для таких систем характерны законы квантовой. логики. В конечном счете, это приводит к замыканию макромира таких систем [c.22]
Как и закон постоянства состава, закон кратных отношений предусматривает постоянство атомной массы любого химического элемента, что возможно только при условии постоянства его изотопного состава. [c.14]
Доказательство постоянства состава для самых разнообразных химических соединений уже являлось само по себе свидетельством в пользу дискретности строения материи. Применение же закона постоянства состава для анализа любого из указанных рядов показывает, что существование двух (или нескольких) соединений, образующихся при взаимодействии любой пары химических элементов, возможно лишь в том случае, когда состав соединений будет отличаться один от другого на целые атомы. Естественно, что эти различия в составе химических соединений ряда, впрочем, как и сами основные законы химии, справедливы лишь при условии, что материя действительно состоит из мельчайших неделимых частиц. [c.16]
[c.16]
В начале XIX в. Ж- Пруст в длительном споре с К- Бертолле отстаивал мысль, что вещество независимо от способов получения обладает одним и тем же составом. Это утверждение было сформулировано в закон постоянства состава. Исходя из данных о составе вещества выводилась его химическая формула с постоянным количественным соотношением элементов ( Oj, HjO, СН4). Поэтому соединения постоянного состава были названы стехиометрическими соединениями (стехиометрия от греческого stoi heian — основание, элемент и metreo — мерю). Закон постоянства состава и стехио-метричность соединений долгое время считались незыблемыми. Однако в начале XX в. И. С. Курнаков на основании своих исследований пришел к выводу о существовании нестехиометрических соединений, т. е. характеризующихся переменным составом. Н. С. Курнаков отмечал, что было бы ошибкой считать соединения переменного состава… чем-то редким и исключительным . Соединения постоянного состава Н. С. Курнаков назвал дальтонидами в честь Д. Дальтона, широко применявшего атомно-молекулярную теорию к химическим явлениям. Нестехиометрические соединения были названы в честь К. Бертолле бертоллидами. [c.105]
Дальтона, широко применявшего атомно-молекулярную теорию к химическим явлениям. Нестехиометрические соединения были названы в честь К. Бертолле бертоллидами. [c.105]
И наконец, использование закона постоянства состава и закона кратных отношений позволило Д. Дальтону установить значения относительных атомных масс элементов, принимая за единичную — массу атома водорода. [c.16]
Азеотропные смеси не являются химическими соединениями. Это подтверждается тем, что состав азеотропной смеси зависит от давления, а следовательно, не соблюдается обязательный для каждого химического соединения закон постоянства состава. Так, например, смесь этиловый спирт — вода при давлении 101,3 кПа образует азеотроп, содержащий 88,4 мол.% спирта. При понижении давления концентрация спирта в азеотропе увеличивается, а при абсолютном давлении ниже 12 кПа азеотропная смесь вовсе не образуется. [c. 17]
17]
Структура книги построена следующим образом первая часть, методологическая, написана сравнительно популяр(ю и посвящается критике атомизма, закона постоянства состава, представлению о энтропии, как мере хаоса, разрушающей ро.чп энтропии и ряду других догм естествознания. Вторая часть 6 [c.6]
Природа опирается на законы развития многокомпонентных систем -веществ, завязанных в единое целое. Для систем — веществ не выполняются точно законы сохранения вещества, законы постоянства состава. [c.39]
Различные образцы одного и того же вещества, представляю-щег.о собой химическое соединение, содержат в своем составе одни и те же элементы и всегда в одинаковых пропорциях. При этом каким бы способом мы ни получали данное соединение, оно всегда имеет один и тот же состав. Таков смысл известного закона постоянства состава. [c.12]
Предложен системный подход к веществу, согласно которому все вещество в природе заключено не в молекулярные, а в многокомпонентные стохастические системы (МСС) с случайным распределением состава. Для вещества, как многокомпонентной системы, не выполним закон постоянства состава. Он справедлив с некоторой точностью только для основного, доминирующего в этой системе, компонента. [c.65]
Для вещества, как многокомпонентной системы, не выполним закон постоянства состава. Он справедлив с некоторой точностью только для основного, доминирующего в этой системе, компонента. [c.65]
Атомизм, сыгравший выдающуюся роль в прошлом, сейчас не способствует познанию и созданию единой картины Мира и приводит к утрате единства и целостности окружающей действительности и Человеческой личности. Атомизм теряет смысл при переходе от индивидуальных веществ к большим системам веществ, где необходимо учитывать значение примесей. К основным компонентам добавляются их спутники — примеси. Поэтому любое вещество -система. Предлагается системный подход к исследованию сложного вещества в отличии от классического подхода, учитывающего только индивидуальные основные компоненты, вещество рассматривается как единая стохастическая многокомпонентная система. Природа опирается на законы развития многокомпонентных систем — веществ, завязанных в единое целое. Для систем- веществ не выполняются законы постоянства состава. [c.105]
[c.105]
Таким образом, любое реальное химически чистое вещество содержит в своей системе один доминирующий (основной) компонент и разные компоненты — спутники. Закон постоянства состава выполним только для основного вещества. При системном подходе к веществу с учетом всех даже очень малых количеств компонентов закон постоянства состава не выполняется, суммы компонентов лишь приближенно равны целому. Отсюда следует невыполнимость закона действующих масс для системы в целом. [c.9]
В результате установ. .еиия закона сохранения массы с конца ХУИ1 века в хи.мии прочно утвердились количественные методы исследования. Был изучен количественный состав многих веществ. При этом был установлен закон постоянства состава [c.23]
Еще в прошлом веке стехиометрические законы (законы постоянства состава, кратных отношений, эквивалентов), установленные для молекулярных соединений (газообразных и парообразных), завоевали в теоретической химии настолько прочные позиции, что отклонения от них для веществ любой структуры казались невозможными. Поэтому первые факты получения соединений непостоянного состава, соединений с нарушением стехиометрических соотношений пытались объяснить недостаточной очисткой препаратов. [c.199]
Поэтому первые факты получения соединений непостоянного состава, соединений с нарушением стехиометрических соотношений пытались объяснить недостаточной очисткой препаратов. [c.199]
Поворотный этап в истории развития химической атомистики связан с именем шведского химика Иёнса Якоба Берцелиуса. Он вслед за Дальтоном внес особенно большой вклад в создание атомистической теории. Примерно о 1807 г. Берцелиус вплотную занялся определением точного элементного состава различных соединений. Проведя не одну сотню анализов, он представил столько доказательств, подтверждавших закон постоянства состава, что химики были вынуждены признать справедливость этого закона, а следовательно, и принять атомистическую теорию, которая непосредственно вытекала из закона постоянства состава. [c.61]
Расчеты технологических процссеов, в результате кото[)ы> происходит химическое изменение веш,ества, основаны на сто хиометрпческих законах законе постоянства состава и законе к р а т н (л х отношений, которые выра кают собой взаимное отношение атомов и молекул при их химическом взаимодействии друг с другом. [c.30]
[c.30]
Законы постоянства состава и кратных отношений вытекают из атомно-мо-леиулприого учения. Вещества с молекулярной структурой состоят из одинако-вмх молекул. Поэтому естественно, что состав таких веществ постоянен. При образовании из двух элементов нескольких соединений атомы этих элементов соединяются друг с другом в молекулы различного, но определенного состава. Например, молекула оксида углерода(И) построена из одного атома углерода и одного атома кислорода, а в состав молекулы диоксида углерода входит один атсм углерода и два атома кислорода. Ясно, что масса кислорода, приходящаяся па одну и ту же массу углерода, во втором из этих соедипепнй в 2 раза больше, чем в первом. [c.24]
В некоторых учебниках закон постоянства состава фО рмулируется так Состав химического со- [c.17]
И еще один пример. Наряду с соединениями постоянного состава (характеризующимися целочисленными стехио-метрическими коэффициентами), для которых справедливы законы постоянства состава и кратных отношений, существуют соединения переменного состава (многие оксиды, сульфиды, карбиды, нитриды и т. д.). Так, карбид циркония имеет состав не 2гС (в соответствии с местом элементов-партнеров в периодической системе элементов), а 2гС1—х, где X в границах области непрерывного изменения состава меняется в широких пределах, К подобным выводам можно прийти не только на основании изучения структуры, но и в результате термохимических исследований, так как в соответствии с непрерывным изменением состава будет непрерывно меняться и теплота образования таких солей. [c.29]
д.). Так, карбид циркония имеет состав не 2гС (в соответствии с местом элементов-партнеров в периодической системе элементов), а 2гС1—х, где X в границах области непрерывного изменения состава меняется в широких пределах, К подобным выводам можно прийти не только на основании изучения структуры, но и в результате термохимических исследований, так как в соответствии с непрерывным изменением состава будет непрерывно меняться и теплота образования таких солей. [c.29]
Необходимо заметить, что закон постоянства состава выполняется при условии, что образующие химическое соединение элементы мононзотопны (см. гл. I, 2) илн же имеют строго постоянный изотопный состав. Это естественно, поскольку закон постоян- TB.il состава предусматривает постоянство атомной массы любого химического элемента, что возможно только при условии строгой определенности его изотопного состава. [c.14]
Выше указывалось, что установление закона сохранения массы и закона постоянства состава позволило приписать атомам химических элементов строго определенную массу. Значения масс атомов, выраженные в обычно используемых единицах массы (абсолютная атомная масса rrijJ, очень малы, поэтому применять их в повседневной практике крайне неудобно. Например, масса атома углерода равна [c.17]
Значения масс атомов, выраженные в обычно используемых единицах массы (абсолютная атомная масса rrijJ, очень малы, поэтому применять их в повседневной практике крайне неудобно. Например, масса атома углерода равна [c.17]
Среди неорганических веществ почти 95% не имеют молекулярного строения и, следовательно, являются нестехиометрическими соединениями. Часто отклонения от стехиометрического состава так невелики, что при химическом анализе их установить не удается. (Этим и объясняется тот факт, что закон постоянства состава считали справедливым на протяжении столь долгого аремени.) Однако исследование свойств веществ, например электрической проводимости, окраски, магнитных и др., свидетельствует о наличии переменного состава. [c.107]
Таким образом, при системном подходе к веществу закон постоянства состава не выполняется, суммы компонентов лищь приближенно равны сумме частей. [c.45]
Химия (1986) — [ c.
 12
]
12
]
Неорганическая химия (1987) — [ c.0 ]
Химия для поступающих в вузы 1985 (1985) — [ c.21 ]
Химия для поступающих в вузы 1993 (1993) — [ c.22 ]
Основы общей химии (1988) — [ c.15 ]
Пособие по химии для поступающих в вузы 1972 (1972) — [ c.19 ]
Общая химия в формулах, определениях, схемах (1996) — [ c.10 ]
Общая химия в формулах, определениях, схемах (0) — [ c.10 ]
Общая химия в формулах, определениях, схемах (1985) — [ c.10 ]
Общая химия в формулах, определениях, схемах (0) — [ c.10 ]
Физика и химия в переработке нефти (1955) — [
c. 143
]
143
]
Введение в молекулярную теорию растворов (1959) — [ c.19 , c.23 ]
Курс химии Часть 1 (1972) — [ c.21 ]
Минеральные кислоты и основания часть 1 (1932) — [ c.68 ]
Общая химия и неорганическая химия издание 5 (1952) — [ c.23 ]
Курс общей химии (1964) — [ c.8 , c.9 ]
Очерк общей истории химии (1969) — [ c.437 ]
Неорганическая химия (1979) — [ c.20 ]
Неорганическая химия Издание 2 (1976) — [ c.15 , c.17 ]
Аналитическая химия (1975) — [
c. 263
]
263
]
Химия (1985) — [ c.18 ]
Строение неорганических веществ (1948) — [ c.198 , c.649 ]
Неорганическая химия (1978) — [ c.13 ]
Неорганическая химия (1950) — [ c.10 ]
Химия (1975) — [ c.10 ]
Общая химия Издание 4 (1965) — [ c.10 ]
Химия (1982) — [ c.10 ]
Основы химической термодинамики и кинетики химических реакций (1981) — [ c.41 ]
Введение в физическую химию и кристаллохимию полупроводников Издание 2 (1973) — [
c.11
,
c. 46
,
c.118
,
c.450
,
c.465
]
46
,
c.118
,
c.450
,
c.465
]
Теоретические основы общей химии (1978) — [ c.8 ]
Неорганическая химия (1994) — [ c.505 ]
Химия Издание 2 (1988) — [ c.20 ]
Введение в молекулярную теорию растворов (1956) — [ c.19 , c.23 ]
Общая химия Изд2 (2000) — [ c.14 ]
Метод физико-химического анализа в неорганическом синтезе (1975) — [ c.45 ]
Структуры неорганических веществ (1950) — [ c.19 ]
Закон постоянства состава вещества.
 Законы сохранения в химии
Законы сохранения в химииХимия относится к разряду точных наук, и наряду с математикой и физикой устанавливает закономерности существования и развития материи, состоящей из атомов и молекул. Все процессы, протекающие как в живых организмах, так и среди объектов неживой природы, имеют в своей основе явления превращения массы и энергии. Закон постоянства состава вещества, изучению которого будет посвящена эта статья, и лежит в основе протекания процессов в неорганическом и органическом мире.
Атомно-молекулярное учение
Чтобы понять суть законов, управляющих материальной действительностью, нужно иметь представление о том, из чего она состоит. По словам великого российского ученого М. В. Ломоносова «Во тьме должны пребывать физики и, особенно, химики, не зная внутреннего частиц строения». Именно он в 1741 году, сначала теоретически, а затем и подтвердив опытами, открыл законы химии, служащие основой для изучения живой и неживой материи, а именно: все вещества состоят из атомов, способных образовывать молекулы. Все эти частицы находятся в непрерывном движении.
Все эти частицы находятся в непрерывном движении.
Открытия и ошибки Дж. Дальтона
Спустя 50 лет идеи Ломоносова стал развивать английский ученый Дж. Дальтон. Ученый выполнил важнейшие расчеты по определению атомных масс химических элементов. Это послужило главным доказательством таких предположений: массу молекулы и вещества можно вычислить, зная атомный вес частиц, входящих в её состав. Как Ломоносов, так и Дальтон считали, что, независимо от способа получения, молекула соединения всегда будет иметь неизменный количественный и качественный состав. Первоначально именно в таком виде был сформулирован закон постоянства состава вещества. Признавая огромный вклад Дальтона в развитие науки, нельзя умолчать о досадных ошибках: отрицании молекулярного строения простых веществ, таких как кислород, азот, водород. Ученый считал, что молекулы есть только у сложных химических веществ. Учитывая огромный авторитет Дальтона в научных кругах, его заблуждения негативно повлияли на развитие химии.
Как взвешивают атомы и молекулы
Открытие такого химического постулата, как закон постоянства состава вещества, стало возможным благодаря представлению о сохранении массы веществ, вступивших в реакцию и образовавшихся после нее. Кроме Дальтона, измерение атомных масс проводил И. Берцелиус, составивший таблицу атомных весов химических элементов и предложивший современное их обозначение в виде латинских букв. В настоящее время массу атомов и молекул определяют с помощью углеродной нанотрубки. Результаты, полученные в данных исследованиях, подтверждают существующие законы химии. Ранее ученые использовали такой прибор, как масс-спектрометр, но усложненная методика взвешивания явилась серьёзным недостатком в спектрометрии.
Почему так важен закон сохранения массы веществ
Сформулированный М. В. Ломоносовым выше названный химический постулат доказывает тот факт, что во время реакции атомы, входящие в состав реагентов и продуктов, никуда не исчезают и не появляются из ничего. Их количество сохраняется без изменения до и после химического процесса. Так как масса атомов константна, данный факт логически приводит к закону сохранения массы и энергии. Более того, ученый декларировал эту закономерность, как всеобщий принцип природы, подтверждающий взаимопревращение энергии и постоянство состава вещества.
Их количество сохраняется без изменения до и после химического процесса. Так как масса атомов константна, данный факт логически приводит к закону сохранения массы и энергии. Более того, ученый декларировал эту закономерность, как всеобщий принцип природы, подтверждающий взаимопревращение энергии и постоянство состава вещества.
Идеи Ж. Пруста как подтверждение атомно-молекулярной теории
Обратимся к открытию такого постулата, как закон постоянства состава. Химия конца 18 – начала 19 века — наука, в рамках которой велись научные споры между двумя французскими учеными, Ж. Прустом и К. Бертолле. Первый утверждал, что состав веществ, образовавшихся в результате химической реакции, зависит главным образом от природы реагентов. Бертолле был уверен, что на состав соединений – продуктов реакции влияет еще и относительное количество взаимодействующих между собой веществ. Большинство химиков в начале исследований поддержали идеи Пруста, который сформулировал их следующим образом: состав сложного соединения всегда постоянный и не завит от того, каким способом оно было получено. Однако дальнейшее исследование жидких и твердых растворов (сплавов) подтвердило мысли К. Бертолле. К этим веществам закон постоянства состава был неприменим. Более того, он не действует для соединений с ионными кристаллическими решетками. Состав этих веществ зависит от методов, которыми их добывают.
Однако дальнейшее исследование жидких и твердых растворов (сплавов) подтвердило мысли К. Бертолле. К этим веществам закон постоянства состава был неприменим. Более того, он не действует для соединений с ионными кристаллическими решетками. Состав этих веществ зависит от методов, которыми их добывают.
Каждое химическое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав. Эта формулировка характеризует закон постоянства состава вещества, предложенный Ж. Прустом в 1808 году. В качестве доказательств он приводит следующие образные примеры: малахит из Сибири имеет такой же состав, как и минерал, добытый в Испании; в мире есть только одно вещество киноварь, и не имеет значения, из какого месторождения она получена. Таким образом Пруст подчеркивал постоянство состава вещества, независимо от места и способа его добычи.
Не бывает правил без исключений
Из закона постоянства состава следует, что при образовании сложного соединения химические элементы соединяются друг с другом в определённых весовых соотношениях.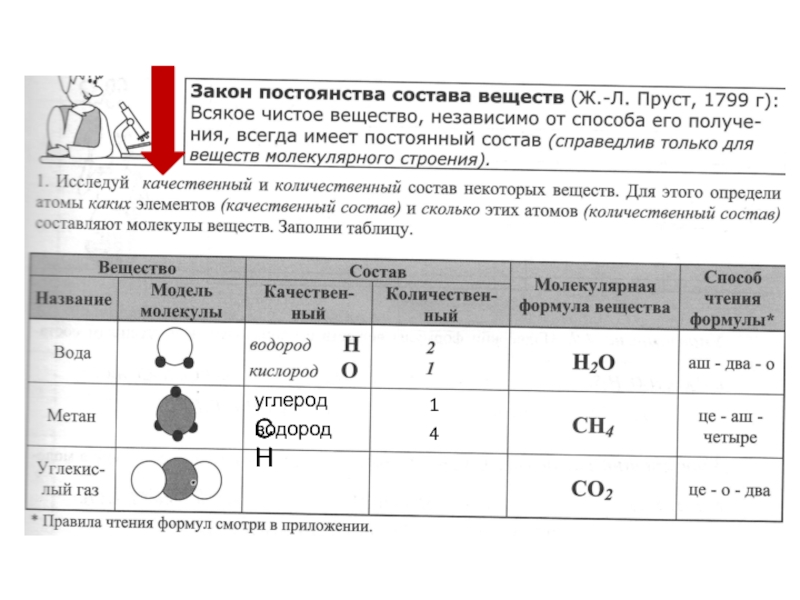 Вскоре в химической науке появились сведения о существовании веществ, имеющих переменный состав, который зависел от способа получения. Русский ученый М. Курнаков предложил назвать эти соединения бертоллидами, например оксид титана, тяжелая вода, нитрид циркония.
Вскоре в химической науке появились сведения о существовании веществ, имеющих переменный состав, который зависел от способа получения. Русский ученый М. Курнаков предложил назвать эти соединения бертоллидами, например оксид титана, тяжелая вода, нитрид циркония.
У этих веществ на 1 весовую часть одного элемента приходится различное количество другого элемента. Так, в бинарном соединении висмута с галлием на одну весовую часть галлия приходится от 1,24 до 1,82 части висмута. Позже химики установили, что, кроме соединения металлов друг с другом, вещества, не подчиняющиеся закону постоянства состава, есть в таком классе неорганических соединений, как оксиды. Бертоллиды характерны также для сульфидов, карбидов, нитридов и гидридов.
Роль изотопов
Получив в свое распоряжение закон постоянства вещества, химия как точная наука смогла увязать весовую характеристику соединения с изотопным содержанием элементов, образующих его. Вспомним, что изотопами считают атомы одного химического элемента с одинаковыми протонными, но различными нуклонными числами. Учитывая наличие изотопов, понятно, что весовой состав соединения может быть переменным при условии постоянства элементов, входящих в это вещество. Если элемент увеличивает содержание какого-либо изотопа, то и весовой состав вещества тоже изменяется. Например, обычная вода содержит 11 % водорода, а тяжелая, образованная его изотопом (дейтерием), – 20 %.
Учитывая наличие изотопов, понятно, что весовой состав соединения может быть переменным при условии постоянства элементов, входящих в это вещество. Если элемент увеличивает содержание какого-либо изотопа, то и весовой состав вещества тоже изменяется. Например, обычная вода содержит 11 % водорода, а тяжелая, образованная его изотопом (дейтерием), – 20 %.
Характеристика бертоллидов
Как мы уже выяснили ранее, законы сохранения в химии подтверждают основные положения атомно-молекулярной теории и являются абсолютно верными для веществ постоянного состава – дальтонидов. А бертоллиды имеют границы, в которых возможно изменение весовых частей элементов. Например, в оксиде четырёхвалентного титана на одну весовую часть металла приходится от 0,65 до 0,67 части кислорода. Вещества непостоянного состава не имеют молекулярного строения, их кристаллические решетки состоят из атомов. Поэтому химические формулы соединений лишь отражают границы их состава. У различных веществ они разные. Температура также может влиять на интервалы изменения весового состава элементов. Если два химических элемента образуют между собой несколько веществ – бертоллидов, то для них также неприменим и закон кратных отношений.
Если два химических элемента образуют между собой несколько веществ – бертоллидов, то для них также неприменим и закон кратных отношений.
Из всех вышеприведенных примеров сделаем вывод: теоретически в химии присутствуют две группы веществ: с постоянным и переменным составом. Наличие в природе этих соединений служит прекрасным подтверждением атомно-молекулярного учения. А вот сам закон постоянства состава уже не является доминирующим в химической науке. Зато он наглядно иллюстрирует историю её развития.
Вещества молекулярного строения закон постоянства состава. Основные законы химии
Одно и то же химическое соединение имеет постоянный состав, вне зависимости от места и способа получения образца. К такому выводу одним из первых пришел основатель современной химии, французский ученый А. де Лавуазье. Он сумел определить состав воды, воздуха, считал, что частицы входят в состав веществ в определенных пропорциях. Позже другим химиком из Франции Ж. Л. Прустом был сформулирован закон постоянства состава. Оба исследователя немало сил приложили, чтобы отстоять свои идеи в споре с научным сообществом.
Позже другим химиком из Франции Ж. Л. Прустом был сформулирован закон постоянства состава. Оба исследователя немало сил приложили, чтобы отстоять свои идеи в споре с научным сообществом.
Взгляды на строение вещества на рубеже XVIII и XIX веков
Химические элементы, соединяясь друг с другом в разных соотношениях, образуют множество веществ. Каждое из них характеризуется определенным набором атомов и соотношением их масс. Но до конца XVIII столетия многие ученые считали иначе. Проблема для них заключалась в неточности количественных методик. К тому же позиции атомно-молекулярных воззрений в то время были зыбкими, господствовала теория флогистона — мифического элемента. В установление количественного состава вещества значительный вклад внесли:
- А. де Лавуазье;
- М. В. Ломоносов;
- Ж. Л. Пруст;
- Д. Дальтон.
Заслуга Ж. Л. Пруста заключается в том, что он усовершенствовал количественные методы Лавуазье, строго им следовал. Ученый предложил закон постоянства состава, сохранения соотношений элементов в образцах соединений. Работу в этом направлении Пруст начал еще в конце XVIII века, но признание его труды получили только в 1808 году. примерно в это же время ввел представление об атомах и массах этих частиц, кратных соотношениях.
Работу в этом направлении Пруст начал еще в конце XVIII века, но признание его труды получили только в 1808 году. примерно в это же время ввел представление об атомах и массах этих частиц, кратных соотношениях.
Биография Ж. Л. Пруста
Ученый, предложивший закон постоянства состава, появился на свет 26 сентября 1754 года на западе Франции. Отец Жозефа Луи был аптекарем в городе Анже. Он и приобщил сына к опытам с Юноша продолжил обучение в Париже, где познакомился с Лавуазье и его научными идеями. В 1776 году Пруст опубликовал свои первые серьезные труды в области химии. С 1799 по 1806 год ученый руководил лабораторией в Мадриде. Во Францию Пруст вернулся в 1806 году. После краткого пребывания в Париже Жозеф Луи отправился в родные места. В 1808-1816 годах получили признание его труды в области изучения состава веществ, в том числе глюкозы. В 1817-м он вышел в отставку и жил в одиночестве до конца своих дней (1826). Пруст был одним из выдающихся ученых своего времени, Рыцарем Почетного легиона, членом наук Неаполя.
Закон постоянства состава. Примеры
Ж. Л. Пруст открыл глюкозу, прославился блестящей победой в научной полемике с соотечественником Бертолле, причиной которой стал закон постоянства состава. Формулировка, предложенная Прустом, гласит: когда несколько элементов образуют химически чистый образец, то он состоит из одних и тех же атомов. Отношения их масс и числа также носят постоянный характер. Примеры:
- Хлорид натрия (NaCl) можно получить при взаимодействии соляной кислоты с гидроксидом натрия. Второй способ — обработка соляной кислотой В двух разных химических реакциях получаем соединение, формула которого NaCl. И в первом, и во втором случае вещество содержит 39,33% натрия и 60,66% хлора.
- Кислород (химический знак O) при образовании соединяется с одним и тем же количеством водорода (H). Если взаимодействует 1,11 г водорода с 8,89 г кислорода, то образуется 10 г воды (H 2 O). Увеличение количества одного из веществ приводит к такому же результату. Не прореагируют атомы того элемента, которого взяли в избытке.
 Масса воды в этом опыте остается такой же — 10 г, состав ее молекул отражает формула H 2 O.
Масса воды в этом опыте остается такой же — 10 г, состав ее молекул отражает формула H 2 O.
Значение открытия постоянства состава
В начале XIX века в теоретической химии утвердились законы, которые соединяют вещества, описывают их соотношения. Изучали качественные и количественные характеристики многие ученые, предложившие универсальные формулировки. Основополагающими были идеи М. В. Ломоносова о сохранении массы в химических превращениях. Установленный Ж. Л. Прустом закон постоянства состава также имеет большое значение для науки и практики. На основании этой закономерности формулу воды записывают только в виде H 2 O, а состав серной кислоты — H 2 SO 4 . Но закон Пруста не имеет такого всеобъемлющего характера, как учение Ломоносова. Поэтому его формулировку уточнили после открытия изотопов. Так называют атомы одного и того же элемента, имеющие разную массу. Соотношение частиц в составе образца является постоянной величиной, но только при условии неизменного изотопного состава. Например, массовый состав водорода и кислорода в обычной и отличается. Вторая жидкость содержит изотоп водорода — дейтерий. Масса тяжелой воды больше, чем обычной.
Например, массовый состав водорода и кислорода в обычной и отличается. Вторая жидкость содержит изотоп водорода — дейтерий. Масса тяжелой воды больше, чем обычной.
Современные взгляды на состав вещества
В соответствии с формулировкой Пруста соотношение масс атомов, составляющих определенное вещество, носит постоянный характер, не зависит от способа получения образца. В начале XX столетия при изучении сплавов металлов были открыты соединения с переменным составом. В этом случае единице веса одного химического элемента могут соответствовать различные массы другого элемента. Например, в соединениях таллия с висмутом на единицу массы первого приходится от 1,2 до 1,8 единицы веса второго элемента. Такие примеры можно найти среди интерметаллических веществ, оксидов, соединений серы, азота, углерода, водорода с металлами. Следовательно, законы, открытые Прустом и Дальтоном, справедливы полностью только в отношении тех веществ, что имеют молекулярное строение. К ним относятся многие кислоты, оксиды, гидриды. Качественная и количественная структура подобных соединений является постоянной. Например, состав воды в атмосфере, Мировом океане, ледниках и живых организмах отражает формула H 2 O.
Качественная и количественная структура подобных соединений является постоянной. Например, состав воды в атмосфере, Мировом океане, ледниках и живых организмах отражает формула H 2 O.
ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
Закон сохранения массы
Закон сохранения массы можно сформулировать так:
«масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции».
Открытие данного закона приписывают М.В. Ломоносову (1748 г. и подтвержден экспериментально им самим в 1756 г.), хотя он сам не приписывал себе авторство. В зарубежной литературе открытие данного закона приписывают А. Лавуазье (1789 г.)
Данный закон верен с большой точностью для всех химических реакций, так как дефект массы несоизмеримо мал
После открытия специальной теории относительности, масса приобрела новые свойства:
1. Масса объекта зависит от его внутренней энергии. При поглощении энергии масса растет, при ее выделении масса уменьшается. Особенно ощутимо изменение массы при ядерных реакциях. При химических реакциях изменение массы пренебрежительно мало – при тепловом эффекте реакции 100 кДж/моль изменение массы составит ~10 -9 г/моль, при нагревании железного утюга на 200° его масса возрастает на величину Δm/m~10 -12
Особенно ощутимо изменение массы при ядерных реакциях. При химических реакциях изменение массы пренебрежительно мало – при тепловом эффекте реакции 100 кДж/моль изменение массы составит ~10 -9 г/моль, при нагревании железного утюга на 200° его масса возрастает на величину Δm/m~10 -12
2. Масса не является аддитивной величиной, т.е масса системы не равна сумме масс её составляющих, например аннигиляция электрона и позитрона, частиц имеющую массу покоя на фотоны, не имеющих массу покоя, масса дейтерия не равна сумме масс протона и нейтрона и т.д.
Из вышесказанного следует, что закон сохранения массы тесно связан с законом сохранения энергии, что объясняется специальной теорией относительности и выполняется с таким же ограничением — надо учитывать обмен системы энергией с внешней средой.
Закон эквивалентов
Открыт в результате химических опытов И. Рихтера в 1791-1798 гг
Первоначальная формулировка закона эквивалентов (термин «эквивалент» ввёл в 1767 г. Г. Кавендиш) была следующей: «Если одно и то же количество какой-либо кислоты нейтрализуется различными количествами двух оснований, то эти количества эквивалентны и нейтрализуются одинаковым количеством любой другой кислоты».
Г. Кавендиш) была следующей: «Если одно и то же количество какой-либо кислоты нейтрализуется различными количествами двух оснований, то эти количества эквивалентны и нейтрализуются одинаковым количеством любой другой кислоты».
Проще говоря, химические соединения взаимодействуют не в произвольных, а в строго определённых количественных соотношения.
Однако, данный закон открыл вопрос о постоянстве состава вещества. Виднейший ученный того времени Клод Луи Бертолле предложил в 1803 г. теорию химического сродства, по средствам сил притяжения и зависящего от плотности вещества и его количества. Он отстаивал предположение о том, что элементный состав вещества может изменяться в некоторых пределах в зависимости от условий, в которых оно было получено. Постоянные отношения в соединениях, по Бертолле, могут иметь место лишь в случаях, когда при образовании таких соединений произошло значительное изменение плотности и, следовательно, сил сцепления. Так, газообразные водород и кислород соединяются в воду в постоянных отношениях, потому что вода — жидкость, обладающая значительно большей плотностью, чем исходные газы. Но если изменение плотности и сцепления при образовании соединения незначительно, образуются вещества переменного состава в широких границах отношений составных частей. Границами для образования таких соединений служат состояния взаимного насыщения составных частей. Учение Бертолле, отвергающее постоянство пропорций в химических соединениях было встречено с явным недоверием несмотря на высокий научный авторитет Бертолле. Однако большинство химиков-аналитиков, в том числе таких, как Клапрот и Вокелен, не решились открыто выступить с опровержением утверждений Бертолле. Лишь один, малоизвестный в то время мадридский химик Пруст не постеснялся выступить с критикой взглядов Бертолле и указать на его экспериментальные ошибки и неправильные выводы. После появления первой критической статьи Пруста (1801 г.) Бертолле счел нужным ответить последнему, отстаивая свои положения. Завязалась интересная и исторически весьма важная полемика, продолжавшаяся несколько лет (до 1808 г.) И хотя доводы Пруста, по-видимому, не вполне убедили Бертолле, который еще в 1809 г.
Но если изменение плотности и сцепления при образовании соединения незначительно, образуются вещества переменного состава в широких границах отношений составных частей. Границами для образования таких соединений служат состояния взаимного насыщения составных частей. Учение Бертолле, отвергающее постоянство пропорций в химических соединениях было встречено с явным недоверием несмотря на высокий научный авторитет Бертолле. Однако большинство химиков-аналитиков, в том числе таких, как Клапрот и Вокелен, не решились открыто выступить с опровержением утверждений Бертолле. Лишь один, малоизвестный в то время мадридский химик Пруст не постеснялся выступить с критикой взглядов Бертолле и указать на его экспериментальные ошибки и неправильные выводы. После появления первой критической статьи Пруста (1801 г.) Бертолле счел нужным ответить последнему, отстаивая свои положения. Завязалась интересная и исторически весьма важная полемика, продолжавшаяся несколько лет (до 1808 г.) И хотя доводы Пруста, по-видимому, не вполне убедили Бертолле, который еще в 1809 г. признавал возможность существования соединений переменного состава, все химики встали на точку зрения Пруста, которому принадлежит, таким образом, заслуга экспериментального установления закона постоянства состава химических соединений.
признавал возможность существования соединений переменного состава, все химики встали на точку зрения Пруста, которому принадлежит, таким образом, заслуга экспериментального установления закона постоянства состава химических соединений.
Закон постоянства состава
Закон постоянства состава (постоянных отношений) открыл французкий ученый Жозеф Луи Пруст. И который стал одним из главных химических законов.
Закон постоянства состава — любое определенное химически чистое соединение, независимо от способа его получения, состоит из одних и тех же химических элементов, причём отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами.
Закон постоянства состава и стехиометричность соединений долгое время считались незыблемыми. Однако в начале XX в. И. С. Курнаков на основании своих исследований пришел к выводу о существовании нестехиометрических соединений, т. е. характеризующихся переменным составом. Еще Д. И. Менделеев (1886 г. ) на основе собственных наблюдений и накопившихся к тому времени многочисленных экспериментальных данных пришел к выводу, о наличие веществ с непостоянным составом и что эти соединения являются настоящими химическими соединениями, лишь находящимися в состоянии диссоциации. Н. С. Курнаков отмечал, что было бы ошибкой считать соединения переменного состава чем-то редким и исключительным. Соединения постоянного состава Н. С. Курнаков назвал дальтонидами
в честь Д. Дальтона, широко применявшего атомно-молекулярную теорию к химическим явлениям. Нестехиометрические соединения были названы в честь К. Бертолле бертоллидами.
По его представлениям, бертоллиды — это своеобразные химические соединения переменного состава, формой существования которых является не молекула, а фаза, то есть химически связанный огромный агрегат атомов. Классическая теория валентности не применима для соединений бертоллидного типа, поскольку они характеризуются переменной валентностью, изменяющейся непрерывно, а не дискретно, Перечисление синтезированных и известных соединений говорит о том, что большинство из них относятся к бертоллидному типу.
) на основе собственных наблюдений и накопившихся к тому времени многочисленных экспериментальных данных пришел к выводу, о наличие веществ с непостоянным составом и что эти соединения являются настоящими химическими соединениями, лишь находящимися в состоянии диссоциации. Н. С. Курнаков отмечал, что было бы ошибкой считать соединения переменного состава чем-то редким и исключительным. Соединения постоянного состава Н. С. Курнаков назвал дальтонидами
в честь Д. Дальтона, широко применявшего атомно-молекулярную теорию к химическим явлениям. Нестехиометрические соединения были названы в честь К. Бертолле бертоллидами.
По его представлениям, бертоллиды — это своеобразные химические соединения переменного состава, формой существования которых является не молекула, а фаза, то есть химически связанный огромный агрегат атомов. Классическая теория валентности не применима для соединений бертоллидного типа, поскольку они характеризуются переменной валентностью, изменяющейся непрерывно, а не дискретно, Перечисление синтезированных и известных соединений говорит о том, что большинство из них относятся к бертоллидному типу. В принципе любое твердое соединение, кроме веществ с молекулярной решеткой, является соединением переменного состава.
В принципе любое твердое соединение, кроме веществ с молекулярной решеткой, является соединением переменного состава.
Бертоллиды, по Курнакову, представляют собой твердые растворы неустойчивых в свободном состоянии химических соединений постоянного состава. Охарактеризовав таким образом соединения постоянного и переменного состава, Курнаков пришел к выводу, что и Пруст, и Бертолле были правы в своих утверждениях.
Однако простоты состав многих бертоллидов записывают как постоянный. Например, состав оксида железа(II) записывают в виде FeO (вместо более точной формулы Fe 1-x O).
©2015-2019 сайт
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование.
Дата создания страницы: 2017-10-25
На прошлом уроке вы познакомились с понятием массовой доли химического элемента в веществе и заметили, что эта величина не зависит от массы самого вещества. Данный урок посвящен изучению закона постоянства состава вещества. Из материалов урока вы узнаете, кто открыл этот закон.
Из материалов урока вы узнаете, кто открыл этот закон.
Тема: Первоначальные химические представления
Урок: Постоянство состава вещества
Ученые XVII-XVIII вв. проводили множество количественных измерений, в т.ч. по определению элемента в веществе. Но результаты их опытов были неточными, и как следствие, не совпадали.
Французский химик Клод Луи Бертолле пытался доказать, что состав веществ зависит от пропорций, в которых находятся реагирующие вещества.
Рис. 1. Клод Луи Бертолле
В отличие от него другой французский химик Жозеф Луи Пруст провел много экспериментов по исследованию состава различных веществ и сделал вывод о постоянстве состава вещества.
Рис. 2. Жозеф Луи Пруст
В 1808 г. Пруст сформулировал закон постоянства состава веществ : «Вещества имеют постоянный состав независимо от способа и места их получения».
В своей работе «Исследование меди» в 1799 г. Пруст показал, что природный карбонат меди и карбонат меди, полученный химиками в лаборатории, имеют один и тот же состав.
Ничем не различаются вода, текущая из нашего крана, вода из родника, или вода, полученная синтетическим путем (имеется в виду состав — воды, а не состав смеси). Вода всегда будет содержать по массе 11,1 % водорода и 88,9 % кислорода.
Но природа гораздо разнообразнее, чем любая теория, созданная человеком. И из закона постоянства состава веществ есть исключения. В XX веке было обнаружено, что некоторые соединения не имеют постоянного состава.
Таким образом, нельзя сказать, что Клод Бертолле был абсолютно неправ. Закон постоянства состава веществ имеет ограничения.
Вещества, имеющие переменный состав существуют, их назвали в честь Бертолле — бертоллидами.
Бертоллиды — соединения переменного состава, не подчиняющиеся законам постоянных и кратных отношений. Бертоллиды являются нестехиометрическими бинарными соединениями переменного состава, который зависит от способа получения. Многочисленные случаи образования бертоллидов открыты в металлических системах, а также среди оксидов, сульфидов, карбидов, гидридов и др. Например, оксид ванадия(II) может иметь в зависимости от условий получения, состав от V 0,9 до V 1,3 .
Например, оксид ванадия(II) может иметь в зависимости от условий получения, состав от V 0,9 до V 1,3 .
1. Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. — М.: АСТ: Астрель, 2006. (с. 25-28)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.21-23)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§9)
4. Химия: неорг. химия: учеб. для 8 кл. общеобр. учреждений / Г.Е. Рудзитис, ФюГю Фельдман. — М.: Просвещение, ОАО «Московские учебники», 2009. (§§10,14)
5. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. — М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов ().
Единая коллекция цифровых образовательных ресурсов ().
2. Электронная версия журнала «Химия и жизнь» ().
Домашнее задание
с. 22-23 №№ 3,7 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
Химия относится к разряду точных наук, и наряду с математикой и физикой устанавливает закономерности существования и развития материи, состоящей из атомов и молекул. Все процессы, протекающие как в живых организмах, так и среди объектов неживой природы, имеют в своей основе явления превращения массы и энергии. вещества, изучению которого будет посвящена эта статья, и лежит в основе протекания процессов в неорганическом и органическом мире.
Атомно-молекулярное учение
Чтобы понять суть законов, управляющих материальной действительностью, нужно иметь представление о том, из чего она состоит. По словам великого российского ученого М. В. Ломоносова «Во тьме должны пребывать физики и, особенно, химики, не зная внутреннего частиц строения». Именно он в 1741 году, сначала теоретически, а затем и подтвердив опытами, открыл законы химии, служащие основой для изучения живой и неживой материи, а именно: все вещества состоят из атомов, способных образовывать молекулы. Все эти частицы находятся в непрерывном движении.
По словам великого российского ученого М. В. Ломоносова «Во тьме должны пребывать физики и, особенно, химики, не зная внутреннего частиц строения». Именно он в 1741 году, сначала теоретически, а затем и подтвердив опытами, открыл законы химии, служащие основой для изучения живой и неживой материи, а именно: все вещества состоят из атомов, способных образовывать молекулы. Все эти частицы находятся в непрерывном движении.
Открытия и ошибки Дж. Дальтона
Спустя 50 лет идеи Ломоносова стал развивать английский ученый Дж. Дальтон. Ученый выполнил важнейшие расчеты по определению атомных масс химических элементов. Это послужило главным доказательством таких предположений: массу молекулы и вещества можно вычислить, зная атомный вес частиц, входящих в её состав. Как Ломоносов, так и Дальтон считали, что, независимо от способа получения, молекула соединения всегда будет иметь неизменный количественный и качественный состав. Первоначально именно в таком виде был сформулирован закон постоянства состава вещества. Признавая огромный вклад Дальтона в развитие науки, нельзя умолчать о досадных ошибках: отрицании молекулярного строения простых веществ, таких как кислород, азот, водород. Ученый считал, что молекулы есть только у сложных Учитывая огромный авторитет Дальтона в научных кругах, его заблуждения негативно повлияли на развитие химии.
Признавая огромный вклад Дальтона в развитие науки, нельзя умолчать о досадных ошибках: отрицании молекулярного строения простых веществ, таких как кислород, азот, водород. Ученый считал, что молекулы есть только у сложных Учитывая огромный авторитет Дальтона в научных кругах, его заблуждения негативно повлияли на развитие химии.
Как взвешивают атомы и молекулы
Открытие такого химического постулата, как закон постоянства состава вещества, стало возможным благодаря представлению о сохранении массы веществ, вступивших в реакцию и образовавшихся после нее. Кроме Дальтона, измерение атомных масс проводил И. Берцелиус, составивший таблицу атомных весов химических элементов и предложивший современное их обозначение в виде латинских букв. В настоящее время массу атомов и молекул определяют с помощью Результаты, полученные в данных исследованиях, подтверждают существующие законы химии. Ранее ученые использовали такой прибор, как масс-спектрометр, но усложненная методика взвешивания явилась серьёзным недостатком в спектрометрии.
Почему так важен закон сохранения массы веществ
Сформулированный М. В. Ломоносовым выше названный химический постулат доказывает тот факт, что во время реакции атомы, входящие в состав реагентов и продуктов, никуда не исчезают и не появляются из ничего. Их количество сохраняется без изменения до и после Так как масса атомов константна, данный факт логически приводит к закону сохранения массы и энергии. Более того, ученый декларировал эту закономерность, как всеобщий принцип природы, подтверждающий взаимопревращение энергии и постоянство состава вещества.
Идеи Ж. Пруста как подтверждение атомно-молекулярной теории
Обратимся к открытию такого постулата, как закон постоянства состава. Химия конца 18 — начала 19 века — наука, в рамках которой велись научные споры между двумя французскими учеными, Ж. Прустом и К. Бертолле. Первый утверждал, что состав веществ, образовавшихся в результате химической реакции, зависит главным образом от природы реагентов. Бертолле был уверен, что на состав соединений — продуктов реакции влияет еще и относительное количество взаимодействующих между собой веществ. Большинство химиков в начале исследований поддержали идеи Пруста, который сформулировал их следующим образом: состав сложного соединения всегда постоянный и не завит от того, каким способом оно было получено. Однако дальнейшее исследование жидких и твердых растворов (сплавов) подтвердило мысли К. Бертолле. К этим веществам закон постоянства состава был неприменим. Более того, он не действует для соединений с ионными кристаллическими решетками. Состав этих веществ зависит от методов, которыми их добывают.
Большинство химиков в начале исследований поддержали идеи Пруста, который сформулировал их следующим образом: состав сложного соединения всегда постоянный и не завит от того, каким способом оно было получено. Однако дальнейшее исследование жидких и твердых растворов (сплавов) подтвердило мысли К. Бертолле. К этим веществам закон постоянства состава был неприменим. Более того, он не действует для соединений с ионными кристаллическими решетками. Состав этих веществ зависит от методов, которыми их добывают.
Каждое химическое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав. Эта формулировка характеризует закон постоянства состава вещества, предложенный Ж. Прустом в 1808 году. В качестве доказательств он приводит следующие образные примеры: малахит из Сибири имеет такой же состав, как и минерал, добытый в Испании; в мире есть только одно вещество киноварь, и не имеет значения, из какого месторождения она получена. Таким образом Пруст подчеркивал постоянство состава вещества, независимо от места и способа его добычи.
Не бывает правил без исключений
Из закона постоянства состава следует, что при образовании сложного соединения химические элементы соединяются друг с другом в определённых весовых соотношениях. Вскоре в химической науке появились сведения о существовании веществ, имеющих переменный состав, который зависел от способа получения. Русский ученый М. Курнаков предложил назвать эти соединения бертоллидами, например оксид титана, нитрид циркония.
У этих веществ на 1 весовую часть одного элемента приходится различное количество другого элемента. Так, в бинарном соединении висмута с галлием на одну весовую часть галлия приходится от 1,24 до 1,82 части висмута. Позже химики установили, что, кроме соединения металлов друг с другом, вещества, не подчиняющиеся закону постоянства состава, есть в таком как оксиды. Бертоллиды характерны также для сульфидов, карбидов, нитридов и гидридов.
Роль изотопов
Получив в свое распоряжение закон постоянства вещества, химия как точная наука смогла увязать весовую характеристику соединения с изотопным содержанием элементов, образующих его. Вспомним, что изотопами считают атомы одного химического элемента с одинаковыми протонными, но различными нуклонными числами. Учитывая наличие изотопов, понятно, что весовой состав соединения может быть переменным при условии постоянства элементов, входящих в это вещество. Если элемент увеличивает содержание какого-либо изотопа, то и весовой состав вещества тоже изменяется. Например, обычная вода содержит 11 % водорода, а тяжелая, образованная его изотопом (дейтерием), — 20 %.
Вспомним, что изотопами считают атомы одного химического элемента с одинаковыми протонными, но различными нуклонными числами. Учитывая наличие изотопов, понятно, что весовой состав соединения может быть переменным при условии постоянства элементов, входящих в это вещество. Если элемент увеличивает содержание какого-либо изотопа, то и весовой состав вещества тоже изменяется. Например, обычная вода содержит 11 % водорода, а тяжелая, образованная его изотопом (дейтерием), — 20 %.
Характеристика бертоллидов
Как мы уже выяснили ранее, законы сохранения в химии подтверждают основные положения атомно-молекулярной теории и являются абсолютно верными для веществ постоянного состава — дальтонидов. А бертоллиды имеют границы, в которых возможно изменение весовых частей элементов. Например, в оксиде четырёхвалентного титана на одну весовую часть металла приходится от 0,65 до 0,67 части кислорода. Вещества непостоянного состава не их кристаллические решетки состоят из атомов. Поэтому химические формулы соединений лишь отражают границы их состава. У различных веществ они разные. Температура также может влиять на интервалы изменения весового состава элементов. Если два химических элемента образуют между собой несколько веществ — бертоллидов, то для них также неприменим и закон кратных отношений.
У различных веществ они разные. Температура также может влиять на интервалы изменения весового состава элементов. Если два химических элемента образуют между собой несколько веществ — бертоллидов, то для них также неприменим и закон кратных отношений.
Из всех вышеприведенных примеров сделаем вывод: теоретически в химии присутствуют две группы веществ: с постоянным и переменным составом. Наличие в природе этих соединений служит прекрасным подтверждением атомно-молекулярного учения. А вот сам закон постоянства состава уже не является доминирующим в химической науке. Зато он наглядно иллюстрирует историю её развития.
Закон постоянства состава впервые сформулировал французский ученый-химик Жозеф Луи Пруст 1801 году. Этот закон утвердился в полемике Пруста с французским химиком Клодом Луи Бертолле. Последний считал, что направление химической реакции (состав ее продуктов) зависит не только от природы взаимодействующих веществ, но и от их относительных количеств. Абсолютизируя результаты своих экспериментальных исследований химических равновесий, он утверждал, что все вещества имеют переменный состав, который может меняться непрерывно от одного компонента к другому: например, оксиды получаются постепенным насыщением металла кислородом. В то же время Пруст, используя значительно более точные методы анализа, показал, что на самом деле таких непрерывных переходов нет. На примере карбоната меди, оксидов олова и сурьмы, сульфидов железа в разных степенях окисления, а также других веществ он доказал определенность составов соединений вне зависимости от способов их получения. Пруст писал: «От одного полюса земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь». Итак закон постоянства состава звучит следующим образом: «Качественный и количественный состав сложного вещества не зависит от способа его получения».
В то же время Пруст, используя значительно более точные методы анализа, показал, что на самом деле таких непрерывных переходов нет. На примере карбоната меди, оксидов олова и сурьмы, сульфидов железа в разных степенях окисления, а также других веществ он доказал определенность составов соединений вне зависимости от способов их получения. Пруст писал: «От одного полюса земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь». Итак закон постоянства состава звучит следующим образом: «Качественный и количественный состав сложного вещества не зависит от способа его получения».
Исследуя химико-аналитически оксиды азота и углерода, этилен и метан, водородные соединения азота и фосфора, некоторый другие вещества, Дальтон в 1803 году установил закон кратных отношений: «Если два элемента образуют друг с другом несколько химических соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как небольшие целые числа». Иными словами весовые отношения простых веществ, образующих сложное вещество, выражаются целыми числами типа 1:2:3… Закон кратных отношений, целочисленные отношения эквивалентных масс имели естественным выводом, что молекулы состоят из нескольких неделимых частиц — «атомов». Отсюда появилась возможность определения относительных атомных масс. Джон Дальтон ввел в химию и сам термин «атом» как мельчайшую частицу химического элемента. Атомы различных элементов, по Дальтону, имеют разную массу и тем отличаются друг от друга.
Иными словами весовые отношения простых веществ, образующих сложное вещество, выражаются целыми числами типа 1:2:3… Закон кратных отношений, целочисленные отношения эквивалентных масс имели естественным выводом, что молекулы состоят из нескольких неделимых частиц — «атомов». Отсюда появилась возможность определения относительных атомных масс. Джон Дальтон ввел в химию и сам термин «атом» как мельчайшую частицу химического элемента. Атомы различных элементов, по Дальтону, имеют разную массу и тем отличаются друг от друга.
Французский ученый Жозеф Луи Гей-Люссак в 1802 году установил, что объем газа при постоянном давлении увеличивается пропорционально температуре. Позднее он вывел еще один закон: давление газа в замкнутом объеме пропорционально температуре. Свойства газов в конце XVIII — начале XIX века исследовали многие ученые. Еще до Гей-Люссака зависимость между объемом газа и температурой изучал французский физик Жак Александр Сезар Шарль. Но он вовремя не опубликовал полученные им данные, а Гей-Люссак же четко сформулировал закон, который в России называют законом Гей-Люссака, а в Англии и США — законом Шарля..jpg) А закон зависимости давления газа от абсолютной температуры наоборот в России известен под именем закона Шарля, а в Англии и США — как закон Гей-Люссака. Часто эти законы называют соответственно первым и вторым законами Гей-Люссака. В 1808 году Гей-Люссак совместно с немецким естествоиспытателем Александром Гумбольдтом сформулировал закон объемных отношений: «объемы вступающих в реакцию газов, находящихся при одинаковых условиях, относятся как целые числа». Например, 2 объема водорода соединяются с 1 объемом кислорода, давая 2 объема водяного пара. Сейчас мы записали бы стехиометрическое уравнение так: 2H 2 +O 2 =2H 2 O. Но в начале XVIII века еще не было разграничения понятия атома и молекулы. Гей-Люссак ничего не говорил о том, в виде каких частиц участвуют в реакциях те или иные газы.
А закон зависимости давления газа от абсолютной температуры наоборот в России известен под именем закона Шарля, а в Англии и США — как закон Гей-Люссака. Часто эти законы называют соответственно первым и вторым законами Гей-Люссака. В 1808 году Гей-Люссак совместно с немецким естествоиспытателем Александром Гумбольдтом сформулировал закон объемных отношений: «объемы вступающих в реакцию газов, находящихся при одинаковых условиях, относятся как целые числа». Например, 2 объема водорода соединяются с 1 объемом кислорода, давая 2 объема водяного пара. Сейчас мы записали бы стехиометрическое уравнение так: 2H 2 +O 2 =2H 2 O. Но в начале XVIII века еще не было разграничения понятия атома и молекулы. Гей-Люссак ничего не говорил о том, в виде каких частиц участвуют в реакциях те или иные газы.
Закон постоянства состава
Каждая чистое вещество независимо от места и способа ее добычи имеет постоянный состав.
Например, вода состоит из атомов водорода и кислорода, причем массовая доля атомов водорода в воде составляет 11,1%, а кислорода — 88,9%. И независимо от места добычи чистая вода — речная, дождевая или морская, полученная из Арктического или Антарктического льда, — будет иметь одинаковый качественный и количественный состав.
И независимо от места добычи чистая вода — речная, дождевая или морская, полученная из Арктического или Антарктического льда, — будет иметь одинаковый качественный и количественный состав.
Закон постоянства состава сформулировал в 1799 году французский ученый Жозеф Луи Пруст. Свое открытие Пруст сделал, опираясь на результаты количественного анализа оксидов, сульфидов и хлоридов металлов. Вследствие проведенного весового анализа оксигенових соединений Фе-рума, меди, олова, ртути и Плюмбу-м он установил, что металлы, которые отвечают этим элементам (железо, медь, олово, ртуть, свинец), соединяются с кислородом всегда в одинаковых пропорциях . В этих же работах он показал, что природный меди карбонат и меди карбонат, полученный химиком в лаборатории, имеют тот же постоянный состав и цвет. Так же ничем не отличается меди оксид, полученный из малахита и полученный в результате взаимодействия меди с кислородом.
Противоположных взглядов придерживался его соотечественник Клод Бертолле, который утверждал, что состав химических соединений может изменяться в зависимости от условий их получения.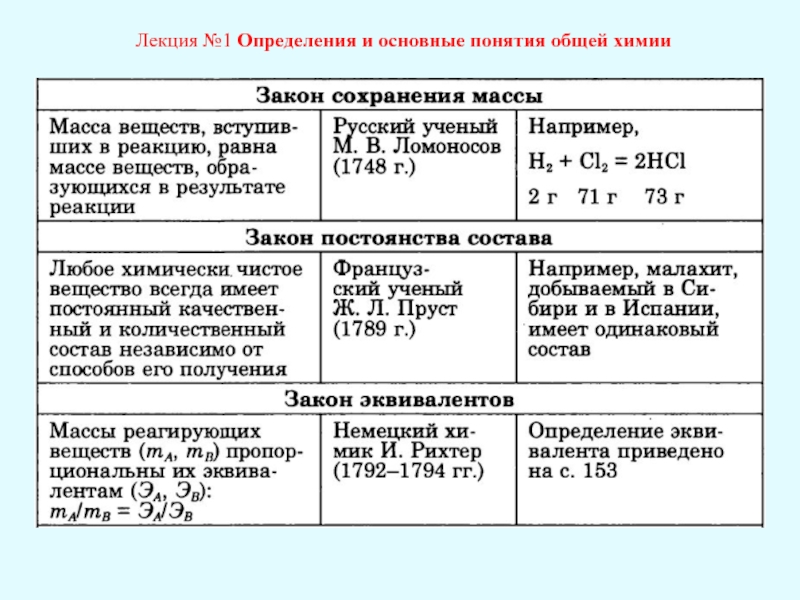 Он доказывал, что на прохождение химических реакций влияет масса, летучесть, растворимость, упругость и т.д.. Началась научная полемика, длившаяся несколько лет.
Он доказывал, что на прохождение химических реакций влияет масса, летучесть, растворимость, упругость и т.д.. Началась научная полемика, длившаяся несколько лет.
В то же время в полемике принял участие английский ученый Джон Дальтон. После убедительных доказательств Пруста и Дальтона взгляды Пруста были поддержаны лучшими химиками того времени, а позиции Бертолле признаны ошибочными. Закон постоянства состава позволил установить количественные соотношения атомов химических элементов в соединениях и стал основой определения атомных масс элементов. Сейчас закон постоянства состава воспринимают как обычную вещь, однако в то время открытия этого закона было прорывом в развитии химии как науки и стало одним из существенных доказательств атомно-молекулярного учения.
Однако идеи Бертолле получили новое толкование в ХХ веке, когда были открыты многочисленные соединения переменного состава, к которым принадлежали некоторые оксиды, сульфиды, нитриды и т.д.. После этого открытия по предложению русского химика Н. С. Курнакова соединения с постоянным составом были названы Дальтониды, а с переменным — бертоллиды. Состав Дальтониды выражают с помощью простых формул целочисленными индексами, например: h3O, SO2, C2H6. А состав бертоллиды меняется и не соответствует стехиометрическим соотношением. Например, состав ванадий (П) оксида обычно выражают с помощью формулы VO, хотя на самом деле его состав может изменяться в пределах от VO0 9 до VO13. При взаимодействии циркония с азотом образуется цирконий нитрид. Помимо состава ZrN, является нитриды ZrN0 59, ZrN0 69, ZrN0, 74, ZrN0, 89
С. Курнакова соединения с постоянным составом были названы Дальтониды, а с переменным — бертоллиды. Состав Дальтониды выражают с помощью простых формул целочисленными индексами, например: h3O, SO2, C2H6. А состав бертоллиды меняется и не соответствует стехиометрическим соотношением. Например, состав ванадий (П) оксида обычно выражают с помощью формулы VO, хотя на самом деле его состав может изменяться в пределах от VO0 9 до VO13. При взаимодействии циркония с азотом образуется цирконий нитрид. Помимо состава ZrN, является нитриды ZrN0 59, ZrN0 69, ZrN0, 74, ZrN0, 89
В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение: состав соединений молекулярной структуры является постоянным независимо от способа добывания Состав соединений с немолекулярного структурой (атомной, ионной или металлической) не является постоянным и зависит от условий добычи.
Закон сохранения массы веществ.
 Закон сохранения энергии. Закон постоянства состава
Закон сохранения энергии. Закон постоянства состава
I. Закон сохранения массы вещества
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. (М.В.Ломоносов, 1748 г)
Подтвердить правильность закона сохранения массы веществ можно с помощью следующего опыта. В первом сосуде Ландольта подготовим растворы йодида калия и нитрата свинца. Во втором сосуде – пройдет реакция хлорида железа с роданидом калия. Плотно закрываем пробки. Уравновешиваем чашки весов. Сохранится ли равновесие после окончания реакций? В первом сосуде выпадает желтый осадок йодида свинца, во втором образуется темно-красный роданид трехвалентного железа. В сосудах Ландольта произошли химические реакции: образовались новые вещества. Но равновесие не нарушилось. Масса исходных веществ всегда равна массе продуктов реакции.
Но равновесие не нарушилось. Масса исходных веществ всегда равна массе продуктов реакции.
Рис. Эксперимент, подтверждающий правильность закона сохранения массы веществ
Опыты, иллюстрирующие закон сохранения массы веществ
Приведем пример еще одного опыта, доказывающего правильность закона сохранения массы веществ в химических реакциях. Внутри колбы при закрытой пробке будет гореть свеча. Уравновесим весы. Подожжем свечу и опустим ее в колбу. Плотно закроем колбу пробкой. Горение свечи – это химический процесс. Израсходовав находящийся в колбе кислород, свеча гаснет, химическая реакция завершается. Но равновесие весов не нарушается: масса продуктов реакции остается такой же, какой была масса исходных веществ.
Рис. Эксперимент с горящей свечой в колбе
Открытие закона сохранения массы веществ имело огромное значение для дальнейшего развития химии. На основании закона сохранения массы веществ производят важнейшие расчеты и составляют уравнения химических реакций.
На основании закона сохранения массы веществ производят важнейшие расчеты и составляют уравнения химических реакций.
2H2 + O2 = 2H2O
m(H2) + m(O2) = m(H2O)
(2∙2г/моль) + (1∙32г/моль) = (2∙18г/моль)
II. Закон постоянства состава вещества
1. Открытие закона постоянства состава веществ
Ученые XVII-XVIII вв. проводили множество количественных измерений, в т.ч. по определению массовой доли элемента в веществе. Но результаты их опытов были неточными, и как следствие, не совпадали.
Французский химик Клод Луи Бертолле пытался доказать, что состав веществ зависит от пропорций, в которых находятся реагирующие вещества.
Рис. Клод Луи Бертолле
В отличие от него другой французский химик Жозеф Луи Пруст провел много экспериментов по исследованию состава различных веществ и сделал вывод о постоянстве состава вещества.
Рис. Жозеф Луи Пруст
В 1808 г. Пруст сформулировал закон постоянства состава веществ: «Вещества имеют постоянный состав независимо от способа и места их получения».
2. Суть закона
В своей работе «Исследование меди» в 1799 г. Пруст показал, что природный карбонат меди и карбонат меди, полученный химиками в лаборатории, имеют один и тот же состав.
Ничем не различаются вода, текущая из нашего крана, вода из родника, или вода, полученная синтетическим путем (имеется в виду состав чистого вещества – воды, а не состав смеси). Вода всегда будет содержать по массе 11,1 % водорода и 88,9 % кислорода.
Но природа гораздо разнообразнее, чем любая теория, созданная человеком. И из закона постоянства состава веществ есть исключения. В XX веке было обнаружено, что некоторые соединения не имеют постоянного состава.
3. Ограниченность закона
Таким образом, нельзя сказать, что Клод Бертолле был абсолютно неправ. Закон постоянства состава веществ имеет ограничения.
Вещества, имеющие переменный состав существуют, их назвали в честь Бертолле – бертоллидами.
Бертоллиды — соединения переменного состава, не подчиняющиеся законам постоянных и кратных отношений. Бертоллиды являются нестехиометрическими бинарными соединениями переменного состава, который зависит от способа получения. Многочисленные случаи образования бертоллидов открыты в металлических системах, а также среди оксидов, сульфидов, карбидов, гидридов и др. Например, оксид ванадия(II) может иметь в зависимости от условий получения, состав от V0,9 до V1,3.
Следует помнить!
- Закон строго применим только к соединениям с молекулярной структурой (Дальтонидам).
 Соединения с немолекулярной структурой (Бертоллиды) часто имеют переменный состав.
Соединения с немолекулярной структурой (Бертоллиды) часто имеют переменный состав. - Обратное утверждение, что определённому составу отвечает определённое соединение, неверно. Так, диметиловый эфир и этиловый спирт имеют одинаковый количественный и качественный состав, но это разные вещества.
III. Закон Авогадро
В равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. (1811 г)
Cледствия из закона Авогадро:
1 следствие:
Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объём.
Так, 6,02 ∙ 1023 молекул (1 моль) любого газа и любой смеси газов при н.у. занимает объём равный 22,4 л.
2 следствие:
Отношение объёмов реагирующих веществ, измеренных при одинаковых условиях, равно отношению стехиометрических коэффициентов, т. е. равно отношению количеств этих веществ.
е. равно отношению количеств этих веществ.
V1:V2:V3 = ν1:ν2:ν3
H2 + Cl2 = 2HCl
V(H2):V(Cl2):V(HCl) = ν(H2):ν(Cl2):ν(HCl) = 1 : 1 : 2
3 следствие:
Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их плотностей (1).
Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их молярных масс (поскольку в равных объёмах газов при одинаковых условиях содержится одинаковое число молекул и, следовательно, одинаковое число молей) (2).
Это отношение называется относительной плотностью одного газа по другому (3)
D – показывает во сколько раз один газ тяжелее или легче другого и является безразмерной величиной.
Например, (4)
IV. Закон объёмных отношений
При неизменных температуре и давлении объёмы, вступающих в реакцию газов, относятся друг к другу, а также к объёмам образующихся газообразных продуктов, как небольшие целые числа. (Ж.Гей-Люссак, 1805 г)
Химия — 7
тельными атомными массами элементов можно прийти к выводу, что молекула воды состоит из двух атомов водорода и одного атома кислорода. Состав воды и других химических соединений независимо от способа их получения и места нахождения всегда остается постоянным. Данный закон был открыт в 1799 году французским химиком Ж.Л.Прустом. В настоящее время закон постоянства состава веществ выражается следующим образом:
Данный закон был открыт в 1799 году французским химиком Ж.Л.Прустом. В настоящее время закон постоянства состава веществ выражается следующим образом:
Независимо от способа получения, состав и свойства химических соединений молекулярного строения всегда постоянны.
Данный закон о постоянстве и неизменности состава и свойств веществ с молекулярным строением является одним из основных законов химии. Для большинства химических соединений немолекулярного строения закон постоянства состава не подходит.
Как известно, не все вещества имеют молекулярное строение. Целая группа веществ состоит из атомов и ионов. Как же составляются химические формулы этих веществ?
Химические формулы веществ с немолекулярным строением составляются на основе соотношения частиц элементов (атомов или ионов) в соединениях. Для определения этого соотношения выясняется, сколько частиц другого элемента окружает (соединяется) частицу элемента в кристалле вещества немолекулярного строения. Исследования физическими методами строения кристаллов вещества позволяют получить такие сведения.
Исследования физическими методами строения кристаллов вещества позволяют получить такие сведения.
Как известно, в кварце количественное соотношение между атомами кремния и кислорода составляет 1:2. Значит, его формулу можно представить в виде: SiO2. В хлориде алюминия соотношение между ионами алюминия и хлора — 1:3. Следовательно, его формула — АlСl3.
Пользуясь краткими названиями химических элементов из таблицы 3, можно прочитать формулы:
CO2 — це — o — 2;
H2O — аш — 2 — o;
CH4 — це — аш — 4;
SiO2 — силиций — o — 2;
AlCl3 — алюминий — хлор — 3;
P2O5 — пэ — 2 — o — 5 и т.д.
Закон постоянства состава: формулировка, примеры, значение
Одно и то же химическое соединение имеет постоянный состав, независимо от места и способа получения пробы. К такому выводу одним из первых пришел основоположник современной химии французский ученый А. де Лавуазье. Он умел определять состав воды, воздуха, органических веществ, считал, что частицы входят в состав веществ в определенных пропорциях. Позднее другой ученый из Франции Ж.Л. Пруст сформулировал закон постоянства композиции. Оба исследователя упорно трудились, чтобы защитить свои идеи в споре с научным сообществом.
де Лавуазье. Он умел определять состав воды, воздуха, органических веществ, считал, что частицы входят в состав веществ в определенных пропорциях. Позднее другой ученый из Франции Ж.Л. Пруст сформулировал закон постоянства композиции. Оба исследователя упорно трудились, чтобы защитить свои идеи в споре с научным сообществом.
Взгляды на строение вещества на рубеже XVIII-XIX вв.
Химические элементы, соединяясь друг с другом в различных соотношениях, образуют совокупность веществ. Каждый из них характеризуется определенным набором атомов и соотношением их масс. Но до конца XVIII века многие ученые считали иначе.Проблемой для них была неточность количественных методов. Кроме того, позиции атомно-молекулярных воззрений в то время были шаткими, господствовала теория флогистона — мифического элемента. При определении количественного состава вещества значительный вклад внесли:
- А. де Лавуазье;
- М.В. Ломоносова;
- Дж. Л. Пруст;
- Д. Далтон.

Заслуга Ж. Л. Пруста в том, что он усовершенствовал количественные методы Лавуазье, неукоснительно им следовал.Ученый предложил закон постоянства состава, сохранения соотношений элементов в образцах соединений. Пруст начал свою работу в этом направлении в конце 18 века, но признание его работы получили только в 1808 году. Примерно в то же время Джон Дальтон ввел представление об атомах и массах этих частиц, кратных отношениях.
Биография Ж. Л. Пруста
Ученый, предложивший закон постоянства состава, родился 26 сентября 1754 года на западе Франции.Отец Жозефа Луи был аптекарем в Анже. Он также познакомил своего сына с экспериментами с химическими веществами. Молодой человек продолжил обучение в Париже, где познакомился с Лавуазье и его научными идеями. В 1776 году Пруст опубликовал свои первые серьезные работы в области химии. С 1799 по 1806 год ученый возглавлял лабораторию в Мадриде. Во Францию Пруст вернулся в 1806 году. После недолгого пребывания в Париже Жозеф-Луи отправился в родные места. В 1808-1816 годах получили признание его работы в области изучения состава веществ, в том числе и глюкозы.В 1817 вышел в отставку и жил один до конца своих дней (1826). Пруст был одним из выдающихся ученых своего времени, кавалером ордена Почетного легиона, членом Королевской академии наук Неаполя.
В 1808-1816 годах получили признание его работы в области изучения состава веществ, в том числе и глюкозы.В 1817 вышел в отставку и жил один до конца своих дней (1826). Пруст был одним из выдающихся ученых своего времени, кавалером ордена Почетного легиона, членом Королевской академии наук Неаполя. Закон постоянства состава. Примеры
Ж. Л. Пруст открыл глюкозу, прославился блестящей победой в научной полемике с соотечественником Бертолле, причиной которой стал закон постоянства состава. Формулировка, предложенная Прустом, гласит: когда несколько элементов образуют химически чистый образец, он состоит из одних и тех же атомов.Отношения между их массами и числами также постоянны. Примеры:
- Хлорид натрия (NaCl) можно получить взаимодействием соляной кислоты с гидроксидом натрия. Второй способ – обработка карбоната натрия соляной кислотой. В двух различных химических реакциях мы получаем соединение, формула которого NaCl. В обоих случаях вещество содержит 39,33% натрия и 60,66% хлора.
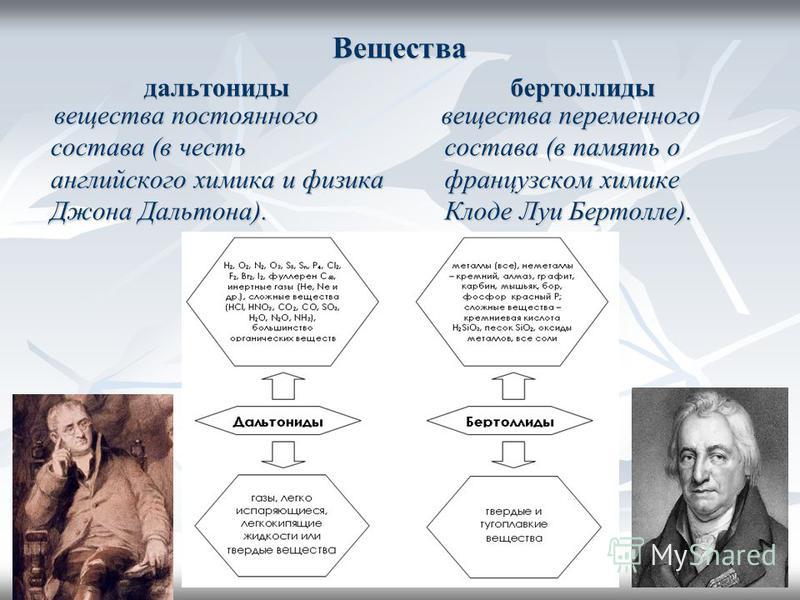
- Кислород (химический знак О) при образовании молекулы воды соединяется с таким же количеством водорода (Н).При взаимодействии 1,11 г водорода с 8,89 г кислорода образуется 10 г воды (H 2 O). К такому же результату приводит увеличение количества одного из веществ. Атомы элемента, взятого в избытке, вступать в реакцию не будут. Масса воды в этом опыте остается прежней — 10 г, состав ее молекул отражает формулу Н 2 О.
Значение открытия постоянства состава
В начале XIX в. века в теоретической химии были установлены законы, связывающие вещества, описывающие их отношения.Качественные и количественные характеристики изучались многими учеными, которые предлагали универсальные рецептуры. Основополагающими были идеи М. В. Ломоносова о сохранении массы при химических превращениях. Закон постоянства композиции, установленный Ж. Л. Прустом, также имеет большое значение для науки и практики. На основании этой закономерности формула воды записывается только в виде Н 2 О, а состав серной кислоты — Н 2 SO 4 . Но закон Пруста не имеет такого всеобъемлющего характера, как учение Ломоносова. Поэтому его формулировка была уточнена после открытия изотопов. Так называют атомы одного и того же элемента, имеющие разную массу. Соотношение частиц в составе пробы постоянно, но только при условии неизменности изотопного состава. Например, массовый состав водорода и кислорода в обычной и тяжелой воде различен. Вторая жидкость содержит изотоп водорода-дейтерий.Масса тяжелой воды больше обычной.
Но закон Пруста не имеет такого всеобъемлющего характера, как учение Ломоносова. Поэтому его формулировка была уточнена после открытия изотопов. Так называют атомы одного и того же элемента, имеющие разную массу. Соотношение частиц в составе пробы постоянно, но только при условии неизменности изотопного состава. Например, массовый состав водорода и кислорода в обычной и тяжелой воде различен. Вторая жидкость содержит изотоп водорода-дейтерий.Масса тяжелой воды больше обычной.
Современные взгляды на состав вещества
В соответствии с формулировкой Пруста, отношение масс атомов, входящих в состав определенного вещества, носит постоянный характер, не зависящий от способа получения образца. В начале 20 века при исследовании металлических сплавов были обнаружены соединения переменного состава. При этом единице веса одного химического элемента могут соответствовать разные веса другого элемента.Например, в соединениях таллия с висмутом на единицу массы первого приходится от 1,2 до 1,8 единицы массы второго элемента. Такие примеры можно найти среди интерметаллических веществ, оксидов, соединений серы, азота, углерода, водорода с металлами. Следовательно, открытые Прустом и Дальтоном законы справедливы только в отношении тех веществ, которые имеют молекулярное строение. К ним относятся многие кислоты, оксиды, гидриды. Качественный и количественный состав таких соединений постоянен.Например, состав воды в атмосфере, океанах, ледниках и живых организмах отражает формула Н 2 О.
Такие примеры можно найти среди интерметаллических веществ, оксидов, соединений серы, азота, углерода, водорода с металлами. Следовательно, открытые Прустом и Дальтоном законы справедливы только в отношении тех веществ, которые имеют молекулярное строение. К ним относятся многие кислоты, оксиды, гидриды. Качественный и количественный состав таких соединений постоянен.Например, состав воды в атмосфере, океанах, ледниках и живых организмах отражает формула Н 2 О.
Вещества молекулярного строения, закон постоянства состава. Основные законы химии
Одно и то же химическое соединение имеет постоянный состав, независимо от места и способа получения пробы. Одним из первых к такому выводу пришел основоположник современной химии французский ученый А.де Лавуазье. Он умел определять состав воды, воздуха, считал, что частицы входят в состав веществ в определенных пропорциях. Позднее другой химик из Франции Ж. Л. Пруст сформулировал закон постоянства состава. Оба исследователя приложили немало усилий, чтобы отстоять свои идеи в споре с научным сообществом.
Л. Пруст сформулировал закон постоянства состава. Оба исследователя приложили немало усилий, чтобы отстоять свои идеи в споре с научным сообществом.
Взгляды на строение вещества на рубеже 18-19 веков
Химические элементы, соединяясь друг с другом в различных соотношениях, образуют многие вещества.Каждый из них характеризуется определенным набором атомов и соотношением их масс. Но до конца 18 века многие ученые думали иначе. Проблемой для них была неточность количественных методов. Кроме того, позиции атомистических и молекулярных воззрений в то время были зыбкими, господствовала теория о флогистоне, мифическом элементе. Существенный вклад в установление количественного состава вещества внесли:
- А.де Лавуазье;
- Ломоносов М.В.;
- Дж. Л. Пруст;
- Д. Далтон.
Заслуга Ж. Л. Пруста состоит в том, что он усовершенствовал количественные методы Лавуазье и строго следовал им. Ученый предложил закон постоянства состава, сохранения соотношений элементов в образцах соединений. Пруст начал работу в этом направлении в конце 18 века, но признание его работы получили лишь в 1808 году. Примерно в это же время были введены понятия атомов и масс этих частиц, кратных соотношениям.
Пруст начал работу в этом направлении в конце 18 века, но признание его работы получили лишь в 1808 году. Примерно в это же время были введены понятия атомов и масс этих частиц, кратных соотношениям.
Биография Ж. Л. Пруста
Ученый, предложивший закон постоянства состава, родился 26 сентября 1754 года на западе Франции. Отец Жозефа Луи был фармацевтом в городе Анже. Именно он познакомил сына с экспериментами с Юношей и продолжил обучение в Париже, где познакомился с Лавуазье и его научными идеями. В 1776 году Пруст опубликовал свою первую серьезную работу в области химии. С 1799 по 1806 год ученый руководил лабораторией в Мадриде.Пруст вернулся во Францию в 1806 году. После недолгого пребывания в Париже Жозеф Луи отправился в родные места. В 1808-1816 годах получили признание его работы в области изучения состава веществ, в том числе и глюкозы. В 1817 вышел в отставку и жил один до конца своих дней (1826). Пруст был одним из выдающихся ученых своего времени, кавалером ордена Почетного легиона, членом Неаполитанского совета наук.
Закон постоянства состава. Примеры
Ж. Л. Пруст открыл глюкозу, прославился блестящей победой в научной полемике со своим соотечественником Бертолле, причиной которой стал закон постоянства состава.Формулировка, предложенная Прустом, гласит: когда несколько элементов образуют химически чистый образец, то он состоит из одинаковых атомов. Отношения их масс и чисел также постоянны. Примеры:
- Хлорид натрия (NaCl) можно получить путем взаимодействия соляной кислоты с гидроксидом натрия. Второй способ – обработка соляной кислотой. В двух различных химических реакциях мы получаем соединение, формула которого – NaCl. И в первом, и во втором случае вещество содержит 39.33% натрия и 60,66% хлора.
- Кислород (химический символ O) при образовании соединяется с таким же количеством водорода (H). Если 1,11 г водорода прореагируют с 8,89 г кислорода, то образуется 10 г воды (H 2 O). К такому же результату приводит увеличение количества одного из веществ. Атомы элемента, взятые в избытке, не будут реагировать.
 Масса воды в этом эксперименте осталась прежней — 10 г, состав ее молекул отражает формула H 2 O.
Масса воды в этом эксперименте осталась прежней — 10 г, состав ее молекул отражает формула H 2 O.
Значение открытия постоянства состава
В начале 19 века в теоретической химии были установлены законы, связывающие вещества и описывающие их отношения.Качественные и количественные характеристики изучались многими учеными, которые предлагали универсальные рецептуры. Основными были идеи М. В. Ломоносова о сохранении массы при химических превращениях. Закон постоянства композиции, установленный Ж. Л. Прустом, также имеет большое значение для науки и практики. Исходя из этой закономерности, формула воды записывается только в виде H 2 O, а состав серной кислоты – H 2 SO 4. Но закон Пруста не так исчерпывающ, как закон Ломоносова.Поэтому его формулировка была уточнена после открытия изотопов. Так называются атомы одного и того же элемента, имеющие разную массу. Соотношение частиц в составе пробы является постоянной величиной, но только при условии постоянного изотопного состава. Например, массовый состав водорода и кислорода в обычном и различном. Вторая жидкость содержит изотоп водорода, дейтерий. Масса тяжелой воды больше массы обычной воды.
Например, массовый состав водорода и кислорода в обычном и различном. Вторая жидкость содержит изотоп водорода, дейтерий. Масса тяжелой воды больше массы обычной воды.
Современные представления о составе вещества
В соответствии с формулировкой Пруста отношение масс атомов, входящих в состав определенного вещества, постоянно и не зависит от способа получения образца.В начале 20 века при исследовании металлических сплавов были обнаружены соединения с переменным составом. При этом единице веса одного химического элемента могут соответствовать разные массы другого элемента. Например, в соединениях таллия с висмутом на единицу массы первого приходится от 1,2 до 1,8 единиц массы второго элемента. Такие примеры можно найти среди интерметаллических веществ, оксидов, соединений серы, азота, углерода, водорода с металлами.Следовательно, открытые Прустом и Дальтоном законы полностью справедливы только для тех веществ, которые имеют молекулярное строение. К ним относятся многие кислоты, оксиды, гидриды. Качественный и количественный состав таких соединений постоянен. Например, состав воды в атмосфере, Мировом океане, ледниках и живых организмах отражается формулой H 2 O.
Качественный и количественный состав таких соединений постоянен. Например, состав воды в атмосфере, Мировом океане, ледниках и живых организмах отражается формулой H 2 O.
ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
Закон сохранения массы
Закон сохранения массы можно сформулировать так:
«масса веществ, вступающих в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.»
Открытие этого закона приписывается М.В. Ломоносова (1748 г. и подтверждено им экспериментально в 1756 г.), хотя сам авторства себе не приписывал. В зарубежной литературе открытие этого закона приписывается А. Лавуазье (1789)
Этот закон с большой точностью верен для всех химических реакций, так как дефект массы несоизмеримо мал
После открытия специальной теории относительности масса приобрела новые свойства:
1.Масса объекта зависит от его внутренней энергии. Когда энергия поглощается, масса увеличивается; при высвобождении энергии масса уменьшается. Особенно заметно изменение массы при ядерных реакциях. В химических реакциях изменение массы пренебрежимо мало — при тепловом эффекте реакции 100 кДж/моль изменение массы составит ~ 10 -9 г/моль, при нагревании железного железа на 200° его масса увеличивается на Δm/m ~ 10 -12
Особенно заметно изменение массы при ядерных реакциях. В химических реакциях изменение массы пренебрежимо мало — при тепловом эффекте реакции 100 кДж/моль изменение массы составит ~ 10 -9 г/моль, при нагревании железного железа на 200° его масса увеличивается на Δm/m ~ 10 -12
2. Масса не является аддитивной величиной, т.е.е. масса системы не равна сумме масс ее компонентов, например, аннигиляция электрона и позитрона, частиц, имеющих массу покоя, в фотоны, не имеющие массы покоя, масса дейтерия равна не равный сумме масс протона и нейтрона и т. д. d.
Из вышеизложенного следует, что закон сохранения массы тесно связан с законом сохранения энергии, который объясняется специальной теорией относительности и выполняется с тем же ограничением — необходимо учитывать обмен энергией между системой и окружающей средой.
Закон эквивалентов
Обнаружен в результате химических опытов И. Рихтера в 1791-1798 гг.
Первоначальная формулировка закона эквивалентов (термин «эквивалент» введен в 1767 г. Г. Кавендишем) была следующей: «Если одно и то же количество какой-либо кислоты нейтрализуется разными количествами двух оснований, то эти количества эквивалентны и нейтрализуется таким же количеством любой другой кислоты».
Г. Кавендишем) была следующей: «Если одно и то же количество какой-либо кислоты нейтрализуется разными количествами двух оснований, то эти количества эквивалентны и нейтрализуется таким же количеством любой другой кислоты».
Проще говоря, химические соединения взаимодействуют не в произвольных, а в строго определенных количественных соотношениях.
Однако этот закон открыл вопрос о постоянстве состава материи. Крупнейший ученый того времени Клод Луи Бертолле предложил в 1803 году теорию химического сродства, посредством сил притяжения и зависящего от плотности вещества и его количества. Он отстаивал предположение, что элементный состав вещества может изменяться в определенных пределах в зависимости от условий, при которых оно было получено. Постоянные отношения в соединениях, по Бертолле, могут иметь место только в тех случаях, когда при образовании таких соединений произошло значительное изменение плотности и, следовательно, сил сцепления.Так, газообразные водород и кислород соединяются в воду в постоянных соотношениях, потому что вода — это жидкость с гораздо большей плотностью, чем исходные газы. Но если изменение плотности и сцепления при образовании соединения незначительно, то вещества переменного состава образуются в широком диапазоне соотношений составных частей. Границами образования таких соединений являются состояния взаимного насыщения составных частей. Учение Бертолле, отвергающее постоянство пропорций в химических соединениях, было встречено с явным недоверием, несмотря на высокий научный авторитет Бертолле.Однако большинство химиков-аналитиков, в том числе такие, как Клапрот и Воклен, не осмеливались открыто опровергать утверждения Бертолле. Только один малоизвестный в то время мадридский химик Пруст не стеснялся критиковать взгляды Бертолле и указывать на его экспериментальные ошибки и неверные выводы. После появления первой критической статьи Пруста (1801 г.) Бертолле счел необходимым ответить на последнюю, защищая свою позицию. Завязалась интересная и исторически очень важная полемика, длившаяся несколько лет (до 1808 г.).И хотя доводы Пруста, по-видимому, не вполне убедили Бертолле, еще в 1809 г.
Но если изменение плотности и сцепления при образовании соединения незначительно, то вещества переменного состава образуются в широком диапазоне соотношений составных частей. Границами образования таких соединений являются состояния взаимного насыщения составных частей. Учение Бертолле, отвергающее постоянство пропорций в химических соединениях, было встречено с явным недоверием, несмотря на высокий научный авторитет Бертолле.Однако большинство химиков-аналитиков, в том числе такие, как Клапрот и Воклен, не осмеливались открыто опровергать утверждения Бертолле. Только один малоизвестный в то время мадридский химик Пруст не стеснялся критиковать взгляды Бертолле и указывать на его экспериментальные ошибки и неверные выводы. После появления первой критической статьи Пруста (1801 г.) Бертолле счел необходимым ответить на последнюю, защищая свою позицию. Завязалась интересная и исторически очень важная полемика, длившаяся несколько лет (до 1808 г.).И хотя доводы Пруста, по-видимому, не вполне убедили Бертолле, еще в 1809 г. Закон постоянства состава химических соединений.
Закон постоянства состава химических соединений.
Закон постоянства состава
Закон постоянства состава (постоянных отношений) был открыт французским ученым Жозефом Луи Прустом.И который стал одним из основных химических законов.
Закон постоянства состава — любое определенное химически чистое соединение, независимо от способа его получения, состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числа.
Закон постоянства состава и стехиометричности соединений долгое время считался незыблемым. Однако в начале ХХ в.И. С. Курнаков на основании своих исследований пришел к выводу о существовании нестехиометрических соединений, т. е. характеризующихся переменным составом. Еще Д. И. Менделеев (1886 г.) на основании собственных наблюдений и многочисленных экспериментальных данных, накопленных к тому времени, пришел к выводу, что существуют вещества с переменным составом и что эти соединения являются настоящими химическими соединениями, только в состоянии диссоциации . Н. С. Курнаков отмечал, что было бы ошибкой считать соединения переменного состава чем-то редким и исключительным.Соединения постоянного состава Н. С. Курнаков назвал дальтонидов в честь Д. Дальтона, широко применившего атомно-молекулярную теорию к химическим явлениям. Нестехиометрические соединения были названы в честь C. Berthollet berthollids. По его мнению, бертоллиды представляют собой своеобразные химические соединения переменного состава, формой существования которых является не молекула, а фаза, т. е. химически связанная огромная совокупность атомов. Классическая теория валентности неприменима к соединениям бертоллидного типа, так как для них характерна переменная валентность, меняющаяся непрерывно, а не дискретно.Перечень синтезированных и известных соединений свидетельствует о том, что большинство из них относится к бертоллидному типу. В принципе любое твердое соединение, кроме веществ с молекулярной решеткой, является соединением переменного состава.
Н. С. Курнаков отмечал, что было бы ошибкой считать соединения переменного состава чем-то редким и исключительным.Соединения постоянного состава Н. С. Курнаков назвал дальтонидов в честь Д. Дальтона, широко применившего атомно-молекулярную теорию к химическим явлениям. Нестехиометрические соединения были названы в честь C. Berthollet berthollids. По его мнению, бертоллиды представляют собой своеобразные химические соединения переменного состава, формой существования которых является не молекула, а фаза, т. е. химически связанная огромная совокупность атомов. Классическая теория валентности неприменима к соединениям бертоллидного типа, так как для них характерна переменная валентность, меняющаяся непрерывно, а не дискретно.Перечень синтезированных и известных соединений свидетельствует о том, что большинство из них относится к бертоллидному типу. В принципе любое твердое соединение, кроме веществ с молекулярной решеткой, является соединением переменного состава.
Бертоллиды, по Курнакову, представляют собой твердые растворы химических соединений постоянного состава, неустойчивых в свободном состоянии. Охарактеризовав таким образом соединения постоянного и переменного состава, Курнаков пришел к выводу, что и Пруст, и Бертолле были правы в своих утверждениях.
Охарактеризовав таким образом соединения постоянного и переменного состава, Курнаков пришел к выводу, что и Пруст, и Бертолле были правы в своих утверждениях.
Однако простота состава многих бертоллидов фиксируется как постоянная. Например, состав оксида железа(II) записывается как FeO (вместо более точной формулы Fe 1-x O).
©2015-2019 сайт
Все права принадлежат их авторам. Этот сайт не претендует на авторство, а предоставляет бесплатное использование.
Дата создания страницы: 25.10.2017
На прошлом уроке вы познакомились с понятием массовой доли химического элемента в веществе и заметили, что эта величина не зависит от массы самого вещества.Этот урок посвящен изучению закона постоянства состава вещества. Из материалов урока вы узнаете, кто открыл этот закон.
Тема: Первоначальные химические идеи
Урок: Постоянство состава вещества
Ученые XVII-XVIII вв. было проведено множество количественных измерений, в т. ч. по определению элемента в веществе. Но результаты их экспериментов были неточными и, как следствие, не совпадали.
ч. по определению элемента в веществе. Но результаты их экспериментов были неточными и, как следствие, не совпадали.
Французский химик Клод Луи Бертолле пытался доказать, что состав веществ зависит от пропорций, в которых находятся реагенты.
Рис. 1. Клод Луи Бертолле
Напротив, другой французский химик, Жозеф Луи Пруст, провел множество экспериментов по изучению состава различных веществ и пришел к выводу, что состав вещества постоянен.
Рис. 2. Жозеф Луи Пруст
В 1808 году Пруст сформулировал закон постоянства состава вещества : « Вещества имеют постоянный состав, независимо от способа и места их получения.
В своем исследовании меди в 1799 году Пруст показал, что природный карбонат меди и карбонат меди, полученный химиками в лаборатории, имеют одинаковый состав.
Нет никакой разницы между водой, текущей из нашего крана, водой из родника или водой, полученной синтетическим путем (имеется в виду состав воды, а не состав смеси). Вода всегда будет содержать 11,1% водорода и 88,9% кислорода по массе.
Вода всегда будет содержать 11,1% водорода и 88,9% кислорода по массе.
Но природа гораздо разнообразнее любой теории, созданной человеком.И есть исключения из закона постоянства состава веществ. В 20 веке было обнаружено, что некоторые соединения не имеют постоянного состава.
Таким образом, нельзя сказать, что Клод Бертолле был абсолютно не прав. Закон постоянства состава веществ имеет ограничения.
Существуют вещества с переменным составом, они были названы в честь Бертолле — бертоллиды.
Бертоллиды – соединения переменного состава, не подчиняющиеся законам постоянных и кратных соотношений.Бертоллиды представляют собой нестехиометрические бинарные соединения переменного состава, который зависит от способа получения. Обнаружены многочисленные случаи образования бертоллидов в металлических системах, а также среди оксидов, сульфидов, карбидов, гидридов и др. Например, оксид ванадия(II) может иметь, в зависимости от условий получения, состав от V 0,9 до В 1,3.
1. Сборник задач и упражнений по химии: 8 класс: к учебнику П.А. Оржековский и др.«Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегель. — М.: АСТ: Астрель, 2006. (с. 25-28)
2. Ушакова О.В. Рабочая тетрадь по химии: 8 класс: к учебнику П.А. Оржековский и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. изд. проф. П.А. Оржековский — М.: АСТ: Астрель: Профиздат, 2006. (с. 21-23)
3. Химия: 8 класс: учеб. для общеобразовательных учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005. (§9)
4. Химия: неорг. химия: учеб. на 8 кл. общеобразовательные учреждения / Г.Э. Рудзитис, ФуГью Фельдман. — М.: Просвещение, ОАО «Московские учебники», 2009. (§§10,14)
5. Энциклопедия для детей. Том 17. Химия / Глава. под редакцией В.А. Володин, ведущий. научное изд. И. Леенсон. — М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов ().
2. Электронная версия журнала «Химия и жизнь» ().
Домашнее задание
с. 22-23 №№ 3,7 из Рабочей тетради по химии: 8 класс: к учебнику П.А. Оржековский и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. изд. проф. П.А. Оржековский — М.: АСТ: Астрель: Профиздат, 2006.
Химия относится к разряду точных наук и, наряду с математикой и физикой, устанавливает законы существования и развития материи, состоящей из атомов и молекул.Все процессы, происходящие как в живых организмах, так и среди объектов неживой природы, основаны на явлениях превращения массы и энергии. вещество, изучению которого будет посвящена данная статья, и лежит в основе протекания процессов в неорганическом и органическом мире.
Атомно-молекулярное учение
Чтобы понять суть законов, управляющих материальной реальностью, нужно иметь представление о том, из чего она состоит. По мнению великого русского ученого М.В. Ломоносов, «Физики и, особенно, химики должны оставаться во тьме, не зная внутренних частиц строения». Именно он в 1741 г. сначала теоретически, а затем подтвержденный опытами открыл законы химии, служащие основой для изучения живой и неживой материи, а именно: все вещества состоят из атомов, способных образовывать молекулы. Все эти частицы находятся в постоянном движении.
Именно он в 1741 г. сначала теоретически, а затем подтвержденный опытами открыл законы химии, служащие основой для изучения живой и неживой материи, а именно: все вещества состоят из атомов, способных образовывать молекулы. Все эти частицы находятся в постоянном движении.
Открытия и ошибки Дж. Дальтона
Спустя 50 лет английский ученый Дж.Дальтон стал развивать идеи Ломоносова. Ученый выполнил важнейшие расчеты по определению атомных масс химических элементов. Это послужило главным доказательством таких предположений: массу молекулы и вещества можно вычислить, зная атомный вес частиц, входящих в его состав. И Ломоносов, и Дальтон считали, что независимо от способа получения молекула соединения всегда будет иметь неизменный количественный и качественный состав.Первоначально именно в такой форме был сформулирован закон постоянства состава вещества. Признавая огромный вклад Дальтона в развитие науки, нельзя умолчать о досадных ошибках: отрицании молекулярного строения таких простых веществ, как кислород, азот, водород. Ученый считал, что молекулы есть только у сложных молекул. Учитывая огромный авторитет Дальтона в научных кругах, его заблуждения отрицательно сказались на развитии химии.
Ученый считал, что молекулы есть только у сложных молекул. Учитывая огромный авторитет Дальтона в научных кругах, его заблуждения отрицательно сказались на развитии химии.
Как взвешивают атомы и молекулы
Открытие такого химического постулата, как закон постоянства состава вещества, стало возможным благодаря понятию сохранения массы веществ, вступивших в реакцию и образовались после нее. Помимо Дальтона измерением атомных масс занимался И. Берцелиус, составивший таблицу атомных весов химических элементов и предложивший их современное обозначение в виде латинских букв.В настоящее время массу атомов и молекул определяют с помощью результатов, полученных в этих исследованиях, подтверждающих существующие законы химии. Раньше ученые пользовались таким прибором, как масс-спектрометр, но сложная техника взвешивания была серьезным недостатком спектрометрии.
Почему важен закон сохранения массы?
Вышеупомянутый химический постулат, сформулированный М. В. Ломоносовым, доказывает тот факт, что в ходе реакции атомы, входящие в состав реагентов и продуктов, никуда не исчезают и не возникают из ничего.Их количество остается неизменным до и после. Так как масса атомов постоянна, то этот факт логически приводит к закону сохранения массы и энергии. Более того, ученый провозгласил эту закономерность универсальным принципом природы, подтверждающим взаимопревращение энергии и постоянство состава материи.
В. Ломоносовым, доказывает тот факт, что в ходе реакции атомы, входящие в состав реагентов и продуктов, никуда не исчезают и не возникают из ничего.Их количество остается неизменным до и после. Так как масса атомов постоянна, то этот факт логически приводит к закону сохранения массы и энергии. Более того, ученый провозгласил эту закономерность универсальным принципом природы, подтверждающим взаимопревращение энергии и постоянство состава материи.
Идеи Дж. Пруста как подтверждение атомно-молекулярной теории
Обратимся к открытию такого постулата, как закон постоянства состава.Химия конца 18 — начала 19 века — это наука, в которой велись научные споры между двумя французскими учеными, Ж. Прустом и Ш. Бертолле. Первые утверждали, что состав веществ, образующихся в результате химической реакции, зависит главным образом от природы реагентов. Бертолле был уверен, что на состав соединений — продуктов реакции влияет и относительное количество взаимодействующих веществ. Большинство химиков в начале исследований поддерживали идеи Пруста, который сформулировал их следующим образом: состав сложного соединения всегда постоянен и не зависит от того, каким способом оно было получено. Однако дальнейшее изучение жидких и твердых растворов (сплавов) подтвердило идеи К. Бертолле. К этим веществам был неприменим закон постоянства состава. Более того, он не работает для соединений с ионными кристаллическими решетками. Состав этих веществ зависит от способов их добычи.
Однако дальнейшее изучение жидких и твердых растворов (сплавов) подтвердило идеи К. Бертолле. К этим веществам был неприменим закон постоянства состава. Более того, он не работает для соединений с ионными кристаллическими решетками. Состав этих веществ зависит от способов их добычи.
Каждое химическое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав. Эта формулировка характеризует закон постоянства состава вещества, предложенный Дж.Прустом в 1808 г. В качестве доказательства он приводит следующие образные примеры: малахит из Сибири имеет тот же состав, что и минерал, добываемый в Испании; в мире есть только одно киноварное вещество, и неважно, из какого месторождения оно получено. Таким образом, Пруст подчеркивал постоянство состава материи независимо от места и способа ее добычи.
Правил без исключений не бывает
Из закона постоянства состава следует, что при образовании комплексного соединения химические элементы соединяются друг с другом в определенных весовых соотношениях. Вскоре в химической науке появились сведения о существовании веществ с переменным составом, который зависел от способа получения. Русский ученый М. Курнаков предложил называть эти соединения бертоллидами, например, оксид титана, нитрид циркония.
Вскоре в химической науке появились сведения о существовании веществ с переменным составом, который зависел от способа получения. Русский ученый М. Курнаков предложил называть эти соединения бертоллидами, например, оксид титана, нитрид циркония.
Эти вещества имеют разное количество другого элемента на 1 весовую часть одного элемента. Так, в бинарном соединении висмута с галлием на одну весовую часть галлия приходится от 1.24 на 1,82 части висмута. Позднее химики установили, что, помимо соединения металлов друг с другом, существуют вещества, не подчиняющиеся закону постоянства состава, например оксиды. Бертоллиды характерны также для сульфидов, карбидов, нитридов и гидридов.
Роль изотопов
Имея в своем распоряжении закон постоянства вещества, химия как точная наука смогла связать весовую характеристику соединения с изотопным содержанием образующих его элементов.Напомним, что атомы одного и того же химического элемента с одним и тем же протоном, но с разным числом нуклонов считаются изотопами. При наличии изотопов понятно, что весовой состав соединения может быть переменным при условии, что элементы, входящие в состав этого вещества, постоянны. Если элемент увеличивает содержание какого-либо изотопа, то меняется и весовой состав вещества. Например, обычная вода содержит 11 % водорода, а тяжелая вода, образованная его изотопом (дейтерием), содержит 20 %.
При наличии изотопов понятно, что весовой состав соединения может быть переменным при условии, что элементы, входящие в состав этого вещества, постоянны. Если элемент увеличивает содержание какого-либо изотопа, то меняется и весовой состав вещества. Например, обычная вода содержит 11 % водорода, а тяжелая вода, образованная его изотопом (дейтерием), содержит 20 %.
Характеристика бертоллидов
Как мы выяснили ранее, законы сохранения в химии подтверждают основные положения атомно-молекулярной теории и абсолютно справедливы для веществ постоянного состава — дальтонидов. А бертоллиды имеют границы, в которых возможно изменение весовых частей элементов. Например, в оксиде четырехвалентного титана на одну весовую часть металла приходится от 0,65 до 0,67 частей кислорода. Вещества переменного состава не состоят из атомов в своих кристаллических решетках.Поэтому химические формулы соединений лишь отражают границы их состава. Они различны для разных веществ. Температура также может влиять на интервалы изменения весового состава элементов. Если два химических элемента образуют между собой несколько веществ — бертоллидов, то к ним также неприменим закон кратных отношений.
Если два химических элемента образуют между собой несколько веществ — бертоллидов, то к ним также неприменим закон кратных отношений.
Из всех приведенных примеров делаем вывод: теоретически в химии есть две группы веществ: с постоянным и переменным составом.Наличие этих соединений в природе является прекрасным подтверждением атомно-молекулярной теории. Но сам закон постоянства состава уже не является господствующим в химической науке. Но он наглядно иллюстрирует историю его развития.
Закон постоянства состава был впервые сформулирован французским химиком Жозефом Луи Прустом в 1801 году. Этот закон был установлен в полемике Пруста с французским химиком Клодом Луи Бертолле. Последние считали, что направление химической реакции (состав ее продуктов) зависит не только от природы взаимодействующих веществ, но и от их относительных количеств.Абсолютизируя результаты своих экспериментальных исследований химических равновесий, он утверждал, что все вещества имеют переменный состав, который может непрерывно меняться от одного компонента к другому: например, оксиды получаются при постепенном насыщении металла кислородом.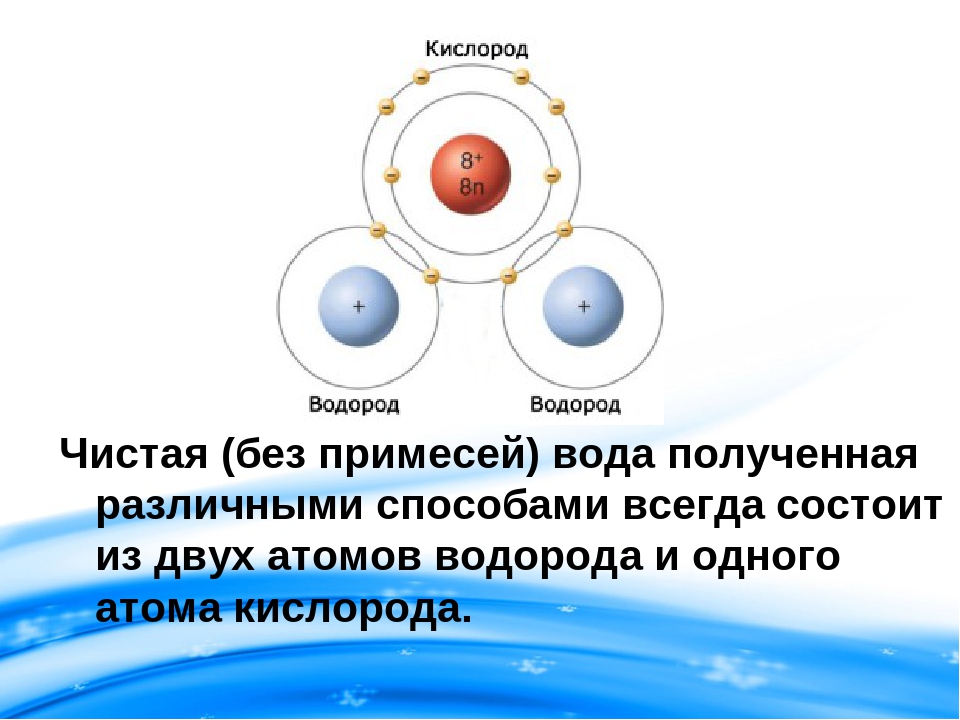 В то же время Пруст с помощью гораздо более точных методов анализа показал, что на самом деле таких непрерывных переходов не существует. На примере карбоната меди, оксидов олова и сурьмы, сульфидов железа в различных степенях окисления, а также других веществ он доказал достоверность составов соединений независимо от способов их получения.Пруст писал: «От одного полюса земли до другого соединения имеют одинаковый состав и одни и те же свойства. Нет никакой разницы между оксидом железа из Южного полушария и Северного полушария. Малахит из Сибири имеет тот же состав, что и малахит из Испании. Во всем мире есть только одна киноварь. Итак, закон постоянства состава заключается в следующем: «Качественный и количественный состав сложного вещества не зависит от способа его получения.»
В то же время Пруст с помощью гораздо более точных методов анализа показал, что на самом деле таких непрерывных переходов не существует. На примере карбоната меди, оксидов олова и сурьмы, сульфидов железа в различных степенях окисления, а также других веществ он доказал достоверность составов соединений независимо от способов их получения.Пруст писал: «От одного полюса земли до другого соединения имеют одинаковый состав и одни и те же свойства. Нет никакой разницы между оксидом железа из Южного полушария и Северного полушария. Малахит из Сибири имеет тот же состав, что и малахит из Испании. Во всем мире есть только одна киноварь. Итак, закон постоянства состава заключается в следующем: «Качественный и количественный состав сложного вещества не зависит от способа его получения.»
Исследуя химико-аналитические оксиды азота и углерода, этилена и метана, водородные соединения азота и фосфора и некоторые другие вещества, Дальтон в 1803 г. установил закон кратных отношений: «Если два элемента образуют друг с другом несколько химических соединений, то при этом масса одного из них равна таким массам другого, которые относятся друг к другу как малые целые числа.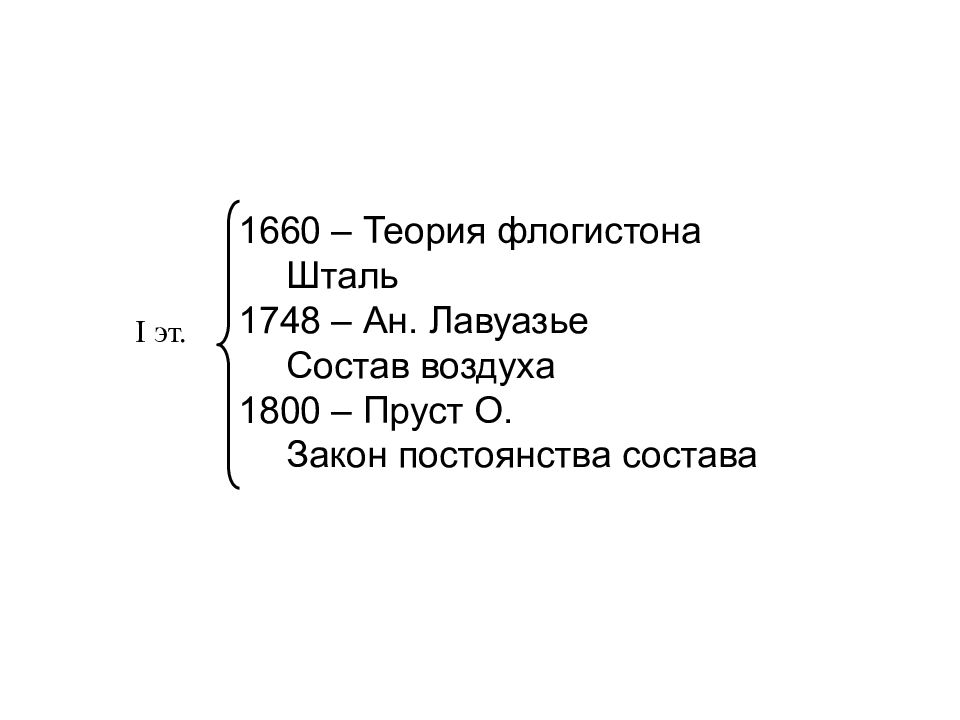 Другими словами, весовые соотношения простых веществ, образующих сложное вещество, выражаются целыми числами, например 1:2:3…Закон кратных отношений, целочисленных отношений эквивалентных масс имел естественный вывод о том, что молекулы состоят из нескольких неделимых частиц – «атомов». Отсюда стало возможным определение относительных атомных масс. Джон Дальтон ввел в химию термин «атом» как мельчайшую частицу химического элемента. Атомы разных элементов, по Дальтону, имеют разную массу и тем самым отличаются друг от друга.
Другими словами, весовые соотношения простых веществ, образующих сложное вещество, выражаются целыми числами, например 1:2:3…Закон кратных отношений, целочисленных отношений эквивалентных масс имел естественный вывод о том, что молекулы состоят из нескольких неделимых частиц – «атомов». Отсюда стало возможным определение относительных атомных масс. Джон Дальтон ввел в химию термин «атом» как мельчайшую частицу химического элемента. Атомы разных элементов, по Дальтону, имеют разную массу и тем самым отличаются друг от друга.
Французский ученый Жозеф Луи Гей-Люссак установил в 1802 году, что объем газа при постоянном давлении увеличивается пропорционально температуре.Позже он вывел другой закон: давление газа в замкнутом объеме пропорционально температуре. Свойства газов в конце 18 — начале 19 века изучались многими учеными. Еще до Гей-Люссака связь между объемом газа и температурой изучал французский физик Жак Александр Сезар Шарль. Но он не опубликовал вовремя полученные им данные, и Гей-Люссак четко сформулировал закон, который в России называется законом Гей-Люссака, а в Англии и США — законом Шарля. А закон зависимости давления газа от абсолютной температуры, наоборот, в России известен под названием закона Шарля, а в Англии и США — как закон Гей-Люссака. Эти законы часто называют первым и вторым законами Гей-Люссака соответственно. В 1808 г. Гей-Люссак совместно с немецким естествоиспытателем Александром Гумбольдтом сформулировал закон объемных отношений: «объемы реагирующих газов при одних и тех же условиях относятся как целые числа». Например, 2 объема водорода соединяются с 1 объемом кислорода, чтобы произвести 2 объема водяного пара.Сейчас бы мы написали стехиометрическое уравнение так: 2H 2 + O 2 = 2H 2 O. Но в начале 18 века еще не существовало различия между понятиями атом и молекула. Гей-Люссак ничего не сказал о том, какие частицы принимают участие в реакциях тех или иных газов.
А закон зависимости давления газа от абсолютной температуры, наоборот, в России известен под названием закона Шарля, а в Англии и США — как закон Гей-Люссака. Эти законы часто называют первым и вторым законами Гей-Люссака соответственно. В 1808 г. Гей-Люссак совместно с немецким естествоиспытателем Александром Гумбольдтом сформулировал закон объемных отношений: «объемы реагирующих газов при одних и тех же условиях относятся как целые числа». Например, 2 объема водорода соединяются с 1 объемом кислорода, чтобы произвести 2 объема водяного пара.Сейчас бы мы написали стехиометрическое уравнение так: 2H 2 + O 2 = 2H 2 O. Но в начале 18 века еще не существовало различия между понятиями атом и молекула. Гей-Люссак ничего не сказал о том, какие частицы принимают участие в реакциях тех или иных газов.
Закон постоянства состава вещества. Законы сохранения в химии
Химия относится к разряду точных наук и наряду с математикой и физикой устанавливает законы существования и развития материи, состоящей из атомов и молекул. Все процессы, происходящие как в живых организмах, так и среди объектов неживой природы, основаны на явлении превращения массы и энергии. Закон постоянства состава вещества, изучению которого будет посвящена данная статья, лежит в основе процессов в неорганическом и органическом мире.
Все процессы, происходящие как в живых организмах, так и среди объектов неживой природы, основаны на явлении превращения массы и энергии. Закон постоянства состава вещества, изучению которого будет посвящена данная статья, лежит в основе процессов в неорганическом и органическом мире.
Атомно-молекулярное учение
Чтобы понять сущность законов, управляющих материальной реальностью, надо иметь представление о том, из чего она состоит.По словам великого русского ученого М. В. Ломоносова «Во мраке должны оставаться физики и, особенно, химики, не зная внутренних частиц строения». Именно он в 1741 г. сначала теоретически, а затем подтвержденный опытами открыл законы химии, служащие основой для изучения живой и неживой материи, а именно: все вещества состоят из атомов, способных образовывать молекулы. Все эти частицы находятся в непрерывном движении.
Открытия и ошибки Дж.Dalton
Через 50 лет идею Ломоносова начал развивать английский ученый Дж. Дальтон. Ученый провел важнейшие расчеты по определению атомных масс химических элементов. Это послужило главным доказательством таких предположений: массу молекулы и вещества можно рассчитать, зная атомный вес частиц, входящих в его состав. И Ломоносов, и Дальтон считали, что независимо от способа получения молекула соединения всегда будет иметь неизменный количественный и качественный состав.Первоначально именно в такой форме был сформулирован закон постоянства состава вещества. Признавая огромный вклад Дальтона в развитие науки, нельзя умолчать о досадных ошибках: отрицании молекулярного строения таких простых веществ, как кислород, азот, водород. Ученый считал, что молекулы есть только в сложных химических веществах. Учитывая огромный авторитет Дальтона в научных кругах, его ошибки отрицательно сказались на развитии химии.
Ученый провел важнейшие расчеты по определению атомных масс химических элементов. Это послужило главным доказательством таких предположений: массу молекулы и вещества можно рассчитать, зная атомный вес частиц, входящих в его состав. И Ломоносов, и Дальтон считали, что независимо от способа получения молекула соединения всегда будет иметь неизменный количественный и качественный состав.Первоначально именно в такой форме был сформулирован закон постоянства состава вещества. Признавая огромный вклад Дальтона в развитие науки, нельзя умолчать о досадных ошибках: отрицании молекулярного строения таких простых веществ, как кислород, азот, водород. Ученый считал, что молекулы есть только в сложных химических веществах. Учитывая огромный авторитет Дальтона в научных кругах, его ошибки отрицательно сказались на развитии химии.
Как мы взвешиваем атомы и молекулы
Открытие такого химического постулата, как закон постоянства состава вещества, стало возможным благодаря идее сохранения массы веществ, прореагировавших и образовавшихся после него. Кроме Дальтона измерение атомных масс проводил И. Берцелиус, составивший таблицу атомных весов химических элементов и предложивший их современное обозначение в виде латинских букв. В настоящее время массу атомов и молекул определяют с помощью углеродной нанотрубки.Результаты, полученные в этих исследованиях, подтверждают существующие законы химии. Раньше ученые использовали такой прибор, как масс-спектрометр, но сложная техника взвешивания была серьезным недостатком спектрометрии.
Кроме Дальтона измерение атомных масс проводил И. Берцелиус, составивший таблицу атомных весов химических элементов и предложивший их современное обозначение в виде латинских букв. В настоящее время массу атомов и молекул определяют с помощью углеродной нанотрубки.Результаты, полученные в этих исследованиях, подтверждают существующие законы химии. Раньше ученые использовали такой прибор, как масс-спектрометр, но сложная техника взвешивания была серьезным недостатком спектрометрии.
Почему важен закон сохранения массы вещества?
Названный выше химический постулат, сформулированный М. В. Ломоносовым, доказывает тот факт, что в ходе реакции атомы, входящие в состав реагентов и продуктов, никуда не исчезают и не возникают из ничего.Их количество остается неизменным до и после химического процесса. Поскольку масса атомов постоянна, этот факт логически приводит к закону сохранения массы и энергии. Более того, ученый провозгласил эту закономерность универсальным принципом природы, подтверждающим взаимопревращение энергии и постоянство состава материи.
Идеи Пруста как подтверждение атомно-молекулярной теории
Обратимся к открытию такого постулата, как закон постоянства состава.Химия конца 18 — начала 19 веков — наука, в рамках которой велись научные споры между двумя французскими учеными, Ж. Прустом и Ш. Бертолле. Первые утверждали, что состав веществ, образующихся в результате химической реакции, зависит главным образом от природы реагентов. Бертолле был уверен, что относительное количество взаимодействующих веществ также влияет на состав соединений-продуктов реакции. Большинство химиков в начале исследований поддерживали идеи Пруста, который сформулировал их следующим образом: состав сложного соединения всегда постоянен и не зависит от того, каким образом он был получен.Однако дальнейшее изучение жидких и твердых растворов (сплавов) подтвердило мысли К. Бертолле. К этим веществам был неприменим закон постоянства состава. Более того, он не работает для соединений с ионными кристаллическими решетками. Состав этих веществ зависит от методов, которыми они добываются.
Каждое химическое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав. Эта формулировка характеризует закон постоянства состава вещества, предложенный Дж.Прустом в 1808 г. В качестве доказательства он приводит следующие образные примеры: малахит из Сибири имеет тот же состав, что и минерал, добываемый в Испании; В мире есть только одно киноварное вещество, и неважно, из какого месторождения оно получено. Таким образом, Пруст подчеркивал постоянство состава вещества независимо от места и способа добычи.
Правил без исключений не бывает
Из закона постоянства состава следует, что при образовании сложного соединения химические элементы соединяются друг с другом в определенных весовых соотношениях.Вскоре в химической науке появились сведения о существовании веществ, имеющих переменный состав, который зависел от способа получения. Русский ученый М. Курнаков предложил называть эти соединения бертоллидами, например оксид титана, тяжелая вода, нитрид циркония.
Эти вещества имеют различное количество другого элемента на 1 часть по массе одного элемента. Так, в бинарном соединении висмута с галлием на одну весовую часть галлия приходится 1.24 на 1,82 части висмута. Позднее химики установили, что, помимо соединения металлов друг с другом, к этому классу неорганических соединений, подобно оксидам, относятся вещества, не подчиняющиеся закону постоянства состава. Бертоллиды характерны также для сульфидов, карбидов, нитридов и гидридов.
Роль изотопов
Получив в свое распоряжение закон постоянства вещества, химия как точная наука смогла связать весовую характеристику соединения с изотопным содержанием образующих его элементов.Напомним, что изотопами считаются атомы одного химического элемента с одинаковыми протонами, но разными числами нуклонов. С учетом наличия изотопов понятно, что весовой состав соединения может быть переменным при условии, что элементы, входящие в это вещество, постоянны. Если элемент увеличивает содержание какого-либо изотопа, то меняется и весовой состав вещества. Например, обычная вода содержит 11 % водорода, а тяжелая вода, образованная его изотопом (дейтерием), — 20 %.
Например, обычная вода содержит 11 % водорода, а тяжелая вода, образованная его изотопом (дейтерием), — 20 %.
Характеристика бертоллидов
Как мы уже выяснили, законы сохранения в химии подтверждают основные положения атомно-молекулярной теории и абсолютно справедливы для веществ постоянного состава — дальтонидов. Бертоллиды имеют границы, в которых возможно изменение весовых частей элементов. Например, в оксиде четырехвалентного титана на одну весовую часть металла приходится от 0,65 до 0,67 частей кислорода. Вещества непостоянного состава не имеют молекулярной структуры, их кристаллические решетки состоят из атомов.Поэтому химические формулы соединений лишь отражают границы их состава. Разные вещества разные. Температура может влиять и на интервалы изменения весового состава элементов. Если два химических элемента образуют между собой несколько бертоллидов, то для них также неприменим закон кратных отношений.
Из всех приведенных примеров сделаем вывод: теоретически в химии есть две группы веществ: с постоянным и переменным составом.
