Растворы насыщенные и ненасыщенные — Справочник химика 21
Напротив, если в насыщенном растворе электролита уменьшить концентрацию одного из понов (например, связав его каким-либо другим ионом), произведение концентраций ионов будет меньше значения ПР, раствор станет ненасыщенным, а равновесие между жидкой фазой и осадком сместится в сторону растворения осадка. Следовательно, растворение осадка малорастворимого электролита происходит при условии, что произведение концентраций его ионов меньше значения ПР. [c.141]Различают растворы насыщенные, ненасыщенные и пересыщенные. Раствор, содержащий максимальное количество вещества, которое может раствориться в данном количестве растворителя при определенной температуре (с образованием устойчивого раствора), называют насыщенным. [c.87]
Каким путем можно определить, является ли заданный раствор насыщенным, ненасыщенным или пересыщенным [c.
Ненасыщенный раствор Раствор, концентрация которого ниже насыщенного Ненасыщенные углеводороды Углеводороды с двойными и тройными связями [c.546]
Поскольку понятие насыщения раствора связано с равновесием процесса растворения, его можно относить только к определенным условиям раствор, насыщенный при одной температуре, может стать ненасыщенным (или пересыщенным) при другой. Таким образом, растворимость вещества является функцией температуры, а если вещ,ество газообразно, то и функцией давления газа над раствором. Чаще всего растворимость твердых веществ при повышении температуры увеличивается, а жидких и газообразных — уменьшается. [c.147]
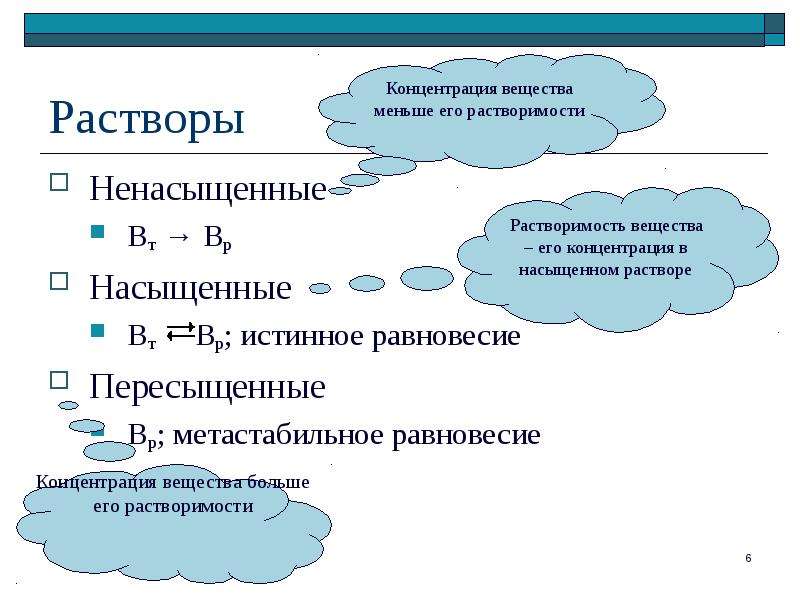
По соотношению преобладания числа частиц, переходящих в раствор и удаляющихся из раствора, или. другими словами, по состоянию равновесия, различают растворы насыщенные, ненасыщенные, пересыщенные. [c.145]
По соотношению преобладания числа частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. С другой стороны, по относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные. [c.106]
С другой стороны, по относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные. [c.106]
Насыщенный раствор — это раствор, находящийся при данных условиях в термодинамическом равновесии с растворенным веществом. Раствор, содержащий меньшее количество растворенного вещества, чем это отвечает насыщенному раствору, называется ненасыщенным. При охлаждении насыщенного раствора образуется пересыщенный раствор, содержащий больше растворенного вещества, чем это отвечает насыщенному раствору. При некотором пределе перенасыщения или при внесении в пересыщенный раствор кристалла растворенного вещества илп другого вещества, могущего слулкристаллов растворенного вещества, которое продолжается до образования насыщенного раствора.
Различают растворы насыщенные, ненасыщенные и пересыщенные. Раствор, содержащий максимальное количество вещества, которое может раствориться в данном количестве раствори [c. 72]
72]
Второй этап — охлаждение упаренного раствора (точка А) до 0°С. Раствор А при температуре 94 С ненасыщен, при охлаждении состав его не изменяется до момента достижения кривой насыщения в точке В. При дальнейшем охлаждении хлорид калия кристаллизуется и состав раствора изменяется до точки С, которая соответствует раствору, насыщенному хлоридом калия (21% КС1) при 0°С. На изотерме i = 0° (прямая F) находится точка D (состав исходного раствора на втором этапе) и точки, представляющие два комплекса, которые образовались из этого исходного раствора, — твердый хлорид калия F и раствор С. [c.190]
Вершины треугольника отвечают чистым компонентам Н О, АХ, ВХ. В точке т имеется жидкий раствор, содержащий обе соли, но ненасыщенный относительно них. На линии МЫ, например, в точке раствор насыщен относительно соли АХ, а [c.430]
Когда раствор содержит максимальное количество растворенного вещества, которое в нем может содержаться при данной температуре, мы говорим, что раствор насыщенный. При любом меньшем содержании растворенного вещества получается ненасыщенный раствор. [c.53]
При любом меньшем содержании растворенного вещества получается ненасыщенный раствор. [c.53]
Для возобновления цикла необходимо растворить в маточном растворе при 100° С такое же (8,65 кг) количество КС1 из сильвинита. Состояние ненасыщенного хлоридом калия раствора при его нагревании и растворении сильвинита изменяется вначале по линии п — S (до изотермы 100° С), а затем по линии растворов, насыщенных хлоридом патрия.
Иногда абсорбируемый компонент может реагировать в жидкости с образованием твердого продукта слабой растворимости— например, растворение SO2 в растворах Са(ОН)г. Часть растворенного SO2 будет находиться в свободном состоянии, часть — в связанной форме в виде сульфита. Условия равновесия представлены на рис. V-106. Линия А представляет условия для чистой воды (с = 0), кривая fi — условия для насыщенного раствора. Для ненасыщенных растворов имеется пучок линий для разных концентраций. [c.454]
В трех склянках находится насыщенный, ненасыщенный и пересыщенный растворы одного и того же вещества. Определите, в какой из склянок находится тот или иной раствор. [c.43]
Определите, в какой из склянок находится тот или иной раствор. [c.43]
Допустим, что кусок твердого тела с поверхностью 5 растворяется в ненасыщенном растворе этого вещества при перемешивании. Перемешивание жидкости не захватывает полностью всего ее объема, и некоторый слой, прилегающий к поверхности твердого тела, остается в относительном покое (рнс. 179). В этом слое концентрация растворяемого вещества переменна непосредственно на поверхности тела раствор остается практически насыщенным с ас. а на внешней границе слоя концентрация вещества такая же, как в остальном объеме раствора с. Этот слой называется диффузионным, так как изменение концентрации в нем определяется процессом диффузии. При более интенсивном перемешивании толщина диффузионного слоя уменьшается. При толщине диффузионного слоя градиент концентрации будет [c.426]
Какими двумя различными способами можно сделать а) насыщенный раствор твердого вещества ненасыщенным б) ненасыщенный его раствор насыщенным [c.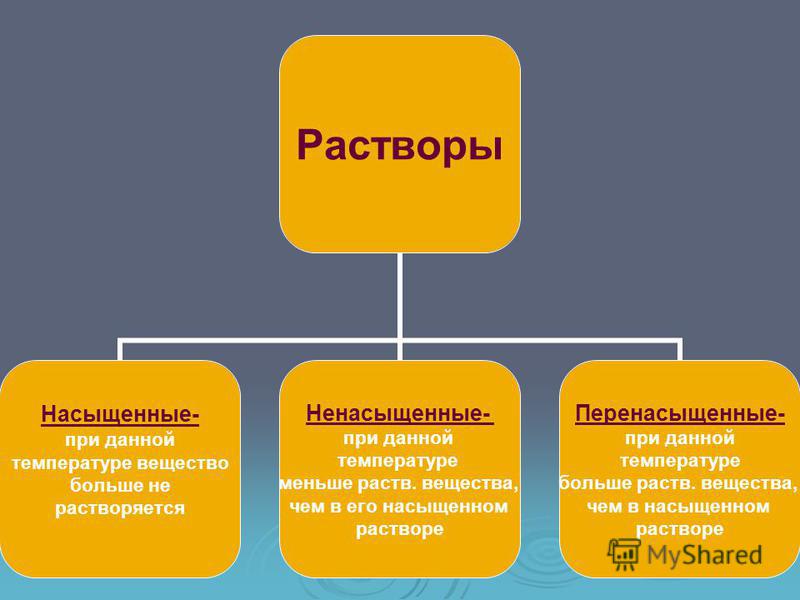 43]
43]
Если произведение концентраций ионов меньше значения ПР малорастворимого электролита или равно ему, то в этих условиях осадок не образуется. В первом случае раствор является ненасыщенным, а во втором — только достигшим насыщения по отношению к данному малорастворимому соединению.
Укажите для каждого из приводимых ниже примеров, какой имеется раствор — насыщенный или ненасыщенный (рис. 3) [c.21]
П.29). Отложим по оси абсцисс концентрацию смеси. Точки а и Ь отвечают температурам кристаллизации (плавления) индивидуальных веществ — соответственно А и В. Кривые ае и еЬ — взаимосвязи между температурой и концентрацией насыщенных растворов — соответственно насыщенными компонентами А и В. Точка е характеризует состав раствора, насыщенного обоими компонентами. Выше аеЬ система гомогенна (ненасыщенные растворы). [c.129]
В этом растворе на 100 г воды приходится 20 г соли АХ и Юг соли ВХ .

Если ироизве 1ение концентраций ионов меньше значений ПР малорастворимого электролита или равно ему, то в этих условиях осадок не образу( тся. В первом случае раствор является ненасыщенным, а во втором — только достигшим насыщения по отношению к данному малорастворимому соединению. Осадок образуется лишь в том случае, когда произведение концентраций ионов больше ПР, и прекраща(5тся, когда эти величины становятся равными друг другу, т. е. когда в системе устанавливается динамическое равновесие между раствором и твердой фазой.
 [c.120]
[c.120] Процесс растворения идет самопроизвольно (АОсО) и раствор остается ненасыщенным. Когда энтальпийный и энтропийный факторы в уравнении (П. 10) станут одинаковыми, т. е. ДО = О, система окажется в состоянии истинного равновесия. Раствор становится насыщенным. В таком растворе неопределенно долго могут сосуществовать без каких-либо изменений раствор и избыток растворяемого вещества. Так как скорость, с которой молекулы, отрываясь от поверхности твердого тела (при наличии его избытка), переходят в раствор, равна скорости осаждения молекул растворенного вещества на той же поверхности, равновесное состояние может быть нарушено только в результате изменения температуры, давления или введения других веществ (см. ниже). Из изложенного следует, что растворимости твердых веществ способствует склонность к возрастанию неупорядоченности, а их кристаллизации — энергетический фактор, т. е. склонность к понижению потенциальной энергии. Равновесие соответствует концентрации, отвечающей уравновешиванию обоих процессов.
Растворение сильвинита производят при 90—110 С раствором, ненасыщепным хлоридом калия и почти насыщенным хлоридом патрия. Такой раствор извлекает из сильвинита хлорид калия, а хлорид натрия остается в твердой фазе (в отвале). Полученный после отделения нерастворившегося Na l горячий раствор, насыщенный хлоридом калия, осветляют отстаиванием от взвешенных в нем частиц солей, глины и т. п. После этого раствор охлаждают и из него кристаллизуется хлорид калия. Его отделяют на центрифугах, а маточный раствор подогревают (причем он становится ненасыщенным хлоридом калия) и направляют на растворение новых порций сильвинита. [c.460]
Рассмотрим фазовое равновесие в трехкомпонентной системе вода — две соли с одноименным ионом . На рис. 50 представлена изотермная проекция диаграммы состояния этой системы. Соли не образуют с водой гидратов и двойных солей, комплексных соединений или твердых растворов. Вершины треугольника Розебума отвечают чистым компонентам Н. 0, РХ и QX. Точка А показывает концентрацию соли РХ в насыш,енном водном растворе, а точка В — концентрацию соли рх в насыщенном водном растворе этой же соли. Кривая АС характеризует растворимость соли РХ в водных растворах соли РХ разного состава, а кривая ВС — растворимость соли рХ в водных растворах соли РХ. В точке С раствор насыщен обеими солями Любая точка на поле между вершиной Н.20 и кривой АСВ отвечает ненасыщенным растворам солей. Любая точка на поле ЛС (РХ) представляет собой двухфазную систему, состоящую из раствора двух солей и твердой соли РХ. Любая точка на поле СВ (QX) — система, состоящая из раствора двух солей и твердой соли РХ. Область (РХ)С(РХ) соответствует трехфазным системам в ней сосуществуют насыщенный обеими солями раствор состава С и кристаллы РХ и ОХ. Если взять ненасыщенный раствор, отвечаюнгий фигуративной точке М, и постепенно испарять воду, то по мере удаления воды количественное соотношение между солями в системе остается постоянным.
Вершины треугольника Розебума отвечают чистым компонентам Н. 0, РХ и QX. Точка А показывает концентрацию соли РХ в насыш,енном водном растворе, а точка В — концентрацию соли рх в насыщенном водном растворе этой же соли. Кривая АС характеризует растворимость соли РХ в водных растворах соли РХ разного состава, а кривая ВС — растворимость соли рХ в водных растворах соли РХ. В точке С раствор насыщен обеими солями Любая точка на поле между вершиной Н.20 и кривой АСВ отвечает ненасыщенным растворам солей. Любая точка на поле ЛС (РХ) представляет собой двухфазную систему, состоящую из раствора двух солей и твердой соли РХ. Любая точка на поле СВ (QX) — система, состоящая из раствора двух солей и твердой соли РХ. Область (РХ)С(РХ) соответствует трехфазным системам в ней сосуществуют насыщенный обеими солями раствор состава С и кристаллы РХ и ОХ. Если взять ненасыщенный раствор, отвечаюнгий фигуративной точке М, и постепенно испарять воду, то по мере удаления воды количественное соотношение между солями в системе остается постоянным. В связи с этим фигуративные точки, отвечающие составам систем в процессе выпаривания, будут лежать на прямой (НаО) Е. В точке а начнут выделяться кристаллы соли РХ. Для определения состава раствора, соответствующего фигуративной точке Ь, проводим конноду через вершину треугольника РХ и точку Ь до пересечения с точкой на кривой АС. [c.201]
В связи с этим фигуративные точки, отвечающие составам систем в процессе выпаривания, будут лежать на прямой (НаО) Е. В точке а начнут выделяться кристаллы соли РХ. Для определения состава раствора, соответствующего фигуративной точке Ь, проводим конноду через вершину треугольника РХ и точку Ь до пересечения с точкой на кривой АС. [c.201]
Предположим, кусок твердого тела с поверхностью Зх растворяется в ненасыщенном растворе этого вещества в условиях перемешивания, причем перемешивание не захватывает всего объема жидкости, так что некоторый слой, прилегающий к поверхности твердого тела, остается в относительном покое (рис. 44). В этом слое концентрация растворяемого вещества изменяется, на поверхности раствор остается насыщенным с концентрацией Снас> а на внешней стороне слоя кoнцeнтpaI я зiиз-ка к концентрации в объеме (с). Подобный слой н гвается диффузионным, так как изменение концентрации в нем [c.147]
Ксли концентрация раствора не достигает концентрации насыщения при данных условиях, то раствор называется ненасыщенным. Если концентрация растворов больше концентрации насыще-1П[я, такие растворы называются пересыщенными. Пересыщенные растворы очень неустойчивы. Избыточное вещество выкристалли-)Ор,ывастся при встряхивании илн внесении в раствор центров кристаллизации в виде кристалликов соли или пыли. [c.19]
Если концентрация растворов больше концентрации насыще-1П[я, такие растворы называются пересыщенными. Пересыщенные растворы очень неустойчивы. Избыточное вещество выкристалли-)Ор,ывастся при встряхивании илн внесении в раствор центров кристаллизации в виде кристалликов соли или пыли. [c.19]
Способы вырамсенпя состава растворов. Насыщенные растворы применяют сравнительно редко. В большинстве случаев пользуются ненасыщенными растворами, содержащими меньше растворенного вещества, чем его содержит при данной температуре насыщенный раствор. При этом растворы с низким содержанием растворенного вещества называются разбавленными, с высоким — концентрированными. [c.217]
При внесении растворяемого вещества в растворитель про цесс растворения идет самопроизвольно (ДСраствор остается ненасыщенным, т. е. в р.1створ может переходить еще некоторое количество вещества. Когда энтальпийный и энтропийный факторы процесса станут одинаковыми, т. е. ДС-0, система окажется в состоянии истинного равновесия. Раствор становится насыщенным, в такой системе неопределенно долго могут сосуществовать без каких-либо изменений раствор и избыток растворяемого вещества. Равновесное состояние может быть нарушено только в результате изменения температуры, давления или введения других веществ. [c.249]
Раствор становится насыщенным, в такой системе неопределенно долго могут сосуществовать без каких-либо изменений раствор и избыток растворяемого вещества. Равновесное состояние может быть нарушено только в результате изменения температуры, давления или введения других веществ. [c.249]
Разница между насыщенными и ненасыщенными растворами (Наука и природа)
Насыщенные против ненасыщенных растворов
Термин насыщение имеет различные определения в различных областях химии. В то время как в физической химии идея насыщения отличается от того, как насыщение рассматривается в органической химии. Тем не менее, слово насыщение имеет латинское происхождение и буквально означает «заполнить». Поэтому основная идея насыщения состоит в том, чтобы заполнить общую емкость, тогда как ненасыщенность означает, что для заполнения всей емкости остается еще немного места..
Что такое насыщенный раствор?
Решение состоит из растворения растворенного вещества в растворителе. Полученная смесь — это то, что мы называем решением. При любой заданной температуре и давлении существует ограничение на количество растворенного вещества, которое может быть растворено в конкретном растворителе, чтобы растворенное вещество оставалось растворенным в фазе раствора. Этот предел известен как точка насыщения. При попытке растворить больше растворенного вещества, превышающего точку насыщения, избыток растворенного вещества будет образовывать осадок на дне, разделяясь на твердую фазу. Это происходит для того, чтобы поддерживать предел растворенных веществ, который раствор может выдерживать при данной температуре и давлении.
Полученная смесь — это то, что мы называем решением. При любой заданной температуре и давлении существует ограничение на количество растворенного вещества, которое может быть растворено в конкретном растворителе, чтобы растворенное вещество оставалось растворенным в фазе раствора. Этот предел известен как точка насыщения. При попытке растворить больше растворенного вещества, превышающего точку насыщения, избыток растворенного вещества будет образовывать осадок на дне, разделяясь на твердую фазу. Это происходит для того, чтобы поддерживать предел растворенных веществ, который раствор может выдерживать при данной температуре и давлении.
Поэтому любое решение, достигшее своей точки насыщения, называется «насыщенным решением». В принципе, может быть два типа насыщенных растворов; полностью насыщенный и почти насыщенный. Когда он полностью насыщен, обычно мы наблюдаем образовавшийся осадок на дне из-за невозможности дальнейшего растворения растворенного вещества в растворителе.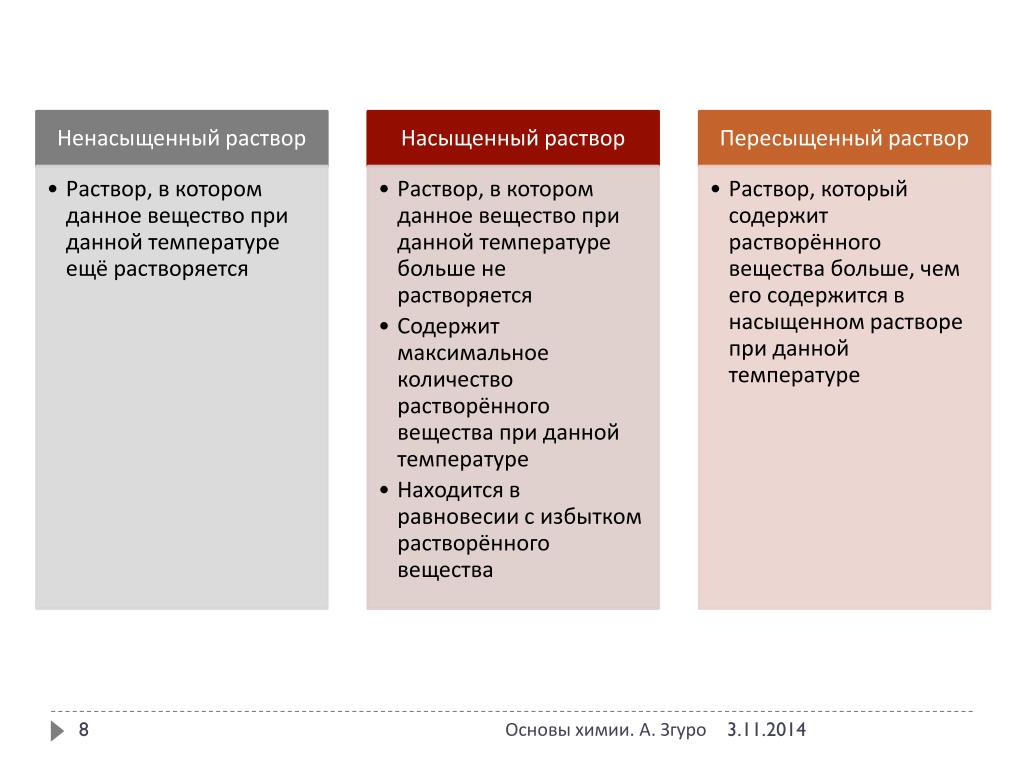 Принимая во внимание, что когда он почти насыщен, раствор будет содержать почти точное количество растворенных веществ, необходимых для насыщения; следовательно, немного добавленного растворенного вещества может взорваться в небольшом количестве осадка на дне. Поэтому, когда раствор почти насыщен, даже если мы рассматриваем его как насыщенный раствор, мы не увидим осадка на дне. Точка насыщения данного количества раствора изменяется в зависимости от температуры и давления. Тот же объем растворителя может удерживать большее количество растворенного вещества в фазе раствора при более высокой температуре. Следовательно, чем выше температура, тем больше растворенных веществ необходимо для насыщения. Напротив, когда давление увеличивается, насыщение достигается легко.
Принимая во внимание, что когда он почти насыщен, раствор будет содержать почти точное количество растворенных веществ, необходимых для насыщения; следовательно, немного добавленного растворенного вещества может взорваться в небольшом количестве осадка на дне. Поэтому, когда раствор почти насыщен, даже если мы рассматриваем его как насыщенный раствор, мы не увидим осадка на дне. Точка насыщения данного количества раствора изменяется в зависимости от температуры и давления. Тот же объем растворителя может удерживать большее количество растворенного вещества в фазе раствора при более высокой температуре. Следовательно, чем выше температура, тем больше растворенных веществ необходимо для насыщения. Напротив, когда давление увеличивается, насыщение достигается легко.
При растворении растворенного вещества в растворителе важно делать это при регулярном перемешивании. Это делается для того, чтобы избежать локального пересыщения (небольшое количество объема растворителя, которое проходит точку его насыщения). Таким образом, растворенные вещества должны быть равномерно распределены по всему объему и не должны быть сброшены в том же месте.
Таким образом, растворенные вещества должны быть равномерно распределены по всему объему и не должны быть сброшены в том же месте.
Что такое ненасыщенный раствор?
Ненасыщенные растворы — это растворы, способные растворять в них больше растворенных веществ. Эти растворы еще не прошли свою точку насыщения, следовательно, никогда не несут осадок на дне. Ненасыщенные растворы и почти насыщенные растворы, как описано выше, выглядели бы почти одинаково снаружи, но их можно легко отличить, выполнив быстрый шаг. То есть, после растворения небольшого количества растворенных молекул, почти насыщенный раствор превращался бы в осадок, почти мгновенно проходящий точку насыщения, тогда как для ненасыщенного раствора не было бы никакой разницы во внешнем виде, поскольку растворенные вещества полностью растворялись, так как достаточно комната для размещения их в фазе решения.
Обычно раствор, который был насыщен при более низкой температуре, можно сделать ненасыщенным при более высокой температуре, так как повышение температуры увеличивает пропускную способность растворенных веществ в фазе раствора.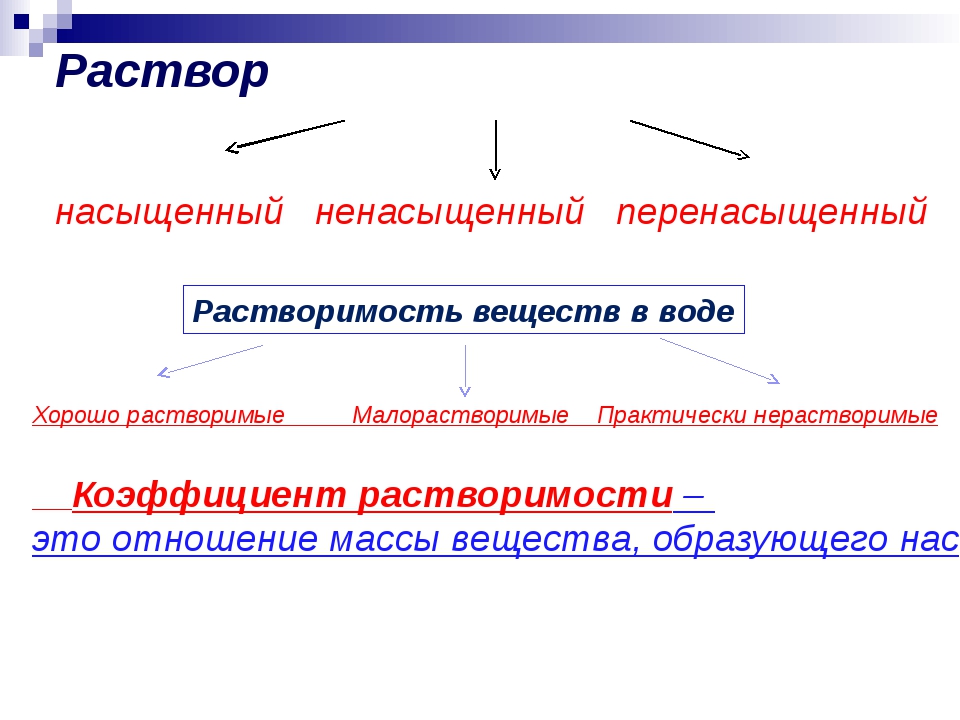 .
.
В чем разница между насыщенными и ненасыщенными растворами?
• Насыщенные растворы не способны больше растворять растворенные вещества в фазе раствора, тогда как ненасыщенные растворы могут.
• Обычно насыщенные растворы несут осадок на дне, но ненасыщенные растворы не.
• С увеличением температуры насыщение уменьшается, но ненасыщенность увеличивается.
Химия Тема 5-6, 7-8 — 9 класс — Дистанционное обучение 9-11 класс — Каталог файлов
Химия
Тема 5-6, 7-8
Растворимость, её зависимость от разных факторов. Насыщенные и ненасыщенные растворы. Тепловые явления которые сопровождают растворения веществ. Физико-химическая суть процесса растворения. Понятия о кристаллогидратах.
Количественный состав раствора. Массовая доля растворенного вещества. Приготовление раствора. Вычисление массовой доли и массы растворенного вещества в растворе.
Цель: продолжить развивать знания учащихся о растворе на примере понятия растворимость; формировать умение решать задачи с использованием понятия растворимость; определить факторы влияющие на растворимость веществ. Ознакомить учащихся со способами отображения состава растворов, понятиями «массовая доля растворенного вещества» и «концентрация раствора»; формировать навыки использования этих понятий для определения и приготовления растворов.
Мы с вами приступаем к изучению нового раздела химии. Чтобы догадаться, о чем сегодняшний урок, вы должны продолжить стихотворение.
Как-то утром я проспал.
в школу быстро собирался:
Чал холодный наливал,
Сахар всыпал, помешал,
Но не сладким он остался.
Я ещё досыпал ложку,
Стал послаще он немножко.
Чай допил я до остатка,
А в остатке стало сладко
Сахар ждал меня на дне!
Стал прикидывать в уме –
Отчего судьбы немилость?
Виновата – растворимость.
Количественной способностью растворятся в воде определяют физической величиной — растворимостью. Растворимость — это физическая величина, которая показывает, какую массу определённого вещества можно растворить в 1 литре растворителя при определённой температуре и давлении.
Для большинства растворимость увеличивается, если увеличить t° — это один из факторов.
Для других это природа растворителя и растворимого вещества (бензин в воде не растворяется, а в спирте очень даже).
Раствор, в котором данное вещество при определенной t° больше не растворяется — насыщенный раствор. А раствор в котором это вещество ещё может растворятся — ненасыщенный.
А раствор в котором это вещество ещё может растворятся — ненасыщенный.
Вопрос, как можно из насыщенного сделать ненасыщенный раствор? Нужно просто увеличить t°. А как сделать из ненасыщенного насыщенный? Модно уменьшить t°, добавить растворимого вещества или испарить растворитель.
Ненасыщенные растворы бывают:
— концентрированные;
— разбавленные.
Классификация веществ по их растворимости в воде.
- Хорошо растворимые — если при комнатной температуре в 100 г воды растворяется больше 1 г этого вещества.
- Малорастворимые – если при таких условиях растворяется меньше 1 г вещества в 100 г воды.
- Практически нерастворимые вещества – такие вещества, растворимость которых меньше 0,01 г в 100 г воды.
Рассмотрите таблицу растворимости кислот, оснований и солей в воде, подберите по два примера для каждой из групп веществ.
Совершенно нерастворимых веществ в природе не существует.
Растворение это физико-химический процесс. Если мы в стакан с водой добавим перманганат калия (К2MnO4), то:
а) происходит разрушение кристаллической решётки твердого вещества до молекул;
б) распределение молекул вещества между молекулами воды (диффузия).
Как ускорить этот процесс:
1. Подогреть;
2. Перемешать.
Если мы в воду будем добавлять любое другое вещество, то можно будет наблюдать также и изменение t° самого раствора. Т.о. Энергия выделяется или поглощается в результате определённых химических процессах.
Растворение веществ сопровождается образованием соединений между молекулами растворителя и растворённого вещества. Этот процесс называют — сольватацией, если растворитель вода, то — гидратацией. А образованные вещества — сольваты или гидраты. Если при этом энергии сольватации мало, раствор использует внешнюю энергию и поэтому охлаждается. Если энергии много, то отдаёт энергию — раствор сам по себе нагревается, даже может начать кипеть.
Если при этом энергии сольватации мало, раствор использует внешнюю энергию и поэтому охлаждается. Если энергии много, то отдаёт энергию — раствор сам по себе нагревается, даже может начать кипеть.
Гидраты – непрочные соединения веществ с водой, существующие в растворе. Косвенным доказательством гидратации является существование твердых кристаллогидратов – солей, в состав которых входит вода. Ее в этом случае называют кристаллизационной. Например, к кристаллогидратам относится хорошо известная соль голубого цвета – медный купорос CuSO4 ∙ 5H2O. Безводный сульфат меди (II) – кристаллы белого цвета. Изменение цвета сульфат меди (II) на голубой при растворении его в воде и существование голубых кристаллов медного купороса является еще одним доказательством гидратной теории Д. И. Менделеева.
Таблица. Окраска некоторых кристаллогидратов и безводных солей.
|
Формула кристаллогидрата |
Цвет кристаллогидрата |
Цвет безводной соли
|
|
CuSO4 ∙ 5H2O CuCl2∙6 H2O CоCl2∙6 H2O
|
Синий Голубой Темно-розовый |
Белый Зеленый Синий |
Состав раствора может быть передан двумя способами:
1. Долей растворенного вещества (массовой или объёмной).
Долей растворенного вещества (массовой или объёмной).
2. Концентрацией.
Массовая доля растворенного вещества (w) — это отношение массы растворенного вещества к массе раствора.
w= m(вещества) / m(раствора) *100%,
Единица измерения — %.
Соответственно производные главной формулу такие:
m(вещества)= m(раствора)*w / 100%
m(раствора)= m(вещества)*100% / w
Итак второй способ выражения количественного состава раствора — это концентрация.
Молярная концентрация растворенного вещества — это физическая величина равная отношению количества растворенного вещества (υ) к объёму раствора (V).
Сm= υ(вещества) / V(раствора),
Единица измерения моль/л.
Задание для учащегося (выполнить в своих тетрадях):
Задача №1.
Вычислите «w» растворенного вещества в растворе, полученному в результате перемешивания 20г сахара и 130г воды?
Задача №2.
Какую массу NaCl и h3O надо взять для приготовления раствора массой 1 кг с массовой долей растворенного вещества 5%?
Задача № 3.
При растворении гидроксида натрия (NaOH) массой 120 г, получаем раствор объёмом 2л. Определить молярную концентрацию гадроксида натрия?
Задача №4
Какую массу хлорида цинка (ZnCl2) нужно взять, чтобы получить его раствор объёмом 250 мл, молярная концентрация которого равна 0,1 моль/л? (не забудьте 250 мл перевести в лиры)
Задача №5
Определите массовую долю кислоты в растворе, полученном растворением 33,6 л хлороводорода (HCl) в 245,25 г воды (н/у)?
Задача №6
На ХФЗ производят раствор глюкозы. Глюкоза применяется в медицине как средство усиленного углеводного питания, как компонент различных кровезамещающих и противошоковых жидкостей, при отравлениях угарным газом и анилином. Определите массу глюкозы, которую получит пациент при инъекции одной ампулы 40%-ного раствора объёмом 10 мл.(Плотность раствора равна 1,54 г/мл).
Глюкоза применяется в медицине как средство усиленного углеводного питания, как компонент различных кровезамещающих и противошоковых жидкостей, при отравлениях угарным газом и анилином. Определите массу глюкозы, которую получит пациент при инъекции одной ампулы 40%-ного раствора объёмом 10 мл.(Плотность раствора равна 1,54 г/мл).
Домашнее задание: выучить §9, ответить письменно на вопросы после параграфа (решить задачи), повторить §6-8. Заполнить в тетрадях следующую таблицу:
|
№ |
m(вещества),г |
m(H2O),г |
m(раствора),г |
w, % |
|
1 |
30 |
170 |
? |
? |
|
2 |
50 |
100 |
? |
? |
|
3 |
5 |
95 |
? |
? |
|
4 |
100 |
100 |
? |
? |
|
5 |
? |
? |
120 |
5 |
|
6 |
? |
? |
200 |
12 |
|
7 |
? |
? |
300 |
7 |
|
8 |
? |
? |
150 |
15 |
А1.
 Дайте определение концентрации раствора.2. Чем отличаются ненасыщенные, насыщенные и перенасыщенные растворы?3. Назовите способы разбавления и концентрирования растворов. Приведитепримеры из повседневной жизни.
Дайте определение концентрации раствора.2. Чем отличаются ненасыщенные, насыщенные и перенасыщенные растворы?3. Назовите способы разбавления и концентрирования растворов. Приведитепримеры из повседневной жизни. Ответ:
Объяснение:
1. Концентрация — величина, характеризующая количественный состав раствора.
Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это соотношение неоднородных величин.
Те величины, которые являются отношением однотипных величин (отношение массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора) правильно называть долями. Однако на практике для обоих видов выражения состава применяют термин концентрация и говорят о концентрации растворов.
Существует много способов выражения концентрации растворов:
массовая доля, объемная доля, молярность, моляльность, нормальна концентрация(мольная коцентрация эквивалента, титр раствора, мольная доля.
2.
По концентрации растворенного вещества растворы делят на:
Ненасыщенные растворы – это растворы, в которых концентрация растворенного вещества меньше, чем в соответствующем насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое количества растворенного вещества.
Насыщенные растворы – это растворы, в которых достигнута максимальная концентрация растворенного вещества при данных условиях. Насыщенный раствор можно приготовить даже в бытовых условиях – например, раствор поваренной соли в воде. Если в стакан воды постепенно добавлять соль, рано или поздно соль перестанет растворяться. Это и будет насыщенный раствор.
Пересыщенный раствор – это раствор, в котором концентрация растворенного вещества больше, чем в насыщенном. Избыток растворенного вещества легко выпадает в осадок. Приготовить пересыщенный раствор можно, например, с помощью охлаждения насыщенного раствора поваренной соли. При понижении температуры растворимость поваренной соли уменьшается, и раствор становится пересыщенным.
3.
а) Способы разбавления растворов:
Как в качественном, так и в количественном анализе часто пользуются реактивами приблизительной концентрации. Такие растворы готовят из более концентрированных растворов путем их разбавления. Для этого предварительно рассчитывают, какой объем концентрированного раствора следует взять, чтобы, разбавив его водой или смешав с менее концентрированным раствором, получить раствор заданной концентрации.
Пример из повседневной жизни разбавления растворов:
Приготовила слишком сладкий чай, добавляю к нему воду и получаю раствор с меньшей массовой долей сахара.
Купила уксусную эссенцию 99%, а в повседневной жизни пользуюсь 9% 3%,6% или 9% раствором уксусной кислоты. Тогда разбавляю уксусную эссенцию:
1 часть уксусной эссенции и 22 части воды и получаю раствор уксусной кислоты 3%;
1 часть уксусной эссенции и 11 частей воды и получаю раствор уксусной кислоты 6%;
1 часть уксусной эссенции и 7 частей воды и получаю раствор уксусной кислоты 9%
б) Способ концентрирования растворов:
Выпариванием — удалении растворителя путем парообразования при кипении.
Пример из повседневной жизни:
Кипячение воды в чайнике — пример выпаривания (известковый налет).
Образование соли на берегах соляных озер так же пример выпаривания.
Кристаллизация — процесс выделения твердого вещества из его раствора. Обязательное условие кристаллизации — пересыщение раствора.
Пример из повседневной жизни:
Замораживание воды в морозилке холодильника, происходит кристаллизация воды с образованием льда. ПРИГОТОВЛЯЕМ КУБИКИ ЛЬДА ДЛЯ ОХЛАЖДЕНИЯ НАПИТКОВ.
Выращивание кристаллов поваренной соли и сахара.
Экстрагирование — извлечение из твердого или жидкого веще-ства одного или нескольких компонентов с помощью растворите ля. При этом извлекаемые компоненты переходят из твердой или жидкой фазы в растворитель
| Этапы урока |
Длитель- ность |
Деятельность учителя |
Деятельность обучающихся |
Учебные материала (ссылка на цифровые ресурсы) |
| Организа- ционный этап |
1 мин.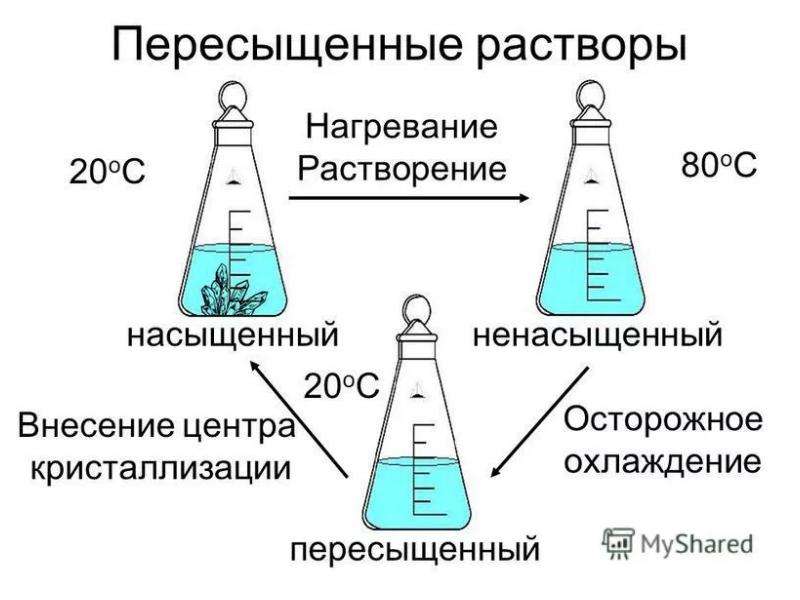 |
Приветствует учащихся. Проверяет готовность учащихся к уроку. Отмечает отсутствующих |
Приветствуют учителя. Проверяют наличие учебных принадлежностей |
|
| Постановка цели и задач урока | 7 мин. | (Презентация) Как вы думаете о чём мы с вами будем говорить сегодня на уроке? Сформулируйте тему урока. (Слайд 1) Запишите тему урока в тетради «Вода – растворитель. Растворы». Сформулируйте цель урока. Цели урока: дать определение понятию «раствор». Изучить процесс растворения веществ в воде. Узнать, из каких частей может состоять раствор. |
Дети рассматривают слайд и
формулируют тему урока Записывают тему урока в тетради. Учащиеся думают и отвечают. |
|
| Мотивация учебной деятельности учащихся | 4 мин. | Создание проблемной ситуации. Демонстрация растворения сахара. Какое это явление? |
Высказывают свои предположения | Состав раствора. Видеофрагмент https://2035school.ru/lesson/rastvory_ rastvorimost/ |
| Актуализация знаний | 12 мин. | Смотрим видео. И даем
определение раствору. Знаете ли вы, что является растворенным веществом и растворителем для каждого из этих растворов? — Напиток кола. — Духи. — Морская вода. — Раствор сульфат меди (II). — Лак для ногтей. — Сироп. Изучение свойств растворов занимает важное
место в современной науке. Что происходит во время процесса растворения? А теперь посмотрим видеофрагмент. Растворы бывают насыщенные и ненасыщенные. |
Записывают в тетради
определение раствора. Учащиеся определяют, что является растворителем и растворенным веществом.
Учащиеся размышляют. |
Что такое раствор. Видеофрагмент
https://2035school.ru/lesson/rastvory_ rastvorimost/ Иллюстрация https://2035school.ru/lesson/rastvory_
Что происходит во время процесса растворения? Видеофрагмент https://2035school.ru/lesson/ Насыщенные и ненасыщенные растворы https://2035school.ru/lesson/ |
| Первичное усвоение новых знаний | 5 мин. |
Задание. Заполните таблицу. Вода, хлорид натрия, углекислый газ, вода, содовая вода, уксус |
Дети заполняют таблицу | Тренажер. Задание. |
| Физкульт- минутка |
1 мин. | Проведение упражнений | Учащиеся выполняют упражнение для глаз | |
| Первичная проверка понимания | 5 мин. | Задание 1. Посмотрите, растворимы
ли следующие вещества в воде и в керосине. Задание 2. Выберите растворимое вещество и растворитель, которые при смешивании образуют раствор. Задание 3. Закончите предложение. |
Отвечают на поставленные задачи. | Факторы, влияющие на процесс
растворения. Задание 1, 2 и 3. https://2035school.ru/lesson/ |
| Первичное закрепление | 5 мин. | Задание. Просмотрите видео и закончите предложения. | Влияние температуры на
растворение веществ в воде https://2035school.ru/lesson/ rastvory_rastvorimost/ |
|
| Рефлексия (подведение итогов занятия) | 4 мин. | (На экран выводятся вопросы с
помощью документ-камеры.) 1. На уроке я работал… 2. Своей работой на уроке я… 3. Урок для меня показался… 4. 5. Мое настроение… 6. Материал урока мне был… |
Учащиеся каждый на листочке прописывают, а некоторые и проговаривают ответы на вопросы. | |
| Информация о домашнем задании, инструктаж | 1 мин. | Запишите домашнее задание. Повторить изученный материал. Составить кроссворд по теме. | Записывают домашнее задание |
|
Трудовые действия |
Нанесение бинарного антифрикционного покрытия на подшипники скольжения |
|
Комбинированное пористое размерное хромирование штоков, валов, цилиндров с использованием сложных дополнительных анодов |
|
|
Комбинированное размерное хромирование деталей сложной конфигурации с использованием очень сложных дополнительных анодов |
|
|
Меднение алюминия, магния, цинка, титана и их сплавов |
|
|
Меднение с использованием реверсированного тока, корректировка растворов меднения, подготовка анодов меднения, поддержание заданного режима, устранение основных неполадок при меднении |
|
|
Нанесение гальванических и химических покрытий на поверхности деталей сложной и особо сложной конфигурации |
|
|
Нанесение многослойных покрытий с соблюдением режима осаждения: нанесение первого слоя; промывка; дополнительная полировка; обезжиривание и декапирование; нанесение второго слоя металла; обработка после осаждения второго слоя; окончательная обработка деталей |
|
|
Нанесение проводящего слоя на металлические формы, предварительная обработка форм из гигроскопичных материалов |
|
|
Нанесение проводящего слоя путем химического восстановления серебра и меди из водных растворов |
|
|
Никелирование специальных черных и цветных металлов |
|
|
Никелирование током переменной полярности |
|
|
Никелирование труб и соединительных деталей |
|
|
Оксидирование изделий из нержавеющей, кислотоупорной, азотированной стали и стали специальных марок |
|
|
Оксидирование цветных металлов и сплавов |
|
|
Осаждение меди способом электронатирания |
|
|
Осаждение металла на проводящий или разделительный слой: подготовка формы к осаждению; обработка форм для улучшения смачивания их электролитом; завешивание форм в ванны; приготовление электролитов для затяжки и наращивания; затяжка, ведение процесса; наращивание толстых слоев металла; отделение формы |
|
|
Нанесение покрытия из сплава олово-свинец на втулки главных шатунов авиадвигателей с сохранением гиперболической поверхности |
|
|
Нанесение покрытий на изделия из цинковых сплавов, титана и его сплавов |
|
|
Пористое хромирование штоков, валов, пресс-форм |
|
|
Размерное хромирование и никелирование деталей по 5-му квалитету (1-му классу точности) |
|
|
Твердое хромирование крупногабаритных пресс-форм сложной конфигурации с использованием особо сложных анодов, экранов |
|
|
Химическое нанесение пленок серебра и меди |
|
|
Химическое оксидирование |
|
|
Хромирование деталей, требующих установки дополнительных анодов; изменение пространственного положения анодов и деталей в процессе хромирования |
|
|
Профильное хромирование с наращиванием слоя хрома по всему профилю деталей |
|
|
Черное никелирование деталей и изделий |
|
|
Электрохимическое оксидирование |
|
|
Необходимые умения |
Выполнять глубокое оксидирование |
|
Выполнять комбинированное пористое размерное хромирование штоков, валов, цилиндров с использованием сложных дополнительных анодов |
|
|
Выполнять комбинированное размерное хромирование деталей особо сложной конфигурации с использованием очень сложных дополнительных анодов |
|
|
Выполнять покрытие сплавом олово-свинец втулок главных шатунов авиадвигателей с сохранением гиперболической поверхности |
|
|
Выполнять пористое хромирование штоков, валов, пресс-форм |
|
|
Выполнять размерное хромирование и никелирование деталей по 5-му квалитету (1-му классу точности) |
|
|
Выполнять твердое хромирование пресс-форм крупногабаритных сложной конфигурации с использованием особо сложных анодов, экранов |
|
|
Выполнять хромирование деталей, требующих установки дополнительных анодов; менять пространственное положение анодов и деталей в процессе хромирования |
|
|
Наносить гальванические и химические покрытия на поверхности деталей сложной и особо сложной конфигурации |
|
|
Устранять неполадки в работе ванн в процессе хромирования, лужения, свинцевания, оксидирования, меднения, цинкования, железнения |
|
|
Необходимые знания |
Технология блестящего никелирования |
|
Свойства блескообразующих добавок |
|
|
Способы приготовления электролитов для блестящего никелирования |
|
|
Влияние углерода на структуру и свойства углеродистой стали, влияние примесей на свойства углеродистой стали, классификация и маркировка углеродистых сталей |
|
|
Влияние цинка на структуру и механические свойства латуни, свойства, применение, марки и обозначения латуни по действующим техническим регламентам |
|
|
Кинематические, электрические схемы в пределах выполняемой работы и конструкция всех типов гальванических ванн, регулирующих и автоматических приборов и устройств |
|
|
Классификация и свойства электроизоляционных материалов (физико-механические, химические и тепловые), гигроскопичность изоляционных материалов, особенности кремнийорганической изоляции |
|
|
Классификация инструментальных легированных сталей и требования, предъявляемые к ним |
|
|
Марки и область применения низколегированных, среднелегированных и высоколегированных инструментальных сталей |
|
|
Меднение по способу биполярного расположения деталей в ванне, сущность и область применения, способы устранения неполадок при меднении, исправления брака |
|
|
Меднение в этилендиаминовом электролите, преимущество этого электролита |
|
|
Способы монтажа и включения дополнительных анодов |
|
|
Назначение и применение индикаторов в процессах гальванизации |
|
|
Назначение, режим и способы нанесения всех видов гальванических покрытий |
|
|
Назначение чертежей деталей, требования, предъявляемые к чертежам деталей, последовательность чтения чертежей деталей, общие сведения о сборочных чертежах |
|
|
Рассеивающая способность электролитов, кроющая способность электролитов, пассивация анодов, борьба с ней |
|
|
Понятие о чертежах общего вида, ремонтных сборочных и групповых сборочных чертежах, условности и упрощения, установленные государственными стандартами для сборочных чертежей, порядок чтения сборочных чертежей |
|
|
Понятие о чертеже детали и сборочной единицы, способах соединения деталей и сборочных единиц |
|
|
Постоянный ток, электрические цепи постоянного тока, тепловое действие тока, химическое действие электрического тока, химические источники электрической энергии |
|
|
Особенности электродных процессов при никелировании, влияние водородного показателя (pH) электролитов на процесс никелирования, назначение и способы применения буферных добавок |
|
|
Приемы оксидирования алюминия и его сплавов, способы приготовления электролита для анодирования, правила ведения процесса, способы обработки деталей после анодирования |
|
|
Приемы размерного хромирования и никелирования по 5-му квалитету (1-му классу точности) |
|
|
Процесс кристаллизации чистого металла, явление анизотропии, кристаллизация чистого железа, полиморфизм железа при нагревании и охлаждении и возникающие при этом кристаллические структуры |
|
|
Растворимость твердых и газообразных веществ в воде, ее зависимость от температуры и давления, эндотермические и экзотермические реакции при растворении веществ |
|
|
Растворы насыщенные, ненасыщенные и перенасыщенные, способы выражения концентрации растворов |
|
|
Специальные виды никелирования, никелирование крепежных и мелких деталей |
|
|
Специальные процессы меднения, местная защита от цементации |
|
|
Способы оксидирования, толщина и свойства оксидных пленок в зависимости от способа оксидирования |
|
|
Способы подготовки алюминиевых изделий перед нанесением гальванических покрытий на алюминиевые сплавы |
|
|
Среда раствора, величина pH, способы ее измерения |
|
|
Структура гальванических покрытий, определяющая правильность технологического процесса |
|
|
Способы получения блестящих покрытий, блескообразующие добавки |
|
|
Структура, основные требования, предъявляемые к антифрикционным сплавам |
|
|
Структура сплавов, полученных электролитическим путем, способы нанесения покрытий из сплавов свинец-олово, олово-никель, олово-висмут, олово-кадмий, вольфрам-никель, кобальт-никель |
|
|
Назначение схем, их типы и виды по действующим техническим регламентам, принятые условные обозначения, последовательность чтения схем |
|
|
Физико-химические свойства никеля, область применения и толщина никелевых покрытий |
|
|
Способы электрокристаллизации сплавов |
|
|
Способы электрохимического оксидирования в серной, хромовой и щавелевой кислотах |
|
|
Способы электрохимического оксидирования меди и ее сплавов, состав растворов и режим |
|
|
Требования охраны труда при нанесении гальванических покрытий |
|
|
Другие характеристики |
— |
Что такое растворы | Решаем химию: вопросы и ответы
С растворами мы имеем дело ежедневно. Но как понять, раствор ли перед нами? Например, если мешать поваренную соль и воду, то получится раствор? А если смешать растительное масло и воду? Или добавить к воде спирт? Давайте разберёмся с этим.
Но как понять, раствор ли перед нами? Например, если мешать поваренную соль и воду, то получится раствор? А если смешать растительное масло и воду? Или добавить к воде спирт? Давайте разберёмся с этим.
Фото: 2do2go.ru
Итак,
раствор – однородная система, в которой нет границы раздела вещества. Чтобы получился раствор, нужно не менее двух веществ: растворитель и растворённое вещество.
При образовании раствора агрегатное состояние растворителя не меняется. Например, если мы смешиваем поваренную соль и воду, то агрегатное состояние воды, растворителя, не меняется: она остаётся жидкой. А как понять, какое из веществ будет растворителем, если мы смешиваем два вещества в одном агрегатном состоянии, например, воду и спирт? В таком случае принято считать, что растворитель – вещество, которое в растворе преобладает, то есть его попросту больше.
А как вы ответите на вопрос, образуется ли раствор, если смешать воду и растительное масло? Попробуйте провести этот опыт дома, и вы убедитесь, что при смешивании этих жидкостей образуется граница раздела, так что получить раствор растительного масла в воде не получится.
Как правило, говоря о растворах, мы представляем жидкости. Но существуют и твёрдые растворы, которые образуются при сплавлении металлов. Когда образуется сплав, границы между разными веществами-металлами не существует, так что формально сплавы являются растворами. Отметим, что и газы при смешивании образуют однородные смеси, в которых нет никакой границы между веществами, но называть смеси газов растворами не принято.
Растворимость
Способность вещества образовывать с другими веществами растворы называют растворимостью.
Растворимость у веществ разная и зависит от ряда факторов. Например, каждый знает, что мел крайне плохо растворяется в воде, потому что у карбоната кальция растворимость в воде низкая. А вот сахар в воде растворяется отлично, потому что его растворимость в воде высока.
От чего зависит растворимость
Представьте, что у вас есть два стакана с одинаковым количеством воды. Но в одном стакане вода холодная, в другом – горячая. Где растворится больше сахара? Конечно же, в горячей воде. Отсюда можно сделать вывод, что
Но в одном стакане вода холодная, в другом – горячая. Где растворится больше сахара? Конечно же, в горячей воде. Отсюда можно сделать вывод, что
с повышением температуры растворимость увеличивается.
Это утверждение справедливо почти для всех твёрдых и жидких веществ, которые растворяют в жидкостях. Зато
растворимость газов в жидкостях при повышении температуры падает.
Эту закономерность запомнить легко. Вспомните, сколько газа образуется, если открыть бутылку с газировкой на холоде, и сколько газа образуется, если открыть бутылку в жаркий полдень. Конечно же, во втором случае газообразование будет сильнее, поскольку в тепле газ растворяется в жидкости хуже и выделяется.
Насыщенные и ненасыщенные растворы
Давайте мысленно и даже реально проведём такой эксперимент. Возьмём стакан холодной воды и попытаемся растворить там поваренную соль, постепенно её добавляя. Сначала соль будет растворяться, затем мы увидим, что при добавлении соли растворения уже не происходит. Это значит, что мы получили насыщенный раствор.
Сначала соль будет растворяться, затем мы увидим, что при добавлении соли растворения уже не происходит. Это значит, что мы получили насыщенный раствор.
Насыщенный раствор – раствор, в котором больше нельзя растворить растворяемое вещество.
Теперь давайте нагреем наш стакан. Мы увидим, что теперь соль растворилась и даже если мы введём ещё некоторое количество соли, оно тоже растворится. Это значит, что у нас ненасыщенный раствор.
Ненасыщенный раствор – раствор, в котором растворённое вещество ещё может растворяться.
Конечно, если мы в горячую воду добавим очень много соли, то и там она перестанет растворяться, потому что у нас снова будет насыщенный раствор.
Обратите внимание, что измеряется растворимость массой вещества, которая может раствориться в 100 граммах растворителя с образованием насыщенного раствора при данной температуре. Например, растворимость сульфата магния в воде при 0 градусов – 22 г в 100 г воды, а при 100 градусах – 50,4 г в 100 г воды.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
ненасыщенных растворов: обзор и примеры | Что такое ненасыщенный раствор в химии? — Видео и стенограмма урока
Растворимость и ненасыщенные растворы
Растворимость — это термин, используемый для определения способности растворенного вещества растворяться в растворителе. Он определяет максимальное количество растворенного вещества, необходимое для достижения растворителем точки насыщения.Растворитель становится насыщенным, когда достигается его точка насыщения ; когда это происходит, он устанавливает состояние равновесия . Когда достигается равновесие, скорости диссоциации и преобразования растворенного вещества равны. Ненасыщенные растворы еще не достигли своего равновесия, поскольку скорость диссоциации растворенного вещества намного выше, чем скорость реформирования растворенного вещества. С учетом вышесказанного можно предположить, что равновесие растворимости ненасыщенных растворов выше, чем концентрация растворенного вещества, присутствующего в растворе.Взаимосвязь между степенью насыщения растворов и растворимостью резюмируется следующим образом:
Когда достигается равновесие, скорости диссоциации и преобразования растворенного вещества равны. Ненасыщенные растворы еще не достигли своего равновесия, поскольку скорость диссоциации растворенного вещества намного выше, чем скорость реформирования растворенного вещества. С учетом вышесказанного можно предположить, что равновесие растворимости ненасыщенных растворов выше, чем концентрация растворенного вещества, присутствующего в растворе.Взаимосвязь между степенью насыщения растворов и растворимостью резюмируется следующим образом:
- Раствор является насыщенным, когда концентрация его растворенного вещества равна его растворимости.
- Раствор является ненасыщенным, если концентрация его растворенного вещества ниже его растворимости.
Факторы растворимости
Всего существует пять факторов, которые влияют на растворимость любого раствора: температура раствора, размер молекул растворенного вещества, давление на частицы растворенного вещества, полярность растворенного вещества и растворителя, и скорость растворения смеси. Это параметры, которые влияют на растворимость, или, скорее, скорость растворения , которая является параметром, оценивающим скорость, с которой растворитель растворяет растворенное вещество. Коэффициенты скорости решения подробно обсуждаются следующим образом:
Это параметры, которые влияют на растворимость, или, скорее, скорость растворения , которая является параметром, оценивающим скорость, с которой растворитель растворяет растворенное вещество. Коэффициенты скорости решения подробно обсуждаются следующим образом:
- Температура раствора прямо пропорциональна растворимости раствора, что является общим правилом для жидких растворителей. С другой стороны, газы ведут себя противоположным образом. Наблюдается, что повышение температуры сопровождается уменьшением растворимости газов, то есть потому, что увеличенная кинетическая энергия как растворителя, так и растворенного вещества заставит молекулы газа растворенного вещества избегать притяжения частиц растворителя.Что касается жидкого растворителя, причина, по которой растворимость увеличивается с температурой, заключается в том, что избыточное тепло снабжает растворитель достаточной энергией, чтобы преодолеть межмолекулярные силы и разрушить частицы растворенного вещества.

- Любое изменение давления практически не влияет на жидкости и твердые тела из-за их несжимаемой природы. Но это не относится к газам. При фиксированной температуре растворимость газов в фиксированном объеме растворителя (жидкости) увеличивается с увеличением парциального давления газов, как того требует закон Генри .
- Размер частицы растворенного вещества является жизненно важным фактором, влияющим на скорость растворения. Можно заметить, что при фиксированной температуре и давлении размер молекул двух растворенных веществ с одинаковым уровнем полярности определяет скорость растворимости. Как правило, растворенные вещества с меньшим размером молекулы растворяются быстрее, чем растворенные вещества с более крупным размером молекул. Это связано с тем, что площадь поверхности более мелких частиц больше, чем площадь поверхности объемных частиц, и растворители растворяют растворенные вещества с большей площадью поверхности быстрее.
- Общий закон растворимости гласит, что подобное растворяется в подобном.
 Можно предположить, что только полярные растворенные вещества могут быть растворены в полярных растворителях, таких как поваренная соль и вода. Полярные растворенные вещества не могут растворяться в органических растворителях из-за их неполярной природы. Полярность определяется как неравное распределение заряда между атомами или неравное распределение электронов.
Можно предположить, что только полярные растворенные вещества могут быть растворены в полярных растворителях, таких как поваренная соль и вода. Полярные растворенные вещества не могут растворяться в органических растворителях из-за их неполярной природы. Полярность определяется как неравное распределение заряда между атомами или неравное распределение электронов. - Перемешивание или взбалтывание напрямую не увеличивает растворимость растворителя, но заставляет хорошие фракции растворенного вещества находиться в постоянном контакте с растворителем.Это верно, когда сахар не перемешивают в чайной чашке.
Следует отметить, что концентрация растворенного вещества не оказывает прямого влияния на растворимость самого растворителя, но это основной фактор , который влияет на скорость растворения .
Примеры ненасыщенных растворов
Ниже приведены примеров ненасыщенных растворов :
- Любой раствор с концентрацией растворенного вещества ниже точки насыщения растворенного вещества является ненасыщенным раствором.
 Пример — две чайные ложки соли, растворенные в одном литре воды.
Пример — две чайные ложки соли, растворенные в одном литре воды. - Уксус — это ненасыщенный раствор, состоящий из уксусной кислоты, которая является растворенным веществом, и воды, которая является растворителем.
- Дым — пример газообразных ненасыщенных растворов.
- Туман, который состоит из воды в качестве растворенного вещества и воздуха в качестве растворителя.
Краткое содержание урока
Ненасыщенные растворы — это растворы, способные растворять больше растворенного вещества, поскольку концентрация растворенного вещества не достигла точки насыщения растворителя .Растворенное вещество — это любое вещество, существующее в любом состоянии вещества, которое растворено в растворителе , который представляет собой жидкость, которая растворяет растворенное вещество без его химического изменения. Вода — универсальный растворитель, который используется многократно. В ненасыщенных растворах концентрация растворенного вещества ниже, чем его растворимость , что является термином, используемым для определения максимальной концентрации растворенного вещества, которое может быть растворено в растворителе до достижения его точки насыщения.
Концентрация растворенного вещества является наиболее важным фактором, влияющим на скорость растворения , то есть время, необходимое для растворения растворенного вещества.На скорость растворения влияют и другие факторы:
- Растворимость увеличивается с температурой в жидкостях и уменьшается в газах.
- Повышение парциального давления газов увеличивает растворимость газов.
- Полярность , явление, возникающее из-за неравномерного распределения электронов, влияет на растворимость, так что полярные растворители растворяют только полярные растворенные вещества. (Подобное растворяется в подобном).
- Более мелкие частицы растворенного вещества растворяются более эффективно из-за увеличенной площади поверхности.
- Перемешивание стимулирует растворимость за счет увеличения контакта между растворенным веществом и растворителем.
Любой раствор с концентрацией растворенного вещества ниже точки насыщения является примером ненасыщенного раствора:
- Щепотка соли, растворенная в стакане воды.

- Туман, в котором вода и воздух являются растворенным веществом и растворителем соответственно.
- Уксус, в котором уксусная кислота и вода являются растворенными веществами и растворителями соответственно.
Лаборатория ненасыщенных растворов
Ненасыщенный раствор
Приготовьте стакан воды с щепоткой соли.Вероятно, это ненасыщенный раствор. Чтобы проверить это, добавьте еще крошечную щепотку соли и перемешайте. Продолжайте, пока соль не перестанет добавляться в раствор. Любая дополнительная соль оседает на дно стакана. Теперь у вас есть насыщенный раствор.
Ненасыщенный раствор из насыщенного раствора
Теперь, когда у вас есть насыщенный раствор, если вы увеличите его температуру, он станет ненасыщенным при более высокой температуре. Если добавить в стакан воды, раствор тоже станет ненасыщенным.
Другие примеры
Вы можете проводить аналогичные эксперименты, добавляя сахар в кофе или воду.
Растворимость
Количество соли, необходимое при комнатной температуре для приготовления насыщенного раствора, не будет таким же, как количество необходимого сахара. Это количество, растворимость, варьируется от вещества к веществу. Попробуйте добавить в воду другие растворенные вещества и посмотрите, правда ли это.
Газ, растворенный в жидкости
Вопрос 1:
Можете ли вы назвать некоторые обычные предметы, которые представляют собой газ, растворенный в жидкости?
Твердое вещество растворено в твердом веществе
Бронза — это олово, растворенное в меди.
Вопрос 2:
Можете ли вы думать о других?
Ответы:
Ответ 1:
Газированная минеральная вода — это пузырьки углекислого газа в воде.
Ответ 2:
Латунь — это сплав меди и цинка.
Ненасыщенные растворы — типы, свойства, примеры, факторы и ответы на часто задаваемые вопросы
Ненасыщенный раствор — это химический раствор, в котором концентрация растворенного вещества ниже, чем его равновесная растворимость. Если количество растворенного вещества равно точке насыщения растворителя, раствор называется насыщенным раствором.
Если количество растворенного вещества равно точке насыщения растворителя, раствор называется насыщенным раствором.
[Изображение будет загружено в ближайшее время]
Насыщение и растворимость
Растворимость — это мера объема растворенного вещества, которое может раствориться в растворителе. Растворимость зависит от растворителя. Например, соль растворяется в воде, но не в масле. С повышением температуры растворимость твердых веществ в воде обычно увеличивается. Например, в горячей воде можно растворить больше сахара или соли, чем в холодной.Растворимость часто зависит от давления, но она не является определяющим фактором, и в ежедневных расчетах ее чаще всего игнорируют. Поскольку растворимость зависит от температуры, ненасыщенный раствор при более высоких температурах может стать насыщенным или даже перенасыщенным при более низких температурах. Ученые и повара обычно используют тепло для приготовления ненасыщенных растворов, когда растворенное вещество не растворяется полностью при более низкой температуре.
Типы насыщенности
В растворе есть три уровня насыщенности.
-
В ненасыщенном растворе меньше растворенного вещества, чем количество растворенного вещества, которое он может растворить. В таких растворах не остается нерешенных веществ.
-
Насыщенный раствор содержит больше растворителя на единицу объема, чем ненасыщенный раствор. Растворенное вещество растворилось до тех пор, пока его больше нельзя было растворять, оставив некоторое нерастворенное вещество в растворе. Обычно нерастворенное вещество плотнее раствора и опускается на дно емкости.
-
В перенасыщенном растворе растворено больше растворителя, чем в насыщенном растворе. Растворитель легко отделяется от раствора путем кристаллизации или осаждения. Для перенасыщения раствора могут потребоваться особые условия.
 Это помогает нагреть раствор, чтобы увеличить его растворимость и добавить больше растворенного вещества.
Это помогает нагреть раствор, чтобы увеличить его растворимость и добавить больше растворенного вещества.
Свойства ненасыщенных растворов
-
Ненасыщенные растворы обычно обладают более высокой реакционной способностью, чем насыщенные растворы.Например, с большим количеством ненасыщенных жирных кислот льняное масло, триглицериды оливкового масла откладываются быстрее, чем те, которые имеют большое количество отложений насыщенных жирных кислот, таких как кокосовый жир.
-
В длинной углеродной цепи жирная кислота с двойной или тройной связью может вызвать искривление углеродной цепи.
-
Некоторые углеводороды предотвращают вращение атомов вокруг связи, закрепляя их в определенных структурных образованиях.
Примеры ненасыщенных растворов
-
Добавление ложки сахара в горячую чашку кофе дает раствор ненасыщенного сахара.

-
Уксус — это раствор ненасыщенной уксусной кислоты в воде.
-
Туман — это раствор ненасыщенного водяного пара в воздухе.
-
В качестве растворителя газообразные растворы содержат газ, а растворенное вещество может находиться в твердом, жидком или даже газообразном состоянии. Хорошие примеры ненасыщенных газообразных растворов включают воздух, дым и туман.
-
0,01 М HCl представляет собой раствор ненасыщенной соляной кислоты в воде.
Концентрация растворенного вещества в ненасыщенном растворе намного ниже его равновесной растворимости.Для конкретного растворителя у каждого раствора будет предел. Следовательно, растворимость в растворителе имеет определенное значение.
Факторы, влияющие на насыщение
-
При повышении температуры растворимость ионных растворов увеличивается с образованием анионсодержащих соединений.

-
Для большей растворимости твердые вещества должны быть мелко измельчены.
-
Концентрация накапливается на поверхности растворителя, вызывая более высокую степень кристаллизации в неподвижном растворе, поэтому перемешивание раствора предотвращает накопление за счет максимального увеличения чистой скорости растворения.
-
Скорость кристаллизации будет зависеть от концентрации растворенного вещества на поверхности кристалла, в зависимости в основном от температуры, а не от скорости растворимости.
-
Раствор будет насыщенным, и если растворимость и скорость кристаллизации одинаковы, может быть достигнуто динамическое равновесие.
Факты
-
Больше растворенного вещества может быть растворено в ненасыщенном растворе до того, как он достигнет точки насыщения.
 Когда раствор достигает точки насыщения, растворенное вещество больше не растворяется в растворителе, и этот раствор считается насыщенным раствором. Таким образом, оба раствора изначально являются ненасыщенными по своей природе, и в конечном итоге при нанесении на них раствора они превращаются в насыщенный раствор.
Когда раствор достигает точки насыщения, растворенное вещество больше не растворяется в растворителе, и этот раствор считается насыщенным раствором. Таким образом, оба раствора изначально являются ненасыщенными по своей природе, и в конечном итоге при нанесении на них раствора они превращаются в насыщенный раствор. -
Растворенное вещество называется компонентом раствора, растворенным в растворителе и присутствующим в растворе в меньшем количестве. Растворителем называют ту часть раствора, которая присутствует в большем количестве и растворяет в нем раствор.Например, в растворе, содержащем сахар и воду, сахар действует как растворенное вещество, а вода действует как растворитель, и раствор, содержащий воду, называется водным раствором.
РЕШЕНИЕ: Объясните разницу между насыщенными и ненасыщенными растворами.
Стенограмма видео
Здравствуйте. Сегодня мы поговорим о вопросе 88 главы 14, который просит нас рассмотреть разницу между насыщенными и ненасыщенными растворами.Так был насыщенный ненасыщенный раствор. Давайте начнем. Существует один. Там, где есть растворитель, в данном случае будет вода и немного соли. Допустим, в воде есть немного соли, но мы вливаем еще немного соли, а затем, после того, как мы перемешали, эта соль растворяется в воде, и в воде просто больше соли, немного больше соли. И так это ненасыщенный раствор, потому что он смог растворить больше штурма Салюта. Однако мы можем нарисовать насыщенный раствор. Давайте переместим их в ту сторону, где я обозначил ненасыщенный раствор.Теперь, если мы нарисуем насыщенный раствор здесь с левой стороны, у нас снова может быть раствор соленой воды. Скажем так, в нем больше соли. В этой воде много соли. Это действительно соленая вода. Из него получаются действительно хорошие макароны, и поэтому, когда мы идем к Адму или Султану, если мы добавляем больше соли, у нас остается такое же количество соли, все еще растворенной в ней.
Сегодня мы поговорим о вопросе 88 главы 14, который просит нас рассмотреть разницу между насыщенными и ненасыщенными растворами.Так был насыщенный ненасыщенный раствор. Давайте начнем. Существует один. Там, где есть растворитель, в данном случае будет вода и немного соли. Допустим, в воде есть немного соли, но мы вливаем еще немного соли, а затем, после того, как мы перемешали, эта соль растворяется в воде, и в воде просто больше соли, немного больше соли. И так это ненасыщенный раствор, потому что он смог растворить больше штурма Салюта. Однако мы можем нарисовать насыщенный раствор. Давайте переместим их в ту сторону, где я обозначил ненасыщенный раствор.Теперь, если мы нарисуем насыщенный раствор здесь с левой стороны, у нас снова может быть раствор соленой воды. Скажем так, в нем больше соли. В этой воде много соли. Это действительно соленая вода. Из него получаются действительно хорошие макароны, и поэтому, когда мы идем к Адму или Султану, если мы добавляем больше соли, у нас остается такое же количество соли, все еще растворенной в ней. Раствор уже есть, и вся эта соль растворена, плавая в растворе. . И я собираюсь покрасить соль, которую мы добавляем, в красный цвет.Мы добавим кучу красных частиц соли. И теперь, когда соль растворяется, она остается на дне стакана, вода больше не может растворять соль. Он насыщен. Соли слишком много, чтобы что-то еще растворилось. И поэтому любая дополнительная соль, которую мы добавляем, просто оседает на дно в виде мелкого порошка. И так, если бы мы сделали то же самое справа и цвет добавили бы соленый красный. Фактически, эта красная соль все еще плавает в растворе, в отличие от уже насыщенного раствора, где она просто опустилась на дно, потому что не могла перейти в раствор.Для этого просто больше нет места. Надеюсь, это поможет вам понять разницу между насыщенным и ненасыщенным раствором. Спасибо
Раствор уже есть, и вся эта соль растворена, плавая в растворе. . И я собираюсь покрасить соль, которую мы добавляем, в красный цвет.Мы добавим кучу красных частиц соли. И теперь, когда соль растворяется, она остается на дне стакана, вода больше не может растворять соль. Он насыщен. Соли слишком много, чтобы что-то еще растворилось. И поэтому любая дополнительная соль, которую мы добавляем, просто оседает на дно в виде мелкого порошка. И так, если бы мы сделали то же самое справа и цвет добавили бы соленый красный. Фактически, эта красная соль все еще плавает в растворе, в отличие от уже насыщенного раствора, где она просто опустилась на дно, потому что не могла перейти в раствор.Для этого просто больше нет места. Надеюсь, это поможет вам понять разницу между насыщенным и ненасыщенным раствором. Спасибо
Ненасыщенные, насыщенные и перенасыщенные растворы
Разница между ненасыщенными, насыщенными и перенасыщенными растворами
By Theydiffer — 21 декабря 2015 г.
Раствор может быть либо газом, либо жидкостью. Раствор — это просто смесь растворенного вещества и растворителя.Растворимое вещество — это растворяемое вещество. Растворитель — это газ или жидкость, в которых растворяется растворенное вещество. Есть три типа растворов: ненасыщенные, насыщенные и перенасыщенные. Ниже мы рассмотрим каждое из этих решений и их отличия.
Определения
- Ненасыщенный раствор — это раствор, в котором к растворителю добавлено небольшое количество растворенного вещества. Растворитель абсорбирует все растворенные вещества, и еще остается место для их добавления. Растворитель не достиг своего предела и может растворить больше растворенного вещества, если его добавить к нему.Например, если вы добавите ложку сахара в стакан с водой, сахар полностью растворится. Раствор ненасыщенный.
- Раствор называется насыщенным , когда растворенное вещество не может растворяться в растворителе. По мере того, как к растворителю добавляется все больше и больше растворенного вещества, он достигает точки, когда растворитель не может растворить больше растворенного вещества из-за некоторых конкретных условий (обратите внимание, способность растворенного вещества растворять различные количества растворителя варьируется и зависит от условий, таких как температура , давление и т.
 д.).Это когда раствор становится насыщенным. Если вы добавите еще растворенное вещество, оно осядет на дне емкости. Например, когда вода смешивается с кристаллами лимонада, кристаллы лимонада растворяются. Когда кристаллы лимонада не могут раствориться в воде, раствор считается насыщенным. Любые дополнительные кристаллы лимонада не растворятся, а осядут на дне, потому что вода уже удерживает столько, сколько может.
д.).Это когда раствор становится насыщенным. Если вы добавите еще растворенное вещество, оно осядет на дне емкости. Например, когда вода смешивается с кристаллами лимонада, кристаллы лимонада растворяются. Когда кристаллы лимонада не могут раствориться в воде, раствор считается насыщенным. Любые дополнительные кристаллы лимонада не растворятся, а осядут на дне, потому что вода уже удерживает столько, сколько может. - Перенасыщенный раствор , с другой стороны, — это когда избыток растворенного вещества растворяется в растворителе в результате изменений температуры, давления или других условий.При комнатной температуре насыщенный раствор сохраняет максимально возможное количество растворенного вещества, а остальное становится избыточным. Если к растворителю добавляется еще какое-либо растворенное вещество, оно не растворяется, а скорее оседает на дне контейнера. Однако при повышении температуры растворитель может растворить дополнительное растворенное вещество, которое изначально оседало на дне.
 Даже если затем раствор охладить до комнатной температуры, он все равно может удерживать растворенный избыток растворенного вещества в течение некоторого времени. Именно тогда он становится перенасыщенным.Но это временное состояние; со временем выпадет в осадок избыток растворителя, и раствор снова станет насыщенным.
Даже если затем раствор охладить до комнатной температуры, он все равно может удерживать растворенный избыток растворенного вещества в течение некоторого времени. Именно тогда он становится перенасыщенным.Но это временное состояние; со временем выпадет в осадок избыток растворителя, и раствор снова станет насыщенным.
Вот пример, иллюстрирующий разницу между ненасыщенными, насыщенными и перенасыщенными растворами.
Допустим, в стакане воды можно растворить 10 ложек сахара при комнатной температуре.
- Случай первый: если вы добавите 2 ложки сахара в стакан воды комнатной температуры, он все растворится, образуя ненасыщенный раствор.
- Случай второй: если вы добавите 12 ложек сахара в стакан воды комнатной температуры, он растворит только 10 из них, а две дополнительные ложки осядут на дно стакана. Это делает насыщенный раствор.
- Случай третий: если нагреть раствор во втором случае, все 12 ложек сахара растворятся в растворе.
 Затем вы можете охладить его до комнатной температуры и убедиться, что в этом количестве воды растворено 12 ложек сахара, в то время как вы знаете, что можно сохранить только 10 ложек.Это делает раствор перенасыщенным. Через некоторое время осаждаются лишние 2 ложки, и раствор снова переходит в перенасыщенное состояние.
Затем вы можете охладить его до комнатной температуры и убедиться, что в этом количестве воды растворено 12 ложек сахара, в то время как вы знаете, что можно сохранить только 10 ложек.Это делает раствор перенасыщенным. Через некоторое время осаждаются лишние 2 ложки, и раствор снова переходит в перенасыщенное состояние.
Сравнительная таблица
Насыщенные и ненасыщенные и перенасыщенные растворы:
| Насыщенный раствор | Ненасыщенный раствор | Перенасыщенный раствор |
| Растворенный избыток растворенного вещества по возможности не растворяется | Растворил весь растворитель и может принять больше. | Растворитель растворил больше растворенного вещества, чем это обычно возможно в определенных условиях. Это временное состояние. |
Эксперимент: приготовление насыщенных и ненасыщенных растворов
Насыщенный раствор — это раствор, в котором растворено столько растворенного вещества, сколько оно способно растворить. При нагревании раствора насыщенный раствор можно превратить в ненасыщенный. Без добавления какого-либо растворителя его можно превратить в ненасыщенный раствор. Ненасыщенный раствор содержит меньше максимального количества растворенного вещества, которое может быть растворено при этой температуре.Пример: при нагревании насыщенного раствора сахара при высокой температуре он начинает растворяться.
При нагревании раствора насыщенный раствор можно превратить в ненасыщенный. Без добавления какого-либо растворителя его можно превратить в ненасыщенный раствор. Ненасыщенный раствор содержит меньше максимального количества растворенного вещества, которое может быть растворено при этой температуре.Пример: при нагревании насыщенного раствора сахара при высокой температуре он начинает растворяться.
Если добавляется еще растворенное вещество, но оно не растворяется, значит исходный раствор был насыщенным. Если добавленное растворенное вещество растворяется, то исходный раствор был ненасыщенным. Насыщенный раствор не может больше растворять растворенное вещество. Следовательно, размер кристалла останется прежним.
Эксперимент —
Задача: Сделать насыщенные и ненасыщенные растворы.Чтобы определить, является ли раствор насыщенным или ненасыщенным, нам нужно добавить в раствор кристаллы или растворимое вещество.
Необходимые аксессуары: Один стакан, мерная колба, мешалка, соль и вода.
Процедура: Очистите стакан, промыв его хорошо. Используйте мерную колбу, чтобы налить в стакан 100 миллилитров воды. Теперь продолжайте добавлять в воду небольшими порциями соль и перемешивать. Таким образом продолжайте добавлять соль и перемешивать, пока добавленная соль не перестанет растворяться, несмотря на тщательное перемешивание.
Анализ:
Насыщенный раствор — это раствор, когда растворенное вещество может растворяться в растворителе. Например, если у вас есть бутылка с водой, и вы вливаете в нее кристаллы лимонада, и она растворяется, значит, раствор насыщен. Ненасыщенный раствор — это когда растворенное вещество не может раствориться в растворителе. Например, если у вас есть стакан воды, и вы нальете в него что-то вроде растительного масла, оно не растворится. Это делает раствор ненасыщенным.
Почему при добавлении соли маленькими кусочками на определенной стадии соль не растворяется, несмотря на постоянное перемешивание? Причина в том, что в процессе регулярного добавления соли раствор стал насыщенным. Это состояние, когда растворитель (вода) не может больше растворять растворенное вещество (соль). Таким образом, при определенной температуре, если максимальное количество растворенного вещества, которое может быть растворено определенным количеством растворителя, растворяется растворителем, то полученный раствор называется насыщенным раствором.
Это состояние, когда растворитель (вода) не может больше растворять растворенное вещество (соль). Таким образом, при определенной температуре, если максимальное количество растворенного вещества, которое может быть растворено определенным количеством растворителя, растворяется растворителем, то полученный раствор называется насыщенным раствором.
С другой стороны, это раствор, если количество растворенного вещества меньше максимального количества растворенного вещества, которое может растворить растворитель, этот раствор будет ненасыщенным.
В вышеупомянутых случаях раствор, полученный на всех этапах до последней порции добавленной соли, которая осталась нераскрытой, является примерами ненасыщенного раствора.В насыщенном растворе небольшое количество растворенного вещества не растворяется, несмотря на сильное перемешивание. С другой стороны, в ненасыщенном растворе добавленное растворенное вещество будет продолжать растворяться из-за перемешивания до тех пор, пока раствор не превратится в насыщенный раствор.
Теперь, в случае перенасыщенного раствора, в растворе есть избыток растворенного вещества, поэтому он хочет оставить свой избыток растворенного вещества, из-за чего добавленные кристаллы или растворенное вещество станут больше по размеру, чем раньше.
Вот некоторые примеры структурированного раствора:
- Газированная вода насыщена углеродом; следовательно, он выделяет углерод через пузырьки.
- Добавление сахара в воду до тех пор, пока он не перестанет растворяться, создает насыщенный раствор.
- Продолжая растворять соль в воде до тех пор, пока она не перестанет растворяться, образуется насыщенный раствор.
Разница между насыщенными и ненасыщенными растворами
Автор: Мария
Насыщенные и ненасыщенные решения
Термин «насыщение» имеет разные определения в различных областях химии. В то время как в физической химии идея насыщения отличается от того, как насыщение рассматривается в органической химии. Тем не менее, слово «насыщенность» имеет латинское происхождение и буквально означает «наполнять». Таким образом, основная идея насыщения заключается в заполнении всей емкости, тогда как ненасыщенность означает, что для заполнения всей емкости остается еще немного места.
В то время как в физической химии идея насыщения отличается от того, как насыщение рассматривается в органической химии. Тем не менее, слово «насыщенность» имеет латинское происхождение и буквально означает «наполнять». Таким образом, основная идея насыщения заключается в заполнении всей емкости, тогда как ненасыщенность означает, что для заполнения всей емкости остается еще немного места.
Что такое насыщенный раствор?
Раствор получают растворением растворенного вещества в растворителе.Полученная смесь — это то, что мы называем раствором. При любой заданной температуре и давлении существует предел количества растворенного вещества, которое может быть растворено в конкретном растворителе, чтобы растворенное вещество оставалось растворенным в фазе раствора. Этот предел известен как точка насыщения . При попытке растворения большего количества растворенного вещества, превышающего точку насыщения, избыток растворенного вещества будет образовывать осадок на дне, разделяясь на твердую фазу. Это происходит для того, чтобы поддерживать предел растворенных веществ, который раствор может удерживать при данной температуре и давлении.
Это происходит для того, чтобы поддерживать предел растворенных веществ, который раствор может удерживать при данной температуре и давлении.
Следовательно, любой раствор, достигший точки насыщения, известен как «насыщенный раствор». В принципе, может быть два типа насыщенных растворов; полностью насыщенный и почти насыщенный . Когда он полностью насыщен, обычно мы наблюдаем образование осадка на дне из-за невозможности дальнейшего растворения растворенного вещества в растворителе. В то время как, когда он почти насыщен, раствор будет содержать почти точное количество растворенных веществ, необходимое для насыщения; следовательно, небольшое количество добавленного растворенного вещества может превратиться в небольшой осадок на дне.Следовательно, когда раствор почти насыщен, даже если мы рассматриваем его как насыщенный раствор, мы не наблюдаем осадка на дне. Точка насыщения данного количества раствора варьируется в зависимости от температуры и давления. Тот же объем растворителя может удерживать большее количество растворенного вещества в фазе раствора при более высокой температуре. Следовательно, чем выше температура, тем больше количество растворенных веществ необходимо для насыщения. Напротив, когда давление увеличивается, насыщение достигается легко.
Тот же объем растворителя может удерживать большее количество растворенного вещества в фазе раствора при более высокой температуре. Следовательно, чем выше температура, тем больше количество растворенных веществ необходимо для насыщения. Напротив, когда давление увеличивается, насыщение достигается легко.
При растворении растворенного вещества в растворителе важно делать это при регулярном перемешивании. Это делается для того, чтобы избежать локального перенасыщения (небольшое количество растворителя, превышающее точку насыщения). Следовательно, растворенные вещества должны быть равномерно распределены по всему объему и не должны попадать в одно и то же место.
Что такое ненасыщенный раствор?
Ненасыщенные растворы — это растворы, способные растворять в себе больше растворенных веществ.Эти растворы еще не прошли точку насыщения, поэтому на дне никогда не будет осадка. Ненасыщенные растворы и почти насыщенные растворы, как описано выше, будут выглядеть почти одинаково снаружи, но их можно легко отличить, выполнив быстрый шаг. То есть, при растворении небольшого количества молекул растворенного вещества, почти насыщенный раствор разорвется в осадок, почти мгновенно пройдя точку насыщения, тогда как для ненасыщенного раствора не будет никакой разницы по внешнему виду, поскольку растворенные вещества полностью растворятся, поскольку их достаточно. комната для размещения их на этапе решения.
То есть, при растворении небольшого количества молекул растворенного вещества, почти насыщенный раствор разорвется в осадок, почти мгновенно пройдя точку насыщения, тогда как для ненасыщенного раствора не будет никакой разницы по внешнему виду, поскольку растворенные вещества полностью растворятся, поскольку их достаточно. комната для размещения их на этапе решения.
Обычно раствор, который был насыщен при более низкой температуре, можно сделать ненасыщенным при более высокой температуре, поскольку повышение температуры увеличивает пропускную способность растворенных веществ в фазе раствора.
В чем разница между насыщенными и ненасыщенными растворами?
• Насыщенные растворы не могут растворять растворенные вещества в фазе раствора, в отличие от ненасыщенных растворов.
• Обычно насыщенные растворы несут на дне осадок, а ненасыщенные растворы — нет.
• С повышением температуры насыщенность уменьшается, а ненасыщенность увеличивается.
В чем, по вашему мнению, различия и сходства между насыщенным ненасыщенным и перенасыщенным раствором? — Restaurantnorman.com
Как вы думаете, в чем разница и сходство между насыщенным ненасыщенным и перенасыщенным раствором?
Ответ: Насыщенный раствор содержит максимальное количество растворенного вещества, которое может раствориться при температуре. Перенасыщенные растворы содержат больше, чем максимальное количество растворенного вещества, которое может быть растворено при этой температуре.
Что такое ненасыщенный цвет?
Когда чистый, яркий, сильный оттенок красного смешивается с переменным количеством белого, получается более слабый или бледный красный цвет, каждый из которых имеет один и тот же оттенок, но разную насыщенность. Эти более бледные цвета называются ненасыщенными.
Что такое насыщенные и ненасыщенные цвета?
С технической точки зрения насыщенность цвета — это выражение полосы пропускания света от источника. Термин оттенок относится к цвету самого изображения, а насыщенность описывает интенсивность (чистоту) этого оттенка.Когда цвет полностью насыщен, цвет считается наиболее чистым (наиболее истинным).
Термин оттенок относится к цвету самого изображения, а насыщенность описывает интенсивность (чистоту) этого оттенка.Когда цвет полностью насыщен, цвет считается наиболее чистым (наиболее истинным).
Что вы приготовите ненасыщенный раствор?
При перемешивании сахара или соли с водой образуется ненасыщенный, насыщенный или перенасыщенный раствор, в зависимости от того, сколько сахара или соли (растворенного вещества) вы добавляете в растворитель (воду). Когда вы добавляете небольшое количество растворенного вещества, все оно растворяется, образуя ненасыщенный раствор.
В какой из поваренной соли и воды образуется насыщенный раствор?
Ответ: Повышение температуры мало влияет на растворимость хлорида натрия или поваренной соли.Помимо этого, соль также увеличивает температуру кипения воды. На 100 граммов почти кипящей воды (от 200 до 212 градусов по Фаренгейту) вы можете добавить около 40 граммов соли, прежде чем она станет насыщенной.
Как приготовить насыщенный солевой раствор?
Для приготовления насыщенного раствора соли указанную соль добавляют в теплую (около 40 ° C) дистиллированную воду при перемешивании до тех пор, пока соль не перестанет растворяться.


 В химии процессы
растворения рассматриваются с позиций трёх
теорий: физической, химической,
физико-химической.
В химии процессы
растворения рассматриваются с позиций трёх
теорий: физической, химической,
физико-химической.
 За урок я…
За урок я…