Конспект урока по химии на тему «Растворы и растворимость»
Тема 10. Растворы и растворимость
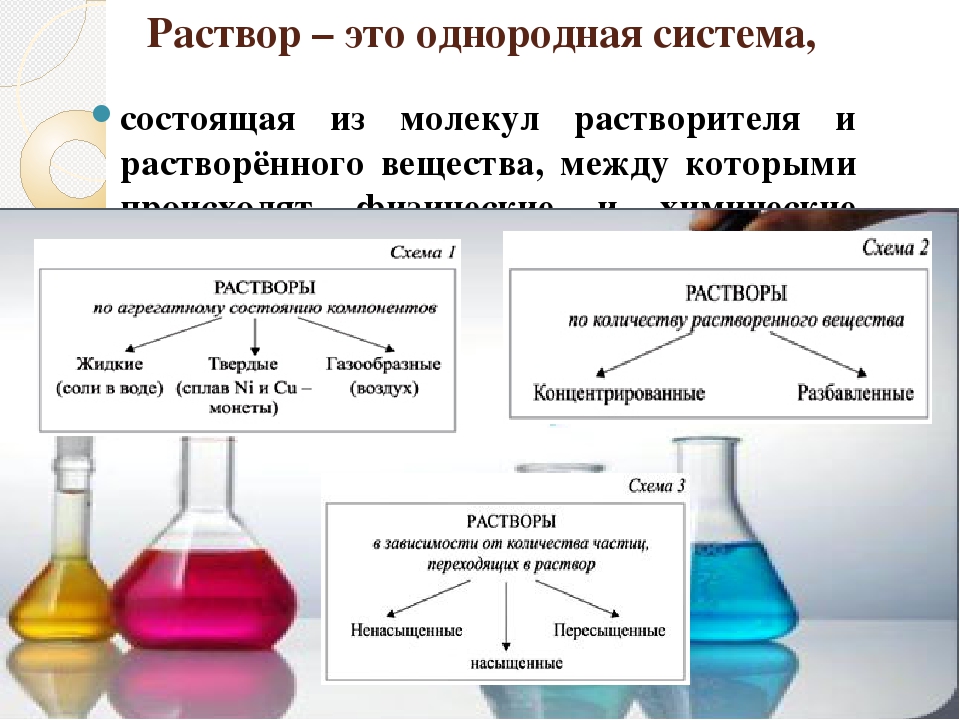
Раствором называют жидкую или твердую гомогенную систему, состоящую из двух или большего числа исходных веществ (компонентов), относительное содержание которых в системе может изменяться в широких пределах. Растворы обычно устойчивы во времени. Образование растворов, как и химических соединений, обычно сопровождается тепловыми эффектами. Главное отличие растворов от химических соединений – переменный состав растворов и постоянный – химических соединений..
В растворе условно выделяют растворенное вещество и растворитель. Растворитель может быть жидким или твердым, растворенное вещество – газообразным, жидким или твердым. Растворитель – это вещество, которое при данных условиях существует в том же агрегатном состоянии, что и образовавшийся раствор. Так, если 700 мл водорода растворить в 1 см3 металла палладия, то растворителем будет палладий, так как при обычных условиях и он, и образующийся раствор – твердые вещества.
Если оба вещества, образующие раствор, находятся в одном и том же агрегатном состоянии, то растворителем считают то из них, которого больше. Так, если 50 г ацетона растворить в 70 г спирта, то спирт рассматривают как растворитель, а ацетон – как растворенное вещество. Однако, если одно из веществ, образующих раствор – вода, то воду считают растворителем вне зависимости от того, каково ее относительное содержание в растворе. Например, известны 96%-й раствор спирта в воде, 98%-й раствор серной кислоты и т.д.
Рассмотрим растворение какого-либо твердого вещества А в жидкости (в школьном курсе обычно речь идет о водных растворах). Скорость растворения vА пропорциональна скорости удаления частиц с единицы поверхности k
1 и общей поверхности кристаллов S:vА = k1S.
Скорость обратного процесса – перехода вещества из раствора в кристаллы (скорость осаждения vОС) пропорциональна числу частиц растворенного вещества А в единице объема раствора (молярной концентрации [А] в растворе), площади поверхности кристаллов S и скорости выделения А на единичной поверхности кристаллов k2:
vОС= k2S[A]
Если при данной температуре устанавливается равновесие, то скорости растворения и осаждения сравниваются, и
vА = k1S = k2S[A] = vОС
или k1
 е.
е. К = k1/ k2 = [A] = const
Таким образом, при равновесии концентрация вещества в среде определенного растворителя при выбранной температуре [A] постоянна.
Равновесное содержание растворенного вещества в растворе при данной температуре принято указывать в расчете на 100 г растворителя (например, 100 г воды). Такое равновесное содержание называют растворимостью вещества. Изменение растворимости с температурой передает так называемая кривая растворимости. Количественная мера растворимости – это концентрация насыщенного раствора или масса растворенного вещества, приходящаяся на 100 г растворителя.
Если содержание вещества в растворе отвечает установлению при данной температуре равновесия между твердой фазой и раствором, то такой раствор называют
насыщенным. Если содержание вещества ниже равновесного значения, то раствор называют ненасыщенным.
Обычно с увеличением температуры растворимость вещества в воде растет. В соответствии с принципом Ле Шателье это означает, что в таких случаях растворение – это эндотермический процесс (встречаются и случаи образования водных растворов, когда теплота при растворении выделяется).
Результирующий тепловой эффект при растворении обусловлен действием двух факторов. Первый фактор – это затраты энергии на разрушение кристаллической структуры при переходе вещества из твердой фазы в раствор. Второй фактор – это выделение теплоты при взаимодействии перешедших в раствор частиц с растворителем (в случае воды – это энергия присоединения молекул воды к перешедшей в раствор частице, энергия ее гидратации). Нужно также учесть, что при растворении возрастает хаотичность расположения микрочастиц системы в пространстве (растет энтропия), и это благоприятствует самопроизвольному течению растворения. Результирующий тепловой эффект растворения (теплота растворения) обусловлен действием этих двух факторов.
В общем случае взаимодействие содержащихся в растворе микрочастиц растворенного вещества с растворителем называют сольватацией. Если растворитель – вода, то такое взаимодействие называют гидратацией.
Из сказанного об отрицательном тепловом эффекте растворения в воде большинства веществ можно заключить, что на разрушение кристаллической структуры при растворении в воде чаще всего расходуется больше энергии, чем выделяется при гидратации растворенных частиц.
В случае растворения газов в воде энергия на разрушение кристаллической решетки не затрачивается, а энергия гидратации молекул газа выделяется. Поэтому растворение газов в воде чаще всего сопровождается положительным тепловым эффектом, и растворимость газов в воде с ростом температуры падает.
Чаще всего с ростом температуры растворимость вещества в воде увеличивается. Предположим, что раствор, насыщенный при какой-либо повышенной температуре, осторожно (не перемешивая, не встряхивая) охлаждают. Часто в таких случаях выделения твердой фазы при достижении более низкой температуры не наблюдается, и содержание вещества в растворе оказывается выше того, которое соответствует насыщенному раствору. Такие растворы называют пересыщенными. В отличие от ненасыщенных и насыщенных растворов пересыщенные растворы метастабильны – хотя часто их можно хранить очень долго, рано или поздно из них происходит выделение «избыточного» растворенного вещества. Выделение из них избыточного вещества наблюдается, например, при внесении в такой раствор затравки – небольшого кристаллика растворенного вещества, или при трении стеклянной палочкой о стенки сосуда, в котором находится пересыщенный раствор.
Часто в таких случаях выделения твердой фазы при достижении более низкой температуры не наблюдается, и содержание вещества в растворе оказывается выше того, которое соответствует насыщенному раствору. Такие растворы называют пересыщенными. В отличие от ненасыщенных и насыщенных растворов пересыщенные растворы метастабильны – хотя часто их можно хранить очень долго, рано или поздно из них происходит выделение «избыточного» растворенного вещества. Выделение из них избыточного вещества наблюдается, например, при внесении в такой раствор затравки – небольшого кристаллика растворенного вещества, или при трении стеклянной палочкой о стенки сосуда, в котором находится пересыщенный раствор.
Растворы часто подразделяют на разбавленные и концентрированные. Четкой границы между ними нет. Обычно разбавленными называют такие растворы, в которых содержание растворенного вещества мало (менее 1 г на 100 г раствора). Поведение растворенных частиц в разбавленном растворе не зависит от присутствия в растворе других частиц этого или какого-либо другого растворенного вещества.
Если введение дополнительной порции растворяемого вещества в раствор приводит к изменению поведения микрочастиц в растворе (изменению их гидратации), то такой раствор относят к числу концентрированных. Концентрированными могут быть и насыщенные, и ненасыщенные растворы.
Чаще всего содержание растворенного вещества в растворе выражают через массовую (мольную) долю или через молярную концентрацию. Массовая доля растворенного вещества w (дубль вэ) равна
w = =
где mр.в. – масса растворенного вещества, mр-ра – масса раствора, mр-ритель – масса растворителя. Массовую долю растворенного вещества выражают или в долях единицы, или в процентах.
Молярная концентрация, как уже было сообщено в разделе 7, – это отношение числа молей растворенного вещества к объему раствора, выраженному в кубических дециметрах или в литрах.
Кроме массовой доли и молярной концентрации, существуют многие другие способы выражения содержания в растворе растворенного вещества. К их числу принадлежат: а) титр раствора – масса растворенного вещества (в миллиграммах и т.п. единицах) в 1 мл раствора, б) нормальность раствора (число молей вещества, деленное на число эквивалентности данного соединения в 1 л раствора. Например, для серной кислоты, для которой число эквивалентности равно 2, однонормальный раствор – это раствор, содержащий 98:2 = 49 г H
Задание на дом
1. Сколько граммов хлорида натрия надо внести в 100 г воды, чтобы приготовить 10%-й раствор?
2. Сколько литров (н.у.) газа хлороводорода надо дополнительно растворить в 200 мл 20%-й соляной кислоты (плотность 1,1 г/см3), чтобы получить 30%-ю соляную кислоту?
3. Сколько миллилитров воды и 25%-го раствора серной кислоты надо взять для приготовления 1 кг 12%-го раствора серной кислоты?
Сколько миллилитров воды и 25%-го раствора серной кислоты надо взять для приготовления 1 кг 12%-го раствора серной кислоты?
4. Как экспериментально различить ненасыщенный, насыщенный и пересыщенный растворы?
5. 500 г ВаCl2·2H2O растворили в 10 л воды. Какова массовая доля хлорида бария в полученном растворе?
6. Укажите все факторы, позволяющие повысить скорость растворения сахара в воде.
Краткий конспект подготовки к ЗНО по химии № 7 Раствор
Качественный и количественный состав растворов
Раствор – это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности.
Жидкие растворы (в дальнейшем будем называть их просто «растворами») состоят из жидкого 
Состав растворов обычно передаётся содержанием в них растворённого вещества в виде массовой доли или молярной концентрации.
Массовая доля и молярная концентрация растворённого вещества
Массовая доля ω (В) растворенного вещества В – это отношение его массы m (B) к массе раствора m (р), где m (р) = m (вещества) + m .
Единица массовой доли вещества в растворе – доля от единицы или от 100%.
Пример:
Если в 100 г раствора находится 1 г , то ω () = 0,01 (1%). Такой раствор называют однопроцентным (1%-ный раствор KBr).
Для приготовления 100 г 1%-ного раствора некоторой соли надо взять 1 г этой соли и 99 г воды.
Молярная концентрация – количество растворённого вещества (число молей) в единице объёма раствора.
Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации , которое принято обозначать М. Так, раствор с концентрацией 0,5моль/л называют 0,5-молярным.
Возможно другое обозначение молярной концентрации , которое принято обозначать М. Так, раствор с концентрацией 0,5моль/л называют 0,5-молярным.
,
где:
ν – количество растворённого вещества, моль;
V – общий объём раствора, л.
Пример: Если в 1 л раствора содержится 1 моль KBr, то с (KBr) = 1 моль/л. Такой раствор называют одномолярным и обозначают 1М. Аналогичным образом записи 0,1М; 0,01М и 0,001М означают деци-, санти- и миллимолярный раствор.
Для приготовления 1 л 1М раствора KBr необходимо взять навеску соли с количеством вещества 1 моль (то есть 119 г), растворить ее в воде объемом, например, 0,8 л (то есть обязательно меньше 1 л) и затем довести объем раствора до 1 л добавлением воды.
Объем раствора V (р) при данной температуре связан с массой раствора m (р) и его плотностью (ρ) следующим образом: m (р) = ρ • V (р).
Например, 100 г некоторого раствора с плотностью 1,074 г/мл (1074 г/мл) имеет объем 93,1 мл (0,0931 л).
Энергетика растворения
Процесс растворения твердого вещества в воде сопровождается разрушением кристаллической решетки (затрата энергии в форме теплоты, -Qкр) и гидратацией – образованием гидратов B , то есть соединений переменного состава между частицами растворенного вещества и молекулами воды (выделение теплоты, +Qгидр).Рис.1.
В результате общий тепловой эффект растворения равен
Q(р) = —Qкр + Qгидр
Если тепловой эффект растворения:
1. положительный (Q(р) больше 0), то после растворения вещества раствор становится теплее (например, это происходит в случае приготовления раствора )
2. если же тепловой эффект отрицательный (Q(р) меньше 0), то раствор становится холоднее (иногда температура может опуститься ниже 0°С, например для или ).
3. В тех редких случаях, когда Q(р) = 0, температура раствора остается постоянной (например, для NaCl).
Переход в раствор жидких и газообразных веществ также сопровождается гидратацией их молекул и положительным тепловым эффектом.
Поэтому в соответствии с принципом Ле-Шателье повышение температуры ведет к уменьшению растворимости газов в воде.
Таким образом, растворение – это физико-химический процесс разрушения связей в исходных веществах и образования новых связей в гидратах. Это положение является основным содержанием химической теории растворов Д.И. Менделеева.
Кристаллогидраты
Многие гидраты оказываются настолько устойчивыми, что не разрушаются и приполном выпаривании раствора.
Так, известны твердые кристалогидраты:
– пентагидрат сульфата меди(II)
– декагидрат карбоната натрия
– додекагидрат сульфата алюминия-калия.
Если для приготовления раствора используют не безводное вещество, а его кристаллогидрат B , то следует при расчетах учитывать воду, которая входит в состав кристаллогидрата (кр). Массу кристаллогидрата mкр определяют по формуле
Массу кристаллогидрата mкр определяют по формуле
mкр =(mB/MB)Mкр,
где MB и Mкр– молярные массы соответственно безводного растворяемого вещества и его кристаллогидрата.
Определение массы воды , которую следует добавить к рассчитанной массе кристаллогидрата для приготовления его раствора заданного состава, ведут по формуле
= m(раствора) – mкр.
Тесты подготовки к ЗНО:
Online-тест подготовки к ЗНО по химии №7 «Растворы»
Online-тест подготовки к ЗНО по химии№8 «Повторение»
Online-тест подготовки к ЗНО по химии №9 «Срез 1»
Растворы. Растворение
Цели урока.
- Формирование представлений о растворении как физико-химическом процессе, растворах как физико-химических системах и их классификации.
- Формирование понятий раствор, растворение, диссоциация, гидратация.
Оборудование и реактивы: сахар, хлорид
натрия, сульфат меди (II), пересыщенный раствор
ацетата натрия, борная кислота, этанол, керосин,
охлажденная дистиллированная вода, термометр,
химические стаканы – 6 шт.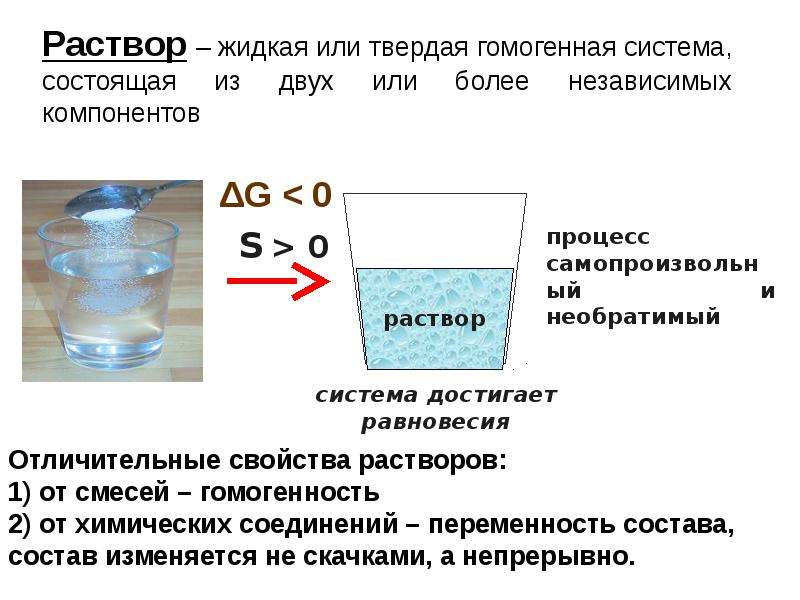 , ступка с пестиком,
пробирки – 2 шт., спиртовка, стеклянные палочки –
8 шт.
, ступка с пестиком,
пробирки – 2 шт., спиртовка, стеклянные палочки –
8 шт.
Ход урока
1. Учитель дает представление о многообразии растворов в окружающем мире, о существовании растворов с разным агрегатным состоянием и их отличительных признаках. Делается акцент на водных растворах как наиболее часто используемых в деятельности человека. На конкретных примерах рассматриваются существенные признаки растворов.
2. На основе демонстрационных экспериментов выявляются процессы, протекающие при растворении, делаются первые попытки определения процесса растворения.
Эксперимент 1
В 2 стакана наливаем по 50 мл воды. В первый стакан опустим несколько крупных кристаллов сульфата меди (II), в другой – такое же количество перетертого в ступке сульфата меди (II).
В стакане с перетертым сульфатом меди голубое
окрашивание появляется быстрее, а мелкие
кристаллы исчезают. В другом стакане процесс
растворения протекает медленнее. Измельченные
вещества растворяются быстрее.
В другом стакане процесс
растворения протекает медленнее. Измельченные
вещества растворяются быстрее.
Делается вывод о необходимости измельчения и перемешивания компонентов раствора.
На основе видеофрагмента и схемы рассматривается сущность процессов диссоциации и гидратации растворенного вещества.
3. Выводятся основные определения понятий темы.
Растворение – это физико-химический процесс, включающий в себя разрушение кристаллической решетки вещества (диссоциацию) и взаимодействие образовавшихся частиц с молекулами растворителя (сольватацию).
Растворы – это однородная устойчивая система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.
На основе определения проверятся усвоение
учащимися различия растворов и неоднородных
смесей, растворения и других физических и
химических процессов.
Закрепляются и фиксируются основные понятия темы.
Растворение — физико-химический процесс, включающий в себя разрушение кристаллической решетки вещества и взаимодействие образовавшихся частиц с молекулами растворителя.
Диссоциация — распад вещества на составные части.
Гидратация – химическое взаимодействие вещества с водой.
Раствор — однородная устойчивая система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.
4. Классификация растворов по количеству растворенного вещества. Определение зависимости растворимости от температуры.
Эксперимент 2
В 4 стакана нальем по 50 мл воды, охлажденной до 15
градусов Цельсия. Поместим по 5 г сахара, соли
(хлорида натрия), сульфата меди (II) и борной
кислоты в стаканы и тщательно перемешаем.
Борная кислота лишь частично растворилась.
Добавляем следующие 5 г сульфата меди (II), соли и сахара.
Нерастворившиеся кристаллы сульфата меди (II) оседают на дно стакана.
В оставшиеся стаканы добавим еще 10г соли и сахара, перемешаем растворы.
Соль полностью не растворилась, а сахар по прежнему полностью растворился в воде.
Нагреем получившиеся растворы.
При нагревании осадки полностью растворились.
Добавим еще немного веществ в соответствующие растворы.
Добавленные вещества продолжают растворяться.
Делается вывод о существовании насыщенных и ненасыщенных растворов и их признаках.
Эксперимент 3
“Мгновенная” кристаллизация пересыщенного раствора ацетата натрия.
Вывод о существовании неустойчивых
пересыщенных растворов и их отличительных
особенностях.
- Разбор опорного конспекта и фиксация его учащимися.
- Домашнее задание: карточки с задачами о растворах, §24, вопр. 1-4.
Приложение 1
Приложение 2
5.1. Общая характеристика и классификация растворов
Глава 5. РАСТВОРЫ.
5.1. Общая характеристика и классификация растворов.
Если в сосуд с водой поместить кристаллы поваренной соли, сахара или перманганата калия (марганцовки), то мы можем наблюдать, как количество твердого вещества постепенно уменьшается. При этом вода, в которую были добавлены кристаллы, приобретает новые свойства: у нее появляется соленый или сладкий вкус (в случае марганцовки появляется малиновая окраска), изменяется плотность, температура замерзания и т.д. Полученные жидкости уже нельзя назвать водой, даже если они неотличимы от воды по внешнему виду (как в случае с солью и сахаром). Это – растворы.
Раствор — однородная многокомпонентная система, состоящая из растворителя, растворённых веществ и продуктов их взаимодействия.
Растворы не отстаиваются и сохранятся все время однородными. Если раствор профильтровать через самый плотный фильтр, то ни соль, ни сахар, ни марганцевокислый калий не удается отделить от воды. Следовательно, эти вещества в воде раздроблены до наиболее мелких частиц – молекул. Молекулы могут опять собраться в кристаллы только тогда, когда мы выпарим воду. Таким образом, растворы – это молекулярные смеси.
По агрегатному состоянию растворы могут быть жидкими (морская вода), газообразными (воздух) или твёрдыми (многие сплавы металлов).
Размеры частиц в истинных растворах — менее 10-9 м (порядка размеров молекул).
Любой раствор состоит из растворителя и растворенного вещества. В приведенных примерах растворителем является вода. Но не всегда обязательно вода является растворителем. Например, можно получить раствор воды в серной кислоте. Здесь растворителем будет кислота. Можно приготовить и растворы кислоты в воде.
Из двух или нескольких компонентов раствора растворителем является тот, который взят в большем количестве и имеет то же агрегатное состояние, что и раствор в целом.
Рассмотрим, как происходит растворение веществ. Для этого понаблюдаем, как растворяется добавленный в чай сахар. Если чай холодный, то сахар растворяется медленно. Наоборот, если чай горячий и размешивается ложечкой, то растворение происходит быстро.
Попадая в воду, молекулы сахара, находящиеся на поверхности кристаллов сахарного песка, образуют с молекулами воды донорно-акцепторные (водородные) связи. При этом с одной молекулой сахара связывается несколько молекул воды. Тепловое движение молекул воды заставляет связанные с ними молекулы сахара отрываться от кристалла и переходить в толщу молекул растворителя (рис. 5.1).
Рекомендуемые файлы
Рис. 5.1. Молекулы сахара (белые кружочки), находящиеся на поверхности кристалла сахара, окружены молекулами воды (темные кружочки). Между молекулами сахара и воды возникают водородные связи, благодаря которым молекулы сахара отрываются от поверхности кристалла. Молекулы воды, не связанные с молекулами сахара, на рисунке не показаны.
Между молекулами сахара и воды возникают водородные связи, благодаря которым молекулы сахара отрываются от поверхности кристалла. Молекулы воды, не связанные с молекулами сахара, на рисунке не показаны.
Молекулы сахара, перешедшие из кристалла в раствор, могут передвигаться по всему объему раствора вместе с молекулами воды благодаря тепловому движению. Это явление называется диффузией. Диффузия происходит медленно, поэтому около поверхности кристаллов находится избыток уже оторванных от кристалла, но еще не диффундировавших в раствор молекул сахара. Они мешают новым молекулам воды подойти к поверхности кристалла, чтобы связаться с его молекулами водородными связями. Если раствор перемешивать, то диффузия происходит интенсивнее и растворение сахара идет быстрее. Молекулы сахара распределяются равномерно и раствор становится одинаково сладким по всему объему.
Количество молекул, способных перейти в раствор, часто ограничено. Молекулы вещества не только покидают кристалл, но и вновь присоединяются к кристаллу из раствора.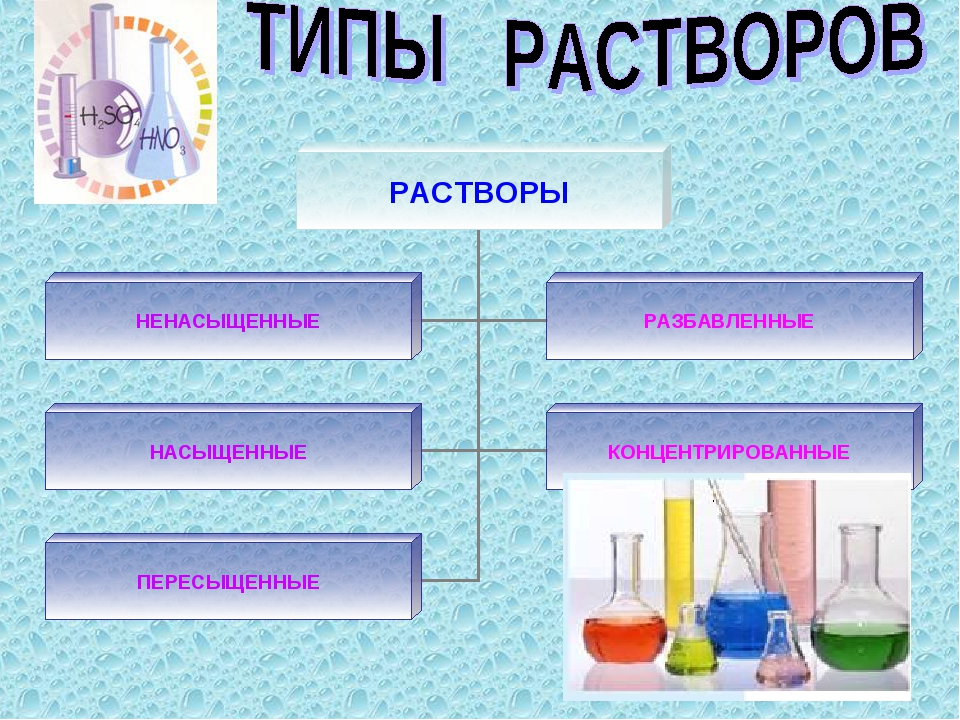 Пока кристаллов относительно немного, больше молекул переходит в раствор, чем возвращается из него – идет растворение. Но если растворитель находится в контакте с большим количеством кристаллов, то число уходящих и возвращающихся молекул становится одинаковым и для внешнего наблюдателя растворение прекращается.
Пока кристаллов относительно немного, больше молекул переходит в раствор, чем возвращается из него – идет растворение. Но если растворитель находится в контакте с большим количеством кристаллов, то число уходящих и возвращающихся молекул становится одинаковым и для внешнего наблюдателя растворение прекращается.
Растворы делятся на ненасыщенные, насыщенные и перенасыщенные.
Ещё посмотрите лекцию «Функционирование ЛВС» по этой теме.
Насыщенным раствором называется раствор, находящийся в динамическом равновесии с твердым растворяемым веществом. Под динамическим равновесием понимают то, что уравниваются скорости двух процессов: перехода растворяемого вещества в раствор и выпадения его из раствора. Иными словами, насыщенный раствор характеризуется строго определенным содержанием растворенного вещества в фиксированном количестве растворителя при данной температуре.
Например, если поместить 50 г NaCl в 100 г H2O, то при 20ºC растворится только 36 г соли.
Ненасыщенный раствор — раствор, содержащий меньше вещества, чем в насыщенном растворе.
Поместив в 100 г воды при 20ºC меньше 36 г NaCl, мы получим ненасыщенный раствор.
Перенасыщенный раствор — раствор, содержащий больше растворенного вещества, чем насыщенный.
Такой раствор находится в метастабильном (неустойчивом) равновесии. О его неустойчивости говорит то, что при любом физическом воздействии на него, например, встряхивании или образовании в растворе центра кристаллизации путем внесения кристалла, избыток растворенного вещества мгновенно выпадает в осадок: происходит кристаллизация вещества из пересыщенного раствора.
При нагревании смеси соли с водой до 1000 C произойдёт растворение 39,8 г NaCl в 100 г воды. Если теперь удалить из раствора нерастворившуюся соль, а раствор осторожно охладить до 20ºC, избыточное количество соли не всегда выпадает в осадок. В этом случае мы имеем дело с перенасыщенным раствором. Помешивание, встряхивание, добавление крупинок соли может вызвать кристаллизацию избытка соли и переход в насыщенное устойчивое состояние.
Помешивание, встряхивание, добавление крупинок соли может вызвать кристаллизацию избытка соли и переход в насыщенное устойчивое состояние.
В зависимости от содержания растворенного вещества растворы также разделяются на концентрированные и разбавленные. Эти понятия не надо путать с понятиями насыщенных и ненасыщенных растворов. Раствор может быть насыщенным, но в то же время и разбавленным. Примером этого могут служить растворы всех труднорастворимых солей. Например, раствор сульфата бария, полученный сливанием растворов хлорида бария и сульфата натрия. И наоборот, концентрированный раствор необязательно будет насыщенным. Примером такого раствора является 90%-ный раствор серной кислоты.
Проверочная работа к уроку химии «Растворение. Растворимость веществ в воде. Понятие об электролитах»
Проверочная работа: «Растворимость. Растворы»
В-1
1) Растворы – это однородная устойчивая система, состоящая из …
а) смеси растворённого вещества и воды;
б) частиц растворенного вещества, растворителя и продуктов их взаимодействия;
в) частиц растворённого вещества и любого растворителя, вне зависимости от возможности их взаимодействия.
2) Гидраты – это …
а) молекулы воды;
б) соединения, в которых образующим элементом выступает водород;
в) непрочные продукты, взаимодействия растворённого вещества с водой, существующие в растворе.
3) По какому признаку можно предположить, что растворение – это химический процесс?
а) выделение газа; б) выпадение осадка; в) изменение вкуса; г) выделение тепла.
4) Какой теории растворов придерживались С.Аррениус и Вант-Гофф?
а) химической; б) физической; в) математической; г) биологической.
5) От чего зависит растворимость твёрдых веществ в воде?
а) концентрация; б) разбавление; в) давление; г) температура.
6) Насыщенным называют раствор, в котором…
а) количество растворённого вещества меньше количества растворителя;
б) количество растворённого вещества больше количества растворителя;
в) растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется.
7) Вещество считается нерастворимым в воде если…
а) в 100г воды при комнатной температуре его растворятся более 1г.;
б) в 100г воды при комнатной температуре его растворятся от 0,1 до 1г.;
в) в 100г воды при комнатной температуре его растворятся менее 0,1г.
Приведите три примера таких веществ, используя таблицу растворимости.
8) Рассмотрите график зависимости растворимости веществ от температуры и выполните задания:
А) Определите количество нитрата калия – КNO3, которое может раствориться в 100г воды при 400С.
Б) Рассчитайте массовую долю (ω) нитрата калия, содержащегося в этом растворе при 400С.
В) Во сколько раз количество КNO3, способного раствориться в 100г воды, больше количества KClO3, при той же температуре?
9) Вещества, способные при растворении проводить электрический ток, называются:
а) электроны; б) электролиты; в) эмоленты; г) элементы.
10) Тип химической связи в молекулах неэлектролитов:
а) ионный; б) металлический; в) ковалентный неполярный; г) ковалентный полярный.
Проверочная работа: «Растворимость. Растворы»
В-2
1) Растворение — это …
а) химическая реакция между растворённым веществом и растворителем;
б) это процесс смешивания любого вещества с водой;
в) это процесс, разрушения кристаллической решетки вещества и взаимодействия образовавшихся частиц с молекулами растворителя.
2) Кристаллогидраты – это …
а) соли, в состав которых входят молекулы воды;
б) непрочные продукты, взаимодействия растворённого вещества с водой, существующие в растворе;
в) кристаллические вещества, способные растворяться в воде.
3) По какому сопутствующему процессу можно предположить, что растворение – это физический процесс?
а) излучение; б) диффузия; в) индукция; г) радиоактивность.
4) Какой теории растворов придерживался Д.И.Менделеев?
а) химической; б) физической; в) математической; г) биологической.
5) При повышении, какого фактора растворимость газов в воде уменьшается?
а) концентрации; б) объёма растворителя; в) давления; г) температуры.
6) Пересыщенным называют раствор, в котором…
а) количество растворённого вещества меньше количества растворителя;
б) количество растворённого вещества больше количества растворителя;
в) растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется.
7) Вещество считается растворимым в воде если…
а) в 100г воды при комнатной температуре его растворятся более 1г.;
б) в 100г воды при комнатной температуре его растворятся от 0,1 до 1г.;
в) в 100г воды при комнатной температуре его растворятся менее 0,1г.
Приведите три примера таких веществ, используя таблицу растворимости.
8) Рассмотрите график зависимости растворимости веществ от температуры и выполните задания:
График такой же как и в первом варианте.
А) Определите количество хлорида натрия – NaCl, которое может раствориться в 100г воды при 800С.
Б) Рассчитайте массовую долю (ω) хлорида натрия, содержащегося в этом растворе при 800С.
В) Во сколько раз количество NaCl, способного раствориться в 100г воды, меньше количества K2Cr2O7, при той же температуре?
9) Вещества, при растворении которых не происходит их распад на ионы, отчего их растворы не проводят электрический ток, называются:
а) неметаллы; б) электролиты; в) неодимы; г) неэлектролиты.
10) Тип химической связи в молекулах электролитов:
а) ионный; б) металлический; в) водородный; г) ковалентный неполярный.
Растворы (реферат) — На 5 баллов
Растворы
Растворами называются термодинамически устойчивые гомогенные системы, состоящие из двух и более веществ, а также продуктов их взаимодействия между собой.
Вещества, образующие раствор, называются иначе его компонентами. Их состав и концентрация в растворе могут изменяться в пределах ограниченных взаимной растворимостью.
Характерной особенностью растворов является то, что составляющие их компоненты присутствуют в них в виде отдельных молекул или ионов, которые равномерно распределяются по всему объему системы. В связи с этим в растворах отсутствует поверхность раздела между веществами и не протекают поверхностные явления, приводящие к значительному увеличению внутренней энергии. Такие растворы называются иначе истинными. Они являются термодинамически устойчивыми, образуются самопроизвольно и могут существовать неограниченно долгое время, если не изменять их количественный состав и условия хранения.
Истинные растворы в зависимости от своего агрегатного состояния подразделяются на газообразные, твердые и жидкие.
Газообразные растворы называются иначе газовыми смесями. Примером такой смеси может служить земная атмосфера, состоящая, главным образом, из азота и кислорода, а также некоторых других веществ, присутствующих в значительно меньших количествах (углекислого газа, водяных паров, благородных газов и т. д.).
д.).
Твердыми растворами являются многие сплавы металлов, некоторые неорганические минералы. Образуются твердые растворы при кристаллизации расплавов.
Наибольшее распространение в природе и в хозяйственной деятельности человека получили жидкие растворы. Они, в свою очередь, подразделяются на растворы газов в жидкостях, жидкостей в жидкостях и растворы твердых веществ в жидкостях.
Различают также растворы низкомолекулярных соединений (НМС) и растворы высокомолекулярных соединений (ВМС). Последние по многим свойствам значительно отличаются от растворов НМС и поэтому будут рассмотрены отдельно.
При характеристике составных частей жидких растворов используют понятия растворитель и растворенное вещество. Однако, провести между ними четкую разграничительную линию удается не всегда. Легче всего это сделать, если образующие раствор вещества, в индивидуальном виде находятся в разных агрегатных состояниях. В этом случае растворителем всегда считается то вещество, которое при тех же условиях, что и получившийся раствор, является жидкостью. Твердые и газообразные вещества, входящие в состав такого раствора, называются растворенными веществами.
Твердые и газообразные вещества, входящие в состав такого раствора, называются растворенными веществами.
При образовании раствора из двух смешивающихся жидкостей растворителем чаще всего называют то вещество, которое присутствует в растворе в бóльших количествах, или же по взаимной договоренности какое-то конкретное вещество (например, Н2О), независимо от его содержания в системе.
К твердым растворам и газовым смесям понятия растворитель и растворенное вещество не применяют.
Жидкие растворы, в которых в качестве растворителя выступает Н2О, называются водными. Если растворителем является какая-то другая жидкость — неводными.
Для медицины наибольшее значение имеют водные растворы, т.к. Н2О является универсальным растворителем для веществ самой различной природы и составляет основную часть внутренней среды человеческого организма. В зависимости от возраста человека на долю воды в его теле может приходиться от 80 до 50% по массе. При этом важнейшие биологические жидкости (кровь, лимфа, моча, слюна, пот и т. д.) содержат в своем составе различные растворенные вещества: неорганические соли, белки, углеводы, аминокислоты и другие гетеро- и полифункциональные органические соединения. В водной среде в живых организмах протекают многочисленные биохимические реакции. Усваивание пищи связано с переходом питательных веществ в растворенное состояние. Это облегчает их дальнейшую транспортировку биологическими жидкостями к органам и тканям. Выведение из организма метаболитов также осуществляется путем перевода их в растворенное состояние.
д.) содержат в своем составе различные растворенные вещества: неорганические соли, белки, углеводы, аминокислоты и другие гетеро- и полифункциональные органические соединения. В водной среде в живых организмах протекают многочисленные биохимические реакции. Усваивание пищи связано с переходом питательных веществ в растворенное состояние. Это облегчает их дальнейшую транспортировку биологическими жидкостями к органам и тканям. Выведение из организма метаболитов также осуществляется путем перевода их в растворенное состояние.
Физические свойства Н2О и строение ее молекул
При комнатных условиях чистая вода — жидкость без запаха и вкуса. Температура кипения Н2О (при р=101,325 кПа) равна 100оС, температура замерзания 0оС. В тонком слое вода бесцветна, однако при толщине более двух метров приобретает голубоватый оттенок. Вода является хорошим растворителем для многих веществ, поэтому чистой Н2О в природе нет. Она всегда содержит многочисленные примеси растворенных веществ. Для очистки от них воду доводят до кипения, а образовавшиеся при этом водяные пары путем охлаждения вновь конденсируют в жидкость. Этот процесс называют «перегонкой», а получившуюся Н2О — дистиллированной водой.
Этот процесс называют «перегонкой», а получившуюся Н2О — дистиллированной водой.
Молекулы Н2О состоят из двух атомов водорода Н и одного атома кислорода О, соединенных между собой ковалентными полярными связями. На атоме О, как на более электроотрицательном сосредоточен частичный отрицательный заряд |δ-| < 1, а на атомах Н — частичный положительный заряд |δ+| < 1. Молекула Н2О имеет угловую форму. Атомы водорода, связанные одинарными δ-связями с атомами кислорода, образуют угол, равный 104,5о (рис. 16). Он несколько отличается от тетраэдрического (109о28′), хотя атом О в молекуле Н2О находится в состоянии sp3-гибридизации.
Отклонение угла связи от тетраэдрического связано с взаимным отталкиванием двух неподеленных электронных пар, находящихся на гибридных орбиталях атома кислорода.
Рис. 1 — Схема образования молекулы Н2О
Вследствие своего строения молекула Н2О обладает значительным дипольным моментом (рис. 17) и является сильнополярной. В связи с этим вода имеет большую диэлектрическую проницаемость и в ее среде значительно уменьшаются (приблизительно в 80 раз) кулоновские силы взаимодействия между электрическими зарядами. Это приводит к тому, что прочность связей в ионной кристаллической решетке, а также между полярными молекулами твердых и жидких веществ и между атомами в самих этих молекулах тоже понижается ≈ в 80 раз.
Это приводит к тому, что прочность связей в ионной кристаллической решетке, а также между полярными молекулами твердых и жидких веществ и между атомами в самих этих молекулах тоже понижается ≈ в 80 раз.
d
≠ 0
Рис. 2 — Дипольный момент молекулы Н2О
Благодаря этому свойству вода хорошо растворяет вещества, образованные ионными и ковалентными полярными связями, вызывая при этом электролитическую диссоциацию электролитов и реакции гидролитического разложения веществ.
Вода по сравнению с другими водородными соединениями элементов IVA — VIIA групп (HCl, h3S, Ch5, HF, Nh4) имеет аномально высокие температуры кипения и плавления, обладает высокой теплоемкостью и удельной теплотой испарения.
Эти свойства воды объясняются способностью ее молекул образовывать друг с другом прочные водородные связи. Причем одна молекула Н2О может образовать водородные связи с четырьмя другими молекулами воды. Это создает возможность построения сложной трехмерной пространственной структуры из ассоциированных молекул Н2О, в которой имеется много пустот. Благодаря этому плотность льда меньше плотности жидкой воды, т.к. в последнем случае вследствие теплового движения происходит частичное разрушение водородных связей и образовавшиеся свободные молекулы воды могут заполнять имеющиеся полости, увеличивая тем самым плотность жидкости.
Благодаря этому плотность льда меньше плотности жидкой воды, т.к. в последнем случае вследствие теплового движения происходит частичное разрушение водородных связей и образовавшиеся свободные молекулы воды могут заполнять имеющиеся полости, увеличивая тем самым плотность жидкости.
Водородные связи молекулы Н2О могут образовывать не только между собой, но и с полярными функциональными группами органических веществ: спиртов, аминов, карбоновых кислот, различных гетеро- и полифункциональных соединений, способствуя тем самым их растворению.
Таким образом, вода является универсальным растворителем и способна растворять в себе как многочисленные неорганические, так и органические соединения.
Механизм образования растворов
Растворы занимают промежуточное положение между механическими смесями веществ и индивидуальными химическими соединениями, обладая определенными свойствами и тех и других систем и в тоже время значительно отличаясь от каждой из них.
Так по сравнению со смесями растворы являются более однородными и в любой своей части обладают одинаковыми физическими свойствами и химическим составом, как и индивидуальные соединения.
В то же время многие вещества в растворах, как и в механических смесях, сохраняют неизменными часть свойств, присущих им в чистом виде. В отличие от индивидуальных соединений растворы обладают переменным составом и отличаются природой связи между своими структурными единицами. Если для химических веществ характерны ковалентные и ионные связи, то в растворах между их компонентами присутствуют более слабые диполь-дипольные, ион-дипольные или ван-дер-ваальсовые взаимодействия, а в некоторых случаях — водородные связи и донорно-акцепторные взаимодействия.
Таким образом, процесс растворения нельзя рассматривать как простое механическое распределение одного вещества в другом.
Дмитрий Иванович Менделеев (1834-1907)
Поистине великий ученый. Нет, кажется, ни одной области химии, в которую бы он не внес свой вклад. Наиболее известные его работы, кроме периодического закона, это открытие «температуры абсолютного кипения» (критической точки), разработка физико-химической (гидратной) теории растворов, формулировка обобщенного газового закона. Еще одним главным делом своей жизни Д.И. Менделеев считал учебник «Основы химии».
Еще одним главным делом своей жизни Д.И. Менделеев считал учебник «Основы химии».
При растворении имеет место физико-химическое взаимодействие растворяемого вещества с молекулами растворителя, в результате которого разрушается его исходная структура и происходит образование новой структуры, свойственной раствору. При этом различают физическую и химическую стадии растворения вещества, которые протекают одновременно.
На физической стадии происходит процесс измельчения (диспергирования) растворяемого вещества до отдельных молекул или ионов и их равномерное распределение во всем объеме раствора. Осуществляется она за счет действия молекул растворителя на вещество и протекания процесса диффузии.
На этой стадии энергия всегда затрачивается, т.к. она необходима для разрыва связей в кристаллической решетке твердого вещества или межмолекулярных связей при растворении жидкости.
Покажем механизм этого процесса на примере растворения в Н2О соли KCl, имеющей ионную кристаллическую решетку (рис. 3).
3).
Диполи растворителя ориентируются соответствующим образом относительно ионов кристаллической решетки на ее поверхности и в результате своего теплового движения и колебательного движения ионов последовательно вырывают их из узлов решетки и переводят в раствор.
Чем прочнее связи в кристаллической решетке, тем большее количество энергии нужно затратить на ее разрушение. Межмолекулярные связи в жидкостях, как правило, слабее чем в твердых веществах, поэтому при их растворении энергии затрачивается гораздо меньше.
Рис. 3 — Механизм растворения ионного соединения (KCl) в воде
В газах молекулы практически не связаны между собой, поэтому на физической стадии их растворения энергия не расходуется.
На химической стадии растворения происходит взаимодействие частиц растворенного вещества (молекул или ионов) с молекулами растворителя и образуются химические соединения: гидраты (если в роли растворителя выступает Н2О) или сольваты (если растворителем выступает любая другая жидкость).
В зависимости от природы растворенного вещества сольваты (гидраты) могут образовываться как в результате физических взаимодействий: ион-дипольного (при растворении веществ с ионной структурой) и диполь-дипольного (при растворении веществ с молекулярной структурой), так и химических.
Химические взаимодействия осуществляются за счет образования донорно-акцепторных связей. При этом ионы растворенного вещества являются акцепторами, а молекулы растворителя (Н2О, Nh4) — донорами электронных пар. Образующиеся таким образом гидраты называются иначе аквакомплексами: [Cu(h3O)6]2+, [Al(Н2О)6]3+. Их образование в растворах часто сопровождается изменением окраски. Так растворение безводного медь(II)-сульфата белого цвета приводит к появлению интенсивной голубой окраски. Гидратные оболочки полярных молекул органических соединений появляются в результате образования водородных связей между их функциональными группами и молекулами воды.
Вследствие образования гидратов (сольватов) при растворении многих веществ имеет место контрактация — сжатие объема системы из-за ее самоуплотнения (особенно в случае концентрированных растворов). При этом объем получившегося раствора будет меньше суммы объемов растворителя и растворяемого вещества (если только последнее не является газом).
При этом объем получившегося раствора будет меньше суммы объемов растворителя и растворяемого вещества (если только последнее не является газом).
Образование гидратных (сольватных) оболочек всегда сопровождается выделением энергии. При гидратации ионов количество выделившейся энергии и число удерживаемых молекул воды зависят от величины их заряда и радиуса.
Чем больше заряд иона и меньше его радиус, тем большее количество энергии выделяется и тем более устойчивой будет образовавшаяся гидратная оболочка (рис. 4).
Рис. 4 — Зависимость размеров гидратных оболочек ионов от величины их радиуса
Если вещество в растворе находится в виде молекул, то количество выделяемой при гидратации энергии пропорционально полярности его молекул.
В ходе теплового движения частицы растворенного вещества в растворе перемещается вместе со своими гидратными (сольватными) оболочками, которые составляют с ними одно целое.
В большинстве случаев образовавшиеся гидратные (сольватные) оболочки являются непрочными и легко разрушаются уже при слабом нагревании или при выпадении веществ из раствора. Но иногда гидратные соединения настолько устойчивы, что выпадают из раствора в виде кристаллов, которые называются иначе кристаллогидратами, а содержащаяся в них Н2О — кристаллизационной.
Но иногда гидратные соединения настолько устойчивы, что выпадают из раствора в виде кристаллов, которые называются иначе кристаллогидратами, а содержащаяся в них Н2О — кристаллизационной.
В химических формулах кристаллогидратов молекулы Н2О пишутся через точку (табл. 1). Из этих формул видно, сколько молекул Н2О окружают одну молекулу вещества.
Таблица 1 — Формулы и тривиальные названия кристаллогидратов
Название кристаллогидрата
Химическая формула
Сода кристаллическая
Na2CO3 · 10 Н2О
Медный купорос
CuSO4 · 5 Н2О
Железный купорос
FeSO4 · 7 Н2О
Глауберова соль
Na2SO4 · 10 Н2О
Английская соль
MgSO4 · 7 Н2О
Гипс
CaSO4 · 2 Н2О
Алебастр
CaSO4 · 0,5 Н2О
При нагревании (иногда достаточно сильном) кристаллогидраты разрушаются, а кристаллизационная Н2О испаряется.
Физическая и химическая стадии процесса растворения протекают одновременно. Суммарный тепловой эффект при растворении вещества определяется соотношением между двумя этими стадиями.
Суммарный тепловой эффект при растворении вещества определяется соотношением между двумя этими стадиями.
Если на физической стадии энергии затрачивается больше, чем её выделяется на химической стадии, то при растворении такого вещества температура раствора будет понижаться, а энергия, в целом, затрачиваться. Это наблюдается, например, при растворении NaCl, Nh5NO3.
Если же на физической стадии энергии расходуется меньше, чем выделяется на химической стадии, то при растворении таких веществ температура раствора, наоборот, будет повышаться, а энергия, в целом, выделяться. Особенно хорошо это наблюдается при растворении в воде NaOH, KOH, h3SO4.
Если на физической стадии затрачивается примерно столько же энергии, сколько выделяется на химической, то температура раствора при растворении такого вещества практически не будет меняться.
При растворении газов теплота всегда выделяется, т.к. на физической стадии энергия не расходуется.
Тепловые эффекты растворения большинства веществ незначительны, поэтому заметного разогревания или охлаждения растворов, как правило, не наблюдается. Однако в некоторых случаях, например, при растворении в Н2О гидроксидов щелочных металлов или h3SO4, происходит настолько сильное разогревание раствора, что он может даже закипеть. Поэтому при приготовлении водных растворов кислот и щелочей требуется особая осторожность. В частности, при получении разбавленного раствора h3SO4 нужно приливать небольшими порциями концентрированную кислоту в Н2О, а не наоборот.
Однако в некоторых случаях, например, при растворении в Н2О гидроксидов щелочных металлов или h3SO4, происходит настолько сильное разогревание раствора, что он может даже закипеть. Поэтому при приготовлении водных растворов кислот и щелочей требуется особая осторожность. В частности, при получении разбавленного раствора h3SO4 нужно приливать небольшими порциями концентрированную кислоту в Н2О, а не наоборот.
При растворении NaCl или Nh5NO3 температура раствора может, понизиться до минусовой.
Теплоту, выделяемую или поглощаемую при растворении 1 моля вещества называют его теплотой растворения (Qраств.).
Растворимость веществ. Факторы, влияющие на растворимость
Одни вещества лучше растворяются в том или ином растворителе, другие хуже. Считается, что абсолютно нерастворимых веществ нет. Каждое вещество способно к растворению, пусть даже в некоторых случаях и в очень незначительных количествах (например, ртуть в воде, бензол в воде).
К сожалению, до настоящего времени, нет теории, с помощью которой можно было бы предсказать и вычислить растворимость любого вещества в соответствующем растворителе. Обусловлено это сложностью и многообразием взаимодействия компонентов раствора между собой и отсутствием общей теории растворов (особенно концентрированных). В связи с этим необходимые данные по растворимости веществ получают, как правило, опытным путем.
Обусловлено это сложностью и многообразием взаимодействия компонентов раствора между собой и отсутствием общей теории растворов (особенно концентрированных). В связи с этим необходимые данные по растворимости веществ получают, как правило, опытным путем.
Количественно способность вещества к растворению характеризуется чаще всего растворимостью или коэффициентом растворимости (S).
Растворимость (S) показывает сколько граммов вещества может максимально раствориться при данных условиях (температуре, давлении) в 100 г растворителя с образованием насыщенного раствора.
При необходимости коэффициент растворимости определяется и для другого количества растворителя (например, для 1000 г, 100 см3, 1000 см3 и т.д.).
По растворимости все вещества в зависимости от своей природы делятся на 3 группы: 1) хорошо растворимые; 2) мало растворимые; 3) плохо растворимые или нерастворимые.
Коэффициент растворимости для веществ первой группы больше 1 г (на 100 г растворителя), для веществ второй группы лежит в интервале 0,01 — 1,0 г и для веществ третьей группы S < 0,01 г.
На растворимость веществ оказывают влияние многие факторы, главными из которых являются природа растворителя и растворяемого вещества, температура, давление, наличие в растворе других веществ (особенно электролитов).
Влияние природы веществ на растворимость
Установлено опытным путем, что в растворителе, молекулы которого полярны, лучше всего растворяются вещества, образованные ионными или ковалентными полярными связями. А в растворителе, молекулы которого неполярны, лучше растворяются вещества, образованные слабополярными или неполярными ковалентными связями. По другому эту выявленную закономерность можно сформулировать так: «Подобное растворяется в подобном».
Растворимость веществ во многом обуславливается силой и характером их взаимодействия с молекулами растворителя. Чем сильнее выражено это взаимодействие, тем больше растворимость и наоборот.
Известно, что силы, действующие между неполярными и слабополярными молекулами, невелики и неспецифичны, т. е. в количественном выражении существенно не зависят от вида вещества.
е. в количественном выражении существенно не зависят от вида вещества.
Если в неполярную жидкость В ввести однотипные неполярные молекулы А, то энергия взаимодействия частиц А и В между собой не будет значительно отличаться от энергии взаимодействия между частицами А и А или частицами В и В. Поэтому подобно тому как смешиваются любые количества одного и того же вещества, с большой вероятностью будут неограниченно смешиваться друг с другом (т.е. растворяться друг в друге) и различные неполярные жидкости.
По этой же причине и молекулярные кристаллы обычно лучше растворяются в неполярных жидкостях.
Если же энергия взаимодействия молекул А и А или В и В больше чем А и В, то одинаковые молекулы каждого компонента будут предпочтительнее связываться между собой и растворимость их друг в друге понизится (табл. 6).
Полярность любого растворителя часто характеризуют значением его диэлектрической проницаемости (ε), которая легко определяется опытным путем. Чем она больше, тем более полярным является вещество.
Таблица 2 — Растворимость KI (мас%) в растворителях различной полярности
Растворитель
Н2О
Ch4OH
н-С4Н9ОН
C6H6
Диэлектрическая проницаемость растворителя, ε
80,4
31,2
10,72
2,3
Растворимость, KI
59,8
14,97
0,2
0,00016
Растворимость веществ значительно повышается если они способны образовывать с растворителем водородные или донорно-акцепторные связи. Примером большой растворимости, обусловленной образованием водородных связей, является раствор этилового спирта в Н2О, а образованием донорно-акцепторных связей — раствор Nh4 в воде. При этом растворимость спирта не ограничена, а Nh4 в Н2О растворяется в объемном соотношении ~ 700 : 1.
Влияние давления на растворимость веществ
Влияние давления на растворимость твердых и жидких веществ практически не сказывается, т.к. объем системы при этом изменяется незначительно. Только при очень высоких давлениях изменение растворимости становится заметным. Так, например, растворимость Nh5NO3 снижается почти вдвое при повышении давления до 106 кПа (т.е. приблизительно в 10 000 раз больше атмосферного).
Так, например, растворимость Nh5NO3 снижается почти вдвое при повышении давления до 106 кПа (т.е. приблизительно в 10 000 раз больше атмосферного).
Существенное влияние давление оказывает лишь на растворимость газов. Причем если между газом и растворителем не возникает химического взаимодействия, то согласно закона Генри растворимость газа при постоянной температуре прямо пропорциональна его давлению над раствором
S = kp
где k — коэффициент пропорциональности, зависящий от природы жидкости и газа; p — давление газа над раствором.
Закон Генри справедлив только для разбавленных растворов и в условиях низких давлений.
Если речь идет о растворении не одного газообразного вещества, а смеси, состоящей из нескольких газов, то согласно закона Дальтона растворимость каждого компонента смеси при постоянной температуре пропорциональна его парциальному давлению над жидкостью и не зависит от общего давления смеси и присутствия других газов.
Парциальное давление отдельного газа в смеси (р1) рассчитывается по формуле:
р1 = робщ. · Х1
· Х1
где робщ. — общее давление газовой смеси; Х1 — мольная доля газа в смеси.
Если газовая смесь состоит из нескольких компонентов, то ее общее давление определяется суммой парциальных давлений всех газов, входящих в смесь:
робщ. = р1 + р2 + р3 + …
Газы, вступающие во взаимодействие с растворителем (например, Nh4, SO2, HCl) при растворении в Н2О закону Генри и Дальтона не подчиняются. Их растворимость также увеличивается с повышением давления, но по более сложной зависимости.
Понижение давления газа над раствором ведет к уменьшению его растворимости и выделению из жидкости в виде пузырьков.
Изменением растворимости газа при резком снижении давления обусловлена так называемая кессонная болезнь, которой могут заболеть водолазы, работающие глубоко под водой. В этих условиях они дышат воздухом, находящимся под большим давлением. При этом растворимость газов в крови сильно увеличивается. Если после окончания работы подниматься на поверхность слишком быстро, то вследствие резкого уменьшения давления избыточные газы, растворенные в крови, начинают бурно выделяться.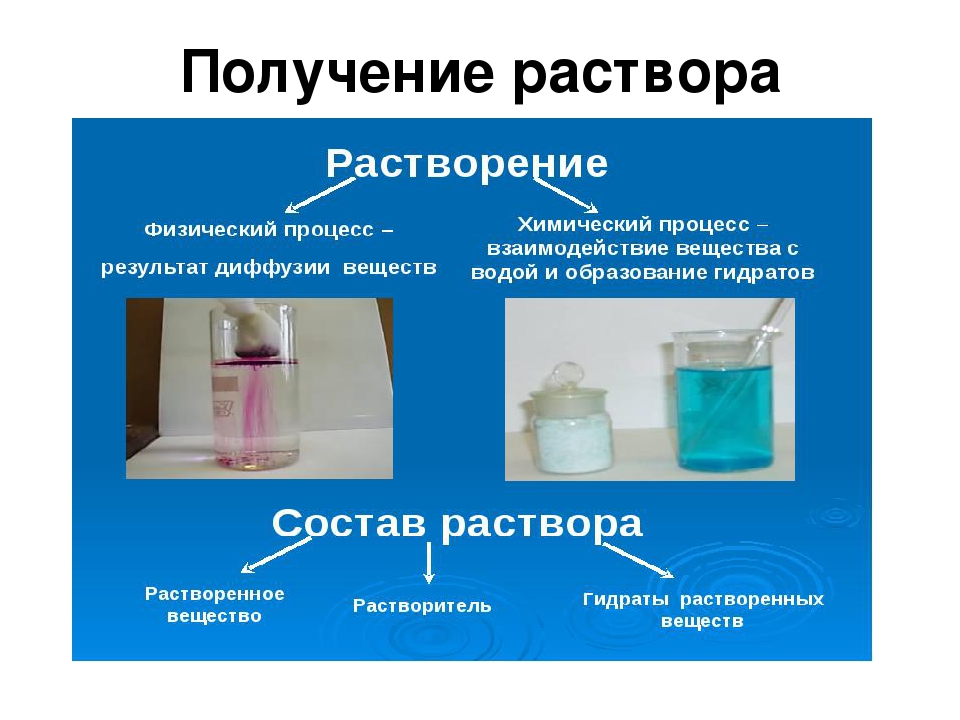 Образовавшиеся пузырьки закупоривают кровеносные сосуды, что приводит к нарушению кровообращения, многочисленным кровоизлияниям в различных тканях и органах из-за разрыва капилляров.
Образовавшиеся пузырьки закупоривают кровеносные сосуды, что приводит к нарушению кровообращения, многочисленным кровоизлияниям в различных тканях и органах из-за разрыва капилляров.
Поэтому подъем на поверхность с больших глубин должен быть достаточно долгим и медленным, чтобы лишний газ успевал удаляться из кровеносной системы через органы дыхания.
Аналогичная картина может возникнуть и при разгерметизации на большой высоте кабин и салонов самолетов, скафандров военных летчиков.
Влияние температуры на растворимость веществ
Растворимость большинства твердых и жидких веществ при повышении температуры в той или иной степени увеличивается. Для некоторых твердых веществ (особенно если при их растворении теплота выделяется) растворимость, наоборот, может понижаться с повышением температуры.
Зависимость растворимости веществ от температуры часто наглядно показывают при помощи графиков, которые называют кривыми растворимости (рис. 5). Растворимость газов уменьшается с повышением температуры. Длительным кипячением можно почти полностью удалить растворенные газы из жидкости. Насыщение же жидкости газом, наоборот, целесообразнее проводить при низких температурах.
Длительным кипячением можно почти полностью удалить растворенные газы из жидкости. Насыщение же жидкости газом, наоборот, целесообразнее проводить при низких температурах.
Изменением растворимости с температурой часто пользуются для очистки веществ путем перекристаллизации. При остывании горячего насыщенного раствора какой-либо соли, загрязненной посторонними примесями, значительная ее часть (соли) выделится в виде осадка, а загрязняющие примеси останутся в растворе, так как последний даже на холоде по отношению к ним не будет насыщенным.
Рис. 5 — Кривые растворимости твердых веществ (1) и газов (2) в зависимости от температуры
Подобным образом можно очищать лишь те твердые вещества, растворимость которых сильно зависит от температуры.
Влияние электролитов на растворимость веществ
Если растворитель содержит примеси, то растворимость веществ в нем уменьшается. Особенно сильно это заметно, когда в роли такого постороннего соединения выступает электролит, а растворяемым веществом является газ. Например, в 1 см3 Н2О при 20оС растворяется около 3 см3 газообразного Cl2, а в 1 см3 насыщенного раствора NaCl растворяется всего 0,3 см3 хлора. Русский ученый — физиолог И.М. Сеченов установил количественную зависимость между растворимостью газа и концентрацией электролита в растворе (закон Сеченова):
Например, в 1 см3 Н2О при 20оС растворяется около 3 см3 газообразного Cl2, а в 1 см3 насыщенного раствора NaCl растворяется всего 0,3 см3 хлора. Русский ученый — физиолог И.М. Сеченов установил количественную зависимость между растворимостью газа и концентрацией электролита в растворе (закон Сеченова):
S = S0e-kC
где S — растворимость газа в растворе электролита; S0 — растворимость газа в растворителе; С — молярная концентрация электролита в растворе; k — константа, зависящая от природы газа, электролита и температуры.
Закон Сеченова позволяет исследовать растворимость газов в крови, которая содержит в своем составе значительное число растворенных веществ, в том числе и электролитов.
Подобно газам при добавлении в раствор электролитов может понижаться растворимость и некоторых жидкостей, твердых веществ.
Это явление называют иначе высаливанием, т.к. в качестве электролита чаще всего используют соли.
Одной из причин уменьшения растворимости веществ в присутствии электролитов может быть образование прочных гидратных (сольватных) оболочек вокруг ионов, на которые распадаются электролиты. В результате этого количество свободных молекул жидкости, а значит и ее растворяющая способность, понижается.
В результате этого количество свободных молекул жидкости, а значит и ее растворяющая способность, понижается.
Взаимная растворимость жидкостей
При смешивании жидкостей в зависимости от их природы, характера и силы взаимодействия между молекулами возможны 3 случая: 1) неограниченная растворимость; 2) ограниченная растворимость; 3) практическая нерастворимость.
В первом случае жидкости смешиваются друг с другом в любых соотношениях с образованием однородного раствора (вода и глицерин, вода и этиловый спирт, бензол и толуол).
При ограниченной растворимости обе жидкости растворяются друг в друге достаточно хорошо, но их взаимная растворимость не безгранична и достигает при данных условиях какого-то определенного предела. Примером таких систем являются вода и фенол, вода и анилин, диэтиловый эфир и вода.
При смешивании анилина с водой образуется 2 слоя. В верхнем слое содержится больше воды и меньше анилина, а в нижнем слое — наоборот. Таким образом, верхний слой можно рассматривать как насыщенный раствор анилина в Н2О, а нижний — воды в анилине. При постоянной температуре эти слои будут находиться в состоянии равновесия и концентрация растворенных веществ в них будет оставаться строго определенной. Добавление к этой смеси некоторого количества анилина или воды приведет только к увеличению объема нижнего или верхнего слоя, но концентрации растворенных веществ в них не изменяются.
При постоянной температуре эти слои будут находиться в состоянии равновесия и концентрация растворенных веществ в них будет оставаться строго определенной. Добавление к этой смеси некоторого количества анилина или воды приведет только к увеличению объема нижнего или верхнего слоя, но концентрации растворенных веществ в них не изменяются.
Повышение температуры обычно вызывает увеличение взаимной растворимости жидкостей. В некоторых случаях это может привести к неограниченной растворимости, и жидкости будут смешиваться друг с другом при данных условиях в любых соотношениях.
Температура, выше которой оба компонента начинают неограниченно растворяться друг в друге, называется критической температурой растворения. Для смеси анилин — вода она равна 168оС, для смеси фенол — вода — 65,9оС.
Примером практически нерастворимых друг в друге жидкостей является вода и бензол, вода и ртуть. При смешивании эти системы разделяются на 2 слоя. Весьма вероятно, что в каждом слое в незначительном количестве будет присутствовать и другая жидкость (т. к. абсолютно нерастворимых веществ нет). Но ее концентрация будет настолько мала, что ею можно пренебречь.
к. абсолютно нерастворимых веществ нет). Но ее концентрация будет настолько мала, что ею можно пренебречь.
Если в такую двухслойную систему, состоящую из двух практически не смешивающихся жидкостей, внести небольшое количество какого-нибудь третьего вещества, то через некоторое время оно распределится между двумя слоями.
Например, если в систему вода — сероуглерод (CS2) поместить навеску I2 и смесь тщательно перемешать, то йод можно будут обнаружить и в водном и в сероуглеродном слоях. Однако концентрация I2 в СS2 будет значительно выше чем в Н2О. При введении дополнительного количества I2 изменится концентрация его в каждом слое, но отношение концентраций при данной температуре сохраняется постоянным. Оно также не изменится если прибавить к полученной трехкомпонентной системе сероуглерод или воду.
Таким образом при постоянной температуре отношение равновесных концентраций растворенного вещества, распределившегося между двумя несмешивающимися жидкостями, является величиной постоянной, независящей от общего количества компонентов. Эта закономерность называется иначе законом распределения Нернста. Математически он записывается следующим образом:
Эта закономерность называется иначе законом распределения Нернста. Математически он записывается следующим образом:
где С1 и С2 — концентрации растворенного вещества в первом и втором растворителе соответственно; K — коэффициент распределения.
На различной растворимости одного и того же вещества в несмешивающихся жидкостях основан метод его извлечения из разбавленного раствора.
По этому методу к исходному разбавленному раствору добавляют другой растворитель, несмешивающийся с растворителем в первом растворе, но хорошо растворяющий извлекаемое вещество. При этом из первоначального разбавленного раствора растворенное вещество переходит в слой добавленного растворителя и концентрируется в нем. Этот процесс называется экстракцией.
Вальтер Фридрих Нернст
Вальтер Фридрих Нернст (1864-1941) — немецкий ученый. Известен своими работами в области физической химии растворов. В 1898 г. им разработана теория гальванического элемента. Наибольшую известность Нернсту принесли термодинамические исследования веществ при низких температурах, в результате которых было установлено, что при температуре абсолютного нуля энтропия однородного твердого тела стремится к нулю (тепловая теорема Нернста). В 1920 г. В. Нернст был удостоен Нобелевской премии.
В 1920 г. В. Нернст был удостоен Нобелевской премии.
Экстракцию из растворов применяют для разделения близкокипящих жидкостей, жидкостей с малой летучестью паров и высокой температурой кипения, веществ, разлагающихся при нагревании, т.е. в тех случаях, когда разделение перегонкой малоэффективно или вообще невозможно. Например, пенициллин и ряд других антибиотиков нельзя концентрировать выпариванием из разбавленных растворов, т.к. эти соединения при нагревании разрушаются. Для получения концентрированных растворов антибиотиков проводят их экстракцию бутил или этилацетатом.
Способы выражения состава растворов
Состав любого раствора может быть выражен как качественно, так и количественно. Обычно, при качественной оценке раствора применяют такие понятия как, насыщенный, ненасыщенный, пересыщенный (или перенасыщенный), концентрированный и разбавленный раствор.
Насыщенным называется раствор, в котором содержится максимально возможное при данных условиях (t, р) количество растворённого вещества. Насыщенный раствор часто находится в состоянии динамического равновесия с избытком растворённого вещества, при котором процесс растворения и процесс кристаллизации (выпадения вещества из раствора) протекают с одинаковой скоростью.
Насыщенный раствор часто находится в состоянии динамического равновесия с избытком растворённого вещества, при котором процесс растворения и процесс кристаллизации (выпадения вещества из раствора) протекают с одинаковой скоростью.
Для приготовления насыщенного раствора растворение вещества необходимо вести до образования осадка, не исчезающего при длительном хранении.
Ненасыщенным называется раствор, который содержит вещества меньше, чем его может раствориться при данных условиях.
Перенасыщенные растворы содержат в себе по массе больше растворённого вещества, чем его может раствориться в данных условиях. Образуются перенасыщенные растворы при быстром охлаждении насыщенных растворов. Они неустойчивы и могут существовать ограниченное время. Очень быстро лишнее растворённое вещество выпадает в осадок, а раствор превращается в насыщенный.
Следует отметить, что при изменении температуры насыщенный и ненасыщенный растворы могут легко обратимо превращаться друг в друга. Процесс выделения твёрдого вещества из насыщенного раствора при понижении температуры называется кристаллизацией. Кристаллизация и растворение играют огромную роль в природе: приводят к образованию минералов, имеют большое значение в атмосферных и почвенных явлениях. На основе кристаллизации в химии распространён метод очистки веществ, который называется перекристаллизацией.
Процесс выделения твёрдого вещества из насыщенного раствора при понижении температуры называется кристаллизацией. Кристаллизация и растворение играют огромную роль в природе: приводят к образованию минералов, имеют большое значение в атмосферных и почвенных явлениях. На основе кристаллизации в химии распространён метод очистки веществ, который называется перекристаллизацией.
Для приблизительного количественного выражения состава раствора используют понятия концентрированный и разбавленный растворы.
Концентрированным называется раствор, в котором масса растворённого вещества соизмерима с массой растворителя, т.е. не отличается от него более чем в 10 раз.
Если же масса растворённого вещества более чем в десять раз меньше массы растворителя, то такие растворы называются разбавленными.
Однако следует помнить, что деление растворов на концентрированные и разбавленные условно, и чёткой границы между ними нет.
Точный количественный состав растворов выражают при помощи массовой доли растворённого вещества, его молярной концентрации, а также некоторыми другими способами.
Массовая доля растворённого вещества (w) — это безразмерная физическая величина, равная отношению массы растворённого вещества к общей массе раствора, т.е.
Обычно выражается в долях единицы или в процентах. Массовая доля, выраженная в %, называется процентной концентрацией. Она показывает, какая масса вещества растворена в 100 г раствора.
Молярная концентрация (С) или молярность — это величина, равная отношению количества растворённого вещества к объему раствора (в литрах), т.е.
Молярность измеряется в моль/л и показывает сколько моль вещества растворено в одном литре раствора. Молярность обозначается обычно буквой М. Если в одном литре раствора содержится 1 моль вещества, то такой раствор называется одномолярным (1М), если 0,1 моль вещества — децимолярным (0,1М), если 0,01 моль вещества — сантимолярным (0,01М), если 0,001 моль вещества — миллимолярным (0,001М).
Титром (Т) называется отношение массы вещества в граммах к объёму раствора в мл, т.е.
Титр имеет размерность г/мл, он показывает, сколько грамм вещества растворено в 1 мл раствора.
Моляльная концентрация или моляльность (m) — это величина, равная отношению количества растворённого вещества к массе растворителя, выраженной в кг, т.е.
Моляльность имеет размерность моль/кг и показывает, какое количество вещества растворено в 1 кг растворителя.
Мольная доля (Х) — это величина, равная отношению количества растворённого вещества к общему количеству вещества в растворе:
вода молекула раствор нернст
Мольная доля — это безразмерная величина и измеряется в долях единицы или в %. Молярная концентрация химического эквивалента вещества (С) или нормальная концентрация — это величина, равная отношению количества химического эквивалента растворённого вещества к объему раствора (в литрах), т.е.
Молярная концентрация химического эквивалента вещества измеряется в моль/л и показывает сколько моль эквивалента вещества растворено в одном литре раствора. Она обозначается обычно буквой н. Если в одном литре раствора содержится 1 моль химического эквивалента вещества, то такой раствор называется однонормальным (1н), если 0,1 моль вещества — децинормальным (0,1н), если 0,01 моль вещества — сантинормальным (0,01н), если 0,001 моль вещества — миллинормальным (0,001н).
Она обозначается обычно буквой н. Если в одном литре раствора содержится 1 моль химического эквивалента вещества, то такой раствор называется однонормальным (1н), если 0,1 моль вещества — децинормальным (0,1н), если 0,01 моль вещества — сантинормальным (0,01н), если 0,001 моль вещества — миллинормальным (0,001н).
Термодинамические аспекты процесса растворения. Идеальные растворы
Согласно второму началу термодинамики в изобарно-изотерических условиях (р, Т = const) вещества могут самопроизвольно растворяться в каком-либо растворителе, если при совершении этого процесса энергия Гиббса системы уменьшается, т.е.
DG < 0 или DH — TDS < 0
При растворении жидких и твердых веществ энтропия системы обычно возрастает (DS > 0), т.к. растворяемые вещества из более упорядоченного состояния переходят в менее упорядоченное состояние. Особенно сильно это выражено при растворении твердых веществ. Вклад энтропийного фактора (ТDS) при этом становится преобладающим по сравнению с энтальпийным (DН) и приводит к уменьшению энергии Гиббса даже если растворение вещества сопровождается поглощением энергии (DН > 0).
Роль энтропийного фактора еще больше усиливается при повышении температуры, потому что в этом случае множитель Т становится бóльшим и произведение ТDS существеннее увеличивается. Именно поэтому растворимость твердых и жидких веществ с повышением температуры, как правило, возрастает.
Если при растворении твердого либо жидкого вещества энергия выделяется (DН < 0), то оба фактора (и энтальпийный и энтропийный) действуют в одинаковом направлении и способствуют уменьшению энергии Гиббса.
При растворении газов энтропия системы, как правило, уменьшается (DS < 0), т.к. вещество при этом из менее упорядоченного состояния переходит в более упорядоченное. Таким образом уменьшение энергии Гиббса в этом случае возможно только за счет большего вклада энтальпийного фактора. Причем изменение энтальпии должно быть меньше нуля (DН < 0). Именно это (т.е. выделение энергии) и наблюдается при растворении газов, но величина теплового эффекта данного явления обычно не превышает 15-20 кДж/моль, поэтому даже при небольшом увеличении температуры вклад энтропийного фактора начинает преобладать, а растворимость газов в жидкости уменьшается.
Растворы, в процессе образования которых тепловые и объемные эффекты отсутствуют, т.е. DН = 0 и DV = 0 (изменение объема) называются идеальными.
Такие растворы получаются при смешивании компонентов А и В, у которых силы взаимодействия между однородными (А и А, В и В) и разнородными (А и В) молекулами равны.
Образование растворов в данном случае сопровождается лишь хаотическим распределением частиц без изменения характера и величины сил взаимодействия между собой. Поэтому тепловые эффекты отсутствуют.
Свойства идеальных растворов подобно свойствам разреженных газовых смесей не зависят от природы растворенного вещества, а определяются лишь его концентрацией (т.е. количеством) в растворе. При этом единственной причиной образования таких растворов (как и газовых смесей) является увеличение энтропии (DS > 0).
В идеальных растворах свойства отдельных компонентов не отличаются от их свойств в чистом индивидуальном виде.
Реальные растворы не обладают свойствами идеальных растворов, но могут в той или иной степени приближаться к ним. Особенно это характерно для разбавленных растворов, в которых можно пренебречь взаимодействием между частицами растворенного вещества, т.к. они в нем достаточно разобщены, т.е. находятся на большом расстоянии друг от друга.
Особенно это характерно для разбавленных растворов, в которых можно пренебречь взаимодействием между частицами растворенного вещества, т.к. они в нем достаточно разобщены, т.е. находятся на большом расстоянии друг от друга.
Скачать архив (255.7 Kb)
Схожие материалы:
Растворы
Растворы(по О.А. Алекину)
Растворами называются однородные тела, в которых одно вещество рассеяно в виде мельчайших частиц в другом.
Обычно представление о растворах ограничивают жидким состоянием тела, вообще же, расширяя это понятие, к растворам можно отнести и твердые тела, например сплавы, которые могут рассматриваться как равномерное распределение одного металла в другом.
Вещество, находящееся в растворе в преобладающем количестве, называется растворителем, в меньшем количестве — растворенным веществом. В зависимости от рода растворителя существуют различные жидкие растворы: водные, спиртовые, аммиачные, эфирные и пр.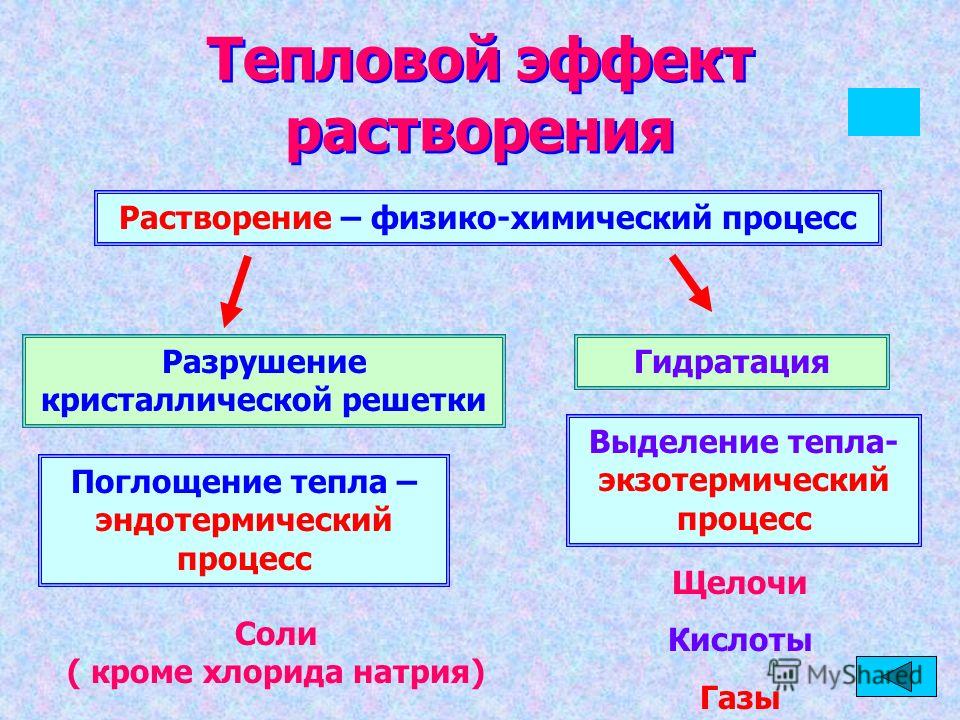
Свойство воды при соприкосновении со многими веществами в той или иной мере растворять их, несомненно, является одной из важнейших особенностей ее. Водные растворы, из-за исключительной распространенности воды в природе и ее роли для органического мира, представляют собой одну из важнейших разновидностей растворов. Именно в водных растворах протекает болыпая часть реакций между различными растворенными твердыми веществами. Поэтому водным растворам уделяется особое место в химии и им посвящаются большие ее разделы. Здесь мы коснемся кратко лишь наиболее ясных понятий этого важного раздела химии и притом только в отношении водных растворов твердых и газообразных веществ, как наиболее распространенных форм растворов, изучаемых гидрохимией.
В зависимости от величины частиц растворенного вещества различают истинные и коллоидные растворы.
К истинным растворам относятся растворы, в которых растворенное вещество находится в крайней степени рассеяния — в виде молекул и ионов.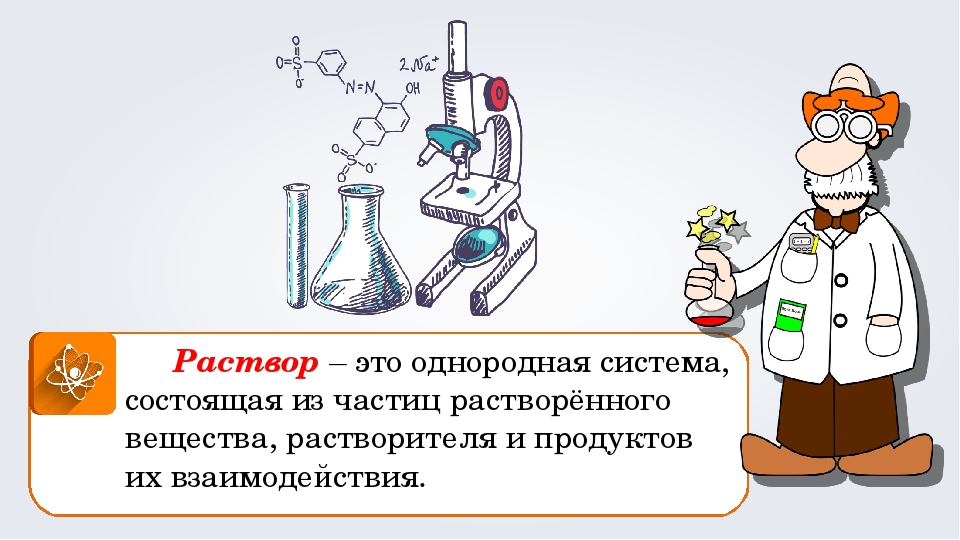 Поэтому такие растворы еще часто называются молекулярно-ионными. Размеры растворенных частиц — молекул и ионов — в истинных растворах не превышают 10-7 мм.
Поэтому такие растворы еще часто называются молекулярно-ионными. Размеры растворенных частиц — молекул и ионов — в истинных растворах не превышают 10-7 мм.
Растворы с более крупными частицами, размером свыше 10-7 мм, называются колло-идными. Частицы растворенного вещества в коллоидных растворах уже не состоят из отдельных молекул, а включают целые группы молекул и ионов. Поэтому размер коллоидных частиц значительно больше молекул и ионов — в пределах от 10-7 до 10-6 мм. При такой еще весьма высокой степени раздробленности растворенного вещества частицы коллоидов имеют очень большую общую поверхность, вследствие чего между ними и молекулами воды существует тесное взаимодействие. В результате этого частицы коллоидов тесно связаны с растворителем, и коллоидный раствор является устойчивым.
Устойчивости коллоидов способствует также наличие у коллоидных частиц зарядов, возникающих из-за присутствия ионов, притягиваемых (адсорбируемых) частицами из раствора. Коллоидные частицы столь малы, что их можно видеть только с помощью ультра-микроскопа. Коллоидный раствор может иметь окраску или быть слабо мутным (опалесцировать).
Коллоидные частицы столь малы, что их можно видеть только с помощью ультра-микроскопа. Коллоидный раствор может иметь окраску или быть слабо мутным (опалесцировать).
В природных водах коллоидные растворы встречаются очень часто, но в малых количествах. К ним, например, относятся различные органические соединения как живых организмов, так и продуктов их распада. Коллоиды органического вещества содержат в своем составе различные элементы (фосфор, азот, углерод, серу и др.) и являются одним из источников их поступления в воду. В коллоидном состоянии в природных водах часто находятся и чисто неорганические соединения, как например соединения железа и кремния.
При размерах более 10-5 мм частицы растворенного вещества становятся настолько велики, что заметны в растворе уже невооруженным глазом, придавая ему мутный вид. Это обстоятельство нарушает характерную особенность раствора — его однородность, поэтому подобные смеси относятся уже не к растворам, а к механическим смесям очень мелкого рассеяния — суспензиям. Примером суспензий в природных водах может служить глинистая суспензия, часто встречающаяся в природных водах в значительных количествах, особенно в реках с ледниковым питанием. Устойчивость таких суспензий бывает самая различная и зависит от размера частиц: чем крупнее частицы, тем менее устойчива смесь. Очень тонкая суспензия весьма устойчива и может не оседать много дней. Более грубые суспензии, размером свыше 10-5 мм, называются взвесями; они изучаются в гидрологии в разделе, называемом сток наносов, или твердый сток.
Примером суспензий в природных водах может служить глинистая суспензия, часто встречающаяся в природных водах в значительных количествах, особенно в реках с ледниковым питанием. Устойчивость таких суспензий бывает самая различная и зависит от размера частиц: чем крупнее частицы, тем менее устойчива смесь. Очень тонкая суспензия весьма устойчива и может не оседать много дней. Более грубые суспензии, размером свыше 10-5 мм, называются взвесями; они изучаются в гидрологии в разделе, называемом сток наносов, или твердый сток.
13: Решения — Chemistry LibreTexts
-
- Последнее обновление
- Сохранить как PDF
Растворы играют очень важную роль во многих биологических, лабораторных и промышленных применениях химии. Особое значение имеют растворы, содержащие вещества, растворенные в воде, или водные растворы. Решения представляют собой равновесные системы, и уроки, извлеченные из нашего последнего раздела, снова будут иметь особое значение. Количественные измерения решений — еще один ключевой компонент этой единицы. Растворы могут включать все физические состояния — газы, растворенные в газах (окружающий нас воздух), твердые вещества, растворенные в твердых телах (металлические сплавы), жидкости, растворенные в твердых телах (амальгамы — жидкая ртуть, растворенная в другом металле, таком как серебро, олово или медь).В этом блоке мы почти исключительно будем иметь дело с водными растворами — веществами, растворенными в воде.
Особое значение имеют растворы, содержащие вещества, растворенные в воде, или водные растворы. Решения представляют собой равновесные системы, и уроки, извлеченные из нашего последнего раздела, снова будут иметь особое значение. Количественные измерения решений — еще один ключевой компонент этой единицы. Растворы могут включать все физические состояния — газы, растворенные в газах (окружающий нас воздух), твердые вещества, растворенные в твердых телах (металлические сплавы), жидкости, растворенные в твердых телах (амальгамы — жидкая ртуть, растворенная в другом металле, таком как серебро, олово или медь).В этом блоке мы почти исключительно будем иметь дело с водными растворами — веществами, растворенными в воде.
-
- 13.1: Прелюдия — Трагедия в Камеруне
- Озеро Ньос — кратерное озеро в Северо-Западном регионе Камеруна, глубокое озеро высоко на склоне неактивного вулкана на вулканической равнине Оку вдоль Камерунской линии вулканов. Мероприятия.
 Воды озера подпитывается вулканической плотиной. Карман магмы находится под озером и просачивает в воду углекислый газ, превращая его в углекислоту.Ньос — одно из трех известных взрывающихся озер, насыщенных таким образом углекислым газом.
Воды озера подпитывается вулканической плотиной. Карман магмы находится под озером и просачивает в воду углекислый газ, превращая его в углекислоту.Ньос — одно из трех известных взрывающихся озер, насыщенных таким образом углекислым газом.
-
- 13.2: Растворы — гомогенные смеси
- Есть два типа смесей: смеси, в которых вещества равномерно смешаны друг с другом (называемые раствором), и смесь, в которой вещества не смешаны равномерно (называемые гетерогенными смесь). Раствор — это ровная (или гомогенная) смесь веществ. Здесь следует отметить, что когда говорят, что раствор имеет однородные свойства повсюду, определение относится к свойствам на уровне частиц.
-
- 13.3: Растворы твердых тел, растворенных в воде: как приготовить Rock Candy Растворы
- могут быть образованы во множестве комбинаций с использованием твердых тел, жидкостей и газов. Мы также знаем, что растворы имеют постоянный состав, и мы также можем варьировать этот состав до определенной степени, чтобы поддерживать однородный характер раствора.
 В этом разделе будут рассмотрены причины, по которым образуются растворы, наряду с обсуждением того, почему вода чаще всего используется для растворения веществ различных типов.
В этом разделе будут рассмотрены причины, по которым образуются растворы, наряду с обсуждением того, почему вода чаще всего используется для растворения веществ различных типов.
-
- 13.4: Растворы газов в воде
- Другие факторы также влияют на растворимость данного вещества в данном растворителе. Одним из таких факторов является температура, растворимость газа обычно снижается с повышением температуры. Это одно из самых серьезных последствий теплового загрязнения природных водоемов.
-
- 13,5: Концентрация раствора: массовый процент
- Чтобы точно определить раствор, нам нужно указать его концентрацию: сколько растворенного вещества растворено в определенном количестве растворителя.Такие слова, как разбавленный или концентрированный, используются для описания растворов, которые содержат мало или много растворенного вещества, соответственно, но это относительные термины, значения которых зависят от различных факторов.
 Массовый / массовый процент (% м / м) определяется как масса растворенного вещества, деленная на массу раствора, умноженную на 100:
Массовый / массовый процент (% м / м) определяется как масса растворенного вещества, деленная на массу раствора, умноженную на 100:
-
- 13,6: Концентрация раствора: Молярность
- Другой способ выражения концентрации — укажите количество молей растворенного вещества на единицу объема раствора.Из всех количественных мер концентрации химики чаще всего используют молярность. Молярность определяется как количество молей растворенного вещества на литр раствора. Символ молярности — ММ или моль / литр. Химики также используют квадратные скобки для обозначения молярности вещества.
-
- 13.7: Разведение раствора
- Нас часто беспокоит, сколько растворенного вещества растворено в данном количестве раствора. Мы начнем обсуждение концентрации раствора с двух связанных и относительных терминов — разбавленный и концентрированный.
-
- 13,8: Стехиометрия раствора
- Реакции двойного замещения включают реакцию между ионными соединениями в растворе, и в ходе реакции ионы в двух реагирующих соединениях «переключаются» (они заменяют друг друга).
 Поскольку эти реакции происходят в водном растворе, мы можем использовать понятие молярности для прямого расчета количества молей реагентов или продуктов, которые будут образованы, и, следовательно, их количества (то есть объема растворов или массы осадков).
Поскольку эти реакции происходят в водном растворе, мы можем использовать понятие молярности для прямого расчета количества молей реагентов или продуктов, которые будут образованы, и, следовательно, их количества (то есть объема растворов или массы осадков).
-
- 13.9: Понижение точки замерзания и повышение точки кипения
- Понижение точки замерзания и повышение точки кипения — это «совокупные свойства», которые зависят от концентрации растворенного вещества в растворителе, но не от типа растворенного вещества. В приведенном выше примере это означает, что людям в более холодном климате не обязательно нужна соль, чтобы добиться такого же эффекта на дорогах — подойдет любое растворенное вещество. Однако чем выше концентрация растворенного вещества, тем сильнее изменятся эти свойства.
-
- 13.10: Osmosis
- Осмотическое давление возникает из-за разницы концентраций между растворами, разделенными полупроницаемой мембраной, и является важной биологической проблемой.

Растворы и смеси — Химия для старших классов
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает одно или больше ваших авторских прав, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее в информацию, описанную ниже, назначенному ниже агенту.Если репетиторы вуза предпримут действия в ответ на ан Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как в виде ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно
искажать информацию о том, что продукт или действие нарушает ваши авторские права. Таким образом, если вы не уверены, что контент находится
на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Таким образом, если вы не уверены, что контент находится
на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \
достаточно подробностей, чтобы позволить репетиторам Varsity найти и точно идентифицировать этот контент; например нам требуется
а
ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему утверждению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Раствор (химия) — Энциклопедия Нового Света
Растворение поваренной соли в воде.В химии раствор представляет собой комбинацию двух или более веществ, образующих гомогенную смесь.Среда, растворяющая другое вещество, называется растворителем ; растворяющееся вещество называется растворенным веществом . Смешанные вместе материалы могут находиться в твердом, жидком или газообразном состоянии.
Вода — это обычный растворитель, способный растворять многие другие вещества. Таким образом, раствор образуется, когда твердое вещество, такое как поваренная соль или сахар, растворяется в воде. Также в воде могут растворяться такие газы, как диоксид углерода и кислород. Кроме того, жидкости могут растворяться в других жидкостях, а газы — в других газах.Сплавы являются примерами твердых растворов.
Кроме того, жидкости могут растворяться в других жидкостях, а газы — в других газах.Сплавы являются примерами твердых растворов.
Если растворенное вещество и растворитель существуют в равных количествах, например, смесь этанола и воды 50:50, понятия «растворенное вещество» и «растворитель» становятся менее актуальными. В таком случае вещество, которое чаще используется в качестве растворителя, может быть обозначено как растворитель — в этом примере это будет вода.
Идеальные решения
Идеальный раствор определяется как раствор, в котором взаимодействия молекул растворителя друг с другом равны их взаимодействиям с растворенными веществами.Свойства идеального раствора можно рассчитать путем линейной комбинации свойств его компонентов.
Полярность растворителя
Растворители можно в целом разделить на полярные и неполярные. Обычно полярные или ионные соединения растворяются только в полярных растворителях, тогда как неполярные растворенные вещества растворяются в неполярных растворителях. Общее практическое правило: «подобное растворяется в подобном».
Общее практическое правило: «подобное растворяется в подобном».
Полярность растворителя обычно измеряется с помощью его диэлектрической проницаемости.Вода, высокополярный растворитель, имеет диэлектрическую проницаемость 78,5. Этанол с диэлектрической проницаемостью 24,3 имеет промежуточную полярность. Примером неполярного растворителя является гексан с диэлектрической проницаемостью 1,9.
Простой тест на полярность жидкого растворителя — это потереть пластиковый стержень, чтобы вызвать статическое электричество. Если этот заряженный стержень держать близко к текущему потоку растворителя и путь растворителя отклоняется, растворитель полярен.
Молекулы некоторых веществ, например додецилсульфата натрия, имеют полярные и неполярные области.Этот класс молекул (называемый амфипатическими молекулами ) включает поверхностно-активные вещества, такие как мыло и эмульгаторы. Молекулы поверхностно-активного вещества могут стабилизировать эмульсии, выстраиваясь на границе раздела между полярной и неполярной жидкостями, причем их полярные концы находятся в полярной жидкости, а их неполярные концы — в неполярной жидкости.
Сольватация
В растворе молекулы или ионы растворенного вещества окружаются молекулами растворителя. Если молекулы растворителя образуют относительно стабильные структуры вокруг молекул растворенного вещества, этот процесс известен как сольватация . Например, когда поваренная соль (хлорид натрия) растворяется в воде, полярные молекулы воды окружают каждый из ионов натрия (катионов) и ионов хлора (анионов), образуя относительно стабильные структуры. Таким образом, сольватация позволяет взаимодействию растворенного вещества и растворителя оставаться стабильным.
Концентрация
Есть несколько способов измерить прочность раствора. Количество растворенного вещества, которое растворяется в единице измерения растворителя, называется концентрацией раствора.Он может быть измерен в граммах растворенного вещества на литр раствора или в молях растворенного вещества на литр раствора и так далее.
Чтобы сконцентрировать раствор, нужно добавить больше растворенного вещества или уменьшить количество растворителя (например, путем селективного испарения). И наоборот, чтобы разбавить раствор, нужно добавить больше растворителя или уменьшить количество растворенного вещества.
И наоборот, чтобы разбавить раствор, нужно добавить больше растворителя или уменьшить количество растворенного вещества.
Растворимость и насыщение
Количество растворенного вещества, которое будет растворяться в определенном количестве растворителя при данных условиях, называется растворимостью растворенного вещества в этом растворителе.Когда растворенное вещество больше не может быть растворено в растворителе, говорят, что раствор является насыщенным . Однако момент, когда раствор может стать насыщенным, в значительной степени зависит от факторов окружающей среды, таких как температура, давление и загрязнение. Повышение растворимости (например, путем увеличения температуры) для растворения большего количества растворенного вещества, а затем снижение растворимости приводит к перенасыщению раствора.
Как правило, чем выше температура растворителя, тем больше твердого вещества он может растворить.Однако некоторые соединения обладают обратной растворимостью, что означает, что по мере нагревания растворителя может быть растворено меньше растворенного вещества. Некоторые поверхностно-активные вещества демонстрируют такое поведение. Растворимость жидкостей в жидкостях обычно менее чувствительна к температуре, чем растворимость твердых веществ или газов, тогда как газы обычно становятся менее растворимыми с повышением температуры.
Некоторые поверхностно-активные вещества демонстрируют такое поведение. Растворимость жидкостей в жидкостях обычно менее чувствительна к температуре, чем растворимость твердых веществ или газов, тогда как газы обычно становятся менее растворимыми с повышением температуры.
Если два вещества не смешиваются полностью, существует концентрация, при которой растворенное вещество не растворяется в растворе. На данный момент раствор считается насыщенным .Если к насыщенному раствору добавить дополнительное растворенное вещество, оно не растворится. Вместо этого произойдет разделение фаз, что приведет либо к сосуществованию фаз, либо к суспензии. Точка насыщения зависит от многих переменных, таких как температура окружающей среды и точная химическая природа растворителя и растворенного вещества.
«Общее количество растворенных твердых веществ» — это общий термин в ряде дисциплин. Он выражается по-разному, в зависимости от используемого аналитического метода. В качестве воды это относится к количеству остатка, остающегося после испарения воды из пробы.
Виды решений
См. Также
- Коллигативные свойства
- Коллоид
- Молярный раствор
- Процентное решение
- Равновесие растворимости
- Растворимость
- Суспензия (химия)
- Решение (проблема)
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
Streitwieser, Эндрю и Клейтон Х. Хиткок и Эдвард М. Косовер, (1992). Введение в органическую химию , 4-е изд., Macmillan Publishing Company, Нью-Йорк. ISBN 0-02-418170-6.
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия
в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в New World Encyclopedia :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Журнал химии растворов | Дом
Journal of Solution Chemistry предлагает форум для исследований по физической химии жидких растворов в таких областях, как физическая химия, химическая физика, молекулярная биология, статистическая механика, биохимия и биофизика.Акцент делается на бумагах, в которых растворитель играет доминирующую, а не второстепенную роль. В число избранных тем входят экспериментальные исследования диэлектрических, спектроскопических, термодинамических, транспортных или релаксационных свойств как электролитов, так и неэлектролитов в жидких растворах.
Журнал информации
- Главные редакторы
- Издательская модель
- Гибрид (трансформирующий журнал).Как публиковать у нас, в том числе в открытом доступе
Показатели журнала
- 1,677 (2020)
- Импакт-фактор
- 1,447 (2020)
- Пятилетний импакт-фактор
- 44 дня
- Подача первого решения
- 111,075 (2020)
- Загрузки
Журнал прикладной химии растворов и моделирования
ДокторMiklós Somai
Я был поражен профессионализмом и справедливостью редакции на протяжении всего процесса публикации. Я очень благодарен за отличный сервис и обязательно опубликую еще раз с …
Я очень благодарен за отличный сервис и обязательно опубликую еще раз с …
Д-р Сандип Кумар Вашист
Я действительно впечатлен профессионализмом и редакционным процессом Lifescience Global.До сих пор это был мой лучший издательский опыт. Производство было очень быстрым и качественным. Я бы …
Доктор Венант Чоконте Нана
Lifescience Global — это быстро, эффективно и профессионально. Моя статья, опубликованная в Международном статистическом журнале медицинских исследований, была подготовлена в рекордно короткие сроки, в то время как она была опубликована в …
ДокторШигеюки Хамори
Мне понравилось работать с Journal of Reviews on Global Economics. Я очень впечатлен профессиональным отношением редакции. Я с нетерпением жду публикации в Lifescience Global . ..
..
Стариков Евгений Борисович
Мне понравился процесс публикации в Journal of Applied Solutions Chemistry and Modeling, и время, необходимое для завершения публикации, идеально.Вот почему я отправлю свою следующую рукопись …
Д-р Марджори Р. Фридман
Было очень приятно работать с компанией «Lifescience Global», которая недавно опубликовала статью, которую я написал в Международном журнале детского здоровья и питания. Переписка была своевременной, а публикация …
ДокторДэвид Дант
И мои соавторы, и я были очень впечатлены быстрой реорганизацией журнала, а также тем усердием, с которым редакционная группа следила за нами, чтобы обеспечить оперативную публикацию …
Д-р Димитрис Хациниколау
Я благодарен команде Lifescience Global за быстрое и отличное обслуживание. Я действительно впечатлен качеством и скоростью их работы, что зачастую является самым важным. Я обязательно говорю о другом …
Я действительно впечатлен качеством и скоростью их работы, что зачастую является самым важным. Я обязательно говорю о другом …
Д-р Марьям Мобед-Миремади
Было очень приятно работать со всеми членами команды Lifescience Global от стадии приглашения до стадии финальной публикации. Персонал приветливый, красноречивый и знающий. Рез…
Доктор Афеф Феких
Работа с Lifescience Global была, безусловно, лучшим издательским опытом, который у меня когда-либо был. Рецензирование и редакционное решение были приняты довольно быстро. Редакция работала очень профессионально и ответила на электронную почту …
Д-р Руфино Эчегойен
Опыт работы с Lifescience Global был полезным.Тщательные редакционные комментарии и подробные наблюдения академических читателей обогатили нашу статью. Это было очень хорошо …
Это было очень хорошо …
Д-р Халед И Ораби
Для меня большая честь публиковаться в Lifescience Global. Я выражаю свою искреннюю признательность издателю за то, что он сыграл решающую роль в просвещении научного сообщества.
ДокторТуомас Такало
Я опубликовал свою статью в Journal of Reviews on Global Economics и очень ценю оперативность рецензентов во время рецензирования и всего процесса публикации.
Доктор Джеймс Х. Табибиан
Работа с командой Lifescience Global над подготовкой и публикацией нашей рукописи была эффективной и простой на всех этапах; это был замечательный опыт.
Дениз Бэрд Шварц, MS, RD, FADA, CNSC
Отлично смотрится в сети. Я очень доволен обработкой журналов Lifescience Global, процесс был коротким и эффективным. Бесплатный онлайн-доступ очень полезен при рекомендации статьи t …
Я очень доволен обработкой журналов Lifescience Global, процесс был коротким и эффективным. Бесплатный онлайн-доступ очень полезен при рекомендации статьи t …
ДокторРожерио Корреа Перес
Было очень приятно работать с Lifescience Global и Journal of Pharmacy and Nutrition Sciences (JPANS). Ответы редакции были быстрыми и всегда очень любезными. Надеюсь, что скоро опубликую …
Д-р Уте Инегбенебор
Я должен безмерно поблагодарить компанию Lifescience Global за успех моей работы.Я более чем доволен исключительной добротой и откровенностью коллектива публикации. Желаю Lifescience G …
Д-р Оскар А. Линарес
Я обязательно поделюсь своим отличным опытом работы с Lifescience Global.
Д-р Джеред Б. Кольберт
Кольберт
Мне очень понравилось работать с Lifescience Global. Ценю профессионализм сотрудников и образцовую скорость реакции. Я никогда не работал с журналом и редактором, который так двигался …
Chem4Kids.com: Вопрос: Решения
Прежде чем мы углубимся в растворов , давайте отделим растворы от других типов смесей.Растворы — это группы молекул, которые смешаны и равномерно распределены в системе. Ученые говорят, что растворов составляют гомогенные системы, . Все в растворе равномерно разложить и тщательно перемешать. Гетерогенные смеси имеют нечто большее (более высокую концентрацию) в одной части системы по сравнению с другой.
Сравним сахар в воде (H 2 O) с песком в воде. Сахар растворяется и разливается по стакану с водой.Песок опускается на дно. Сахар-вода — это однородная смесь, а песок-вода — гетерогенная смесь. Оба являются смесями, но только сахар с водой также можно назвать раствором.
Оба являются смесями, но только сахар с водой также можно назвать раствором.
Простое решение — это, по сути, два вещества, которые равномерно смешаны друг с другом. Один из них называется растворенным веществом, а другой — растворителем. Растворенное вещество — это растворяемое вещество (сахар).
 Растворитель — это тот, который растворяет (вода). Как показывает опыт, растворителя обычно больше, чем растворенного вещества. Будьте терпеливы со следующим предложением, когда мы все сложим. Количество растворенного вещества, которое может быть растворено растворителем, определяется как , растворимость . Это много «сол» слов.
В науке всему есть особые названия. У них также есть названия для различных типов однородных смесей. Раствор — это общий термин, используемый для описания однородных смесей с мелкими частицами. Коллоиды — это растворы с более крупными частицами. Когда вы смотрите на коллоиды, обычно они кажутся туманными или молочными. Фактически, молоко представляет собой эмульгированный коллоид .
Растворитель — это тот, который растворяет (вода). Как показывает опыт, растворителя обычно больше, чем растворенного вещества. Будьте терпеливы со следующим предложением, когда мы все сложим. Количество растворенного вещества, которое может быть растворено растворителем, определяется как , растворимость . Это много «сол» слов.
В науке всему есть особые названия. У них также есть названия для различных типов однородных смесей. Раствор — это общий термин, используемый для описания однородных смесей с мелкими частицами. Коллоиды — это растворы с более крупными частицами. Когда вы смотрите на коллоиды, обычно они кажутся туманными или молочными. Фактически, молоко представляет собой эмульгированный коллоид .
Вы также можете услышать о коллоидах, если изучите почву. В то время как молоко представляет собой органических коллоидов , почвы могут состоять из неорганических коллоидов , таких как глина.
Подробнее о решениях в части II …
Водный круговорот в Водолее (видео NASA / GSFC)
химических растворов Рона Куртуса
SfC Home> Физические науки> Химия>
Рона Куртуса (от 14 сентября 2005 г.)
A химический раствор является результатом растворения вещества в жидком растворителе, где материалы не вступают в химическую реакцию и обычно являются либо полярными, либо обеими неполярными молекулами.
Молекулы или ионы раствора смешиваются однородно и не разделяются механическими средствами. Изменение температуры обычно используется для разделения ингредиентов растворов.
Вопросы, которые могут у вас возникнуть:
- Какие бывают типы решений?
- Что происходит, когда что-то растворяется?
- Какие еще характеристики у решений?
Этот урок ответит на эти вопросы.
Виды решений
Комбинация материалов для создания раствора включает жидкости, твердые вещества и газы, растворяющиеся в жидкости или в газе.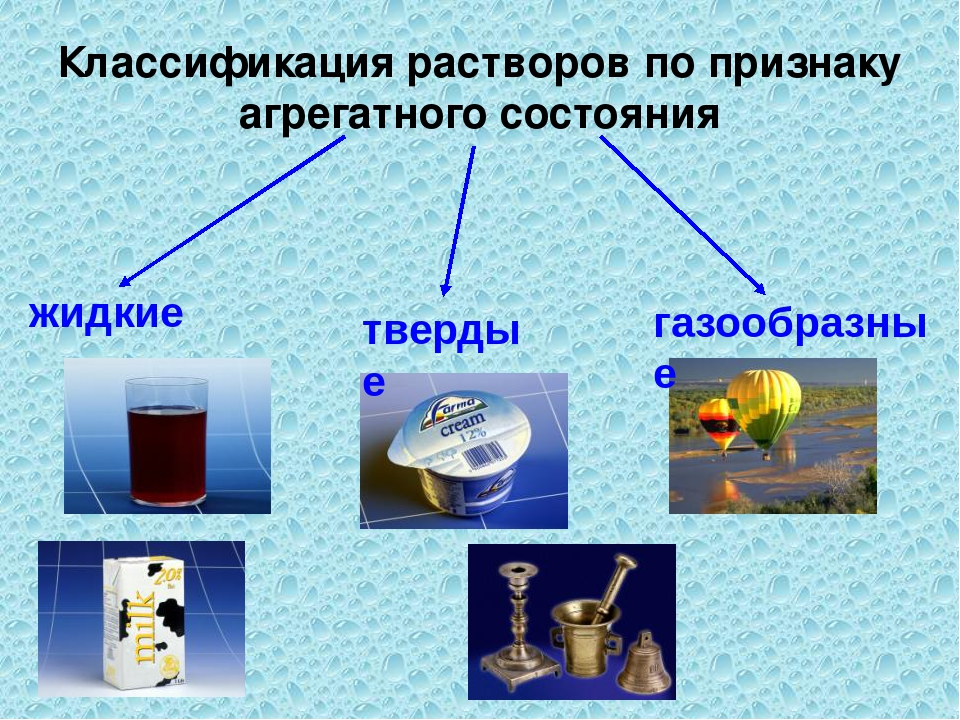 Основное требование состоит в том, что оба предмета должны быть либо полярными, либо неполярными, чтобы они могли легко смешиваться и образовывать раствор. В некоторых особых случаях полярные и неполярные материалы могут образовывать раствор.
Основное требование состоит в том, что оба предмета должны быть либо полярными, либо неполярными, чтобы они могли легко смешиваться и образовывать раствор. В некоторых особых случаях полярные и неполярные материалы могут образовывать раствор.
(Дополнительную информацию см. В разделе «Полярные и неполярные молекулы».)
Жидкость в жидкости
Молекулы спирта и воды равномерно смешиваются и образуют раствор. Это потому, что они обе полярные молекулы.Молекулы распределены по всему раствору, но при этом они не соединяются химически, чтобы сформировать другое вещество.
Один плюс один меньше двух
Интересно отметить, что вы можете смешать литр воды с литром спирта, но вы не получите 2 литра смеси. Вместо этого вы получаете только около 1 1/2 литра. (То же самое справедливо и для измерения в квартах или пинтах). Причина, по которой 1 + 1 не равно 2 в этом случае, заключается в том, что молекулы смешиваются друг с другом и заполняют пространства, которые обычно были бы пустыми в жидкости сами по себе.
Твердое тело в жидкости
Некоторые твердые вещества могут растворяться в жидкости с образованием раствора. Обычные примеры — смешивание соли с водой или сахара в воде.
Сахарная вода
Сахарная вода все еще имеет сладкий вкус, хотя кристаллы сахара, растворенные в воде, не видны.
Соленая вода
Когда соль растворяется в воде, молекулы NaCl расщепляются на ионы с положительными ионами Na + и отрицательными ионами Cl — .Это связано с тем, что H 2 O является полярной молекулой, а Na имеет только один электрон на своей внешней орбите и было бы «более комфортно» с полной внешней оболочкой, а Cl не имеет одного электрона для завершения своей внешняя оболочка.
Газ в жидкости
Газ может растворяться в жидкости. Поскольку аммиак ( NH 3 ) является полярным газом, он легко растворяется в воде ( H 2 O ) с образованием раствора.
Хотя углекислый газ ( CO 2 ) является неполярной молекулой, при определенных обстоятельствах он растворяется в воде с образованием раствора.Двуокись углерода растворяется в воде под давлением в газированных напитках. Когда давление сбрасывается путем открытия бутылки или банки, газ CO 2 быстро отделяется от воды в виде пузырьков.
Жидкость в газе
Примером растворения жидкости в газе является растворение воды в воздухе с образованием влаги.
Газ в газе
Основные газы в воздухе, азот ( N 2 ), кислород ( O 2 ) и углекислый газ ( CO 2 ) являются неполярными молекулами и, таким образом, объединяются в раствор. .Воздух — это раствор, в котором молекулы распределены равномерно.
Растворение
Количество материала и скорость его растворения в растворителе зависят от температуры и давления.
Точка насыщения
Когда количество материала достигает максимума для данной температуры и давления, оно достигает точки насыщения . После этого материал больше не будет растворяться в растворителе. Например, сахар будет растворяться в воде, пока вы не достигнете точки насыщения для этой температуры.После этого сахар, который вы добавляете, не растворяется, а просто собирается на дне емкости.
После этого материал больше не будет растворяться в растворителе. Например, сахар будет растворяться в воде, пока вы не достигнете точки насыщения для этой температуры.После этого сахар, который вы добавляете, не растворяется, а просто собирается на дне емкости.
Растворение жидкостей и твердых тел
Жидкости и твердые вещества обычно более растворимы при более высоких температурах.
Соль в воде
Это означает, что в теплой воде растворяется больше соли, чем в холодной. В более холодной воде растворяется меньше соли. Если вы почти достигнете точки насыщения соли в воде при заданной температуре, а затем снизите температуру воды, избыток соли будет выпадать в осадок или «не растворяться» и появляться на дне емкости.
Вода в воздухе
Точно так же определенное количество воды может растворяться в воздухе при заданной температуре. Допустимый процент при данной температуре называется относительной влажностью . Точка насыщения для добавления воды в воздух при заданной температуре означает, что относительная влажность составляет 100%.
Если относительная влажность очень высока и температура понижается или остывает, в воздухе может быть растворено меньше водяного пара, поэтому вода будет выпадать в виде дождя.Точка росы — это температура, при которой будет идти дождь для данной относительной влажности.
Ваше тело охлаждается через пот. Если влажность и температура высокие, эта жидкость не будет легко растворяться в воздухе, и вы будете потеть и почувствуете дискомфорт. Если температура высокая, но влажность низкая, пот испарится в воздухе, и вы не почувствуете такого дискомфорта.
Растворяющиеся газы
Газы становятся более растворимыми при повышении давления.Это означает, что углекислый газ легко растворяется в воде или водно-сахарном растворе под высоким давлением. Как только давление сброшено, например, когда вы открываете крышку бутылки с безалкогольным напитком, в жидкости может раствориться меньше CO 2 , и появятся газированные пузыри.
Прочие характеристики
К другим характеристикам растворов относится их разделение, электрическая проводимость и концентрация.
Концентрация раствора
Концентрация раствора — это процентное отношение одной молекулы к другой.Когда количества равны, концентрация составляет 50%.
Ликер
По закону на бутылке с ликером должна быть указана концентрация или процентное соотношение количества алкоголя к воде. Они используют термин «доказательство», который в два раза превышает процент концентрации, так что 200-стойкость является максимальной. 80-градусный ликер содержит 40% алкоголя.
Разделение
Методы разделения растворов включают превышение точки насыщения, испарение и кипение.
Превышение точки насыщения
Материал отделяется от растворителя, когда раствор становится более чем перенасыщенным.Подобное ранее наблюдалось при понижении температуры водно-солевого раствора для осаждения избытка соли.
Испарение
Когда вода испаряется из раствора, концентрация другого материала увеличивается до тех пор, пока он не достигнет точки насыщения, при которой он выпадет в осадок.
Дистилляция
Дистилляция — это нагревание раствора двух жидкостей с разными температурами кипения. Когда вы достигнете точки кипения, равной двум, более летучий материал испарится первым, оставив другой материал.Некоторые из менее летучих веществ также испаряются, поэтому вы не получите 100% чистого вещества.
Одним из примеров является кипячение водно-спиртового раствора для испарения спирта перед водой. Температура кипения воды составляет 100 ° C (212 ° F), а спирта — 78,5 ° C (173 ° F). Пар будет богаче спиртом. Повторные перегонки могут привести к получению 95% спиртового раствора.
Кипячение
При кипячении раствора твердого вещества, растворенного в жидкости, может выпадать осадок.Например, кипячение воды в солевом растворе скоро приведет к тому, что концентрация соли станет настолько большой, что она выпадет в осадок и осядет на дно.
Электролиты
Некоторые водные растворы проводят электричество и называются электролитами. Обычно это происходит, когда атомы распадаются на ионы, потому что это позволяет электронам свободно перемещаться. Типичный пример этого — раствор соленой воды.
Обычно это происходит, когда атомы распадаются на ионы, потому что это позволяет электронам свободно перемещаться. Типичный пример этого — раствор соленой воды.
Сводка
Раствор является результатом растворения вещества в жидком растворителе, где материалы не вступают в химическую реакцию и являются либо полярными, либо обеими неполярными молекулами.Молекулы или ионы раствора смешиваются однородно и не разделяются механическими средствами. Вместо этого изменение температуры обычно разделяет их.
Ищите решение
Ресурсы и ссылки
Полномочия Рона Куртуса
Сайты
Химические ресурсы
Книги
(Примечание: Школа чемпионов может получать комиссионные от покупки книг)
Книги по химии с самым высоким рейтингом
Вопросы и комментарии
У вас есть вопросы, комментарии или мнения по этой теме? Если да, отправьте свой отзыв по электронной почте.
