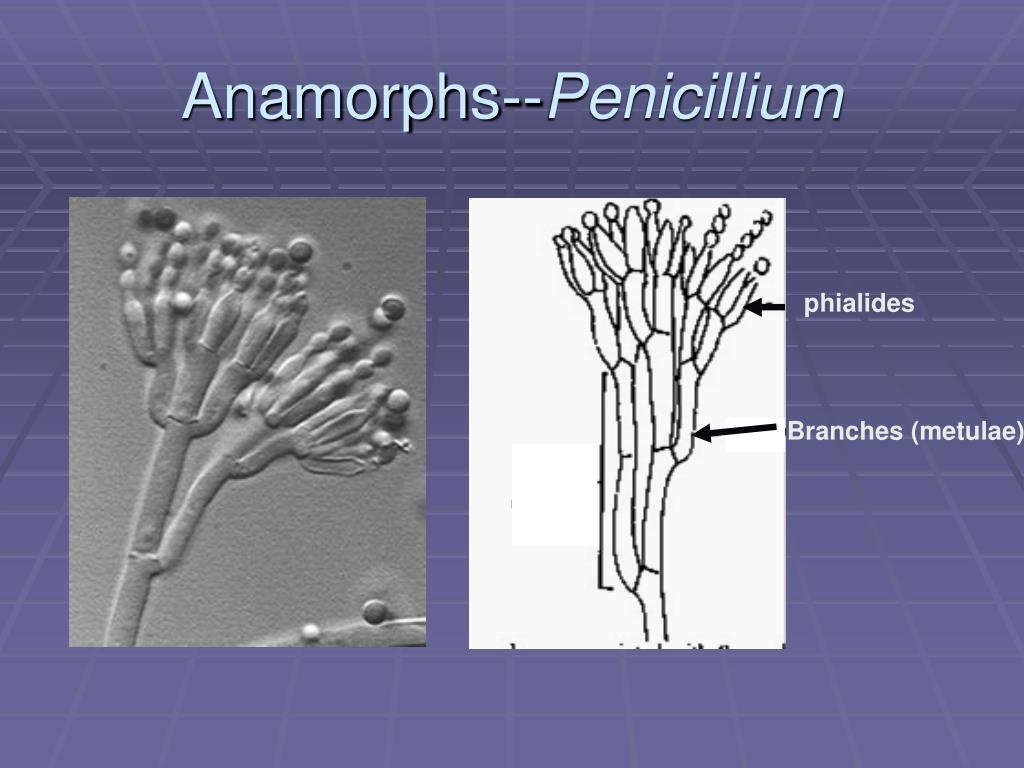
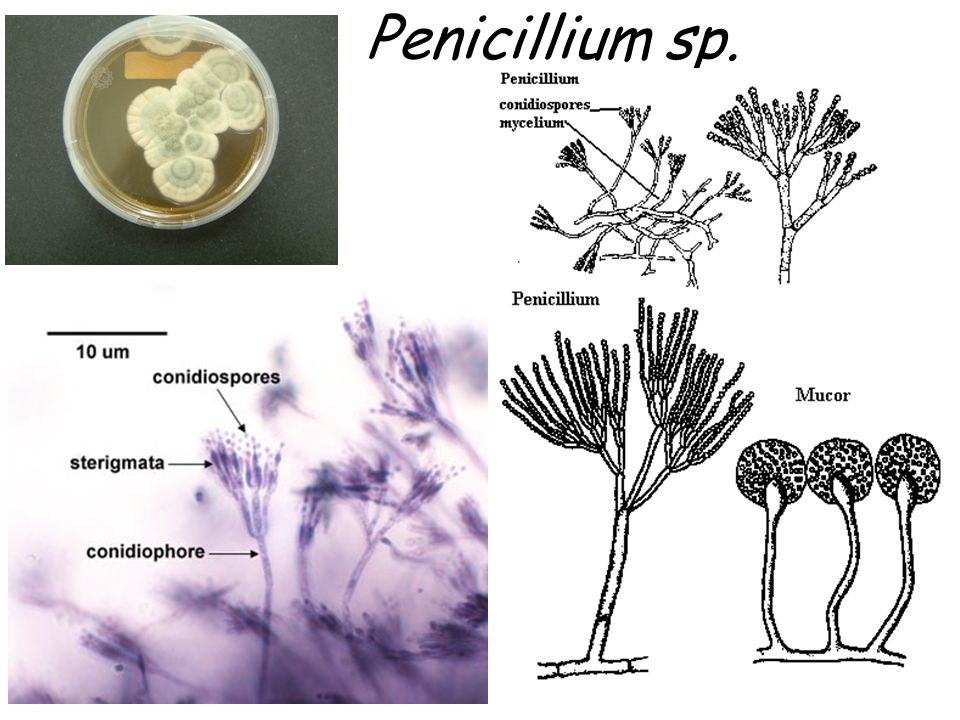
Пеницилл
Пенициллы по праву занимают первое место по распространению среди гифомицетов. Естественный резервуар их — почва, причем они, будучи в большинстве видов космополитами, в отличие от аспергиллов, приурочены больше к почвам северных широт.[ …]
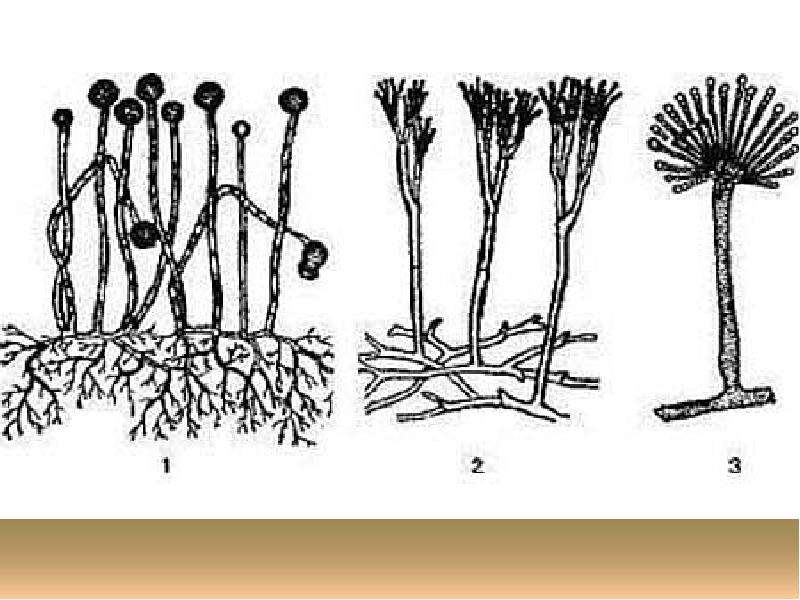
Мицелий пенициллов в общих чертах не отличается от мицелия аспергиллов. Основное различие между этими двумя близкими родами заключается в строении конидиального аппарата. У пенициллов он более разнообразен и представляет собой в верхней части кисточку различной степени сложности (отсюда его синоним «кистевик»). На основе строения кисточки и некоторых других признаков (морфологических и культуральных) в пределах рода установлены секции, подсекции и серии.[ …]
Некоторые пенициллы секции Asymmetrica (P. nigricans) образуют антигрибной антибиотик гризеофульвин, который показал хорошие результаты в борьбе с некоторыми болезнями растений. Его можно использовать для борьбы с грибами, вызывающими заболевания кожи и волосяных луковиц у людей и животных.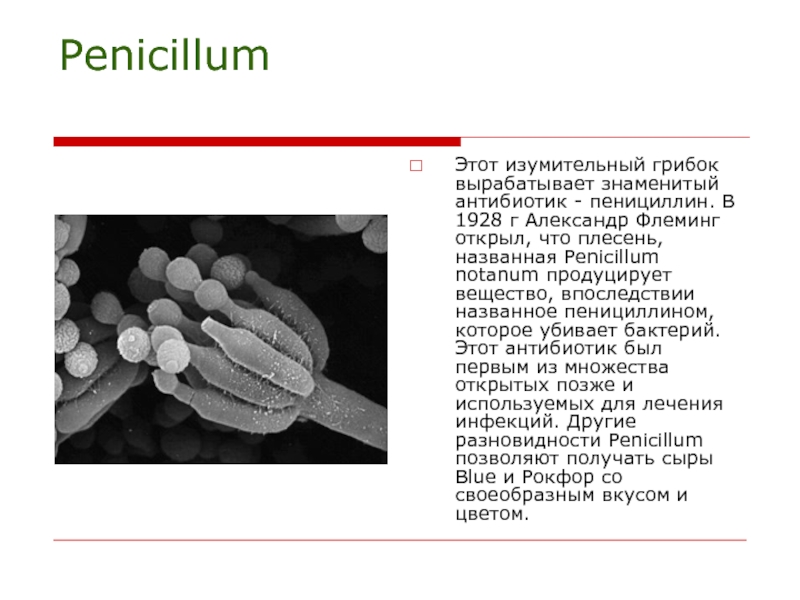
Кроме указанных пенициллов, используемых человеком в столь различных направлениях, среди представителей секции АзуттеШ-са имеется много вредоносных. Так, большой экономический ущерб причиняют Р. с иа т и Р. иаНсит, вызывающие гниение плодов цитрусовых. Часто обе гнили встречаются вместе, но они легко различимы, особенно в начале образования плесневых налетов. Р. сН£иа1;ит — раневой паразит, т. е. в здоровые, неповрежденные плоды его мицелий проникнуть не может. При благоприятных условиях он очень быстро распространяется по поверхности плодов, покрывая их в течение трех-четырех дней зеленовато-оливковым плотным налетом конидий. Пораженные плоды очень быстро сохнут на воздухе, сморщиваются и в заключение покрываются углублениями и мумифицированной коркой грязно-оливково-коричневого цвета («зеленая гниль» плодов цитрусовых).[ …]
В колониях многих пенициллов, как у аспергиллов, имеются склероции, служащие, по-видимому, для перенесения неблагоприятных условий.[ …]
Однако у некоторых пенициллов и аспергил-лов, по традиции также относимых к несовершенным грибам, известны сумчатые стадии, принадлежащие к различным родам эуроциевых. [ …]
[ …]
Однако у некоторых пенициллов и аспергил-лов, по традиции также относимых к несовершенным грибам, известны сумчатые стадии, принадлежащие к различным родам эуроциевых.[ …]
Очень большое значение имеют пенициллы из серии Р. roqueforti. Они обитают в почве, но преобладают в группе сыров, характеризующихся «мраморностью». Это сыр «Рокфор», родиной которого является Франция; сыр «Гор-гонцола» из Северной Италии, сыр «Стилтон» из Англии и др. Всем этим сырам свойственны рыхлая структура, специфический вид (прожилки и пятна голубовато-зеленого цвета) и характерный аромат. Дело в том, что соответствующие культуры грибов используются в определенный момент процесса изготовления сыров. Р. roqueforti и родственные виды способны расти в рыхло спрессованном твороге потому, что хорошо переносят пониженное содержание кислорода (в смеси газов, образующихся в пустотах сыра, его содержится меньше 5%). Кроме того, они устойчивы к высокой концентрации соли в кислой среде и образуют при этом липолитические и протеолитические ферменты, воздействующие на жировые и белковые компоненты молока.
Имея широкий набор ферментов, пенициллы заселяют различные субстраты и принимают самое активное участие в аэробном разрушении растительных остатков.[ …]
Использование продуктов обмена веществ пенициллов далеко не исчерпано, и дальнейшее изучение, без сомнения, откроет новые возможности их применения в различных отраслях народного хозяйства.[ …]
Важнейшие почвенные грибы относятся к родам пеницилл, аспергилл и фузариум (стр.[ …]
Большое значение из коремиальных грибов имеют пенициллы из серии P. cyclopium. Они широко распространены в почве и на органических субстратах, часто выделяются с зерна и зерновых продуктов, с промышленных товаров в разных зонах земного шара и отличаются высокой и разнообразной активностью.[ …]
Лечебные свойства плесеней, образуемых колониями пенициллов, были впервые отмечены русскими учеными В. А. Манассеиным и А. Г. Полотебновым еще в 70-х годах прошлого века. Они использовали эти плесени для лечения кожных заболеваний и сифилиса.[ …]
Они использовали эти плесени для лечения кожных заболеваний и сифилиса.[ …]
Особенно большое распространение и значение среди пенициллов имеют представители секции АвуттеШса.[ …]
В лесостепной зоне в серых лесных почвах также преобладают пенициллы, а аспергиллы, как и дрожжи, встречаются редко. Мукоровые грибы и триходермы присутствуют примерно в таких же количествах, что и в почвах лесолуговой зоны. Фузариума обычно мало в серых лесных почвах, но в почве, занятой травянистыми растениями, грибы этого рода встречаются обильно.[ …]
В северной зоне, в частности в почвах тундры, наиболее крупная группировка микроскопических грибов принадлежит пенициллам. Эти почвы также обильно заселены дрожжевыми и дрожжеподобными организмами. В северных почвах, в том числе почвах тундры, медленно протекают минерализационные процессы, и поэтому почвы насыщаются слаборазложившими-ся растительными остатками. Именно в таких почвах и развиваются дрожжевые организмы. В почвах тундры почти отсутствуют аспергил-лы, редко встречаются грибы родов фузариум (Fusarium) и триходерма (Trichoderma). [ …]
[ …]
У представителей многих родов несовершенных грибов (Myrothecium verrucaria, Trichoderma viride, Trichoderma koningii, Stysanus stemo-nites, некоторые виды пенициллов) экспериментально установлена способность продуцировать целлюлозолитические ферменты. Это позволяет использовать их в целлюлозно-бумажной промышленности для получения определенных сортов бумаги и картона из древесных отходов.[ …]
В степной зоне и в черноземных целинных почвах число грибов примерно такое же, как и в серых лесных почвах. Количество пенициллов несколько более 50%, но заметно увеличивается число аспергиллов и фузариумов. Дрожжевые организмы встречаются в этих почвах в незначительном количестве. Далее к югу в каштановых почвах число аспергиллов и фузариумов все более и более увеличивается. Что касается общего количества грибов в этих почвах, оно гораздо меньше, чем в почвах Севера.[ …]
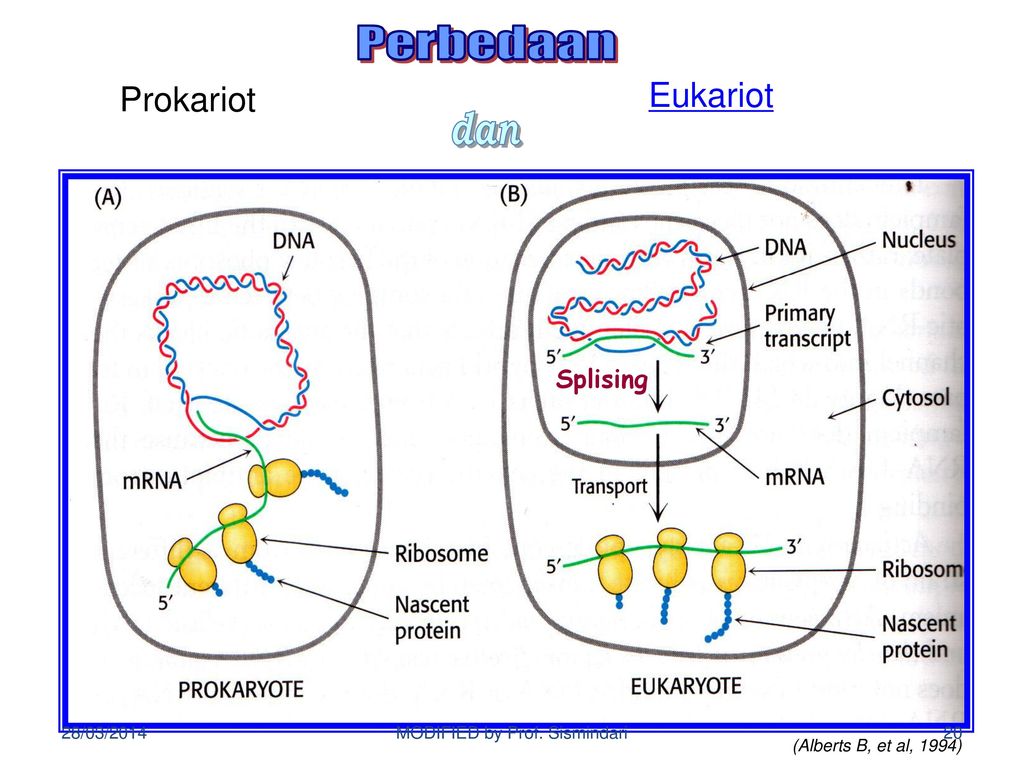
Низшие грибы часто имеют многоядерный мицелий или состоят из одной клетки. Представителями низших грибов являются плесневые грибы: мукор, пеницилл, аспергилл.
Из лесных почв и подстилки главным образом хвойных лесов разных мест земного шара выделяется обычно P. thomii (табл. 56, 57), легко отличимый от других пенициллов секции Monoverticillata наличием розовых склероциев.[ …]
Подобные наблюдения свидетельствуют о специфичности видового состава грибов в ризосфере растений.[ …]
Это наиболее опасные и агрессивные с коррозионной точки зрения микроорганизмы из-за их физиологических и биохимических особенностей. К тому же аспергилл и пеницилл отличаются быстротой роста и энергией размножения. Считается, что идеальными условиями для появления и дальнейшего распространения плесневых грибов является относительная влажность воздуха выше 90 % и температура воздуха более 20 °С выше нуля (Чуйко, 1978).
По-видимому, наиболее процветающими в природных условиях оказываются представители секции Asymmetrica. Они имеют более широкую экологическую амплитуду, • чем другие пенициллы, лучше других переносят пониженную температуру (P. puberulum, например, может образовывать плесневые налеты на мясе в холодильниках) и относительно меньшее содержание кислорода. Многие из них встречаются в почве не только в поверхностных слоях, но и на значительной глубине, особенно коремиальные формы. Для некоторых видов, как, например, для P. chrysogenum, установлены очень широкие температурные границы (от —4 до +33 °С).[ …]
Среди аспергиллов выявлено также большее количество видов, способных расти на среде с высокой концентрацией ионов меди, 4 из 24 (табл. 1), тогда как среди 28 исследованных пенициллов выявлено только 3 резистентные культуры (табл. 2).[ …]
1), тогда как среди 28 исследованных пенициллов выявлено только 3 резистентные культуры (табл. 2).[ …]
Грибы-сапрофиты питаются отмершими организмами, органическими остатками, пищевыми продуктами, созревшими плодами, вызывая их гниение и распад. К сапрофитам относятся мукор, пеницилл, аспергилл, большинство шляпочных грибов.[ …]
Одно из выдающихся достижений последнего времени — открытие антибиотиков. Первый антибиотик, получивший широкое применение в практике, был пенициллин — продукт жизнедеятельности одного из видов грибов-пенициллов. В медицине широко применяют препараты из склероциев спорыньи. При помощи гриба черной плесени (Aspergillus niger) в промышленном масштабе получают лимонную кислоту.[ …]
В зависимости от типа леса, породы дерева и других условий состав видов и родов грибов на разных стадиях разложения может несколько варьировать. Например, при разложении сосновой и еловой древесины развиваются разные виды пенициллов. Кроме того, в процессе разложения еловой древесины принимает участие большее количество видов этого рода и т. п.[ …]
п.[ …]
Результаты исследования показали, что грибы рода Aspergillus, как правило, более устойчивы к токсическому действию меди, чем представители рода Pénicillium. Добавление в среду 0,25 мМ меди полностью ингибировало рост 17 % аспергиллов (табл. 1) и 39 % пенициллов (табл. 2).[ …]
Почвенные гифомицеты различают и по отношению их к влажности почвы. Среди них встречаются гигрофилы, развивающиеся при высокой влажности почвы, и есть мезофилы, развивающиеся при средней, т. е. обычной, влажности почвы без капельножидкой влаги, как, например, большинство пенициллов и многие другие. Наконец, известны и ксерофиты, к которым могут быть отнесены многие виды ас-пергиллов, а также стемфилий етрЬу-1шт) и другие темноокрашенные гифомицеты.[ …]
До недавнего времени не было ясно, существуют ли фаги против плесневых грибов и дрожжей. В последние годы найдены фаги, активные против грибов родов пенициллбв, аспергил-лов и других, а также против некоторых дрожжей. Интересно отметить, что вирус удалось выявить и у тех видов пенициллов, которые применяются в промышленности для получения пенициллина. Не выявлены вирусы, активные против простейших животных, а также истинных спирохет.[ …]
Не выявлены вирусы, активные против простейших животных, а также истинных спирохет.[ …]
Частным случаем аменсализма является аллелопатия (антибиоз) — влияние одного организма на другой, при котором во внешнюю среду выделяются продукты жизнедеятельности одного организма, отравляя ее и делая непригодной для жизни другого. Аллелопатия распространена у растений, грибов, бактерий. Например, гриб-пеницилл продуцирует вещества, подавляющие жизнедеятельность бактерий. Пеницилл используют для получения пенициллина. Это первый открытый в медицине антибиотик. В последнее время в понятие «аллелопатия» включают и положительное воздействие.[ …]
У несовершенных грибов с разными типами конидий хорошо прослеживается параллелизм в усложнении структуры конидиеносцев и их аггрегации, ведущих к увеличению количества спор.[ …]
Исключительно высокая численность микроскопических грибов обнаружена в почвах тайги. Условия для размножения грибов здесь намного лучше, чем в почвах тундры. Органических веществ, поступающих в почву тайги, значительно больше, чем в почвах тундры; температурные условия также более благоприятны для развития грибов.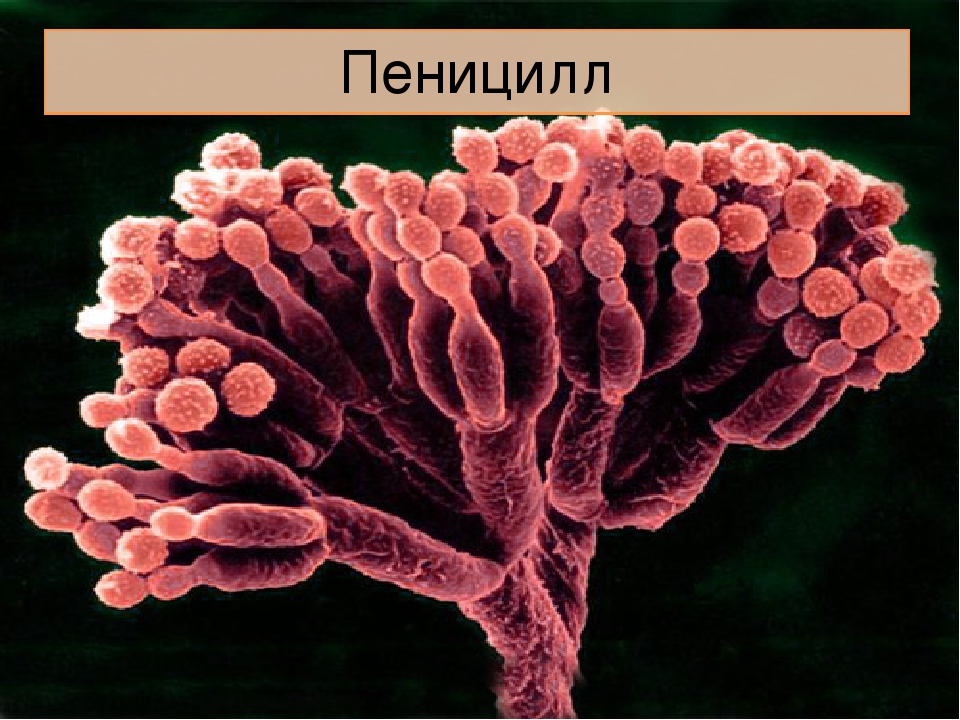 В этих почвах количество пенициллов в процентном отношении примерно такое же, как и в почвах тундры. Из грибов других родов там много видов триходермы, которые обильно размножаются в почвах с высоким содержанием органических веществ.[ …]
В этих почвах количество пенициллов в процентном отношении примерно такое же, как и в почвах тундры. Из грибов других родов там много видов триходермы, которые обильно размножаются в почвах с высоким содержанием органических веществ.[ …]
Источниками инфекции многих возбудителей заболеваний могут быть неперегнившие растительные остатки, а также сорные зимующие растения, поражающиеся этими болезнями. Некоторые возбудители заболеваний (грибы из рода Fusarium, Ps. holci и др.) могут распространяться с семенами. Они нередко являются причиной снижения всхожести семян, а также способствуют увеличению поражаемости семян и проростков пеницилле-зом.[ …]
Нередко она преобладает в цикле развития, а клейстотеции образуются лишь спорадически. У большой группы грибов, связанных по происхождению с эуроциевыми, сумчатые стадии утрачены полностью и конидиальное спороноше-пие — единственный способ размножения. К этой группе относятся такие широко распространенные почвенные грибы, как многие пенициллы и аспергиллы, а также некоторые виды из рода акремониум (Acremonium).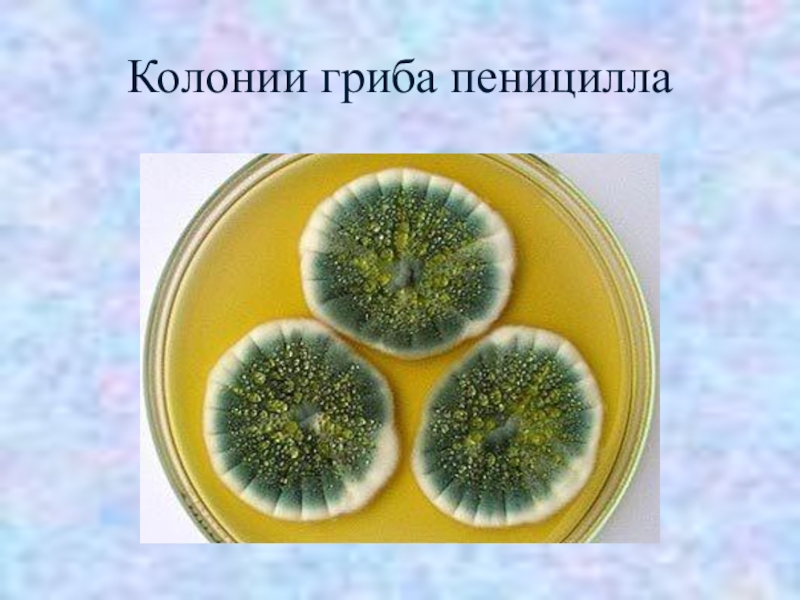 [ …]
[ …]
Лизогения широко распространена среди всех систематических групп микроорганизмов. Это явление детально изучено у сальмонелл — возбудителей брюшного тифа и паратифа, у дифтерийной палочки; все культуры этих видов патогенных бактерий оказались лизогенными. Лизогения широко распространена среди стрептококков, споровых форм бактерий, клубеньковых бактерий, актиномицетов, микобактерий и др.; она выявлена и у некоторых мицелиальных грибов (пенициллов) и дрожжей.[ …]
Пробы, взятые для химического анализа, параллельно подвергали биологическому анализу. Для выращивания живых организмов, вызывающих разрушение штукатурного слоя, использовали метод посева на стерильную среду. В результате было установлено, что биохимическая коррозия строительных конструкций была вызвана деятельностью плесневых грибов, принадлежащих к классу Fungi imperfecti, или Deuteromycetes (несовершенные грибы, или дейтеромицеты). В основном это многочисленные виды, распространенные повсеместно, родов Aspergillus (аспергилл) и Pénicillium (пеницилл). У некоторых из них известны сумчатые стадии, и такие виды относят к классу Ascomycetes (аскомицеты).[ …]
У некоторых из них известны сумчатые стадии, и такие виды относят к классу Ascomycetes (аскомицеты).[ …]
Среди почвенных микроскопических грибов имеется большое число и таких, которые способны в процессе жизнедеятельности синтезировать весьма сложные органические соединения — антибиотики, оказывающие губительные воздействия на бактерии и другие микроорганизмы. Антибиотическая активность почвенных микроскопических грибов представляет собой приспособление к условиям среды, обильно заселенной различными микроорганизмами, ведущими между собой и с другими грибами активную борьбу за существование. Например, двенадцать видов пенициллов образуют антибиотик пенициллин. Известны грибы, продуцирующие токсигенные вещества и подавляющие рост высших растений.[ …]
Такая форма взаимоотношений называется метабиотической. И, наконец, существует целая группа микроорганизмов, находящаяся в антагонистических взаимоотношениях с другими микробами. Наиболее часто проявляется антагонизм между плесенями и бактериями.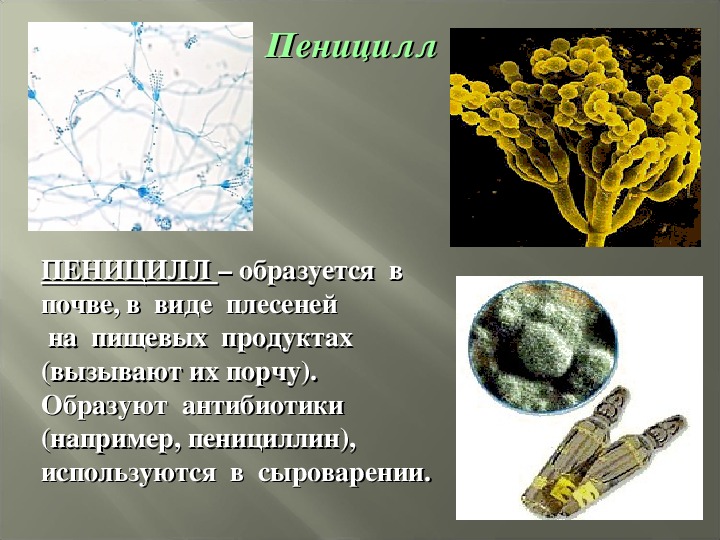 Плесени выделяют особые вещества, называемые антибиотиками, которые подавляют развитие многих бактерий. Это явлениё, называемое антибиозом, было очень широко изучено, и в настоящее время антибиотики являются одним из эффективнейших лекарственных препаратов. На фармацевтических заводах, производящих антибиотики, используются в качестве продуцентов различные плесневые грибы — пенициллы, актиномицеты. Но не только плесневые грибы могут продуцировать антибиотики. Например, антибиотик грамицидин, очень эффективно убивающий гноеродные кокки, продуцируется определенной бактерией, обнаруженной в почве, и использованной затем как продуцент этого антибиотика.[ …]
Плесени выделяют особые вещества, называемые антибиотиками, которые подавляют развитие многих бактерий. Это явлениё, называемое антибиозом, было очень широко изучено, и в настоящее время антибиотики являются одним из эффективнейших лекарственных препаратов. На фармацевтических заводах, производящих антибиотики, используются в качестве продуцентов различные плесневые грибы — пенициллы, актиномицеты. Но не только плесневые грибы могут продуцировать антибиотики. Например, антибиотик грамицидин, очень эффективно убивающий гноеродные кокки, продуцируется определенной бактерией, обнаруженной в почве, и использованной затем как продуцент этого антибиотика.[ …]
Человек в своей деятельности часто встречается с грибами из этой группы. Это не только многочисленные и всем хорошо известные зеленые, голубые и черные плесени на разнообразных пищевых продуктах. Они развиваются также на различных промышленных изделиях и материалах. В благоприятных для развития условиях, особенно в тропиках, они могут за короткий срок вызывать разрушение тканей, кожи, различных синтетических материалов (например, электроизоляции), ускорять процессы коррозии металлов, повреждать приборы, оптику и многие другие изделия.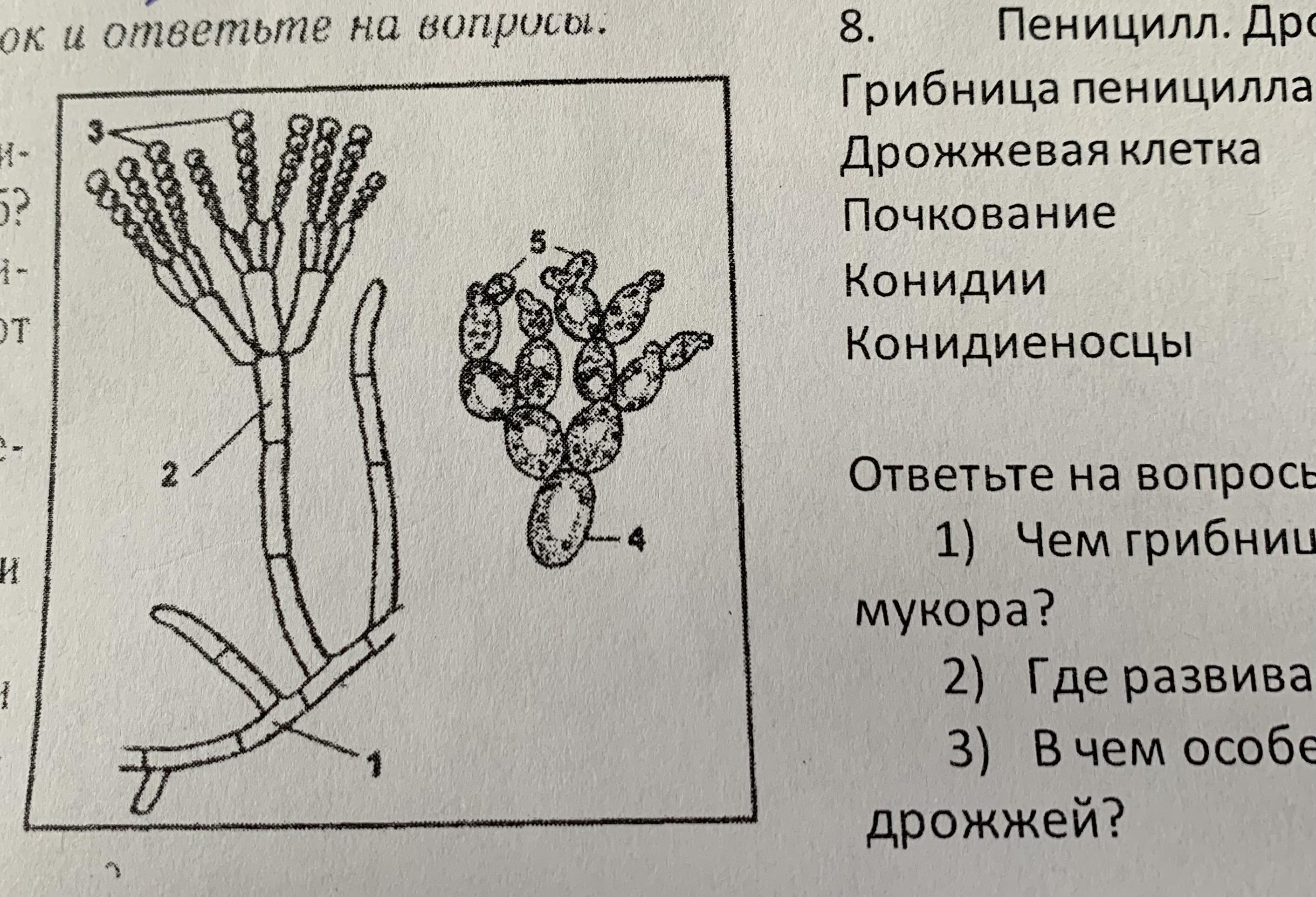 С другой стороны, некоторые из эуроциевых и близких к ним несовершенных грибов из формальных родов аспергилл (Aspergillus) и пеницилл (Pénicillium) широко используют в микробиологической промышленности как продуценты антибиотиков (пенициллины, цефалоспорин С и др.), ферментов и органических кислот, а также для приготовления некоторых пищевых продуктов — сыров (рокфор, камамбер) и соусов.[ …]
С другой стороны, некоторые из эуроциевых и близких к ним несовершенных грибов из формальных родов аспергилл (Aspergillus) и пеницилл (Pénicillium) широко используют в микробиологической промышленности как продуценты антибиотиков (пенициллины, цефалоспорин С и др.), ферментов и органических кислот, а также для приготовления некоторых пищевых продуктов — сыров (рокфор, камамбер) и соусов.[ …]
В кислых почвах обычно численность грибов больше, чем в нейтральных, но при этом их видовое разнообразие обычно меньше. По мнению некоторых исследователей, в кислых, а также в щелочных почвах микофлора беднее по видовому составу не из-за угнетающего действия на нее реакции среды, а потому, что в этих условиях многие грибы не выдерживают борьбы за существование с другими микроорганизмами почвы. Часть грибов в этих почвах гибнет под воздействием антагонистов из мира бактерий и актиномицетов. В различных поч-венно-климатических зонах при одном и том же значении кислотности (pH) почвы видовой состав грибных сообществ различен. Кроме того, виды грибов, принадлежащие к одному роду, подчас выявляют различное отношение к реакции среды.[ …]
Кроме того, виды грибов, принадлежащие к одному роду, подчас выявляют различное отношение к реакции среды.[ …]
Ученые предполагают, что лишайниковые микобионты не встречаются в природе в свобод-ноживущем состоянии. На эту мысль наводит тот факт, что в культуре на искусственных средах изолированные микобионты растут очень медленно и никогда не образуют плодовых тел. Колонии лишайниковых грибов в культуре совсем не похожи по внешнему облику на слоевище лишайника, из которого они были изолированы. В жидкой среде гриб образует в основном слизеподобную мицелиальную массу или отдельные комочки, а на агаре — компактные колонии.[ …]
В 1928 г. в Англии профессор А. Флеминг обратил внимание на одну из чашек с питательной средой, на которую была посеяна бактерия стафиллококк. Колония бактерии перестала расти под действием попавшей из воздуха и развивавшейся в этой же чашке сине-зеленой плесени. Флеминг выделил гриб в чистую куль-туру (зто оказался Pénicillium notatum) и продемонстрировал его способность продуцировать бактериостатическое вещество, которое он назвал пенициллином.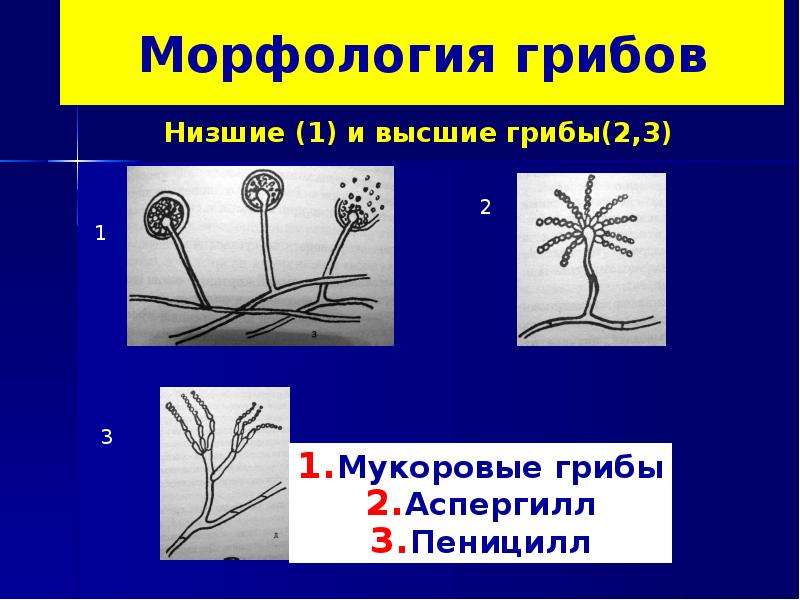 Флеминг рекомендовал использовать это вещество и отметил, что его можно применять в медицине. Однако значение пенициллина стало очевидным в полной мере лишь в 1941 г. Флори, Чейн и другие описали методы получения, очистки пенициллина и итоги первых клинических испытаний этого препарата. После этого была намечена программа дальнейших исследований, включавшая поиски более подходящих сред и способов культивирования грибов и получения более продуктивных штаммов. Можно считать, что именно с работ по повышению продуктивности пенициллов началась история научной селекции микроорганизмов.[ …]
Флеминг рекомендовал использовать это вещество и отметил, что его можно применять в медицине. Однако значение пенициллина стало очевидным в полной мере лишь в 1941 г. Флори, Чейн и другие описали методы получения, очистки пенициллина и итоги первых клинических испытаний этого препарата. После этого была намечена программа дальнейших исследований, включавшая поиски более подходящих сред и способов культивирования грибов и получения более продуктивных штаммов. Можно считать, что именно с работ по повышению продуктивности пенициллов началась история научной селекции микроорганизмов.[ …]
|
Плесневые грибы из рода Penicillium относятся к растениям, которые очень широко распространены в природе. Это род грибов класса несовершенных, насчитывающий более 250 видов. Особое значение имеет зеленая кистевидная плесень – пеницилл золотистый, так как используется человеком для производства пенициллина. Естественной средой обитания пенициллов является почва. Пенициллы часто можно увидеть в виде зеленого или голубого плесневого налета на разнообразных субстратах, в основном, растительных. Гриб пеницилл имеет сходное строение с аспергиллом, также относящимся к плесневым грибам. Вегетативный мицелий пеницилла ветвящийся, прозрачный и состоит из множества клеток. Отличие пеницилла от мукора в том, что его грибница многоклеточная, тогда как у мукора – одноклеточная. Гифы гриба пеницилла либо погружены в субстрат, либо расположены на его поверхности. От гиф отходят прямостоячие или приподнимающиеся конидиеносцы. Эти образования ветвятся в верхнем отделе и формируют кисточки, несущие цепочки одноклеточных окрашенных спор – конидий. Кисточки пенициллов могут быть нескольких видов: одноярусные, двухярусные, трехярусные и несимметричные. У некоторых видов пенициллов конидии образуют пучки – коремии. Размножение пеницилла происходит с помощью спор. Гриб пеницилл, как и мукор провоцирует порчу продуктов питания и принимает участие в разложении тканей растительных и животных организмов, благодаря большому набору выделяемых ферментов. Многие из пенициллов обладают положительными качествами для человека. Они продуцируют ферменты, антибиотики, что обусловливает их широкое применение в фармацевтической и пищевой промышленности. Так, антибактериальный препарат пенициллин получают при использовании Penicillium chrysogenum, Penicillium notatum. Изготовление антибиотика происходит в несколько этапов. Вначале культуру гриба получают на питательных средах с добавлением кукурузного экстракта для лучшей продукции пенициллина. Также плесневые грибы из рода Penicillium широко применяются в сыроварении, в частности, Penicillium camemberti, Penicillium Roquefort. Эти плесени используются в изготовлении «мраморных» сыров, к примеру, «Рокфор», «Горнцгола», «Стилтош». Все перечисленные виды сыров имеют рыхлую структуру, а также характерный вид и запах. Культуры пенициллов применяются на определенном этапе изготовления продукта. Так, при производстве сыра «Рокфор» используется селекционный штамм гриба Penicillium Roquefort, который может развиваться в рыхло спрессованном твороге, так как отлично переносит низкую концентрацию кислорода, а также устойчив к повышенному содержанию солей в кислой среде. В настоящее время ученые проводят дальнейшие исследовательские работы по изучению продуктов обмена веществ пенициллов, чтобы в будущем их можно было использовать на практике в разных отраслях хозяйства. |
90 лет назад ученый Флеминг получил первый антибиотик – пенициллин
90 лет назад британский микробиолог Александр Флеминг получил первый в мире антибиотик – пенициллин. После дальнейших исследований удалось наладить промышленное производство препарата, который в период Второй мировой войны спас сотни тысяч жизней.
90 лет назад британский микробиолог Александр Флеминг случайно выделил из плесневелых грибов пенициллин – первый в мире антибиотик. Массовое производство лекарственного препарата было налажено в период Второй мировой войны. Считается, что открытие Флеминга помогло избежать сотен тысяч жертв. Отныне даже серьезное ранение отнюдь не влекло за собой неминуемую кончину.
Считается, что открытие Флеминга помогло избежать сотен тысяч жертв. Отныне даже серьезное ранение отнюдь не влекло за собой неминуемую кончину.
В годы Первой мировой Флеминг служил военным врачом. Спасая солдат, он болезненно воспринимал многочисленные случаи гибели от гангрены или сепсиса.
К знаковому изобретению ученого подтолкнуло стечение обстоятельств. В начале сентября он приступил к работе в своей лаборатории после месячного отдыха с семьей. Перед отъездом Флеминг собрал все культуры стафилококков на столе в углу помещения. А по возвращении заметил, что одни колонии – там, где появились плесневелые грибы, — оказались уничтожены, в то время как другие сохранились в целости.
Выросшие грибы были отнесены к роду пеницилловых. Название пенициллин ученый ввел 7 марта 1929 года.
Бывший помощник гения Мерлин Прайс, оценив наблюдение, заметил, что аналогично Флеминг ранее открыл лизоцим — антибактериальный агент, фермент класса гидролаз, разрушающий клеточные стенки бактерий путем гидролиза пептидогликана клеточной стенки бактерий муреина.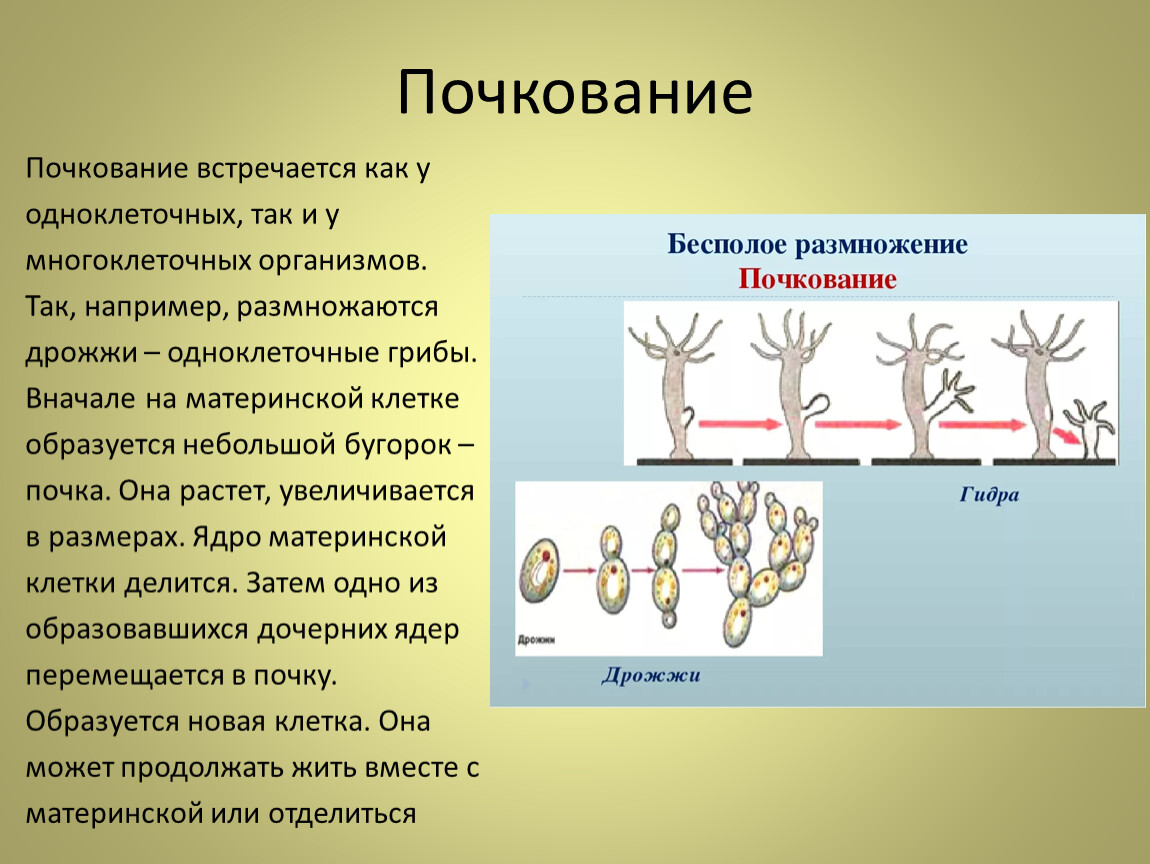 Это событие также произошло во многом случайно: будучи простуженным, Флеминг чихнул и увидел, что выделяемая из носа слизь может уничтожать некоторые бактерии.
Это событие также произошло во многом случайно: будучи простуженным, Флеминг чихнул и увидел, что выделяемая из носа слизь может уничтожать некоторые бактерии.
Флеминг исследовал положительное антибактериальное воздействие пенициллина на множество организмов, и заметил, что он подавляет такие бактерии, как стафилококки, стрептококки, пневмококки, гонококки, дифтерийная палочка и бациллы сибирской язвы,
но не действует на кишечную палочку, тифозную палочку и возбудителей гриппа, паратифа, холеры, от которых Флеминг тоже пытался лечить.
Открытие британского ученого ознаменовало эру современных антибиотиков. Флеминг также обнаружил, что бактерии обладали устойчивостью к антибиотикам, если действовали малым количеством пенициллина, либо если антибиотик употреблялся слишком короткий срок.
Изобретатель предупреждал о нежелательности использования пенициллина до определения диагноза. Если же средство действительно крайне необходимо, нельзя применять его в течение незначительного периода и в малых дозах. В таких условиях у бактерий развивается устойчивость к антибиотикам.
В таких условиях у бактерий развивается устойчивость к антибиотикам.
Рассказывая об, очевидно, главном дне своей жизни, Флеминг не стеснялся подчеркивать случайность открытия.
«Когда я проснулся на рассвете 28 сентября 1928 года, я, конечно, не планировал революцию в медицине своим открытием первого в мире антибиотика или бактерии-убийцы, — улыбался биолог. — Но я полагаю, что именно это я и сделал».
Исследователь продолжил экспериментировать, но еще очень долго пенициллин оставался незамеченным в научных кругах. Его применение не укладывалось в принятую тогда концепцию укрепления иммунитета.
Следующим этапом развития пенициллина стали разработки профессором Оскфордского университета Говардом Флори и химиком Борисом Чейном, который, являясь евреем левых взглядов, был вынужден эмигрировать в Англию после прихода к власти в Германии нацистов.
Чейн продолжил исследования Флеминга и смог получить неочищенный пенициллин в количествах, достаточных для первых биологических испытаний сначала на животных, а затем и в клинике.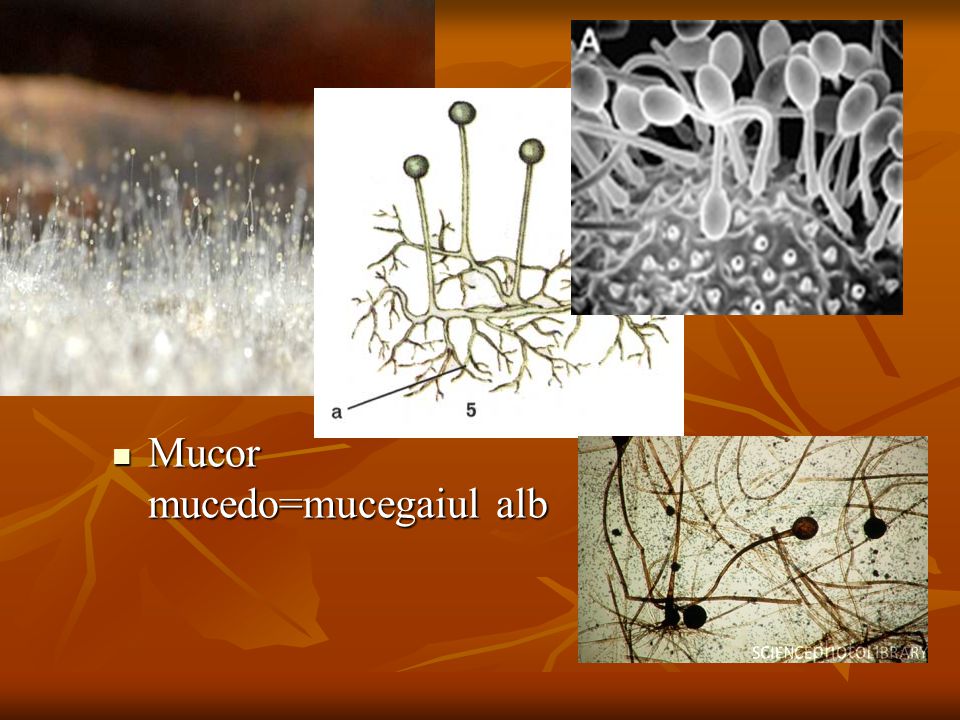
После года мучительных экспериментов по выделению и очистке продукта грибов удалось получить первые 100 мг чистого пенициллина.
При этом первого пациента, лондонского полицейского с заражением крови, спасти не удалось. Сперва ему действительно стало лучше, но не хватило накопленного запаса пенициллина, который быстро выводился почками. Первым счастливчиком, которого вылечили от аналогичного недуга благодаря антибиотику, стал в 1941 году 15-летний подросток.
Опасаясь вторжения немецких войск на Британские острова, Чейни спрятал плесневые споры, пропитав ими прокладки пиджаков и карманов.
«Если меня убьют, первым делом хватайте мой пиджак», — инструктировал он коллег.
В условиях континентальной блокады организовать выпуск препарата в Англии не удалось. Поэтому Чейн и Флори отправились совершенствовать технологию в США.
Промышленное производство пенициллина началось в 1943 году фармакологическими гигантами страны.
Изобретение назвали «лекарством века».
В 1945 году Флеминг, Чейн и Флори были удостоены Нобелевской премии в области медицины «за открытие пенициллина и его целебного воздействия при различных инфекционных болезнях». Как отмечалось тогда в СМИ, эти ученые сделали для разгрома нацизма больше, чем целые дивизии. Более полвека спустя, в 1999-м, «отца антибиотика» включили в список 100 самых важных людей XX века по версии журнала «Тайм».
«Это открытие изменило ход истории. Вещество, которое Флеминг назвал пенициллином, является очень активным противоинфекционным средством», — сообщалось в комментарии к выбору.
В СССР к опытам по созданию пенициллина приступили сразу же, как только получили секретную информацию о разработках в Англии группой Чейна и Флори. Первые образцы пенициллина получили в 1942 году микробиологи Зинаида Ермольева и Тамара Балезина из плесени, взятой со стены московского бомбоубежища. Еще два года спустя после длительных исследований и наблюдений препарат был испытан на раненых.
Произведенный эффект оказался ошеломляющим, но антибиотик долгое время получали кустарным способом в малых объемах, не достаточных для лечения большого количества раненых воинов.
СССР не сразу удалось наладить массовое производство: поначалу получался низкокачественный препарат, терявший свойства при хранении и вызывавший побочные действия у больных. Лишь в 1948 году случился прорыв в этом направлении. Ему способствовал Чейни, решивший в обход введенного в США запрета на продажу технологий поделиться «рецептом» с советскими коллегами.
Сегодня пенициллин уже не используется в медицинских целях – ему на смену пришли новые, более совершенные виды антибиотиков.
Растения, грибы, бактерии
Экспозиция зала знакомит с представителями бактерий, грибов и основных групп растений.
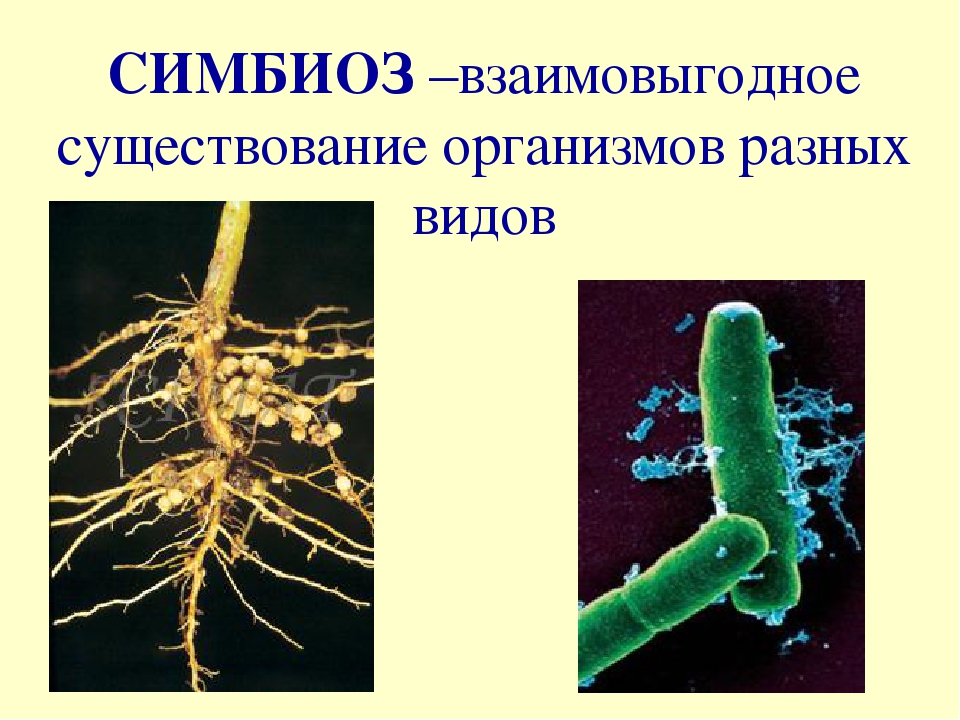
Бактерии, самые древние живые организмы на Земле, возникли около 4 млрд лет назад. В разделе представлены фотографии и зафиксированные культуры разных видов бактерий, влажные препараты клубеньков азотфиксирующих бактерий на корнях бобовых растений, железная руда лимонит — продукт жизнедеятельности древних железобактерий.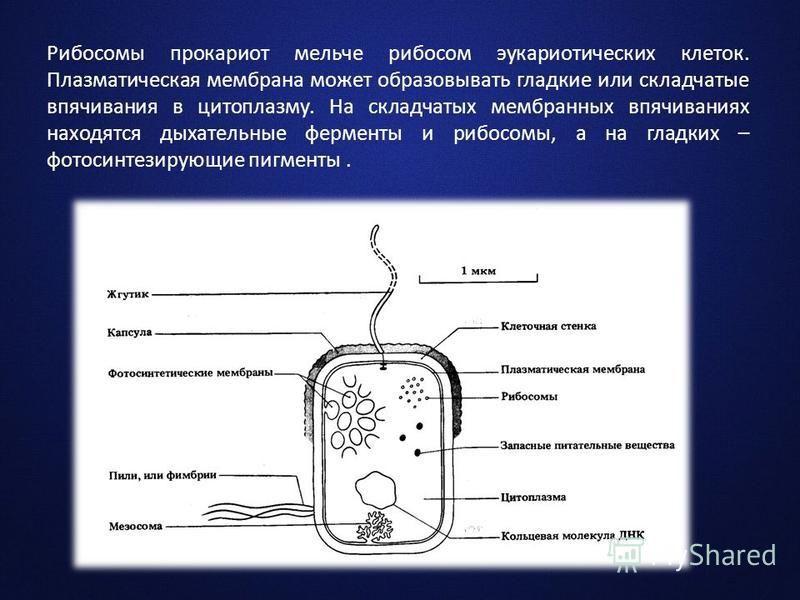
Грибов насчитывается около 100 тысяч видов. Обычно грибами в обиходе называют лишь плодовые тела шляпочных грибов. В разделе «Грибы» показано разнообразие форм этого царства: съедобные и ядовитые грибы, возбудители болезней растений, колонии плесневых грибов аспергиллов и пенициллов, грибы-хищники. Они представлены натуральными экспонатами, муляжами, на фотографиях и рисунках, в фиксирующей жидкости. Муляжи грибов выполнены А. Ф. Манаевым.
В зале можно увидеть лишайники — одни из самых загадочных организмов на планете, тело которых представляет собой ассоциацию грибов и одноклеточных водорослей. Лишайники представлены различными формами: кустистыми, листоватыми, накипными. Бóльшая часть экспозиции зала посвящена царству растений, насчитывающему более 330 тысяч видов. Царство делится на две группы: низшие растения (водоросли) и высшие растения (моховидные, папоротниковидные, голосеменные, покрытосеменные).
Водоросли — самые древние растения на Земле. Они возникли почти 2 млрд лет тому назад. Цветной рисунок в экспозиции показывает распределение водорослей на глубину до 250 метров. В разделе представлены гербарий и объёмная сушка зелёных, бурых и красных водорослей, в том числе два вида ламинарии, больше известной как морская капуста; литотамнион — водоросль с наружным известковым скелетом; напоминающая коралл кладофора.
Цветной рисунок в экспозиции показывает распределение водорослей на глубину до 250 метров. В разделе представлены гербарий и объёмная сушка зелёных, бурых и красных водорослей, в том числе два вида ламинарии, больше известной как морская капуста; литотамнион — водоросль с наружным известковым скелетом; напоминающая коралл кладофора.
Из высших растений демонстрируются гербарий, отпечатки ископаемых растений и объёмная сушка мхов, плаунов, хвощей и папоротников, в том числе лист современного древовидного папоротника, большая коллекция шишек хвойных растений. Уникальны модели цветковых растений, изготовленные Н. Н. Кочиным. Интересно познакомиться с коллекцией плодов и семян, способами их распространения. Представлены плоды экзотических деревьев (дынного, макаронного, колбасного) и плоды огромного зонтичного растения — ферулы.
В экспозиции также представлены макеты фрагментов экосистем с характерной флорой арктической пустыни и тундры. Центральное место в зале занимает диорама «Пойменный луг», в которой демонстрируется разнообразие растительности заливных лугов.
Экспозиция создана в 1978 году. Автор экспозиции — В. В. Ксенофонтова, ведущий художник — М. М. Рожков. С 2004 года в зале создана сменная экспозиция «Страницы Красной книги Москвы», в которой показаны ставшие редкими и исчезающими в городе растения. Авторы экспозиции — Е. Н. Михеечева и В. А. Смирнова, художник — Е. М. Голубятникова.
В свободном доступе в зале размещены фрагменты стволов каменной берёзы и пробкового дуба, макеты самого крупного травянистого растения — банана и самого быстрорастущего растения — бамбука. Эти экспонаты снабжены этикетками со шрифтом Брайля и доступны для тактильного осмотра.
В зале проводится более 10 экскурсий ботанической тематики.
Итоговый тест по теме «Грибы и бактерии»
1 вариант1.Бактерии относят к а) прокариотам б) эукариотам в) растениям
2.Основа любого гриба а) мицелий б) плодовое тело в) спорангий
3.Грибы нельзя отнести к царству животных, так как у них а) размножение спорами б) питание путем осмоса в) оба ответа верны
4. Ферменты грибов могут работать вне клетки а) никогда б) всегда в) иногда
Ферменты грибов могут работать вне клетки а) никогда б) всегда в) иногда
5.Дыхание грибов может быть а) аэробным ( кислородным) б) анаэробным ( бескислородным) в) оба ответа верны
6.На злаковых растениях паразитирует а) фитофтора б) спорынья в) трутовик
7.Бактерии размножаются а) делением клетки б) спорами в)почкованием
8.При симбиозе с деревьями грибы дают им а) воду б) воду и органические вещества в) органические вещества
9.Мукор – гриб а) одноклеточный б) многоклеточный в) колониальный
10.Бактерии, вызывающие болезни растений, по способу питания а) сапрофиты б) паразиты в) симбионты
11.Для получения кисло-молочных продуктов используют а) бактерий б) грибов в) тех и других
12.В природе грибы могут быть а) продуцентами б) консументами в) консументами и редуцентами
13.Вешенки по способу питания являются а) паразитами б) сапрофитами в) симбионтами
14.Холерный вибрион имеет форму а) спирали б) изогнутую в) палочки
15. Среди бактерий мало а) сапрофитов б) паразитов в) автотрофов
Среди бактерий мало а) сапрофитов б) паразитов в) автотрофов
16.Опенок может быть а) паразитом б) сапрофитом в) тем и другим
17.Для получения антибиотиков используют а) мукор б) аспергилл в) пеницилл
18.В бактериальной клетке есть а) ядро б( рибосомы в) митохондрии
19.Главная роль грибов в природе а) пища для животных б) разрушение органических веществ в) образование органических веществ
20.У бактерий, обитающих на дне моря, дыхание а) аэробное б) анаэробное в) оба ответа верны
21.Человек научился выращивать а) вешенки б) маслят в) сыроежек
22.Головню, спорынью, ржавчину относят к грибам а) паразитам б) симбионтам в) сапрофитам
23.Портит продукты а) мукор б) доджи в) трутовик
24.Грибы-паразиты человек может использовать а) для борьбы с другими организмами б) в пищу в) не использует никак
25.Споры – это приспособление бактерий к а) размножению б) переносу неблагоприятных условий в)оба ответа верны
ИТОГОВЫЙ ТЕСТ ПО ТЕМЕ «ГРИБЫ И БАКТЕРИИ»
2 вариант
1. Грибы нельзя отнести к растениям, так как у них а) запасное питательное вещество – гликоген б) клеточная стенка из хитина в) оба ответа верны
Грибы нельзя отнести к растениям, так как у них а) запасное питательное вещество – гликоген б) клеточная стенка из хитина в) оба ответа верны
2.У грибов плодовые тела могут быть только а) многоклеточными б) одноклеточными в) нет ответа
3.У бактерий, портящих консервы, дыхание а) аэробное ( кислородное) б) анаэробное ( бескислородное) в) зависит от условий
4.В природе грибы и бактерии используют вырабатываемые ими антибиотики для а) усиления роста б) для борьбы за среду обитания в) никак не используют
5.Гриб, разрушающий древесину, это а) трутовик б) домовой гриб в) оба гриба
6.Признаки животных у грибов а) постоянный рост б) осмотическое питание в) запасное питательное вещество – гликоген
7.Витамины в нашем организме создают а) палочка Коха б) кишечная палочка в) нет ответа
8.Большинство бактерий по способу питания а) автотрофы б) симбионты в) гетеротрофы
9.Грибы плохо перевариваются в нашем организме, так как у них а) много жиров б) много минеральных солей в) есть хитин в оболочке
10. Белой плесенью называют а) пеницилл б) мукор в) аспергилл
Белой плесенью называют а) пеницилл б) мукор в) аспергилл
11.В бактериальной клетки нет а) рибосом б) хромосомы в) ядра
12.Шампиньоны по способу питания а) сапрофиты б) паразиты в) симбионты
13.Размножение спорами происходит а) у бактерий б) у грибов и бактерий в) только у грибов
14.Спорангий у пеницилла в форме а) шара б) кисти в) спирали
15.Гриб чага – это а) паразит б) симбионт в) сапрофит
16.На злаках паразитирует а) спорынья б) головня в) обе
17.Шляпочные грибы не могут размножаться а) почкованием б) спорами в) кусочками мицелия
18.Пеницилл относится к грибам а) одноклеточным б) многоклеточным в) колониальным
19.Плодородие почвы обеспечивается а) только бактериями б) только грибами в) грибами и бактериями
20.К грибам- паразитам относятся а) трутовик б) ржавчина в) оба гриба
21.Все нити грибницы называются а) микоризой б) грибокорнем в) мицелием
22.Для прорастания спор грибов необходим а)свет б) тепло в) сухая почва
23. Клубеньковые бактерии а) поселяются на корнях бобовых б)поглощают азот из воздуха в) оба ответа верны
Клубеньковые бактерии а) поселяются на корнях бобовых б)поглощают азот из воздуха в) оба ответа верны
24.Плодовое тело состоит из пенька и шляпки у а) дождевика б) трюфеля в) рыжика
25.Способность бактерий и грибов вырабатывать антибиотики используется а) человеком б) сами организмами в) оба ответа верны
Критерии оценки: «5» — 23,24 «4» — 17-23 «3» — 12-16
Тема №5204 Признаки организмов
1. Задание 3 Что содержится в чёрных шариках на концах длинных ответвлений у гриба мукора?
1) микроскопические плоды
2) питательные вещества
3) вода с минеральными солями
4) микроскопические споры
Ответ: 4
2. Задание 3 Признаки бывают наследуемые или приобретённые. Какой из следующих признаков является приобретённым?
1) группа крови
2) шрам на теле
3) цвет глаз
4) число позвонков
Ответ: 2
3. Задание 3 Сходство жизнедеятельности цианобактерий и цветковых растений проявляется в способности к
Задание 3 Сходство жизнедеятельности цианобактерий и цветковых растений проявляется в способности к
1) образованию семян
2) автотрофному питанию
3) двойному оплодотворению
4) гетеротрофному питанию
Ответ: 2
4. Задание 3 Некоторые бактерии выживают в условиях вечной мерзлоты в виде
1) спор
2) вегетативных клеток
3) симбиоза с грибами
4) множественных колоний
Ответ: 1
5. Задание 3 Чем спора отличается от свободной бактерии?
1) Спора — многоклеточное образование, а свободная бактерия — одноклеточное.
2) Спора менее долговечна, чем свободная бактерия.
3) Спора питается автотрофно, а свободная бактерия — гетеротрофно.
4) Спора имеет более плотную оболочку, чем свободная бактерия.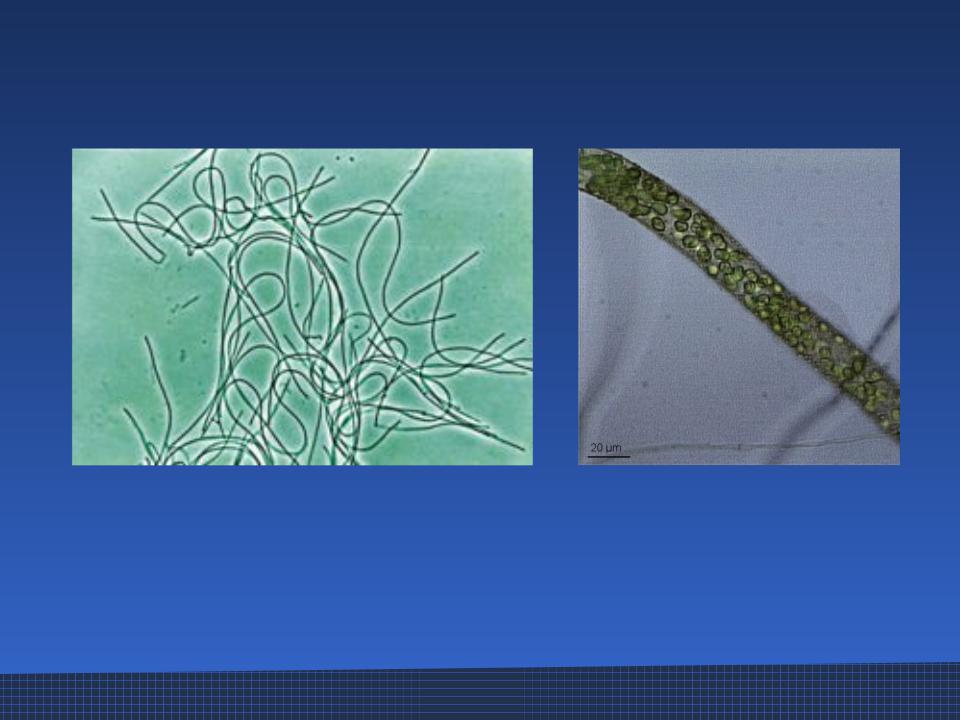
Ответ: 4
6. Задание 3 Возбудители дифтерии являются
1) автотрофами
2) сапротрофами
3) паразитами
4) симбионтами
Ответ: 3
7. Задание 3 Какой из приёмов борьбы с болезнетворными бактериями наиболее эффективен в операционном блоке?
1) пастеризация
2) регулярное проветривание
3) облучение ультрафиолетовыми лучами
4) мытье полов горячей водой
Ответ: 3
8. Задание 3 Укажите случай симбиоза бактерии с другим организмом.
1) бацилла сибирской язвы и овца
2) вибрион холеры и человека
3) кишечная палочка и человек
4) сальмонелла и курица
Ответ: 3
9. Задание 3 В каких отношениях находятся гриб и водоросль, образующие лишайник?
1) Их отношения взаимовыгодны.
2) Водоросль паразитирует на грибе.
3) Они конкурируют за свет и воду.
4) Их отношения нейтральны.
Ответ: 1
10. Задание 3 Корни, оплетённые гифами гриба, представляют собой
1) лишайник
2) плесень
3) микоризу
4) спору
Ответ: 3
11. Задание 3 Сахар превращается в спирт благодаря жизнедеятельности
1) пеницилла
2) мукора
3) головни
4) дрожжей
Ответ: 4
12. Задание 3 Лишайники не растут в крупных городах потому, что там
1) загрязнён воздух
2) недостаточная влажность
3) нет водорослей
4) нет грибов
Ответ: 1
13. Задание 3 Пеницилл отличается от мукора тем, что
1) пеницилл многоклеточный, а мукор одноклеточный гриб
2) пеницилл образует плесень на продуктах, а мукор нет
3) пеницилл размножается спорами, а мукор — грибницей
4) пеницилл — гетеротроф, а мукор — автотроф
Ответ: 1
14. Задание 3 Поселяясь на пнях, опята используют их для
Задание 3 Поселяясь на пнях, опята используют их для
1) получения энергии из неорганических веществ
2) защиты от болезнетворных бактерий
3) получения готовых органических веществ
4) привлечения насекомых-опылителей
Ответ: 3
15. Задание 3 Какие грибы не образуют микоризы с древесными растениями?
1) трутовики
2) подберёзовики
3) лисички
4) подосиновики
Ответ: 1
16. Задание 3 Какие бактерии считают «санитарами планеты»?
1) молочнокислые
2) гниения
3) уксуснокислые
4) клубеньковые
Ответ: 2
17. Задание 3 Проводящая ткань растений, по клеткам которой осуществляется передвижение органических веществ, состоит из
1) волокон
2) клеток с волосками
3) сосудов
4) ситовидных трубок
Ответ: 4
18. Задание 3 Волокно как особый вид механической ткани сильно развито в стебле
Задание 3 Волокно как особый вид механической ткани сильно развито в стебле
1) льна-долгунца
2) кукурузы
3) томата
4) тюльпана
Ответ: 1
19. Задание 3 Прочность и упругость организму растения обеспечивает
1) проводящая ткань
2) образовательная ткань
3) основная ткань
4) механическая ткань
Ответ: 4
20. Задание 3 К основной ткани в цветковом растении относят
1) кожицу
2) фотосинтезирующую ткань
3) образовательную ткань
4) пробку
Ответ: 2
21. Задание 3 Грибы, в отличие от растений,
1) содержат хитин в оболочках клеток
2) дышат углекислым газом
3) растут в течение всей жизни
4) в клетках имеют ядра
Ответ: 1
22. Задание 3 По способу питания молочнокислые бактерии относят к
Задание 3 По способу питания молочнокислые бактерии относят к
1) бактериям-сапротрофам
2) бактериям-паразитам
3) фотосинтезирующим бактериям
4) автотрофным бактериям
Ответ: 1
23. Задание 3 По способу питания цианобактерии (синезелёные) относят к
1) гетеротрофным бактериям
2) автотрофным бактериям
3) бактериям-сапротрофам
4) бактериям-паразитам
Ответ: 2
24. Задание 3 Бактерии, вызывающие ангину, относят к группе
1) автотрофных бактерий
2) бактерий-паразитов
3) бактерий гниения
4) бактерий-сапротрофов
Ответ: 2
25. Задание 3 Что представляет собой микориза?
1) грибокорень
2) грибницу, разросшуюся в почве
3) отдельные нити гриба, образующие плодовое тело
4) мочковатую корневую систему растения
Ответ: 1
26. Задание 3 . У бактериальной клетки отсутствует(-ют)
Задание 3 . У бактериальной клетки отсутствует(-ют)
1) нуклеиновые кислоты
2) клеточная оболочка
3) клеточное ядро
4) рибосомы
Ответ: 3
27. Задание 3 . К комплексным организмам относят
1) лишайники
2) шляпочные грибы
3) водоросли
4) плесневые грибы
Ответ: 1
28. Задание 3 . Клетка гриба отличается от растительной клетки отсутствием
1) пластид
2) клеточной стенки
3) ядра
4) эндоплазматической сети
Ответ: 1
29. Задание 3 . Клетка гриба отличается от животной клетки наличием
1) клеточной стенки
2) митохондрий
3) пластид
4) ядра
Ответ: 1
30. Задание 3 . Клетки грибов, в отличие от клеток бактерий, имеют
1) оформленное ядро
2) цитоплазму
3) рибосомы
4) плазматическую мембрану
Ответ: 1
31. Задание 3 . Какие из перечисленных ниже грибов проще выращивать в искусственных условиях?
Задание 3 . Какие из перечисленных ниже грибов проще выращивать в искусственных условиях?
1) лисички
2) маслята
3) белые грибы
4) шампиньоны
Ответ: 4
32. Задание 3 . Ягель (олений мох) по своему строению относится к
1) грибам
2) лишайникам
3) моховидным
4) травянистым растениям
Ответ: 2
33. Задание 3 . Какие грибы размножаются почкованием?
1) опята
2) пеницилл
3) дрожжи
4) мукор
Ответ: 3
34. Задание 3 . Плесневые грибы человек использует в
1) выпечке хлеба
2) силосовании кормов
3) получении сыров
4) приготовлении столового вина
Ответ: 3
35. Задание 3 . Выберите верное утверждение.
1) у одноклеточного организма нет способности к половому размножению
2) у одноклеточного организма все функции выполняет одна клетка
3) у многоклеточного организма нет дифференциации на органы и ткани
4) у многоклеточного организма всегда есть билатеральная симметрия
Ответ: 2
36. Задание 3 . Выберите верное утверждение.
Задание 3 . Выберите верное утверждение.
1) у одноклеточного растения нет способности к половому размножению
2) одноклеточные растения неспособны к активному движению
3) у многоклеточного растения не бывает дифференциации на органы и ткани
4) у многоклеточного растения объём тела потенциально не ограничен
Ответ: 4
37. Задание 3 . Что такое мицелий?
1) фотосинтезирующая часть лишайника
2) орган спороношения гриба
3) симбиотический орган гриба и корней растений
4) вегетативное тело гриба
Ответ: 4
38. Задание 3 . Что такое гифы?
1) нити, составляющие тело гриба
2) органы спороношения гриба
3) органы прикрепления гриба к субстрату
4) фотосинтезирующая часть лишайника
Ответ: 1
39. Задание 3 . К какому царству относится организм, схема строения клетки которого изображена на рисунке?
Задание 3 . К какому царству относится организм, схема строения клетки которого изображена на рисунке?
1) Бактерии
2) Растения
3) Грибы
4) Животные
Ответ: 1
40. Задание 3 . К какому царству относится организм, схема строения клетки которого изображена на рисунке?
1) Бактерии
2) Растения
3) Грибы
4) Животные
Ответ: 3
41. Задание 3 . Бактерии, наиболее полезные для человека, — это
1) молочнокислые
2) стрептококки
3) туберкулёзные палочки
4) пневмококки
Ответ: 1
42. Задание 3 . Дрожжи получают энергию для своей жизнедеятельности путём
1) преобразования энергии солнечного света
2) поглощения из почвы минеральных веществ
3) разложения сахара на спирт и углекислый газ
4) получения из почвы органических веществ
Ответ: 3
43. Задание 3 . На каком из рисунков представлен фрагмент тела гриба мукора?
Задание 3 . На каком из рисунков представлен фрагмент тела гриба мукора?
1) 1
2) 2
3) 3
4) 4
Ответ: 2
44. Задание 3 . На каком из рисунков представлен фрагмент тела гриба подосиновика?
1) 1
2) 2
3) 3
4) 4
Ответ: 3
45. Задание 3 . Плесневые грибы человек не использует при
1) выпечке хлеба
2) силосовании кормов
3) получении сыров
4) приготовлении столового вина
Ответ: 2
46. Задание 3 . Каково отличие высших грибов от низших?
1) У них мицелий разделён на отдельные клетки.
2) Они бывают только сапрофитами.
3) У них клетки не имеют клеточной стенки.
4) Они не образуют плодовое тело.
Ответ: 1
47. Задание 3 . Каково отличие низших грибов от высших?
1) У них мицелий разделён на отдельные клетки.
2) Они не образуют плодовое тело.
3) У них клетки не имеют клеточной стенки.
4) Они бывают только паразитами.
Ответ: 2
48. Задание 3 . Растения потребляют кислород и выделяют углекислый газ в процессе
1) дыхания только в темноте
2) дыхания на свету и в темноте
3) передвижения органических веществ
4) фотосинтеза на свету
Ответ: 2
49. Задание 3 . У представителей какого из царств живой природы в строении имеется образовательная ткань?
1) Животные
2) Бактерии
3) Грибы
4) Растения
Ответ: 4
50. Задание 3 . Представителей царства Бактерии относят к прокариотам, так как в их клетках отсутствует(-ют)
1) оформленное ядро
2) митохондрии
3) пластиды
4) рибосомы
Ответ: 1
51. Задание 3 . Чем различаются организмы животных и растений?
Задание 3 . Чем различаются организмы животных и растений?
1) способом питания
2) наличием дыхания
3) способностью воспроизводить себе подобных
4) приспособленностью к среде обитания
Ответ: 1
52. Задание 3 . Растения отличаются от грибов наличием в клетке
1) ядра
2) хлоропластов
3) митохондрий
4) оболочки
Ответ: 2
53. Задание 3 . Бактерии, вызывающие ангину, относят к группе
1) автотрофных бактерий
2) бактерий гниения
3) бактерий-паразитов
4) бактерий-сапротрофов
Ответ: 3
Свидетельство наличия уникальных микробов широкого профиля в симпатрических отдаленных морских губках приливной зоны (Porifera: Demospongiae)
Разнообразие и специфичность микробных сообществ в морской среде является ключевым аспектом экологии и эволюции как эукариотических хозяев, так и связанных с ними прокариот. Морские губки имеют филогенетически разнообразные и сложные микробные линии. Здесь мы исследовали бактериальное сообщество губок и паттерны распределения микробов у трех симпатрических литоральных морских демоспонгов, Hymeniacidon perlevis, Ophlitaspongia papilla и Polymastia penicillus с Атлантического побережья Португалии, используя классические методы выделения и библиотеки клонов генов 16S рРНК.Оценка микробного состава с использованием почти полноразмерных последовательностей гена 16S рРНК (примерно 1400 п.н.) из изолятов (n = 31) и частичных последовательностей (примерно 280 п.н.) из библиотек клонов (n = 349) выявила различные бактериальные сообщества и другие микробы, связанные с губками. Большинство бактериальных изолятов были членами отряда Vibrionales и других симбиотических бактерий, таких как Pseudovibrio ascidiaceiocola, Roseobacter sp., Hahellaceae sp. и Cobetia sp. Расширенный анализ с использованием экологических показателей, включающих 142 OTU, подтвердил четкую дифференциацию профилей бактериальных сообществ среди губок-хозяев и окружающей их морской воды.
Морские губки имеют филогенетически разнообразные и сложные микробные линии. Здесь мы исследовали бактериальное сообщество губок и паттерны распределения микробов у трех симпатрических литоральных морских демоспонгов, Hymeniacidon perlevis, Ophlitaspongia papilla и Polymastia penicillus с Атлантического побережья Португалии, используя классические методы выделения и библиотеки клонов генов 16S рРНК.Оценка микробного состава с использованием почти полноразмерных последовательностей гена 16S рРНК (примерно 1400 п.н.) из изолятов (n = 31) и частичных последовательностей (примерно 280 п.н.) из библиотек клонов (n = 349) выявила различные бактериальные сообщества и другие микробы, связанные с губками. Большинство бактериальных изолятов были членами отряда Vibrionales и других симбиотических бактерий, таких как Pseudovibrio ascidiaceiocola, Roseobacter sp., Hahellaceae sp. и Cobetia sp. Расширенный анализ с использованием экологических показателей, включающих 142 OTU, подтвердил четкую дифференциацию профилей бактериальных сообществ среди губок-хозяев и окружающей их морской воды.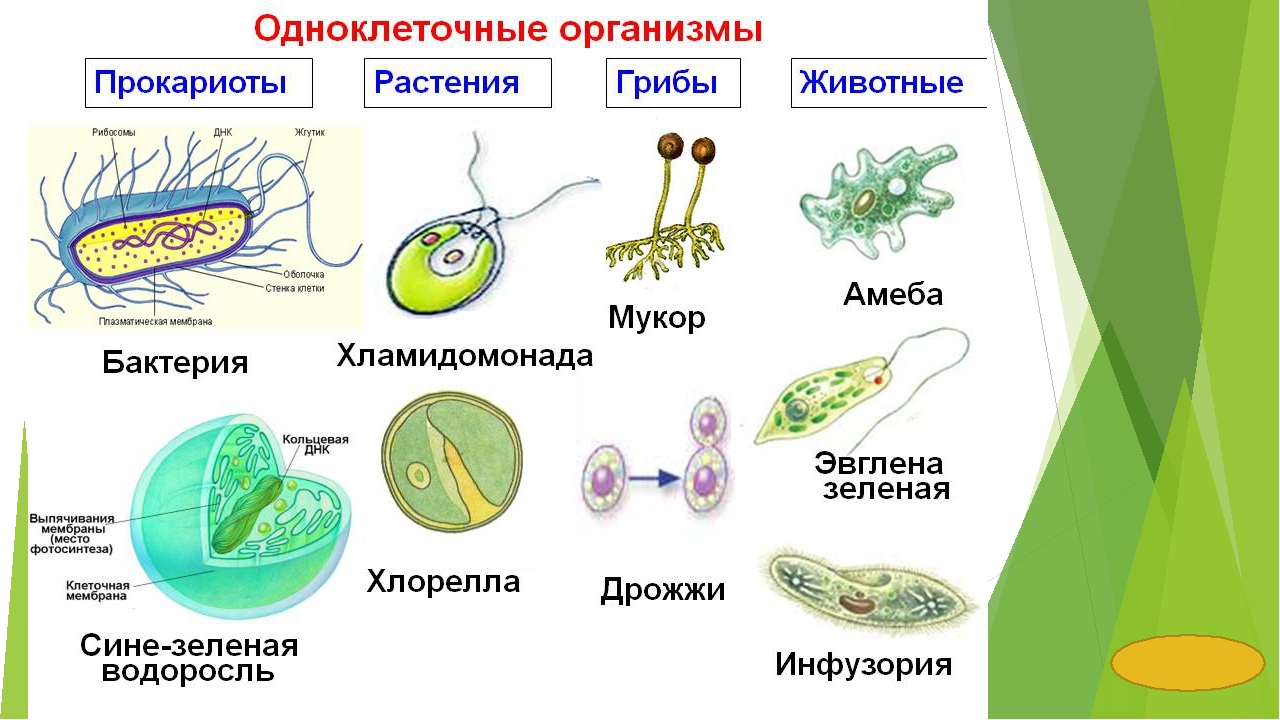 Филогенетический анализ позволил определить клады, представляющие общие бактериальные сообщества, особенно между H. perlevis и географически отдаленно родственными H. heliophila, а также среди других губок. Кроме того, мы также наблюдали три отдельные и уникальные группы бактерий: Betaproteobactria (~ 81%), Spirochaetes (~ 7%) и Chloroflexi (~ 3%), которые строго поддерживаются у видов-хозяев с низким содержанием микробов O. papilla и P . penicillus. Наше исследование выявило в значительной степени универсальный характер микробных ассоциаций среди этих одновременно встречающихся приливных морских губок.
Филогенетический анализ позволил определить клады, представляющие общие бактериальные сообщества, особенно между H. perlevis и географически отдаленно родственными H. heliophila, а также среди других губок. Кроме того, мы также наблюдали три отдельные и уникальные группы бактерий: Betaproteobactria (~ 81%), Spirochaetes (~ 7%) и Chloroflexi (~ 3%), которые строго поддерживаются у видов-хозяев с низким содержанием микробов O. papilla и P . penicillus. Наше исследование выявило в значительной степени универсальный характер микробных ассоциаций среди этих одновременно встречающихся приливных морских губок.
Архивы Halimeda и Penicillus — Геологические экскурсии
Сообщение в серии How to … по карбонатной минералогии — карбонатный шлам
Micrite — ощутимое сокращение микрокристаллического кальцита
Известковые илы являются важными компонентами большинства неглубоких карбонатообразующих сред: платформ, краев и склонов платформ, задних и передних рифов, а также лагун. Они также накапливаются в неглубоких щелочных озерах и в виде илов на глубоком океанском дне. Как и их терригенные собратья, они накапливаются в виде дискретных пластов и в виде матрицы к крупнозернистым карбонатным каркасам.
Они также накапливаются в неглубоких щелочных озерах и в виде илов на глубоком океанском дне. Как и их терригенные собратья, они накапливаются в виде дискретных пластов и в виде матрицы к крупнозернистым карбонатным каркасам.
Известковый шлам или микрит включает арагонит и кальцит (и, возможно, доломит), имеющие размер кристаллов менее 4-5 микрон. Таким образом, любое подробное исследование требует SEM или аналогичной технологии. Их размер зерен и, следовательно, высокая удельная площадь поверхности означает, что они весьма реакционноспособны и склонны к перекристаллизации в более грубые мозаики из кальцит-доломитового шпата.
Сегодня наибольшие объемы карбонатных илов образуются в мелководных теплых морях на глубинах обычно менее 10 м. Вся карбонатная грязь образуется в результате атмосферных осадков либо напрямую (то есть без биологического вмешательства), либо как побочный продукт биологической активности. Хотя в этом есть определенная степень уверенности, относительный вклад каждого источника остается спорным даже после десятилетий исследований. Менее значимые с точки зрения объема, но, возможно, не менее важные источники грязи включают биоэрозию и механическое разрушение скелетного материала.
Менее значимые с точки зрения объема, но, возможно, не менее важные источники грязи включают биоэрозию и механическое разрушение скелетного материала.
Несколько видов зеленых водорослей образуют арагонитовые иглы и пластинки микронного размера, которые опадают, когда водоросль умирает. Из них водорослей кодиевых Halimeda и Penicillus являются наиболее плодовитыми продуцентами. Например, во Флоридском заливе и измерения продуктивности арагонита Penicillus на рифе (в виде игл длиной 2-3 мкм) показывают, что только этот вид может составлять всю отложившуюся там грязь (Stockman et al. 1967). Другие виды кодиевых водорослей плюс разрушение скелетного материала также вносят грязь, но в этом месте Penicillus — это он.Арагонит, добываемый на этих мелководьях, также переносится в приливные отмели и дальше от берега.
За канавой на берегу Большого Багамы также есть полосы арагонитовой грязи. Расчеты, подобные тем, которые были выполнены для Флориды, показывают, что большая часть этой грязи (на объемной основе) также могла быть получена из водорослей кодиевых водорослей. Однако это оспаривается Миллиманом и другими , которые утверждают, что большая часть арагонита микронных размеров (до 75%) выпала в осадок непосредственно из морской воды, потому что:
Однако это оспаривается Миллиманом и другими , которые утверждают, что большая часть арагонита микронных размеров (до 75%) выпала в осадок непосредственно из морской воды, потому что:
- Морфология кристаллов арагонита больше похожа на кристаллы, полученные прямым осаждением, а
- Содержание стронция в иле слишком велико — отношение Sr / Mg ≈ 4 по сравнению со средними значениями ≈ 2 для кодиевых водорослей.
Одно из явлений, которое вызвало интерес как потенциальный источник арагонитовой грязи, — это спонтанное образование молочно-белых облаков взвешенного карбоната, или пятен . Они образуются на неглубоких платформах и сохраняются ровно столько, сколько требуется для того, чтобы подвеска рассеялась или выпала из нее. В качестве объяснений часто используются два механизма:
- Если донный ил взбалтывается кормлением рыб (это наблюдалось), и
- При попадании прямых осадков из морской воды.Измерение пятен на банке Гранд Багама показывает, что большая часть суспензии представляет собой арагонит микронных размеров, но может присутствовать кальцит с высоким содержанием магния до 20% ( Shinn et al 1989 ).

Некоторая поддержка гипотезы о прямых осадках связана с примерами мерцания в районах, лишенных донных красных и зеленых водорослей (например, Trucial Coast). Однако это не исключает возможности того, что взвешенные водоросли могут играть определенную роль. J.W. Морс предположил, что осаждение арагонита массой в нормальной морской воде может происходить, если фотосинтез фитопланктона (во время цветения водорослей) снижает растворенный CO 2 .
Багамский арагонит также переносится в приливные отмели и мелководные лагуны, а также на край платформы, где он накапливается из взвеси на прилегающем глубоководном склоне; карбонатная грязь, которая накапливается таким образом, называется гемипелагической грязью .
В позднем палеозое ниша известковых водорослей была занята филлоидными водорослями, которые были ответственны за образование грязевых курганов. Классические примеры можно найти в пенсильванских циклотемах Канзаса и Оклахомы.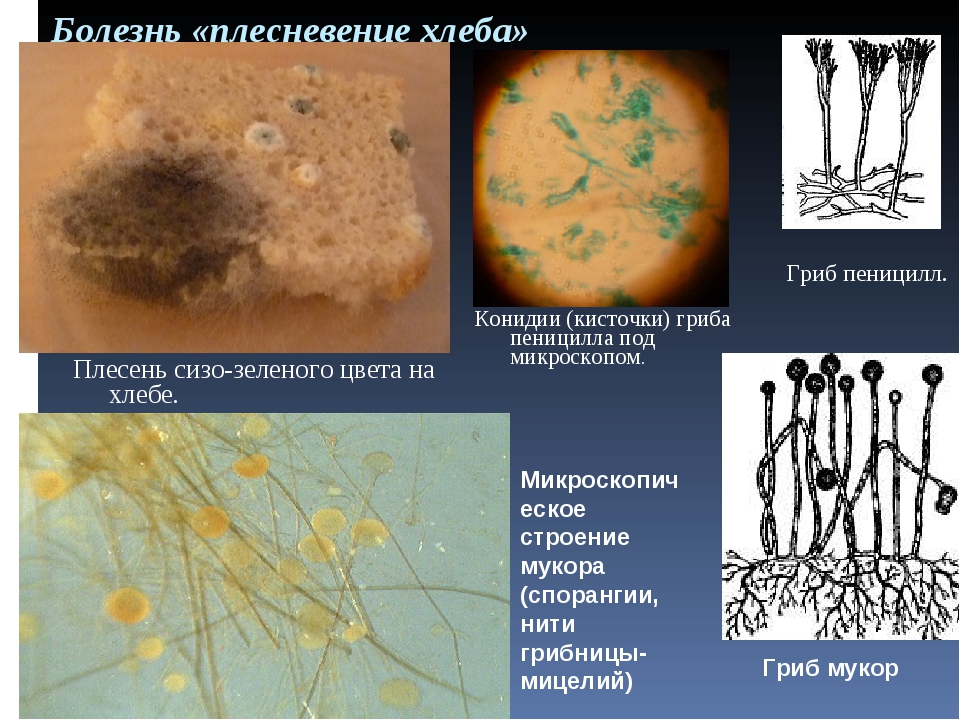 Здесь они образуют часть регрессивной фации известняка, где пластинчатые и листовидные филлоиды выступали в качестве структурной основы для построек. Фации были хорошо описаны с помощью Phil Heckel (и множества ссылок в нем).
Здесь они образуют часть регрессивной фации известняка, где пластинчатые и листовидные филлоиды выступали в качестве структурной основы для построек. Фации были хорошо описаны с помощью Phil Heckel (и множества ссылок в нем).
Докембрийские карбонатные глинистые породы (в основном доломитизированные) неизменно связаны с строматолитами всех форм и размеров, от простых ламинарных матов до сложных нарастающих рифоподобных структур, подобных примеру, показанному в верхней части сообщения.Обычно считается, что их созданию способствовали прокариотических цианобактерий (фанерозойские красные и зеленые водоросли являются эукариотами). Седиментологические данные показывают, что, как и их фанерозойские собратья, они тоже населяли мелководный морской шельф, платформу и межприливные среды (вот ссылка на Строматолитовый Атлас ).
Однако карбонатный ил отложился на внешних краях платформ и прилегающих склонах. Пример с островов Белчер (формация Костелло) состоит из тонкослоистых долютитов и кальцилутутов с необычным кальци-турбидитом, но без признаков слоистых пластин крипталгала.Считается также, что эти отложения накопились из ила, взвешенного в толще воды (т.е. гемипелагического), который образовался на «фабрике» карбонатного ила на мелководной платформе.
Пример с островов Белчер (формация Костелло) состоит из тонкослоистых долютитов и кальцилутутов с необычным кальци-турбидитом, но без признаков слоистых пластин крипталгала.Считается также, что эти отложения накопились из ила, взвешенного в толще воды (т.е. гемипелагического), который образовался на «фабрике» карбонатного ила на мелководной платформе.
Глубоководные илы состоят в основном из кокколитов и планктонных фораминифер, которые обитают в самых верхних водах океана (в фотической зоне) и в мертвом состоянии постепенно опускаются на морское дно. Илы накапливаются в океанических регионах, лишенных терригенных отложений.
ссылок на другие посты из этой серии
Минералогия карбонатов
Минералогия карбонатов; скелетные зерна
Минералогия карбонатов; нескелетные зерна
Минералогия карбонатов; классификация
Минералогия карбонатов; карбонатные фабрики
Минералогия карбонатов; основы геохимии
Минералогия карбонатов: Строматолитовые рифы
Как это:
Нравится Загрузка. ..
..
Свидетельств уникальных и универсальных микробов в отдаленно связанных симпатрических приливных морских губках (Porifera: Demospongiae)
Abstract
Разнообразие и специфичность микробных сообществ в морской среде является ключевым аспектом экологии и эволюции как эукариотических хозяев, так и связанных с ними прокариот. Морские губки имеют филогенетически разнообразные и сложные микробные линии. Здесь мы исследовали бактериальное сообщество губок и паттерны распределения микробов у трех симпатрических литоральных морских демоспонгов, Hymeniacidon perlevis , Ophlitaspongia papilla и Polymastia penicillus , с Атлантического побережья Португалии с использованием классических методов изоляции и клона гена 16S рРНК. библиотеки.Оценка микробного состава с использованием почти полноразмерных последовательностей гена 16S рРНК (примерно 1400 п.н.) из изолятов (n = 31) и частичных последовательностей (примерно 280 п.н.) из библиотек клонов (n = 349) выявила различные бактериальные сообщества и другие микробы, связанные с губками. Большинство бактериальных изолятов были членами отряда Vibrionales и других симбиотических бактерий, таких как Pseudovibrio ascidiaceiocola , Roseobacter sp., Hahellaceae sp. и Cobetia sp.Расширенный анализ с использованием экологических показателей, включающих 142 OTU, подтвердил четкую дифференциацию профилей бактериальных сообществ среди губок-хозяев и окружающей их морской воды. Филогенетический анализ позволил определить клады, представляющие общие бактериальные сообщества, в частности, между H. perlevis и географически отдаленным родственником H. heliophila , а также среди других губок. Кроме того, мы также наблюдали три отдельные и уникальные бактериальные группы: Betaproteobactria (∼81%), Spirochaetes, (∼7%) и Chloroflexi (∼3%), которые строго поддерживаются в организме хозяина с низким содержанием микробов. вид O.сосочек и P . пеницилл . Наше исследование выявило в значительной степени универсальный характер микробных ассоциаций среди этих одновременно встречающихся приливных морских губок.
Большинство бактериальных изолятов были членами отряда Vibrionales и других симбиотических бактерий, таких как Pseudovibrio ascidiaceiocola , Roseobacter sp., Hahellaceae sp. и Cobetia sp.Расширенный анализ с использованием экологических показателей, включающих 142 OTU, подтвердил четкую дифференциацию профилей бактериальных сообществ среди губок-хозяев и окружающей их морской воды. Филогенетический анализ позволил определить клады, представляющие общие бактериальные сообщества, в частности, между H. perlevis и географически отдаленным родственником H. heliophila , а также среди других губок. Кроме того, мы также наблюдали три отдельные и уникальные бактериальные группы: Betaproteobactria (∼81%), Spirochaetes, (∼7%) и Chloroflexi (∼3%), которые строго поддерживаются в организме хозяина с низким содержанием микробов. вид O.сосочек и P . пеницилл . Наше исследование выявило в значительной степени универсальный характер микробных ассоциаций среди этих одновременно встречающихся приливных морских губок.
Образец цитирования: Алекс А., Сильва В., Васконселос В., Антунес А. (2013) Доказательства наличия уникальных и универсальных микробов у отдаленно связанных симпатрических приливных морских губок (Porifera: Demospongiae). PLoS ONE 8 (11): e80653. https://doi.org/10.1371/journal.pone.0080653
Редактор: Костас Бурцис, Международное агентство по атомной энергии, Австрия
Поступило: 1 апреля 2013 г .; Дата принятия: 7 октября 2013 г .; Опубликован: 12 ноября 2013 г.
Авторские права: © 2013 Alex et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Ануп Алекс был поддержан грантом на докторскую степень SFRH / BD / 62356/2009 от Fundação para a Ciência e a Tecnologia (FCT). Эта работа была частично поддержана Европейским фондом регионального развития (ERDF) через программу COMPETE — Операционная конкурентоспособность и национальными фондами через FCT в рамках проектов PEst-C / MAR / LA0015 / 2013, PTDC / AAC-AMB / 104983/2008 (FCOMP -01-0124-FEDER-008610), PTDC / AAC-CLI / 116122/2009 (FCOMP-01-0124-FEDER-014029) и PTDC / MAR / 099642/2008.Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Эта работа была частично поддержана Европейским фондом регионального развития (ERDF) через программу COMPETE — Операционная конкурентоспособность и национальными фондами через FCT в рамках проектов PEst-C / MAR / LA0015 / 2013, PTDC / AAC-AMB / 104983/2008 (FCOMP -01-0124-FEDER-008610), PTDC / AAC-CLI / 116122/2009 (FCOMP-01-0124-FEDER-014029) и PTDC / MAR / 099642/2008.Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Губки (Phylum Porifera) — древние группы беспозвоночных многоклеточных, окаменелости которых датируются 600 миллионами лет и содержат множество разнообразных симбиотических микроорганизмов, таких как археи [1], цианобактерии [2], гетеротрофные бактерии [ 3], водоросли, грибы [4] и динофлагелляты [5].Считается, что передача симбиотических бактерий в губках происходит через гаметы [6] — [8].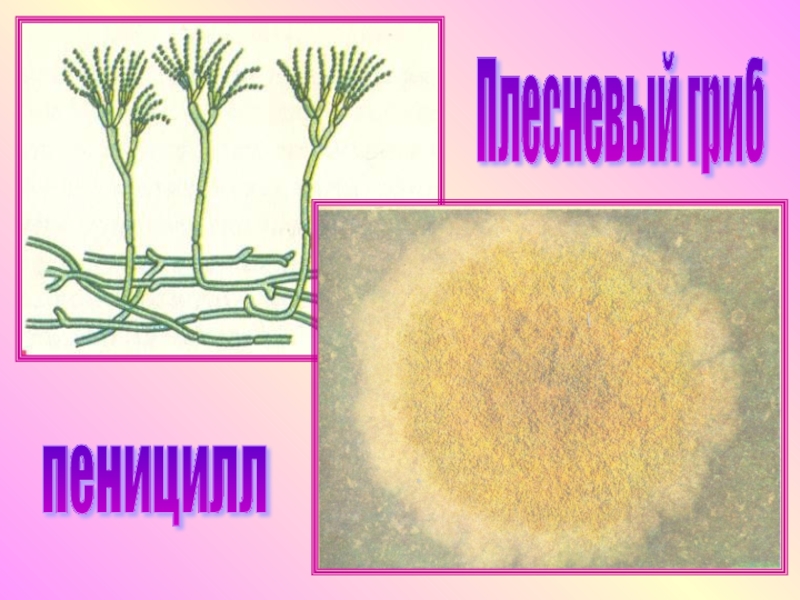 Однако было установлено, что некоторые микробы из окружающей морской воды ассоциируются с губками [9], что предполагает горизонтальное приобретение симбионтов. Таким образом, была предложена новая модель приобретения симбионтов, которая включает как опосредованный личинками перенос, так и поглощение окружающей средой при формировании сложной микробиоты губок [10]. Разнообразная микробиота губок может способствовать метаболизму хозяина посредством фотосинтеза [2], основных событий азотного цикла [11] — [14], восстановления сульфатов [15] и фиксации углерода [16], [17], а в свою очередь, хозяин обеспечивает обогатила экологическую нишу для своих микробных партнеров.
Однако было установлено, что некоторые микробы из окружающей морской воды ассоциируются с губками [9], что предполагает горизонтальное приобретение симбионтов. Таким образом, была предложена новая модель приобретения симбионтов, которая включает как опосредованный личинками перенос, так и поглощение окружающей средой при формировании сложной микробиоты губок [10]. Разнообразная микробиота губок может способствовать метаболизму хозяина посредством фотосинтеза [2], основных событий азотного цикла [11] — [14], восстановления сульфатов [15] и фиксации углерода [16], [17], а в свою очередь, хозяин обеспечивает обогатила экологическую нишу для своих микробных партнеров.
Методы выделения [18], [19] и несколько молекулярных методологий, таких как денатурирующий гель-градиентный электрофорез (DGGE) [20], [21], полиморфизм длины концевого рестрикционного фрагмента (T-RFLP) [22], [23] и библиотеки клонов [24] широко использовались для профилирования микробов, происходящих из губок. На сегодняшний день насчитывается 32 основных бактериальных типа [25] и несколько возможных новых, связанных с губками бактериальных сообществ, таких как « Candidatus Synechococcus spongiarum» [26], кандидатный тип « Poribacteria » [27] и NW001-подобные Alphaproteobacteria [8], были идентифицированы.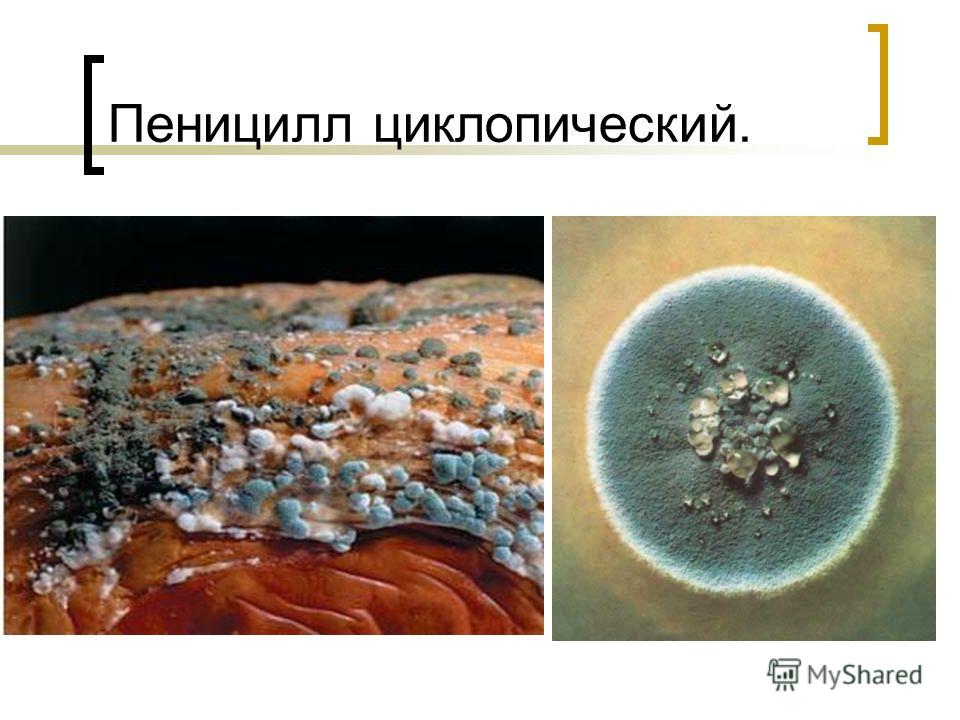 Кроме того, с развитием методов секвенирования (т. Е. Секвенирования следующего поколения) [9] исследователи преуспели в изучении разнообразного микробного консорциума среди широкого круга губок-хозяев [28]. Поиск бактерий, ассоциированных с губками, был усилен с учетом фармацевтического потенциала новых биоактивных соединений [29]. Однако мало что известно о движущей силе эволюции специфичности микробных симбионтов.
Кроме того, с развитием методов секвенирования (т. Е. Секвенирования следующего поколения) [9] исследователи преуспели в изучении разнообразного микробного консорциума среди широкого круга губок-хозяев [28]. Поиск бактерий, ассоциированных с губками, был усилен с учетом фармацевтического потенциала новых биоактивных соединений [29]. Однако мало что известно о движущей силе эволюции специфичности микробных симбионтов.
Экологической оценке специфичности губчатых микробов и разнообразия ассоциированных с губками бактериальных сообществ в последнее время уделяется больше внимания, чтобы лучше понять глобальное морское биоразнообразие [30].Предыдущие исследования показали, что симбиоз губок и бактерий варьируется от ассоциации с несколькими или одним видами хозяев (специализация) [23], [31] до многих хозяев (обобщение) [32] во времени и пространстве. Разница в численности микробов разделила губки на группы с низким содержанием микробов (LMA) и с высоким содержанием микробов (HMA) [33].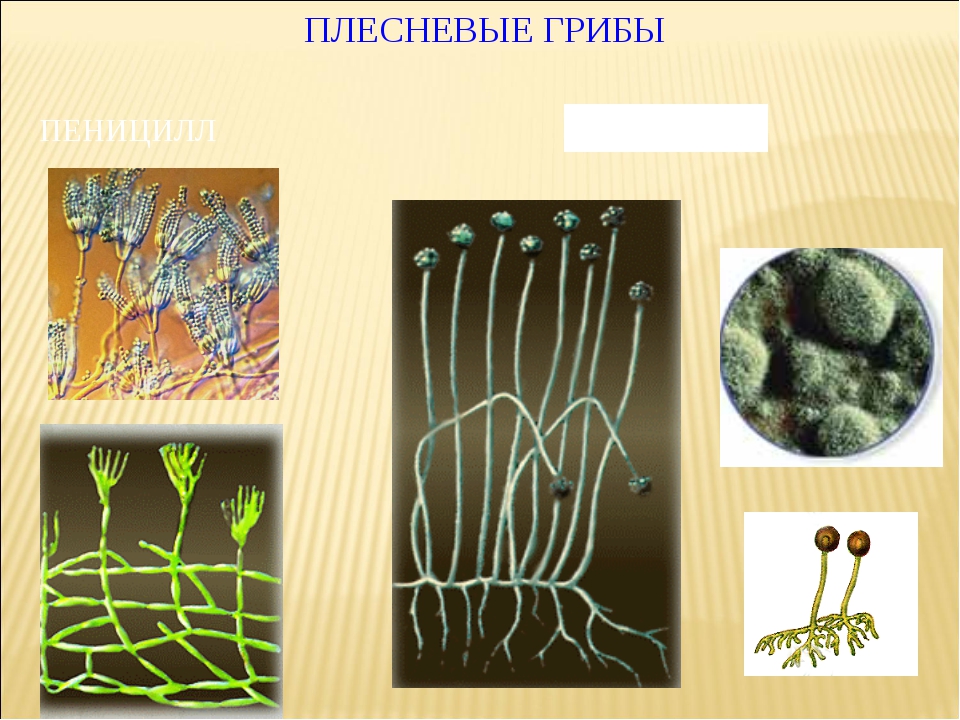 Губки LMA являются хозяевами менее разнообразных и более специализированных микробных сообществ [23], [34], тогда как губки HMA содержат разнообразные и различные бактериальные сообщества. Дополнительные данные о бактериальном разнообразии необходимы для более точного описания ассоциаций губок и микробов, и в этом исследовании мы изучили бактериальное разнообразие у трех одновременно встречающихся приливных губок из Атлантического океана в Португалии: Hymeniacidon perlevis Montagu, 1818 (Halichondrida: Halichondriidae), Ophlitaspongia papilla Bowerbank, 1866 (Poeciosclerida: Microcionidae) и Polymastia penicillus Montagu, 1818 (Hadromerida: Polymastiidae).
Губки LMA являются хозяевами менее разнообразных и более специализированных микробных сообществ [23], [34], тогда как губки HMA содержат разнообразные и различные бактериальные сообщества. Дополнительные данные о бактериальном разнообразии необходимы для более точного описания ассоциаций губок и микробов, и в этом исследовании мы изучили бактериальное разнообразие у трех одновременно встречающихся приливных губок из Атлантического океана в Португалии: Hymeniacidon perlevis Montagu, 1818 (Halichondrida: Halichondriidae), Ophlitaspongia papilla Bowerbank, 1866 (Poeciosclerida: Microcionidae) и Polymastia penicillus Montagu, 1818 (Hadromerida: Polymastiidae).
Раздача H . perlevis (бисквитная крошка) простирается от Атлантики до побережья Средиземного моря и в Желтом море, обитая на твердых поверхностях, погруженных в осадочные породы, с выступающими наружу оскулами [35]. О высоком микробном разнообразии Actinobacteria сообщалось в H.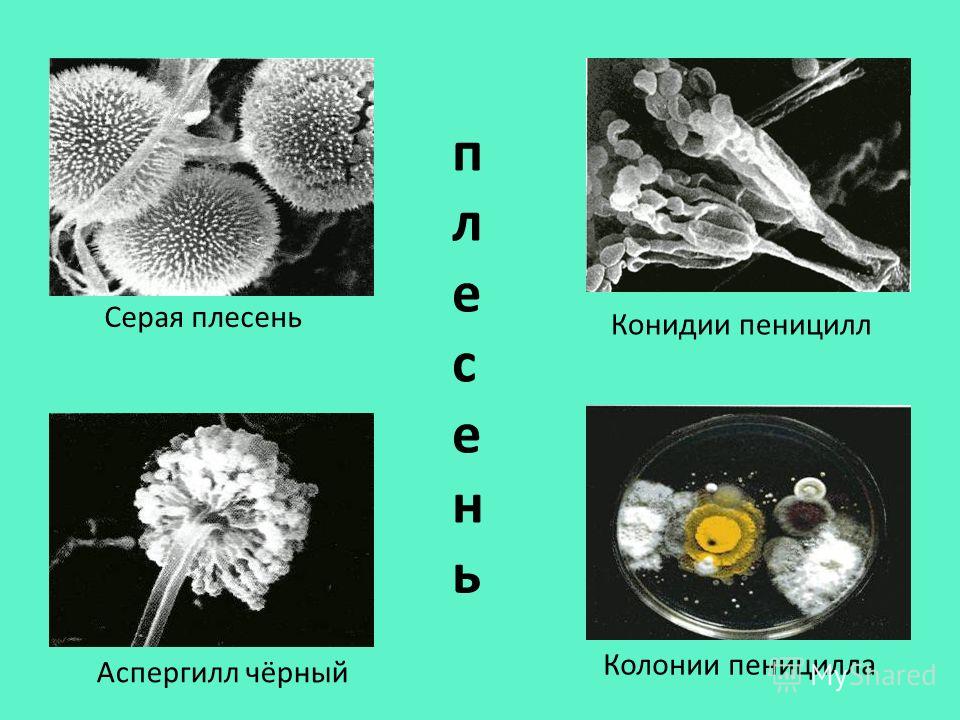 perlevis , распространенном в Китайском Желтом море с помощью культурально-зависимых [36] и независимых от культуры методов [37]. O. papilla — сублиторальная губка глубокого оранжево-красного цвета, о которой ранее сообщалось на Британских островах, во Франции и Испании [38], но этот вид также можно найти в Португалии.Он был изучен из-за его цитотоксической активности [39], но не было найдено доказательств существования бактериальных сообществ. P. penicillus обычно населяет гребни, основная часть которых погребена в отложениях, а сосочки выступают наружу. Его распространение простирается от Британских островов и атлантического побережья Европы и Северной Америки, и недавно было показано, что он продуцирует фармакологически активные вторичные метаболиты [40].
perlevis , распространенном в Китайском Желтом море с помощью культурально-зависимых [36] и независимых от культуры методов [37]. O. papilla — сублиторальная губка глубокого оранжево-красного цвета, о которой ранее сообщалось на Британских островах, во Франции и Испании [38], но этот вид также можно найти в Португалии.Он был изучен из-за его цитотоксической активности [39], но не было найдено доказательств существования бактериальных сообществ. P. penicillus обычно населяет гребни, основная часть которых погребена в отложениях, а сосочки выступают наружу. Его распространение простирается от Британских островов и атлантического побережья Европы и Северной Америки, и недавно было показано, что он продуцирует фармакологически активные вторичные метаболиты [40].
Изучаемые здесь морские губки представляют три отдаленно родственных отряда класса Demospongiae, симпатрически живущих в чистой приливной экологической зоне с частым контактом с воздухом во время отлива в отличие от других постоянно погружающихся в воду видов.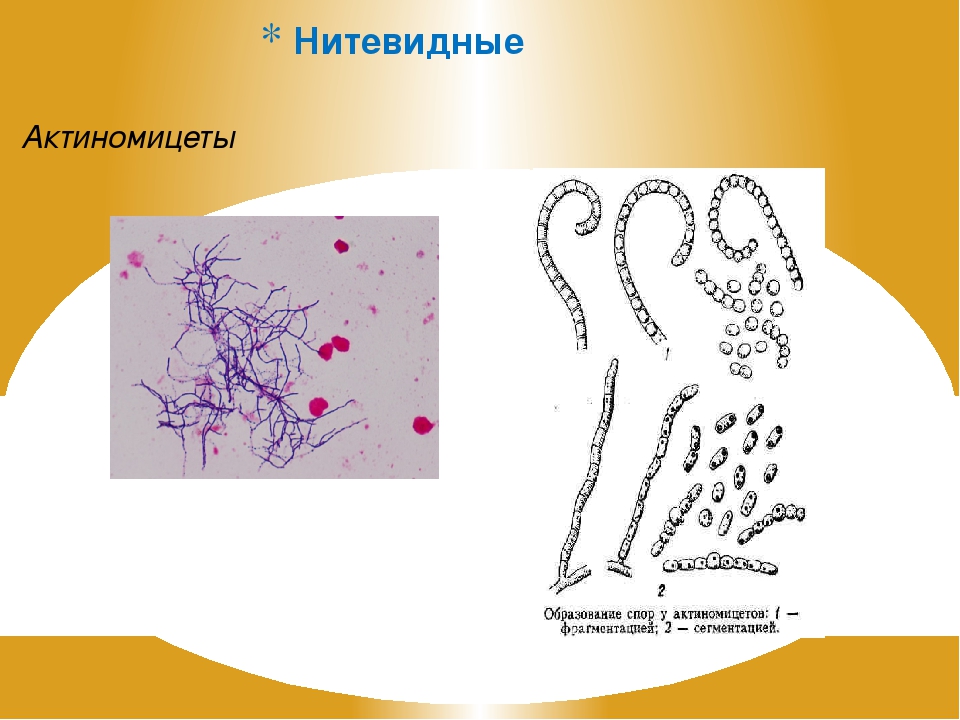 Несмотря на существование некоторых микробных исследований, связанных с губками, в различных географических регионах (Средиземноморье [10], [32], [41], Австралия [9], [30], Карибский бассейн [42], [43] и Юго-Западная Атлантика [1]). ], [24]), насколько нам известно, подобная характеристика не проводилась в Атлантическом океане (европейское атлантическое побережье). Здесь мы использовали бактериальную изоляцию и независимые от культуры методы (библиотека клонов гена 16S рРНК), чтобы охарактеризовать микробные профили губок, различную структуру микробного сообщества и распределение симбиотических микробов в трех симпатрических приливных морских губках из одного географического местоположения (Praia da Memória , Португалия).
Несмотря на существование некоторых микробных исследований, связанных с губками, в различных географических регионах (Средиземноморье [10], [32], [41], Австралия [9], [30], Карибский бассейн [42], [43] и Юго-Западная Атлантика [1]). ], [24]), насколько нам известно, подобная характеристика не проводилась в Атлантическом океане (европейское атлантическое побережье). Здесь мы использовали бактериальную изоляцию и независимые от культуры методы (библиотека клонов гена 16S рРНК), чтобы охарактеризовать микробные профили губок, различную структуру микробного сообщества и распределение симбиотических микробов в трех симпатрических приливных морских губках из одного географического местоположения (Praia da Memória , Португалия).
Результаты
Филогенетические взаимоотношения бактериальных изолятов губок
Культурально-зависимые методы позволили изолировать гетеротрофных бактерий от морских губок H. perlevis (n = 9), O. papilla (n = 11) и P. penicillus (n = 11). BLAST-поиски с использованием почти полноразмерных последовательностей 16S рРНК (примерно 1400 п.н.) из изолятов выявили как грамположительные бактерии Firmicutes (10%), так и грамотрицательные группы Proteobacteria , преимущественно Alphaproteobacteria (16%) и Gammaproteobacteria (74%) (рисунок 1, таблица S1).Филогенетический анализ дополнительно подтвердил присутствие группы бактериальных изолятов (45%), частично совпадающих с ранее описанными губками и другими морскими беспозвоночными бактериями. P. penicillus и O . Бактериальные изоляты papilla имели тесную аффилированность с асцидийным симбионтом Pseudovibrio ascidiaceicola (n = 3) и ассоциированным с губкой Roseobacter sp. (n = 1). Большинство культивируемых бактериальных сообществ сгруппировано в пределах порядка Vibrionales .Изоляты, связанные с Oceanospirillales (ранее сообщалось о морских губках), также были получены от H.
penicillus (n = 11). BLAST-поиски с использованием почти полноразмерных последовательностей 16S рРНК (примерно 1400 п.н.) из изолятов выявили как грамположительные бактерии Firmicutes (10%), так и грамотрицательные группы Proteobacteria , преимущественно Alphaproteobacteria (16%) и Gammaproteobacteria (74%) (рисунок 1, таблица S1).Филогенетический анализ дополнительно подтвердил присутствие группы бактериальных изолятов (45%), частично совпадающих с ранее описанными губками и другими морскими беспозвоночными бактериями. P. penicillus и O . Бактериальные изоляты papilla имели тесную аффилированность с асцидийным симбионтом Pseudovibrio ascidiaceicola (n = 3) и ассоциированным с губкой Roseobacter sp. (n = 1). Большинство культивируемых бактериальных сообществ сгруппировано в пределах порядка Vibrionales .Изоляты, связанные с Oceanospirillales (ранее сообщалось о морских губках), также были получены от H. perlevis и P. penicillus .
perlevis и P. penicillus .
Рис. 1. Филогения и разнообразие бактериальных изолятов морских губок H. perlevis (HM), P. penicillus (PL) и O. papilla (OP).
( A ) Филогенетическое дерево максимального правдоподобия с почти полной длиной последовательностей гена 16S рРНК (примерно 1400 п.н.) с использованием Prochlorococcus marinus в качестве внешней группы.Бактериальные изоляты, полученные из губок, полученные в результате этого исследования, выделены жирным шрифтом. Представлены ближайшие родственники, полученные с помощью поиска BLAST (таблица S1), с их регистрационными номерами GenBank. Пунктирная рамка ограничивает группы бактерий, связанных с губками (т. Е. Группа бактерий, извлеченных из этого исследования, с ранее зарегистрированными микробами из других губок). Представлены значения поддержки узла начальной загрузки> 50%. ( B ) Гистограмма с накоплением, показывающая относительную численность разнообразия 16S рРНК, полученного из источников губок.
https://doi.org/10.1371/journal.pone.0080653.g001
Библиотека клонов 16S рРНК и количество OTU
Окончательный набор данных, состоящий из 349 частичных последовательностей 16S рРНК из губок H . perlevis (n = 86), O . сосочек (n = 91) и P . penicillus (n = 77) и окружающая морская вода (n = 95) были отнесены к 142 оперативным таксономическим единицам (OTU) на расстоянии 0,01. Кластеризация бактериальных последовательностей из каждого источника при более низких порогах идентичности привела к уменьшению количества наблюдаемых OTU (рисунок S1).Кривые разрежения (Рисунок 2) и Chao1 (Таблица S2) предполагают более высокое бактериальное богатство окружающей морской воды (300), за которым следуют губки-хозяева P . пеницилл (181), H . perlevis (45) и O . сосочек (15). Оценка охвата Гудом (таблица S2) показала полноту выборки для O. papilla (0,81), за вычетом выборки для H. perlevis (0,60), P. penicillus (0.42) и морская вода (0,30). OTU в морской воде оставались ненасыщенными, что позволяет предположить, что еще предстоит обнаружить гораздо большее разнообразие видов бактерий.
papilla (0,81), за вычетом выборки для H. perlevis (0,60), P. penicillus (0.42) и морская вода (0,30). OTU в морской воде оставались ненасыщенными, что позволяет предположить, что еще предстоит обнаружить гораздо большее разнообразие видов бактерий.
Рисунок 2. Кривая разрежения для последовательностей гена 16S рРНК, полученных из морской воды, H . perlevis , O . сосочек и P . пеницилл .
OTU извлекаются на расстоянии 0,01 (сходство 99%). Каждая линия представляет собой соответствующий вид губок и окружающую используемую морскую воду.
https://doi.org/10.1371/journal.pone.0080653.g002
Состав некультивируемой микробиоты губки
Риботипическое разнообразие 16S рРНК, полученное из морских губок H . perlevis , O . сосочек и P . penicillus , выявлены представители бактериального сообщества 10 типов (табл. 1). Alphaproteobacteria и Bacteroidetes были выделены из всех трех губок-хозяев и источников морской воды.В H. perlevis преобладали Gammaproteobacteri a (67,4%) и Alphaproteobacteria (24,5%). В O. papilla доминировали исключительно Betaproteobacteria (81,3%) как основная и уникальная группа бактерий (Рисунок S2, Таблица 1). Представители филума Alphaproteobacteria преобладали у P. penicillus (80,5%), но редко у O. papilla (5,49%). Среди отобранных губок и морской воды Betaproteobacteria и Spirocheates были извлечены только из O.сосочек . Другой член филума Chloroflexi (2,59%) был обнаружен в небольшом количестве, связанный с губкой P. penicillus , но отсутствовал в других источниках.
1). Alphaproteobacteria и Bacteroidetes были выделены из всех трех губок-хозяев и источников морской воды.В H. perlevis преобладали Gammaproteobacteri a (67,4%) и Alphaproteobacteria (24,5%). В O. papilla доминировали исключительно Betaproteobacteria (81,3%) как основная и уникальная группа бактерий (Рисунок S2, Таблица 1). Представители филума Alphaproteobacteria преобладали у P. penicillus (80,5%), но редко у O. papilla (5,49%). Среди отобранных губок и морской воды Betaproteobacteria и Spirocheates были извлечены только из O.сосочек . Другой член филума Chloroflexi (2,59%) был обнаружен в небольшом количестве, связанный с губкой P. penicillus , но отсутствовал в других источниках.
Бактериальное разнообразие и структура сообщества
Количественные экологические индексы выявили существенные различия в бактериальных сообществах разных источников.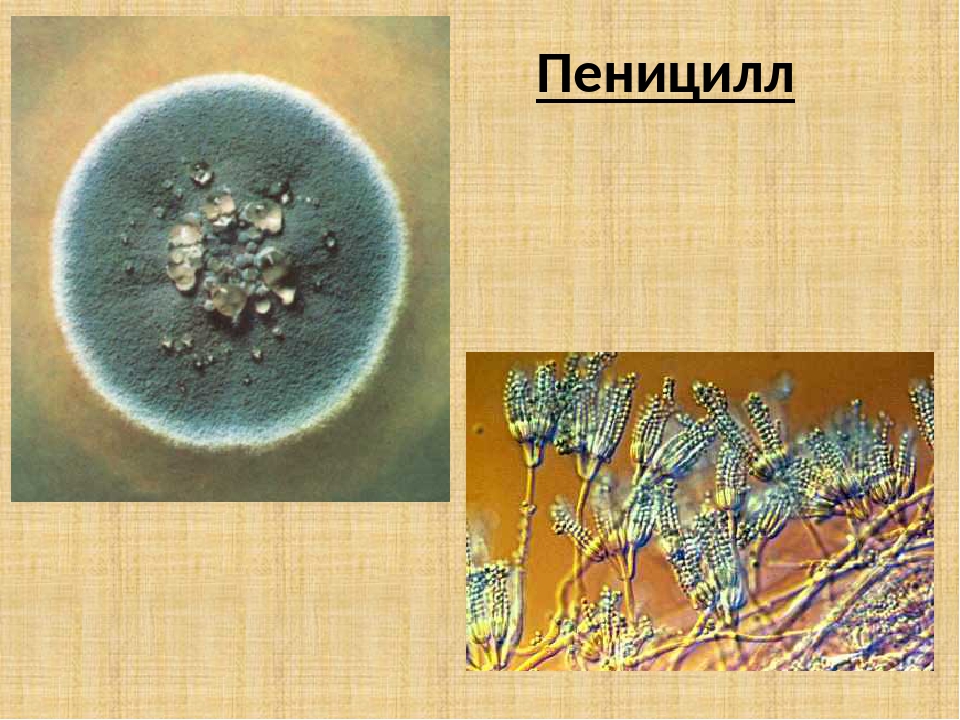 Сообщества морских бактерий продемонстрировали более высокое наблюдаемое ( S obs ) и ожидаемое ( S chao1 ) богатство, более низкое доминирование ( D simpson ) и более высокую равномерность ( E 1 / D ). индексы, указывающие на четкую бактериальную дифференциацию среди ассоциированных с губками бактериальных сообществ (рис. 3, таблица S2).Подобные значения ровности наблюдались среди бактериальных сообществ в P . penicillus и H . perlevis . Кроме того, эти две губки показали перекрывающийся доверительный интервал, указывающий на одинаковое микробное разнообразие. Однородность теста молекулярной дисперсии подтвердила значительно более высокое генетическое разнообразие среди ассоциированных с морской водой бактериальных сообществ ( HOMOVA , P <0,005) (Таблица S3) по сравнению с сообществами ассоциированных с губками бактерий.Парное сравнение показало значительную генетическую дифференциацию ( AMOVA , P <0,001) и отдельные филогенетические линии (P-тест, P <0,001) среди бактериальных сообществ из разных источников (Таблица S3).
Сообщества морских бактерий продемонстрировали более высокое наблюдаемое ( S obs ) и ожидаемое ( S chao1 ) богатство, более низкое доминирование ( D simpson ) и более высокую равномерность ( E 1 / D ). индексы, указывающие на четкую бактериальную дифференциацию среди ассоциированных с губками бактериальных сообществ (рис. 3, таблица S2).Подобные значения ровности наблюдались среди бактериальных сообществ в P . penicillus и H . perlevis . Кроме того, эти две губки показали перекрывающийся доверительный интервал, указывающий на одинаковое микробное разнообразие. Однородность теста молекулярной дисперсии подтвердила значительно более высокое генетическое разнообразие среди ассоциированных с морской водой бактериальных сообществ ( HOMOVA , P <0,005) (Таблица S3) по сравнению с сообществами ассоциированных с губками бактерий.Парное сравнение показало значительную генетическую дифференциацию ( AMOVA , P <0,001) и отдельные филогенетические линии (P-тест, P <0,001) среди бактериальных сообществ из разных источников (Таблица S3). Анализ LIBSHUFF четко показал, что структура бактериального сообщества была различной (LIBSHUFF, P <0,0001) между губками-хозяевами (Таблица S3). Метод главных координат (PCoA) выявил отличия бактериальных сообществ от губок-хозяев и морской воды (рис. 4).Клоны из морской воды разделяли только одну OTU с губками-хозяевами (рис. 5). Напротив, у H. perlevis и P. penicillus была одна ОТЕ, а у других губок не было ни одной.
Анализ LIBSHUFF четко показал, что структура бактериального сообщества была различной (LIBSHUFF, P <0,0001) между губками-хозяевами (Таблица S3). Метод главных координат (PCoA) выявил отличия бактериальных сообществ от губок-хозяев и морской воды (рис. 4).Клоны из морской воды разделяли только одну OTU с губками-хозяевами (рис. 5). Напротив, у H. perlevis и P. penicillus была одна ОТЕ, а у других губок не было ни одной.
Рисунок 3. Показатели экологического разнообразия бактериальных сообществ H. perlevis , O. papilla , P . penicillus и морская вода.
(A) Доминирование бактерий (B) Бактериальное богатство и (C) бактериальная однородность.
https: // doi.org / 10.1371 / journal.pone.0080653.g003
Рис. 4. График анализа главных координат (PCoA), основанный на взвешенных одноразрывных расстояниях.
Последовательности 16s рРНК группируются в соответствии с источником образца с использованием файла сопоставления категорий.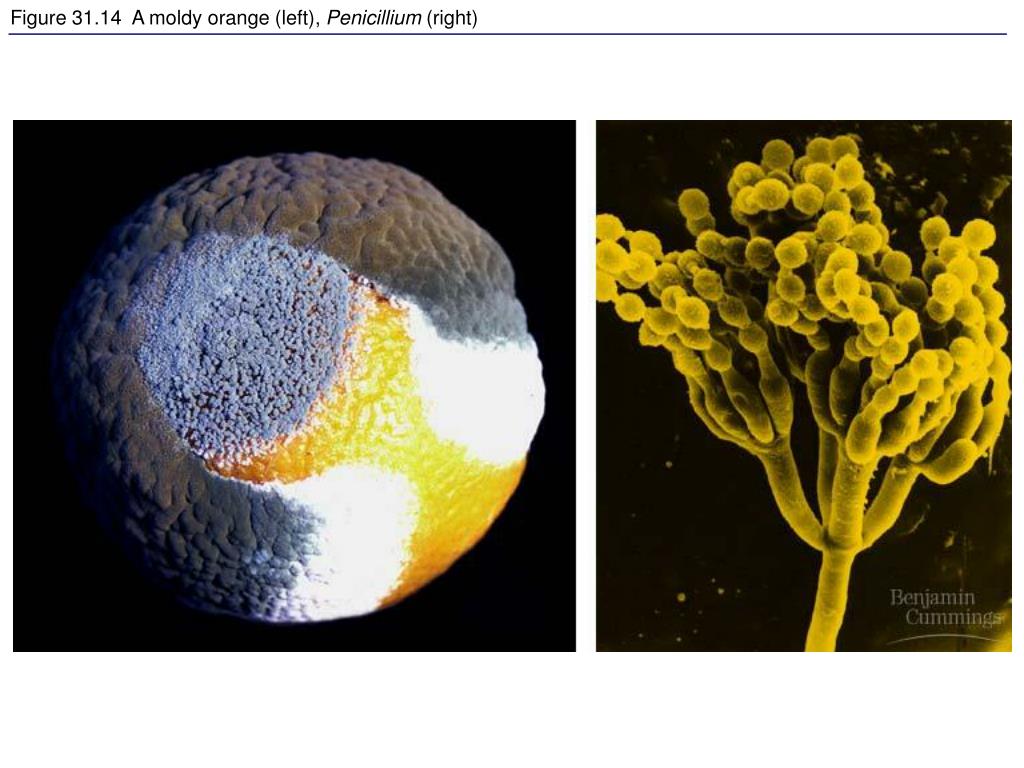 Процентное изменение объясняется первыми двумя основными компонентами (P1 и P2).
Процентное изменение объясняется первыми двумя основными компонентами (P1 и P2).
https://doi.org/10.1371/journal.pone.0080653.g004
Рис. 5. Диаграмма Венна, представляющая распределение общих OTU между хостами губки H . perlevis (HM), O . сосочек (OP), P . penicillus (PL) и морская вода (SW).
Цифры на схеме представляют уникальные и совместно используемые OTU.
https://doi.org/10.1371/journal.pone.0080653.g005
Филогенетический анализ микробиоты некультивируемых губок
Филогенетический анализ OTU (n = 142) из морской воды и губок подтвердил существование отдельных бактериальных групп (рис. 6).Основные группы II, VII и IX включали последовательности, представляющие Bacteroidetes (16,1%), Alphaproteobacteria (38,7%) и Gammaproteobacteria (20,4%), но Gammaproteobacteria отсутствовали в губке O. papilla. Клоны из P. penicillus (22%) в группе VII были аффилированы с симбионтами из губки Halichondria panicea из Северного моря (рис. 7) и в некоторых случаях с симбионтами из губки Haliclona sp.и хрупкая звезда ( Ophiactis balli ). Примечательно, что как клоны H. perlevis в группе VII (36%), так и клоны в группе IX (37%) были связаны с симбионтами, о которых сообщалось, из географически разделенных родственных губок H. heliophila из Мексиканского залива.
papilla. Клоны из P. penicillus (22%) в группе VII были аффилированы с симбионтами из губки Halichondria panicea из Северного моря (рис. 7) и в некоторых случаях с симбионтами из губки Haliclona sp.и хрупкая звезда ( Ophiactis balli ). Примечательно, что как клоны H. perlevis в группе VII (36%), так и клоны в группе IX (37%) были связаны с симбионтами, о которых сообщалось, из географически разделенных родственных губок H. heliophila из Мексиканского залива.
Рисунок 6. Филогения и разнообразие библиотек клонов гена 16S рРНК из H. perlevis , O. papilla , P . penicillus и морская вода.
(A) Кольцевое филогенетическое дерево максимального правдоподобия, построенное с использованием частичных последовательностей генов 16S рРНК бактериальных OTU.(B) Разнообразие библиотеки клонов, полученное из каждого источника.
https://doi.org/10.1371/journal.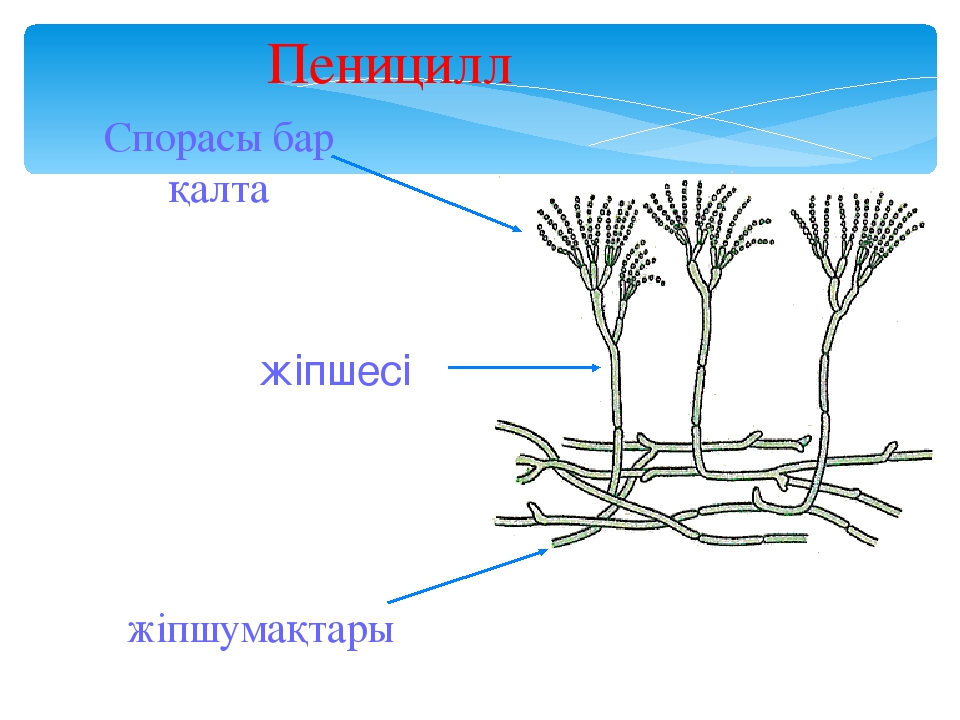 pone.0080653.g006
pone.0080653.g006
Рис. 7. Бактерии, ассоциированные с губками, среди губок-хозяев H. perlevis , P. penicillus и O . papilla и его сходство с глобально распределенными родственными и неродственными губками-хозяевами.
(A) Глобальная карта, на которой показано расположение губок-хозяев, укрывающих скопление бактерий, аналогичное микробам, полученным в ходе настоящего исследования.Цветным треугольником на карте показаны виды губок из других исследований. (B – C) Бактерии, связанные с губками, от разных хозяев, определенные с помощью методов изоляции и невозделывания, представленные в виде круговой диаграммы [73], показывающей их численность и принадлежность к микробам, обнаруженным в связи с глобально распределенными губками-хозяевами.
https://doi.org/10.1371/journal.pone.0080653.g007
Bacteroidetes в группе II, представленной клонами морской воды (65%), были связаны с бактериями прибрежных отложений и биопленок. Однако P. penicillus (клон 58) имел сходство с бактериальным штаммом (JX050191, группа II) из морской губки Leucosolenia sp. (класс Calcarea) (Рисунок S3). Другие бактериальные клоны, полученные из губок, аффилированные с основными типами, представлены в группе I ( Chloroflexi ), группе III ( спирохет ), группе IV ( Deltaproteobacteria ), группе VIII ( Betaproteobacteria ) и группе XIV ( Planctomycetia ). Наш филогенетический анализ неоднократно обнаруживал частичное совпадение микробов, обнаруженных в этом исследовании, с бактериями, связанными с губками, о которых ранее сообщалось в другом месте.Примечательно, что ни одна из последовательностей библиотеки клонов 16S рРНК, извлеченных из исследуемых губок, не показала сходства с культивируемыми бактериальными изолятами.
Однако P. penicillus (клон 58) имел сходство с бактериальным штаммом (JX050191, группа II) из морской губки Leucosolenia sp. (класс Calcarea) (Рисунок S3). Другие бактериальные клоны, полученные из губок, аффилированные с основными типами, представлены в группе I ( Chloroflexi ), группе III ( спирохет ), группе IV ( Deltaproteobacteria ), группе VIII ( Betaproteobacteria ) и группе XIV ( Planctomycetia ). Наш филогенетический анализ неоднократно обнаруживал частичное совпадение микробов, обнаруженных в этом исследовании, с бактериями, связанными с губками, о которых ранее сообщалось в другом месте.Примечательно, что ни одна из последовательностей библиотеки клонов 16S рРНК, извлеченных из исследуемых губок, не показала сходства с культивируемыми бактериальными изолятами.
Обсуждение
Бактериальные изоляты из губок
В этом исследовании мы определили разнообразие культивируемых бактерий, связанных с губками, с использованием классических методов культивирования / выделения.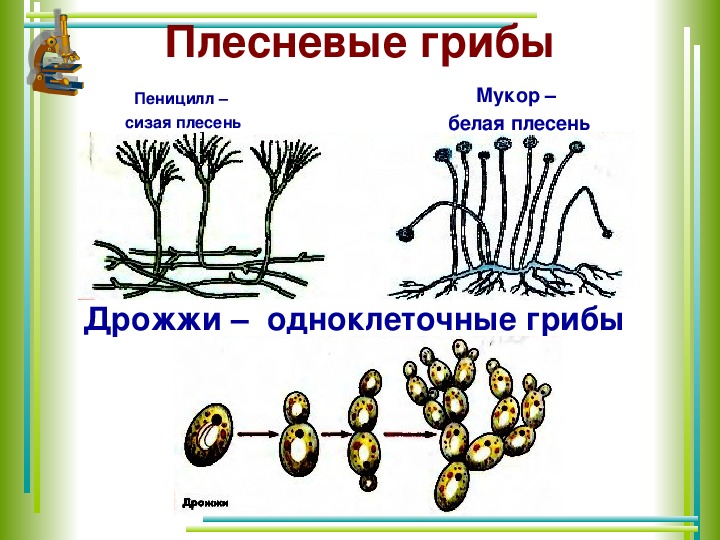 Культивированные изоляты гетеротрофных бактерий (> 35%) из губок-хозяев H. perlevis , O . сосочек и P . penicillus показал высокое сходство с ранее описанными бактериями, связанными с губками, из разных географических регионов (рис. 7). Изоляция П . ascidiaceicola из симпатрических губок O. papilla и P. penicillus (Таблица S1) с высоким сходством последовательностей (> 99%) с изолятом из морских сквиртов Polycitor proliferus и Botryllidae sp. [44], предполагает симбиотический образ жизни с широким кругом хозяев.Широкое разнообразие Pseudovibrio sp. были выделены из губок в Ирландии [45], Средиземном море [46] и Бразилии [47] с многообещающей антимикробной активностью. Отсутствие морских брызг и извлечение P . ascidiaceicola из двух исследованных здесь губок предполагает симбиотическую ассоциацию с приливными морскими губками. Специфика P .
Культивированные изоляты гетеротрофных бактерий (> 35%) из губок-хозяев H. perlevis , O . сосочек и P . penicillus показал высокое сходство с ранее описанными бактериями, связанными с губками, из разных географических регионов (рис. 7). Изоляция П . ascidiaceicola из симпатрических губок O. papilla и P. penicillus (Таблица S1) с высоким сходством последовательностей (> 99%) с изолятом из морских сквиртов Polycitor proliferus и Botryllidae sp. [44], предполагает симбиотический образ жизни с широким кругом хозяев.Широкое разнообразие Pseudovibrio sp. были выделены из губок в Ирландии [45], Средиземном море [46] и Бразилии [47] с многообещающей антимикробной активностью. Отсутствие морских брызг и извлечение P . ascidiaceicola из двух исследованных здесь губок предполагает симбиотическую ассоциацию с приливными морскими губками. Специфика P . ascidiaceicola в приливных губках, однако, следует лучше оценивать путем одновременного отбора проб асцидий и губок, сосуществующих в одном месте и характеризующих бактериальные изоляты.Секвенирование генома двух штаммов рода Pseudovibrio выявило кластеры генов, которые, вероятно, участвуют во взаимодействиях хозяин-симбионт [48].
ascidiaceicola в приливных губках, однако, следует лучше оценивать путем одновременного отбора проб асцидий и губок, сосуществующих в одном месте и характеризующих бактериальные изоляты.Секвенирование генома двух штаммов рода Pseudovibrio выявило кластеры генов, которые, вероятно, участвуют во взаимодействиях хозяин-симбионт [48].
Приблизительно 58% культивируемых бактериальных изолятов из трех исследованных здесь губок-хозяев сгруппированы в Vibrionales (рис. 1), с высоким сходством последовательностей с другими изолятами Vibrio , полученными из губок (SD). Высокое сродство вибрионов приливных (мелководных) морских губок к придонным SD-вибрионам из Leiodermatium sp.и Scleritoderma cyanea , собранная на глубине 630 м и 364 м в разных местах по всему миру [49], демонстрирует повсеместное распространение вибрионов среди губок-хозяев. Более высокая заболеваемость Vibrio sp. также сообщалось о других морских губках [50], а также о наличии V . alginolyticu s в качестве пробионтов [51]. Связанные с губкой Vibrio sp. может принести пользу хозяину за счет азотфиксации [52], но точная роль все еще неясна. Псевдоальтеромонас sp. был выделен из H. perlevis , который, как было показано ранее, разлагает полициклические ароматические углеводороды (ПАУ) [53]. Точная роль Pseudoalteromonas sp. неясно, но он может защитить губку-хозяина от токсичных сред. Мы также выделили другие бактерии, ассоциированные с губками, Hahellaceae sp. и Cobetia marina ( Oceanospirillales ), которые были связаны с атлантико-средиземноморской губкой Sarcotragus spinosulus и морскими губками из Южно-Китайского моря (рис. 7).Здесь мы сообщаем о бактериальных изолятах из H. perlevis , P. penicillus и O. papilla и их сходстве с ассоциированными с губками бактериями из неродственных хозяев и удаленных мест.
alginolyticu s в качестве пробионтов [51]. Связанные с губкой Vibrio sp. может принести пользу хозяину за счет азотфиксации [52], но точная роль все еще неясна. Псевдоальтеромонас sp. был выделен из H. perlevis , который, как было показано ранее, разлагает полициклические ароматические углеводороды (ПАУ) [53]. Точная роль Pseudoalteromonas sp. неясно, но он может защитить губку-хозяина от токсичных сред. Мы также выделили другие бактерии, ассоциированные с губками, Hahellaceae sp. и Cobetia marina ( Oceanospirillales ), которые были связаны с атлантико-средиземноморской губкой Sarcotragus spinosulus и морскими губками из Южно-Китайского моря (рис. 7).Здесь мы сообщаем о бактериальных изолятах из H. perlevis , P. penicillus и O. papilla и их сходстве с ассоциированными с губками бактериями из неродственных хозяев и удаленных мест.
Разнообразие и специфичность библиотеки клонов 16S рРНК
Профиль бактериального сообщества, определенный библиотеками клонов 16S рРНК из трех симпатрических литоральных морских губок, H.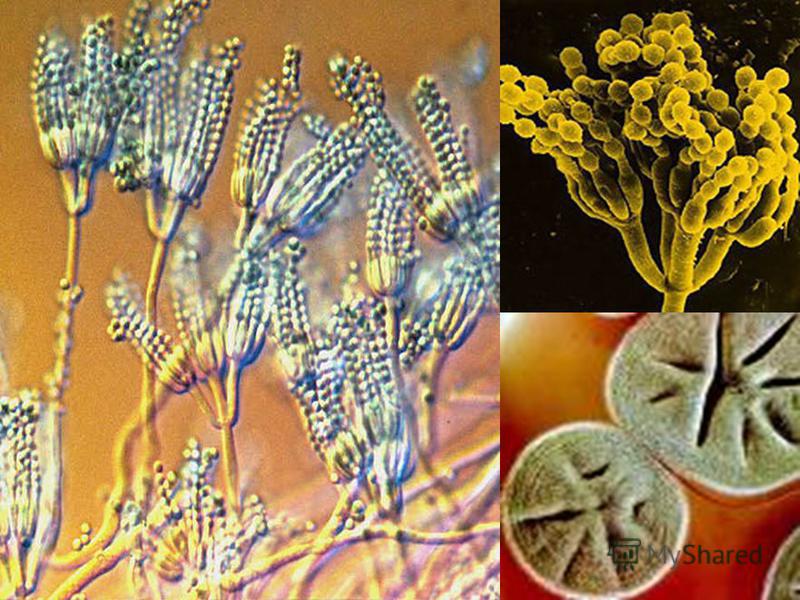 perlevis , O. papilla и P. penicillus , заметно отличался от окружающего сообщества бактерий в морской воде (рис. 4).Экологические показатели, такие как большее преобладание, меньшая насыщенность и меньшая ровность губок (рис. 3), также подтверждают четкое различие между микробами из губок-хозяев и окружающей морской водой. Анализ разреженности и оценка охвата показали меньшую глубину отбора образцов видов бактерий из H. perlevis и P. penicillus по сравнению с O. papilla (Рисунок 2, Таблица S2). Учитывая сложную природу ассоциаций бактерий, связанных с губками, глубокое секвенирование позволит избежать недооценки бактериального разнообразия.Интенсивный отбор образцов, вероятно, позволит выявить больше видов бактерий от соответствующих изученных хозяев губок. Количественная оценка бактериального разнообразия, связанного с губками, выявленная с помощью нашего молекулярного подхода, предполагает, что оцениваемые здесь губки относятся к видам с низким микробным содержанием (LMA).
perlevis , O. papilla и P. penicillus , заметно отличался от окружающего сообщества бактерий в морской воде (рис. 4).Экологические показатели, такие как большее преобладание, меньшая насыщенность и меньшая ровность губок (рис. 3), также подтверждают четкое различие между микробами из губок-хозяев и окружающей морской водой. Анализ разреженности и оценка охвата показали меньшую глубину отбора образцов видов бактерий из H. perlevis и P. penicillus по сравнению с O. papilla (Рисунок 2, Таблица S2). Учитывая сложную природу ассоциаций бактерий, связанных с губками, глубокое секвенирование позволит избежать недооценки бактериального разнообразия.Интенсивный отбор образцов, вероятно, позволит выявить больше видов бактерий от соответствующих изученных хозяев губок. Количественная оценка бактериального разнообразия, связанного с губками, выявленная с помощью нашего молекулярного подхода, предполагает, что оцениваемые здесь губки относятся к видам с низким микробным содержанием (LMA). Однако комбинация электронной микроскопии для определения морфотипов бактерий и молекулярных методов может лучше определить численность микробов в губках-хозяевах [24].
Однако комбинация электронной микроскопии для определения морфотипов бактерий и молекулярных методов может лучше определить численность микробов в губках-хозяевах [24].
Кроме того, отсутствие или минимальное совместное использование OTU (рис. 5) среди губок, собранных в одном месте отбора проб (10 м друг от друга между каждым участком сбора), предполагает существование уникальных микробных сообществ.Около 50 % ассоциированной с губкой бактериальной 16S рРНК, полученной в результате нашего исследования, показали сходство с другими ассоциированными с губками бактериями, о которых сообщалось в других местах, подтверждая широко распространенный характер консорциума микробов губок (рис. 7). Существование определенных наблюдаемых бактериальных линий у симпатрических губок указывает на возможность получения микробов посредством вертикальной передачи симбионтов через личинок или из водной толщи (горизонтальное поглощение). Некоторые из бактерий, обнаруженных в губках, были тесно связаны с бактериями осадка, которые могли быть либо отфильтрованными частицами пищи, либо случайными резидентными бактериями. Обнаружение многих бактерий, связанных с губкой, в местах обитания, не относящихся к губке, предполагает выживание бактерий вне тела губки и поглощение из окружающей среды через фильтрующее питание [54]. Методы секвенирования нового поколения и дополнительные данные о выборке могут предоставить ценную информацию, чтобы лучше понять природу таких ассоциаций.
Обнаружение многих бактерий, связанных с губкой, в местах обитания, не относящихся к губке, предполагает выживание бактерий вне тела губки и поглощение из окружающей среды через фильтрующее питание [54]. Методы секвенирования нового поколения и дополнительные данные о выборке могут предоставить ценную информацию, чтобы лучше понять природу таких ассоциаций.
Среди трех симпатрических приливных морских губок большинство (76%) микробных сообществ извлечено из H . perlevis обнаружил сходство с последовательностями 16S рРНК, ассоциированными с сестринскими видами H . heliophila (рис. 7, рис. S3 — группа VII и группа IX), отобранные в Мексиканском заливе [23]. Что интересно, ни один из них не сравнится с H . Heliophila ассоциированных бактерий, отобранных из юго-западной части Атлантического океана в Бразилии [24]. Отсутствие сходства с бактериальными клонами из родственных видов юго-западной Атлантики может быть связано с (i) недостаточным отбором последовательностей 16S рРНК или (ii) влиянием различных факторов окружающей среды.
Кроме того, мы наблюдали четкую картину глобального распределения (гомогенный образец) микробного сообщества, полученного от трех симпатрических губок, исследованных в этом исследовании (рис. 7).Например, Planctomycetacia (группа XIV) из H. perlevis и P. penicillus показали высокое сходство с бактериальными последовательностями, ассоциированными с морскими губками Haliclona sp. и Suberites zeteki (Рисунок S3). Н . perlevis и P. penicillus -ассоциированные бактерии сформировали кластер последовательностей с бактериальными последовательностями, полученными из неродственной губки Axinella corrugata , что свидетельствует об общем микробном распределении среди губок.Бактерия, аффилированная с филумом Chloroflexi [6], общей линией ассоциированных с губками бактерий, была извлечена только из библиотеки клонов P . penicillus (рис. 6, таблица 1) и в небольшом количестве (2,59%). Интересно, что модель P . penicillus бактериальное сообщество Maribacter sp. W1510, ранее выделенный из морской губки Leucosolenia sp. (класс Calcarea ).Необходимы дальнейшие исследования, чтобы подтвердить сходство микробного сообщества губок разных классов.
Интересно, что модель P . penicillus бактериальное сообщество Maribacter sp. W1510, ранее выделенный из морской губки Leucosolenia sp. (класс Calcarea ).Необходимы дальнейшие исследования, чтобы подтвердить сходство микробного сообщества губок разных классов.
В соответствии с предыдущими выводами, мы наблюдали тенденцию уникальных и универсальных бактериальных ассоциаций в покрывающей корку губке O . сосочек . Анализ библиотеки клонов показал, что Betaproteobacteria (81,3%) были многочисленной и уникальной микробной линией и что менее многочисленная Spirochaetes (7,69%) была связана с O . сосочек (рис. 6), образующий два отдельных кластера (рис. S3; группа VIII и группа III) с другими ассоциированными с губками бактериями, что позволяет предположить, что это универсальный вид. Необходимы дальнейшие исследования, в том числе более обширный отбор проб, чтобы подтвердить, наблюдается ли уникальность бактериальных сообществ в другие периоды отбора проб.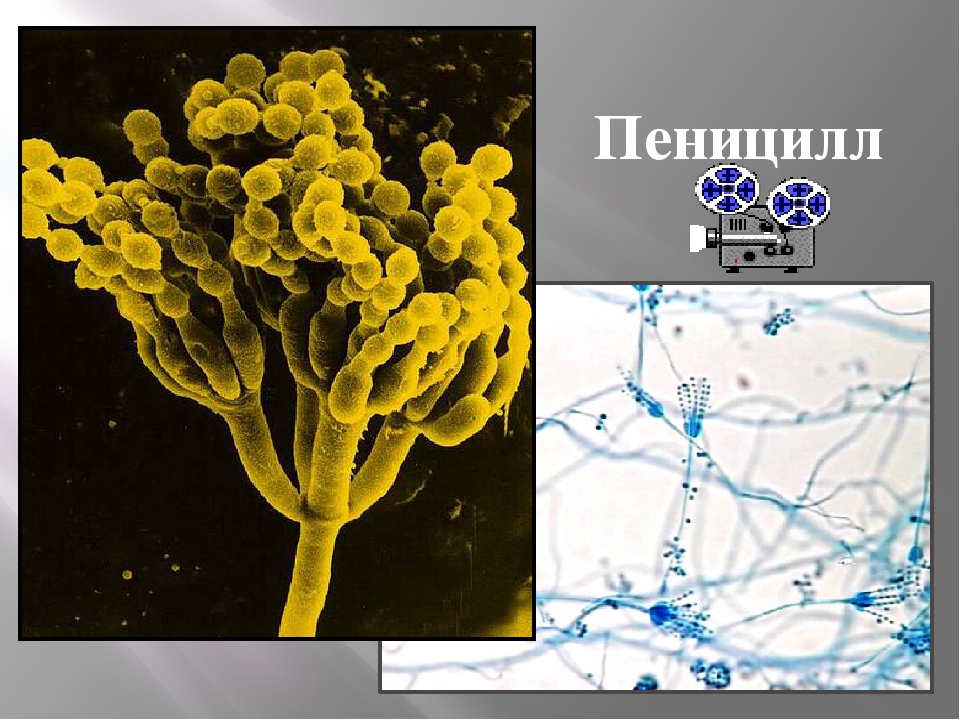 Непредставленность цианобактериальных последовательностей губок может быть связана либо с уменьшенным количеством протестированных клонов, либо с отсутствием фотосинтезирующих бактерий в период отбора проб.Мы также не наблюдали бактерий архей, несмотря на использование праймеров, специфичных для архей и бактерий. Возможно, это связано либо с неэффективностью праймера, либо с неадекватным отбором клонов.
Непредставленность цианобактериальных последовательностей губок может быть связана либо с уменьшенным количеством протестированных клонов, либо с отсутствием фотосинтезирующих бактерий в период отбора проб.Мы также не наблюдали бактерий архей, несмотря на использование праймеров, специфичных для архей и бактерий. Возможно, это связано либо с неэффективностью праймера, либо с неадекватным отбором клонов.
Общее бактериальное разнообразие — общая тенденция среди микробиоты губок
Методологии, зависящие от культур и независимые от культур, позволили получить бактериальный консорциум из приливных морских губок H. perlevis , P. penicillus и O. papilla с тенденцией как «уникальной» (низкая тенденция), так и «. универсальные (высокая тенденция) ассоциации.Среди изученных симпатрических губок была очевидна более высокая тенденция к генералистской ассоциации бактериальных симбионтов. Различные экологические параметры, включая физические факторы, такие как сезон, химические переменные (pH окружающей воды) и потребности в питательных веществах, могут играть важную роль в определении микробной структуры губки [30].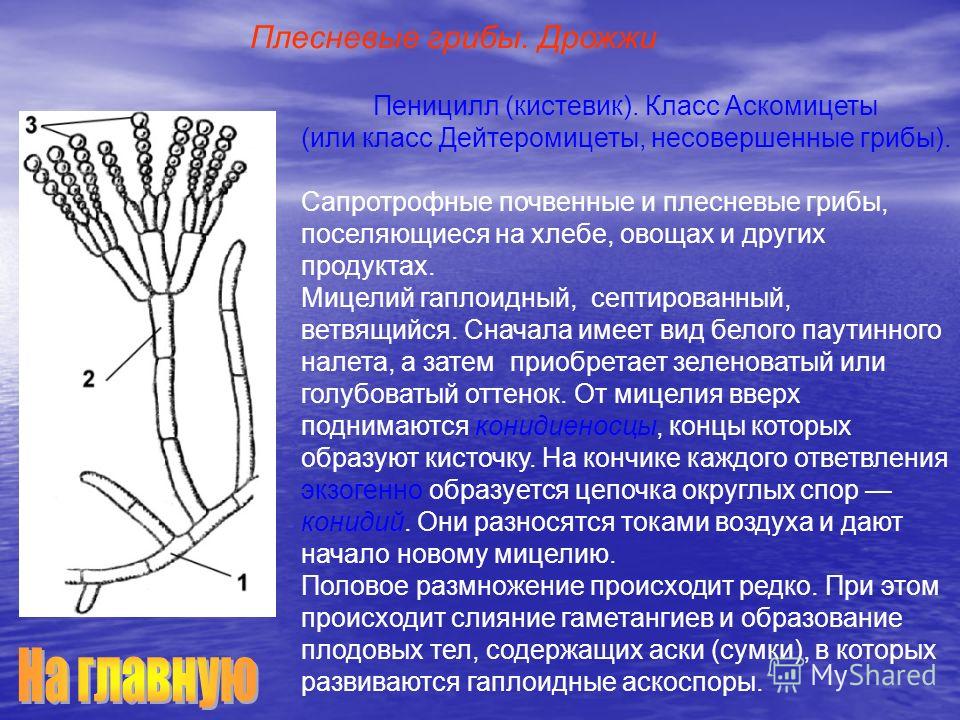 Об изменении фотосинтетических бактериальных сообществ сообщалось среди исследованных губок H. perlevis , отобранных в разные сезоны [55].Изученные иногда погружаемые в воду губки, которые подвергаются постоянному движению воды и случайному солнечному свету, могут оказывать избирательное давление, которое формирует микробный консорциум внутри губок. Для исследования пространственно-временной структуры микробиоты необходим обширный отбор проб из разных географических регионов.
Об изменении фотосинтетических бактериальных сообществ сообщалось среди исследованных губок H. perlevis , отобранных в разные сезоны [55].Изученные иногда погружаемые в воду губки, которые подвергаются постоянному движению воды и случайному солнечному свету, могут оказывать избирательное давление, которое формирует микробный консорциум внутри губок. Для исследования пространственно-временной структуры микробиоты необходим обширный отбор проб из разных географических регионов.
В заключение, мы впервые охарактеризовали бактериальные сообщества трех симпатрических литоральных морских губок H. perlevis , O.сосочек и P . penicillus с побережья Атлантического океана, что подтверждает наличие уникальных и разнообразных микробов из 10 различных типов бактерий. Виды губок с низким содержанием микробов O. papilla и P . У penicillus были уникальные микробы по сравнению с другими сопутствующими губками. Большинство бактериальных последовательностей 16S рРНК в этом исследовании были сходны с другими родственными и неродственными связанными с губками / не связанными с губками бактериями, независимо от глубины и географии, что является дополнительным доказательством сложной природы ассоциаций. Эти новые результаты позволяют лучше понять глобальное разнообразие бактерий, связанных с губками. Однако полная природа наблюдаемых ассоциаций потребует дальнейших подробных исследований.
Эти новые результаты позволяют лучше понять глобальное разнообразие бактерий, связанных с губками. Однако полная природа наблюдаемых ассоциаций потребует дальнейших подробных исследований.
Материалы и методы
Заявление об этике
В исследовании не участвовали какие-либо виды, находящиеся под угрозой исчезновения или охраняемые. Для сбора проб беспозвоночных с приливного скалистого пляжа не требовалось никаких специальных разрешений на научные исследования. Более того, для взятия образца губки не требовалось приносить в жертву животное, и для исследования был использован только 1 см 3 внутренней области ткани губки, которая может легко регенерироваться животным и не оказывает воздействия на окружающую среду.
Сбор и обработка образцов культивируемых бактерий
Виды морских губок Hymeniacidon perlevis (n = 2), Ophlitaspongia papilla (n = 3) и Polymastia penicillus (n = 2) были собраны на литоральном скалистом берегу Прайя-да-Мемориа в Португалии (41. 2308206N 8.7216926). W). Образцы губки и окружающая морская вода были собраны и транспортированы в изолированном холодильнике в лабораторию для немедленной процедуры. Образцы промывали стерильной морской водой, осторожно встряхивая 4–5 раз, чтобы удалить свободно прикрепленные поверхностные бактерии.Примерно 1 см. 3 внутренней области ткани губки иссекали и измельчали с использованием стерильной ступки и пестика в 10 мл автоклавированной морской воды. Гомогенат серийно разбавляли до 10 -5 и высевали на среду Difco ™ Marine Agar 2216. В среду добавляли амфотерицин B (1 мл / 100 мл) для предотвращения роста грибков. Планшеты инкубировали при 28 ° C до 1 недели в темноте. Колонии дважды наносили штрихами на среду для получения чистой культуры.
Идентификация культивируемых бактерий по гену 16S рРНК
Отдельные бактериальные колонии были проверены на основе морфологии и цвета для дальнейшего анализа.Для экстракции ДНК чистые бактериальные колонии инокулировали в пробирки объемом 2 мл, содержащие среду Difco ™ Marine broth 2216. Пробирки для культивирования инкубировали при 28 ° C при постоянном встряхивании в течение 3 дней в темноте для максимального сбора бактериальных клеток с последующей экстракцией ДНК с использованием набора для геномной ДНК PureLink ™ (Invitrogen) в соответствии с инструкциями производителя.
генов 16S рРНК амплифицировали с универсальными бактериальными праймерами 8F (5′-AGAGTTTGATCCTGGCTCAG -3 ‘) и 1492R (l) (5′-GGTTACCTTGTTACGACTT-3’) [56].Реакции ПЦР проводили в объеме 50 мкл, состоящем из 5 мкл 10 × буфера для ПЦР (Invitrogen), 5 мкл 2,5 мМ DNTP (NZYTech), 2,5 мкл 2,5 мМ MgCl 2 (Invitrogen), 2,5 мкл 10 мкМ. каждый праймер, 0,5 мкл 5 ед / мкл ДНК-полимеразы Taq (Invitrogen) и 2,5 мкл 30 нг геномной ДНК. Профили циклирования ПЦР: начальная денатурация в течение 5 минут при 94 ° C; 30 циклов 94 ° C в течение 1 минуты, 55 ° C в течение 1 минуты, 72 ° C в течение 2 минут; и окончательное удлинение в течение 10 минут при 72 ° C. Продукты ПЦР очищали с помощью набора PureLink ™ Quick Gel Extraction and PCR Purification Combo Kit (Invitrogen) и секвенировали с помощью Macrogen Europe с использованием анализатора ДНК ABI 3730XL (Applied Biosystems). Последовательности были проверены на наличие химер с помощью Mallard [57] и были депонированы в GenBank (номера доступа KF155235 – KF155265).
Последовательности были проверены на наличие химер с помощью Mallard [57] и были депонированы в GenBank (номера доступа KF155235 – KF155265).
Экстракция ДНК из губки и окружающей морской воды
Вид губок H. perlevis (n = 2, сокращенно HM), P. penicillus (n = 2, сокращенно PL) и O. papilla (n = 3, сокращенно OP) были обработаны ( описано в предыдущем разделе) для общей геномной ДНК. Примерно 1 см. 3 тканей губки переваривали в соответствии с протоколом, указанным для грамположительных и грамотрицательных бактерий с помощью набора геномной ДНК PureLink ™ (Invitrogen).Окружающую морскую воду (n = 1, сокращенно SW) фильтровали через стерильный фильтр с размером пор 0,45 мкм. После экстракции ДНК частицы, прикрепленные к фильтровальной бумаге, соскребали. Молекулярную идентификацию видов губок проводили с использованием маркера гена цитохромоксидазы I (COI). Праймеры, кодирующие штрих-кодирование губки [58], использовали для амплификации частичной области COI с использованием ранее описанных условий ПЦР [55].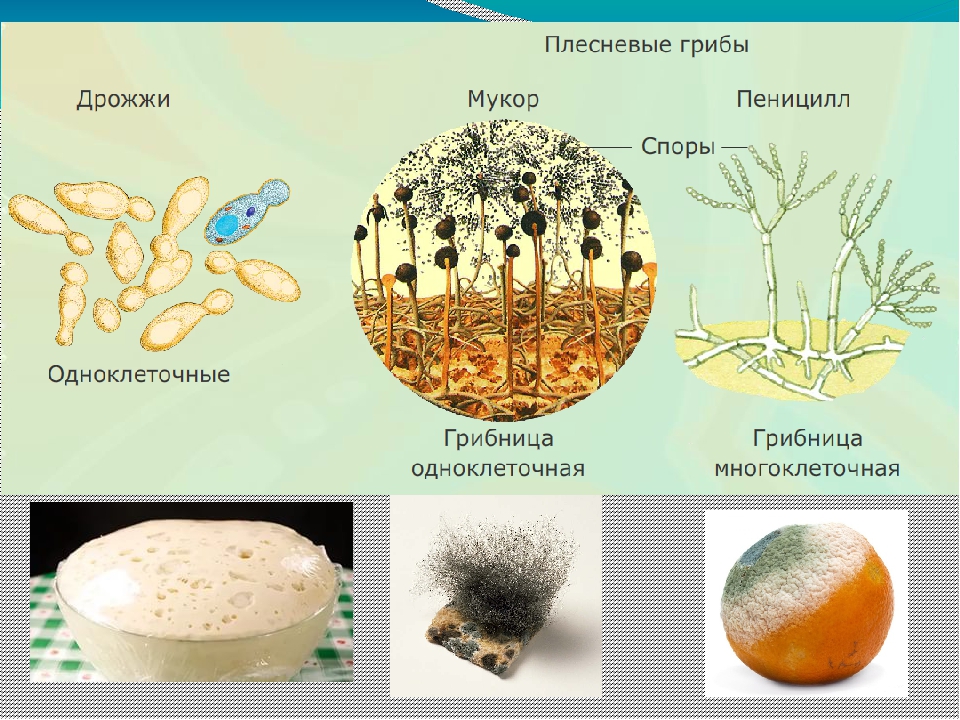 Последовательности депонированы в GenBank (инвентарные номера KF225481 – KF225487).
Последовательности депонированы в GenBank (инвентарные номера KF225481 – KF225487).
Конструирование библиотеки генов ПЦР и 16S рРНК
Частичный ген 16S рРНК был амплифицирован для подготовки библиотеки клонов с универсальным прямым праймером U789F (5′-TAGATACCCSSGTAGTCC-3 ‘) и обратным праймером U1068R (5′-CTGACGR CRGCCATGC-3’), нацеленным на гипервариабельный регион V6 как бактерий, так и архей. [59].Реакции ПЦР в трех экземплярах были выполнены для каждого образца губки в объеме 50 мкл, состоящего из аналогичной реакционной смеси ПЦР, используемой для культивируемых бактерий, за исключением увеличения концентрации праймера (5 мкл по 10 мкм каждый праймер), с ранее описанными условиями цикла [28]. Продукты ПЦР очищали в геле с помощью набора PureLink ™ Quick Gel Extraction and PCR Purification Combo Kit (Invitrogen).
Очищенные соответствующие ампликоны 16S рРНК объединяли и использовали в качестве вставки ДНК для конструирования библиотеки клонов с использованием векторов pTOP TA V2 в Macrogen Europe. Положительные клоны подвергали скринингу, и клоны со вставкой ~ 300 п.н. секвенировали двунаправленно с использованием векторных праймеров.
Положительные клоны подвергали скринингу, и клоны со вставкой ~ 300 п.н. секвенировали двунаправленно с использованием векторных праймеров.
Необработанные данные последовательности из 384 клонов были проанализированы на предмет загрязнения вектора с помощью VecScreen (http://www.ncbi.nlm.nih.gov/VecScreen/VecScreen.html). Последовательности были дополнительно проверены и обрезаны примерно до 300 п.н. с помощью конвейера предварительной обработки последовательностей SeqTrim [60] и, при необходимости, проверены и отредактированы вручную в BioEdit Sequence Editor [61]. Обработанные последовательности были проверены на химеры и другие артефакты с помощью Mallard [57].Набор данных, удаленных химер (n = 349), был использован для дальнейшего анализа и депонирован в GenBank (номера доступа KF171537 – KF171885).
Назначение оперативной таксономической единицы (OTU) для библиотеки клонов
Последовательности библиотеки клонов были выровнены с использованием алгоритма Nearest Alignment Space Termination (NAST) [62], реализованного в базе данных генов 16S рРНК Greengenes [63]. Последовательности были назначены и кластеризованы для OTU с разными значениями отсечки с использованием метода самого дальнего соседа, реализованного в программном пакете mothur [64].OTU, определенные при пороговом значении 0,01 (сходство 99%), были включены в последующий анализ биоразнообразия и структуры сообществ.
Последовательности были назначены и кластеризованы для OTU с разными значениями отсечки с использованием метода самого дальнего соседа, реализованного в программном пакете mothur [64].OTU, определенные при пороговом значении 0,01 (сходство 99%), были включены в последующий анализ биоразнообразия и структуры сообществ.
Анализ бактериального биоразнообразия и структуры сообщества библиотеки клонов
Индексы биоразнообразия и генетическая структура восстановленного бактериального сообщества из губок-хозяев и морской воды (SW) были оценены с помощью различных калькуляторов, реализованных в пакете mothur [64]. Расчет бактериального богатства включал наблюдаемое видовое богатство ( S obs ) и ожидаемое богатство с оценкой Chao1 ( S chao1 ).Индексы разнообразия Симпсона, D simpson и E 1 / D были использованы для оценки бактериального доминирования и равномерности. Для определения охвата выборкой использовалась оценка охвата Гуда. Генетическую дифференциацию среди и внутри сообщества ассоциированных с губками бактерий и окружающей воды сравнивали с использованием AMOVA [65] и HOMOVA [66]. Сходство между структурой сообщества симбионтов оценивали с помощью филогенетического теста сортировки клонов (P-тест; [67]). Попарное сравнение бактериальных сообществ среди губок-хозяев и морской воды оценивалось с помощью LIBSHUFF [68].Двумерный анализ главных координат (PCoA) был проведен для визуального сравнения различий сообществ среди источников с использованием взвешенного алгоритма Unifrac с этапами нормализации [69].
Генетическую дифференциацию среди и внутри сообщества ассоциированных с губками бактерий и окружающей воды сравнивали с использованием AMOVA [65] и HOMOVA [66]. Сходство между структурой сообщества симбионтов оценивали с помощью филогенетического теста сортировки клонов (P-тест; [67]). Попарное сравнение бактериальных сообществ среди губок-хозяев и морской воды оценивалось с помощью LIBSHUFF [68].Двумерный анализ главных координат (PCoA) был проведен для визуального сравнения различий сообществ среди источников с использованием взвешенного алгоритма Unifrac с этапами нормализации [69].
Филогенетический анализ культивируемых бактерий и библиотек клонов
Последовательности культивируемых бактериальных 16S рРНК (n = 31) и OTU из морской воды и соответствующих губок-хозяев (n = 142) с определенным сходством 99%, а их ближайший родственник, полученный из базы данных GenBank с помощью поиска BLAST в сентябре 2012 года, был сопоставлен со справочной базой данных greengenes [63]. Таксономическая принадлежность дополнительно проверяется с помощью базы данных RDP [70], чтобы минимизировать таксономическую неверную интерпретацию. Филогенетические деревья максимального правдоподобия были построены в PhyML [71] с использованием метода эвристического поиска Nearest-Neighbor-Interchange (NNI). Наиболее подходящие эволюционные модели, GTR + I + G для изолятов и TIM + G + I для библиотек клонов, были приняты в соответствии с информационным критерием Акаике с коррекцией (AICc), реализованным в MrAIC ver. 1.4.4 [72].
Таксономическая принадлежность дополнительно проверяется с помощью базы данных RDP [70], чтобы минимизировать таксономическую неверную интерпретацию. Филогенетические деревья максимального правдоподобия были построены в PhyML [71] с использованием метода эвристического поиска Nearest-Neighbor-Interchange (NNI). Наиболее подходящие эволюционные модели, GTR + I + G для изолятов и TIM + G + I для библиотек клонов, были приняты в соответствии с информационным критерием Акаике с коррекцией (AICc), реализованным в MrAIC ver. 1.4.4 [72].
Дополнительная информация
Рисунок S3.
Филогенетическое дерево максимального правдоподобия, построенное с частичным геном 16S рРНК, полученным из ассоциированных с губками бактерий. Самый близкий родственник, полученный из базы данных, использовался для построения дерева. Различные группы бактерий показаны в цветной прямоугольной рамке. Последовательности клонов, полученные в результате этого исследования, выделены жирным шрифтом с указанием номера клона. Клады сжаты (треугольники) и указаны значения поддержки бутстрапа (%).
Клады сжаты (треугольники) и указаны значения поддержки бутстрапа (%).
https://doi.org/10.1371/journal.pone.0080653.s003
(PDF)
Благодарности
Мы благодарим Пратипу Виджаякумари за помощь в выделении бактерий. Мы также хотели бы поблагодарить доктора Уоррена Э. Джонсона из Смитсоновского института биологии сохранения, Национального зоологического парка, Фронт-Роял, штат Вирджиния, США, за критическое редактирование рукописи. Комментарии, предоставленные младшим редактором и двумя анонимными рецензентами, улучшили более раннюю версию этой рукописи.
Вклад авторов
Эксперименты задуманы и разработаны: А.Алекс А. Антунес. Выполнял опыты: Алексей Алексеевич VS. Проанализированы данные: А. Алекс, А. Антунес. Предоставленные реагенты / материалы / инструменты анализа: В.В. Антунес. Написал доклад: А. Алекс А. Антунес.
Список литературы
- 1.
Turque AS, Batista D, Silveira CB, Cardoso AM, Vieira RP и др.
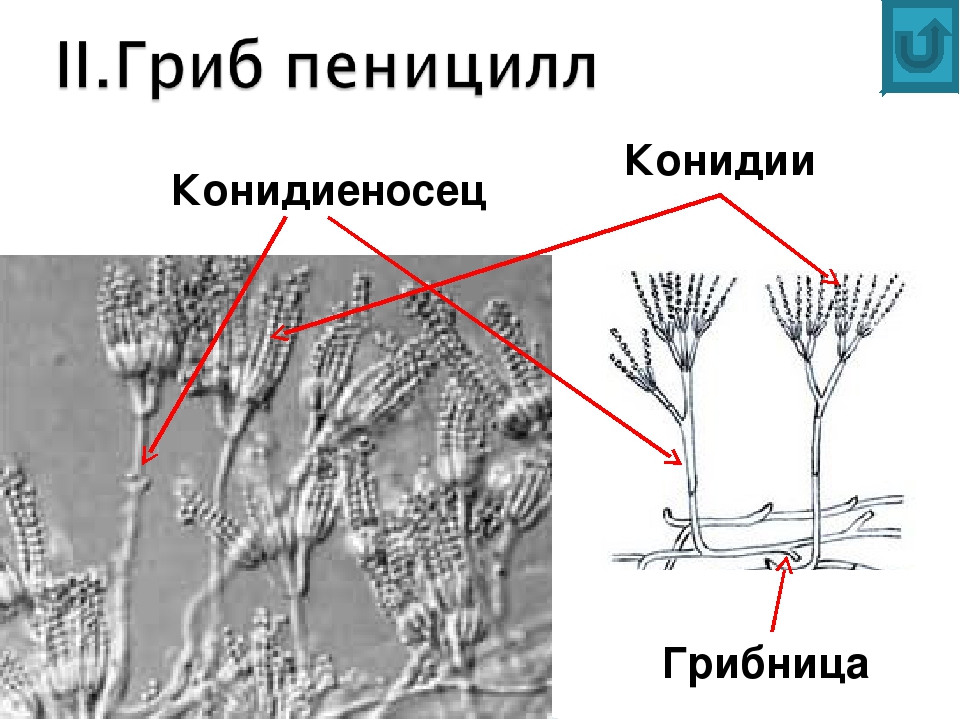 (2010) Формирование окружающей среды сообществ архей, связанных с губками. PLoS ONE 5: e15774
(2010) Формирование окружающей среды сообществ архей, связанных с губками. PLoS ONE 5: e15774 - 2. Usher KM, Bergman B, Raven JA (2007) Изучение взаимозависимости цианобактерий.Annu Rev Ecol Evol Syst 38: 255–273
- 3. Santavy DL, Willenz P, Colwell RR (1990) Фенотипическое исследование бактерий, связанных с карибской склерогубкой, Ceratoporella nicholsoni. Appl Environ Microbiol 56: 1750–1762.
- 4. Maldonado M, Cortadellas N, Trillas MI, Rützler K (2005) Эндосимбиотические дрожжи, передаваемые по материнской линии в морской губке. Biol Bull 209: 94–106.
- 5. Garson MJ, Flowers AE, Webb RI, Charan RD, McCaffrey EJ (1998) Ассоциация губка / динофлагеллят в гаплосклеридной губке Haliclona sp.: клеточное происхождение цитотоксических алкалоидов путем фракционирования в градиенте плотности Перколла. Cell Tissue Res 293: 365–373
- 6.
Хентшель У., Хопке Дж., Хорн М., Фридрих А.Б., Вагнер М.
 и др. (2002) Молекулярные доказательства однородного микробного сообщества губок из разных океанов. Appl Environ Microbiol 68: 4431–4440
и др. (2002) Молекулярные доказательства однородного микробного сообщества губок из разных океанов. Appl Environ Microbiol 68: 4431–4440 - 7. Usher KM, Kuo J, Fromont J, Sutton DC (2001) Вертикальная передача цианобактериальных симбионтов в морской губке Chondrilla australiensis (Demospongiae).Hydrobiologia 461: 9–13.
- 8. Enticknap JJ, Kelly M, Peraud O, Hill RT (2006) Характеристика культивируемого альфа-протеобактериального симбионта, общего для многих морских губок, и доказательства вертикальной передачи через личинки губок. Appl Environ Microbiol 72: 3724–3732
- 9. Вебстер Н.С., Тейлор М.В., Бехнам Ф., Люкер С., Раттей Т. и др. (2010) Глубокое секвенирование выявило исключительное разнообразие и способы передачи симбионтов бактериальных губок. Environ Microbiol 12: 2070–2082
- 10.Schmitt S, Hentschel U, Taylor M (2012) Глубокое секвенирование показывает разнообразие и структуру сообщества сложной микробиоты у пяти средиземноморских губок.
 Hydrobiologia 687: 341–351
Hydrobiologia 687: 341–351 - 11. Diaz MC, Ward BB (1997) Опосредованная губкой нитрификация в тропических бентосных сообществах. Mar Ecol Prog Ser 156: 97–107
- 12. Байер К., Шмитт С., Хентчель У. (2008) Физиология, филогения и доказательства in situ бактериальных и архейных нитрификаторов в морской губке Aplysina aerophoba.Environ Microbiol 10: 2942–2955
- 13. Hoffmann F, Radax R, Woebken D, Holtappels M, Lavik G и др. (2009) Сложный круговорот азота в губке Geodia barretti. Environ Microbiol 11: 2228–2243
- 14. Wilkinson CR, Fay P (1979) Фиксация азота в губках коралловых рифов с симбиотическими цианобактериями. Природа 279: 527–529
- 15. Хоффманн Ф., Ларсен О, Тиль В., Рапп Х.Т., Папе Т. и др. (2005) Анаэробный мир в губках. Журнал геомикробиологии 22: 1–10
- 16.Wilkinson CR (1983) Чистая первичная продуктивность губок коралловых рифов. Наука 219: 410–412
- 17.
Такер Р.
 В. (2005) Влияние затенения на симбиоз губчатых цианобактерий: сравнение ассоциаций конкретных хозяев и ассоциаций широкого профиля. Интегр Комп Биол 45: 369–376
В. (2005) Влияние затенения на симбиоз губчатых цианобактерий: сравнение ассоциаций конкретных хозяев и ассоциаций широкого профиля. Интегр Комп Биол 45: 369–376 - 18. Lafi FF, Garson MJ, Fuerst JA (2005) Культурные бактериальные симбионты, выделенные из двух разных видов губок (Pseudoceratina clavata и Rhabdastrella globostellata) с Большого Барьерного рифа, демонстрируют сходное филогенетическое разнообразие.Microb Ecol 50: 213–220
- 19. Margassery LM, Kennedy J, O’Gara F, Dobson AD, Morrissey JP (2012) Разнообразие и антибактериальная активность бактерий, выделенных из прибрежных морских губок Amphilectus fucorum и Eurypon major. Lett Appl Microbiol 55: 2–8
- 20. Ван Г, Юн С.-Х, Лефайт Э (2009) Микробные сообщества, связанные с инвазивной гавайской губкой Mycale armata. ISME J 3: 374–377
- 21.
Андерсон С.А., Норткот П.Т., Пейдж М.Дж. (2010) Пространственная и временная изменчивость бактериального сообщества у различных хемотипов новозеландской морской губки Mycale hentscheli.
 FEMS Microbiol Ecol 72: 328–342
FEMS Microbiol Ecol 72: 328–342 - 22. Ли Э-И, Ли Х. К., Ли Ю. К., Сим С. Дж., Ли Дж. Х. (2003) Разнообразие симбиотических сообществ архей в морских губках из Кореи. Biomol Eng 20: 299–304.
- 23. Эрвин П.М., Олсон Дж. Б., Такер Р. В. (2011) Филогенетическое разнообразие, специфичность к хозяину и профилирование сообществ связанных с губками бактерий в северной части Мексиканского залива. PLoS ONE 6: e26806
- 24. Turque A, Cardoso A, Silveira C, Vieira R, Freitas F и др.(2008) Бактериальные сообщества морских губок Hymeniacidon heliophila и Polymastia janeirensis и их среда в Рио-де-Жанейро, Бразилия. Морская биология 155: 135–146
- 25. Simister RL, Deines P, Botté ES, Webster NS, Taylor MW (2012) Пересмотр специфичных для губок кластеров: комплексная филогения связанных с губками микроорганизмов. Environ Microbiol 14: 517–524
- 26.
Лемло М.Л., Фромонт Дж., Брюммер Ф., Ашер К. (2009) Разнообразие и изобилие фотосинтетических губок в Западной Австралии с умеренным климатом.
 BMC Ecology 9: 4
BMC Ecology 9: 4 - 27. Lafi FF, Fuerst JA, Fieseler L, Engels C, Goh WWL и др. (2009) Широкое распространение Poribacteria в Demospongiae. Appl Environ Microbiol 75: 5695–5699
- 28. Ли О.О., Ван Й., Ян Дж., Лафи Ф.Ф., Аль-Сувайлем А. и др. (2011) Пиросеквенирование выявляет очень разнообразные и видоспецифичные микробные сообщества губок из Красного моря. ISME J 5: 650–664
- 29. Томас TRA, Кавлекар Д.П., LokaBharathi PA (2010) Морские препараты от ассоциации губчатых микробов — обзор.Морские препараты 8: 1417–1468
- 30. Тейлор М.В., Шупп П.Дж., Даллёф И., Кьеллеберг С., Стейнберг П.Д. (2004) Специфичность хозяина у морских губчатых бактерий и потенциальные последствия для разнообразия морских микробов. Environ Microbiol 6: 121–130.
- 31. Монтальво Н.Ф., Хилл Р.Т. (2011) Связанные с губкой бактерии строго содержатся в двух тесно связанных, но географически удаленных хозяевах губки. Прикладная и экологическая микробиология 77: 7207–7216
- 32.
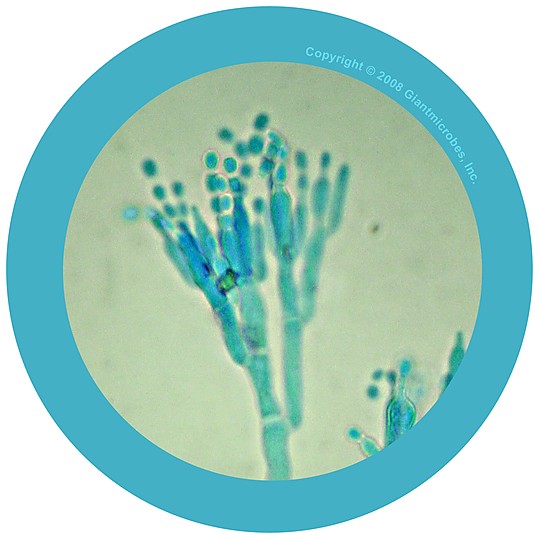 Эрвин PM, López-Legentil S, González-Pech R, Turon X (2012) Специфическая смесь универсалов: бактериальные симбионты в средиземноморском регионе Ircinia spp. FEMS Microbiol Ecol 79: 619–637
Эрвин PM, López-Legentil S, González-Pech R, Turon X (2012) Специфическая смесь универсалов: бактериальные симбионты в средиземноморском регионе Ircinia spp. FEMS Microbiol Ecol 79: 619–637 - 33. Hentschel U, Fieseler L, Wehrl M, Gernert C, Steinert M, et al .. (2003) Микробное разнообразие морских губок. В: Мюллер PDWEG, редактор. Губки (Porifera). Прогресс в молекулярной и субклеточной биологии. Берлин-Гейдельберг-Шпрингер. С. 59–88.
- 34. Джайлс Э.С., Камке Дж., Мойтиньо-Силва Л., Тейлор М.В., Хентчел У. и др.(2013) Профили бактериальных сообществ губок с низким микробным содержанием. FEMS Microbiology Ecology 83: 232–241
- 35. Cabioch L (1968) Вклад в ознакомление с фауной губернии Западного Манша: démosponges de la région de Roscoff. Cahiers de Biologie marine.
- 36.
Чжан Х., Ли Ю.К., Чжан В., Ли Х.К. (2006) Культурные актинобактерии из морской губки Hymeniacidon perleve: изоляция и филогенетическое разнообразие с помощью анализа RFLP-ген 16S рРНК.
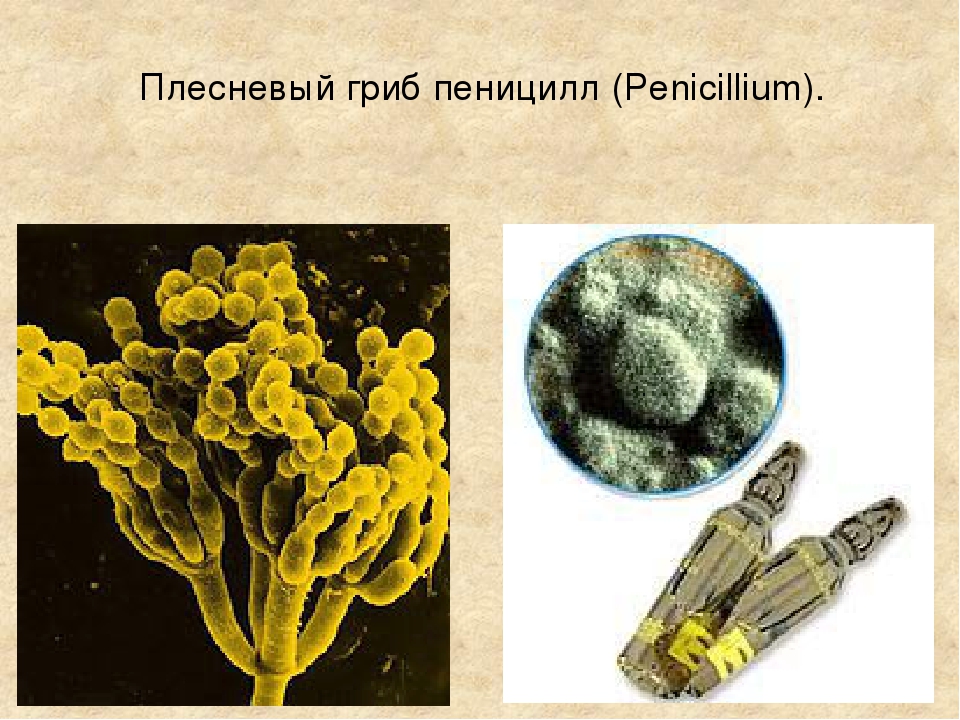 Антони Ван Левенгук 90: 159–169
Антони Ван Левенгук 90: 159–169 - 37. Xin Y, Huang J, Deng M, Zhang W (2008) Независимый от культуры метод вложенной ПЦР выявляет большое разнообразие актинобактерий, связанных с морскими губками Hymeniacidon perleve и Sponge sp. Антони Ван Левенгук 94: 533–542
- 38. Howson CM, Chambers SJ (1999) Ophlitaspongia и Ophlitaspongia papilla восстановлены, и описан новый вид Ophlitaspongia (Porifera: Demospongiae: Microcionidae). Журнал Морской биологической ассоциации Соединенного Королевства 79: 609–620.
- 39. Феррейра М., Кабадо А.Г., Чапела М.-Дж., Фахардо П., Атанасова М. и др. (2011) Цитотоксическая активность экстрактов морских губок из Северо-Западного Испании на линии клеток нейробластомы. Environ Toxicol Pharmacol 32: 430–437
- 40.
Carballeira NM, Montano N, Balaña-Fouce R, Prada CF (2009) Первый полный синтез и антипротозойная активность (Z) -17-метил-13-октадеценовой кислоты, новой морской жирной кислоты из губки Polymastia penicillus.
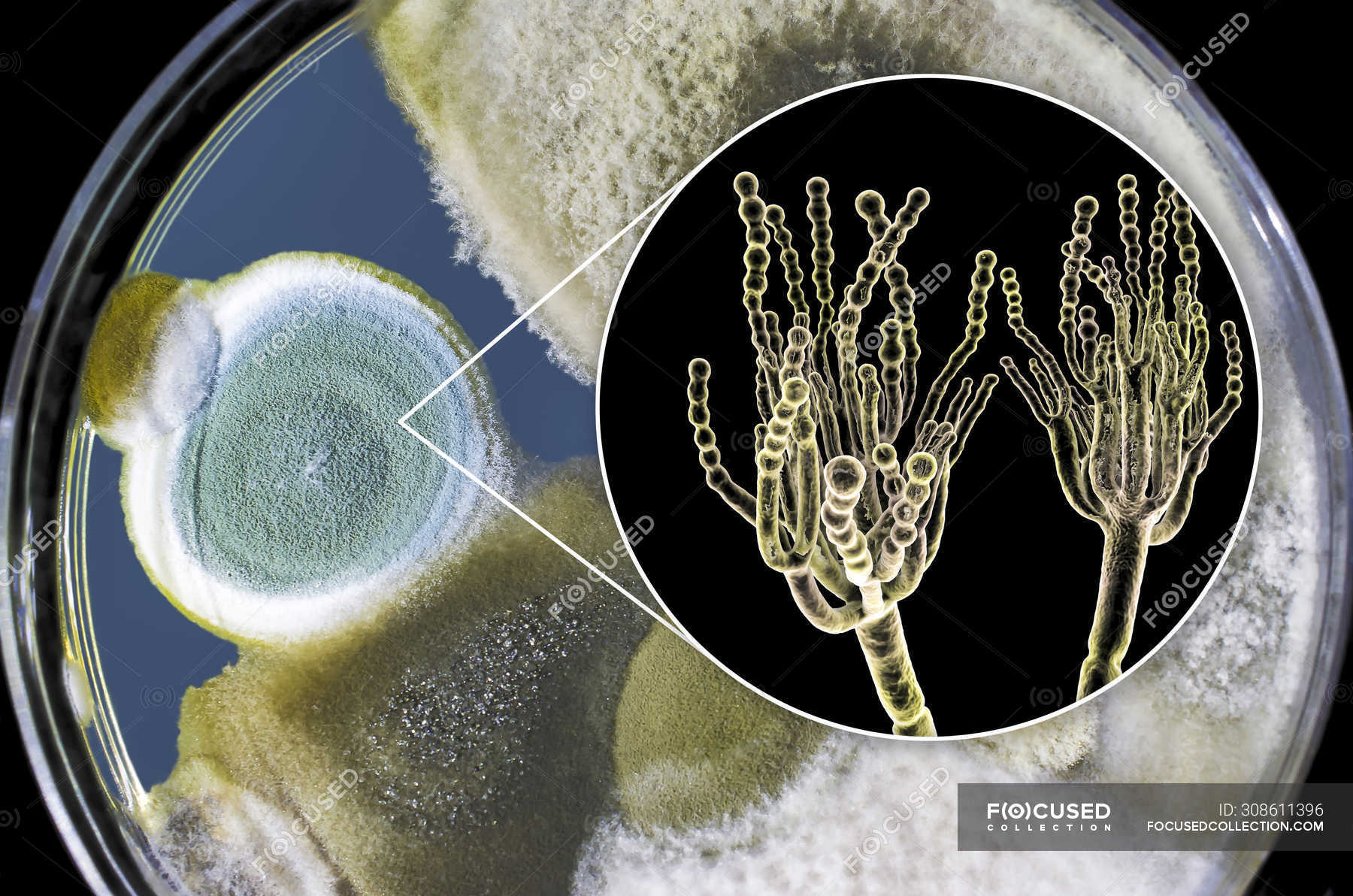 Chem Phys Lipids 161: 38–43
Chem Phys Lipids 161: 38–43 - 41.Тиль В., Лейнингер С., Шмальоханн Р., Брюммер Ф., Имхофф Дж. Ф. (2007) Губчатые бактериальные ассоциации средиземноморской губки Chondrilla nucula (Demospongiae, Tetractinomorpha). Microb Ecol 54: 101–111
- 42. Hill M, Hill A, Lopez N, Harriott O (2005) Специфические для губок бактериальные симбионты в Карибской губке, Chondrilla nucula (Demospongiae, Chondrosida). Морская биология 148: 1221–1230
- 43. Meyer B, Kuever J (2008) Филогенетическое разнообразие и пространственное распределение микробного сообщества, связанного с карибской глубоководной губкой Polymastia cf.corticata с помощью анализа генов 16S рРНК, aprA и amoA. Microb Ecol 56: 306–321
- 44. Фукунага Ю., Курахаши М., Танака К., Янаги К., Йокота А. и др. (2006) Pseudovibrio ascidiaceicola sp. nov., выделенный из асцидий (морских брызг). Int J Syst Evol Microbiol 56: 343–347
- 45.
О’Халлоран Дж. А., Барбоса TM, Моррисси Дж.
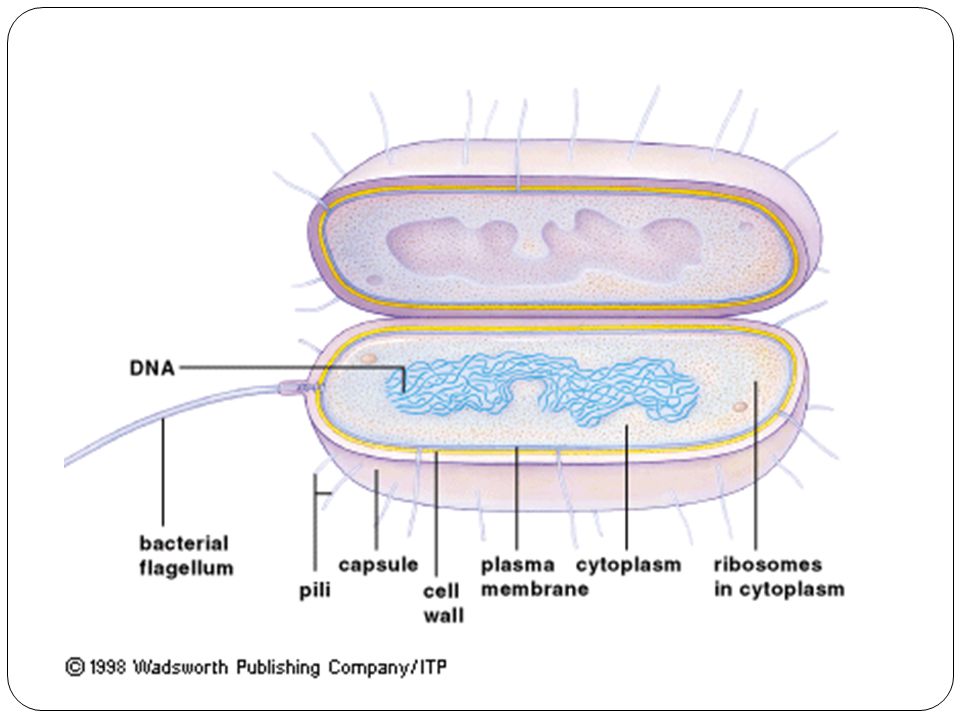 П., Кеннеди Дж., О’Гара Ф. и др. (2011) Разнообразие и антимикробная активность Pseudovibrio spp. из ирландских морских губок. J Appl Microbiol 110: 1495–1508
П., Кеннеди Дж., О’Гара Ф. и др. (2011) Разнообразие и антимикробная активность Pseudovibrio spp. из ирландских морских губок. J Appl Microbiol 110: 1495–1508 - 46.Muscholl-Silberhorn A, Thiel V, Imhoff J (2008) Изобилие и биоактивность культивируемых бактерий, ассоциированных с губками, из Средиземного моря. Микробная экология 55: 94–106
- 47. Santos OCS, Pontes PVML, Santos JFM, Muricy G, Giambiagi-deMarval M и др. (2010) Выделение, характеристика и филогения ассоциированных с губками бактерий с антимикробной активностью из Бразилии. Рес Microbiol 161: 604-612
- 48. Бондарев В., Рихтер М., Романо С., Пиль Дж., Шведт А. и др.. (2013) Род Pseudovibrio содержит метаболически разносторонние бактерии, приспособленные к симбиозу. Environ Microbiol. DOI: https: //doi.org/10.1111/1462-2920.12123.
- 49.
Hoffmann M, Monday SR, McCarthy PJ, Lopez JV, Fischer M, et al. (2013) Генетические и филогенетические доказательства горизонтального переноса генов среди экологически разрозненных групп морских вибрионов.
 Кладистика 29: 46–64
Кладистика 29: 46–64 - 50. Зан Дж, Фукуа С., Хилл Р.Т. (2011) Разнообразие и функциональный анализ генов luxS у вибрионов морских губок Mycale laxissima и Ircinia strobilina.ISME J 5: 1505–1516
- 51. Гомес-Гил Б., Роке А., Тернбулл Дж. Ф. (2000) Использование и выбор пробиотических бактерий для использования в культуре личиночных водных организмов. Аквакультура 191: 259–270
- 52. Shieh WY, Lin YM (1994) Ассоциация гетеротрофных азотфиксирующих бактерий с морской губкой Halichondria Sp. Бюллетень морских наук 54: 557–564.
- 53. Hedlund BP, Staley JT (2006) Выделение и характеристика штаммов Pseudoalteromonas с дивергентными катаболическими свойствами полициклических ароматических углеводородов.Environ Microbiol 8: 178–182
- 54.
Тейлор М.В., Цай П., Симистер Р.Л., Дайнес П., Ботте Э. и др. (2013) «Специфические для губок» бактерии широко распространены (но редко) в разнообразных морских средах.
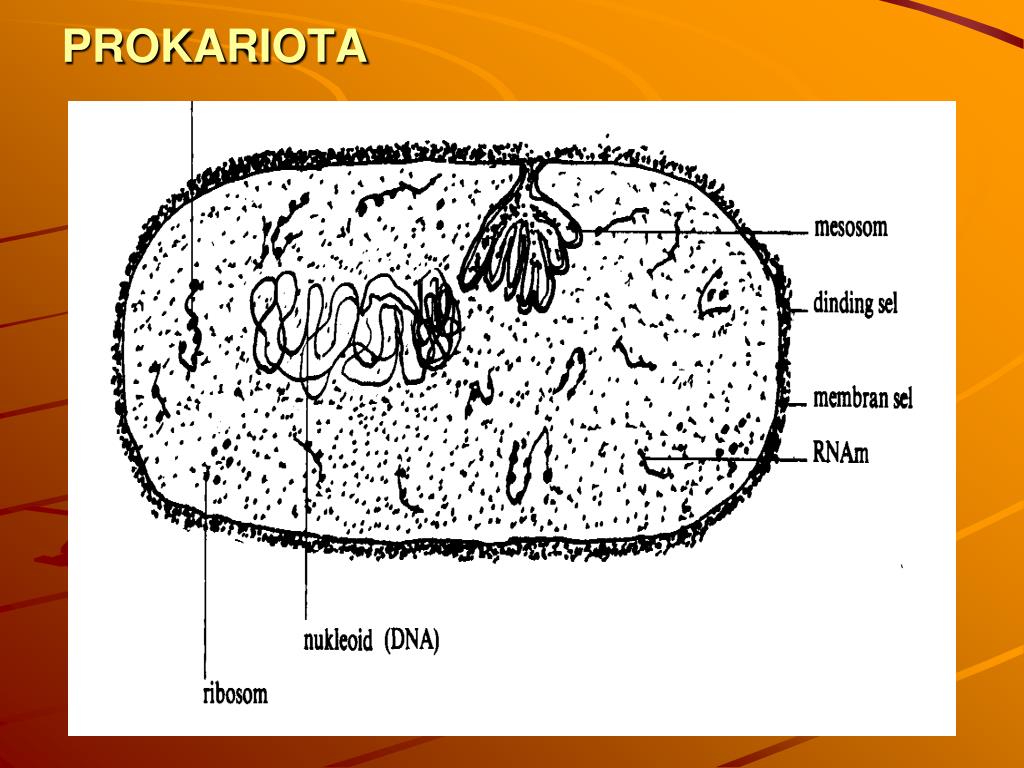 ISME J 7: 438–443
ISME J 7: 438–443 - 55. Алекс А., Васконселос В., Таманьини П., Сантос А., Антунес А. (2012) Необычная ассоциация симбиотических цианобактерий в генетически разнообразной приливной морской губке Hymeniacidon perlevis (Demospongiae, Halichondrida). PLoS ONE 7: e51834
- 56.Тернер С., Прайер К.М., Миао В.П., Палмер Дж.Д. (1999) Изучение глубоких филогенетических взаимоотношений между цианобактериями и пластидами с помощью анализа последовательности малых субъединиц рРНК. J Eukaryot Microbiol 46: 327–338.
- 57. Ashelford KE, Chuzhanova NA, Fry JC, Jones AJ, Weightman AJ (2006) Новое программное обеспечение для скрининга показывает, что самые последние библиотеки больших клонов генов 16S рРНК содержат химеры. Appl Environ Microbiol 72: 5734–5741
- 58. Meyer CP, Geller JB, Paulay G (2005) Мелкомасштабный эндемизм на коралловых рифах: архипелажная дифференциация раковинных брюхоногих моллюсков.Эволюция 59: 113–125.
- 59.
 Baker GC, Smith JJ, Cowan DA (2003) Обзор и повторный анализ доменно-специфичных праймеров 16S. J Microbiol Methods 55: 541–555.
Baker GC, Smith JJ, Cowan DA (2003) Обзор и повторный анализ доменно-специфичных праймеров 16S. J Microbiol Methods 55: 541–555. - 60. Фальгерас Дж., Лара А.Дж., Фернандес-Посо Н., Кантон ФР, Перес-Трабадо Дж. И др. (2010) SeqTrim: конвейер с высокой пропускной способностью для предварительной обработки любого типа чтения последовательности. BMC Bioinformatics 11: 38
- 61. Hall T (1999) BioEdit: удобный редактор выравнивания биологических последовательностей и программа анализа для Windows 95/98 / NT.Nucleic Acids Symposium Series 41: 95–98.
- 62. ДеСантис Т.З., Хугенгольц П., Келлер К., Броди Э.Л., Ларсен Н. и др. (2006) NAST: сервер множественного выравнивания последовательностей для сравнительного анализа генов 16S рРНК. Нуклеиновые кислоты Res 34: W394 – W399
- 63.
ДеСантис Т.З., Хугенгольц П., Ларсен Н., Рохас М., Броди Е.Л. и др. (2006) Greengenes, проверенная химерами база данных генов 16S рРНК и рабочая среда, совместимая с ARB.
 Appl Environ Microbiol 72: 5069–5072
Appl Environ Microbiol 72: 5069–5072 - 64.Schloss PD, Westcott SL, Ryabin T, Hall JR, Hartmann M, et al. (2009) Представляем mothur: программное обеспечение с открытым исходным кодом, независимое от платформы, поддерживаемое сообществом, для описания и сравнения микробных сообществ. Appl Environ Microbiol 75: 7537–7541
- 65. Excoffier L, Smouse PE, Quattro JM (1992) Анализ молекулярной дисперсии, выведенной из метрических расстояний между гаплотипами ДНК: применение к данным рестрикции митохондриальной ДНК человека. Генетика 131: 479–491.
- 66.Стюарт CN, Excoffier L (1996) Оценка генетической структуры и изменчивости популяции с данными RAPD: приложение к Vaccinium macrocarpon (американская клюква). Журнал эволюционной биологии 9: 153–171
- 67. Мартин А.П. (2002) Филогенетические подходы к описанию и сравнению разнообразия микробных сообществ. Appl Environ Microbiol 68: 3673–3682
- 68.
Singleton DR, Furlong MA, Rathbun SL, Whitman WB (2001) Количественные сравнения библиотек последовательностей генов 16S рРНК из образцов окружающей среды.
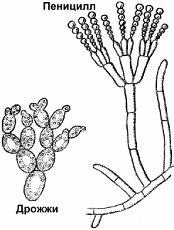 Appl Environ Microbiol 67: 4374–4376
Appl Environ Microbiol 67: 4374–4376 - 69. Hamady M, Lozupone C, Knight R (2010) Fast UniFrac: обеспечение высокопроизводительного филогенетического анализа микробных сообществ, включая анализ данных пиросеквенирования и PhyloChip. ISME J 4: 17–27
- 70. Коул Дж. Р., Ван К., Карденас Э., Фиш Дж., Чай Б. и др. (2009) The Ribosomal Database Project: улучшенное выравнивание и новые инструменты для анализа рРНК. Nucl Acids Res 37: D141 – D145
- 71. Guindon S, Gascuel O (2003) Простой, быстрый и точный алгоритм для оценки крупных филогений по максимальной вероятности.Syst Biol 52: 696–704.
- 72. Nylander JA. (2004) MrAIC.pl. Программа распространяется автором. Центр эволюционной биологии Уппсальского университета.
- 73. Ондов Б.Д., Бергман Н.Х., Филлиппи А.М. (2011) Интерактивная метагеномная визуализация в веб-браузере. BMC Bioinformatics 12: 385
ассоциаций строматолит-тромболит в современной среде, остров Ли Стокинг, Багамы, JSTOR
Абстрактный Столбчатые образования, обнаруженные в приливном русле у острова Ли Стокинг, Эксума-Кейс, Багамы, были интерпретированы как современные гигантские строматолиты, растущие в сублиторальной нормальной морской среде. Однако эти органически сформированные колонки обнаруживают три заметные внутренние структуры: (1) прокариотические строматолиты, состоящие из чередующихся слоев крупнозернистых ооидов и пелоидов, и мелкозернистого микрита, образованного исключительно микробной активностью; (2) эукариотические строматолиты, состоящие из микробно-индуцированных микритных слоев, чередующихся со слоями детрита, накопленными, связанными и цементированными эукариотическими водорослями; и (3) тромболиты с неровной, свернувшейся тканью, образованные микробами, водорослями и многоклеточными животными.Фанерозойские тромболиты, напротив, интерпретировались как неламинированные строматолиты, построенные цианобактериями. В настоящее время эукариотические организмы зарастают все столбики. Таким образом, одновременное образование прокариотических строматолитов, эукариотических строматолитов и тромболитов в идентичных условиях в нынешних условиях представляется маловероятным. Мы предполагаем, что прокариотические строматолиты представляют собой формы, которые начали развиваться в приливной среде с голоценовым затоплением Большой Багамской банки.
Однако эти органически сформированные колонки обнаруживают три заметные внутренние структуры: (1) прокариотические строматолиты, состоящие из чередующихся слоев крупнозернистых ооидов и пелоидов, и мелкозернистого микрита, образованного исключительно микробной активностью; (2) эукариотические строматолиты, состоящие из микробно-индуцированных микритных слоев, чередующихся со слоями детрита, накопленными, связанными и цементированными эукариотическими водорослями; и (3) тромболиты с неровной, свернувшейся тканью, образованные микробами, водорослями и многоклеточными животными.Фанерозойские тромболиты, напротив, интерпретировались как неламинированные строматолиты, построенные цианобактериями. В настоящее время эукариотические организмы зарастают все столбики. Таким образом, одновременное образование прокариотических строматолитов, эукариотических строматолитов и тромболитов в идентичных условиях в нынешних условиях представляется маловероятным. Мы предполагаем, что прокариотические строматолиты представляют собой формы, которые начали развиваться в приливной среде с голоценовым затоплением Большой Багамской банки.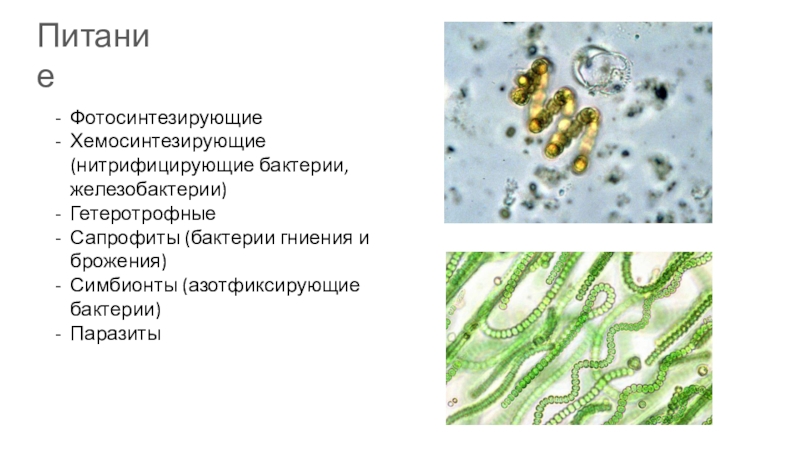 Однако тромболиты начали формироваться в нынешних нормальных морских сублиторальных условиях. Эукариотические строматолиты представляют собой промежуточные формы между прокариотическими строматолитами и тромболитами. Имеются данные о постепенном переходе от строматолитовых к тромболитовым рифам, связанным с повышением уровня моря. По мере углубления произошло бы уменьшение солености, увеличение энергии и, возможно, увеличение поступления питательных веществ; все факторы, способствующие росту тромболитов. Мы предполагаем, что сосуществующие строматолиты и тромболиты, обнаруженные у острова Ли Стокинг, не росли одновременно, а отражали реакцию на изменение экологического контроля с изменением уровня моря.
Однако тромболиты начали формироваться в нынешних нормальных морских сублиторальных условиях. Эукариотические строматолиты представляют собой промежуточные формы между прокариотическими строматолитами и тромболитами. Имеются данные о постепенном переходе от строматолитовых к тромболитовым рифам, связанным с повышением уровня моря. По мере углубления произошло бы уменьшение солености, увеличение энергии и, возможно, увеличение поступления питательных веществ; все факторы, способствующие росту тромболитов. Мы предполагаем, что сосуществующие строматолиты и тромболиты, обнаруженные у острова Ли Стокинг, не росли одновременно, а отражали реакцию на изменение экологического контроля с изменением уровня моря.
PALAIOS подчеркивает влияние жизни на историю Земли. Основанный в 1986 году, это журнал, выходящий раз в два месяца, который распространяет информацию среди геологов и биологов со всего мира, интересующихся широким кругом тем, включая, помимо прочего, биогеохимию, ихнологию, палеоклиматологию, палеоэкологию, палеоокеанографию, седиментологию, стратиграфию, геомикробиологию.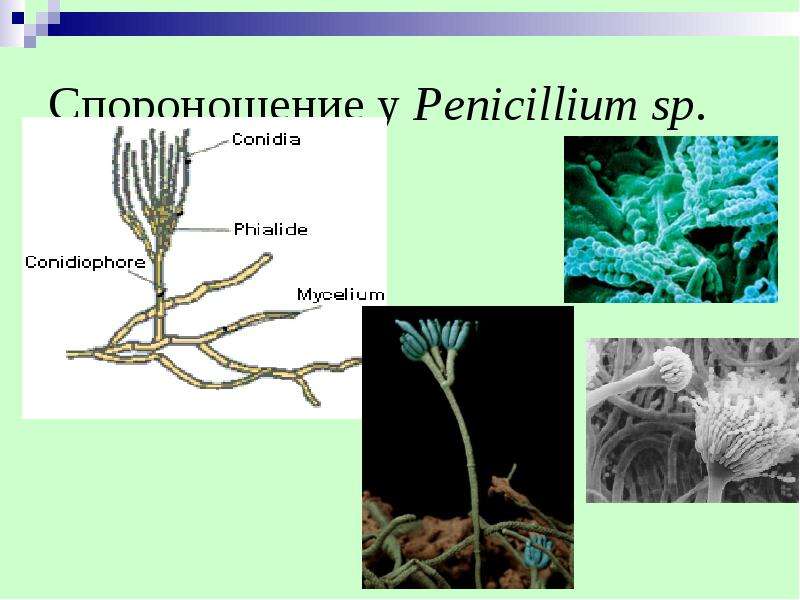 , палеобиогеохимия и астробиология.PALAIOS публикует оригинальные статьи, в которых особое внимание уделяется использованию палеонтологии для ответа на важные геологические и биологические вопросы, которые способствуют нашему пониманию истории Земли. Соответственно, для публикации с гораздо большей вероятностью будут отобраны рукописи, предмет и выводы которых имеют более широкое геологическое значение, а не узконаправленные дискурсы.
PALAIOS — это предпочтительный журнал для публикации новаторских исследований, охватывающих все аспекты прошлой и настоящей жизни, на основе которых можно расшифровать геологические, биологические, химические и атмосферные процессы и применить их для поиска решений прошлых и будущих геологических и палеонтологических проблем.
, палеобиогеохимия и астробиология.PALAIOS публикует оригинальные статьи, в которых особое внимание уделяется использованию палеонтологии для ответа на важные геологические и биологические вопросы, которые способствуют нашему пониманию истории Земли. Соответственно, для публикации с гораздо большей вероятностью будут отобраны рукописи, предмет и выводы которых имеют более широкое геологическое значение, а не узконаправленные дискурсы.
PALAIOS — это предпочтительный журнал для публикации новаторских исследований, охватывающих все аспекты прошлой и настоящей жизни, на основе которых можно расшифровать геологические, биологические, химические и атмосферные процессы и применить их для поиска решений прошлых и будущих геологических и палеонтологических проблем.
SEPM (Общество осадочной геологии) — международное некоммерческое общество со штаб-квартирой в Талсе, Оклахома. Через свою сеть международных членов Общество занимается распространением научной информации по седиментологии, стратиграфии, палеонтологии, наукам об окружающей среде, морской геологии, гидрогеологии и многим другим смежным специальностям. Общество поддерживает своих членов в их профессиональных целях, публикуя два крупных научных журнала: Journal of Sedimentary Research и PALAIOS.Кроме того, SEPM выпускает конференции по техническим исследованиям, короткие курсы и специальные публикации. Посредством программ непрерывного образования, публикаций, встреч и других программ SEPM участники получают и обмениваются информацией, относящейся к их геологическим специальностям.
Общество поддерживает своих членов в их профессиональных целях, публикуя два крупных научных журнала: Journal of Sedimentary Research и PALAIOS.Кроме того, SEPM выпускает конференции по техническим исследованиям, короткие курсы и специальные публикации. Посредством программ непрерывного образования, публикаций, встреч и других программ SEPM участники получают и обмениваются информацией, относящейся к их геологическим специальностям.
ассоциаций строматолит-тромболит в современной среде, остров Ли Стокинг, Багамы | PALAIOS
Столбчатые образования, обнаруженные в приливном канале у острова Ли-Стокинг, Эксума-Кейс, Багамы, были интерпретированы как современные гигантские строматолиты, растущие в сублиторальной нормальной морской среде.Однако эти органически сформированные колонки обнаруживают три заметные внутренние структуры: (1) прокариотические строматолиты, состоящие из чередующихся слоев крупнозернистых ооидов и пелоидов, и мелкозернистого микрита, образованного исключительно микробной активностью; (2) эукариотические строматолиты, состоящие из микробно-индуцированных микритных слоев, чередующихся со слоями детрита, накопленными, связанными и цементированными эукариотическими водорослями; и (3) тромболиты с неровной, свернувшейся тканью, образованные микробами, водорослями и многоклеточными животными. Напротив, фанерозойские тромболиты интерпретировались как неламинированные строматолиты, построенные цианобактериями. В настоящее время эукариотические организмы зарастают все столбики. Таким образом, одновременное образование прокариотических строматолитов, эукариотических строматолитов и тромболитов в идентичных условиях в нынешних условиях представляется маловероятным. Мы предполагаем, что прокариотические строматолиты представляют собой формы, которые начали развиваться в приливной среде с голоценовым затоплением Большой Багамской банки.Однако тромболиты начали формироваться в нынешних нормальных морских сублиторальных условиях. Эукариотические строматолиты представляют собой промежуточные формы между прокариотическими строматолитами и тромболитами. Имеются данные о постепенном переходе от строматолитовых к тромболитовым рифам, связанным с повышением уровня моря. По мере углубления произошло бы уменьшение солености, увеличение энергии и, возможно, увеличение поступления питательных веществ; все факторы, способствующие росту тромболитов.
Напротив, фанерозойские тромболиты интерпретировались как неламинированные строматолиты, построенные цианобактериями. В настоящее время эукариотические организмы зарастают все столбики. Таким образом, одновременное образование прокариотических строматолитов, эукариотических строматолитов и тромболитов в идентичных условиях в нынешних условиях представляется маловероятным. Мы предполагаем, что прокариотические строматолиты представляют собой формы, которые начали развиваться в приливной среде с голоценовым затоплением Большой Багамской банки.Однако тромболиты начали формироваться в нынешних нормальных морских сублиторальных условиях. Эукариотические строматолиты представляют собой промежуточные формы между прокариотическими строматолитами и тромболитами. Имеются данные о постепенном переходе от строматолитовых к тромболитовым рифам, связанным с повышением уровня моря. По мере углубления произошло бы уменьшение солености, увеличение энергии и, возможно, увеличение поступления питательных веществ; все факторы, способствующие росту тромболитов. Мы предполагаем, что сосуществующие строматолиты и тромболиты, обнаруженные у острова Ли Стокинг, не росли одновременно, а отражали реакцию на изменение экологического контроля с изменением уровня моря.
Мы предполагаем, что сосуществующие строматолиты и тромболиты, обнаруженные у острова Ли Стокинг, не росли одновременно, а отражали реакцию на изменение экологического контроля с изменением уровня моря.
CSIRO ИЗДАТЕЛЬСТВО | Морские и пресноводные исследования
Консорциумы микробов в отложениях водно-болотных угодий: анализ биомаркеров воздействия гидрологического режима, вегетации и сезона на бентосные микробы
П. И. Бун, П. Вирту и П. Д. Николс47 (1) стр. 27 — 41
Круговорот углерода на заболоченных территориях Австралии: важность метана
Бун Пол I.
Труды SIL, 1922-2010. 2000 27 (1). стр.37
Связь потоков метана с колебаниями растительного покрова и уровня грунтовых вод на уровне микросайта: модельное исследование
Кеттунен Ану
Глобальные биогеохимические циклы. 2003 17 (2). п.н / д
Аэробные гаммапротеобактериальные метанотрофы снижают выбросы метана из кислородных и бескислородных озерных вод
Освальд Кирстен,
Милуцкая Яна,
Бренд Андреас,
Хач Филипп,
Литтманн Стен,
Верли Бернхард,
Кайперс Марсель М.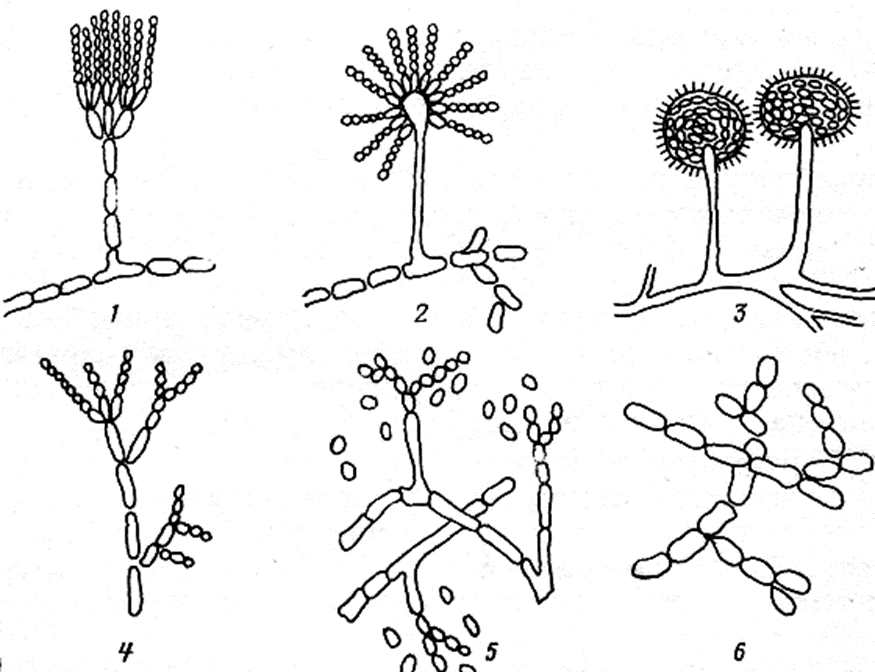 М., Шуберт Карстен Дж.
М., Шуберт Карстен Дж.
Лимнология и океанография. 2016 61 (S1). п.S101
Первый общий синтез и противопротозойная активность (Z) -17-метил-13-октадеценовой кислоты, новой морской жирной кислоты из губки Polymastia penicillus
Карбаллейра Нестор М., Монтано Нэшбли, Баланья-Фус Рафаэль, Prada Кристофер Фернандес
Химия и физика липидов. 2009 161 (1). стр.38
Общий рекорд фотосинтетической биомассы между 9400 и 2200 л.н. и его связь с изменениями температуры на участке высокой Арктики недалеко от Ню-Олесунн, Шпицберген
Ян Чжункан, Ван Цзяньцзюнь, Юань Линьси, Ченг Вэньхань, Ван Юйхун, Се Чжоуцин, Сунь Лигуан
Полярная биология. 2019 42 (5).стр.991
Экологическое воздействие плотин, водозабора и управления реками на пойменные заболоченные земли в Австралии
Кингсфорд Р.
Austral Ecology. 2000 25 (2). стр.109
стр.109
Идентификация и характеристика экологически значимых прокариот в донных отложениях пресноводных озер: молекулярные и культуральные исследования
Весна Стефан, Шульце Ренате, Оверманн Йорг, Шлейфер Карл-Хайнц
Обзоры микробиологии FEMS. 2000 24 (5). стр.573
Изменение экосистемы голоцена в лагуне Литл-Лланготлин, Австралия: последствия для управления водно-болотными угодьями, внесенными в список Рамсарской конвенции
Вудворд Крейг, Шульмейстер Джеймс, Завадски Атун, Ребенок Дэвид, Барри Линда, Хотчкис Майкл
Hydrobiologia. 2017 785 (1). стр.337
Сравнение термохимолиза и классических методов химической деградации и экстракции для анализа углеводов, лигнина и липидов в торфяном болоте
Юнес К., Грассе Л.
Журнал аналитического и прикладного пиролиза. 2018 134 стр.61
Экологические последствия колебаний уровня воды в озерах (2008 г. )
)
Ванцен Карл М., Джанк Вольфганг Дж., Ротхаупт Карл-Отто
Лимнология (2001)
Долгосрочное влияние гидрологического режима на структуру и функции микробных сообществ в донных отложениях речных водно-болотных угодий
Фулькье Арно, Волат Бернадетт, Нейра Марк, Борнетт Гудрун, Монтюэль Бернар
FEMS Microbiology Ecology. 2013 85 (2). стр.211
Влияние гидрологического режима на бактериальное разнообразие отложений и структуру сообществ в озере Султанпур, Гуруграм, Харьяна
Бхат Сандхья, Пампош
Серия конференций IOP: Наука о Земле и окружающей среде. 2020 612 (1). п.012021
Увязка почвенного процесса и микробной экологии в экосистемах пресноводных водно-болотных угодий
Гуткнехт Джессика Л.М., Гудман Роберт М., Бальсер Тери С.
Растения и почва. 2006 289 (1-2). стр.17
Синтез новой концептуальной модели для облегчения управления озерами временного бассейна дефляции
Гоун Бен, Шольц Оливер
Озера и водохранилища: наука, политика и управление в целях устойчивого использования.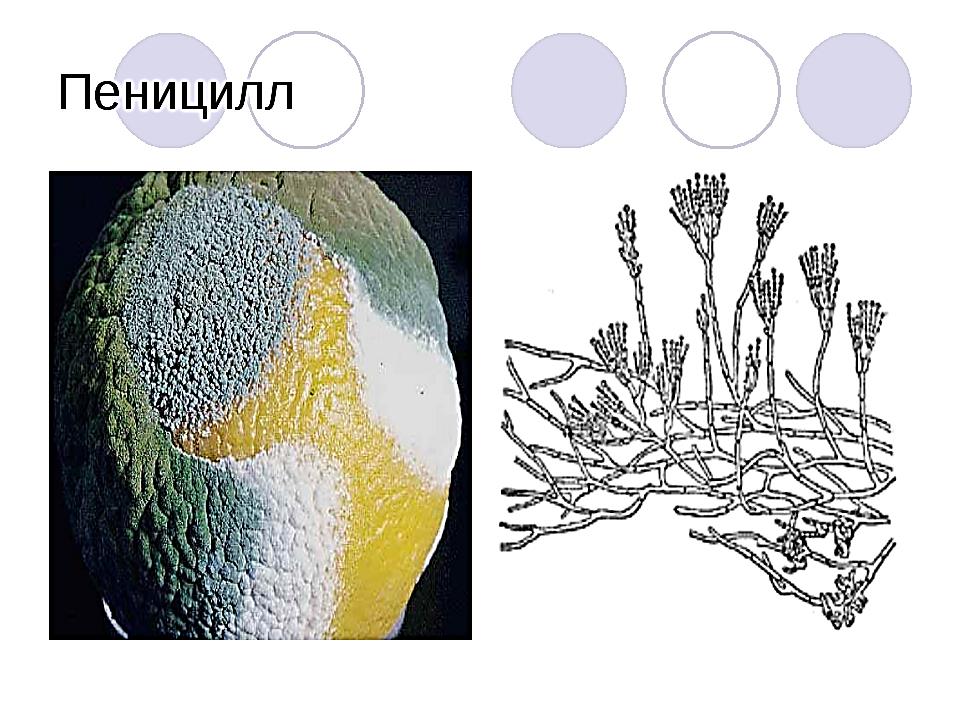 2006 11 (3).стр.177
2006 11 (3).стр.177
Достижения в области микробной экологии (2000)
Френзель Питер
Расширение концепции паводковых импульсов (FPC) для озер
Ванцен Карл М., Джанк Вольфганг Дж., Ротхаупт Карл-Отто
Hydrobiologia. 2008 613 (1). стр.151
Восстановление экосистемы водно-болотных угодий: путь к устойчивой окружающей среде (2020)
Гупта Говинд, Хан Джаббар, Упадхьяй Атул Кумар, Сингх Навин Кумар
Ответ микробов с течением времени на гидрологические процедуры и удобрения в смоделированных влажных прериях
Ментцер Джессика Л, Гудман Роберт М., Бальсер Тери С.
Растения и почва. 2006 284 (1-2). стр.85
Бактерии в гелевых пробах: сравнение активности иммобилизованных сульфатредуцирующих бактерий с сульфатредукцией in situ в отложениях заболоченных земель
Эденборн Гарри М., Брикетт Линн А.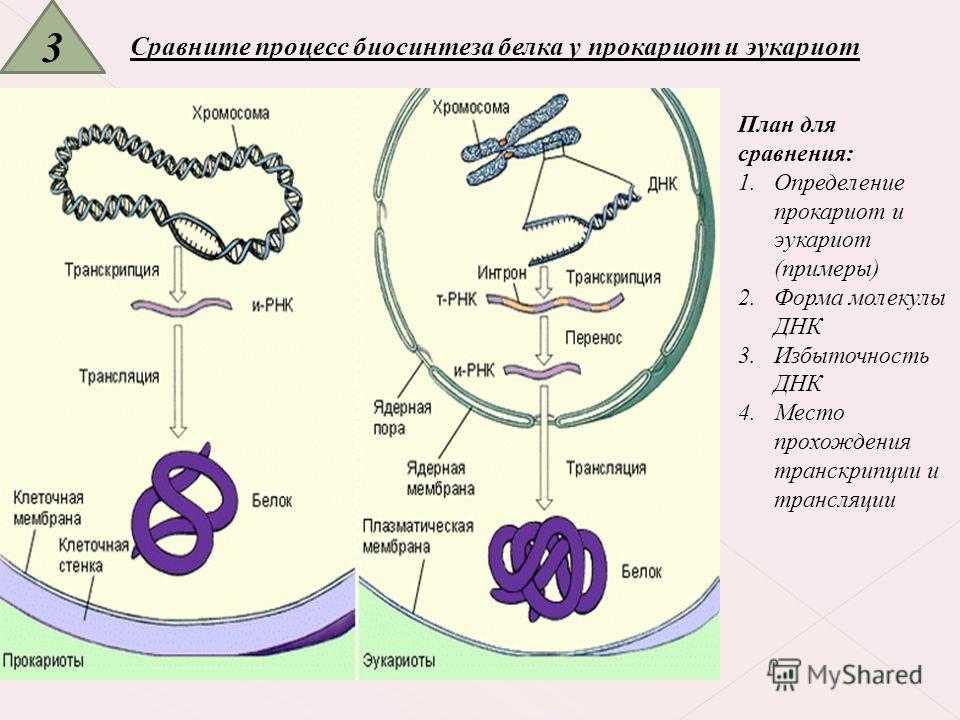
Журнал микробиологических методов. 2001 46 (1). стр.51
Первые полные синтезы (Z) -15-метил-10-гексадеценовой кислоты и (Z) -13-метил-8-тетрадеценовой кислоты
Карбаллейра Нестор М., Монтано Нэшбли, Падилья Луис Ф.
Химия и физика липидов. 2007 145 (1). стр.37
Прокариоты (2006)
Боуман Джон
Энциклопедия микробиологии окружающей среды (2003)
Николс Питер Д., Николс Кэрол А.Манкузо
Структуры микробных сообществ в отложениях бескислородных пресноводных озер вдоль градиента загрязнения металлами
Гоф Хайди Л., Шталь Давид А.
Журнал ISME. 2011 5 (3). стр.543
Экологическое воздействие плотин, водозабора и управления реками на пойменные заболоченные земли в Австралии
Кингсфорд Р.Т.
Austral Ecology. 2000 25 (2). стр.109
Изменения в структуре микробного сообщества донных отложений в большом водохранилище во время чрезвычайной просадки
Боулдинг А. Н.,
Рис Г. Н.,
Болдуин Д. С.,
Сутер П. Дж., Уотсон Г. О.
Н.,
Рис Г. Н.,
Болдуин Д. С.,
Сутер П. Дж., Уотсон Г. О.
Морские и пресноводные исследования. 2008 59 (10). стр.890
Одновременная оценка микробных фосфолипидных жирных кислот и диэфирных липидов методом капиллярной газовой хроматографии
Добродетель Патти, Николс Питер Д., Бун Павел I.
Журнал микробиологических методов. 1996 25 (2). стр.177
Источники органического вещества и структура микробного сообщества в отложениях гавани Вишакхапатнам, восточное побережье Индии
Харджи Ранджита Р., Бхосле Нараян Б., Гарг Анита, Савант Субхаш С., Венкат Кришнамурти
Химическая геология. 2010 276 (3-4). стр.309
Состав растительности и структурные изменения микробного сообщества почвы вдоль гидрологического градиента водно-болотных угодий
Баласоория В. К., Денеф К., Питерс Дж., Верхоест Н. Э.К., Бёкс П.
Гидрология и науки о Земле. 2008 12 (1). стр.277
2008 12 (1). стр.277
Регуляторы производства метана в прибрежных водно-болотных угодьях и меры реагирования на смоделированные глобальные изменения
Вицца Кармелла, Вест Уильям Э., Джонс Стюарт Э., Харт Джулия А., Ламберти Гэри А.
Биогеонауки. 2017 14 (2). стр.431
Физико-химические и микробные свойства нор месторождения, питающегося талассинидовой креветкой-призраком Biffarius arenosus (Decapoda: Callianassidae)
Берд Ф.Л., Бун П.И., Николс П.Д.
Наука об эстуариях, прибрежных зонах и шельфе. 2000 51 (3). стр.279
Установка технологических водно-болотных угодий для удаления следов органических загрязнителей и патогенов из городских сточных вод
Джаспер Джастин Т., Нгуен Ми Т., Джонс Закэри Л., Исмаил Нивеен С., Седлак Давид Л., Острый Джонатан О., Люти Ричард Г., Хорн Алекс Дж., Нельсон Кара Л.
Инженерные науки об окружающей среде. 2013 30 (8). стр.421
2013 30 (8). стр.421
Вариабельность очистки сточных вод водно-болотных угодий в холодном климате
Веркер А.Г., Догерти Дж. М., МакГенри Дж. Л., Ван Лун В. А.
Экологическая инженерия. 2002 19 (1). стр.1
Методы биомаркеров для выявления бактерий, продуцирующих полиненасыщенные жирные кислоты
Николс Дэвид С., МакМикин Том А.
Журнал микробиологических методов. 2002 48 (2-3).стр.161
Органический фосфор в водной среде
Болдуин Даррен С.
Химия окружающей среды. 2013 10 (6). стр.439
Влияние низких температур на воспроизводство летних и многолетних коловраток из регионов с умеренным климатом: последствия для экологии и жизненного цикла
Гилберт Джон Дж.
Водная экология. 2020 54 (3). стр.711
Профили жирных кислот являются биомаркерами использования рыб в среде обитания в экосистеме река-пойма
Грубый Нил П. ,
Трушенски Джесси Т., Уитледж Грегори В.
,
Трушенски Джесси Т., Уитледж Грегори В.
Hydrobiologia. 2016 773 (1). стр.63
Устойчивые климатические действия и управление водными ресурсами (2021 г.)
Бхат Сандхья, Пампош
Кислота гра обитания морских организмов: иллюстрация морского биоразнообразия
Барнатан Жиль
Oléagineux, Corps gras, Lipides. 2010 17 (4). стр.238
Взаимоотношения между растениями, почвами и микробными сообществами вдоль гидрологического градиента в Пайнелэндс Нью-Джерси, США
Ю Шен, Эренфельд Джоан Г.
Летопись ботаники. 2010 105 (1). стр.185
Руководство Берджи по систематике архей и бактерий (2015)
Боумен Джон П.
Численность, активность и структура сообщества пелагических метанокисляющих бактерий в озерах умеренного пояса
Сунд Ингвар, Баствикен Дэвид, Транвик Ларс Дж.
Прикладная и экологическая микробиология. 2005 71 (11). стр.6746
2005 71 (11). стр.6746
Концепции и споры в области экологии приливных болот (2002)
Керкхоф Ли, Скала Дэвид Дж.
Гидрология отражается в функционировании и составе сообществ метанотрофов в прибрежных водно-болотных угодьях бореального озера
Сильянен Анри М.П., Саари Энн, Краузе Саша, Ленсу Ансси, Эйбелл Гай Си Джей, Бодроссы Левенте, Боделье Пауль Л.Э., Мартикайнен Пертти Дж.
FEMS Microbiology Ecology. 2011 75 (3). стр.430
Профиль липидов микробов и экзополисахариды: опыт начат с профессором Дэвидом Уайтом и доставлен в Тасманию, Австралия
Николс Питер Д., Манкузо Николс Кэрол А.
Журнал микробиологических методов. 2008 74 (1). стр.33
Реакция детритных хлопьев и микробных биомаркеров почвы на активное управление питательными веществами Флорида Эверглейдс
Беллинджер Брент Дж.,
Хагерти Скот Э.,
Ньюман Сьюзен, повар Марк И.
Микробная экология. 2012 64 (4). стр.893
Композиции, изотопные натуральные для гетеротрофов и детерминация органических биоразлагаемых органических веществ
Créach Véronique, Бертру Жорж, Мариотти Андре
Comptes Rendus de l’Académie des Sciences — Series III — Sciences de la Vie. 1997 320 (4). стр.339
Использование анализа жирных кислот фосфолипидов для измерения воздействия кислотного дренажа горных пород на микробные сообщества в отложениях
Бен-Дэвид Э.А., Холден П.Дж., Стоун Д.Дж.М., Харч Б.Д., Фостер Л.Дж.
Микробная экология. 2004 48 (3). стр.300
Липиды в пресноводных экосистемах (1999)
Наполитано Гильермо Э.
Мелкомасштабная пространственная изменчивость химических и биохимических свойств почвы в повторно заболоченном деградированном торфянике
Негасса Вакене, Баум Кристель, Шлихтинг Андре, Мюллер Юрген, Лайнвебер Петер
Границы науки об окружающей среде.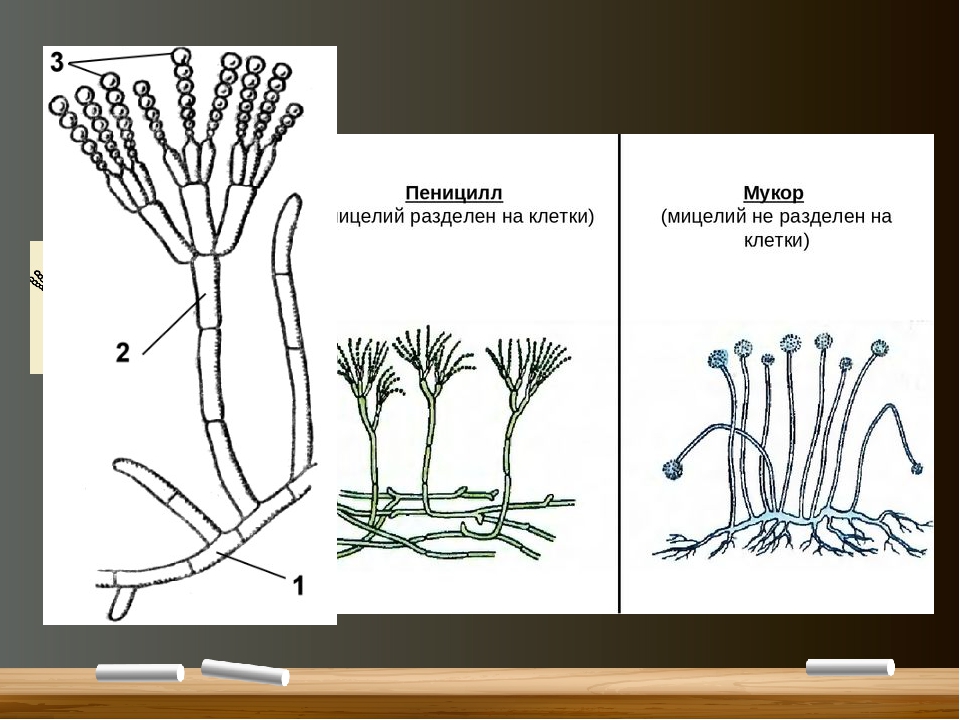 2019 7
2019 7
Связи между сообществами донных микробов и пресноводных насекомых в рвах деградированных торфяников
Уотли Меррин Х., ван Лун Э. Эмиэль, Черли Кьяра, Вонк Дж. Арье, ван дер Гест Харм Г., адмирал Вим
Экологические индикаторы. 2014 46 стр. 415
Роль грапсидных крабов, Parasesarma erythrodactyla, в проникновении листьев мангрового дерева в пищевую сеть эстуариев: исследование мезокосма
Нерот Кэролайн, Мезиан Тарик, Провост-Говрич Анаис, Рыбарчик Эрве, Ли С.Yip
Морская биология. 2009 156 (11). стр.2343
Руководство Берджи по систематике архей и бактерий (2015)
Боумен Джон П.
Реакция структуры микробного сообщества на естественную и ускоренную смену гидрархов в бореальных водно-болотных угодьях на севере Хоккайдо, Япония
Акияма Масару, Симидзу Сатору, Ишидзима Ёдзи, Наганума Такеши
Лимнология. 2010 11 (3). стр.273
2010 11 (3). стр.273
Ответ бактериальных внеклеточных ферментов на затопление пойменных отложений
Бернс А., Райдер Д. С.
Пресноводная биология. 2001 46 (10). стр.1299
Экспериментальные диетические манипуляции для определения относительной важности аллохтонных и автохтонных пищевых ресурсов в тропических водотоках
ЛА ДЭННИ К.П., ЛЕЙНГ КЕННЕТ М.Ю., ДАДЖОН ДЭВИД
Пресноводная биология. 2007 0 (0). p.071010211532001
На свойства почвы водно-болотных угодий и местные бактериальные сообщества влияют изменения высоты
Ли Филип О., Сапожник Кори, Олсон Джули Б.
Водно-болотные угодья. 2019 39 (1).стр.99
Разнообразие микробных сообществ как потенциальный биоиндикатор стоков AMD и сталелитейных заводов в водно-болотных угодьях дна долины с канализацией
Стаебе К.,
Ботес М.,
Мадлала Т.,
Оберхолстер П. Дж., Клоэте Т. Э.
Дж., Клоэте Т. Э.
Загрязнение воды, воздуха и почвы. 2018 229 (12).
Развитие сифонной зеленой водоросли Penicillus и состояние Espera
Ботанический журнал Линнеевского общества, 74: 189-214.С 5 пластинами и 4 фигурами
Апрель 1977 г.
Развитие сифонной зеленой водоросли Penicillus и штата Эспера
EI FRIEDMANN, FLS AND WC ROTH
Департамент биологических наук, Университет штата Флорида, Таллахасси, Флорида 32306 США A Принято к публикации Сентябрь I976
Слоевище Penicillus состоит из двух типов волокон: осевых волокон неопределенного роста и боковых волокон определенного роста.При вегетативном размножении новые растения возникают из горизонтальных ризоидов.В развитии можно выделить четыре стадии. На стадии прирнордиума кончик ризоида набухает и образует зачаток. На стадии прорастания восходящие и нисходящие осевые нити возникают из зачатка, первые вырастают в пучок и дают начало боковым мешковидным ветвям, каждая из которых образует восходящую и нисходящую ветви, а затем ветви в ризоидные веточки. Вместе эти конструкции составляют основу ножки. При этом нисходящие осевые филаменты удлиняются и становятся главными ризоидальными филаментами с боковыми ризоидальными веточками.В ранней ювенильной стадии формируется ножка. Удлиняющиеся восходящие осевые нити образуют мозговое вещество, а их боковые стороны образуют кору. В поздней ювенильной стадии осевые нити образуют головку.
Вместе эти конструкции составляют основу ножки. При этом нисходящие осевые филаменты удлиняются и становятся главными ризоидальными филаментами с боковыми ризоидальными веточками.В ранней ювенильной стадии формируется ножка. Удлиняющиеся восходящие осевые нити образуют мозговое вещество, а их боковые стороны образуют кору. В поздней ювенильной стадии осевые нити образуют головку.
В состоянии Espera Penicillus отсутствует ножка, поскольку восходящие осевые волокна не соединяются в пучок. Эспера была выращена в лабораторных культурах из растений Penicillus, собранных в Карибском регионе, а также редко встречается в природе в этой области. Это состояние может быть реакцией на стресс окружающей среды.
Обсуждается уплощение талломов и их ориентация перпендикулярно направлению волн.
Сравнение Penicillus и Codium показывает, что у многоосных Eusiphoniidae существует по крайней мере два типа развития.
КЛЮЧЕВЫЕ СЛОВА: — Eusiphoniidae — морфология развития, Penicillus — состояние Espera.
СОДЕРЖАНИЕ
Введение. . . . . . . . . . . . . . . . . . . . . . Материалы и методы . . . . . . . . . . . . . . . . . . . Результаты .. . . . . . . . . . . . . . . . . . . . . .
Ризоиды. . . . . . . . . . . . . . . . . . . . . Первородная стадия. . . . . . . . . . . . . . . . . . Стадия зародыша. . . . . . . . . . . . . . . . . . . Ранняя ювенильная стадия. . . . . . . . . . . . . . . . . . Поздняя ювенильная стадия. . . . . . . . . . . . . . . . . . Влияние окружающей среды, симметрия и ориентация слоевища. . . . . . . Государство Эсперо. . . . . . . . . . . . . . . . . . . Морфологическая пластичность. . . . . . . .. . . . . . . .
190 193 193 193 196 196 201 202 203 204 208
* Представлено У. К. Р. в частичном выполнении требований для получения степени доктора
14 189 Философия в Университете штата Флорида.
190 E. I. FRIEDMANN AND W.C. ROTH
Обсуждение. . . . . . . . . . . . . . . . . . . . . . 208 Конструкционные элементы. . . . . . . . . . . . . . . . . . 208 Морфологические области и области развития слоевища.. . . . . . 209 Симметрия и волновое действие. . . . . . . . . . . . . . . 209
. . . . . . . . . . . . . . . . . 208 Морфологические области и области развития слоевища.. . . . . . 209 Симметрия и волновое действие. . . . . . . . . . . . . . . 209
Esperu и другие морфологически редуцидные формы Caulerpaies. . . . . 210
Развитие у Penicillus и Codium. . . . . . . . . . . . 21 1 Примечание по таксономии. . . . . . . . . . . . . . . . . 212
Список литературы. . . . . . . . . . . . . . . . . . . . . . 212
Штат Эспера. . . . . . . . . . . . . . 209 Филогенетические соображения. . . . . . . . . . . . .. . 21 1
Благодарности. . . . . . . . . . . . . . . . . . . . 212
ВВЕДЕНИЕ
Морфологически сложная структура Penicillus (Udoteaceae, Caulerpales, Eusiphoniidae), состоящая из переплетенных ценоцитарных филаментов, представляет собой нетрадиционный тип организации слоевища у растений. Эта бентическая морская водоросль имеет пантропическое распространение: четыре вида встречаются в Карибском море и по одному в Средиземном море, на Малайском архипелаге, а также на западе и севере Австралии.
Для облегчения понимания метода лечения здесь приводится краткое описание зрелого таллома Penicillus.
Тело Penicillus (рис. 1, табл. 1) состоит из трех морфологически обособленных областей: основания, ножки и головки. Основание включает ризоидальную систему, состоящую из основных ризоидальных нитей и тонких боковых ветвей (рис. 1E), и основание ножки (структурно отчетливая часть ножки, погруженная в субстрат).Ножка цилиндрическая или несколько сжатая. В центре ножки находится продолговатый мозг, состоящий из продольно ориентированных, разветвленных и переплетенных нитей. Эти медуллярные нити несут разветвленные боковые ветви, которые Воронин (1862) назвал кошками. Кошки образуют компактную кору (рис. 1D), внешняя поверхность которой кальцинирована. Головка состоит из пучка свободных и дихотомически разветвленных кальцифицированных волокон (рис. 1С).
Основной формой размножения Penicillus является вегетативное размножение ризоидами (рис.1Al-3), наблюдаемый Дюшассеном в 1850 году и подтвержденный несколькими недавними авторами (Colinvaux, Wilbur & Watabe, 1965; Colinvaux, 1968, 1972; Stockman, Ginsburg & Shinn, 1967; Roth, 1971; Meinesz, 1972a, 1973). Фалькенберг в 1879 г. сообщил о подобном размножении ризоидами близкородственного рода Udotea. В Penicillus Рот (1971) описал образование новых растений из восходящих и нисходящих нитей, которые возникают в результате набухания на концах ризоидов. Meinesz (1972a, 1973) опубликовал более подробное описание и иллюстрации этого процесса развития.
Фалькенберг в 1879 г. сообщил о подобном размножении ризоидами близкородственного рода Udotea. В Penicillus Рот (1971) описал образование новых растений из восходящих и нисходящих нитей, которые возникают в результате набухания на концах ризоидов. Meinesz (1972a, 1973) опубликовал более подробное описание и иллюстрации этого процесса развития.
Мало что известно о половом размножении Penicillus. Структуры, описанные Duchassaing (1850) и Woronin (1862), были порами в кальцинированной оболочке растения (Gepp & Gepp, 1911) или животного происхождения (Ernst, 1904). По-видимому, первое правильное наблюдение за половым размножением у Penicillus было сделано Агардом, который в 1890 году описал fila comae apice inflata et hoc apices endochromate atrovirente farctos (кома1 (= головчатые) нити, вздутые на концах, и эти кончики заполнены темно-зеленым пигментом) как репродуктивные структуры.Подобная форма воспроизводства впоследствии была
РАЗВИТИЕ PENICILL US (EUSIPHONIIDAE) 191
Рис. 1. Структура и стадии развития Penkillus cupitufus (полуидиаграмматика). A. Взрослое растение с горизонтальными главными ризоидальными нитями: A, h4, стадии развития; А и А, стадия прорастания; А ,, ювенильная стадия. x 1. Б. Состояние эсперы. x 1. C. Капитулярная нить. x 4. D. Структура ножки, показывающая медуллярные нити и боковые ветви (кошки), которые образуют кору.x 4. E. Участок вертикальной главной ризоидальной нити с боковыми ризоидальными веточками. x 20.
1. Структура и стадии развития Penkillus cupitufus (полуидиаграмматика). A. Взрослое растение с горизонтальными главными ризоидальными нитями: A, h4, стадии развития; А и А, стадия прорастания; А ,, ювенильная стадия. x 1. Б. Состояние эсперы. x 1. C. Капитулярная нить. x 4. D. Структура ножки, показывающая медуллярные нити и боковые ветви (кошки), которые образуют кору.x 4. E. Участок вертикальной главной ризоидальной нити с боковыми ризоидальными веточками. x 20.
обнаружено у близкородственного рода Uclotea (Yamada, 1934; Phillips, 1957; Nizamuddin, 1963; Moorjani, 1969; Meinesz, 1969, 1973) и недавно у Penicillus (Colinvaux, 1972, 1974; Meinesz, 1975). . Недостаток информации о половом размножении Penicillus может указывать на то, что это явление нечасто встречается в природе.
Своеобразная форма в истории жизни Penicillus в Средиземном море была описана Decaisne (1842) как Espera rnediterrunea (рис.1Б). Этот завод
192 E.I. ФКИДМАНН И У.С. КОТ
Таблица 1.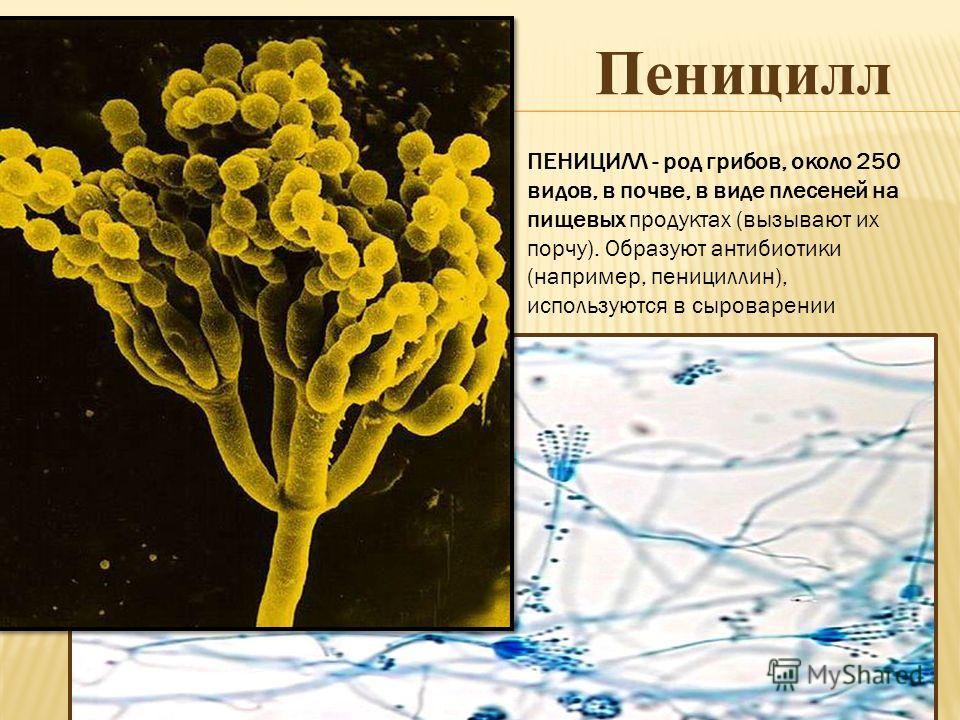 Зрелый Penicillus dumetosus (собранный в природе) с двумя молодыми растениями, полученными в культуре из ризоидов. Слева: ранняя ювенильная стадия (также проиллюстрирована на фото 2G). Правильно; стадия прорастания. x 2.
Зрелый Penicillus dumetosus (собранный в природе) с двумя молодыми растениями, полученными в культуре из ризоидов. Слева: ранняя ювенильная стадия (также проиллюстрирована на фото 2G). Правильно; стадия прорастания. x 2.
РАЗВИТИЕ PENZCILLUS (EUSIPI-IONIIDAE) 193
состоит из прямых, дихотомически разветвленных, кальцинированных нитей, подобных головным нитям Penicillus, и которые происходят из основной массы ризоидов.Следуя предположению Воронина (1862) о том, что эспера представляет собой ювенильную стадию развития Penicillus, Турет (в Bornet, 1892) перевел эсперу на Penicillus как P. mediterraneus. Гепп и Гепп (1911), Хамель (1928) и Оливье (1929) также рассматривали эсперу как стадию развития стипитата Penicillus. Согласно Huvt & Huvk (1964), средиземноморское растение является аналогом карибского Penicillus capitatus, отличаясь от последнего только наличием формы Espera.Однако формы Espera у карибских видов Penicillus наблюдались в культуре (Roth & Friedmann, 1973), а недавно и в природе (Roth & Friedmann, 1976).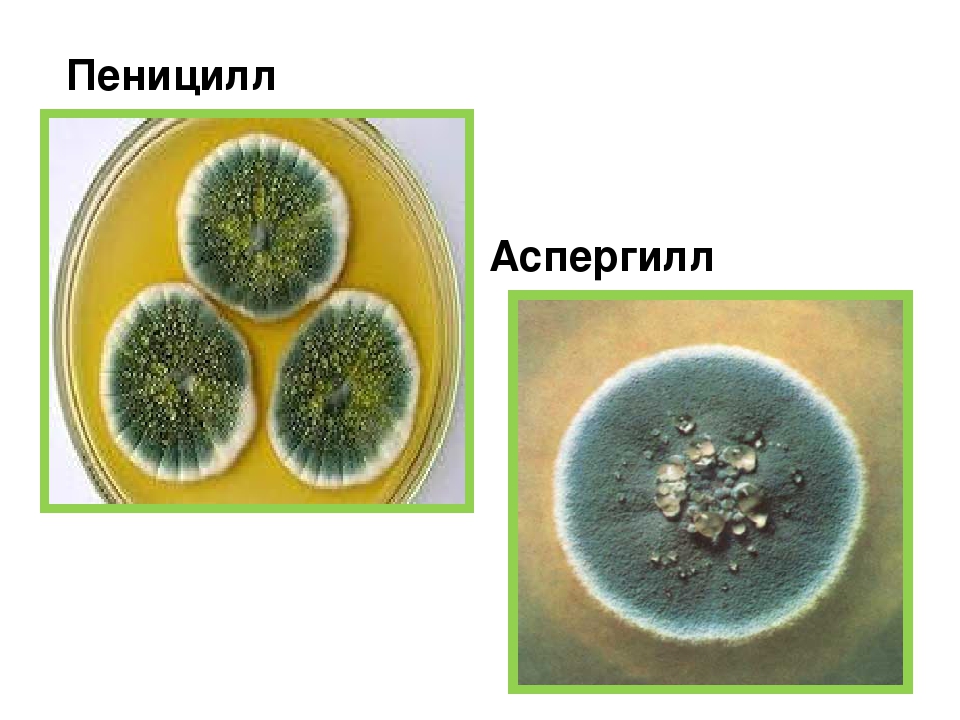 Майнес (1972a, 1973) показал, что эспера — это не стадия в последовательности развития, а, скорее, состояние, которое может появиться в истории жизни водоросли. Также описание Харви (1858 г.) австралийского Penicillus nodulosus Blainv. сильно указывает на наличие у этого вида состояния эсперы.
Майнес (1972a, 1973) показал, что эспера — это не стадия в последовательности развития, а, скорее, состояние, которое может появиться в истории жизни водоросли. Также описание Харви (1858 г.) австралийского Penicillus nodulosus Blainv. сильно указывает на наличие у этого вида состояния эсперы.
Настоящее исследование основано на четырех карибских видах Penicillus: P.capitatus Lmk., P. dumetosus (Lamour.) Blainv., P. pyriformis Gepp и P. lamourouxii Dcne. Поскольку стадии развития у этих видов по существу одинаковы, материал для иллюстрации был выбран из всех четырех видов. Время от времени проводились наблюдения за родственными Rhipocephalus oblongus (Dcne.) Kiitz., R. phoenix (Ell. & Solan.) Kiitz. И Udotea conglutinata (Ell. & Solan.) Lamour
Эта статья является частью серии по биологии Penicillus. Более ранние статьи касались наличия кристаллов оксалата кальция в вакуоме (Friedmann, Roth, Turner & McEwen, 1972) и тонкой структуры капитулярных волокон (Turner & Friedmann, 1974).


 Плесневые налеты на субстратах образуются обычно грибами нескольких видов одновременно. Питание пеницилла осуществляется за счет всасывания готовых органических веществ, поэтому пеницилл, как и все плесени, относится к грибам-паразитам. Некоторые виды пенициллов обладают патогенными свойствами по отношению к человеку, растениям и животным. Большой ущерб хозяйству наносится при размножении гриба с образованием плесени на пищевых и сельскохозяйственных продуктах. Заплесневение кормов при неправильном хранении может повлечь гибель животных после употребления их в пищу из-за накопления разных токсических продуктов.
Плесневые налеты на субстратах образуются обычно грибами нескольких видов одновременно. Питание пеницилла осуществляется за счет всасывания готовых органических веществ, поэтому пеницилл, как и все плесени, относится к грибам-паразитам. Некоторые виды пенициллов обладают патогенными свойствами по отношению к человеку, растениям и животным. Большой ущерб хозяйству наносится при размножении гриба с образованием плесени на пищевых и сельскохозяйственных продуктах. Заплесневение кормов при неправильном хранении может повлечь гибель животных после употребления их в пищу из-за накопления разных токсических продуктов. Затем выращивают пенициллин по способу погруженных культур в особых ферментаторах объемом в несколько тысяч литров. После извлечения пенициллина из культуральной жидкости проводится его обработка органическими растворителями и растворами солей до получения конечного продукта – натриевой или калиевой соли пенициллина.
Затем выращивают пенициллин по способу погруженных культур в особых ферментаторах объемом в несколько тысяч литров. После извлечения пенициллина из культуральной жидкости проводится его обработка органическими растворителями и растворами солей до получения конечного продукта – натриевой или калиевой соли пенициллина. Пеницилл выделяет протеолитические и липолитические ферменты, оказывающие воздействие на молочные белки и жиры. Сыр под влиянием плесневых грибов приобретает маслянистость, рыхлость, характерный приятный вкус и запах.
Пеницилл выделяет протеолитические и липолитические ферменты, оказывающие воздействие на молочные белки и жиры. Сыр под влиянием плесневых грибов приобретает маслянистость, рыхлость, характерный приятный вкус и запах.