Особенности внешнего и внутреннего строения, покровов нематод (круглых червей) | Биология. Реферат, доклад, сообщение, краткое содержание, лекция, шпаргалка, конспект, ГДЗ, тест
Раздел: Черви (Плоские, Круглые, Кольчатые)
Известно свыше 30 тыс. видов нематод. Обитают они преимущественно в почве и различных водоемах, приблизительно треть видов ведет паразитический образ жизни.
Для нематод характерна двусторонняя симметрия тела. Само тело округлое в поперечном сечении, что и обусловило еще одно название этого типа — Круглые черви. Размеры нематод варьируют от долей миллиметра (например, у обитателей почв) до 8 м (у паразита плаценты кашалота).
Покровы нематод — кожно-мускульный мешок. Клетки покровного эпителия выделяют наружу многослойную кутикулу — плотное неклеточное образование. Нематоды передвигаются, поочередно сокращая спинные и брюшные полоски мышц.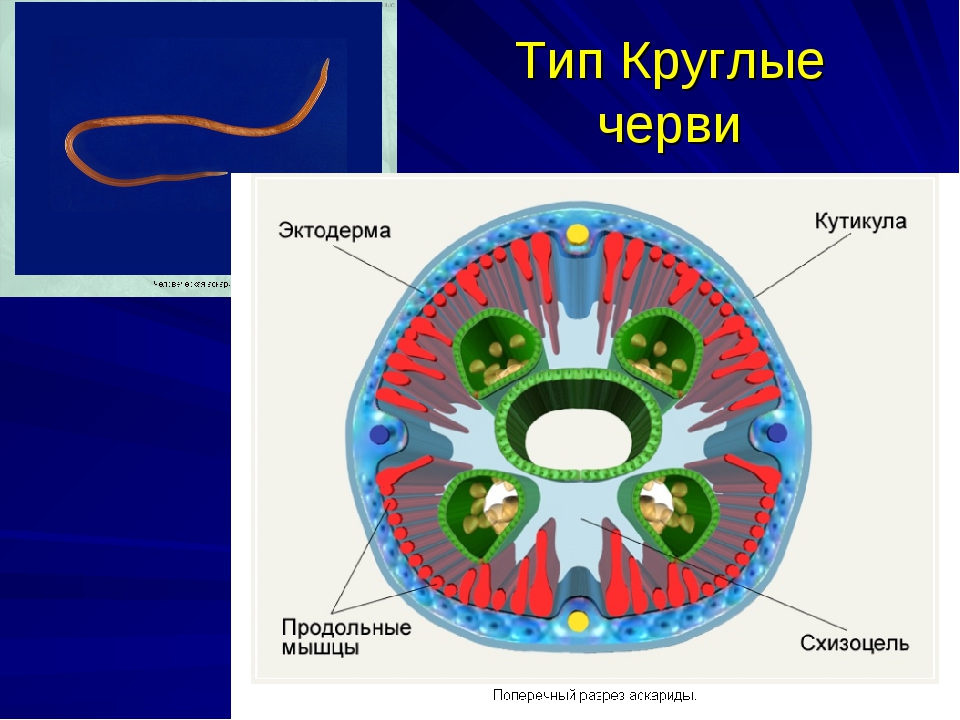 При этом их тело волнообразно изгибается. Кутикула благодаря своей упругости разгибает тело, когда расслабляются мышцы. Она также защищает тело от повреждений твердыми частицами почвы, а также от воздействия вредных химических соединений окружающей среды, у паразитов — от пищеварительных соков хозяина.
При этом их тело волнообразно изгибается. Кутикула благодаря своей упругости разгибает тело, когда расслабляются мышцы. Она также защищает тело от повреждений твердыми частицами почвы, а также от воздействия вредных химических соединений окружающей среды, у паразитов — от пищеварительных соков хозяина.
Особенности внутреннего строения нематод (рис. 83). Между внутренними органами нематод находится первичная полость тела. Она характеризуется тем, что не имеет собственной выстилки, которая бы отделяла ее от внутренних органов и тканей. Жидкость, заполняющая полость тела, выполняет различные функции, в первую очередь, транспортную. Она переносит к различным тканям и органам питательные вещества, газы, а к органам выделения — конечные продукты обмена веществ. Таким образом, жидкость, заполняющая полость тела, выполняет функции крови, поскольку кровеносной системы у нематод нет. Находясь под давлением, она обеспечивает поддержание постоянной формы тела животного, выполняя функции
гидроскелета.
| Рис. 83. Строение нематод: 1 — внешний вид; 2 — внутреннее строение |
У нематод, по сравнению с плоскими червями, наблюдают такие усложнения организации: Материал с сайта http://worldofschool.ru
- их тело покрыто плотной кутикулой, которая надежно защищает внутренние органы и принимает участие в движении;
- появляется первичная полость тела, заполненная жидкостью; эта жидкость осуществляет транспорт питательных веществ и газов по организму, поддерживает форму тела;
Для строения нематод характерны такие признаки:
- тело удлиненное, двустороннесимметричное, округлое на поперечном срезе;
- покровы — кожно-мускульный мешок;
-
Внутреннее строение круглых червей
Какая форма тела у нематоды
Полостная жидкость нематод выполняет функцию
Круглые черви-внешний вид
Изучение особенностей покровов тела круглых червей
-
Какие усложнения организации наблюдают у нематод по сравнению с плоскими червями?
-
Что такое первичная полость тела?
Общая характеристика типа Круглые черви
Кто такие круглые черви?
Свободноживущие, или паразитические, трехслойные беспозвоночные с веретенообразным телом, у которых есть первичная полость тела.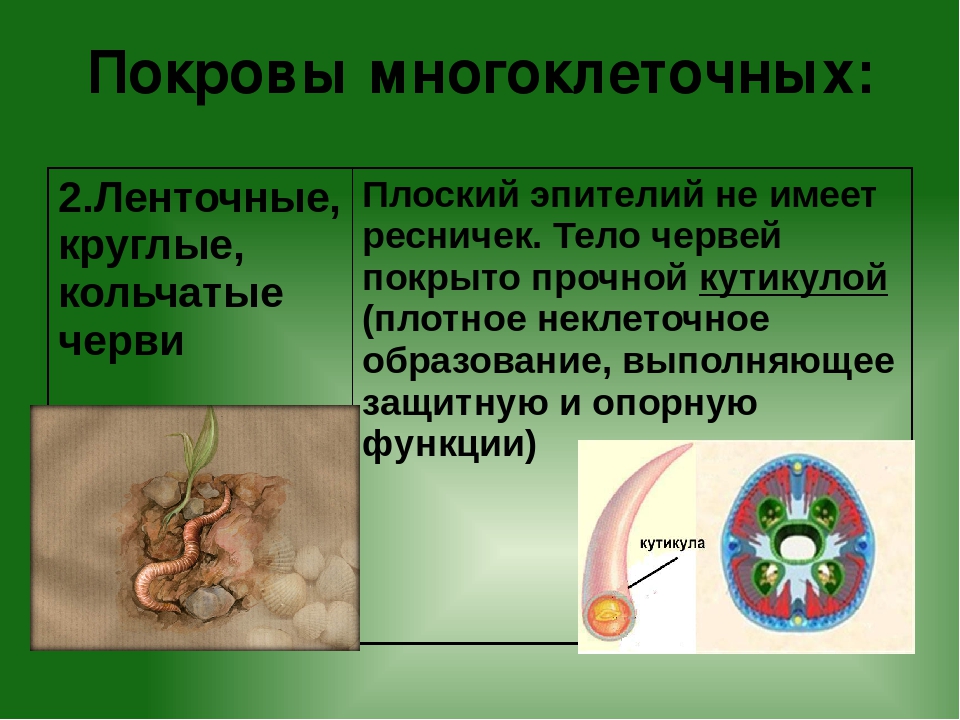 Они живут во всех основных водных и наземных средах. Среди круглых червей опасны паразиты животных и человека.
Они живут во всех основных водных и наземных средах. Среди круглых червей опасны паразиты животных и человека.
Особенности внешнего строения круглых червей
Форма тела и размеры
Тело круглых червей веретенообразное, имеет двустороннюю симметрию. Размеры варьируют в широких пределах — от долей миллиметра до 8 метров.
Покровы тела
Снаружи тело круглых червей скрыто кутикулой (слоем плотного вещества, образующего эпителий).
Особенности внутреннего строения круглых червей
Нематоды — трехслойные животные. Все их органы и ткани развиваются из трех зародышевых листков — энтодермы, мезодермы и эктодермы.
Между кожно-мускульным мешком и внутренними органами располагается первичная полость тела (пространство между органами, не имеет собственной выстилки из эпителиальной ткани). Как правило, полость тела заполнена жидкостью, находящейся под давлением и играет роль гидростатического скелета.
Опорно-двигательная система
Вместе с кутикулой и эпителием мышцы круглых червей образуют кожно-мускульный мешок. Мышечные волокна в большинстве видов расположены в виде продольных мышечных лент. Обычно их четыре.
Пищеварительная система
Дыхательная система
Отсутствует. Дышат всей поверхностью тела.
Кровеносная система
Отсутствует.
Выделительная система
Часто представлена кожными железами, в некоторых случаях такая же, как у плоских червей.
Нервная система
Состоит из окологлоточного нервного кольца и одного или нескольких продольных нервных стволов или мозгового ганглия с нервами, отходящими от него. Органы чувств развиты слабо.
Размножение
Большинство круглых червей раздельнополы.
Свободноживущие нематоды
По способу питания различают сапротрофы и хищных нематод. Сапротрофы питаются органическими остатками, находящиеся в почве или на дне водоемов, и участвуют в грунтотвирних процессах. Хищные нематоды являются активными регуляторами количества многих почвенных организмов, в том числе и других нематод. Свободноживущие нематоды являются кормом для многих организмов почв и водоемов.
Вопросы к ученикам
Что такое первичная полость тела?
Как устроена пищеварительная система круглых червей?
Как устроена нервная система круглых червей?
Примеры вопросов и заданий для самостоятельной работы учащихся
Опишите, как двигаются круглые черви.
Почему полость тела имеет для круглых червей большое значение? (Целом выполняет опорную (гидростатическое скелет), трофическую, дыхательную, выделительную и некоторые другие функции)
Сравните процессы пищеварения в плоских и круглых червей.
1 задание Обозначь верный ответ. Круглые черви имеют покровы… со щетинками кутикулу с ресничками 2…
 5 задание Выбери, какие из суждений верны. А. Аскарида относится к Типу Плоские черви. Б. Взрослая человеческая аскарида обитает в крови человека. 6 задание Отметь, какие из суждений верны. А. Плоские черви обладают лучевой симметрией. Б. Большинство Круглых червей — гермафродиты. 7 задание Найди признаки, соответствующие типу Круглые черви (запиши буквы, обозначающие верные признаки, в алфавитном порядке, без пробелов). Круглые черви — . В — не имеют кровеносной системы. Д — в пространстве между органами находится паренхима. Ж — нервная система узлового типа. П — кишечник заканчивается анальным отверстием. У — тело не разделено на сегменты. М — кишечник заканчивается слепо. 8 задание Выбери, в чём выражается приспособленность аскариды к обитанию в организме человека (запиши нужные буквы в алфавитном порядке, без пробелов): . У — хорошо развитая кровеносная система. Б — развитие личинки в теле хозяина. И — плотные покровы тела. Г — наличие двусторонней симметрии тела. П — наличие кожно-мускульного мешка.
5 задание Выбери, какие из суждений верны. А. Аскарида относится к Типу Плоские черви. Б. Взрослая человеческая аскарида обитает в крови человека. 6 задание Отметь, какие из суждений верны. А. Плоские черви обладают лучевой симметрией. Б. Большинство Круглых червей — гермафродиты. 7 задание Найди признаки, соответствующие типу Круглые черви (запиши буквы, обозначающие верные признаки, в алфавитном порядке, без пробелов). Круглые черви — . В — не имеют кровеносной системы. Д — в пространстве между органами находится паренхима. Ж — нервная система узлового типа. П — кишечник заканчивается анальным отверстием. У — тело не разделено на сегменты. М — кишечник заканчивается слепо. 8 задание Выбери, в чём выражается приспособленность аскариды к обитанию в организме человека (запиши нужные буквы в алфавитном порядке, без пробелов): . У — хорошо развитая кровеносная система. Б — развитие личинки в теле хозяина. И — плотные покровы тела. Г — наличие двусторонней симметрии тела. П — наличие кожно-мускульного мешка.
Биология. Тип Круглые черви — описание.
Тип Круглые черви
К типу Круглые черви, или Нематоды, относятся свыше 100000 видов трёхслойных двусторонне-симметричных животных с веретеновидной формой тела. В поперечном сечении тело круглых червей имеет форму круга.
Примеры круглых червей: аскарида, острица, коловратка.
Строение и жизнедеятельность
Важная особенность круглых червей — наличие первичной полости тела — щели между покровами и кишечником.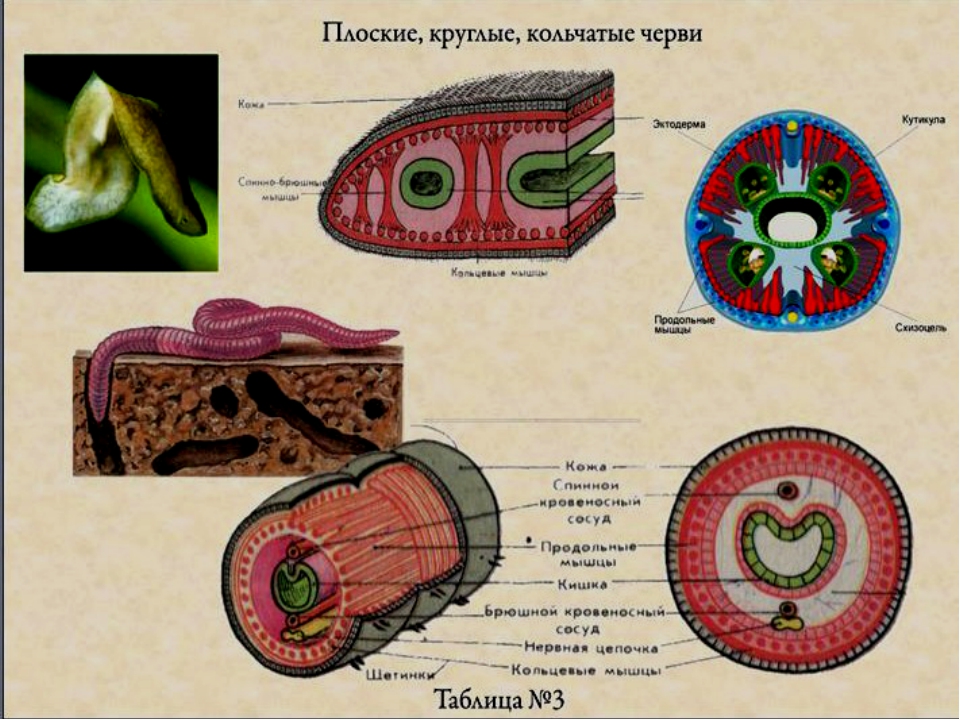 Первичная полость заполнена жидкостью, которая выполняет транспортную функцию, а давление жидкости в полости обеспечивает упругость тела, благодаря которой круглые черви могут зарываться в грунт.
Первичная полость заполнена жидкостью, которая выполняет транспортную функцию, а давление жидкости в полости обеспечивает упругость тела, благодаря которой круглые черви могут зарываться в грунт.
Покровы. Тело круглых червей сверху покрыто плотной девятислойной кутикулой, которая формируется из клеток покровного эпителия. Такая особенность покрова позволила круглым червям приспособиться к жизни в самых разнообразных условиях.
Движение. Передвигаются круглые черви лёжа на боку, благодаря сокращению продольных мышц, которые сгибают тело в спиннобрюшном направлении.
Питание. По краям рта расположены зубцы, служащие для измельчения пищи. Жидкость в первичнои полости оказывает давление и на стенки кишечника, поэтому пища в пищеварительный тракт закачивается под давлением. Роль насоса выполняет глотка. Пищеварительный тракт заканчивается анальным отверстием.
Выделение. Жидкие продукты выделяются одноклеточными железами во внешнюю среду, твёрдые — накапливаются в клетках, расположенных в полости тела.
Кровеносной и дыхательной систем у круглых червей нет.
Нервная система и органы чувств. Нервная система начинается с окологлоточного нервного кольца, от которого отходят несколько продольных стволов, соединённых поперечными перемычками. Ротовое отверстие окружено выростами, связанными с органами чувств — осязания и химического чувства.
Размножение. Круглые черви раздельнополы, оплодотворение внутреннее, очень плодовиты. Яйца покрыты плотной оболочкой, которая защищает их от неблагоприятных условий. Из яйца выходит личинка. Самки толще и длиннее самцов.
Образ жизни и значение в природе
Свободноживущие круглые черви освоили водоёмы и почву. Почвенные нематоды питаются остатками растений и животных, способствуют почвообразованию. Некоторые нематоды — хищники, питающиеся микроорганизмами и другими червями, некоторые употребляют в пищу и грибы. Имеются также и паразиты растений. Водные круглые черви являются пищей для рыб, почвенные — для хищных грибов.
Около 50 видов круглых червей могут паразитировать в организме человека, самые распространённые — аскарида и острица, живущие в кишечнике человека. Эти нематоды отравляют организм хозяина своими выделениями. Самка острицы, откладывая яйца вокруг заднего прохода человека, вызывает сильный зуд.
ТИП КРУГЛЫЕ ЧЕРВИ — ПОДЦАРСТВО МНОГОКЛЕТОЧНЫЕ
ТИП КРУГЛЫЕ ЧЕРВИ
Круглые черви являются многоклеточными трехслойными животными с билатеральной симметрией тела. Тело имеет цилиндрическую форму с круглым сечением на поперечном разрезе (отсюда и название типа). Сегментация тела отсутствует, но в большей степени, нежели у плоских червей, выражена цефализация (греч. kephale — голова) — сосредоточение на переднем конце тела жизненно важных органов. У круглых червей впервые появляется полость тела, т.е. обособленное пространство между стенкой тела (кожно-мускульный мешок) и внутренними органами (напомним, что у плоских червей это пространство заполнено рыхлой клетчаткой — паренхимой).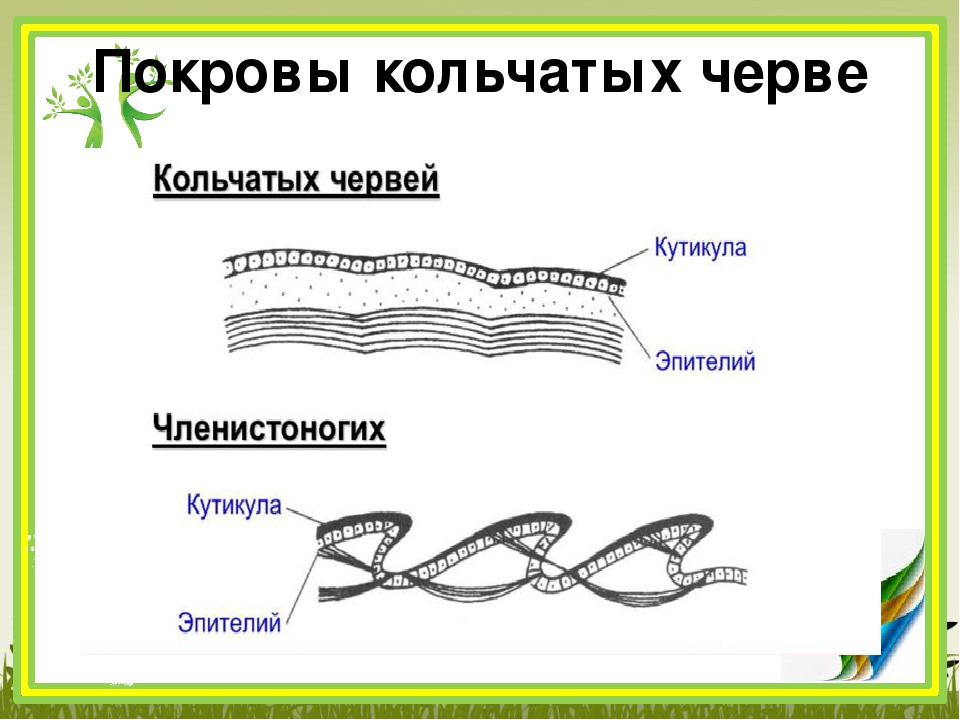 Полость тела у них является первичной (псевдоцель), поскольку эмбрионально происходит непосредственно из бластоцеля и представляет собой пространство между эктодермой (покровом тела) и энтодермой кишки. Появление полости чрезвычайно выгодно для животного. Во-первых, она заполнена жидкостью, по которой значительно более эффективно осуществляется диффузия веществ — питательных веществ от кишечника к тканям, продуктов распада от тканей к органам выделительной системы, кислорода от покровов тела к тканям, углекислого газа от тканей к поверхности тела и т. д. Во-вторых, будучи практически несжимаемой, заполняющая полость тела жидкость давит изнутри на его стенку, обеспечивая внутреннюю опору, т.е. действует как внутренний гидроскелет. Это обеспечивает сохранение постоянной формы тела червя.
Полость тела у них является первичной (псевдоцель), поскольку эмбрионально происходит непосредственно из бластоцеля и представляет собой пространство между эктодермой (покровом тела) и энтодермой кишки. Появление полости чрезвычайно выгодно для животного. Во-первых, она заполнена жидкостью, по которой значительно более эффективно осуществляется диффузия веществ — питательных веществ от кишечника к тканям, продуктов распада от тканей к органам выделительной системы, кислорода от покровов тела к тканям, углекислого газа от тканей к поверхности тела и т. д. Во-вторых, будучи практически несжимаемой, заполняющая полость тела жидкость давит изнутри на его стенку, обеспечивая внутреннюю опору, т.е. действует как внутренний гидроскелет. Это обеспечивает сохранение постоянной формы тела червя.
Как и у плоских, у круглых червей отсутствует дыхательная и кровеносная системы, поэтому газообмен идет через покровы тела, а транспорт веществ между тканями осуществляется посредством обычной диффузии через полостную жидкость. Однако имеются пищеварительная, выделительная (у некоторых представителей может отсутствовать), нервная и половая системы.
Однако имеются пищеварительная, выделительная (у некоторых представителей может отсутствовать), нервная и половая системы.
В пищеварительной системе у круглых червей появляется задняя кишка и анальное отверстие, которые отсутствовали у плоских червей. Как и передняя кишка, задняя имеет эктодермальное происхождение (напомним, что средняя кишка происходит из энтодермы). Благодаря этому пищеварительная система круглых червей значительно более совершенная и эффективная, чем у описанных ранее типов. Прежде всего, сквозная пищеварительная трубка дает возможность пищевым массам проходить по ней в одностороннем направлении, а не в двустороннем, как это происходит у плоских червей (напомним, что у них фекалии выводятся наружу через те же органы — переднюю и среднюю кишку, что и поступают пищевые частицы). Одностороннее передвижение веществ дает возможность различным отделам пищеварительной системы специализироваться.
Выделительная система развита относительно слабо. У разных представителей этого типа она представлена протонефридиями или видоизмененными кожными железами.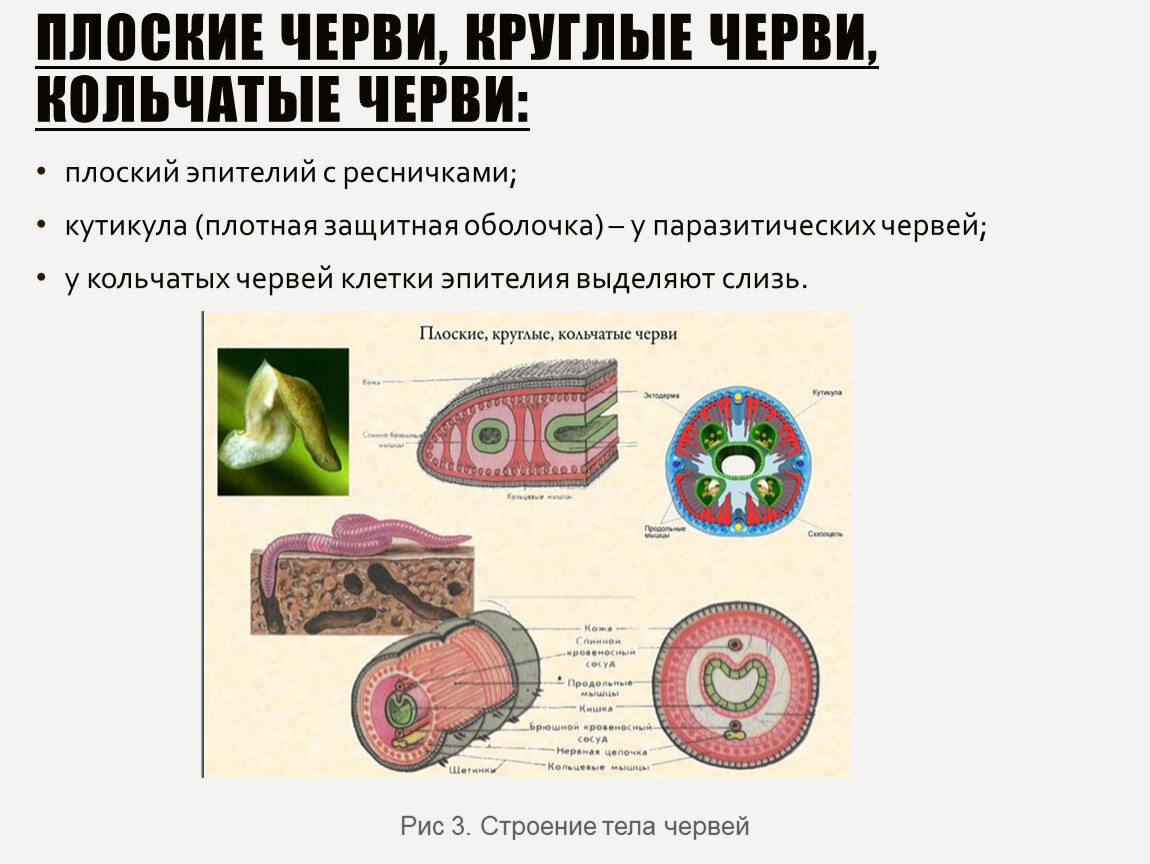 У некоторых форм органы выделения отсутствуют.
У некоторых форм органы выделения отсутствуют.
Нервная система ортогонального типа, состоит из окологлоточного нервного кольца и отходящих от него нервных стволов, которые связаны между собой многочисленными комиссурами. Отростки нервных клеток образуют эпителиальное сплетение. Органы чувств развиты слабо.
Половая система организована более просто, чем у плоских червей. Большинство круглых червей раздельнополые, причем обычно имеет место половой диморфизм.
Тип включает в себя классы: собственно круглые черви, брюхоресничные, киноринхи, волосатики и коловратки. Ниже мы подробно рассмотрим организацию класса собственно круглые черви.
кожных покровов | биология | Британника
покров , в биологии, сеть признаков, образующих покров организма. Покровы ограничивают тело организма, отделяя его от окружающей среды и защищая от посторонних предметов. В то же время он обеспечивает связь с внешним миром, позволяя организму жить в определенной среде.
Среди одноклеточных организмов, таких как бактерии и простейшие, покровы соответствуют клеточной мембране и любой секретируемой оболочке, которую производит организм.У большинства беспозвоночных животных слой (или слои) поверхностных (эпителиальных) клеток — часто с дополнительными секретируемыми покрытиями — составляет покров. У позвоночных пограничный покров — с множеством производных элементов, таких как чешуя, перья и волосы — принял сложность системы органов, покровной системы.
Покровы состоят из слоев, которые могут иметь одноклеточную толщину, как у многих беспозвоночных, или многоклеточную толщину, как у некоторых беспозвоночных и всех позвоночных.В каждом случае клетки, из которых состоят покровы, принадлежат к классу тканей, называемых эпителием, который у большинства животных называется эпидермисом. Под эпидермисом и снабжая его питательными веществами, является дерма. В дополнение к клеточным слоям покровы часто включают неклеточное покрытие или кутикулу, секретируемую эпидермисом. Такие покрытия встречаются у большинства беспозвоночных. Кожа позвоночных образовала множество видов желез и множество роговых структур, но на ней нет покрытий.
Такие покрытия встречаются у большинства беспозвоночных. Кожа позвоночных образовала множество видов желез и множество роговых структур, но на ней нет покрытий.
Широкое разнообразие кожных покровов позвоночных еще раз демонстрирует адаптивный характер покровов тела: от почти непробиваемого щита броненосца и густой пушистой шерсти арктического медведя до слизистого чешуйчатого покрова трески и исключительно гладкой кожи морской свиньи. У земноводных и рыб часто есть слизистые железы, которые смазывают их кожу и предотвращают переувлажнение и порчу. У рептилий толстая кожаная кожа, которая помогает уменьшить потерю воды и служит броней против врагов.Птицы используют свои перья — производные кожи — для полета и защиты своего тела. Волосатая или пушистая шубка многих наземных млекопитающих изолирует их, отводит воду и надежно защищает от травм.
Компоненты
Покровы одноклеточных организмов состоят из клеточной мембраны и любой оболочки, которую она выделяет. Практически все бактерии имеют внешнюю клеточную стенку, которая поддерживает форму и упругость клетки и обеспечивает защиту.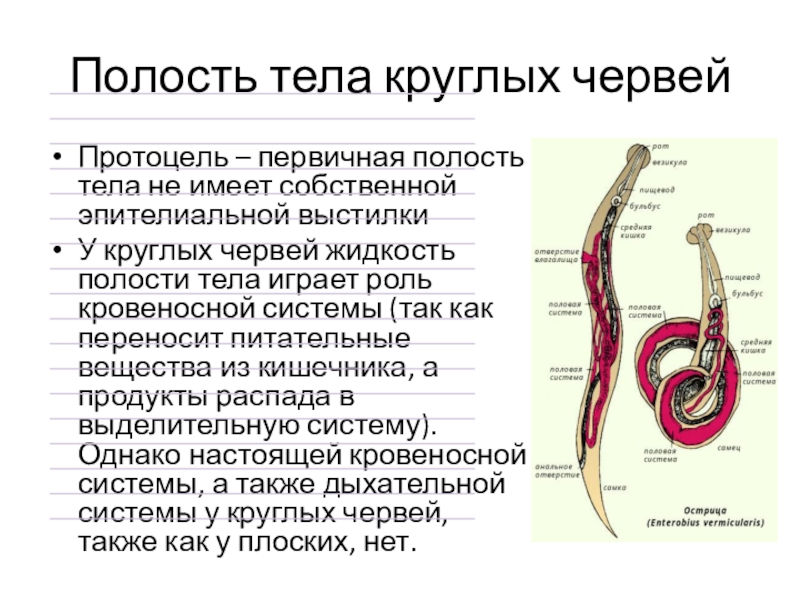 Однако у многоклеточных беспозвоночных есть единственный внешний слой эпителиальных клеток, и они могут секретировать различные поверхностные покрытия, начиная от слизистой оболочки книдарий (полипы, морские анемоны, медузы) и заканчивая жесткой кутикулой насекомых.Эпителиальный слой может включать в себя клетки нескольких типов, такие как сенсорные клетки, клетки желез и стрекательные клетки, а внешние поверхности могут нести микроворсинки, реснички или другие тонкие выступы. Кроме того, клетки могут образовывать наросты, такие как щетина, шипы, выступы и гребни.
Однако у многоклеточных беспозвоночных есть единственный внешний слой эпителиальных клеток, и они могут секретировать различные поверхностные покрытия, начиная от слизистой оболочки книдарий (полипы, морские анемоны, медузы) и заканчивая жесткой кутикулой насекомых.Эпителиальный слой может включать в себя клетки нескольких типов, такие как сенсорные клетки, клетки желез и стрекательные клетки, а внешние поверхности могут нести микроворсинки, реснички или другие тонкие выступы. Кроме того, клетки могут образовывать наросты, такие как щетина, шипы, выступы и гребни.
Прочность некоторых беспозвоночных животных, таких как кольчатые черви (дождевые черви, морские черви и пиявки) и некоторых моллюсков, зависит от растяжения водой отдельных клеток, образующих стенку тела.Во многих других формах твердые скелетные материалы откладываются либо внутри клеток, либо на внешней поверхности. Неклеточные покрытия покровов беспозвоночных чрезвычайно разнообразны по составу и размеру, и они пересекаются по таксономическим категориям. Эти жесткие структуры могут служить не более чем защитным панцирем, но у членистоногих, включая ракообразных, насекомых и пауков, многослойный и твердый покров образует экзоскелет, к которому прикреплены мышцы. У иглокожих экзоскелет находится ниже эпидермиса.
Эти жесткие структуры могут служить не более чем защитным панцирем, но у членистоногих, включая ракообразных, насекомых и пауков, многослойный и твердый покров образует экзоскелет, к которому прикреплены мышцы. У иглокожих экзоскелет находится ниже эпидермиса.
кожный покров | биология | Британника
покров , в биологии, сеть признаков, образующих покров организма. Покровы ограничивают тело организма, отделяя его от окружающей среды и защищая от посторонних предметов. В то же время он обеспечивает связь с внешним миром, позволяя организму жить в определенной среде.
Среди одноклеточных организмов, таких как бактерии и простейшие, покровы соответствуют клеточной мембране и любой секретируемой оболочке, которую производит организм.У большинства беспозвоночных животных слой (или слои) поверхностных (эпителиальных) клеток — часто с дополнительными секретируемыми покрытиями — составляет покров. У позвоночных пограничный покров — с множеством производных элементов, таких как чешуя, перья и волосы — принял сложность системы органов, покровной системы.
Покровы состоят из слоев, которые могут иметь одноклеточную толщину, как у многих беспозвоночных, или многоклеточную толщину, как у некоторых беспозвоночных и всех позвоночных.В каждом случае клетки, из которых состоят покровы, принадлежат к классу тканей, называемых эпителием, который у большинства животных называется эпидермисом. Под эпидермисом и снабжая его питательными веществами, является дерма. В дополнение к клеточным слоям покровы часто включают неклеточное покрытие или кутикулу, секретируемую эпидермисом. Такие покрытия встречаются у большинства беспозвоночных. Кожа позвоночных образовала множество видов желез и множество роговых структур, но на ней нет покрытий.
Широкое разнообразие кожных покровов позвоночных еще раз демонстрирует адаптивный характер покровов тела: от почти непробиваемого щита броненосца и густой пушистой шерсти арктического медведя до слизистого чешуйчатого покрова трески и исключительно гладкой кожи морской свиньи. У земноводных и рыб часто есть слизистые железы, которые смазывают их кожу и предотвращают переувлажнение и порчу. У рептилий толстая кожаная кожа, которая помогает уменьшить потерю воды и служит броней против врагов.Птицы используют свои перья — производные кожи — для полета и защиты своего тела. Волосатая или пушистая шубка многих наземных млекопитающих изолирует их, отводит воду и надежно защищает от травм.
У рептилий толстая кожаная кожа, которая помогает уменьшить потерю воды и служит броней против врагов.Птицы используют свои перья — производные кожи — для полета и защиты своего тела. Волосатая или пушистая шубка многих наземных млекопитающих изолирует их, отводит воду и надежно защищает от травм.
Компоненты
Покровы одноклеточных организмов состоят из клеточной мембраны и любой оболочки, которую она выделяет. Практически все бактерии имеют внешнюю клеточную стенку, которая поддерживает форму и упругость клетки и обеспечивает защиту. Однако у многоклеточных беспозвоночных есть единственный внешний слой эпителиальных клеток, и они могут секретировать различные поверхностные покрытия, начиная от слизистой оболочки книдарий (полипы, морские анемоны, медузы) и заканчивая жесткой кутикулой насекомых.Эпителиальный слой может включать в себя клетки нескольких типов, такие как сенсорные клетки, клетки желез и стрекательные клетки, а внешние поверхности могут нести микроворсинки, реснички или другие тонкие выступы.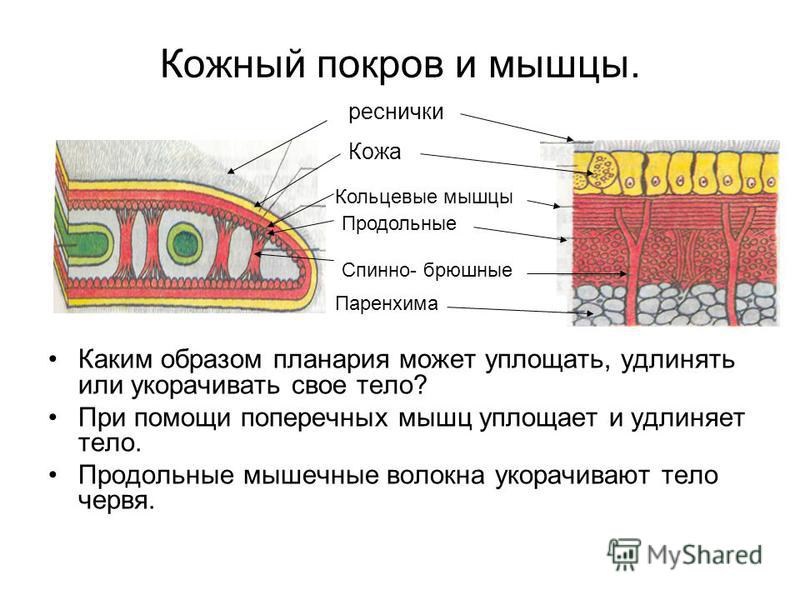 Кроме того, клетки могут образовывать наросты, такие как щетина, шипы, выступы и гребни.
Кроме того, клетки могут образовывать наросты, такие как щетина, шипы, выступы и гребни.
Прочность некоторых беспозвоночных животных, таких как кольчатые черви (дождевые черви, морские черви и пиявки) и некоторых моллюсков, зависит от растяжения водой отдельных клеток, образующих стенку тела.Во многих других формах твердые скелетные материалы откладываются либо внутри клеток, либо на внешней поверхности. Неклеточные покрытия покровов беспозвоночных чрезвычайно разнообразны по составу и размеру, и они пересекаются по таксономическим категориям. Эти жесткие структуры могут служить не более чем защитным панцирем, но у членистоногих, включая ракообразных, насекомых и пауков, многослойный и твердый покров образует экзоскелет, к которому прикреплены мышцы. У иглокожих экзоскелет находится ниже эпидермиса.
Тонкая структура стенки тела и рост кутикулы взрослой нематоды Ascaris lumbricoides | Журнал клеточной науки
Тонкая структура стенки тела Ascaris lumbricoides исследована электронно-микроскопическими методами.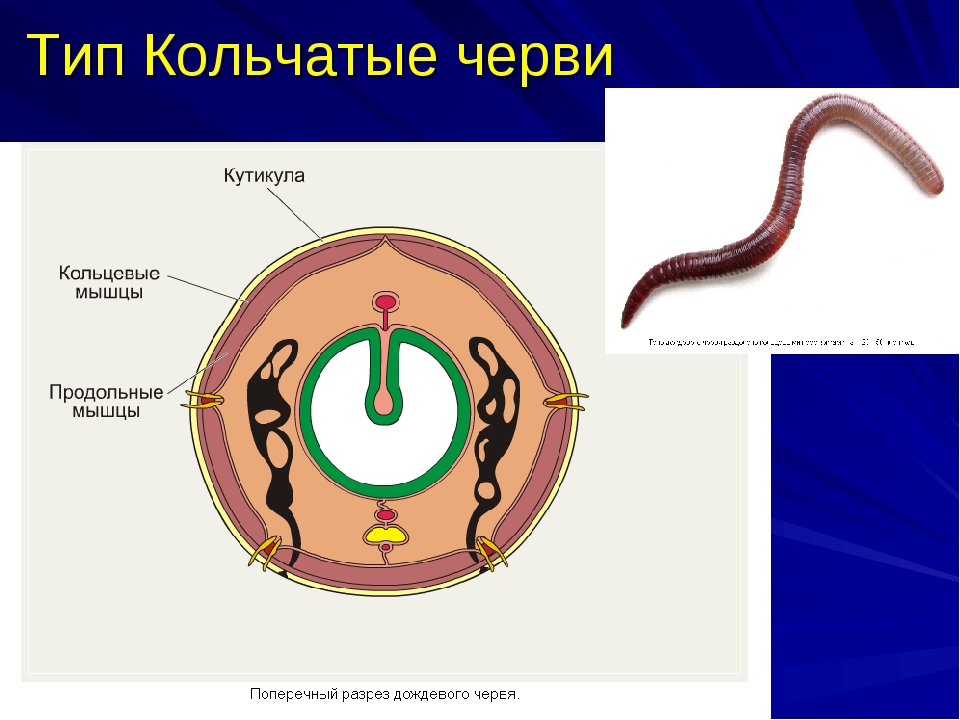 Стенка тела состоит из кутикулы, эпидермиса и одного слоя мышечных клеток. Кутикула содержит несколько слоев: поверхностную мембрану, кору, «фибриллярный слой», матричный или гомогенный слой, 3 слоя волокон и базальную пластинку.Кора делится на однородный внешний корковый слой и фиброзный внутренний корковый слой. «Фибриллярный слой» представляет собой серию каналов, которые проходят от внутренней части матричного слоя до коры головного мозга. У каналов отчетливые стенки, но содержимое не было продемонстрировано. Никаких волокон или ламелей в матричном слое обнаружить не удалось. Пряди волоконных слоев и базальная пластинка сформированы из тонких фибрилл диаметром менее 10 мкм. Существует внутренняя система каналов, которая связывает эпидермис с базальной пластинкой и слоями волокон.Эпидермис имеет сеть волокон, некоторые из которых прикрепляют мышечные клетки к кутикуле. Мышечная клетка содержит миофиламенты двух типов, массив крупных волокон размером около 30 мкм. диаметром, каждая из которых окружена множеством более мелких нитей диаметром от 5 до 7 мкм.
Стенка тела состоит из кутикулы, эпидермиса и одного слоя мышечных клеток. Кутикула содержит несколько слоев: поверхностную мембрану, кору, «фибриллярный слой», матричный или гомогенный слой, 3 слоя волокон и базальную пластинку.Кора делится на однородный внешний корковый слой и фиброзный внутренний корковый слой. «Фибриллярный слой» представляет собой серию каналов, которые проходят от внутренней части матричного слоя до коры головного мозга. У каналов отчетливые стенки, но содержимое не было продемонстрировано. Никаких волокон или ламелей в матричном слое обнаружить не удалось. Пряди волоконных слоев и базальная пластинка сформированы из тонких фибрилл диаметром менее 10 мкм. Существует внутренняя система каналов, которая связывает эпидермис с базальной пластинкой и слоями волокон.Эпидермис имеет сеть волокон, некоторые из которых прикрепляют мышечные клетки к кутикуле. Мышечная клетка содержит миофиламенты двух типов, массив крупных волокон размером около 30 мкм. диаметром, каждая из которых окружена множеством более мелких нитей диаметром от 5 до 7 мкм. Гликоген находится в эпидермисе и мышцах и идентифицируется как гранулы; обычно происходит слипание гранул с образованием отложений диаметром около 100 мкм. Снаружи от сарколеммы лежит соединительнотканная оболочка, которая содержит коллаген, вероятно, в форме фибриллярного и мелкодисперсного материала.
Гликоген находится в эпидермисе и мышцах и идентифицируется как гранулы; обычно происходит слипание гранул с образованием отложений диаметром около 100 мкм. Снаружи от сарколеммы лежит соединительнотканная оболочка, которая содержит коллаген, вероятно, в форме фибриллярного и мелкодисперсного материала.
Кутикула молодых взрослых особей Ascaris имеет базовую структуру, аналогичную строению взрослых червей. По мере роста взрослого червя кутикула увеличивается в объеме, и это увеличение затрагивает все слои кутикулы. Гомогенный или матричный слой увеличивается в толщине быстрее, чем слои волокон, и оба эти слоя растут быстрее, чем корковый слой. Рибонуклеиновой кислоты больше в эпидермисе молодых людей, чем у взрослых червей, и это коррелирует с развитием эндоплазматического ретикулума и рибосом.Предполагается, что обширная система каналов в кутикуле транспортирует материалы ко всем слоям кутикулы.
Покровы морского этиуранского червя Urechis caupo на JSTOR
Абстрактный Во время отлива вода в норе морского эхиуранового червя Urechis caupo становится гипоксичной, а концентрация сероводорода достигает уровней, токсичных для большинства животных. Морфология покровов U. caupo оценивается как поверхность обмена и барьер проникновения.Адаптивные особенности включают морщинистый характер эпидермиса, который увеличивает площадь поверхности для поглощения кислорода, и толстую мышечную стенку тела, которая обеспечивает главную движущую силу в создании перистальтических движений вдоль стенки тела для вентиляции норы. Эпидермис покрыт кутикулой и содержит два типа секретирующих слизь клеток: ортохроматические и метахроматические. Нижележащая соединительная ткань и три мышечных слоя образуют основную часть стенки тела. Покровы не представляют собой значительного структурного барьера для проникновения, хотя слизь, выделяемая эпидермальными клетками, может задерживать проникновение сульфидов.Ультраструктурные исследования предполагают три возможных механизма, которые U. caupo может использовать для противодействия токсическим эффектам сульфида на покровной поверхности: метаболизм симбиотических бактерий, встроенных в самый внутренний слой кутикулы и сгруппированных вместе в поверхностном эпидермисе, отмирание периферических, подвергшихся воздействию сульфидов клетки и окисление сульфида в специализированных лизосомальных органеллах, богатых железом, называемых сульфидными окисляющими телами.
Морфология покровов U. caupo оценивается как поверхность обмена и барьер проникновения.Адаптивные особенности включают морщинистый характер эпидермиса, который увеличивает площадь поверхности для поглощения кислорода, и толстую мышечную стенку тела, которая обеспечивает главную движущую силу в создании перистальтических движений вдоль стенки тела для вентиляции норы. Эпидермис покрыт кутикулой и содержит два типа секретирующих слизь клеток: ортохроматические и метахроматические. Нижележащая соединительная ткань и три мышечных слоя образуют основную часть стенки тела. Покровы не представляют собой значительного структурного барьера для проникновения, хотя слизь, выделяемая эпидермальными клетками, может задерживать проникновение сульфидов.Ультраструктурные исследования предполагают три возможных механизма, которые U. caupo может использовать для противодействия токсическим эффектам сульфида на покровной поверхности: метаболизм симбиотических бактерий, встроенных в самый внутренний слой кутикулы и сгруппированных вместе в поверхностном эпидермисе, отмирание периферических, подвергшихся воздействию сульфидов клетки и окисление сульфида в специализированных лизосомальных органеллах, богатых железом, называемых сульфидными окисляющими телами.
Текущие выпуски доступны на веб-сайте Chicago Journals: прочтите последний выпуск.Первоначально опубликованный Морской биологической лабораторией, «Биологический бюллетень» направлен на распространение новых научных результатов в широко связанных областях биологии в соответствии с более чем 100-летней традицией передового опыта. Биологический бюллетень публикует выдающиеся оригинальные исследования с всеобъемлющей целью объяснить, как организмы развиваются, функционируют и развиваются в своей естественной среде обитания. С этой целью журнал публикует статьи в области нейробиологии и поведения, физиологии и биомеханики, экологии и эволюции, развития и воспроизводства, клеточной биологии, симбиоза и систематики.Биологический бюллетень делает упор на фундаментальные исследования морских систем, но также публикует статьи междисциплинарного характера и на неморские темы, которые соответствуют фундаментальным целям журнала.
С момента своего основания в 1890 году в качестве одного из трех основных подразделений Чикагского университета, University of Chicago Press взял на себя обязательство распространять стипендии высочайшего стандарта и публиковать серьезные работы, которые способствуют образованию, способствуют общественному пониманию , и обогатить культурную жизнь.Сегодня Отдел журналов издает более 70 журналов и сериалов в твердом переплете по широкому кругу академических дисциплин, включая социальные науки, гуманитарные науки, образование, биологические и медицинские науки, а также физические науки.
Ультраструктура нематод: сложные системы и процессы
J Parasit Dis. 2016 Dec; 40 (4): 1130–1140.
иMaha M. A. Basyoni
Кафедра медицинской паразитологии медицинского факультета Каирского университета, Каир, Египет
Enas M.
 А. Ризк
А. Ризк Кафедра медицинской паразитологии, медицинский факультет, Каирский университет, Каир, Египет
Кафедра медицинской паразитологии, медицинский факультет, Каирский университет, Каир, Египет
Автор, отвечающий за переписку.Поступило 16 апреля 2015 г .; Принято 1 августа 2015 г.
Авторское право © Индийское общество паразитологов, 2016 г. Эта статья цитируется в других статьях в PMC.Abstract
Нематодные черви — одни из самых распространенных организмов на Земле.К ним относятся свободноживущие формы, а также паразиты растений, насекомых, людей и других животных. В последнее время наблюдается всплеск интереса к биологии нематод, в том числе к области ультраструктуры нематод. Нематоды округлые с полостью тела. У них есть кишки с одной стороны, с ртом на одном конце и анусом на другом. У них есть псевдоциелома, выстланная с одной стороны мезодермой, а с другой стороны — энтодермой. Похоже, что кутикула — очень сложный и эволюционно пластичный элемент с важными функциями, включая защиту, движение тела и поддержание формы. У них есть только продольные мускулы, так что; они, кажется, мечутся взад и вперед. Хотя у нематод есть пищеварительная, репродуктивная, нервная и выделительная системы, у них нет отдельной системы кровообращения или дыхания. Нематоды используют хемосенсорные и механосенсорные нейроны, встроенные в кутикулу, чтобы ориентироваться и реагировать на широкий спектр внешних стимулов. Взрослые люди состоят примерно из 1000 соматических клеток, и сотни из них обычно связаны с репродуктивной системой. Ультраструктура нематод стремится предоставить исследования, которые позволят использовать их в качестве моделей для различных биологических процессов, включая: болезни человека, иммунитет, паразитарные взаимодействия хозяина и проявление филогеномики.Последнее, однако, не было сведено в единую инклюзивную сущность. Следовательно, в текущем обзоре мы попытались предоставить комплексный подход к текущим знаниям, доступным для ультраструктур нематод.
У них есть только продольные мускулы, так что; они, кажется, мечутся взад и вперед. Хотя у нематод есть пищеварительная, репродуктивная, нервная и выделительная системы, у них нет отдельной системы кровообращения или дыхания. Нематоды используют хемосенсорные и механосенсорные нейроны, встроенные в кутикулу, чтобы ориентироваться и реагировать на широкий спектр внешних стимулов. Взрослые люди состоят примерно из 1000 соматических клеток, и сотни из них обычно связаны с репродуктивной системой. Ультраструктура нематод стремится предоставить исследования, которые позволят использовать их в качестве моделей для различных биологических процессов, включая: болезни человека, иммунитет, паразитарные взаимодействия хозяина и проявление филогеномики.Последнее, однако, не было сведено в единую инклюзивную сущность. Следовательно, в текущем обзоре мы попытались предоставить комплексный подход к текущим знаниям, доступным для ультраструктур нематод.
Ключевые слова: нематоды, ультраструктура, электронный микроскоп
Введение
нематоды были в центре внимания с 1990-х годов, когда свободноживущие бактериоядные Caenorhabditis elegans стали были первым многоклеточным организмом с полностью секвенированным геномом (Aboobaker и Blaxter 2000).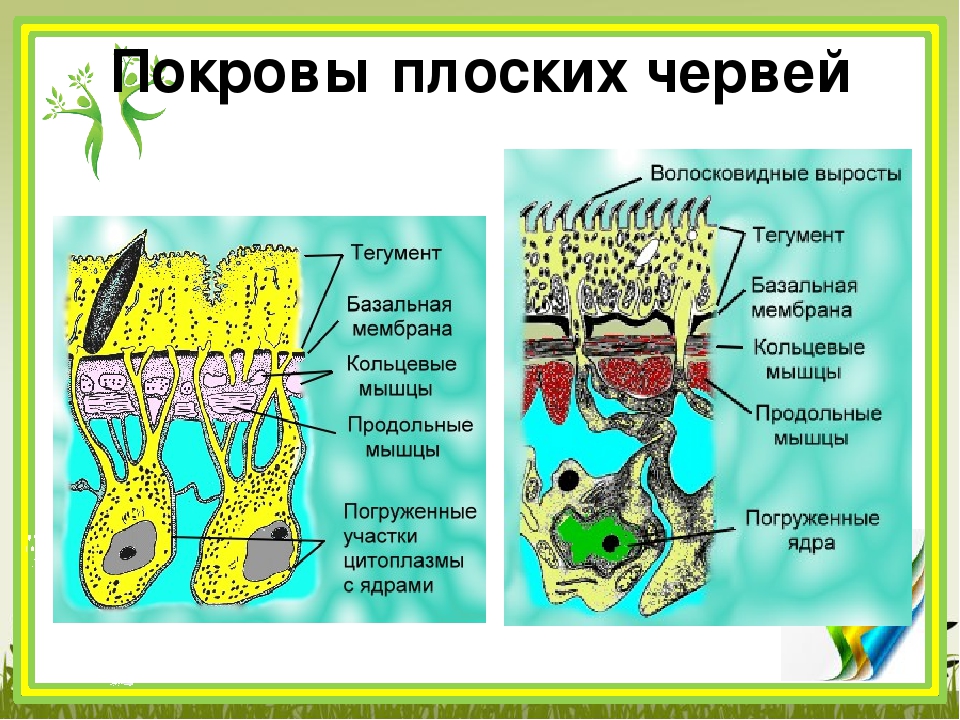 Это предоставило важный потенциал для изучения других видов нематод, но прошло еще десять лет, прежде чем он стал доступен для паразитической нематоды Brugia malayi (Aguinaldo et al. 1997). Они обитают в морской, пресной и наземной среде. Некоторые из них полезны для минерализации почвы, а другие вызывают болезни растений (Du four et al. 2003).
Это предоставило важный потенциал для изучения других видов нематод, но прошло еще десять лет, прежде чем он стал доступен для паразитической нематоды Brugia malayi (Aguinaldo et al. 1997). Они обитают в морской, пресной и наземной среде. Некоторые из них полезны для минерализации почвы, а другие вызывают болезни растений (Du four et al. 2003).
Наряду с членистоногими нематоды входят в самые разнообразные таксоны животного мира с разумной глобальной оценкой, насчитывающей более 1 миллиона видов (Scheffers et al.2012). Нематоды были разделены на разные группы животных, собранных в соответствии с их внешностью, в целом похожей на червей, несложной конструкцией внутренней полости тела, называемой псевдоцеломом, дефицитом ресничек и четко выраженной головой (Storer et al., 1979; Buchsbaum et al. 1987; Агуинальдо и др. 1997). Эти нематоды, по-разному известные как Aschelminths или Pseudocoelomata, возникли в результате упрощения за счет более сложного строения тела более чем одной группы предковых организмов (Wallace et al. 1996).
1996).
Нематоды на древе жизни животных на самом деле связаны с членистоногими и приапулидами из недавно признанной клады линяющих организмов, Ecdysozoa (Telford et al. 2008). У гельминтов все морфологические аспекты необходимо изучать под световым микроскопом (LM), потому что эти структуры очень важны в контексте их систематической классификации (González and Hamann 2010). Несмотря на это, ранние наблюдения LM описали нематод как трубку внутри трубки, без глаз, придатков, истинной сегментации и состоящую из почти 1000 соматических клеток на их полностью развитой стадии.Нематоды используют хемосенсорные и механосенсорные нейроны, встроенные в кутикулу, чтобы ориентироваться и реагировать на широкий спектр внешних раздражителей (Neher and Powers 2005). Однако из-за ограничений LM внедрение электронной микроскопии расширило возможности выявления нематод до широкого круга мелких нематод и выявило наличие многочисленных органелл нематод, которые никогда не распознавались LM (Bird and Bird 1991).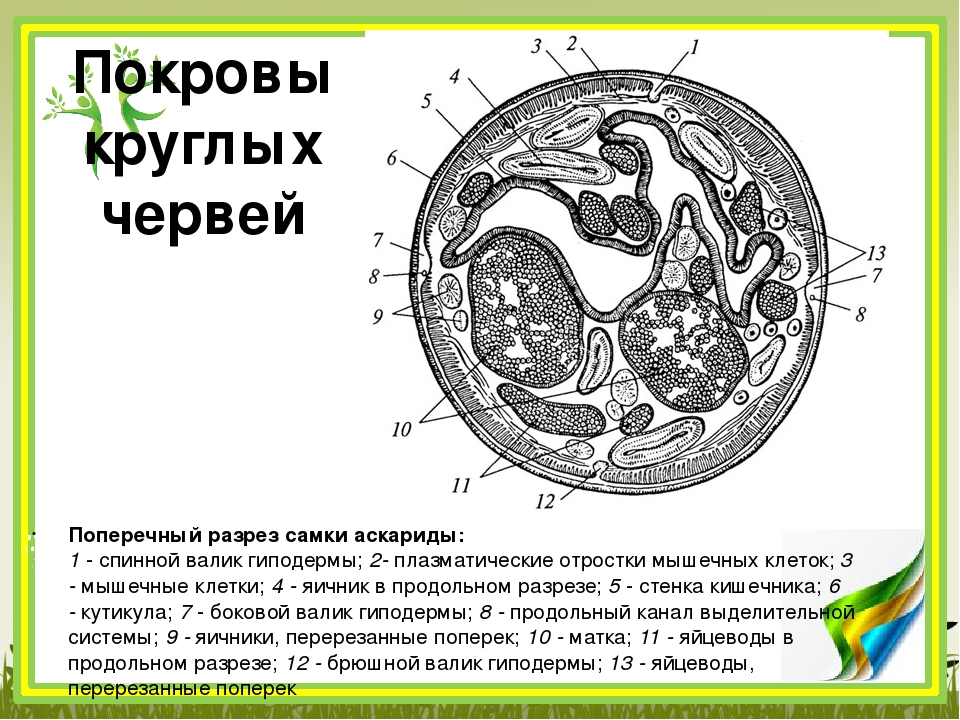 При изучении организации нематод ценность электронного микроскопа заключается в его способности предоставлять трехмерные описания с большим увеличением, что позволяет распознавать пространственные ассоциации между структурами нематод.Его можно использовать для разделения групп, которые морфологически идентичны при исследовании в LM, проверки видов и отображения различий между популяциями или расами (Гиббонс 1986). Несмотря на то, что в часто появляющихся публикациях сообщается, что нематоды имеют консервативную морфологию, на самом деле, наоборот, верно то, что виды типа Nemata действительно морфологически несовместимы. Следовательно, этот обзор представляет собой попытку оценить организацию мягких тканей нематод, чтобы связать их ультраструктуру с их функциональной специализацией, поведением в микросреде хозяина и иммуноцитохимическими характеристиками.
При изучении организации нематод ценность электронного микроскопа заключается в его способности предоставлять трехмерные описания с большим увеличением, что позволяет распознавать пространственные ассоциации между структурами нематод.Его можно использовать для разделения групп, которые морфологически идентичны при исследовании в LM, проверки видов и отображения различий между популяциями или расами (Гиббонс 1986). Несмотря на то, что в часто появляющихся публикациях сообщается, что нематоды имеют консервативную морфологию, на самом деле, наоборот, верно то, что виды типа Nemata действительно морфологически несовместимы. Следовательно, этот обзор представляет собой попытку оценить организацию мягких тканей нематод, чтобы связать их ультраструктуру с их функциональной специализацией, поведением в микросреде хозяина и иммуноцитохимическими характеристиками.
Стенка тела нематод
Стенка тела нематод состоит из кутикулы и одного слоя продольных мышечных клеток (рис.). Они разделены тонким слоем гиподермы (эпидермиса), который расширяется медиально с интервалами по окружности, образуя гиподермальные тяжи (Gaugler and Bilgrami 2004).
а — г
Wuchereria bancrofti Анализ методом ТЕА. a Гиподермальная цитоплазма (H) с клеточными органеллами, включая эндоплазматический ретикулум (ER), аппарат Гольджи (GA) и митохондрии (, стрелка головы ).Мышечный слой (M) подчеркнут базальными пластинками (BM) ( бар, ,6 мм). b Поперечный разрез, показывающий кутикулу (C), гиподермальную цитоплазму (H) с ядрышками (N) и частицами гликогена (G) ( бар, 1 мм). c Сечение, показывающее кутикулу (C), базальный слой ( звездочка ) с мембранными выступами ( тонкая стрелка ), ориентированными в сторону гиподермы (H), частицы гликогена (G) ( bar 1 мм). d Сечение, показывающее кутикулу (C) с эпикутикулой (EP), внешний кортикальный слой (EC), внутренний кортикальный слой (IC), средний слой (ML), внешний волокнистый слой (EF), внутренний волокнистый слой (IF), базальный слой (звездочка) с перепончатыми выступами (тонкая стрелка), выходящими в сторону гиподермы (H), и мышечный слой (M), окруженный базальными пластинками (BM) и эндоплазматическим ретикулумом (ER) ( бар, 1 мм) (Oliveira-Menezes et al. al.2010)
al.2010)
Кутикула
В настоящее время в биохимии, иммунологии и молекулярной биологии кутикулы нематод вызывает серьезную озабоченность, поскольку она функционирует как интерфейс, соединяющий нематод и их хозяин, защищающий животное от внешней среды и позволяющий ему оставаться гомеостатическим внутри. Удлиненное несегментированное тело нематоды покрыто толстой кутикулой, которая представляет собой гибкую внешнюю оболочку, состоящую в основном из белка со следами липидов и углеводов.Он выстилает ротовую полость, пищевод, задний проход, клоаку, экскреторные поры и влагалище. Эта кутикула покрыта эпикутикулой поверхностного слоя, богатого углеводами (5–20 нм), который играет важную роль в уклончивых иммунных механизмах. Кутикула состоит из трех областей: кортикальной зоны, срединной зоны и базальной зоны (рис.). Кортикальная зона содержит высокорезистентный белок (кутикулин), стабилизированный поперечными связями дитирозина. В средней зоне даже с помощью ЭМ можно было различить небольшие образования. Однако в базальной зоне можно выделить 2–3 фиброзных слоя; первый слой проходит под углом примерно 75 ° к продольной оси червяка, а второй слой проходит под углом 135 ° к первому слою, образуя решетчатую структуру.Примечательно, что эти волокнистые слои не растягиваются, но допускают продольное растяжение за счет модификации ангелов и, таким образом, представляют собой главные механизмы гидростатического скелета нематод (Fetterer and Rhoads 1993).
Однако в базальной зоне можно выделить 2–3 фиброзных слоя; первый слой проходит под углом примерно 75 ° к продольной оси червяка, а второй слой проходит под углом 135 ° к первому слою, образуя решетчатую структуру.Примечательно, что эти волокнистые слои не растягиваются, но допускают продольное растяжение за счет модификации ангелов и, таким образом, представляют собой главные механизмы гидростатического скелета нематод (Fetterer and Rhoads 1993).
Схематическая диаграмма, показывающая слои кутикулы взрослого человека и идентифицированные молекулярные компоненты в каждом из них. Sc Поверхностное покрытие, эпикутикула Ep , Co кортикальная зона, Md медиальная зона, BS базальная зона (Blaxter and Robertson 1998)
С возрастом толщина кутикулы взрослого человека увеличивается из-за расширения базальная зона (Herndon et al.Ротовая полость, глотка, прямая кишка, выводной проток и пора являются главными отверстиями нематоды, которые также покрыты кутикулой. Хотя, в отличие от кутикулы тела, кутикулы, выстилающие отверстия, не кажутся многослойными. Считается, что эти кутикулы секретируются нижележащими клетками, которые обычно являются эпителиальными. На кутикуле выводного протока и поры видны участки с характерным рисунком. Тем не менее, кутикула глотки представляет собой наиболее яркий пример, поскольку она содержит как минимум четыре несовместимых типа структур: перемычка кутикулы, лоскуты, измельчитель, сито и каналы (рис.). Они могут служить для укрепления пор и сохранения ее открытой (Райт и Томсон, 1981).
Хотя, в отличие от кутикулы тела, кутикулы, выстилающие отверстия, не кажутся многослойными. Считается, что эти кутикулы секретируются нижележащими клетками, которые обычно являются эпителиальными. На кутикуле выводного протока и поры видны участки с характерным рисунком. Тем не менее, кутикула глотки представляет собой наиболее яркий пример, поскольку она содержит как минимум четыре несовместимых типа структур: перемычка кутикулы, лоскуты, измельчитель, сито и каналы (рис.). Они могут служить для укрепления пор и сохранения ее открытой (Райт и Томсон, 1981).
Кутикулярные структуры глотки. ДИК-изображение головы взрослой нематоды (, вид сбоку, ), показывающее отделы глотки (, черные метки, ) и различные структуры, обнаруженные в слизистой оболочке просвета кутикулы (, белые метки, ). Узкий промежуток между двумя луковицами — это перешеек, в котором располагается нервное кольцо в окружающей соматической ткани (Altun and Hall 2012)
Кутикула может быть гладкой или украшенной кольцами, продольными бороздками или шипами, или она может иметь хорошо развитые крыловидные структуры, называемые боковыми крыльями, когда они присутствуют, они проходят по всей длине тела. Шейные крылья находятся на передней части тела, а хвостовые крылья — на хвосте у некоторых самцов (Gardner 2001). Модель изменчивости кутикулярного комплекса включает кутикулярные дуги, обнаруженные у видов отряда Strongylida: Trichostrongyloidea, которые представляют собой экзокутикулярные изменения в серию кутикулярных гребней. Кутикулярные гребни поддерживаются скелетными стержнями, называемыми синлофами. У этих форм гребни, проходящие вдоль тела нематоды, сохраняют свое положение в кишечнике своих хозяев.Другие формы имеют экзокутикулу с зубчатыми гребнями, неровностями или могут быть очень гладкими. У некоторых групп есть большие кутикулярные присоски прямо перед клоакой, которые ограничены сенсорными сосочками, которые позволяют самцу найти самку в кишечнике хозяина (Gardner 2001). Филогенетическая интерпретация ультраструктуры кутикулы нематод рассмотрена в рамках недавних данных о последовательностях ДНК. Элементы кутикулы, по-видимому, несколько раз независимо возникали внутри нематод и, следовательно, очень гомоплазированы (например,г.
Шейные крылья находятся на передней части тела, а хвостовые крылья — на хвосте у некоторых самцов (Gardner 2001). Модель изменчивости кутикулярного комплекса включает кутикулярные дуги, обнаруженные у видов отряда Strongylida: Trichostrongyloidea, которые представляют собой экзокутикулярные изменения в серию кутикулярных гребней. Кутикулярные гребни поддерживаются скелетными стержнями, называемыми синлофами. У этих форм гребни, проходящие вдоль тела нематоды, сохраняют свое положение в кишечнике своих хозяев.Другие формы имеют экзокутикулу с зубчатыми гребнями, неровностями или могут быть очень гладкими. У некоторых групп есть большие кутикулярные присоски прямо перед клоакой, которые ограничены сенсорными сосочками, которые позволяют самцу найти самку в кишечнике хозяина (Gardner 2001). Филогенетическая интерпретация ультраструктуры кутикулы нематод рассмотрена в рамках недавних данных о последовательностях ДНК. Элементы кутикулы, по-видимому, несколько раз независимо возникали внутри нематод и, следовательно, очень гомоплазированы (например,г. корковые или базальные радиальные бороздки, слои спиральных волокон и жидкий матрикс со стойками) (Decraemer et al. 2003). До сих пор ультраструктуры наружной кутикулы тела трудноизлечимы. Однако, что весьма удивительно, кутикула нематоды может препятствовать пищеварению во враждебных желудках позвоночных-хозяев. С другой стороны, нематоды могут быть очень хрупкими, они остаются неотъемлемой частью только в осмотически сбалансированных тканях хозяина (члены отряда Filaroidea), и они могут лопнуть, если попадут в ткани с меньшим количеством солей.Это зависит от вида нематод и характеристик ее жизненного цикла (Gardner 2001).
корковые или базальные радиальные бороздки, слои спиральных волокон и жидкий матрикс со стойками) (Decraemer et al. 2003). До сих пор ультраструктуры наружной кутикулы тела трудноизлечимы. Однако, что весьма удивительно, кутикула нематоды может препятствовать пищеварению во враждебных желудках позвоночных-хозяев. С другой стороны, нематоды могут быть очень хрупкими, они остаются неотъемлемой частью только в осмотически сбалансированных тканях хозяина (члены отряда Filaroidea), и они могут лопнуть, если попадут в ткани с меньшим количеством солей.Это зависит от вида нематод и характеристик ее жизненного цикла (Gardner 2001).
Эпикутикула (гиподерма)
Самый внешний слой кутикулы — это эпикутикула толщиной 6–10 нм, состоящая из 2 темных пластинок, разделенных более темным промежутком. Несмотря на его сходство с клеточной мембраной, он не происходит из внешнего гиподермального слоя (Mehlhorn 2008).
У взрослых червей он обычно синцитиальный, а ядра располагаются в 4 утолщенных частях (гиподермальных тяжах). Гиподермальные тяжи проходят продольно и делят соматическую мускулатуру на 4 квадранта. У большинства видов брюшные и спинные канатики содержат продольные нервные стволы, а боковые стволы содержат латеральные каналы выделительной системы. Эпикутикула содержит митохондрии и эндоплазматический ретикулум, особенно в областях спинного мозга, и отвечает за секрецию кутикулы (Bird and Bird 1991). Бациллярные полосы представляют собой модификации латеральных (или медиальных) клеток гиподермы у некоторых видов нематод.В которых несинцитиальные гиподермальные клетки, по-видимому, имеют железистую специализацию, направленную наружу, чтобы секретировать материал к кутикулярной поре (бациллярной поре), возможно, участвующей в осморегуляции. У некоторых видов клетки, содержащие нейросекреторные гранулы, проецируют ресничные окончания в бациллярную полосу (железистую клетку), позволяя высвобождать гранулы по направлению к псевоцелому в ответ на сенсорное воздействие на эти реснички (Herndon et al. 2010).
Гиподермальные тяжи проходят продольно и делят соматическую мускулатуру на 4 квадранта. У большинства видов брюшные и спинные канатики содержат продольные нервные стволы, а боковые стволы содержат латеральные каналы выделительной системы. Эпикутикула содержит митохондрии и эндоплазматический ретикулум, особенно в областях спинного мозга, и отвечает за секрецию кутикулы (Bird and Bird 1991). Бациллярные полосы представляют собой модификации латеральных (или медиальных) клеток гиподермы у некоторых видов нематод.В которых несинцитиальные гиподермальные клетки, по-видимому, имеют железистую специализацию, направленную наружу, чтобы секретировать материал к кутикулярной поре (бациллярной поре), возможно, участвующей в осморегуляции. У некоторых видов клетки, содержащие нейросекреторные гранулы, проецируют ресничные окончания в бациллярную полосу (железистую клетку), позволяя высвобождать гранулы по направлению к псевоцелому в ответ на сенсорное воздействие на эти реснички (Herndon et al. 2010).
Мышечный слой
Механически стенка тела нематоды состоит из многослойной кутикулы и продольного ленточного веретена мышечных клеток (рис.). Мышца нематод не похожа на другие мышцы тем, что каждый саркомер перпендикулярно связан с местом приложения силы, кутикулой. Саркомер состоит из тонких и толстых слоев миофиламентов, простирающихся между двумя цилиндрическими телами, как z-линии мышц позвоночных (Gaugler and Bilgrami 2004). Нематоды содержат 2 типа мышц: соматические, связанные со структурой тела, и специализированные мышцы, относящиеся к определенным частям тела для определенной цели (Bird and Bird 1991).У нематод существует два основных типа архитектуры мышечных волокон: платимиарии и целомиарии (Burr and Gans 1987). Мускулатура поперечно-полосатая, и каждая мышечная клетка состоит из индивидуализированных сократительных и неконтрактильных частей. Платимиарная мышечная клетка (рис.) Имеет скорее яйцевидную форму в поперечном сечении и содержит свои сократительные волокна на одной стороне, прилегающей к гиподерме, и имеет миоцитон (тело неконтрактильной клетки) примерно такой же ширины, выпячивающийся в псевдоцель. Миоцитон содержит ядра, крупные митохондрии, многочисленные кристы, рибосомы, эндоплазматический ретикулум, гликоген и липиды.Клетка целомиарии имеет более веретеновидную форму с сократительной частью на дистальном конце узкой U. Дистальный конец U помещается напротив гиподермы (Roberts and Janovy 1996).
Миоцитон содержит ядра, крупные митохондрии, многочисленные кристы, рибосомы, эндоплазматический ретикулум, гликоген и липиды.Клетка целомиарии имеет более веретеновидную форму с сократительной частью на дистальном конце узкой U. Дистальный конец U помещается напротив гиподермы (Roberts and Janovy 1996).
Мышцы головы, шеи и стенок тела. a Организация соматических мышц у взрослого. C. elegans , вид сзади под косой. Мышцы стенки тела организованы в четыре квадранта (видны только спинные квадранты) с двумя рядами клеток в каждом. Пруток 50 мкм. b Расположение мышц головы и шеи, вид снизу. c Расположение соматических мышц хвоста, вид снизу. Оригинальное увеличение, × 600 (Алтун, Холл, 2009)
Строение косо-поперечнополосатой мышцы платимьярия. a Схематическое изображение мышечной клетки стенки тела. Ряды плотных тел ( точек, ) и полосы А ( тонких линий, ) макроскопически придают полосатому виду. Бляшки прикрепления локализуются в конце I-перевязи терминальной половины, где мышечные клетки в квадранте контактируют друг с другом.( Верхняя вставка ) Слои ткани снаружи (кутикула, , верх, ) внутрь (мышца, , нижняя часть, ). (Bl) Базальная пластинка между мышцей и подкожной клетчаткой (Hyp). b Схематическое изображение клина миофибриллярной части и мышечного живота. Ядро и органеллы расположены внутри мышечного живота. Решетка миофиламентов представляет собой лист из волокон на стороне мышечной клетки, которая находится напротив гиподермы. Сократительные единицы регистрируются продольно; однако они расположены тандемно по горизонтали, что дает чередование полос из толстых ( маленьких желтых точек и линий ) и тонких нитей ( маленьких черных точек и линий ).На боковой и верхней сторонах рисунка не показаны тонкие нити. (ДБ) Плотное тело (Алтун и Холл, 2009). (Цветной рисунок онлайн)
Бляшки прикрепления локализуются в конце I-перевязи терминальной половины, где мышечные клетки в квадранте контактируют друг с другом.( Верхняя вставка ) Слои ткани снаружи (кутикула, , верх, ) внутрь (мышца, , нижняя часть, ). (Bl) Базальная пластинка между мышцей и подкожной клетчаткой (Hyp). b Схематическое изображение клина миофибриллярной части и мышечного живота. Ядро и органеллы расположены внутри мышечного живота. Решетка миофиламентов представляет собой лист из волокон на стороне мышечной клетки, которая находится напротив гиподермы. Сократительные единицы регистрируются продольно; однако они расположены тандемно по горизонтали, что дает чередование полос из толстых ( маленьких желтых точек и линий ) и тонких нитей ( маленьких черных точек и линий ).На боковой и верхней сторонах рисунка не показаны тонкие нити. (ДБ) Плотное тело (Алтун и Холл, 2009). (Цветной рисунок онлайн)
Гидростатический скелет
Кутикула, гиподерма и мышечный слой составляют стенку тела нематоды, и его основная функция — действовать как гидростатико-скелетная система (Harris and Crofton 1957). Соматическая мускулатура и остальная часть стенки тела окружают жидкообразную полость, псевдоцеле или псевдоцеле, которая заполнена жидкостью и гемолимфой, которые выглядят как прозрачный розовый, почти бесклеточный раствор.Кутикула нематод действует как анизометрический скелет, в котором продольная соматическая мускулатура сокращается относительно эластичной кутикулы, которая становится жесткой за счет гидростатического давления жидкости тела внутри псевдоциелома (Chappell 1986). Псевдоцелома содержит целомоциты, уникальный тип клеток, которые имеют яйцевидную форму или имеют множество ответвлений. Они обеспечивают тургор-гидростатическое давление для животного в целом, действуют как смазка между тканями и обеспечивают среду для межклеточной передачи сигналов и транспорта питательных веществ.Они могут играть роль в хранении витамина B12, синтезе белка и секреторных функциях (Bolla et al. 1972; Altun and Hall 2009).
Соматическая мускулатура и остальная часть стенки тела окружают жидкообразную полость, псевдоцеле или псевдоцеле, которая заполнена жидкостью и гемолимфой, которые выглядят как прозрачный розовый, почти бесклеточный раствор.Кутикула нематод действует как анизометрический скелет, в котором продольная соматическая мускулатура сокращается относительно эластичной кутикулы, которая становится жесткой за счет гидростатического давления жидкости тела внутри псевдоциелома (Chappell 1986). Псевдоцелома содержит целомоциты, уникальный тип клеток, которые имеют яйцевидную форму или имеют множество ответвлений. Они обеспечивают тургор-гидростатическое давление для животного в целом, действуют как смазка между тканями и обеспечивают среду для межклеточной передачи сигналов и транспорта питательных веществ.Они могут играть роль в хранении витамина B12, синтезе белка и секреторных функциях (Bolla et al. 1972; Altun and Hall 2009).
Нервная система
Нервная система круглых червей состоит из передней нервной ткани, окружающей глотку, которая образует дорсальные и вентральные нервные тяжи, идущие от конца к концу (Wagoner 2004).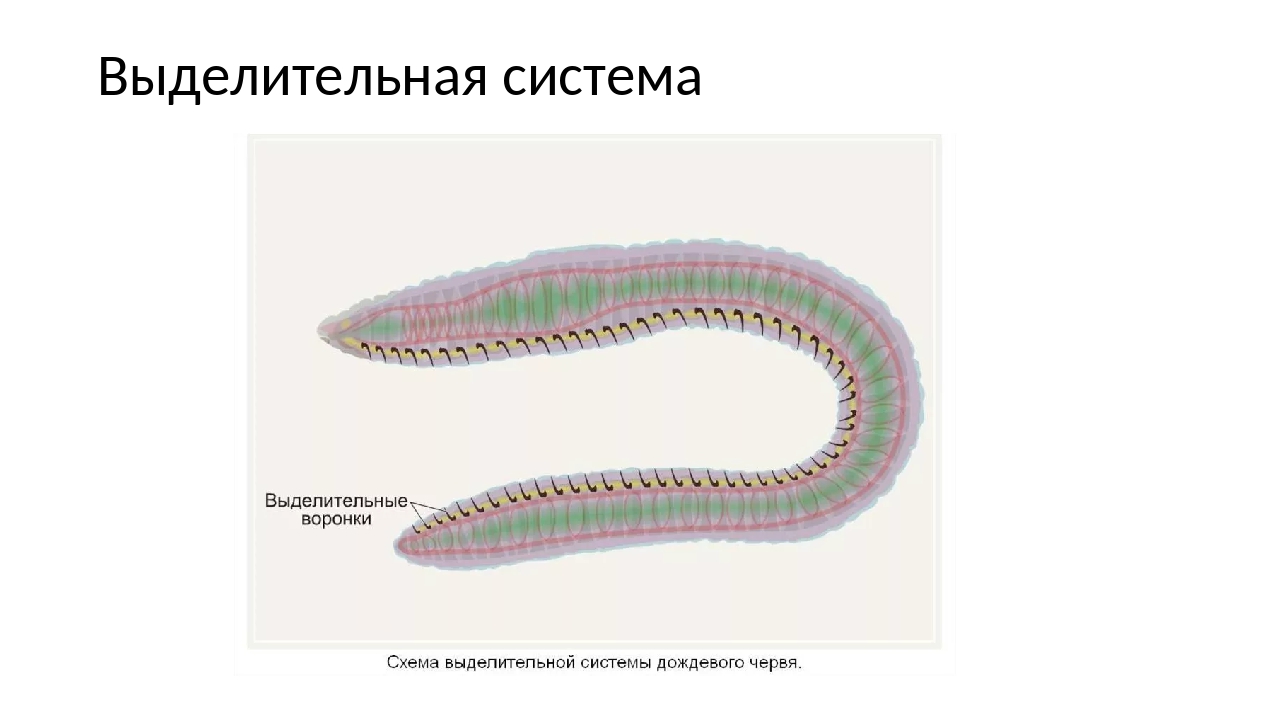 Нервное кольцо, называемое окологлоточным сообществом, окружает перешеек глотки. В дополнение к нервному кольцу центральная нервная система состоит из интернейронов и связанных ганглиев, а также вентрального нервного пучка.Перед нервным кольцом расположены скопления ядер (папиллярные ганглии). Самый большой из этих ганглиев является латеральным и включает тела клеток для иннервации амфид и большинства нейронов головы (Chen et al. 2004). Вентральный нервный ствол оканчивается преанальным ганглием, от которого две ветви охватывают прямую кишку как заднее нервное кольцо или ректальное коммисур. Остальные клеточные тела расположены вдоль средней линии вентральной части и в хвосте (Lewbart 2011). Примечательно, что нематоды обогащены множеством сенсилл (маленьких органов чувств), включая головные и хвостовые сосочки, которые представляют хеморецепторы и механорецепторы (Bogitsh et al.2005).
Нервное кольцо, называемое окологлоточным сообществом, окружает перешеек глотки. В дополнение к нервному кольцу центральная нервная система состоит из интернейронов и связанных ганглиев, а также вентрального нервного пучка.Перед нервным кольцом расположены скопления ядер (папиллярные ганглии). Самый большой из этих ганглиев является латеральным и включает тела клеток для иннервации амфид и большинства нейронов головы (Chen et al. 2004). Вентральный нервный ствол оканчивается преанальным ганглием, от которого две ветви охватывают прямую кишку как заднее нервное кольцо или ректальное коммисур. Остальные клеточные тела расположены вдоль средней линии вентральной части и в хвосте (Lewbart 2011). Примечательно, что нематоды обогащены множеством сенсилл (маленьких органов чувств), включая головные и хвостовые сосочки, которые представляют хеморецепторы и механорецепторы (Bogitsh et al.2005).
Головные органы чувств
Амфиды
Одна любопытная структура, которая встречается у всех немат, — это амфид, очень изменчивый хемосенсорный орган, который может быть очень очевидным (рис.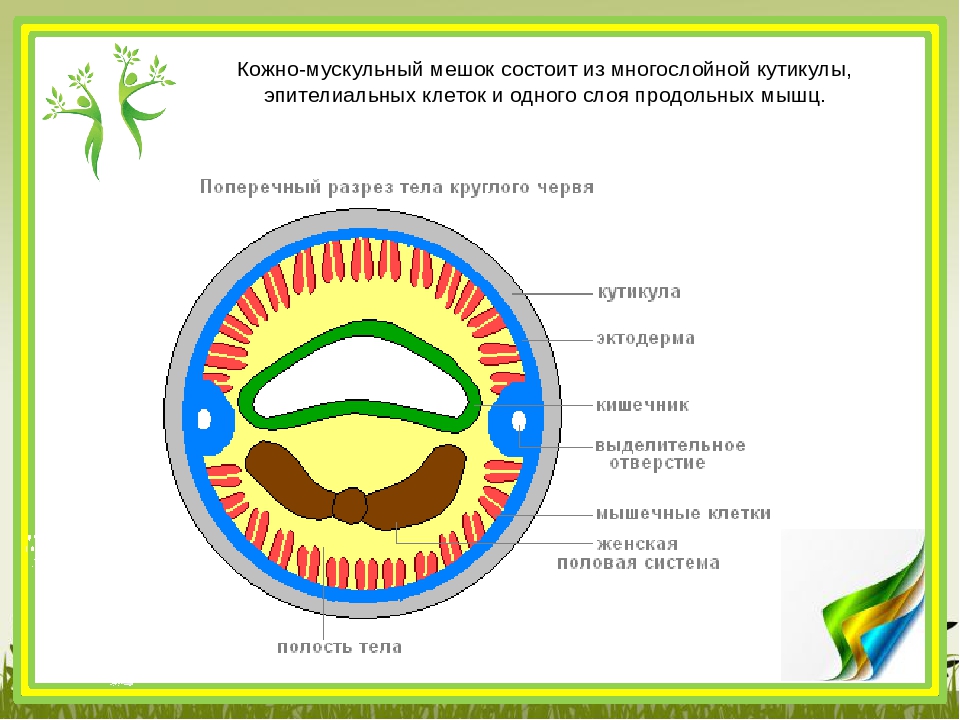 ) Или очень незаметным. У нематод есть две особи амфид, которые представляют собой специализированные сенсиллы, расположенные сбоку на голове. Эти двусторонне-симметричные структуры обычно имеют большое значение для идентификации. В основном бывают двух видов: спиральные и неспиральные. Обычно неспиральная амфида представляет собой кармановидную структуру, в которой внешнее отверстие (апертура) имеет форму поперечной щели, ведущей в полость (ямку), заполненную студенистым веществом (желатиновое тело).У спиральной амфиды ямка открытая и удлиненная, обычно поворачивается вентрально (от нерва), хотя в некоторых случаях амфида может быть ранена дорсально (The Darwin Nematode Project 2006).
) Или очень незаметным. У нематод есть две особи амфид, которые представляют собой специализированные сенсиллы, расположенные сбоку на голове. Эти двусторонне-симметричные структуры обычно имеют большое значение для идентификации. В основном бывают двух видов: спиральные и неспиральные. Обычно неспиральная амфида представляет собой кармановидную структуру, в которой внешнее отверстие (апертура) имеет форму поперечной щели, ведущей в полость (ямку), заполненную студенистым веществом (желатиновое тело).У спиральной амфиды ямка открытая и удлиненная, обычно поворачивается вентрально (от нерва), хотя в некоторых случаях амфида может быть ранена дорсально (The Darwin Nematode Project 2006).
Хемосенсорный орган, расположенный в переднем отделе нематоды ( Xiphinema americanum ) (Campbell and Reece 2002)
Губные и головные сосочки
Вокруг рта расположены сосочки двух основных типов: губные сосочки на окружающих губы рот и головные сосочки за ртом.Это механорецепторы, иннервируемые сосочковыми нервами из циркумозофагеального комьюсуза (Bogitsh et al. 2005).
2005).
Хвостовые органы чувств
Хвостовые сосочки
наблюдаются у самцов нематод и способствуют копуляции (рис. B).
a Фазмидные (ph) модификации кутикулы заднего конца тела Rhabdias sp. b Хвостовые сосочки (cp) на заднем конце тела нематод-паразитов самцов амфибий (González et al.2012)
Фазмиды
парные органы чувств, расположенные двусторонним образом близко к кончику хвоста (Fagerholm et al. 2004). Морфологически сходные с амфидами, фазмиды несут одноклеточные железы, открывающиеся во впадину, в дополнение к сенсорным нервным окончаниям (Fig. A) (Bogitsh et al. 2005).
Спикулы
Самцы нематод обычно обладают кутикулярными копулятивными органами (спикулами) (рис.), Которые вставляются в вульву самки для прикрепления самца к самке и расширения вульвы против давления внутреннего тела для передачи сперматозоидов (фон Ливен). и Bärmann 2005).Было показано, что копулятивные спикулы нематод Heterakis gallinarum и Nippostrongylus brasiliensis содержат нервные аксоны и обладают холинэстеразной активностью, связанной с этими аксонами. Структура и положение этих аксонов указывает на то, что спикула является тактильным органом, который способен действовать как сенсорный датчик во время копуляции (Lee 1973). В общем, каждая спикула представляет собой трубчатую структуру, состоящую из склеротизированного кутикулярного покрытия и центрального цитоплазматического ядра, содержащего нервные ткани.В целом можно выделить три части: цилиндрическую головку, цилиндрический стержень и более уплощенное лезвие с двумя склеротизированными крыловидными выступами (vela), один из которых идет к дорсальной, а другой — к брюшной стороне. Вела более заметна, когда спикула видна с внутренней поверхности. Отверстие цитоплазматического ядра обычно располагается на боковой внешней поверхности головки спикулы. На дистальном конце каждой спикулы может быть одна или две маленькие поры (Rammah and Hirschmann 1987).
Структура и положение этих аксонов указывает на то, что спикула является тактильным органом, который способен действовать как сенсорный датчик во время копуляции (Lee 1973). В общем, каждая спикула представляет собой трубчатую структуру, состоящую из склеротизированного кутикулярного покрытия и центрального цитоплазматического ядра, содержащего нервные ткани.В целом можно выделить три части: цилиндрическую головку, цилиндрический стержень и более уплощенное лезвие с двумя склеротизированными крыловидными выступами (vela), один из которых идет к дорсальной, а другой — к брюшной стороне. Вела более заметна, когда спикула видна с внутренней поверхности. Отверстие цитоплазматического ядра обычно располагается на боковой внешней поверхности головки спикулы. На дистальном конце каждой спикулы может быть одна или две маленькие поры (Rammah and Hirschmann 1987).
Aplectana hylambatis , задний конец самца. Pap преанальных сосочков, ptap постанальных сосочков, s спикул fa фиксированных сочленений, la боковых крыльев. Масштабная линейка 40 мкм (Gonzalez and Hamann 2010)
Масштабная линейка 40 мкм (Gonzalez and Hamann 2010)
Внутренняя трубка тела или пищеварительная система
Пищеварительная система образована ротовой полостью между пищеводом и ротовым отверстием на переднем конце червя (Gutierrez 2000).Он четко делится на стоматотеум, брыжейку и проктодеум. (Bird and Bird 1991).
Желудок (передняя кишка)
Включает рот и губы, ротовую полость и пищевод. Рот окружают 6 губ (две суб-дорсальные, две субвентральные и две боковые). В некоторых случаях они могут быть уменьшены частичным слиянием до 3 или полным слиянием с образованием единого кольца вокруг рта. Ротовая полость имеет форму цилиндрической или треугольной трубки, оканчивающейся клапаном, подобным голосовому аппарату, который может нести мельчайшие зубы.На кутикулярной выстилке стомы могут образовываться зубы. Эозофагус — самая большая часть желудка, находящаяся между стомой и кишечником. Изнутри глотка выстлана кутикулой, а снаружи — перепонкой (базальной пластинкой). Он содержит лучевые мышцы, железы пищевода и клапаны, что предотвращает срыгивание пищи. У некоторых нематод средняя и задняя части глотки опухшие, образуя мышечные луковицы (рис.) (Bird and Bird 1991). Шлифовальный станок — это кутикула, состоящая в основном из трех пар мышечных клеток, которые вращаются при сокращении мышц (Avery and Thomas 1997).Эти взаимосвязанные «зубы» действуют при мацерации пищи и могут функционировать как клапан, регулирующий односторонний поток пищи в кишечник (Altun and Hall 2012). У кишечных паразитов млекопитающих из рода Trichuris (Adenophorea: Trichuridae) стома отсутствует, а пищевод сформирован из стихоцитов, содержащих стихосому, имеющую железистую функцию (Gardner 2001).
Он содержит лучевые мышцы, железы пищевода и клапаны, что предотвращает срыгивание пищи. У некоторых нематод средняя и задняя части глотки опухшие, образуя мышечные луковицы (рис.) (Bird and Bird 1991). Шлифовальный станок — это кутикула, состоящая в основном из трех пар мышечных клеток, которые вращаются при сокращении мышц (Avery and Thomas 1997).Эти взаимосвязанные «зубы» действуют при мацерации пищи и могут функционировать как клапан, регулирующий односторонний поток пищи в кишечник (Altun and Hall 2012). У кишечных паразитов млекопитающих из рода Trichuris (Adenophorea: Trichuridae) стома отсутствует, а пищевод сформирован из стихоцитов, содержащих стихосому, имеющую железистую функцию (Gardner 2001).
Кишечник (средняя кишка)
Это простая полая прямая немышечная трубка, состоящая из одного слоя эпителиальных клеток.Характерной особенностью кишечника нематод является то, что он прочно прикреплен к ротовой полости и анальному отверстию (рис.). Таким образом, когда нематода разрезана, кишечник останется на месте и, таким образом, кишечник всегда будет существовать в разрезе (Gutierrez 2000).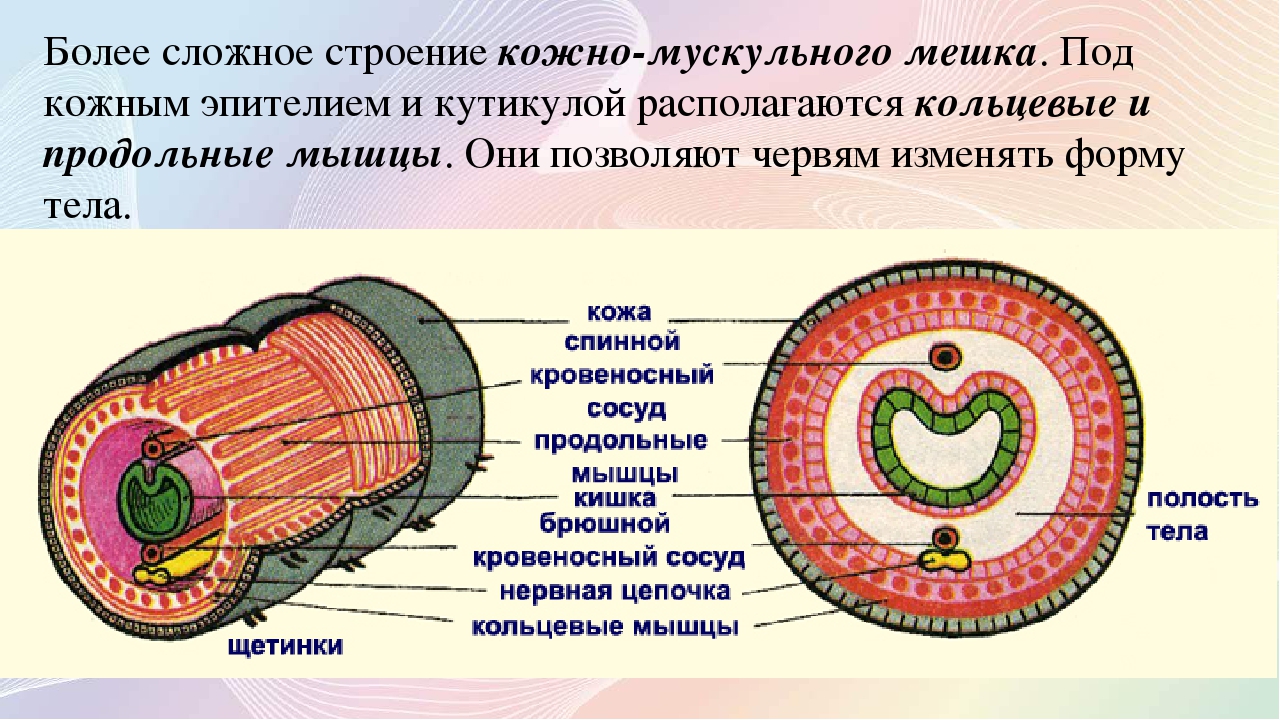 Цитоплазма кишечной эпителиальной клетки нематод имеет множество структур, включая рибосомы, аппарат Гольджи, эндоплазматический ретикулум и митохондрии, липидные капли, ламеллярные тела, ядро и в некоторых случаях микроворсинки, покрытые электронно-плотным аморфным материалом (Bird and Bird 1991).
Цитоплазма кишечной эпителиальной клетки нематод имеет множество структур, включая рибосомы, аппарат Гольджи, эндоплазматический ретикулум и митохондрии, липидные капли, ламеллярные тела, ядро и в некоторых случаях микроворсинки, покрытые электронно-плотным аморфным материалом (Bird and Bird 1991).
Кишечник взрослого человека проходит параллельно гонаде по длине тела, вид снизу. Изображение, полученное методом дифференциальной интерференционно-контрастной микроскопии (ДИК); увеличение × 400 (Altun and Hall. 2012)
Проктодеум (задняя кишка)
Он состоит из прямой кишки и ануса у женщин и клоаки у мужчин. Прямая кишка представляет собой кутикулярную выстилку и инвагинирует в прямую железу. Женские нематоды состоят из простой трубки, ведущей к анальному отверстию, тогда как репродуктивная система, открытая в нее, образует клоаку, у самцов содержит спикулы и другие копулятивные структуры.Ультраструктурно анус имеет щелевидную структуру с вентральной стороны. Открытие заднего прохода контролируется одноклеточной Н-образной депрессорной мышцей (рис. ), Которая действует, поднимая дорсальную стенку прямой кишки и подтягивая заднюю губу ануса, чтобы открыть ее (Bird and Bird 1991).
), Которая действует, поднимая дорсальную стенку прямой кишки и подтягивая заднюю губу ануса, чтобы открыть ее (Bird and Bird 1991).
Задняя кишка. а Графическое изображение структур заднего пищеварительного тракта. ( Темные овалы ) Мышечные ядра. B Просвет задней части кишечника заканчивается у ректального клапана, состоящего из двух клеток (virL и virR).Клапан окружен трехлопастной ректальной железой, состоящей из трех ячеек (rect_D, rect_VL, rect_VR). Клетки железы соединяются с просветом сразу после клапана (не показано). Мышца сфинктера (Sph mu) окружает железу и проникает в нее. ТЭМ, поперечный разрез; бар 1 мкм (Altun and Hall 2012)
Секреторная / экскреторная система
Считается, что секреторно-экскреторные (S-E) системы были названы так на основании их морфологии и до того, как были обнаружены основные функции.Существуют убедительные доказательства того, что большая часть экскреции происходит через кишечник (Bird and Bird 1991). Большинство выделительных систем, по-видимому, выполняют секреторные и осморегуляторные функции. Существуют два основных типа систем S-E: железистые и трубчатые. Большинство свободноживущих нематод (Adenophora) имеют железистый тип, тогда как трубчатый тип обычно встречается у паразитических нематод (Secernentae) (Nelson and Albert 1983). Чаще всего используется трубчатая форма, при которой два длинных канала в подкожной клетчатке соединяются друг с другом поперечным каналом около переднего конца (Н-образной формы).Парные субвентральные железы с гранулярной цитоплазмой, которые, как считается, выполняют секреторную функцию, открываются в поперечный канал. Срединный брюшной проток или пора открывается от поперечного канала наружу. Это экскреторная пора. Его расположение является видоспецифичным и служит таксономическим признаком. Второй тип выделительной системы состоит из единственной клетки вентральной железы или ренетты, которая присутствует в полости тела и напрямую связана с выделительной порой (рис.
Большинство выделительных систем, по-видимому, выполняют секреторные и осморегуляторные функции. Существуют два основных типа систем S-E: железистые и трубчатые. Большинство свободноживущих нематод (Adenophora) имеют железистый тип, тогда как трубчатый тип обычно встречается у паразитических нематод (Secernentae) (Nelson and Albert 1983). Чаще всего используется трубчатая форма, при которой два длинных канала в подкожной клетчатке соединяются друг с другом поперечным каналом около переднего конца (Н-образной формы).Парные субвентральные железы с гранулярной цитоплазмой, которые, как считается, выполняют секреторную функцию, открываются в поперечный канал. Срединный брюшной проток или пора открывается от поперечного канала наружу. Это экскреторная пора. Его расположение является видоспецифичным и служит таксономическим признаком. Второй тип выделительной системы состоит из единственной клетки вентральной железы или ренетты, которая присутствует в полости тела и напрямую связана с выделительной порой (рис. ) (Lee 2003).
) (Lee 2003).
Дифференциальное интерференционно-контрастное микроскопическое изображение выделительной системы взрослого человека C.elegans . a Клетка экскреторной железы расположена на вентральной стороне между кишечником и конечной луковицей глотки. b Ядро выделительной клетки большое, имеет вид «жареного яйца» с большим ядрышком. c Клетка протока находится впереди выделительной клетки d Клетка экскреторной поры находится вентрально от клетки протока. Канал проходит через канал и поровые клетки и открывается наружу в поре. РВГ; ретровезикулярный ганглий (Altun and Hall 2012)
Мужская репродуктивная система
Половые органы нематод представляют собой простые трубчатые структуры, которые являются продолжением их протоков, поэтому ни сперматозоиды, ни яйца не попадают в псевдоциелом (Bird and Bird 1991).Мужская репродуктивная система состоит из семенников и протоков, таких как семявыносящие протоки, семенных пузырьков и эякуляционных протоков, в дополнение к дополнительным органам, включая спикулы, копулятивную сумку и генитальные крылья (Baran 2011). У secernenteans есть только один тест (монорхический) по сравнению с аденофором, который имеет два семенника (диорхический) (Bird and Bird 1991). Яички представляют собой трубчатые структуры, выстланные эпителием и железистой тканью, сперматозоиды вырабатываются на конце и созревают по мере того, как они мигрируют к общему отверстию клоаки.Проксимальный, расположенный выше по течению конец трубки — это твердое яичко небольшого диаметра, покрытое эпителием (рис.). Он заполнен маленькими сферическими первичными зародышевыми клетками и не имеет просвета. Первичные половые клетки связаны с ветвящимся ядром, или рахисом. Митотические деления половых клеток продуцируют сперматогонии, которые перемещаются вниз по течению, чтобы подвергнуться сперматогенезу. Могут присутствовать несколько отделов яичка. Следующая область мужской трубки — семявыносящий проток. Он немного больше в диаметре, чем семенник, и также покрыт тонким эпителием.Его внутренняя часть заполнена сперматогониями и их дочерями, подвергающимися сперматогенезу.
У secernenteans есть только один тест (монорхический) по сравнению с аденофором, который имеет два семенника (диорхический) (Bird and Bird 1991). Яички представляют собой трубчатые структуры, выстланные эпителием и железистой тканью, сперматозоиды вырабатываются на конце и созревают по мере того, как они мигрируют к общему отверстию клоаки.Проксимальный, расположенный выше по течению конец трубки — это твердое яичко небольшого диаметра, покрытое эпителием (рис.). Он заполнен маленькими сферическими первичными зародышевыми клетками и не имеет просвета. Первичные половые клетки связаны с ветвящимся ядром, или рахисом. Митотические деления половых клеток продуцируют сперматогонии, которые перемещаются вниз по течению, чтобы подвергнуться сперматогенезу. Могут присутствовать несколько отделов яичка. Следующая область мужской трубки — семявыносящий проток. Он немного больше в диаметре, чем семенник, и также покрыт тонким эпителием.Его внутренняя часть заполнена сперматогониями и их дочерями, подвергающимися сперматогенезу.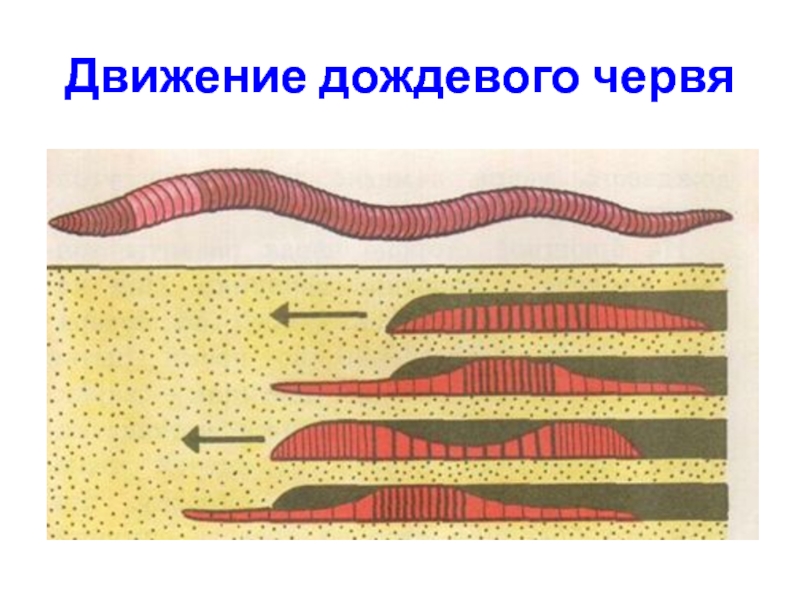 Организация содержимого семявыносящего протока более рыхлая, чем у семенника, а его половые клетки крупнее и не прикреплены к позвоночнику. Просвет присутствует, хотя он может быть незаметен, поскольку он заполнен развивающимися половыми клетками. Следующая область мужского протока — семенной пузырек. Стенки эпителия этой области намного толще, чем стенки верхних отделов половой трубы. Эякуляторный проток, который является наиболее низовой областью мужской системы, слишком далеко кзади, чтобы находиться в том же поперечном сечении, что и семенник и семявыносящий проток (Fox 2006).
Организация содержимого семявыносящего протока более рыхлая, чем у семенника, а его половые клетки крупнее и не прикреплены к позвоночнику. Просвет присутствует, хотя он может быть незаметен, поскольку он заполнен развивающимися половыми клетками. Следующая область мужского протока — семенной пузырек. Стенки эпителия этой области намного толще, чем стенки верхних отделов половой трубы. Эякуляторный проток, который является наиболее низовой областью мужской системы, слишком далеко кзади, чтобы находиться в том же поперечном сечении, что и семенник и семявыносящий проток (Fox 2006).
Организация зародышевой линии взрослых мужчин. Nomarski DIC-изображение хвостовой части взрослого самца с отделениями репродуктивного тракта, вид сбоку. DG Дистальная гонада, PG проксимальная гонада, DTC клетка дистального конца (Altun and Hall 2012)
Женская репродуктивная система
В отличие от мужской репродуктивной системы женская репродуктивная система двойная, поэтому есть два яичника, два яйцевода и две матки. Есть только одно влагалище и гонопора, но они не будут представлены на слайде.Самые мелкие участки — это завязь. Их легко распознать, потому что они твердые, в то время как яйцеводы и матка полые. Яичник имеет центральное клеточное ядро, известное как рахис, от которого исходит единственный слой длинных узких первичных половых клеток. Их ядра обычно легко увидеть. Митотические деления половых клеток продуцируют оогонии, которые перемещаются вниз по течению, когда они подвергаются оогенезу. Яичник и яйцевод окружены тонким эпителием, который часто отделяется от зародышевых клеток, оставляя между ними белое пространство.Яйцевод почти такой же, как и яичник, но немного больше в диаметре и полый. Его эпителий похож на эпителий яичника и толстый, но имеет небольшой просвет вместо рахиса. Вокруг просвета находится один толстый слой оогониев (вверх по течению) или ооцитов (дальше вниз по течению). Матки намного больше, чем яйцеводы или яичники. Они заполнены большими «яйцами» с оболочкой на разных стадиях оогенеза и развития, а стенка матки толстая и мускулистая (Fox 2006).
Есть только одно влагалище и гонопора, но они не будут представлены на слайде.Самые мелкие участки — это завязь. Их легко распознать, потому что они твердые, в то время как яйцеводы и матка полые. Яичник имеет центральное клеточное ядро, известное как рахис, от которого исходит единственный слой длинных узких первичных половых клеток. Их ядра обычно легко увидеть. Митотические деления половых клеток продуцируют оогонии, которые перемещаются вниз по течению, когда они подвергаются оогенезу. Яичник и яйцевод окружены тонким эпителием, который часто отделяется от зародышевых клеток, оставляя между ними белое пространство.Яйцевод почти такой же, как и яичник, но немного больше в диаметре и полый. Его эпителий похож на эпителий яичника и толстый, но имеет небольшой просвет вместо рахиса. Вокруг просвета находится один толстый слой оогониев (вверх по течению) или ооцитов (дальше вниз по течению). Матки намного больше, чем яйцеводы или яичники. Они заполнены большими «яйцами» с оболочкой на разных стадиях оогенеза и развития, а стенка матки толстая и мускулистая (Fox 2006).
Значение ультраструктурных исследований нематод
Податливость и консервативность генов многих видов нематод подтверждают важность их исследований ультраструктуры, которые позволяют использовать их в качестве моделей для различных биологических процессов; включая человеческие болезни, старение, иммунитет, развитие, экологию, эволюцию и взаимодействия между хозяином и бактериями (Aboobaker and Blaxter 2000; Couillault and Ewbank 2002; Goodrich-Blair and Clarke 2007; Mitreva et al. 2009; Markaki and Tavernarakis 2010; Neher 2010) ; Сюй и Ким 2011).Кроме того, ультраструктура и иммунолокализация двух изоферментов, глутатион-S-трансферазы (GST1) и (GST2) были выполнены с использованием электронной микроскопии иммунного золота. Эти изоферменты были обнаружены в кутикуле и внешней гиподерме Onchocerca volvulous и считались секретируемыми белками. (Wildenburg et al. 1998). В C. elegans детальная реконструкция ПЭМ была необходима для понимания сложности межклеточных отношений в пространственной топологии и межклеточных соединений для коммуникации на протяжении всего развития (Nguyen et al. 1999).
1999).
На самом деле показано, что разнообразная и дизъюнктивная ультраструктура нематод отслеживает молекулярную филогению, даже если классически их сигналы выглядят сильно контрастирующими. Следовательно, изучение ультраструктуры нематод имеет широкое значение для выражения филогеномики, которая предсказывает примат молекулярных данных для вывода о древе жизни (Rokas et al. 2003).
Эти данные предлагают приложение для разрешения деталей многоклеточных комплексов в масштабе, полезном для проверки гипотез филогении.В результате доступны точные карты топографии клеток в области головы трех отдаленно родственных нематод, что позволяет использовать минимально филогенетический подход (Ragsdale and Baldwin 2010).
Несмотря на свою зловещую репутацию, изучение ультраструктур паразитических нематод также может иметь много положительных последствий для интересов и здоровья человека. Например, энтомопатогенные нематоды (EPN), такие как steinernematids и heterorhabditids, коммерчески используются в качестве агентов биологической борьбы с вредителями сельскохозяйственных культур (Grewal et al. 2005).
2005).
Кроме того, паразитические нематоды человека проходят испытания на предмет терапевтического использования при многих аутоиммунных заболеваниях (Summers et al. 2005; Kuijk and van Die 2010; Correale and Farez 2011).
Ввиду фитосанитарного значения нематод рода Bursaphelenchus и ограниченной информации об их ультраструктуре, в средиземноморских лесных местообитаниях Италии была проведена программа исследований вредных фитопаразитических нематод и их переносчиков в средиземноморских лесных местообитаниях Италии для получения информации о морфологии. , биология, вредоносность и стратегии борьбы с аборигенными видами, связанными с исчезновением деревьев-хозяев (Carletti et al.2013).
Учитывая взаимодействие паразита и хозяина, была исследована активность антибиотиков рифампицина, окситетрациклина и хлорамфеникола против филяриатных паразитов. Кроме того, просвечивающая электронная микроскопия использовалась для изучения эффектов рифампицина и окситетрациклина на филяриальные ткани и на эндосимбионтную бактерию, Wolbachia . Ультраструктурные исследования этих обработанных червей показали, что практически все бактерии были удалены из тканей паразита. Ткани взрослых червей выглядели в основном неповрежденными, но с гранулематозным ответом клеток-хозяев, прилипших к некоторым образцам.Однако развивающиеся маточные формы оказались аномальными и сильно поврежденными, что свидетельствует об отмене эмбриогенеза (Townson et al. 2000).
Ультраструктурные исследования этих обработанных червей показали, что практически все бактерии были удалены из тканей паразита. Ткани взрослых червей выглядели в основном неповрежденными, но с гранулематозным ответом клеток-хозяев, прилипших к некоторым образцам.Однако развивающиеся маточные формы оказались аномальными и сильно поврежденными, что свидетельствует об отмене эмбриогенеза (Townson et al. 2000).
Примечательно, что методы изучения взаимодействия Wolbachia / filaria на ультраструктурном уровне остались неизменными, а механизмы обмена материалами и подвижность эндобактерий не известны. Недавно замена замораживания / замораживания под высоким давлением значительно улучшила сохранность филяриальных тканей для электронной микроскопии, чтобы выявить мембраны и субклеточные ультраструктуры, которые могут иметь решающее значение для обмена материалами между Wolbachia и его хозяином (Fischer et al.2014).
В заключение, информация, представленная в этом обзоре, может способствовать объяснению биологии этих малоизвестных паразитов.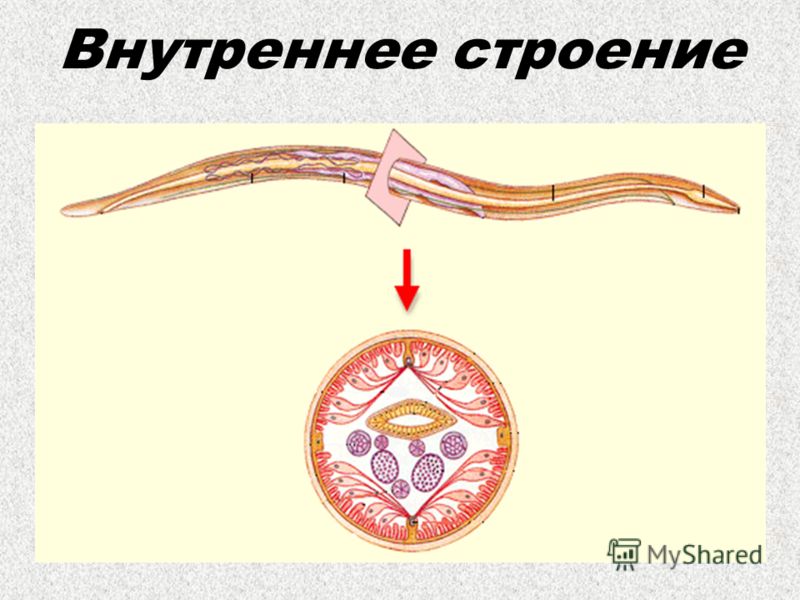 Следовательно, дальнейшие исследования с использованием ПЭМ могут быть направлены на сопоставление ультраструктуры нематод с их функциями. Более того, перспективные исследования ультраструктуры нематод должны быть сосредоточены на расширении изучаемых географических областей, одновременно расширяя исследование на других возможных хозяев нематод — человека.
Следовательно, дальнейшие исследования с использованием ПЭМ могут быть направлены на сопоставление ультраструктуры нематод с их функциями. Более того, перспективные исследования ультраструктуры нематод должны быть сосредоточены на расширении изучаемых географических областей, одновременно расширяя исследование на других возможных хозяев нематод — человека.
Ссылки
- Aboobaker AA, Blaxter ML.Медицинское значение Caenorhabditis elegans . Ann Med. 2000; 32: 23–30. DOI: 10.3109 / 078538
995906. [PubMed] [CrossRef] [Google Scholar]
- Агинальдо А., Турбевилль Дж., Линфорд Л., Ривера М., Гарей Дж., Рафф Р., Лейк Дж. Свидетельства о кладе нематод, членистоногих и других линяющих животных. Природа. 1997. 387: 489–493. DOI: 10.1038 / 387489a0. [PubMed] [CrossRef] [Google Scholar]
- Altun ZF, Hall DH (2009) Мышечная система, соматическая мышца. Червь Атлас. DOI: 10.3908 / wormatlas.1,7
- Altun ZF, Hall DH (2012) Справочник по анатомии C.
 elegans . Атлас червей. Http://www.wormatlas.org/hermaphrodite/hermaphroditehomepage.htm
elegans . Атлас червей. Http://www.wormatlas.org/hermaphrodite/hermaphroditehomepage.htm - Avery L, Thomas JH (1997) C. elegans , Кормление и дефекация In: Riddle DL, Blumenthal T, Meyer BJ (eds. ). 2-е изд. Лаборатория издательства Колд-Спринг-Харбор (штат Нью-Йорк), Нью-Йорк
- Баран М. Репродуктивная система нематод. Паразитология. 2011; 7: 163. [Google Scholar]
- Берд А.Ф., Берд Дж. Строение нематод.Сан-Диего: академическая пресса; 1991. [Google Scholar]
- Blaxter ML, Robertson WM. Кутикула. В: Перри Р.Н., Райт DJ, редакторы. Физиология и биохимия свободноживущих нематод и нематод, паразитирующих на растениях. Нью-Йорк: CAB International; 1998. С. 25–48. [Google Scholar]
- Богитш Б., Картер С., Оельтманн Т. (2005) Общая характеристика нематод. В: Паразитология человека 15: 308
- Болла Р.И., Вайнштейн П.П., Каин Г.Д. Тонкая структура целомоцита взрослого человека Ascaris sum .J Parasitol. 1972; 58: 1025–1036.
 DOI: 10.2307 / 3278127. [PubMed] [CrossRef] [Google Scholar]
DOI: 10.2307 / 3278127. [PubMed] [CrossRef] [Google Scholar] - Бухсбаум Р., Бухсбаум М., Пирс Дж., Пирс В. Животные без позвоночника. Чикаго: Издательство Чикагского университета; 1987. [Google Scholar]
- Burr A, Gans C. Механическое значение косо-полосатой архитектуры в мышцах нематод. Biol Bull. 1987. 194 (1): 1–6. DOI: 10.2307 / 1542507. [PubMed] [CrossRef] [Google Scholar]
- Campbell NC, Reece JR (2002) Sharon-taxonomy, 2010-p2.В: Биология нематод 6-е (изд.) Сан-Франциско: Бенджамин Каммингс. http://www.apsnet.org/edcenter/illglossary/Article%20Images/amphid
- Carletti B, Paoli F, Isidoro N, Roversi PF (2013) Ультраструктура переднего пищеварительного тракта Bursaphelenchus mucronatus (Nematoda Aphelenchoididae) . REDIA, XCVI; 69–77
- Чаппелл Л. Функциональная биология нематод. J Trop Ecol. 1986; 2: 92. DOI: 10.1017 / S026646740000064X. [CrossRef] [Google Scholar]
- Чен З, Чен С., Диксон Д.Нематология: достижения и перспективы.
 Основной нервный элемент. 2004; 1: 221. [Google Scholar]
Основной нервный элемент. 2004; 1: 221. [Google Scholar] - Корреале Дж., Фарез М. Влияние паразитарных инфекций на течение рассеянного склероза. J Neuroimmunol. 2011; 233: 6–11. DOI: 10.1016 / j.jneuroim.2011.01.002. [PubMed] [CrossRef] [Google Scholar]
- Couillault C, Ewbank J. Разнообразные бактерии являются патогенами Caenorhabditis elegans . Заражение иммунной. 2002; 70: 4705–4707. DOI: 10.1128 / IAI.70.8.4705-4707.2002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Decraemer W., Karanastasi E, Brown D, Backeljau T.Обзор ультраструктуры кутикулы тела нематоды и ее филогенетическая интерпретация. Биол Ред. 2003; 78: 465–510. DOI: 10.1017 / S1464793102006115. [PubMed] [CrossRef] [Google Scholar]
- Du Four R, Guerena M, Earles R (2003) Альтернативный контроль нематод. ATTRA — Национальная информационная служба по устойчивому сельскому хозяйству http://www.oisat.org/downloads/nematode
- Fagerholm H, Bruňanská M, Roepstorff A, Eriksen L.
 Ультраструктура фасмид аскаридоидной нематодегистеротилации auctum.J Parasitol. 2004. 90 (3): 499–506. DOI: 10.1645 / GE-3168. [PubMed] [CrossRef] [Google Scholar]
Ультраструктура фасмид аскаридоидной нематодегистеротилации auctum.J Parasitol. 2004. 90 (3): 499–506. DOI: 10.1645 / GE-3168. [PubMed] [CrossRef] [Google Scholar] - Феттерер Р.Х., Роадс М.Л. Биохимия кутикулы нематод: отношение к паразитическим нематодам домашнего скота. Vet Parasitol. 1993. 46 (1–4): 103–111. DOI: 10.1016 / 0304-4017 (93) -N. [PubMed] [CrossRef] [Google Scholar]
- Фишер К., Битти В., Вейл Дж., Фишер П. Замораживание / замораживание под высоким давлением Фиксация улучшает ультраструктурную оценку взаимодействия эндосимбионта wolbachia и филяриальной нематоды-хозяина.PLoS One. 2014 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Фокс Р. Анатомия беспозвоночных в Интернете. Ascaris suum Pig Roundworm: Университет Ландера; 2006. [Google Scholar]
- Fürst von Lieven A, Bärmann VW. Как нематоды могут спариваться без спикул? Функция мужских половых желез у аскариды Myolaimus . Зоология. 2005. 108 (3): 211–216. DOI: 10.
 1016 / j.zool.2005.04.002. [PubMed] [CrossRef] [Google Scholar]
1016 / j.zool.2005.04.002. [PubMed] [CrossRef] [Google Scholar] - Гарднер С. Вормс, Nematoda. В кн .: Левин С.А., редактор.Энциклопедия биоразнообразия. Линкольн: Academic Press, Университет Небраски; 2001. [Google Scholar]
- Гоглер Р., Билграми А. (2004) Поведение нематод, поведение передвижений, Роль гидростатического скелета, стр. 27
- Гиббонс Л. Справочник СЭМ по морфологии нематод-паразитов позвоночных. Oxu: CAB International; 1986. [Google Scholar]
- González C, Hamann M. Первое сообщение о нематодных паразитах Physalaemus santafecinus (Anura: Leiuperidae) из Корриентеса, Аргентина.Rev Mex Biodiv. 2010; 81: 3. [Google Scholar]
- González C, Hamann M, Salgad C (2012) Исследование гельминтов-паразитов земноводных с помощью сканирующей электронной микроскопии, сканирующей электронной микроскопии, д-р Вячеслав Казмирук (редактор), ISBN: 51
- Goodrich-Blair H , Кларк Д. Мутуализм и патогенез у Xenorhabdus и Photorhabdus: две дороги к одному месту назначения.
 Mol Microbiol. 2007. 64: 260–268. DOI: 10.1111 / j.1365-2958.2007.05671.x. [PubMed] [CrossRef] [Google Scholar]
Mol Microbiol. 2007. 64: 260–268. DOI: 10.1111 / j.1365-2958.2007.05671.x. [PubMed] [CrossRef] [Google Scholar] - Гревал П., Элерс С., Шапиро-Илан Д.Нематоды как агенты биоконтроля. Уоллингфорд: CABI Publishing; 2005. [Google Scholar]
- Gutierrez Y (2000) Нематоды, полость тела. В: Диагностическая патология паразитарных инфекций с клиническими корреляциями, 2-е (edn), p 278
- Harris JE, Crofton HD. Строение и функции нематод: внутреннее давление и структура кутикулы у Ascaris . J Exp Biol. 1957; 34: 116–130. [Google Scholar]
- Херндон Л.А., Шмайсснер П.Дж., Дударонек Дж.М., Браун П.А., Листнер К.М., Сакано И., Паупар М.С., Холл Д.Х., Дрисколл М.Стохастические и генетические факторы влияют на тканеспецифическое снижение старения C. elegans . Природа. 2002; 419: 808–814. DOI: 10,1038 / природа01135. [PubMed] [CrossRef] [Google Scholar]
- Херндон Л.А., Алтун З.Ф., Холл Д.Х. (2010) Глоссарий Б. WormAtlas. doi: 10.3908 / wormatlas.
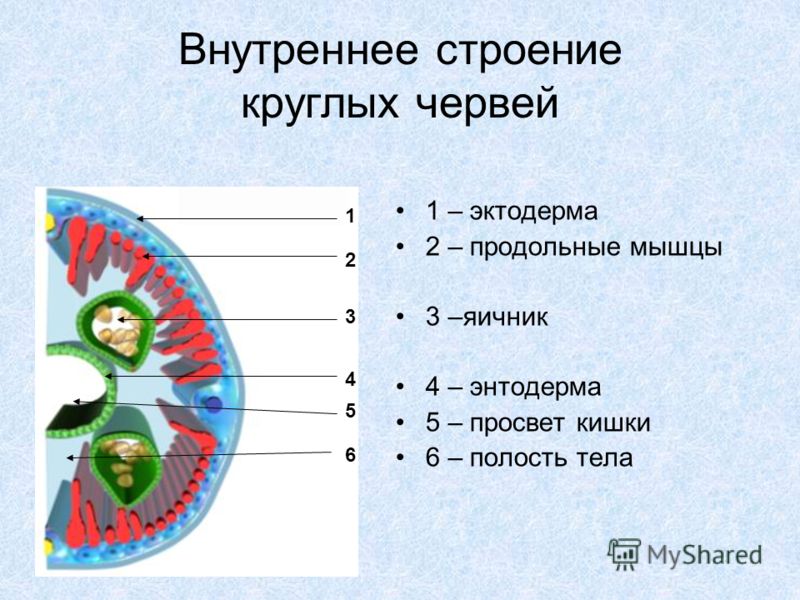 6.2
6.2 - Kuijk LM, van Die I. Черви приходят на помощь: могут ли гликаны червей защитить от аутоиммунных заболеваний? МСБМБ Жизнь. 2010. 62: 303–312. [PubMed] [Google Scholar]
- Ли DL. Доказательства сенсорной функции копулятивных спикул нематод.J Zool. 1973; 169: 281–285. DOI: 10.1111 / j.1469-7998.1973.tb04557.x. [CrossRef] [Google Scholar]
- Ли DL. Биология нематод, секреторно-выделительная система. Эндокринология. 2003. 76: 112–114. [Google Scholar]
- Lewbart G (2011) Нематоды, нервная система В: Медицина беспозвоночных, 2-е изд. John Wiley & Sons
- Markaki M, Tavernarakis N. Моделирование болезней человека в Caenorhabditis elegans . Biotechnol J. 2010; 5: 1261–1276. DOI: 10.1002 / biot.201000183.[PubMed] [CrossRef] [Google Scholar]
- Мельхорн Х. Энциклопедия паразитологии. Великобритания: Kluwer Academic Publishers; 2008. [Google Scholar]
- Митрева М., Смант Дж., Хелдер Дж. Роль горизонтального переноса генов в эволюции паразитизма растений среди нематод.
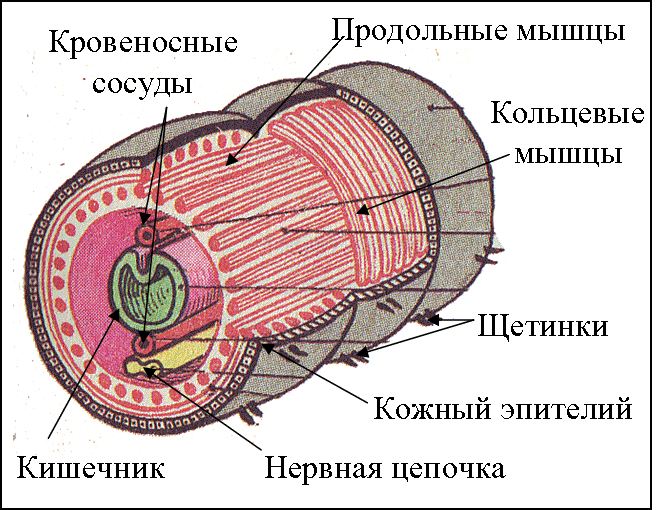 Методы Мол биол. 2009; 532: 517–535. DOI: 10.1007 / 978-1-60327-853-9_30. [PubMed] [CrossRef] [Google Scholar]
Методы Мол биол. 2009; 532: 517–535. DOI: 10.1007 / 978-1-60327-853-9_30. [PubMed] [CrossRef] [Google Scholar] - Neher DA. Экология растений и свободноживущих нематод в естественных и сельскохозяйственных почвах. Анну Рев Фитопатол.2010. 48: 371–394. DOI: 10.1146 / annurev-phyto-073009-114439. [PubMed] [CrossRef] [Google Scholar]
- Нехер Д.А., Пауэрс Т. (2005) Нематоды. www.uvm.edu/dneher/Publications/encyclopedia
- Nelson K, Albert S. Riddle D (1983) Тонкая структура секреторно-выделительной системы Caenorhabditis elegans F. J Ultrastruc Res. 1983; 82: 156–171. DOI: 10.1016 / S0022-5320 (83)
-3. [PubMed] [CrossRef] [Google Scholar]
- Nguyen CQ, Hall DH, Yang Y, Fitch DHA. Морфогенез кончика хвоста самца Caenorhabditis elegans .Dev Biol. 1999. 207: 86–106. DOI: 10.1006 / dbio.1998.9173. [PubMed] [CrossRef] [Google Scholar]
- Оливейра-Менезеш А., Нороэс Дж., Драйер Дж., Ланфреди Р. Ультраструктурный анализ стенки тела wuchereria bancrofti (Nematoda: Filarioidea).
 Микрон. 2010. 41: 526–531. DOI: 10.1016 / j.micron.2010.01.007. [PubMed] [CrossRef] [Google Scholar]
Микрон. 2010. 41: 526–531. DOI: 10.1016 / j.micron.2010.01.007. [PubMed] [CrossRef] [Google Scholar] - Рэгсдейл Э., Болдуин Дж. Устранение филогенетического несоответствия для определения гомологии и фенотипической эволюции: пример из Nematoda. Proc R Soc. 2010; 9277: 1299–1307.DOI: 10.1098 / rspb.2009.2195. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Раммах А., Хиршманн Х. Морфологическое сравнение и таксономическая полезность копулятивных структур отдельных видов нематод. J Nematol. 1987. 19 (3): 314–323. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Робертс Л.С., Янови Дж. Фонд паразитологии. Лондон: WMC Brown; 1996. [Google Scholar]
- Рокас А., Уильямс Б.Л., Кинг Н., Кэрролл С.Б. Подходы на уровне генома к разрешению несоответствия в молекулярных филогенезах.Природа. 2003; 425: 798–804. DOI: 10,1038 / природа02053. [PubMed] [CrossRef] [Google Scholar]
- Scheffers BR, Joppa LN, Pimm SL, Laurance WF. Что мы знаем и чего не знаем об отсутствии биоразнообразия на Земле.
 Trends Ecol Evol. 2012; 27: 501–510. DOI: 10.1016 / j.tree.2012.05.008. [PubMed] [CrossRef] [Google Scholar]
Trends Ecol Evol. 2012; 27: 501–510. DOI: 10.1016 / j.tree.2012.05.008. [PubMed] [CrossRef] [Google Scholar] - Storer T, Usinger R, Stebbins R, Nybakken J. Общая зоология. 6. Нью-Йорк: Книжная компания Макгроу-Хилл; 1979. [Google Scholar]
- Summers RW, Elliott D, Urban J, Jr, Thompson R, Weinstock J. Trichuris suis Терапия активного язвенного колита: рандомизированное контролируемое исследование. Гастроэнтерология. 2005; 128: 825–832. DOI: 10.1053 / j.gastro.2005.01.005. [PubMed] [CrossRef] [Google Scholar]
- Телфорд MJ, Bourlat SJ, Economou A, Papillon D, Rota-Stabelli O. Эволюция Ecdysozoa. Филос Транс Соц Лондон Б. 2008; 363: 1529–1537. DOI: 10.1098 / rstb.2007.2243. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Проект по нематодам Дарвина (2006) Структура нематод: Общее введение в морские нематоды.Амфиды. http://www.pml-nematode.org.uk
- Townson S, Hutton D, Siemienska J, Hollick L, Scanlon T, Tagboto SK, Taylor MJ.
 Антибиотики и вольбахия при филяриальных нематодах: антифиляриальная активность рифампицина, окситетрациклина и хлорамфеникола против Onchocerca gutturosa, Onchocerca lienalis и Brugia pahangi . Ann Trop Med Parasitol. 2000. 94 (8): 801–816. DOI: 10.1080 / 00034983.2000.11813605. [PubMed] [CrossRef] [Google Scholar]
Антибиотики и вольбахия при филяриальных нематодах: антифиляриальная активность рифампицина, окситетрациклина и хлорамфеникола против Onchocerca gutturosa, Onchocerca lienalis и Brugia pahangi . Ann Trop Med Parasitol. 2000. 94 (8): 801–816. DOI: 10.1080 / 00034983.2000.11813605. [PubMed] [CrossRef] [Google Scholar] - Вагонер Б.М. (2004) Учебное пособие по паразитологии нематод.Осень 2012 г. Heth: 3–10. http://www.ucmp.berkeley.edu/phyla/ecdysozoa/nematoda.html
- Wallace Lee R, Ricci C, Melone G. Кладистический анализ морфологии псевдокеломата (ашельминта). Invertebr Biol. 1996. 115 (2): 104–112. DOI: 10.2307 / 3227041. [CrossRef] [Google Scholar]
- Wildenburg G, Liebau E, Henkel-Duhresen K. Onchoceca volvulous: ультраструктурная локализация глутатион-S-трансферазы. Exp Parasitol. 1998. 88 (1): 34–42. DOI: 10.1006 / expr.1998.4189. [PubMed] [CrossRef] [Google Scholar]
- Райт К.А., Томсон Дж.Буккальная капсула C. elegans (Nematoda: Rhabditoidea): ультраструктурное исследование.
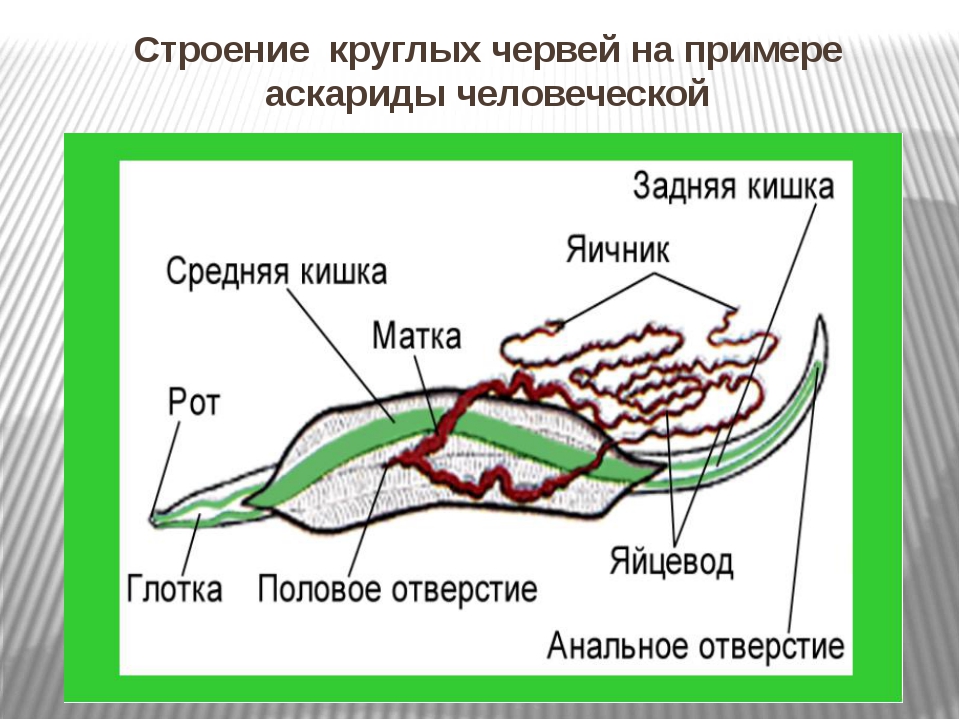 Может J Zool. 2011; 59: 1952–1961. DOI: 10.1139 / z81-266. [CrossRef] [Google Scholar]
Может J Zool. 2011; 59: 1952–1961. DOI: 10.1139 / z81-266. [CrossRef] [Google Scholar] - Xu X, Kim S. Ранняя пташка ловит червя: новые технологии для набора инструментов Caenorhabditis elegans . Nat Rev Genet. 2011; 12: 793–801. DOI: 10,1038 / NRG3050. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Накопление мочевой кислоты в эпидермисе формирует белый покров личинок Samia ricini
Abstract
Белый цвет личиночных покровов тутового шелкопряда Bombyx mori считается результатом накопления мочевой кислоты в его эпидермальных клетках.Личинки шелкопряда eri Samia ricini (Lepidoptera; Saturniidae) также имеют белый непрозрачный покров, но мало что известно о механизме его окраски. В этом исследовании мы сначала выполнили анализ кормления S . ricini личинок с использованием аллопуринола, ингибитора ксантиноксидазы, который катализирует разложение ксантина до мочевой кислоты. Эта обработка индуцировала ясный полупрозрачный фенотип покровов, что указывает на личиночную окраску S . ricini также определяется накоплением мочевой кислоты. Затем исследовать генетическую основу, которая контролирует накопление мочевой кислоты в S . ricini , мы выделили и охарактеризовали S . ricini гомолог млекопитающих биогенез лизосом-связанных органелл комплекса 1 , субъединица 2 ( BLOS2 ), которая, как известно, играет решающую роль в биосинтезе уратных гранул. Мы создали ген нокаут S , опосредованный эффекторной нуклеазой, подобной активатору транскрипции (TALEN). ricini BLOS2 ( SrBLOS2 ) и удалось создать нокаут-штамм SrBLOS2 ( SrBLOS2 KO ). SrBLOS2 KO мутанты проявляли фенотип полупрозрачных личиночных покровов и не обладали мочевой кислотой в эпидермисе, что также наблюдалось у личинок, получавших аллопуринол.
Эта обработка индуцировала ясный полупрозрачный фенотип покровов, что указывает на личиночную окраску S . ricini также определяется накоплением мочевой кислоты. Затем исследовать генетическую основу, которая контролирует накопление мочевой кислоты в S . ricini , мы выделили и охарактеризовали S . ricini гомолог млекопитающих биогенез лизосом-связанных органелл комплекса 1 , субъединица 2 ( BLOS2 ), которая, как известно, играет решающую роль в биосинтезе уратных гранул. Мы создали ген нокаут S , опосредованный эффекторной нуклеазой, подобной активатору транскрипции (TALEN). ricini BLOS2 ( SrBLOS2 ) и удалось создать нокаут-штамм SrBLOS2 ( SrBLOS2 KO ). SrBLOS2 KO мутанты проявляли фенотип полупрозрачных личиночных покровов и не обладали мочевой кислотой в эпидермисе, что также наблюдалось у личинок, получавших аллопуринол. Кроме того, электронная микроскопия показала, что уратные гранулы редко наблюдались в эпидермисе личинок SrBLOS2 KO , тогда как обильные гранулы были обнаружены в эпидермисе личинок дикого типа.Эти результаты ясно продемонстрировали, что личинка S . ricini накапливает мочевую кислоту в виде уратных гранул в эпидермисе, и что генетическая основа, контролирующая накопление мочевой кислоты, эволюционно сохраняется в S . ricini и B . Мори .
Кроме того, электронная микроскопия показала, что уратные гранулы редко наблюдались в эпидермисе личинок SrBLOS2 KO , тогда как обильные гранулы были обнаружены в эпидермисе личинок дикого типа.Эти результаты ясно продемонстрировали, что личинка S . ricini накапливает мочевую кислоту в виде уратных гранул в эпидермисе, и что генетическая основа, контролирующая накопление мочевой кислоты, эволюционно сохраняется в S . ricini и B . Мори .
Образец цитирования: Ли Дж., Киучи Т., Кавамото М., Шимада Т., Кацума С. (2018) Накопление мочевой кислоты в эпидермисе формирует белые покровы личинок Samia ricini .PLoS ONE 13 (10): e0205758. https://doi.org/10.1371/journal.pone.0205758
Редактор: Дж. Джо Халл, Служба сельскохозяйственных исследований Министерства сельского хозяйства США, США
Поступила: 7 июня 2018 г . ; Принята к печати: 1 октября 2018 г .; Опубликовано: 15 октября 2018 г.
; Принята к печати: 1 октября 2018 г .; Опубликовано: 15 октября 2018 г.
Авторские права: © 2018 Lee et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Нуклеотидные последовательности были отправлены в банк данных DDBJ / EMBL / GenBank под номерами доступа LC378373, LC378374 и LC378375 – LC 378377.
Финансирование: JL получает стипендию от Японское общество содействия науке (17J06249). https://kaken.nii.ac.jp/en/grant/KAKENHI-PROJECT-17J06249/. Эта работа была поддержана грантом на научные исследования (A) (15H02482) для TK, TS и SK. https: // kaken.nii.ac.jp/en/grant/KAKENHI-PROJECT-15H02482/. Дополнительная поддержка ТЗ и СК со стороны Японского общества содействия науке (17H06431). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Мочевая кислота — конечный продукт пуринового обмена [1]. Считается, что большинство насекомых просто выделяют мочевую кислоту, чтобы избавиться от избыточного азота.Однако недавние исследования показали, что насекомые повторно используют и утилизируют мочевую кислоту по-разному [2–3]. Личинки Bombyx mori (Lepidoptera: Bombycidae) представляют собой один из примеров. В . Личинки mori накапливают мочевую кислоту в виде уратных гранул в своих эпидермальных клетках [4–5]. Поскольку уратные гранулы рассеивают и отражают внешний свет, личиночный покров B . mori кажется белым и непрозрачным. Следовательно, B . mori Мутантные штаммы с дефектами синтеза, транспорта или накопления мочевой кислоты обнаруживают фенотип полупрозрачных покровов [6–8]. Хотя биологическое значение накопления мочевой кислоты неясно, широко распространено мнение, что уратные гранулы в эпидермальных клетках защищают биомолекулы от фотоокислительного стресса. Мочевая кислота является физиологическим антиоксидантом [9], а мочевая кислота — дефицитная B . Личинки mori сверхчувствительны к ультрафиолетовому (УФ) свету и УФ-индуцированным реактивным формам кислорода [10–11]. Учитывая, что личинки чешуекрылых насекомых, таких как Papilio polyxenes и Spodoptera litura , покровы которых не совсем белые, также накапливают мочевую кислоту [12–13], эта теория кажется весьма правдоподобной, поскольку дикие насекомые постоянно подвергаются воздействию фотоокислительный стресс, вызванный естественным УФ-светом.
Хотя биологическое значение накопления мочевой кислоты неясно, широко распространено мнение, что уратные гранулы в эпидермальных клетках защищают биомолекулы от фотоокислительного стресса. Мочевая кислота является физиологическим антиоксидантом [9], а мочевая кислота — дефицитная B . Личинки mori сверхчувствительны к ультрафиолетовому (УФ) свету и УФ-индуцированным реактивным формам кислорода [10–11]. Учитывая, что личинки чешуекрылых насекомых, таких как Papilio polyxenes и Spodoptera litura , покровы которых не совсем белые, также накапливают мочевую кислоту [12–13], эта теория кажется весьма правдоподобной, поскольку дикие насекомые постоянно подвергаются воздействию фотоокислительный стресс, вызванный естественным УФ-светом.
Чешуекрылые насекомые обычно накапливают мочевую кислоту в эпидермисе, но все еще неясно, способствует ли накопленная мочевая кислота окраске личиночных покровов у других видов чешуекрылых, кроме B . Мори .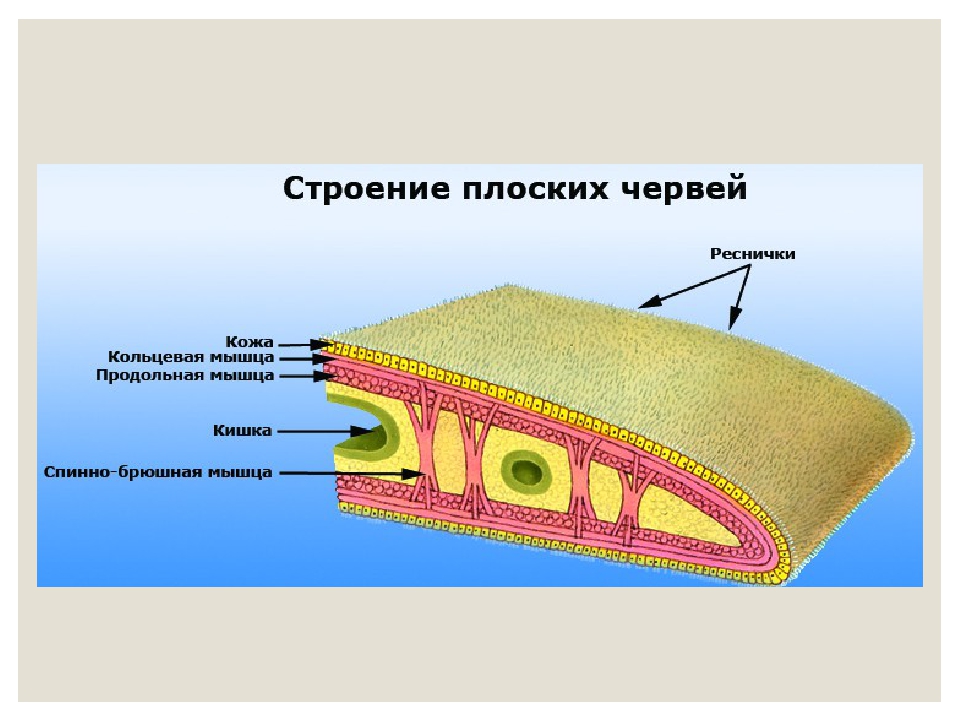 Samia ricini (Lepidoptera; Saturniidae) — гигантский тутовый шелкопряд с белым и непрозрачным личиночным покровом, аналогичный B . mori (рис. 1А). Если накопление мочевой кислоты является причиной белизны личиночных покровов (рис. 1В), то недостаток мочевой кислоты может резко изменить его внешний вид.Целью данного исследования является выявление механизма окраски личиночных покровов S . ricini , мы использовали как физиологический, так и молекулярно-биологический подходы. Во-первых, мы подавили синтез мочевой кислоты в S . ricini личинок через кормление аллопуринолом, ингибитором ксантиноксидазы, который катализирует разложение ксантина до мочевой кислоты. Во-вторых, мы выполнили нокаут, опосредованный эффекторной нуклеазой, подобной активатору транскрипции (TALEN), гомолога гена, участвующего в накоплении мочевой кислоты в B . Мори .
Samia ricini (Lepidoptera; Saturniidae) — гигантский тутовый шелкопряд с белым и непрозрачным личиночным покровом, аналогичный B . mori (рис. 1А). Если накопление мочевой кислоты является причиной белизны личиночных покровов (рис. 1В), то недостаток мочевой кислоты может резко изменить его внешний вид.Целью данного исследования является выявление механизма окраски личиночных покровов S . ricini , мы использовали как физиологический, так и молекулярно-биологический подходы. Во-первых, мы подавили синтез мочевой кислоты в S . ricini личинок через кормление аллопуринолом, ингибитором ксантиноксидазы, который катализирует разложение ксантина до мочевой кислоты. Во-вторых, мы выполнили нокаут, опосредованный эффекторной нуклеазой, подобной активатору транскрипции (TALEN), гомолога гена, участвующего в накоплении мочевой кислоты в B . Мори .
Рис. 1. Графический вид личинки Samia ricini .
(A) Личинка пятого возраста S . Ричини . Покровы белые, непрозрачные. (B) Механизм окраски личиночных покровов Bombyx mori (слева) и гипотетическая модель S . ricini окраска покровов (справа).
https://doi.org/10.1371/journal.pone.0205758.g001
Мы сосредоточились на S . ricini гомолог млекопитающих биогенез связанного с лизосомами комплекса органелл 1 , субъединица 2 ( BLOS2 ), потому что S . ricini BLOS2 ( SrBLOS2 ), вероятно, является Z-сцепленным геном из-за высококонсервативной синтении Z-хромосомы среди чешуекрылых насекомых [13–14]. Путем нацеливания на SrBLOS2 мы наблюдали мутантный фенотип в поколении 1 (G 1 ), потому что самки G 1 могут быть гемизиготными по локусу SrBLOS2 .
В этом исследовании мы обнаружили, что S . Личинки ricini накапливают мочевую кислоту в виде уратных гранул в эпидермисе, и что определенная часть генетической основы, которая контролирует накопление мочевой кислоты, эволюционно сохраняется между S . ricini и B . Мори . Насколько нам известно, это первый отчет об успешном редактировании генома в S . Ричини .
ricini и B . Мори . Насколько нам известно, это первый отчет об успешном редактировании генома в S . Ричини .
Материалы и методы
Насекомые
S . личинок ричини личинок были предоставлены Национальным проектом биологических ресурсов (NBRP; http://shigen.nig.ac.jp/wildmoth/). S . личинок ricini. личинок выращивали на искусственной диете (Insecta LFS, Носан, Канагава, Япония) в условиях длинного дня (16 часов света / 8 часов темноты) при 25 ° C. TALEN-опосредованный ген KO личинок и их потомков (G 0 и G 1 особей) выращивали на листьях Ricinus communis в тех же условиях. Синяя линия была одной из линий замены сегментов хромосомы, полученных в результате обратного скрещивания F 1 индивидуумов между S . ricini и Samia cynthia pryeri , филогенетически близкий к S вид. ricini , а также сохранились в NBRP. Личинки синей линии выращивали на R . communis в условиях короткого дня (12 часов света / 12 часов темноты) при 25 ° C.
Личинки синей линии выращивали на R . communis в условиях короткого дня (12 часов света / 12 часов темноты) при 25 ° C.
Ингибирование синтеза мочевой кислоты в
S . ричини личинкиМы использовали метод, описанный Мацуо и Исикава (1999) [10]. Четыреста миллиграммов аллопуринола (Вако, Осака, Япония) добавляли к 300 г Insecta LFS и вводили в S . ricini на всей стадии личинки. Скорость роста особей, получавших Insecta LFS, неоднородна, что делает невозможным сбор особей на одной и той же стадии развития. В экспериментах на рис. 2 мы использовали людей того же возраста (20 дней).
Рис. 2. Фенотип личинок Samia ricini , обработанных аллопуринолом.
(A) Вид снизу S . ricini личинок, обработанных (справа) или без (слева) аллопуринола. (B) Вид снизу S . ricini личинок, обработанных (справа) или без (слева) аллопуринола. Для облегчения наблюдения рассечены вентральные покровы и удалены внутренние органы. (C) Сравнение концентраций мочевой кислоты в покровах S . ricini личинок, обработанных аллопуринолом или без него. Данные представлены как среднее значение + стандартная ошибка. n = 6. ** p <0,01 по критерию Стьюдента t .
(C) Сравнение концентраций мочевой кислоты в покровах S . ricini личинок, обработанных аллопуринолом или без него. Данные представлены как среднее значение + стандартная ошибка. n = 6. ** p <0,01 по критерию Стьюдента t .
https://doi.org/10.1371/journal.pone.0205758.g002
Количественное определение содержания мочевой кислоты в кожных покровах
S . ричини личинки Покровы 20-дневных личинок или личинок четвертого возраста пятого возраста вскрывали и хранили при -30 ° C до использования. После гомогенизации 0.002 г покровов кипятили в 1000 мкл дистиллированной воды в течение 10 мин. Содержание мочевой кислоты измеряли с использованием набора для анализа мочевой кислоты QuantiChrom (BioAssay Systems, Калифорния, США) в соответствии с протоколами производителя.Мы измерили оптическую плотность каждого образца при 595 нм, используя iMARK Microplate Reader (BIO-RAD, CA, USA), и рассчитали концентрацию мочевой кислоты в каждом образце. Для измерений на мутантах SrBLOS2 KO использовали особи штамма №22.
Для измерений на мутантах SrBLOS2 KO использовали особи штамма №22.
Определение частичных нуклеотидных последовательностей
SrBLOS2 и SrRp49Частичные нуклеотидные последовательности кДНК SrBLOS2 и SrRp49 были получены посредством поиска tBLASTn с использованием S .Данные транскриптома ricini для средней кишки личинок (SilkBase, http://silkbase.ab.a.u-tokyo.ac.jp) с аминокислотными последовательностями B . mori BLOS2 (BmBLOS2, GenBank BAI63077.1) и BmRP49 (GenBank NP_0010
.1) в качестве запросов соответственно. Кроме того, чтобы понять геномную структуру SrBLOS2 , мы разработали три набора праймеров для амплификации его интронов (таблица S1) в соответствии с геномной структурой BmBLOS2 . Геномную ПЦР проводили с использованием KOD FX Neo (ToYoBo, Осака, Япония).Программа ПЦР для SrBLOS2 была следующей: 98 ° C в течение 2 мин; 40 циклов по 10 с при 98 ° C, 30 с при 57 ° C и 3 мин при 68 ° C; и 68 ° C в течение 2 мин.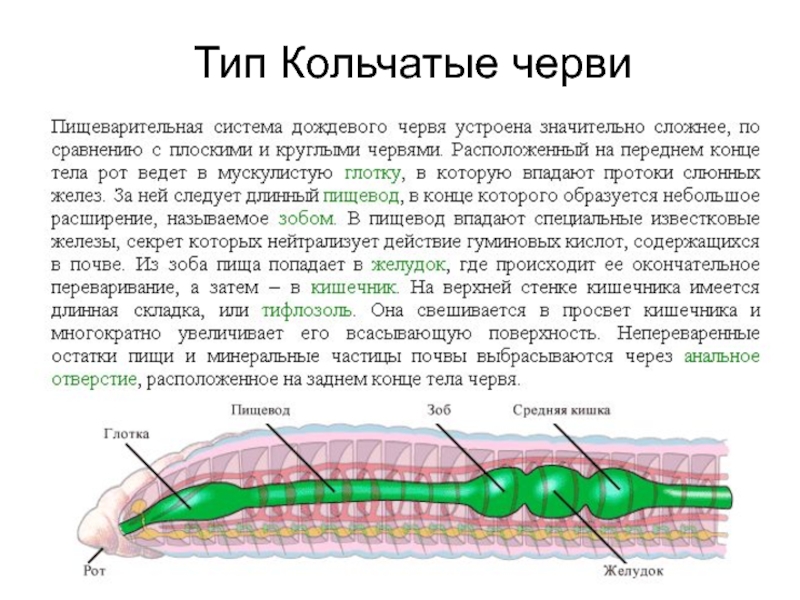 Амплифицированные фрагменты клонировали в векторы pGEM-T Easy (Promega, Мэдисон, Висконсин, США) и секвенировали на генетическом анализаторе 3130xl (Applied Biosystems, Карлсбад, Калифорния, США). Анализ последовательности проводили с использованием GENETYX-MAC версии 16.0.1 (GENETYX Co., Токио, Япония) и ATSQ версии 5.1.3 (GENETYX Co.).
Амплифицированные фрагменты клонировали в векторы pGEM-T Easy (Promega, Мэдисон, Висконсин, США) и секвенировали на генетическом анализаторе 3130xl (Applied Biosystems, Карлсбад, Калифорния, США). Анализ последовательности проводили с использованием GENETYX-MAC версии 16.0.1 (GENETYX Co., Токио, Япония) и ATSQ версии 5.1.3 (GENETYX Co.).
Филогенетический анализ
Филогенетическое дерево гомологов BLOS2 насекомых было построено с использованием MEGA7.0 [15]. История эволюции была выведена с использованием метода максимального правдоподобия, основанного на матричной модели JTT [16]. Было показано дерево с наибольшим логарифмическим правдоподобием (-1293,7573). Процент деревьев, в которых связанные таксоны сгруппированы вместе, был рассчитан с помощью бутстрэппинга с 1000 повторениями. Для создания филогенетического дерева мы использовали 78 аминокислотных последовательностей, включая 12 последовательностей от чешуекрылых насекомых, 3 последовательности от двукрылых насекомых, 27 последовательностей от двукрылых насекомых, 7 последовательностей от жесткокрылых насекомых, 28 последовательностей от перепончатокрылых насекомых и 1 последовательность от человек. sapiens .Номера доступа в GenBank этих аминокислотных последовательностей перечислены в таблице S2.
sapiens .Номера доступа в GenBank этих аминокислотных последовательностей перечислены в таблице S2.
Анализ экспрессии мРНК
SrBLOS2 в S . ричини салфетки Тотальная РНК была извлечена из S . ricini эмбрионов или тканей с использованием реагента TRIzol (Invitrogen, Carlsbad, CA, USA) в соответствии с протоколом производителя и подвергнутых обратной транскрипции с использованием обратной транскриптазы SuperScript III (Thermo Fisher Scientific, Массачусетс, США) с праймерами олиго-dT (TaKaRa Bio , Сига, Япония).ОТ-ПЦР выполняли с использованием KOD FX Neo (ToYoBo) или Ex-Taq (TaKaRa). Используемые праймеры перечислены в таблице S1. Программа ПЦР для SrBLOS2 была следующей: 98 ° C в течение 2 мин; 40 циклов по 10 с при 98 ° C, 30 с при 60 ° C и 15 с при 68 ° C; и 68 ° C в течение 2 мин. Программа ПЦР для SrRp49 была следующей: 94 ° C в течение 2 минут; 25 циклов по 20 с при 94 ° C, 30 с при 60 ° C и 30 с при 72 ° C; и 72 ° C в течение 10 мин. Амплифицированные фрагменты SrBLOS2 и SrRp49 клонировали в векторы pGEM-T Easy и секвенировали на генетическом анализаторе 3130xl.Анализ последовательности проводился с использованием GENETYX-MAC версии 16.0.1 и ATSQ версии 5.1.3.
Амплифицированные фрагменты SrBLOS2 и SrRp49 клонировали в векторы pGEM-T Easy и секвенировали на генетическом анализаторе 3130xl.Анализ последовательности проводился с использованием GENETYX-MAC версии 16.0.1 и ATSQ версии 5.1.3.
Строительство ТАЛЕНА, нацеленного на
СрБЛОС2 Пара TALEN была разработана для нацеливания на кодирующую последовательность SrBLOS2 с использованием TALEN Targeter (https://tale-nt.cac.cornell.edu/node/add/talen). Мы локализовали целевой сайт, последовательность которого была 5′-CCAGCTTTGAAGTACTGGAtccacatgaccctgtTATAAGTAGGTTAGCAACTC-3 ‘, на экзоне 2. Нуклеотиды заглавными буквами обозначают сайты связывания RVD левого и правого TALEN.Модули TALE были собраны с использованием Golden Gate TALEN и TAL Effector kit 2.0 (Addgene, Кембридж, Массачусетс, США) в соответствии с высокоэффективными методами строительства, разработанными Cermak et al. (2011) с некоторыми модификациями Takasu et al. (2014) [17,18]. pBlue-TAL (регистрационный номер GenBank KF724948), который был разработан для редактирования генома в B . mori [18], использовали в качестве целевой плазмиды. МРНК TALEN синтезировали in vitro с использованием набора MEGAscript T7 ultra (Ambion, MA, США) в соответствии с протоколами производителя.Очищенную мРНК растворяли в буфере для отжига (100 мМ ацетат калия, 2 мМ ацетат магния, 30 мМ 4- (2-гидроксиэтил) -1-пиперазинэтансульфоновая кислота-КОН, pH 7,4), доводили до трех различных концентраций (200, 400 и 600). нг / мкл) и хранили при -80 ° C до использования. Непосредственно перед инъекцией эмбриона смешивали левую и правую мРНК TALEN.
pBlue-TAL (регистрационный номер GenBank KF724948), который был разработан для редактирования генома в B . mori [18], использовали в качестве целевой плазмиды. МРНК TALEN синтезировали in vitro с использованием набора MEGAscript T7 ultra (Ambion, MA, США) в соответствии с протоколами производителя.Очищенную мРНК растворяли в буфере для отжига (100 мМ ацетат калия, 2 мМ ацетат магния, 30 мМ 4- (2-гидроксиэтил) -1-пиперазинэтансульфоновая кислота-КОН, pH 7,4), доводили до трех различных концентраций (200, 400 и 600). нг / мкл) и хранили при -80 ° C до использования. Непосредственно перед инъекцией эмбриона смешивали левую и правую мРНК TALEN.
Подготовка эмбриона и эмбриональная микроинъекция
Чтобы разрешить S . ricini бабочек для совокупления пары самцов и самок помещали в небольшие бумажные пакеты.Через 18–24 ч совокупления пары разъединяли, а самцов удаляли. Самки моли начали откладывать яйца на стенку бумажного пакета сразу после наступления темноты.
Яйца, отделенные от бумажного пакета, индивидуально прикрепляли к предметному стеклу микроскопа с помощью мгновенного клея. Инъекцию проводили с помощью микроинжектора (IM 300 Microinjector, Narishige, Tokyo, Japan). Примерно 1–5 нл каждого раствора мРНК TALEN вводили в каждый эмбрион через 4–8 ч после откладки яиц.Все процедуры выполнялись при 25 ° C. Введенные эмбрионы инкубировали при 25 ° C в увлажненной чашке Петри, что способствовало их вылуплению через 10 дней.
Переход G
0 лицВзрослые особи G 0 бабочек скрещивались друг с другом. После использования девственных особей противоположного пола бабочки G 0 были скрещены с бабочками дикого типа. Через 36–48 ч совокупления пары разъединяли и удаляли самцов. Все родители трех штаммов, описанных в разделе результатов, были G 0 особей.
Обнаружение и секвенирование ДНК мутаций у G
1 особей Десять только что вылупившихся личинок из каждого выводка собирали в одну пробирку, и геномную ДНК экстрагировали методом HotSHOT [19]. Этот шаг был повторен для другой группы из 10 только что вылупившихся личинок. Геномную ПЦР проводили с использованием KOD FX Neo (ToYoBo) со специфическими праймерами (таблица S1). Продукты ПЦР разбавляли в 2 раза буфером 1 × TE, денатурировали и гибридизовали следующим образом: 95 ° C в течение 10 мин; снижение со скоростью −2 ° C / с до 85 ° C и −0.От 1 ° C / с до 25 ° C; и, наконец, выдержка при 4 ° C. Электрофорез на микрочипах повторно гибридизованных продуктов ПЦР проводили с использованием MultiNA (Shimadzu, Kyoto, Japan). Продукты ПЦР локуса SrBLOS2 также использовали для секвенирования ДНК после клонирования в векторы pGEM-T Easy. Для каждого выводка было отобрано 20 бактериальных колоний и проанализировано путем секвенирования ДНК. Что касается штамма № 28, геномную ДНК экстрагировали из трех личинок самцов G 2 с использованием набора DNeasy Blood & Tissue (QIAGEN, Hilden, Германия) и использовали для секвенирования ДНК их локусов SrBLOS2 .
Этот шаг был повторен для другой группы из 10 только что вылупившихся личинок. Геномную ПЦР проводили с использованием KOD FX Neo (ToYoBo) со специфическими праймерами (таблица S1). Продукты ПЦР разбавляли в 2 раза буфером 1 × TE, денатурировали и гибридизовали следующим образом: 95 ° C в течение 10 мин; снижение со скоростью −2 ° C / с до 85 ° C и −0.От 1 ° C / с до 25 ° C; и, наконец, выдержка при 4 ° C. Электрофорез на микрочипах повторно гибридизованных продуктов ПЦР проводили с использованием MultiNA (Shimadzu, Kyoto, Japan). Продукты ПЦР локуса SrBLOS2 также использовали для секвенирования ДНК после клонирования в векторы pGEM-T Easy. Для каждого выводка было отобрано 20 бактериальных колоний и проанализировано путем секвенирования ДНК. Что касается штамма № 28, геномную ДНК экстрагировали из трех личинок самцов G 2 с использованием набора DNeasy Blood & Tissue (QIAGEN, Hilden, Германия) и использовали для секвенирования ДНК их локусов SrBLOS2 .
Просвечивающая электронная микроскопия (ПЭМ)
Кожные покровы личинок пятого возраста 4 дня ( SrBLOS2 KO и дикого типа) вскрывали, фиксировали в течение 24 часов при 4 ° C в 4% параформальдегиде в фосфатном буферном растворе и дважды промывали фосфатным буферным раствором для 10 мин на льду.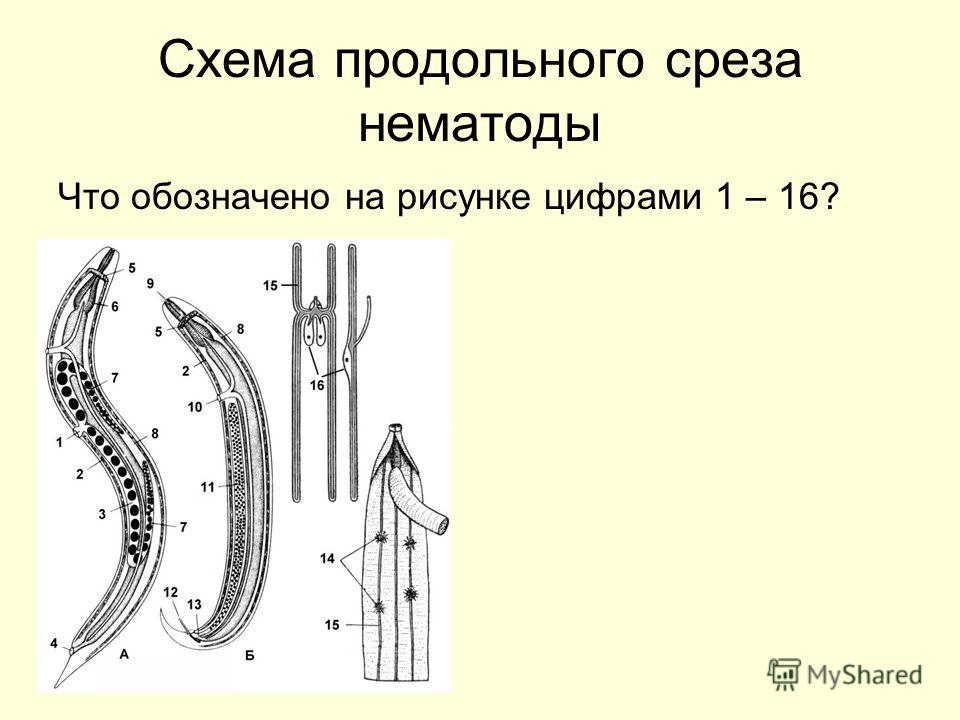 Вторичную фиксацию проводили в течение 3 ч при 4 ° C в 2% оксиде осмия (VIII) в фосфатном буферном растворе, а образцы дважды промывали фосфатным буферным раствором в течение 10 мин на льду.После фиксации ткани дегидратировали в серии градиентных этанолов. На заключительном этапе обезвоживания ткани, пропитанные абсолютным этанолом, помещали на ночь при 4 ° C. Заливку проводили с использованием набора для заделки с низкой вязкостью Spurr (Polysciences, Warrington, PA, USA) в соответствии с протоколами производителя. Полимеризацию проводили при 70 ° C в течение 24 ч. Срезы толщиной восемьдесят нанометров вырезали и окрашивали 4% уранилацетатом и цитратом свинца. Срезы исследовали при 80 кВ под просвечивающим электронным микроскопом (JEM-1400 plus, Nihondenshi, Tokyo, Japan).
Вторичную фиксацию проводили в течение 3 ч при 4 ° C в 2% оксиде осмия (VIII) в фосфатном буферном растворе, а образцы дважды промывали фосфатным буферным раствором в течение 10 мин на льду.После фиксации ткани дегидратировали в серии градиентных этанолов. На заключительном этапе обезвоживания ткани, пропитанные абсолютным этанолом, помещали на ночь при 4 ° C. Заливку проводили с использованием набора для заделки с низкой вязкостью Spurr (Polysciences, Warrington, PA, USA) в соответствии с протоколами производителя. Полимеризацию проводили при 70 ° C в течение 24 ч. Срезы толщиной восемьдесят нанометров вырезали и окрашивали 4% уранилацетатом и цитратом свинца. Срезы исследовали при 80 кВ под просвечивающим электронным микроскопом (JEM-1400 plus, Nihondenshi, Tokyo, Japan).
Отложение нуклеотидной последовательности
Неполные последовательности кДНК SrBLOS2 и SrRp49 и последовательности ДНК трех интронов SrBLOS2 доступны под номерами доступа LC378373, LC378374 и LC378375– LC 378377 соответственно.
Результаты
Обработка аллопуринолом индуцировала фенотип полупрозрачного кожного покрова в
S . ричини личинкиПо сравнению с контрольной группой, покровы группы, получавшей аллопуринол, демонстрировали слегка полупрозрачный фенотип (рис. 2A и 2B).Концентрация мочевой кислоты резко снизилась в покровах личинок в группе, получавшей аллопуринол (рис. 2С). Эти результаты показывают, что белый цвет S . ricini личиночные покровы образуются за счет накопления мочевой кислоты в эпидермисе.
Идентификация и характеристика
SrBLOS2 Посредством поиска BLAST по S . ricini по данным транскриптома средней кишки, мы идентифицировали контиг, который включает предполагаемую кодирующую последовательность (CDS) S . ricini BLOS2 ( SrBLOS2 ). CDS SrBLOS2 имеет длину 438 пар оснований, и поиск выведенной аминокислотной последовательности InterProScan показал, что SrBLOS2 принадлежит к семейству BLOS2 (IPR019269).
Мы разработали три набора праймеров для амплификации интронных областей SrBLOS2 , используя геномную структуру BmBLOS2 в качестве эталона. Геномная ПЦР выявила, что CDS SrBLOS2 состоит из четырех экзонов (рис. 3А). Кроме того, филогенетический анализ показал, что гомологи чешуекрылых BLOS2, включая SrBLOS2 , сгруппированы в одну кладу (рис. 3B), указывая тем самым, что SrBLOS2 является ортологом чешуекрылых BLOS2 .
Рис. 3. Геномная структура и филогенетический анализ Samia ricini биогенез комплекса лизосомных органелл 1 , субъединица 2 ( SrBLOS2 ).
(A) Геномная структура SrBLOS2 . Цифры показывают размеры экзонов и интронов. (B) Филогенетическое дерево гомологов BLOS2 насекомых. Дерево было построено с использованием MEGA7.0 (Kumar et al., 2015). Последовательность BLOS2 человека была включена в качестве внешней группы.
https: // doi.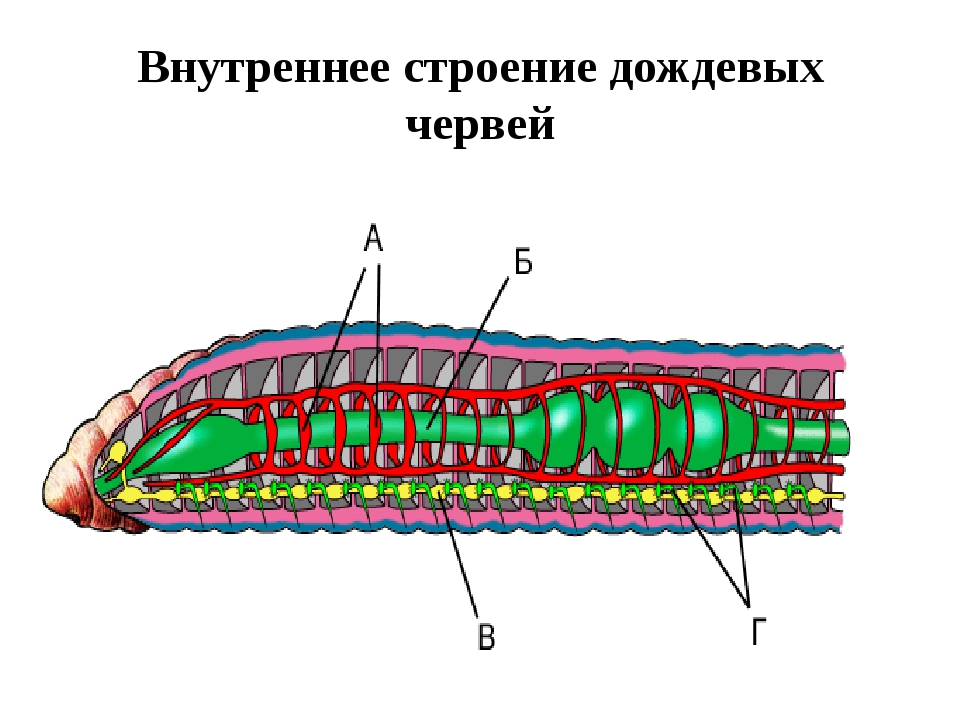 org / 10.1371 / journal.pone.0205758.g003
org / 10.1371 / journal.pone.0205758.g003
Профиль экспрессии
SrBLOS2 в тканях личинокЧтобы исследовать, в какой ткани функционирует SrBLOS2 , экспрессию SrBLOS2 в 10 тканях личинок исследовали с помощью ОТ-ПЦР. У личинок пятого возраста на четвертый день экспрессия SrBLOS2 была обнаружена во всех исследованных тканях (рис. 4). Этот повсеместный паттерн экспрессии был подобен таковому у BmBLOS2 [7].
Рис. 4. Анализ RT-PCR биогенеза Samia ricini комплекса связанных с лизосомами органелл 1 , субъединица 2 ( SrBLOS2 ) в S . ricini тканей личинок.
Суммарная РНК личинок четвертого возраста пятого возраста особей дикого типа была использована для ОТ-ПЦР. SrRp49 использовали в качестве внутреннего контроля. ВП, эпидермис; MG, средняя кишка; AS, передняя шелковая железа; МС, средняя шелковая железа; PS, задняя шелковая железа; OV, яичник; TES, яичко; ML — мальпигиевы канальцы; TR — трахея; FB, толстое тело.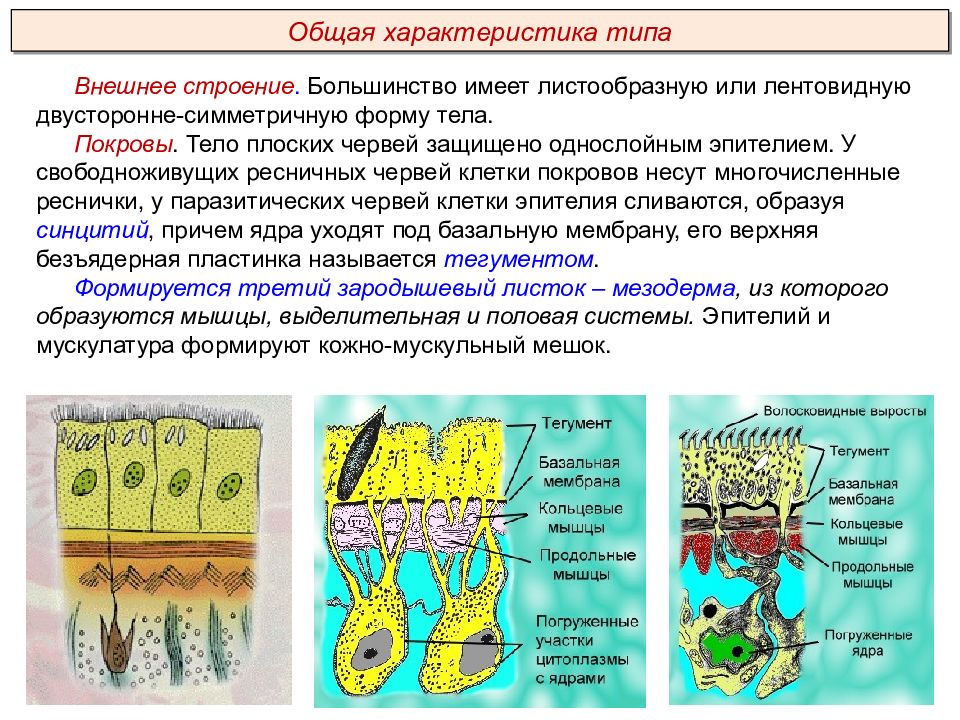
https://doi.org/10.1371/journal.pone.0205758.g004
Микроинъекция мРНК TALEN для
SrBLOS2Мы разработали сайт нацеливания TALEN на экзоне 2 CDS SrBLOS2 (рис. 5A).Смесь мРНК левого и правого TALEN в концентрациях 400 (200 + 200), 800 (400 + 400) и 1200 (600 + 600) нг / мкл вводили в три партии яиц (144, 312 и 164 яиц, соответственно). Инъецированные яйца показали коэффициенты вылупления 20,8 (30/144), 40,1 (125/312) и 22,6% (37/164), соответственно (Таблица 1). Хотя мы ожидали увидеть соматические мозаики в покровах G 0 , нам не удалось идентифицировать людей, демонстрирующих пятнистый и полупрозрачный фенотип в их покровах.
Рис. 5. Характеристика генерируемой эффекторной нуклеазой, подобной активатору транскрипции (TALEN) Samia ricini, биогенез связанного с лизосомами комплекса органелл 1 , субъединица 2 , нокаут-мутанты ( SrBLOS2 KO ).
(A) Схематическое представление последовательностей спейсера и связывания TALEN, нацеленных на SrBLOS2 .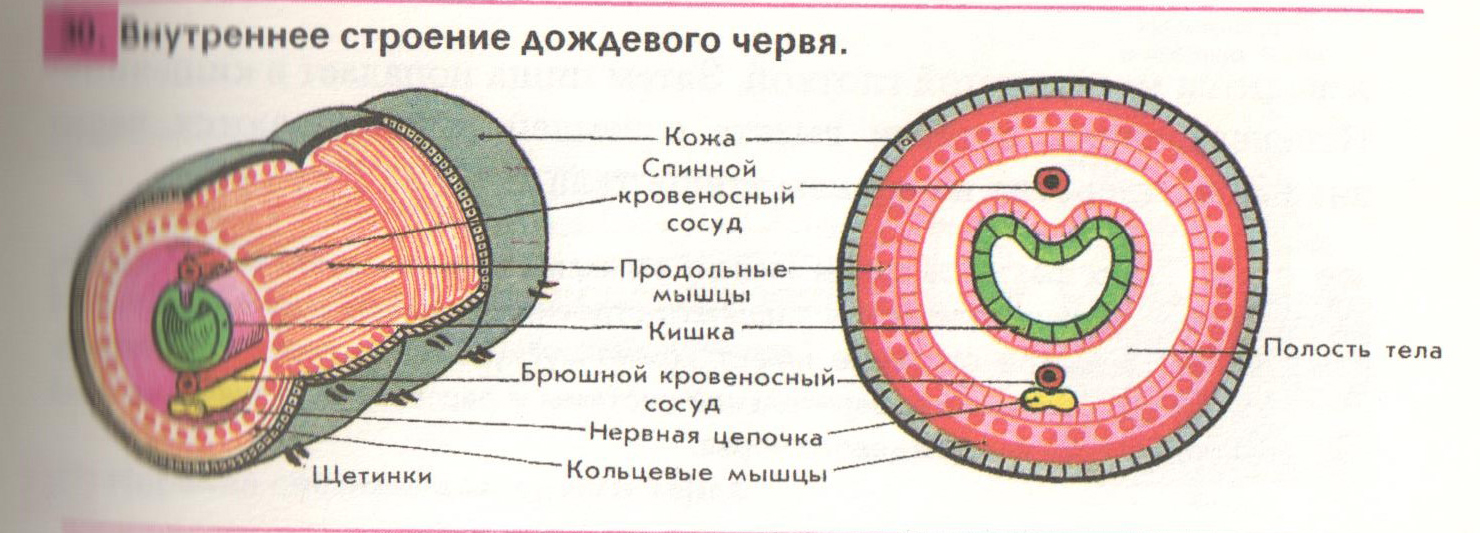 (B) Личиночный фенотип SrBLOS2 KO особей. На верхней панели показаны личинки штамма №22.Слева показана личинка дикого типа, справа — две полупрозрачные особи. На нижней панели показаны личинки из штамма №28. Вверху представлена личинка дикого типа, а внизу — одна полупрозрачная особь. (C) Мутации, внесенные в три штамма SrBLOS2 KO . Последовательность прокладки показана красным. Кодоны преждевременной остановки, генерируемые сдвигом кадра, выделены красными квадратами. Выведенная аминокислотная последовательность SrBLOS2 дикого типа показана вверху.(D) Сравнение концентраций мочевой кислоты в покровах S . ricini дикого типа и личинки штамма №22. Данные представлены как среднее значение + стандартная ошибка. n = 3. *** p <0,001 по t-критерию Стьюдента.
(B) Личиночный фенотип SrBLOS2 KO особей. На верхней панели показаны личинки штамма №22.Слева показана личинка дикого типа, справа — две полупрозрачные особи. На нижней панели показаны личинки из штамма №28. Вверху представлена личинка дикого типа, а внизу — одна полупрозрачная особь. (C) Мутации, внесенные в три штамма SrBLOS2 KO . Последовательность прокладки показана красным. Кодоны преждевременной остановки, генерируемые сдвигом кадра, выделены красными квадратами. Выведенная аминокислотная последовательность SrBLOS2 дикого типа показана вверху.(D) Сравнение концентраций мочевой кислоты в покровах S . ricini дикого типа и личинки штамма №22. Данные представлены как среднее значение + стандартная ошибка. n = 3. *** p <0,001 по t-критерию Стьюдента.
https://doi.org/10.1371/journal.pone.0205758.g005
Обнаружение мутантных аллелей в G
1 выводков Путем скрещивания братьев-сестер G 0 особей друг с другом было получено 128 выводков G 1 (табл. 1).Среди них 20, 79 и 29 были получены из партий яиц, инъецированных 400, 800 и 1200 нг / мкл мРНК TALEN, соответственно. С помощью электрофореза на микрочипе мы обнаружили, что два выводка G 1 (штаммы № 22 и № 29) имели мутации в локусе SrBLOS2 (S1 Фиг.). Из них только штамм № 22 включал индивидов с фенотипом полупрозрачного кожного покрова (рис. 5В). Кроме того, штамм № 28, в котором мутация не была обнаружена электрофорезом на микрочипе, содержал людей с фенотипом полупрозрачных покровов (рис. 5В).
1).Среди них 20, 79 и 29 были получены из партий яиц, инъецированных 400, 800 и 1200 нг / мкл мРНК TALEN, соответственно. С помощью электрофореза на микрочипе мы обнаружили, что два выводка G 1 (штаммы № 22 и № 29) имели мутации в локусе SrBLOS2 (S1 Фиг.). Из них только штамм № 22 включал индивидов с фенотипом полупрозрачного кожного покрова (рис. 5В). Кроме того, штамм № 28, в котором мутация не была обнаружена электрофорезом на микрочипе, содержал людей с фенотипом полупрозрачных покровов (рис. 5В).
На основании результатов электрофореза на микрочипе мутации штаммов №22 и №29 передавались от одного из родителей (S1A и S1B, фиг.). Если бы разные мутации были унаследованы от обоих родителей, должно было быть больше полос гетеродуплекса. Что касается штамма № 28, полупрозрачные особи G 1 были самками, а потомство G 2 , полученное путем скрещивания братьев и сестер, не проявляло полупрозрачного фенотипа, что указывает на то, что основателем G 0 был самец.
Секвенирование ДНК локусов SrBLOS2 трех штаммов показало, что каждый штамм имел единственный различный мутантный аллель. Двухнуклеотидная делеция, четырехнуклеотидная делеция, трехнуклеотидная делеция и двухнуклеотидная замена были обнаружены в штаммах №22, №28 и №29 соответственно. Первые два аллеля генерировали преждевременный стоп-кодон, тогда как последний генерировал делецию одной аминокислоты и две замены аминокислот (рис. 5C).
Скорости передачи зародышевой линии (GTR) TALEN-опосредованных
мутаций SrBLOS2Мы рассчитали GTR как количество выводков G 1 с мутантными аллелями, деленное на общее количество взрослых бабочек G 0 .GTR мутации SrBLOS2 , опосредованной TALEN, составил 3,80% (таблица 1).
Накопление мочевой кислоты в виде уратных гранул в эпидермальных клетках
S . ричини личинки Чтобы подтвердить, является ли фенотип полупрозрачных покровов TALEN-опосредованных мутантов SrBLOS2 KO отсутствием уратных гранул, мы измерили концентрацию мочевой кислоты в эпидермисе мутантов SrBLOS2 KO . По сравнению с людьми дикого типа, у мутантов почти полностью отсутствовало накопление мочевой кислоты в эпидермисе (рис. 5D).
По сравнению с людьми дикого типа, у мутантов почти полностью отсутствовало накопление мочевой кислоты в эпидермисе (рис. 5D).
Кроме того, ТЕА показала, что эпидермальные клетки людей дикого типа имели многочисленные уратные гранулы овальной формы (рис. 6A и 6B), тогда как мутанты SrBLOS2 KO имели чрезвычайно уменьшенное количество таких гранул (рис. 6C и 6D). , что указывает на то, что SrBLOS2 незаменим для образования уратных гранул в эпидермальных клетках S . ричини личинок.
Рис. 6. Просвечивающая электронная микроскопия эпидермиса особей дикого типа и Samia ricini биогенеза связанных с лизосомами органелл комплекса 1 , субъединица 2 , нокаут ( SrBLOS2 KO ).
Микрофотографии эпидермиса личинки дикого типа четвертого возраста пятого возраста в низком (A) и большом увеличении (B). Микрофотографии эпидермиса 5-го возраста на 4-й день в малом (В) и большом увеличении (Г) SrBLOS2 KO личинки. Красные квадраты в A и C указывают увеличенные области в B и D соответственно. N — ядро; CU — кутикула; УГ, гранулы уратов; UN, неизвестные вакуолевидные органеллы.
Красные квадраты в A и C указывают увеличенные области в B и D соответственно. N — ядро; CU — кутикула; УГ, гранулы уратов; UN, неизвестные вакуолевидные органеллы.
https://doi.org/10.1371/journal.pone.0205758.g006
Обсуждение
Накопление мочевой кислоты в покровах
S . ричини личинки Поскольку покровы людей, получавших аллопуринол, и мутантов SrBLOS2 KO были бесцветными и полупрозрачными (рис. 2 и 5В), мы пришли к выводу, что мочевая кислота является основным веществом, которое формирует однородно белые покровы S . ричини личинок. Напротив, у большинства видов Saturniidae характерны различные паттерны окраски личиночных покровов. Базальный цвет остальных покровов личинок сатурниидов — зеленый, который представлен смесью билинов и каротиноидов [20].У этих видов мочевая кислота вряд ли способствует зеленому цвету кожных покровов. Некоторые штаммы S . ricini имеют голубые покровы (S2A Fig, «синий» штамм). Однако синие штаммы содержат такое же количество мочевой кислоты в эпидермисе (S2B, рис.). Принимая во внимание тот результат, что Spodoptera litura , личиночный покров которого равномерно черный независимо от части тела, также накапливает мочевую кислоту [13], можно сделать вывод, что накопление мочевой кислоты не всегда коррелирует с цветом покровов личинок чешуекрылых.
Однако синие штаммы содержат такое же количество мочевой кислоты в эпидермисе (S2B, рис.). Принимая во внимание тот результат, что Spodoptera litura , личиночный покров которого равномерно черный независимо от части тела, также накапливает мочевую кислоту [13], можно сделать вывод, что накопление мочевой кислоты не всегда коррелирует с цветом покровов личинок чешуекрылых.
SrBLOS2 функционирует в образовании уратных гранул
Некоторые B . Штаммы mori обладают фенотипом полупрозрачного кожного покрова. Среди этих мутантных штаммов od ( d istinct o ily ), ответственный ген которого был выяснен как BmBLOS2 , демонстрирует относительно высокую прозрачность [7, 21]. ТЕМ показала, что или мутантов накапливают меньшее количество уратных гранул меньшего размера по сравнению с тем, что наблюдается у личинок дикого типа [5].
BLOS2 является одной из восьми субъединиц комплекса BLOC-1 [22], который необходим для нормального биогенеза и транспортировки связанных с лизосомами органелл [23]. Считается, что комплекс BLOC-1 действует на ранней стадии меланосомы, поскольку дефицит BLOC-1 связан с обесцвечиванием шерсти у мышей и красными глазами у людей [24]. Учитывая эти предыдущие сообщения, весьма вероятно, что BmBLOS2 действует в образовании уратных гранул. В настоящем исследовании мы наблюдали, что мутанты SrBLOS2 KO также демонстрируют полупрозрачный покров, недостаточное накопление мочевой кислоты и уменьшенное количество гранул урата в эпидермисе (рис. 5D и 6), что указывает на то, что функция BLOS2 является Сохранено между B . mori и S . Ричини . Кроме того, как сообщается в BmBLOS2 и S . litura BLOS2 [7, 13], SrBLOS2 локализованы на Z-хромосоме. По сравнению с аутосомными генами, морфологические фенотипы мутантов KO можно наблюдать на одно поколение раньше, демонстрируя, что гомологи BLOS 2 представляют собой идеальные мишени для применения подходов к редактированию генома к немодельным видам чешуекрылых.
Считается, что комплекс BLOC-1 действует на ранней стадии меланосомы, поскольку дефицит BLOC-1 связан с обесцвечиванием шерсти у мышей и красными глазами у людей [24]. Учитывая эти предыдущие сообщения, весьма вероятно, что BmBLOS2 действует в образовании уратных гранул. В настоящем исследовании мы наблюдали, что мутанты SrBLOS2 KO также демонстрируют полупрозрачный покров, недостаточное накопление мочевой кислоты и уменьшенное количество гранул урата в эпидермисе (рис. 5D и 6), что указывает на то, что функция BLOS2 является Сохранено между B . mori и S . Ричини . Кроме того, как сообщается в BmBLOS2 и S . litura BLOS2 [7, 13], SrBLOS2 локализованы на Z-хромосоме. По сравнению с аутосомными генами, морфологические фенотипы мутантов KO можно наблюдать на одно поколение раньше, демонстрируя, что гомологи BLOS 2 представляют собой идеальные мишени для применения подходов к редактированию генома к немодельным видам чешуекрылых.
Отсутствие
SrBLOS2 KO G 0 особей с фенотипом соматической мозаики Соматические мозаики в покровах SrBLOS2 KO G 0 особей обнаружить не удалось.Когда S . Личинки ricini переходят в третий возраст, они начинают продуцировать кристаллический белый порошок из шипов на спине [25]. Этот порошок распространяется от шипов и покрывает все тело личинки. Производство белого порошка прекращается в период линьки, но кроме этого периода образуется огромное количество белого порошка, что делает невозможным визуально отличить мутанты SrBLOS2 KO от особей дикого типа. По этой причине мы не обнаружили мозаичных личинок G 0 , хотя их мозаичный фенотип проявлялся в покровах.В отличие от личиночных покровов, кристаллический порошок не состоит из мочевой кислоты, так как его основными компонентами являются насыщенные спирты с прямой цепью, а именно n -триаконтанол (C 30 H 62 O, 92,0%) и n -октакозанол (C 28 H 58 O, 0,56%) [25]. С помощью ПЭМ были обнаружены вакуолеподобные большие органеллы, отличные от уратных гранул (рис. 6В). Потому что подобных органелл в личиночных покровах B не обнаружено. mori [5], эти вакуолеподобные органеллы, вероятно, были S . ricini — специфический. Эти органеллы, по-видимому, возникли из базальной мембраны эпидермальных клеток (фиг. 6B) и существуют даже в эпидермальных клетках мутантов SrBLOS2 KO (фиг. 6D). Большой размер этих органелл может указывать на их роль в транспортировке или синтезе химических соединений, таких как n -триаконтанол или n -октакозанол.
С помощью ПЭМ были обнаружены вакуолеподобные большие органеллы, отличные от уратных гранул (рис. 6В). Потому что подобных органелл в личиночных покровах B не обнаружено. mori [5], эти вакуолеподобные органеллы, вероятно, были S . ricini — специфический. Эти органеллы, по-видимому, возникли из базальной мембраны эпидермальных клеток (фиг. 6B) и существуют даже в эпидермальных клетках мутантов SrBLOS2 KO (фиг. 6D). Большой размер этих органелл может указывать на их роль в транспортировке или синтезе химических соединений, таких как n -триаконтанол или n -октакозанол.
GTR TALEN-опосредованных мутаций в
S . ричини Хотя Takasu et al.[18] сообщили, что GTR TALENs, которые индуцировали соматические мозаики у G 0 индивидуумов, достигали 100% у B . mori , у TALEN — S . ricini был крайне низким (3,80%, таблица 1).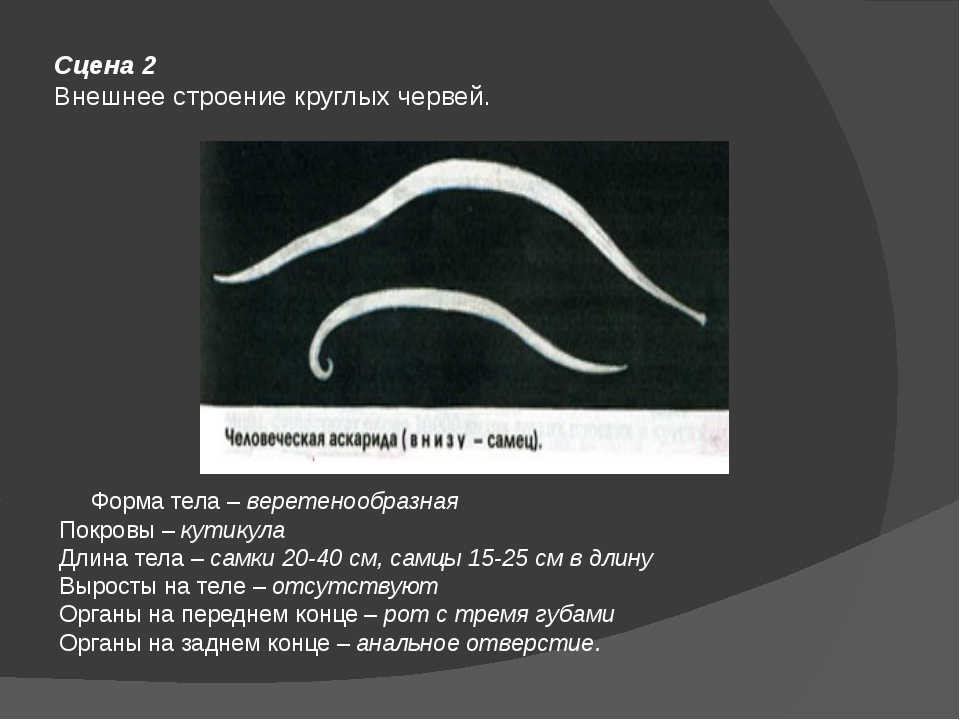 Предыдущие исследования показали, что GTR сильно зависит от целевых последовательностей независимо от инструментов редактирования генома. Например, Yang et al. [26] разработали две пары TALEN для нокаутации корецептора рецептора запаха в O . Furnacalis .Хотя одна пара TALEN была высокоэффективной, а GTR достиг 62,9%, другая пара не вызвала генерации даже соматической мозаики. Таким образом, ОТО ТАЛЕНОВ в S . ricini можно улучшить, изменив целевую последовательность. Мы также подозреваем, что структура вектора экспрессии TALEN pBlue-TAL также способствовала низкому GTR, наблюдаемому в S . Ричини . pBlue-TAL настроен для трансляции мРНК в B . mori ; я.е., использование кодонов, последовательность Козака и трек UTR были оптимизированы на основе геномной информации B . mori [18]. Когда геном S . ricini секвенирован в будущем, мы сможем настроить pBlue-TAL для S .
Предыдущие исследования показали, что GTR сильно зависит от целевых последовательностей независимо от инструментов редактирования генома. Например, Yang et al. [26] разработали две пары TALEN для нокаутации корецептора рецептора запаха в O . Furnacalis .Хотя одна пара TALEN была высокоэффективной, а GTR достиг 62,9%, другая пара не вызвала генерации даже соматической мозаики. Таким образом, ОТО ТАЛЕНОВ в S . ricini можно улучшить, изменив целевую последовательность. Мы также подозреваем, что структура вектора экспрессии TALEN pBlue-TAL также способствовала низкому GTR, наблюдаемому в S . Ричини . pBlue-TAL настроен для трансляции мРНК в B . mori ; я.е., использование кодонов, последовательность Козака и трек UTR были оптимизированы на основе геномной информации B . mori [18]. Когда геном S . ricini секвенирован в будущем, мы сможем настроить pBlue-TAL для S . ricini и улучшают ОТО TALEN.
ricini и улучшают ОТО TALEN.
Поскольку их большие тела подходят для экспериментов, энтомологи часто использовали S . ricini в качестве модели для физиологических и биохимических исследований [27–29], а также накоплены знания и экспериментальные методы для этого вида [30–31].Для увеличения полезности S . ricini в качестве модельного организма, полногеномное секвенирование S . ricini сильно ожидаемо.
Дополнительная информация
S1 Рис. Типичные изображения электрофореза микрочипа.
(A) Обнаружение мутаций, внесенных в выводки поколения 1. Их родители происходят из яиц, которым вводят 800 (400 + 400) нг / мкл мРНК эффекторной нуклеазы, подобной активатору транскрипции. ПЦР не удалась во второй партии штаммов №29 и №30.
(B) Изображения с большим увеличением электрофореза на микрочипе штаммов № 22 и № 29, которые включают Samia ricini биогенез связанного с лизосомами комплекса органелл 1 , субъединица 2 , ( SrBLOS2 KO ) мутантов. В дополнение к основной полосе (обозначенной стрелками) были обнаружены две полосы (обозначенные звездочками), что указывает на то, что продукты ПЦР из SrBLOS2 штаммов № 22 и № 29 являются гетерозиготными.
В дополнение к основной полосе (обозначенной стрелками) были обнаружены две полосы (обозначенные звездочками), что указывает на то, что продукты ПЦР из SrBLOS2 штаммов № 22 и № 29 являются гетерозиготными.
https://doi.org/10.1371 / journal.pone.0205758.s003
(TIFF)
S2 Рис. Голубой штамм
Samia ricini .(A) Личинки пятого возраста S . ricini непосредственно перед прядением. Цвет его покровов слегка голубоватый.
(B) Сравнение концентраций мочевой кислоты в покровах дикого типа и синего штамма S . Ричини . Данные представлены как среднее значение + стандартная ошибка. Н.С., с. > 0.05 по t-критерию Стьюдента.
https://doi.org/10.1371/journal.pone.0205758.s004
(TIFF)
Благодарности
Мы благодарим Такааки Даймона (Университет Киото) за критические советы при строительстве TALEN и Фумико Исидзуна (Центр развития технологий, Высшая школа сельского хозяйства и наук о жизни Токийского университета) за подготовку образцов для ПЭМ и сбор данных.
Ссылки
- 1. Майуоло Дж., Оппедисано Ф., Граттери С., Мусколи К., Моллаче В.Регулирование обмена и выведения мочевой кислоты. Int J Cardiol. 2016; 213: 8–14. pmid: 26316329
- 2. Кашима Т., Накамура Т., Тодзё С. Рециркуляция мочевой кислоты в щитовке, Parastrachia japonensis (Hemiptera: Parastrachiidae), во время диапаузы. J. Insect Physiol. 2006; 52: 816–825. pmid: 16797581
- 3. Тасаки Э., Сакураи Х., Нитао М., Мацуура К., Юти Ю. Мочевая кислота, важный антиоксидант, способствующий выживанию термитов. PLoS One. 2017; 12: 1–12.
- 4. Цудзита М., Сакураи С. Генетические и биохимические исследования хромогранул в гиподерме личинок тутового шелкопряда, Bombyx mori . J Seric Sci Japan. 1964; 33: 447–459.
- 5. Тамура Т., Акаи Х. Сравнительная ультраструктура гиподермальных клеток личинок у нормальных и масляных мутантов Bombyx . Cytologia (Токио). 1990; 55: 519–530.
- 6. Комото Н. Удаленная часть одного из двух генов ксантиндегидрогеназы вызывает полупрозрачную личиночную кожу у мутанта oq тутового шелкопряда ( Bombyx mori ).Насекомое Biochem Mol Biol. 2002; 32: 591–597. pmid: 12020833
- 7. Фуджи Т., Даймон Т., Утино К., Банно Ю., Кацума С., Сезутсу Х. и др. Трансгенный анализ гена BmBLOS2 , который определяет прозрачность личиночных покровов тутового шелкопряда, Bombyx mori . Насекомое Mol Biol. 2010; 19: 659–667. pmid: 20546041
- 8. Ван Л., Киучи Т., Фуджи Т., Даймон Т., Ли М., Банно И. и др. Мутация нового гена переносчика ABC ответственна за неспособность включить мочевую кислоту в эпидермис ok мутантов тутового шелкопряда, Bombyx mori .Насекомое Biochem Mol Biol. 2013; 43: 562–571. pmid: 23567590
- 9. Эймс Б.Н., Каткарт Р., Швиерс Э., Хохштейн П. Мочевая кислота обеспечивает антиоксидантную защиту человека от старения и рака, вызванного окислителями и радикалами: гипотеза. Proc Natl Acad Sci U S. A. 1981; 78: 6858–6862. pmid: 6947260
- 10. Мацуо Т., Исикава Ю. Защитная роль мочевой кислоты против фотоокислительного стресса у тутового шелкопряда, Bombyr mori (Lepidoptera: Bombycidae). Appl Entomol Zool.1999; 34: 481–484.
- 11. Ху Ю.Г., Шен Ю.Х., Чжан З., Ши Г.К. Меланин и ураты предотвращают повреждение ультрафиолетом покровов тутового шелкопряда, Bombyx mori . Arch Insect Biochem Physiol. 2013; 83: 41–55. pmid: 23575996
- 12. Тиммерман С., Беренбаум М. Отложение мочевой кислоты в личиночных покровах черных ласточкиных хвостов и предположения о ее возможных функциях. J Lepid Soc. 1999; 53: 104–107.
- 13. Чжу Г, Пэн Й, Чжэн М., Чжан Х, Сунь Дж.CRISPR / Cas9 опосредовал нокаут BLOS2 , приводящий к исчезновению желтых полос и белых пятен на личиночных покровах у Spodoptera litura . J. Insect Physiol. 2017; 103: 29–35. pmid: 28927827
- 14. Траут В., Сахара К., Марек Ф. Половые хромосомы и определение пола у чешуекрылых. Sex Dev. 2007; 1: 332–346. pmid: 183
- 15. Кумар С., Стечер Г., Тамура К. MEGA7: молекулярно-эволюционный генетический анализ версии 7.0 для больших наборов данных.Mol Biol Evol. 2016; 33: 1870–1874. pmid: 27004904
- 16. Джонс Д. Т., Тейлор В. Р., Торнтон Дж. М.. Быстрое создание матриц данных о мутациях из белковых последовательностей. Comput Appl Biosci. 1992; 8: 275–282. pmid: 1633570
- 17. Чермак Т., Дойл Е.Л., Кристиан М., Ван Л., Чжан Ю., Шмидт С. и др. Эффективный дизайн и сборка пользовательских TALEN и других эффекторных конструкций на основе TAL для нацеливания на ДНК. Nucleic Acids Res. 2011; 39: 7879.
- 18. Такасу Й., Саджван С., Даймон Т., Осанай-Футахаши М., Утино К., Сезуцу Х. и др.Efficient TALEN construction for Bombyx mori gene targeting. PLoS One. 2013; 8: 1–11.
- 19. Truett GE, Heeger P, Mynatt RL, Truett AA, Walker JA, Warman ML. Preparation of PCR-quality mouse genomic DNA with hot sodium hydroxide and tris (HotSHOT). Biotechniques. 2000; 29: 52–54. pmid:106
- 20. Saitoh H. Yasan no Shikisai ni kakawaru Bilin to Sono Ketsugo Tanpakushitsu—Aoiro no Shikisai ni Kakusareta Seizonsenryaku—. Sanshi-konchu Biotech.2011; 79: 153–158.
- 21. Fujii T, Abe H, Katsuma S, Mita K, Shimada T. Картирование сцепленных с полом генов на последовательность генома с использованием различных аберраций Z-хромосомы в Bombyx mori . Насекомое Biochem Mol Biol. 2008; 38: 1072–1079. pmid: 19216995
- 22. Фалькон-Перес Дж. М., Старчевич М., Гаутам Р., Dell’Angelica EC. BLOC-1, новый комплекс, содержащий паллидин и приглушенные белки, участвующие в биогенезе меланосом и гранул, плотных тромбоцитов.J Biol Chem. 2002; 277: 28191–28199. pmid: 12019270
- 23. Dell’Angelica EC. Строительный BLOC (k) s лизосом и родственных органелл. Curr Opin Cell Biol. 2004; 16: 458–464. pmid: 15261680
- 24. Гаутам Р., Новак Е.К., Тан Дж., Вакамацу К., Ито С., Суонк RT. Взаимодействие генов синдрома Германского-Пудлака в регуляции органелл, связанных с лизосомами. Движение. 2006; 7: 779–792. pmid: 16787394
- 25. Бауэрс WS, Томпсон MJ. Идентификация основных компонентов кристаллического порошка, покрывающего кутикулу личинки Samia cynthia ricini (Jones).J. Insect Physiol. 1965; 11: 1003–1011.
- 26. Ян Б., Фуджи Т., Ишикава Ю., Мацуо Т. Целевой мутагенез корецептора рецептора одоранта с использованием TALEN в Ostrinia Furnacalis . Насекомое Biochem Mol Biol. 2016; 70: 53–59. pmid: 26689645
- 27. Гилберт Л.И., Шнайдерман Х.А. Стимуляция переднегрудных желез экстрактами ювенильных гормонов насекомых. Природа. 1959; 184: 171–173.
- 28. White JF, Sastrodihardjo S. Мейоз в куколочных клетках яичника Samia cynthia , культивируемых in vitro.Природа. 1966; 212: 314–315. pmid: 5339132
- 29. Нагасава Х., Катаока Х., Хори Й., Исогай А., Тамура С., Судзуки А. и др. Выделение и некоторые характеристики проторацикотропного гормона из Bombyx mori . Gen Comp Endocrinol. 1984; 53: 143–152. pmid: 6714648
- 30. Кобаяши М., Бурдетт В.Дж. Гетерологичная трансплантация всех тел между чешуекрылыми, диапаузирующими на стадии яйца и куколки. Природа. 1962; 194: 401–402. pmid: 14457447
- 31.Mizoguchi A, Ishizaki H. Переднегрудные железы сатурниидной моли Samia cynthia ricini обладают циркадными часами, контролирующими время очистки кишечника. Proc Natl Acad Sci U S. 1982; 79: 2726–2730. pmid: 16593181
Без названия 1
Анатомия беспозвоночных онлайн
Ascaris suum ©
Свинья аскариды
5 июля 2006 г.
Авторские права 2001,
Ричард Фокс
Университет Ландера
Предисловие
Этот это одно из многих упражнений, доступных в справочнике Беспозвоночные Анатомия онлайн , и Интернет-лабораторное руководство для курсов по зоологии беспозвоночных.Дополнительный упражнения, глоссарий и главы о расходных материалах и лабораторных методах. также доступны на этом сайте. Терминология и филогения, используемая в этих упражнениях, соответствует использованию в упражнениях на беспозвоночных. Учебник зоологии Рупперта, Фокса и Барнса (2004). С переносом условные обозначения относятся к рисункам в учебнике. Выноски без дефиса относятся к фигурам, включенным в упражнение. Глоссарий включает термины из этого учебника, а также лабораторные упражнения.
Систематика
Циклонейральная СП , Introverta, Nematoida, Nematoda P , Secernentea C , Rhabditida O , Ascaridida, Ascaridina, Ascaridoidea SF , Ascaridae F , (Рис. 22-35, 9-26)
Циклоневральная СП
Cycloneuralia включает Gastrotricha, Nematoda, Nematomorpha, Priapulida, Kinorhyncha и Loricifera.Большинство имеют секретируемую кутикулу и лишены локомоторных ресничек, поэтому передвижение затруднено. выполняется с помощью мускулов. Мозг — это круглая полоса вокруг передней кишки. состоит из переднего, среднего и заднего мозга (рис. 22-2А). Глотка радиально-симметричный (рис. 22-15). В большинстве случаев тело компактно без тела полость, но у крупных видов может быть обширный гемоцель. Eutely, примерно с 1000 ячеек, обычное дело.
Нематода
В 20000 известных видов нематод обитают в наземных, морских и пресных водах. среды обитания и встречаются почти во всех влажных местообитаниях.В таксон включает множество паразитов растений и животных, многие из которых имеют медицинское происхождение. или сельскохозяйственного значения, но большинство из них являются свободноживущими (непаразитарными). Большинство нематоды, или круглые черви, длинные, тонкие, внешне почти безликие, конические на обоих концах и круглые в поперечном сечении (рис. 22-7A). В Полость тела, если она есть, представляет собой гемоцель, образованный от бластоцеля.
В тело покрыто толстой внеклеточной кутикулой, секретируемой клеточным или синцитиальный эпидермис, который линяет во время ювенильного развития (рис. 22-11, 22-9).В ядра эпидермиса погружены под эпителиальный слой на четыре продольных эпидермальные шнуры, увеличивающие длину животного. В стенка тела с хорошо развитыми продольными мускулами, но без круговой мускулатуры.
В кишечник завершен терминальным передним ртом и субтерминальным задним анусом. Это состоит из эктодермальной передней и задней кишки и энтодермальной средней кишки. Тело полость, или гемоцель, не выстлана мезотелием и отсутствуют мышцы, соединительная ткань или другое производное мезодермы, связанное со средней кишкой.
В нервная система представляет собой ганглиозное круговое кольцо, отсюда и название «Циклоневральная», с несколькими продольными нервными тяжами, наиболее важными из который представляет собой ганглиозный двойной брюшной канатик (рис. 22-11A). В нервные тяжи расположены в продольных эпидермальных тяжах вместе с эпидермальные ядра. Цитоплазматический процессы иннервации от продольных мышц распространяются на продольные нервные связки и выполняют функцию мотонейронов, которых нет.Сенсорный оборудование может включать уникальные хемосенсорные амфиды и сенсорные щетинки вокруг рот.
Большинство у нематод отсутствуют реснички или жгутики даже в сперме. Там являются, однако, производными ресничек у амфид (рис. 22-8B), а реснички являются присутствует в эпителии кишечника некоторых нематод (рис. 22-16A). Круглые черви являются аммонотеликами, и азот выводится в основном путем диффузии по телу. стена. Осморегуляция в некоторых случаях осуществляется через систему выводных каналов и, возможно, через экскреторные железы.Нет нефридии присутствуют.
Нематоды обычно гонохорические, а оплодотворение происходит внутри при совокуплении. Сексуальный диморфизм является обычным явлением. Нематода сперматозоиды не имеют жгутиков и, вероятно, используют амебоидное движение. Нематода в развитии наблюдается явление, известное как уменьшение хромосом, при котором многие хромосомного материала презумптивных соматических клеток дегенерирует и теряется (Рис 22-20). Зародыш клетки, однако, сохраняют полный набор генетического материала.Разработка прямой и включает четыре молодых и один взрослый возраст, отделенные от каждого другие по линькам. Большинство нематоды маленькие (<3 мм) и свободноживущие, но некоторые из паразитических видов, например, Ascaris , может достигать 50 см.
Secernentea C
Когда-то известная как Фазмидия, Secernentea включает в себя: наземные нематоды и многие важные паразиты. Свободноживущий, непаразитический виды, такие как Cephalobus , обычно являются почвенными обитателями.Присутствуют фазмиды, амфиды пористые. Выделительный каналы, а иногда и экскреторные железы, присутствуют (Рис. 22-17). Эпидермальные клетки могут быть одноядерными или многоядерными.
Лабораторные образцы
Аскариды включает в себя самых крупных нематод, и несколько членов семейства являются крупными достаточно, чтобы препарировать в лабораториях зоологии беспозвоночных. Аскарида suum , свиной аскарид, является крупным космополитическим видом, достигающим длины до 50 см (Рис 22-21).Это удобен для лабораторных исследований анатомии нематод из-за большого размер и доступность. An практически идентичный вид, A. lumbricoides , встречается у людей, овец, крупного рогатого скота, обезьян и белок. В долгое время считалось, что двое принадлежат к одному виду, и до недавнего времени оба считались название A. lumbricoides . Сохранилось образцы доступны в компаниях-поставщиках биологических препаратов. Поставляется на коммерческой основе образцы обычно маркируются как А.lumbricoides , но может быть либо разновидность. Слайды поперечного сечения также доступны в продаже.
Внешняя анатомия
Место сохранившаяся взрослая особь Ascaris в длинный узкий рассекающий поддон с водопроводной водой. Пока не обязательно, препарирование лучше всего проводить с помощью препаровального микроскопа. Сохранилось черви нежные, с ними нужно обращаться осторожно.
Смотреть на поверхности червя с помощью препаровального микроскопа и обратите внимание, что это прочный и устойчивый к деформации.Это покрыта толстой белковой кутикулой , которая играет важную роль при отсутствии круговых мышц в сдерживании высокое гидростатическое давление гемоцела. Смотреть за характерный орнамент кутикулы, который у этого вида состоит из мелких окружных гребней. В кутикула консервированных образцов хрупкая, и грубое обращение может привести к ее повреждению. сломать или отклеить.
Рисунок 1.Вид левой стороны самца Ascaris . Нематода54L.gif
Определять пол вашего экземпляра. Самки достигают больших размеров, чем самцы. В задний конец самцов изогнут снизу и имеет вид пастушьего посоха (Рисунок 1). Две крошечные копулятивных спикулы май быть видимым, выступающим из ануса на внутренней изгибе изгиба. В задний конец самок заметно не изогнут.
Рисунок 2. Спинной вскрытие самки Ascaris . В правая часть репродуктивной системы опущена, а левая часть переместился влево, чтобы обнажить кишечник. В репродуктивная система была упрощена и распутана для ясности. Нематода55La.gif
Выделить между передним и задним концами. Загнутый задний конец самцов составляет это легко для этого пола, но самки прямые с похожими передними и задние концы.В оба пола, однако рот терминальный на переднем конце, но задний конец не имеет терминального отверстия. Просмотрено в лоб с помощью ручной линзы можно увидеть, что рот окружен три маленькие губы . (Это легче рассмотреть рот с ручной линзой, чем с рассекающим микроскопом из-за проблемы с ориентацией длинного червяка вертикально на сцене.)
В три губы Ascaris образованный слиянием шести губ предковых нематод (рис. 22-8A).Один губы расположены дорсомедиально, тогда как два других — вентролатерально. В Расположение рта и губ радиально-симметрично. В субтерминал анус из оба пола расположены немного впереди заднего кончика червя (рис. 2). Это поперечная вентральная щель и лучший ориентир для распознавания вентральная поверхность. Его положение сразу за кончиком на брюшной поверхности называется субтерминальный.(В рот, который находится на самом конце его конца, является конечным.)
В женский гонопор, известный как вульва , расположен на средней брюшной линии примерно на 1/3 длины животного кзади от рот. Это маленькие поры лучше всего обнаруживать при увеличении. Женская репродуктивная система открывается наружу независимо от кишечника, и в этом нет клоаки. секс. Мужская репродуктивная система не имеет собственных внешних гонопор и сперма выходит из животного через задний проход (= вентиляционное отверстие).Два выступающие копулятивные спикулы, входящие в состав копулятивных самцов аппарат, у некоторых экземпляров может выходить из заднего прохода.
Зная вентрально , переднее , и задний , вы теперь можно найти спинной , правый , и осталось . Находить плоскость симметрии и дорсальная срединная линия.
В четыре продольных шнура в стенке корпуса видны снаружи тонкими, бледные полосы (рис. 1, 2, 3, 4, 5, 22-10B, C, 22-11).Эти — спинные , вентральные , и два продольных боковых эпидермальные шнуры . Они тусклые, но различимые при хорошем освещении, и в них сосредоточены эпидермальные ядра. В два боковых шнура видны легче всего. Крошечная пора, принадлежащая выделительной система каналов расположена сразу кзади от рта на брюшной средняя линия, но обычно не видна.
Внутренняя анатомия
» Должность червяк в расслаивающем поддоне с водой брюшной стороной вниз.Самцы необходимо немного повернуть, чтобы учесть завиток хвоста.
Держать аккуратно большим и указательным пальцами одной руки червяка и булавкой от насекомых №1 чтобы соскоблить продольный среднедорсальный разрез через кутикулу и продольный мышцы стенки тела в передней трети тела. Делать старайтесь держать разрез на спинной средней линии, даже если нет много ориентиров, которые помогут вам. В два боковых эпидермальных шнура, которые открываются вашим разрезом, большие и заметные продольные выступы на внутренней стороне стенки корпуса, которые можно использовать для ориентации.Вы должны сделать дорсальный разрез таким образом, чтобы боковой эпидермальный канатик находится на равном расстоянии по обе стороны от него. Ты сначала не сможет увидеть шнуры и должен подождать, пока разрез достаточно долго, чтобы раздвинуть стены. На переднем конце тела имеются несколько органов можно повредить, но тем не менее вы должны быть осторожны. Ты можете развить свои навыки обращения с булавкой для насекомых в этой области, где есть возможность повреждения уменьшаются.
В кутикула имеет тенденцию сопротивляться режущему движению булавки, так что она отделяется неравномерно, но в него проникают несколько царапин в одном и том же месте.В продольные мышцы внутри кутикулы, с другой стороны, помогают направлять штифт в правильном направлении и нет соединительной ткани или круговых мышц препятствовать прохождению штифта.
Продлевать разрез кпереди от рта. Отклонить срезанные края стенки тела и приколите их к воску булавками от насекомых №1 вставлен под углом 45 °. Быть осторожно, отталкивая стенку тела. В внутренние органы, особенно кишечник, очень нежные и легко ломаются.Дальше, кишечник часто прилегает к стенке тела и легко проходит через разрыв точка движением стенки тела.
Когда вы вскрыли и закололи переднюю треть червя, продлите разрез кзади до конца тела, отклоняя и придавливая стенки. Открытие средняя часть червя немного сложнее, потому что она заполнена репродуктивная система (рис. 2).
Стена тела
Кузов стена будет изучена в более детали позже, используя слайды поперечного сечения (рис. 3, 4, 5, 22-11), но некоторые из его особенности видны при крупном разрезе.В тяжелая, прозрачная кутикула его самый внешний слой. Немедленно внутри кутикулы находится невзрачный тонкий эпидермис. Внутри эпидермис представляет собой толстую белую оболочку из продольных мышцы , состоящие из одного слой клеток, которые выступают в гемоцель (рис. 4).
Гемоцель , или полость тела, заполнена жидкостью под исключительно высоким давлением (выше чем у любого другого животного) и представляет собой гидростатический скелет.Практически все другие системы органов подвержены этому давлению и должны быть в состоянии функционируют под его влиянием. В давление поддерживает форму тела и действует как гидростатический каркас против на которые мышцы стенки тела действуют, чтобы совершить передвижение.
В ядра эпидермальных клеток сосредоточены в четырех продольных эпидермальных шнуры (рис 1,2,3,4,5, 22-11А). В два боковых эпидермальных шнура большие и заметные, выступающие в гемоцеле.В спинной и вентральный канатики гораздо менее заметны, а спинной канатик обычно разрушается срединным разрезом. Ты должен отодвинуть окружающие мышечные клетки в сторону, чтобы увидеть вентральную и дорсальную шнуры. Каждый эпидермальный шнур включает по крайней мере один продольный нервный шнур и экскреторный канал присутствует в каждом боковом канатике. В эпидермальные тяжи разделяют соматическую мускулатуру на дорсальные и вентральные поля. и делать удобные ориентиры.
Пищеварительная система
Кишка — это длинная прямая трубка, идущая ото рта к анусу (рис. 2, 22-10).Это состоит из передней эктодермальной передней кишки, энтодермальной средней кишки и эктодермальный задний кишечник.
Переместить терминал рот . Передняя кишка, или стомодеум , состоит из ротовой полости и глотки, что соответствует их эктодермальной истоки, выстланы кутикулой. В рот открывается в небольшую незаметную тонкостенную щечную полость (рис. 22-13А). Немедленно кзади от ротовой полости находится более длинный и толстостенный зев , сильно мускулистые стенки используются для всасывания пищи в кишечник в противовес высокое гидростатическое давление hemocoel (рис. 2, 22-14B).В задний конец глотки немного опух, просвет глотки увеличен. треугольной формы в поперечном сечении, как и у других циклоневральных особей (рис. 22-15).
Посмотреть на коммерчески подготовленном слайде поперечного сечения глотки (Рис. 22-15). Примечание толстые мускулистые стенки глотки и трехлучевой просвет с кутикулой оболочка. При заполнении во время еды просвет расширяется и становится круглым.
В средняя кишка, или кишка , начинается сразу кзади от глотки (рис. 2, 22-10A). Это представляет собой длинную уплощенную в дорсовентральном направлении трубку, идущую кзади почти до анус. в отличие эктодермальной передней кишки, ее стенки состоят исключительно из простой столбчатой или кубовидный эпителий и его базальная пластинка. Там нет ассоциированной мышцы, соединительной ткани или мезотелия.
В Кишечник — это область гидролиза и всасывания.В середине тела ваш взгляд на кишечник, вероятно, закрыт репродуктивной системой, но вы можете найти его снова позади этой области. Ascaris существует главным образом на мономерах (сахарах и аминокислотах) из кишечного содержимого его хозяин. Они абсорбируются микроворсинками эпителия средней кишки.
В Кишечник расширяется кзади, чтобы присоединиться к короткой эктодермальной задней кишке, или прямой кишке (Рис. 2).В у женщин прямую кишку трудно отличить от кишечника, но в у мужчин прямая кишка — это клоака , которая получает мужской половой проток и кишечник, прежде чем открыться наружу через анус (рис. 22-18А). Существование эктодермальный, прямая кишка выстлана кутикулой.
Дыхательная система
Энергия метаболизм анаэробный, особых газообменных структур нет.
Система транспортировки жидкости
В неразделенный гемоцель (= псевдоцель) нематод устраняет необходимость в гемоцеле. системы и нету. Транспорт считается, что достигается за счет распространения среди мелких видов и за счет перемещения гемоцелевая жидкость (кровь) у крупных видов.
Экскреторный / осморегуляторный Система
В выделительная система состоит из огромной системы Н-образных каналов, содержащихся внутри одиночная ячейка (Рис. 22-17A, B).В стойки «H» — это продольные каналы, расположенные в латеральном эпидермальном слое. шнуры и простираются по всей длине червяка. Два продольных канала соединяются друг с другом через поперечный канал около переднего конца червь. А короткий выводной проток ведет от поперечного канала к выводной поре на передняя вентральная средняя линия. В Считается, что система в основном осморегулирующая. Система выводных каналов трудно наблюдать при крупном вскрытии сохранившихся целых экземпляров.В экскреторная пора расположена сразу за ртом на брюшной по средней линии, но найти ее сложно.
Нервная система
Учиться нервной системы Ascaris требуется специально подготовленный материал и не будет предприниматься. В Центральная нервная система состоит из характерного циклоневрального мозга, который представляет собой трехстороннее нервное кольцо вокруг глотки (рис. 22-11A). Пытаться найти мозг.Дорсальные, вентральные и латеральные продольные нервы возникают от головного мозга и простираются кзади в эпидермальных тяжах. Из вентральный нервный тяж является наиболее важным и представляет собой двойной ганглиоз. шнур. Спинной канатик одиночный, неанглионированный. А небольшой боковой нервный тяж присутствует в каждом боковом эпидермальном канатике. Ascaris имеет нет амфид.
Локомоция
В опорно-двигательная система состоит из находящегося под давлением гемоэля, который является гидростатическим скелет, антагонистические спинные и вентральные продольные мышечные поля стенка тела и эластичная кутикула, которая содержит гидростатическое давление и противостоит продольным мускулам.Когда одно мышечное поле сокращается, противоположная сторона тела удлиняется для облегчения гидростатическое давление и кутикула на этой стороне растягивается (Рис. 22-12A). Альтернативный сокращения спинных и вентральных мышечных полей приводят к синусоидальным волнам в дорсо-вентральная плоскость проходит по длине тела. Расположение белковые волокна в кутикуле позволяют изменять длину червя, но не его диаметр. Этот приводит к характерным дорсо-вентральным толчковым движениям, которые могут быть переведено на эффективное поступательное движение в вязкой среде или окружающей среде, такие как влажный песок или стенки кишечника хозяина, с твердыми или стойкими поверхности, на которые нужно давить.Нематоды (кроме очень маленьких) относительно беспомощны в чистой воде и не способен к направленному движению, но эффективно передвигаться, когда есть субстрат, на который нужно давить.
> 1а. Если живые нематоды доступны в лаборатории, поместите некоторых в чашку Петри с воды и наблюдайте за их движением с помощью препаровального микроскопа. Добавлять немного песка к блюду и обратите внимание на разницу в эффективности передвижение. <
Репродуктивная система
В репродуктивная система представляет собой трубку с гонадными железами, продолжающимися гоноды, так что гаметы не попадают в гемоцель (рис. 22-18A, 22-19A). И мужчина, и женские системы — это длинные сужающиеся трубки, свернутые спиралью в гемоцеле. В твердые свободные концы трубок перед потоком имеют небольшой диаметр, но расширяются и становятся полыми по мере того, как они распространяются вниз по течению к гонопорам.Твердый верх концы — гонады, яичники или семенники. Полые более крупные области специализированные для различных целей, включая транспортировку и хранение гамет. Митотические деления примордиальных половых клеток в гонаде производят диплоидные гониальные клетки. клетки, которые движутся вниз по гоноду, претерпевая на своем пути гаметогенез. Учиться репродуктивной системы вашего образца, а затем посмотрите на разрез противоположный пол. Вы должны быть знакомы с обоими полами.
Женский
Женский аскариды имеют Y-образную репродуктивную систему, состоящую из двух трубок, каждая с яичник, яйцевод и матка, образующие плечо Y (рис. 2, 22-10).В две руки соединяются, образуя общее (непарное) влагалище, которое является стержнем буквы «Y». В влагалище выходит наружу через единственный гонопор. Это удобно проследить систему в обратном направлении, начиная с гонопора, но при этом в виду, что женские гаметы движутся в противоположном направлении. В верхние концы с малым диаметром называются «входными».
Переместить приблизительное положение вульвы по средней брюшной линии и посмотрите на на внутренней поверхности стенки тела, чтобы найти короткую трубку, прикрепленную к стенке тела.Этот трубка влагалище и в нее открывается вульва (рис. 2, 22-10А). В влагалище образовано слиянием двух больших извитых трубчатых маток (рис. 2, 22-19А). Каждый матка расширяется кзади, уменьшаясь в диаметре, почти до заднего конца гемоцеле.
Upstream каждой матки составляет яйцевод малого диаметра (рис. 2). А небольшая припухлость семенная сосуд , расположен на стыке яйцевода и матки (рис. 2, 22-19А).В яйцеводы проходят кпереди, без значительного изменения диаметра, примерно до уровня влагалища, где оно поворачивается и снова бежит кзади. В два яйцевода обвиваются вокруг матки, кишечника и самих себя.
Около в середине тела каждый яйцевод уменьшается в диаметре и становится яичником . В яичники твердые, не трубчатые, образуют массу нитей малого диаметра в середина червяка.
Оогония продуцируются митотическими делениями первичных половых клеток в верхнем яичнике.В оогонии перемещаются вниз по течению к верхнему яйцеводу, где дополнительные митотические подразделения производить первичные ооциты. В клетка оплодотворяется в семяприемнике до начала мейотических делений, пока это все еще диплоидный ооцит. Один раз оплодотворенный, он попадает в матку, где развивает хитиновую скорлупу и подвергается оогенезу с последующим эмбриональным развитием. В матка содержит «яйца» в скорлупе на всех стадиях оогенеза и эмбрионального разработка.
Мужской
В репродуктивная система мужских аскарид похожа на женскую, но только одна. трубку, а не две (рис. 22-18A). Твердый свободный конец трубы перед потоком семенник — это . Это представляет собой небольшую белую твердую нить, свернутую в задней трети гемоцели. В виде он крутится взад и вперед, постепенно увеличивается в диаметре. В конце концов он поворачивается кпереди и становится vas семявыносящий проток, или семявыносящий проток.Этот область мужского протока полая и содержит мужские половые клетки, подвергающиеся сперматогенез. Это делает в середине гемоцели несколько петель, некоторые из которых расширяются кзади от области яичка.
В последняя петля семявыносящего протока снова поворачивается кзади и резко расширяется до стать семенного пузырька , трубка большого диаметра, идущая прямо кзади в задней трети животное.Его диаметр увеличивается по мере того, как он расширяется кзади и в нем хранятся сперматозоиды.
До достигая заднего конца тела, мужской проток уменьшается в диаметре один раз снова и становится семяизвержением воздуховод . Этот мышечный проток проходит кзади от конца семенного пузырька и соединяется прямая кишка или клоака, непосредственно перед анальным отверстием. А область секреторного эпителия, предстательная железа, лежит между семенными пузырек и семявыбрасывающий проток.Два ретрактивный копулятивный спикулы расположены рядом клоака. В спикулы располагаются в глубоких мешочках, выходящих из клоаки (рис. 22-18A, B). В течение совокупление они распространяются из ануса в вульву самки держать вульву открытой (рис. 22-18D).
Поперечные сечения
Исследование окрашенные поперечные срезы области глотки (рис.3, 22-15) и др. задние срезы, показывающие мужскую и женскую репродуктивную систему (рис. 4, 5).Ориентирование эти разделы иногда трудны, и вы не можете полагаться на положение на слайд для подсказок. В латеральные эпидермальные тяжи намного крупнее спинных и вентральных тяжей и можно использовать, чтобы отличить латеральную от дорсальной / вентральной (рис. 4, 5). Различать дорсальный от вентрального затруднен, но лучшим ориентиром является кишечник, обычно (но не всегда) в дорсальной половине гемоцели. к счастью это не имеет большого значения, если вы не можете различить спинной и вентрально, но важно отличать латеральную от дорсальной и вентральный.
Стена тела
В стенку тела можно изучить на любом из ваших поперечных сечений, но, если возможно, Удобнее всего начинать с поперечного сечения глотки (рис. 3). В внешний слой корпуса стенка — это толстая кутикула . Это представляет собой неживой внеклеточный секрет, который окрашивается в розовый цвет в большинстве препаратов (Рис 3, 4, 22-11).
Немедленно внутри кутикулы находится более тонкий эпидермис , который секретирует кутикулу (рис. 3).На на большинстве слайдов эпидермис выглядит как тонкий бледно-розовый слой, но он может быть отделены от кутикулы белым пространством. Если в настоящее время это пространство — артефакт, возникший в результате процесса изготовления слайдов и в жизни нет места между кутикулой и эпидермисом. Вместе эпидермис и кутикула составляют покров .
В эпидермис — это синцитий, ядра которого расположены в четырех эпидермисах . шнуры втянутые в корпус полость. справа и слева боковые эпидермальные тяжи ар большие и легко размещаемые (рис. 3, 4). В в этих тяжах малозаметные выводные протоки.
дорсальный и вентральный эпидермальные шнуры много меньше, но их можно найти при внимательном осмотре. дорсальный и вентральный продольные нервные тяжи являются обычно видны в дорсальных и вентральных эпидермальных тяжах соответственно.
В Самая толстая часть стенки корпуса — продольная слой мышцы (рис.3, 4, 22-11Б). Этот представляет собой единый слой крупных клеток, которые выпирают далеко в полость тела и занимают многое из этого. Каждая мышца ячейка состоит из очевидной периферии и менее заметной центральной части. В периферический, или фибриллярный , область находится на внутренней стороне базальной пластинки эпидермиса и содержит сократительные волокна клетки.Это легко узнать, потому что волокна окрашиваются в темно-розовый цвет и образуют толстый контур вокруг этой части клетки.
В ядро и большая часть цитоплазмы (или саркоплазмы), однако, находятся в большом, но менее заметный, выпуклый, центрально расположенный саркоплазматический область , которая простирается глубоко в полость тела. В очертания этой части клетки не так очевидны, как очертания фибриллярная область.
В два боковых эпидермальных шнура делят продольную мышечную оболочку на антагонистические спинные и вентральные мышечные поля. В нематоды аксоны мотонейронов не выходят из центральной нервной системы (нервные тяжи) и не доходят до мышц. Узкий саркоплазматические расширения, или иннервация отростки , возникают от апикальных концов мышечных клеток и идут к дорсальный или вентральный нервный канатик к синапсу с нейронами, ограниченными спинным мозгом.В процессы иннервации передают двигательные команды от центральной нервной системы к мышцы при отсутствии периферических аксонов, которые выполняют эту функцию в большинство животных.
Пищеварительная система
В белое пространство внутри червя — это hemocoel (= псевдоцель), или полость тела, и в ней находятся пищеварительный и репродуктивный системы (рис. 3,4). Глотка (= пищевод) имеет округлое сечение с толстыми мышечными стенками (рис.3).В в остальном просвет его свернут и имеет трехлучевую форму (= Y-образную форму). В просвет расширен за счет сокращения лучевых мышц стенок глотки. В виде часть передней кишки, глотка выстлана эпидермисом, которого не видно, и имеет толстую кутикулу вагонка , которая есть.
Кишечник — это обычно уплощенный (рис. 4, 5), но может быть расширенным и очень большим. В на высокой мощности видно, что стенки кишечника состоят из однослойной столбчатый эпителий из очень высокие клетки.В базальные концы клеток опираются на базальных lamina , которую можно увидеть снаружи кишечной трубки. В базальная пластинка отделяет эпителий от гемоцели, мышцы отсутствуют или мезотелий, связанный с кишечником. В апикальные концы эпителиальных клеток микроворсинки образуют абсорбирующую щеточку граница , которая отображается как темная линия вокруг просвета средней кишки. В гемоцель ограничен снаружи соматической мускулатурой, которая является мезодермальной, а внутри — эпителием средней кишки, который является энтодермальным.
Рис. 3. Поперечный разрез зева Ascaris . Нематода71L.gif
Репродуктивная система
Коммерчески подготовленные слайды обычно содержат по одному разделу от мужских и женских особей. Эти разрезы делаются через задние отделы тела и включают несколько разрезы через области репродуктивной трубки (ей).
Мужской
Учиться поперечный разрез самца Ascaris (рис. 4). Мужской поперечные сечения обычно меньше диаметра, чем охватывающие, и не имеют больших матки, заполненные яйцами (рис. 5). Мужская репродуктивная система представляет собой длинную, многогранную спираль. трубка. Плоскость сечения пройдет через эту трубку много раз и каждая специализированная область трубки, вероятно, будет представлена много раз. В количество раз зависит от уровня раздела.
Рисунок 4. Крест разрез самца Ascaris . Нематода56La.gif
В проксимальным верхним концом трубки является семенник , который плотная, небольшого диаметра и покрыта эпителием (рис. 4, 22-18A). Это наполнен маленькими сферическими первобытными половые клетки и не имеет просвета. В примордиальные половые клетки связаны с ветвящимся ядром, или rachis .Митотический деления половых клеток производят сперматогонии, которые перемещаются вниз по течению к проходят сперматогенез. Могут присутствовать несколько отделов яичка.
В следующая область мужской трубки — vas семявыносящий проток . Это немного больше в диаметре, чем семенник, а также окружен тонким эпителий. Его внутренняя часть наполнена сперматогониями и их дочери проходят сперматогенез.В организация содержимого семявыносящего протока более рыхлая, чем у семявыносящего протока. семенник и его половые клетки крупнее и не прикрепляются к позвоночнику. А просвет присутствует, хотя он может быть не очевиден, так как он заполнен развивающиеся половые клетки. Через семявыносящий проток должно быть несколько участков. в гемоэле вашего образца.
В следующая область мужского протока — семенной канал . везикула . Амебовидный здесь хранятся сперматозоиды (рис. 22-18C).Большинство слайды имеют один разрез семенного пузырька, но один сделан слишком далеко спереди не будет. В жизни семенной пузырь больше в диаметре, чем другие области мужская система, но в сохранившемся материале она часто сужается и может быть меньше. В эпителиальные стенки этой области намного толще, чем у верхних отделов репродуктивная труба, и это лучший способ ее распознать. В семявыбрасывающий проток, который является нижним по потоку участком мужской системы, слишком далеко кзади, чтобы находиться в том же поперечном сечении, что и яичко и семявыносящие протоки семявыносящий проток.
Женский
Учиться поперечный разрез самки Ascaris и его репродуктивная система. Это должен быть узнаваем по его двум большим маткам, заполненным яйцами. В женская репродуктивная система состоит из двух длинных, свернутых спиралью трубок (рис. 22-10А). В плоскость сечения проходит через эти трубки много раз, и каждая область трубки наверняка будет представлен много раз. В количество зависит от уровня раздела.Большинство разделов должны включать разрезы через яичники, яйцеводы и матки. В извилистая, спиралевидная природа репродуктивной системы приводит к образованию нескольких секций через яичники и яйцеводы, но, вероятно, не через матку. в отличие мужская репродуктивная система женщины двойная, поэтому есть два яичники, два яйцевода и две матки. Там есть только одно влагалище и гонопор, но они не будут представлены на слайде.
В наименьшие срезы яичника (рис. 5, 22-19А).Эти легко узнаваемы, потому что они твердые, в то время как яйцеводы и матка полые (хотя и полные яиц, что могут показаться твердыми). В яичник имеет центральное клеточное ядро, известное как рахис , из которых исходит единственный слой длинных узких исконных половые клетки . Их ядра обычно легко увидеть. Митотический деления половых клеток производят оогонии, которые перемещаются вниз по течению, когда они подвергаются оогенезу. Яичник и яйцевод окружены тонким эпителием, который часто отделяются от зародышевых клеток, оставляя белое пространство между их.Этот космос — это артефакт. Рахис может казаться крошечным просветом, но это не так. Если присмотритесь, вы увидите в нем бледные, слегка окрашенные клетки. (Если здесь нет клеток и центр органа белый, вы смотрите на яйцевод, а не яичник.)
Яйцевод имеет почти такой же, как и яичник, но немного больше в диаметре и полый (рис 5). Его эпителий похож на эпителий яичника и толстый, но имеет небольшой просвет вместо рахиса.Вокруг просвет представляет собой единый толстый слой оогониев (вверх по течению) или ооцитов (дальше вниз по течению).
матки , из которых в большинстве поперечных сечений должно быть два, намного больше, чем яйцеводы или яичники. Они наполнены большими «яйцами» с скорлупой на разных стадиях оогенеза и развитие и стенка матки толстая и мускулистая.
Жизненный цикл
В В жизненном цикле аскарид участвует только один хозяин, который заражается при проглатывании яиц аскарид в его пище или воде.Эти вылупляются в кишечнике, и молодые черви мигрируют в печень, где попадают гемальная система хозяина. Они переносятся с кровью в легкие, где попадают в просвет альвеол. От здесь они подползают к глотке, затем следуют по просвету кишечника, чтобы вернуться к маленькому кишечник, где они созревают во взрослых круглых червей и питаются химусом.
Рисунок 5. Крест секция самки Ascaris с репродуктивная система.В детали стенки корпуса опущены. Нематода57La.gif
Огромный несколько червей могут присутствовать на одном хозяине (рис. 22-21). После созревание, совокупление происходит, и самки производят и выпускают яйца с скорлупой, которые оставить хозяина в фекалиях. Когда полностью развитое и заразное, «яйцо» аскариды содержит крошечного молодого червяка. способен заразить нового хозяина. Аскарида яйца трудно убить, и они сохраняют жизнеспособность в почве до 20 лет и широко распространены в окружающей среде.Разработка прямой, без явной личинки. В молодые особи проходят четыре линьки, чтобы стать взрослыми (рис. 22-9).
Проглатывание яиц и последующее инфицирование чаще всего встречается у детей из-за их привычки играть в траве и песке и без разбора глотать различные потенциально загрязненные материалы.
Список литературы
Гудчайлд CG. 1950. Аскариды lumbricoides , pp 243-251 в Brown FA.(ред). Выбрано Типы беспозвоночных. Вайли, Нью-Йорк. 597p.
Крофтон HD . 1966. Нематоды. Hutchinson Univ. Библиотека, Лондон. 160р.
Maggenti A. 1981. Общие Нематология. Спрингер-Верлаг, Нью-Йорк. 372п.
Петрункевич А . 1916. Морфология. типов беспозвоночных.Макмиллан, Нью-Йорк. 263п.
Рупперт Э., Фокс РС, Барнс РБ. 2004. Зоология беспозвоночных, функциональный эволюционный подход, 7 th ed. Брукс Коул Томсон, Белмонт, Калифорния. 963 с.
Шмидт GO, Робертс LS . 1989. Фонды паразитологии, 4 -е изд. Раз Зеркало / Мосби, Нью-Йорк. 750p.
Уэллс ММ. 1924. Аскарида megalocephala , краткое изложение истории жизни, анатомии и цитологии лошадь — Аскарида . Общий Паб «Биологические ресурсы» (Turtox). Стр. 1-24.
Райт КА. 1991. Нематоды. Харрисон FW, Рупперт Э. (ред.). Микроскопический Анатомия беспозвоночных т. 4 Aschelminthes . Вили-Лисс, Нью-Йорк. 424стр.
Принадлежности
Диссекционный микроскоп
Длинный узкий лоток для препарирования (алюминиевый лоток для кубиков льда с воском дно в идеале)
Булавки от насекомых из нержавеющей стали # 1
10-кратный ручной объектив
Препараты поперечного сечения мужской и женской репродуктивной системы
Поперечный слайд через зев
Живые мелкие нематоды, такие как Cephalobus
Диссекционный микроскоп
Пляжный песок
Крест срезы репродуктивной области самца и самки Ascaris представлены можно получить в Carolina Biological and Ward’s Natural Science.
