Молекулярные основы наследственности — СтудИзба
Лекция 3 Молекулярные основы наследственности
В 1927 году Кольцовым М.К. была выдвинута гипотеза о белковой природе гена. Изучение химии нуклеиновых кислот (рибонуклеиновой и дезоксирибонуклеиновой) началось в Тюбингенской лаборатории в Германии. Здесь в 1868-1869 г.г. молодой швейцарский физиолог и гистолог Ф. Мимер с ядерной массы лейкоцитов выделил вещество с сильными кислыми свойствами – нуклеин (от лат. ядро). Это была смесь двух веществ – нуклеиновой кислоты и белка. Ученый доказал, что в состав нуклеиновых кислот входят фосфорная кислота, пуриновые и пиримидиновые основания, углеводные компоненты (сахара).
Исследованиями Ф.Гриффитса (1928), О.Эвери, К.Мак-Леода (1944) доказано, что вещество, которое направленно изменяет наследственность пневмококков, является ДНК, а не белок. С этого времени роль ДНК в наследственности большинство ученых считают доказанной.
Структурной единицей ДНК является нуклеотид. В состав каждого нуклеотида входит три компонента: остаток фосфорной кислоты, сахар пентоза – дезоксирибоза, азотистые основания – пуриновые (аденин — А, гуанин — Г) и пиримидиновые (тимин — Т, цитозин — Ц).
В состав каждого нуклеотида входит три компонента: остаток фосфорной кислоты, сахар пентоза – дезоксирибоза, азотистые основания – пуриновые (аденин — А, гуанин — Г) и пиримидиновые (тимин — Т, цитозин — Ц).
Структура молекулы ДНК была установлена в 1953 г. Д.Уотсоном и Ф.Криком. Молекула ДНК состоит из двух связанных между собой полинуклеотидных нитей спирально скрученных. Молекула ДНК состоит из тысяч нуклеотидов (108 и более). Нуклеотиды последовательно связаны друг с другом в цепочку с помощью остатка фосфорной кислоты и молекулы дезоксирибозы. Специфичность каждого нуклеотида в молекуле ДНК определяется наличием соответствующего азотистого основания. Каждый нуклеотид одной цепочки соединяется водородными связями с нуклеотидом другой цепочки строго закономерно: аденин соединяется с тимином двумя водородными связями, гуании – с цитозином тремя водородными связями.
Число пуриновых нуклеотидов (А+Г) равно числу пиримидиновых (Ц+Т), то есть отношение (А+Г):(Т+Ц)=1. Две комплементарные нити образуют правовинтовую спираль, каждый виток которой имеет длину 3,4 нм, расстояние между нуклеотидами 0,34 нм. Азотистые основания ориентированы к середине спирали.
Азотистые основания ориентированы к середине спирали.
Число нуклеотидов и их последовательность в молекуле ДНК специфичны для каждого вида и частично – для каждой особи. Д.Уотсон ввел понятие о видовой специфичности ДНК. Коэффициентом видовой специфичности называют соотношение (А+Т):(Г+Ц).
Репликацией называют процесс самокопирования молекулы ДНК с точным соблюдением порядка чередования нуклеотидов, присущего исходным комплементарным нитям. У многоклеточных организмов в результате слияния гамет при оплодотворении образуется зигота, в которой содержится наследственная информация гаплоидных геномов родительских особей. В онтогенезе из зиготы в результате митоза образуются миллиарды клеток, каждая из которых несет в себе всю генетическую информацию.
Репликация происходит в период синтеза (S-период) интерфазы митотического цикла. На отдельных участках молекулы ДНК образуются так называемые вилки репликации (участки молекулы ДНК, где расплетаются комплементарные нити). В этих местах водородные связи между азотистыми основаниями под действием соответствующих ферментов (ДНК-полимераз) разрываются, комплементарные нити разъединяются, и каждая из них становится матрицей, на которой происходит синтез дочерних нитей.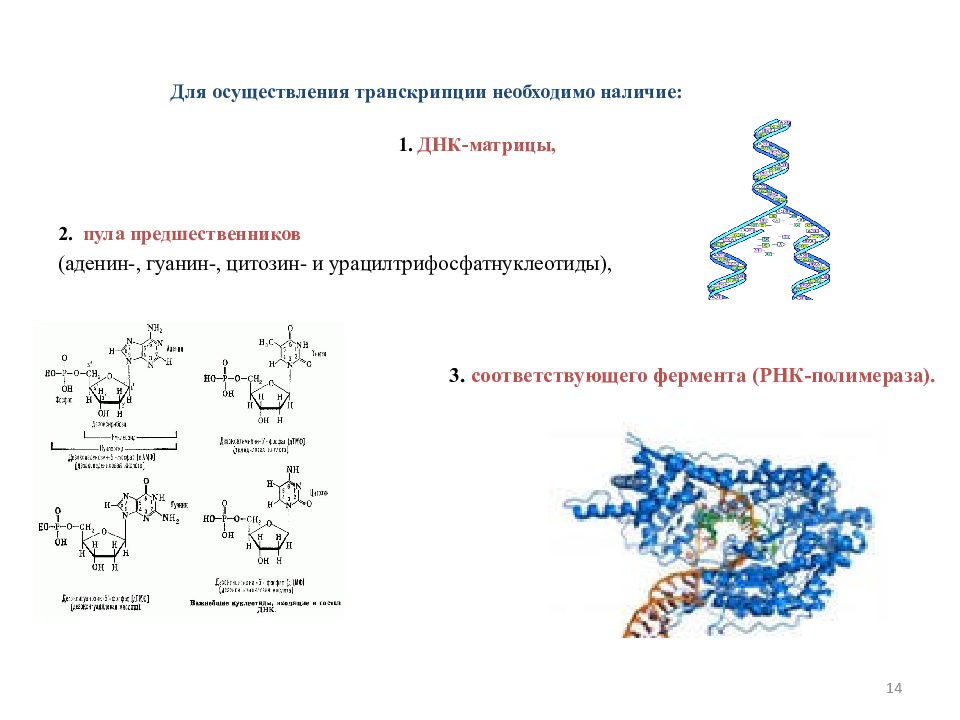 Таким образом, ДНК способна самовоспроизводиться (реплицироваться, самокопироваться) и сохранять наследственную информацию, закодированную в ней в виде последовательности чередования нуклеотидных оснований, во множестве поколений клеток, образующихся в онтогенезе многоклеточного организма.
Таким образом, ДНК способна самовоспроизводиться (реплицироваться, самокопироваться) и сохранять наследственную информацию, закодированную в ней в виде последовательности чередования нуклеотидных оснований, во множестве поколений клеток, образующихся в онтогенезе многоклеточного организма.
Структура молекулы РНК отличается от ДНК тем, что тимин (Т) заменяется урацилом (У), а дезоксирибоза – рибозой. Молекула РНК одноцепочечная. Они имеют значительно меньшие размеры, чем ДНК.
Рекомендуемые файлы
Виды РНК: матричная (мРНК, или информационная иРНК), рибосомальная (рРНК), транспортная (тРНК). Все рибонуклеиновые кислоты синтезируются на соответствующих участках молекулы ДНК, как на матрице при участии фермента РНК-полимеразы.
Строение белка и его синтез.
Белкам принадлежит исключительно важная роль в жизнедеятельности каждой клетки (построение мембран, хроматина, рибосом, митохондрий). Первичная молекула белка представляет собой цепочку, состоящую из 100-300 различных аминокислот и более, порядок чередования которых определяет специфичность данной молекулы: каждая из 20 аминокислот может встречаться многократно, но местонахождение контролируется ДНК. В настоящее время для многих молекул белка установлена их первичная структура, то есть порядок чередования аминокислот в полипептидной цепи.
В настоящее время для многих молекул белка установлена их первичная структура, то есть порядок чередования аминокислот в полипептидной цепи.
Вторичная структура белковой молекулы зависит от первичной: аминокислоты в полипептидной цепи соединяются водородными связями между NH– и СО-группами, в результате чего она свертывается в так называемую альфа-спираль.
Третичная структура белковых молекул образуется в результате связывания так называемыми дисульфидными мостиками (S-S) двух цистеиновых остатков аминокислот.
Четвертичная структура белковых молекул характеризуется тем, что они состоят из двух-четырех различных, стабильно соединенных полипептидных цепей. Такая структура характерна для многих ферментов.
Вторичная, третичная, четвертичная структуры белковых молекул зависят от числа и порядка чередования аминокислот в полипептидной цепи, то есть от первичной структуры.
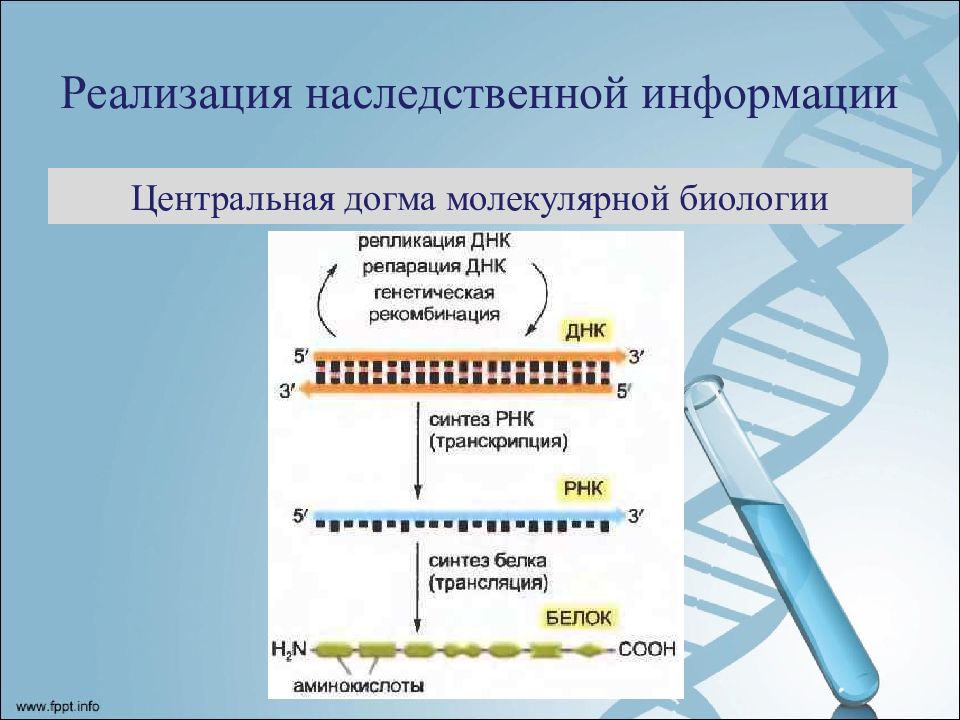
Процесс синтеза белка в клетке называется биосинтезом. Он осуществляется под контролем молекулы ДНК, которая таким образом реализует закодированную в ней наследственную информацию. Процесс биосинтеза сложный и включает ряд этапов – транскрипцию и трансляцию.
Процесс биосинтеза сложный и включает ряд этапов – транскрипцию и трансляцию.
Рекомендуем посмотреть лекцию «16.3 Русская литература XVIII века».
Транскрипция – это процесс считывания информации с ДНК на иРНК во время ее синтеза (первый этап реализации генетической информации в клетках). Транскрипция происходит в ядре клетки: на участке определенного гена молекулы ДНК синтезируется мРНК. Этот синтез осуществляется при участии комплекса ферментов, главным из которых является ДНК-зависимая РНК-полимераза, которая прикрепляется к начальной (инициальной) точке молекулы ДНК, расплетает двойную спираль и, перемещаясь вдоль одной из нитей, синтезирует рядом с ней комплементарную нить мРНК. В результате транскрипции мРНК содержит генетическую информацию в виде последовательного чередования нуклеотидов, порядок которых точно скопирован с соответствующего участка (гена) молекулы ДНК.
В ДНК наряду с участками, кодирующими рРНК, тРНК и полипептиды, имеются фрагменты, не содержащие генетической информации. Они получили название интронов в отличие от кодирующих фрагментов, которые называются экзонами. Установлено, что, если в ДНК считываются только участки экзонов, зрелая мРНК не образуется.
Они получили название интронов в отличие от кодирующих фрагментов, которые называются экзонами. Установлено, что, если в ДНК считываются только участки экзонов, зрелая мРНК не образуется.
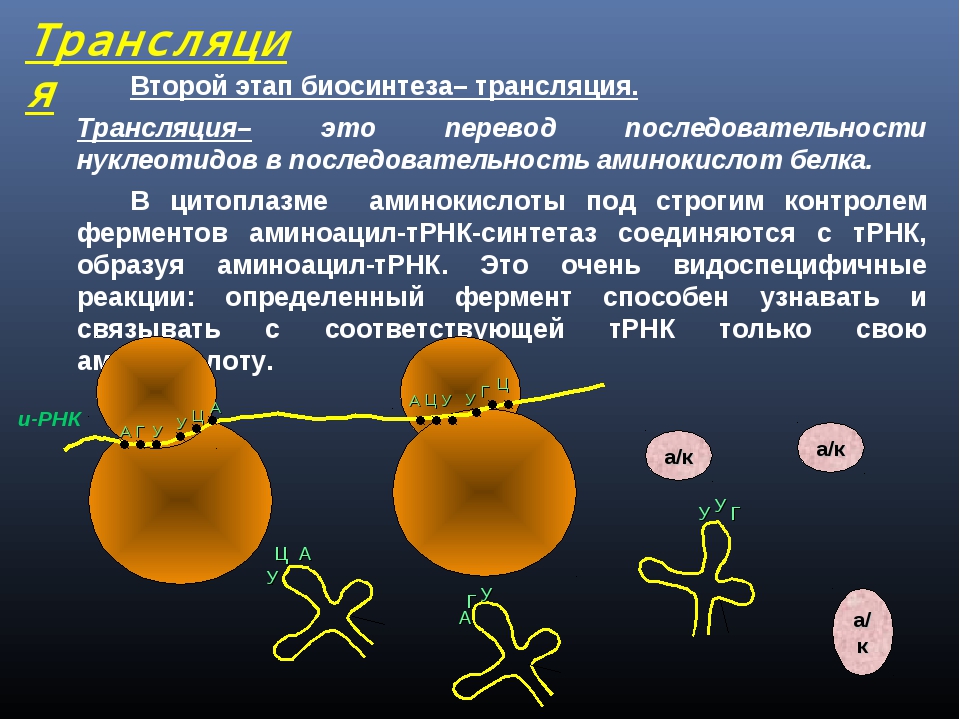
Следующий этап биосинтеза белка – трансляция – происходит в цитоплазме на рибосомах при участии тРНК.
Трансляция (от лат. передача) – это синтез полипептидных цепей белков по матрице иРНК согласно генетическому коду. Генетический код – свойственная живым организмам единая система записи наследственной информации в молекулах нуклеиновых кислот в виде последовательности нуклеотидов; определяет последовательность включения аминокислот в синтезирующуюся полипептидную цепь в соответствии с последовательностью нуклеотидов ДНК гена (или процесс перевода триплетной последовательности нуклеотидов молекулы ДНК в последовательность аминокислот в белковой молекуле). В узком смысле генетический код – это словарь кодонов (триплетов иРНК), кодирующих те или иные аминокислоты и знаки пунктуации белкового синтеза.
В 1964 году Дж.Маттей, Ф.Крик, М.Ниренберг, а затем С.Очао расшифровали генетический код. Триплет ДНК, или кодоген – это три соседних нуклеотида, которые несут информацию на включение одной из 20 основных аминокислот в полипептидную цепь белка. Триплеты – это не просто случайные группы трех нуклеотидов, а видовая специфичность молекул ДНК и РНК. Генетический код колинеарный, то есть четкое соответствие между последовательностями кодонов нуклеиновых кислот и аминокислотами полипептидной цепи. Генетический код универсальный, триплетный, вырожденный, неперекрывающийся.
Транспортные РНК синтезируются в ядре, но функционируют в свободном состоянии в цитоплазме клетки. Одна молекула тРНК содержит 76-85 нуклеотидов и имеет довольно сложную структуру, напоминающую клеверный лист. Три участка тРНК имеют особо важное значение: 1) антикодон, состоящий из трех нуклеотидов, определяющий место прикрепления тРНК к соответствующему комплементарному кодону (мРНК) на рибосоме; 2) участок, определяющий специфичность тРНК, способность данной молекулы прикрепляться только к определенной аминокислоте; 3) акцепторный участок, к которому прикрепляется аминокислота.
 Он одинаков для всех тРНК и состоит из трех нуклеотидов – ЦЦА. Присоединению аминокислоты к тРНК предшествует ее активация ферментом аминоацил-тРНК-синтетазой. Этот фермент специфичен для каждой аминокислоты. Активированная аминокислота прикрепляется тРНК и доставляется ею на рибосому.
Он одинаков для всех тРНК и состоит из трех нуклеотидов – ЦЦА. Присоединению аминокислоты к тРНК предшествует ее активация ферментом аминоацил-тРНК-синтетазой. Этот фермент специфичен для каждой аминокислоты. Активированная аминокислота прикрепляется тРНК и доставляется ею на рибосому. Молекула мРНК выходит из ядра в цитоплазму и прикрепляется к малой субъединице рибосомы. Трансляция начинается со стартового кодона (инициатора синтеза) –АУГ. Когда тРНК доставляет к рибосоме активированную аминокислоту, ее антикодон соединяется водородными связями с нуклеотидами комплементарного кодона мРНК. Акцепторный конец тРНК с соответствующей аминокислотой прикрепляется к поверхности большой субъединице рибосомы. После первой аминокислоты другая тРНК доставляет следующую аминокислоту, и таким образом на рибосоме синтезируется полипептидная цепь. Синтез полипептидной цепи прекращается, когда на мРНК появляется один из кодонов-терминаторов – УАА, УАГ или УГА. Начало синтеза полипептидной цепи называется инициацией, а окончание синтеза – терминацией.
Тесты по молекулярным основам наследственности
Тестовые задания по теме
«Молекулярные основы наследственности»
Инструкция: выбрать один наиболее правильный ответ
Полипептидная цепь белка это
Вторичная структура
Первичная структура
Третичная структура
Четвертичная структура
Полипептид состоит из
Белков
Нуклеотидов
Аминокислот
Азотистых оснований
Нуклеотид является частью
Полипептида
Аминокислоты
Белка
Дезоксирибонуклеиновой кислоты
Дезоксирибоза это
ДНК
Нуклеотид
Сахар
Аминокислота
Кодон это
Три аминокислоты
Т-РНК
Три нуклеотида
Часть полипептида
Синтез белка происходит
Ядре клетки
Рибосомах
В глыбках хроматина
В митохондриях
Трансляция это
Переписывание информации с ДНК на И-РНК
Перевод информации с И-РНК на М-РНК
Сборка первичной структуры белка
Сборка ДНК
Комплементарность это соответствие
А – Г
Г – Т
Т –А
Ц – А
Разрезание молекулы ДНК происходит с помощью
Гидроктазы
Рестриктазы
ДНК-полимеразы
РНК-полимеразы
Узнавание нужной аминокислоты происходит в
АКЦ рибосомы
ППЦ рибосомы
Ядре
Митохондрии
В одну рибосому одновременно может попасть
2 нуклеотида
6 нуклеотидов
3 триплета
6 триплетов
Информационная РНК проходит при трансляции через
Ядро
Рибосому
Митохондрию
Лизосому
Образование пептидных связей между аминокислотами происходит при трансляции в
Ядре Кариолемму
АКЦ рибосомы
ППЦ рибосомы
Митохондриях
Трансляция происходит в
Ядре
АКЦ рибосомы
ППЦ рибосомы
Гранулярной ЭПС
Транскрипция это
Перенос информации с М-РНК на белок
Перенос информации с ДНК на И-РНК
Удвоение молекулы ДНК
Разрезание молекулы ДНК
Сборка И-РНК на матрице ДНК идет с помощью
Ревертазы
ДНКА-полимеразы
РНК-полимеразы
Рестриктазы
Тестовые задания открытого типа по теме
«Молекулярные основы наследственности. ДНК и РНК. Синтез белка.»
ДНК и РНК. Синтез белка.»
Инструкция: закончите фразу.
ДНК по своей структуре является …
Комплементарность – это …
Генетический код – это …
В состав одного нуклеотида ДНК входят …
Отличия ДНК от РНК:
…
…
…
Строение ДНК в 1953 году открыли
Каждой аминокислоте по генетическому коду соответствует ….
Рибоза входит в состав …
Кодон – это…
Остаток фосфорной кислоты РО4-3 входит в состав …
Транскрипция — это …
РНК бывает трех видов:
…
…
…
ДНК входит в состав …
Трансляция происходит в …
В рибосомах различают два центра:
…
…
Трансляция – это.
 ..
..Т-РНК переносит к месту сборки белка на своем конце …
Редупликация ДНК – это …
Каждая рибосома состоит из двух частей:
…
…
Образование из нескольких рибосом называется …
Пособие для самостоятельной работы студентов с глоссарием
Тема «Цитологические основы наследственности»
В соматической клетке человека 46 хромосом, которые хорошо различны в метафазу митоза. В интерфазном ядре видны только глыбки хроматина.
Хроматин – это ДНК + белок.
Кариотип – это набор хромосом в соматической клетке, характерный для данного вида.
Кариограмма – хромосомы кариотипа, выстроенные по порядку.
Каждая хромосома кариотипа имеет парную себе или гомологичную хромосому, сходную по размерам, строению и генам, находящиеся в ней.
В каждом кариотипе различают пару половых (ХХ для ♀ и ХУ для ♂) и 22 пары аутосом.
Аутосомы – хромосомы кариотипа, одинаковые для мужчины и женщины. В половых клетках по 1 половой и по 22 аутосомы.
Ядро клетки окружено ядерной мембраной – кариолеммой, внутри ядра находится кариоплазма, в которой видны в интерфазу глыбки хроматина и ядрышко. В ядрышке находится РНК и формируются рибосомы.
В хромосомах кариотипа человека сосредоточены ≈ 60000 генов.
Молекулу ДНК в 1953 году расшифровали Уотсон и Крик.
Лекция Молекулярные основы наследственности Биосинтез белка Транскрипция 1
Лекция Молекулярные основы наследственности. Биосинтез белка. Транскрипция. 1
План 1. Организация наследственного материала. а) Историческое развитие концепции гена. б) Фукционально-генетическая классификация генов. 2. Особенности транскрипции. 3. Транскрипция у прокариот. Регуляция транскрипции у прокариот. Схема работы лактозного оперона. 4. Транскрипция у эукариот. Регуляция транскрипции у эукариот. 2
Регуляция транскрипции у эукариот. 2
1. Организация наследственного материала. а) Историческое развитие концепции гена. б) Фукционально-генетическая классификация генов.
Организация наследственного материала Современные представления о природе генетического аппарата позволяют выделить три уровня его организации: • Генный • Хромосомный • Геномный
Геномный уровень организации наследственного материала • Геном это совокупность наследственного материала в гаплоидном наборе хромосом клеток организмов соответствующего биологического вида. • Геном видоспецифичен. • Геном сбалансированный, эволюционно «проработанной» и отобранный объем генетической информации. • С геномным уровнем генетического аппарата эукариот связывают переход к избирательной транскрипции генов по времени (период онтогенеза), месту (тип клеток) и объему.
Хромосомный уровень организации наследственного материала Связан с его большим объемом по сравнению с прокариотической клеткой.
Генный уровень организации наследственного материала. • Ген – это единица наследственности и изменчивости. • По современным представлениям ген – это участок молекулы ДНК, кодирующий информацию о синтезе определенного полипептида или нуклеиновой кислоты.
а) Историческое развитие концепции гена
б) Фукционально-генетическая классификация генов.
2. Особенности транскрипции.
Так выглядит транскрипция – синтез РНК для последующего производства белка http: //www. vechnayamolodost. ru/pages/drugienaukiozhizni/rodkoodnrntrimndr 80. html
Фермент РНК-полимераза (зеленые комки) ползет по молекуле ДНК (скрученный тяж) и «считывает» ее, синтезируя молекулу РНК (разноцветная лента). В молекуле РНК интроны показаны серым, экзоны — яркими цветами. Вырезанные фрагменты РНК уплывают вдаль, облепленные разнообразными полупрозрачными РНК-связывающими белками. 12
В молекуле РНК интроны показаны серым, экзоны — яркими цветами. Вырезанные фрагменты РНК уплывают вдаль, облепленные разнообразными полупрозрачными РНК-связывающими белками. 12
Стадии и ферменты транскрипции Транскрипция – биосинтез одноцепочечной молекулы РНК на матрице ДНК 1. Синтез молекул РНК идет в направлении 5’– 3′; считывание матричной ДНК идет в направлении 3’– 5‘ 2. Для каждого гена только одна из цепей ДНК кодирующая, то есть, каждая молекула РНК считывается только с одной цепи ДНК. 3. Разные гены могут считываться с противоположных цепей ДНК 4. Синтезированная молекула РНК идентична кодирующей цепи ДНК (кроме замены основания тимин на урацил) http: //www. alliot. fr/bio. shtml. fr 13
Стадии и ферменты транскрипции Для осуществления транскрипции необходимо наличие: 1. ДНК-матрицы, 2. пула предшественников (аденин-, гуанин-, цитозин- и урацилтрифосфатнуклеотиды), 3. соответствующего фермента (РНК-полимераза). 14
Последовательность ДНК, транскрибируемая в одну молекулу РНК, начинающаяся промотором и заканчивающаяся терминатором, называется транскрипционной единицей, или транскриптоном. Промотор — сайт ДНК, с которым связывается РНК-полимераза. Терминатор — последовательность ДНК, 15 http: //www. biochemistry. ru/biohimija_severina/B 5873 Part 31 -185. html на которой РНК-полимераза прекращает синтез РНК
Промотор — сайт ДНК, с которым связывается РНК-полимераза. Терминатор — последовательность ДНК, 15 http: //www. biochemistry. ru/biohimija_severina/B 5873 Part 31 -185. html на которой РНК-полимераза прекращает синтез РНК
Транскрипция – матричный процесс, в котором выделяют три стадии Стадии транскрипции ИНИЦИАЦИЯ (самая медленная стадия) промотор ЭЛОНГАЦИЯ Процессы, происходящие на стадиях транскрипции 1. 2. 3. Связывание РНК-полимеразы с ДНК Расплетание ДНК на участке 10 -20 нуклеотидов Формирование первых фосфодиэфирных связей Удлинение цепи РНК (самая длительная стадия) ТЕРМИНАЦИЯ (самая короткая стадия) терминатор 1. Остановка синтеза РНК 2. Распад тройного комплекса ДНК—-РНК-полимераза——РНК 16
3. Транскрипция у прокариот. Регуляция транскрипции у прокариот. Схема работы лактозного оперона.
Схема регуляции транскрипции у прокариот (гипотеза оперона) была предложена Ф. Жакобом и Ж. Моно в 1961 г. на примере лактозного оперона для объяснения регуляция генов у E. coli (Нобелевская премия по физиологии и медицине, 1965 г. ). Оперон – группа тесно сцепленных генов, находящихся под контролем общего промотора и транскрибируемых как единая и-РНК. Оперон – группа структурных генов управляемых одним геномоператором. Оперон – участок ДНК, на котором синтезируется и-РНК, определяющая синтез белка 18
Моно в 1961 г. на примере лактозного оперона для объяснения регуляция генов у E. coli (Нобелевская премия по физиологии и медицине, 1965 г. ). Оперон – группа тесно сцепленных генов, находящихся под контролем общего промотора и транскрибируемых как единая и-РНК. Оперон – группа структурных генов управляемых одним геномоператором. Оперон – участок ДНК, на котором синтезируется и-РНК, определяющая синтез белка 18
Регуляция транскрипции у прокариот В состав оперона входит: 1. Промотор 2. Инициатор 3. Ген-оператор 4. Структурные гены 5. Терминатор Ген-регулятор не является частью оперона, он активен постоянно и на основе его информации через и-РНК синтезируется особый белокрепрессор. Белок-репрессор связывается индуктором. Индуктор – вещество, инициирующее синтез фермента, который его разлагает. 19
Схема работы лактозного оперона Оперон работает 20
Регуляция работы генов у прокариот http: //bio.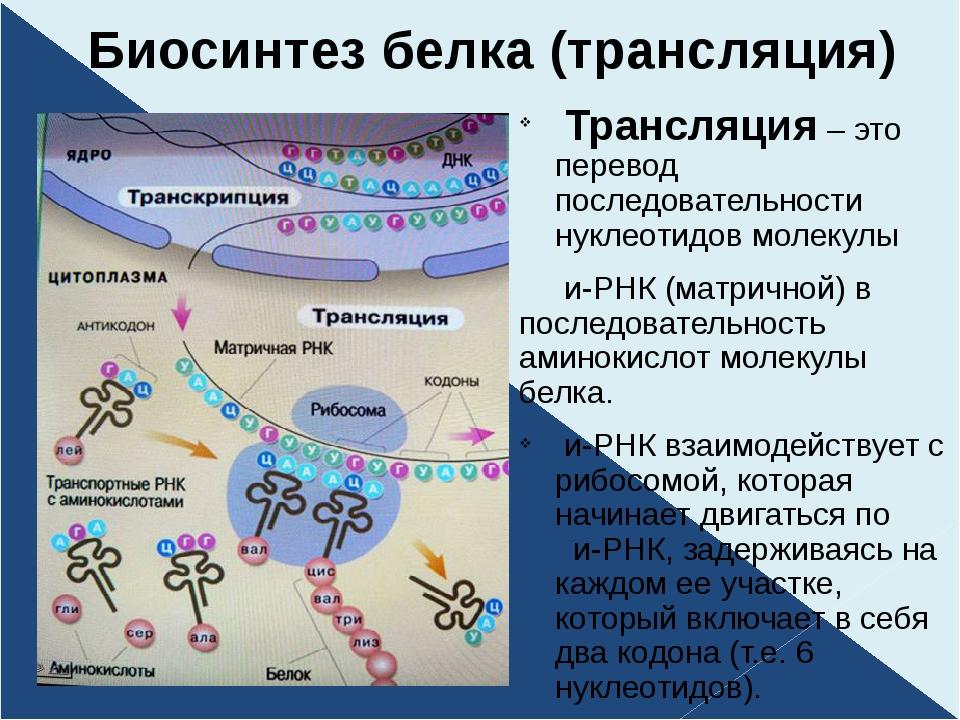 fizteh. ru/student/files/biology/biolections/lection 11. html 21
fizteh. ru/student/files/biology/biolections/lection 11. html 21
4. Транскрипция у эукариот. Регуляция транскрипции у эукариот.
Схема регуляции транскрипции у эукариот разработана Георгием Павловичем Георгиевым (1972 г. ) и получила название гипотезы транскриптона. Единица транскрипции у эукариот также транскриптон Принцип регуляции (обратная связь) сохраняется, но механизмы ее более сложные. В прокариотической клетке наследственный материал и аппарат биосинтеза белка пространственно не разобщены, поэтому транскрипция и трансляция происходят почти одновременно. У эукариот транскрипция происходит в ядре и сопровождается процессингом пре-РНК транскрипта, трансляция — в 23 цитоплазме на рибосомах.
Транскрипция у эукариот Транскриптон состоит из неинформативной (акцепторной) и информативной (структурной) зон. Неинформативная зона начинается промотором с инициатором. Далее следует группа генов-операторов, за которым расположена информативная зона. Информативная зона образована структурным геном, разделенным на экзоны и интроны. Заканчивается транскриптон терминатором. 24
Информативная зона образована структурным геном, разделенным на экзоны и интроны. Заканчивается транскриптон терминатором. 24
Энхансеры Энхансер (усилители транскрипции, англ. enhance — увеличивать, усиливать) – это генетический элемент, обладающий усиливающим транскрипцию действием, которое практически не зависит от расположения элемента относительно контролируемого им гена. http: //moikompas. ru/compas /regulation_gene 25
Энхансеры представлены короткими последовательностями ДНК, включающих десятки нуклеотидных пар. Энхансер увеличивает эффективность транскрипции гена в десятки и сотни раз. Энхансеры способны активировать гены на больших расстояниях, достигающих нескольких десятков тысяч пар нуклеотидов. В некоторых случаях они могут активировать транскрипцию генов, расположенных на других хромосомах. Энхансер увеличивает эффективность транскрипции гена в десятки и сотни раз. Особенность энхансеров состоит в том, что они способны действовать на больших расстояниях (более чем 1000 п. н. ) и вне зависимости от ориентации по отношению к направлению транскрипции гена. Еще одной важной характеристикой энхансера является его способность активировать любой промотор, расположенный сравнительно недалеко. Энхансеры — основное средство регуляции транскрипции в клетках высших эукариот. Для взаимодействия энхансера с промотором необходимо приблизить эти сайты друг к другу. Возможность такого контакта может определяться другими регуляторными участками, формирующими петлевую укладку хроматина.
н. ) и вне зависимости от ориентации по отношению к направлению транскрипции гена. Еще одной важной характеристикой энхансера является его способность активировать любой промотор, расположенный сравнительно недалеко. Энхансеры — основное средство регуляции транскрипции в клетках высших эукариот. Для взаимодействия энхансера с промотором необходимо приблизить эти сайты друг к другу. Возможность такого контакта может определяться другими регуляторными участками, формирующими петлевую укладку хроматина.
Сайленсеры Сайленсер (ослабители транскрипции, англ. silense — заглушать) – это регуляторный участок ДНК, который подавляет активность промотора. Также как энхэнсеры, сайленсеры действуют в определенной степени независимо от ориентации в геноме и от расстояния от промотора. Связывание белков-репрессоров с сайленсерами приводит к понижению или к полному подавлению синтеза РНК-полимеразой. http: //kak. znate. ru/docs/index-9406. html 27
Сайленсеры Ингибирование транскрипции с использованием регуляторных элементов, называемых сайленсерами, — активный процесс.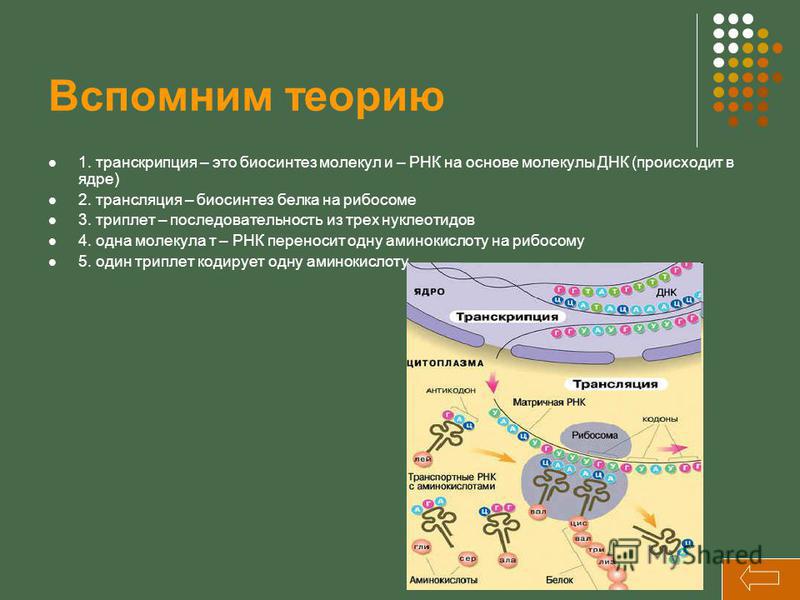 В этом случае происходит прямое подавление инициации транскрипции путем разрушения транскрипционного комплекса на промоторе или посредством его инактивации иным способом. Первый из описанных в 1986 г. сайленсеров обладал классическими энхансероподобными свойствами, действуя на промоторы, расположенные в цис-положении (на той же молекуле ДНК) на большом расстоянии. При этом активность сайленсера, подобно энхансеру, не зависела от его ориентации по отношению к регулируемому промотору.
В этом случае происходит прямое подавление инициации транскрипции путем разрушения транскрипционного комплекса на промоторе или посредством его инактивации иным способом. Первый из описанных в 1986 г. сайленсеров обладал классическими энхансероподобными свойствами, действуя на промоторы, расположенные в цис-положении (на той же молекуле ДНК) на большом расстоянии. При этом активность сайленсера, подобно энхансеру, не зависела от его ориентации по отношению к регулируемому промотору.
Инсуляторы Специфичность действия энхансеров и сайленсеров определяется инсуляторами, которые блокируют активность энхансера или сайленсера. Существуют определенные последовательности нуклеотидов длиной в несколько сотен пар оснований, которые обладают способностью подавлять позитивное и негативное влияние эухроматина и гетерохроматина на экспрессию трансгенов, интегрированных в этот хроматин и фланкированных указанными последовательностями в новом сайте интеграции. Такие участки ДНК как бы изолируют ген, находящийся между ними, способствуя сохранению его обычной пространственной структуры. Эти последовательности известны под названием инсуляторов (англ. insulate — изолировать) и как регуляторные области локусов (LCR — locus control regions). Введение одного из таких элементов между энхансером и промотором регулируемого гена приводит к функциональной изоляции энхансера и подавлению экспрессии гена. http: //kak. znate. ru/docs/index-9406. html 29
Эти последовательности известны под названием инсуляторов (англ. insulate — изолировать) и как регуляторные области локусов (LCR — locus control regions). Введение одного из таких элементов между энхансером и промотором регулируемого гена приводит к функциональной изоляции энхансера и подавлению экспрессии гена. http: //kak. znate. ru/docs/index-9406. html 29
Процессинг первичных транскриптов Процессинг (созревание) РНК – совокупность биохимических реакций, в результате которых происходит модификация пре-РНК с образованием зрелых молекул РНК: структурная (уменьшается молекулярная масса) и химическая. 30
Процессинг первичных транскриптов http: //rpp. nashaucheba. ru/docs/index-102487. html 31
Процессинг РНК как компонент центральной догмы молекулярной биологии ДНК Репликация рекомбинация репарация пре-РНК репликация БЕЛОК сворачивание сборка ПРОЦЕССИНГ ФУНКЦИЯ 32
Сплайсинг – это точное воссоединение (сшивание) участков, соответствующих экзонам. 33 http: //bio. fizteh. ru/student/files/biology/biolections/lection 25. html
33 http: //bio. fizteh. ru/student/files/biology/biolections/lection 25. html
Альтернативный сплайсинг • обеспечивает кодирование одним геном различных конечных продуктов (структурно и функционально различающихся полипептидов), что определяется спецификой клетки (ткани), то есть, один ген обеспечивает образование изоформ белка, специфичных для различных конкретных тканей; • является эффективным и экономичным способом кодирования множества продуктов ограниченным числом нуклеотидов; • служит одним из механизмов порождения белкового разнообразия у высших эукариот; 34
http: //www. biospsma. spb. ru/SZGMU_SITE/TL_Abstracts_of_l ectures/Structure_and_function_of_the_gene. html
Молекулярная основа наследственности
Молекулярная основа наследственностиМОЛЕКУЛЯРНАЯ ОСНОВА НАСЛЕДСТВИЯ
Поиск генетических
материал привел к ДНК
_ До 1940-х годов большое разнообразие белков
казалось, указывает на то, что белки были генетическим материалом.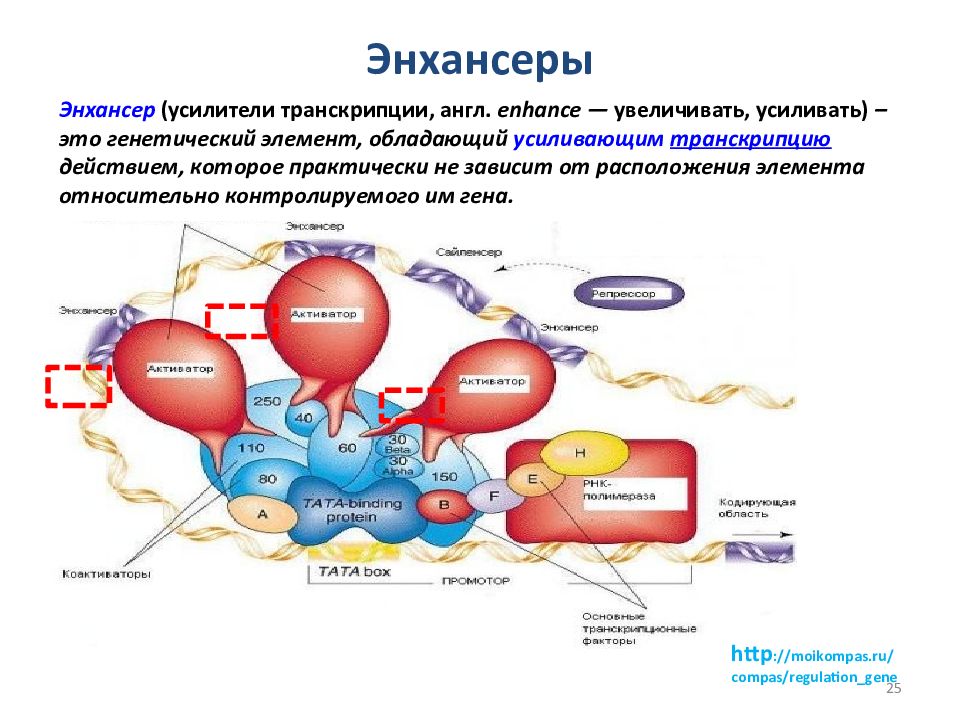
_ Начало открытия генетической роли ДНК
с исследованием Griffith в 1928 году.
_ Он изучил Streptococcus pneumoniae , бактерию
вызывает пневмонию у млекопитающих.Инжир
16.1.
_ Штамм R был безвреден.
_ Штамм S, был патогенен.
_ Гриффит
смешанный убитый нагреванием штамм S с живыми бактериями штамма R и введенный
это в мышь.
_ Мышь умерла, а он восстановил патогенную
штамм из крови мыши.
_ Гриффит назвал это явление трансформацией ,
изменение генотипа и фенотипа в результате ассимиляции
чужеродное вещество (теперь известное как ДНК) клеткой.
_ В 1944 год, Эйвери, Маккарти и Маклауд, после многих лет экспериментов с бактерии, объявили, что трансформирующим веществом является ДНК . Многие все еще были настроены скептически.
_ Далее
доказательства того, что ДНК была генетическим материалом, были получены в результате исследований
которые отслеживали заражение бактерий вирусами.
_ Вирусы состоят из молекул ДНК (иногда
РНК), окруженный защитной оболочкой белка .
_ Для репликации вирус заражает клетку-хозяина и захватывает
над метаболическим механизмом клетки. Кино!
_ Вирусы
которые специально атакуют бактерии, называются бактериофагами
или просто фагов . Инжир
16.2а
_ В
1952, Херши и Чейз показали, что ДНК является генетической
материал фага Т2. Инжир
16.2b
_ К
определить источник генетического материала в фаге Hershey
и Чейз разработали эксперимент, в котором они могли маркировать белок
или ДНК, а затем отследить, которые вошли в E.coli во время
инфекционное заболевание.
_ Они вырастили одну партию фага Т2 в присутствии радиоактивной серы, маркируют белки, но не ДНК.
_ Они вырастили очередную партию в наличие радиоактивного фосфора, маркирующего ДНК, но не белки.
_ Они позволили каждой партии
заражают отдельные культуры E.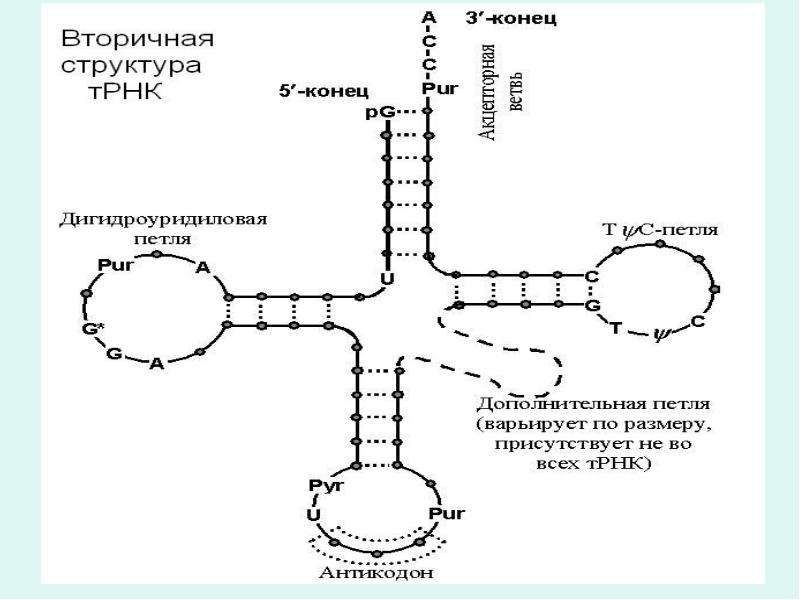 coli .
coli .
_ Раскрутили культивированных зараженных клетки в блендере, стряхивая любые части фага, которые остались вне бактерий.
_ Смеси формовались в центрифуга, которая отделяла более тяжелые бактериальные клетки в осадок из более легких свободных фагов и части фага в жидкости супернатант.
_ Херши и Чейз обнаружили, что когда бактерии были инфицированы фагами Т2, которые содержали радиоактивно меченых белков, большая часть радиоактивности находилась в супернатант, а не в осадке.
_ При исследовании бактериального культуры с фагом Т2, имеющим радиоактивно меченую ДНК, большинство радиоактивность была в осадке с бактериями.
_ Херши и Чейз заключили что инъецированная ДНК фага обеспечивает генетическую информацию что заставляет инфицированные клетки производить новую вирусную ДНК и белки, которые собираются в новые вирусы.
_ Другие доказательства — клетки
удвоить количество ДНК в клетке перед митозом, а затем распределить
ДНК поровну каждой дочерней клетке.
_ В диплоидном наборе хромосом вдвое больше ДНК, чем в гаплоидном.
закладывается в гаметах одного и того же организма.
_ К 1947 году Чаргафф имели разработал ряд правил, основанных на исследовании состава ДНК в организмах.
_ Он уже знал, что ДНК полимер нуклеотидов, состоящий из азотистого основания дезоксирибозы, и фосфатная группа. Инжир 16,3
_ Основания могут быть адениновыми (А), тимин (Т), гуанин (Г) или цитозин (С).
_ Чаргафф отметил, что ДНК состав варьируется от вида к виду.
_ У любого вида четыре основания встречаются в характеристических, но не обязательно равных, отношения.
_ Он тоже нашел закономерность в соотношениях нуклеотидных оснований, которые известны как Чаргаффа правила.
_ Количество аденинов было примерно равно количеству тиминов ( %T = %A ).
_ Количество гуанинов было
примерно равно количеству цитозинов ( %G = %C ).
_ ДНК человека состоит из 30,9 % аденина, 29,4 % тимина, 19,9% гуанина и 19,8% цитозина.
_ Уилкинс и Франклин использовали рентген Кристаллография для изучения структуры ДНК. Инжир 16,4
_ Ватсон
и Crick , основанный на работе Уилкинса и Франклина,
начал работать над моделью ДНК с двумя нитями, двойной спиралью.
Инжир
16.5.
_ Ключевой прорыв произошел, когда Уотсон поставил сахаро-фосфатный
цепь снаружи и азотистые основания внутри
двойная спираль.
_ Цепи сахаро-фосфатные каждой нити подобны боковым канатам веревочной лестницы.
_ Пары азотистых оснований, одна из каждой нити сформируйте перекладины.
_ Лестница образует изгиб каждый десять баз.
_ Азотистые основания в паре в определенных сочетаниях: аденин с тимином и гуанином с цитозином.
_ Спаривание, как у нуклеотидов
не соответствует единому диаметру, указанному данными рентгеновского снимка.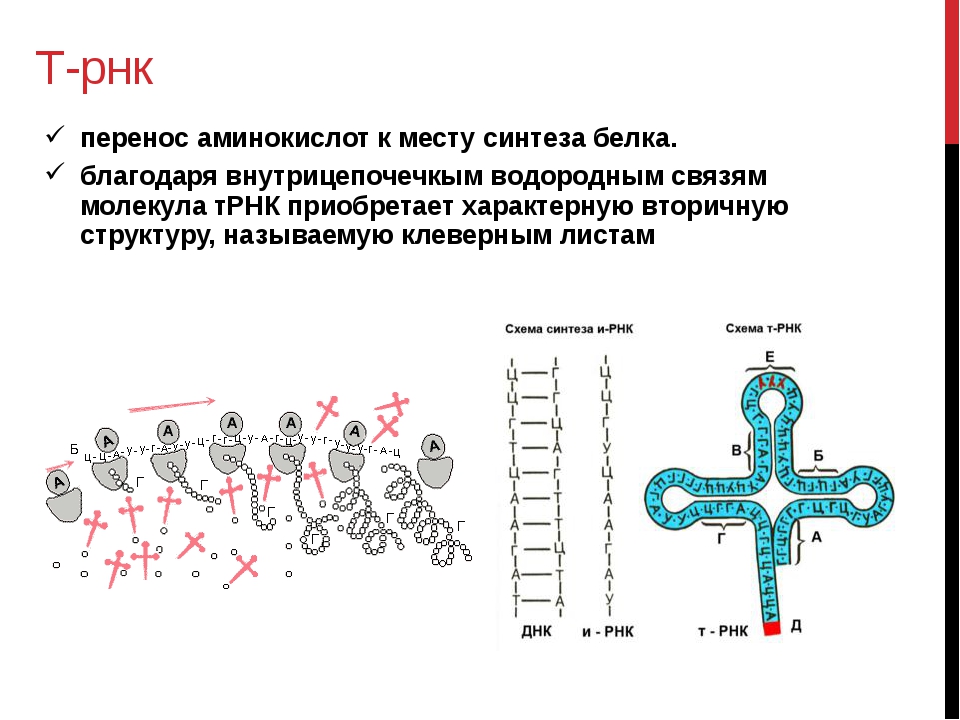
_ Пара пурин-пурин слишком широк, и пара пиримидин-пиримидин была бы слишком короткая.
_ Только пиримидин-пуриновая пара будет давать диаметр 2 нм, указанный рентгеновскими данными.
_ Кроме того, Уотсон и Крик установили, что химические боковые группы азотистых оснований образуют водородные связи, соединяющие две нити. Инжир 16.6.
_ На основании данных их структура, аденин будет образовывать две водородные связи только с тимином а гуанин будет образовывать три водородные связи только с цитозином.
_ Это открытие объяснило правила.
_ Линейная последовательность четыре основания можно варьировать бесчисленным множеством способов.
_ Каждый ген имеет уникальный порядок азотистых оснований.
Репликация ДНК
_ Во второй статье Уотсон и Крик опубликовали свою гипотезу.
для того, как ДНК реплицируется.
- _ Когда клетка копирует ДНК
молекулы, каждая нить служит шаблоном для упорядочения нуклеотидов
в новую комплементарную цепь.
 Инжир
16.7.
Инжир
16.7.
_ Модель Уотсона и Крика, полуконсервативная репликация, предсказывает что при репликации двойной спирали каждая из дочерних молекул будет иметь одну старую нить и одну новую прядь. Инжир 16.8.
_ Другие конкурирующие модели, консервативная модель и дисперсионная также были предложены модели.
_ Эксперименты Мезельсона и Шталя в конце 1950-х годов поддержали полуконсервативная модель, предложенная Уотсоном и Криком. две другие модели.
Большое разнообразие ферментов и другие белки осуществляют репликацию ДНК
- _ Требуется E. coli меньше
чем час, чтобы скопировать каждую из 5 миллионов пар оснований в его
одну хромосому и делятся, образуя две идентичные дочерние клетки.
_ Человеческая клетка может копировать свои 6 миллиардов пар оснований и делиться на дочерние клетки всего за несколько часов, с одной ошибкой на миллиард нуклеотиды.
_ Более дюжины ферментов и
другие белки участвуют в репликации ДНК.
_ Репликация молекулы ДНК начинается на специальных сайтах, ориджинов репликации. Рис 16.10. Кино!
_ В бактерий это единственная специфическая последовательность нуклеотидов , которая распознается с помощью ферментов репликации.
_ Эти ферменты разделяют нити, образующие повторений «пузыря» .
_ Репликация продолжается в обоих направлениях, пока вся молекула не будет скопирована.
_ В эукариот , есть может быть сотен или тысяч сайтов происхождения на хромосому .
_ В местах происхождения ДНК нити расходятся, образуя репликационный «пузырь» с вилок репликации на каждом конце.
_ Пузырьки репликации удлиняются поскольку ДНК реплицируется и в конечном итоге сливается.
_ ДНК-полимеразы катализируют удлинение новой ДНК на репликационной вилке.
_ Нуклеотиды добавляются к
растущий конец новой цепи полимеразой.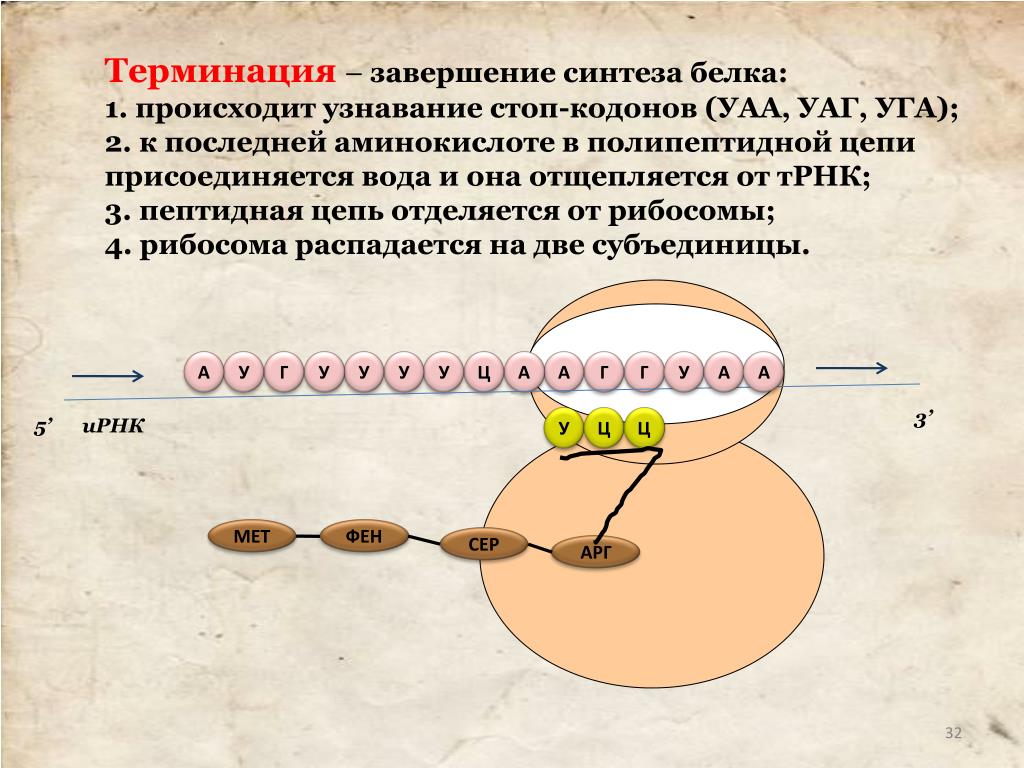
_ Необработанные нуклеотиды представляют собой нуклеозид трифосфаты .
- _ Каждый имеет азотистое основание ,
дезоксирибозу и трифосфатный хвост.
- _ По мере добавления каждого нуклеотида последние две фосфатные группы гидролизуются с образованием пирофосфата .Инжир 16.11.
- _ Экзэргонический гидролиз пирофосфата до двух молекул неорганического фосфата полимеризация нуклеотида в новую цепь.
_ Нити двойной спирали антипараллельны . Инжир 16.12.
- _ Сахаро-фосфатные костяки
бегите в противоположных направлениях.
- _ Каждая цепь ДНК имеет 3′ конец со свободной гидроксильной группой , присоединенной к дезоксирибозе и 5′-конец со свободной фосфатной группой , присоединенной к дезоксирибозе.
- _ ДНК-полимеразы могут только добавить нуклеотиды к свободному 3′-концу растущей цепи ДНК.
 Инжир
16.13.
Инжир
16.13.
- _ Новая цепь ДНК может быть удлиняются в направлении 5′->3′.
- _ На вилке репликации, одна родительская нить (3′-> 5′ в развилке), ведущая цепь , может использоваться полимеразами в качестве матрицы для непрерывного комплементарная нить. Кино!
- _ Другая родительская нить (5′->3′ в развилку) копируется отстающая нить . от развилки короткими отрезками ( фрагментов Окадзаки ).Кино!
- _ Фрагменты Окадзаки, каждый около 100-200 нуклеотидов соединяются ДНК-лигазой с образованием сахарофосфатный остов одной цепи ДНК.
- _ Каждая цепь ДНК имеет 3′ конец со свободной гидроксильной группой , присоединенной к дезоксирибозе и 5′-конец со свободной фосфатной группой , присоединенной к дезоксирибозе.
Для запуска новой цепочки требуется
праймер , короткий сегмент РНК. Инжир
16.14.
- _ Праймер состоит примерно из 10 нуклеотидов
долго у эукариот.
- _ Primase , РНК-полимераза, связывает рибонуклеотиды с праймером.
- _ Еще одна ДНК-полимераза позже заменяет рибонуклеотиды праймера .

- _ Для ведущей пряди требуется образование только одного праймера.
- _ Отстающая прядь требует образование нового праймера по мере развития репликационной вилки.
- _ После формирования грунтовки, ДНК-полимераза может добавлять новые нуклеотиды от разветвления до тех пор, пока он сталкивается с предыдущим фрагментом Окадзаки.
- _ Праймеры преобразованы к ДНК до того, как ДНК-лигаза соединит фрагменты вместе.
- _ Копируется отстающая ветвь от развилки короткими сегментами, каждый из которых требует нового праймера.
- _ Primase , РНК-полимераза, связывает рибонуклеотиды с праймером.
Сводка репликации. Инжир 16.16. Кино!
Основные белки репликации. Инжир 16.15.
Помимо праймазы, ДНК-полимеразы, и ДНК-лигазы, некоторые другие белки играют заметную роль в Синтез ДНК.
- _ A спираль раскручивается
и разделяет нити матричной ДНК на репликационной вилке.
_ Одноцепочечные связывающие белки сохраняют непарную матрицу нити расходятся во время репликации.
ДНК-полимераза корректирует каждого нового нуклеотида по шаблону нуклеотида сразу после его добавления.
- _ При наличии неправильного
спаривания, фермент удаляет неправильный нуклеотид, а затем возобновляет
синтез.
- _ Окончательная частота ошибок составляет всего один на миллиард нуклеотидов.
- _ Молекулы ДНК постоянно подвержены воздействию потенциально вредных химических и физических агентов.
- _ Несовпадающие нуклеотиды, которые пропускаются ДНК-полимеразой или мутациями, которые происходят после ДНК синтез завершен, часто можно восстановить.
- _ Каждая ячейка постоянно контролирует и восстанавливает свой генетический материал с помощью более чем 130 репарационных ферментов выявлены у человека.
- _ В ремонте несоответствия, спец. ферменты исправляют неправильно спаренные нуклеотиды.
- _ наследственный дефект один из этих ферментов связан с формой толстой кишки рак .

- _ Вырезание нуклеотидов ремонт , нуклеаза вырезает сегмент поврежденного прядь. Инжир 16.17.
- _ Пробел заполнен ДНК полимераза и лигаза.
- _ Важность правильного функционирование ферментов репарации ясно из наследственного нарушения пигментная ксеродерма .
- _ У лиц с этим расстройство, мутации в их клетках кожи остаются неисправленными и вызвать рак кожи.
- _ Окончательная частота ошибок составляет всего один на миллиард нуклеотидов.
концов молекул ДНК воспроизводятся специальным механизмом. Инжир 16.18.
- _ Обычный механизм репликации
не дает возможности завершить 5′-концы дочерних цепей ДНК.
- _ Повторяющиеся раунды репликации производят все более и более короткие молекулы ДНК.
- _ Концы эукариотических хромосом Молекулы ДНК, теломер , имеют специальные последовательности нуклеотидов. Инжир 16.19б.
- _ В теломерах человека это последовательность обычно TTAGGG, повторяется между 100 и 1000 раз.

- _ Теломеры защищают гены от разрушается в результате нескольких раундов репликации ДНК, обеспечивая механизм восстановления укороченных теломер.
- _ Теломераза использует короткая молекула РНК в качестве матрицы для удлинения 3′-конца теломер.
- _ Теперь есть место для примаса и ДНК-полимераза для удлинения 5′-конца.
- _ Теломераза присутствует в зародышевые клетки, благодаря чему зигот имеют длинные теломеры.
- _ Активная теломераза также обнаружено в раковых соматических клетках .
- _ Это превосходит прогрессивный сокращение, которое в конечном итоге привело бы к самоуничтожению рака.
- _ Теломераза — это , а не присутствуют в большинстве клеток многоклеточных организмов.
- _ Следовательно, ДНК делящихся соматические клетки и культивируемые клетки имеют тенденцию становиться короче.
- _ Длина теломер мая быть лимитирующим фактором в продолжительности жизни некоторых тканей и организма.

- _ Повторяющиеся раунды репликации производят все более и более короткие молекулы ДНК.
наследственность | Определения и факты
Донаучные концепции наследственности
Наследственность долгое время была одним из самых загадочных и загадочных явлений природы.Это произошло потому, что половые клетки, образующие мост, по которому наследственность должна проходить между поколениями, обычно невидимы невооруженным глазом. Только после изобретения микроскопа в начале 17 века и последующего открытия половых клеток можно было понять основы наследственности. До этого древнегреческий философ и ученый Аристотель (4 век до н.э.) предполагал, что относительный вклад родителей женского и мужского пола был очень неравным; Считалось, что самка обеспечивает то, что он называл «материей», а самец — «движением».«90 424 Института Ману 90 425», составленные в Индии между 100 и 300 годами нашей эры, рассматривают роль женщины как роль поля, а роль мужчины — как роль семени; новые тела формируются «в результате совместной работы семени и поля».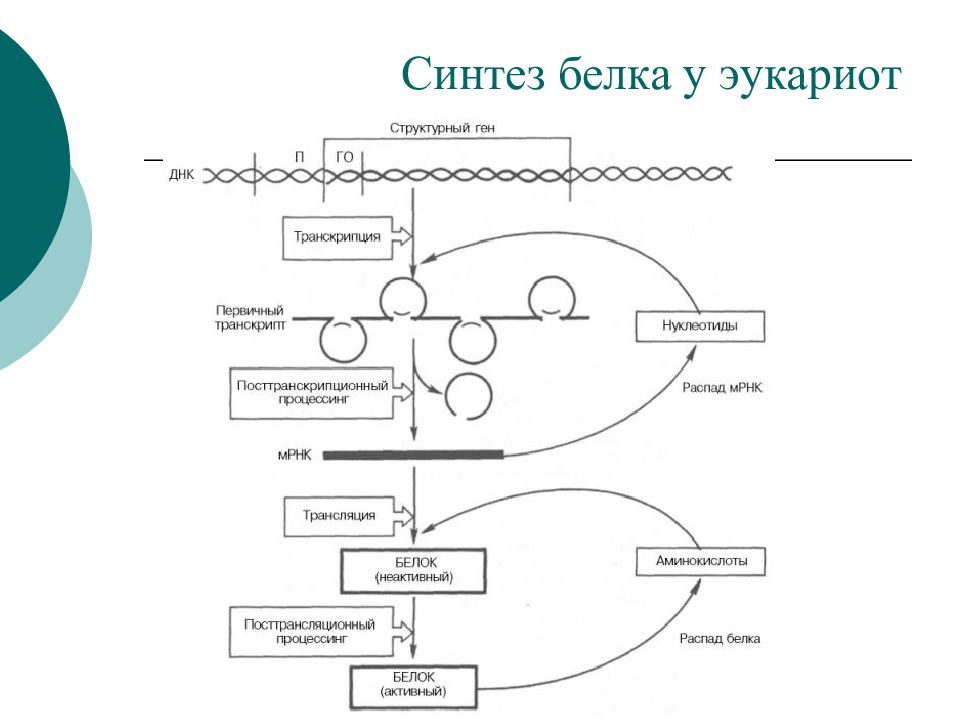 В действительности оба родителя одинаково передают наследственный образец, и в среднем дети похожи на своих матерей не меньше, чем на своих отцов. Тем не менее женские и мужские половые клетки могут сильно различаться по размеру и строению; масса яйцеклетки иногда в миллионы раз превышает массу сперматозоида.
В действительности оба родителя одинаково передают наследственный образец, и в среднем дети похожи на своих матерей не меньше, чем на своих отцов. Тем не менее женские и мужские половые клетки могут сильно различаться по размеру и строению; масса яйцеклетки иногда в миллионы раз превышает массу сперматозоида.
Древние вавилоняне знали, что пыльцу финиковой пальмы мужского пола нужно наносить на пестики женского дерева, чтобы получить плоды. Немецкий ботаник Рудольф Якоб Камерариус показал в 1694 году, что то же самое верно и для кукурузы (кукурузы). Шведский ботаник и исследователь Каролус Линней в 1760 году и немецкий ботаник Йозеф Готлиб Кёльройтер в серии работ, опубликованных с 1761 по 1798 год, описали скрещивания сортов и видов растений. Они обнаружили, что эти гибриды в целом занимали промежуточное положение между родителями, хотя по некоторым характеристикам они могли быть ближе к одному родителю, а по другим — к другому.Кёльрейтер сравнил потомство реципрокных скрещиваний, то есть скрещивания разновидности A , функционирующей как самка, с разновидностью B как самца и, наоборот, разновидности B как самки с A как самца. Гибридное потомство от этих взаимных скрещиваний обычно было одинаковым, что указывает на то, что, вопреки убеждению Аристотеля, наследственность потомства в равной степени происходила от родителей женского и мужского пола. В 1800-х годах было проведено еще много экспериментов с гибридами растений.Эти исследования также показали, что гибриды обычно занимают промежуточное положение между родителями. Между прочим, они записали большинство фактов, которые впоследствии привели Грегора Менделя (, см. ниже ) к формулировке его знаменитых правил и к основанию теории гена. По-видимому, никто из предшественников Менделя не видел значения накапливаемых данных. Общее промежуточное положение гибридов, казалось, лучше всего согласовывалось с верой в то, что наследственность передается от родителей к потомству «по крови», и это убеждение было принято большинством биологов XIX века, включая английского натуралиста Чарльза Дарвина.
Гибридное потомство от этих взаимных скрещиваний обычно было одинаковым, что указывает на то, что, вопреки убеждению Аристотеля, наследственность потомства в равной степени происходила от родителей женского и мужского пола. В 1800-х годах было проведено еще много экспериментов с гибридами растений.Эти исследования также показали, что гибриды обычно занимают промежуточное положение между родителями. Между прочим, они записали большинство фактов, которые впоследствии привели Грегора Менделя (, см. ниже ) к формулировке его знаменитых правил и к основанию теории гена. По-видимому, никто из предшественников Менделя не видел значения накапливаемых данных. Общее промежуточное положение гибридов, казалось, лучше всего согласовывалось с верой в то, что наследственность передается от родителей к потомству «по крови», и это убеждение было принято большинством биологов XIX века, включая английского натуралиста Чарльза Дарвина.
Теория наследственности крови, если это понятие можно удостоить таким названием, на самом деле является частью фольклора, предшествовавшего научной биологии.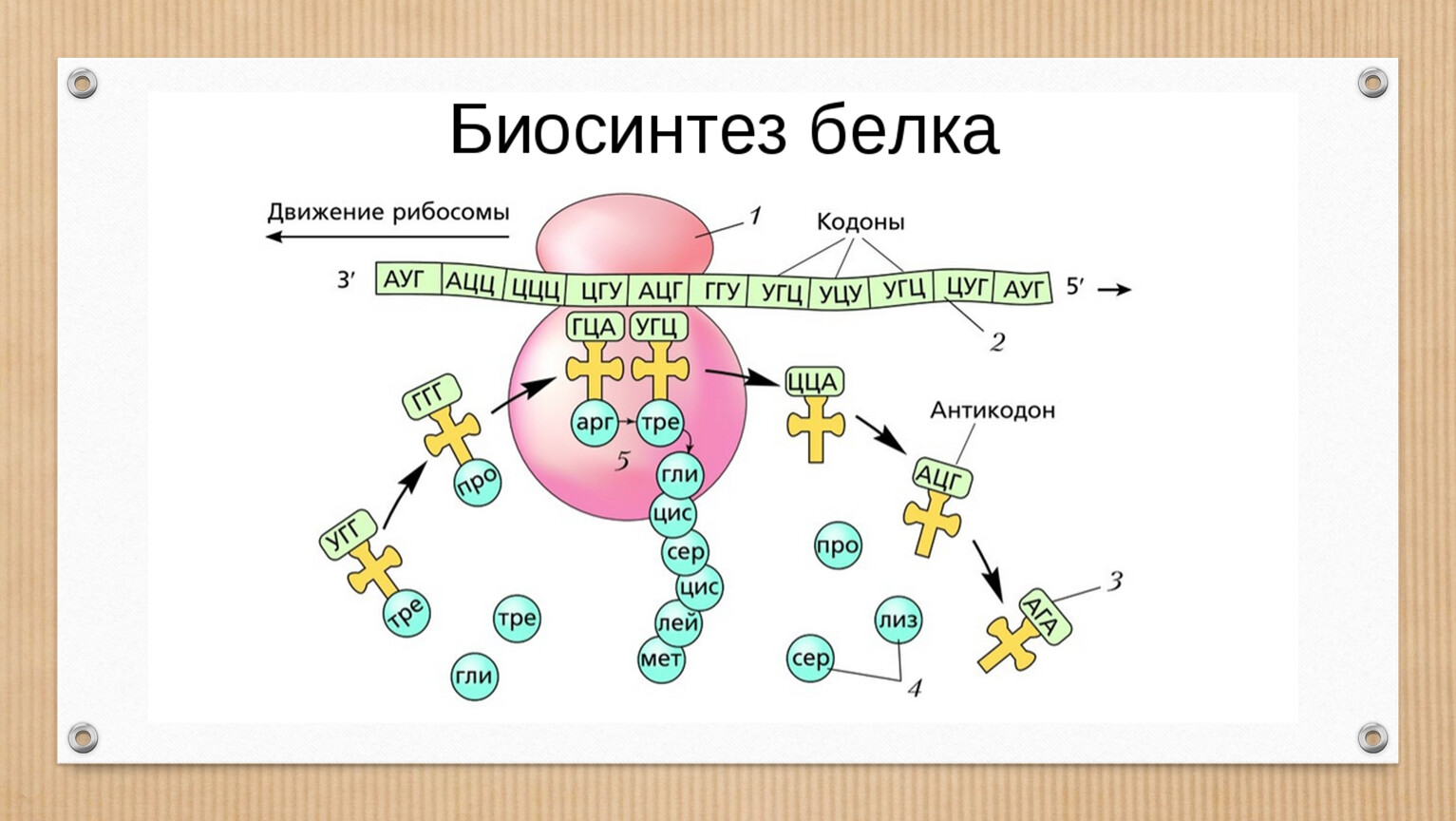 Это подразумевается в таких популярных фразах, как «полукровка», «новая кровь» и «голубая кровь». Это не означает, что наследственность действительно передается через красную жидкость в кровеносных сосудах; существенным моментом является вера в то, что родитель передает каждому ребенку все его характеристики и что наследственный дар ребенка представляет собой сплав, смесь дарований его родителей, бабушек и дедушек и более отдаленных предков.Эта идея нравится тем, кто гордится тем, что имеет благородную или выдающуюся «кровную» линию. Однако возникает загвоздка, когда замечают, что у ребенка есть некоторые характеристики, которых нет ни у одного из родителей, но они присутствуют у некоторых других родственников или присутствовали у более отдаленных предков. Еще чаще видно, что братья и сестры хотя и обнаруживают фамильное сходство в одних чертах, но в других явно различаются. Как одни и те же родители могли передать разную «кровь» каждому из своих детей?
Это подразумевается в таких популярных фразах, как «полукровка», «новая кровь» и «голубая кровь». Это не означает, что наследственность действительно передается через красную жидкость в кровеносных сосудах; существенным моментом является вера в то, что родитель передает каждому ребенку все его характеристики и что наследственный дар ребенка представляет собой сплав, смесь дарований его родителей, бабушек и дедушек и более отдаленных предков.Эта идея нравится тем, кто гордится тем, что имеет благородную или выдающуюся «кровную» линию. Однако возникает загвоздка, когда замечают, что у ребенка есть некоторые характеристики, которых нет ни у одного из родителей, но они присутствуют у некоторых других родственников или присутствовали у более отдаленных предков. Еще чаще видно, что братья и сестры хотя и обнаруживают фамильное сходство в одних чертах, но в других явно различаются. Как одни и те же родители могли передать разную «кровь» каждому из своих детей?
Мендель опроверг теорию крови.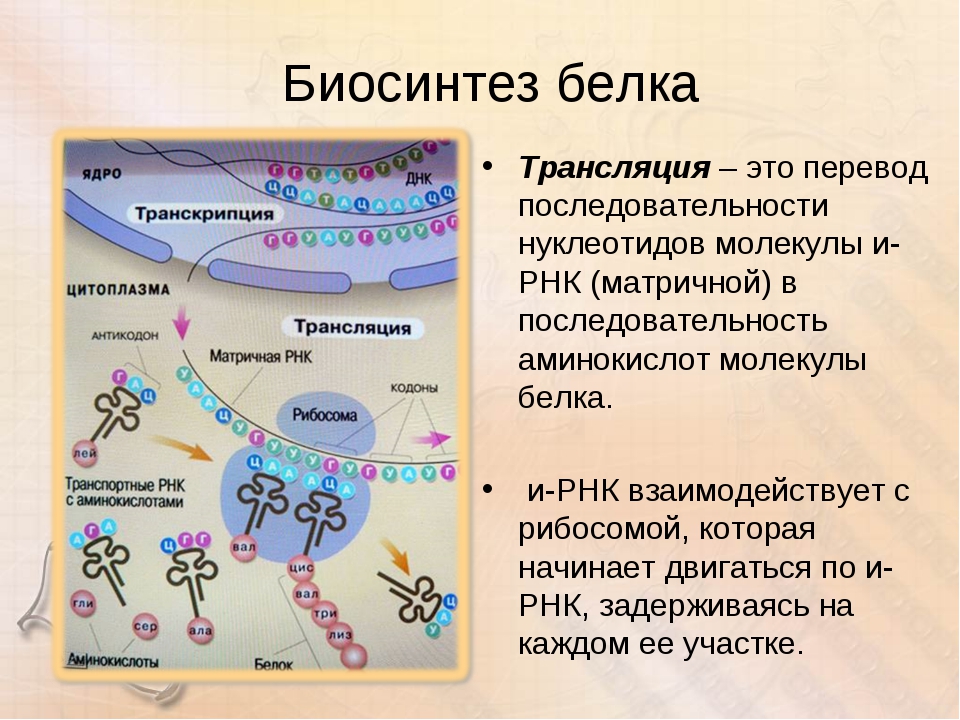 Он показал, (1) что наследственность передается через факторы (теперь называемые генами), которые не смешиваются, а разделяются, (2) что родители передают каждому ребенку только половину имеющихся у них генов и передают разные наборы генов детям. разные дети, и (3) что, хотя братья и сестры получают свою наследственность от одних и тех же родителей, они не получают одну и ту же наследственность (исключение составляют однояйцевые близнецы). Таким образом, Мендель показал, что, даже если бы возвышение какого-либо предка было целиком отражением его генов, весьма вероятно, что некоторые из его потомков, особенно более отдаленные, вообще не унаследовали бы эти «хорошие» гены.У организмов, размножающихся половым путем, включая человека, каждый индивидуум обладает уникальной наследственной одаренностью.
Он показал, (1) что наследственность передается через факторы (теперь называемые генами), которые не смешиваются, а разделяются, (2) что родители передают каждому ребенку только половину имеющихся у них генов и передают разные наборы генов детям. разные дети, и (3) что, хотя братья и сестры получают свою наследственность от одних и тех же родителей, они не получают одну и ту же наследственность (исключение составляют однояйцевые близнецы). Таким образом, Мендель показал, что, даже если бы возвышение какого-либо предка было целиком отражением его генов, весьма вероятно, что некоторые из его потомков, особенно более отдаленные, вообще не унаследовали бы эти «хорошие» гены.У организмов, размножающихся половым путем, включая человека, каждый индивидуум обладает уникальной наследственной одаренностью.
Ламаркизм — школа мысли, названная в честь пионера XIX века, французского биолога и эволюциониста Жана-Батиста де Моне, шевалье де Ламарка, — предполагала, что черты, приобретенные в течение жизни человека, наследуются его потомством, или, говоря современным языком, , что изменения, внесенные средой в фенотип, отражаются в аналогичных изменениях в генотипе. Если бы это было так, то результаты физических упражнений сделали бы физические упражнения гораздо более легкими или даже ненужными для потомства человека. Не только Ламарк, но и другие биологи XIX века, в том числе Дарвин, признавали наследование приобретенных признаков. Его поставил под сомнение немецкий биолог Август Вейсман, чьи знаменитые эксперименты конца 1890-х годов по ампутации хвостов у поколений мышей показали, что такая модификация не приводит ни к исчезновению, ни даже к укорочению хвостов у потомков.Вейсман пришел к выводу, что наследственный дар организма, который он назвал зародышевой плазмой, совершенно обособлен и защищен от влияний, исходящих от остального тела, называемого соматоплазмой или сомой. Понятия зародышевая плазма–соматоплазма связаны с понятиями генотип–фенотип, но они не тождественны, и их не следует смешивать с ними.
Если бы это было так, то результаты физических упражнений сделали бы физические упражнения гораздо более легкими или даже ненужными для потомства человека. Не только Ламарк, но и другие биологи XIX века, в том числе Дарвин, признавали наследование приобретенных признаков. Его поставил под сомнение немецкий биолог Август Вейсман, чьи знаменитые эксперименты конца 1890-х годов по ампутации хвостов у поколений мышей показали, что такая модификация не приводит ни к исчезновению, ни даже к укорочению хвостов у потомков.Вейсман пришел к выводу, что наследственный дар организма, который он назвал зародышевой плазмой, совершенно обособлен и защищен от влияний, исходящих от остального тела, называемого соматоплазмой или сомой. Понятия зародышевая плазма–соматоплазма связаны с понятиями генотип–фенотип, но они не тождественны, и их не следует смешивать с ними.
Ненаследуемость приобретенных признаков не означает, что гены не могут быть изменены влиянием среды; Рентгеновские лучи и другие мутагены, безусловно, изменяют их, а генотип популяции может быть изменен отбором. Это просто означает, что то, что приобретено родителями в их телосложении и интеллекте, не наследуется их детьми. С этими неправильными представлениями связаны убеждения в «препотентности» — т. е. в то, что некоторые особи передают свою наследственность своим потомкам более эффективно, чем другие, — и в «пренатальные влияния» или «материнские впечатления», т. е. в то, что события, переживаемые беременной самкой, отражаются в конституции будущего ребенка. Насколько древними являются эти верования, показано в Книге Бытия, в которой Иаков производит пятнистое или полосатое потомство овец и коз, показывая стадам полосатые прутья, пока животные размножаются.Другая такая вера — «телегония», восходящая к Аристотелю; в нем утверждалось, что на наследственность человека влияет не только его отец, но и самцы, с которыми женщина могла спариваться и которые вызвали предыдущие беременности. Даже Дарвин еще в 1868 г. серьезно обсуждал предполагаемый случай телегонии: случай, когда кобыла спарилась с зеброй, а затем с арабским жеребцом, от которого кобыла произвела на свет жеребенка со слабыми полосами на ногах.
Это просто означает, что то, что приобретено родителями в их телосложении и интеллекте, не наследуется их детьми. С этими неправильными представлениями связаны убеждения в «препотентности» — т. е. в то, что некоторые особи передают свою наследственность своим потомкам более эффективно, чем другие, — и в «пренатальные влияния» или «материнские впечатления», т. е. в то, что события, переживаемые беременной самкой, отражаются в конституции будущего ребенка. Насколько древними являются эти верования, показано в Книге Бытия, в которой Иаков производит пятнистое или полосатое потомство овец и коз, показывая стадам полосатые прутья, пока животные размножаются.Другая такая вера — «телегония», восходящая к Аристотелю; в нем утверждалось, что на наследственность человека влияет не только его отец, но и самцы, с которыми женщина могла спариваться и которые вызвали предыдущие беременности. Даже Дарвин еще в 1868 г. серьезно обсуждал предполагаемый случай телегонии: случай, когда кобыла спарилась с зеброй, а затем с арабским жеребцом, от которого кобыла произвела на свет жеребенка со слабыми полосами на ногах. Простое объяснение этого результата состоит в том, что такие полосы естественным образом встречаются у некоторых пород лошадей.
Простое объяснение этого результата состоит в том, что такие полосы естественным образом встречаются у некоторых пород лошадей.
Все эти верования, от наследования приобретенных черт до телегонии, теперь должны быть причислены к суевериям. Они не выдерживают экспериментального исследования и несовместимы с тем, что известно о механизмах наследственности и о замечательных и предсказуемых свойствах генетического материала. Тем не менее, некоторые люди все еще цепляются за эти убеждения. Некоторые животноводы серьезно относятся к телегонии и не считают чистокровными особей, чьи родители, по общему признанию, «чистокровны», но чьи матери скрещивались с самцами других пород.Советский биолог и агроном Трофим Денисович Лысенко смог почти за четверть века, примерно между 1938 и 1963 годами, сделать свою особую разновидность ламаркизма официальным кредо в Советском Союзе и запретить большую часть преподавания и исследований в области ортодоксальной генетики. . Он и его сторонники опубликовали сотни статей и книг, якобы подтверждающих их утверждения, фактически отрицающие достижения биологии как минимум за предшествующее столетие. Официально лысенковцы были дискредитированы в 1964 году.
Официально лысенковцы были дискредитированы в 1964 году.
Синтез белка — Основные понятия генетики — Геном Квебек Образование и образование
Синтез белка — Основные понятия генетики — Геном Квебек Образование и образованиеВерхОт ДНК к белку — 3D , вашгеном.org, Wellcome Genome Campus (Великобритания) — 2:42 мин.
Белки — это большие молекулы, которые могут выполнять множество различных функций. Они могут способствовать химическим реакциям (например, ферменты), обеспечивать структурную поддержку (например, цитоскелет), передавать сигналы с поверхности клетки (например, мембранные рецепторы) и многое другое.
 Но откуда они?
Но откуда они? Гены в нашей ДНК похожи на рецепты, используемые для производства белков. Но поскольку рецепты закодированы с помощью азотистых оснований (ATCG), их необходимо сначала перевести.Многие белки работают вместе над этой задачей трансляции. Нити двойной спирали ДНК должны сначала разойтись, чтобы можно было получить доступ к гену-мишени. Затем белки производят идентичную копию целевой последовательности ДНК: информационную РНК.
Эта копия рецепта, теперь расшифрованная как мессенджер РНК, затем отправляется за пределы клеточного ядра, поскольку белки производятся в другом месте клетки. Оттуда рибосомы, маленькие частицы, присутствующие в большом количестве вокруг ядра, будут служить поварами, читая рецепт приготовления белка.Аминокислоты являются основными ингредиентами, которые входят в рецепт белка, и рибосомы используют план, предоставленный матричной РНК, чтобы расположить аминокислоты в правильном порядке и сформировать длинную цепь. Аминокислоты представляют собой органические молекулы, содержащие амин, химическое соединение, полученное из аммиака.
 Химикам известны сотни аминокислот, но только 20 из них образуют белки. Но белки в этой линейной форме еще не готовы. Чтобы функционировать, он должен складываться в стиле оригами. Это когда он превращается из одиночной цепи в сложную трехмерную структуру.
Химикам известны сотни аминокислот, но только 20 из них образуют белки. Но белки в этой линейной форме еще не готовы. Чтобы функционировать, он должен складываться в стиле оригами. Это когда он превращается из одиночной цепи в сложную трехмерную структуру.
Бонусный материал
РНК (рибонуклеиновая кислота) практически идентична ДНК (дезоксирибонуклеиновая кислота). Его структура аналогична на химическом уровне, но менее стабильна. В то время как ДНК имеет форму скрученной лестницы, образованной двумя комплементарными половинками, РНК чаще всего состоит из одной нити. Он выглядит как лестница, разрезанная пополам сверху донизу. Как и ДНК, РНК состоит из четырех типов азотистых оснований, которые выстраиваются в очень специфической последовательности.В ДНК такими основаниями являются аденин (А), тимин (Т), цитозин (С) и гуанин (Г). Но в РНК тимин заменен урацилом (U), который также способен образовывать пары с аденином (A). Но почему мы не находим урацил в ДНК? Это делается для того, чтобы облегчить восстановление ДНК при возникновении мутации.
Откройте для себя все основные понятия генетики:
Генетические регуляторные механизмы в синтезе белков
Здесь мы рассматриваем принцип трафарета для минерализации внеклеточного матрикса, который описывает процесс с двойным отрицанием (ингибирование ингибиторов), который способствует минерализации в костях и других минерализованных тканях, в то время как состояние по умолчанию ингибирование само по себе предотвращает минерализацию в других местах мягких соединительных тканей.Принцип трафарета действует на нескольких уровнях: от макромасштаба (скелет/зубной ряд 90 424 против 90 425 мягких соединительных тканей) до микромасштаба (например, энтезы и комплекс прикрепления зубов, где мягкая периодонтальная связка расположена между минерализованным цементом зуба и минерализованным альвеолярным отростком). кость) и до мезомасштаба (минеральная мозаика). Он относится как к низкомолекулярным ( например, пирофосфат) и белковым ( например остеопонтин) ингибиторам минерализации, так и к промоторам (ферменты, например, e.г. TNAP, PHEX), которые разлагают ингибиторы, позволяя и регулируя минерализацию. В этом процессе возникает организационный мотив для костного минерала, который мы называем кросс-фибриллярной минеральной мозаикой , где минеральные образования, называемые мозаиками, , геометрически аппроксимируют вытянутые эллипсоиды и пересекают множественные коллагеновые фибриллы (латерально). Рост тесселей обусловлен структурной анизотропией коллагена, который пространственно ограничен более короткими поперечными размерами тесселей (в среднем 1.6 × 0,8 × 0,8 мкм, соотношение сторон 2, диапазон длин 1,5–2,5 мкм). Временно-пространственно тесселлы упираются в 3D (плотная эллипсоидная упаковка), чтобы заполнить объем внеклеточного матрикса пластинчатой кости.
кость) и до мезомасштаба (минеральная мозаика). Он относится как к низкомолекулярным ( например, пирофосфат) и белковым ( например остеопонтин) ингибиторам минерализации, так и к промоторам (ферменты, например, e.г. TNAP, PHEX), которые разлагают ингибиторы, позволяя и регулируя минерализацию. В этом процессе возникает организационный мотив для костного минерала, который мы называем кросс-фибриллярной минеральной мозаикой , где минеральные образования, называемые мозаиками, , геометрически аппроксимируют вытянутые эллипсоиды и пересекают множественные коллагеновые фибриллы (латерально). Рост тесселей обусловлен структурной анизотропией коллагена, который пространственно ограничен более короткими поперечными размерами тесселей (в среднем 1.6 × 0,8 × 0,8 мкм, соотношение сторон 2, диапазон длин 1,5–2,5 мкм). Временно-пространственно тесселлы упираются в 3D (плотная эллипсоидная упаковка), чтобы заполнить объем внеклеточного матрикса пластинчатой кости.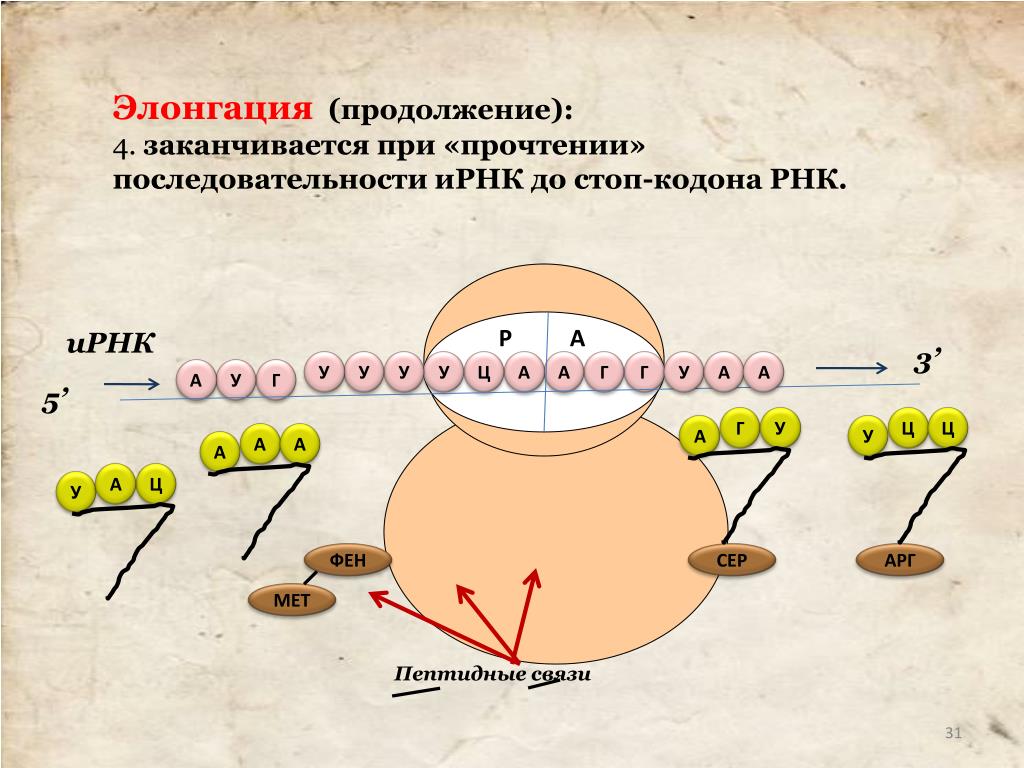 Слабоминерализованные межфазные промежутки между соседними тесселями остаются различимыми даже в зрелой пластинчатой кости. Мозаика одного и того же небольшого базового блока для формирования более крупных структурных узлов приводит к многочисленным трехмерным интерфейсам, позволяет рассеивать критические напряжения и обеспечивает безотказную циклическую деформацию. Неполная мозаика при остеомаляции/одонтомаляции может объяснить, почему мягкие кости с остеомаляцией изгибаются и деформируются под нагрузкой.
Слабоминерализованные межфазные промежутки между соседними тесселями остаются различимыми даже в зрелой пластинчатой кости. Мозаика одного и того же небольшого базового блока для формирования более крупных структурных узлов приводит к многочисленным трехмерным интерфейсам, позволяет рассеивать критические напряжения и обеспечивает безотказную циклическую деформацию. Неполная мозаика при остеомаляции/одонтомаляции может объяснить, почему мягкие кости с остеомаляцией изгибаются и деформируются под нагрузкой.
Генетическая информация и синтез белка
ДНК несет гены, кодирующие белки
Генетический код
Гены представляют собой последовательности нуклеотидов ДНК, которые несут и передают информацию, определяющую аминокислотные последовательности для синтеза белка. Каждая молекула ДНК содержит множество генов. Геном в совокупности относится ко всей генетической информации, закодированной в клетке. За исключением репродуктивных клеток, все клетки человека содержат 46 молекул ДНК в каждом клеточном ядре.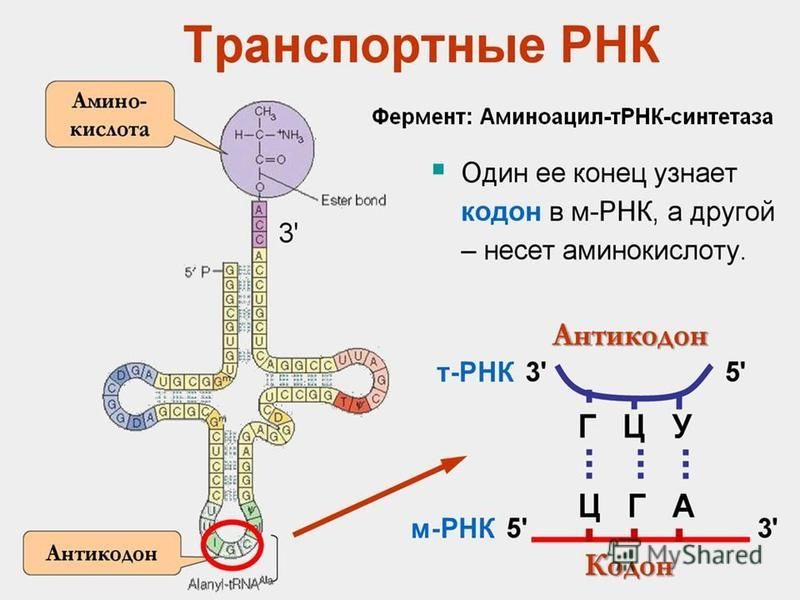 Каждая молекула ДНК соответствует хромосоме. Каждая хромосома упакована белками, называемыми гистонами. Комплекс хромосом и гистонов называют нуклеосомами.
Каждая молекула ДНК соответствует хромосоме. Каждая хромосома упакована белками, называемыми гистонами. Комплекс хромосом и гистонов называют нуклеосомами.
Молекулы РНК отвечают за передачу информации от ДНК к месту синтеза белка. Сами молекулы РНК синтезируются в соответствии с информацией, закодированной в ДНК.
транскрипция трансляция
ДНК -> мРНК -> белок
Напомним, что нуклеотиды ДНК состоят из длинных цепочек оснований.Триплетный код представляет собой последовательность из трех оснований на одной цепи ДНК. Каждый триплетный код «читается» и требует определенной аминокислоты. Напомним, что в ДНК есть 4 основания (гуанин, аденин, цитозин, тимин) и 20 аминокислот, которые связаны друг с другом в различном порядке, образуя различные белки. 4 основания могут быть организованы в 64 различных триплетных кода (последовательность из трех оснований). Шестьдесят один (61) код соответствует одной из 20 аминокислот, данная аминокислота может быть указана более чем одним триплетным кодом, в то время как оставшиеся три триплетных кода действуют как стоп-сигналы и скорее заканчивают белковую цепь. чем добавление аминокислоты.По мере считывания триплетных кодов к растущей цепи добавляется соответствующая аминокислота, и конечным результатом является белок, определяемый информацией ДНК. Генетический код универсален во всех клетках.
чем добавление аминокислоты.По мере считывания триплетных кодов к растущей цепи добавляется соответствующая аминокислота, и конечным результатом является белок, определяемый информацией ДНК. Генетический код универсален во всех клетках.
Синтез белка
Транскрипция: синтез мРНК
Первым делом в синтезе белка является распутывание двойной спирали ДНК и разделение двух нитей нуклеотидов. Одна из нитей будет служить матрицей и будет определять последовательность нуклеотидов РНК.Нить матрицы определяется наличием определенной последовательности нуклеотидов ДНК, называемой промотором. Последовательность расположена ближе к началу гена. РНК-полимераза — это фермент, который соединяет выровненные рибонуклеотиды в цепь. Когда триплетные коды достигают стоп-последовательности или стоп-сигнала, РНК-полимераза заканчивает цепь и затем высвобождает РНК-транскрипт. В качестве последнего штриха к концу транскрибируемой цепи РНК добавляется серия адениновых нуклеотидов, называемая поли-А-хвостом . Хвост жизненно важен, поскольку он дает сигнал, необходимый для того, чтобы позволить РНК выйти из ядра, а затем соединиться с рибосомами в цитоплазме, где из закодированной информации будут синтезироваться белки.
Хвост жизненно важен, поскольку он дает сигнал, необходимый для того, чтобы позволить РНК выйти из ядра, а затем соединиться с рибосомами в цитоплазме, где из закодированной информации будут синтезироваться белки.
В ДНК последовательности из трех оснований называются триплетными кодами, а в РНК последовательности из трех оснований, определяющие одну аминокислоту, называются кодонами. Следовательно, триплетные коды и кодоны аналогичны по функциям. Вся последовательность нуклеотидов во всей цепи матрицы транскрибируется в первичный транскрипт РНК.Только определенные сегменты этого гена на самом деле кодируют аминокислоты. Сегменты называются экзонами, а некодирующие сегменты между экзонами называются интронами. Интроны отделяются от гена сплайсосомой, образуя непрерывную последовательность экзонов; последовательность теперь называется мРНК.
Трансляция: синтез полипептидов
После удаления интронов мРНК выходит в цитоплазму через ядерные поры и связывается с рибосомой. Каждая рибосома состоит из белков и класса РНК, называемого рибосомной РНК (рРНК), которая представляет собой цепь, транскрибируемую с ДНК в ядрышке.
Каждая рибосома состоит из белков и класса РНК, называемого рибосомной РНК (рРНК), которая представляет собой цепь, транскрибируемую с ДНК в ядрышке.
Транспортная РНК (тРНК) является связующим звеном между аминокислотой и ее кодоном мРНК, поскольку молекула тРНК в форме листьев клевера может соединяться с обоими. Транспортная РНК синтезируется в ядре до того, как она выйдет в цитоплазму. Фермент, называемый аминоацил-тРНК-синтетазой (их 20, специфичных для каждой аминокислоты), связывает определенные аминокислоты с молекулами тРНК. Затем молекула тРНК и аминокислота спариваются с мРНК с последовательностью из трех оснований, называемой антикодоном. Антикодон определяет аминокислоту.
Сборка белка представляет собой трехстадийный процесс:
- Инициация полипептидной цепи начинается со связывания антикодона в комплексе аминокислота-тРНК с соответствующим кодоном в комплексе мРНК-рибосома. Это начальное связывание управляется ферментами, называемыми факторами инициации; активность этих ферментативных факторов регулирует скорость синтеза белка.
 Фаза инициации — самая медленная из трех фаз в процессе сборки.
Фаза инициации — самая медленная из трех фаз в процессе сборки. - Удлинение полипептидной цепи – вторая фаза.Каждая аминокислота, вводимая в цепь на молекуле тРНК, связана пептидной связью с концом растущей белковой цепи; свободная тРНК затем высвобождается из рибосомы и присоединяется к другой аминокислоте.
- Рибосома действует как «считыватель», и когда она достигает терминирующей последовательности в мРНК, связь между полипептидной цепью и тРНК разрывается. Готовый белок затем высвобождается из рибосомы, и рибосома становится доступной для следующей нити мРНК, исходящей из ядра.
Когда небольшой белок выходит из рибосомы, он подвергается сворачиванию. Более крупные белки будут складываться в углублении небольшой полой белковой камеры, называемой шаперонами. Если что-то должно быть добавлено к белковой цепи, например производные углеводов или липидов, это происходит в месте шаперона. В конце концов, молекулы мРНК расщепляются на нуклеотиды цитоплазматическими ферментами.
Митохондриальная ДНК не имеет интронов. Каждая митохондрия имеет полный набор механизмов для производства собственных белков, остальное обеспечивает ядерная ДНК.
Регуляция синтеза белка
Сигналы внутри или снаружи клетки могут включать или выключать транскрипцию генов. Эта регуляция осуществляется посредством аллостерической или ковалентной модуляции класса ферментов, называемых факторами транскрипции. Преинициаторный комплекс в промоторной области формирует эти факторы и активирует или репрессирует процесс инициации (такой как разделение нитей ДНК, активация РНК-полимеразы).
Белковая секреция
Белки, секретируемые клеткой, имеют сигнальную последовательность, которая связывается со специфическим мембранным белком на поверхности гранулярного эндоплазматического ретикулума и направляется в его просвет, внутри которого сигнальная последовательность удаляется, а углеводные группы присоединены (почти все секретируемые белки являются гликопротеинами). Части ретикулума отпочковываются, образуя пузырьки, содержащие белки. Везикулы мигрируют в аппарат Гольджи и сливаются с мембраной Гольджи. В Golgi группы могут быть добавлены или удалены в соответствии с конечным назначением белков. Затем белки упаковываются в везикулы, которые отпочковываются от поверхности мембраны Гольджи и перемещаются к плазматической мембране, где они сливаются и высвобождают свое содержимое во внеклеточную жидкость посредством процесса, называемого экзоцитозом.
Части ретикулума отпочковываются, образуя пузырьки, содержащие белки. Везикулы мигрируют в аппарат Гольджи и сливаются с мембраной Гольджи. В Golgi группы могут быть добавлены или удалены в соответствии с конечным назначением белков. Затем белки упаковываются в везикулы, которые отпочковываются от поверхности мембраны Гольджи и перемещаются к плазматической мембране, где они сливаются и высвобождают свое содержимое во внеклеточную жидкость посредством процесса, называемого экзоцитозом.
Репликация и экспрессия генетической информации
Каждая клетка имеет 44 аутосомы, хромосомы, содержащие гены, продуцирующие белки, определяющие структуру и функции клетки, и 2 половые хромосомы, содержащие гены, определяющие пол.Каждый родитель вносит половину этих (22) аутосом и (1) половых хромосом. Каждая пара аутосом имеет гомологичные гены, кодирующие один и тот же белок.
Каждый раз, когда клетка делится, все 46 хромосом, каждая из которых соответствует молекуле ДНК, должны быть реплицированы, и идентичные копии должны быть переданы каждой из новых дочерних клеток. Следовательно, все клетки (кроме сперматозоидов и яйцеклеток) имеют одинаковый набор ДНК (и, следовательно, генов). Что отличает одну клетку от другой, так это дифференциальная экспрессия различных наборов генов.
Следовательно, все клетки (кроме сперматозоидов и яйцеклеток) имеют одинаковый набор ДНК (и, следовательно, генов). Что отличает одну клетку от другой, так это дифференциальная экспрессия различных наборов генов.
Репликация ДНК
ДНК — единственная молекула в клетке, способная воспроизводить себя без получения информации от какого-либо другого компонента клетки. Во время репликации две нити двойной спирали расходятся, и каждая открытая нить действует как матрица, к которой присоединяются свободные дезоксирибонуклеотидтрифосфаты. Затем фермент ДНК-полимераза связывает свободные нуклеотиды, образуя цепь, комплементарную каждой цепи матрицы, образуя две идентичные молекулы ДНК.
Ферменты, способствующие репликации, прикрепляются к ДНК непосредственно перед местом разделения нитей.Чтобы ферменты находили место для закрепления, когда процесс репликации достигает терминального сегмента молекулы ДНК, фермент, называемый теломеразой, добавляет повторяющуюся последовательность, называемую теломерой , на конце молекулы ДНК.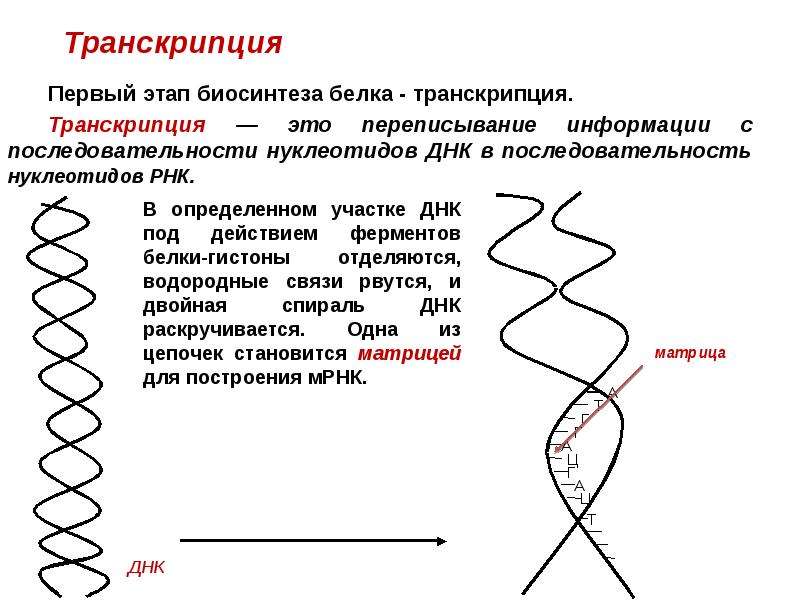 В отсутствие теломеразы каждая репликация приводит к укорочению молекулы ДНК. Любая ошибка в базовой последовательности во время репликации исправляется с помощью механизма, называемого корректурой.
В отсутствие теломеразы каждая репликация приводит к укорочению молекулы ДНК. Любая ошибка в базовой последовательности во время репликации исправляется с помощью механизма, называемого корректурой.
Деление клетки и клеточный цикл
Период между концом одного деления и началом следующего называется интерфазой .Клетка проводит большую часть своего времени в интерфазе, которую можно разделить на:
- G1 (Пробел 1) : Период от конца одного деления до S фазы.
- S (Синтез) : Период, когда репликация ДНК происходит после фазы G1.
- G2 (Пробел 2) : Короткий интервал между окончанием S-фазы и фактическим делением клетки.
М-фаза — собственно клеточное деление, состоящее из ядерного деления, митоза и цитоплазматического деления, цитокинеза .
Двумя критическими контрольными точками, контролирующими ход клеточного цикла, являются границы GI – S и G2 – M.
Некоторые клетки, например, стволовые клетки, делятся непрерывно и непрерывно проходят через последовательные клеточные циклы, в то время как некоторые клетки, например нервные клетки, редко делятся и проводят большую часть своего времени в фазе, называемой G0, которая представляет собой остановленную G1 без входа в фаза С. Go может быть временной фазой, и клетка может повторно войти в активный клеточный цикл после получения подходящих сигналов от белков, называемых факторами роста, которые контролируют синтез ферментов, киназ цикла клеточного деления (киназы cdc) и циклинов.
В результате репликации молекулы ДНК образуются две идентичные цепи, называемые сестринскими хроматидами; соединяются вместе в точке, называемой центромерой. Непосредственно перед клеточным делением имеется 46 хромосом, каждая из которых состоит из двух хроматид. Ядерная оболочка разрывается, центромеры хромосом сцепляются с нитями веретена, состоящими из микротрубочек, выходящих из центросомы. 2 центриоли центросомы делятся, и пара перемещается в противоположные стороны клетки.
Сестринские хроматиды расходятся на центромере и движутся к противоположным центриолям.Цитокинез окончательно делит клетку на две части. Волокна веретена распадаются, вновь появляется ядерная мембрана и раскручиваются хроматиды.
Мутация
Любое изменение последовательности нуклеотидов ДНК, вызванное факторами, называемыми мутагенами, которые разрывают химические связи в ДНК и приводят к потере или включению сегментов. Это также происходит естественным образом из-за ошибок во время репликации.
Типы мутаций:
- Точечная мутация – Одно основание заменяется другим.Может изменить или не изменить аминокислотную последовательность из-за избыточности генетического кода.
- Добавление/удаление – Добавляются или удаляются целые участки ДНК, что приводит к неправильному прочтению кода или потере набора генов.
Мутация может не иметь никакого эффекта, если:
- Мутация происходит в сегменте интрона
- Измененная аминокислота не влияет на структуру и функцию полипептида
- Гомологичный ген не поврежден и способен продуцировать интактный белок
- Аминокислота может быть получена из внешних источников.
Мутация в сперматозоиде или яйцеклетке не влияет на человека, но влияет на потомство.
Мутации могут способствовать внесению вариаций, некоторые из которых могут быть лучше с точки зрения конкуренции.
Механизмы восстановления ДНК
В клетках имеется ряд ферментативных механизмов, которые могут восстанавливать одну измененную цепь ДНК на основе матрицы, обеспечиваемой неповрежденной цепью.
Генофонд
Аллели представляют собой варианты одного и того же гена. От каждого родителя передается по одному аллелю каждого гена.Если оба аллеля идентичны, индивидуум гомозиготен по этому гену, если два различны, индивидуум гетерозиготен. Совокупность аллелей у особи называется ее генотипом. Экспрессия генотипов в белки, производящие специфическую структурную и функциональную форму, называется фенотипом.
Каждый гомологичный аллель гена (за исключением генов в половых хромосомах) может транслироваться в белки. Если только один из аллелей активен и дает признак, его называют доминантным аллелем.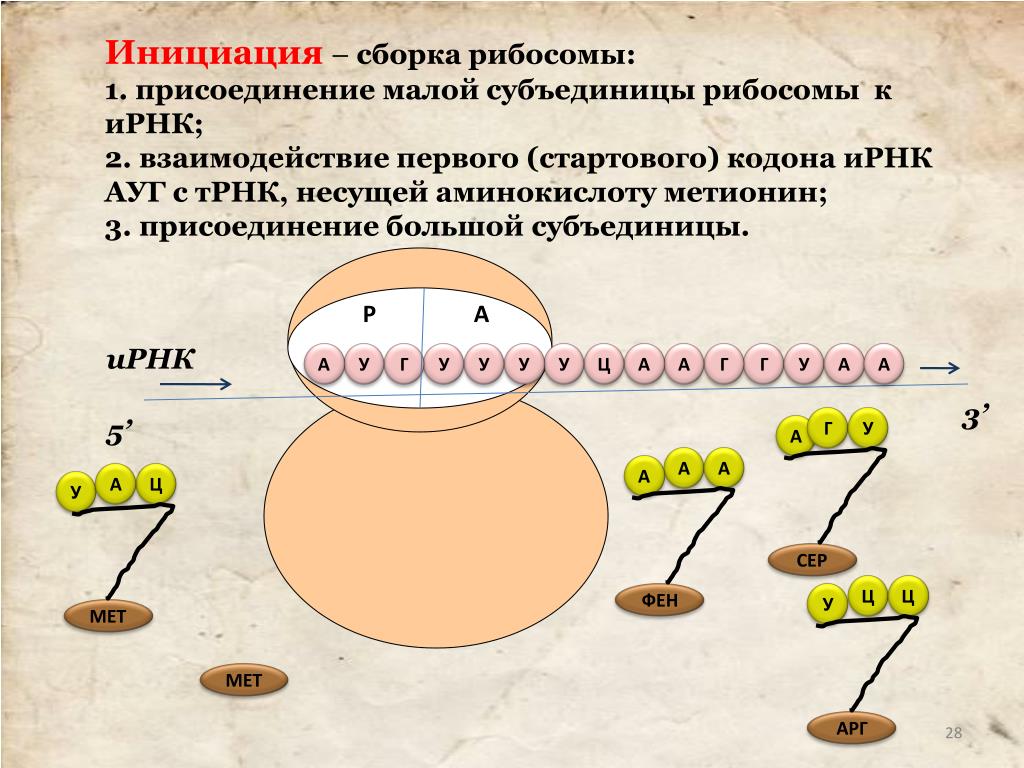 Если оба аллеля должны быть активны для получения определенного признака, такие аллели называются рецессивными.
Если оба аллеля должны быть активны для получения определенного признака, такие аллели называются рецессивными.
Генетическое заболевание может быть результатом наследования мутантных генов, которые вызывают аномальную структуру или функцию. Семейная гиперхолестеринемия, муковисцидоз, серповидноклеточная анемия, гемофилия, мышечная дистрофия являются моногенными заболеваниями. Полигенные заболевания возникают в результате нескольких дефектных генов, каждый из которых сам по себе малоэффективен. Примерами являются диабет, гипертония и рак.
Хромосомные болезни возникают в результате добавления или делеции целых хромосом или их частей во время мейоза. Примером может служить синдром Дауна или трисомия 21, при которой яйцеклетка имеет дополнительную копию хромосомы 21.
Рак
Рак — это генетическое заболевание, которое обычно не передается по наследству. Возникают в результате мутаций в соматических клетках. Приводит к отказу системы контроля, которая регулирует клеточное деление, и приводит к неконтролируемому росту.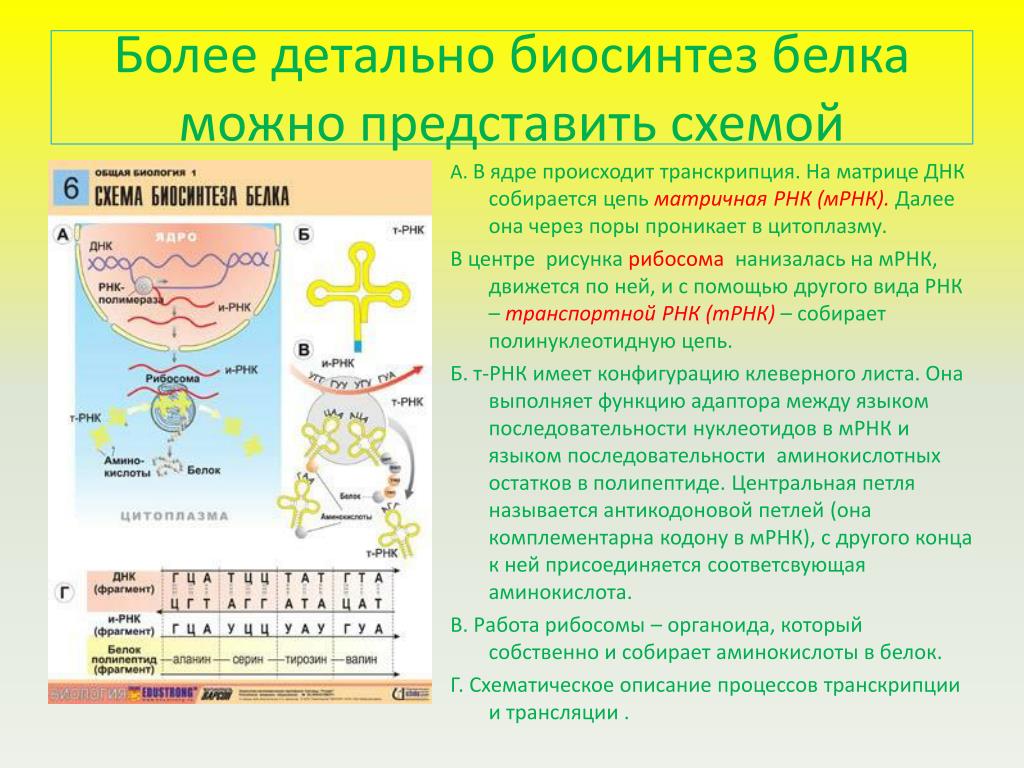
Доминантные гены, вызывающие рак, называемые онкогенами, кодируют аномальные формы рецепторов клеточной поверхности, которые связывают факторы роста и производят непрерывный сигнал роста.Рецессивные гены, вызывающие рак, называемые генами-супрессорами опухолей, не могут продуцировать белки, которые ингибируют различные этапы репликации клеток.
Аномальная репликация клеток образует тканевую массу, называемую опухолью . Если эти клетки остаются локализованными, это называется доброкачественной опухолью, если они проникают в окружающие ткани, это называется злокачественной опухолью.
Рак, развивающийся в эпителиальных клетках, называется карциномой, в мышечных клетках — саркомой, а в лейкоцитах — лимфомой.Наиболее часто поражаются легкие, толстая кишка и молочная железа. Заболеваемость раком увеличивается с возрастом из-за накопления дефектных мутаций.
Мутагены, повышающие вероятность раковой трансформации клетки, называются канцерогенами.
Генная инженерия
Модификация последовательности оснований молекулы ДНК путем добавления или удаления оснований. Включает:
Включает:
- Разрезание нитей ДНК в определенных местах, называемых сайтами рестрикции, бактериальными ферментами, называемыми рестрикционными нуклеазами.
- Связывание полученных интересующих фрагментов с другой молекулой ДНК с помощью фермента, называемого лигазой.
Процесс переноса ДНК из одного организма в другой называется трансфекцией, а организм, в который произошел такой перенос, называется трансгенным организмом.
Бактерии могут быть трансфицированы человеческими генами для производства больших количеств человеческих белков. Включает производство ДНК без интронов, называемой комплементарной ДНК (кДНК), с использованием вирусного фермента, называемого обратной транскриптазой, на матрице мРНК.Потребность в кДНК возникает из-за того, что бактериальная ДНК не имеет ни интронов, ни механизма их сплайсинга.
Следующий
Понимание молекулярной основы синдрома ломкой Х-хромосомы | Молекулярная генетика человека
Аннотация
Синдром ломкой Х-хромосомы, распространенная форма наследственной умственной отсталости, в основном вызывается массивной экспансией триплетных повторов CGG, расположенных в 5′-нетранслируемой области гена ломкой Х умственной отсталости-1 ( FMR1 ). У пациентов с синдромом ломкой Х гиперметилированы расширенные триплетные повторы CGG и репрессирована экспрессия гена FMR1 , что приводит к отсутствию белка FMR1 (FMRP) и последующей умственной отсталости. FMRP представляет собой РНК-связывающий белок, который перемещается между ядром и цитоплазмой. Этот белок участвует в трансляции белков, поскольку он связан с полирибосомами и шероховатым эндоплазматическим ретикулумом. Здесь мы обсуждаем недавний прогресс, достигнутый в понимании молекулярного механизма экспансии повторов CGG и физиологических функций FMRP.Эти исследования не только помогут пролить свет на молекулярную основу общего класса заболеваний человека с экспансией тринуклеотидных повторов, но и обеспечат путь к пониманию аспектов человеческого познания и интеллекта.
У пациентов с синдромом ломкой Х гиперметилированы расширенные триплетные повторы CGG и репрессирована экспрессия гена FMR1 , что приводит к отсутствию белка FMR1 (FMRP) и последующей умственной отсталости. FMRP представляет собой РНК-связывающий белок, который перемещается между ядром и цитоплазмой. Этот белок участвует в трансляции белков, поскольку он связан с полирибосомами и шероховатым эндоплазматическим ретикулумом. Здесь мы обсуждаем недавний прогресс, достигнутый в понимании молекулярного механизма экспансии повторов CGG и физиологических функций FMRP.Эти исследования не только помогут пролить свет на молекулярную основу общего класса заболеваний человека с экспансией тринуклеотидных повторов, но и обеспечат путь к пониманию аспектов человеческого познания и интеллекта.
Поступила 13 января 2000 г.; Принято 1 февраля 2000 г.
ВВЕДЕНИЕ
Синдром ломкой Х-хромосомы является одной из наиболее распространенных форм наследственной умственной отсталости с частотой 1 случай на 4000 мужчин и 1 случай на 8000 женщин (1,2). Синдром передается как сцепленный с Х-хромосомой доминантный признак и со сниженной пенетрантностью (80% у мужчин и 30% у женщин) (1,2). Синдром ломкой Х-хромосомы связан с ломким участком, обозначенным как FRAXA (хрупкий сайт, Х-хромосома, сайт А), на Xq27.3 рядом с концом длинного плеча. Клинические проявления синдрома ломкой Х-хромосомы включают умственную отсталость от легкой до тяжелой степени, с IQ от 20 до 60, слегка аномальные черты лица с выдающейся челюстью и большими ушами, в основном у мужчин, и макроорхизм у мужчин в постпубертатном возрасте.У многих пациентов также обнаруживаются тонкие аномалии соединительной ткани, гиперактивность и синдром дефицита внимания, а также аутоподобное поведение (1,2). В 1991 г. путем позиционного клонирования была выявлена молекулярная основа синдрома ломкой Х-хромосомы, и было показано, что она связана с массивной экспансией тринуклеотидных повторов в гене ломкой Х-синдрома умственной отсталости-1 ( FMR1 ) (3–6). Это было одно из первых идентифицированных нарушений у человека, вызванных динамической мутацией, экспансией тринуклеотидных повторов.
Синдром передается как сцепленный с Х-хромосомой доминантный признак и со сниженной пенетрантностью (80% у мужчин и 30% у женщин) (1,2). Синдром ломкой Х-хромосомы связан с ломким участком, обозначенным как FRAXA (хрупкий сайт, Х-хромосома, сайт А), на Xq27.3 рядом с концом длинного плеча. Клинические проявления синдрома ломкой Х-хромосомы включают умственную отсталость от легкой до тяжелой степени, с IQ от 20 до 60, слегка аномальные черты лица с выдающейся челюстью и большими ушами, в основном у мужчин, и макроорхизм у мужчин в постпубертатном возрасте.У многих пациентов также обнаруживаются тонкие аномалии соединительной ткани, гиперактивность и синдром дефицита внимания, а также аутоподобное поведение (1,2). В 1991 г. путем позиционного клонирования была выявлена молекулярная основа синдрома ломкой Х-хромосомы, и было показано, что она связана с массивной экспансией тринуклеотидных повторов в гене ломкой Х-синдрома умственной отсталости-1 ( FMR1 ) (3–6). Это было одно из первых идентифицированных нарушений у человека, вызванных динамической мутацией, экспансией тринуклеотидных повторов.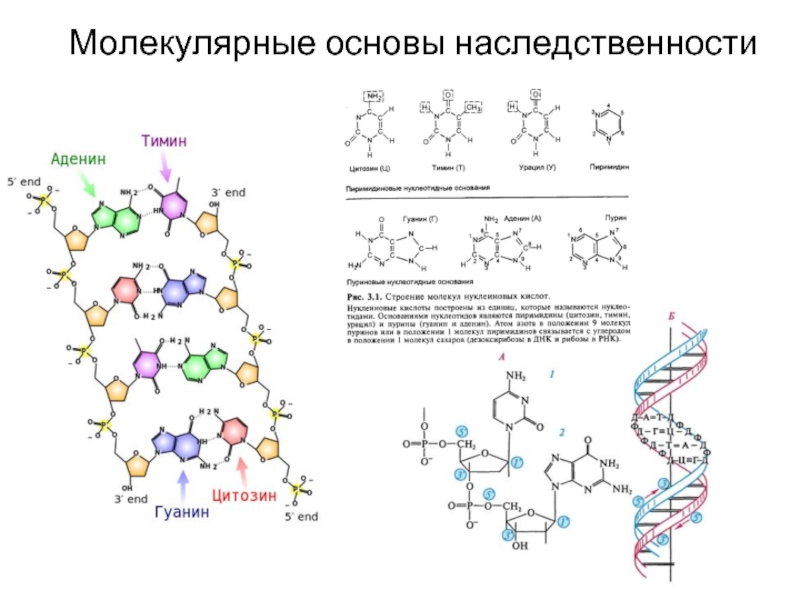
FMR1 представляет собой высококонсервативный ген, состоящий из 17 экзонов и занимающий около 38 т.п.н. (7,8). В пределах 4,4 т.п.н. транскрипта FMR1 тринуклеотидный повтор CGG расположен в 5′-нетранслируемой области (5′-UTR). У нормальных людей этот повтор CGG сильно полиморфен по длине и содержанию, часто перемежается прерываниями AGG (9–13). Нормальный размер повторов колеблется от 7 до примерно 60, при этом 30 повторов обнаруживаются на наиболее распространенном аллеле. У большинства пораженных людей повторы CGG значительно расширены до 230 повторов (полная мутация) и становятся аномально гиперметилированными, что приводит к молчанию гена FMR1 .Аллели с количеством повторов CGG от 60 до 230 называются премутациями. Обычно они неметилированы с нормальным уровнем транскрипта и белка, но крайне нестабильны при передаче следующему поколению (1,14). Расширение премутации до полной мутации может происходить только путем материнской передачи и зависит от длины материнской премутации. Из-за Х-сцепления пораженные мужчины имеют более тяжелые фенотипы, чем пораженные женщины, чей фенотип модулируется коэффициентом активации нормальной Х-хромосомы.Идентификация других мутаций FMR1 гена, таких как делеции и точковая мутация среди пациентов с обычным фенотипом, но без экспрессии ломкого сайта, твердо установила, что ген FMR1 является единственным геном, участвующим в патогенезе синдрома ломкой Х-хромосомы (15). ,16). Таким образом, отсутствие продукта гена FMR1 , белка ломкой Х умственной отсталости (FMRP), является типичной причиной синдрома ломкой Х-хромосомы. Ген FMR1 широко экспрессируется в тканях человека и мыши (17).Множественные изоформы FMRP, благодаря обширному альтернативному сплайсингу на 3′-конце, появляются в различных тканях, и некоторые из них присутствуют на разных количественных уровнях (7,18,19). FMRP участвует в связывании РНК и, возможно, участвует в контроле трансляции (20,21). Модель синдрома ломкой Х-хромосомы на животных была создана с использованием нацеливания на гены (22).
Из-за Х-сцепления пораженные мужчины имеют более тяжелые фенотипы, чем пораженные женщины, чей фенотип модулируется коэффициентом активации нормальной Х-хромосомы.Идентификация других мутаций FMR1 гена, таких как делеции и точковая мутация среди пациентов с обычным фенотипом, но без экспрессии ломкого сайта, твердо установила, что ген FMR1 является единственным геном, участвующим в патогенезе синдрома ломкой Х-хромосомы (15). ,16). Таким образом, отсутствие продукта гена FMR1 , белка ломкой Х умственной отсталости (FMRP), является типичной причиной синдрома ломкой Х-хромосомы. Ген FMR1 широко экспрессируется в тканях человека и мыши (17).Множественные изоформы FMRP, благодаря обширному альтернативному сплайсингу на 3′-конце, появляются в различных тканях, и некоторые из них присутствуют на разных количественных уровнях (7,18,19). FMRP участвует в связывании РНК и, возможно, участвует в контроле трансляции (20,21). Модель синдрома ломкой Х-хромосомы на животных была создана с использованием нацеливания на гены (22). Мыши с нокаутом FMR1 демонстрируют макроорхизм и тонкий дефицит обучения и памяти, которые имитируют человеческий фенотип.
Мыши с нокаутом FMR1 демонстрируют макроорхизм и тонкий дефицит обучения и памяти, которые имитируют человеческий фенотип.
Недавние исследования синдрома ломкой Х-хромосомы были сосредоточены на двух областях.(i) Нестабильность и метилирование повторов CGG, когда и как возникает нестабильность повторов CGG? Каков молекулярный механизм метилирования ДНК расширенных повторов CGG? (ii) физиологические функции FMRP; какие гены являются мишенями FMRP in vivo ? Как РНК-связывающий белок, какую роль (роли) FMRP играет в трансляции? Как отсутствие FMRP приводит к дефициту обучения и памяти во время развития? Здесь мы рассмотрим последние достижения в этих двух областях, направленные на понимание молекулярной основы синдрома ломкой Х-хромосомы.
НЕСТАБИЛЬНОСТЬ И МЕТИЛИРОВАНИЕ ПОВТОРОВ CGG
В нормальной популяции повтор CGG полиморфен, но наследуется стабильно. Повторение является загадочным с вкраплениями повторов AGG, которые чаще всего встречаются в положениях повтора 10 и 20 (11). Изменение длины повтора CGG обнаруживается на 3′-конце повтора, и оказывается, что триплеты AGG играют решающую роль в поддержании стабильности повтора (11). Большинство премутационных аллелей либо не имеют AGG, либо имеют только одно прерывание AGG на 5′-конце повтора (10, 13, 23).Потеря этих прерываний приводит к аллелям с более длинными участками совершенных повторов CGG, которые склонны к расширению до премутаций, особенно когда участки содержат> 30 совершенных повторов CGG. В отличие от нормального аллеля, премутация нестабильна и может распространяться до полной мутации или до премутации другого размера (6). Не сообщалось о новых мутациях со всеми аномальными аллелями, которые в конечном итоге произошли от премутаций, по крайней мере, в самых последних поколениях. Риск расширения премутации до полной мутации в следующем поколении экспоненциально возрастает с числом повторов от 65 до 100.Это явление устраняет ожидание при синдроме ломкой Х-хромосомы (также известном как «парадокс Шермана»), который клинически проявляется как увеличение числа и доли умственно отсталых людей в последующих поколениях семей с уязвимой Х-хромосомой (24,25).
Изменение длины повтора CGG обнаруживается на 3′-конце повтора, и оказывается, что триплеты AGG играют решающую роль в поддержании стабильности повтора (11). Большинство премутационных аллелей либо не имеют AGG, либо имеют только одно прерывание AGG на 5′-конце повтора (10, 13, 23).Потеря этих прерываний приводит к аллелям с более длинными участками совершенных повторов CGG, которые склонны к расширению до премутаций, особенно когда участки содержат> 30 совершенных повторов CGG. В отличие от нормального аллеля, премутация нестабильна и может распространяться до полной мутации или до премутации другого размера (6). Не сообщалось о новых мутациях со всеми аномальными аллелями, которые в конечном итоге произошли от премутаций, по крайней мере, в самых последних поколениях. Риск расширения премутации до полной мутации в следующем поколении экспоненциально возрастает с числом повторов от 65 до 100.Это явление устраняет ожидание при синдроме ломкой Х-хромосомы (также известном как «парадокс Шермана»), который клинически проявляется как увеличение числа и доли умственно отсталых людей в последующих поколениях семей с уязвимой Х-хромосомой (24,25). Примечательно, что премутация расширяется до полной мутации только тогда, когда она передается носителем женского пола, но не носителем мужского пола. Причина этого в том, что самцы с полной мутацией имеют в сперме только аллели премутационного размера (см. ниже) (26). При полной мутации повтор CGG сильно расширен и гиперметилирован, что приводит к репрессии гена FMR1 и ведет к потере FMRP.Однако мозаицизм как длины повторов CGG, так и статуса метилирования существует у пациентов с хрупкой Х-хромосомой (1). У большинства больных соматическая вариация длины повторов обнаруживается во всех тканях и выражена примерно у 15% пациентов, что называется мозаикой. Кроме того, некоторые носители полных мутаций имеют неметилированные премутационные полосы, которые предположительно продуцируют FMRP и которые можно обнаружить у некоторых высокофункциональных пациентов с хрупкой Х-хромосомой. Также некоторые аллели с полной мутацией частично метилированы или полностью неметилированы.Были представлены некоторые доказательства того, что транскрипты FMR1 с большими экспансиями плохо транслируются (27).
Примечательно, что премутация расширяется до полной мутации только тогда, когда она передается носителем женского пола, но не носителем мужского пола. Причина этого в том, что самцы с полной мутацией имеют в сперме только аллели премутационного размера (см. ниже) (26). При полной мутации повтор CGG сильно расширен и гиперметилирован, что приводит к репрессии гена FMR1 и ведет к потере FMRP.Однако мозаицизм как длины повторов CGG, так и статуса метилирования существует у пациентов с хрупкой Х-хромосомой (1). У большинства больных соматическая вариация длины повторов обнаруживается во всех тканях и выражена примерно у 15% пациентов, что называется мозаикой. Кроме того, некоторые носители полных мутаций имеют неметилированные премутационные полосы, которые предположительно продуцируют FMRP и которые можно обнаружить у некоторых высокофункциональных пациентов с хрупкой Х-хромосомой. Также некоторые аллели с полной мутацией частично метилированы или полностью неметилированы.Были представлены некоторые доказательства того, что транскрипты FMR1 с большими экспансиями плохо транслируются (27). Эти наблюдения указывают на то, что расширение повторов CGG и метилирование расширенных повторов CGG являются двумя отдельными событиями, связь которых до сих пор не ясна. Как статус метилирования, так и длина повтора на активной Х-хромосоме будут влиять на количество продуцируемого FMRP, что важно во время развития познания.
Эти наблюдения указывают на то, что расширение повторов CGG и метилирование расширенных повторов CGG являются двумя отдельными событиями, связь которых до сих пор не ясна. Как статус метилирования, так и длина повтора на активной Х-хромосоме будут влиять на количество продуцируемого FMRP, что важно во время развития познания.
Хотя время экспансии повторов CGG до сих пор не ясно, два периода времени, в течение которых премутация расширяется до полной мутации: мейоз и раннее эмбриональное развитие.Ожидание в каждом последующем поколении хрупких X-семей указывает на то, что расширение должно происходить в зародышевых клетках (либо во время премейотического, либо во время мейотического деления). Кроме того, было постулировано, что нестабильность повторов CGG существует постзиготически (28). Подтверждающим доказательством является то, что носители полных мутаций обнаруживают соматический мозаицизм повторов CGG (28,29). Однако длина повторов CGG на конкретном аллеле в дифференцированной клетке, полученной от этих носителей, обычно митотически стабильна, хотя недавние исследования показывают, что полностью расширенные повторы FMR1 CGG проявляют нестабильность, зависящую от длины и дифференцировки, в клеточных гибридах (30, 31). Анализ повторов CGG в гаметах плодов с полной мутацией показал, что яички 13-недельного плода с полной мутацией не обнаруживают признаков премутаций, тогда как 17-недельный плод с полной мутацией демонстрирует некоторые зародышевые клетки с признаками премутаций (32). Также в ооцитах плодов с полной мутацией можно обнаружить только аллели полной экспансии (32). Эти результаты показывают, что нестабильность повторов CGG возникает либо во время премейотического или мейотического деления, либо постзиготически, но на очень ранней стадии развития до сегрегации зародышевой линии, что происходит на 5-й день развития (33).Однако самое простое объяснение, поддерживаемое моделированием, заключается в том, что полная мутация передается в ооците, а редукционная нестабильность объясняет мозаицизм. Это ждет прямого экспериментального подтверждения, и остается возможным, что события в зиготе способствуют экспансии.
Анализ повторов CGG в гаметах плодов с полной мутацией показал, что яички 13-недельного плода с полной мутацией не обнаруживают признаков премутаций, тогда как 17-недельный плод с полной мутацией демонстрирует некоторые зародышевые клетки с признаками премутаций (32). Также в ооцитах плодов с полной мутацией можно обнаружить только аллели полной экспансии (32). Эти результаты показывают, что нестабильность повторов CGG возникает либо во время премейотического или мейотического деления, либо постзиготически, но на очень ранней стадии развития до сегрегации зародышевой линии, что происходит на 5-й день развития (33).Однако самое простое объяснение, поддерживаемое моделированием, заключается в том, что полная мутация передается в ооците, а редукционная нестабильность объясняет мозаицизм. Это ждет прямого экспериментального подтверждения, и остается возможным, что события в зиготе способствуют экспансии.
Молекулярный механизм экспансии повторов CGG до сих пор неясен. Модель, основанная на репликации, в которой проскальзывание фрагментов идеального повтора Оказаки приводит к расширению повтора, наиболее предпочтительна в литературе, по крайней мере, для премутации в премутационную вариацию.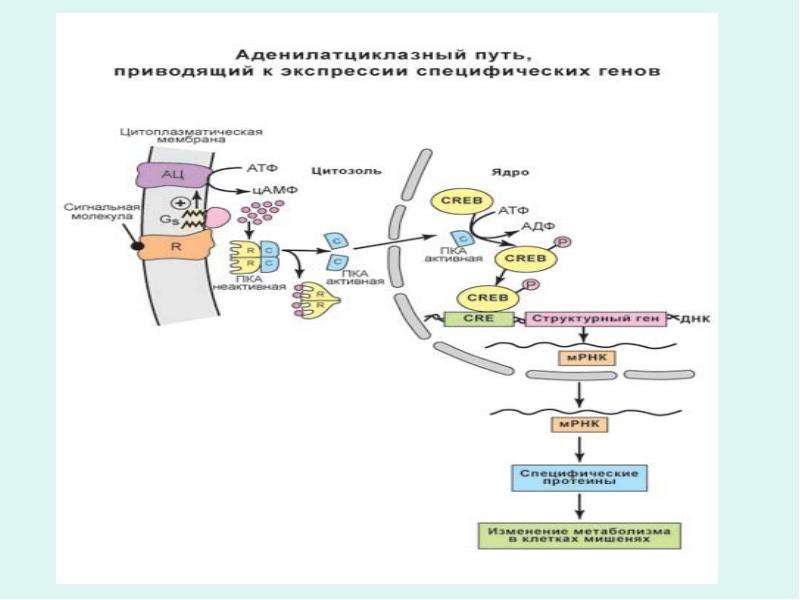 Согласно этой модели, для большинства нормальных аллелей повторы CGG прерываются двумя AGG, а число длинных совершенных повторов составляет <30, что не превышает длину нормального фрагмента Оказаки млекопитающих, составляющую 25–300 нуклеотидов; длинный идеальный повтор может быть закреплен прерываниями AGG. Когда зарождающаяся нить содержит >30 совершенных повторов без прерывания в качестве эталона, фрагмент Оказаки, содержащий только повторы CGG, будет иметь тенденцию проскальзывать во время репликации, вероятно, также под влиянием необычной структуры ДНК, предполагаемой повтором (11,34,35).Однако эта модель не может легко объяснить, как проскальзывание может привести к огромному расширению во время передачи от премутации к полной мутации. Недавно было предположено, что эндонуклеаза RAD27 у дрожжей, или FEN-1, гомолог у млекопитающих, играет ключевую роль в нестабильности повторов (36). Эта эндонуклеазная активность отвечает за удаление 5′-рибонуклеотида, полученного из РНК-праймера, и 5′-конца фрагмента Оказаки, который замещается растущим 3′-концом предшествующего фрагмента Окадзаки.
Согласно этой модели, для большинства нормальных аллелей повторы CGG прерываются двумя AGG, а число длинных совершенных повторов составляет <30, что не превышает длину нормального фрагмента Оказаки млекопитающих, составляющую 25–300 нуклеотидов; длинный идеальный повтор может быть закреплен прерываниями AGG. Когда зарождающаяся нить содержит >30 совершенных повторов без прерывания в качестве эталона, фрагмент Оказаки, содержащий только повторы CGG, будет иметь тенденцию проскальзывать во время репликации, вероятно, также под влиянием необычной структуры ДНК, предполагаемой повтором (11,34,35).Однако эта модель не может легко объяснить, как проскальзывание может привести к огромному расширению во время передачи от премутации к полной мутации. Недавно было предположено, что эндонуклеаза RAD27 у дрожжей, или FEN-1, гомолог у млекопитающих, играет ключевую роль в нестабильности повторов (36). Эта эндонуклеазная активность отвечает за удаление 5′-рибонуклеотида, полученного из РНК-праймера, и 5′-конца фрагмента Оказаки, который замещается растущим 3′-концом предшествующего фрагмента Окадзаки.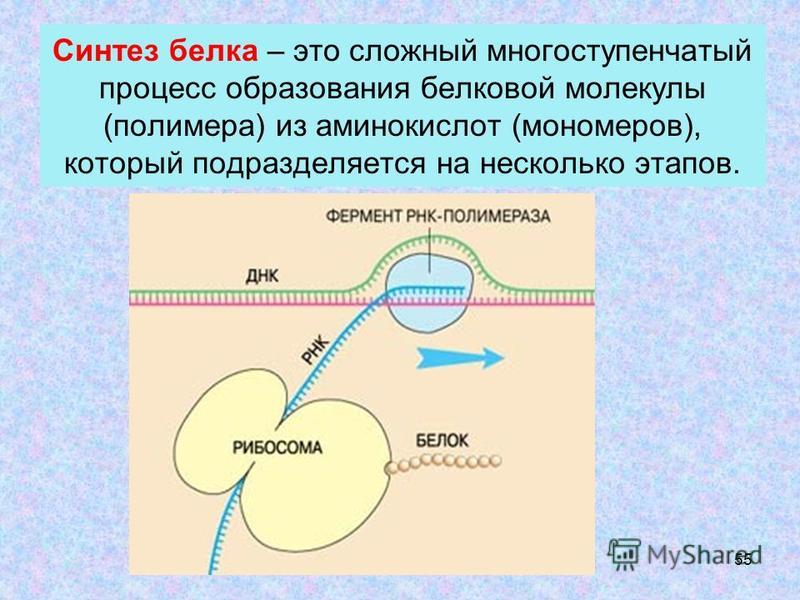 Было обнаружено, что делеция RAD27 у дрожжей дестабилизирует массивы динуклеотидов, благоприятствуя добавлению повторов, а также накоплению дупликационных мутаций, что указывает на то, что RAD27, следовательно, может участвовать в расширении триплетных повторов (37-39). Гомолог RAD27 млекопитающих, FEN-1, функционирует как в процессинге фрагментов Оказаки во время синтеза отстающих цепей, так и в процессинге разветвленных структур, возникающих при эксцизионной репарации оснований длинными участками, что указывает на то, что субстрат FEN-1 должен быть одноцепочечным. (40).Структурный анализ показал, что триплетные повторы могут образовывать внутримолекулярную вторичную структуру (шпильку), которая будет устойчива к активности эндонуклеазы FEN-1 (36,41,42). В отсутствие RAD27 у дрожжей наблюдение, что триплетные повторы, включая CGG, CAG и CTG, имеют значительно повышенную частоту экспансии, подтверждает эту идею (43,44). Кроме того, было продемонстрировано, что у дрожжей вторичная структура действительно может ингибировать процессинг лоскута в триплетных повторах зависимым от длины образом, скрывая 5′-конец лоскута, который необходим как для связывания, так и для расщепления с помощью FEN-1 (45).
Было обнаружено, что делеция RAD27 у дрожжей дестабилизирует массивы динуклеотидов, благоприятствуя добавлению повторов, а также накоплению дупликационных мутаций, что указывает на то, что RAD27, следовательно, может участвовать в расширении триплетных повторов (37-39). Гомолог RAD27 млекопитающих, FEN-1, функционирует как в процессинге фрагментов Оказаки во время синтеза отстающих цепей, так и в процессинге разветвленных структур, возникающих при эксцизионной репарации оснований длинными участками, что указывает на то, что субстрат FEN-1 должен быть одноцепочечным. (40).Структурный анализ показал, что триплетные повторы могут образовывать внутримолекулярную вторичную структуру (шпильку), которая будет устойчива к активности эндонуклеазы FEN-1 (36,41,42). В отсутствие RAD27 у дрожжей наблюдение, что триплетные повторы, включая CGG, CAG и CTG, имеют значительно повышенную частоту экспансии, подтверждает эту идею (43,44). Кроме того, было продемонстрировано, что у дрожжей вторичная структура действительно может ингибировать процессинг лоскута в триплетных повторах зависимым от длины образом, скрывая 5′-конец лоскута, который необходим как для связывания, так и для расщепления с помощью FEN-1 (45). Таким образом, понимание физиологического значения FEN-1 будет важно для разгадки тайны, окружающей экспансию триплетных повторов. Кроме того, было высказано предположение, что повреждение ДНК играет значительную роль в расширении триплетных повторов. У Escherichia coli дефицит некоторых функций эксцизионной репарации нуклеотидов может резко повлиять на стабильность длинных повторяющихся вставок в плазмиде (46). Аналог единственного абазового сайта на 5′-конце матрицы тракта триплетных повторов может индуцировать массовую экспансию триплетных повторов во время синтеза ДНК in vitro (47).В самом деле, расщепление повтора ДНК из-за репарации может инициировать инвазию цепи, запускающую экспансию посредством незапланированного механизма репликации ДНК, такого как события типа генной конверсии.
Таким образом, понимание физиологического значения FEN-1 будет важно для разгадки тайны, окружающей экспансию триплетных повторов. Кроме того, было высказано предположение, что повреждение ДНК играет значительную роль в расширении триплетных повторов. У Escherichia coli дефицит некоторых функций эксцизионной репарации нуклеотидов может резко повлиять на стабильность длинных повторяющихся вставок в плазмиде (46). Аналог единственного абазового сайта на 5′-конце матрицы тракта триплетных повторов может индуцировать массовую экспансию триплетных повторов во время синтеза ДНК in vitro (47).В самом деле, расщепление повтора ДНК из-за репарации может инициировать инвазию цепи, запускающую экспансию посредством незапланированного механизма репликации ДНК, такого как события типа генной конверсии.
Чтобы полностью понять временной и молекулярный механизм экспансии повторов CGG, необходимы модели животных, демонстрирующие нестабильность повторов CGG во время передачи по зародышевой линии. Только на животных моделях станет возможным легко изучать гаметогенез и ранний эмбриогенез в определенные моменты времени.К сожалению, такой модели животного в настоящее время нет. Создание животных моделей с полными мутациями CGG-повторов в настоящее время технически сложно из-за крайней нестабильности полной мутации в E.coli . Трансгенные мыши с премутационным аллелем FMR1 были созданы двумя отдельными группами; однако в обоих случаях нестабильности повтора CGG не наблюдалось (48,49). Недавно были получены трансгенные мыши YAC, которые несут человеческий ген FMR1 , содержащий повторы CGG различного размера, и не было обнаружено нестабильности повторов CGG (A.М. Пейер и Д.Л. Нельсон, представленный для публикации). У этих трансгенных мышей сайты интеграции либо трансгена, либо YAC являются случайными, что может указывать на то, что нестабильность триплетных повторов требует наличия -цис--действующего элемента(ов). Это также подтверждается ассоциативными исследованиями, хотя это остается спорным (50).
Только на животных моделях станет возможным легко изучать гаметогенез и ранний эмбриогенез в определенные моменты времени.К сожалению, такой модели животного в настоящее время нет. Создание животных моделей с полными мутациями CGG-повторов в настоящее время технически сложно из-за крайней нестабильности полной мутации в E.coli . Трансгенные мыши с премутационным аллелем FMR1 были созданы двумя отдельными группами; однако в обоих случаях нестабильности повтора CGG не наблюдалось (48,49). Недавно были получены трансгенные мыши YAC, которые несут человеческий ген FMR1 , содержащий повторы CGG различного размера, и не было обнаружено нестабильности повторов CGG (A.М. Пейер и Д.Л. Нельсон, представленный для публикации). У этих трансгенных мышей сайты интеграции либо трансгена, либо YAC являются случайными, что может указывать на то, что нестабильность триплетных повторов требует наличия -цис--действующего элемента(ов). Это также подтверждается ассоциативными исследованиями, хотя это остается спорным (50). Будет интересно изучить нестабильность повторов CGG с размером премутации в мышином FMR1 или соседнем локусе с использованием подхода нацеливания на гены (knock-in).Кроме того, эти нокаутированные мыши будут протестированы на различных генетических фонах и подвергнуты мутагенезу, чтобы определить пути, которые приводят к нестабильности триплетных повторов. Однако возможно, что могут существовать межвидовые различия между человеком и мышью в этом отношении и что у людей отсутствуют механизмы, присутствующие у мышей, которые стабилизируют повторы.
Будет интересно изучить нестабильность повторов CGG с размером премутации в мышином FMR1 или соседнем локусе с использованием подхода нацеливания на гены (knock-in).Кроме того, эти нокаутированные мыши будут протестированы на различных генетических фонах и подвергнуты мутагенезу, чтобы определить пути, которые приводят к нестабильности триплетных повторов. Однако возможно, что могут существовать межвидовые различия между человеком и мышью в этом отношении и что у людей отсутствуют механизмы, присутствующие у мышей, которые стабилизируют повторы.
Время и молекулярный механизм метилирования расширенного повтора CGG, которые приводят к молчанию транскрипции FMR1 , также находятся в стадии обширного изучения.Как обсуждалось ранее, все аллели из интактных яичников плодов с полной мутацией полностью расширены, но не метилированы. Однако было показано, что образцы ворсин хроиона, взятые на разных стадиях развития, метилированы в разной степени (32). Кроме того, исследования лимфобластоидов человека с полной мутацией показали, что метилирование индивидуального цитозина CpG поразительно вариабельно в гиперметилированном эпигенотипе, полученном от одного человека (51). Эти результаты показывают, что метилирование расширенных повторов CGG происходит в широком диапазоне и является динамическим процессом.Три различных семейства генов ДНК-метилтрансфераз, названных Dnmt1 , Dnmt2 и Dnmt3 , были идентифицированы в клетках млекопитающих, но какие ДНК-метилтрансферазы участвуют в метилировании расширенных повторов CGG, до сих пор неизвестно (52). . Недавно было показано, что метилирование повторов CGG вызывает сайленсинг транскрипции за счет деацетилирования гистонов (53). В клетках нормальных людей 5′-конец FMR1 , который содержит повторы CGG, связан с ацетилированными гистонами h4 и h5, но ацетилирование снижается в клетках с гиперметилированной полной мутацией (53).Деацетилирование гистонов в локусе FMR1 , индуцированное гиперметилированием расширенных повторов CGG, изменит структуру хроматина 5′-конца гена FMR1 , что приведет к молчанию транскрипции (рис. 1). Обработка хрупких Х-клеток 5-азадеоксицитидином (5-аза-dC), который индуцирует деметилирование ДНК посредством ингибирования ДНК-метилтрансферазы, приводила к повторной ассоциации ацетилированных гистонов h4 и h5 с FMR1 и реактивации транскрипции (53,54).
Эти результаты показывают, что метилирование расширенных повторов CGG происходит в широком диапазоне и является динамическим процессом.Три различных семейства генов ДНК-метилтрансфераз, названных Dnmt1 , Dnmt2 и Dnmt3 , были идентифицированы в клетках млекопитающих, но какие ДНК-метилтрансферазы участвуют в метилировании расширенных повторов CGG, до сих пор неизвестно (52). . Недавно было показано, что метилирование повторов CGG вызывает сайленсинг транскрипции за счет деацетилирования гистонов (53). В клетках нормальных людей 5′-конец FMR1 , который содержит повторы CGG, связан с ацетилированными гистонами h4 и h5, но ацетилирование снижается в клетках с гиперметилированной полной мутацией (53).Деацетилирование гистонов в локусе FMR1 , индуцированное гиперметилированием расширенных повторов CGG, изменит структуру хроматина 5′-конца гена FMR1 , что приведет к молчанию транскрипции (рис. 1). Обработка хрупких Х-клеток 5-азадеоксицитидином (5-аза-dC), который индуцирует деметилирование ДНК посредством ингибирования ДНК-метилтрансферазы, приводила к повторной ассоциации ацетилированных гистонов h4 и h5 с FMR1 и реактивации транскрипции (53,54).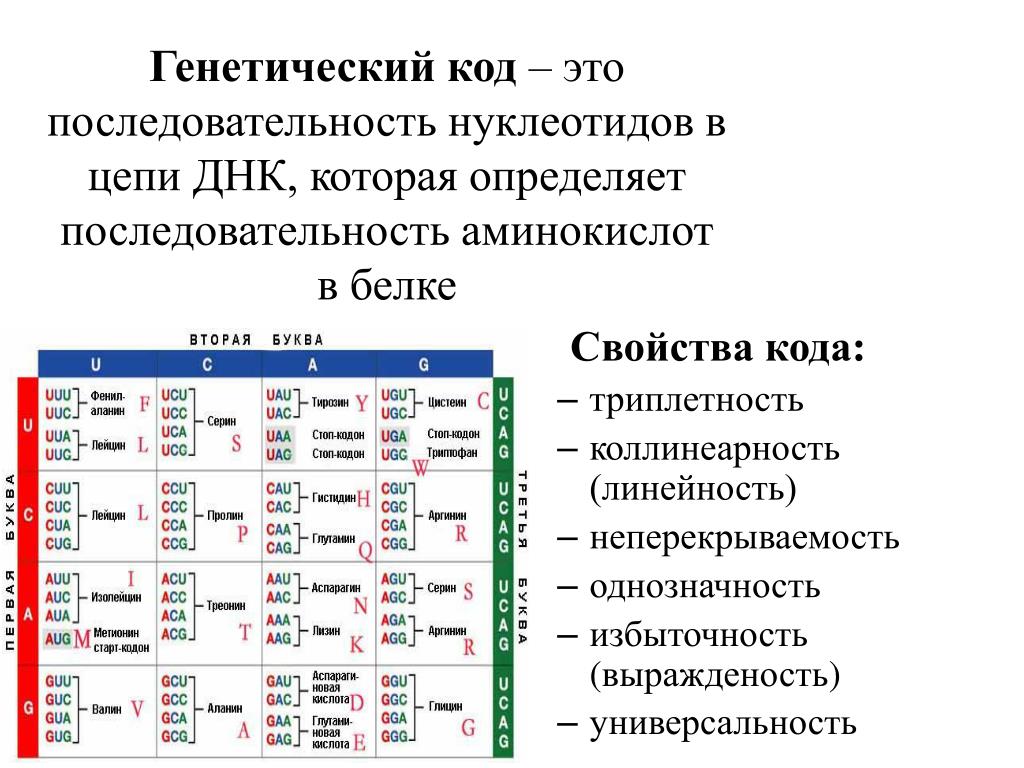 Но обработка ломких Х-клеток различными ингибиторами гистоновых деацетилаз приводила к незначительной реактивации гена FMR1 . Однако сочетание этих ингибиторов гистондеацетилазы с 5-аза-dC может привести к большему увеличению транскриптов FMR1 , чем только 5-аза-dC, что свидетельствует о синергическом эффекте гиперацетилирования гистонов и деметилирования ДНК при реактивации FMR1 full мутация (55). Эта стратегия реактивации может обеспечить потенциальный терапевтический подход к синдрому ломкой Х-хромосомы.Однако побочный эффект этих препаратов и сложность эффективной трансляции транскриптов FMR1 с большими повторами могут ограничивать этот подход (27,56).
Но обработка ломких Х-клеток различными ингибиторами гистоновых деацетилаз приводила к незначительной реактивации гена FMR1 . Однако сочетание этих ингибиторов гистондеацетилазы с 5-аза-dC может привести к большему увеличению транскриптов FMR1 , чем только 5-аза-dC, что свидетельствует о синергическом эффекте гиперацетилирования гистонов и деметилирования ДНК при реактивации FMR1 full мутация (55). Эта стратегия реактивации может обеспечить потенциальный терапевтический подход к синдрому ломкой Х-хромосомы.Однако побочный эффект этих препаратов и сложность эффективной трансляции транскриптов FMR1 с большими повторами могут ограничивать этот подход (27,56).
ФИЗИОЛОГИЧЕСКАЯ ФУНКЦИЯ(И) FMRP
Поскольку синдром ломкой Х-хромосомы является заболеванием с одним геном, вызываемым отсутствием FMRP, возникает вопрос, как отсутствие FMRP индуцирует клинический фенотип. Ответ на этот вопрос требует полного понимания физиологических функций FMRP.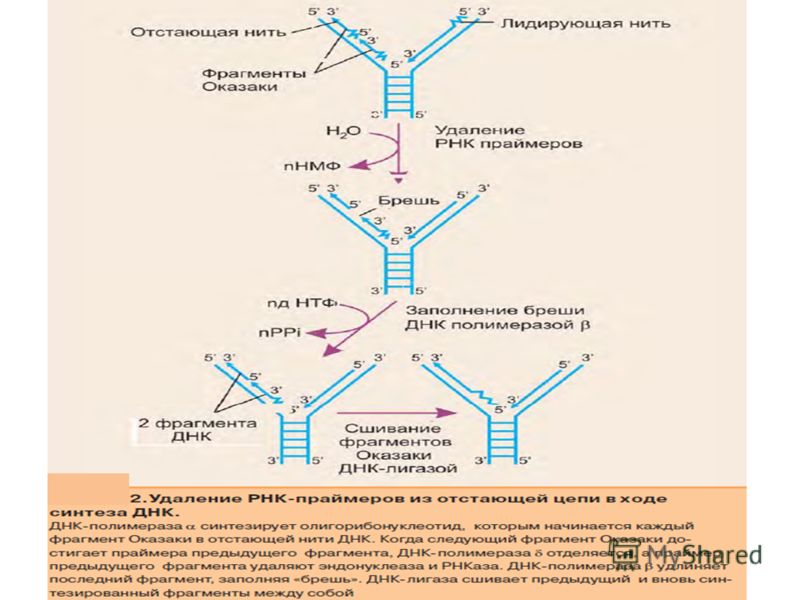 Ген FMR1 широко экспрессируется в тканях человека и мыши. Гибридизация in situ с тканями взрослых мышей показала обильную экспрессию в головном мозге, семенниках, яичниках, эпителии пищевода, тимусе, глазах и селезенке с умеренной экспрессией в толстой кишке, матке, щитовидной железе и печени и отсутствием экспрессии в сердце, аорте или мышца (17). Анализ аминокислотной последовательности FMRP выявил наличие двух типов РНК-связывающего мотива, двух доменов гомологии рибонуклеопротеина K (KH-домены) и кластеров остатков аргинина и глицина (RGG-боксы), что позволяет предположить, что FMRP является РНК-связывающим мотивом. белок (20,21).Кроме того, у пациента с миссенс-мутацией была обнаружена необычно тяжелая умственная отсталость (15). Точечная мутация изменяет остаток изолейцина на аспарагин в положении 304 (I304N), который расположен во втором домене KH FMRP, и этот изолейцин хорошо консервативен почти в каждом домене KH различных белков (57, 58). Это также указывает на то, что свойство FMRP связывать РНК имеет решающее значение для его функций.
Ген FMR1 широко экспрессируется в тканях человека и мыши. Гибридизация in situ с тканями взрослых мышей показала обильную экспрессию в головном мозге, семенниках, яичниках, эпителии пищевода, тимусе, глазах и селезенке с умеренной экспрессией в толстой кишке, матке, щитовидной железе и печени и отсутствием экспрессии в сердце, аорте или мышца (17). Анализ аминокислотной последовательности FMRP выявил наличие двух типов РНК-связывающего мотива, двух доменов гомологии рибонуклеопротеина K (KH-домены) и кластеров остатков аргинина и глицина (RGG-боксы), что позволяет предположить, что FMRP является РНК-связывающим мотивом. белок (20,21).Кроме того, у пациента с миссенс-мутацией была обнаружена необычно тяжелая умственная отсталость (15). Точечная мутация изменяет остаток изолейцина на аспарагин в положении 304 (I304N), который расположен во втором домене KH FMRP, и этот изолейцин хорошо консервативен почти в каждом домене KH различных белков (57, 58). Это также указывает на то, что свойство FMRP связывать РНК имеет решающее значение для его функций. Также были идентифицированы два аутосомных гомолога гена FMR1 , FXR1 и FXR2 , и общая структура соответствующих белков очень похожа на структуру FMRP (59,60).Было высказано предположение, что из-за их сходства FXR1P и FXR2P могут компенсировать функцию (функции) FMRP в его отсутствие, что приводит к нелетальному, но очень мягкому фенотипу как у человека, так и у мыши. Однако клетки пациентов с ломкой Х-хромосомой и нокаутных мышей FMR1 , лишенных экспрессии FMRP, имеют нормальный уровень экспрессии как FXR1P, так и FXR2P (61). Функции этого семейства FMRP, включая FMRP, FXR1P и FXR2P, тщательно изучались в последние несколько лет (62).
Также были идентифицированы два аутосомных гомолога гена FMR1 , FXR1 и FXR2 , и общая структура соответствующих белков очень похожа на структуру FMRP (59,60).Было высказано предположение, что из-за их сходства FXR1P и FXR2P могут компенсировать функцию (функции) FMRP в его отсутствие, что приводит к нелетальному, но очень мягкому фенотипу как у человека, так и у мыши. Однако клетки пациентов с ломкой Х-хромосомой и нокаутных мышей FMR1 , лишенных экспрессии FMRP, имеют нормальный уровень экспрессии как FXR1P, так и FXR2P (61). Функции этого семейства FMRP, включая FMRP, FXR1P и FXR2P, тщательно изучались в последние несколько лет (62).
Исследования специфичности связывания РНК FMRP показали, что FMRP преимущественно связывается с поли(G) и поли(U) вместо поли(C) и поли(A) in vitro .Более того, FMRP может связываться только с селективными мРНК мозга in vitro , включая 3′-UTRs основного белка миелина (MBP) и сам сигнал FMR1 (63).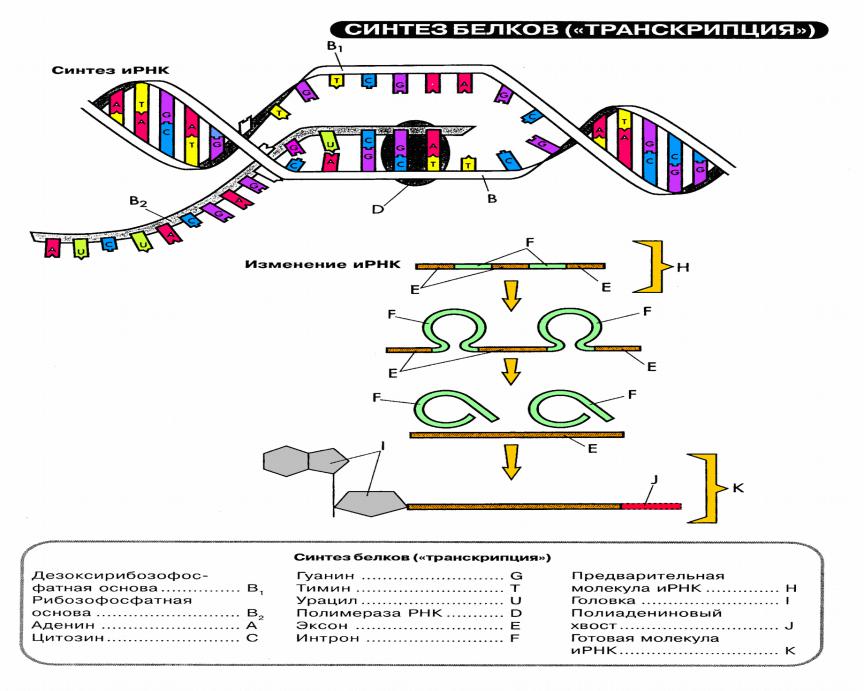 Однако специфичность связывания in vivo с и нативные РНК-мишени FMRP еще предстоит определить. Это будет очень важно для понимания физиологических функций FMRP. Другая сторона этой истории заключается в том, какие области FMRP взаимодействуют с РНК. Из-за присутствия KH-доменов и RGG-бокса в составе FMRP можно было бы предположить, что эти области должны отвечать за взаимодействие с РНК.Однако путем создания делеционных мутантов FMRP, N-концевого участка, двух областей KH и C-концевого участка было показано, что только первый домен KH, но не второй, взаимодействует с РНК (64). Этот результат согласуется с наблюдением, что FMRP с точечной мутацией (I304N) во втором домене KH может связываться с РНК, хотя эта мутация может нарушать структуру домена KH (63). Что еще более интересно, как N-, так и C-концевые области проявляют способность связываться с РНК. В пределах N-концевого участка не удается идентифицировать ни одного известного РНК-связывающего мотива, и эта область преимущественно связывается с поли(G), подобно первым доменам KH.
Однако специфичность связывания in vivo с и нативные РНК-мишени FMRP еще предстоит определить. Это будет очень важно для понимания физиологических функций FMRP. Другая сторона этой истории заключается в том, какие области FMRP взаимодействуют с РНК. Из-за присутствия KH-доменов и RGG-бокса в составе FMRP можно было бы предположить, что эти области должны отвечать за взаимодействие с РНК.Однако путем создания делеционных мутантов FMRP, N-концевого участка, двух областей KH и C-концевого участка было показано, что только первый домен KH, но не второй, взаимодействует с РНК (64). Этот результат согласуется с наблюдением, что FMRP с точечной мутацией (I304N) во втором домене KH может связываться с РНК, хотя эта мутация может нарушать структуру домена KH (63). Что еще более интересно, как N-, так и C-концевые области проявляют способность связываться с РНК. В пределах N-концевого участка не удается идентифицировать ни одного известного РНК-связывающего мотива, и эта область преимущественно связывается с поли(G), подобно первым доменам KH. Связывание РНК С-концом, содержащим RGG-бокс, кажется неспецифическим, поскольку оно распознает основания с сопоставимой аффинностью (64). На основании этих данных было высказано предположение, что FMRP является белком с множественными сайтами взаимодействия с РНК: специфичность последовательности, скорее всего, достигается за счет всего блока, который компрометирует первые ∼400 остатков, тогда как С-конец обеспечивает неспецифический связующая поверхность (64). Кристаллическая структура полноразмерного FMRP в конечном итоге решит этот вопрос.
Связывание РНК С-концом, содержащим RGG-бокс, кажется неспецифическим, поскольку оно распознает основания с сопоставимой аффинностью (64). На основании этих данных было высказано предположение, что FMRP является белком с множественными сайтами взаимодействия с РНК: специфичность последовательности, скорее всего, достигается за счет всего блока, который компрометирует первые ∼400 остатков, тогда как С-конец обеспечивает неспецифический связующая поверхность (64). Кристаллическая структура полноразмерного FMRP в конечном итоге решит этот вопрос.
Также было показано, что FMRP связывается с активно транслируемыми полирибосомами РНК-зависимым образом через частицы матричного рибонуклеопротеина (mRNP) (65,66). Во-первых, ассоциация FMRP-рибосом чувствительна к низким уровням РНКазы, которая удаляет мРНК, связывающую транслирующиеся полирибосомы, не нарушая сборки рибосом (65-67). Во-вторых, обработка ЭДТА, которая диссоциирует рибосомы на субъединицы, высвобождает FMRP в комплексы с диапазоном размеров, близким к крупной мРНП-частице, которая составляет около 660 кДа (67, 68).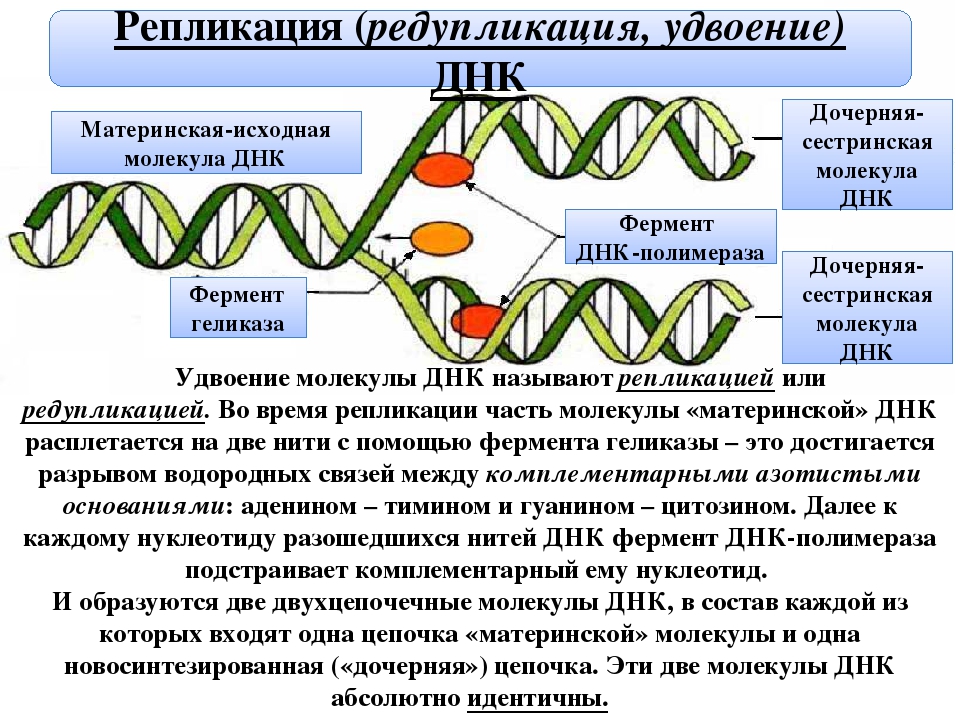 Однако в клетках с мутантным I304N FMRP, несмотря на нормальную экспрессию и ассоциацию с цитоплазматической РНК, частицы mRNP имеют меньший размер и не ассоциируют с активно транслирующими полирибосомами (68). В-третьих, почти все цитоплазматические FMRP могут быть захвачены совместно с поли(А) РНК (65,68). В совокупности эти данные свидетельствуют о том, что FMRP связывается с рибосомами как компонент частиц мРНП. Учитывая тяжелый фенотип пациентов с точечными мутациями, ассоциация FMRP с полирибосомами должна иметь функциональное значение.Недавние исследования показывают, что FMRP может образовывать димеры, а белки точечной мутации этого не делают, что позволяет предположить, что димеризация может иметь решающее значение для ассоциации FMRP с полирибосомами (D.M. Absher and S.T. Warren, рукопись в процессе подготовки). Белки, входящие в состав мРНП, содержащих FMRP, остаются в значительной степени неизвестными. Недавно была разработана система культивирования клеток, экспрессирующая меченный эпитопом FMRP.
Однако в клетках с мутантным I304N FMRP, несмотря на нормальную экспрессию и ассоциацию с цитоплазматической РНК, частицы mRNP имеют меньший размер и не ассоциируют с активно транслирующими полирибосомами (68). В-третьих, почти все цитоплазматические FMRP могут быть захвачены совместно с поли(А) РНК (65,68). В совокупности эти данные свидетельствуют о том, что FMRP связывается с рибосомами как компонент частиц мРНП. Учитывая тяжелый фенотип пациентов с точечными мутациями, ассоциация FMRP с полирибосомами должна иметь функциональное значение.Недавние исследования показывают, что FMRP может образовывать димеры, а белки точечной мутации этого не делают, что позволяет предположить, что димеризация может иметь решающее значение для ассоциации FMRP с полирибосомами (D.M. Absher and S.T. Warren, рукопись в процессе подготовки). Белки, входящие в состав мРНП, содержащих FMRP, остаются в значительной степени неизвестными. Недавно была разработана система культивирования клеток, экспрессирующая меченный эпитопом FMRP. Показано, что с помощью иммунопреципитации по крайней мере шесть других белков образуют частицы mRNP вместе с FMRP (69).Двумя из этих белков являются FXR1P и FXR2P, что согласуется с предыдущими выводами (60). Кроме того, нуклеолин, известный компонент других мРНП, также присутствует в частицах мРНП, содержащих FMRP (69,70). Идентификация остальных ассоциированных белков будет важна для анализа функции (функций) FMRP. Наблюдение, что FMRP ассоциирован с полирибосомами, предполагает, что FMRP может модулировать трансляцию мРНК и влиять на нестабильность мРНК in vivo . Действительно, недавние исследования показали, что FMRP может подавлять трансляцию связанных сообщений в анализе трансляции in vitro (Z.Ли и Ю. Фэн, рукопись в процессе подготовки).
Показано, что с помощью иммунопреципитации по крайней мере шесть других белков образуют частицы mRNP вместе с FMRP (69).Двумя из этих белков являются FXR1P и FXR2P, что согласуется с предыдущими выводами (60). Кроме того, нуклеолин, известный компонент других мРНП, также присутствует в частицах мРНП, содержащих FMRP (69,70). Идентификация остальных ассоциированных белков будет важна для анализа функции (функций) FMRP. Наблюдение, что FMRP ассоциирован с полирибосомами, предполагает, что FMRP может модулировать трансляцию мРНК и влиять на нестабильность мРНК in vivo . Действительно, недавние исследования показали, что FMRP может подавлять трансляцию связанных сообщений в анализе трансляции in vitro (Z.Ли и Ю. Фэн, рукопись в процессе подготовки).
Хотя FMRP преимущественно локализуется в цитоплазме, как функциональный сигнал ядерной локализации (NLS), так и сигнал ядерного экспорта (NES) были идентифицированы в FMRP с использованием конструкций делеции FMRP (67).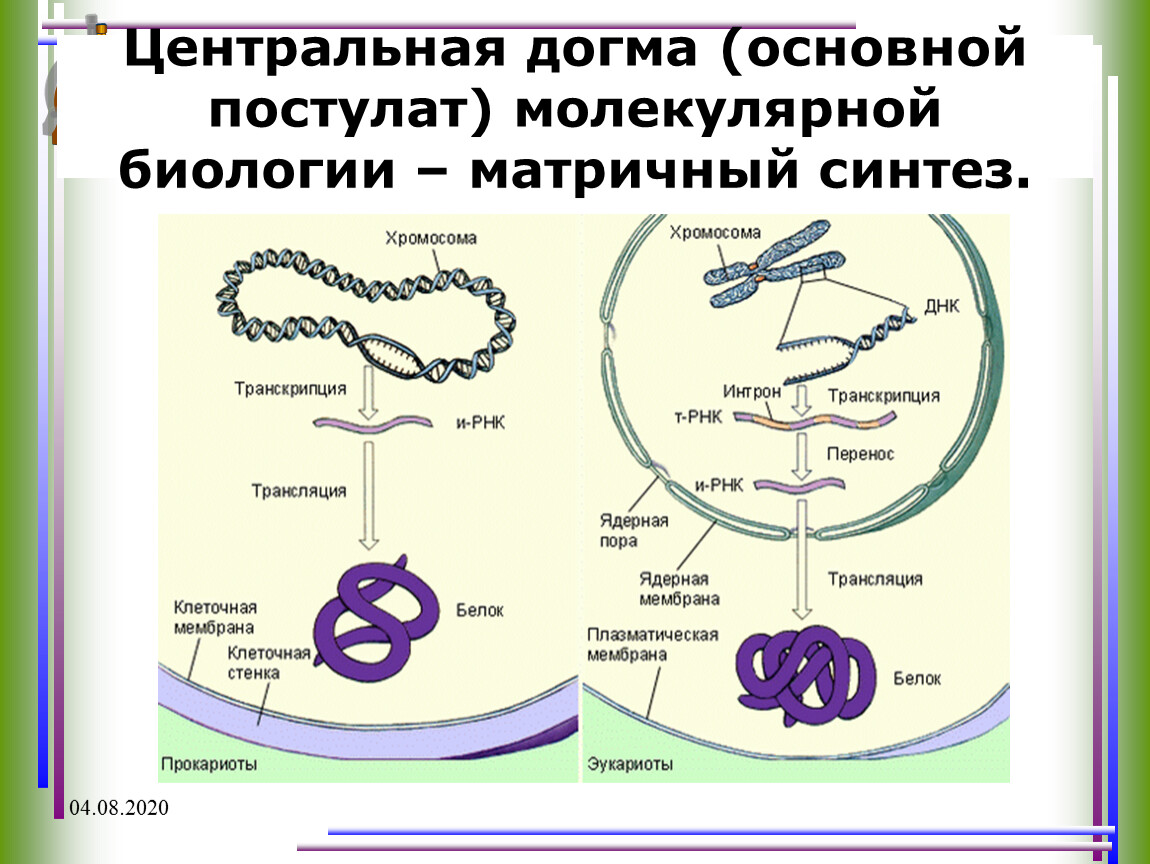 В то время как NLS расположен на N-конце FMRP, NES FMRP, кодируемый экзоном 14, очень похож на мотивы NES, описанные для HIV-1 Rev и ингибитора протеинкиназы (PKI), и достаточен для прямого ядерного экспорта микроинъецированного вируса. белковый конъюгат (67).Присутствие этих сигналов локализации указывает на то, что FMRP может перемещаться между ядром и цитоплазмой. Электронная микроскопия Immunogold показала, что FMRP существует в ядре и наблюдается при прохождении через ядерную пору (71). На основании этих наблюдений было предположено, что FMRP играет роль в специфическом экспорте мРНК из ядра в цитоплазму (67). Зарождающийся FMRP проникает в ядро и там собирается в mRNP, взаимодействуя со специфическими транскриптами РНК и другими белками.Частицы mRNP, содержащие FMRP и его РНК-мишень, будут транспортироваться в цитоплазму. В качестве альтернативы также была выдвинута гипотеза о возможной роли в модуляции локализации, стабильности и/или трансляции его мРНК-мишени. Недавно было показано, что FMRP является фосфопротеином и субстратом нерецепторной тирозинкиназы Fes (72).
В то время как NLS расположен на N-конце FMRP, NES FMRP, кодируемый экзоном 14, очень похож на мотивы NES, описанные для HIV-1 Rev и ингибитора протеинкиназы (PKI), и достаточен для прямого ядерного экспорта микроинъецированного вируса. белковый конъюгат (67).Присутствие этих сигналов локализации указывает на то, что FMRP может перемещаться между ядром и цитоплазмой. Электронная микроскопия Immunogold показала, что FMRP существует в ядре и наблюдается при прохождении через ядерную пору (71). На основании этих наблюдений было предположено, что FMRP играет роль в специфическом экспорте мРНК из ядра в цитоплазму (67). Зарождающийся FMRP проникает в ядро и там собирается в mRNP, взаимодействуя со специфическими транскриптами РНК и другими белками.Частицы mRNP, содержащие FMRP и его РНК-мишень, будут транспортироваться в цитоплазму. В качестве альтернативы также была выдвинута гипотеза о возможной роли в модуляции локализации, стабильности и/или трансляции его мРНК-мишени. Недавно было показано, что FMRP является фосфопротеином и субстратом нерецепторной тирозинкиназы Fes (72).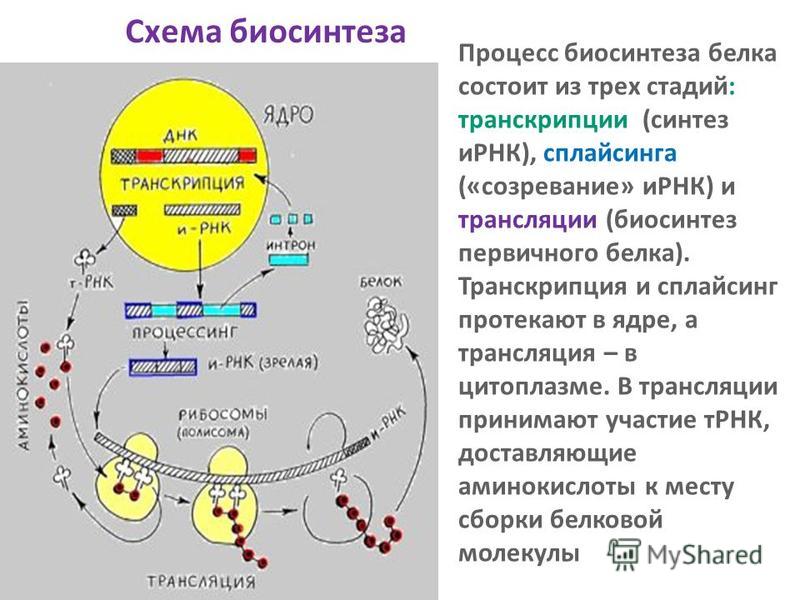 Интересно, что фосфорилированный по тирозину FMRP в основном расположен в ядре. Значение статуса фосфорилирования FMRP в челноке между ядром и цитоплазмой в настоящее время неясно, но предполагает регуляцию с помощью передачи сигнала.Два гомолога FMRP, FXR1P и FXR2P, также содержат сигнальный мотив NLS и NES в том же положении, что и в FMRP. Хотя FXR2P имеет сходный сигнальный мотив с FMRP, было показано, что FMRP и FXR2P имеют различную ядерную локализацию (73). FMRP перемещается между цитоплазмой и нуклеоплазмой, тогда как FXR2P перемещается между цитоплазмой и ядрышком, что указывает на то, что они могут транспортировать разные РНК или выполнять разные физиологические функции (73). Эта идея дополнительно подтверждается идентификацией нового РНК-связывающего ядерного белка (NUFIP), который взаимодействует с FMRP.NUFIP взаимодействует только с FMRP, но не с FXR1P и FXR2P (70). Следовательно, возможно, что эти три гомологичных белка взаимодействуют с разными белками/участками внутри ядра и могут выполнять там специфические, а не перекрывающиеся функции, но, по-видимому, сливаются, по крайней мере частично, в цитоплазме, образуя общую частицу мРНП.
Интересно, что фосфорилированный по тирозину FMRP в основном расположен в ядре. Значение статуса фосфорилирования FMRP в челноке между ядром и цитоплазмой в настоящее время неясно, но предполагает регуляцию с помощью передачи сигнала.Два гомолога FMRP, FXR1P и FXR2P, также содержат сигнальный мотив NLS и NES в том же положении, что и в FMRP. Хотя FXR2P имеет сходный сигнальный мотив с FMRP, было показано, что FMRP и FXR2P имеют различную ядерную локализацию (73). FMRP перемещается между цитоплазмой и нуклеоплазмой, тогда как FXR2P перемещается между цитоплазмой и ядрышком, что указывает на то, что они могут транспортировать разные РНК или выполнять разные физиологические функции (73). Эта идея дополнительно подтверждается идентификацией нового РНК-связывающего ядерного белка (NUFIP), который взаимодействует с FMRP.NUFIP взаимодействует только с FMRP, но не с FXR1P и FXR2P (70). Следовательно, возможно, что эти три гомологичных белка взаимодействуют с разными белками/участками внутри ядра и могут выполнять там специфические, а не перекрывающиеся функции, но, по-видимому, сливаются, по крайней мере частично, в цитоплазме, образуя общую частицу мРНП.
Поскольку первичный фенотип синдрома ломкой Х-хромосомы, умственная отсталость, возникает в ЦНС, возникает вопрос, какова функция FMRP в ЦНС или как отсутствие FMRP приводит к когнитивному дефициту.На основании вышеизложенного была выдвинута гипотеза, что в нейронах FMRP может играть роль в транспорте своих мРНК-мишеней из ядра в цитоплазму, модулировать локализацию этих мРНК и далее регулировать локальный синтез белка, входя в состав полирибосом, которые будет иметь важное значение для нормального развития и функций нейронов (рис. 2). Несколько наблюдений подтверждают эту идею. Во-первых, исследования с использованием иммунозолота показали, что FMRP локализуется в нуклеоплазме нейронов и внутри ядерной поры, что свидетельствует о том, что FMRP действительно участвует в ядерном экспорте мРНК в нейроне (71).Во-вторых, ультраструктурные исследования мозга крыс выявили высокие уровни иммунореактивности FMRP в перикарионах нейронов, где они концентрируются в областях, богатых рибосомами, в частности вблизи или между цистернами шероховатого эндоплазматического ретикулума (71). Более того, FMRP также наблюдался в дендритах большого и малого калибра, в дендритных точках ветвления, в местах отхождения шеек шипов и в головках шипов, во всех известных местах нейрональных полирибосом (71). В-третьих, FMRP может совместно фракционироваться с синаптосомными рибосомами, что указывает на то, что FMRP может регулировать локальный белковый синтез синаптосом (71).Регуляция синтеза белка внутри дендритного шипа важна для развития синапсов и пластичности мозга (74-77). В соответствии с этой идеей, аномальные дендритные шипы наблюдались как в мозге хрупких пациентов с X, так и у мышей с нокаутом FMR1 (78,79). Это говорит о том, что у большинства пациентов с ломкой Х-хромосомой из-за отсутствия FMRP синтез белка неправильно регулируется во время развития синапса, что может привести к умственной отсталости. У пациента с точечной мутацией (I304N) FMRP не мог димеризоваться, а мРНП, содержащие FMRP, не могли связываться с полирибосомой, что может изолировать мРНК, связанную с FMRP, от трансляции, что приводило к необычно тяжелому фенотипу (68) (рис.
Более того, FMRP также наблюдался в дендритах большого и малого калибра, в дендритных точках ветвления, в местах отхождения шеек шипов и в головках шипов, во всех известных местах нейрональных полирибосом (71). В-третьих, FMRP может совместно фракционироваться с синаптосомными рибосомами, что указывает на то, что FMRP может регулировать локальный белковый синтез синаптосом (71).Регуляция синтеза белка внутри дендритного шипа важна для развития синапсов и пластичности мозга (74-77). В соответствии с этой идеей, аномальные дендритные шипы наблюдались как в мозге хрупких пациентов с X, так и у мышей с нокаутом FMR1 (78,79). Это говорит о том, что у большинства пациентов с ломкой Х-хромосомой из-за отсутствия FMRP синтез белка неправильно регулируется во время развития синапса, что может привести к умственной отсталости. У пациента с точечной мутацией (I304N) FMRP не мог димеризоваться, а мРНП, содержащие FMRP, не могли связываться с полирибосомой, что может изолировать мРНК, связанную с FMRP, от трансляции, что приводило к необычно тяжелому фенотипу (68) (рис. .2). Регуляция синтеза белка, зависящего от синаптической активности, с помощью FMRP дополнительно подтверждается наблюдением, что трансляция FMRP увеличивалась в синаптонейросомах крыс после стимуляции специфическим агонистом mGluR (80). Для дальнейшего понимания нейронных функций FMRP важна животная модель. Однако в настоящее время единственной доступной животной моделью является мышь с нокаутом FMR1 , чьи поведенческие аномалии чрезвычайно малозаметны, что ограничивает широкое распространение анализа (81; A.М. Пейер и Д.Л. Нельсон, представленный для публикации). Разработка новых моделей животных, включая мышей с регулируемой экспрессией FMRP, будет очень полезна для анализа роли (ролей) FMRP во время развития нейронов и образования синапсов.
.2). Регуляция синтеза белка, зависящего от синаптической активности, с помощью FMRP дополнительно подтверждается наблюдением, что трансляция FMRP увеличивалась в синаптонейросомах крыс после стимуляции специфическим агонистом mGluR (80). Для дальнейшего понимания нейронных функций FMRP важна животная модель. Однако в настоящее время единственной доступной животной моделью является мышь с нокаутом FMR1 , чьи поведенческие аномалии чрезвычайно малозаметны, что ограничивает широкое распространение анализа (81; A.М. Пейер и Д.Л. Нельсон, представленный для публикации). Разработка новых моделей животных, включая мышей с регулируемой экспрессией FMRP, будет очень полезна для анализа роли (ролей) FMRP во время развития нейронов и образования синапсов.
ЗАКЛЮЧЕНИЕ
С момента открытия в 1991 г. гена FMR1 и молекулярной основы этого расстройства о синдроме ломкой Х-хромосомы стало известно многое. Однако остается много вопросов. Хотя экспансия повторов CGG, по-видимому, происходит во время мейоза или раннего эмбрионального развития, точное время этой экспансии еще предстоит определить.Разработка моделей животных, которые демонстрируют подобную нестабильность повторов CGG во время передачи через поколения, будет иметь решающее значение для понимания молекулярного механизма экспансии повторов CGG, который остается очень неуловимым. Эти исследования не только помогут нам понять синдром ломкой Х-хромосомы, но также будут важны для понимания молекулярной основы, по крайней мере, еще 12 заболеваний человека с аналогичной динамической мутацией, экспансией тринуклеотидных повторов. С другой стороны, физиологические функции FMRP широко изучаются, чтобы выяснить, как отсутствие FMRP приводит к клиническому фенотипу синдрома ломкой Х-хромосомы.Чтобы окончательно ответить на этот вопрос и разработать эффективное вмешательство при синдроме ломкой Х-хромосомы, необходимо объединить как молекулярно-генетические, так и нейробиологические подходы, чтобы приблизить молекулярные аномалии к нейроповеденческим фенотипам.
Хотя экспансия повторов CGG, по-видимому, происходит во время мейоза или раннего эмбрионального развития, точное время этой экспансии еще предстоит определить.Разработка моделей животных, которые демонстрируют подобную нестабильность повторов CGG во время передачи через поколения, будет иметь решающее значение для понимания молекулярного механизма экспансии повторов CGG, который остается очень неуловимым. Эти исследования не только помогут нам понять синдром ломкой Х-хромосомы, но также будут важны для понимания молекулярной основы, по крайней мере, еще 12 заболеваний человека с аналогичной динамической мутацией, экспансией тринуклеотидных повторов. С другой стороны, физиологические функции FMRP широко изучаются, чтобы выяснить, как отсутствие FMRP приводит к клиническому фенотипу синдрома ломкой Х-хромосомы.Чтобы окончательно ответить на этот вопрос и разработать эффективное вмешательство при синдроме ломкой Х-хромосомы, необходимо объединить как молекулярно-генетические, так и нейробиологические подходы, чтобы приблизить молекулярные аномалии к нейроповеденческим фенотипам. Должны быть разработаны новые модели животных и парадигмы тестирования поведения. Эти исследования также дадут нам представление о механизмах познания, памяти и поведения у человека. Более того, открытие тех генов, чьи мРНК взаимодействуют с FMRP, предоставит гены-кандидаты для других нарушений, ограничивающих развитие когнитивных функций.
Должны быть разработаны новые модели животных и парадигмы тестирования поведения. Эти исследования также дадут нам представление о механизмах познания, памяти и поведения у человека. Более того, открытие тех генов, чьи мРНК взаимодействуют с FMRP, предоставит гены-кандидаты для других нарушений, ограничивающих развитие когнитивных функций.
БЛАГОДАРНОСТИ
П.Дж. является партнером, а С.Т.В. является исследователем Медицинского института Говарда Хьюза. Эта работа частично поддерживается грантами NIH HD20521 и HD35576 для S.T.W.
Рис. 1. Механизм подавления транскрипции FMR1 посредством экспансии повторов CGG. Нормальная структура хроматина вокруг повторов CGG показана вверху рисунка. Расширенные повторы CGG (800) сначала метилируют (этап A).Затем белок метил-связывающего домена (MeCP2) будет связываться с гиперметилированными повторами CGG и образовывать комплекс с гистондеацетилазами (HDAC) через репрессор транскрипции (Sin3) (этап B). HDAC деацетилируют гистоны h4 и h5 хроматина вокруг повторов CGG (этап C). Деацетилирование гистонов приводит к ремоделированию хроматина (конденсации хроматина) и репрессии транскрипции, предположительно за счет исключения активатора (шаг D).
HDAC деацетилируют гистоны h4 и h5 хроматина вокруг повторов CGG (этап C). Деацетилирование гистонов приводит к ремоделированию хроматина (конденсации хроматина) и репрессии транскрипции, предположительно за счет исключения активатора (шаг D).
Рис. 1. Механизм подавления транскрипции FMR1 посредством экспансии повторов CGG.Нормальная структура хроматина вокруг повторов CGG показана вверху рисунка. Расширенные повторы CGG (800) сначала метилируют (этап A). Затем белок метил-связывающего домена (MeCP2) будет связываться с гиперметилированными повторами CGG и образовывать комплекс с гистондеацетилазами (HDAC) через репрессор транскрипции (Sin3) (этап B). HDAC деацетилируют гистоны h4 и h5 хроматина вокруг повторов CGG (этап C). Деацетилирование гистонов приводит к ремоделированию хроматина (конденсации хроматина) и репрессии транскрипции, предположительно за счет исключения активатора (шаг D).
Рис. 2. Предполагаемая модель для функций FMRP. ( A ) У нормального человека образующиеся FMRP, димеризуясь в цитоплазме, проникают в ядро и там собираются в mRNP, взаимодействуя со специфическими транскриптами РНК и другими белками, некоторые из которых известны. Частицы мРНП, содержащие FMRP и его мРНК-мишень, будут транспортироваться в цитоплазму, а мРНП представлены рибосоме. В нейронах некоторые из этих FMRP-содержащих mRNP будут локализоваться в дендритах и участвовать в локальном синтезе белка.( B ) У большинства хрупких пациентов с Х без FMRP мРНК-мишени FMRP могут взаимодействовать с альтернативными мРНП, допуская частичную трансляцию, но аномальные в регуляции, локализации или количестве. ( C ) У пациента с точечной мутацией (I304N) FMRP не может димеризоваться в цитоплазме и образует частичный mRNP, который может быстро перемещаться между ядром и цитоплазмой. FMRP-содержащие mRNP теперь не могут связываться с полирибосомой, возможно, изолируя FMRP-связанную мРНК от трансляции, что приводит к необычно тяжелому фенотипу из-за подавления даже частичной трансляции.
( A ) У нормального человека образующиеся FMRP, димеризуясь в цитоплазме, проникают в ядро и там собираются в mRNP, взаимодействуя со специфическими транскриптами РНК и другими белками, некоторые из которых известны. Частицы мРНП, содержащие FMRP и его мРНК-мишень, будут транспортироваться в цитоплазму, а мРНП представлены рибосоме. В нейронах некоторые из этих FMRP-содержащих mRNP будут локализоваться в дендритах и участвовать в локальном синтезе белка.( B ) У большинства хрупких пациентов с Х без FMRP мРНК-мишени FMRP могут взаимодействовать с альтернативными мРНП, допуская частичную трансляцию, но аномальные в регуляции, локализации или количестве. ( C ) У пациента с точечной мутацией (I304N) FMRP не может димеризоваться в цитоплазме и образует частичный mRNP, который может быстро перемещаться между ядром и цитоплазмой. FMRP-содержащие mRNP теперь не могут связываться с полирибосомой, возможно, изолируя FMRP-связанную мРНК от трансляции, что приводит к необычно тяжелому фенотипу из-за подавления даже частичной трансляции.
Рис. 2. Предполагаемая модель для функции(й) FMRP. ( A ) У нормального человека образующиеся FMRP, димеризуясь в цитоплазме, проникают в ядро и там собираются в mRNP, взаимодействуя со специфическими транскриптами РНК и другими белками, некоторые из которых известны. Частицы мРНП, содержащие FMRP и его мРНК-мишень, будут транспортироваться в цитоплазму, а мРНП представлены рибосоме. В нейронах некоторые из этих FMRP-содержащих mRNP будут локализоваться в дендритах и участвовать в локальном синтезе белка.( B ) У большинства хрупких пациентов с Х без FMRP мРНК-мишени FMRP могут взаимодействовать с альтернативными мРНП, допуская частичную трансляцию, но аномальные в регуляции, локализации или количестве. ( C ) У пациента с точечной мутацией (I304N) FMRP не может димеризоваться в цитоплазме и образует частичный mRNP, который может быстро перемещаться между ядром и цитоплазмой. FMRP-содержащие mRNP теперь не могут связываться с полирибосомой, возможно, изолируя FMRP-связанную мРНК от трансляции, что приводит к необычно тяжелому фенотипу из-за подавления даже частичной трансляции.
Каталожные номера
1 Уоррен, С.Т. и Шерман, С.Л. (
2000
) Синдром ломкой Х-хромосомы. В Scriver, C.R., Beaudet, A.L., Sly, W.S. и Валле, Д. (ред.), Метаболические и молекулярные основы наследственных заболеваний , 8-е изд. McGraw-Hill, Нью-Йорк, штат Нью-Йорк, в печати.2 Уоррен, С.Т. и Нельсон, Д.Л. (
1994
) Достижения в области молекулярного анализа синдрома ломкой Х-хромосомы.Дж. Ам. Мед. доц.
,271
,536
–542.3 Кремер, Э.Дж., Причард, М., Линч, М., Ю, С., Холман, К., Бейкер, Э., Уоррен, С.Т., Шлезингер, Д., Сазерленд, Г.Р. и Ричардс, Р.И. (
1991
) Картирование нестабильности ДНК в ломкой X-цепочке с последовательностью тринуклеотидных повторов p(CCG)n.Наука
,252
,1711
–1714. 4 Ю. С., Причард М., Кремер Э., Линч М., Нанкарроу Дж., Бейкер Э., Холман К., Малли Дж. К., Уоррен С. Т., Шлезингер Д. и др.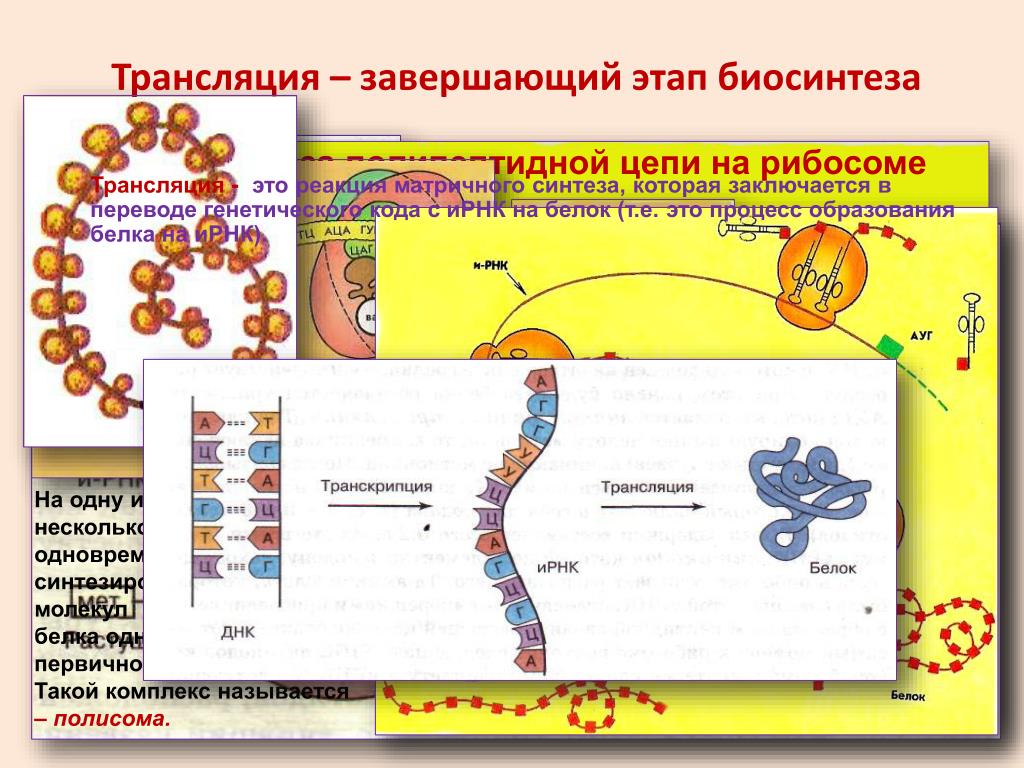 др. (
др. (
1991
) Хрупкий генотип X характеризуется нестабильной областью ДНК.Наука
,252
,1179
–1181.5 Веркерк А.Дж., Пьеретти М., Сатклифф Дж.С., Фу Ю.Х., Куль Д.П., Пиццути А., Райнер О., Ричардс С., Виктория М.Ф., Чжан Ф.П. и другие. (
1991
) Идентификация гена (FMR-1), содержащего повтор CGG, совпадающий с кластерной областью точки разрыва, демонстрирующей вариацию длины при синдроме ломкой Х-хромосомы.Сотовый
,65
,905
–914.6 Оберле, И., Руссо Ф., Хейтц Д., Кретц К., Девис Д., Ханауэр А., Боуэ Дж., Бертеас М.Ф. и Mandel, JL (
1991
) Нестабильность сегмента ДНК из 550 пар оснований и аномальное метилирование при синдроме ломкой Х-хромосомы.Наука
,252
,1097
–1102.7 Эшли, К.Т., Сатклифф, Дж.С., Кунст, К.Б., Лейнер, Х.А., Эйхлер, Э.Е., Нельсон, Д.Л. и Уоррен, С.Т. (
1993
) FMR-1 человека и мыши: альтернативный сплайсинг и инициация трансляции после CGG-повтора.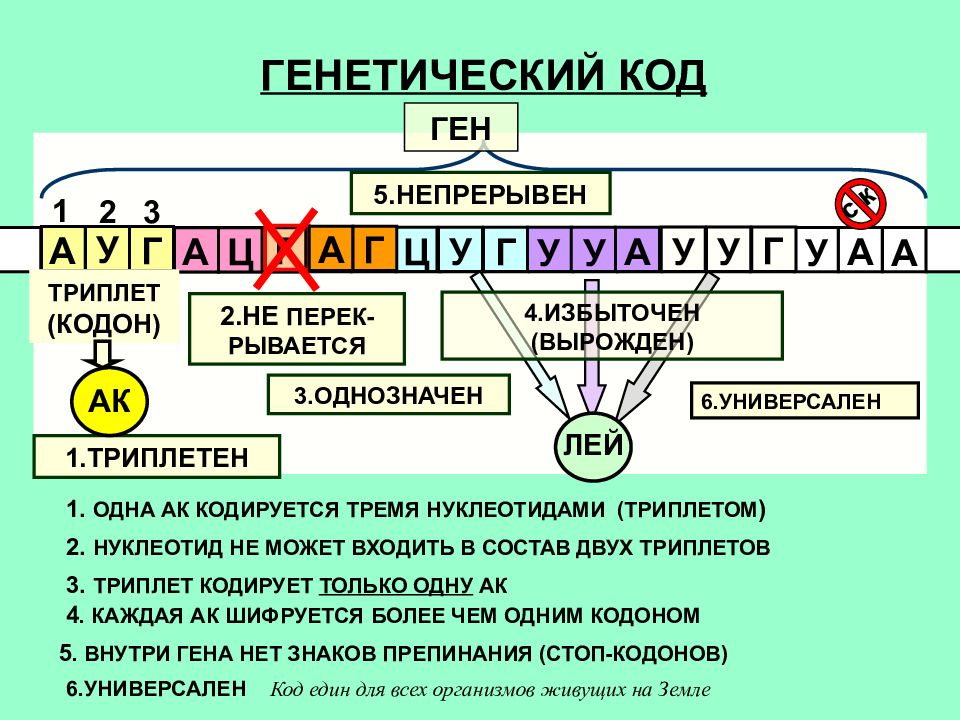
Природа Ген.
,4
,244
–251.8 Эйхлер Э.Э., Ричардс С., Гиббс Р.А. и Нельсон, Д.Л. (
1993
) Тонкая структура человеческого гена FMR1 .Гум. Мол. Жене.
,2
,1147
–1153. [Ошибка (1994
)Гум. Мол. Жене.
,3
,684
–685.]9 Фу, Ю.Х., Куль, Д.П., Пиццути, А., Пьеретти, М., Сатклифф, Дж.С., Ричардс, С., Веркерк, А.Дж., Холден, Дж.Дж., Фенвик-младший, Р.Г., Уоррен, С.Т. и другие. (
1991
) Изменение повтора CGG в ломком сайте X приводит к генетической нестабильности: разрешение парадокса Шермана.Сотовый
,67
,1047
–1058.10 Эйхлер Э.Э., Холден Дж.Дж., Попович Б.В., Рейсс А.Л., Сноу К., Тибодо С.Н., Ричардс К.С., Уорд П.А. и Нельсон, Д.Л. (
1994
) Длина непрерывных повторов CGG определяет нестабильность в гене FMR1 .Природа Ген.
,8
,88
–94. 11 Кунст, С. Б. и Уоррен, С. Т. (
Б. и Уоррен, С. Т. (
1994
) Скрытые и полярные вариации ломкого повтора X могут привести к предрасположенности к нормальным аллелям.Сотовый
,77
,853
–861.12 Сноу К., Доуд Л.К., Хагерман Р., Перголицци Р.Г., Эрстер С.Х. и Тибодо, С.Н. (
1993
) Анализ последовательности CGG в локусе FMR-1 в хрупких семьях X и в общей популяции.Ам. Дж. Хам. Жене.
,53
,1217
–1228.13 Сноу, К., Тестер, Д.Дж., Крукеберг, К.Е., Шайд, Д.Дж. и Тибодо, С.Н. (
1994
) Анализ последовательности ломкого тринуклеотидного повтора X: последствия для происхождения ломкой мутации X.Гум. Мол. Жене.
,3
,1543
–1551.14 Фэн Ю., Лаккис Л., Дэвис Д. и Уоррен С.Т. (
1995
) Количественное сравнение экспрессии генов FMR1 в нормальных и премутационных аллелях.Ам. Дж. Хам. Жене.
,56
,106
–113. 15 Де Буль, К. , Веркерк, А.Дж., Ренье, Э., Витс, Л., Хендрикс, Дж., Ван Рой, Б., Ван ден Бос, Ф., де Грааф, Э., Оостра, Б.А. и Виллемс, П. Дж. (
, Веркерк, А.Дж., Ренье, Э., Витс, Л., Хендрикс, Дж., Ван Рой, Б., Ван ден Бос, Ф., де Грааф, Э., Оостра, Б.А. и Виллемс, П. Дж. (
1993
) Точечная мутация в гене FMR -1, связанная с ломкой умственной отсталостью X.Природа Ген.
,3
,31
–35.16 Ворле Д., Коцот Д., Херст М.С., Манка А., Корн Б., Шмидт А., Барби Г., Ротт Х.Д., Пустка А., Дэвис К.Е. и Steinbach, P. (
1992
). Микроделеция менее 250 т.п.н., включая проксимальную часть гена FMR-I и участок ломкой-X, у мужчины с клиническим фенотипом синдрома ломкой-X.Ам. Дж. Хам. Жене.
,51
,299
–306.17 Хайндс, Х.Л., Эшли, К.Т., Сатклифф, Дж.С., Нельсон, Д.Л., Уоррен, С.Т., Хаусман, Д.Е. и Schalling, M. (
1993
). Тканеспецифическая экспрессия FMR-1 свидетельствует о функциональной роли синдрома ломкой Х-хромосомы.Природа Ген.
,3
,36
–43. [Ошибки (1993
) Nature Genet.
5
,312
.]18 Ханджян Э.В., Фортин А., Тибодо А., Тремблей С., Кот Ф., Девис Д., Мандель Дж.Л. и Руссо Ф. (
1995
) Гетерогенный набор белков FMR1 широко распространен в тканях мыши и модулируется в клеточной культуре.Гум. Мол. Жене.
,4
,783
–789.19 Verheij, C., de Graaff, E., Bakker, C.E., Willemsen, R., Willems, P.J., Meijer, N., Galjaard, H., Reuser, A.J., Oostra, B.A. и Хогевен, А.Т. (
1995
) Характеристика белков FMR1, выделенных из различных тканей.Гум. Мол. Жене.
,4
,895
–901.20 Эшли-младший, К.Т., Уилкинсон, К.Д., Рейнс, Д. и Уоррен, С.Т. (
1993
) Белок FMR1: консервативные домены семейства RNP и селективное связывание РНК.Наука
,262
,563
–566.21 Siomi, H., Siomi, M.C., Nussbaum, R.L. и Dreyfuss, G. (
1993
) Белковый продукт ломкого гена X, FMR1 , имеет характеристики РНК-связывающего белка.
Сотовый
,74
,291
–298.22 Голландско-бельгийский консорциум Fragile X (
1994
) Мыши с нокаутом Fmr1 : модель для изучения умственной отсталости Fragile X.Сотовый
,78
,23
–33.23 Zhong, N., Yang, W., Dobkin, C. и Brown, W. T. (
1995
) Нестабильность хрупкого гена X: закрепление AGG и связанных микросателлитов.Ам. Дж. Хам. Жене.
,57
,351
–361.24 Шерман, С.Л., Мортон, Н.Е., Джейкобс, П.А. и Тернер Г. (
1984
) Синдром маркера (X): цитогенетический и генетический анализ.Энн. Гум. Жене.
,48
,21
–37.25 Шерман С.Л., Джейкобс П.А., Мортон Н.Е., Фростер-Искениус У., Ховард-Пиблз П.Н., Нильсен К.Б., Партингтон М.В., Сазерленд Г.Р., Тернер Г. и Уотсон М. (
1985
) Дальнейший сегрегационный анализ синдрома ломкой Х-хромосомы с особым упором на передающих мужчин. Гум. Жене.
69
,289
–299.26 Ренье, Э., Витс, Л., Де Буль, К., Ван Рой, Б., Ван Вельзен, Д., де Грааф, Э., Веркерк, А.Дж., Йоренс, Х.З., Дарби Дж. К., Оостра Б. и Виллемс П. Дж. (
1993
) Полная мутация гена FMR-1 у мужчин с хрупкой Х-хромосомой отсутствует в их сперме.Природа Ген.
,4
,143
–146.27 Фэн Ю., Чжан Ф., Локи Л.К., Честейн Дж.Л., Лаккис Л., Эберхарт Д. и Уоррен С.Т. (
1995
) Подавление трансляции за счет экспансии тринуклеотидных повторов в FMR1.Наука
,268
,731
–734.28 Devys, D., Biancalana, V., Rousseau, F., Boue, J., Mandel, JL и Oberle, I. (
1992
) Анализ полных ломких X мутаций в тканях плода и монозиготных близнецов показывает, что аномальное метилирование и соматическая гетерогенность устанавливаются на ранних стадиях развития.Ам. Дж. Мед. Жене.
,43
,208
–216. 29 Ворле, Д., Херст, М.С., Кеннеркнехт, И.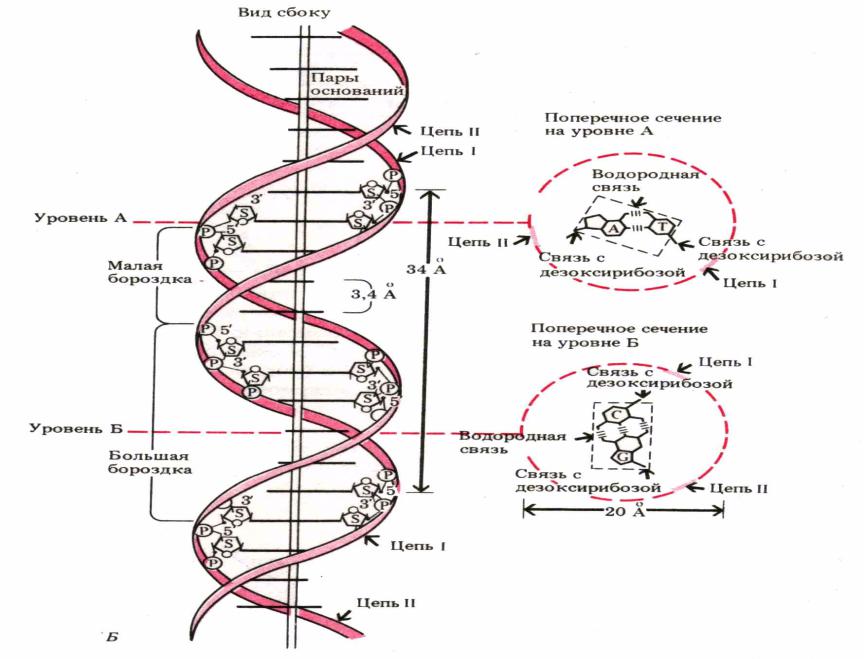 , Дэвис, К.Е. и Steinbach, P. (
, Дэвис, К.Е. и Steinbach, P. (
1992
) Мозаицизм генотипа в хрупких тканях плода X.Гум. Жене.
,89
,114
–146.30 Бурман Р.В., Попович Б.В., Джеки П.Б. и Теркер, М.С. (
1999
) Полностью расширенные повторы FMR1 CGG проявляют нестабильность, зависящую от длины и дифференцировки, в клеточных гибридах, которая не зависит от метилирования ДНК.Гум. Мол. Жене.
,8
,2293
–2302.31 Wohrle, D., Hennig, I., Vogel, W. и Steinbach, P. (
1993
) Митотическая стабильность ломких X-мутаций в дифференцированных клетках указывает на раннюю постконцептуальную экспансию тринуклеотидных повторов.Природа Ген.
,4
,140
–142.32 Малтер, Х.Е., Ибер, Дж.К., Виллемсен, Р., де Грааф, Э., Тарлтон, Дж.К., Лейсти, Дж., Уоррен, С.Т. и Оостра, Б.А. (
1997
) Характеристика полной мутации синдрома ломкой Х-хромосомы в гаметах плода. Природа Ген.
15
,165
–169.33 Ларсен, В. Дж. (
1993
) Эмбриология человека . Черчилль Ливингстон, Нью-Йорк, штат Нью-Йорк.34 Эйхлер Э.Э., Макферсон Дж.Н., Мюррей А., Джейкобс П.А., Чакраварти А. и Нельсон Д.Л. (
1996
) Анализ гаплотипов и вкраплений повтора FMR1 CGG идентифицирует два разных мутационных пути возникновения синдрома ломкой Х-хромосомы.Гум. Мол. Жене.
,5
,319
–330.35 Чанг, М.Ю., Ранум, Л.П., Дувик, Л.А., Сервадио, А., Зогби, Х.Ю. и Орр, Х.Т. (
1993
) Доказательства механизма, предрасполагающего к межпоколенческой нестабильности повторов CAG при спиноцеребеллярной атаксии I типа.Природа Ген.
,5
,254
–258.36 Горденин Д.А., Кункель Т.А. и Резник, Массачусетс (
1997
) Повторное расширение — все в лоскуте?Природа Ген.
,16
,116
–118. 37 Джонсон, Р.Е., Коввали, Г. К., Пракаш, Л. и Пракаш, С. (
К., Пракаш, Л. и Пракаш, С. (
1995
) Потребность дрожжевой экзонуклеазы RTh2 5′-3′ для стабильности простой повторяющейся ДНК.Наука
,269
,238
–240.38 Кокоска Р.Дж., Стефанович Л., Тран Х.Т., Резник М.А., Горденин Д.А. и Petes, T.D. (
1998
) Дестабилизация микро- и минисателлитных последовательностей ДНК дрожжей мутациями, влияющими на нуклеазу, участвующую в процессинге фрагментов Окадзаки (rad27), и ДНК-полимеразу дельта (pol3-t).Мол. Клетка. биол.
,18
,2779
–2788.39 Тишкофф Д.Х., Филози Н., Гайда Г.М. и Колоднер, Р. Д. (
1997
) Новый механизм предотвращения мутаций, зависящий от S.cerevisiae RAD27 отличается от репарации несоответствия ДНК.Сотовый
,88
,253
–263.40 Бамбара, Р.А., Муранте, Р.С. и Хенриксен, Л.А. (
1997
) Ферменты и реакции в эукариотической вилке репликации ДНК. J. Biol. хим.
хим.
272
,4647
–4650.41 Гейси А.М., Гоэллнер Г., Юраник Н., Макура С. и МакМюррей К.Т. (
1995
) Тринуклеотидные повторы , которые расширяются при заболеваниях человека , образуют шпильки in vitro .Сотовый
,81
,533
–540.42 Чен, X., Мариаппан, С.В., Катасти, П., Ратлифф, Р., Мойзис, Р.К., Лааюн, А., Смит, С.С., Брэдбери, Э.М. и Гупта, Г. (
1995
) Шпильки образованы одиночными цепями ДНК хрупких триплетных Х-повторов: структура и биологические последствия.Проц. Натл акад. науч. США
,92
,5199
–5203.43 Фройденрайх, С. Х., Ставенхаген, Дж. Б. и Закиан, В.A. (
1997
) Стабильность тринуклеотидного повтора CTG/CAG у дрожжей зависит от его ориентации в геноме.Мол. Клетка. биол.
,17
,2090
–2098.44 Уайт П.Дж., Бортс Р.Х. и Херст М.К. (
1999
) Стабильность матрицы триплетных повторов ломкого X (CGG)(n) человека в Saccharomyces cerevisiae , дефицитных по аспектам метаболизма ДНК.
Мол. Клетка. биол.
,19
,5675
–5684.45 Спиро, К., Пеллетье, Р., Рольфсмайер, М.Л., Диксон, М.Дж., Лахью, Р.С., Гупта, Г., Парк, М.С., Чен, X., Мариаппан, С.В.С. и МакМюррей, К.Т. (
1999
) Ингибирование процессинга FEN-1 вторичной структурой ДНК в тринуклеотидных повторах.Мол. Сотовый
,4
,1079
–1085.46 Parniewski, P., Bacolla, A., Jaworski, A. and Wells, RD (
1999
) Эксцизионная репарация нуклеотидов влияет на стабильность длинных транскрибируемых (CTG*CAG) путей в зависимости от ориентации у Escherichia палочка .Нуклеиновые Кислоты Рез.
,27
,616
–623.47 Lyons-Darden, T. and Topal, M.D. (
1999
) Абазические сайты индуцируют экспансию триплетных повторов во время репликации ДНК in vitro .J. Biol. хим.
,274
,25975
–25978. 48 Lavedan, C., Grabczyk, E., Usdin, K. and Nussbaum, R.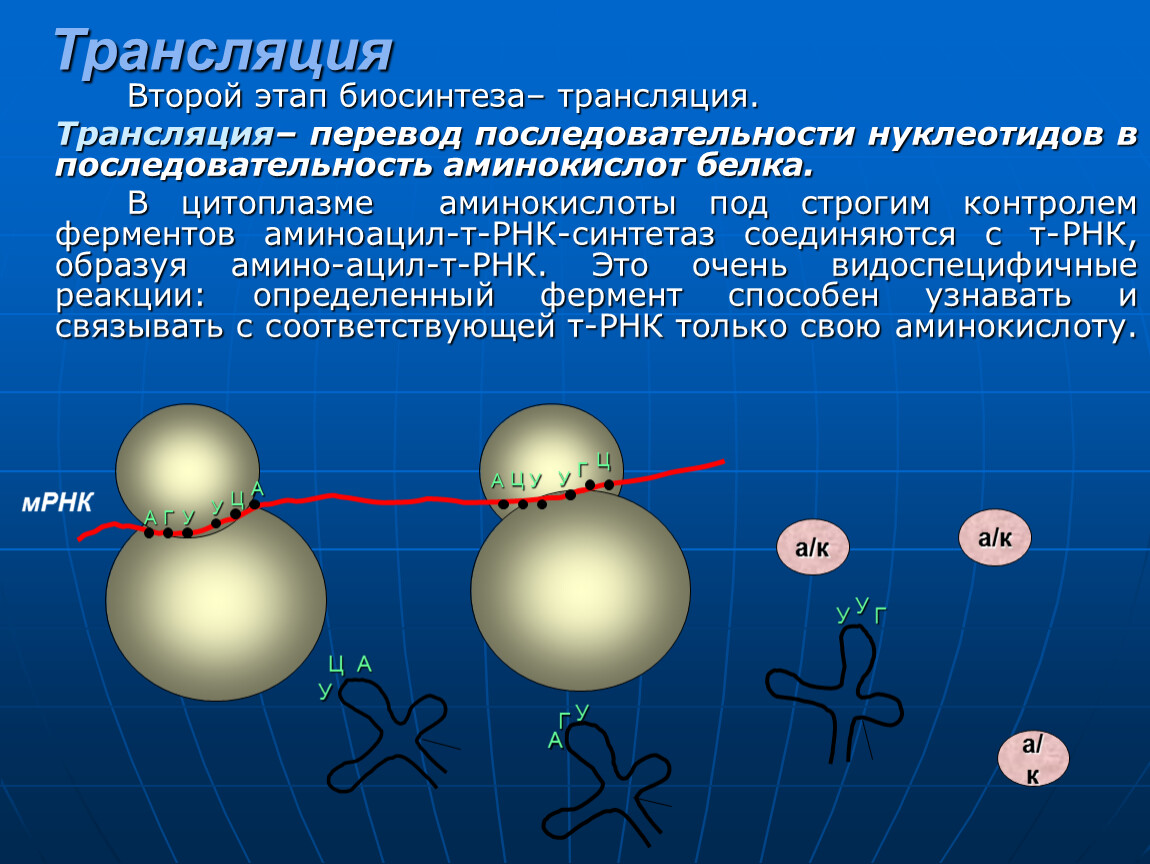 L. (
L. (
1998
) Длинные непрерывающиеся повторы CGG в пределах первого экзона человеческого гена FMR1 не являются по своей природе нестабильными у трансгенных мышей.Геномика
,50
,229
–240.49 Bontekoe, C.J., de Graaff, E., Nieuwenhuizen, I.M., Willemsen, R. and Oostra, B.A. (
1997
) FMR1 Премутационный аллель (CGG) 81 стабилен у мышей.Евро. Дж. Хам. Жене.
,5
,293
–298.50 Брок Г.Дж., Андерсон Н.Х. и Монктон Д.Г. (
1999
) Cis -действующие модификаторы расширенной повторяемости триплетов CAG/CTG: ассоциации с фланкирующим содержанием GC и близостью к островкам CpG.Гум. Мол. Жене.
,8
,1061
–1067.51 де Врис, Б.Б., Галлей, Д.Дж., Оостра, Б.А. и Нирмейер, М.Ф. (
1998
) Синдром ломкой Х-хромосомы.J. Med. Жене.
,35
,579
–589. 52 Okano, M. , Xie, S. и Li, E. (
, Xie, S. и Li, E. (
1998
) Клонирование и характеристика семейства новых ДНК (цитозин-5) метилтрансфераз млекопитающих.Природа Ген.
,19
,219
–220.53 Кофе Б., Чжан Ф., Уоррен С.Т. и Reines, D. (
1999
). Ацетилированные гистоны связаны с FMR1 в нормальных, но не хрупких клетках с Х-синдромом.Природа Ген.
,22
,98
–101. [Ошибки (1999
)Nature Genet.
,22
,209
.]54 Чиурацци, П., Помпони, М.Г., Виллемсен, Р., Оостра, Б.А. и Neri, G. (
1998
) In vitro Реактивация гена FMR1 , связанного с синдромом ломкой Х-хромосомы.Гум. Мол. Жене.
,7
,109
–113.55 Chiurazzi, P., Pomponi, M.G., Pietrobono, R., Bakker, C.E., Neri, G. and Oostra, B.A. (
1999
) Синергический эффект гиперацетилирования гистонов и деметилирования ДНК при реактивации гена FMR1 . Гум. Мол. Жене.
Мол. Жене.
8
,2317
–2323.56 Тассон Ф., Хагерман Р.Дж., Тейлор А.К., Гейн Л.В., Годфри Т.Е. и Хагерман, П.J. (
2000
) Повышенные уровни матричной РНК FMR1 у мужчин-носителей: новый механизм участия в синдроме ломкой Х-хромосомы.Ам. Дж. Хам. Жене.
,66
,6
–15.57 Муско, Г., Стиер, Г., Джозеф, К., Кастильоне Морелли, М.А., Нильджес, М., Гибсон, Т.Дж. и Пасторе, А. (
1996
) Трехмерная структура и стабильность домена KH: молекулярное понимание синдрома ломкой Х-хромосомы.Сотовый
,85
,237
–245.58 Siomi, H., Choi, M., Siomi, MC, Nussbaum, RL и Dreyfuss, G. (
1994
) Существенная роль доменов KH в связывании РНК: нарушение связывания РНК из-за мутации в домене KH FMR1 , который вызывает синдром ломкой Х-хромосомы.Сотовый
,77
,33
–39. 59 Siomi, M.C., Siomi, H., Sauer, W.H., Srinivasan, S., Nussbaum, R. L. и Dreyfuss, G. (
L. и Dreyfuss, G. (
1995
) FXR1, аутосомный гомолог хрупкого гена умственной отсталости X.EMBO J.
,14
,2401
–2408.60 Zhang, Y., O’Connor, JP, Siomi, MC, Srinivasan, S., Dutra, A., Nussbaum, RL и Dreyfuss, G. (
1995
) Белок хрупкого синдрома умственной отсталости X взаимодействует с новые гомологи FXR1 и FXR2.EMBO J.
,14
,5358
–5366.61 Хогевен, А.Т. и Оостра, Б.А. (
1997
) Синдром ломкой Х-хромосомы.Дж.Наследовать. Метаб. Дис.
,20
,139
–151.62 Ханджян, Э. В. (
1999
) Биология хрупкого белка умственной отсталости X, РНК-связывающего белка.Биохим. Клеточная биол.
,77
,331
–342.63 Браун В., Смолл К., Лаккис Л., Фэн Ю., Гюнтер К., Уилкинсон К.Д. и Уоррен, С.Т. (
1998
) Очищенный рекомбинантный Fmrp проявляет избирательное связывание РНК как внутреннее свойство хрупкого белка умственной отсталости X.
J. Biol. хим.
,273
,15521
–15527.64 Adinolfi, S., Bagni, C., Musco, G., Gibson, T., Mazzarella, L. and Pastore, A. (
1999
) Анализ FMR1, белка, ответственного за синдром ломкой Х-хромосомы, в его структурные и функциональные домены.РНК
,5
,1248
–1258.65 Corbin, F., Bouillon, M., Fortin, A., Morin, S., Rousseau, F. и Khandjian, EW (
1997
) Хрупкий белок умственной отсталости X связан с поли(А) + мРНК в активно транслирующих полирибосомах.Гум. Мол. Жене.
,6
,1465
–1472.66 Tamanini, F., Meijer, N., Verheij, C., Willems, P.J., Galjaard, H., Oostra, B.A. и Хогевен, А.Т. (
1996
) FMRP связан с рибосомами через РНК.Гум. Мол. Жене.
,5
,809
–813.67 Эберхарт, Д.Е., Малтер, Х.Е., Фэн, Ю. и Уоррен, С.Т. (
1996
) Хрупкий белок умственной отсталости X представляет собой рибонуклеопротеин, содержащий сигналы как ядерной локализации, так и ядерного экспорта.
Гум. Мол. Жене.
,5
,1083
–1091.68 Фэн Ю., Абшер Д., Эберхарт Д.Е., Браун В., Малтер Х.Е. и Уоррен, С.Т. (
1997
) FMRP связывается с полирибосомами как mRNP, а мутация I304N тяжелого синдрома ломкой Х-хромосомы отменяет эту связь.Мол. Сотовый
,1
,109
–118.69 Семан С., Браун В. и Уоррен С.Т. (
1999
) Выделение рибонуклеопротеиновой частицы, связанной с FMRP, и идентификация нуклеолина и хрупких X-родственных белков как компонентов комплекса.Мол. Клетка. биол.
,19
,7925
–7932.70 Bardoni, B., Schenck, A. and Mandel, J.L. (
1999
) Новый РНК-связывающий ядерный белок, взаимодействующий с хрупким белком умственной отсталости X ( FMR1 ).Гум. Мол. Жене.
,8
,2557
–2566.71 Фэн Ю., Гутекунст К.А., Эберхарт Д.Е., Йи Х., Уоррен С.Т. и Херш, С.М. (
1997
) Fragile X белок умственной отсталости: ядерно-цитоплазматический челнок и ассоциация с соматодендритными рибосомами.
J. Neurosci.
,17
,1539
–1547.72 ДиМарко, С.П., Семан, С., Торре, Э. и Уоррен, С.Т. (
1999
) FMRP представляет собой фосфопротеин и субстрат нерецепторной триозинкиназы Fes.Ам. Дж. Хам. Жене.
,65
(доп.),A269
.73 Таманини Ф., Бонтеку К., Баккер С.Е., ван Унен Л., Анар Б., Виллемсен Р., Йошида М., Гальярд Х., Оостра Б.А. и Хогевен, А.Т.(
1999
) Различные мишени для ломких Х-родственных белков, выявляемые их различной ядерной локализацией.Гум. Мол. Жене.
,8
,863
–869.74 Стюард О. и Фальк П.М. (
1986
) Механизм синтеза белков в постсинаптических участках во время синаптогенеза: количественное исследование связи между полирибосомами и развивающимися синапсами.J. Neurosci.
,6
,412
–423.75 Стюард О. и Ривз Т.М. (
1988
) Механизм синтеза белков под постсинаптическими участками нейронов ЦНС: ассоциация между полирибосомами и другими органеллами в синаптических участках./protein-synthesis-drawing-586040174-57f165975f9b586c3547af8d.jpg)
J. Neurosci.
,8
,176
–184.76 Miyashiro, K., Dichter, M. and Eberwine, J. (
1994
) О природе и дифференциальном распределении мРНК в нейритах гиппокампа: последствия для функционирования нейронов.Проц.Натл акад. науч. США
,91
,10800
–10804.77 Kang, H. and Schuman, E.M. (
1996
) Необходимость локального синтеза белка в нейротрофин-индуцированной синаптической пластичности гиппокампа.Наука
,273
,1402
–1406.78 Комери, Т.А., Харрис, Дж.Б., Виллемс, П.Дж., Оостра, Б.А., Ирвин, С.А., Вейлер, И.Дж. и Greenough, WT (
1997
) Аномальные дендритные шипы у хрупких мышей с нокаутом X: дефицит созревания и обрезки.Проц. Натл акад. науч. США
,94
,5401
–5404.79 Хинтон В.Дж., Браун В.Т., Вишневский К. и Руделли Р.Д. (
1991
) Анализ неокортекса у трех мужчин с синдромом ломкой Х-хромосомы.
утра. Дж. Мед. Жене.
,41
,289
–294.80 Weiler, IJ, Irwin, SA, Klintsova, AY, Spencer, CM, Brazelton, AD, Miyashiro, K., Comery, TA, Patel, B., Eberwine, J. and Greenough, WT (
1997
) Белок Fragile X умственной отсталости транслируется вблизи синапсов в ответ на активацию нейротрансмиттера.Проц. Натл акад. науч. США
,94
,5395
–5400.81 Паради В., Меликян Х.Е., Расмуссен Д.Л., Кеннесон А., Конн П.Дж. и Уоррен С.Т. (
1999
) Мышь Fragile X: эффекты напряжения нокаутного фенотипа и доказательства, свидетельствующие о недостаточной функции миндалевидного тела.Неврология
,94
,185
–192.Молекулярная основа распознавания ТРНК Увеловатор Комплекс
Saccharomyces Cerevisiae Штамм SCCM49 ( Mata; His3δ1; Leu2δ0; Met15δ0, URA3Δ0 ; YLR384C -3x Флаг :: NATNT2 ), штамм ELP1-3XFLAG , был получен путем интеграции кассеты метки 3xFLAG и маркера natNT2 в геном родительского штамма BY4741.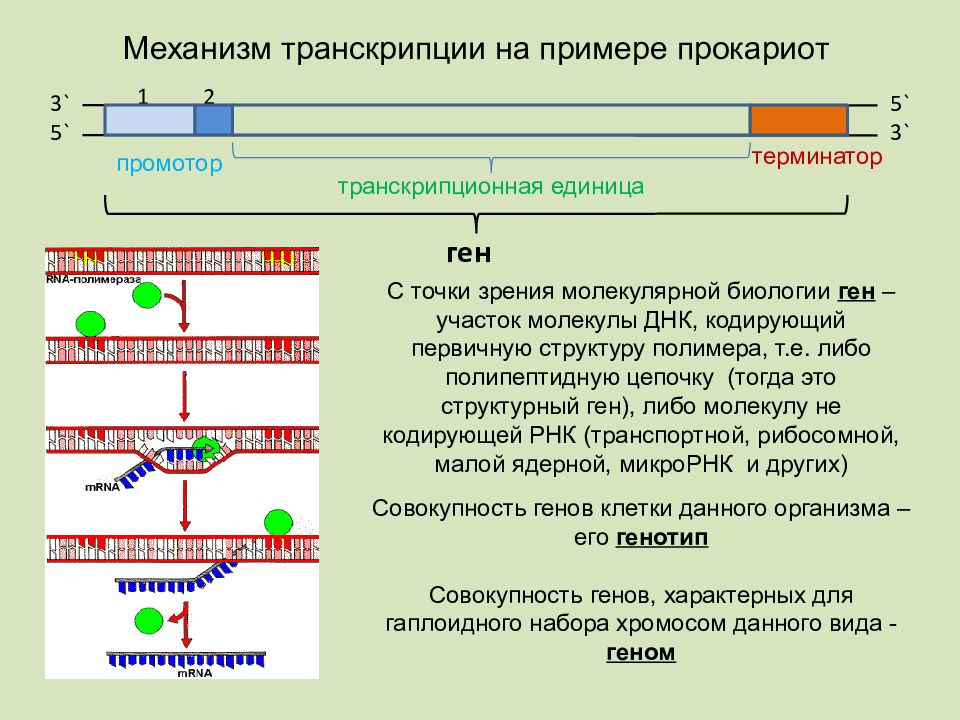 Клетки дрожжей выращивали, как описано ранее ( 26 ). Клетки (от 350 до 400 г), экспрессирующие Elp1 с С-концевым FLAG-мечением, суспендировали в буфере А [250 мМ Hepes (pH 7,9), 125 мМ NaCl, 0,1% NP-40, 10% глицерина, 50 мМ NaF, 0,1 мМ Na . 3 VO 4 , 1 мМ фенилметилсульфонилфторид (PMSF)], дополненный коктейлем ингибиторов протеазы (complete EDTA-free, Roche), и лизировали при 4°C со стеклянными шариками в BeadBeater (BioSpec). Растворимую фракцию, полученную после центрифугирования (1 час при 30000 g в роторе Beckman JA-14), инкубировали с 5 мл предварительно уравновешенного аффинного геля ANTI-FLAG M2 (Sigma-Aldrich) в течение 2-3 часов при 4°С.После промывки смолы М2 буфером B [10 мМ Hepes (pH 7,9), 125 мМ NaCl, 0,1% NP-40, 10% глицерин, 50 мМ NaF, 0,1 мМ Na 3 VO 4 , добавлен 1 мМ PMSF с коктейлем ингибиторов протеазы] и буфер C [10 мМ Hepes (pH 7,9), 125 мМ NaCl, 10% глицерин, 50 мМ NaF, 0,1 мМ Na 3 VO 4 ], связанный Elp123 элюировали в буфере C, содержащем 3 × Пептид FLAG (0,1 мг/мл; Sigma-Aldrich). К элюату добавляли конечную концентрацию 2-меркаптоэтанола 5 мМ. Образец концентрировали до концентрации от 7 до 20 мг/мл и подвергали заключительной стадии очистки с использованием Superose 6 Увеличить 3.Колонка 2/300 (GE Healthcare) в буфере D [10 мМ Hepes (pH 7,9), 125 мМ NaCl, 50 мМ NaF, 0,1 мМ Na 3 VO 4 , 5 мМ 2-меркаптоэтанол] или буфере E [10 мМ Hepes (pH 7,9), 125 мМ NaCl, 50 мМ NaF, 0,1 мМ Na 3 VO 4 , 5 мМ дитиотреитола (DTT), 5 мМ MgCl 2 ]. Для реконструкции апоЕlp123 гель-фильтрацию проводили в буфере D. Очищенный Ер123 инкубировали с транскрибированной in vitro тРНК S. cerevisiae Ala UGC в молярном соотношении 1:3 в течение 30 мин при 25°С в присутствие 1 мМ MgCl 2 и 1 мМ ацетил-КоА.Образец сшивали 0,01% глутаральдегидом (Electron Microscopy Sciences) в течение 1 часа при 4°C, гасили буфером 40 мМ трис-HCl (конечная концентрация) в течение 10 минут, а затем погружали.
Клетки дрожжей выращивали, как описано ранее ( 26 ). Клетки (от 350 до 400 г), экспрессирующие Elp1 с С-концевым FLAG-мечением, суспендировали в буфере А [250 мМ Hepes (pH 7,9), 125 мМ NaCl, 0,1% NP-40, 10% глицерина, 50 мМ NaF, 0,1 мМ Na . 3 VO 4 , 1 мМ фенилметилсульфонилфторид (PMSF)], дополненный коктейлем ингибиторов протеазы (complete EDTA-free, Roche), и лизировали при 4°C со стеклянными шариками в BeadBeater (BioSpec). Растворимую фракцию, полученную после центрифугирования (1 час при 30000 g в роторе Beckman JA-14), инкубировали с 5 мл предварительно уравновешенного аффинного геля ANTI-FLAG M2 (Sigma-Aldrich) в течение 2-3 часов при 4°С.После промывки смолы М2 буфером B [10 мМ Hepes (pH 7,9), 125 мМ NaCl, 0,1% NP-40, 10% глицерин, 50 мМ NaF, 0,1 мМ Na 3 VO 4 , добавлен 1 мМ PMSF с коктейлем ингибиторов протеазы] и буфер C [10 мМ Hepes (pH 7,9), 125 мМ NaCl, 10% глицерин, 50 мМ NaF, 0,1 мМ Na 3 VO 4 ], связанный Elp123 элюировали в буфере C, содержащем 3 × Пептид FLAG (0,1 мг/мл; Sigma-Aldrich). К элюату добавляли конечную концентрацию 2-меркаптоэтанола 5 мМ. Образец концентрировали до концентрации от 7 до 20 мг/мл и подвергали заключительной стадии очистки с использованием Superose 6 Увеличить 3.Колонка 2/300 (GE Healthcare) в буфере D [10 мМ Hepes (pH 7,9), 125 мМ NaCl, 50 мМ NaF, 0,1 мМ Na 3 VO 4 , 5 мМ 2-меркаптоэтанол] или буфере E [10 мМ Hepes (pH 7,9), 125 мМ NaCl, 50 мМ NaF, 0,1 мМ Na 3 VO 4 , 5 мМ дитиотреитола (DTT), 5 мМ MgCl 2 ]. Для реконструкции апоЕlp123 гель-фильтрацию проводили в буфере D. Очищенный Ер123 инкубировали с транскрибированной in vitro тРНК S. cerevisiae Ala UGC в молярном соотношении 1:3 в течение 30 мин при 25°С в присутствие 1 мМ MgCl 2 и 1 мМ ацетил-КоА.Образец сшивали 0,01% глутаральдегидом (Electron Microscopy Sciences) в течение 1 часа при 4°C, гасили буфером 40 мМ трис-HCl (конечная концентрация) в течение 10 минут, а затем погружали. 