Разработка урока 10 «Размножение и развитие, паразитизм плоских червей» /Быховский Б.Е., 7 кл/
Урок 10.1. Размножение и развитие, паразитизм плоских червей
Цель: раскрыть особенности размножения, развития плоских червей, в связи с их приспособленностью к паразитизму.
Ход урока
Организационный момент.
Актуализация знаний. На предыдущем уроке мы познакомились с представителями типа Плоские черви. Сегодня мы уделим внимание особенностям жизнедеятельности и паразитизма плоских червей, что важно для профилактики заболеваний, вызываемых этими видами.
2. Проверка знаний (фронтальный опрос)
Слайд 2 – Что означают термины? Биологический словарик.
Эктодерма, энтодерма, мезодерма
Кожно-мускульный мешок
Паренхима
Сенсиллы
Лестничная нервная система
Гермафродит
Слайд 3 – Расскажите об особенностях внутреннего строения ресничных червей по рисунку.
Слайд 4 – Назовите системы органов и выполняемые функции
Слайд 5 – Проверка по таблице
Слайд 6 — Сравнительная характеристика кишечнополостных и плоских червей
Слайд 7 — Какие прогрессивные изменения произошли у плоских червей?
Слайд 8 – Проверьте свои знания
Какие классы входят в тип плоские черви
Ресничные черви, сосальщики, ленточные черви.
Какие системы органов появились у плоских червей?
Пищеварительная, выделительная, половая, нервная.
Как дышат плоские черви?
Ресничные — через поверхность тела
3. Изучение нового материала.
Рассмотреть особенности среды обитания, строения, питания, размножения, развития и регенерации представителя плоских червей – печеночного сосальщика.
Отметить, что отсутствие пищеварительных органов у паразитических форм является следствием процесса дегенерации.
Обратить внимание учащихся на основные стадии развития этого паразита и основные среды, в которых оно осуществляется (водная среда, организм улитки, водные растения, организм человека и сельскохозяйственного животного).
Под руководством учителя учащиеся выполняют задания 1-2 в парах.
Слайды 9-10 – Класс Ресничные черви
Слайды 11-12 – Класс Сосальщики
Слайды 13-19 – Жизненный цикл печеночного сосальщика
Слайды 20-21 – Класс Ленточные черви
Слайд 22 – Особенности строения лентецов
Слайд 24 – Плодовитость лентецов
Слайд 30 — Приспособления червей к паразитизму
Пищеварительная система хорошо развита или полностью отсутствует, а паразиты всасывают пищу покровами
Анаэробы
Нервная система упрощена или полностью отсутствует
Большая плодовитость
Яйца устойчивы во внешней среде
Развитие непрямое: яйцо-личинка-взрослый червь
Жизненный цикл сложный со сменой хозяев
Рассказать о мерах борьбы с печеночным сосальщиком: о борьбе химическими средствами с промежуточным хозяином – улиткой малым прудовиком, лечебными препаратами – со взрослой формой этого паразита.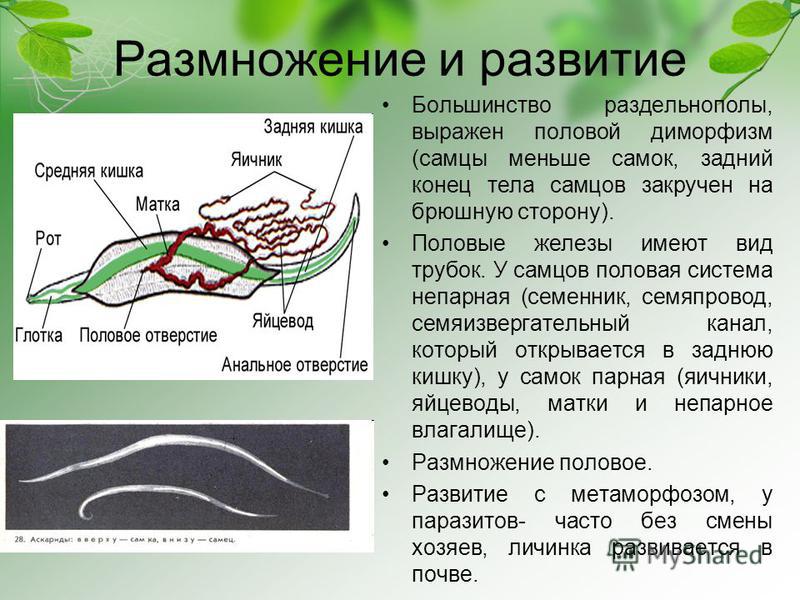 Подчеркнуть важность предупреждения заболевания и борьбе с ним.
Подчеркнуть важность предупреждения заболевания и борьбе с ним.
Закрепление нового материала.
Слайд 31 — Заполните таблицу
Виды червейВопросы
для изучения
Печеночный сосальщик
Бычий цепень
Эхинококк
Основной (окончательный) хозяин
Промежуточный хозяин
Признаки паразитизма
Класс
Слайд 32 – Проверка заполнения таблицы «Плоские паразитические черви»
5. Подведение итогов. Оценивание учащихся.
Слайд 33 — Домашнее задание: изучить материал § 12, схему рис. 24 стр.37, по желанию оформить сообщения о многообразии представителей плоских червей.
Размножение плоских червей
Некоторые плоские черви рождаются гермафродитами.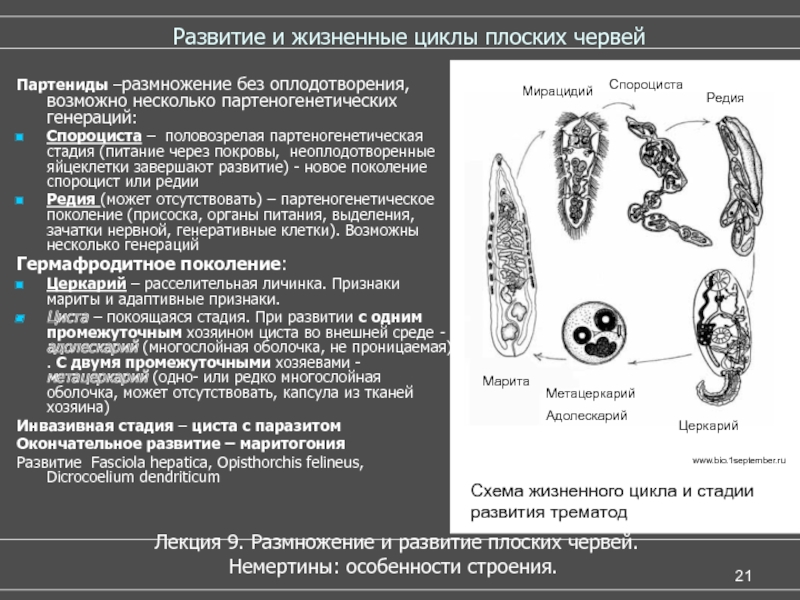 Есть интересные виды среди них. Когда приходит время спариваться, две особи вступают в поединок на пенисах. Таких фехтовальщиков, даже по порнофильмам трудно вспомнить. Тот, кто сумеет первым нанести “удар” своим “достоинством”, остаётся самцом. Проигравший становится самкой. Но иногда этот червь, может с самим собой драться, после чего. Для чего они это делают? Ради выживания или забавы ради? Обо всё по порядку.
Есть интересные виды среди них. Когда приходит время спариваться, две особи вступают в поединок на пенисах. Таких фехтовальщиков, даже по порнофильмам трудно вспомнить. Тот, кто сумеет первым нанести “удар” своим “достоинством”, остаётся самцом. Проигравший становится самкой. Но иногда этот червь, может с самим собой драться, после чего. Для чего они это делают? Ради выживания или забавы ради? Обо всё по порядку.
У природы всегда было своеобразное чувство юмора. А фантазии позавидует любой художник. Те же дизайнеры часто черпают у даров природы вдохновение.
Вкратце:
Hancockanus Pseudobiceros – плоские черви гермафродиты, т. е. вид, не имеющий определенного пола. Каждый плоской червь имеет два пениса. Будучи гермафродитами, каждая особь обладает как яичниками для производства яиц, так и семенниками для производства сперматозоидов. Чтобы выполнить акт спаривания, каждый из двух плоских червей атакует другого своей парой острых пенисов, которые имеют форму двуглавого кинжала.
Более подробно:
На Западе только что вышла книга Мэтта Саймона, который уже много лет является автором научного раздела Wired, где рассказывает о самых странных и даже абсурдных созданиях и их порой весьма чудном поведении. Предлагаем вашему вниманию фрагмент главы о пенисном фехтовании плоских червей – в нашем вольном переводе.
Самцам в животном королевстве относительно сладко живется, в то время как истинное бремя жития взвалено на самок, которые тратят огромное количество энергии на производство яиц, выращивание потомства, присмотр за ним.
Битвы членов происходят на коралловых рифах. Начинается все достаточно невинно. Два ярко окрашенных плоских червя сближаются и начинают трогать друг друга за разные места. Но это затишье перед бурей: вскоре каждый из них встает на дыбы и обнажает свое оружие – два острых белых стилета по имени пенис. Словно фехтовальщики, черви совершают выпады и уклоняются, стараясь пырнуть противника в любую часть тела, чтобы осеменить его, и одновременно прикладывая все усилия, чтобы избежать осеменения самому. Все это может продолжаться целый час, пока наконец противники не втянут свои двойные пенисы и не разойдутся в разные стороны, оба израненные и исполненные спермы – можно видеть, как бледные ручейки семенной жидкости струятся по их телам на пути к флегматичным яйцеклеткам.
Возможно, вы спросите: зачем нужно это жестокое травматическое осеменение? Все дело в том, что интересы обоих червей донельзя похожи: никто из них не хочет быть самкой. Производить все эти яйца с неимоверным энерговысосом, да еще и с глубокими ранами по всему беременному телу. В то время как победитель просто передал свои гены и уполз, совершенно не парясь о взращивании потомства.
Но вот что самое странное. Естественный отбор диктует червю: уж коли тебя протыкают, в твоих же интересах, чтобы протыкали глубоко и щедро. Самые опытные фехтовальщики наиболее успешны в плане воспроизводства, и все черви желают передать их гены своим детям, которые также, вероятно, станут выдающимися бойцами и осеменителями. Такова жестокая ирония природы: плоский червь не хочет, чтобы его протыкали пенисом и оплодотворяли, но если такова судьба – нужно ей отдаться всецело, подставить пенису соперника вторую щеку, третью, пятую, впитать как можно больше его чемпионской спермы.
А вот еще одна причуда природы: плоский червь Macrostomum hystrix, прозрачный и микроскопический. Как и наш красавец с рифа, он спаривается, нанося партнеру сперматические увечья. Но порой ему бывает так одиноко, что своим стилетом приходится пырять самого себя. Данный способ известен как селфинг. Особенность M. hystrix заключается в том, что селфинг происходит… в голову. Стилет располагается у хвоста, а голова, конечно же, на другом конце тела, так что, ловко изогнувшись, червь втыкает своего джонсона прямо в башку! Сперматозоиды затем прокладывают себе путь назад по телу, чтобы оплодотворить яйцеклетки. Таким образом, если приспичит, червь может размножаться самостоятельно. Ученые, открывшие в прошлом году такое поведение, осторожно назвали его не травматическим, а гиподермическим осеменением, поскольку не были уверены, что существо наносит себе серьезные раны, протыкая стилетом голову. Нет, это не шутка.
Далеко не только плоские черви забавляются подобными сексуальными проделками. Если вам нужна еще одна причина бояться, презирать или ненавидеть постельных клопов, то вот вам факт: они размножаются с помощью травматического осеменения прямо в вашей постели. Самец прокалывает экзоскелет самки своей гениталией и накачивает в ее тело сперму. Самке из-за этого пришлось даже разработать специальные белки, которые разрушают стенки бактерий, – все это нужно, чтобы избежать инфекции во время подобных утех. Так и происходит в битве полов: одна сторона совершенствует атаки, другая – защиту. Природа создает проблемы и сама же их решает.
Если вам нужна еще одна причина бояться, презирать или ненавидеть постельных клопов, то вот вам факт: они размножаются с помощью травматического осеменения прямо в вашей постели. Самец прокалывает экзоскелет самки своей гениталией и накачивает в ее тело сперму. Самке из-за этого пришлось даже разработать специальные белки, которые разрушают стенки бактерий, – все это нужно, чтобы избежать инфекции во время подобных утех. Так и происходит в битве полов: одна сторона совершенствует атаки, другая – защиту. Природа создает проблемы и сама же их решает.
О плоских червях:
К типу Плоских червей относятся более 25 тысяч видов. Плоские черви имеют двустороннюю (билатеральную) симметрию.
Они подразделяются на две большие группы: хищники, которые проживают в пресноводных и соленых источниках; паразиты, которые селятся в организме людей и животных и вызывают различные заболевания.
Плоские черви бывают ресничные, сосальщики, ленточные. Размеры их очень разнообразны. К примеру, если один тип червей имеет размер, равный 1 мм, то прочие разновидности вырастают до 10 метров в длину. Тело червяка имеет симметрию.
Размеры их очень разнообразны. К примеру, если один тип червей имеет размер, равный 1 мм, то прочие разновидности вырастают до 10 метров в длину. Тело червяка имеет симметрию.
Тело Плоских червей состоит из трёх слоев клеток: эктодермы, энтодермы и мезодермы (т. е. они трёхслойные животные). У них впервые появляется третий слой клеток — мезодерма, средний слой клеток, который залегает между эктодермой и энтодермой.
Тело представляет собой кожно-мускульный мешок, который состоит из покровного эпителия и трёх слоёв мышц — кольцевых, косых и продольных. Кожно-мускульный мешок позволяет животному сохранять постоянную форму тела.
Внутри кожно-мускульного мешка расположены внутренние органы, пространство между которыми заполнено — паренхимой, группа клеток, имеющих отростки, которая заполняет пространство между органами.
Внутренней полости тела у плоских червей нет!
Тело свободноживущих червей сверху покрыто ресничками, которые обеспечивают передвижение червя (у паразитических червей ресничек нет). У Плоских червей развиты пищеварительная, выделительная, нервная и половая система органов.
У Плоских червей развиты пищеварительная, выделительная, нервная и половая система органов.
Пищеварительная система примитивная, начинается ртом, расположенным посредине тела на брюшной стороне. Далее идут глотка и кишечник, который слепо заканчивается (анального отверстия нет). Непереваренные остатки пищи выводятся наружу через рот.
Выделительная система представлена протонефридиями, состоящими из канальцев, начинающихся звёздчатыми клетками с пучками ресничек. Пучки ресничек, колеблясь, создают ток жидкости и направляют её к выделительной поре.
Протонефридии — система канальцев, которые пронизывают всё тело животного и открываются снаружи порами.
Нервная система состоит из нервных узлов (ганглиев) на передней части тела и нервных стволов, расположенных вдоль тела. Нервные стволы соединены между собой поперечными перемычками. Такой тип нервной системы называют лестничным.
Некоторые плоские черви (свободноживущие) имеют примитивные органы чувств — глаза и статоцисты (органы равновесия).
В организме плоского червя имеются и мужские, и женские органы размножения. Такие животные называются гермафродиты.
Имеются мужские половые железы — семенники и женские — яичники.
В паренхиме расположены многочисленные пузырьки — семенники. От них идут трубчатые семяпроводы. Мужские половые клетки транспортируются с помощью семяпроводов к совокупительному органу. Всё это части мужской половой системы.
Женская половая система состоит из парных яичников, от которых к совокупительной сумке отходят трубочки — яйцеводы.
Гермафродиты — организмы, которые одновременно имеют как мужские, так и женские половые органы.
Внутреннее оплодотворение — тип оплодотворения, при котором слияние яйцеклетки и сперматозоида происходит внутри женского организма.
Перекрёстное оплодотворение — оплодотворение, при котором яйцеклетка оплодотворяется сперматозоидом другой особи.
Самооплодотворение — оплодотворение, при котором яйцеклетка оплодотворяется сперматозоидом той же особи.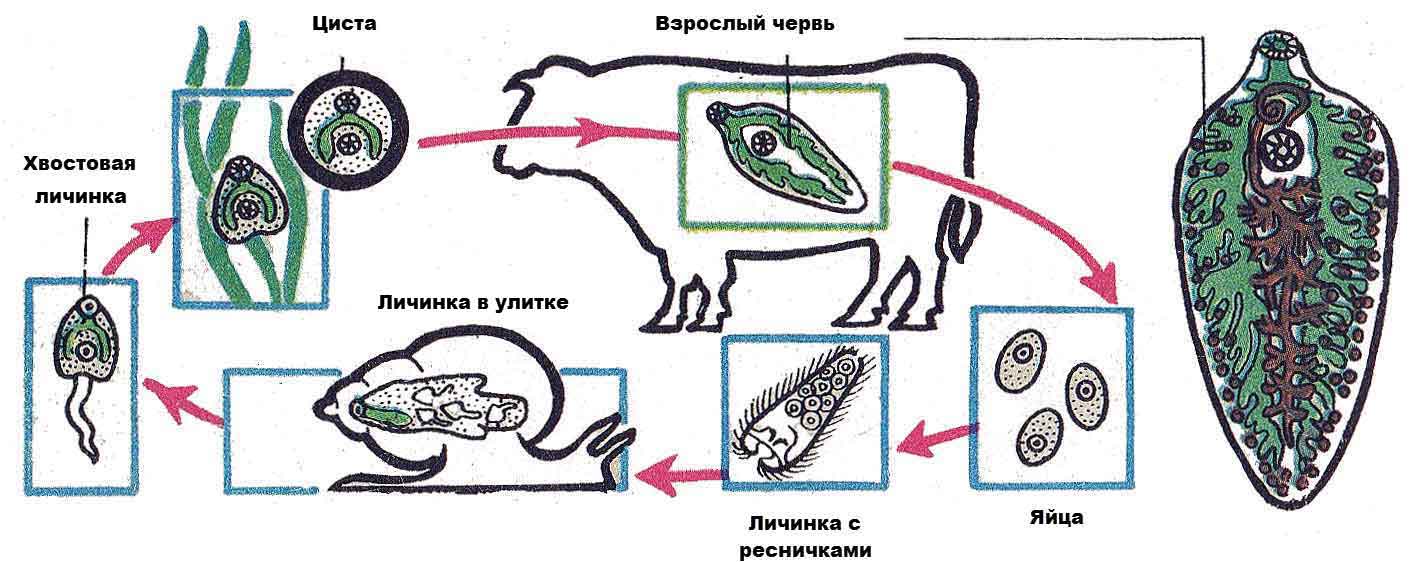
Дыхательная и кровеносная системы отсутствуют. Поглощение кислорода и выделение углекислого газа осуществляется всей поверхностью тела. С целью транспорта питательных веществ к тканям используются многочисленные выросты кишечника.
Плоские черви обитают во всех средах жизни, в том числе паразитируют в других организмах.
Гельминты (паразитические черви) вызывают опасные заболевания животных и человека.
Эти паразиты приводят к сильным болям, истощению, малокровию.
Например, возбудителем болезни описторхоза является кошачья двуустка, которая паразитирует в печени и желчных протоках, желчном пузыре. Этим заболеванием заражаются при употреблении в пищу замороженной карповой рыбы.
Человек заражается свиным цепнем, употребляя в пищу заражённую свинину, а бычьим цепнем — при употреблении заражённой говядины. Поэтому нельзя употреблять в пищу мясо, которое не прошло санитарный контроль.
Гельминты — паразитические черви.
Гельминтозы — заболевания, вызванные паразитическими червями.
У паразитирующих представителей имеется своя классификацией:
- гирокотилиды — поселяются и развиваются в теле химеровых рыб;
- моногенеи — живут в промысловой рыбе;
- цестодообразные — паразитируют в ракообразных животных, а также рыбах;
- аспидогастры — живут в моллюсках, рыбах, черепахах;
- трематоды — поражают живые организмы, в том числе и людей;
- цестоды — чаще прочих плоских гельминтов встречаются в теле человека.
У разных типов схожее строение. Но есть и некоторые характерные особенности.
Плоские черви представлены богатым многообразием, они играют неоднозначную роль в природе.
Для животных и людей они пользы не приносят, вызывают осложнения и неприятные симптомы, могут привести к болезням. Но они участвуют в пищевых цепочках, являясь пищей для других живых организмов.
Источник:
https://www.facts-worldwide.info/boj-penisov-ploskih-chervej/
http://batrachospermum. ru/2016/10/penis-fencing-selfing/
ru/2016/10/penis-fencing-selfing/
https://www.yaklass.ru/p/biologia/zhivotnye/bespozvonochnye-zhivotnye-krome-chlenistonogikh-15746/tip-ploskie-chervi-14612/re-2fa3ad86-b934-4890-a3f8-8fabc85e5a99
https://1001student.ru/biologiya/ploskie-chervi-obshchaya-harakteristika.html
Программа вступительных испытаний по биологии
Программа составлена на основе федерального государственного образовательного стандарта среднего общего образования и объединяет в себе все основные содержательные компоненты биологических знаний. В содержание программы включен материал из всех разделов школьной биологии. Экзаменационные задания по биологии не выходят за рамки данной программы, но требуют глубокой проработки всех ее элементов. Для успешных ответов на задания необходимо свободное и осознанное владение биологическими понятиями, теориями, законами и закономерностями. В содержание вступительных испытаний включены задания в тестовой форме.
ПОРЯДОК ПРОВЕДЕНИЯ ВСТУПИТЕЛЬНЫХ ИСПЫТАНИЙ
В определенное расписанием время абитуриенты должны занять места в назначенной аудитории, для чего с собой необходимо иметь: паспорт, экзаменационный лист, ручку. После размещения всех, допущенных к вступительным испытаниям, представитель экзаменационной комиссии объясняет правила оформления ответа и раздает листы с экзаменационными заданиями. С этого момента начинается отсчет времени. Продолжительность вступительных испытаний — два академических часа (90 минут).
ТРЕБОВАНИЯ К ПИСЬМЕННОМУ ЭКЗАМЕНУ И КРИТЕРИИ ОЦЕНКИ
Абитуриент, сдающий вступительный экзамен в вуз по биологии должен показать знания, навыки и умения, соответствующие программе средней общеобразовательной школы.
Письменный экзамен по биологии состоит из 20-ти тестовых заданий.
Правильное решение каждого задания оценивается 5 баллами.
Результаты выполнения экзаменационной работы оцениваются по 100-балльной системе.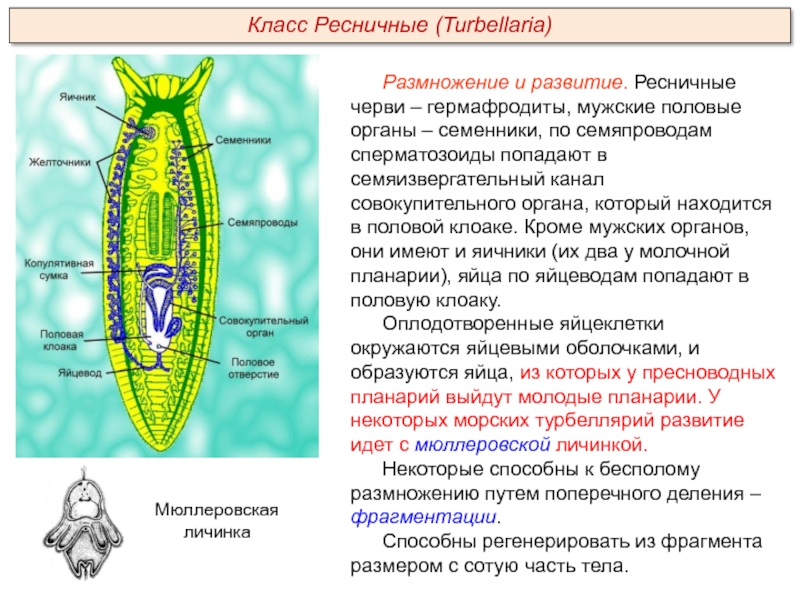 Максимальное количество баллов, выставляемых за экзаменационную работу, – 100. Количество баллов, необходимое для получения положительной оценки, — 39.
Максимальное количество баллов, выставляемых за экзаменационную работу, – 100. Количество баллов, необходимое для получения положительной оценки, — 39.
СОДЕРЖАНИЕ ПРОГРАММЫ
Растения. Бактерии. Грибы. Лишайники. Растительный мир как составная часть природы, его разнообразие. Значение растений в природе и жизни человека. Охрана растений. Корень. Развитие корня из семени. Виды корней. Типы корневых систем. Внешнее и внутреннее строение корня. Рост корня. Дыхание корней. Основные функции корня. Удобрения. Значение обработки почвы, внесение удобрений и полив. Видоизменения корней.
Побег. Почка – зачаточный побег. Почки листовые и цветочные. Строение почек. Развитие побега из почки. Лист. Внешнее строение листа. Жилкование. Листья простые и сложные. Листорасположение. Особенности микроскопического строения листа в связи с его функциями. Фотосинтез. Дыхание листа. Испарение воды листьями. Видоизменения листьев.
Стебель. Морфологические формы стеблей. Ветвление и формирование кроны. Внутреннее строение стебля древесного растения в связи с выполняемыми функциями. Рост стебля в длину и в толщину. Передвижение минеральных и органических веществ по стеблю. Видоизмененные побеги: корневище, клубень, луковица; их биологическое значение.
Ветвление и формирование кроны. Внутреннее строение стебля древесного растения в связи с выполняемыми функциями. Рост стебля в длину и в толщину. Передвижение минеральных и органических веществ по стеблю. Видоизмененные побеги: корневище, клубень, луковица; их биологическое значение.
Способы вегетативного размножения цветковых растений. Вегетативное размножение с помощью корней, листьев, стеблей и видоизмененных побегов. Значение вегетативного размножения.
Цветок – орган семенного размножения. Строение цветка: цветоножка, цветоложе, околоцветник, тычинки и пестик. Однополые и обоеполые цветки. Однодомные и двудомные растения. Значение цветка в размножении растений. Соцветия, их многообразие и биологическое значение. Перекрестное опыление, самоопыление. Ветроопыляемые и насекомоопыляемые растения. Образование плодов и семян. Типы плодов. Строение семян однодольных и двудольных растений. Химический состав семян. Дыхание семян. Питание и рост проростков. Распространение плодов и семян.
Растение – целостный организм. Ткани растительного организма. Взаимосвязи клеток, тканей и органов. Основные процессы жизнедеятельности растения. Растительные сообщества.
Основные отделы растений.
Водоросли. Строение и жизнедеятельность одноклеточных и нитчатых зеленых водорослей. Размножение водорослей. Бурые морские водоросли. Значение водорослей в природе и жизни человека.
Мхи. Строение и размножение (на конкретном примере), усложнение в процессе эволюции. Особенности строения сфагнума. Образование торфа и его значение.
Папоротникообразные. Строение и размножение (на конкретном примере), усложнение в процессе эволюции. Папоротники, хвощи, плауны. Роль в природе.
Голосеменные. Строение и размножение (на конкретном примере), усложнение в процессе эволюции. Многообразие. Значение в природе и в хозяйственной деятельности человека.
Покрытосеменные. Особенности строения и жизнедеятельности покрытосеменных, их классификация. Признаки классов двудольных и однодольных растений. Класс Двудольные растения. Характеристика семейств крестоцветных, розоцветных, бобовых, пасленовых и сложноцветных, их значение в природе и жизни человека. Класс Однодольные растения. Семейства: лилейные, злаки. Отличительные признаки растений данных семейств, их биологические особенности и значение.
Класс Двудольные растения. Характеристика семейств крестоцветных, розоцветных, бобовых, пасленовых и сложноцветных, их значение в природе и жизни человека. Класс Однодольные растения. Семейства: лилейные, злаки. Отличительные признаки растений данных семейств, их биологические особенности и значение.
Происхождение культурных растений. Понятие о сорте. Важнейшие сельскохозяйственные растения (зерновые, плодово-ягодные, овощные, масличные, технические и другие). Биологические основы их выращивания.
Бактерии. Особенности строения и жизнедеятельности прокариотической клетки. Формы бактерий. Размножение бактерий. Распространение бактерий. Роль бактерий в природе и жизни человека.
Общая характеристика царства грибов. Особенности строения и жизнедеятельности шляпочных грибов. Дрожжи. Плесневые грибы: пеницилл и мукор. Грибы-паразиты. Их строение, питание и размножение. Значение грибов в природе и хозяйственной деятельности человека.
Лишайники. Особенности строения, питания и размножения лишайников как симбиотических организмов.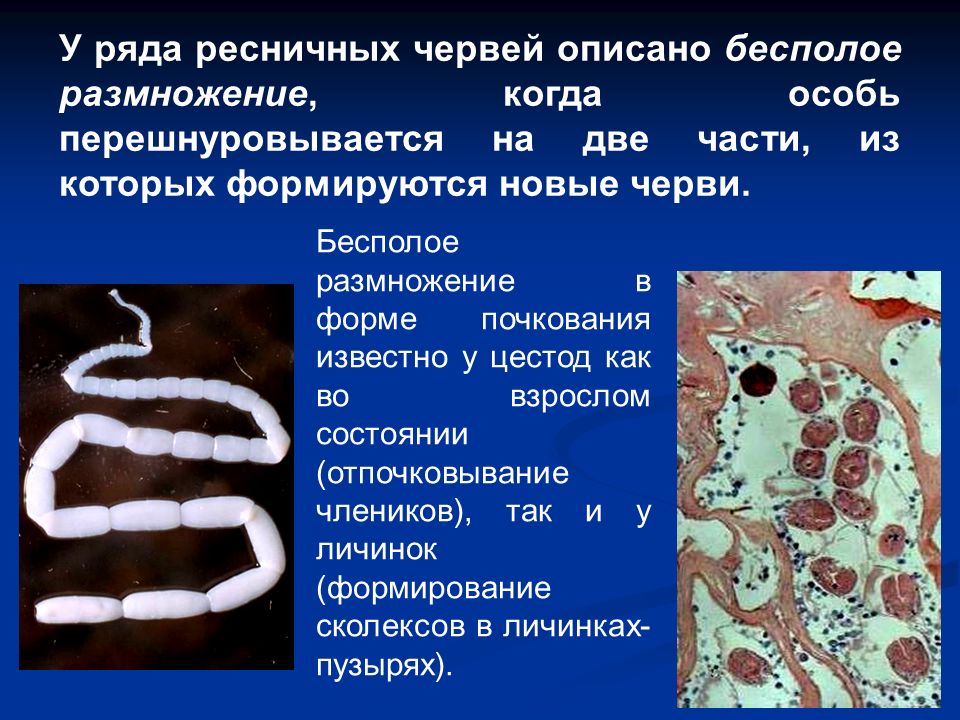 Многообразие лишайников. Роль лишайников в природе и жизни человека.
Многообразие лишайников. Роль лишайников в природе и жизни человека.
Животные. Основные отличия животных от растений. Черты их сходства. Многообразие животного мира.
Одноклеточные. Общая характеристика. Среда обитания, особенности строения и жизнедеятельности одноклеточных животных: передвижение, питание, дыхание, размножение (на примере амебы обыкновенной, инфузории-туфельки). Образование цист. Многообразие и значение одноклеточных животных.
Тип Кишечнополостные. Общая характеристика типа. Гидра пресноводная: среда обитания, внешнее строение, вид симметрии. Дифференциация клеток у кишечнополостных. Питание, передвижение, регенерация и размножение. Многообразие кишечнополостных (коралловые полипы и медузы), их значение.
Тип Плоские черви. Класс Ресничные черви. Белая планария: среда обитания, внешнее строение, передвижение. Двусторонняя симметрия. Ткани, органы, системы органов плоских червей. Классы Сосальщики и Ленточные черви. Особенности строения и жизнедеятельности в связи с паразитическим образом жизни. Жизненные циклы печеночного сосальщика и бычьего цепня. Многообразие плоских червей. Вред, наносимый животноводству и людям, меры борьбы.
Жизненные циклы печеночного сосальщика и бычьего цепня. Многообразие плоских червей. Вред, наносимый животноводству и людям, меры борьбы.
Тип Круглые черви. Аскарида человеческая: внешнее и внутреннее строение, жизнедеятельность и размножение. Профилактика аскаридоза.
Тип Кольчатые черви. Общая характеристика типа. Малощетинковые черви. Дождевой червь: среда обитания, внешнее и внутреннее строение. Регенерация, размножение. Роль дождевых червей в почвообразовании. Многощетинковые черви. Усложнение кольчатых червей в процессе эволюции.
Тип Моллюски. Общая характеристика типа. Среда обитания. Особенности строения, питания, дыхания, размножения на примере одного из представителей типа. Многообразие моллюсков: классы Брюхоногие, Двустворчатые и Головоногие. Значение в природе и жизни человека.
Тип Членистоногие. Общая характеристика типа Членистоногие.
Класс Ракообразные. Общая характеристика класса. Среда обитания, особенности строения, жизнедеятельности, размножения.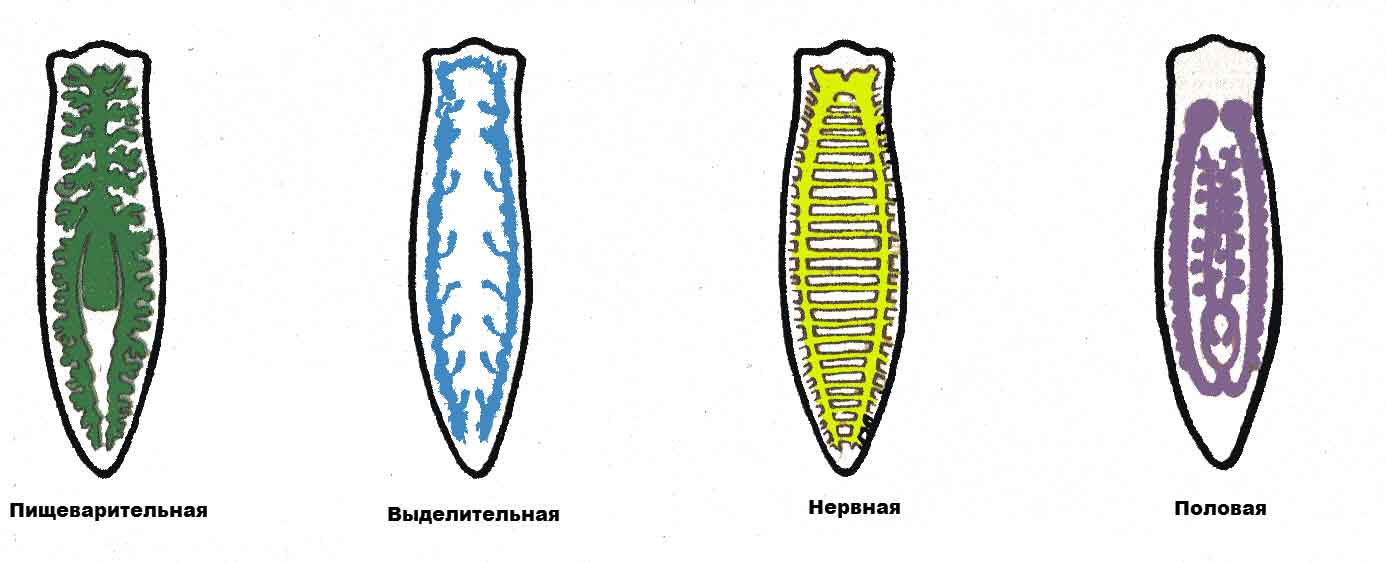 Многообразие. Роль в природе и жизни человека.
Многообразие. Роль в природе и жизни человека.
Класс Паукообразные. Общая характеристика класса. Особенности строения, питания, дыхания, размножения и поведения паука-крестовика в связи с жизнью на суше. Клещи. Особенности строения и жизнедеятельности. Роль в природе и жизни человека. Меры защиты от клещей.
Класс Насекомые. Общая характеристика класса. Особенности строения, и жизнедеятельности (на конкретном примере). Размножение. Типы развития насекомых.
Характеристика основных отрядов насекомых: Чешуекрылых, Двукрылых, Перепончатокрылых. Значение насекомых.
Тип Хордовые. Общая характеристика и происхождение хордовых. Особенности строения ланцетника. Черты сходства с беспозвоночными животными.
Хрящевые и костные рыбы. Общая характеристика класса. Особенности внешнего и внутреннего строения в связи со средой обитания. Нервная система и органы чувств. Рефлексы. Поведение. Размножение и развитие. Древние кистеперые рыбы – предки Земноводных. Многообразие и значение рыб.
Класс Земноводные. Общая характеристика класса. Многообразие земноводных (отряды хвостатые, бесхвостые), их происхождение, значение и охрана. Особенности строения, жизнедеятельности и размножения в связи с обитанием в воде и на суше. Многообразие и значение земноводных.
Класс Пресмыкающиеся. Общая характеристика класса. Среда обитания, особенности строения, размножения, поведения в связи с жизнью на суше. Регенерация. Происхождение пресмыкающихся. Древние пресмыкающиеся. Многообразие пресмыкающихся, их значение и охрана.
Класс Птицы. Общая характеристика класса. Внешнее строение. Особенности внутреннего строения и процессов жизнедеятельности, связанные с полетом. Поведение птиц. Размножение и развитие, забота о потомстве. Приспособленность птиц к сезонным явлениям в природе. Экологические группы птиц. Происхождение птиц. Роль птиц в природе и жизни человека. Охрана птиц.
Класс Млекопитающие. Общая характеристика класса. Особенности внешнего строения, скелета, мускулатуры, внутреннего строения и обмена веществ.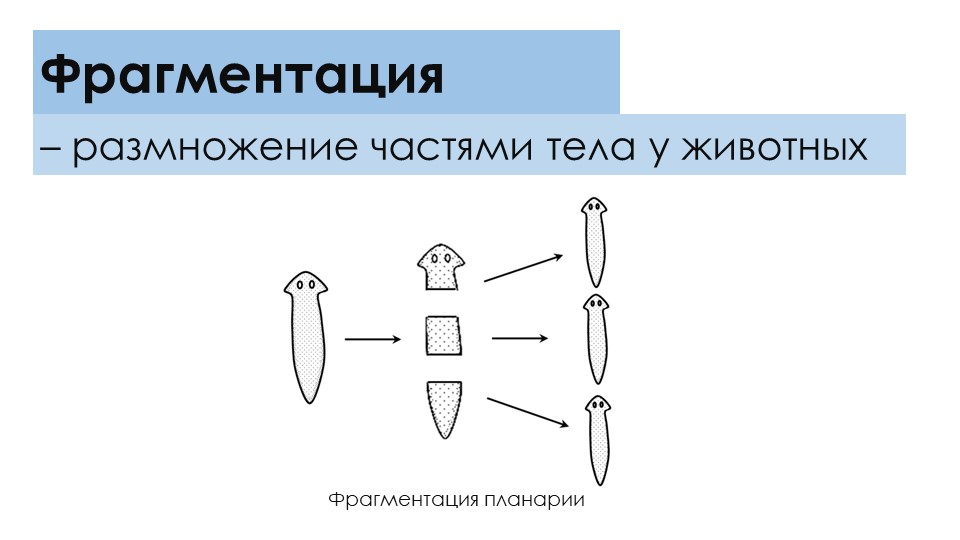 Размножение, развитие, забота о потомстве. Приспособленность млекопитающих к сезонным явлениям в природе. Усложнение нервной системы, органов чувств, поведения. Происхождение млекопитающих. Первозвери. Сумчатые. Характеристика отрядов плацентарных (насекомоядные, рукокрылые, грызуны, зайцеобразные, хищные, ластоногие, китообразные, копытные, приматы). Роль млекопитающих в природе и жизни человека, их охрана.
Размножение, развитие, забота о потомстве. Приспособленность млекопитающих к сезонным явлениям в природе. Усложнение нервной системы, органов чувств, поведения. Происхождение млекопитающих. Первозвери. Сумчатые. Характеристика отрядов плацентарных (насекомоядные, рукокрылые, грызуны, зайцеобразные, хищные, ластоногие, китообразные, копытные, приматы). Роль млекопитающих в природе и жизни человека, их охрана.
Человек и его здоровье. Особенности строения и жизнедеятельности животной клетки. Основные ткани организма человека. Органы и системы органов, связь их строения с выполняемыми функциями. Нервная и гуморальная регуляция функций физиологических систем. Человек и окружающая среда. Опорно-двигательная система человека. Сходство скелета человека и животных. Отделы скелета человека. Особенности скелета человека, связанные с трудовой деятельностью и прямохождением. Состав и строение костей. Рост костей. Типы соединения костей и их значение. Первая помощь при ушибах, растяжениях связок, вывихах и переломах. Мышцы, их строение и функции. Основные группы мышц. Работа мышц. Влияние ритма и нагрузки на работу мышц. Утомление мышц. Предупреждение искривления позвоночника и развития плоскостопия. Кровь и кровообращение. Внутренняя среда организма и ее относительное постоянство. Значение крови и кровообращения. Состав крови, плазма крови. Свертывание крови. Строение и функции клеток крови. Группы крови, переливание крови, донорство. Иммунитет. Значение прививок. Органы кровообращения: сердце и кровеносные сосуды. Строение и работа сердца. Большой и малый круги кровообращения. Движение крови по сосудам, кровяное давление, пульс. Регуляция деятельности сердца и кровеносных сосудов. Лимфообращение. Предупреждение сердечно-сосудистых заболеваний. Первая помощь при кровотечениях. Вредное влияние курения на сердечно-сосудистую систему. Дыхательная система. Значение, строение и функции органов дыхания. Голосовой аппарат. Дыхательные движения. Газообмен в легких и тканях. Жизненная емкость легких. Нервно-гуморальная регуляция дыхания.
Мышцы, их строение и функции. Основные группы мышц. Работа мышц. Влияние ритма и нагрузки на работу мышц. Утомление мышц. Предупреждение искривления позвоночника и развития плоскостопия. Кровь и кровообращение. Внутренняя среда организма и ее относительное постоянство. Значение крови и кровообращения. Состав крови, плазма крови. Свертывание крови. Строение и функции клеток крови. Группы крови, переливание крови, донорство. Иммунитет. Значение прививок. Органы кровообращения: сердце и кровеносные сосуды. Строение и работа сердца. Большой и малый круги кровообращения. Движение крови по сосудам, кровяное давление, пульс. Регуляция деятельности сердца и кровеносных сосудов. Лимфообращение. Предупреждение сердечно-сосудистых заболеваний. Первая помощь при кровотечениях. Вредное влияние курения на сердечно-сосудистую систему. Дыхательная система. Значение, строение и функции органов дыхания. Голосовой аппарат. Дыхательные движения. Газообмен в легких и тканях. Жизненная емкость легких. Нервно-гуморальная регуляция дыхания. Искусственное дыхание. Инфекционные болезни, передающиеся через воздух. Предупреждение воздушно-капельных инфекций. Гигиена дыхания. Влияние загрязнения воздушной среды на дыхательную систему человека.
Искусственное дыхание. Инфекционные болезни, передающиеся через воздух. Предупреждение воздушно-капельных инфекций. Гигиена дыхания. Влияние загрязнения воздушной среды на дыхательную систему человека.
Пищеварительная система. Питательные вещества и пищевые продукты. Понятие о пищеварении. Роль ферментов в пищеварении. Строение и функции органов пищеварения. Пищеварение в ротовой полости, желудке и кишечнике. Всасывание. Значение печени и поджелудочной железы в пищеварении. Регуляция процессов пищеварения. Роль И.П. Павлова в изучении функций органов пищеварения. Гигиена питания.
Общая характеристика обмена веществ и энергии. Пластический и энергетический обмены, их взаимосвязь. Обмен белков, жиров, углеводов в организме человека. Водно-солевой обмен. Витамины, их значение в обмене веществ. Авитаминозы, гиповитаминозы, гипервитаминозы. Рацион, режим и нормы питания.
Мочевыделительная система: строение и функции. Образование мочи. Значение выделения продуктов обмена.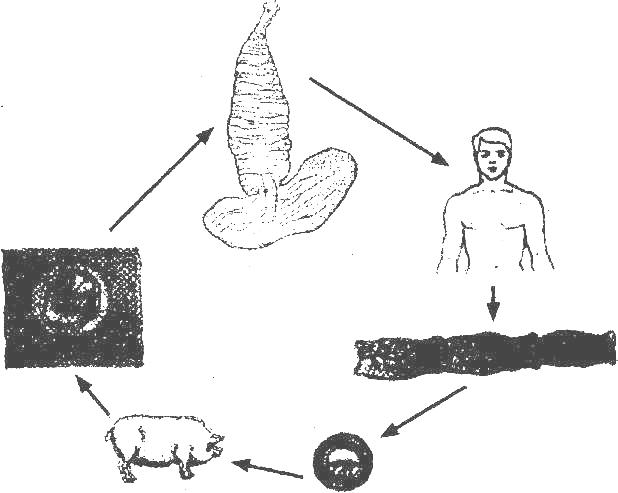 Профилактика заболеваний органов мочевыделения.
Профилактика заболеваний органов мочевыделения.
Строение и функции кожи. Роль кожи в терморегуляции. Закаливание организма. Гигиена кожи. Первая помощь при тепловом и солнечном ударах, ожогах и обморожениях.
Железы внутренней секреции. Их значение в жизнедеятельности и развитии организма. Гормоны. Внутрисекреторная деятельность гипофиза, щитовидной железы, надпочечников, поджелудочной железы. Болезни, связанные с нарушением деятельности желез внутренней секреции.
Нервная система. Ее значение в регуляции и координации функций организма и осуществлении взаимосвязи организма со средой. Центральная и периферическая нервная система человека. Понятие о рефлексе. Строение и функции спинного мозга. Строение и функции отделов головного мозга. Большие полушария головного мозга: доли и функциональные зоны. Роль вегетативной нервной системы в регуляции работы внутренних органов. Вредное влияние никотина, алкоголя и наркотиков на нервную систему. Анализаторы, органы чувств, их значение. Строение, функции и гигиена зрительного и слухового анализаторов. Высшая нервная деятельность человека (ВНД). Роль И.М. Сеченова и И.П. Павлова в создании учения о высшей нервной деятельности. Безусловные и условные рефлексы. Биологическое значение образования и торможения условных рефлексов. Отличия высшей нервной деятельности человека от ВНД животных. Речь и мышление. Сознание как функция мозга. Социальная обусловленность поведения человека. Сон, его значение и гигиена умственного труда. Режим дня и его значение.
Строение, функции и гигиена зрительного и слухового анализаторов. Высшая нервная деятельность человека (ВНД). Роль И.М. Сеченова и И.П. Павлова в создании учения о высшей нервной деятельности. Безусловные и условные рефлексы. Биологическое значение образования и торможения условных рефлексов. Отличия высшей нервной деятельности человека от ВНД животных. Речь и мышление. Сознание как функция мозга. Социальная обусловленность поведения человека. Сон, его значение и гигиена умственного труда. Режим дня и его значение.
Система органов размножения: строение и функции. Оплодотворение и внутриутробное развитие. Рождение ребенка. Уход за новорожденным. Личная гигиена подростков.
Общая биология. Биология – наука о жизни. Методы биологических исследований. Уровни организации живой материи. Основы цитологии. Клетка – структурная и функциональная единица живого. Химические элементы клеток. Неорганические соединения клетки. Роль воды в клетке и организме. Органические вещества клеток: углеводы, липиды, белки, нуклеиновые кислоты, АТФ; их роль в клетке.
Строение эукариотической клетки. Клеточная стенка и наружная клеточная мембрана: строение и функции. Протоплазма и цитоплазма клетки. Ядро: строение и функции. Хромосомы и хроматин. Вакуолярная система клетки: эндоплазматическая сеть, аппарат Гольджи, лизосомы, вакуоли). Митохондрии и пластиды. Немембранные органоиды: рибосомы, цитоскелет, клеточный центр, органоиды движения. Клеточные включения. Особенности строения клеток прокариот. Сравнительная характеристика строения клеток растений и животных. Особенности строения и жизнедеятельности прокариот. Положения клеточной теории.
Обмен веществ и превращение энергии – основа жизнедеятельности клетки. Классификация организмов по источнику энергии и типу питания. Энергетический обмен в клетке (на примере окисления глюкозы), его сущность, значение АТФ. Фотосинтез: световая и темновая фазы, значение. Хемосинтез. Ген, генетический код и его свойства. Биосинтез белков: транскрипция и трансляция. Реакции матричного синтеза. Взаимосвязь пластического и энергетического обменов.
Неклеточные формы жизни (вирусы). Строение, размножение вирусов. Вирусные заболевания человека. Профилактика СПИДа.
Размножение и индивидуальное развитие организмов. Соматические и половые клетки многоклеточного организма. Хромосомы, гаплоидный и диплоидный набор хромосом. Гомологичные хромосомы.
Клеточный цикл. Интерфаза. Механизм и биологическое значение митоза. Мейоз – редукционное деление, механизм и биологическое значение мейоза.
Сперматогенез и овогенез у животных. Оплодотворение у животных. Двойное оплодотворение цветковых растений. Онтогенез. Эмбриональное и постэмбриональное развитие. Прямое и непрямое постэмбриональное развитие. Формы размножения организмов: бесполое и половое. Способы бесполого размножения (митоз, спорообразование, фрагментация, почкование, вегетативное размножение). Половое размножение организмов. Партеногенез. Гермафродитизм.
Основы генетики. Генетика как наука, ее задачи и методы исследования. Основные понятия генетики: наследственность, изменчивость, доминантные и рецессивные признаки.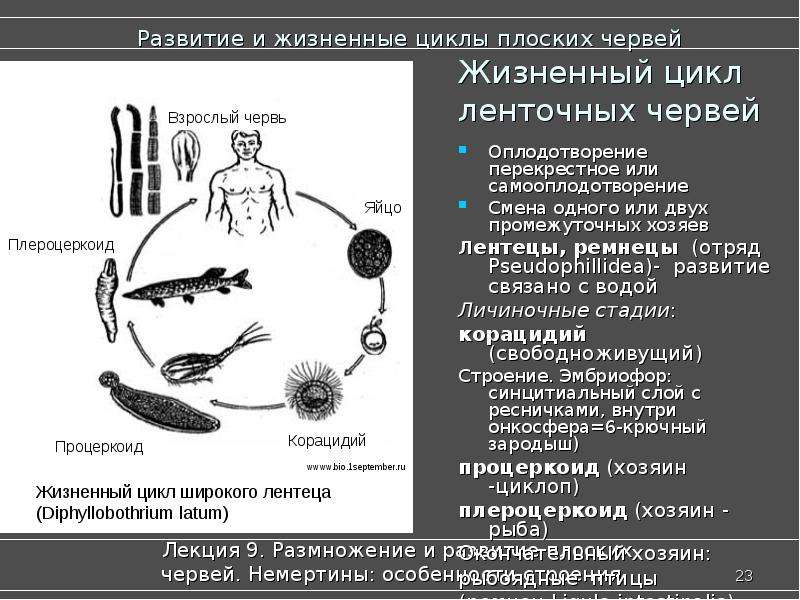 Аллельные гены. Фенотип и генотип. Гетерозиготные и гомозиготные организмы. Закономерности, установленные Г. Менделем для моно – и дигибридного скрещиваний: правило единообразия гибридов, закон расщепления, гипотеза чистоты гамет, закон независимого наследования признаков. Их цитологические основы. Генотип как целостная исторически сложившаяся система. Взаимодействие неаллельных генов. Анализирующее скрещивание. Сцепленное наследование. Хромосомная теория наследственности. Генетика пола. Наследование признаков, сцепленных с полом. Генетика человека. Методы изучения наследственности человека. Наследственные болезни человека. Значение генетики для медицины и здравоохранения.
Аллельные гены. Фенотип и генотип. Гетерозиготные и гомозиготные организмы. Закономерности, установленные Г. Менделем для моно – и дигибридного скрещиваний: правило единообразия гибридов, закон расщепления, гипотеза чистоты гамет, закон независимого наследования признаков. Их цитологические основы. Генотип как целостная исторически сложившаяся система. Взаимодействие неаллельных генов. Анализирующее скрещивание. Сцепленное наследование. Хромосомная теория наследственности. Генетика пола. Наследование признаков, сцепленных с полом. Генетика человека. Методы изучения наследственности человека. Наследственные болезни человека. Значение генетики для медицины и здравоохранения.
Наследственная и ненаследственная изменчивость. Классификация мутаций. Мутагены. Искусственный мутагенез. Мутации – материал для естественного и искусственного отбора. Закон гомологических рядов в наследственной изменчивости Н.И. Вавилова. Модификационная изменчивость. Норма реакции. Статистические закономерности модификационной изменчивости.
Основы селекции. Селекция как наука, ее задачи. Значение работ Н.И. Вавилова для развития селекции. Основные методы селекции растений. Особенности и методы селекции животных. Типы разведения животных. Методы селекции микроорганизмов. Биотехнология, ее значение и основные направления: микробиологический синтез, генная и клеточная инженерия.
Основы экологии. Экология: предмет, задачи и методы исследования. Среда обитания. Особенности водной, наземно-воздушной, почвенной и организменной сред обитания. Приспособленность организмов к обитанию в различных средах. Экологические факторы: абиотические, биотические, антропогенные; их комплексное воздействие на организм. Закономерности влияния экологических факторов на организм.
Экологическая характеристика популяции. Структура популяции. Динамика численности популяции. Факторы, регулирующие численность. Взаимоотношения особей в популяциях.
Понятие о сообществе, биогеоценозе, экосистеме. Структура и организация биогеоценоза. Разнообразие популяций в биогеоценозе, их взаимосвязи. Типы взаимодействий особей в биогеоценозах. Цепи питания и трофические сети. Саморегуляция и устойчивость биогеоценозов. Смена биогеоценозов. Агроценозы. Охрана биогеоценозов.
Разнообразие популяций в биогеоценозе, их взаимосвязи. Типы взаимодействий особей в биогеоценозах. Цепи питания и трофические сети. Саморегуляция и устойчивость биогеоценозов. Смена биогеоценозов. Агроценозы. Охрана биогеоценозов.
Основы эволюционного учения. Додарвиновский период в биологии: значение трудов К.Линнея и Ж.-Б. Ламарка. Предпосылки возникновения учения Дарвина. Основные положения теории эволюции Ч. Дарвина.
Популяция – единица вида и эволюции. Движущие силы эволюции: естественный отбор, борьба за существование, наследственная изменчивость, мутации, изоляция, дрейф генов, популяционные волны, генный поток. Естественный отбор – ведущий эволюционный фактор. Форы отбора. Механизм возникновения адаптаций. Относительный характер приспособленности.
Вид: критерии и структура вида. Видообразование. Доказательства эволюции. Биологический прогресс и регресс. Пути достижения биологического прогресса.
Развитие органического мира. Происхождение жизни на Земле. Развитие мира в архейскую, протерозойскую, палеозойскую, мезозойскую и кайнозойскую эры. Основные ароморфозы.
Развитие мира в архейскую, протерозойскую, палеозойскую, мезозойскую и кайнозойскую эры. Основные ароморфозы.
Происхождение человека. Движущие силы антропогенеза: социальные и биологические факторы. Древнейшие, древние, ископаемые люди современного типа. Человеческие расы, их происхождение и единство.
Основы учения о биосфере. Геосферы Земли. Биосфера и ее границы. В.И. Вернадский о возникновении биосферы. Живое, косное и биокосное вещество, их свойства. Функции живого вещества, роль в круговороте веществ и превращении энергии в биосфере. Биосфера в период научно-технического прогресса. Роль человека в природе. Понятие о ноосфере. Загрязнение окружающей среды.
ПОРЯДОК ПРОВЕДЕНИЯ ВСТУПИТЕЛЬНЫХ ИСПЫТАНИЙ
Вступительные испытания по биологии проводятся в письменной форме. В определенное расписанием время абитуриенты должны занять места в назначенной аудитории, для чего с собой необходимо иметь: паспорт, экзаменационный лист, ручку. После размещения всех допущенных к вступительным испытаниям представитель экзаменационной комиссии объясняет правила оформления ответа и раздает листы с экзаменационными заданиями. С этого момента начинается отсчет времени. Продолжительность вступительных 2 академических часа (90 минут). По окончании отведенного времени абитуриенты должны сдать листы ответа представителям экзаменационной комиссии и выйти из аудитории.
С этого момента начинается отсчет времени. Продолжительность вступительных 2 академических часа (90 минут). По окончании отведенного времени абитуриенты должны сдать листы ответа представителям экзаменационной комиссии и выйти из аудитории.
После проверки работы выставляется общая балльная оценка, которая сообщается абитуриенту в приемной комиссии.
Правильное решение каждого задания оценивается 5 баллами.
Результаты выполнения экзаменационной работы оцениваются по 100-балльной системе. Максимальное количество баллов, выставляемых за экзаменационную работу – 100. Количество баллов, необходимое для получения положительной оценки, соответствует 45 баллам.
ПРИМЕРЫ ТЕСТОВЫХ ЗАДАНИЙ:
1. Какой уровень организации живого служит основным объектом изучения цитологии?:
1. клеточный
2. популяционно-видовой
3. биогеоценотический
2. Какие формы жизни занимают промежуточное положение между телами живой и неживой природы?:
1. вирусы
вирусы
2. бактерии
3. лишайники
3. При скрещивании двух морских свинок с черной шерстью (доминантный признак) получено потомство, среди которого особи с белой шерстью составили 25%. Каковы генотипы родителей?:
1. АА х аа
2. Аа х АА
3. Аа х Аа
4. Укажите признак, характерный только для царства растений:
1. имеют клеточное строение
2. дышат, питаются, растут, размножаются
3. имеют фотосинтезирующую ткань
5. Признак приспособленности птиц к полету:
1. появление четырехкамерного сердца
2. образование роговых щитков на ногах
3. наличие полых костей
6. Наибольшее количество крахмала человек потребляет, используя в пищу:
1. листья салата и укропа
2. растительное и сливочное масло
3. хлеб и картофель
7. Совокупность внешних признаков особей относят к критерию вида:
1. географическому
2. морфологическому
морфологическому
3. экологическому
8. У человека в связи с прямохождением:
1. сформировался свод стопы
2. когти превратились в ногти
3. срослись фаланги пальцев стопы
9. Минерализация органических соединений почвы осуществляется благодаря деятельности:
1. наземных животных
2. микроорганизмов
3. корней растений
10. Число хромосом при половом размножении в каждом поколении возрастало бы вдвое, если бы в ходе эволюции не сформировался процесс:
1. митоза
2. оплодотворения
3. мейоза
11. Артериальная кровь превращается у человека в венозную в:
1. капилярах малого круга кровообращения
2. капилярах большого круга кровообращения
3. печеночной вене
12. Организмы в процессе жизнедеятельности постоянно изменяют среду своего обитания, что способствует:
1. росту и развитию организмов
2. саморазвитию экосистемы
саморазвитию экосистемы
3. размножению организмов
13. Какая наука изучает ископаемые остатки организмов:
1. биогеография
2. палеонтология
3. сравнительная анатомия
14. Встраивание своей нуклеиновой кислоты в ДНК клетки-хозяина осуществляют:
1. бактериофаги
2. хемотрофы
3. автотрофы
15. Какой закон проявится в наследовании признаков при скрещивании организмов с генотипами: Аа х Аа?:
1. единообразия
2. расщепления
3. сцепленного наследования
16. Что образуется из оплодотворенной яйцеклетки растений?:
1. семя
2. зародыш
3. эндосперм
17. Млекопитающих можно отличить от других позвоночных по наличию:
1. волосяного покрова и ушных раковин
2. сухой кожи с роговыми чешуями
3. голой кожи, покрытой слизью
18. Колебания уровня сахара в крови и моче человека свидетельствуют о нарушениях деятельности:
1. желудка
желудка
2. поджелудочной железы
3. щитовидной железы
19. Интенсивность размножения и ограниченность ресурсов для жизни организмов являются предпосылкой:
1. борьбы за существование
2. мутационной изменчивости
3. изоляции популяций
20. Какой из примеров относят к биотическим факторам?:
1. поедание тлей божьими коровками
2. весенний разлив реки
3. сезонное пересыхание водоема
СПИСОК ЛИТЕРАТУРЫ ДЛЯ ПОДГОТОВКИ К ВСТУПИТЕЛЬНЫМ ИСПЫТАНИЯМ ПО БИОЛОГИИ
1. Билич Г. Л. Биология для поступающих в ВУЗы. – М.: Оникс, 2007.
2. Лемеза Н. Биология для поступающих в ВУЗы. – М.: Юнипресс, 2006.
3. Мамонтов С. Г. Биология. Пособие для поступающих в ВУЗы. – М.: Дрофа, 2001.
4. Чепурнова Н.Е. Биология. Руководство для поступающих в вузы.: Учебное пособие /
5. Шустанова Т.А. Репетитор по биологии для поступающих в ВУЗы. –М.: Феникс, 2008.
Причудливые брачные привычки плоских червей
Изображение : Микроскопическое изображение Macrostomum hystrix показывает передние глаза (1) на голове, за которыми следуют парные семенники (2), парные яичники (3), развивающиеся яйца (4), самка гениталии, содержащие три зрелых яйца (5), и область мужских половых органов в хвосте червя (6).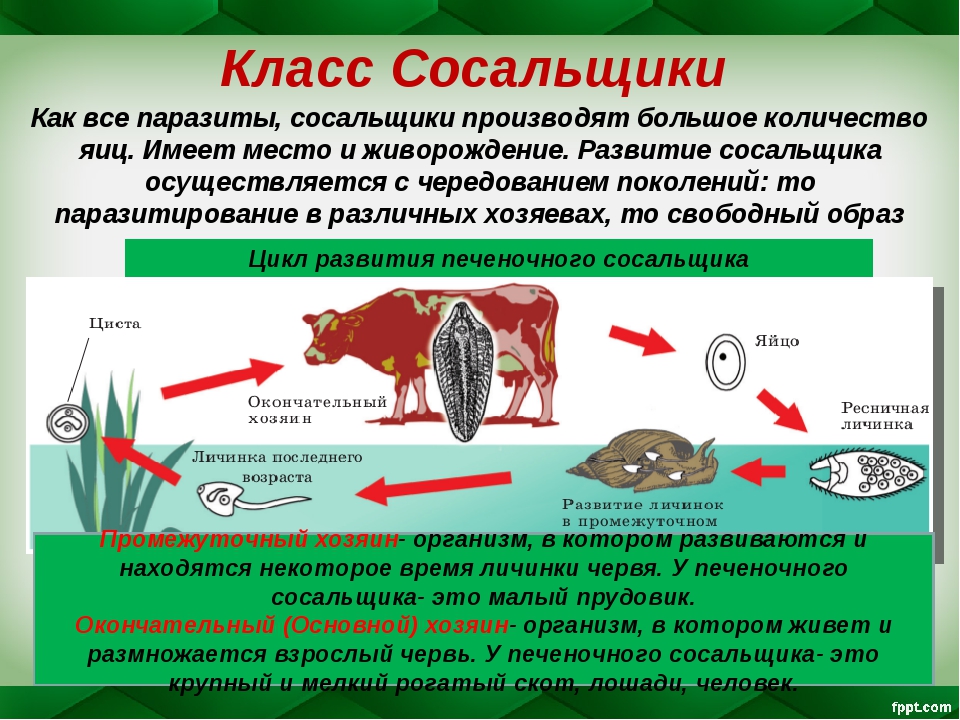 посмотреть больше
посмотреть больше
Кредит: (Изображение: Лукас Шерер)
Неспособность найти партнера для спаривания подрывает репродуктивные перспективы любого животного, но у плоских червей вида Macrostomum hystrix это может вызвать настоящую головную боль. Зоологи из Базельского и Билефельдского университетов обнаружили, на что готовы пойти эти животные ради размножения, в том числе, по-видимому, вводя сперму прямо себе в голову.Академический журнал Proceedings of the Royal Society B опубликовал свои выводы.
Отсутствие партнера обычно означает катастрофу для животных, размножающихся половым путем. Однако некоторые одновременные гермафродиты — животные, у которых одновременно есть и мужские, и женские половые органы — разработали выход из этого сценария: самооплодотворение. Это несовершенное решение, так как любое потомство, полученное в результате так называемого «самоопыления», неизбежно будет врожденным, но все же лучше, чем вообще не воспроизводиться.
В предыдущих исследованиях было установлено, что вид плоских червей Macrostomum hystrix способен переключаться именно на такое самоопыление при изоляции от партнеров по спариванию, поведение, характерное для многих, но не для всех одновременных гермафродитов. В своем новом исследовании доктор Лукас Шерер из Базельского университета и его команда демонстрируют причудливые, но замечательные механизмы, разработанные Macrostomum hystrix , которые делают это возможным.
Выстрел в голову
Изучаемые плоские черви очень прозрачны, поэтому их внутренности легко наблюдать под микроскопом.При этом зоологи обнаружили, что в условиях самоопыления, когда гермафродитные особи должны были использовать собственную сперму для оплодотворения собственной яйцеклетки, у червей в области хвоста было очень мало сперматозоидов. Это резко контрастирует с червями, содержащимися в группе, у которых больше всего сперматозоидов находится в их хвостах, недалеко от того места, где фактически происходит оплодотворение. Вместо этого у изолированных червей было больше сперматозоидов в области головы.
Вместо этого у изолированных червей было больше сперматозоидов в области головы.
Это подразумевает довольно странный путь осеменения: с помощью своего игольчатого мужского копулятивного органа изолированный червь может самостоятельно вводить сперму в собственное переднее тело, откуда сперма затем движется через тело к яйцеклетке.«Насколько нам известно, это первый описанный пример подкожной инъекции спермы себе в голову. Для нас это звучит травматично, но для этих плоских червей это может быть лучшим выходом, если они не могут найти себе пару, но все же хотят воспроизводить», — объясняет доктор Стивен Рамм, первый автор исследования.
Такой запутанный маршрут, вероятно, необходим, потому что, хотя черви и являются гермафродитами, между мужской и женской репродуктивными системами нет внутренних связей.
###
Первоисточник
Рамм С.А., Шлаттер А., Пуарье М., Шерер Л. (2015)
Подкожное самоосеменение как стратегия репродуктивной гарантии
Труды Королевского общества B | дои: 10. 1098/рспб.2015.0660
1098/рспб.2015.0660
Отказ от ответственности: AAAS и EurekAlert! не несут ответственности за достоверность новостных сообщений, размещенных на EurekAlert! содействующими учреждениями или для использования любой информации через систему EurekAlert.
Плоские черви могут «видеть» даже после обезглавливания
Айлин Вудворд
Безголовые плоские черви все еще реагируют на УФ-излучение
Shettigar et al., наук. Доп. 2017;3: e1603025
Снести им головы. Нелюбящие свет планарии плоские черви, известные своей невероятной способностью регенерировать утраченные части тела, избегают света даже после того, как их обезглавили. Это говорит о том, что у них развился второй способ реагировать на свет, не связанный с глазами.
Плоские черви планарии, которые часто живут в темных, водянистых средах, защищенных от прямого света, не имеют сложных глаз, как у нас. Но у многих на голове есть два примитивных «глазка» без линз, которые могут определять интенсивность света.
Но у многих на голове есть два примитивных «глазка» без линз, которые могут определять интенсивность света.
Акашу Гулиани из Института биологии стволовых клеток и регенеративной медицины в Бангалоре, Индия, и его коллегам было любопытно узнать больше о зрении плоских червей. Они изучили вид Schmidtea mediterranea , подтвердив, что его пятна на глазах побуждают животных уклоняться от видимого света.
Неожиданно оказалось, что S. mediterranea на самом деле обладает своеобразным цветовым зрением. Несмотря на то, что в его глазных пятнах отсутствуют фоторецепторы, специфичные для длины волны, команда Гульяни обнаружила, что животное с большей вероятностью уйдет от синего, чем от красного света.
Исследователи полагают, что черви различают разные цвета, сравнивая количество света, поглощаемого двумя глазными пятнами, а не видя цвет самого света: например, они могли бы изменить предпочтение плоского червя красного цвета синему, увеличив его. интенсивность первого.
интенсивность первого.
Больше, чем кажется на первый взгляд
Но зрение плоских червей — это не только это. Затем Гульяни и его коллеги использовали тот факт, что их плоские черви-планарии могут пережить обезглавливание и отрастить себе голову, чтобы изучить, как они реагируют на свет, когда у них нет головы.
Оказалось, что черви все же реагируют на свет, но уже в ультрафиолетовой, а не в видимой части спектра. Это говорит о том, что черви развили два совершенно независимых способа реагировать на свет, говорят исследователи: один опосредован через глазные пятна и мозг, а другой — общечеловеческий рефлекс, который не включает глаза, точный механизм которого еще предстоит выяснить. быть идентифицированным.
В течение недели, в течение которой плоские черви регенерировали свои головы, команда следила за тем, как быстро вырастали их мозг и глазные пятна, а также когда они снова начинали реагировать на видимый свет.
Через четыре дня глазные пятна снова отросли, но черви продолжали сильнее реагировать на УФ, чем на видимый свет.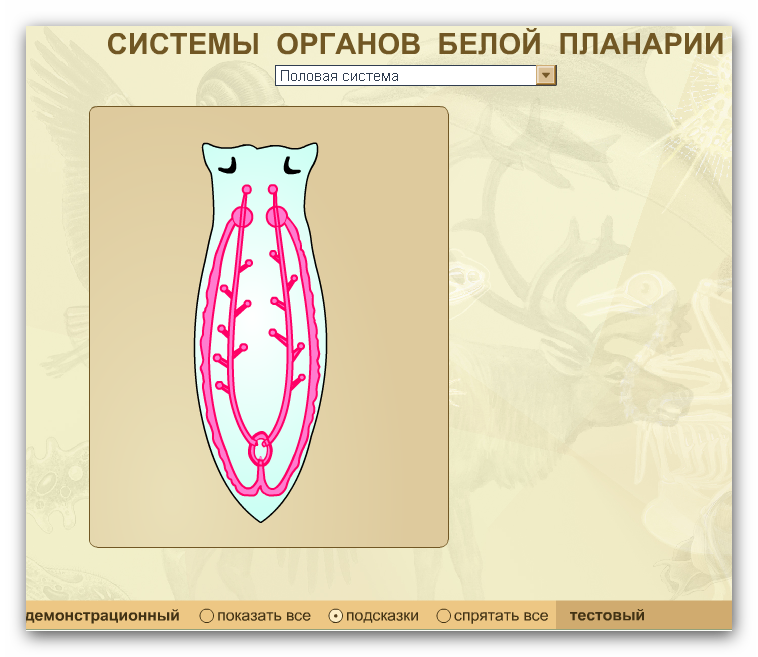 Только через семь дней к ним вернулось их более сильное предпочтение ускользать от видимого света, что позволяет предположить, что их глазные пятна и мозг снова взяли на себя контроль. Только на 12-й день их чувствительность к такому свету увеличилась до такой степени, что они сильнее реагировали на свет в более синем конце видимого спектра.
Только через семь дней к ним вернулось их более сильное предпочтение ускользать от видимого света, что позволяет предположить, что их глазные пятна и мозг снова взяли на себя контроль. Только на 12-й день их чувствительность к такому свету увеличилась до такой степени, что они сильнее реагировали на свет в более синем конце видимого спектра.
Команда Гульяни предполагает, что реакция «кишечного инстинкта» на ультрафиолетовый свет может быть древним механизмом, а реакция глаза и мозга на видимый свет — более поздним эволюционным приобретением.Таким образом, исследователи задаются вопросом, могут ли их эксперименты «воспроизвести» эволюцию в ускоренном темпе, показывая, как плоские черви перешли от реакции на ультрафиолетовый свет как бездумного рефлекса к реакции на видимый свет через путь, контролируемый мозгом.
«Удивительное совпадение, что эксперименты по обезглавливанию и регенерации, по-видимому, копируют — по крайней мере, в хронологическом порядке — то, что могло произойти в ходе эволюции», — говорит Гульяни.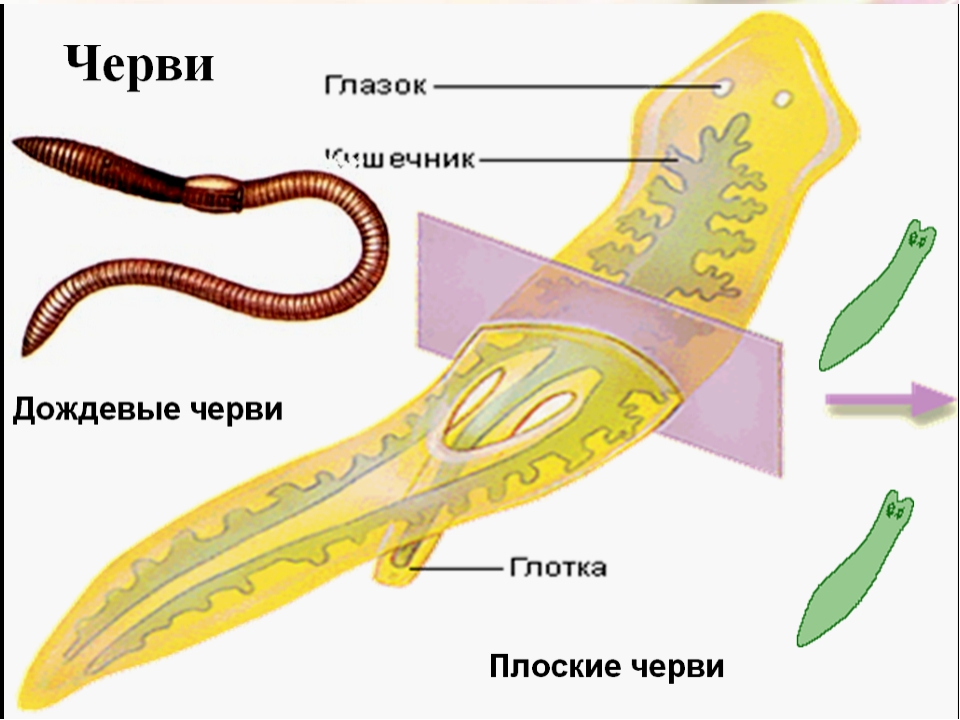 Возможно, эту идею стоит изучить в будущих экспериментах.
Возможно, эту идею стоит изучить в будущих экспериментах.
Йохен Ринк из Института молекулярной клеточной биологии и генетики им. Макса Планка в Дрездене, Германия, считает, что эксперимент команды был прекрасно спланирован и творчески подходил к использованию планарий. «Где еще в природе можно отрубить голову и спросить, видят ли остальные части тела свет или нет?» он говорит.
Ссылки на журналы: Science Advances , DOI: 10.1126/sciadv.1603025
Подробнее: Биоэлектрический удлинитель заставляет плоских червей отращивать голову вместо хвоста
Еще на эту тему:
РНК-последовательность трех свободноживущих видов плоских червей предполагает быструю эволюцию генов, связанных с репродукцией | BMC Genomics
Культуры животных
Образцы Macrostomum hystrix Ørsted 1843 sensu Luther 1905, используемые в этом исследовании, происходят от инбредной линии, полученной от аутбредной культуры, первоначально собранной в мае 2010 г. из солоноватого канала в региональном парке Сан-Россор, недалеко от Пизы, Италия (N43.6848, Е10.2838; обратите внимание, что название M. hystrix таксономически проблематично, как указано в [15]). После открытия, что M. hystrix может самоопыляться [19], инбредная линия SR1 была получена путем принудительного самоопыления в течение восьми поколений, за которым последовало несколько поколений однородного разведения (прогнозируемый коэффициент инбридинга, F = 0,998, [31 ]). Образцы Macrostomum Spirale Ax 1956 происходят из многолетней аутбредной лабораторной культуры, первоначально собранной в ноябре 2004 года в самом устье Этан-де-Бигулья на Корсике, Франция (N42.6591, Е9.4504). Наконец, образцы Macrostomum pusillum Ax 1951 происходят из многолетней аутбредной лабораторной культуры, впервые собранной в апреле 2006 г. со стороны лагуны Марано в Линьяно-Саббьядоро, Италия (N45.6916, E13.1311; обратите внимание, что название M. pusillum также проблематичен таксономически, как указано в [15]).
из солоноватого канала в региональном парке Сан-Россор, недалеко от Пизы, Италия (N43.6848, Е10.2838; обратите внимание, что название M. hystrix таксономически проблематично, как указано в [15]). После открытия, что M. hystrix может самоопыляться [19], инбредная линия SR1 была получена путем принудительного самоопыления в течение восьми поколений, за которым последовало несколько поколений однородного разведения (прогнозируемый коэффициент инбридинга, F = 0,998, [31 ]). Образцы Macrostomum Spirale Ax 1956 происходят из многолетней аутбредной лабораторной культуры, первоначально собранной в ноябре 2004 года в самом устье Этан-де-Бигулья на Корсике, Франция (N42.6591, Е9.4504). Наконец, образцы Macrostomum pusillum Ax 1951 происходят из многолетней аутбредной лабораторной культуры, впервые собранной в апреле 2006 г. со стороны лагуны Марано в Линьяно-Саббьядоро, Италия (N45.6916, E13.1311; обратите внимание, что название M. pusillum также проблематичен таксономически, как указано в [15]).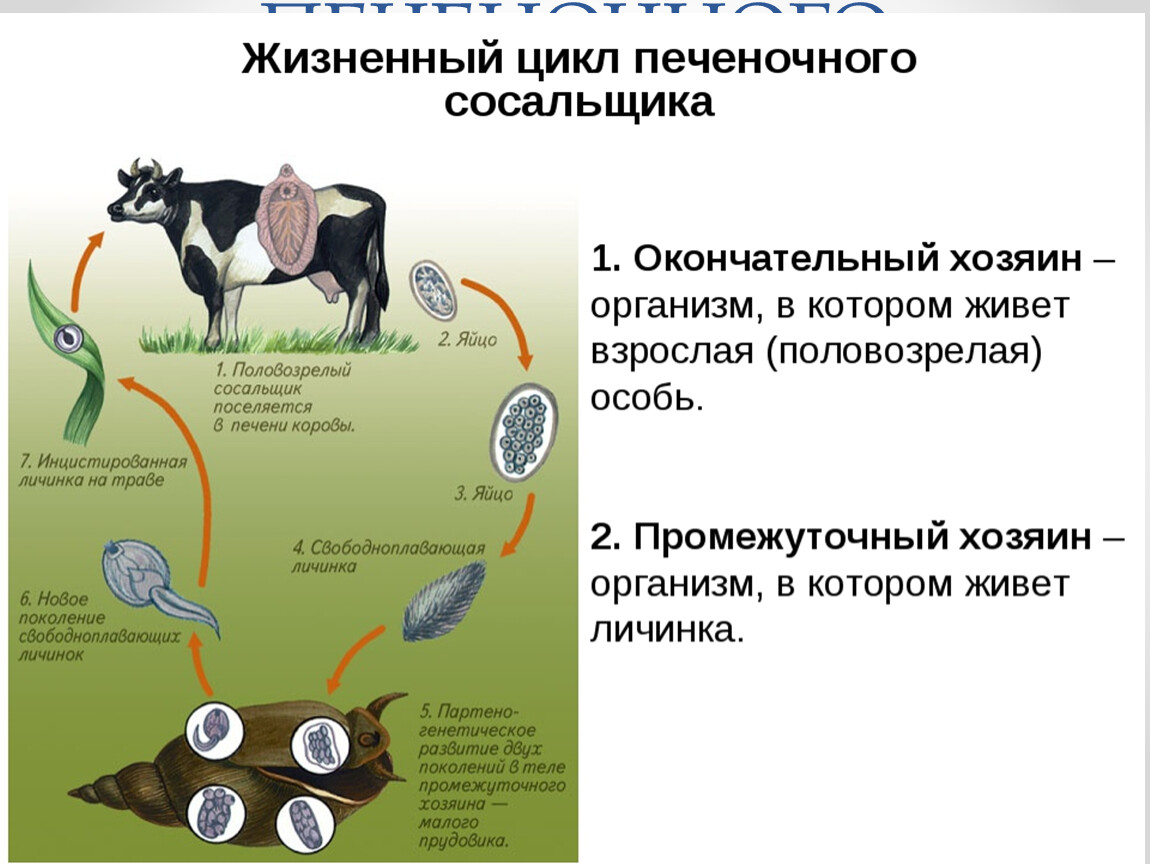 Отбор проб в региональном парке Сан-Россоре проводился на основании разрешения 3299/7–2-1 Tenuta di San Rossore, Италия. Два других участка не включали национальные парки или другие охраняемые территории суши или моря.Все виды содержались в повторяющихся популяциях в стеклянных чашках Петри и питались диатомовыми водорослями Nitzschia curvilineata Hustedt 1922. В каждом поколении 20 молодых особей добавляли в чашку и оставляли расти в течение нескольких недель (от четырех до пяти недель для М). Spirale и M. hystrix и три-четыре недели для M. pusillum ), после чего снова 20 ювенильных особей были перенесены в новый набор чашек Петри для запуска следующего поколения. Червей содержали в искусственной морской воде (ASW, Wiegandt) с соленостью 32 ‰ в течение 90–114 M.Spirale и M. pusillum , а при солености 8 ‰ для M. hystrix . Все животные, использованные для транскриптомов, были не старше двух месяцев.
Отбор проб в региональном парке Сан-Россоре проводился на основании разрешения 3299/7–2-1 Tenuta di San Rossore, Италия. Два других участка не включали национальные парки или другие охраняемые территории суши или моря.Все виды содержались в повторяющихся популяциях в стеклянных чашках Петри и питались диатомовыми водорослями Nitzschia curvilineata Hustedt 1922. В каждом поколении 20 молодых особей добавляли в чашку и оставляли расти в течение нескольких недель (от четырех до пяти недель для М). Spirale и M. hystrix и три-четыре недели для M. pusillum ), после чего снова 20 ювенильных особей были перенесены в новый набор чашек Петри для запуска следующего поколения. Червей содержали в искусственной морской воде (ASW, Wiegandt) с соленостью 32 ‰ в течение 90–114 M.Spirale и M. pusillum , а при солености 8 ‰ для M. hystrix . Все животные, использованные для транскриптомов, были не старше двух месяцев.
Экспериментальный дизайн
Поскольку некоторые гены могут быть активны только во время развития или во время регенерации, мы хотели получить животных на разных стадиях жизни, чтобы значительная часть генов была представлена в полученных транскриптомах.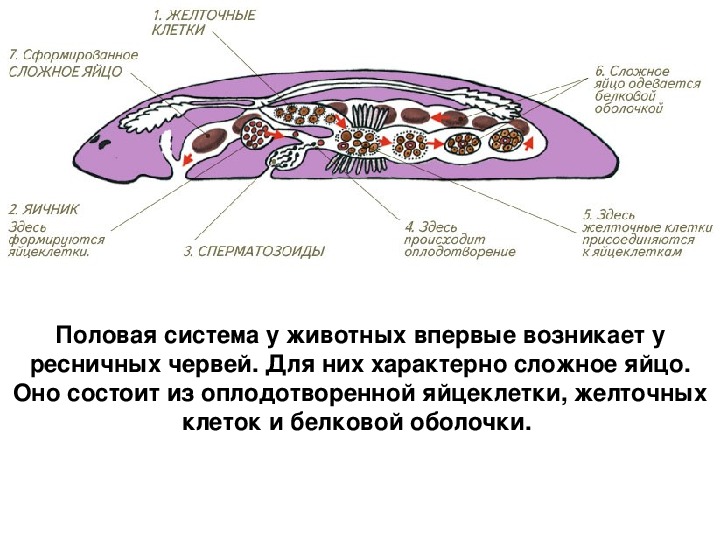 Это также позволило нам идентифицировать гены, которые являются DE между этими стадиями жизни, и определить пулы-кандидаты генов, имеющих отношение к конкретным функциям (например,г. гены, активированные у взрослых по сравнению с молодыми, являются хорошими кандидатами на гены, связанные с репродукцией). Мы получили образцы РНК для взрослых особей (A), вылупившихся детенышей (H) и регенерантов (R), используя три биологических повтора для каждого состояния и вида, всего 27 библиотек RNA-Seq (рис. 2a). Мы определили взрослых особей как животных с хорошо видимыми семенниками и собрали по 60 животных на повторность для M. hystrix и M. Spirale и по 225 животных на повторность для M. pusillum (из-за меньшего размера тела этого вида, см. рис.1). Образцы детенышей состояли из смеси животных разных стадий развития, от только что вылупившихся плоских червей до ранних ювенильных стадий, но без видимых гонад. Мы собрали в среднем около 330, 650 и 1100 детенышей для каждой повторности M.
Это также позволило нам идентифицировать гены, которые являются DE между этими стадиями жизни, и определить пулы-кандидаты генов, имеющих отношение к конкретным функциям (например,г. гены, активированные у взрослых по сравнению с молодыми, являются хорошими кандидатами на гены, связанные с репродукцией). Мы получили образцы РНК для взрослых особей (A), вылупившихся детенышей (H) и регенерантов (R), используя три биологических повтора для каждого состояния и вида, всего 27 библиотек RNA-Seq (рис. 2a). Мы определили взрослых особей как животных с хорошо видимыми семенниками и собрали по 60 животных на повторность для M. hystrix и M. Spirale и по 225 животных на повторность для M. pusillum (из-за меньшего размера тела этого вида, см. рис.1). Образцы детенышей состояли из смеси животных разных стадий развития, от только что вылупившихся плоских червей до ранних ювенильных стадий, но без видимых гонад. Мы собрали в среднем около 330, 650 и 1100 детенышей для каждой повторности M. hystrix , M. Spirale и M. pusillum соответственно. В связи с необходимостью большого количества животных детенышей M. pusillum и M. Spirale собирали в двух временных точках, растворяли в реагенте Tri™ (Sigma) и хранили при температуре - 80 °C до выделения РНК (см. ниже).Животных, использованных для группы регенерантов, ампутировали на уровне позади яичников (черные пунктирные линии на рис. 1), а затем поместили в УШВ с диатомовыми водорослями и дали им регенерировать в течение переменного периода времени перед отбором проб для отлова животных на разных стадиях регенерации. . Для M. hystrix и M. Spirale десять животных на повторность ампутировали каждый день в течение шести последующих дней, а на седьмой день выделяли общую РНК (6 × 10 = 60 животных на повторность). М.pusillum обрабатывали аналогичным образом, но из-за меньшего размера и более короткого времени регенерации пять раз ампутировали по 30 животных, а тотальную РНК выделяли на шестой день (5 × 30 = 150 животных на повторность).
hystrix , M. Spirale и M. pusillum соответственно. В связи с необходимостью большого количества животных детенышей M. pusillum и M. Spirale собирали в двух временных точках, растворяли в реагенте Tri™ (Sigma) и хранили при температуре - 80 °C до выделения РНК (см. ниже).Животных, использованных для группы регенерантов, ампутировали на уровне позади яичников (черные пунктирные линии на рис. 1), а затем поместили в УШВ с диатомовыми водорослями и дали им регенерировать в течение переменного периода времени перед отбором проб для отлова животных на разных стадиях регенерации. . Для M. hystrix и M. Spirale десять животных на повторность ампутировали каждый день в течение шести последующих дней, а на седьмой день выделяли общую РНК (6 × 10 = 60 животных на повторность). М.pusillum обрабатывали аналогичным образом, но из-за меньшего размера и более короткого времени регенерации пять раз ампутировали по 30 животных, а тотальную РНК выделяли на шестой день (5 × 30 = 150 животных на повторность).
Выделение РНК, подготовка библиотеки и секвенирование
Перед экстракцией черви голодали в течение 24 часов, чтобы дать им время отрыгнуть съеденные диатомеи. Затем червей постепенно расслабляли, используя ряд разведений 7,14% MgCl 2 в воде, а затем непосредственно растворяли в реагенте Tri™ (Sigma) путем пипетирования вверх и вниз.В дальнейшем экстракцию проводили в соответствии с рекомендациями производителя, с небольшой модификацией, заключающейся в том, что мы центрифугировали смесь реагента Tri™ и хлороформа в течение 20 мин вместо рекомендуемых 15 мин. Проверка качества, подготовка библиотек и секвенирование выполнялись Центром геномики в Базеле при Департаменте науки и инженерии биосистем Швейцарской высшей технической школы Цюриха в Базеле. Библиотеки готовили с использованием набора TruSeq® Stranded mRNA Kit (Illumina) и секвенировали как считывания парных концов длиной 101 п.н. на секвенаторе HiSeq2500 (с использованием набора HiSeq® SBS Kit v4, Illumina).
Сборка транскриптома
Мы использовали Rcorrector (commit 24940c9, [46]) со стандартными настройками для исправления ошибок из-за неточного базового вызова, сохраняя чтения, которые не могли быть исправлены. Rcorrector — это метод коррекции на основе k-mer, разработанный специально для данных RNA-Seq. Сначала он строит граф де Брейна ридов, а затем оценивает охват k-меров в графе. K-меры с низким покрытием по сравнению с другими членами пути, вероятно, связаны с ошибкой секвенирования и исправлены [46].После исправления ошибок мы обрезали адаптеры секвенирования и чтения низкого качества с помощью Trimmomatic (версия 0.36, команда: 2:30:10:8:TRUE LEADING:5 TRAILING:5 SLIDINGWINDOW:4:15 AVGQUAL:30 MINLEN:36), удалив низкие -quality и требующий общего балла Phred 30. Затем мы собрали транскриптомы de novo, используя Trinity (версия 2.6.6, [47]), с размером k-mer 25, нормализацией цифрового чтения и с настройками для многоцепочечных библиотек. .
Удаление перекрестного загрязнения
Все 27 библиотек были мультиплексированы и запущены на двух дорожках секвенатора. Для демультиплексирования считываний все библиотеки были отнесены к их соответствующему образцу с использованием двойных комбинаторных индексов набора TruSeq (т. е. индексов 8 bp i5 и i7 D501-D508 и D707-D710 соответственно). Наши образцы были уникальны только по одному индексу, при этом все индексы i5 и два из четырех индексов i7 использовались для маркировки нескольких видов. Недавно стало очевидным, что такое индексирование может привести к ошибкам демультиплексирования из-за так называемого скачкообразного изменения индекса [48, 49]. Во время этого процесса сильно выраженные чтения из одной библиотеки могут перекрестно загрязнять другую библиотеку на той же дорожке, а затем, по-видимому, происходят в этой библиотеке в небольшом количестве.Поскольку мы использовали такие индексы и имели высокий охват секвенированием, это, вероятно, вызывает беспокойство в наших данных. Чтобы смягчить проблему, мы очистили наши сборки с помощью CroCo с настройками по умолчанию [50]. CroCo использует информацию об уровнях экспрессии в сборках для обнаружения перекрестного загрязнения [50].
Для демультиплексирования считываний все библиотеки были отнесены к их соответствующему образцу с использованием двойных комбинаторных индексов набора TruSeq (т. е. индексов 8 bp i5 и i7 D501-D508 и D707-D710 соответственно). Наши образцы были уникальны только по одному индексу, при этом все индексы i5 и два из четырех индексов i7 использовались для маркировки нескольких видов. Недавно стало очевидным, что такое индексирование может привести к ошибкам демультиплексирования из-за так называемого скачкообразного изменения индекса [48, 49]. Во время этого процесса сильно выраженные чтения из одной библиотеки могут перекрестно загрязнять другую библиотеку на той же дорожке, а затем, по-видимому, происходят в этой библиотеке в небольшом количестве.Поскольку мы использовали такие индексы и имели высокий охват секвенированием, это, вероятно, вызывает беспокойство в наших данных. Чтобы смягчить проблему, мы очистили наши сборки с помощью CroCo с настройками по умолчанию [50]. CroCo использует информацию об уровнях экспрессии в сборках для обнаружения перекрестного загрязнения [50]. Мы удалили транскрипты, которые CroCo определил как загрязнения, и сохранили транскрипты с неоднозначным сигналом, чтобы быть консервативными.
Мы удалили транскрипты, которые CroCo определил как загрязнения, и сохранили транскрипты с неоднозначным сигналом, чтобы быть консервативными.
Оценка качества транскриптома
Для оценки качества транскриптома мы запустили TransRate (версия 1.0.2, [33]), который отображает считывания обратно в сборку и вычисляет метрики сопоставления (например, если обе пары считывания сопоставляются с одним и тем же транскриптом в ожидаемом порядке), за которым следует BUSCO (версия 2.0, [51]), который выполняет поиск за наличие курируемого набора основных консервативных генов. В частности, мы провели анализ BUSCO с набором данных многоклеточных животных, состоящим из 978 генов (версия загружена 1 ноября 2016 г.). Мы определили эмпирический размер вставки наших библиотек путем сопоставления операций чтения со сборками с помощью bwa (версия 0.7.17-r1188), а затем извлечение среднего размера вставки с помощью Picard (версия 2.20.2). Мы рассчитали 21-мерное распределение обрезанных и исправленных прочтений с помощью медузы (вариант: -C, версия 2. 2.6) и записали количество различных k-меров.
2.6) и записали количество различных k-меров.
Транскриптомы, используемые для обнаружения ортологии и анализа DE
Поскольку используемый метод обнаружения ортологии работает с аминокислотными последовательностями (см. следующий раздел), мы сначала вывели открытые рамки считывания (ORF) и соответствующие им аминокислотные последовательности для сгенерированных транскриптомов М.hystrix , M. Spirale и M. pusillum . Мы использовали TransDecoder (версия 2.0.1, [52]) в сочетании с поиском Pfam (версия 32.0) для сохранения транскриптов с предсказанными белками и сохраняли только одну ORF на транскрипт, используя опцию «—single_best_only». Затем мы уменьшили полученные предсказанные белки с помощью алгоритма кластеризации CD-HIT (версия 4.7, [53]), установили кластерные аминокислотные последовательности с идентичностью не менее 99,5% и извлекли кодирующие последовательности, соответствующие сгруппированным аминокислотам, для анализа DE.Эти упрощенные транскриптомы затем использовались в конвейере обнаружения ортологии и анализе DE.
Для M. lignano, мы использовали ранее опубликованную сборку транскриптома, ориентированную на геном (Mlig_RNA_3_7_DV1.v3 [36]; метод, описанный в [12]), в качестве отправной точки для нашего анализа. Поскольку многие транскрипты M. lignano подвергаются транссплайсингу [11, 12], первоначальная сборка была модифицирована для уточнения моделей генов, предсказания открытых рамок считывания (ORF) с помощью TransDecoder и удаления некодирующих и повторяющихся областей с помощью сопоставление с эталонным геномом (Mlig_RNA_3_7_DV1.v3.coregenes, описанный в [12]). Кроме того, Грудневская и соавт. [36] предоставили файл, содержащий аминокислотные последовательности только для лучшей ОРС на транскрипт (сгенерирован с помощью TransDecoder, Mlig_RNA_3_7_DV1.v3.genes.bestORF.pep). Эти данные наиболее точно соответствуют данным по аминокислотам, которые мы получили из наших сборок de novo. Поэтому мы также кластеризовали эту версию сборки с CD-HIT при идентичности последовательности 99,5% и снова извлекли соответствующие кодирующие последовательности.
Таким образом, мы использовали четыре набора данных аминокислотных последовательностей, представленных лучшей ORF на транскрипт, для определения ортологии и соответствующие наборы данных кодирующих последовательностей для количественной оценки экспрессии и анализа DE.Мы называем эти наборы данных сокращенными сборками транскриптома в случае трех сборок de novo и Mlig_37v3 для сборки M. lignano .
Обнаружение ортологии
Нашей основной целью анализа обнаружения ортологии была идентификация гомологичных генов между тремя видами, которые мы секвенировали для этого исследования, и хорошо аннотированным транскриптомом Macrostomum lignano . Мы использовали OrthoFinder в аминокислотном режиме (версия 2.2.6, [41]), метод, который выводит целые наборы гомологичных транскриптов (которые мы называем ортогруппами [OGs] в тексте), основанный на подходе генного дерева.Мы запустили OrthoFinder с флагом «—msa», чтобы использовать множественное выравнивание последовательностей вместо DendroBLAST по умолчанию. В этом режиме OrthoFinder выводит несколько выравниваний последовательностей для каждого кластера предполагаемых гомологов, используя MAFFT, а затем выводит дерево генов, используя FastTree. Чтобы оценить влияние кластеризации на обнаруженные ортологи, мы запустили OrthoFinder как с необработанными, так и с уменьшенными транскриптомами в качестве входных данных (необработанные относятся к транскриптомам до кластеризации CD-HIT). Мы обнаружили, что большинство расшифровок были общими для двух подходов, и только меньшая часть была доступна только одному методу (общие: 218 367, только необработанные: 20 119, только CD-HIT: 8768).В дальнейшем мы решили использовать кластерные наборы ортологов аминокислот CD-HIT, поскольку они менее сложны и более поддаются последующему анализу.
В этом режиме OrthoFinder выводит несколько выравниваний последовательностей для каждого кластера предполагаемых гомологов, используя MAFFT, а затем выводит дерево генов, используя FastTree. Чтобы оценить влияние кластеризации на обнаруженные ортологи, мы запустили OrthoFinder как с необработанными, так и с уменьшенными транскриптомами в качестве входных данных (необработанные относятся к транскриптомам до кластеризации CD-HIT). Мы обнаружили, что большинство расшифровок были общими для двух подходов, и только меньшая часть была доступна только одному методу (общие: 218 367, только необработанные: 20 119, только CD-HIT: 8768).В дальнейшем мы решили использовать кластерные наборы ортологов аминокислот CD-HIT, поскольку они менее сложны и более поддаются последующему анализу.
Анализ DE
Мы провели анализ DE между всеми тремя нашими биологическими состояниями, т.е. взрослыми особями (A), детенышем (H) и регенерантами (R). Однако из трех возможных результирующих контрастов мы здесь в первую очередь сосредоточимся на сравнении взрослых особей и вылупившихся детенышей (AvH), поскольку это сравнение позволяет идентифицировать транскрипты-кандидаты, которые являются DE в контексте репродукции. Сравнения между взрослыми особями и регенерантами (AvR) и регенерантами и вылупившимися птенцами (RvH) в основном рассматриваются в дополнительной информации, причем первое сравнение позволяет идентифицировать транскрипты-кандидаты, которые являются DE во время регенерации, в то время как последнее сравнение априори не делает этого. представляют собой очень информативный контраст.
Сравнения между взрослыми особями и регенерантами (AvR) и регенерантами и вылупившимися птенцами (RvH) в основном рассматриваются в дополнительной информации, причем первое сравнение позволяет идентифицировать транскрипты-кандидаты, которые являются DE во время регенерации, в то время как последнее сравнение априори не делает этого. представляют собой очень информативный контраст.
Мы количественно оценили экспрессию транскриптов в наших уменьшенных транскриптомах, поскольку это позволяет упростить сравнение экспрессии между видами. В частности, мы сопоставили обрезанные и скорректированные чтения, используемые для сборки транскриптома (см. выше), с кодирующими последовательностями сокращенных сборок транскриптома, используя Salmon в режиме квази-картирования (версия 0.9, [54]), а затем вывел DE, используя DESeq2 (версия 1.24.0, [55]). Фильтрация для удаления генов с низкой экспрессией может повысить эффективность анализа DE [55, 56, 57, 58], и мы использовали следующий двухэтапный подход, в котором используется функция независимой фильтрации DESeq2. Во-первых, все данные были пропущены через конвейер DESeq2 и протестированы все парные контрасты (AvH, AvR и RvH). Были собраны общие средние пороги подсчета, определенные с помощью DESeq2 для каждого контраста, и затем минимальный из этих порогов использовался для фильтрации генов для множественной коррекции теста в каждом контрасте.Это гарантировало, что одни и те же критерии использовались в каждом анализе. Количество транскриптов, оставшихся после этой процедуры фильтрации, приведено в таблице 1. Таким образом, только эти оставшиеся транскрипты были протестированы на ДЭ. Обратите внимание, что оценки DE с использованием транскриптомов, собранных de novo, могут привести к необъективным оценкам и должны интерпретироваться с осторожностью [59].
Во-первых, все данные были пропущены через конвейер DESeq2 и протестированы все парные контрасты (AvH, AvR и RvH). Были собраны общие средние пороги подсчета, определенные с помощью DESeq2 для каждого контраста, и затем минимальный из этих порогов использовался для фильтрации генов для множественной коррекции теста в каждом контрасте.Это гарантировало, что одни и те же критерии использовались в каждом анализе. Количество транскриптов, оставшихся после этой процедуры фильтрации, приведено в таблице 1. Таким образом, только эти оставшиеся транскрипты были протестированы на ДЭ. Обратите внимание, что оценки DE с использованием транскриптомов, собранных de novo, могут привести к необъективным оценкам и должны интерпретироваться с осторожностью [59].
Обнаружение OG с постоянным сигналом DE между видами
Предполагаемые OG могут быть объединены с анализом DE для идентификации семейств генов, демонстрирующих постоянный сигнал экспрессии у всех трех видов.Мы предоставляем наборы генов-кандидатов из OG с согласованным сигналом DE между взрослыми особями и вылупившимся детенышем (дополнительный файл 4: таблица S1 и дополнительный файл 8: таблица S5 с подробным описанием OG и всей аннотационной информацией для OG соответственно). Эти гены консервативны не только по последовательности (на что указывает тот факт, что они находятся в одном и том же OG), но и по аспектам уровня их экспрессии, что делает их многообещающими мишенями для поиска генов, связанных с репродукцией (если они активируются у взрослых) или гены, необходимые для развития (если активируются у вылупившихся детенышей).Чтобы быть аннотированными, мы требовали, чтобы OG имел по крайней мере один транскрипт для каждого вида, который является DE в отличие от исследуемого. Затем мы разделили OG на те, которые показали согласованный сигнал между всеми генами DE, и те, которые показали противоречивые сигналы.
Эти гены консервативны не только по последовательности (на что указывает тот факт, что они находятся в одном и том же OG), но и по аспектам уровня их экспрессии, что делает их многообещающими мишенями для поиска генов, связанных с репродукцией (если они активируются у взрослых) или гены, необходимые для развития (если активируются у вылупившихся детенышей).Чтобы быть аннотированными, мы требовали, чтобы OG имел по крайней мере один транскрипт для каждого вида, который является DE в отличие от исследуемого. Затем мы разделили OG на те, которые показали согласованный сигнал между всеми генами DE, и те, которые показали противоречивые сигналы.
Реаннотация транскриптома
Macrostomum lignano Предыдущие исследования использовали RNA-Seq в M. lignano для идентификации групп генов, участвующих в репродукции [21,22,23] или функции необластов [6], но не всех в этих исследованиях использовался один и тот же эталонный транскриптом.Поэтому мы объединили информацию из трех выбранных исследований RNA-Seq (см. рис. 2b-d) и перенесли их аннотации в самый последний транскриптом (см. выше). В частности, мы включили исследование [21], в котором были получены данные об экспрессии генов-кандидатов, преимущественно экспрессируемых в определенных областях тела (т. экспрессируется как в необластах, так и в ткани зародышевой линии (обозначается набором данных необластов ), а также в исследовании [23], в котором сравнивалась экспрессия червей, содержащихся в различных социальных группах (изолированных, парных и октетов; упоминается как набор социальных данных ). ).Мы также идентифицировали транскрипты, которые будут амплифицироваться с использованием праймеров существующих зондов ISH, которые были разработаны на основе предыдущих версий транскриптома. В дополнительном файле 13: «Реаннотация транскриптома Mlig_37v3» мы более подробно обобщаем подходы, использованные в этих исследованиях, и объясняем, как мы перенесли эти результаты в транскриптом Mlig_37v3, чтобы впоследствии перенести их в наши вновь созданные транскриптомы (см.
рис. 2b-d) и перенесли их аннотации в самый последний транскриптом (см. выше). В частности, мы включили исследование [21], в котором были получены данные об экспрессии генов-кандидатов, преимущественно экспрессируемых в определенных областях тела (т. экспрессируется как в необластах, так и в ткани зародышевой линии (обозначается набором данных необластов ), а также в исследовании [23], в котором сравнивалась экспрессия червей, содержащихся в различных социальных группах (изолированных, парных и октетов; упоминается как набор социальных данных ). ).Мы также идентифицировали транскрипты, которые будут амплифицироваться с использованием праймеров существующих зондов ISH, которые были разработаны на основе предыдущих версий транскриптома. В дополнительном файле 13: «Реаннотация транскриптома Mlig_37v3» мы более подробно обобщаем подходы, использованные в этих исследованиях, и объясняем, как мы перенесли эти результаты в транскриптом Mlig_37v3, чтобы впоследствии перенести их в наши вновь созданные транскриптомы (см.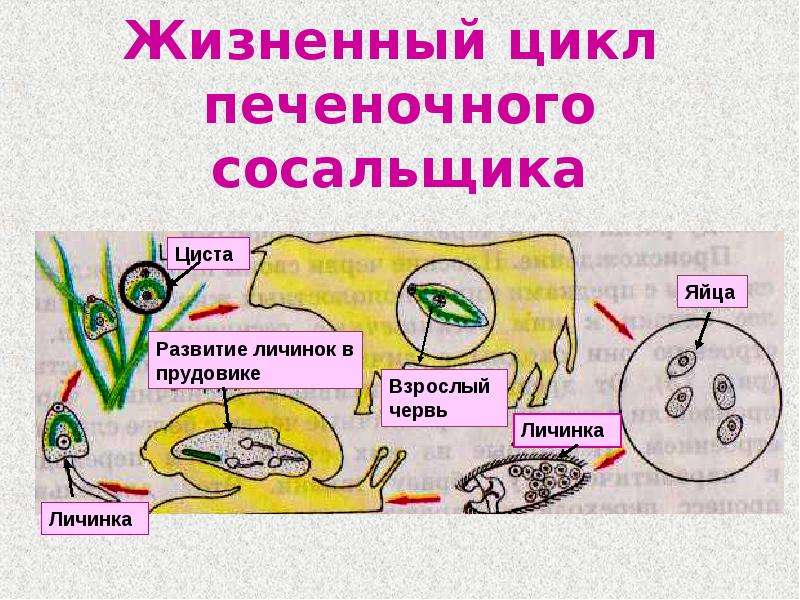 следующий раздел).
следующий раздел).
Аннотация транскриптома
Мы выполнили аннотацию de novo трех транскриптомов с помощью Trinotate (версия 3.1.1, [60]), который выполняет поиск BLASTX в базе данных белков (в нашем случае Swiss-Prot и UniRef90 из выпуска 2018_11) для присвоения аннотации. Инструмент также оценивает наличие сигнальных пептидов с помощью SignalP (версия 4.1, [61]), трансмембранных доменов с помощью TMHMM (версия 2.0, [62]) и содержание домена с помощью HMMER (версия 3.1b2) по базе данных семейства белков Pfam ( версия 32.0, [63]). Мы также передали аннотации, полученные из трех экспериментов RNA-Seq, и различных экспериментов ISH, проведенных с M.lignano (см. предыдущий раздел), используя наши предполагаемые OG. Для этого мы предположили, что гены, разделяющие OG, имеют аналогичную функцию, и перенесли аннотации с генов M. lignano на другие гены в группе. Мы разрешили ОГ содержать несколько аннотаций как внутри, так и между наборами данных.
Дивергенция белка OG по аннотации
Чтобы выяснить, проявляют ли определенные OG большую дивергенцию на уровне последовательности, мы оценили дивергенцию белка для каждой OG, которая содержала все четыре вида. Сначала мы отфильтровали каждое выравнивание OG, чтобы оно содержало только белковые последовательности, которые имеют общую выровненную область (дополнительный файл 17: рис. S3A), что привело к удалению одного OG, который в результате содержал только три вида. Затем для оставшихся 11 330 OG мы рассчитали все попарные белковые расстояния, используя функцию protdist PHYLIP (версия 3.697, [64]), используя модель замещения JTT и сохраняя только межвидовые значения (дополнительный файл 17: рис. , S3B). Чтобы избежать выбора одной репрезентативной последовательности для каждого вида и OG, мы суммировали белковые расстояния каждой пары видов как среднее значение всех попарных сравнений между их последовательностями (дополнительный файл 17: рис.С3С). Наконец, мы усреднили расстояния белков для всех пар видов, чтобы получить одну оценку дивергенции белков на OG. Для дальнейшего анализа мы исключили 16 OG с расхождением белков более двух замен на сайт, поскольку они, вероятно, близки к насыщению или представляют собой несоответствия.
Сначала мы отфильтровали каждое выравнивание OG, чтобы оно содержало только белковые последовательности, которые имеют общую выровненную область (дополнительный файл 17: рис. S3A), что привело к удалению одного OG, который в результате содержал только три вида. Затем для оставшихся 11 330 OG мы рассчитали все попарные белковые расстояния, используя функцию protdist PHYLIP (версия 3.697, [64]), используя модель замещения JTT и сохраняя только межвидовые значения (дополнительный файл 17: рис. , S3B). Чтобы избежать выбора одной репрезентативной последовательности для каждого вида и OG, мы суммировали белковые расстояния каждой пары видов как среднее значение всех попарных сравнений между их последовательностями (дополнительный файл 17: рис.С3С). Наконец, мы усреднили расстояния белков для всех пар видов, чтобы получить одну оценку дивергенции белков на OG. Для дальнейшего анализа мы исключили 16 OG с расхождением белков более двух замен на сайт, поскольку они, вероятно, близки к насыщению или представляют собой несоответствия.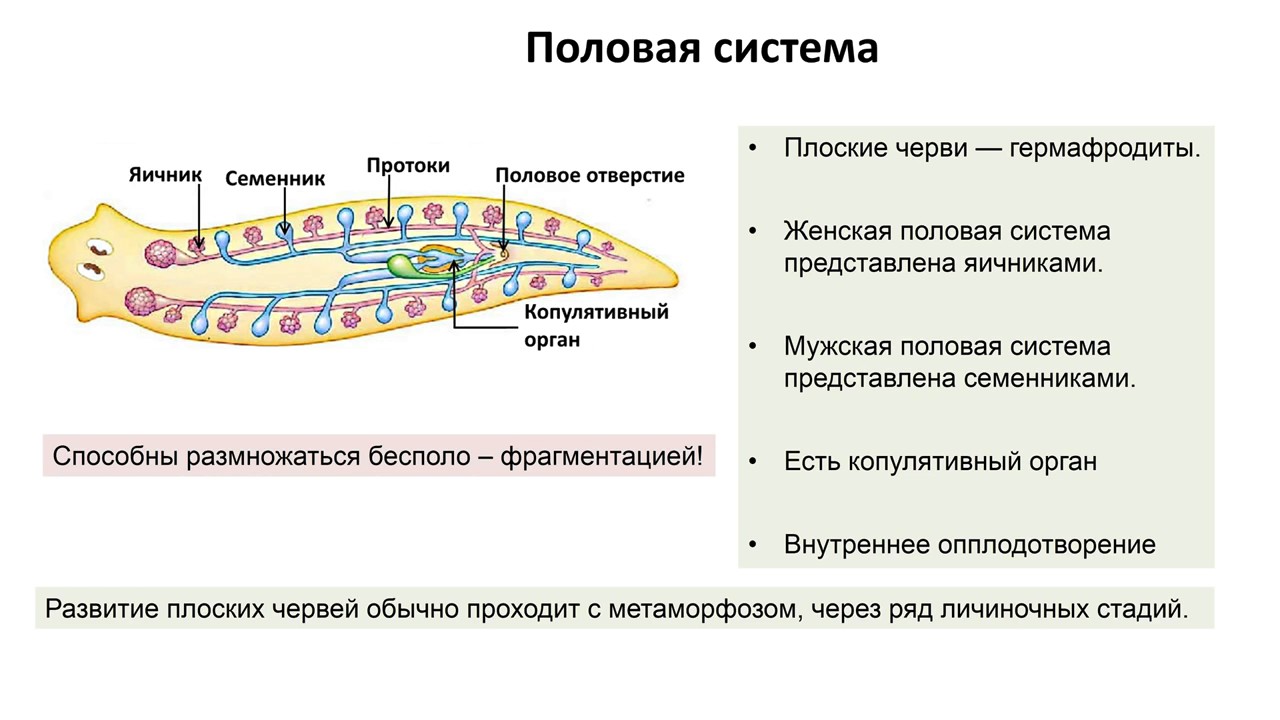 Затем мы сравнили распределения белковых дивергенций аннотированных OG (положение: семенник [ n = 726], яичник [ n = 259] и область хвоста [ n = 172]; необласт: n5 172_FACS [
Затем мы сравнили распределения белковых дивергенций аннотированных OG (положение: семенник [ n = 726], яичник [ n = 259] и область хвоста [ n = 172]; необласт: n5 172_FACS [
_FACS4] 259] и необластных [
n = 184]; социальных: OvI [ n = 2215] и ОБА [ n = 259]) против ОГ без аннотации из каждого источника аннотаций (позиционные 10,151], необластной [ n = 10,159] и социальный [ n = 8803]).Чтобы частично смягчить псевдорепликацию, которая может возникнуть в результате обработки OG как независимых образцов, мы рассчитали медианное расхождение белков для всех OG без аннотаций, а затем выполнили критерий знакового ранга Уилкоксона для одной выборки в отношении этого значения, дополнительно скорректировав множественные сравнения с использованием критерия Бенджамини. -процедура Хохберга [65].Видовой состав OG по аннотации
Если гены, связанные с репродукцией, развиваются быстро, то мы ожидаем, что немного OG с M.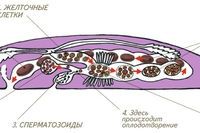 lignano — производная аннотация, предполагающая полное половое размножение (т. Е. Содержит все четыре вида). В частности, мы ожидаем, что меньшее количество OG будет содержать M. pusillum , поскольку он наиболее отдаленно связан с M. lignano (рис. 1). Напротив, ожидается, что OG со специфичной для необластов аннотацией будут более консервативными, и поэтому мы ожидали, что они будут более полными. Чтобы проверить это, мы сравнили долю полных OG каждого типа аннотаций со случайной выборкой всех OG.Кроме того, мы сравнили долю OG с позиционной аннотацией, содержащей только M. lignano и M. Spirale , со случайной выборкой всех OG. Эти OG являются кандидатами в гены, ответственные за морфологические различия между реципрокно и подкожно спаривающимися видами, поскольку подкожно скрещивающийся M. hystrix филогенетически ближе к M. lignano , чем к M. Spirale (рис. 1). В частности, эти OG могут содержать гены, контролирующие наличие или длину щетинок сперматозоидов и щеточки сперматозоидов, структур, которые отсутствуют у видов, спаривающихся подкожно (см.
lignano — производная аннотация, предполагающая полное половое размножение (т. Е. Содержит все четыре вида). В частности, мы ожидаем, что меньшее количество OG будет содержать M. pusillum , поскольку он наиболее отдаленно связан с M. lignano (рис. 1). Напротив, ожидается, что OG со специфичной для необластов аннотацией будут более консервативными, и поэтому мы ожидали, что они будут более полными. Чтобы проверить это, мы сравнили долю полных OG каждого типа аннотаций со случайной выборкой всех OG.Кроме того, мы сравнили долю OG с позиционной аннотацией, содержащей только M. lignano и M. Spirale , со случайной выборкой всех OG. Эти OG являются кандидатами в гены, ответственные за морфологические различия между реципрокно и подкожно спаривающимися видами, поскольку подкожно скрещивающийся M. hystrix филогенетически ближе к M. lignano , чем к M. Spirale (рис. 1). В частности, эти OG могут содержать гены, контролирующие наличие или длину щетинок сперматозоидов и щеточки сперматозоидов, структур, которые отсутствуют у видов, спаривающихся подкожно (см. 1).
1).
Мы использовали подход повторной выборки, чтобы проверить, различаются ли OG по своему видовому составу на основе их аннотации. Мы взяли образцы из всех OG, которые содержали 90 114 M. lignano 90 115, независимо от того, были ли они аннотированы или нет. Затем для каждой проверенной аннотации была взята случайная выборка, равная количеству ОГ с аннотацией, и зарегистрированы в них виды (например, ОГ, содержащие все четыре вида). Мы повторили эту процедуру 100 000 раз и сравнили полученное распределение с эмпирическим значением.Мы использовали долю выборок, в которых эмпирическая выборка была меньше или больше, чем выборка, в качестве значения p , проверяющего, имеют ли аннотированные OG большее или меньшее количество генов с определенным видовым составом, чем ожидалось. Обратите внимание, что транскрипты нельзя считать полностью независимыми, т.к. i) они могут быть частью одной и той же коэкспрессионной сети и ii) неравновесие по сцеплению между ними может ограничивать их эволюцию. Оба этих эффекта могут эффективно приводить к псевдорепликации, поэтому значения p следует интерпретировать с учетом этого предостережения.Чтобы скорректировать множественное тестирование, мы использовали процедуру Бенджамини-Хохберга и применили ее ко всем p-значениям, полученным для каждого теста в наборе OG с определенным видовым составом. Ресэмплинг был выполнен в R (версия 3.5.0, CRAN). Визуализация пересечений между аннотациями была выполнена с использованием графиков UpSet [66], реализованных в R-пакете UpSetR [67].
Оба этих эффекта могут эффективно приводить к псевдорепликации, поэтому значения p следует интерпретировать с учетом этого предостережения.Чтобы скорректировать множественное тестирование, мы использовали процедуру Бенджамини-Хохберга и применили ее ко всем p-значениям, полученным для каждого теста в наборе OG с определенным видовым составом. Ресэмплинг был выполнен в R (версия 3.5.0, CRAN). Визуализация пересечений между аннотациями была выполнена с использованием графиков UpSet [66], реализованных в R-пакете UpSetR [67].
Тестирование на обогащение сигнальным пептидом
Поскольку ранее было показано, что транскрипты, аннотированные как хвостовая область, специфичная в наборе позиционных данных, содержат большое количество белков семенной жидкости с признаками секреции [40], мы проверили, являются ли OG с хвостовой областью аннотация была дополнена аннотацией SignalP.Для этого мы провели тест хи-квадрат, сравнив ожидаемое количество аннотаций SignalP (полученное из доли OG с каждым типом аннотаций) с наблюдаемым количеством. Затем мы визуально сравнили ожидаемые и наблюдаемые значения, чтобы определить, какой класс аннотаций был обогащен.
Затем мы визуально сравнили ожидаемые и наблюдаемые значения, чтобы определить, какой класс аннотаций был обогащен.
Филогенетика
Мы использовали 1263 однозначных ортолога, идентифицированных с помощью OrthoFinder (см. выше), чтобы сделать вывод о филогенетической связи между нашими четырьмя видами. Мы выровняли аминокислотную последовательность каждого ортолога с помощью MAFFT (версия 7.310 [68]) с помощью алгоритма L-INS-i и объединили выравнивания с помощью AMAS [69]. Это привело к выравниванию 615 314 аминокислотных сайтов с 13,6% отсутствующих данных. Мы оценили филогению максимального правдоподобия, используя IQ-TREE (версия 1.5.5, [70]) с отдельным разделом для каждого гена, и мы вывели наилучшую модель замещения для каждого раздела, используя ModelFinder [71] с критерием BIC. Мы использовали сверхбыструю начальную загрузку [72] в сочетании с тестом приблизительного отношения правдоподобия, подобным Симодайре-Хасегаве [73], для оценки поддержки двухразделов.
ISH всего препарата
Мы выполнили ISH для членов OG0014441, который содержал i) лучший бластн-хит для транскрипта RNA815_7008 M.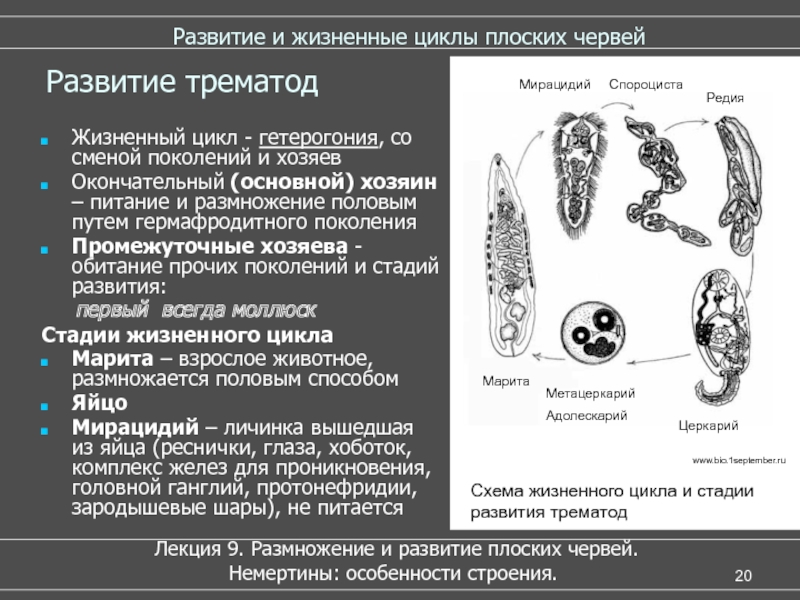 lignano [21] ([email protected], см. Дополнительный файл 18: Таблица S11), ii) Machtx_20180703@G07456_i1, iii) Macspi_20180703@G161928_i1 и iv) Macpus_20180703@G35224_i1. Для РНК815_7008 мы добавили последовательности T7 и SP6 к 5′-концу опубликованных праймеров и разработали праймеры для других видов. Условия ПЦР: 98 °C 30 с; 35 x [98 °C 10 с; 58 °С 30 с; 72 °С 30 с]; 72 °C 120 с, 4 °C 15 мин.Полученные продукты ПЦР для M. hystrix, M. Spirale, и M. pusillum клонировали в вектор pGEM-T (Promega, США). Плазмиды экстрагировали с помощью системы PureYield Plasmid Minipreps System (Promega, США). На плазмидах проводили ПЦР с набором праймеров М13 для получения матричной ДНК, которую перед синтезом зонда очищали с помощью Wizard SV Gel and PCR Clean-Up System (Promega, США). ПЦР-фрагменты M. lignano очищали с помощью набора Roche High Pure PCR Product Purification Kit (Sigma-Aldrich, США).Все четыре матрицы ДНК были секвенированы в Microsynth AG, Швейцария.
lignano [21] ([email protected], см. Дополнительный файл 18: Таблица S11), ii) Machtx_20180703@G07456_i1, iii) Macspi_20180703@G161928_i1 и iv) Macpus_20180703@G35224_i1. Для РНК815_7008 мы добавили последовательности T7 и SP6 к 5′-концу опубликованных праймеров и разработали праймеры для других видов. Условия ПЦР: 98 °C 30 с; 35 x [98 °C 10 с; 58 °С 30 с; 72 °С 30 с]; 72 °C 120 с, 4 °C 15 мин.Полученные продукты ПЦР для M. hystrix, M. Spirale, и M. pusillum клонировали в вектор pGEM-T (Promega, США). Плазмиды экстрагировали с помощью системы PureYield Plasmid Minipreps System (Promega, США). На плазмидах проводили ПЦР с набором праймеров М13 для получения матричной ДНК, которую перед синтезом зонда очищали с помощью Wizard SV Gel and PCR Clean-Up System (Promega, США). ПЦР-фрагменты M. lignano очищали с помощью набора Roche High Pure PCR Product Purification Kit (Sigma-Aldrich, США).Все четыре матрицы ДНК были секвенированы в Microsynth AG, Швейцария.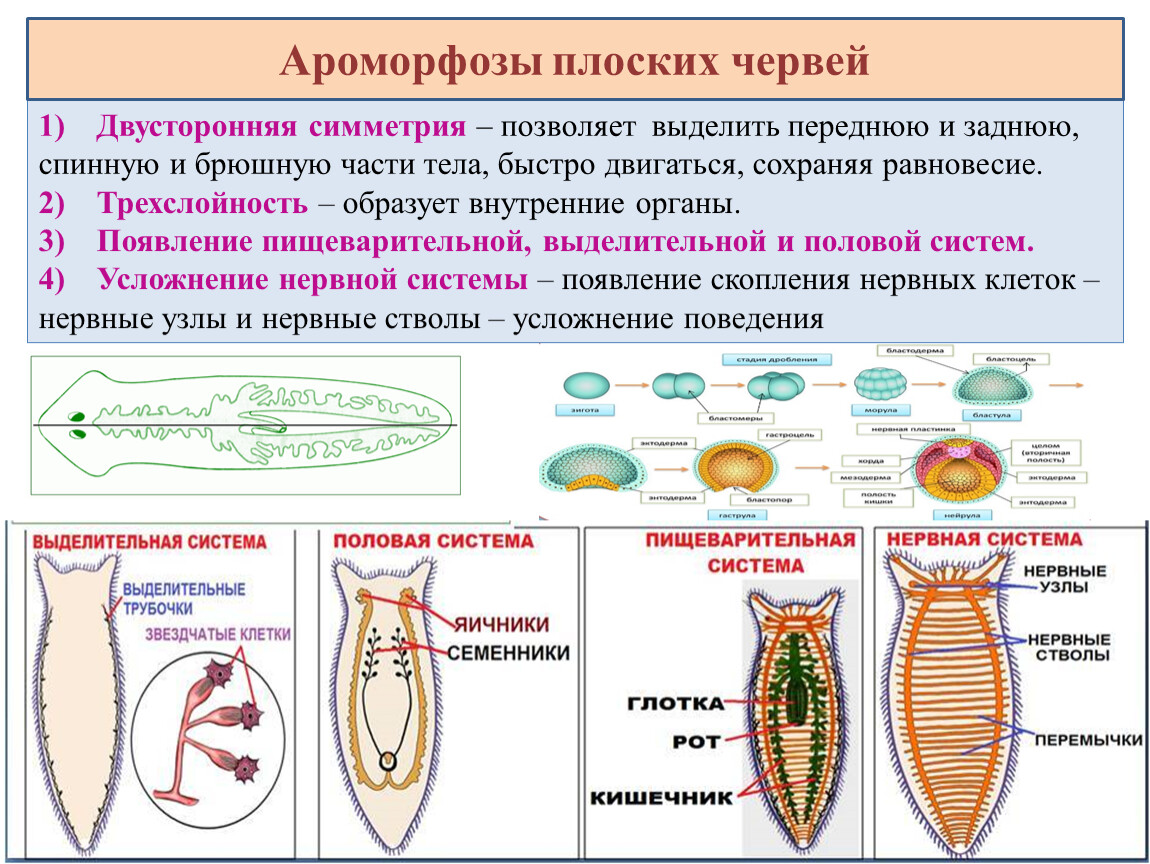 Последовательности праймеров и секвенированные данные можно найти в дополнительном файле 19: таблица S12. В качестве контроля неспецифического окрашивания мы также выполнили все ISH с использованием сенсорных зондов, которые не должны лигироваться с мРНК-мишенью.
Последовательности праймеров и секвенированные данные можно найти в дополнительном файле 19: таблица S12. В качестве контроля неспецифического окрашивания мы также выполнили все ISH с использованием сенсорных зондов, которые не должны лигироваться с мРНК-мишенью.
Зонды ISH были синтезированы с помощью набора для мечения РНК Roche DIG (SP6/T7; Sigma-Aldrich, США) с использованием 6,5 мкл матричной ДНК в 10 мкл реакции. Зонды очищали с помощью колонок Micro Bio-Spin 6 (Bio-Rad, США) в соответствии с протоколом производителя.Зонды разводили до 5 нг/мкл в смеси для гибридизации и хранили при – 80 °C. ISH на тотальном препарате проводили в соответствии с протоколом WISH, описанным в [14], со следующими модификациями: i) релаксация животных с 7,14% MgCl 2 × 6 H 2 O была продлена до 22 мин для M. pusillum и 70 мин для M. Spirale , оба на льду . M. hystrix релаксировали в 0,1% хлорэтоне (1,1,1-трихлор-2-метил-2-пропанол) в искусственной морской воде 8‰ в течение 20 мин на льду; ii) вместо ряда по этанолу использовался убывающий ряд по метанолу; iii) обработка протеазой была сокращена до 15 минут для М. hystrix и M. Spirale и до 10 мин для M. pusillum . iv) Тепловая фиксация в PBSw была продлена до 30 мин (для M. hystrix, M. Spirale, и M. pusillum ). v) Температура стадий жесткой промывки Hybmix/SSC-буфером была увеличена до 64 °C для M. hystrix, M. Spirale, и M. pusillum. Эти изменения уменьшили фоновое окрашивание, что должно облегчить дополнительные исследования в будущем.
hystrix и M. Spirale и до 10 мин для M. pusillum . iv) Тепловая фиксация в PBSw была продлена до 30 мин (для M. hystrix, M. Spirale, и M. pusillum ). v) Температура стадий жесткой промывки Hybmix/SSC-буфером была увеличена до 64 °C для M. hystrix, M. Spirale, и M. pusillum. Эти изменения уменьшили фоновое окрашивание, что должно облегчить дополнительные исследования в будущем.
Миноги, пещерные рыбы, плоские черви и морские анемоны, о боже!
Мария Вацек Бродфут
Институт Стоуэрса собирает зверинец нетрадиционных организмов для изучения здоровья и болезней.
Когда дело доходит до тонкостей биологии, люди представляют собой сложный вид для изучения. К счастью, ученые могут искать информацию в других местах животного мира. Наша планета является домом для примерно 30 миллионов видов животных, от грызунов, которые весят меньше чайной ложки сахара, до китов с сердцем размером с VW Beetles. Хотя внешне мы очень разные, наша биология часто больше похожа, чем различна, особенно на уровне клеток и генов.
Хотя внешне мы очень разные, наша биология часто больше похожа, чем различна, особенно на уровне клеток и генов.
За многие десятилетия биологи привезли несколько таких организмов в свои лаборатории, соорудив аквариумы для полосатых рыбок данио или флаконы для содержания прыгающих плодовых мушек.Тем не менее, они в основном застряли с небольшой горсткой моделей животных, предпочитаемых потому, что их легко приручить или просто разводить в больших количествах.
Робб Крамлауф, доктор философии, считает, что пора расширяться. Как научный руководитель Stowers Institute, он не удивлен, что исследователи Stowers собирают целый зверинец новых модельных организмов, включая кровососущих миноги, слепых пещерных рыб, самовосстанавливающихся плоских червей и флуоресцентных морских анемонов.
«Возможность механистического изучения разнообразия природы — настоящая сила современной биологии», — говорит Крумлауф.«Наша философия заключается в том, чтобы использовать новейшие молекулярные инструменты, чтобы задавать конкретные вопросы об уникальном способе, которым другие организмы действуют, и открывать новую биологию, которая, мы надеемся, будет важна для понимания болезней человека», — говорит Крумлауф.
Кровососущие миноги
Крумлауф немного разбирается в разработке модельных организмов. Будучи молодым ученым в 1980-х годах, он был одним из первых, кто вставил гены в геном мыши, чтобы создать «трансгенных» мышей, которые имитируют развитие и болезни человека.С тех пор он использовал эти мышиные модели для изучения того, как позвоночные, такие как мыши и люди, развили свои уникальные особенности. Его работа на мышах показала, что набор генов, называемых Hox-генами, контролирует расположение развивающегося эмбриона, отмечая, где должны появиться структуры вдоль тела от головы до хвоста. Молекулярная линейка такого рода присутствует не только у мышей и людей, но и у более примитивных организмов, от мух до червей и рыб.
Дальше по древу жизни, на 500 миллионов лет назад, к основанию ветви позвоночных, лежит одно из самых непривлекательных животных из существующих — морская минога Petromyzon marinus .Эти длинные, похожие на угрей рыбы используют бесчелюстной рот, вооруженный спиралевидными рядами роговых зубов, чтобы цепляться за свою добычу и питаться.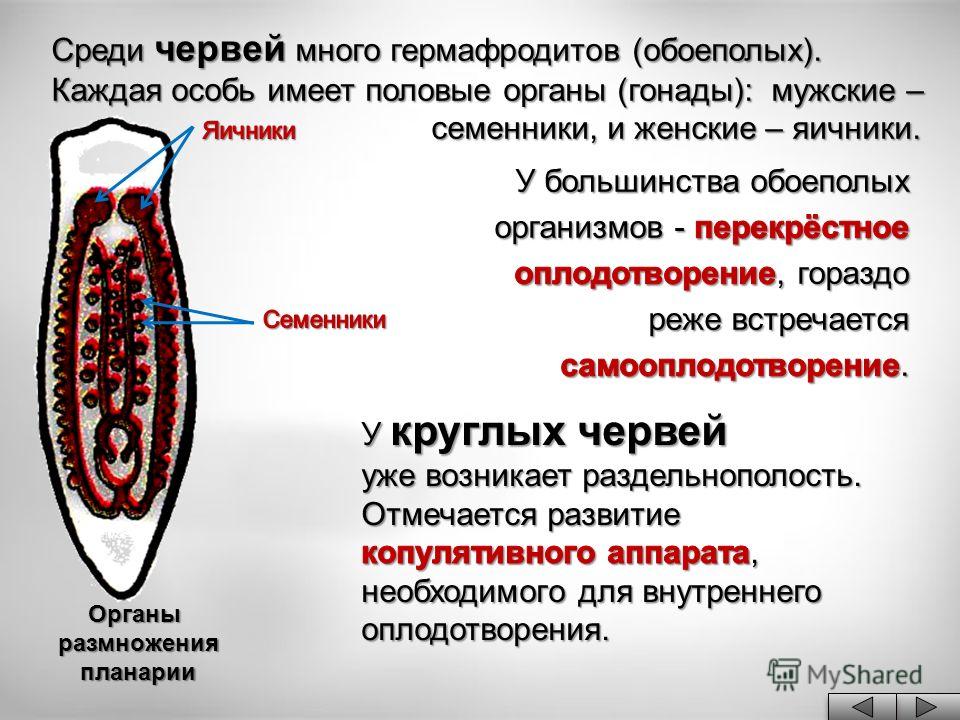 Исследователи предположили, что у миног нет челюстей, потому что их Hox-гены не работают так же, как у высших позвоночных. Крумлауф предположил, что это отсутствие челюстей может быть связано с активностью генов Hox в специализированной структуре мозга, называемой задним мозгом, которая координирует основные функции, такие как сердцебиение, дыхание и движение челюстей. Но проверка этой теории означала, что Крумлауф должен был заполучить этих кровососущих существ.
Исследователи предположили, что у миног нет челюстей, потому что их Hox-гены не работают так же, как у высших позвоночных. Крумлауф предположил, что это отсутствие челюстей может быть связано с активностью генов Hox в специализированной структуре мозга, называемой задним мозгом, которая координирует основные функции, такие как сердцебиение, дыхание и движение челюстей. Но проверка этой теории означала, что Крумлауф должен был заполучить этих кровососущих существ.
Хотя миногу трудно изучать в неволе, в море этих паразитических рыб полно. Точно так же, как взрослые лососи возвращаются на нерестилища своего рождения, миноги плывут из океана в пресноводные ручьи и озера, чтобы нереститься и откладывать икру. Каждое лето сотрудница Крумлауфа Марианна Броннер, доктор философии, достает яйценосных миног из вод Великих озер и сажает их в резервуары Калифорнийского технологического института, где слизистые морские существа производят десятки тысяч оплодотворенных яиц.В то же время исследователи из Стоуэрса каждое лето мигрируют из Канзас-Сити в Калифорнию, чтобы изучить получившиеся эмбрионы — крошечные полупрозрачные сферы, которые опровергают их рогатозубое происхождение.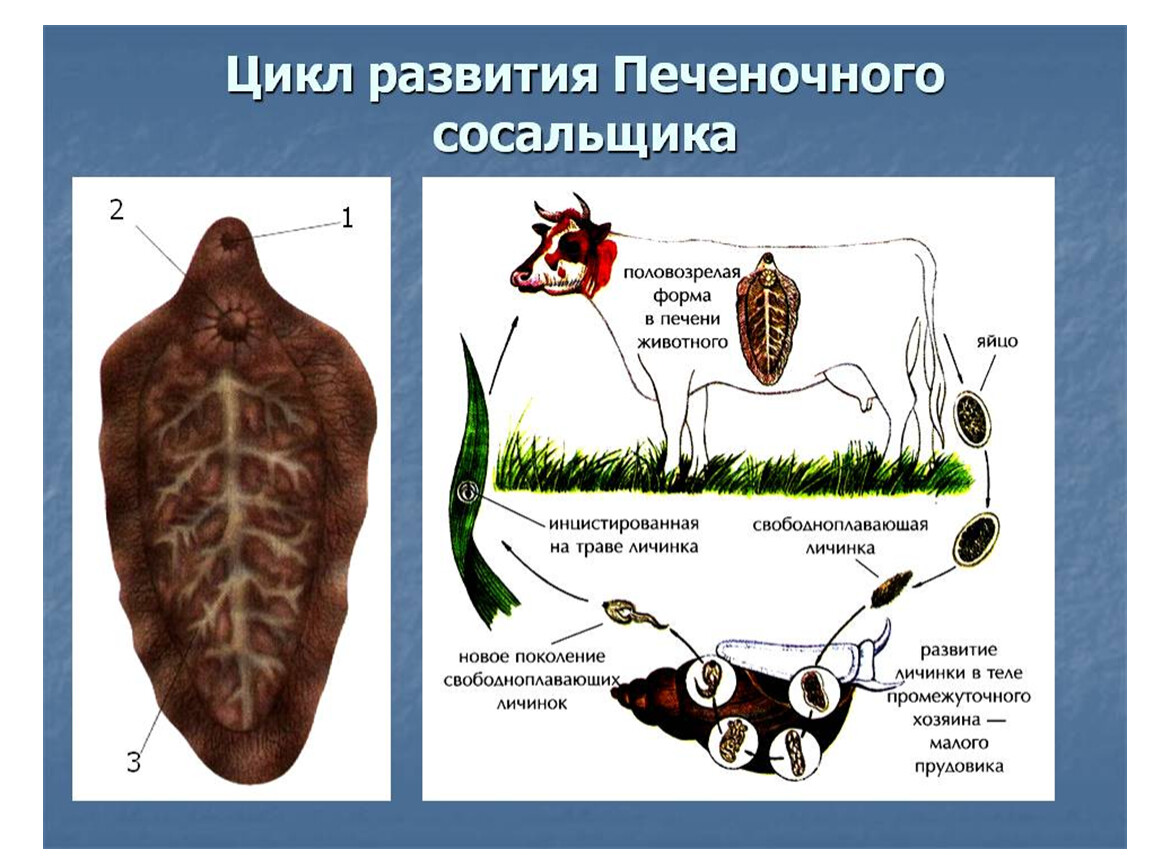
«Я не думаю, что кто-то из нас стал бы изучать это животное, если бы нам приходилось все время работать с взрослыми организмами. Миноги — самые уродливые звери, которых только можно себе представить. Но эмбрионы действительно поразительны и красивы, «, — говорит Крумлауф.
Во время одной из таких поездок член группы Крумлауфа, Хьюго Паркер, доктор философии, манипулировал этими крошечными эмбрионами, прикрепляя флуоресцентные метки к молекулярным переключателям, которые включают или выключают гены Hox.Затем они поместили каждый эмбрион под флуоресцентный микроскоп и наблюдали, как разворачивается световое шоу, когда организм начал развиваться во взрослую форму. К их удивлению, молекулярные переключатели в заднем мозге срабатывали точно так же у бесчелюстной миноги, как и у челюстных позвоночных, таких как рыбки данио. Так как же одни и те же гены могли породить столь поразительно разных животных?
«Мы думаем, что это может быть похоже на поход в хозяйственный магазин, где вы можете купить одни и те же строительные материалы, но при этом с помощью одних и тех же инструментов и материалов можете построить множество различных конструкций», — говорит Крумлауф. «Наследственная функция исходных генов может быть одинаковой, но эти организмы с годами развили разные функции».
«Наследственная функция исходных генов может быть одинаковой, но эти организмы с годами развили разные функции».
Сейчас команда Крумлауфа изучает механизмы, управляющие этим эволюционным процессом, и они надеются, что это даст представление о том, как эти инструкции используются людьми и как они могут быть неверно истолкованы при болезни.
Слепая пещерная рыба
В отличие от миноги, лицо которой может полюбить только мать (или преданный ученый), пещерная рыба Astyanax mexicanus — популярная аквариумная диковинка.Эти существа не только лишены глаз, но и полностью лишены пигмента, что придает их телам почти призрачный розовато-белый блеск. Пещерные рыбы — это больше, чем просто забавное домашнее животное — они продукт эволюционных сил в их самых жестоких и неумолимых проявлениях.
В дикой природе эти обитатели пещер должны выживать в кромешной тьме, где единственная доступная пища попадает в пещеры один раз в год, когда разливаются реки. Наряду с остатками животных и растений, наводнения также приносят новых новобранцев поверхностной рыбы из близлежащих вод, которые также должны адаптироваться к своей суровой новой среде или умереть, пытаясь.Со временем генофонд выживших эволюционирует, поскольку они теряют, казалось бы, бессмысленные свойства, такие как зрение и окраска, и приобретают жизненно важные, такие как устойчивость к голоданию.
Наряду с остатками животных и растений, наводнения также приносят новых новобранцев поверхностной рыбы из близлежащих вод, которые также должны адаптироваться к своей суровой новой среде или умереть, пытаясь.Со временем генофонд выживших эволюционирует, поскольку они теряют, казалось бы, бессмысленные свойства, такие как зрение и окраска, и приобретают жизненно важные, такие как устойчивость к голоданию.
Помощник исследователя Николас Ронер, доктор философии, изучает этот случай экстремальной эволюции и обнаружил, что пещерные рыбы остаются поразительно здоровыми, несмотря на повторяющиеся циклы пиршества или голода. Когда наводнения, наконец, доставляют их ежегодную еду, хищные пещерные рыбы наедаются до тех пор, пока вся еда не закончится.К тому времени, когда они заканчивают есть, многие из их органов удваиваются в размерах, и они становятся в десять раз толще своих поверхностных собратьев. Тем не менее, эти мясистые рыбы не склонны ни к одному из состояний, связанных с ожирением, которые преследуют людей.
«Они — отличная модель для понимания того, почему мы как биологический вид храним так много жира», — говорит Ронер, который недавно получил постдокторскую степень в Гарварде и открыл собственную лабораторию в Институте. «Типичный человек имеет около 25 процентов жира в организме; у наших ближайших родственников-обезьян гораздо меньше одного процента.С точки зрения эволюции люди несут значительное количество жира в организме, и с современными диетами оно только увеличивается. Важно понять, почему люди склонны к ожирению или почему у нас развиваются такие болезни, как диабет и сердечные заболевания».
Будучи постдоком, Ронер содержал аквариумы, полные жирных пещерных рыб и стройных, хотя и более приземленных, поверхностных рыб. Скрещивая два вида рыб друг с другом, он мог проследить наследование различных признаков от поколения к поколению, как это сделал Грегор Мендель со своими знаменитыми растениями гороха.Ронер объединил этот классический генетический подход с современной технологией секвенирования, чтобы точно определить области генома, связанные с пищевым поведением и аппетитом.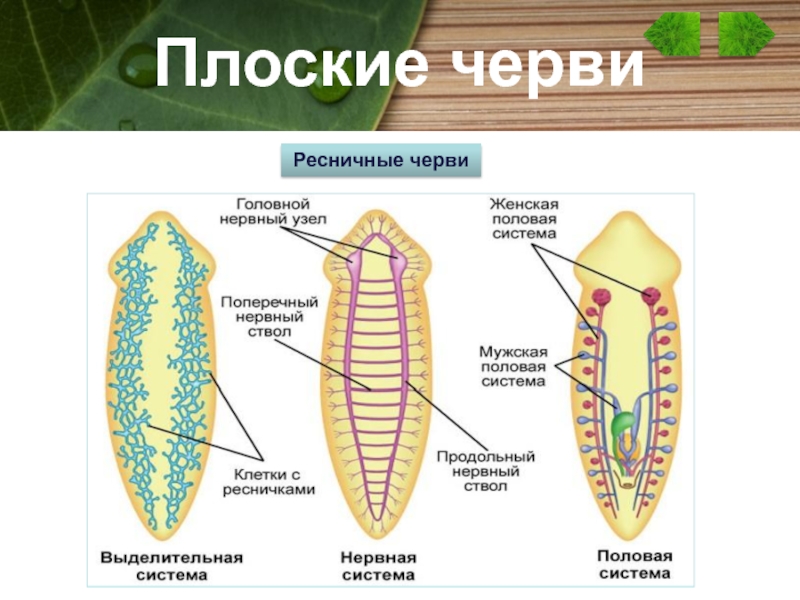 Он обнаружил, что у пещерных рыб есть мутация в рецепторе меланокортина 4, или MC4R, гене, который, как известно, вызывает у людей ненасытный аппетит при мутации. Это наиболее распространенная единственная генетическая причина ожирения.
Он обнаружил, что у пещерных рыб есть мутация в рецепторе меланокортина 4, или MC4R, гене, который, как известно, вызывает у людей ненасытный аппетит при мутации. Это наиболее распространенная единственная генетическая причина ожирения.
Теперь, когда он находится в Институте Стоуэрса, Ронер и его команда будут искать мутации, чтобы объяснить, почему пещерные рыбы способны накапливать так много жира, не страдая от негативных последствий.Такие знания могут привести к новым методам лечения, чтобы смягчить последствия метаболических заболеваний.
«Связь между эволюцией и медициной неоспорима, — говорит Ронер. «Болезни имеют эволюционную основу, поэтому понимание того, почему мы такие, какие мы есть, может помочь нам найти новые подходы к устранению наших слабостей».
Самовосстанавливающиеся плоские черви
Для таких исследователей, как Ронер и Крумлауф, использование репертуара животных за пределами типичных лабораторных моделей позволяет им изучать конкретные характеристики в их самых экстремальных, преувеличенных формах. Прожорливая пещерная рыба стала идеальным животным для изучения метаболизма человека. Бесчелюстная минога представляет собой прекрасную модель для изучения сложностей развития мозга и головы. Точно так же самовосстанавливающийся плоский червь представляет собой идеальную систему для понимания того, как некоторые организмы восстанавливают поврежденные органы или недостающие части тела.
Прожорливая пещерная рыба стала идеальным животным для изучения метаболизма человека. Бесчелюстная минога представляет собой прекрасную модель для изучения сложностей развития мозга и головы. Точно так же самовосстанавливающийся плоский червь представляет собой идеальную систему для понимания того, как некоторые организмы восстанавливают поврежденные органы или недостающие части тела.
«Технологические возможности в биологии беспрецедентны — за считанные дни вы можете буквально перейти от ничего не зная об организме к исчерпывающему списку всех включенных или выключенных генов», — говорит исследователь Алехандро Санчес Альварадо, доктор философии. .«Мы являемся свидетелями будущего биомедицинских исследований, где такие достижения, как секвенирование и редактирование генома, означают, что мы больше не ограничены домашними животными, а можем искать ответы на вопросы о болезнях, старении и регенерации в других местах природы».
Санчес Альварадо считает, что регенерация является одним из последних необузданных рубежей биологии развития. Несмотря на десятилетия исследований, ученые до сих пор не понимают, как нескольким удачливым представителям животного мира удается совершать этот удивительный подвиг.У саламандр может отрасти обрезанный хвост; у рыбок данио могут отрастать плавники или даже кусочки поврежденной сердечной ткани. У одного из самых талантливых регенеративных магов, планарии, после обезглавливания может вырасти совершенно новая голова. Разрезание этих крошечных, стреловидных плоских червей на кусочки приводит к растущему выводку полноразмерных клонов.
Несмотря на десятилетия исследований, ученые до сих пор не понимают, как нескольким удачливым представителям животного мира удается совершать этот удивительный подвиг.У саламандр может отрасти обрезанный хвост; у рыбок данио могут отрастать плавники или даже кусочки поврежденной сердечной ткани. У одного из самых талантливых регенеративных магов, планарии, после обезглавливания может вырасти совершенно новая голова. Разрезание этих крошечных, стреловидных плоских червей на кусочки приводит к растущему выводку полноразмерных клонов.
Двадцать лет назад Санчес Альварадо начал читать об этих жизнерадостных существах, жаждущих узнать их секреты. Когда он узнал, что планарию Schmidtea mediterranea , обладающую небольшим размером генома и небольшим числом хромосом, можно получить из заброшенного фонтана в парке Барселоны, он и его тогдашний постдокторант Фил Ньюмарк, доктор философии, прилетели в город и расставили ловушки с приманкой для печени в каждом фонтане, который смогли найти. Затем исследователи превратили свой улов в линию из сотен тысяч планарий, которые сейчас используются в лабораториях по всей территории Соединенных Штатов.
Затем исследователи превратили свой улов в линию из сотен тысяч планарий, которые сейчас используются в лабораториях по всей территории Соединенных Штатов.
В собственной лаборатории Санчеса Альварадо его команда создает генетическую блок-схему, чтобы описать, как этот чудесный процесс разворачивается у планарий. Сначала они подносят к животному лезвие бритвы, отрезая ему голову или жизненно важный орган, например, глотку. Затем они измеряют, как более 20 000 генов червя включаются или выключаются, когда они начинают отращивать кусочки плоти.Как только исследователи узнают, какие гены задействованы, они используют передовые молекулярные методы, такие как РНК-интерференция, чтобы заставить замолчать каждый из этих генов, чтобы увидеть, как это влияет на способность животного к регенерации в следующий раз, когда оно попадет под нож.
На данный момент его группа ученых идентифицировала несколько групп генов, ответственных за успешную регенерацию. Некоторые, такие как ген под названием β-катенин, помогают организму понять, нужно ли ему снова отрастить голову или хвост. Другие, в том числе ген FoxA, отвечают за восстановление определенного органа.В конце концов, каждая изуродованная планария снова становится целой благодаря действию стволовых клеток, тех самых клеточных образований, которые отвечают за пополнение мертвых или поврежденных клеток, которые проходят через наши вены, выстилают наш кишечник и покрывают нашу кожу.
Другие, в том числе ген FoxA, отвечают за восстановление определенного органа.В конце концов, каждая изуродованная планария снова становится целой благодаря действию стволовых клеток, тех самых клеточных образований, которые отвечают за пополнение мертвых или поврежденных клеток, которые проходят через наши вены, выстилают наш кишечник и покрывают нашу кожу.
«Если бы мы могли собрать информацию о консервативных механизмах между червями и людьми, мы могли бы понять, почему мы можем использовать те же самые клетки только для восстановления простого износа, а не для запуска полномасштабной регенеративной реакции», — говорит Санчес Альварадо.
К сожалению, никто не знает, является ли регенерация способностью, которую другие организмы развили отдельно, или это то, что когда-то было у человеческого рода, но было утрачено.Чтобы ответить на этот вопрос, исследователям придется внимательно изучить наших эволюционных предков, чтобы найти ключи к потенциальному самоисцелению человека.
Люминесцентные морские анемоны
Анализ генетических основ самых разных видов животных становится проще по мере того, как секвенирование становится дешевле и становится более рутинным. По последним подсчетам, были секвенированы геномы почти 2500 многоклеточных организмов, в том числе морских миног, пещерных рыб, планарий и актиний. Эти проекты преподнесли несколько неожиданных сюрпризов.Возьмем актинию звездочку, Nematostella vectensis , на первый взгляд примитивное животное, относящееся к типу других простаков, таких как кораллы и медузы. Неожиданно оказалось, что его геном большой и сложный, он имеет больше общего с людьми и другими позвоночными, чем с традиционными модельными организмами, такими как плодовые мушки или круглые черви.
Это несоответствующее открытие привлекло внимание младшего исследователя Мэтью Гибсона, доктора философии, который большую часть своей карьеры посвятил изучению развития плодовой мушки.Гибсона интересует, как клетки животных складываются в высокоорганизованные слои, называемые эпителием. Эти эпителиальные листы выстилают почти все поверхности тела, создавая барьеры для стенок тела, тканей и органов. Nematostella оказался ошеломляющим примером этого типа клеточной организации, организм, который Гибсон описывает как «красивый мешок эпителия».
Эти эпителиальные листы выстилают почти все поверхности тела, создавая барьеры для стенок тела, тканей и органов. Nematostella оказался ошеломляющим примером этого типа клеточной организации, организм, который Гибсон описывает как «красивый мешок эпителия».
Крупным планом актиния поразительно красива: полупрозрачный, наполненный жидкостью стебель увенчан более чем дюжиной тонких щупалец, похожих на лепестки цветка.Но организм выносливее, чем кажется. Кажется, что он не умирает по естественным причинам и даже выживает, будучи разрезанным надвое, регенерируя свою вторую половину. Когда Гибсон и его команда впервые рассмотрели этих актиний под флуоресцентным микроскопом, они заметили светящиеся пятна ярко-красного цвета прямо под щупальцами животного. Из любопытства они клонировали ген, ответственный за загадочную красную флуоресценцию, позже названный NvFP-7R .
Исследователи точно не знают, для какой цели служит NvFP-7R в актинии, хотя некоторые считают, что он может действовать как своего рода солнцезащитный крем, защищающий организм от вредных лучей.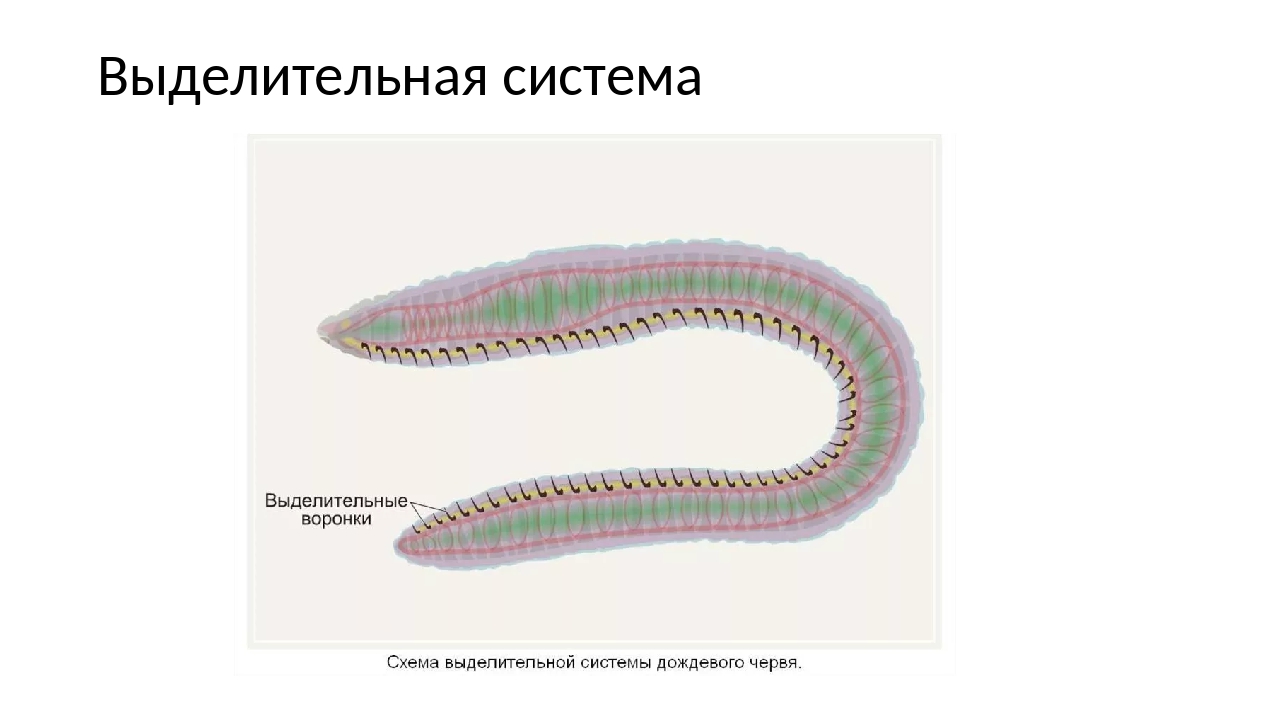 Гибсон и его коллеги придумали собственное применение флуоресцентного белка в качестве мишени для тестирования двух революционных инструментов редактирования генома. Они использовали методы, известные как CRISPR и TALEN, чтобы «выбить» ген NvFP-7R , чтобы стереть ярко-красные пятна животного. Сейчас проводятся аналогичные эксперименты по выбиванию наиболее интересующих их генов — тех, которые участвуют в контроле за развитием и расположением эпителиальных клеток.
Гибсон и его коллеги придумали собственное применение флуоресцентного белка в качестве мишени для тестирования двух революционных инструментов редактирования генома. Они использовали методы, известные как CRISPR и TALEN, чтобы «выбить» ген NvFP-7R , чтобы стереть ярко-красные пятна животного. Сейчас проводятся аналогичные эксперименты по выбиванию наиболее интересующих их генов — тех, которые участвуют в контроле за развитием и расположением эпителиальных клеток.
Биология эпителиальных клеток может предоставить ценную информацию как о нормальном развитии, так и о происхождении рака.Эпителиальные клетки составляют подавляющее большинство раковых заболеваний человека — любой диагноз, который содержит слово «карцинома», имеет эпителиальные корни, и любой рак, который распространился, вышел за пределы эпителиальных слоев. Сосредоточив внимание на фундаментальных клеточных, эволюционных и эволюционных проблемах, Гибсон подчеркивает потенциальное значение этой работы для исследования рака.
Подобно другим исследователям, которые делят компанию с необычными организмами, такими как минога, пещерная рыба и плоские черви, Гибсон быстро указывает, что результаты, оказывающие наибольшее влияние, часто приходят из неожиданных мест.На самом деле, система редактирования генов CRISPR имеет революционные биомедицинские последствия, хотя изначально она была открыта исследователями, изучающими, как бактерии измельчают вторгшиеся вирусы. Сегодня он используется для вырезания и вставки геномов многих видов по желанию.
«Ошибочно думать, что мы уже знаем все, что нужно знать, потому что мы подробно рассмотрели несколько лабораторных животных», — говорит Гибсон. «Один из лучших способов узнать как можно больше — это заглянуть туда, куда никто раньше не заглядывал, или попытаться задать вопросы, которые никто раньше не задавал.Частью получения доступа к новым знаниям является изучение нетрадиционных моделей животных».
плоских червей могут заменить млекопитающих в некоторых токсикологических тестах
Пресноводные планарии маленькие, недорогие, легко размножающиеся, чувствительны к химическим веществам в воде и развиваются в течение недели.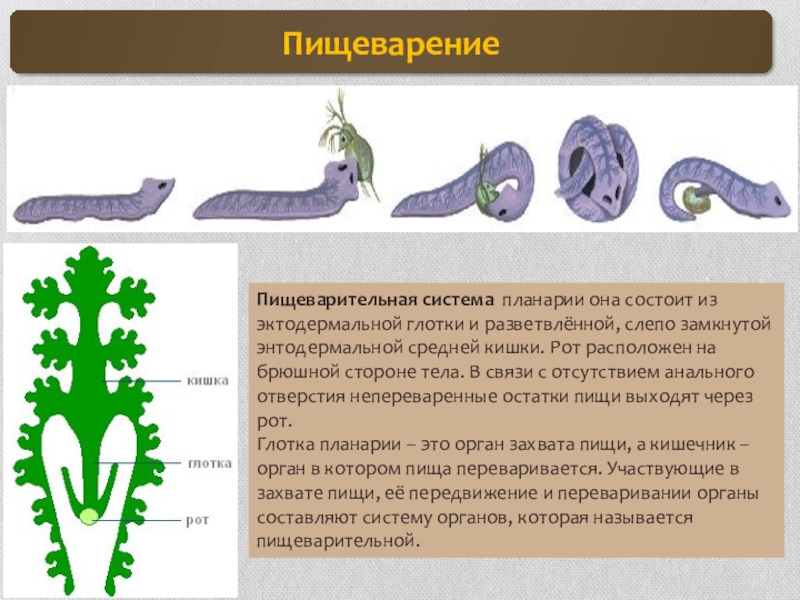 Предоставлено: UC San Diego
Предоставлено: UC San Diego
Лаборатории, которые проверяют химические вещества на неврологическую токсичность, могут сократить использование лабораторных мышей и крыс, заменив эти модели животных крошечными водными плоскими червями, известными как пресноводные планарии.
Ученые из Калифорнийского университета в Сан-Диего обнаружили, что планарии, которых обычно используют в школьных биологических лабораториях для изучения регенерации и примитивной нервной системы, на самом деле довольно сложны, когда дело доходит до моделирования реакции развивающейся нервной системы человека на потенциально токсичные химические вещества.
Исследователи опубликовали свои выводы в текущем выпуске журнала Toxicological Sciences.
«Поскольку планарии обладают уникальными характеристиками, такими как мозг средней сложности, короткое время регенерации и предлагают возможность параллельного изучения взрослых и развивающихся червей, они представляют собой хорошую систему, дополняющую существующие модели животных для изучения нейротоксичности при развитии», — сказала Ева. — Мария Шотц Коллинз, доцент кафедры биологии и физики, возглавлявшая исследовательскую группу.«Использование таких альтернативных моделей животных не только снизит затраты, но и значительно уменьшит количество лабораторных млекопитающих, используемых в токсикологических тестах».
— Мария Шотц Коллинз, доцент кафедры биологии и физики, возглавлявшая исследовательскую группу.«Использование таких альтернативных моделей животных не только снизит затраты, но и значительно уменьшит количество лабораторных млекопитающих, используемых в токсикологических тестах».
Люди сталкиваются с тысячами потенциально токсичных соединений в окружающей среде, и новые химические вещества ежедневно добавляются в продукты, которые мы используем, от пестицидов до косметики и пищевых добавок. Как проверить эти новые химические вещества на их безопасность, стало растущей проблемой, учитывая, что традиционные токсикологические испытания долгое время полагались на лабораторных грызунов.Сейчас предпринимаются усилия по замене их альтернативами, в которых используются культивируемые клетки или альтернативные животные модели, такие как рыбки данио, которые позволяют исследователям быстрее и с меньшими затратами проверять тысячи потенциальных токсинов.
«В последние годы несколько правительственных учреждений начали совместную работу над так называемой «Инициативой Tox21» с целью изменить способ проведения токсикологических испытаний с помощью анализов in vitro, таких как культивированные клетки и альтернативы лабораторным грызунам, — объяснил Шотц Коллинз. «Поскольку каждая платформа тестирования, будь то модель на животных или анализ in vitro, имеет свои ограничения, важно проводить тесты на нескольких платформах, чтобы определить токсические концентрации и механизмы действия для разработки надежных рекомендаций по воздействию на человека».
«Поскольку каждая платформа тестирования, будь то модель на животных или анализ in vitro, имеет свои ограничения, важно проводить тесты на нескольких платформах, чтобы определить токсические концентрации и механизмы действия для разработки надежных рекомендаций по воздействию на человека».
Шотц Коллинз и ее сотрудники начали свое исследование, когда заметили, что планарии, которых они использовали в своих лабораторных экспериментах, были особенно чувствительны к различным условиям окружающей среды.
В качестве эксперимента они разработали полуавтоматическую платформу скрининга с пятью шагами для характеристики токсичности девяти известных «нейротоксикантов», состоящих из обычно используемых растворителей, пестицидов и детергентов, и нейтрального агента, глюкозы, для вида планарии, называемого Дугезия японская. Затем исследователи количественно оценили влияние различных соединений на жизнеспособность планарий, стимулированное и нестимулированное поведение, регенерацию и структуру мозга.
«Сравнение наших результатов с другими альтернативными токсикологическими моделями животных, а именно с личинками рыбок данио и нематодами, показало, что планарии сравнительно чувствительны к тестируемым химическим веществам», — заключили ученые в своей статье.
«Подобно рыбкам данио и нематодам, пресноводные планарии маленькие, недорогие и простые в разведении, чувствительны к химическим веществам в воде и быстро развиваются», — добавили исследователи.
Но планарии также имеют важные преимущества перед этими альтернативными моделями животных.
«Что делает пресноводных планарий уникальными и особенно хорошо подходящими для нейротоксикологии развития, так это наша способность одновременно изучать генетически идентичных взрослых и развивающихся животных, что позволяет нам напрямую сравнивать влияние потенциальных токсикантов на взрослый и развивающийся мозг без возможных осложнений со стороны изменчивость генетических факторов», — написали ученые.
Кроме того, они добавили, что нервная система планарии намного сложнее, чем у нематод, но проще, чем у рыбок данио, и имеет «те же нейронные субпопуляции и нейротрансмиттеры, что и мозг млекопитающих, чтобы иметь отношение к исследованиям на людях. На самом деле считается, что мозг планарии больше похож на мозг позвоночных, чем на мозг других беспозвоночных с точки зрения структуры и функций».
На самом деле считается, что мозг планарии больше похож на мозг позвоночных, чем на мозг других беспозвоночных с точки зрения структуры и функций».
Шотц Коллинз подчеркнула, что, хотя исследование ее группы демонстрирует жизнеспособность пресноводных планарий в качестве альтернативной животной модели нейротоксичности, водные плоские черви не заменят лабораторных грызунов, а вместо этого ограничат их использование.
«Модели на млекопитающих по-прежнему будут необходимы, — добавила она, — но предварительный скрининг с использованием различных моделей позволит нам выбрать меньшее количество токсикантов для тестирования на млекопитающих, тем самым сократив их использование до строгого минимума».
Другими исследователями из Калифорнийского университета в Сан-Диего, участвовавшими в исследовании, были Даниэль Хагстром, Оливье Коше-Эскартин, Сики Чжан и Синди Хуу.
Ссылка на их статью в Toxicological Sciences находится в doi: 10.1093/toxsci/kfv129. Проект был поддержан грантами Национальных институтов здравоохранения (5T32GM007240-37), Фонда Хеллмана, Фонда Берроуза Велкома и Фонда Альфреда П.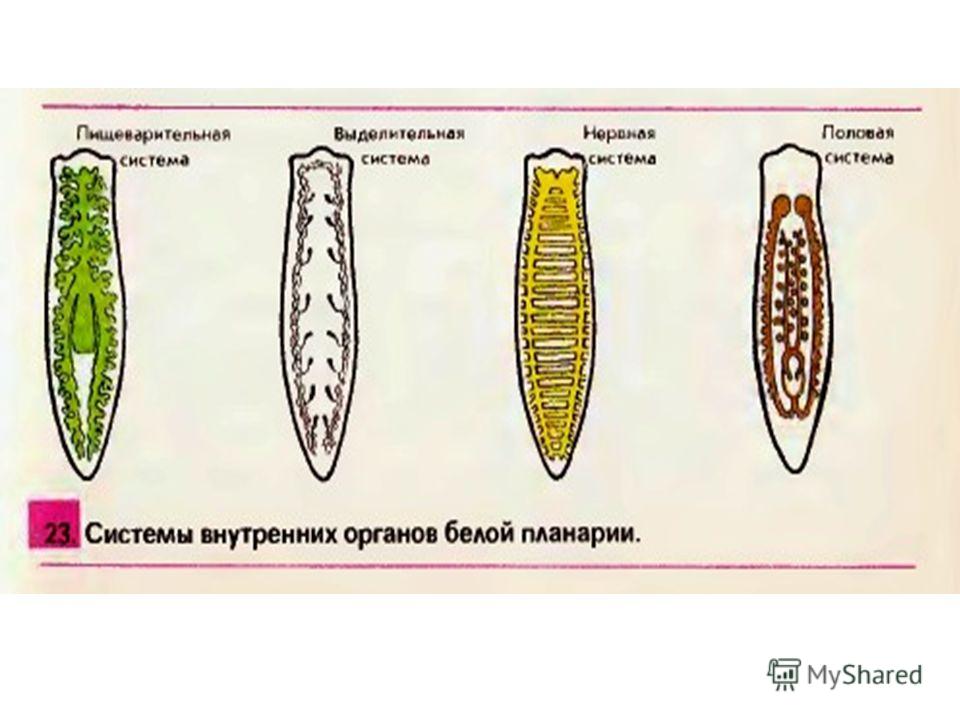 Фонд Слоуна.
Фонд Слоуна.
Поделиться
Обнаружение кораллоядных многослойных плоских червей Amakusaplana acroporae на Большом Барьерном рифе, Австралия — первое сообщение из дикой природы
Abstract
Роль коралловоядных получает все большее признание как важный фактор здоровья кораллов в то время, когда коралловые рифы во всем мире сталкиваются с целым рядом других факторов стресса. Многослойный плоский червь, Amakusaplana acroporae , является ненасытным хищником акропоридных кораллов Индо-Тихоокеанского региона в неволе, и его непреднамеренное попадание в аквариумы привело к гибели целых колоний кораллов.Хотя этот плоский червь был вредителем для сообщества коралловых аквакультур более десяти лет, он был обнаружен только в аквариумах и никогда не описывался в дикой природе. Понимание его биологии и экологии в его естественной среде имеет решающее значение для определения жизнеспособных биологических средств контроля для более успешного выращивания колоний Acropora в аквариумах, а также для нашего понимания того, какие биотические взаимодействия важны для роста кораллов и приспособления к жизни на рифах. Используя морфологические, гистологические и молекулярные методы, мы определили, что поликлад, обнаруженный на Acropora valida с острова Лизард, Австралия, представляет собой A.акропоры . Присутствие внеклеточного Symbiodinium в кишечнике и паренхиме и спироцист в кишечнике указывает на то, что это кораллоядное животное в дикой природе. Обследование размерного ряда особей показывает созревание полового аппарата и увеличение количества глаз при увеличении длины тела. Консервативные оценки численности показывают, что A. acroporae встречались в 7 из 10 собранных колоний кораллов, в среднем 2,6 ± 0,65 (среднее ± SE) особей на колонию.Это первое сообщение о A. acroporae в дикой природе и закладывает основу для будущих исследований экологии и истории жизни A. acroporae в естественной среде обитания.
Используя морфологические, гистологические и молекулярные методы, мы определили, что поликлад, обнаруженный на Acropora valida с острова Лизард, Австралия, представляет собой A.акропоры . Присутствие внеклеточного Symbiodinium в кишечнике и паренхиме и спироцист в кишечнике указывает на то, что это кораллоядное животное в дикой природе. Обследование размерного ряда особей показывает созревание полового аппарата и увеличение количества глаз при увеличении длины тела. Консервативные оценки численности показывают, что A. acroporae встречались в 7 из 10 собранных колоний кораллов, в среднем 2,6 ± 0,65 (среднее ± SE) особей на колонию.Это первое сообщение о A. acroporae в дикой природе и закладывает основу для будущих исследований экологии и истории жизни A. acroporae в естественной среде обитания.
Образец цитирования: Роулинсон К.А., Стелла Дж.С. (2012) Открытие кораллоядных многослойных плоских червей, Amakusaplana acroporae , на Большом Барьерном рифе, Австралия – первое сообщение из дикой природы.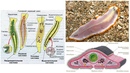 ПЛОС ОДИН 7(8):
е42240.
https://doi.org/10.1371/журнал.pone.0042240
ПЛОС ОДИН 7(8):
е42240.
https://doi.org/10.1371/журнал.pone.0042240
Редактор: Себастьян К. А. Ферс, Центр тропической морской экологии им. Лейбница, Германия
Поступила в редакцию: 11 апреля 2012 г.; Принято: 5 июля 2012 г.; Опубликовано: 1 августа 2012 г.
Авторское право: © Rawlinson, Stella. Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Сбор животных и полевые работы финансировались Фондом Югилбар и Исследовательской станцией на острове Лизард – учреждением Австралийского музея и Премии Управления морского парка Большого Барьерного рифа «Наука для управления», присужденной Дж. С. Стелла. Морфологический и молекулярный анализ финансировался за счет гранта Канадского совета по естественным наукам и инженерным исследованиям (A5056), присужденного Б.К. Зал. Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
С. Стелла. Морфологический и молекулярный анализ финансировался за счет гранта Канадского совета по естественным наукам и инженерным исследованиям (A5056), присужденного Б.К. Зал. Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Роль коралловоядных на коралловых рифах становится все более важной для экологии коралловых рифов, учитывая ряд других факторов стресса, с которыми в настоящее время сталкиваются коралловые рифы во всем мире [1]. Беспозвоночные составляют большинство кораллоядных, превосходя своих собратьев-рыб почти в 3 к 1 [2], [3]. Однако на большинство видов беспозвоночных долгое время не обращали внимания из-за их небольшого размера и загадочной природы [4].Кораллоядные беспозвоночные могут играть важную роль в здоровье кораллов, нанося незначительные или смертельные повреждения своим кораллам-хозяевам, что впоследствии может иметь пагубные последствия для роста и приспособленности кораллов [1]. Они также были вовлечены в передачу или повышение уязвимости к болезням кораллов [5], которые косвенно способствуют утрате кораллов или изменениям в составе сообщества. Поскольку склерактиниевые кораллы являются основными строителями рифов, требуется больше внимания для выявления их хищников и определения роли, которую они могут играть в поддержании или сохранении экосистем коралловых рифов.
Они также были вовлечены в передачу или повышение уязвимости к болезням кораллов [5], которые косвенно способствуют утрате кораллов или изменениям в составе сообщества. Поскольку склерактиниевые кораллы являются основными строителями рифов, требуется больше внимания для выявления их хищников и определения роли, которую они могут играть в поддержании или сохранении экосистем коралловых рифов.
Известно, что два вида многослойных плоских червей охотятся на склерактиниевые кораллы [6], [7], однако очень мало известно об их воздействии на коралловые рифы. Поскольку они маленькие и их трудно обнаружить из-за их превосходной маскировки от кораллового хозяина, они, возможно, до сих пор не учитывались в большинстве исследований животных, связанных с кораллами. Один такой загадочный поликлад, Acropora -поедающий плоский червь (широко известный как AEFW), был недавно идентифицирован и классифицирован как Amakusaplana acroporae Rawlinson et al., 2011 [7]. Известный только из аквариумов как известный вредитель кораллов Acropora , этот вид никогда не встречался в дикой природе. Фактически, таксономическое отнесение было основано на множестве экземпляров, собранных в двух аквариумах в США. Хотя большинство мелких животных, которые живут и питаются кораллами, оказывают незначительное вредное воздействие на кораллового хозяина, если таковое вообще имеется [8], заражение A. acroporae акропоридами в неволе может привести к быстрой и полной гибели колонии [9]. A. acroporae является разрушительным хищником по крайней мере девяти аквариумных индо-тихоокеанских акропор ( Acropora valida, A.pulchra, A. millepora, A. tortuosa, A. nana, A. tenuis, A. formosa, A. echinata и A. yongei ), особи откладывают несколько кладок яиц на хозяина Acropora , и вылупившиеся детеныши имеют низкую дисперсию способность [7]. Эти характеристики жизненного цикла в сочетании с высокой специфичностью добычи для Acropora делают этот вид потенциально важным кораллоядным кораллом Acropora .
Фактически, таксономическое отнесение было основано на множестве экземпляров, собранных в двух аквариумах в США. Хотя большинство мелких животных, которые живут и питаются кораллами, оказывают незначительное вредное воздействие на кораллового хозяина, если таковое вообще имеется [8], заражение A. acroporae акропоридами в неволе может привести к быстрой и полной гибели колонии [9]. A. acroporae является разрушительным хищником по крайней мере девяти аквариумных индо-тихоокеанских акропор ( Acropora valida, A.pulchra, A. millepora, A. tortuosa, A. nana, A. tenuis, A. formosa, A. echinata и A. yongei ), особи откладывают несколько кладок яиц на хозяина Acropora , и вылупившиеся детеныши имеют низкую дисперсию способность [7]. Эти характеристики жизненного цикла в сочетании с высокой специфичностью добычи для Acropora делают этот вид потенциально важным кораллоядным кораллом Acropora .
Corallivory на кораллах Acropora представляет особый интерес для управления охраной природы, поскольку Acropora является одним из наиболее экологически важных родов кораллов для коралловых рифов во всем мире.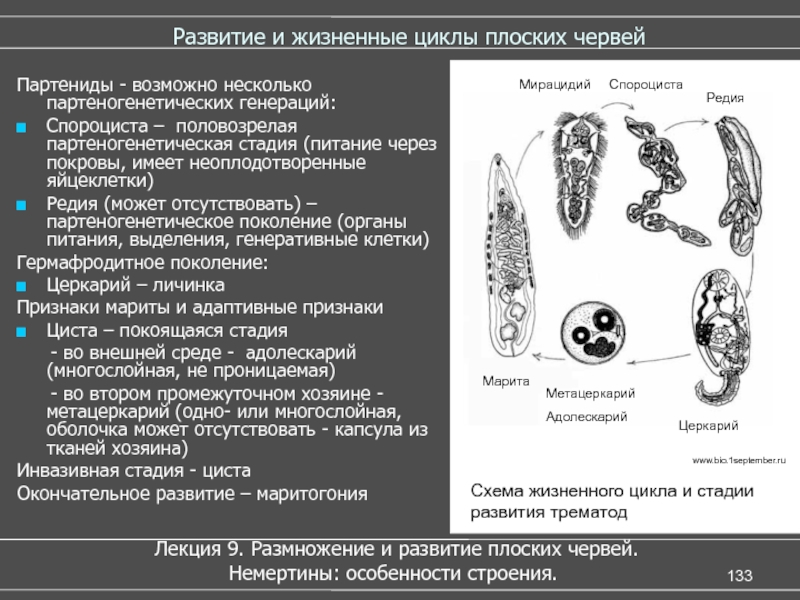 Это самый крупный из существующих родов кораллов, встречающийся во всех тропических океанах как доминирующий коралл, строящий рифы [10]. Акропориды являются источником критической среды обитания и пищи для огромного разнообразия (~150 видов) коралловых животных [3], [11], [12]. Это чрезвычайно многочисленные и быстрорастущие ветвящиеся кораллы, но они являются одними из наиболее восприимчивых кораллов к обесцвечиванию [13] и болезням [14]. Кроме того, многие кораллофаги активно выбирают виды Acropora в качестве предпочтительной добычи [1], [2], такие как морская звезда терновый венец, Acanthaster planci [15] и брюхоногие моллюски Drupella conus [16]. ].Акропориды также имеют коммерческое значение, поскольку входят в тройку самых популярных родов, собираемых для аквариумной торговли [17]. Таким образом, акропориды часто находятся в центре усилий по сохранению, таких как восстановление рифов [18], и понимание того, какие биотические и абиотические взаимодействия влияют на рост, выживание и распространение акропоридных кораллов, имеет решающее значение для их эффективного сохранения.
Это самый крупный из существующих родов кораллов, встречающийся во всех тропических океанах как доминирующий коралл, строящий рифы [10]. Акропориды являются источником критической среды обитания и пищи для огромного разнообразия (~150 видов) коралловых животных [3], [11], [12]. Это чрезвычайно многочисленные и быстрорастущие ветвящиеся кораллы, но они являются одними из наиболее восприимчивых кораллов к обесцвечиванию [13] и болезням [14]. Кроме того, многие кораллофаги активно выбирают виды Acropora в качестве предпочтительной добычи [1], [2], такие как морская звезда терновый венец, Acanthaster planci [15] и брюхоногие моллюски Drupella conus [16]. ].Акропориды также имеют коммерческое значение, поскольку входят в тройку самых популярных родов, собираемых для аквариумной торговли [17]. Таким образом, акропориды часто находятся в центре усилий по сохранению, таких как восстановление рифов [18], и понимание того, какие биотические и абиотические взаимодействия влияют на рост, выживание и распространение акропоридных кораллов, имеет решающее значение для их эффективного сохранения.
Учитывая, что Amakusaplana acroporae предпочитает индо-тихоокеанские виды Acropora , предполагается, что этот червь является эндемичным для этого региона.Его загадочная окраска и относительно небольшой размер затрудняют обнаружение in situ, а , следовательно, его легко ввести в аквариумы в качестве эпифауны Acropora . Обнаружение A. acroporae в его естественной среде позволит продолжить изучение его биологии и экологических взаимодействий, а это, в свою очередь, может привести к открытию эффективных биологических средств борьбы с этим кораллоядным в неволе. Это исследование было направлено на то, чтобы определить, является ли еще не идентифицированный многослойный плоский червь, обнаруженный в колониях Acropora valida с острова Лизард, Австралия, Amakusaplana acroporae .
Материалы и методы
Сбор и фиксация животных
животных были собраны на острове Лизард в северной части Большого Барьерного рифа, Австралия (рис. 1а) (в соответствии с разрешением Управления морского парка Большого Барьерного рифа: G09/32695.1). Отбор проб проводился в ноябре 2011 г. при средней температуре воды 28,5–29,5°С. Десять колоний (около 20 см в диаметре) Acropora valida были собраны случайным образом в мелководной рифовой среде обитания (глубина 2–4 м) в лагуне острова Лизард (рис.1б) (14°41′13,04 ю.ш., 145°27′20,06 в.д.). Все кораллы выглядели здоровыми и не имели никаких признаков повреждения тканей. Колонии кораллов сначала накрывали полиэтиленовым пакетом, чтобы обеспечить удержание животных, осторожно отделяли от субстрата и переправляли в пресной морской воде в лабораторию. Из-за загадочной природы многослойных ассоциатов визуальный осмотр не выявил животных. Другая макрофауна была визуально идентифицирована и зарегистрирована. Кораллы держали над пустым контейнером и всю поверхность, включая все межветвевое пространство, промывали струями морской воды под высоким давлением примерно в течение одной минуты.
1а) (в соответствии с разрешением Управления морского парка Большого Барьерного рифа: G09/32695.1). Отбор проб проводился в ноябре 2011 г. при средней температуре воды 28,5–29,5°С. Десять колоний (около 20 см в диаметре) Acropora valida были собраны случайным образом в мелководной рифовой среде обитания (глубина 2–4 м) в лагуне острова Лизард (рис.1б) (14°41′13,04 ю.ш., 145°27′20,06 в.д.). Все кораллы выглядели здоровыми и не имели никаких признаков повреждения тканей. Колонии кораллов сначала накрывали полиэтиленовым пакетом, чтобы обеспечить удержание животных, осторожно отделяли от субстрата и переправляли в пресной морской воде в лабораторию. Из-за загадочной природы многослойных ассоциатов визуальный осмотр не выявил животных. Другая макрофауна была визуально идентифицирована и зарегистрирована. Кораллы держали над пустым контейнером и всю поверхность, включая все межветвевое пространство, промывали струями морской воды под высоким давлением примерно в течение одной минуты. Воду в емкости просеивали через сито 1×1 мм, которое затем переворачивали над емкостью со свежей морской водой. Этот метод оказался успешным как для вытеснения животных, так и для поддержания их в живых и в хорошем состоянии. Для гистологического анализа и анализа всего препарата особей фиксировали в 4% замороженном формальдегиде в морской воде и оставляли на ночь при комнатной температуре. Затем животных несколько раз промывали в морской воде перед тем, как перевести на хранение в 70% этанол. Для молекулярного анализа взрослые особи сохраняли в 95% неденатурированном этаноле.
Воду в емкости просеивали через сито 1×1 мм, которое затем переворачивали над емкостью со свежей морской водой. Этот метод оказался успешным как для вытеснения животных, так и для поддержания их в живых и в хорошем состоянии. Для гистологического анализа и анализа всего препарата особей фиксировали в 4% замороженном формальдегиде в морской воде и оставляли на ночь при комнатной температуре. Затем животных несколько раз промывали в морской воде перед тем, как перевести на хранение в 70% этанол. Для молекулярного анализа взрослые особи сохраняли в 95% неденатурированном этаноле.
Рисунок 1. Место сбора Amakusaplana acroporae.
(a) Карта северной части Большого Барьерного рифа, Австралия, с врезкой острова Лизард. (b) Фотография острова Лизард с местом сбора (красный квадрат) Amakusaplana acroporae из коралла-хозяина Acropora valida. Фото предоставлено «Спутниковый снимок GeoEye».
https://doi.org/10.1371/journal.pone.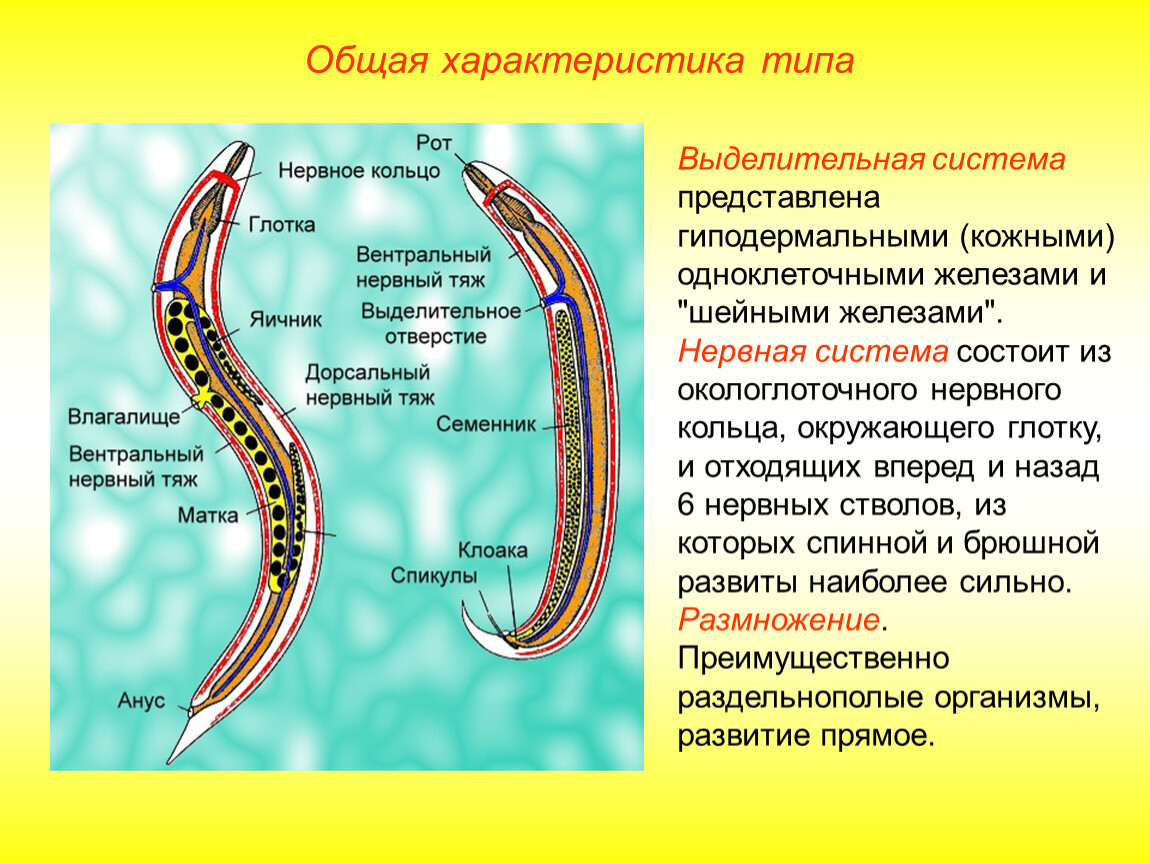 0042240.g001
0042240.g001
Морфологический анализ
Гистологические протоколы и протоколы цельных препаратов описаны в Rawlinson et al.[7]. Для идентификации видов гистологические срезы, залитые парафином (5 мкМ), окрашивали в соответствии с протоколом трихрома Массона. Присутствие и распределение Symbiodinium в червях было подтверждено путем наблюдения их автофлуоресценции с помощью флуоресцентного составного микроскопа Zeiss Axioscope на срезах, окрашенных DAPI (4′, 6-диамидино-2-фенилиндол, Sigma). Пять особей были рассечены в поперечной плоскости, три особи — в сагиттальной плоскости и две особи смонтированы в виде цельных препаратов.Весь материал, включая целые экземпляры, хранится в Музее Тропиков Квинсленда.
Молекулярный анализ
Геномная ДНК была извлечена из одного взрослого образца (G20079), и участок D1–D2 гена 28 S рДНК был амплифицирован с использованием новой пары прямого (3′–5′) и обратного (3′–5′) праймеров, разработанной для Amakusaplana acroporae на основе консервативных областей в выровненных поликладных последовательностях 28S рДНК [7]. ПЦР проводили с использованием следующих значений температуры/времени цикла: 4 мин при 94°C; 45 циклов по 20 с при 94°С, 20 с при 52.5°С и 90 с при 72°С; 8 мин при 72°C для окончательного удлинения. ПЦР подвергали электрофорезу в 1% агарозном геле, продукт вырезали и очищали с использованием набора Qiagen MinElute Gel Extraction Kit. Амплифицированный фрагмент клонировали и секвенировали в обоих направлениях с использованием векторной системы pGem-T easy (Promega). Область D1-D2 28 S рДНК G20079 (инвентарный номер Genbank JQ791553) была выровнена с использованием алгоритма ClustalW в MacVector с поликладными последовательностями, использованными Rawlinson et al. [7] (внешняя группа Macrostomum lignano ).Филогенетические деревья были построены с использованием байесовского вывода (BI) в MrBayes 3.2 [19]. Анализ проводился для 2 000 000 поколений с частотой дискретизации 100. Поддержка узлов определялась апостериорными вероятностями.
ПЦР проводили с использованием следующих значений температуры/времени цикла: 4 мин при 94°C; 45 циклов по 20 с при 94°С, 20 с при 52.5°С и 90 с при 72°С; 8 мин при 72°C для окончательного удлинения. ПЦР подвергали электрофорезу в 1% агарозном геле, продукт вырезали и очищали с использованием набора Qiagen MinElute Gel Extraction Kit. Амплифицированный фрагмент клонировали и секвенировали в обоих направлениях с использованием векторной системы pGem-T easy (Promega). Область D1-D2 28 S рДНК G20079 (инвентарный номер Genbank JQ791553) была выровнена с использованием алгоритма ClustalW в MacVector с поликладными последовательностями, использованными Rawlinson et al. [7] (внешняя группа Macrostomum lignano ).Филогенетические деревья были построены с использованием байесовского вывода (BI) в MrBayes 3.2 [19]. Анализ проводился для 2 000 000 поколений с частотой дискретизации 100. Поддержка узлов определялась апостериорными вероятностями.
Результаты
Морфологический анализ
Анализ общей морфологии был проведен у восемнадцати человек, восемь из которых были сделаны для гистологического анализа анатомии. Мы отнесли это животное к семейству Prosthiostomidae (подотряд Cotylea) на основании следующих признаков: отсутствие щупалец, рот на переднем конце глоточной камеры, трубчатая глотка, большой мускулистый семенной пузырь, примыкающий к паре толсто- добавочные пузырьки со стенками, сосочек полового члена и стилет, заключенные в карман полового члена, короткое влагалище, закрученное спереди, и маточные каналы, расположенные в виде буквы Н [20].Диагноз рода Amakusaplana устанавливали по отсутствию брюшной присоски, небольшому срединному углублению на переднем крае и неравномерно расположенным глазам в передней области тела [21]. Мы определили, что это животное относится к Amakusaplana acroporae (а не Amakusaplana ohshimai , типу и только другим видам Amakusaplana ) на основании расположения глаз (четкие кластеры маргинальных и мозговых глаз у A. acroporae ) и глаза. количество (менее половины количества глаз у A.acroporae по сравнению с A.
Мы отнесли это животное к семейству Prosthiostomidae (подотряд Cotylea) на основании следующих признаков: отсутствие щупалец, рот на переднем конце глоточной камеры, трубчатая глотка, большой мускулистый семенной пузырь, примыкающий к паре толсто- добавочные пузырьки со стенками, сосочек полового члена и стилет, заключенные в карман полового члена, короткое влагалище, закрученное спереди, и маточные каналы, расположенные в виде буквы Н [20].Диагноз рода Amakusaplana устанавливали по отсутствию брюшной присоски, небольшому срединному углублению на переднем крае и неравномерно расположенным глазам в передней области тела [21]. Мы определили, что это животное относится к Amakusaplana acroporae (а не Amakusaplana ohshimai , типу и только другим видам Amakusaplana ) на основании расположения глаз (четкие кластеры маргинальных и мозговых глаз у A. acroporae ) и глаза. количество (менее половины количества глаз у A.acroporae по сравнению с A.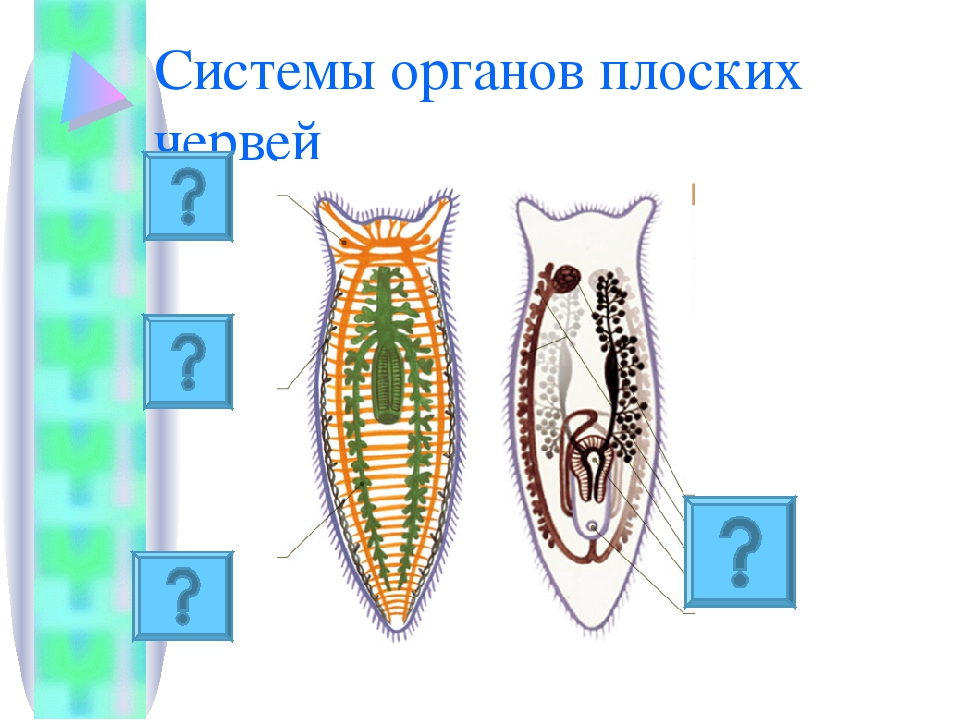 ohshimai ) и особенности репродуктивных систем (луковичное предсердие самки и отчетливая яйцевая камера у A. acroporae ) (см. ниже и [7]).
ohshimai ) и особенности репродуктивных систем (луковичное предсердие самки и отчетливая яйцевая камера у A. acroporae ) (см. ниже и [7]).
Особи Amakusaplana acroporae , собранные на острове Лизард, имели размеры от 3–6 мм в длину и 1,5–3,5 мм в ширину в фиксированном состоянии. Изучение макроморфологии и гистологических срезов животных с разной длиной тела выявило две тенденции в признаках, имеющих таксономическое значение.Во-первых, с увеличением длины тела увеличивается количество глаз. Два скопления вентральных краевых глаз увеличились с 5 глаз на скопление у животного длиной 3,2 мм (рис. 2а) до 10 глаз на скопление у животного длиной 5 мм (рис. 2б). Количество церебральных глаз, сгруппированных вокруг мозга, также увеличилось с 27 до 35 у этих двух людей (рис. 2а и б). Во-вторых, мужская репродуктивная система созревает раньше женской репродуктивной системы. Четыре исследованных особи с длиной тела <4 мм имели зрелые мужские, но незрелые женские репродуктивные системы. Половая система самца состоит из полового члена, вооруженного длинным склератизированным стилетом (рис. 2в), который находится в оболочке полового члена и выступает в предсердие самца. Половой член через эякуляторный проток соединяется с двумя добавочными пузырьками и большим семенным пузырьком, каждый из которых окружен мышечной оболочкой (рис. 2в). Предстательные железы впадают в оболочку полового члена, а секрет предстательной железы и сперматозоиды видны в мужском предсердии (рис. 2с). В то время как женская репродуктивная система у этих особей была незрелой, присутствовал женский гонопор (рис.2г), но в матках не было видно яиц (рис. 2а) и не было развито скорлуповых желез. Особи длиной ≥4 мм имели зрелые мужские и женские репродуктивные системы. Яйца присутствовали в яичниках и парных матках (рис. 2б), хорошо развитые скорлуповые железы окружали расширенное предсердие самки и отчетливую овальную яйцеклетку (рис. 2е), а сперматозоиды присутствовали в семявыносящих протоках и семенных пузырьках.
Половая система самца состоит из полового члена, вооруженного длинным склератизированным стилетом (рис. 2в), который находится в оболочке полового члена и выступает в предсердие самца. Половой член через эякуляторный проток соединяется с двумя добавочными пузырьками и большим семенным пузырьком, каждый из которых окружен мышечной оболочкой (рис. 2в). Предстательные железы впадают в оболочку полового члена, а секрет предстательной железы и сперматозоиды видны в мужском предсердии (рис. 2с). В то время как женская репродуктивная система у этих особей была незрелой, присутствовал женский гонопор (рис.2г), но в матках не было видно яиц (рис. 2а) и не было развито скорлуповых желез. Особи длиной ≥4 мм имели зрелые мужские и женские репродуктивные системы. Яйца присутствовали в яичниках и парных матках (рис. 2б), хорошо развитые скорлуповые железы окружали расширенное предсердие самки и отчетливую овальную яйцеклетку (рис. 2е), а сперматозоиды присутствовали в семявыносящих протоках и семенных пузырьках. Это развитие репродуктивной зрелости с увеличением длины тела указывает на то, что это животное является последовательным, а затем одновременным гермафродитом.
Это развитие репродуктивной зрелости с увеличением длины тела указывает на то, что это животное является последовательным, а затем одновременным гермафродитом.
Рисунок 2. Анатомия и морфология Amakusaplana acroporae с острова Лизард, Австралия.
Макеты и схематические изображения (a) 3,2 мм и (b) 5,0 мм длиной A. acroporae (масштаб = 1 мм), демонстрирующие общую морфологию и развитие женских репродуктивных структур. Особи длиной менее 4 мм обладают (в) зрелой мужской репродуктивной системой, но (г) незрелой женской системой. Особи длиной более 4 мм обладают зрелыми (д) мужской и женской (е) репродуктивными системами.(g) Поперечное сечение дистальной части глотки показывает морфологию ее расщелины. Symbiodinium присутствуют в кишечнике и паренхиме A. acroporae и могут наблюдаться (h) с помощью автофлуоресценции и (i) световой микроскопии, спироцисты также видны в просвете кишечника. AV Аксессуар, BR Мозг, CE Главный глаз, CE Cerebral Eye, EC яичная камера, FA Женский атриум, FG Женский гонопор, в кишечник, м рот, мА мужской атриум , MB Мускулистая лампочка, мне маргинальный глаз, мг Мужской гонопор, ov яичника, pH Pharenx, PHC Pharyning, PNST Penis Stylet, SC Spirocysts, SG железы, sgp оболочка железы, sp сперматозоиды, sv семенные пузырьки, sym Symbiodinium , ut uteri, vi vagina interna .
https://doi.org/10.1371/journal.pone.0042240.g002
Amakusaplana acroporae с острова Лизард отличались от особей, собранных в аквариумах, двумя морфологическими признаками. Во-первых, количеством краевых глазков, сгруппированных по обе стороны от углубления переднего края. Половозрелые особи с острова Лизард имеют 9,83±0,98 (среднее ±SD; n = 6) краевых глаз на скопление вместо 2–3 у половозрелых животных из аквариумов. Во-вторых, при осмотре в поперечном сечении трубчатый зев А.acroporae расщеплен [7]. Эта щель появляется только на дистальном конце глотки у четырех животных, исследованных в поперечном сечении с острова Лизард (рис. 2g), тогда как у экземпляра, исследованного из неволи, она простирается дальше к кишечнику.
Молекулярный анализ
Байесовский анализ данных о последовательности 28S рДНК (рис. 3) разрешает особь с острова Лизард (G20079) в пределах хорошо поддерживаемой клады (BI: 100%) Amakusaplana acroporae , собранных из двух разных аквариумов в США (Вирджиния).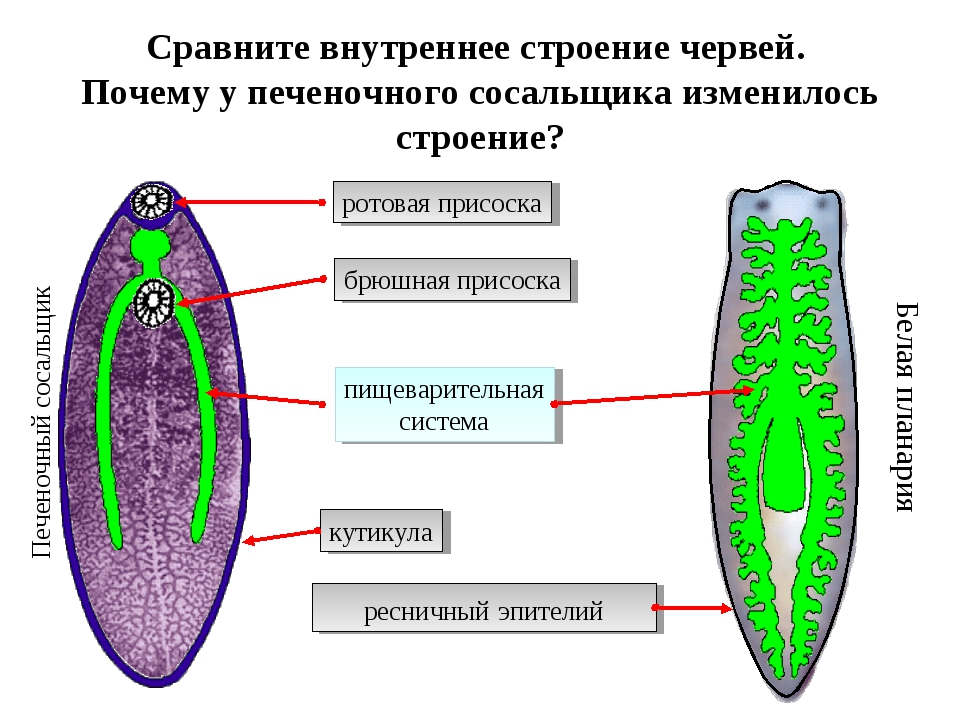 и Нью-Йорк).Этот анализ согласуется с отнесением этой особи на основе морфологии к A. acroporae.
и Нью-Йорк).Этот анализ согласуется с отнесением этой особи на основе морфологии к A. acroporae.
Рис. 3. Консенсусное филогенетическое дерево, полученное в результате байесовского анализа данных о последовательности 28S рДНК.
Поддержка клады, указанная байесовскими апостериорными вероятностями. Поликлад острова Лизард (G20079) выпадает из неволи в хорошо поддерживаемую кладу Amakusaplana acroporae .
https://doi.org/10.1371/journal.pone.0042240.g003
Частота встречаемости и свидетельства Corallivory
Amakusaplana acroporae обнаружен в 7 из 10 собранных колоний кораллов. В каждой колонии было обнаружено от 1 до 5 животных, в среднем 2,6 ± 0,65 (среднее ± SE) животных на колонию. Все восемь особей A. acroporae , которые были исследованы гистологически, имели Symbiodinium в кишечнике и паренхиме, распределенной по всему телу (рис. 2h и i). Symbiodinium не наблюдались внутриклеточно, и их автофлуоресценция отличала их от поликладных клеток (рис.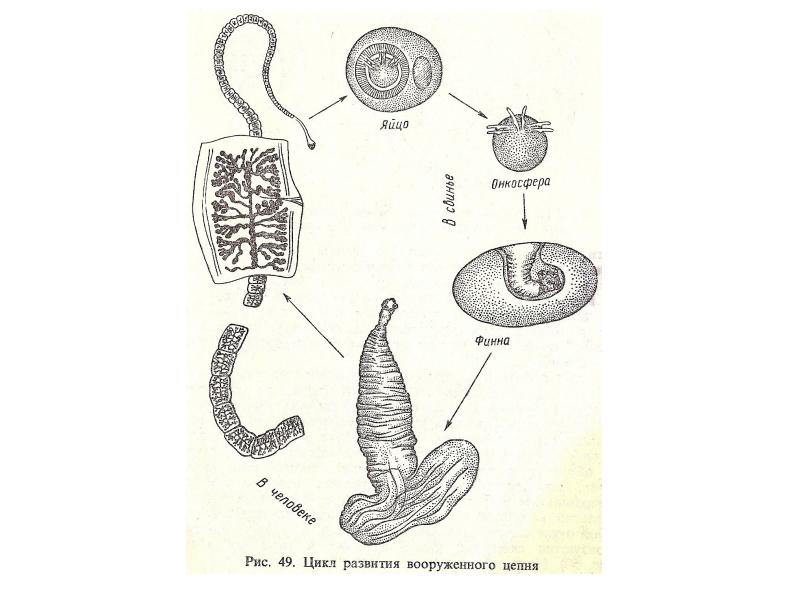 2ч). Крупные (∼24 мкм) необожженные спироцисты были особенно многочисленны в основном стволе кишечника, менее многочисленны в ветвях кишечника и отсутствовали в дорсальном эпидермисе. Другой аморфный материал в кишечнике мог состоять из коралловой слизи и ткани.
2ч). Крупные (∼24 мкм) необожженные спироцисты были особенно многочисленны в основном стволе кишечника, менее многочисленны в ветвях кишечника и отсутствовали в дорсальном эпидермисе. Другой аморфный материал в кишечнике мог состоять из коралловой слизи и ткани.
Другая макрофауна, присутствующая в колониях
Acropora ValidaКаждая из десяти колоний содержала другую макрофауну, в том числе пару размножающихся коралловых крабов (обозначенных как Tetralia nigrolineata) , 2 бычков ( Gobiodon brochus ) и 2 креветок-палемонид ( Coralliocaris graminea ).
Обсуждение
Это исследование идентифицирует многослойного плоского червя, обнаруженного в колониях Acropora valida вокруг острова Лизард, как Amakusaplana acroporae , и представляет собой первое сообщение об этом животном в дикой природе. Свидетельство того, что A. acroporae является кораллоядным в своей естественной среде обитания, как и в аквариумах, подтверждается присутствием Symbiodinium и кишечнополостных спироцист в кишечнике и паренхиме. Кроме того, внеклеточное распределение Symbiodinium предполагает, что они были проглочены и не являются симбионтами, живущими в пределах A.акропоры . Обнаружение A. acroporae в его естественной среде и документирование метода извлечения животных из их кораллового хозяина живыми поможет дальнейшим исследованиям численности, распространения и экологии этого коралловоядного.
Кроме того, внеклеточное распределение Symbiodinium предполагает, что они были проглочены и не являются симбионтами, живущими в пределах A.акропоры . Обнаружение A. acroporae в его естественной среде и документирование метода извлечения животных из их кораллового хозяина живыми поможет дальнейшим исследованиям численности, распространения и экологии этого коралловоядного.
Многокладчатые плоские черви морфологически достаточно однородны, и за последние два столетия описания и классификации видов основывались на ограниченном числе таксономических признаков [20], [22], [23]. Эти признаки, используемые на всех таксономических уровнях, описываются на основе общей морфологии и анатомии животного; например наличие брюшной присоски, тип и положение глотки, наличие щупалец, детали репродуктивной системы и узоры глаз.Однако эти последние два источника таксономических признаков, которые важны для идентификации на уровне видов Prosthiostomidae, демонстрируют пластичность во время созревания, как это наблюдается в этом исследовании и у Като [24] (у Prosthiostomum (L. ) purum) . Поэтому, не имея доступа к материалу Amakusaplana ohshimai для сравнительного морфологического и молекулярного анализа, мы не можем исключить возможность того, что Amakusaplana acroporae является синонимом A. ohshimai , учитывая, что признаки, которые отличают два вида (расположение глаз и количество , морфометрия мужской и женской репродуктивных систем и наличие яйцевой камеры) варьируют в зависимости от длины тела и созревания.Это подчеркивает необходимость включения в будущие описания видов изменений морфологических признаков в процессе развития, а также внутри и между популяциями, где это возможно. Тем не менее, на основании наших морфологических и молекулярных диагнозов мы уверены, что поликлады, собранные на острове Лизард, принадлежат к тем же видам, что и описанные в аквариумах [7].
) purum) . Поэтому, не имея доступа к материалу Amakusaplana ohshimai для сравнительного морфологического и молекулярного анализа, мы не можем исключить возможность того, что Amakusaplana acroporae является синонимом A. ohshimai , учитывая, что признаки, которые отличают два вида (расположение глаз и количество , морфометрия мужской и женской репродуктивных систем и наличие яйцевой камеры) варьируют в зависимости от длины тела и созревания.Это подчеркивает необходимость включения в будущие описания видов изменений морфологических признаков в процессе развития, а также внутри и между популяциями, где это возможно. Тем не менее, на основании наших морфологических и молекулярных диагнозов мы уверены, что поликлады, собранные на острове Лизард, принадлежат к тем же видам, что и описанные в аквариумах [7].
Присутствие Symbiodinium и кишечнополостных спироцист в кишечнике и паренхиме свидетельствует о том, что Amakusaplana acroporae является кораллоядным в своей естественной среде обитания. Никаких других объектов добычи не наблюдалось в кишечнике A. acroporae , что указывает на то, что они, возможно, являются облигатными кораллофагами (как это было продемонстрировано на единственном другом известном поликладном Prosthiostomum (Prosthiostomum) montiporae , питающемся склерактиниями [25]). Поскольку морфология спироцист в пределах Anthozoa довольно однородна [26], более прямым доказательством того, что A. acropora питается A. valida , может быть сравнение молекулярных отпечатков ткани коралла в содержимом кишечника с тканью коралла-хозяина.В отличие от некоторых поликладных видов, которые секвестрируют нематоцисты от книдарий-жертв в латеральном и заднем краях их дорсального эпидермиса [27]-[29], в этом исследовании не было свидетельств секвестрации спироцист у A. acroporae . Хотя некоторые кораллофаги обладают морфологическими адаптациями, обеспечивающими им защиту от нематоцист кораллов [30], неизвестно, как A. acroporae преодолевает нематоцисты Acropora .
Никаких других объектов добычи не наблюдалось в кишечнике A. acroporae , что указывает на то, что они, возможно, являются облигатными кораллофагами (как это было продемонстрировано на единственном другом известном поликладном Prosthiostomum (Prosthiostomum) montiporae , питающемся склерактиниями [25]). Поскольку морфология спироцист в пределах Anthozoa довольно однородна [26], более прямым доказательством того, что A. acropora питается A. valida , может быть сравнение молекулярных отпечатков ткани коралла в содержимом кишечника с тканью коралла-хозяина.В отличие от некоторых поликладных видов, которые секвестрируют нематоцисты от книдарий-жертв в латеральном и заднем краях их дорсального эпидермиса [27]-[29], в этом исследовании не было свидетельств секвестрации спироцист у A. acroporae . Хотя некоторые кораллофаги обладают морфологическими адаптациями, обеспечивающими им защиту от нематоцист кораллов [30], неизвестно, как A. acroporae преодолевает нематоцисты Acropora .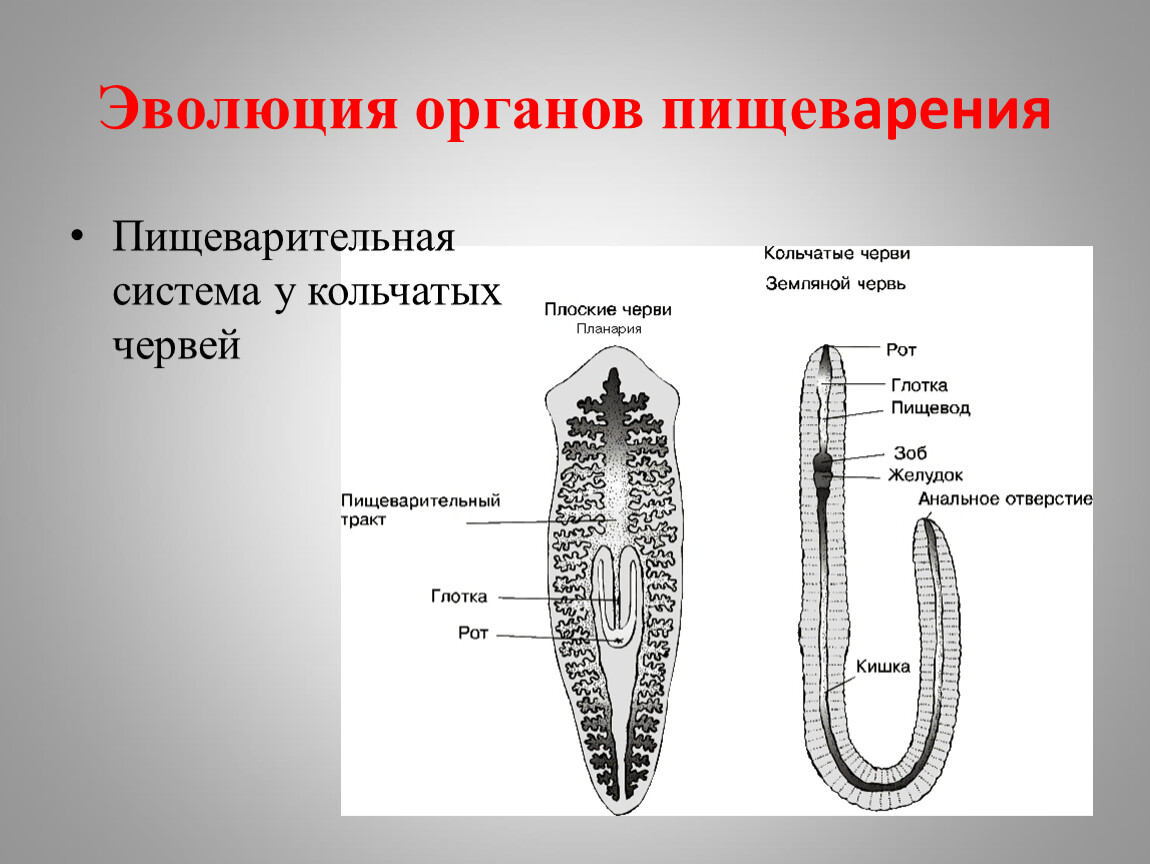
Поскольку Amakusaplana acroporae довольно мала, загадочна и обладает отличной маскировкой от своего акропоридного коралла-хозяина, этот вид легко не заметить, и до сих пор их коралловоядность в дикой природе, вероятно, приписывалась другому виду или даже болезни кораллов [30]. .Более того, до сих пор этот вид был неизвестен морским экологам, что препятствовало возможности узнать о его роли в здоровье кораллов. Хотя Свит и др. [31] сообщили, что в предыдущих исследованиях было обнаружено A. acroporae (или AEFW, как это было известно в то время) в Индонезии и Красном море (цитируя [32]–[34]), Haapkylä et al. [33] фактически относятся к червю-акоэлю из рода Waminoa , который является известным коралловым ассоциатом [35], а в двух других исследованиях плоские черви не упоминаются.Хотя весьма вероятно, что распространение A. acroporae отражает распространение его видов-жертв Acropora , и поэтому его можно найти в Индонезии и Красном море, одних только визуальных методов исследования, вероятно, недостаточно, чтобы увидеть A.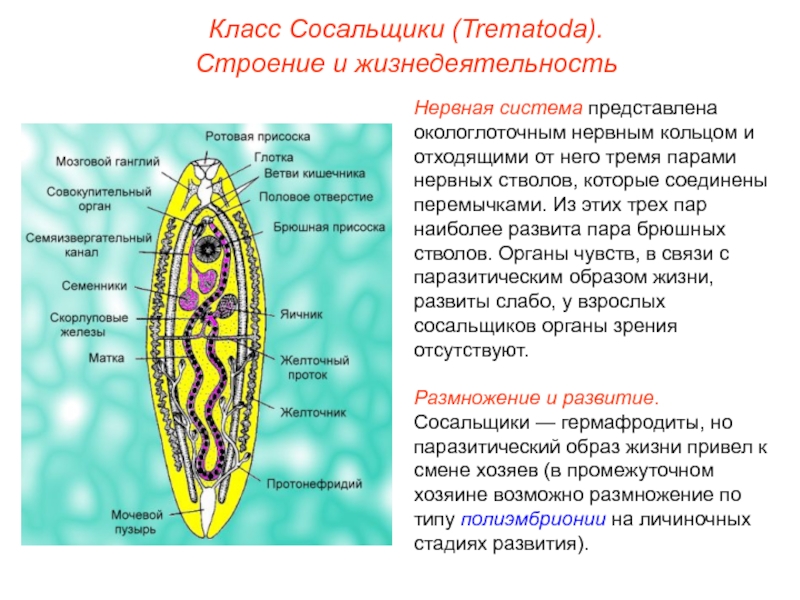 . acroporae in situ (Stella pers obs), хотя в сильно зараженной колонии могут быть видны следы укусов в тканях коралла и кубышки яиц на голом скелете коралла. Поскольку A. acroporae был обнаружен в ассоциации с другими индо-тихоокеанскими видами Acropora в аквариумах ( A.pulchra, A. millepora, A. tortuosa, A. nana, A. tenuis, A. formosa, A. echinata и A. yongei [7]), возможно, эти виды также будут подходящими естественными хозяевами и могут служить как логическую основу для того, чтобы больше узнать об этих животных в естественных условиях.
. acroporae in situ (Stella pers obs), хотя в сильно зараженной колонии могут быть видны следы укусов в тканях коралла и кубышки яиц на голом скелете коралла. Поскольку A. acroporae был обнаружен в ассоциации с другими индо-тихоокеанскими видами Acropora в аквариумах ( A.pulchra, A. millepora, A. tortuosa, A. nana, A. tenuis, A. formosa, A. echinata и A. yongei [7]), возможно, эти виды также будут подходящими естественными хозяевами и могут служить как логическую основу для того, чтобы больше узнать об этих животных в естественных условиях.
Получение знаний о естественной частоте встречаемости и экологии этих многослойных червей будет иметь жизненно важное значение для понимания их экологической роли на коралловых рифах. В колониях Acropora valida , отобранных в этом исследовании, не было обнаружено явного повреждения тканей.Частично это может быть связано с небольшой численностью (в среднем менее трех червей на колонию) или присутствием естественных хищников в колонии кораллов. Оценки численности на колонию в этом исследовании несколько занижены, учитывая, что размер нашей выборки был небольшим, а метод был смещен в сторону особей размером более 1 мм 2 . Размер детенышей Amakusaplana acroporae составляет 250–300 мкм [7], и эти ювенильные стадии избежали сбора. В аквариумах было замечено, что некоторые виды губанов поедают взрослых червей, смещенных в толще воды [7], [9].Эмбриональные и вылупившиеся стадии жизни могут быть уязвимы для различных хищников, таких как брюхоногие и десятиногие моллюски, которые очень разнообразны на акропоридных кораллах [12]. Коралловые крабы, принадлежащие к роду Tetralia, , имеют высокую частоту встречаемости на сильно ветвящихся акропоридах [11] и, как известно, оказывают коралловым хозяевам услуги по очистке [36]. Возможно, эти крабы могут поедать взрослых червей и кубышки яиц, тем самым контролируя численность червей. Также возможно, что А.acroporae становится серьезным вредителем только в нарушенных коралловых системах и аквариумной среде, как в случае с P.
Оценки численности на колонию в этом исследовании несколько занижены, учитывая, что размер нашей выборки был небольшим, а метод был смещен в сторону особей размером более 1 мм 2 . Размер детенышей Amakusaplana acroporae составляет 250–300 мкм [7], и эти ювенильные стадии избежали сбора. В аквариумах было замечено, что некоторые виды губанов поедают взрослых червей, смещенных в толще воды [7], [9].Эмбриональные и вылупившиеся стадии жизни могут быть уязвимы для различных хищников, таких как брюхоногие и десятиногие моллюски, которые очень разнообразны на акропоридных кораллах [12]. Коралловые крабы, принадлежащие к роду Tetralia, , имеют высокую частоту встречаемости на сильно ветвящихся акропоридах [11] и, как известно, оказывают коралловым хозяевам услуги по очистке [36]. Возможно, эти крабы могут поедать взрослых червей и кубышки яиц, тем самым контролируя численность червей. Также возможно, что А.acroporae становится серьезным вредителем только в нарушенных коралловых системах и аквариумной среде, как в случае с P. (P.) montiporae [9], [25]. Необходимы дальнейшие наблюдения за A. acroporae в полевых условиях, чтобы определить скорость потребления тканей кораллов (и последующую гибель колоний), выявить их естественных хищников и количественно определить пространственно-временные закономерности их численности.
(P.) montiporae [9], [25]. Необходимы дальнейшие наблюдения за A. acroporae в полевых условиях, чтобы определить скорость потребления тканей кораллов (и последующую гибель колоний), выявить их естественных хищников и количественно определить пространственно-временные закономерности их численности.
Склерактиниевые кораллы являются наиболее функционально важными кораллами для рифовых процессов, поэтому важно понимать, какие факторы влияют на их рост и выживание.Кораллоядные представляют собой биотический стрессор, который может пагубно повлиять на рост и приспособленность кораллов. Чтобы эффективно управлять усилиями по сохранению Acropora на коралловых рифах и успешно выращивать колонии в аквариумах, крайне важно понимать, какие биотические взаимодействия важны для роста и приспособленности кораллов. Это открытие Amakusaplana acroporae в дикой природе и на острове Лизард облегчит доступ к популяциям этого кораллового симбионта, что позволит исследовать A. acroporae экология, биология и история жизни в естественной среде обитания.
acroporae экология, биология и история жизни в естественной среде обитания.
Благодарности
Мы благодарим д-ра Дж. Эндрю Гиллиса за техническую помощь в проведении молекулярного анализа, проф. Брайана К. Холла за комментарии к этой рукописи, Фернанду де Фариа и Бенджамина Гордона за помощь в сборе, д-ра Алану Греч за создание карты и д-ра Нила Брюса. Музея тропического Квинсленда, Музей Квинсленда для депонирования образцов.
Вклад авторов
Идея и разработка экспериментов: JSS KAR.Выполнял эксперименты: JSS KAR. Проанализированы данные: JSS KAR. Предоставленные реагенты/материалы/инструменты для анализа: JSS KAR. Написал статью: JSS KAR.
Каталожные номера
- 1. Ротян Р.Д., Льюис С.М. (2008) Воздействие коралловых хищников на тропические рифы. Морская экология-Прогресс. Серия 367: 73–91.
- 2.
Коул А.Дж., Пратчетт М.С., Джонс Г.П. (2008)Разнообразие и функциональное значение рыб, питающихся кораллами, на тропических коралловых рифах.
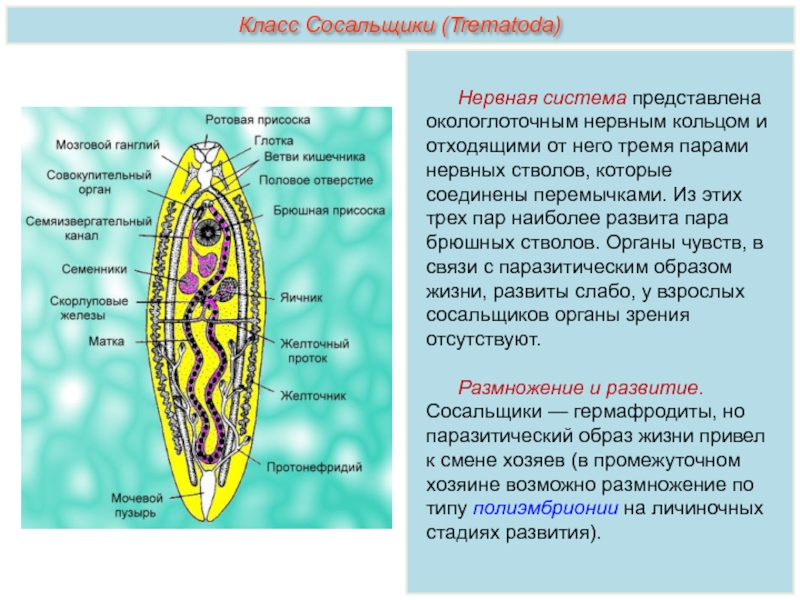 Рыба и рыболовство 9: 286–307.
Рыба и рыболовство 9: 286–307. - 3. Стелла Дж. С., Пратчетт М. С., Хатчингс П. А., Джонс Г. П. (2011) Беспозвоночные, связанные с кораллами: разнообразие, экологическое значение и уязвимость к нарушениям. Океанография и морская биология: ежегодный обзор, том 49: 43–104.
- 4. Bouchet P, Lozouet P, Maestrati P, Heros V (2002) Оценка величины видового богатства в тропической морской среде: исключительно большое количество моллюсков на территории Новой Каледонии. Биологический журнал Линнеевского общества 75: 421–436.
- 5. Sussman M, Loya Y, Fine M, Rosenberg E (2003) Морской огневый червь Hermodice carunculata является зимним резервуаром и весенне-летним переносчиком возбудителя обесцвечивания кораллов Vibrio shiloi . Экологическая микробиология 5: 250–255.
- 6. Poulter JL (1975) Гавайские поликладные плоские черви — Prosthiostomids. Тихоокеанская наука 29: 317–339.
- 7.
Роулинсон К.
 , Гиллис Дж., Биллингс Р., Борнеман Э. (2011)Таксономия и история жизни Acropora , питающихся плоскими червями Amakusaplana acroporae ; ноябрьсп. (Polycladida: Prosthiostomidae). Коралловые рифы 30: 693–705.
, Гиллис Дж., Биллингс Р., Борнеман Э. (2011)Таксономия и история жизни Acropora , питающихся плоскими червями Amakusaplana acroporae ; ноябрьсп. (Polycladida: Prosthiostomidae). Коралловые рифы 30: 693–705. - 8. Кастро П. (1988) Симбиозы животных в сообществах коралловых рифов — Обзор. Симбиоз 5: 161–184.
- 9. Nosratpour F (2008) Наблюдения за многослойным плоским червем, поражающим акропоровые кораллы в неволе. В: RJ L, M J, редакторы. Достижения в разведении кораллов в общественных аквариумах. Арнем, Нидерланды: Зоопарк Бюргерса. 37–46.
- 10. Уоллес К.С., Уиллис Б.Л. (1994) Систематика кораллового рода Acropora : значение новых биологических данных для представлений о видах.Ежегодный обзор экологии и систематики 25: 237–262.
- 11.
Паттон В.К. (1994) Распространение и экология животных, связанных с ветвящимися кораллами (виды Acropora ) Большого Барьерного рифа в Австралии.
 Бюллетень морской науки 55: 193–211.
Бюллетень морской науки 55: 193–211. - 12. Стелла Дж. С., Джонс Г. П., Пратчетт М. С. (2010) Изменчивость в структуре сообществ эпифауны беспозвоночных среди хозяев кораллов. Коралловые рифы 29: 957–973.
- 13. Маршалл П.А., Бэрд А.Х. (2000)Обесцвечивание кораллов на Большом Барьерном рифе: различная восприимчивость среди таксонов.Коралловые рифы 19: 155–163.
- 14. Аронсон Р.Б., Прехт В.Ф. (2001)Болезнь белой полосы и меняющееся лицо карибских коралловых рифов. Гидробиология 460: 25–38.
- 15. Ормонд РФГ, Хэнскомб, Нью-Джерси, Бич Д.Х. (1976) Выбор пищи и обучение у морской звезды с терновым венцом, Acanthaster planci (L). Морское поведение и физиология 4: 93–105.
- 16. Turner SJ (1994) Пространственная изменчивость численности брюхоногих моллюсков Drupella cornus .Коралловые рифы 13: 41–48.
- 17.
Ричардс З., Дельбек Дж., Ловелл Э., Басс Д., Эби Г.
 и др. (2008) Acropora valida . Красный список исчезающих видов МСОП.
и др. (2008) Acropora valida . Красный список исчезающих видов МСОП. - 18. Ринкевич Б. (2005) Сохранение коралловых рифов с помощью активных восстановительных мер, последних подходов и достижений последнего десятилетия. Экологические науки и технологии 39: 4333–4342.
- 19. Ронквист Ф., Хюльсенбек Дж. П. (2003) MrBayes 3: байесовский филогенетический вывод в смешанных моделях.Биоинформатика 19: 1572–1574.
- 20. Prudhoe S (1985) Монография о Polyclad Turbellaria. Лондон: Издательство Оксфордского университета. 259 стр.
- 21. Като К. (1938) Поликлады из Амакуса, Южная Япония. Японский журнал зоологии 8: 537–573.
- 22. Фобель А (1983) Polycladida, Turbellaria. Предложение и создание новой системы. Часть I. Mitteilungen des hamburgischen zoologischen Museums und Instituts 80: 189–259.
- 23.Faubel A (1984) Предложение Polycladida, Turbellaria и создание новой системы. Часть II.
 Mitteilungen des hamburgischen zoologischen Museums und Instituts 81: 189 = 259.
Mitteilungen des hamburgischen zoologischen Museums und Instituts 81: 189 = 259. - 24. Като К. (1937) Тринадцать новых поликладов от Мисаки. Японский журнал зоологии 7: 347–371.
- 25. Jokiel PL, Townsley SJ (1974) Биология Polyclad Prosthiostomum ( Prosthiostomum ) sp, нового кораллового паразита с Гавайев. Тихоокеанская наука 28: 361–373.
- 26. Ostman C (2000) Руководство по номенклатуре и классификации нематоцист, а также некоторые примечания о систематическом значении нематоцист. Scientia Марина 64: 31–46.
- 27. Лейдлоу Ф. (1906 г.) О морской фауне островов Зеленого Мыса из коллекций, сделанных в 1904 г. мистером К. Кросслендом — Многослойные турбеллярии. Труды Лондонского зоологического общества 2: 705–719.
- 28.
Lang A (1884) Die Polycladen (Seeplanarien) des Golfes von Neapel und der angrenzenden Meeresabschnitte.Монографии фауны и флоры Гольфа фон Неапеля. 688.

- 29. Holleman JJ (1998) Два новых вида рода Anonymus из Новой Зеландии (Polycladida, Cotylea). Гидробиология 383: 61–67.
- 30. Робертсон Р. (1970) Обзор хищников и паразитов каменистых кораллов с особой ссылкой на симбиотических переднежаберных брюхоногих моллюсков. Тихоокеанская наука 24: 43–54.
- 31. Sweet M, Jones R, Bythell J (2012)Болезни кораллов в аквариумах и в природе.Журнал Морской биологической ассоциации Соединенного Королевства 92: 791–801.
- 32. Барнеа О., Бен-Дов Э., Крамарски-Винтер Э., Кушмаро А. (2007) Характеристика болезни черных полос у каменистых кораллов Красного моря. Экологическая микробиология 9: 1995–2006.
- 33.
Хаапкила Дж., Сеймур А.С., Требилко Дж., Смит Д. (2007)Распространенность коралловых болезней и здоровье кораллов в морском парке Вакатоби, юго-восток Сулавеси, Индонезия. Журнал Морской биологической ассоциации Соединенного Королевства 87: 403–414.

- 34. Haapkyla J, Unsworth RKF, Seymour AS, Melbourne-Thomas J, Flavell M, et al. (2009)Пространственно-временная динамика коралловых заболеваний в морском национальном парке Вакатоби, юго-восточный Сулавеси, Индонезия. Болезни водных организмов 87: 105–115.
- 35. Winsor L (1990) Marine Turbellaria (Acoela) из Северного Квинсленда. Воспоминания Квинслендского музея 28: 785–800.
- 36. Stewart HL, Holbrook SJ, Schmitt RJ, Brooks AJ (2006) Симбиотические крабы поддерживают здоровье кораллов, очищая отложения.Коралловые рифы 25: 609–615.
Распространение Urceolaria mitra (Peritricha) Эпизой на плоских червях на JSTOR
Абстрактный 1. В лабораторных и полевых экспериментах изучено распространение эпизоотической урцеолярии митра фон Зиб на плоских червях (Polycelis tenuis Ijima). Жизненный цикл перитрихов не осложнен покоящимися стадиями. Только что вылупившиеся плоские черви не заражены; это происходит из внешних источников. 3.В одной серии опытов расселение в небольших объемах воды от зараженных к незараженным имаго и установление эквивалентной популяции заняло около 4 дней, а распространение на только что вылупившихся червей заняло больше времени. 4. Вопреки ранее существовавшему мнению, Urceolaria встречается в природе в планктоне и на субстрате в небольшом количестве. Он может существовать отдельно от своего хозяина только в течение короткого периода времени, примерно 6 часов. В лабораторных условиях он также становится планктонным, но нечасто. Он способен эффективно определить местонахождение своего хозяина и может сделать это в течение 6 часов.в относительно большом объеме воды. 5. Эксперимент показал, что расселение происходит в основном за счет того, что Urceolaria становится свободным плаванием и находит нового хозяина. Такой метод объясняет рассеяние, наблюдаемое в лаборатории. 6. При скученности червей во время кормления рассредоточения не наблюдалось. 7. Измеряя скорость роста молодых Polycelis tenuis и определяя встречаемость и обилие Urceolaria mitra в коллекциях мелких червей, было подсчитано, что половина только что вылупившихся червей заражается через 1-4 недели.
3.В одной серии опытов расселение в небольших объемах воды от зараженных к незараженным имаго и установление эквивалентной популяции заняло около 4 дней, а распространение на только что вылупившихся червей заняло больше времени. 4. Вопреки ранее существовавшему мнению, Urceolaria встречается в природе в планктоне и на субстрате в небольшом количестве. Он может существовать отдельно от своего хозяина только в течение короткого периода времени, примерно 6 часов. В лабораторных условиях он также становится планктонным, но нечасто. Он способен эффективно определить местонахождение своего хозяина и может сделать это в течение 6 часов.в относительно большом объеме воды. 5. Эксперимент показал, что расселение происходит в основном за счет того, что Urceolaria становится свободным плаванием и находит нового хозяина. Такой метод объясняет рассеяние, наблюдаемое в лаборатории. 6. При скученности червей во время кормления рассредоточения не наблюдалось. 7. Измеряя скорость роста молодых Polycelis tenuis и определяя встречаемость и обилие Urceolaria mitra в коллекциях мелких червей, было подсчитано, что половина только что вылупившихся червей заражается через 1-4 недели. Популяция перитрихов достигает среднего максимума, когда черви достигают 4,0 мм. в длину. 8. Поведение при расселении и продолжительность свободного существования U. mitra очень сходны с поведением U. patellae из блюдечек.
Популяция перитрихов достигает среднего максимума, когда черви достигают 4,0 мм. в длину. 8. Поведение при расселении и продолжительность свободного существования U. mitra очень сходны с поведением U. patellae из блюдечек.
Журнал экологии животных, основанный в 1932 году, публикует оригинальные
исследовательские работы по всем аспектам экологии животных; особенно те, которые делают
существенный вклад в наше понимание экологии животных, а также
предлагая понимание вопросов, представляющих общий интерес для экологов.Это включает в себя
обзоры, которые проливают свет на темы, занимающие центральное место в экологии животных, включая теоретические
анализы по конкретным темам. Журнал публикует стандартные статьи, обзоры эссе,
форумные материалы и статьи In Focus (по приглашению). Журнал издается
шесть раз в год. Более подробная информация доступна на сайте www.journalofanimalecology.org.
JSTOR предоставляет цифровой архив печатной версии The Journal.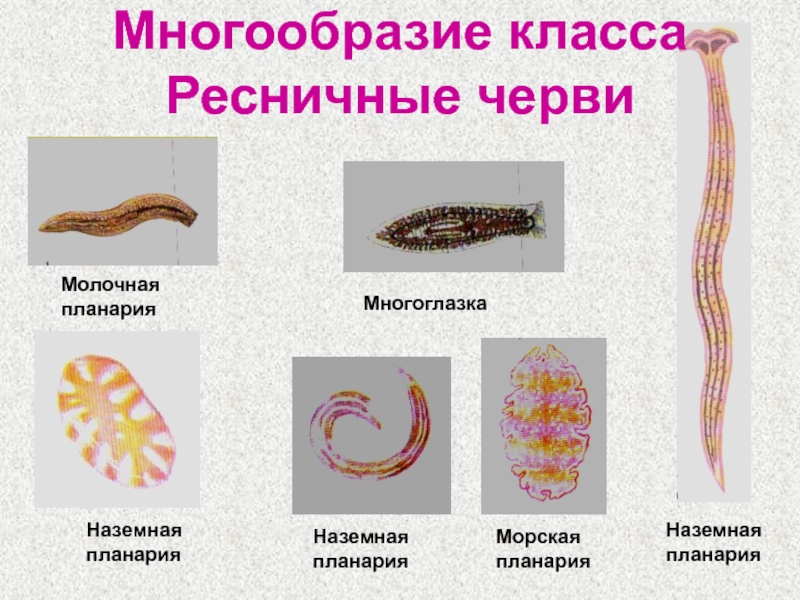 экологии животных. Электронная версия The Journal of Animal
Экология доступна на http://www3.interscience.wiley.com/journal/117960113/home.
Авторизованные пользователи могут иметь доступ к полным текстам статей на этом сайте.
экологии животных. Электронная версия The Journal of Animal
Экология доступна на http://www3.interscience.wiley.com/journal/117960113/home.
Авторизованные пользователи могут иметь доступ к полным текстам статей на этом сайте.
Британское экологическое общество — гостеприимный и инклюзивный дом для всех, кто интересуется экологией. Общество было основано в 1913 году и насчитывает более 6000 членов по всему миру, объединяя людей в региональном, национальном и глобальном масштабах для развития экологической науки. Многочисленные виды деятельности BES включают публикацию целого ряда научной литературы, в том числе семи всемирно известных журналов, организацию и спонсирование различных встреч, финансирование многочисленных программ грантов, образовательную и политическую работу.
.
