Мейоз
Половое размножение животных, растений и грибов связано с формированием специализированных половых клеток.
Мейоз — особый тип деления клеток, в результате которого образуются половые клетки.
В отличии от митоза, при котором сохраняется число хромосом, получаемых дочерними клетками, при мейозе число хромосом в дочерних клетках уменьшается вдвое.
Процесс мейоза состоит из двух последовательных клеточных делений — мейоза I (первое деление) и мейоза II (второе деление).
Удвоение ДНК и хромосом происходит только перед мейозом I.
В результате первого деления мейоза, называемого редукционным, образуются клетки с уменьшенным вдвое числом хромосом. Второе деление мейоза заканчивается образованием половых клеток. Таким образом, все соматические клетки организма содержат двойной, диплоидный (2n), набор хромосом, где каждая хромосома имеет парную, гомологичную хромосому. Зрелые половые клетки имеют лишь одинарный, гаплоидный (n), набор хромосом и соответственно вдвое меньшее количество ДНК.
Фазы мейоза
Во время профазы I мейоза двойные хромосомы хорошо видны в световой микроскоп. Каждая хромосомы состоит из двух хромотид, которые связаны вместе одной центромерой. В процессе спирализации двойные хромосомы укорачиваются. Гомологичные хромосомы тесно соединяются друг с другом продольно (хроматида к хроматиде), или, как говорят, конъюгируют. При этом хроматиды нередко перекрещиваются или перекручиваются одна вокруг другой. Затем гомологичные двойные хромосомы начинают как бы отталкиваться друг от друга. В местах перекреста хроматид происходят поперечные разрыва и обмены их участками. Это явление называют перекрестом хромосом. Одновременно, как и при митозе, распадется ядерная оболочка, исчезает ядрышко, образуются нити веретена. Отличие профазы I мейоза от профазы митоза состоит в конъюгации гомологичных хромосом и взаимном обмене участками в процессе перекреста хромосом.
Характерный признак
метафазы I — расположение в экваториальной плоскости клетки гомологичных хромосом, лежащих парами. Вслед за этим наступает анафаза I, во время которой целые гомологичные хромосомы, каждая состоящая из двух хроматид, отходят к противоположным полюсам клетки. Очень важно подчеркнуть одну особенность расхождения хромосом на этой стадии мейоза: гомологичные хромосомы каждой пары расходятся в стороны случайным образом, независимо от хромосом других пар. У каждого полюса оказывается вдвое меньше хромосом, чем было в клетке при начале деления. Затем наступает телофаза I, во время которой образуются две клетки с уменьшенным вдвое числом хромосом.
Вслед за этим наступает анафаза I, во время которой целые гомологичные хромосомы, каждая состоящая из двух хроматид, отходят к противоположным полюсам клетки. Очень важно подчеркнуть одну особенность расхождения хромосом на этой стадии мейоза: гомологичные хромосомы каждой пары расходятся в стороны случайным образом, независимо от хромосом других пар. У каждого полюса оказывается вдвое меньше хромосом, чем было в клетке при начале деления. Затем наступает телофаза I, во время которой образуются две клетки с уменьшенным вдвое числом хромосом.
Интерфаза короткая, так как синтеза ДНК не происходит. Далее следует второе мейотическое деление (мейоз II). Оно отличается от митоза только тем, что количество хромосом в
 Только теперь наступает настоящая интерфаза. Из каждой исходной клетки возникают четыре клетки с гаплоидным набором хромосом.
Только теперь наступает настоящая интерфаза. Из каждой исходной клетки возникают четыре клетки с гаплоидным набором хромосом.
Разнообразие гамет
Рассмотри мейоз клетки, имеющей три пары хромосом (2n = 6). В этом случае после двух мейотических делений образуются четыре клетки с гаплоидным набором хромосом (n = 3). Поскольку хромосомы каждой пары расходятся в дочерние клетки независимо от хромосом других пар, равновероятно образование восьми тиров гамет с различным сочетанием хромосом, присутствовавших в исходной материнской клетке. Еще большее разнообразие гамет обеспечивается конъюгацией и перекрестом гомологичных хромосом в профазе мейоза, что имеет очень большое общебиологическое значение.
Биологическое значение мейоза
Если бы в процессе мейоза не происходило уменьшения числа хромосом, то в каждом следующем поколении при слиянии ядер яйцеклетки и сперматозоида число хромосом увеличивалось бы бесконечно. Благодаря мейозу зрелые половые клетки получают гаплоидное (n) число хромосом, при оплодотворении же восстанавливается свойственное данному виду диплоидное (2n) число.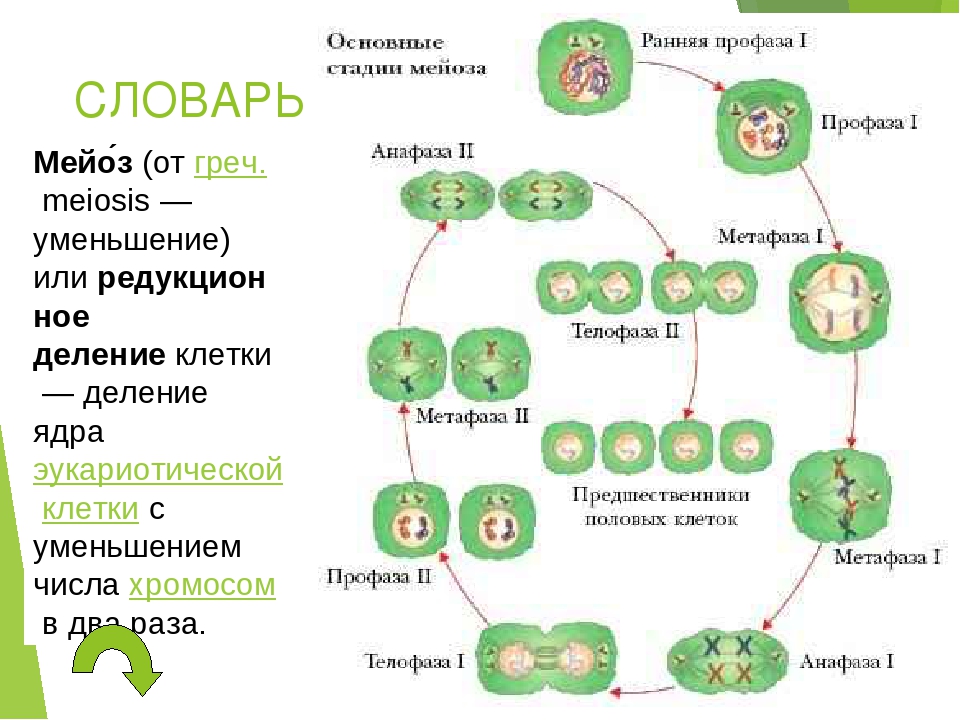 При мейозе гомологичные хромосомы попадают в разные половые клетки, а при оплодотворении парность гомологичных хромосом восстанавливается. Следовательно, обеспечивается постоянных для каждого вида полных диплоидный набор хромосом и постоянное количество ДНК.
Происходящие в мейозе перекрест хромосом, обмен участками, а также независимое расхождение каждой пары гомологичных хромосом определяют закономерности наследственной передачи признака от родителей потомству. Из каждой пары двух гомологичных хромосом (материнской и отцовской), входивших в хромосомный набор диплоидных организмов, в гаплоидном наборе яйцеклетки или сперматозоида содержится лишь одна хромосома. Она может быть:
При мейозе гомологичные хромосомы попадают в разные половые клетки, а при оплодотворении парность гомологичных хромосом восстанавливается. Следовательно, обеспечивается постоянных для каждого вида полных диплоидный набор хромосом и постоянное количество ДНК.
Происходящие в мейозе перекрест хромосом, обмен участками, а также независимое расхождение каждой пары гомологичных хромосом определяют закономерности наследственной передачи признака от родителей потомству. Из каждой пары двух гомологичных хромосом (материнской и отцовской), входивших в хромосомный набор диплоидных организмов, в гаплоидном наборе яйцеклетки или сперматозоида содержится лишь одна хромосома. Она может быть:
- отцовской хромосомой;
- материнской хромосомой;
- отцовской с участком материнской;
- материнской с участком отцовской.
 Это приводит к тяжелым нарушениям в развитии организма или к его гибели.
Это приводит к тяжелым нарушениям в развитии организма или к его гибели.
Другие заметки по биологии
(PDF) Генетический контроль мейоза у растений
404 СИМ АНОВСКИЙ, БОГДАНОВ
ГЕНЕТИКА том 54 № 4 2018
ВМI наблюдается варьирующее число унивален-
тов иредкие мультиваленты. Умутантов sy10 было
изучено поведение хромосом вМI сиспользовани-
ем пяти FISH-зондов. Было установлено, что зна-
чительная часть бивалентов (39%) умутантов обра-
зована негомологичными хромосомами [44, 47, 48].
Для этих же мутантов был проведён анализ распре-
деления белков ASY1 иZYP1 [48]. Оказалось, что
оба белка присутствуют на осях мейотических хро-
мосом, однако синапсис умутантов sy10 оказыва-
ется нарушенным. Уржи также известна мутация
synaptic 3 (sy3), которая препятствует полному за-
вершению синапсиса впрофазе I[39, 40].
7. СБОРКА СИНАПТОНЕМНЫХ
КОМПЛЕКСОВ. ЗИГОТЕНА ИПАХИТЕНА
Процесс взаимодействия гомологичных хромо-
сом принято разделять на четыре этапа: поиск го-
мологии, пресинаптическое выравнивание, спари-
вание исинапсис, т. е. сборка СК [117]. Формиро-
е. сборка СК [117]. Формиро-
вание СК является заключительным ирешающим
этапом взаимодействия гомологичных хромосом.
Нарушения вформировании синаптонемно-
го комплекса являются наиболее часто встречаю-
щимися дефектами умейотических мутантов, по-
лученных спомощью подходов “прямой” генети-
ки (forward genetic screens). Это объясняется тем,
что дефекты синапсиса могут быть следствием не-
скольких первичных дефектов вкогезии сестрин-
ских хроматид, гомологичном спаривании хромо-
сом ирекомбинации. Так, уупоминавшихся выше
мутантов syn1 арабидопсиса иafd1 кукурузы, уко-
торых отсутствует ключевой компонент когезино-
вого комплекса
–
REC8, сборка СК не происходит
[18, 84]. Это говорит озависимости инициации
сборки СК от надлежащей когезии сестринских
хроматид. Напрямую на сборку СК влияют гены,
которые кодируют структурные белки компонентов
СК. Укукурузы, на данный момент, не известны
мутации по таким генам.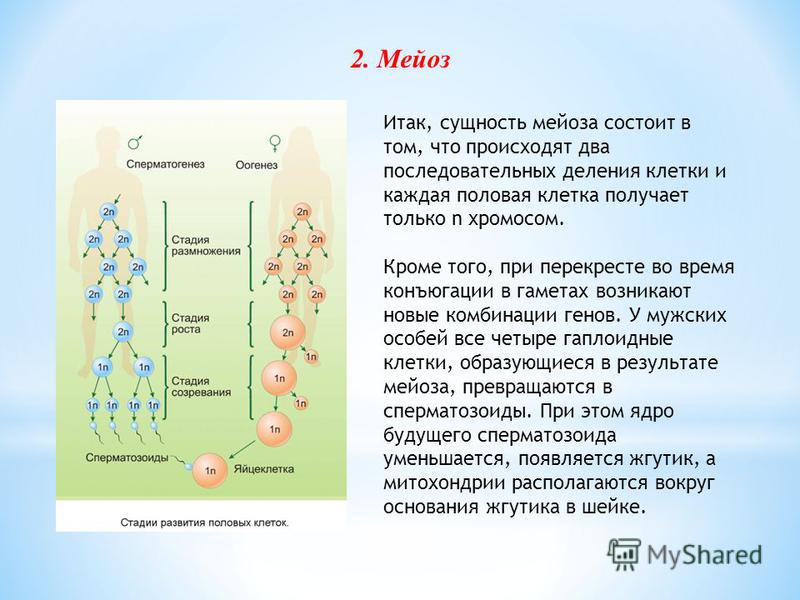 Но они известны уара-
Но они известны уара-
бидопсиса ириса.
У мутантов asynaptic1 (asy1) арабидопсиса нару-
шен синапсис гомологичных хромосом впрофазе I.
Ген ASY1 был клонирован. Оказалось, что он ко-
дирует белок, который обладает значительной го-
мологией вN-концевой части (домен HORMA)
с белком HOP1, который является компонен-
том латеральных элементов СК удрожжей [118].
Вдальнейшем был идентифицирован гомолог это-
го гена уриса
–
PAIR2 [33]. Мутанты asy1 араби-
допсиса (2n = 10) имеют асинаптический цито-
логический фенотип, однако для них характерно
наличие единичных хиазм
–
вметафазе Iвсред-
нем обнаруживается 1.57 бивалента на клетку [118].
Мутанты pair2 риса оказываются асинаптиками
сболее сильно выраженными фенотипами, так
как вметафазе Iнаблюдаются только унивален-
ты [33]. Фенотипы мутантов hop1/asy1 уизученных
организмов (дрожжи, нематода, арабидопсис, рис)
имеют большю схожесть, что говорит оконсерва-
тивности роли белка HOP1/ASY1 впостроении СК
уэтих организмов [33, 118–120]. Впостроении ОЭ/
Впостроении ОЭ/
ЛЭ вмейозе уживотных участвуют другие белки
(SYCP2 иSYCP3), которые не обладают гомологи-
ей сбелком HOP1 дрожжей [121].
Одной из характеристик асинаптических мутан-
тов ржи synaptic 9 (sy9) является нарушенная “за-
грузка” белка ASY1 на хромосомные оси. Для этих
мутантов также характерны преждевременная вы-
грузка RAD51 из профазных мейоцитов, асинапсис
хромосом иналичие только унивалентов в2/3 мей-
оцитов, ярко выраженная спирализация ОЭ вди-
плотене, полная стерильность растений [39, 40, 43,
44, 54]. Также уржи описана уникальная мутация
mei6, которая вызывает дефекты встроении лате-
ральных элементов СК [45]. Дефекты представля-
ют собой ультраструктурные выросты на латераль-
ных элементах типа “шипов” и“перегородок”.
Предполагается, что такие аномалии возникают
врезультате модификации структуры белков, фор-
мирующих латеральные элементы СК, и/или вре-
зультате ошибок самосборки этих белков.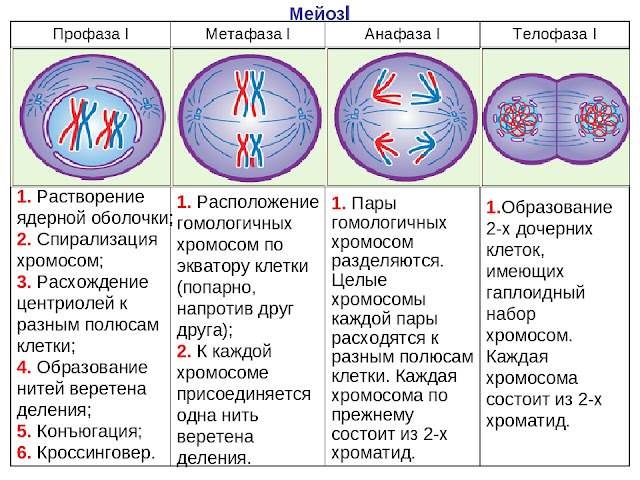 Альтер-
Альтер-
нативная гипотеза основывается на том, что имеет
место достоверная отрицательная корреляция меж-
ду числом выростов всубтерминальных сегментах
СК ичислом рекомбинационных узелков вэтих
сегментах. Поэтому не исключается, что возник-
новение аномальных выростов связано сдефекта-
ми формирования рекомбинационных узелков [39,
40, 45].
У арабидопсиса известны два гена (ZYP1a
и ZYP1b), которые кодируют компоненты цен-
трального элемента СК [28]. Наличие иммунофлу-
оресцентного сигнала AtZYP1 иуzyp1a, иуzyp1b
мутантов, атакже идентичность их цитологоче-
ских фенотипов, свидетельствуют о“взаимоза-
меняемости” этих генов. Оба белка присутствуют
только впрофазе I. Установлено, что инициация
рекомбинации необходима для загрузки AtZYP1 на
хромосомные оси, но она не является достаточным
фактором для превращения AtZYP1 вкомпонент
ЦЭ. При отсутствии белков иAtZYP1a, иAtZYP1b
наблюдается задержка мейоза, спаривание иси-
напсис хромосом отсутствуют вбольшинстве мей-
оцитов.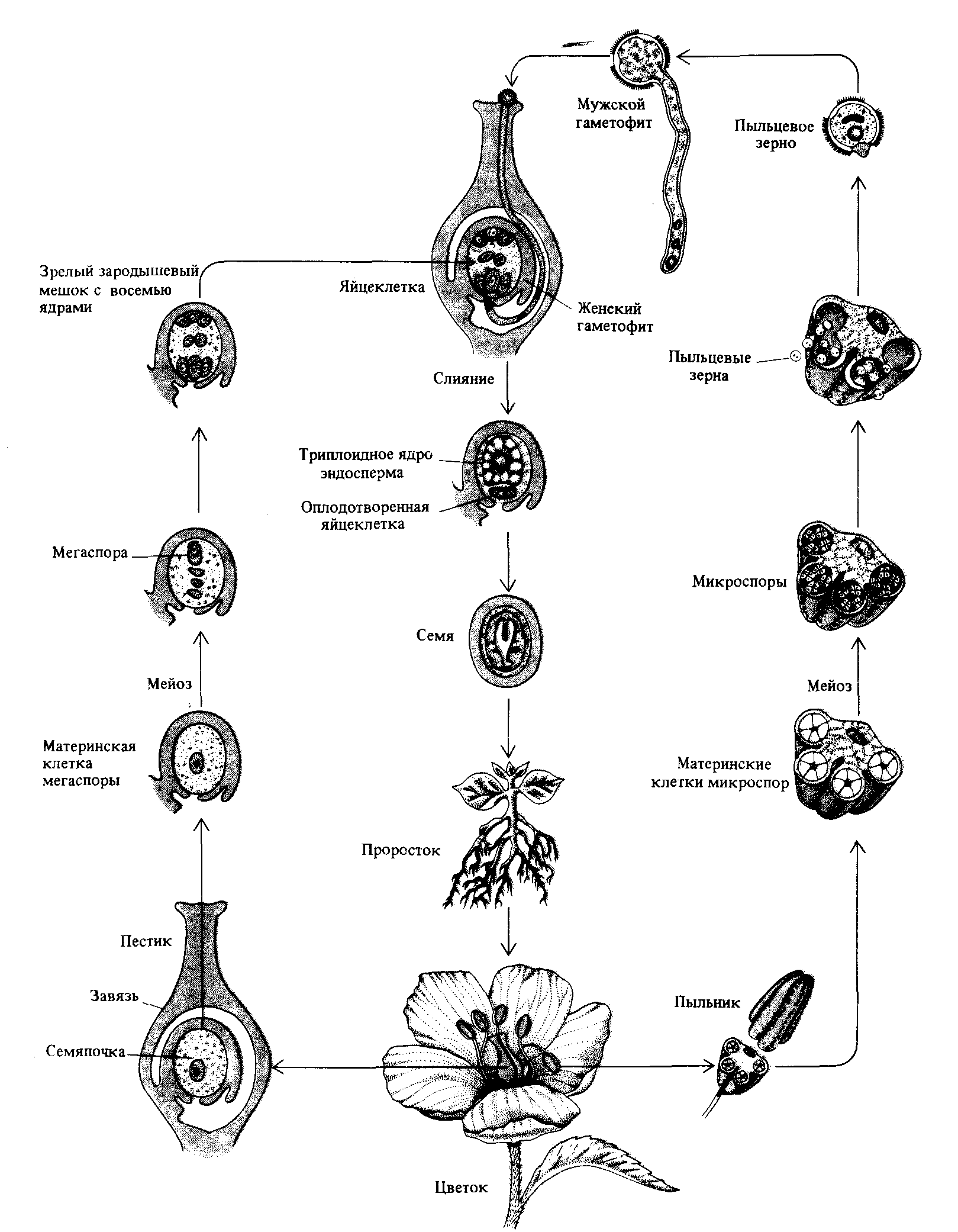 Хиазмы, обнаруживаемые при отсутствии
Хиазмы, обнаруживаемые при отсутствии
обоих AtZYP1 белков, образуются как между гомо-
логичными, так имежду негомологичными хромо-
сомами, т.е. отсутствие ZYP1 уарабидопсиса “раз-
решает” рекомбинацию между негомологичными
районами хромосом.
Среди многих мутаций, нарушающих си-
напсис хромосом, весьма подробно изучена мута-
ция desynaptic2 (dsy2) кукурузы [122]. Продукт гена
Разница между мейозом в растительных и животных клетках — Разница Между
Разница Между 2022
Ключевая разница: Мейоз — это тип деления клеток, который уменьшает количество хромосом. Процессы одинаковы у растений и животных. Однако у животных это приводит к образованию гамет, которые являются
Содержание:
Ключевая разница: Мейоз — это тип деления клеток, который уменьшает количество хромосом. Процессы одинаковы у растений и животных. Однако у животных это приводит к образованию гамет, которые являются репродуктивной или половой клеткой. С другой стороны, у растений он образует споры, которые в дальнейшем превращаются в гаметофит. Таким образом, у растений гаметы образуются в результате митоза, а не мейоза, которые сливаются в зиготу, а затем в спорофит.
Мейоз — это особый тип деления клеток, который встречается у полово-размножающихся организмов. Этот процесс уменьшает количество хромосом в гаметах вдвое по сравнению с родительскими клетками, которые, в свою очередь, обеспечивают сексуальное сочетание.
С другой стороны, у растений он образует споры, которые в дальнейшем превращаются в гаметофит. Таким образом, у растений гаметы образуются в результате митоза, а не мейоза, которые сливаются в зиготу, а затем в спорофит.
Мейоз — это особый тип деления клеток, который встречается у полово-размножающихся организмов. Этот процесс уменьшает количество хромосом в гаметах вдвое по сравнению с родительскими клетками, которые, в свою очередь, обеспечивают сексуальное сочетание. Профаза I — происходит синапсис, после чего происходит кроссинговер. Хромосомы утолщены, и они начинают уходить от ядерной оболочки. В метафазе I тетрады выровнены по центру клетки. В Анафазе I гомологичные хромосомы разделяются. В телофазе I хромосомы продолжают мигрировать к полюсам, и, наконец, образуются две дочерние клетки с гаплоидным числом хромосом. В Фазе II ядро и ядерная мембрана разделяются. В метафазе II хромосомы выровнены и имеют тенденцию ориентироваться в противоположных полюсах. В анафазе II пара хроматид начинает двигаться дальше к полюсам и, наконец, в телофазе II образуются четыре дочерние клетки или гаметы.
В метафазе I тетрады выровнены по центру клетки. В Анафазе I гомологичные хромосомы разделяются. В телофазе I хромосомы продолжают мигрировать к полюсам, и, наконец, образуются две дочерние клетки с гаплоидным числом хромосом. В Фазе II ядро и ядерная мембрана разделяются. В метафазе II хромосомы выровнены и имеют тенденцию ориентироваться в противоположных полюсах. В анафазе II пара хроматид начинает двигаться дальше к полюсам и, наконец, в телофазе II образуются четыре дочерние клетки или гаметы.
Во время мейоза I клетка делится на две части, а во время мейоза II происходит дальнейшее деление, в результате чего получается четыре гаплоидных клетки.
У растений этот процесс наблюдается сразу после образования спор, тогда как у животных он происходит во время образования гамет (сперматозоидов и яйцеклеток). Мейоз происходит в яичках самцов и яичниках самок у животных, тогда как у растений этот процесс происходит в пыльниках самцов и в яичниках самок.Мейоз у животных продуцирует гаметы (сперматозоиды и яйца), тогда как мейоз у растений продуцирует споры. Эти споры превращаются в гаплоидные гаметофиты, которые, в свою очередь, образуют гамет посредством митотического деления.
Эти споры превращаются в гаплоидные гаметофиты, которые, в свою очередь, образуют гамет посредством митотического деления.
У животных эти гаплоидные клетки, образующиеся в результате этого процесса, обычно меньше по размеру и также незаметны, тогда как у растений, как правило, эти клетки могут жить по-своему. У животных мейоз приводит к прямому образованию гамет, тогда как у растений происходит спорический мейоз, при котором они производят споры, а не гамет. Во-первых, гаметофит образуется в процессе митоза, который затем образует гамет.
Сравнение мейоза в клетках растений и животных:
| Мейоз в растительных клетках | Мейоз в клетках животных | |
| Происходит при половом размножении (клетки гамет) | Мужской орган — пыльник Женский орган — яичник | Мужской орган — семенники Женский орган — яичник |
| Производство гаплоидных (n) гаметных клеток | Пыльца и яйцеклетки | Сперма и яйцеклетка |
| Вхождение | Когда поры производятся | Во время производства гамет |
Изображения предоставлены: umanitoba. ca
ca
Мейоз 2
Как правило, второе деление мейоза протекает быстрее первого, в течение нескольких часов. Мейоз в целом процесс более длительный, чем митоз, у человека, допустим, он длится 3,5 недели.
Интерфаза 2, или интеркинез (n2c), является краткой паузой между первым и вторым мейотическими делениями, в это время не идет репликация ДНК.
Интерфаза между мейотическими делениями присуща животным клеткам, у многих растений на этом этапе она отсутствует.
Второе мейотическое деление (мейоз 2) называется эквационным.
Профаза 2 мейоза 2
1. Разрушается ядерная оболочка.
2. Центриоли разбегаются к противоположным полюсам клетки.
3. Создаются нити веретена деления.
4. Набор хромосом и количество ДНК — n2c.
Метафаза 2 мейоза 2
1. Двухроматидные хромосомы выстраиваются по экватору клетки (метафазная пластинка). Процесс этот очень напоминает митоз. На рисунке показано расположение двухроматидной хромосомы в экваториальной плоскости.
Двухроматидные хромосомы выстраиваются по экватору клетки (метафазная пластинка). Процесс этот очень напоминает митоз. На рисунке показано расположение двухроматидной хромосомы в экваториальной плоскости.
2. Нити веретена деления крепятся одним концом к центриолям, вторым — к центромерам. Как и в митозе, две нити веретена деления прикрепляются к одной центромере с разных сторон. Но в мейозе 1 есть другая особенность прикрепления нитей (см. выше).
3. Идет метафаза 2 мейоза и оогенез (образование женских гамет).
1) Смысл сказанного ниже об оогенезе вы лучше поймете после изучения темы «Гаметогенез». Ооциты 1 порядка формируются при образовании яйцеклеток у девочек и «спят» долгие годы, а при половом созревании проходят в стадию роста и могут в ней находиться несколько месяцев, подрастая, увеличиваясь. Затем ооциты 1 порядка проходят мейоз 1, образуются ооциты 2 порядка. Они-то и выходят при овуляции в брюшную полость женщины.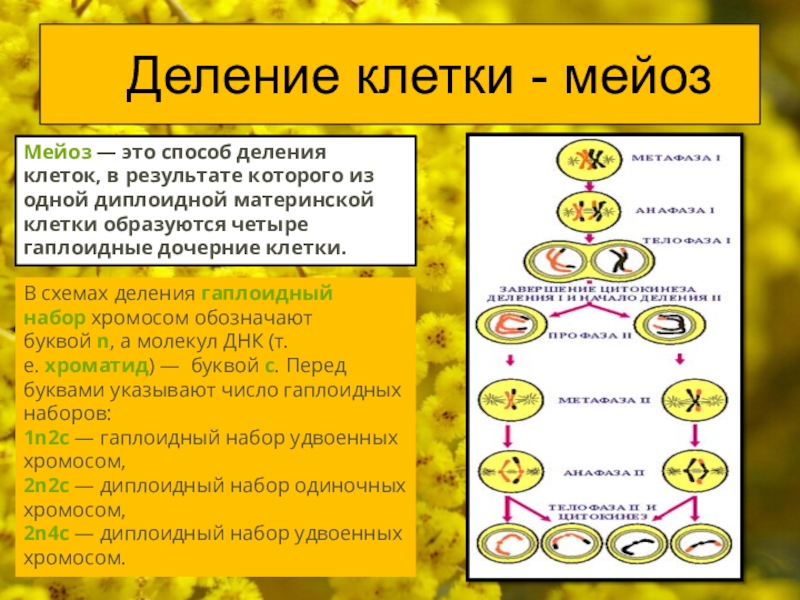
2) Ооциту 2 порядка требуется оплодотворение, и только после этого ооцит еще раз поделится.
3) На данном этапе ооциты ждут оплодотворения, после чего у них пройдет анафаза 2 и телофаза 2. Только после этого образуется яйцеклетка.
4. Набор хромосом и количество ДНК — n2c.
Анафаза 2 мейоза 2
1. Двухроматидные хромосомы делятся на хроматиды. Сестринские хроматиды разбегаются к полюсам клетки, как показано на рисунке. При этом хроматиды превращаются в самостоятельные однохроматидные хромосомы.
2. Набор хромосом и количество ДНК — 2n2c.
Телофаза 2 мейоза 2
1. Происходит деконденсация хромосом.
2. Ядерные мембраны создаются вокруг каждой группы хромосом.
3. Распадаются нити веретена деления, формируется ядрышко, цитоплазма делится (цитотомия), в итоге образуются четыре гаплоидные клетки.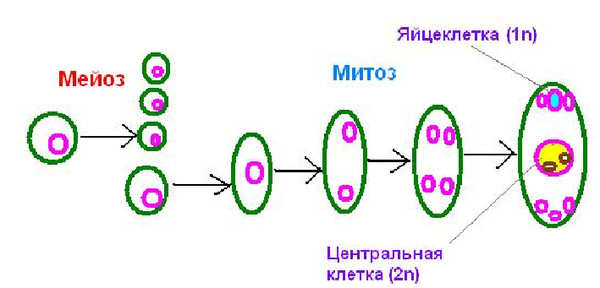
4. Набор хромосом и количество ДНК — nc в каждой клетке.
Митоз и мейоз — это что такое и чем они отличаются
Обновлено 20 июля 2021 Просмотров: 89 439 Автор: Дмитрий Петров- Митоз и его фазы
- Мейоз и его фазы
- Отличие митоза от мейоза
Здравствуйте, уважаемые читатели блога KtoNaNovenkogo.ru. Размножение и развитие многоклеточных живых организмов происходит путём деления клеток. В природе существует несколько вариантов этого процесса.
Мы рассмотрим два из них, наиболее распространённых и важных: митоз и мейоз. Они радикально отличаются друг от друга, но в то же время имеют и общие черты, о чём будет сказано ниже.
Митоз и его фазы
Митозом называется непрямое деление нервных, мышечных и других соматических (неполовых) клеток. Этот способ размножения – самый распространённый в природе.
Митоз включает в себя 4 стадии:
- Профаза – идёт спирализация хромосом; исчезает оболочка ядра; возникает веретено деления – к нему прикрепляются хромосомы.

- Метафаза – завершается спирализация хромосом, образуется экваториальная пластина.
- Анафаза – хромосомы распадаются на две хроматиды, которые устремляются к полюсам клетки.
- Телофаза – идёт деспирализация хромосом; создаётся ядерная оболочка; разделяется цитоплазма; возникают 2 диплоидные клетки.
Конечная цель всего процесса деления – доставка генетического кода от исходной (родительской) клетки до дочерних клеток и там равномерно его распределить. В итоге вновь образованные клетки становятся генетически тождественны материнским.
Период подготовки клетки к делению называется интерфазой. На этом этапе клетка растёт и развивается, что сопровождается синтезом белка, редупликацией ДНК и увеличением числа органоидов в цитоплазме.
Длительность интерфазы в делящихся клетках животных и растений колеблется в пределах 10-20 часов, в то время как собственно митоз продолжается порядка 1,5-2 часов.
У одноклеточных организмов, в стареющих клетках и при патологиях встречается амитоз: прямое деление, когда клетка делится на две и более части путём перетяжки. Характерными признаками процесса являются:
Характерными признаками процесса являются:
- хромосомы минуют стадию спирализации;
- отсутствует веретено деления;
- деление происходит сразу же после удвоения ДНК;
- между дочерними клетками ДНК распределяется неравномерно, что ведёт к спонтанной передаче генетического материала.
Амитоз занимает больше времени, чем митоз. Число дочерних клеток увеличивается, при этом могут появиться не только двухъядерные, но и многоядерные клетки. У животных (в том числе и у человека) амитоз наблюдается в органах, работающих при интенсивной нагрузке (хрящевые ткани, печень, роговица глаза).
У растений этот способ деления встречается в растущих клубнях картофеля, в завязи пестика. Претерпевшая амитоз клетка не может вступить в митотический цикл ввиду того, что хромосомы не удваиваются и бессистемно распределяются между дочерними клетками.
Мейоз и его фазы
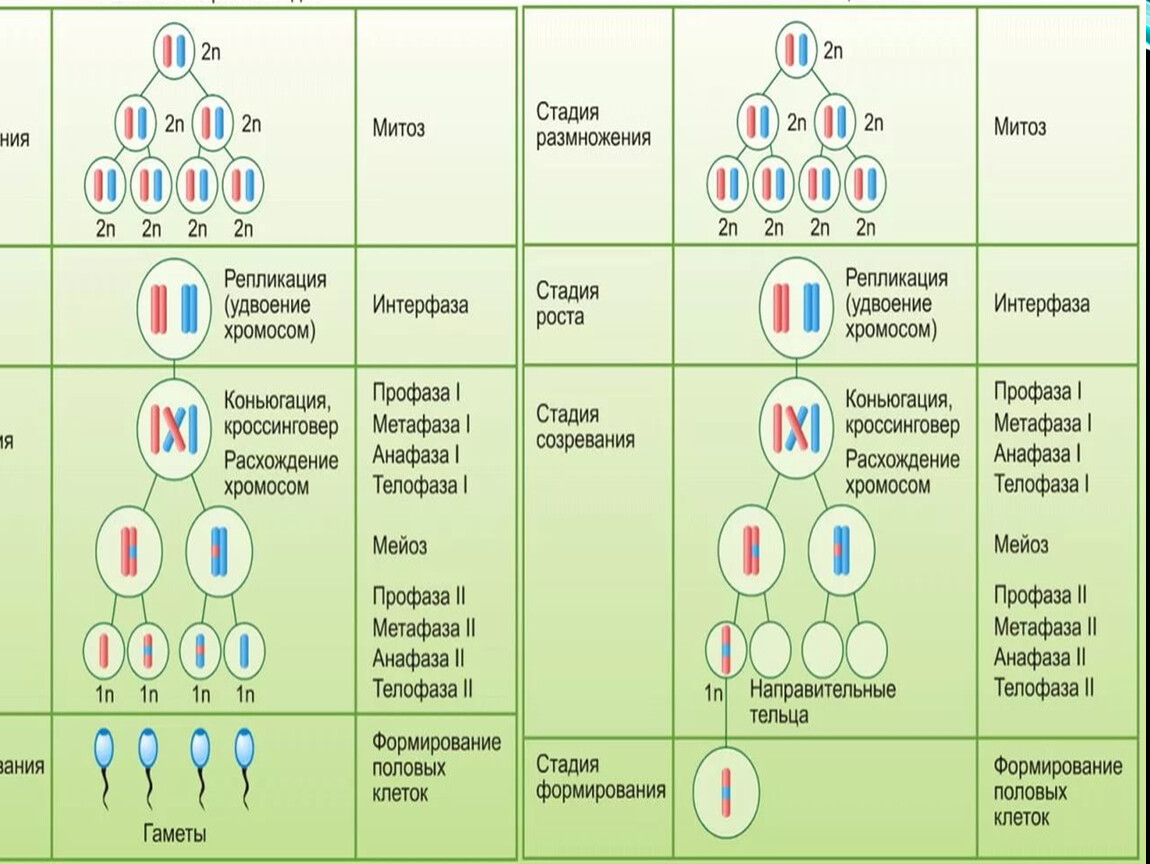
Мейоз – это особенность деления половых (соматических) клеток, когда из материнской диплоидной клетки получаются 4 дочерние гаплоидные клетки, т. е. с редуцированным (уменьшенным в 2 раза) набором хромосом.
е. с редуцированным (уменьшенным в 2 раза) набором хромосом.
Особенностью процесса является то, что он протекает в два последовательных этапа. При этом интерфаза между первым и вторым этапом отсутствует (точнее, она есть, но столь коротка, что ей можно пренебречь).
Сокращение числа хромосом – важнейшая составляющая мейоза. Без этого было бы невозможно поддерживать постоянство набора хромосом, передающихся очередному поколению.
Мейоз претерпевает те же 4 стадии, что и митоз, но эти стадии протекают дважды: на первом и втором этапе деления.
На первом этапе (редукционное деление) происходят следующие процессы:
- Профаза I – идёт спирализация хромосом и расхождение хроматид; исчезает оболочка ядра; конъюгация (образование бивалентов как результат соединения гомологичных хромосом) и кроссинговер (взаимный обмен участками хромосом с передачей генетического материала).
- Метафаза I – биваленты вытягиваются вдоль экватора; формируется веретено деления.
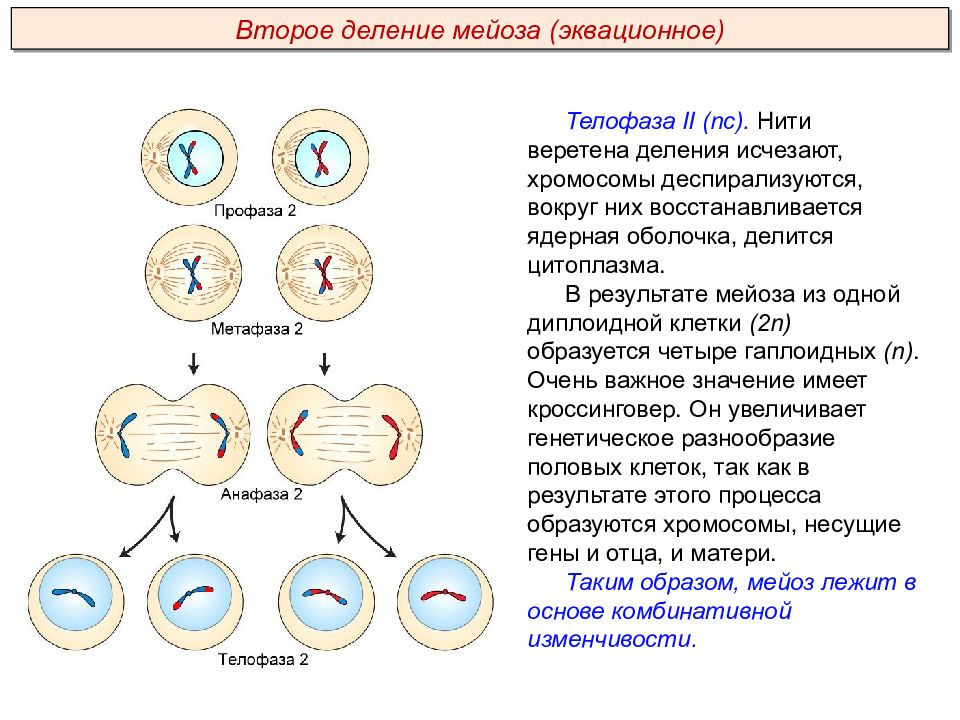
- Анафаза I – раздел бивалентов на хромосомы, которые нитями веретена притягиваются к полюсам клетки.
- Телофаза I – редукция хромосом; разделение цитоплазмы; создание ядерной оболочки; возникновение клеточной стенки.
Результатом первой стадии является образование 2-х дочерних клеток, в которых содержится одинарный (гаплоидный) набор хромосом.
После этого сразу же начинается второй цикл деления.
- Профаза II – аналогична профазе I, за исключением конъюгации и кроссинговера.
- Метафаза II – появляется экваториальная пластина; хроматиды крепятся к веретену деления.
- Анафаза II – аналогична анафазе при митозе.
- Телофаза II – аналогична телофазе при митозе за исключением того, что образуются четыре гаплоидные клетки.
После того как родительские гаметы сливаются (т.е. после процесса оплодотворения), образуется полноценная диплоидная клетка (зигота), несущая полный набор хромосом и дающая начало новой жизни.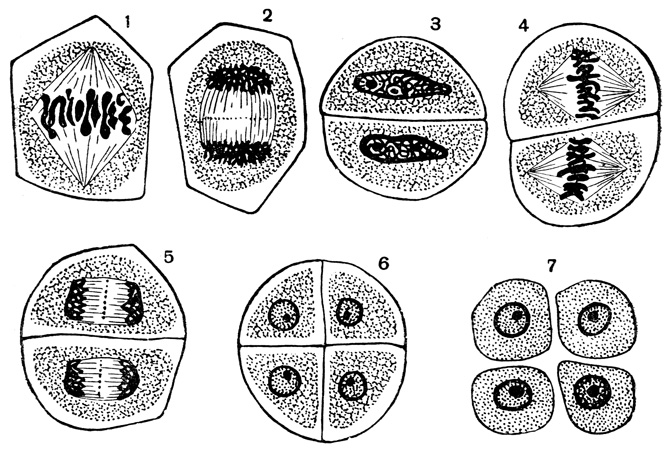
Отличие митоза от мейоза
Кардинальное различие между митозом и мейозом состоит в том, что в первом случае делятся соматические клетки, а во втором – половые. Второй важный момент: митоз протекает в одну стадию, в то время как мейоз является двухстадийным процессом.
Наконец, после митоза образуются две дочерние клетки, а набор хромосом не изменился (остался диплоидным). По завершении мейоза возникают четыре гаметы с редуцированным (уменьшенным в 2 раза) хромосомным набором. Тем не менее, на некоторых фазах оба процесса имеют идентичные схемы деления, хотя и со смещением по времени.
Для наглядности главные отличительные особенности обеих явлений сведены в нижеследующую таблицу.
И митоз, и мейоз имеют огромное значение для жизнедеятельности эукариот.
Без митоза не может произойти обновление клеток, регенерация органов и тканей.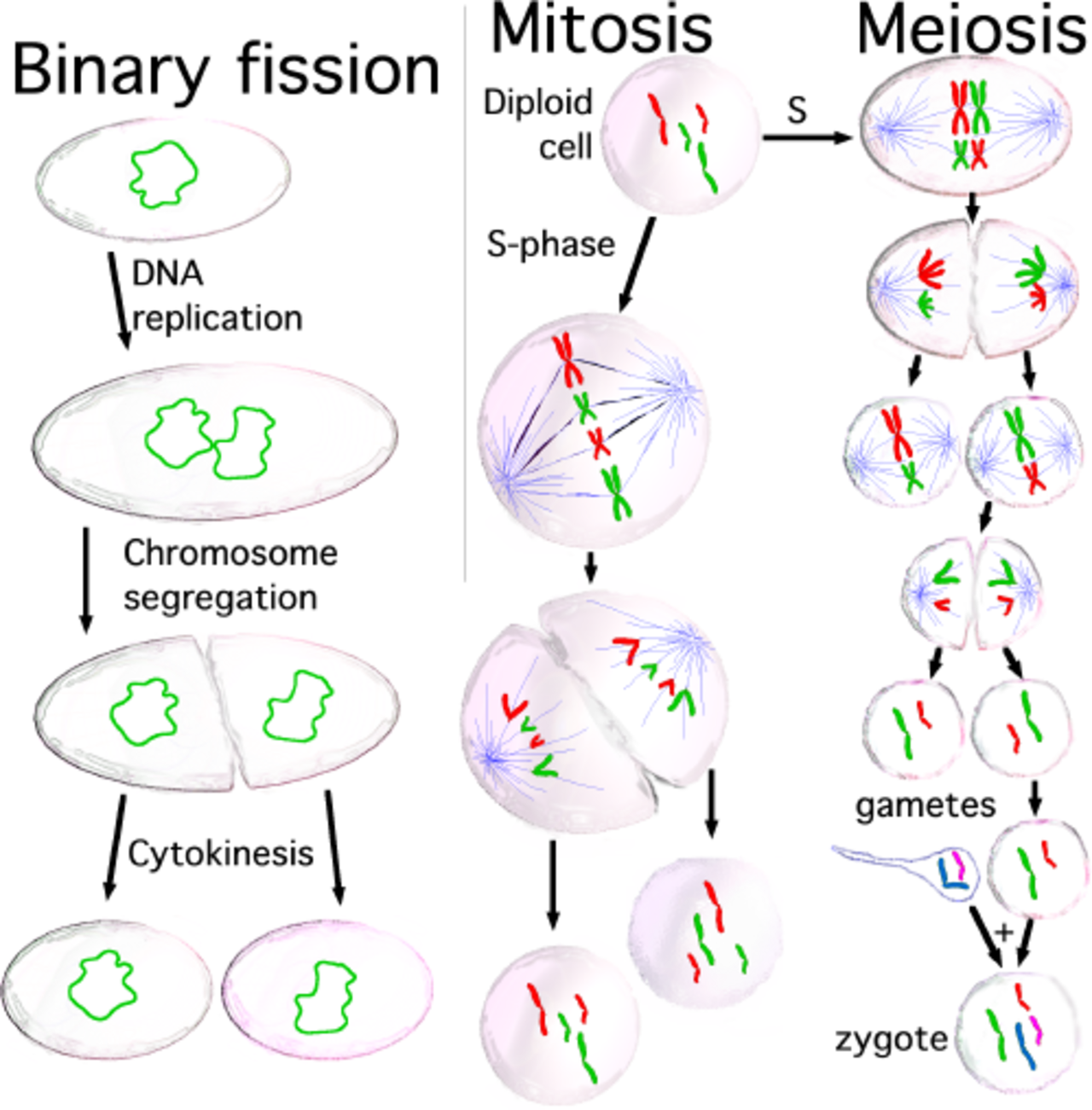 Образование новых органов у растений (корней, стеблей, листьев) – также результат митоза.
Образование новых органов у растений (корней, стеблей, листьев) – также результат митоза.
Благодаря мейозу при половом размножении поддерживается постоянство хромосом, что сохраняет генетическую целостность вида.
А вот у простейших организмов (прокариот) и элементарных ядерных организмов (инфузория, амёба) способ деления другой – бинарное деление надвое. Но это уже другая тема.
Удачи вам! До скорых встреч на страницах блога KtoNaNovenkogo.ru
Эта статья относится к рубрикам:
РАЗМНОЖЕНИЕ СЕМЕННЫХ РАСТЕНИЙ — Размножение: половое и бесполое. Митоз. Мейоз. Гаметы. Оплодотворение. Онтогенез. Регенерация
У всех зелёных растений, обитающих на суше, и у высших водорослей наблюдается чередование поколений, при котором гаметофит чередуется со спорофитом. Наиболее совершенными органами размножения среди растений обладают покрытосеменные. В процессе адаптации к жизни на суше они развили семена и плоды, обеспечивающие питание и защиту зародышам. Мужские гаметы, заключённые в пыльце, переносятся на женские органы (опыление), после чего прорастает пыльцевая трубка.
В процессе адаптации к жизни на суше они развили семена и плоды, обеспечивающие питание и защиту зародышам. Мужские гаметы, заключённые в пыльце, переносятся на женские органы (опыление), после чего прорастает пыльцевая трубка.
Эволюция наделила покрытосеменные растения специализированным органом размножения — цветком. Цветки могут объединяться в группы — соцветия: щитки, колоски, зонтики и другие. Наиболее сложными соцветиями считаются корзинки сложноцветных; нередко они объединяют в себе несколько типов простых цветков. Крупные соцветия лучше привлекают насекомых, нежели небольшие одиночные цветки.
Снаружи цветок окружён чашелистиками и лепестками. У двудольных растений они различаются по строению: внешние чашелистики (чашечка) служат, в основном, для защиты цветка, а расположенный внутри них венчик из лепестков привлекает внимание насекомых. У растений, опыляемых ветром, венчик мелкий и зеленоватый, а иногда отсутствует вовсе. И чашечка, и венчик могут состоять из отдельных лепестков, а могут — из сросшихся (хотя бы частично) в трубочку.
Мужской половой орган цветка — андроцей — состоит из тычинок. Каждая тычинка составлена из заключённых в пыльник четырёх пыльцевых мешков, в которых образуется пыльца, и тычиночной нити, по которой подводятся питательные вещества и вода. Женский половой орган — гинецей (пестик). Он состоит из рыльца, на которое должна попадать пыльца, выполняющего опорные функции столбика и завязи, содержащей один или несколько семязачатков. В семязачатках развиваются зародышевые мешки, которые после оплодотворения превращаются в семена. Кроме того, в состав цветков, опыляемых насекомыми, входят нектарники, которые выделяют сахаристый нектар.
Тычинки и пестик могут развиваться как в одном гермафродитном цветке, так и в разных цветках. В последнем случае мужские и женские особи могут развиваться на одной особи — однодомные растения, либо на разных — двудомные растения.
Пыльцевые зёрна зреют в пыльцевых мешках. У каждого зерна образуется толстая стенка, поверхность которой покрыта рельефными узорами, специфичными для данного вида. Материал, составляющий стенку, очень устойчив, благодаря чему пыльца может сохраняться в неизменности миллионы лет. По мере созревания стенки пыльника ссыхаются и растрескиваются, и пыльца вываливается наружу. В процессе опыления пыльца переносится на пестики. Если пыльца переносится на другое растение, то происходит перекрёстное опыление. Оно менее надежно, чем самоопыление (особенно, в местностях, где представители данного вида существуют на больших расстояниях друг от друга), но зато способствует генетической изменчивости. В ходе эволюции цветковые растения выработали специальные механизмы, способствующие перекрёстному опылению: дихогамию (созревание тычинок и пестиков в разное время), самонесовместимость, строение цветка. У растений, опыляемых насекомыми, цветки имеют специфический аромат, а клейкие или шероховатые пыльцевые зерна легко пристают к телу животного. Растения, опыляемые ветром, вынуждены производить очень большое количество пыльцы.
Материал, составляющий стенку, очень устойчив, благодаря чему пыльца может сохраняться в неизменности миллионы лет. По мере созревания стенки пыльника ссыхаются и растрескиваются, и пыльца вываливается наружу. В процессе опыления пыльца переносится на пестики. Если пыльца переносится на другое растение, то происходит перекрёстное опыление. Оно менее надежно, чем самоопыление (особенно, в местностях, где представители данного вида существуют на больших расстояниях друг от друга), но зато способствует генетической изменчивости. В ходе эволюции цветковые растения выработали специальные механизмы, способствующие перекрёстному опылению: дихогамию (созревание тычинок и пестиков в разное время), самонесовместимость, строение цветка. У растений, опыляемых насекомыми, цветки имеют специфический аромат, а клейкие или шероховатые пыльцевые зерна легко пристают к телу животного. Растения, опыляемые ветром, вынуждены производить очень большое количество пыльцы.
Попав на рыльце, пыльцевое зерно под действием ауксина и сахарозы начинает быстро прорастать вглубь.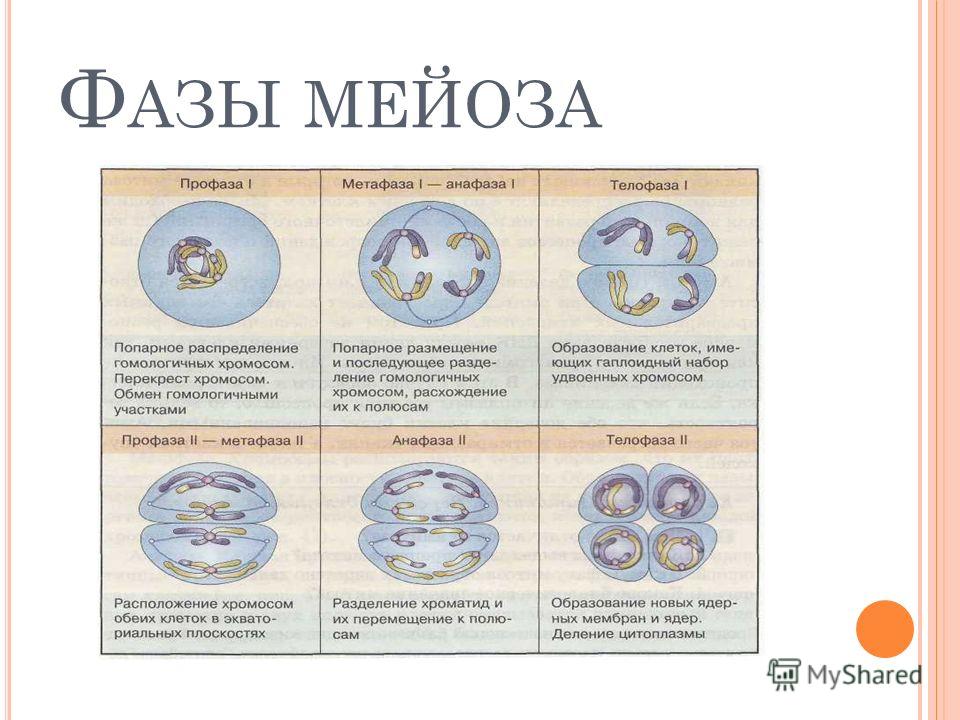 Направление роста определяется особыми веществами (хемотропизм). Ядро пыльцевого зерна делится, образуя две мужские гаметы. С помощью пыльцевой трубки они проникают в зародышевый мешок, где одно из них сливается с женской гаметой, а второе — с двумя полярными ядрами, образуя триплоидное ядро. Семязачаток становится семенем, а завязь — плодом. Плод называется истинным, если образован только завязью, и ложным, если в образовании плода помимо завязи участвуют и другие части цветка, например, цветоложе, венчик. В образовании сборных плодов участвуют несколько пестиков.
Направление роста определяется особыми веществами (хемотропизм). Ядро пыльцевого зерна делится, образуя две мужские гаметы. С помощью пыльцевой трубки они проникают в зародышевый мешок, где одно из них сливается с женской гаметой, а второе — с двумя полярными ядрами, образуя триплоидное ядро. Семязачаток становится семенем, а завязь — плодом. Плод называется истинным, если образован только завязью, и ложным, если в образовании плода помимо завязи участвуют и другие части цветка, например, цветоложе, венчик. В образовании сборных плодов участвуют несколько пестиков.
После многократного деления зигота превращается в многоклеточный зародыш, состоящий из первичного побега, первичного корешка и одной или двух семядолей. В семядолях запасаются питательные вещества. Триплоидное ядро многократно делится, образуя эндосперм, в котором также содержится запас питательных веществ. По мере развития содержание воды в семени снижется до 10-15 %. Плод созревает, стенки завязи приобретают порой весьма замысловатую форму, способствуя распространению семян (колючки и крючки, летучки, крылатки). Остальная часть цветка отмирает. Семена (вместе с плодом или без него) переносятся ветром, водой или животными в новое место, где прорастают, давая начало новому растению.
Остальная часть цветка отмирает. Семена (вместе с плодом или без него) переносятся ветром, водой или животными в новое место, где прорастают, давая начало новому растению.
Семена являются приспособлением растения к наземному образу жизни. Они имеют защитные и питательные функции, дополнительные приспособления для переноса ветром или животными. С другой стороны, производство семян стоит растению большого количества энергии и питательных веществ, а вероятность неудачи при размножении семенами больше, чем при размножении спорами.
10. Гаметогенез и развитие растений. Размножение организмов
10. Гаметогенез и развитие растений
Мейоз в жизненном цикле растений. У растений гаметогенез и размножение протекают иначе, чем у животных. Процесс мейоза происходит у них не на стадии образования гамет, а на стадии образования спор. Кроме того, у растений наблюдается чередование поколений с диплоидным (2n) и гаплоидным (n) набором хромосом.
Поколение с гаплоидным набором хромосом называется гаметофитом. На гаметофите образуются гаметы в процессе митоза. Поколение с диплоидным набором хромосом называется спорофитом, и на нем образуются споры в процессе мейоза. Гаметофит развивается из гаплоидных спор, а спорофит — из диплоидной зиготы, образующейся в результате оплодотворения.
На гаметофите образуются гаметы в процессе митоза. Поколение с диплоидным набором хромосом называется спорофитом, и на нем образуются споры в процессе мейоза. Гаметофит развивается из гаплоидных спор, а спорофит — из диплоидной зиготы, образующейся в результате оплодотворения.
Смена поколений идет по схеме: зигота (2n) —> спорофит (2n) —> мейоз —> споры (n) —> гаметофит (n) —> митоз —> гаметы (n) —>оплодотворение —> зигота (2n)
В цикле развития мейоз всегда происходит один раз. В зависимости от периода жизни спорофита и гаметофита взрослое растение может быть гаплоидным или диплоидным.
Размножение и развитие зеленых водорослей
У низших растений преобладающим поколением является гаметофит. Он размножается бесполым путем, образуя клетки, из которых развиваются взрослые особи. В определенный период на гаметофите образуются гаметы, разные или одинаковые по величине.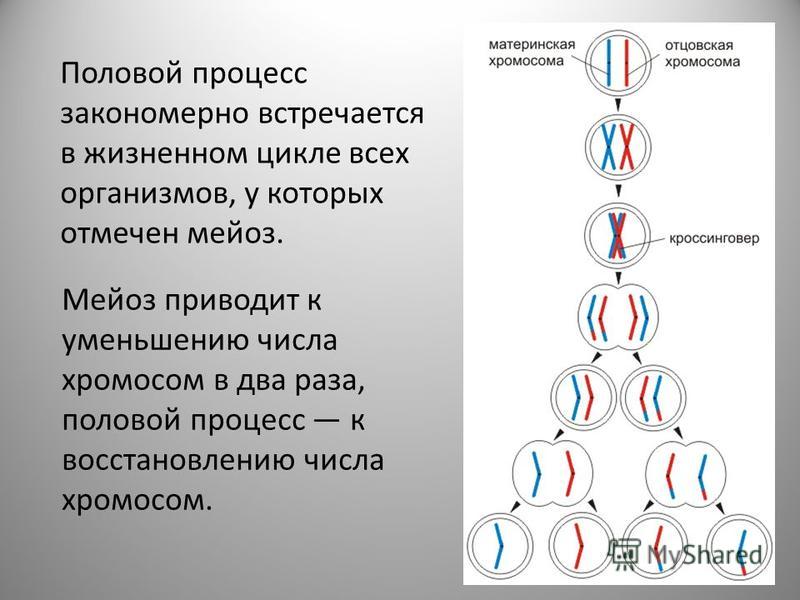
После слияния гамет образуется зигота, которая сразу же делится мейозом и образует споры, дающие начало новым гаметофитам. Таким образом, в жизненном цикле зеленых водорослей диплоидное поколение представлено только одной клеткой — зиготой.
Размножение и развитие высших споровых растений
У мхов, папоротников, плаунов и хвощей размножение происходит спорами.
У мхов взрослым растением является гаметофит (n) — половое поколение, которое развивается при прорастании споры (рис. 19).
Рис. 19. Схема образования (А) и развития (Б) зародышевого мешка: 1 — антиподы; 2 — два центральных ядра; 3 — синергиды; 4 — яйцеклетка
Это листостебельное растение, на побегах которого развиваются органы полового размножения — антеридии (мужские органы) и архегонии (женские органы). В антеридиях в процессе митоза образуются сперматозоиды, а в архегониях — яйцеклетка (как правило, одна). При наличии воды сперматозоиды проникают в архегонии и оплодотворяют яйцеклетку, при этом образуется зигота (2n).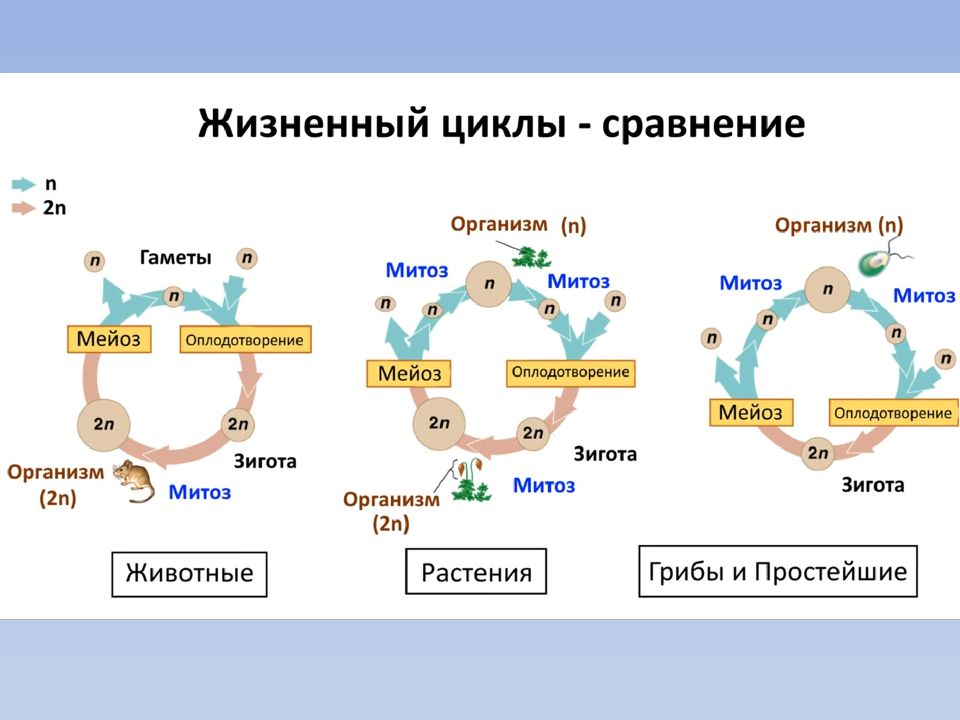 Из зиготы на гаметофите развивается спорофит (2n) в виде коробочки на ножке — спорогона. Спорофит не способен к самостоятельному существованию и питается за счет питательных веществ гаметофита. В спорангиях (коробочке) в результате мейоза образуются споры. Споры после созревания высыпаются и во влажной среде прорастают, давая начало новым гаметофитам.
Из зиготы на гаметофите развивается спорофит (2n) в виде коробочки на ножке — спорогона. Спорофит не способен к самостоятельному существованию и питается за счет питательных веществ гаметофита. В спорангиях (коробочке) в результате мейоза образуются споры. Споры после созревания высыпаются и во влажной среде прорастают, давая начало новым гаметофитам.
Схема жизненного цикла мхов
У папоротников, плаунов и хвощей, наоборот, взрослым растением является спорофит, на котором в специальных органах — спорангиях в результате мейоза образуются споры (n). Споры после созревания высыпаются и прорастают (рис. 20).
Рис. 20. Схема образования (А) и развития (Б) пыльцевого зерна: 1 — вегетативная клетка; 2 — генеративная клетка
При прорастании споры развивается половое поколение — гаметофит, который представлен небольшим заростком и существует очень недолго. На заростке развиваются органы полового размножения — антеридии и архегонии, в которых в результате митоза развиваются гаметы. В антеридиях образуются сперматозоиды, а в архегониях созревает яйцеклетка.
В антеридиях образуются сперматозоиды, а в архегониях созревает яйцеклетка.
Схема жизненного цикла папоротников
При наличии капельно-жидкой влаги сперматозоиды проникают в архегонии и оплодотворяют яйцеклетку, при этом образуется зигота. Из зиготы развивается зародыш, а далее молодое растение — спорофит.
Размножение и развитие семенных растений
У семенных растений размножение происходит семенами. Преобладающим поколением является спорофит, а гаметофит сильно редуцирован, развивается в спорофите и представлен лишь несколькими клетками.
Схема жизненного цикла голосеменных (на примере сосны)
Процесс развития семенных растений рассмотрим более подробно на примере цветковых растений. Взрослое растение имеет диплоидный набор хромосом и является спорофитом. Оно развивается из семени.
Репродуктивным органом является цветок. В цветке образуются женский орган — пестик и мужской — тычинки.
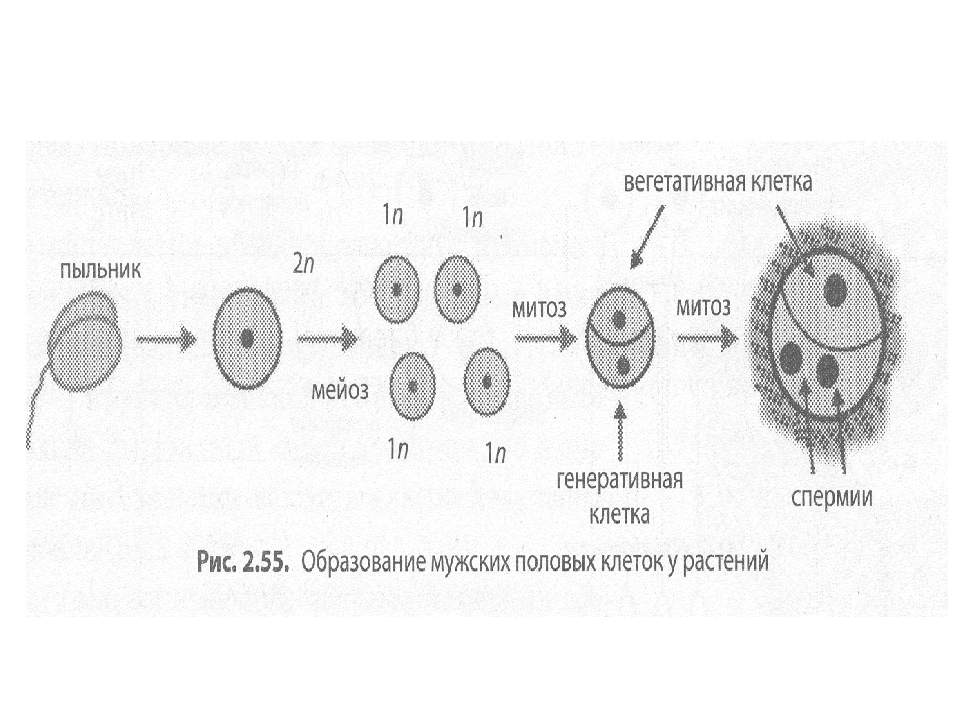
В завязи пестика в семязачатках из спорогенной ткани в результате мейоза образуются 4 споры (n), причем одна из них, крупная — мегаспора развивается в женский заросток — гаметофит; три другие, более мелкие, отмирают.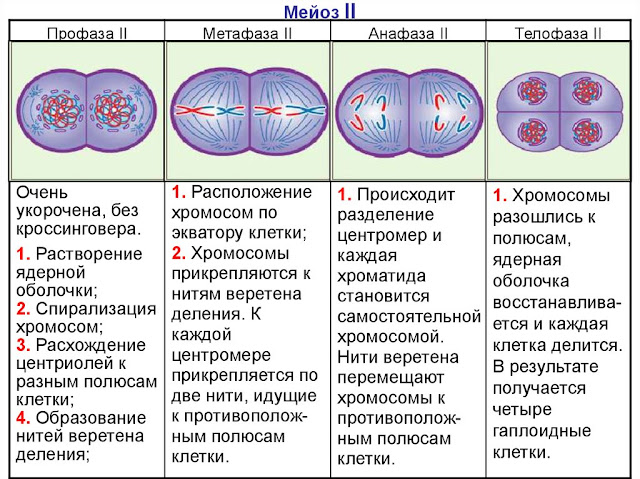
Мегаспора трижды делится митозом, и образуется восьмиядерный зародышевый мешок. Восемь ядер распределяются следующим образом. Ближнее к пыльцевходу крупное ядро — яйцеклетка, рядом два ядра помельче — две сопутствующие клетки — синергиды. На противоположном полюсе мешка располагаются три ядра — антиподы, а в центре располагаются два центральных ядра. Все ядра гаплоидные. Таким образом, женский гаметофит представлен восьмиядерным зародышевым мешком.
В тычинках, в пыльцевых мешках из ткани микроспорангия в результате мейоза образуется много мелких микроспор (n). Все споры развиваются и дают начало мужскому заростку — гаметофиту. Спора делится митозом и образует вегетативную и генеративную клетки. Ядро генеративной клетки делится еще раз, и образуется два спермия. Вегетативная и генеративная клетки покрываются оболочкой, образуется пыльцевое зерно. Таким образом, мужской гаметофит представлен двумя клетками.
При попадании пыльцы на рыльце пестика вегетативная клетка начинает прорастать, образуя пыльцевую трубку и продвигая генеративную клетку к пыльцевходу. Два спермия через пыльцевход проникают в зародышевый мешок. Один спермий сливается с яйцеклеткой, и образуется зигота (2n), из которой развивается зародыш семени. Другой спермий сливается с двумя ядрами центральной клетки, в результате чего образуется эндосперм (3n) семени, в котором запасаются питательные вещества.
Два спермия через пыльцевход проникают в зародышевый мешок. Один спермий сливается с яйцеклеткой, и образуется зигота (2n), из которой развивается зародыш семени. Другой спермий сливается с двумя ядрами центральной клетки, в результате чего образуется эндосперм (3n) семени, в котором запасаются питательные вещества.
Схема жизненного цикла покрытосеменных растений
Этот процесс называется двойным оплодотворением. Он был открыт русским ученым С. П. Навашиным. В результате двойного оплодотворения в семязачатке образуется семя, а из покрова семязачатка — семенная кожура. Вокруг семени из завязи и других частей цветка образуется плод (рис. 21).
Рис. 21. Схема двойного оплодотворения цветковых растений: 1 — пыльца; 2 — пыльцевая трубка вегетативной клетки; 3 — два спермия; 4 — яйцеклетка; 5 — два центральных ядра; 6 — семязачаток; 7 — эндосперм семени; 8 — зародыш; 9 — кожура семени из покрова семязачатка
У растений, при переходе от низших к высшим, наблюдается постепенное увеличение срока жизни спорофита.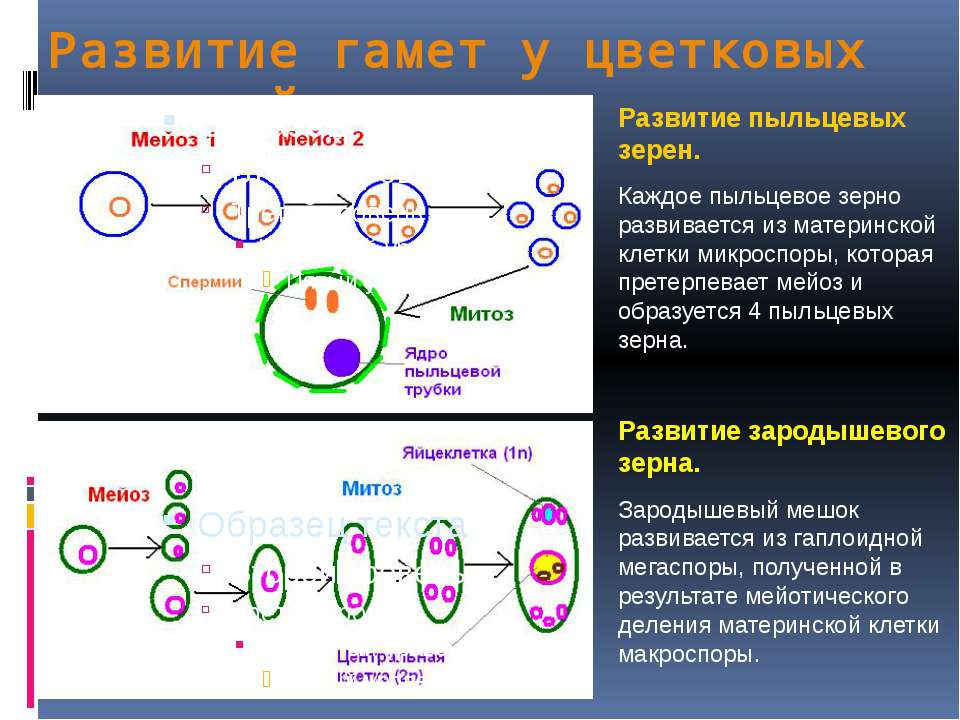 Начиная с папоротникообразных, у всех растений взрослый организм представлен спорофитом, а гаметофит претерпевает постепенно редукцию до одной или нескольких клеток.
Начиная с папоротникообразных, у всех растений взрослый организм представлен спорофитом, а гаметофит претерпевает постепенно редукцию до одной или нескольких клеток.
Вопросы для самоконтроля
1. В чем заключается особенность жизненного цикла растений по сравнению с животными?
2. Как происходит чередование поколений у растений?
3. Что такое гаметофит и спорофит? В чем их отличие?
4. Какое поколение является господствующим у водорослей и мхов, папоротникообразных и семенных растений?
5. Как изменяется гаметофит от низших растений к высшим?
6. В чем их сходство и отличие гаметофита цветковых растений и мхов?
7. Какой процесс называется двойным оплодотворением? В чем его особенность?
границ | Последние достижения в понимании инициации мейоза и апомиктического пути у растений
Введение
Мейоз — чрезвычайно важный этап в половом размножении. Широко признано, что он произошел в результате митоза и имеет некоторые общие черты с митозом (Maynard Smith, 1978). Тем не менее, по крайней мере три специфичных для мейоза события делают мейоз специализированным делением клетки: мейотическая рекомбинация и спаривание между гомологичными хромосомами во время профазы I, подавление разделения сестринских хроматид во время первого деления мейоза и отсутствие репликации хромосом в начале второй дивизион (Клекнер, 1996).Хотя эти специфические для мейоза события были тщательно изучены, механизмы, которые переключают митоз в мейоз, все еще остаются загадкой. У многоклеточных организмов инициация мейоза происходит внутри многоклеточных органов; следовательно, механизмы, которые инициируют мейоз, д. включать сигналы развития. У растений решение начать мейоз также может быть связано со спецификацией судеб репродуктивных клеток, поскольку растения не имеют заранее определенных зародышевых линий. Таким образом, переключение соматической судьбы на судьбу зародышевых клеток и переход клеточного цикла митоз-мейоз происходят последовательно во время развития репродуктивных органов (т.
Широко признано, что он произошел в результате митоза и имеет некоторые общие черты с митозом (Maynard Smith, 1978). Тем не менее, по крайней мере три специфичных для мейоза события делают мейоз специализированным делением клетки: мейотическая рекомбинация и спаривание между гомологичными хромосомами во время профазы I, подавление разделения сестринских хроматид во время первого деления мейоза и отсутствие репликации хромосом в начале второй дивизион (Клекнер, 1996).Хотя эти специфические для мейоза события были тщательно изучены, механизмы, которые переключают митоз в мейоз, все еще остаются загадкой. У многоклеточных организмов инициация мейоза происходит внутри многоклеточных органов; следовательно, механизмы, которые инициируют мейоз, д. включать сигналы развития. У растений решение начать мейоз также может быть связано со спецификацией судеб репродуктивных клеток, поскольку растения не имеют заранее определенных зародышевых линий. Таким образом, переключение соматической судьбы на судьбу зародышевых клеток и переход клеточного цикла митоз-мейоз происходят последовательно во время развития репродуктивных органов (т. е.е., пыльники и семяпочки; Ма, 2005 г.). Важно отметить, что эти половые процессы могут быть заменены бесполым апомиктическим путем, при котором мейоз обходится или происходит митозоподобное деление с образованием нередуцированных дочерних клеток с последующим развитием эмбриона без оплодотворения, апомиктические растения могут затем производить диплоидные семена с идентичными генетическое содержание их материнского генома. Это явление называется апомиксисом и встречается в природе у некоторых цветковых растений (Barcaccia and Albertini, 2013).Если апомиксис внедрить в сельскохозяйственные культуры для получения клональных семян, его применение в сельском хозяйстве будет широким и глубоким. Здесь мы рассматриваем текущее понимание перехода клеточного цикла, который заставляет спорогенные клетки выходить из митотического клеточного цикла и вступать в мейотическую программу у высших растений, а также дополнительно обсуждаем достижения в апомиктическом пути.
е.е., пыльники и семяпочки; Ма, 2005 г.). Важно отметить, что эти половые процессы могут быть заменены бесполым апомиктическим путем, при котором мейоз обходится или происходит митозоподобное деление с образованием нередуцированных дочерних клеток с последующим развитием эмбриона без оплодотворения, апомиктические растения могут затем производить диплоидные семена с идентичными генетическое содержание их материнского генома. Это явление называется апомиксисом и встречается в природе у некоторых цветковых растений (Barcaccia and Albertini, 2013).Если апомиксис внедрить в сельскохозяйственные культуры для получения клональных семян, его применение в сельском хозяйстве будет широким и глубоким. Здесь мы рассматриваем текущее понимание перехода клеточного цикла, который заставляет спорогенные клетки выходить из митотического клеточного цикла и вступать в мейотическую программу у высших растений, а также дополнительно обсуждаем достижения в апомиктическом пути.
Что мы узнали от других модельных видов о инициации мейоза?
Клеточные события во время мейоза эволюционно консервативны среди видов; однако механизмы, контролирующие инициацию мейоза, разнообразны (Pawlowski et al.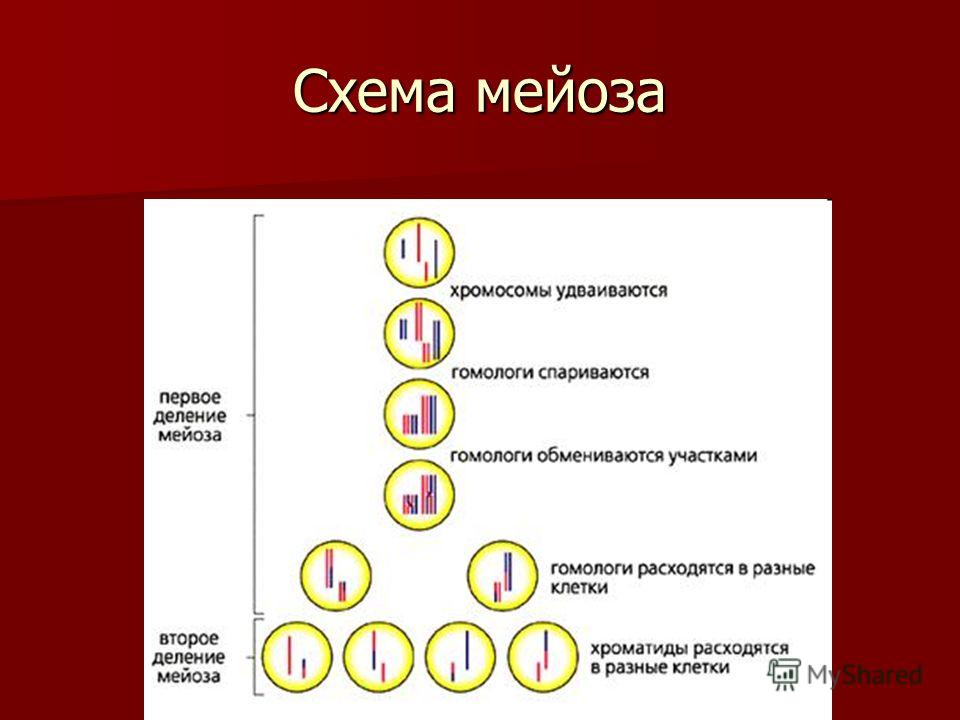 , 2007). Молекулярные регуляторы, выясненные на сегодняшний день, включают сигнальные пути, регуляцию транскрипции и трансляции мейотических генов и цепи циклин-зависимой киназы (CDK). Хотя используются разные механизмы, окончательное считывание, вероятно, является активацией специфического комплекса cyclin-CDK, чтобы инициировать мейотическую S-фазу. Во многих исследованиях также было высказано предположение, что решение о запуске мейоза принимается до наступления премейотической S фазы (Watanabe et al., 2001). Здесь мы сначала резюмируем открытия нескольких модельных видов, а затем обсуждаем последние достижения в области растений.
, 2007). Молекулярные регуляторы, выясненные на сегодняшний день, включают сигнальные пути, регуляцию транскрипции и трансляции мейотических генов и цепи циклин-зависимой киназы (CDK). Хотя используются разные механизмы, окончательное считывание, вероятно, является активацией специфического комплекса cyclin-CDK, чтобы инициировать мейотическую S-фазу. Во многих исследованиях также было высказано предположение, что решение о запуске мейоза принимается до наступления премейотической S фазы (Watanabe et al., 2001). Здесь мы сначала резюмируем открытия нескольких модельных видов, а затем обсуждаем последние достижения в области растений.
Решение о мейозе у одноклеточных дрожжей часто зависит от условий окружающей среды. В почкующихся дрожжах Saccharomyces cerevisiae голодание индуцирует экспрессию гена Initiator of Meiosis I ( IME1 ), который кодирует фактор транскрипции, ответственный за активацию ранних мейотических генов (Chu et al., 1998). Один из этих генов-мишеней, IME2 , который кодирует протеинкиназу Ser / Thr, способствует репликации мейотической ДНК путем прямого фосфорилирования Rfa2, субъединицы репликационного белка A (Foiani et al. , 1996; Клиффорд и др., 2005). Sic1, ингибитор CDK (CDC28), также фосфорилируется Ime2p и затем приводит к его деградации. Впоследствии CDC28, вместе с циклинами S фазы B-типа, Clb5 и Clb6, запускает инициацию премейотической фазы S (Dirick et al., 1998; Stuart and Wittenberg, 1998).
У делящихся дрожжей S. pombe ключевой фактор транскрипции STE11 , который продуцируется в ответ на условия окружающей среды, отвечает за экспрессию ранних мейотических генов (Sugimoto et al., 1991). MEI2, РНК-связывающий белок RRM-типа, играет решающую роль в содействии вступлению в мейоз, регулируя накопление специфичных для мейоза мРНК. Во время митоза MEI2 инактивируется киназой PAT1. В условиях, индуцирующих мейоз, эта репрессия MEI2 высвобождается, делая возможным связывание и стабилизацию специфичных для мейоза мРНК в фазе G1 (Kitamura et al., 2001). Кроме того, этот процесс усиливает стабилизацию также за счет секвестрации белка MMI1, функция которого заключается в устранении этих мейотических мРНК (Harigaya et al.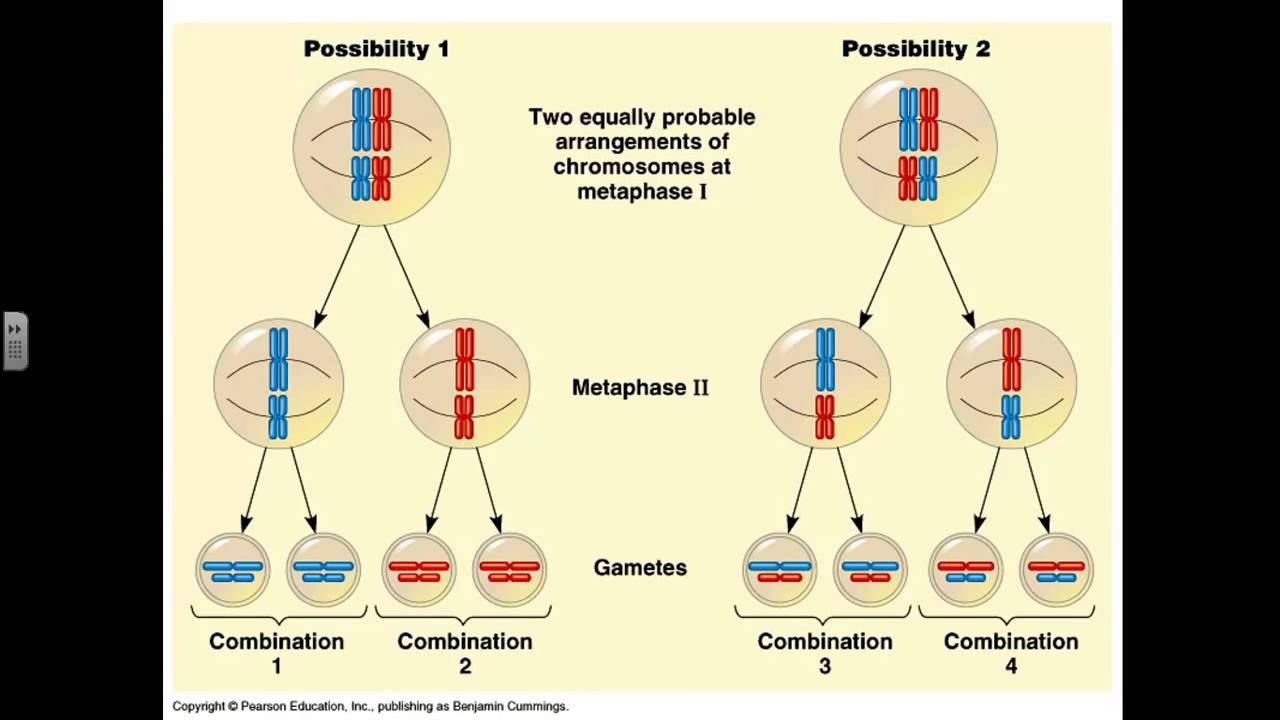 , 2006). Наконец, связывание киназы CDC2 с циклином CIG2 необходимо для вступления в премейотическую S фазу (Borgne et al., 2002). Недавно было обнаружено, что S-пальмитоилирование белков, модификация липидов, регулирует вступление в мейоз (Zhang et al., 2013).
, 2006). Наконец, связывание киназы CDC2 с циклином CIG2 необходимо для вступления в премейотическую S фазу (Borgne et al., 2002). Недавно было обнаружено, что S-пальмитоилирование белков, модификация липидов, регулирует вступление в мейоз (Zhang et al., 2013).
У млекопитающих мейоз запускается на разных стадиях развития у самок и самцов (Bowles and Koopman, 2007). Исследования на мышах показали, что ретиноевая кислота (РА), продуцируемая во время эмбрионального развития, может вызывать мейоз у обоих полов.Уровень RA негативно регулируется ферментом Cyp26b1 , который обладает активностью деградации RA (Bowles et al., 2006; Koubova et al., 2006). стимулируется RA 8 ( Stra8 ), ген, специфичный для позвоночных, затем индуцируется RA и необходим для перехода к мейозу (Anderson et al., 2008). Stra8 не играет роли в митотических фазах развития эмбриональных зародышевых клеток, но у самок он необходим для премейотической репликации ДНК и последующих событий профазы мейоза. С другой стороны, Dmrt1 репрессирует транскрипцию Stra8 в митотической фазе, тем самым предотвращая мейоз (Matson et al., 2010).
С другой стороны, Dmrt1 репрессирует транскрипцию Stra8 в митотической фазе, тем самым предотвращая мейоз (Matson et al., 2010).
Судя по этим исследованиям, механизмы, запускающие мейоз, очень разные, и, что более важно, вовлеченные гены не имеют сходства. Несомненно, разные стратегии эволюционировали из-за разных репродуктивных требований разных организмов.
Решение о переключении митоз-мейоз у растений
У растений мейоз инициируется в спорогенных клетках, которые дифференцируются в семяпочки и пыльники (Bhatt et al., 2001). В каждой яйцеклетке дифференцируется только одна материнская клетка мегаспоры (MMC), окруженная соматическими нуцеллярными клетками, а затем подвергается мейозу (Рисунок 1). Во время развития пыльника, после того, как первичные спорогенные клетки (то есть предшественники материнских клеток пыльцы, PMC) дифференцируются, они сначала проходят несколько раундов митоза для пролиферации, а затем мейоз происходит синхронно во всех PMC каждого пыльника (Рисунок 1; Палмер , 1971).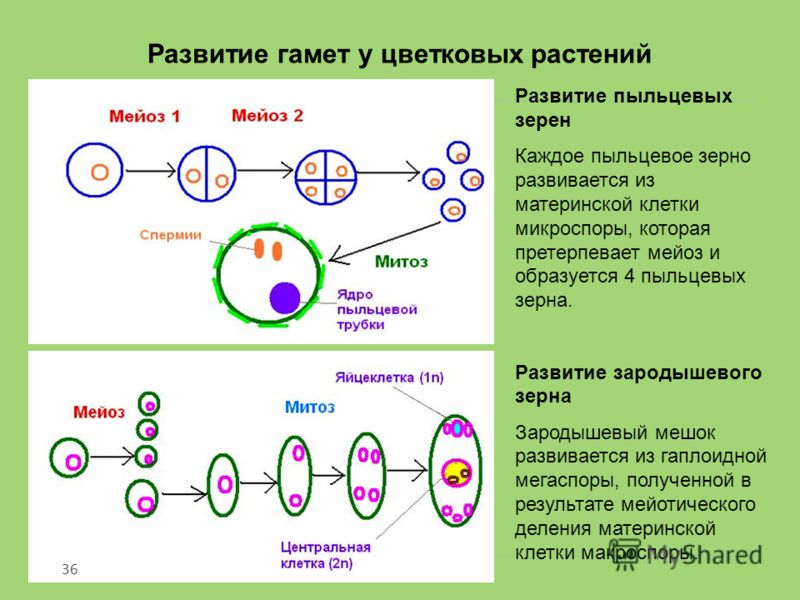 Таким образом, решение о переходе митоза в мейоз д. Согласовываться со стадиями развития пыльников и семяпочек.Напр., Сигнал, запускающий мейоз в пыльнике, д. Генерироваться после полного развития соматических слоев пыльника (Kelliher and Walbot, 2011). Интересно, что сигнал также может устанавливать синхронизацию мейотического клеточного цикла в пыльнике. С другой стороны, только одна MMC в каждой семяпочке специфицирована для входа в мейоз, который сопровождает развитие семяпочки параллельно. Таким образом, регуляторный механизм инициации мейоза может быть различным у самок и самцов у растений из-за различного развития спорогенеза.
Таким образом, решение о переходе митоза в мейоз д. Согласовываться со стадиями развития пыльников и семяпочек.Напр., Сигнал, запускающий мейоз в пыльнике, д. Генерироваться после полного развития соматических слоев пыльника (Kelliher and Walbot, 2011). Интересно, что сигнал также может устанавливать синхронизацию мейотического клеточного цикла в пыльнике. С другой стороны, только одна MMC в каждой семяпочке специфицирована для входа в мейоз, который сопровождает развитие семяпочки параллельно. Таким образом, регуляторный механизм инициации мейоза может быть различным у самок и самцов у растений из-за различного развития спорогенеза.
РИСУНОК 1. Структура репродуктивных органов растений кукурузы и последовательность событий, ведущих к образованию спор или гаметофитов в пыльниках и семязачатках. (A) Продольный разрез пыльника с многочисленными материнскими клетками пыльцы (PMC, показаны серым), которые размножаются из первичных спорогенных клеток путем митоза, который сопровождает развитие окружающих 4 слоев соматических клеток.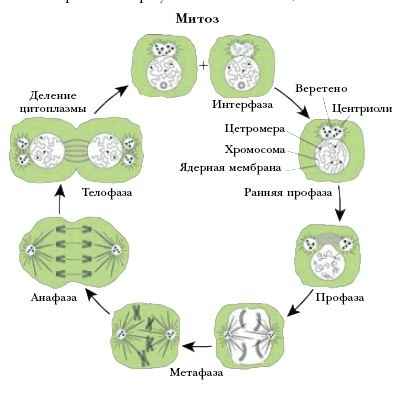 (B) После того, как первичные спорогенные клетки (PSC) дифференцированы, они сначала подвергаются митотическим делениям с образованием спорогенных клеток (SC) и в дальнейшем развиваются в PMC.К тому времени, когда развитие окружающих соматических клеток (показано в A ) завершается, генерируется неизвестный сиганл инициации мейоза, чтобы запустить мейоз синхронно во всех PMC пыльника. Каждый PMC вступает в мейоз, чтобы произвести четыре гаплоидных споровых клетки. (C) Продольный разрез семяпочки с единственной материнской клеткой мегапора (MMC, показана серым). (D) Схематическое изображение, показывающее последовательное развитие зародышевого мешка посредством полового размножения или апомиктических путей.При половом размножении одиночный MMC (показан серым) дифференцируется и затем входит в мейоз, чтобы произвести гаплоидную функциональную мегаспору (FMS), а затем развивается в зародышевый мешок. При диплоспорном апомиксисе указанный MMC обессмысливает аномальный мейоз или митоз с образованием диплоидного FMS.
(B) После того, как первичные спорогенные клетки (PSC) дифференцированы, они сначала подвергаются митотическим делениям с образованием спорогенных клеток (SC) и в дальнейшем развиваются в PMC.К тому времени, когда развитие окружающих соматических клеток (показано в A ) завершается, генерируется неизвестный сиганл инициации мейоза, чтобы запустить мейоз синхронно во всех PMC пыльника. Каждый PMC вступает в мейоз, чтобы произвести четыре гаплоидных споровых клетки. (C) Продольный разрез семяпочки с единственной материнской клеткой мегапора (MMC, показана серым). (D) Схематическое изображение, показывающее последовательное развитие зародышевого мешка посредством полового размножения или апомиктических путей.При половом размножении одиночный MMC (показан серым) дифференцируется и затем входит в мейоз, чтобы произвести гаплоидную функциональную мегаспору (FMS), а затем развивается в зародышевый мешок. При диплоспорном апомиксисе указанный MMC обессмысливает аномальный мейоз или митоз с образованием диплоидного FMS.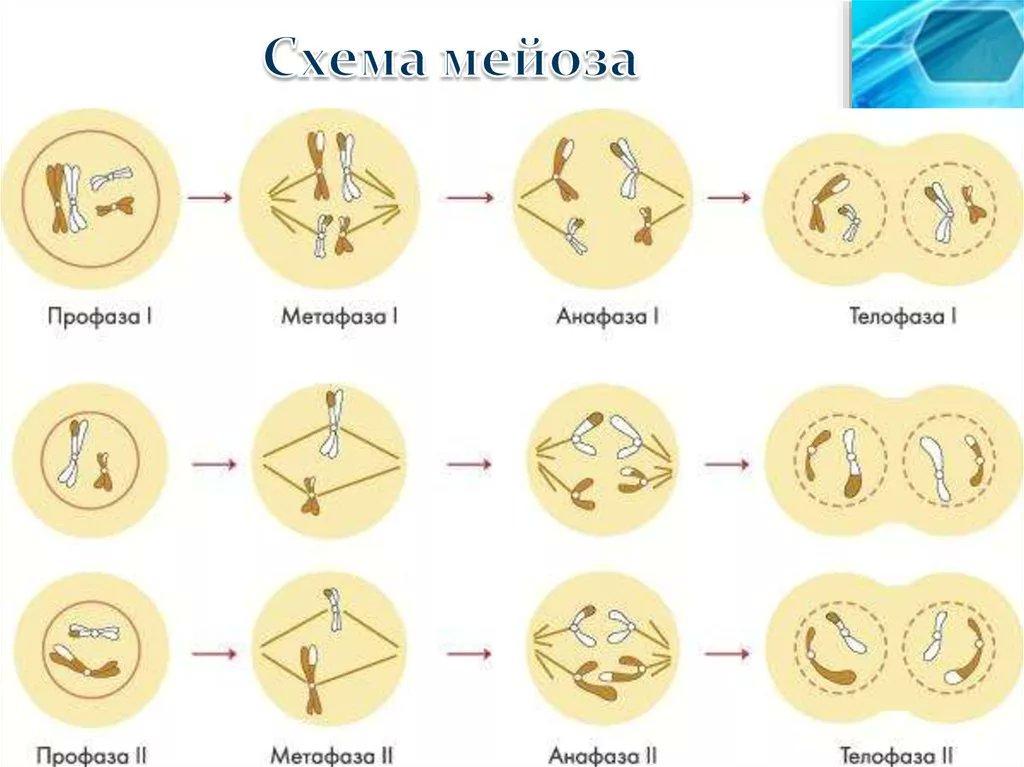 При апоспорном апомиксисе соматические нуцеллярные клетки развиваются в зародышевый мешок без мейоза.
При апоспорном апомиксисе соматические нуцеллярные клетки развиваются в зародышевый мешок без мейоза.
Первым открытием инициации мейоза было выделение мутанта кукурузы ameiotic1 ( am1 ) Роудсом (1956).Исходный мутантный аллель am1 не подвергается мейозу; вместо этого митозоподобные деления происходят в хорошо развитых мейоцитах как в женских, так и в мужских органах (Голубовская и др., 1993). Am1 кодирует специфичный для растений белок спиральной спирали с неизвестными функциями (Pawlowski et al., 2009). Все пять нулевых мутантных аллелей обнаруживают идентичные фенотипы в мужских мейоцитах, в которых митоз заменяет мейоз. Однако самки ММС у мутанта могут либо претерпевать митоз, либо останавливаться в интерфазе.Интересно, что аллель am1-praI , несущий единственную аминокислотную замену (R358W), может вступать в мейоз, но клетки останавливаются на стадии лептотены / зиготены, напоминая фенотип мутанта am1 риса, который также несет аминокислотную замену (R360W ) в консервативном регионе (Голубовская и др.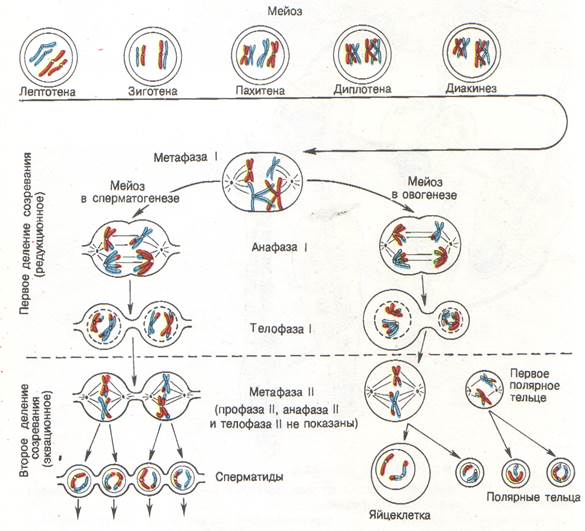 , 1997; Pawlowski et al., 2009; Che et al., 2011). Эти результаты предполагают, что AM1 необходим для инициации мейоза и может также регулировать прогрессию мейоза. В отличие от кукурузы и риса, мутанты в ближайшем гомологе Am1 в Arabidopsis, switch2 / dyad ( swi1 ), обнаруживают аномальный мейоз с дефектами сцепления сестринских хроматид в мужских мейоцитах, и митозоподобное деление было только наблюдается в мейоцитах самок (Mercier et al., 2001, 2003). Эти различия между видами могут указывать на то, что родственные AM1 гены претерпели видоспецифичную диверсификацию.
, 1997; Pawlowski et al., 2009; Che et al., 2011). Эти результаты предполагают, что AM1 необходим для инициации мейоза и может также регулировать прогрессию мейоза. В отличие от кукурузы и риса, мутанты в ближайшем гомологе Am1 в Arabidopsis, switch2 / dyad ( swi1 ), обнаруживают аномальный мейоз с дефектами сцепления сестринских хроматид в мужских мейоцитах, и митозоподобное деление было только наблюдается в мейоцитах самок (Mercier et al., 2001, 2003). Эти различия между видами могут указывать на то, что родственные AM1 гены претерпели видоспецифичную диверсификацию.
В то время как молекулярные функции AM1 / SWI1 все еще неизвестны, анализ микроматриц показал, что AM1 необходим для нормальной экспрессии многих мейотических генов (Nan et al., 2011). Используя микрочипы Agilent 44K, авторы сравнили транскриптомы в 1-мм и 1,5-мм пыльниках am1-489 (нулевой аллель) и am1-praI (точечный мутантный аллель) и их фертильных братьев и сестер.В 1-миллиметровых пыльниках, когда мейоз вот-вот начнется у дикого типа, 484 гена отсутствовали, и 1208 генов эктопически экспрессировались в пыльниках am1-489 .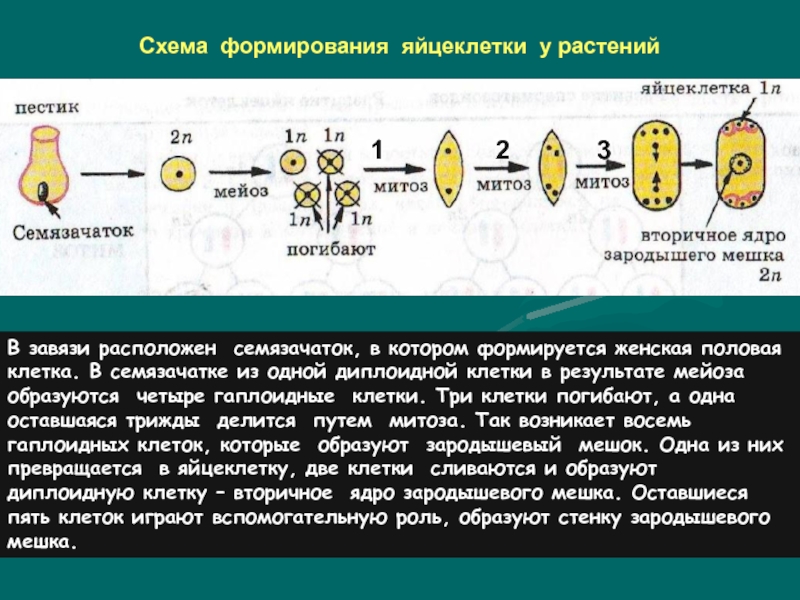 Считается, что эти гены способствуют инициации мейоза или подавлению митоза. В пыльниках размером 1,5 мм во время профазы I в пыльниках дикого типа отсутствовало 3700 транскриптов, а другие гены 3107 дифференциально экспрессировались в пыльниках am1-489 . Почти 60% изменений транскриптома, независимо от стадии, были генами, обогащенными PMC, и среди них было обнаружено много предполагаемых генов, связанных с мейозом.Однако ни один из генов, связанных с мейозом, не регулировался по абсолютной схеме включения / выключения на аллеле am1-489 , что несколько удивительно, учитывая, что PMC am1-489 осуществляют митоз вместо аномального мейоза. Эти результаты переопределяют роль AM1 в модуляции накопления транскриптов для многих мейотических генов, а не просто включают или выключают их (Nan et al., 2011).
Считается, что эти гены способствуют инициации мейоза или подавлению митоза. В пыльниках размером 1,5 мм во время профазы I в пыльниках дикого типа отсутствовало 3700 транскриптов, а другие гены 3107 дифференциально экспрессировались в пыльниках am1-489 . Почти 60% изменений транскриптома, независимо от стадии, были генами, обогащенными PMC, и среди них было обнаружено много предполагаемых генов, связанных с мейозом.Однако ни один из генов, связанных с мейозом, не регулировался по абсолютной схеме включения / выключения на аллеле am1-489 , что несколько удивительно, учитывая, что PMC am1-489 осуществляют митоз вместо аномального мейоза. Эти результаты переопределяют роль AM1 в модуляции накопления транскриптов для многих мейотических генов, а не просто включают или выключают их (Nan et al., 2011).
Недавно был проведен микроматричный анализ полученных с помощью лазера зародышевых и соматических инициалов кукурузы 0.В 3-миллиметровых пыльниках (сразу после дифференцировки спорогенных клеток) обнаружено около 2500 генов, специфичных или обогащенных зародышевыми инициалами (Kelliher, Walbot, 2014).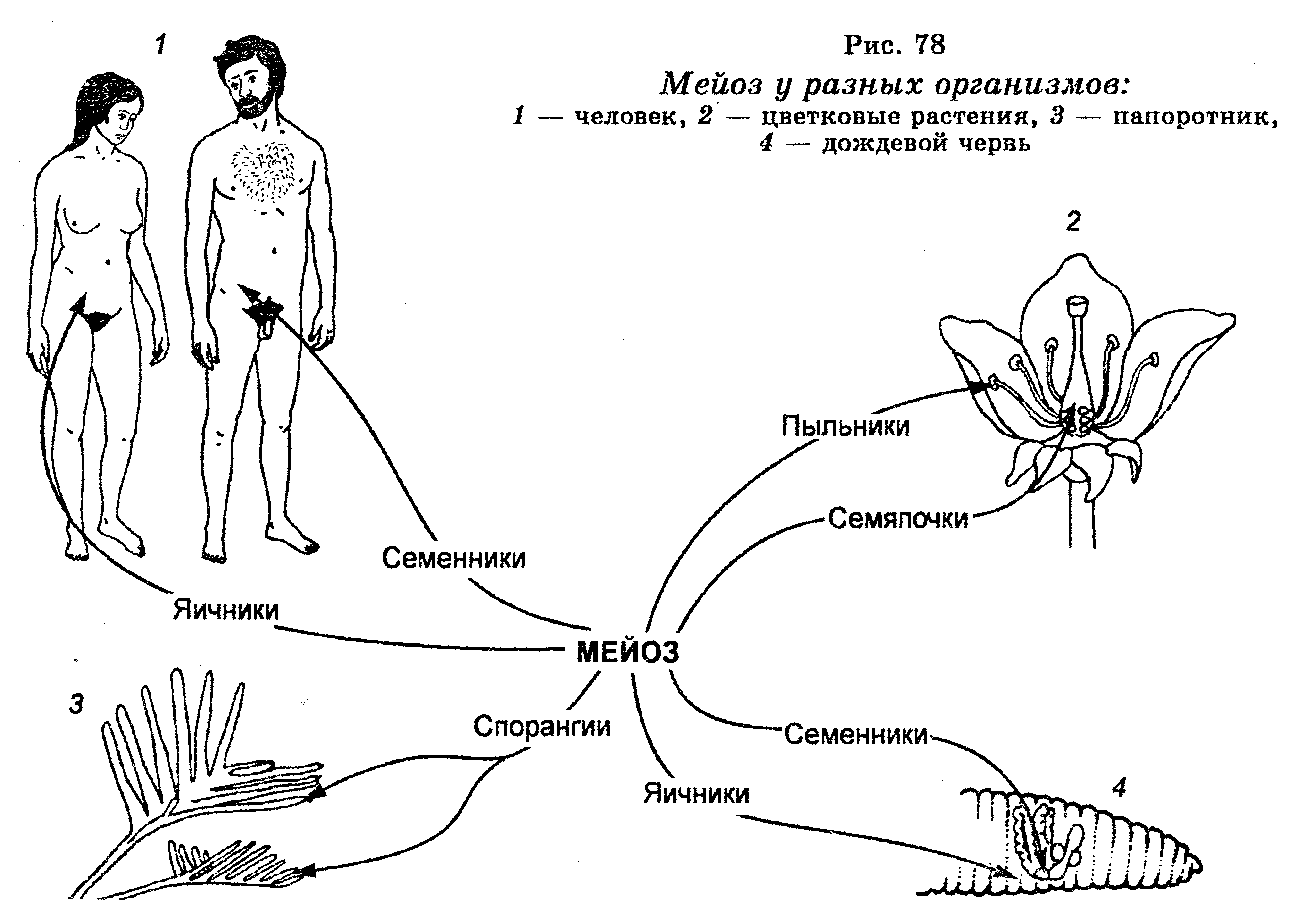 Неожиданно более 100 мейотических генов экспрессируются в период митотической амплификации, который происходит задолго до начала инициации мейоза. Это открытие открывает возможность того, что преждевременная экспрессия мейотических генов позволяет постепенно разбавлять компоненты митотического хроматина — гипотеза, недавно предложенная для зародышевой линии мыши (Hackett et al., 2013). Другая возможность состоит в том, что эти предшественники PMC готовятся к мейозу на уровне транскрипции и могут хранить некоторые мейотические транскрипты для трансляции на более поздних стадиях развития (Zhang et al., 2014). Несмотря на это, это открытие предполагает, что решение о запуске мейоза представляет собой серию последовательных шагов, а не одно переключение. Возможно, экспрессия мейотических генов может быть одним из самых ранних действий, и следующий регуляторный каскад, наконец, управляет инициацией и прогрессированием мейоза.Таким образом, какие факторы транскрипции ответственны за экспрессию ранних мейотических генов и находятся ли мейотические гены под трансляционным контролем, являются интересными вопросами для дальнейшего изучения.
Неожиданно более 100 мейотических генов экспрессируются в период митотической амплификации, который происходит задолго до начала инициации мейоза. Это открытие открывает возможность того, что преждевременная экспрессия мейотических генов позволяет постепенно разбавлять компоненты митотического хроматина — гипотеза, недавно предложенная для зародышевой линии мыши (Hackett et al., 2013). Другая возможность состоит в том, что эти предшественники PMC готовятся к мейозу на уровне транскрипции и могут хранить некоторые мейотические транскрипты для трансляции на более поздних стадиях развития (Zhang et al., 2014). Несмотря на это, это открытие предполагает, что решение о запуске мейоза представляет собой серию последовательных шагов, а не одно переключение. Возможно, экспрессия мейотических генов может быть одним из самых ранних действий, и следующий регуляторный каскад, наконец, управляет инициацией и прогрессированием мейоза.Таким образом, какие факторы транскрипции ответственны за экспрессию ранних мейотических генов и находятся ли мейотические гены под трансляционным контролем, являются интересными вопросами для дальнейшего изучения.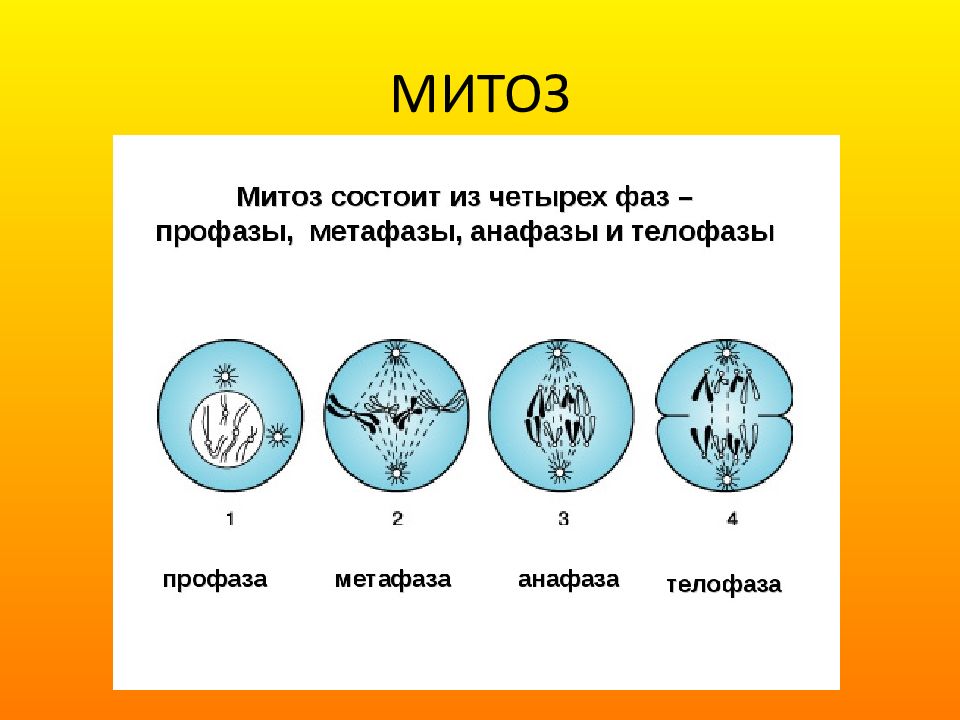 Кроме того, идентификация компонентов регуляторного каскада позволит лучше понять этот процесс.
Кроме того, идентификация компонентов регуляторного каскада позволит лучше понять этот процесс.
Другой ген, который, как сообщается, участвует в инициации мейоза, — это рис MEL2 , названный в честь его фенотипа «мейоз, остановленный на уровне лептотены». MEL2 кодирует белок с мотивом распознавания РНК (RRM), и он необходим для регуляции премейотического G1 / S-фазового перехода мужских и женских половых клеток (Nonomura et al., 2011), поскольку большинство половых клеток не могут войти в премейотическую S-фазу у мутанта mel2 . Небольшая часть PMC может ускользать от дефектов и подвергаться мейозу со значительной задержкой или продолжением митотических циклов. Как белок RRM влияет на инициацию мейоза, неясно на молекулярном уровне, но этот результат подразумевает возможную связь между процессингом мРНК, транспортом или стабильностью и вступлением в мейоз у растений. Исследования на дрожжах показали, что последним триггером для запуска мейоза является активация специфических комплексов cyclin-CDK, чтобы инициировать мейотическую S-фазу. Arabidopsis содержит не менее 50 циклинов, и лишь некоторые из них специфически экспрессируются в соцветии (Буланкова и др., 2013). Анализ мутантов показал, что некоторые из этих циклинов вносят вклад в отдельные процессы, связанные с мейозом, но ни один из мутантов циклина не обнаруживает дефектов инициации мейоза, которые приписывают избыточности генов. Таким образом, будет интересно узнать, какой комплекс cyclin-CDK ответственен за переход, если он вообще есть. Помимо комплексов cyclin-CDK, некоторые специфичные для мейоза регуляторы, такие как фактор репликации MUM2 и белок слипчивости REC8, участвуют в мейотической S фазе, хотя используется большая часть основного аппарата репликации (Strich, 2004).Следовательно, что особенного в премейотической S-фазе и какие специфические гены отличаются от митотической S-фазы у растений? Понимание этих специфичных для мейоза компонентов в S-фазе мейоза поможет нам проиллюстрировать молекулярные механизмы инициации мейоза. Исследование протеомики может дать ценную информацию по этому вопросу.
Arabidopsis содержит не менее 50 циклинов, и лишь некоторые из них специфически экспрессируются в соцветии (Буланкова и др., 2013). Анализ мутантов показал, что некоторые из этих циклинов вносят вклад в отдельные процессы, связанные с мейозом, но ни один из мутантов циклина не обнаруживает дефектов инициации мейоза, которые приписывают избыточности генов. Таким образом, будет интересно узнать, какой комплекс cyclin-CDK ответственен за переход, если он вообще есть. Помимо комплексов cyclin-CDK, некоторые специфичные для мейоза регуляторы, такие как фактор репликации MUM2 и белок слипчивости REC8, участвуют в мейотической S фазе, хотя используется большая часть основного аппарата репликации (Strich, 2004).Следовательно, что особенного в премейотической S-фазе и какие специфические гены отличаются от митотической S-фазы у растений? Понимание этих специфичных для мейоза компонентов в S-фазе мейоза поможет нам проиллюстрировать молекулярные механизмы инициации мейоза. Исследование протеомики может дать ценную информацию по этому вопросу.
На сегодняшний день мутанты, непосредственно влияющие на инициацию мейоза, демонстрируют сходные фенотипы в том, что некоторые репродуктивные клетки не могут вступать в мейоз ни у женщин, ни у мужчин, ни у обоих полов.Хотя некоторые из этих мутантов продуцируют нередуцированные дочерние клетки посредством митозоподобного деления, нет никаких доказательств того, что эти образующиеся в результате диплоидные клетки в семязачатках будут проходить апомиктический путь без оплодотворения. Однако интересное исследование продемонстрировало, что у мутанта Arabidopsis swi1 / dyad , было получено мало семян при опылении пыльцой дикого типа. Большая часть потомства была триплоидной, что позволяет предположить, что нередуцированные дочерние женские клетки после митозоподобного деления способны развиваться дальше и оплодотворяться гаплоидными мужскими гаметами (Ravi et al., 2008).
Текущие достижения в области апомиктического пути
Апомиксис — это тип бесполого размножения через семена, которые избегают как мейоза, так и оплодотворения. В апомиктическом пути дифференцированные ММС или другие соматические клетки в яйцеклетках, которые приобретают судьбу зародышевых клеток, способны обходить мейоз или претерпевать аномальный мейоз с образованием нередуцированных спор, которые далее митотически делятся с образованием зародышевого мешка (Рисунок 1; Колтунов, 1993; Карман , 1997). Хотя апомиксис регулируется генетически и встречается в природе у более чем 400 видов цветковых растений, его реализация на молекулярном уровне все еще неясна.За последние несколько лет появилось все больше доказательств того, что эпигенетический контроль может регулировать апомиксис. У Arabidopsis мутанты argonaute 9 (ago9) демонстрируют несколько MMC по сравнению с одной MMC в яйцеклетке дикого типа, а дополнительные MMC в мутанте способны инициировать гаметогенез, не подвергаясь мейозу, напоминающему апоспорию (Рисунок 1; Olmedo-Monfil и др., 2010). AGO9 предпочтительно взаимодействует с 24-нуклеотидными малыми интерферирующими РНК (миРНК), происходящими из мобильных элементов, чтобы направлять основанное на гомологах РНК-зависимое метилирование ДНК (RdDM).
В апомиктическом пути дифференцированные ММС или другие соматические клетки в яйцеклетках, которые приобретают судьбу зародышевых клеток, способны обходить мейоз или претерпевать аномальный мейоз с образованием нередуцированных спор, которые далее митотически делятся с образованием зародышевого мешка (Рисунок 1; Колтунов, 1993; Карман , 1997). Хотя апомиксис регулируется генетически и встречается в природе у более чем 400 видов цветковых растений, его реализация на молекулярном уровне все еще неясна.За последние несколько лет появилось все больше доказательств того, что эпигенетический контроль может регулировать апомиксис. У Arabidopsis мутанты argonaute 9 (ago9) демонстрируют несколько MMC по сравнению с одной MMC в яйцеклетке дикого типа, а дополнительные MMC в мутанте способны инициировать гаметогенез, не подвергаясь мейозу, напоминающему апоспорию (Рисунок 1; Olmedo-Monfil и др., 2010). AGO9 предпочтительно взаимодействует с 24-нуклеотидными малыми интерферирующими РНК (миРНК), происходящими из мобильных элементов, чтобы направлять основанное на гомологах РНК-зависимое метилирование ДНК (RdDM). Более того, мутации в SUPPRESSOR OF GENE SILENCING3 ( SGS3 ) и RNA-DEPENDENT RNA POLYMERASE6 ( RDR6 ), двух генах, необходимых для биогенеза siRNA, также приводят к дефекту, идентичному дефекту у мутантов ago9 ( Olmedo-Monfil et al., 2010). Точно так же кукуруза AGO104, гомолог Arabidopsis AGO9, регулирует репродуктивную судьбу, несмотря на некоторые различия между фенотипами кукурузы ago104 и Arabidopsis ago9 (Singh et al., 2011). Мутант кукурузы ago104 имеет единственную MMC; однако дефектный женский мейоз с аберрантной конденсацией приводит к функциональным женским гаметам с нередуцированным набором хромосом, напоминающим диплоспорию (Рис. 1). Кроме того, AGO104 необходим для гетерохроматического метилирования CHG и CHH. В соответствии с идеей, что эпигенетика регулирует апомиксис, мутации двух ДНК-метилтрансфераз, DMT102 и DMT103 в кукурузе, также обнаруживают апомиктическое развитие (Garcia-Aguilar et al., 2010).
Более того, мутации в SUPPRESSOR OF GENE SILENCING3 ( SGS3 ) и RNA-DEPENDENT RNA POLYMERASE6 ( RDR6 ), двух генах, необходимых для биогенеза siRNA, также приводят к дефекту, идентичному дефекту у мутантов ago9 ( Olmedo-Monfil et al., 2010). Точно так же кукуруза AGO104, гомолог Arabidopsis AGO9, регулирует репродуктивную судьбу, несмотря на некоторые различия между фенотипами кукурузы ago104 и Arabidopsis ago9 (Singh et al., 2011). Мутант кукурузы ago104 имеет единственную MMC; однако дефектный женский мейоз с аберрантной конденсацией приводит к функциональным женским гаметам с нередуцированным набором хромосом, напоминающим диплоспорию (Рис. 1). Кроме того, AGO104 необходим для гетерохроматического метилирования CHG и CHH. В соответствии с идеей, что эпигенетика регулирует апомиксис, мутации двух ДНК-метилтрансфераз, DMT102 и DMT103 в кукурузе, также обнаруживают апомиктическое развитие (Garcia-Aguilar et al., 2010).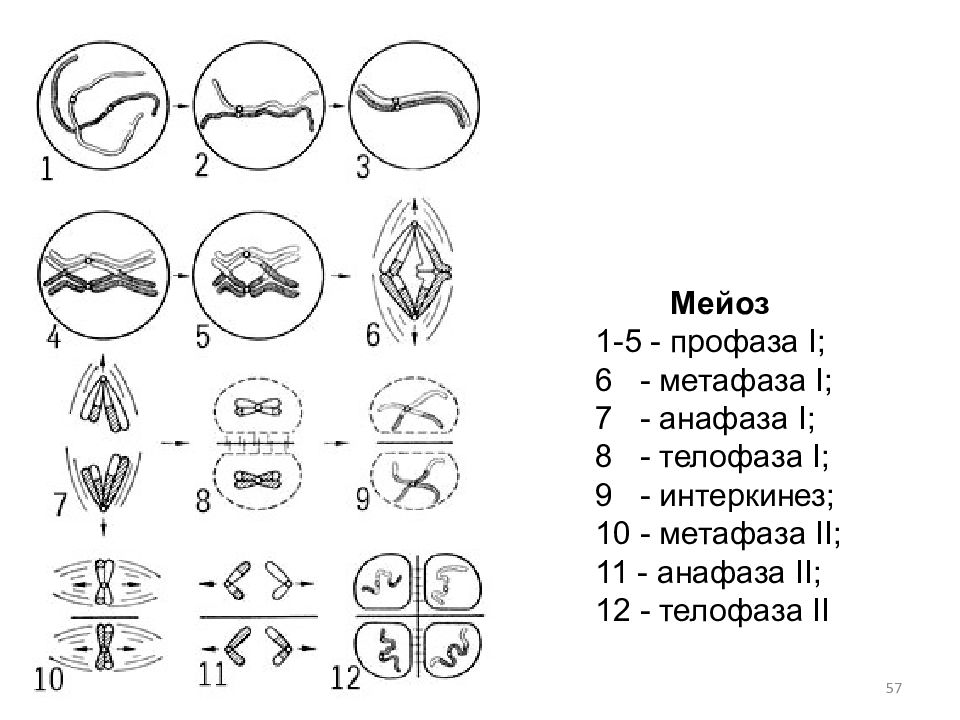 Таким образом, потеря RdDM, по-видимому, направляет соматические клетки к отдельным репродуктивным клеткам с апомиктической судьбой (наблюдается у мутанта Arabidopsis ago9 ) или ведет к апомиксису в правильно определенных MMCs (наблюдается у мутанта кукурузы ago104 ). Интересно, что как AGO9 в Arabidopsis , так и AGO104 в кукурузе специфически экспрессируются в окружающих соматических нуцеллярных клетках, а не в репродуктивных клетках, подразумевая, что оба гена контролируют апомиктический путь не клеточно-автономным образом.siRNA, продуцируемые соматическими клетками, могут перемещаться в зародышевые клетки, чтобы регулировать состояние хроматина путем подавления мобильных элементов. В самом деле, многие мобильные элементы подавляются в яйцеклетках дикого типа Arabidopsis AGO9-зависимым образом (Durán-Figueroa and Vielle-Calzada, 2010). Эти результаты подтверждают связь между siRNA-зависимым ремоделированием хроматина и апомиктическим путем (Garcia-Aguilar et al.
Таким образом, потеря RdDM, по-видимому, направляет соматические клетки к отдельным репродуктивным клеткам с апомиктической судьбой (наблюдается у мутанта Arabidopsis ago9 ) или ведет к апомиксису в правильно определенных MMCs (наблюдается у мутанта кукурузы ago104 ). Интересно, что как AGO9 в Arabidopsis , так и AGO104 в кукурузе специфически экспрессируются в окружающих соматических нуцеллярных клетках, а не в репродуктивных клетках, подразумевая, что оба гена контролируют апомиктический путь не клеточно-автономным образом.siRNA, продуцируемые соматическими клетками, могут перемещаться в зародышевые клетки, чтобы регулировать состояние хроматина путем подавления мобильных элементов. В самом деле, многие мобильные элементы подавляются в яйцеклетках дикого типа Arabidopsis AGO9-зависимым образом (Durán-Figueroa and Vielle-Calzada, 2010). Эти результаты подтверждают связь между siRNA-зависимым ремоделированием хроматина и апомиктическим путем (Garcia-Aguilar et al.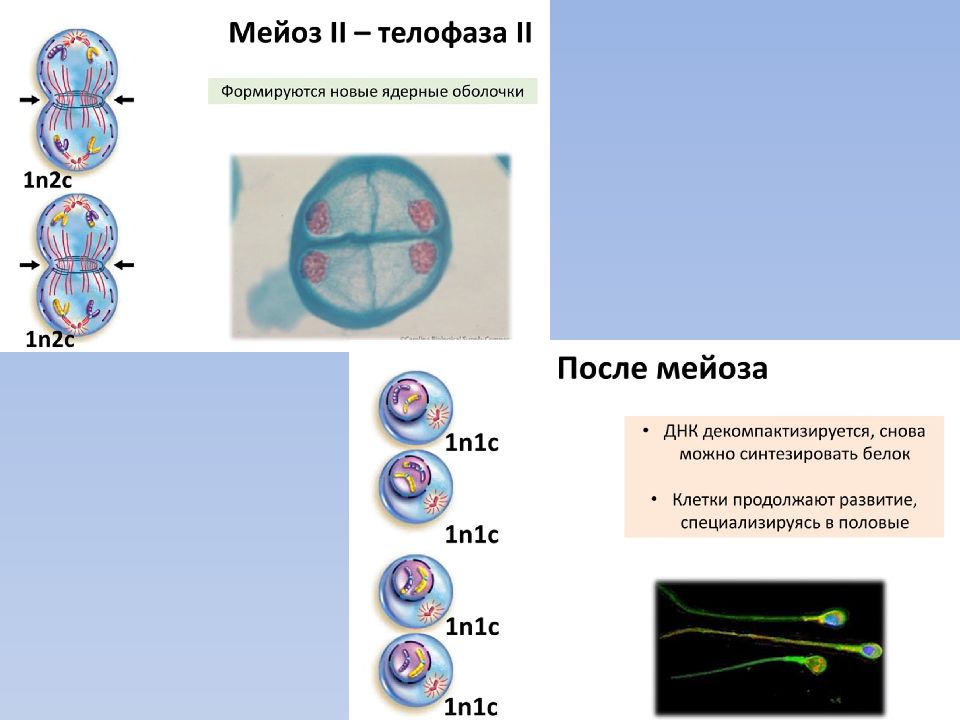 , 2010; Grimanelli, 2012).
, 2010; Grimanelli, 2012).
Другой ген, принадлежащий к семейству ARGONAUTE с мейотическим фенотипом, — это рис MEL1 .Он кодирует белок AGO5, который необходим для поддержания идентичности половых клеток и нормального развития мейоза. Интересно, что мутант mel1 также обнаруживает дефектную конденсацию хромосом с аномальной модификацией перицентромерного гистона (Nonomura et al., 2007). Недавно было показано, что MEL1 связывается с 21-нуклеотидной фазой малых интерферирующих РНК (Komiya et al., 2014). Для понимания эпигенетической регуляции размножения растений необходимы дальнейшие исследования.
За последние несколько лет идентификация мутантов пролила свет на генетический контроль эпигенетических механизмов, участвующих в апомиксисе.Однако до сих пор не ясно, как RdDM-зависимый процесс влияет на спецификацию клеточной судьбы, мейоз и развитие гаметофитов? Почему существует необходимость в siRNA, полученной из транспозиций, в зародышевой линии? Возможно ли, что RdDM сбрасывает судьбу клеток в зародышевой линии, роль также продемонстрирована для пути PIWI животных (Houwing et al. , 2008; Juliano et al., 2011)? Возможно, идентификация мишеней пути RdDM на разных этапах будет существенной для дальнейшего определения их ролей. Кроме того, какова взаимосвязь между AM1 / SWI1-зависимым инициированием мейоза и путем RdDM? Стоит отметить, что изменения в модификации гистонов наблюдались у мутанта swi1 (Boateng et al., 2008), повышая вероятность того, что каким-то образом AM1 / SWI1 участвует в ремоделировании хроматина. Многие интересные вопросы ждут дальнейшего изучения.
, 2008; Juliano et al., 2011)? Возможно, идентификация мишеней пути RdDM на разных этапах будет существенной для дальнейшего определения их ролей. Кроме того, какова взаимосвязь между AM1 / SWI1-зависимым инициированием мейоза и путем RdDM? Стоит отметить, что изменения в модификации гистонов наблюдались у мутанта swi1 (Boateng et al., 2008), повышая вероятность того, что каким-то образом AM1 / SWI1 участвует в ремоделировании хроматина. Многие интересные вопросы ждут дальнейшего изучения.
Заключение
Понимание инициации мейоза и апомиксиса у растений будет поучительным и может иметь множество потенциальных применений для селекции растений и в сельском хозяйстве, включая разработку стратегии получения апомиксиса у сельскохозяйственных культур и возможность манипулирования мейотическим клеточным циклом. Будет критически важно идентифицировать больше участников в решении митоз-мейоз и апомиктическом пути и исследовать их молекулярные функции.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы хотели бы поблагодарить сотрудников лаборатории Ванга за содержательные обсуждения и критические комментарии. Эта работа была поддержана Премией развития карьеры от Academia Sinica, Тайвань.
Список литературы
Андерсон, Э.L., Baltus, A.E., Roepers-Gajadien, H.L., Hassold, T.J., de Rooij, D.G., van Pelt, A.Met al. (2008). Stra8 и его индуктор, ретиноевая кислота, регулируют инициацию мейоза как в сперматогенезе, так и в оогенезе у мышей. Proc. Natl. Акад. Sci. США, 105, 14976–14980. DOI: 10.1073 / pnas.08072
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Боатенг, К. А., Янг, X., Донг, Ф., Оуэн, Х. А., и Макаров, К. А. (2008). SWI1 необходим для событий ремоделирования мейотических хромосом. Мол. Растение. 4, 620–633. DOI: 10.1093 / mp / ssn030
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Borgne, A., Murakami, H., Ayté, J.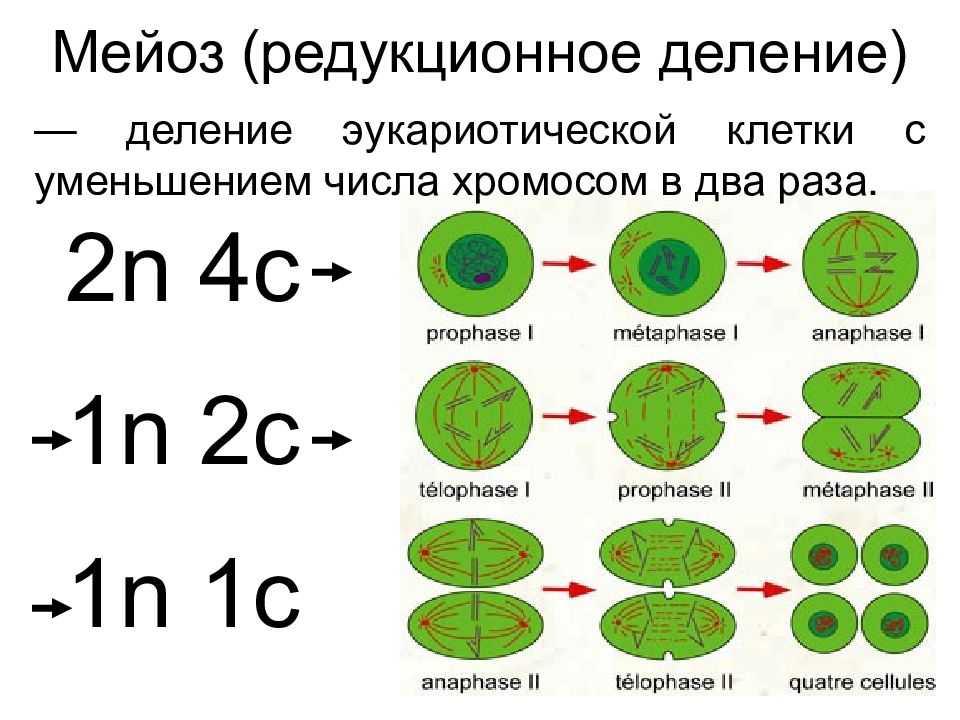 , and Nurse, P. (2002). Циклин Cig2p G1 / S во время мейоза у делящихся дрожжей. Мол. Биол. Клетка. 13, 2080–2090. DOI: 10.1091 / mbc.01-10-0507
, and Nurse, P. (2002). Циклин Cig2p G1 / S во время мейоза у делящихся дрожжей. Мол. Биол. Клетка. 13, 2080–2090. DOI: 10.1091 / mbc.01-10-0507
CrossRef Полный текст
Bowles, J., Knight, D., Smith, C., Wilhelm, D., Richman, J., Mamiya, S., et al. (2006). Передача сигналов ретиноидов определяет судьбу зародышевых клеток у мышей. Наука 312, 596–600. DOI: 10.1126 / science.1125691
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Буланкова П., Акимчева С., Фельнер Б. и Риха К. (2013). Идентификация мейотических циклинов Arabidopsis показывает функциональную диверсификацию генов циклинов растений. PLoS Genet. 9: e1003508. DOI: 10.1371 / journal.pgen.1003508
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Карман, Дж.Г. (1997). Асинхронная экспрессия повторяющихся генов у покрытосеменных может вызывать апомиксис, биспорию, тетраспорию и полиэмбрионию. Biol. Дж.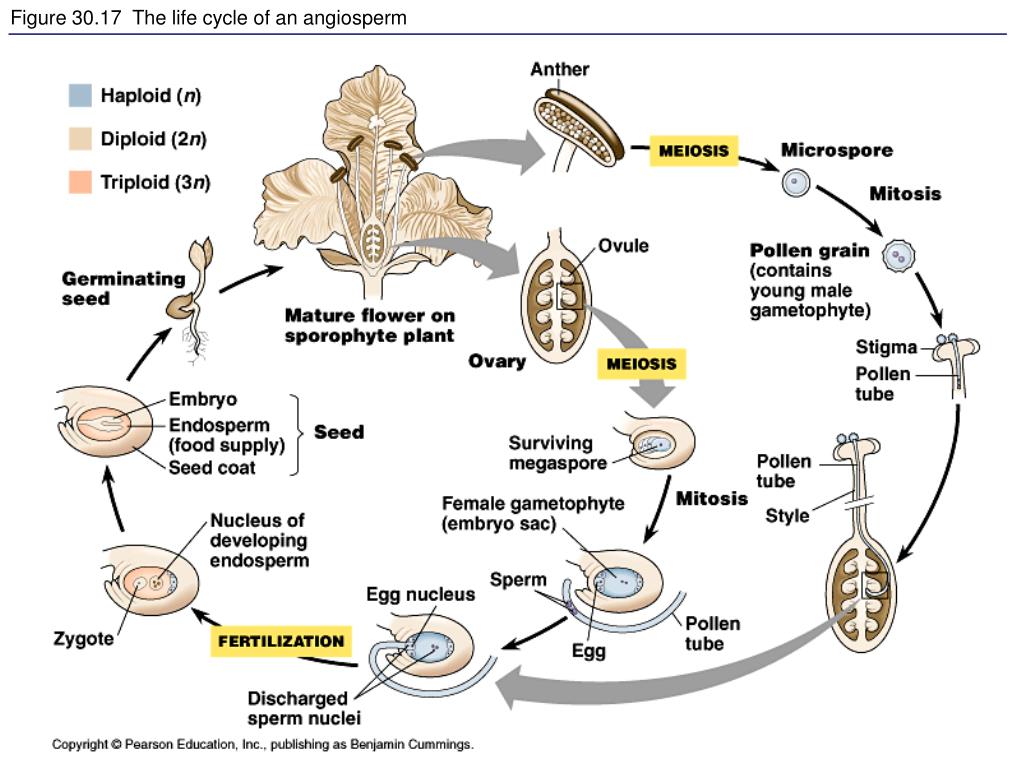 Линн. Soc. 61, 51–94. DOI: 10.1111 / j.1095-8312.1997.tb01778.x
Линн. Soc. 61, 51–94. DOI: 10.1111 / j.1095-8312.1997.tb01778.x
CrossRef Полный текст
Che, L., Tang, D., Wang, K., Wang, M., Zhu, K., Yu, H., et al. (2011). OsAM1 необходим для перехода лептотена-зиготена в рисе. Cell Res. 21, 654–665. DOI: 10.1038 / cr.2011.7
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Чу, С., DeRisi, J., Eisen, M., Mulholland, J., Botstein, D., Brown, P.O., et al. (1998). Программа транскрипции спорообразования у почкующихся дрожжей. Наука 282, 699–705. DOI: 10.1126 / science.282.5389.699
CrossRef Полный текст
Клиффорд Д. М., Старк К. Э., Гарднер К. Э., Хоффманн-Беннинг С. и Браш Г. С. (2005). Механистическое понимание Cdc28-родственной протеинкиназы Ime2 посредством анализа фосфорилирования репликационного протеина А. Cell Cycle 12, 1826–1833.DOI: 10.4161 / cc.4.12.2214
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Дирик, Л. , Гетч, Л., Аммерер, Г., и Байерс, Б. (1998). Регулирование мейотической S-фазы с помощью Ime2 и Clb5,6-ассоциированной киназы в Saccharomyces cerevisiae . Наука 281, 1854–1857. DOI: 10.1126 / science.281.5384.1854
, Гетч, Л., Аммерер, Г., и Байерс, Б. (1998). Регулирование мейотической S-фазы с помощью Ime2 и Clb5,6-ассоциированной киназы в Saccharomyces cerevisiae . Наука 281, 1854–1857. DOI: 10.1126 / science.281.5384.1854
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Дуран-Фигероа, Н., Вьелле-Кальсада, Дж. П. (2010). ARGONAUTE9-зависимое молчание мобильных элементов в перицентромерных областях Arabidopsis . Завод Сигнал. Behav. 5, 1476–1479. DOI: 10.1038 / nature08828
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Фойани М., Наджар-Богер Э., Капоне Р., Сейджи С., Хашимшони Т. и Кассир Т. (1996). Специфическая для мейоза протеинкиназа Ime2 необходима для правильного выбора времени репликации ДНК и образования спор в мейозе дрожжей. Мол. Genet Genet. 253, 278–288. DOI: 10.1007 / s004380050323
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Гарсия-Агилар, М.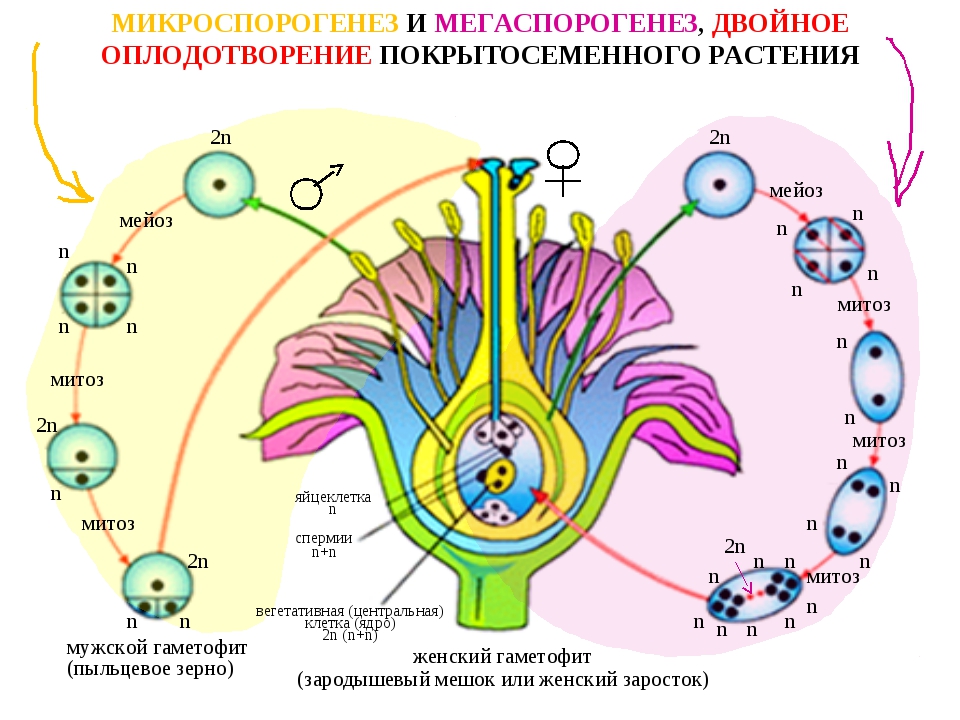 , Мишо, К., Леблан, О., и Гриманелли, Д. (2010). Инактивация пути метилирования ДНК в репродуктивных органах кукурузы приводит к появлению апомиксоподобных фенотипов. Растительная клетка 22, 3249–3267. DOI: 10.1105 / tpc.109.072181
, Мишо, К., Леблан, О., и Гриманелли, Д. (2010). Инактивация пути метилирования ДНК в репродуктивных органах кукурузы приводит к появлению апомиксоподобных фенотипов. Растительная клетка 22, 3249–3267. DOI: 10.1105 / tpc.109.072181
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Голубовская И., Авалкина Н., Шеридан В. Ф. (1997). Новое понимание роли локуса кукурузы ameiotic1. Генетика 147, 1339–1350.
Pubmed Аннотация | Pubmed Полный текст
Голубовская, И., Гребенникова, З.К., Авалкина, Н.А., Шеридан, В.Ф. (1993). Роль гена амейотика в инициации мейоза и последующих мейотических событиях у кукурузы. Генетика 135, 1151–1166.
Pubmed Аннотация | Pubmed Полный текст
Hackett, J. A., Sengupta, R., Zylicz, J. J., Murakami, K., Lee, C., Down, T. A., et al. (2013). Динамика деметилирования ДНК зародышевой линии и стирание отпечатка с помощью 5-гидроксиметилцитозина. Наука 339, 448–452. DOI: 10.1126 / наука.1229277
DOI: 10.1126 / наука.1229277
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Харигая Ю., Танака Х., Яманака С., Танака К., Ватанабе Ю., Цуцуми К. и др. (2006). Селективное удаление матричной РНК предотвращает преждевременный мейоз. Природа 442, 45–50. DOI: 10.1038 / nature04881
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Джулиано К., Ван Дж. И Линь Х. (2011). Объединение зародышевой линии и стволовых клеток: функция белков Piwi и пути piRNA в различных организмах. Annu. Преподобный Жене. 45, 447–469. DOI: 10.1146 / annurev-genet-110410-132541
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Китамура, Л., Катаяма, С., Дхут, С., Сато, М., Ватанабе, Ю., Ямамото, М., и др. (2001). Фосфорилирование Mei2 и Ste11 киназой Pat1 ингибирует половую дифференциацию посредством протеолиза убиквитина и белка 14-3-3 в делящихся дрожжах. Dev. Клетка. 1, 389–399. DOI: 10.1016 / S1534-5807 (01) 00037-5
DOI: 10.1016 / S1534-5807 (01) 00037-5
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Клекнер, Н.(1996). Мейоз: как это могло работать. Proc. Natl. Акад. Sci. USA 93, 8167–8174. DOI: 10.1073 / pnas.93.16.8167
CrossRef Полный текст
Комия Р., Охьянаги Х., Ниихама М., Ватанабе Т., Накано М., Курата Н. и др. (2014). Белок Argonaute MEL1, специфичный для зародышевой линии риса, связывается с фазиРНК, генерируемой более чем из 700 линкРНК. Plant J. 78, 385–397. DOI: 10.1111 / tpj.12483
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Кубова, Ю., Менке, Д. Б., Чжоу, К., Кейпел, Б., Грисволд, М. Д., и Пейдж, Д. К. (2006). Ретиноевая кислота регулирует зависимое от пола время инициации мейоза у мышей. Proc. Natl. Акад. Sci. США 103, 2474–2479. DOI: 10.1073 / pnas.0510813103
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ма, Х. (2005). Молекулярно-генетический анализ микроспорогенеза и микрогаметогенеза у цветковых растений. Annu. Rev. Plant Biol. 56, 393–434. DOI: 10.1146 / annurev.arplant.55.031903.141717
Annu. Rev. Plant Biol. 56, 393–434. DOI: 10.1146 / annurev.arplant.55.031903.141717
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Матсон, К. К., Мерфи, М. В., Грисволд, М. Д., Йошида, С., Бардуэлл, В. Дж., И Заркауэр, Д. (2010). Двойной половой гомолог млекопитающих DMRT1 является транскрипционным привратником, который контролирует решение митоза по сравнению с мейозом в мужских половых клетках. Dev. Клетка. 19, 612–624. DOI: 10.1016 / j.devcel.2010.09.010
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Мэйнард Смит, Дж.(1978). Эволюция секса. Кембридж: Издательство Кембриджского университета.
Мерсье, Р., Армстронг, С. Дж., Хорлоу, К., Джексон, Н. П., Макаров, К. А., Везон, Д. и др. (2003). Мейотический белок SWI1 необходим для образования аксиальных элементов и инициации рекомбинации в Arabidopsis . Разработка 130, 3309–3318. DOI: 10.1242 / dev.00550
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Мерсье, Р.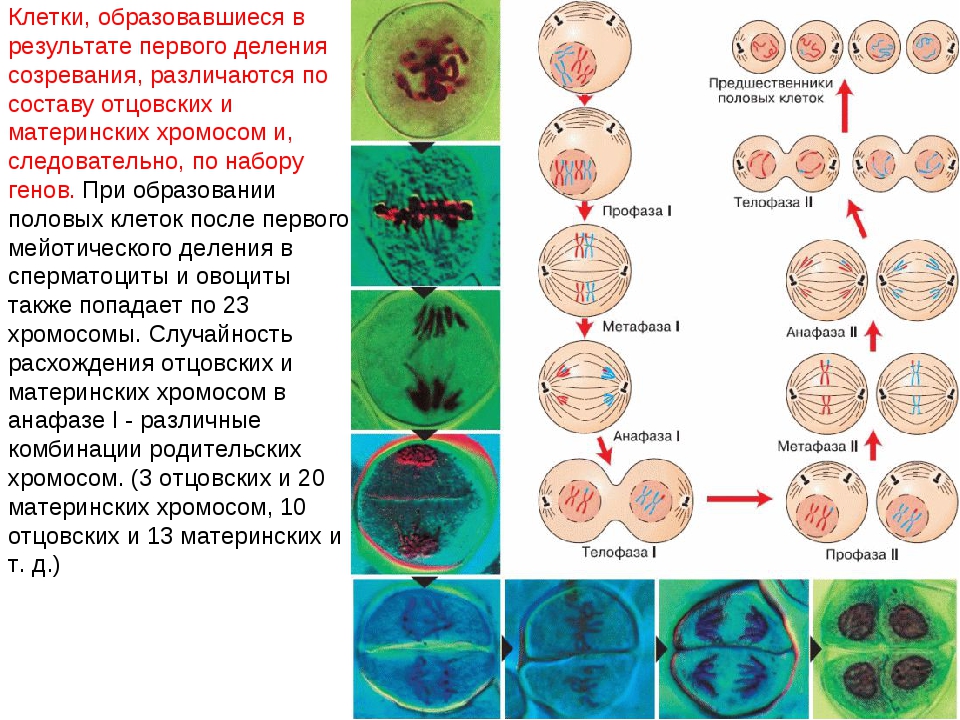 , Везон, Д., Буллиер, Э., Motamayor J. C., Sellier A., Lefevre, F., et al. (2001). SWITCh2 (SWI1): новый белок, необходимый для установления когезии сестринских хроматид и для образования двухвалентных клеток при мейозе. Gene Dev. 15, 1859–1871. DOI: 10.1101 / gad.203201
, Везон, Д., Буллиер, Э., Motamayor J. C., Sellier A., Lefevre, F., et al. (2001). SWITCh2 (SWI1): новый белок, необходимый для установления когезии сестринских хроматид и для образования двухвалентных клеток при мейозе. Gene Dev. 15, 1859–1871. DOI: 10.1101 / gad.203201
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Нан, Г. Л., Ронсерет, А., Ван, Р. К., Фернандес, Дж. Ф., Канде, В. З. и Уолбот, В. (2011). Глобальный транскриптомный анализ двух аллелей ameiotic1 в пыльниках кукурузы: определение этапов входа в мейот и его прохождения через профазу I. BMC Plant Biol. 11: 120. DOI: 10.1186 / 1471-2229-11-120
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Нономура, К., Эйгучи, М., Накано, М., Такашима, К., Комеда, Н., Фукути, С., и др. (2011). Для премейотического G1 / S-фазового перехода у риса ( Oryza sativa L.) необходим новый белок-мотив распознавания РНК. PLoS Genet. 7: e1001265.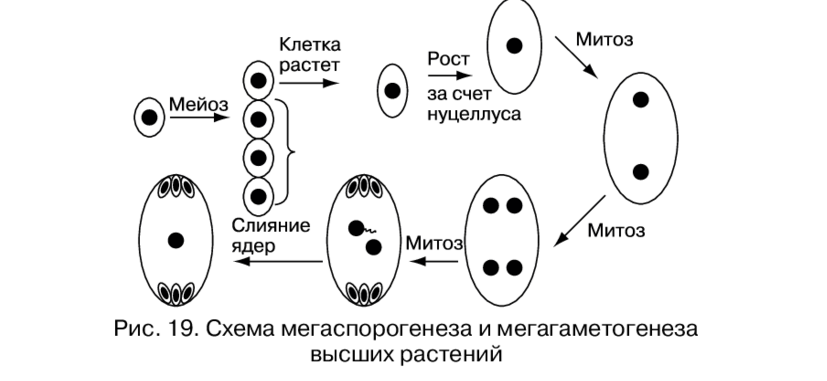 DOI: 10.1371 / journal.pgen.1001265
DOI: 10.1371 / journal.pgen.1001265
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Нономура, К., Морохоши, А., Накано, М., Эйгучи, М., Мияо, А., Хирочика, Х. и др. (2007). Специфический для зародышевых клеток ген семейства ARGONAUTE необходим для прогрессирования премейотического митоза и мейоза во время спорогенеза у риса. Растительная клетка 19, 2583–2594. DOI: 10.1105 / tpc.107.053199
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ольмедо-Монфил, В., Дуран-Фигероа, Н., Артеага-Васкес, М., Демеса-Аревало, Э., Отран, Д., Гриманелли, Д., и др. (2010).Контроль образования женских гамет с помощью пути малой РНК в Arabidopsis . Природа 464, 628–632. DOI: 10.1038 / nature08828
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Палмер Р. Г. (1971). Цитологические исследования амейотической и нормальной кукурузы в отношении премейотического спаривания. Хромосома 35, 233–246.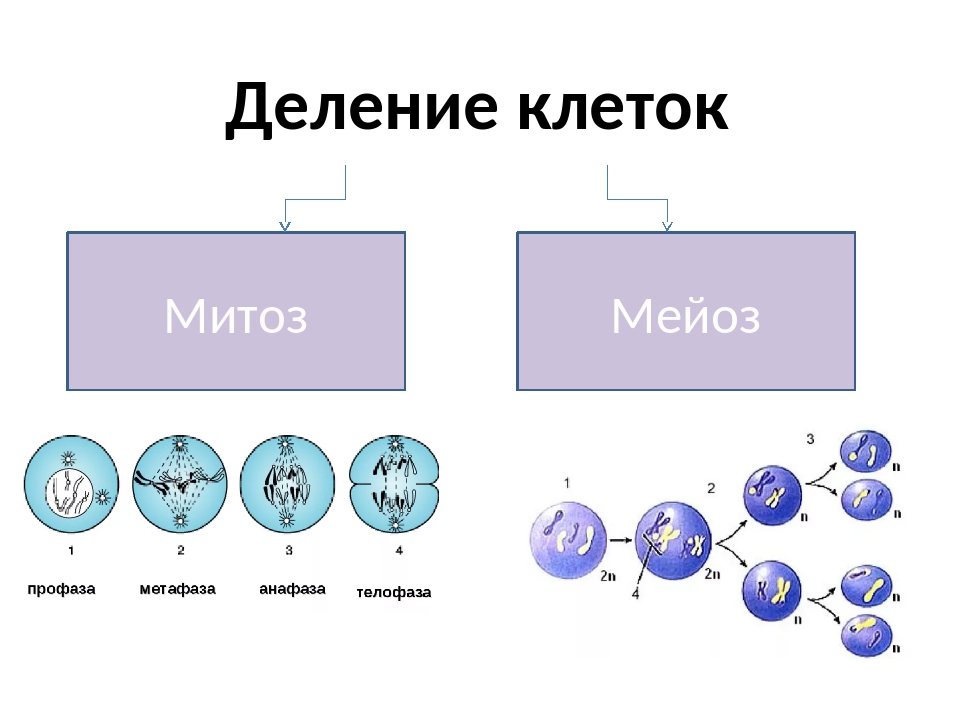 DOI: 10.1007 / BF00326276
DOI: 10.1007 / BF00326276
CrossRef Полный текст
Павловский, В.П., Ван, К.Р., Голубовская, И.Н., Шиманиак, Дж. М., Ши, Л., Хамант, О. и др. (2009). Кукуруза AMEIOTIC1 важна для множества ранних мейотических процессов и, вероятно, необходима для инициации мейоза. Proc. Natl. Акад. Sci. США 106, 3603–3608. DOI: 10.1073 / pnas.0810115106
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Роудс, М. М. (1956). Генетический контроль хромосомного поведения. Maize Genet. Coop. Новости Л. 30, 38–42.
Сингх М., Гоэль С., Meeley, R.B., Dantec, C., Parrinello, H., Michaud, C., et al. (2011). Производство жизнеспособных гамет без мейоза у кукурузы, дефицитной по белку ARGONAUTE. Растительная клетка 23, 443–458. DOI: 10.1105 / TPC.110.079020
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Стрих Р. (2004). Репликация мейотической ДНК. Curr. Вверх. Dev. Биол. 61, 29–60.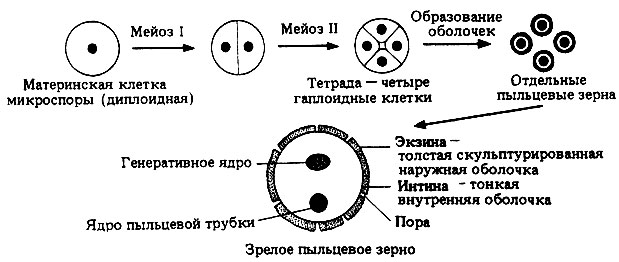 DOI: 10.1016 / S0070-2153 (04) 61002–61007
DOI: 10.1016 / S0070-2153 (04) 61002–61007
CrossRef Полный текст
Стюарт, Д.и Виттенберг К. (1998). CLB5 и CLB6 необходимы для премейотической репликации ДНК и активации контрольной точки S / M мейоза. Genes Dev. 12, 2698–2710. DOI: 10.1101 / gad.12.17.2698
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Сугимото А., Иино Ю., Маэда Т., Ватанабе Ю. и Ямамото М. (1991). Schizosaccharomyces pombe ste11 + кодирует фактор транскрипции с мотивом HMG, который является критическим регулятором полового развития. Genes Dev. 5, 1990–1999. DOI: 10.1101 / gad.5.11.1990
CrossRef Полный текст
Ватанабэ, Ю., Йокобаяси, С., Ямамото, М., и Медсестра, П. (2001). Премейотическая S-фаза связана с редукционной сегрегацией и рекомбинацией хромосом. Природа 409, 359–363. DOI: 10.1038 / 35053103
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Zhang, H., Egger, R. L., Kelliher, T. , Morrow, D., Fernandes, J., Nan, G. L., et al. (2014). Транскриптомы и протеомы определяют прогрессию экспрессии генов в премейотических пыльниках кукурузы. G3 (Bethesda) 4, 993–1010. DOI: 10.1534 / g3.113.009738
, Morrow, D., Fernandes, J., Nan, G. L., et al. (2014). Транскриптомы и протеомы определяют прогрессию экспрессии генов в премейотических пыльниках кукурузы. G3 (Bethesda) 4, 993–1010. DOI: 10.1534 / g3.113.009738
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Чжан М. М., Ву П. Дж., Келли Ф. Д., медсестра П. и Ханг Х. С. (2013). Количественный контроль S-пальмитоилирования белка регулирует вход мейоза у делящихся дрожжей. PLoS Biol. 11: e1001597. DOI: 10.1371 / journal.pbio.1001597
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Растительная жизнь: митоз и мейоз
| Митоз |
Организмы должны иметь возможность расти и воспроизводиться.Прокариоты, такие как бактерии, дублируют дезоксирибонуклеиновую кислоту (ДНК) и делятся путем деления на две части — процесс, называемый бинарным делением.
 Клетки эукариот, в том числе животных, растений, грибов и простейших, делятся одним из двух способов: митозом или мейозом.
Клетки эукариот, в том числе животных, растений, грибов и простейших, делятся одним из двух способов: митозом или мейозом. Митоз производит две клетки, называемые дочерними клетками, с тем же числом хромосом, что и родительская клетка, и используется для производства новых соматических (телесных) клеток у многоклеточных эукариот или новых особей у одноклеточных эукариот. У организмов, размножающихся половым путем, клетки, производящие гаметы (яйцеклетки или сперматозоиды), делятся посредством мейоза, производя четыре клетки, каждая с половиной количества хромосом, которыми обладает родительская клетка.
Репликация хромосом
Все эукариотические организмы состоят из клеток, содержащих хромосомы в ядре. Хромосомы состоят из ДНК и белков. Большинство клеток имеют два полных набора хромосом, которые встречаются парами. Две хромосомы, составляющие пару, гомологичны и содержат все одинаковые локусы (гены, контролирующие производство продукта определенного типа).
Эти пары хромосом обычно называют гомологичными парами.
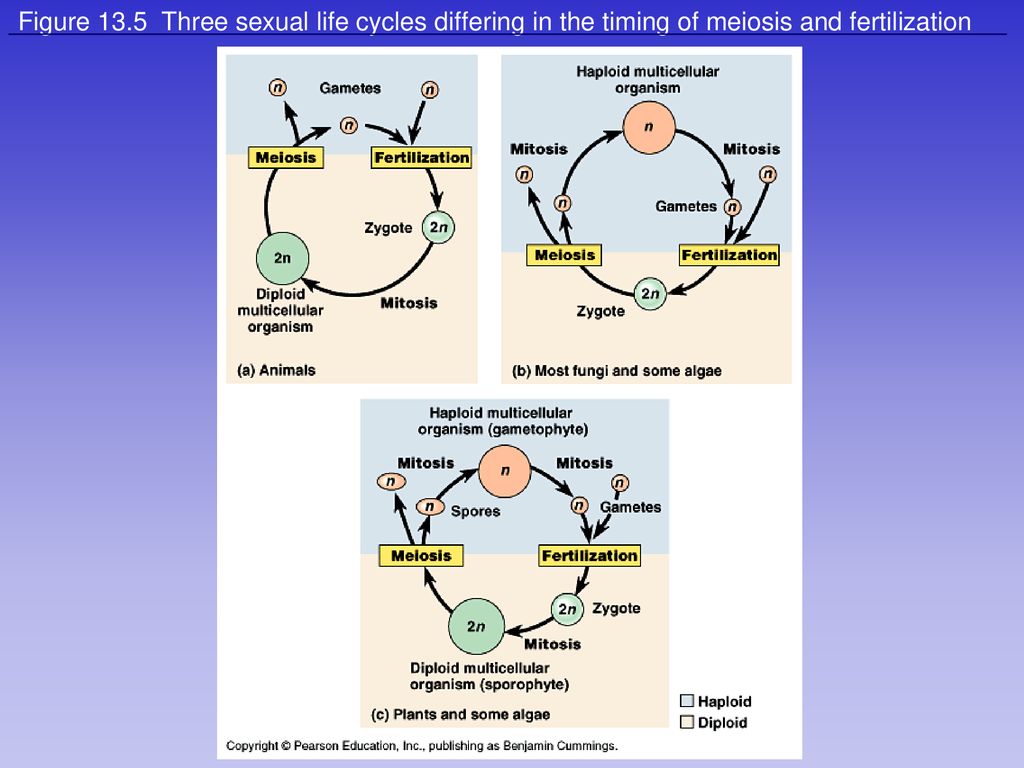 Отдельную хромосому из гомологичной пары иногда называют гомологом.Например, типичные клетки лилии содержат двенадцать пар гомологичных хромосом, всего двадцать четыре хромосомы.
Отдельную хромосому из гомологичной пары иногда называют гомологом.Например, типичные клетки лилии содержат двенадцать пар гомологичных хромосом, всего двадцать четыре хромосомы. Клетки с двумя гомологичными хромосомами каждого типа называются диплоидными. Некоторые клетки, такие как яйцеклетки и сперматозоиды, содержат половину нормального количества хромосом (только по одной из каждого гомолога) и называются гаплоидными. Яйца лилии и сперматозоиды содержат по двенадцать хромосом.
ДНК должна реплицироваться до митоза или мейоза. Если дочерние клетки должны получить полный набор генетической информации, должна быть доступна дублирующая копия ДНК.Прежде чем происходит репликация ДНК, каждая хромосома состоит из одной длинной цепи ДНК, называемой хроматидой. После репликации ДНК каждая хромосома состоит из двух хроматид, называемых сестринскими хроматидами.
Исходная хроматида действует как шаблон для создания второй хроматиды; поэтому они идентичны. Сестринские хроматиды прикреплены к особому участку хромосомы, называемому центросомером.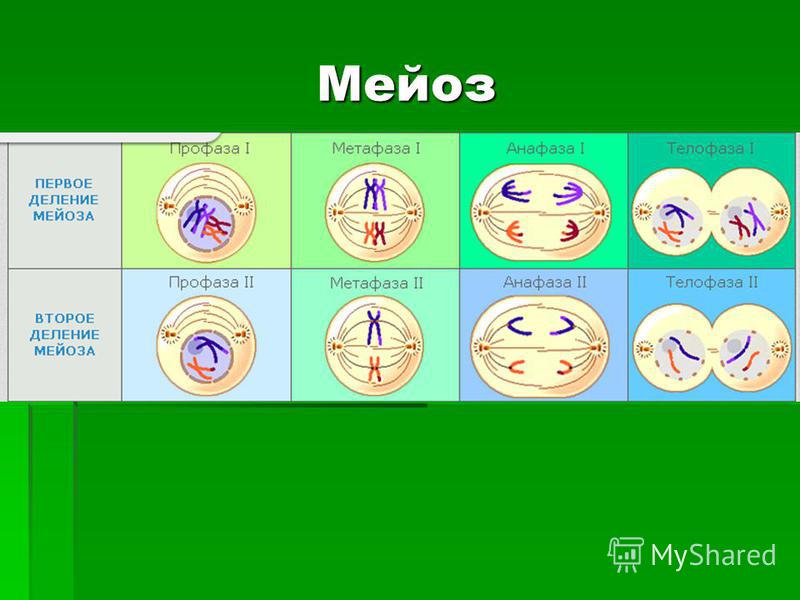 Когда начинается митоз или мейоз, каждая хромосома в клетке состоит из двух сестринских хроматид.
Когда начинается митоз или мейоз, каждая хромосома в клетке состоит из двух сестринских хроматид.
Митоз и мейоз продуцируют дочерние клетки с различными характеристиками. Когда диплоидная клетка подвергается митозу, образуются две идентичные диплоидные дочерние клетки.
Когда диплоидная клетка подвергается мейозу, образуются четыре уникальные гаплоидные дочерние клетки. Важно, чтобы гаметы были гаплоидными, чтобы при слиянии яйцеклетки и сперматозоидов диплоидное состояние зрелого организма восстанавливалось.
Жизненные циклы клетки
Митоз и мейоз возникают в ядерной области клетки, где находятся все хромосомы клетки.Механизмы ядерного контроля начинают деление клеток в подходящее время.
Некоторые клетки при митозе у взрослых организмов делятся редко, тогда как другие клетки делятся постоянно, заменяя старые клетки новыми. Мейоз возникает в ядрах клеток, производящих гаметы. Эти специализированные клетки встречаются в репродуктивных органах, например, в частях цветов высших растений.
Клетки, как и организмы, регулируются жизненными циклами. Жизненный цикл клетки называется клеточным циклом. Клетки проводят большую часть своего времени в интерфазе.Интерфаза разделена на три стадии: первый разрыв (G1), синтез (S) и второй разрыв (G2).
Во время G1 клетка выполняет свои обычные функции и часто увеличивается в размерах. На стадии S ДНК реплицируется, готовясь к делению клетки. На стадии G2 клетка производит материалы, необходимые для создания митотического аппарата и деления цитоплазматических компонентов клетки.
В конце интерфазы клетка готова к делению. Хотя каждая хромосома теперь состоит из двух сестринских хроматид, это не заметно при просмотре под микроскопом.Это потому, что все хромосомы находятся в очень расслабленном состоянии и просто выглядят как диффузный материал, называемый хроматином.
Митоз
Митоз состоит из пяти стадий: профаза, прометафаза, метафаза, анафаза и телофаза. Хотя определенные события определяют каждую стадию, митоз — это непрерывный процесс, и каждая стадия постепенно переходит в следующую. Поэтому иногда бывает сложно определить точное состояние.
Поэтому иногда бывает сложно определить точное состояние.
Во время профазы хроматин становится более плотно свернутым и конденсируется в хромосомы, которые хорошо видны под микроскопом, ядрышко исчезает, и в цитоплазме начинает формироваться веретенообразный аппарат.
В прометафазе ядерная оболочка разрушается, и теперь веретено может вторгаться в ядерную область. Некоторые волокна веретена прикрепляются к области около центромеры каждой хромосомы, называемой кинетохорой.
Веретенообразный аппарат — наиболее очевидная структура митотического аппарата. Ядерная область клетки имеет противоположные полюса, как Северный и Южный полюса Земли. Волокна веретена проходят от полюса к полюсу, проникая через всю ядерную область.
Во время метафазы хромосомы клетки выравниваются в области, называемой метафазной пластинкой, с сестринскими хроматидами, ориентированными к противоположным полюсам. Метафазная пластинка пересекает клетку так же, как экватор проходит через центр Земли. Сестринские хроматиды отделяются во время анафазы.
Сестринские хроматиды отделяются во время анафазы.
Сестринские хроматиды каждой хромосомы разделяются, и волокна веретена тянут каждую сестринскую хроматиду (теперь отдельная хромосома) от каждой пары к противоположным полюсам, подобно тому, как канатная дорога тянет лыжника на гору.Телофаза начинается, когда сестринские хроматиды достигают противоположных полюсов. Как только хроматиды достигают противоположных полюсов, веретено разваливается, и ядерная мембрана заново формируется. Митоз полный.
Мейоз
| Мейоз |
Мейоз II состоит из профазы II, метафазы II, анафазы II и телофазы II. В некоторых клетках между мейозом I и мейозом II возникает интерфаза II, но репликации ДНК не происходит.
Во время профазы I хромосомы конденсируются, ядерная оболочка распадается, и начинает формироваться веретенообразный аппарат. Гомологичные хромосомы объединяются в тетрады (тетрада состоит из четырех хроматид, по две сестринских хроматиды для каждой хромосомы). Плечи сестринских хроматид одного гомолога касаются плеч сестринских хроматид другого гомолога, причем точки контакта называются хиазмами.
Каждая хиазма представляет собой место, где руки имеют одинаковые локусы, так называемые гомологичные области. Во время этого интимного контакта хромосомы подвергаются кроссоверу, при котором хромосомы ломаются в хиазмах и меняют местами гомологичные части.
Этот процесс приводит к рекомбинации (перетасовке связанных аллелей, различных форм генов в новые комбинации), что приводит к повышенной вариабельности потомства и появлению комбинаций признаков, отсутствующих ни у одного из родителей.
Тетрады выравниваются на метафазной пластине во время метафазы I, и одно веретенообразное волокно прикрепляется к кинетохоре каждой хромосомы. В анафазе I вместо разделения сестринских хроматид они остаются прикрепленными на своих центромерах, а гомологичные хромосомы отделяются, причем каждый гомолог из тетрады движется к противоположным полюсам.
В анафазе I вместо разделения сестринских хроматид они остаются прикрепленными на своих центромерах, а гомологичные хромосомы отделяются, причем каждый гомолог из тетрады движется к противоположным полюсам.
Телофаза I начинается, когда гомологи достигают противоположных полюсов, и подобно телофазе митоза, веретенообразный аппарат распадается, и ядерная оболочка повторно формируется вокруг каждого из двух гаплоидных ядер.Поскольку количество хромосом в каждом ядре телофазы I составляет половину числа хромосом в родительском ядре, мейоз I иногда называют редукционным делением.
Мейоз II по существу совпадает с митозом, разделяя два гаплоидных ядра, образовавшихся в мейозе I. Профаза II, метафаза II, анафаза II и телофаза II по существу идентичны стадиям митоза. Мейоз II начинается с двух гаплоидных клеток и заканчивается четырьмя дочерними гаплоидными клетками.
Ядерное деление и цитокинез
Митоз и мейоз приводят к делению ядра.Деление ядра почти всегда согласовано с делением цитоплазмы.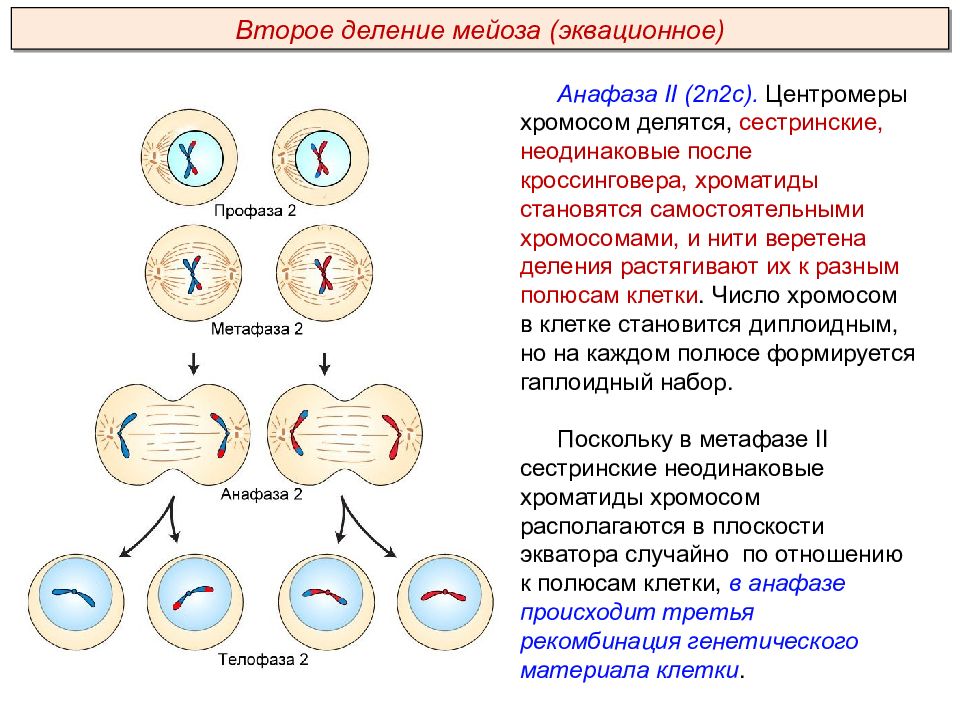 Расщепление цитоплазмы с образованием новых клеток называется цитокинезом. Цитокинез начинается ближе к середине или к концу деления ядра и включает в себя не только деление цитоплазмы, но и органелл.
Расщепление цитоплазмы с образованием новых клеток называется цитокинезом. Цитокинез начинается ближе к середине или к концу деления ядра и включает в себя не только деление цитоплазмы, но и органелл.
У растений после окончания деления ядра между дочерними ядрами должна образоваться новая клеточная стенка. Новая клеточная стенка начинается, когда везикулы, заполненные материалом клеточной стенки, собираются там, где была расположена метафазная пластинка, образуя структуру, называемую клеточной пластиной.
Когда клеточная пластинка полностью сформирована, цитокинез завершен. После цитокинеза клетка возвращается в интерфазу. Митотические дочерние клетки увеличиваются в размерах, воспроизводят органеллы и возобновляют регулярную деятельность. После мейоза гаметы могут быть изменены или транспортироваться в репродуктивной системе.
Чередование поколений
Мейотические дочерние клетки продолжают развитие, только если они сливаются во время оплодотворения.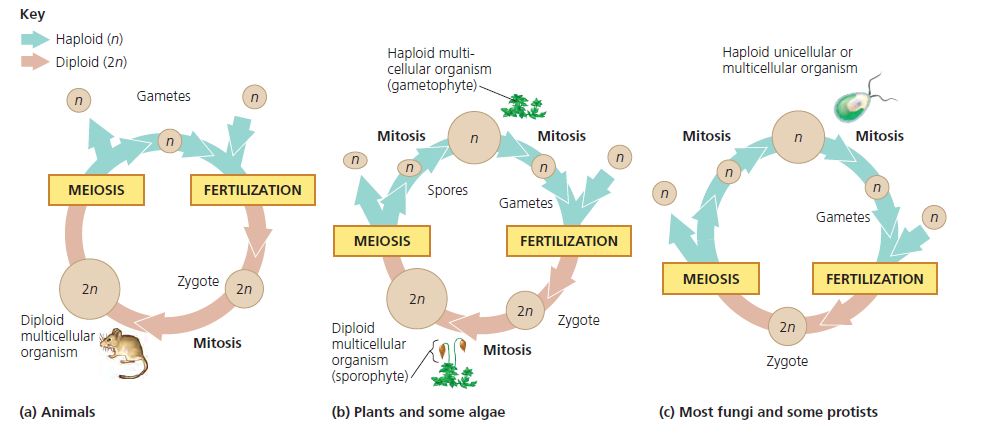 Митоз и мейоз чередуются в течение жизненных циклов организмов, размножающихся половым путем.Стадия жизненного цикла, следующая за митозом, диплоидна, а стадия, следующая за мейозом, — гаплоидна. Этот процесс называется сменой поколений.
Митоз и мейоз чередуются в течение жизненных циклов организмов, размножающихся половым путем.Стадия жизненного цикла, следующая за митозом, диплоидна, а стадия, следующая за мейозом, — гаплоидна. Этот процесс называется сменой поколений.
У растений диплоидное состояние называется поколением спорофитов, а гаплоидная стадия — поколением гаметофитов. У несосудистых растений генерация гаметофитов доминирует в жизненном цикле. Другими словами, растения, которые обычно можно увидеть на лесной подстилке, состоят из гаплоидных клеток.
Спорофиты, имеющие диплоидные клетки, маленькие и прикрепляются к телу гаметофита.У сосудистых растений спорофиты — это крупные многоклеточные особи (например, деревья и папоротники), тогда как гаметофиты очень маленькие и либо встроены в спорофит, либо являются свободноживущими, как папоротники.
Генетическая изменчивость, вызванная половым размножением, оказывает значительное влияние на способность видов выживать и адаптироваться к окружающей среде.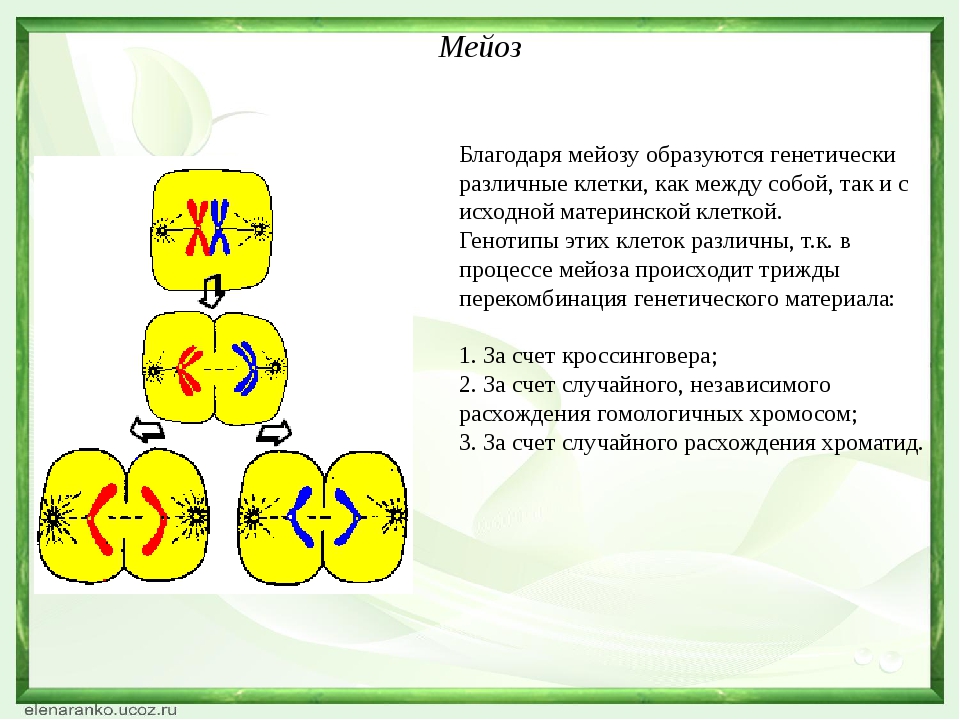 Смена поколений позволяет происходить половому размножению без изменения числа хромосом, характеризующих вид.
Смена поколений позволяет происходить половому размножению без изменения числа хромосом, характеризующих вид.
Мейоз цветковых растений и других зеленых организмов | Журнал экспериментальной ботаники
Аннотация
Половые эукариоты генерируют гаметы, используя специализированное деление клеток, называемое мейозом, которое служит как для уменьшения вдвое количества хромосом, так и для изменения генетической изменчивости, присутствующей в родительском организме. Здесь рассмотрены природа и механизм деления мейотических клеток у растений и его влияние на генетическую изменчивость. Поскольку цветы являются местом мейоза и оплодотворения покрытосеменных растений, мейотический контроль будет рассматриваться в этом контексте развития.Наконец, мы рассматриваем то, что известно о контроле мейоза у зеленых водорослей и нецветущих наземных растений, и обсуждаем эволюционные переходы, относящиеся к мейозу, которые произошли в линиях, дающих начало покрытосеменным.
Введение
Человек выбрал из естественных генетических вариаций виды сельскохозяйственных культур, полезных для сельского хозяйства. Еще предстоит полностью использовать значительное генетическое разнообразие, в том числе вариации, способные повысить урожайность и расширить спектр сельскохозяйственных культур.Для того, чтобы накормить 9 миллиардов человек, которые, по оценкам, будут существовать к 2050 году, потребуется устойчивое увеличение урожайности на 50% (Королевское общество, 2009). Чтобы повысить эффективность селекции сельскохозяйственных культур, важно понимать механизм, с помощью которого генерируются и передаются вариации. Вариации возникают в ходе специализированного редуктивного деления клеток, называемого мейозом, во время которого происходит рекомбинация между гомологичными хромосомами, называемая кроссовером (CO). Частота CO варьируется внутри и между видами и может быть ограничивающей, так что полезные вариации недоступны для разведения. Хотя большинство сельскохозяйственных культур представляют собой покрытосеменные растения, у которых мейоз происходит в органах цветков, нецветковые растения предоставили новое понимание контроля над мейозом растений. Здесь рассмотрены природа деления мейотических клеток у растений, генетические механизмы, которые способствуют изменчивости, и контекст развития, в котором происходит мейоз у наземных растений и их ближайших сестринских групп.
Хотя большинство сельскохозяйственных культур представляют собой покрытосеменные растения, у которых мейоз происходит в органах цветков, нецветковые растения предоставили новое понимание контроля над мейозом растений. Здесь рассмотрены природа деления мейотических клеток у растений, генетические механизмы, которые способствуют изменчивости, и контекст развития, в котором происходит мейоз у наземных растений и их ближайших сестринских групп.
Деления мейотических клеток
Мейоз — это способ деления клеток, специфичный для эукариотических организмов, при котором четыре гаплоидные дочерние клетки образуются из одной диплоидной родительской клетки (Villeneuve and Hillers, 2001; Hamant et al., 2006; Mezard et al. , 2007). Это редуктивное деление достигается с помощью одного раунда репликации ДНК, за которым следуют два раунда сегрегации хромосом и деления клеток (мейоз-I и мейоз-II) (рис. 1). Мейоз, по-видимому, является наследственной чертой эукариот и, как предполагается, возник недалеко от происхождения группы (Villeneuve and Hillers, 2001; Cavalier-Smith, 2002).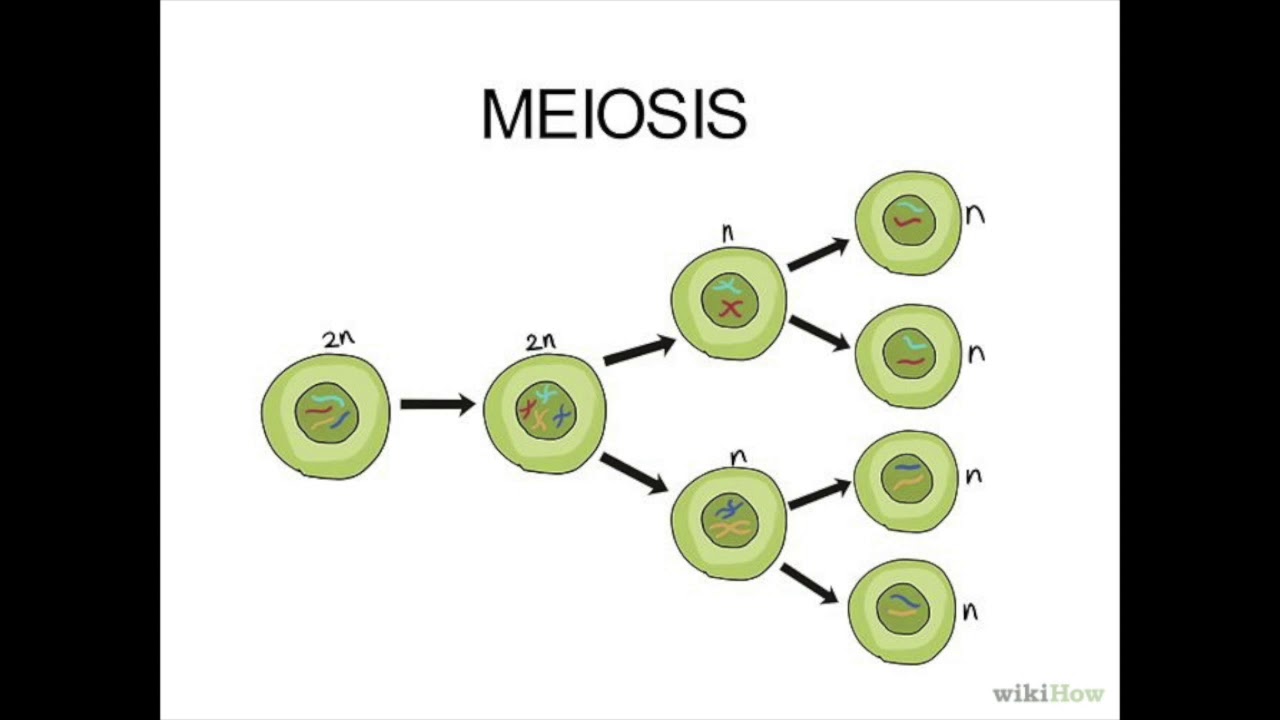 Эта идея подкрепляется наблюдениями, что многие одноклеточные эукариоты, которые когда-то считались бесполыми, с тех пор, как было обнаружено, обладают консервативными генами, специфичными для мейоза (Ramesh et al., 2005; Малик и др. , 2007). Первое мейотическое деление резко отличается от митоза, поскольку гомологичные хромосомы спариваются до сегрегации. Во время второго деления сестринские хроматиды разделяются на противоположные полюса так же, как и во время митоза. В то время как гомологи спариваются во время мейоза-I, они тесно связаны посредством синаптонемного комплекса, который формируется по их длине (Page and Hawley, 2004). Специфическая для мейоза экспрессия эндонуклеазы, SPO11, вызывает большое количество двухцепочечных разрывов (DSB) вдоль парных хромосом (Villeneuve and Hillers, 2001).Подмножество этих сайтов разрыва репарируется посредством путей рекомбинации, которые приводят к физическому обмену между парными хромосомами (CO) (Villeneuve and Hillers, 2001; Hamant et al.
Эта идея подкрепляется наблюдениями, что многие одноклеточные эукариоты, которые когда-то считались бесполыми, с тех пор, как было обнаружено, обладают консервативными генами, специфичными для мейоза (Ramesh et al., 2005; Малик и др. , 2007). Первое мейотическое деление резко отличается от митоза, поскольку гомологичные хромосомы спариваются до сегрегации. Во время второго деления сестринские хроматиды разделяются на противоположные полюса так же, как и во время митоза. В то время как гомологи спариваются во время мейоза-I, они тесно связаны посредством синаптонемного комплекса, который формируется по их длине (Page and Hawley, 2004). Специфическая для мейоза экспрессия эндонуклеазы, SPO11, вызывает большое количество двухцепочечных разрывов (DSB) вдоль парных хромосом (Villeneuve and Hillers, 2001).Подмножество этих сайтов разрыва репарируется посредством путей рекомбинации, которые приводят к физическому обмену между парными хромосомами (CO) (Villeneuve and Hillers, 2001; Hamant et al.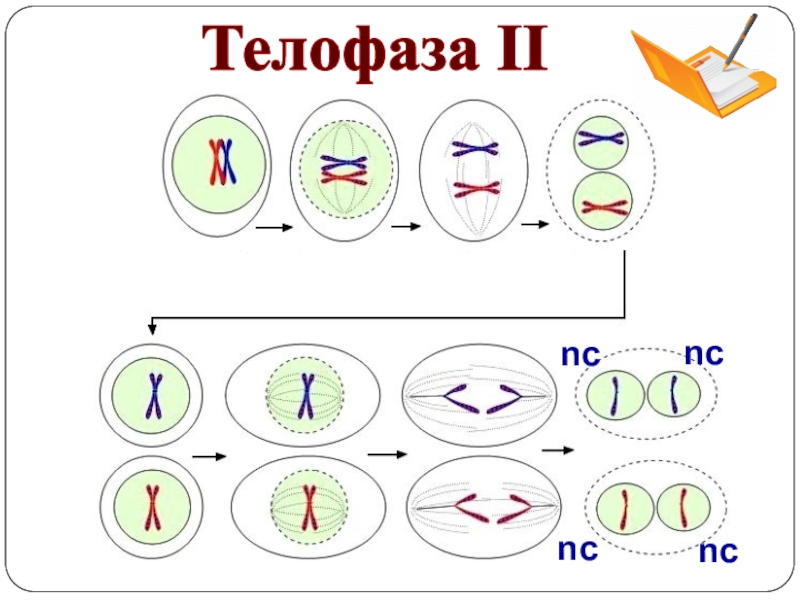 , 2006; Mezard et al. , 2007). Поскольку парные хромосомы разделяются во время мейоза-I, сайты CO могут быть визуализированы цитологически как хиазмы (Armstrong et al. , 2009). Независимое разделение материнских и отцовских наборов хромосом во время мейоза в сочетании с CO между хромосомами означает, что гаметы, вероятно, будут обладать новыми комбинациями генетических вариаций (рис.1).
, 2006; Mezard et al. , 2007). Поскольку парные хромосомы разделяются во время мейоза-I, сайты CO могут быть визуализированы цитологически как хиазмы (Armstrong et al. , 2009). Независимое разделение материнских и отцовских наборов хромосом во время мейоза в сочетании с CO между хромосомами означает, что гаметы, вероятно, будут обладать новыми комбинациями генетических вариаций (рис.1).
Рис. 1.
Наследование хромосом при мейозе. (A) Материнские (белые) и отцовские (черные) унаследованные копии двух пар хромосом показаны в диплоидной родительской клетке. (B) Во время S-фазы мейоза-I реплицируется каждая хромосома. (C) Унаследованные по материнской и отцовской линии пары гомологичных хромосом физически связаны во время профазы мейоза-I. Одновременно со спариванием большое количество двухцепочечных разрывов ДНК (показано короткими вертикальными линиями) индуцируется эндонуклеазой SPO11.(D) В конце мейоза-I микротрубочки веретена прикрепляются к центромерам парных бивалентов, и события рекомбинации завершаются. (E) Члены гомологичных пар хромосом отделяются от противоположных полюсов клетки. (F) Мейоз-I дополняется равным количеством реплицированных рекомбинированных хромосом в дочерних клетках. (G) Во время мейоза-II сцепление теряется между реплицированными хроматидами, которые разделяются на противоположные полюсы клеток. (H) Четыре гаплоидные дочерние клетки производятся с новыми комбинациями наследуемой по материнской и отцовской линии генетической информации.
(E) Члены гомологичных пар хромосом отделяются от противоположных полюсов клетки. (F) Мейоз-I дополняется равным количеством реплицированных рекомбинированных хромосом в дочерних клетках. (G) Во время мейоза-II сцепление теряется между реплицированными хроматидами, которые разделяются на противоположные полюсы клеток. (H) Четыре гаплоидные дочерние клетки производятся с новыми комбинациями наследуемой по материнской и отцовской линии генетической информации.
Рис. 1.
Наследование хромосом при мейозе. (A) Материнские (белые) и отцовские (черные) унаследованные копии двух пар хромосом показаны в диплоидной родительской клетке. (B) Во время S-фазы мейоза-I реплицируется каждая хромосома. (C) Унаследованные по материнской и отцовской линии пары гомологичных хромосом физически связаны во время профазы мейоза-I. Одновременно со спариванием большое количество двухцепочечных разрывов ДНК (показано короткими вертикальными линиями) индуцируется эндонуклеазой SPO11.(D) В конце мейоза-I микротрубочки веретена прикрепляются к центромерам парных бивалентов, и события рекомбинации завершаются. (E) Члены гомологичных пар хромосом отделяются от противоположных полюсов клетки. (F) Мейоз-I дополняется равным количеством реплицированных рекомбинированных хромосом в дочерних клетках. (G) Во время мейоза-II сцепление теряется между реплицированными хроматидами, которые разделяются на противоположные полюсы клеток. (H) Четыре гаплоидные дочерние клетки производятся с новыми комбинациями наследуемой по материнской и отцовской линии генетической информации.
(E) Члены гомологичных пар хромосом отделяются от противоположных полюсов клетки. (F) Мейоз-I дополняется равным количеством реплицированных рекомбинированных хромосом в дочерних клетках. (G) Во время мейоза-II сцепление теряется между реплицированными хроматидами, которые разделяются на противоположные полюсы клеток. (H) Четыре гаплоидные дочерние клетки производятся с новыми комбинациями наследуемой по материнской и отцовской линии генетической информации.
Программируемый разрыв и восстановление ДНК
Важным первым шагом в достижении CO является генерация DSB во всем геноме с помощью SPO11. SPO11 родственен субъединице A архебактериальной топиоизомеразы IV, которая действует, снимая перекручивание ДНК, генерируя временные DSB (Villeneuve and Hillers, 2001; Cavalier-Smith, 2002). Следовательно, компоненты аппарата мейотической рекомбинации могут быть задействованы из механизмов репарации прокариотической ДНК. Два родственных ортолога SPO11-1 и SPO11-2 необязательно необходимы для мейотических DSB у Arabidopsis thaliana (Grelon et al.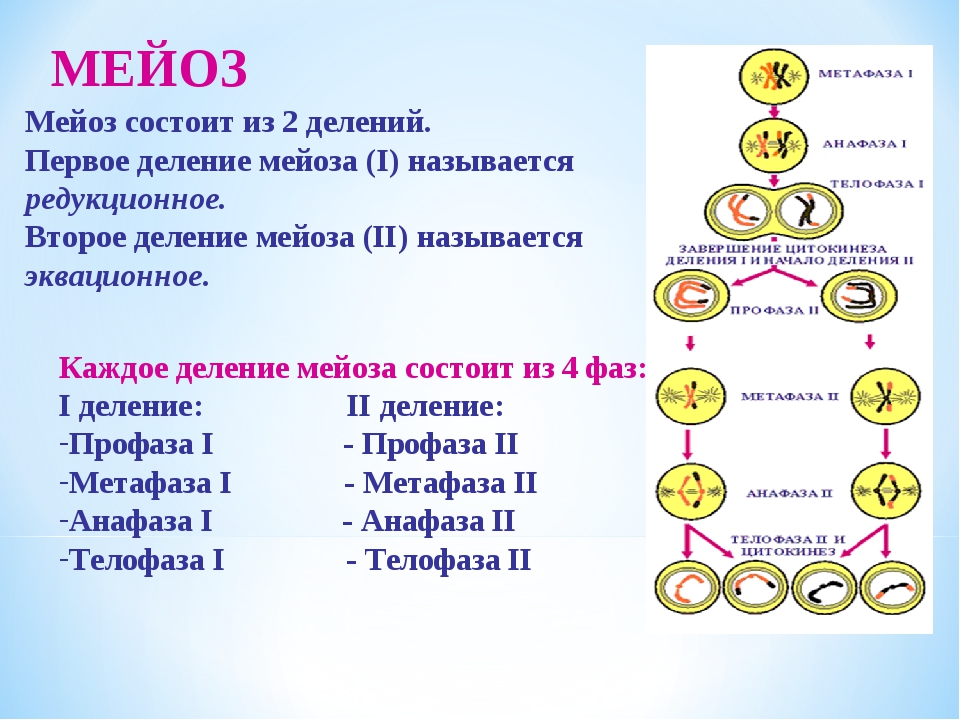 , 2001; Стейси и др. , 2006; Hartung et al. , 2007). Мутанты spo11-1 и spo11-2 лишены мейотических DSB и демонстрируют отсутствие гомологичных пар и синапсов, что означает, что одновалентные хромосомы сегрегируют в мейозе-I (Grelon et al. , 2001; Stacey et al. , 2006; Hartung et al. , 2007). Поскольку одновалентные хромосомы сегрегируют независимо от своего гомологичного партнера, мутанты spo11 показывают высокую частоту хромосомно несбалансированных гамет (Grelon et al., 2001; Стейси и др. , 2006; Hartung et al. , 2007). ДЕФЕКТЫ ИНИЦИАЦИИ ПУТАТИВНОЙ РЕКОМБИНАЦИИ 1 ( PRD1 ), PRD2 и PRD3 гены также необходимы для образования SPO11 -зависимых DSB и вызывают унивалентную сегрегацию при мутации (De et al., 2007, . ). PRD1 и PRD3 имеют сходство последовательностей с известными мейотическими белками, Mei1 млекопитающих и PAIR1 риса, соответственно, но выполняют неизвестные функции во время образования DSB (Libby et al.
, 2001; Стейси и др. , 2006; Hartung et al. , 2007). Мутанты spo11-1 и spo11-2 лишены мейотических DSB и демонстрируют отсутствие гомологичных пар и синапсов, что означает, что одновалентные хромосомы сегрегируют в мейозе-I (Grelon et al. , 2001; Stacey et al. , 2006; Hartung et al. , 2007). Поскольку одновалентные хромосомы сегрегируют независимо от своего гомологичного партнера, мутанты spo11 показывают высокую частоту хромосомно несбалансированных гамет (Grelon et al., 2001; Стейси и др. , 2006; Hartung et al. , 2007). ДЕФЕКТЫ ИНИЦИАЦИИ ПУТАТИВНОЙ РЕКОМБИНАЦИИ 1 ( PRD1 ), PRD2 и PRD3 гены также необходимы для образования SPO11 -зависимых DSB и вызывают унивалентную сегрегацию при мутации (De et al., 2007, . ). PRD1 и PRD3 имеют сходство последовательностей с известными мейотическими белками, Mei1 млекопитающих и PAIR1 риса, соответственно, но выполняют неизвестные функции во время образования DSB (Libby et al. , 2002; Nonomura et al. , 2004; De Muyt et al. , 2007, 2009).
, 2002; Nonomura et al. , 2004; De Muyt et al. , 2007, 2009).
Второй функциональный класс генов, включая MND1 , AHP2 , RAD50 , RAD51C , XRCC3 , MRE11 и COM1 / SAE2 хромосом с мутантным фенотипом мутантной фрагментации synapsis, который подавляется в сочетании с spo11 или prd3 . (Schommer et al. , 2003; Bleuyard et al., 2004; Блейярд и Уайт, 2004; Пуизина и др. , 2004; Ли и др. , 2004; Kerzendorfer et al. , 2006; Panoli et al. , 2006; Uanschou et al. , 2007; Vignard et al. , 2007). Это указывает на то, что эти белки действуют, чтобы обрабатывать DSB во время мейотической рекомбинации, а нерепарированные DSB вызывают фрагментацию хромосом. Процессинг мейотических DSB происходит посредством резекции участка разрыва с образованием 3′-одноцепочечной ДНК, которая используется для вторжения в интактный дуплекс парной гомологичной хромосомы (Bhatt et al.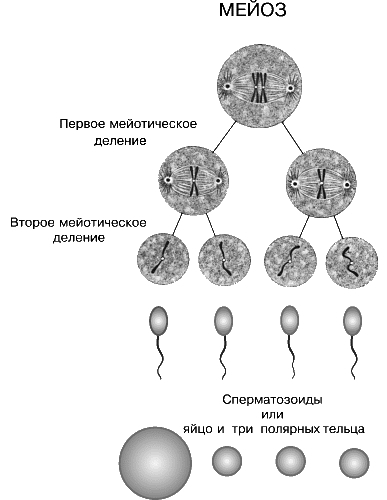 , 2001; Вильнёв и Хиллерс, 2001; Hamant et al. , 2006; Mezard et al. , 2007). Для проникновения оцДНК в дуплексы ДНК требуются рекомбиназы DMC1 и RAD51, которые связаны с белками обмена нити ДНК прокариот RecA (Couteau et al. , 1999; Masson and West, 2001; Villeneuve and Hillers, 2001; Cavalier-Smith, 2002). ; Ли и др. , 2004). Хотя считается, что оба RAD51 и DMC1 действуют на стадии инвазии оцДНК, мутанты rad51 демонстрируют SPO11 -зависимую фрагментацию хромосомы, тогда как мутанты dmc1 демонстрируют одновалентную сегрегацию (Couteau et al., 1999; Ли и др. , 2004). Одним из объяснений этого различия может быть то, что DSB восстанавливаются с использованием сестринских хроматид в dmc1 , но не в rad51 (Couteau et al. , 1999; Li et al. , 2004).
, 2001; Вильнёв и Хиллерс, 2001; Hamant et al. , 2006; Mezard et al. , 2007). Для проникновения оцДНК в дуплексы ДНК требуются рекомбиназы DMC1 и RAD51, которые связаны с белками обмена нити ДНК прокариот RecA (Couteau et al. , 1999; Masson and West, 2001; Villeneuve and Hillers, 2001; Cavalier-Smith, 2002). ; Ли и др. , 2004). Хотя считается, что оба RAD51 и DMC1 действуют на стадии инвазии оцДНК, мутанты rad51 демонстрируют SPO11 -зависимую фрагментацию хромосомы, тогда как мутанты dmc1 демонстрируют одновалентную сегрегацию (Couteau et al., 1999; Ли и др. , 2004). Одним из объяснений этого различия может быть то, что DSB восстанавливаются с использованием сестринских хроматид в dmc1 , но не в rad51 (Couteau et al. , 1999; Li et al. , 2004).
DSBs приводят к CO посредством образования двойного соединения Холлидея (dHJ) между парными гомологичными дуплексами ДНК (Villeneuve and Hillers, 2001).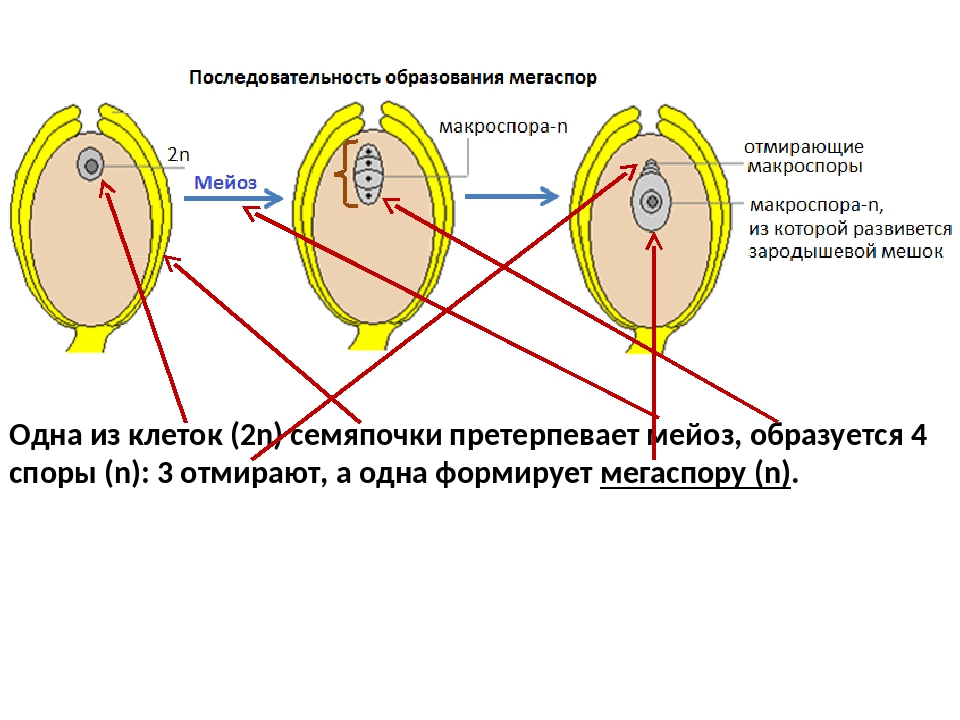 Вслед за инвазией цепи необходим ряд событий для образования dHJ, включая захват второго конца и синтез и лигирование ДНК (Villeneuve and Hillers, 2001).Эти соединения в конечном итоге разрешаются в события CO посредством неизвестной dHJ резольвазы у растений, хотя структурно-специфические эндонуклеазы GEN1 / Yen1 и SLX4 выполняют эту функцию у животных (Svendsen and Harper, 2010). SPO11 генерирует избыток DSB по сравнению с количеством наблюдаемых событий CO. Остальные DSB репарируются посредством генной конверсии (также известной как непересекающийся, NCO) путем, который не включает обмен фланкирующими генетическими маркерами (Villeneuve and Hillers, 2001).Зависящий от синтеза путь отжига цепи, по-видимому, является основным механизмом образования NCO у Saccharomyces cerevisiae , который действует независимо от образования dHJ (McMahill et al. , 2007). В S . cerevisiae решение о восстановлении сайтов DSB как событий CO или NCO принимается на ранней стадии профазы-I, до образования dHJ, поэтому маловероятно, что выбор CO / NCO представляет собой альтернативный процессинг dHJs (Allers and Lichten, 2001; Borner et al.
Вслед за инвазией цепи необходим ряд событий для образования dHJ, включая захват второго конца и синтез и лигирование ДНК (Villeneuve and Hillers, 2001).Эти соединения в конечном итоге разрешаются в события CO посредством неизвестной dHJ резольвазы у растений, хотя структурно-специфические эндонуклеазы GEN1 / Yen1 и SLX4 выполняют эту функцию у животных (Svendsen and Harper, 2010). SPO11 генерирует избыток DSB по сравнению с количеством наблюдаемых событий CO. Остальные DSB репарируются посредством генной конверсии (также известной как непересекающийся, NCO) путем, который не включает обмен фланкирующими генетическими маркерами (Villeneuve and Hillers, 2001).Зависящий от синтеза путь отжига цепи, по-видимому, является основным механизмом образования NCO у Saccharomyces cerevisiae , который действует независимо от образования dHJ (McMahill et al. , 2007). В S . cerevisiae решение о восстановлении сайтов DSB как событий CO или NCO принимается на ранней стадии профазы-I, до образования dHJ, поэтому маловероятно, что выбор CO / NCO представляет собой альтернативный процессинг dHJs (Allers and Lichten, 2001; Borner et al.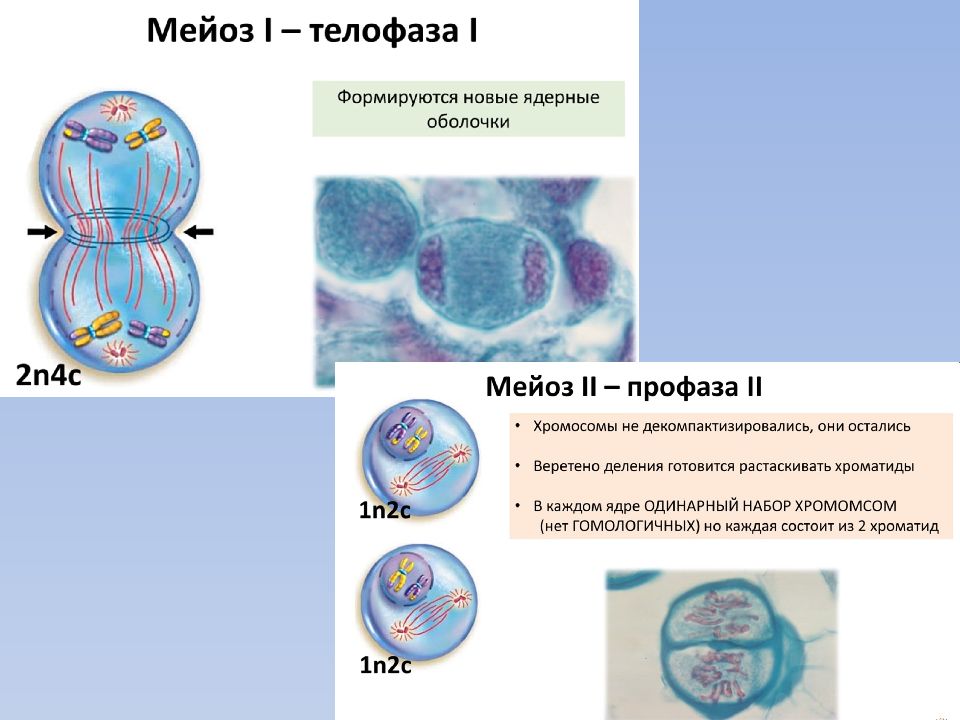 , 2004).
, 2004).
Контроль частоты кроссовера мейоза
На положение CO могут влиять другие CO на той же хромосоме посредством явления, известного как интерференция. При интерференции одно событие подавляет формирование соседних событий зависимым от расстояния способом, что означает, что они более широко распределены, чем ожидалось случайным образом (Sturtevant, 1915; Muller, 1916; Copenhaver et al. , 2002). Однако также встречаются не мешающие СО, которые имеют случайное распределение (Copenhaver et al., 2002). В А . thaliana Мешающие СО класса I составляют большинство (~ 75–85%), а не мешающие СО класса II меньшинство (~ 15-25%) (Copenhaver et al. , 2002; Higgins et al. , 2004; Мерсье и др. , 2005; Берховиц и др. , 2007; Хиггинс и др. , 2008, и ). CO класса I в A . thaliana требует набора генов, включая MSh5 , MSH5 , MLh4 , MER3 / ROCK-N-ROLLERS , PARTING DANCERS , ZIP4 / SPO22 , RPA и Higgins et al.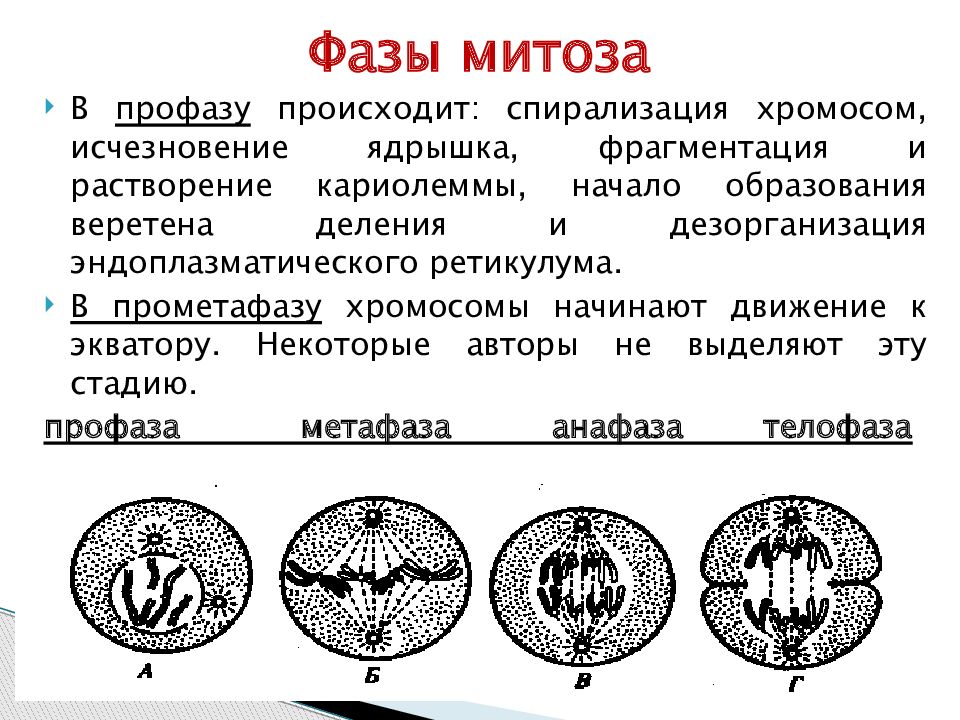 , 2004, 2008 b ; Чен и др. , 2005; Mercier et al. , 2005; Джексон и др. , 2006; Wijeratne et al. , 2006; Челышева и др. , 2007; Macaisne et al. , 2008; Осман и др. , 2009). Нокаут этих генов приводит к резкому снижению частоты CO, а оставшиеся события распределяются случайным образом. Происхождение мейотических белков в репарации прокариотической ДНК снова очевидно, поскольку белки MSh5 и MSH5 родственны бактериальным белкам репарации несоответствия MutS (Villeneuve and Hillers, 2001; Cavalier-Smith, 2002).Неинтерферирующие СО класса II требуют наличия гена MUS81 , который кодирует белок, подобный структурно-специфическим эндонуклеазам (Berchowitz et al. , 2007; Higgins et al. , 2008 a ).
, 2004, 2008 b ; Чен и др. , 2005; Mercier et al. , 2005; Джексон и др. , 2006; Wijeratne et al. , 2006; Челышева и др. , 2007; Macaisne et al. , 2008; Осман и др. , 2009). Нокаут этих генов приводит к резкому снижению частоты CO, а оставшиеся события распределяются случайным образом. Происхождение мейотических белков в репарации прокариотической ДНК снова очевидно, поскольку белки MSh5 и MSH5 родственны бактериальным белкам репарации несоответствия MutS (Villeneuve and Hillers, 2001; Cavalier-Smith, 2002).Неинтерферирующие СО класса II требуют наличия гена MUS81 , который кодирует белок, подобный структурно-специфическим эндонуклеазам (Berchowitz et al. , 2007; Higgins et al. , 2008 a ).
Парные хромосомы обычно показывают по крайней мере одно событие CO, облигатное CO, которое требуется для правильных паттернов хромосомной сегрегации в A . thaliana (Grelon et al. , 2001). Каждые A . thaliana хромосома показывает приблизительно 1.8 CO пермейоз и очень небольшое количество хромосом не показывают CO (Copenhaver et al. , 1998, 2002; Higgins et al. , 2004; Drouaud et al. , 2006, 2007). Положение CO сильно варьируется, а горячие и холодные точки частоты CO существуют вдоль хромосом (Copenhaver et al. , 1998, 1999; Drouaud et al. , 2006, 2007). Выраженное увеличение частоты CO и плотности генов наблюдается в направлении теломер хромосом пшеницы и кукурузы (Liu et al., 2009 г .; Saintenac et al. , 2009 г .; Schnable et al. , 2009). Горячая точка рекомбинации в локусе кукурузы Bronze ( Bz ) находится в богатой генами области, близкой к теломере. Эта область показывает в 40–80 раз более высокие уровни CO, чем в среднем по геному, и окружена большими участками вставок вложенных ретротранспозонов, которые нечасто перекрещиваются (Dooner and Martinez-Ferez, 1997; Fu et al.
, 2001). Каждые A . thaliana хромосома показывает приблизительно 1.8 CO пермейоз и очень небольшое количество хромосом не показывают CO (Copenhaver et al. , 1998, 2002; Higgins et al. , 2004; Drouaud et al. , 2006, 2007). Положение CO сильно варьируется, а горячие и холодные точки частоты CO существуют вдоль хромосом (Copenhaver et al. , 1998, 1999; Drouaud et al. , 2006, 2007). Выраженное увеличение частоты CO и плотности генов наблюдается в направлении теломер хромосом пшеницы и кукурузы (Liu et al., 2009 г .; Saintenac et al. , 2009 г .; Schnable et al. , 2009). Горячая точка рекомбинации в локусе кукурузы Bronze ( Bz ) находится в богатой генами области, близкой к теломере. Эта область показывает в 40–80 раз более высокие уровни CO, чем в среднем по геному, и окружена большими участками вставок вложенных ретротранспозонов, которые нечасто перекрещиваются (Dooner and Martinez-Ferez, 1997; Fu et al. , 2001, 2002). Повторяющиеся области, фланкирующие центромеры, также подавлены для CO, а события, проксимальные центромеры, ассоциируются с неправильной сегрегацией хромосом (Koehler et al., 1996; Lamb et al. , 1997; Дэн и Линь, 2002; Rockmill и др. , 2006).
, 2001, 2002). Повторяющиеся области, фланкирующие центромеры, также подавлены для CO, а события, проксимальные центромеры, ассоциируются с неправильной сегрегацией хромосом (Koehler et al., 1996; Lamb et al. , 1997; Дэн и Линь, 2002; Rockmill и др. , 2006).
Различия в частоте кроссовера можно объяснить эпигенетической информацией. Например в мышке и S . cerevisiae h4 Триметилирование K4 маркирует горячие точки DSB, и нарушение этой модификации снижает DSB (Borde et al. , 2009; Buard et al. , 2009). И наоборот, в A . thaliana CO-холодные повторяющиеся последовательности, фланкирующие центромеру, транскрипционно подавляются с использованием эпигенетической информации, включая метилирование цитозина ДНК и целевое метилирование ДНК в Ascobolous immersus достаточно для подавления частоты CO в несколько сотен раз (Maloisel and Rossignol, 1998; Zhang et al. al., 2006; Зильберман и др.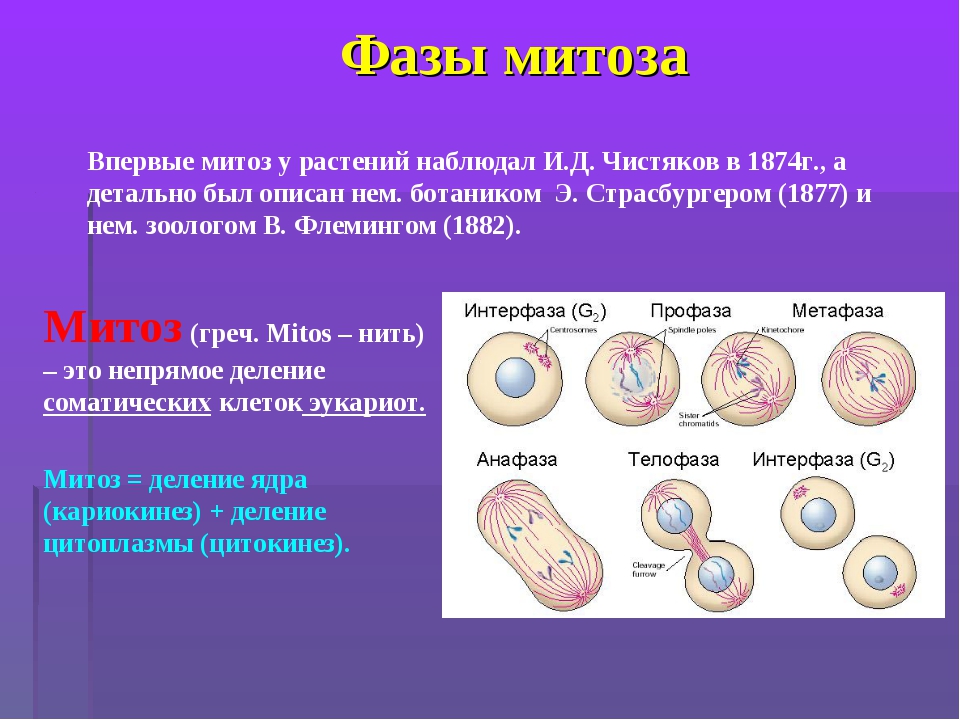 , 2007). Повторяющиеся вставки и инверсии также могут локально подавлять CO и играть важную функциональную роль в организации генома (Dooner, 1986; Nacry et al. , 1998). Это проиллюстрировано подавлением CO в половых хромосомах, локусах типа спаривания и локусах самонесовместимости, где важно поддерживать связь между генами, необходимую для противоположных типов спаривания / несовместимости (Ferris and G динаф, 1994; Casselman et al. , 2000; Мин и Мур, 2007; Бергеро и Чарльзуорт, 2009).Следовательно, частота CO, вероятно, будет определяться комбинацией локальной последовательности ДНК, транс -факторов и эпигенетической информации.
, 2007). Повторяющиеся вставки и инверсии также могут локально подавлять CO и играть важную функциональную роль в организации генома (Dooner, 1986; Nacry et al. , 1998). Это проиллюстрировано подавлением CO в половых хромосомах, локусах типа спаривания и локусах самонесовместимости, где важно поддерживать связь между генами, необходимую для противоположных типов спаривания / несовместимости (Ferris and G динаф, 1994; Casselman et al. , 2000; Мин и Мур, 2007; Бергеро и Чарльзуорт, 2009).Следовательно, частота CO, вероятно, будет определяться комбинацией локальной последовательности ДНК, транс -факторов и эпигенетической информации.
Контроль развития мейотического клеточного цикла
Мейоз требует модификации контроля митотического клеточного цикла, так что за одной S-фазой следуют два последовательных цикла хромосомной сегрегации. Прогрессирование по клеточному циклу контролируется циклинами, которые взаимодействуют с циклин-зависимыми киназами (CDK) и активируют их, которые опосредуют ступенчатые переходы по циклу посредством фосфорилирования (Huntley and Murray, 1999). Несколько генов, участвующих в регуляции мейотической прогрессии, были идентифицированы в A . Талиана . Новый циклиноподобный ген SOLO DANCERS ( SDS ) специфически экспрессируется во время мейоза, а мутанты sds обнаруживают дефекты в спаривании хромосом, сегрегации и CO (Azumi et al. , 2002). Недавно было обнаружено, что мутанты sds образуют DSB, но эффективно восстанавливают их, скорее всего, посредством RAD51-опосредованной межсестринской репарации (De Muyt et al., 2009). Новый ген ОТСУТСТВИЕ ВТОРОГО ДЕЛЕНИЯ1 ( OSD1 ) необходим для мейоза-II, а osd1 продуцирует диплоидные диадные продукты мейоза вместо гаплоидных тетрад (d’Erfurth et al. , 2009). Чувствительный к температуре аллель замены CYCLINA1; 2 , названный поздним асинхронным мейозом1 ( tam1 ), вызывает задержку мейотической прогрессии, что также приводит к образованию диад (Magnard et al.
Несколько генов, участвующих в регуляции мейотической прогрессии, были идентифицированы в A . Талиана . Новый циклиноподобный ген SOLO DANCERS ( SDS ) специфически экспрессируется во время мейоза, а мутанты sds обнаруживают дефекты в спаривании хромосом, сегрегации и CO (Azumi et al. , 2002). Недавно было обнаружено, что мутанты sds образуют DSB, но эффективно восстанавливают их, скорее всего, посредством RAD51-опосредованной межсестринской репарации (De Muyt et al., 2009). Новый ген ОТСУТСТВИЕ ВТОРОГО ДЕЛЕНИЯ1 ( OSD1 ) необходим для мейоза-II, а osd1 продуцирует диплоидные диадные продукты мейоза вместо гаплоидных тетрад (d’Erfurth et al. , 2009). Чувствительный к температуре аллель замены CYCLINA1; 2 , названный поздним асинхронным мейозом1 ( tam1 ), вызывает задержку мейотической прогрессии, что также приводит к образованию диад (Magnard et al.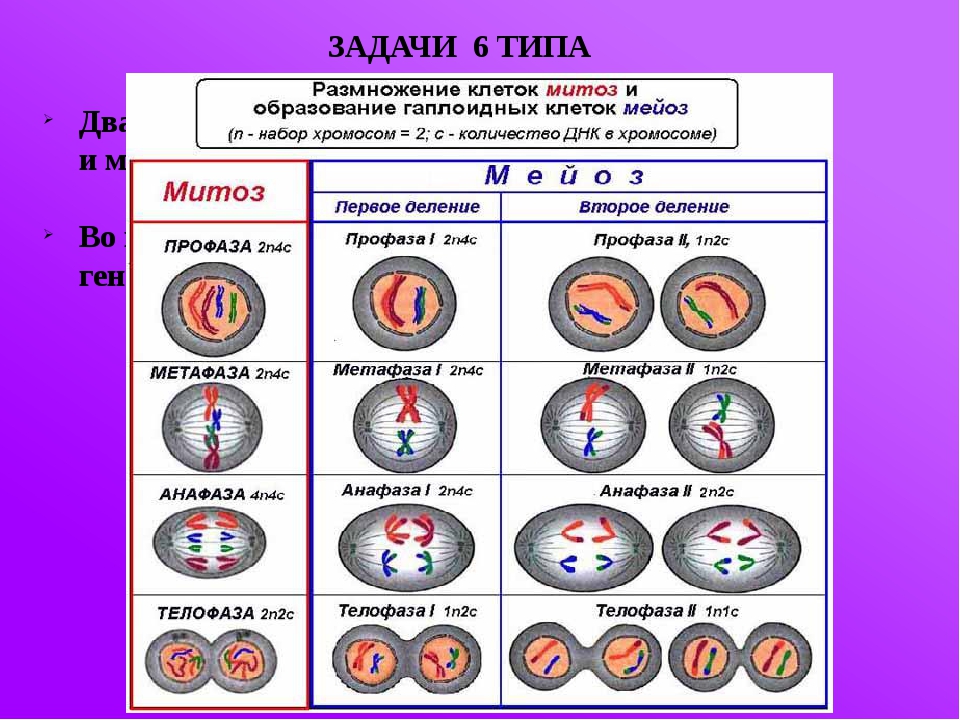 , 2001; Wang et al. al., 2004). Регуляция стабильности белков имеет решающее значение для контроля клеточного цикла, и SKP1-подобные F-бокс-белки действуют, способствуя убиквитинизации и разрушению белков-мишеней, включая циклины (Bai et al. , 1996). Соответственно, мутации в гене , родственном SKP1 ASK1 , обнаруживают дефекты сегрегации мейотических хромосом (Yang et al. , 1999, a ; Zhao et al. , 2006). У животных контрольные точки клеточного цикла заставляют более поздние события зависеть от завершения более ранних событий (Murakami and Nurse, 1999).Механизмы контрольных точек мейоза не были генетически определены в A . thaliana , хотя msh5 и asy1 обнаруживают значительную задержку мейоза, предполагая обратную связь по регуляции мейотической прогрессии (Higgins et al. , 2004; Sanchez-Moran et al. , 2007). Вместе эти результаты демонстрируют, что дефекты развития клеточного цикла могут нарушать мейоз.
, 2001; Wang et al. al., 2004). Регуляция стабильности белков имеет решающее значение для контроля клеточного цикла, и SKP1-подобные F-бокс-белки действуют, способствуя убиквитинизации и разрушению белков-мишеней, включая циклины (Bai et al. , 1996). Соответственно, мутации в гене , родственном SKP1 ASK1 , обнаруживают дефекты сегрегации мейотических хромосом (Yang et al. , 1999, a ; Zhao et al. , 2006). У животных контрольные точки клеточного цикла заставляют более поздние события зависеть от завершения более ранних событий (Murakami and Nurse, 1999).Механизмы контрольных точек мейоза не были генетически определены в A . thaliana , хотя msh5 и asy1 обнаруживают значительную задержку мейоза, предполагая обратную связь по регуляции мейотической прогрессии (Higgins et al. , 2004; Sanchez-Moran et al. , 2007). Вместе эти результаты демонстрируют, что дефекты развития клеточного цикла могут нарушать мейоз.
Ключевые ранние события в мейозе — это идентификация гомологичных хромосомных партнеров, спаривание и образование синаптонемного комплекса (SC) (Page and Hawley, 2004).Идентификация гомологичного партнера происходит по неизвестным механизмам во время профазы-I. У полиплоидных видов спаривание является сложным, поскольку гомологи также должны избегать спаривания с родственными гомеологами (Martinez-Perez et al. , 1999). Например, в гексаплоидной пшенице Ph2 влияет на строгость распознавания гомолога / гомеолога, влияя на ремоделирование хроматина, связанное со спариванием и локализацией SC-компонента ASY1 (Martinez-Perez et al. , 1999; Prieto et al., 2004, 2005; Boden et al. , 2009). Ph2 картируется в повторяющийся локус, содержащий гены киназ, зависимых от клеточного цикла, что вызывает подавление несвязанных генов CDK (Griffiths et al. , 2006; Al-Kaff et al. , 2008). Поскольку родственные гены CDK у млекопитающих влияют на мейотическую прогрессию, транс -замалчивание CDK с помощью Ph2 может приводить к изменениям в спаривании гомологов (Ortega et al.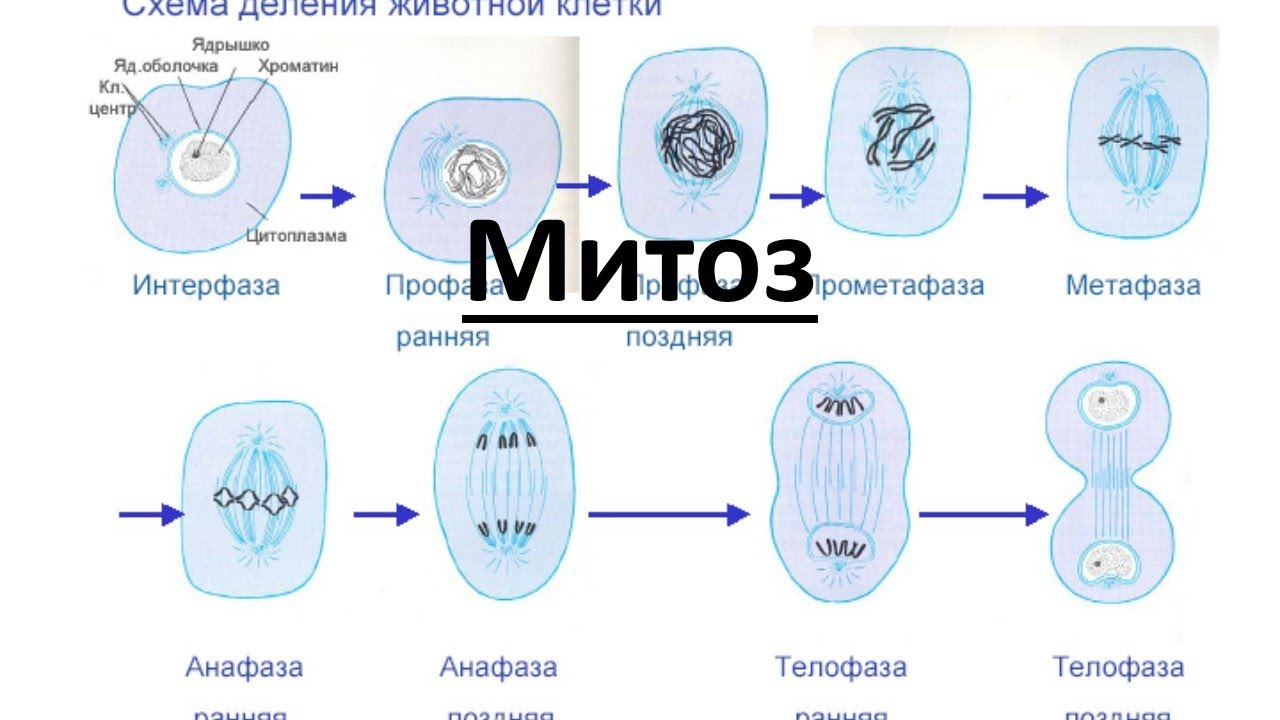 , 2003).Сопряжение может зависеть от формирования DSB, как в A . thaliana или может происходить через ахиазматические механизмы, как у самок Drosophila melanogaster (Grelon et al. , 2001; Page and Hawley, 2004). SWITCh2 / DYAD кодирует новый белок, экспрессируемый во время профазы-I, необходимый для спаривания хромосом, синапсиса и рекомбинации, а у мутантов swi1 / dyad униваленты сегрегируют в мейозе-I. Исследования гомолога кукурузы, AMEIOTIC1 , показывают, что эти функции сохраняются у покрытосеменных (Голубовская et al., 1993; Mercier et al. , 2001, 2003; Agashe et al. , 2002; Рави и др. , 2008; Pawlowski et al. , 2009). ПОЛНЫЙ ГОМОЛОГИЧЕСКИЙ СИНАПСИС1 кодирует второй новый белок, необходимый для спаривания хромосом и синапсиса, который вызывает высокие уровни негомологичного спаривания при мутации (Pawlowski et al. , 2004; Ronceret et al.
, 2003).Сопряжение может зависеть от формирования DSB, как в A . thaliana или может происходить через ахиазматические механизмы, как у самок Drosophila melanogaster (Grelon et al. , 2001; Page and Hawley, 2004). SWITCh2 / DYAD кодирует новый белок, экспрессируемый во время профазы-I, необходимый для спаривания хромосом, синапсиса и рекомбинации, а у мутантов swi1 / dyad униваленты сегрегируют в мейозе-I. Исследования гомолога кукурузы, AMEIOTIC1 , показывают, что эти функции сохраняются у покрытосеменных (Голубовская et al., 1993; Mercier et al. , 2001, 2003; Agashe et al. , 2002; Рави и др. , 2008; Pawlowski et al. , 2009). ПОЛНЫЙ ГОМОЛОГИЧЕСКИЙ СИНАПСИС1 кодирует второй новый белок, необходимый для спаривания хромосом и синапсиса, который вызывает высокие уровни негомологичного спаривания при мутации (Pawlowski et al. , 2004; Ronceret et al. , 2009).
, 2009).
Совпадая со спариванием, SC образуется между гомологичными хромосомами (Page and Hawley, 2004) и компонентами SC, идентифицированными в A . thaliana включает ASYNAPTIC1 ( ASY1 ), ZYP1A , ZYP1B , SCC3 и REC8 / DIF1 / SYN1 (Bai et al., и др., , 1999; Кэрил и др. , 2000; Армстронг и др. , 2002; Цай и др. , 2003; Челышева и др. , 2005; Хиггинс и др. , 2005). ASY1 и ZYP1 обнаруживают отдаленную идентичность с животными белками HOP1 и ZIP1 SC, соответственно (Caryl et al., 2000; Армстронг и др. , 2002; Higgins et al. , 2005). Потеря белков SC вызывает нарушения в синапсисе и образовании CO и может привести к одновалентной сегрегации и фрагментации хромосом (Bai et al. , 1999; Bhatt et al. , 1999; Caryl et al. , 2000; Armstrong и др., , 2002; Cai и др.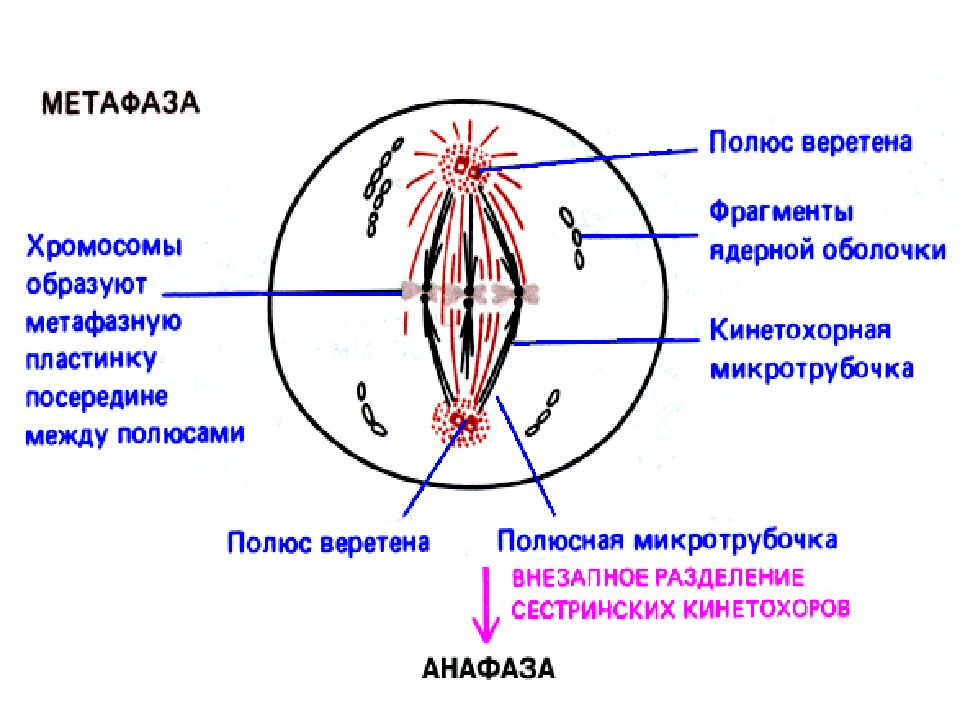 , , 2003; Челышева, и др., , 2005; Хиггинс, и др., , 2005). Интересно, что увеличение частоты CO связано с увеличением общей длины SC по неизвестному механизму (Lynn et al., 2002; Drouaud et al. , 2007). Эти генетические механизмы позволяют по-новому взглянуть на взаимосвязанные процессы распознавания гомологов, образования пар и синапсов у растений.
, , 2003; Челышева, и др., , 2005; Хиггинс, и др., , 2005). Интересно, что увеличение частоты CO связано с увеличением общей длины SC по неизвестному механизму (Lynn et al., 2002; Drouaud et al. , 2007). Эти генетические механизмы позволяют по-новому взглянуть на взаимосвязанные процессы распознавания гомологов, образования пар и синапсов у растений.
Правильные паттерны сегрегации хромосом необходимы для создания сбалансированных гамет и зависят от регуляции SC и сцепления хромосом. Во время митоза когезиновый комплекс удерживает сестринские хроматиды вместе до тех пор, пока субъединица SCC1 не будет расщеплена SEPERASE1 в анафазе, что обеспечит сегрегацию хромосом (Uhlmann et al., 1999). REC8 / DIF1 / SYN1 является специфичным для мейоза ортологом SCC1, а мутант rec8 / dif1 / syn1 нарушает нормальную SC локализацию SCC3 (субъединица когезина, общая с митозом) (Bhatt et al. , 1999; Cai et al. др. , 2003; Челышева и др.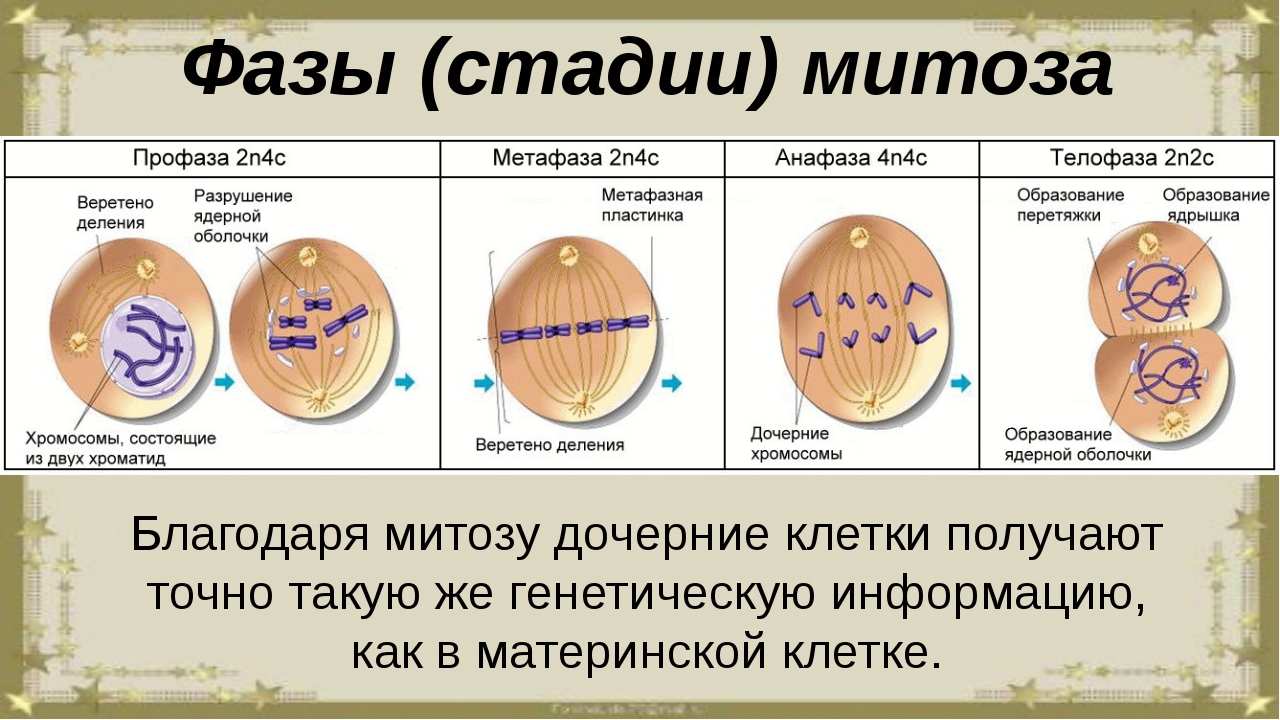 , 2005). Как и в системах животных, A . thaliana REC8 расщепляется цистеиновой протеазой SEPERASE1 (ESP1) (Liu and Makaroff, 2006). Сплоченность в плечах хромосом высвобождается с помощью ESP1 в анафазе-I, но сохраняется в центромерах до анафазы-II (Liu and Makaroff, 2006).У кукурузы центромера REC8 / AFD1 защищена от разрушения ESP1 консервативным белком Shugoshin (SGO1) во время анафазы-I (Hamant et al. , 2005; Watanabe, 2005). Затем SGO1 удаляется, а REC8 разрушается в центромере во время анафазы-II, что обеспечивает расщепление хроматид. Таким образом, для правильных паттернов сегрегации и рекомбинации мейотических хромосом необходимо поэтапное образование и удаление связей между гомологами.
, 2005). Как и в системах животных, A . thaliana REC8 расщепляется цистеиновой протеазой SEPERASE1 (ESP1) (Liu and Makaroff, 2006). Сплоченность в плечах хромосом высвобождается с помощью ESP1 в анафазе-I, но сохраняется в центромерах до анафазы-II (Liu and Makaroff, 2006).У кукурузы центромера REC8 / AFD1 защищена от разрушения ESP1 консервативным белком Shugoshin (SGO1) во время анафазы-I (Hamant et al. , 2005; Watanabe, 2005). Затем SGO1 удаляется, а REC8 разрушается в центромере во время анафазы-II, что обеспечивает расщепление хроматид. Таким образом, для правильных паттернов сегрегации и рекомбинации мейотических хромосом необходимо поэтапное образование и удаление связей между гомологами.
Контекст развития мейоза
Успешное завершение мейозного и полового жизненных циклов зависит от активации мейотического клеточного цикла в правильное время и место развития.У многих животных отделение выделенной линии зародышевых клеток от типов соматических клеток происходит во время эмбриогенеза, различие, не наблюдаемое в некоторых ранних расходящихся линиях животных и растений (Gilbert, 1994; Dickinson and Grant-Dadowon, 2009).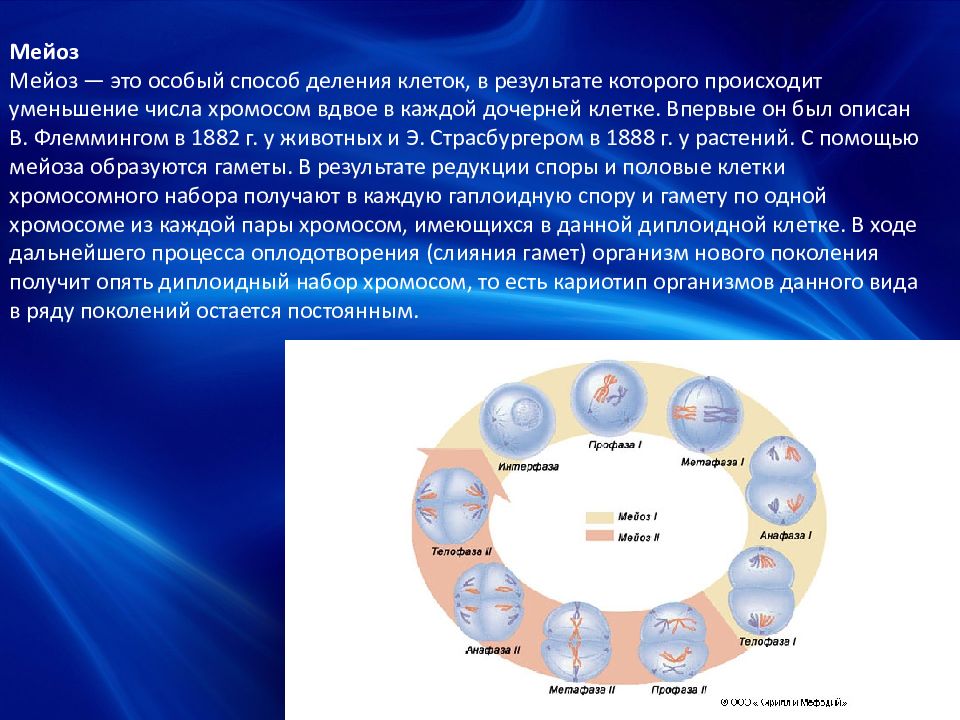 В сестринских группах водорослей для высадки растений одноклеточные зиготы претерпевают мейоз сразу после оплодотворения (рис. 2А). Напротив, у всех наземных растений митотические подразделения предшествуют оплодотворению и мейозу, а мейоз происходит после периода диплоидного развития в специализированных структурах, называемых спорангиями, которые продуцируют многочисленные споры (Bower, 1935; Becker and Marin, 2009).Инициирование путей развития спорангиев часто следует за переключением идентичности меристемы с вегетативной на репродуктивную судьбу (Steeves and Sussex, 1989). Расположение и структура спорангиев варьируются в зависимости от группы растений и связаны с их вторичными функциями, а именно с распространением спор и питанием. Гетероморфные спорангии и споры эволюционировали в сосудистых растениях конвергентно и ассоциировали со специализированными функциями (рис. 2). Женские мегаспорангии имеют меньшее количество более крупных спор (мегаспор), которые могут оставаться внутри родительского растения после оплодотворения, тогда как мужские микроспорангии образуют множество мелких спор (микроспор), которые выполняют функцию рассеивания (Bower, 1935).
В сестринских группах водорослей для высадки растений одноклеточные зиготы претерпевают мейоз сразу после оплодотворения (рис. 2А). Напротив, у всех наземных растений митотические подразделения предшествуют оплодотворению и мейозу, а мейоз происходит после периода диплоидного развития в специализированных структурах, называемых спорангиями, которые продуцируют многочисленные споры (Bower, 1935; Becker and Marin, 2009).Инициирование путей развития спорангиев часто следует за переключением идентичности меристемы с вегетативной на репродуктивную судьбу (Steeves and Sussex, 1989). Расположение и структура спорангиев варьируются в зависимости от группы растений и связаны с их вторичными функциями, а именно с распространением спор и питанием. Гетероморфные спорангии и споры эволюционировали в сосудистых растениях конвергентно и ассоциировали со специализированными функциями (рис. 2). Женские мегаспорангии имеют меньшее количество более крупных спор (мегаспор), которые могут оставаться внутри родительского растения после оплодотворения, тогда как мужские микроспорангии образуют множество мелких спор (микроспор), которые выполняют функцию рассеивания (Bower, 1935).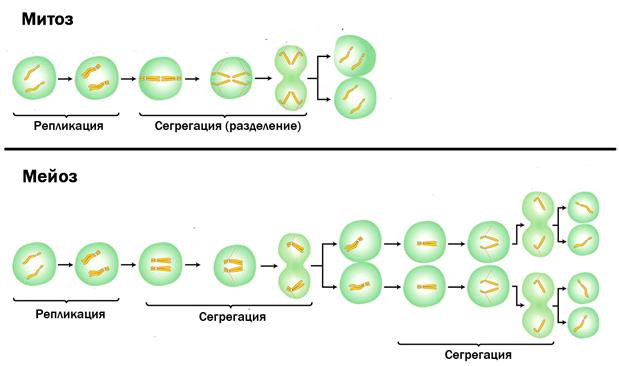 Пол также может влиять на частоту CO (Drouaud et al. , 2007). Таким образом, инициация и прогрессирование мейоза зависят от особенностей развития ткани, в которой он активируется, что обсуждается группой растений ниже.
Пол также может влиять на частоту CO (Drouaud et al. , 2007). Таким образом, инициация и прогрессирование мейоза зависят от особенностей развития ткани, в которой он активируется, что обсуждается группой растений ниже.
Рис. 2.
Филогенетическое распределение признаков, связанных с мейозом у растений. (A) Филогенетические отношения между основными группами растений, показывающими синапоморфии, связанные с мейозом. Гетероспоры имеют полифилетическое происхождение у ликофитов, монилофитов и сперматофитов, обозначенных звездочками.(B) Репродуктивные структуры представителей клад, показанных на (A), и вымершие ископаемые формы протрахеофитов. 1. Электронная микрофотография зигоспор Chlamydomonas monoica (фотография любезно предоставлена профессором Карен П. Ван Винкль-Свифт и с любезного разрешения John Wiley and Sons: см. VanWinkle-Swift KP, Rickoll WL. 1997. Зигоспорная стенка Chlamydomonas monoica (Chlorophyceae): морфогенез и доказательства присутствия спорополленина 1.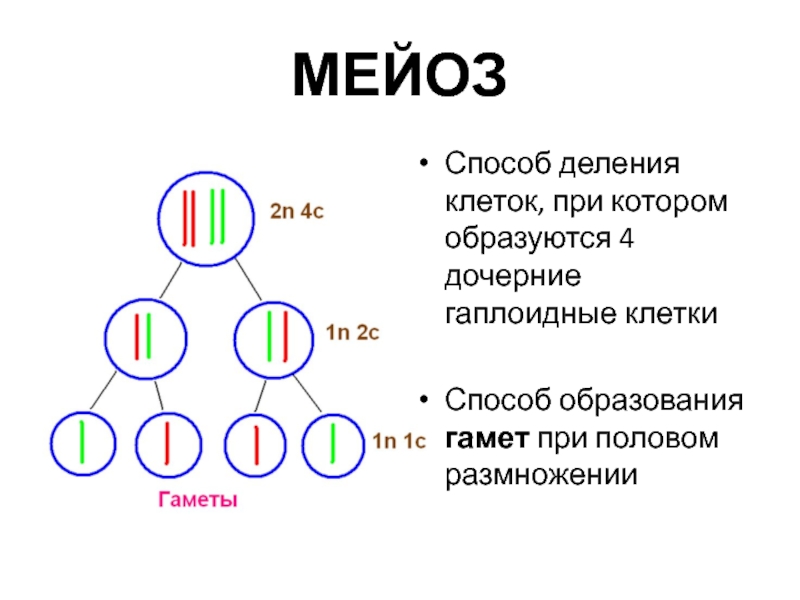 Journal of Phycology 33, 655–665.) 2. Световая микрофотография гаплоидного растения и оогониума (вставка) у харофитной водоросли Chara sp. 3. Ползучий гаплоидный слоевище и диплоидный прямостоячий и детерминированный спорофит Pellia epiphylla (фотографии мохообразных любезно предоставлены Ли Чжан). 4. Гаплоидный листовой гаметофит Atrichum angustatum , несущий диплоидные неразветвленные детерминантные спорофиты. 5. Гаплоидное стелющееся слоевище Folioceros sp. с прямостоячими индетерминантными спорофитами. 6.Ископаемое спорофтье Cooksonia sp. показывает ветвление с терминальными спорангиями (фото любезно предоставлено Дженни Моррис и Дайан Эдвардс). 7. Ископаемый спорофит Zosterophyllum с боковыми спорангиями (фото любезно предоставлено Дженни Моррис и Дайан Эдвардс). 8. Спорофит Selaginella kraussiana , демонстрирующий вегетативное ветвление, неразветвленный репродуктивный стробил, а также мега- и микроспорангий (вставка).
Journal of Phycology 33, 655–665.) 2. Световая микрофотография гаплоидного растения и оогониума (вставка) у харофитной водоросли Chara sp. 3. Ползучий гаплоидный слоевище и диплоидный прямостоячий и детерминированный спорофит Pellia epiphylla (фотографии мохообразных любезно предоставлены Ли Чжан). 4. Гаплоидный листовой гаметофит Atrichum angustatum , несущий диплоидные неразветвленные детерминантные спорофиты. 5. Гаплоидное стелющееся слоевище Folioceros sp. с прямостоячими индетерминантными спорофитами. 6.Ископаемое спорофтье Cooksonia sp. показывает ветвление с терминальными спорангиями (фото любезно предоставлено Дженни Моррис и Дайан Эдвардс). 7. Ископаемый спорофит Zosterophyllum с боковыми спорангиями (фото любезно предоставлено Дженни Моррис и Дайан Эдвардс). 8. Спорофит Selaginella kraussiana , демонстрирующий вегетативное ветвление, неразветвленный репродуктивный стробил, а также мега- и микроспорангий (вставка). 9. Спорангии образовались на стебле Psilotum nudum .10. Вайя Adiantum mairisi , показывающая краевые сори, содержащие спорангии. 11. Концевые конусы Cupressus sp. содержащие мега- и микроспорангии. 12. Тычинки и плодолистики растения Magnolia sp. цветок, содержащий соответственно микро- и мегаспорангии.
9. Спорангии образовались на стебле Psilotum nudum .10. Вайя Adiantum mairisi , показывающая краевые сори, содержащие спорангии. 11. Концевые конусы Cupressus sp. содержащие мега- и микроспорангии. 12. Тычинки и плодолистики растения Magnolia sp. цветок, содержащий соответственно микро- и мегаспорангии.
Рис. 2.
Филогенетическое распределение признаков, связанных с мейозом у растений. (A) Филогенетические отношения между основными группами растений, показывающими синапоморфии, связанные с мейозом.Гетероспоры имеют полифилетическое происхождение у ликофитов, монилофитов и сперматофитов, обозначенных звездочками. (B) Репродуктивные структуры представителей клад, показанных на (A), и вымершие ископаемые формы протрахеофитов. 1. Электронная микрофотография зигоспор Chlamydomonas monoica (фотография любезно предоставлена профессором Карен П. Ван Винкль-Свифт и с любезного разрешения John Wiley and Sons: см. VanWinkle-Swift KP, Rickoll WL. 1997. Зигоспорная стенка Chlamydomonas monoica (Chlorophyceae): морфогенез и доказательства присутствия спорополленина1.Journal of Phycology 33, 655–665.) 2. Световая микрофотография гаплоидного растения и оогониума (вставка) харофитной водоросли Chara sp. 3. Ползучий гаплоидный слоевище и диплоидный прямостоячий и детерминированный спорофит Pellia epiphylla (фотографии мохообразных любезно предоставлены Ли Чжан). 4. Гаплоидный листовой гаметофит Atrichum angustatum , несущий диплоидные неразветвленные детерминантные спорофиты. 5. Гаплоидное стелющееся слоевище Folioceros sp. с прямостоячими индетерминантными спорофитами.6. Ископаемое спорофтье Cooksonia sp. показывает ветвление с терминальными спорангиями (фото любезно предоставлено Дженни Моррис и Дайан Эдвардс). 7. Ископаемый спорофит Zosterophyllum с боковыми спорангиями (фото любезно предоставлено Дженни Моррис и Дайан Эдвардс). 8. Спорофит Selaginella kraussiana , демонстрирующий вегетативное ветвление, неразветвленный репродуктивный стробил, а также мега- и микроспорангий (вставка).
1997. Зигоспорная стенка Chlamydomonas monoica (Chlorophyceae): морфогенез и доказательства присутствия спорополленина1.Journal of Phycology 33, 655–665.) 2. Световая микрофотография гаплоидного растения и оогониума (вставка) харофитной водоросли Chara sp. 3. Ползучий гаплоидный слоевище и диплоидный прямостоячий и детерминированный спорофит Pellia epiphylla (фотографии мохообразных любезно предоставлены Ли Чжан). 4. Гаплоидный листовой гаметофит Atrichum angustatum , несущий диплоидные неразветвленные детерминантные спорофиты. 5. Гаплоидное стелющееся слоевище Folioceros sp. с прямостоячими индетерминантными спорофитами.6. Ископаемое спорофтье Cooksonia sp. показывает ветвление с терминальными спорангиями (фото любезно предоставлено Дженни Моррис и Дайан Эдвардс). 7. Ископаемый спорофит Zosterophyllum с боковыми спорангиями (фото любезно предоставлено Дженни Моррис и Дайан Эдвардс). 8. Спорофит Selaginella kraussiana , демонстрирующий вегетативное ветвление, неразветвленный репродуктивный стробил, а также мега- и микроспорангий (вставка). 9. Спорангии образовались на стебле Psilotum nudum .10. Вайя Adiantum mairisi , показывающая краевые сори, содержащие спорангии. 11. Концевые конусы Cupressus sp. содержащие мега- и микроспорангии. 12. Тычинки и плодолистики растения Magnolia sp. цветок, содержащий соответственно микро- и мегаспорангии.
9. Спорангии образовались на стебле Psilotum nudum .10. Вайя Adiantum mairisi , показывающая краевые сори, содержащие спорангии. 11. Концевые конусы Cupressus sp. содержащие мега- и микроспорангии. 12. Тычинки и плодолистики растения Magnolia sp. цветок, содержащий соответственно микро- и мегаспорангии.
Мейоз у хлорофитных и харофитных водорослей
В группах хлорофитов и харофитов, сестринских по отношению к наземным растениям водорослей, мейоз происходит сразу после оплодотворения (Becker and Marin, 2009).У одноклеточной хлорофитной водоросли Chlamydomonas reinhardtii два гаплоидных типа спаривания, плюс и минус , дифференцируются в гаметы, которые сливаются во время оплодотворения, образуя одноклеточную зиготу (рис. 2B) (Lee et al. , 2008). Идентичность гаметы плюс и минус определяется из локуса MATING-TYPE и требует накопления в цитоплазме белков гомеодомена классов BEL [GAMETE-SPECIFIC PLUS1 (GSP1)] и KNOX [GAMETE-SPECIFIC MINUS1 (GSM1)] соответственно (Феррис и Гуденаф, 1994; Ли и др.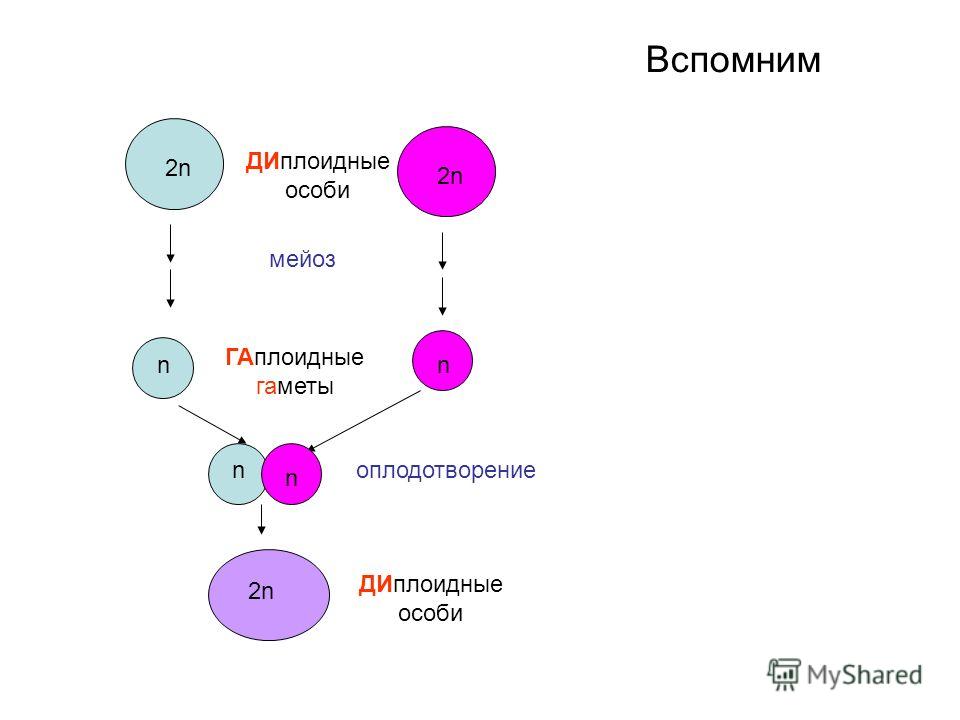 , 2008). После оплодотворения GSP1 и GSM1 гетеродимеризуются, перемещаются в ядро и инициируют паттерны экспрессии зиготических генов (Lee et al. , 2008). Конститутивной экспрессии либо GSP1 , либо GSM1 в противоположном типе гамет достаточно для запуска развития зигот в отсутствие оплодотворения (Zhao et al. , 2001; Lee et al. , 2008). Стабильный C . reinhardtii диплоиды, которые не инициируют мейоз, также могут образовываться, и конститутивной экспрессии GSP1 / GSM1 вместе в этих клетках достаточно для индукции мейоза с нормальными паттернами рекомбинации (Lee et al., 2008). Это указывает на то, что белки гомеодомена GSP1 / GSM1 являются потенциальными триггерами мейоза у хлорофитных водорослей. В отличие от хлорофитов, харофиты имеют многоклеточное гаплоидное тело, которое генерирует свободно плавающие сперматозоиды в антеридиях и яйцеклетках, которые сохраняются в оогониуме родительского растения (рис.
, 2008). После оплодотворения GSP1 и GSM1 гетеродимеризуются, перемещаются в ядро и инициируют паттерны экспрессии зиготических генов (Lee et al. , 2008). Конститутивной экспрессии либо GSP1 , либо GSM1 в противоположном типе гамет достаточно для запуска развития зигот в отсутствие оплодотворения (Zhao et al. , 2001; Lee et al. , 2008). Стабильный C . reinhardtii диплоиды, которые не инициируют мейоз, также могут образовываться, и конститутивной экспрессии GSP1 / GSM1 вместе в этих клетках достаточно для индукции мейоза с нормальными паттернами рекомбинации (Lee et al., 2008). Это указывает на то, что белки гомеодомена GSP1 / GSM1 являются потенциальными триггерами мейоза у хлорофитных водорослей. В отличие от хлорофитов, харофиты имеют многоклеточное гаплоидное тело, которое генерирует свободно плавающие сперматозоиды в антеридиях и яйцеклетках, которые сохраняются в оогониуме родительского растения (рис.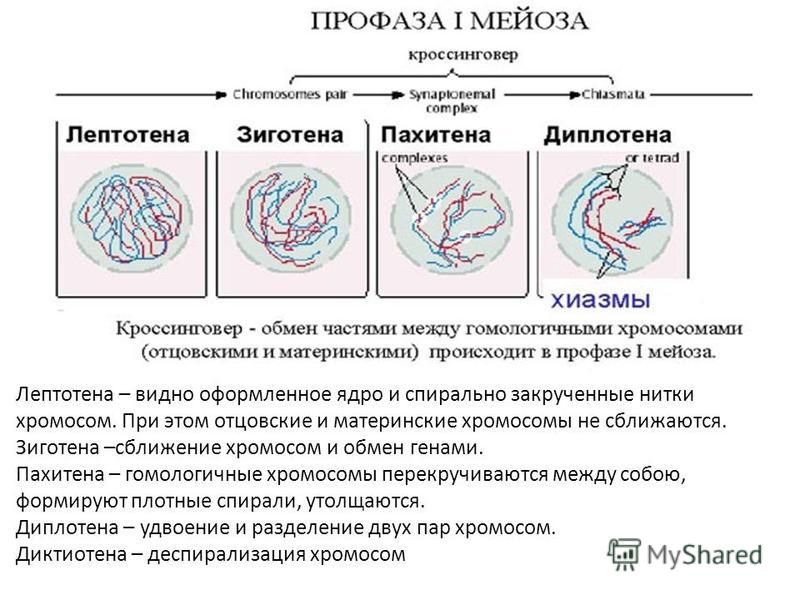 2B). Задержка яиц (оогамия) — это инновация, присущая наземным растениям, которая, как считается, была ключевой адаптацией в их эволюции (McCourt et al. , 2004). Поскольку в настоящее время нет генетических моделей харофитов, потенциальные роли генов KNOX / BEL не изучены, а инициация мейоза у харофитов происходит через неизвестный механизм.
2B). Задержка яиц (оогамия) — это инновация, присущая наземным растениям, которая, как считается, была ключевой адаптацией в их эволюции (McCourt et al. , 2004). Поскольку в настоящее время нет генетических моделей харофитов, потенциальные роли генов KNOX / BEL не изучены, а инициация мейоза у харофитов происходит через неизвестный механизм.
Развитие спорофитов и мейоз мохообразных
В отличие от своих собратьев по водорослям, все наземные растения имеют период многоклеточного диплоидного роста, степень которого варьируется в зависимости от группы растений (Lewis and McCourt, 2004; McCourt et al. , 2004; Becker and Marin, 2009). Сестринские группы мохообразных сосудистых растений демонстрируют ограниченное постэмбриональное развитие без неопределенного апикального роста (Mishler and Churchill, 1985; Shaw and Renzaglia, 2004; Donoghue, 2005).Спорофиты состоят из небольшого одиночного стебля с концевым спорангием, который представляет собой простейший базальный план тела наземного растения (Kenrick, 2002; Donoghue, 2005; Qiu et al.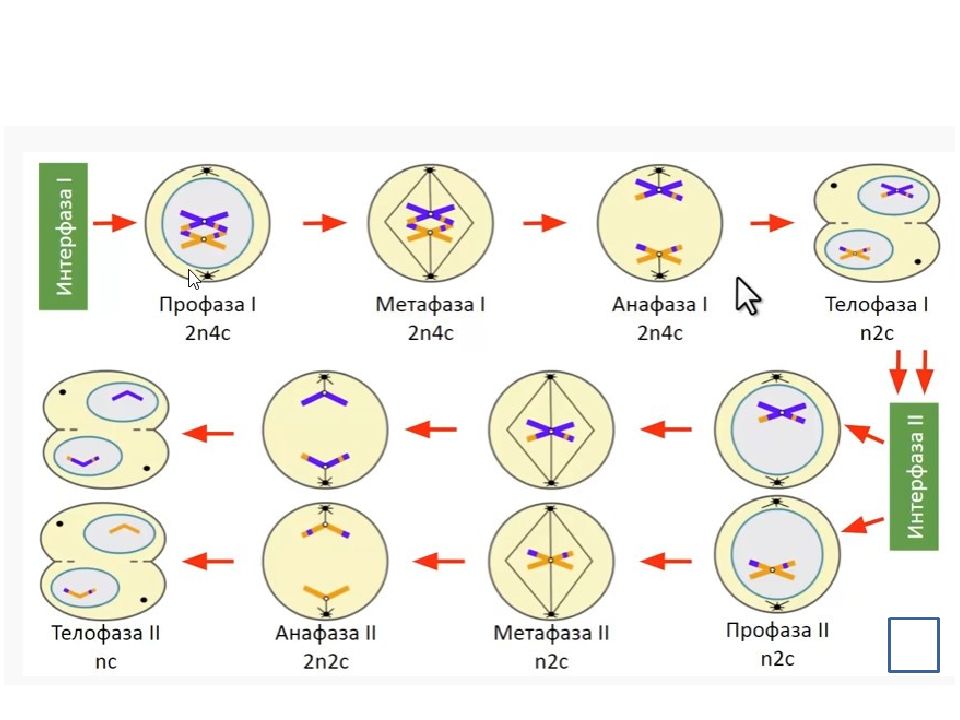 , 2006; Boyce, 2008) (рис. 2). У печеночников и мхов развитие спорангиев останавливает диплоидный рост, тогда как спорофиты роголистника вносят свой вклад в собственное питание и имеют спорангии, которые неопределенно растут из базальной меристемы (Boyce, 2008; Kato and Akiyama, 2005). Слой субэпидермальных арчеспориальных клеток определяется во время развития спорангиев и делится посредством мейоза с образованием спор (мхи) или споровых материнских клеток и вкраплений более высоких клеток, которые выполняют питательные или распределительные функции (печеночники и роголистники).Ткани, окружающие слой арчеспориальных клеток, выполняют распределительные функции, характерные для каждой группы мохообразных (Bower, 1935). Генетические механизмы и механизмы развития, которые регулируют развитие спорофитов мохообразных, в настоящее время плохо изучены, но в последнее время интерес усилился в связи с созданием моделей мха ( Physcomitrella patens ) и печеночника ( Marchantia polymorpha ) (Ishizaki et al.
, 2006; Boyce, 2008) (рис. 2). У печеночников и мхов развитие спорангиев останавливает диплоидный рост, тогда как спорофиты роголистника вносят свой вклад в собственное питание и имеют спорангии, которые неопределенно растут из базальной меристемы (Boyce, 2008; Kato and Akiyama, 2005). Слой субэпидермальных арчеспориальных клеток определяется во время развития спорангиев и делится посредством мейоза с образованием спор (мхи) или споровых материнских клеток и вкраплений более высоких клеток, которые выполняют питательные или распределительные функции (печеночники и роголистники).Ткани, окружающие слой арчеспориальных клеток, выполняют распределительные функции, характерные для каждой группы мохообразных (Bower, 1935). Генетические механизмы и механизмы развития, которые регулируют развитие спорофитов мохообразных, в настоящее время плохо изучены, но в последнее время интерес усилился в связи с созданием моделей мха ( Physcomitrella patens ) и печеночника ( Marchantia polymorpha ) (Ishizaki et al. , 2008). ; Ренсинг, 2008). Два класса генов, которые влияют на развитие спорангии в P . патента являются гомологами A . thaliana LEAFY ( LFY ) и KNOX гены (Champagne and Ashton, 2001; Tanahashi et al. , 2005; Sakakibara et al. , 2008). Пара гомологов LFY избыточно контролирует первое зиготическое деление в P . Patens и двойные мутанты обнаруживают задержку развития зигот (Tanahashi et al. , 2005). У мутантов, которые не арестовываются, нарушается количество, инициация и развитие спорангиев.Эти дефекты могут возникать как следствие аномального развития спорофитов, хотя количество спор и их прорастание также сильно варьируют у мутантов, что указывает на дефекты мейоза (Tanahashi et al. , 2005). Аналогично мутанты класса I KNOX в P . патента имеют аномальные спорангии и уменьшенное количество спор (Sano et al. , 2005; Sakakibara et al.
, 2008). ; Ренсинг, 2008). Два класса генов, которые влияют на развитие спорангии в P . патента являются гомологами A . thaliana LEAFY ( LFY ) и KNOX гены (Champagne and Ashton, 2001; Tanahashi et al. , 2005; Sakakibara et al. , 2008). Пара гомологов LFY избыточно контролирует первое зиготическое деление в P . Patens и двойные мутанты обнаруживают задержку развития зигот (Tanahashi et al. , 2005). У мутантов, которые не арестовываются, нарушается количество, инициация и развитие спорангиев.Эти дефекты могут возникать как следствие аномального развития спорофитов, хотя количество спор и их прорастание также сильно варьируют у мутантов, что указывает на дефекты мейоза (Tanahashi et al. , 2005). Аналогично мутанты класса I KNOX в P . патента имеют аномальные спорангии и уменьшенное количество спор (Sano et al. , 2005; Sakakibara et al. , 2008). Интересно, что экспрессия KNOX специфична для спорофитов в P . patens (Champagne and Ashton, 2001; Sakakibara et al. , 2008), и еще предстоит изучить потенциальную роль генов KNOX и BEL в развитии диплоидов между водорослями и мохообразными.
, 2008). Интересно, что экспрессия KNOX специфична для спорофитов в P . patens (Champagne and Ashton, 2001; Sakakibara et al. , 2008), и еще предстоит изучить потенциальную роль генов KNOX и BEL в развитии диплоидов между водорослями и мохообразными.
Протрахеофиты и сестринские группы семенных растений
Ключевые особенности, которые отличают сосудистые растения от мохообразных, — это формирование неопределенно растущего и ветвящегося диплоидного тела (Mishler and Churchill, 1985; Donoghue, 2005; Langdale and Harrison, 2008).Ископаемые растения, форма которых не представлена в живых растениях, такие как Cooksonia , имеют низкий порядок ветвления и могут иметь увеличенное количество спор за счет увеличения числа концевых спорангиев (рис. 2B) (Edwards and Feehan, 1980; Graham et al. , 2000; Донохью, 2005; Герриенн и др. , 2006). Эти окаменелости поднимают интересные вопросы о природе ассоциации между развитием оси, развитием спорангии и ветвлением, и, что любопытно, редкие ветвящиеся мутанты мохообразных поразительно напоминают спорофиты Cooksonia (рис. 2Б). Альтернативные латеральные положения спорангиев кажутся независимыми от ветвления и, возможно, служили той же цели в других группах окаменелостей (Рис. 2B). Такое расположение проявляется у современных ликофитов, и спорангии возникают либо у основания листьев, либо от стебля через один или два субэпидермальных слоя арчеспориальных клеток. Эти археспориальные клетки дают начало спорогенной ткани ( Lycopodium ) или спорогенным и тапетальным тканям ( Selaginella , Isoetes ) (Bower, 1935).Спорангии монилофитов разнообразны по размеру, количеству спор, образующихся на спорангий, а также их количеству и положению на растении (рис. 2В). Базальная разновидность монилофитов, включающая мараттиоидные папоротники, хвощи, офиоглоссоидные папоротники и венчиковые папоротники, обладают спорангиями, которые развиваются из нескольких клеток и производят тысячи спор (Bower, 1935; Wagner, 1977; Parkinson, 1987; Pryer et al. , 2004). ). Напротив, лептоспорангиатные папоротники развивают многочисленные маленькие спорангии из отдельных клеток, которые обычно содержат десятки спор (Bower, 1935; Pryer et al.
2Б). Альтернативные латеральные положения спорангиев кажутся независимыми от ветвления и, возможно, служили той же цели в других группах окаменелостей (Рис. 2B). Такое расположение проявляется у современных ликофитов, и спорангии возникают либо у основания листьев, либо от стебля через один или два субэпидермальных слоя арчеспориальных клеток. Эти археспориальные клетки дают начало спорогенной ткани ( Lycopodium ) или спорогенным и тапетальным тканям ( Selaginella , Isoetes ) (Bower, 1935).Спорангии монилофитов разнообразны по размеру, количеству спор, образующихся на спорангий, а также их количеству и положению на растении (рис. 2В). Базальная разновидность монилофитов, включающая мараттиоидные папоротники, хвощи, офиоглоссоидные папоротники и венчиковые папоротники, обладают спорангиями, которые развиваются из нескольких клеток и производят тысячи спор (Bower, 1935; Wagner, 1977; Parkinson, 1987; Pryer et al. , 2004). ). Напротив, лептоспорангиатные папоротники развивают многочисленные маленькие спорангии из отдельных клеток, которые обычно содержат десятки спор (Bower, 1935; Pryer et al.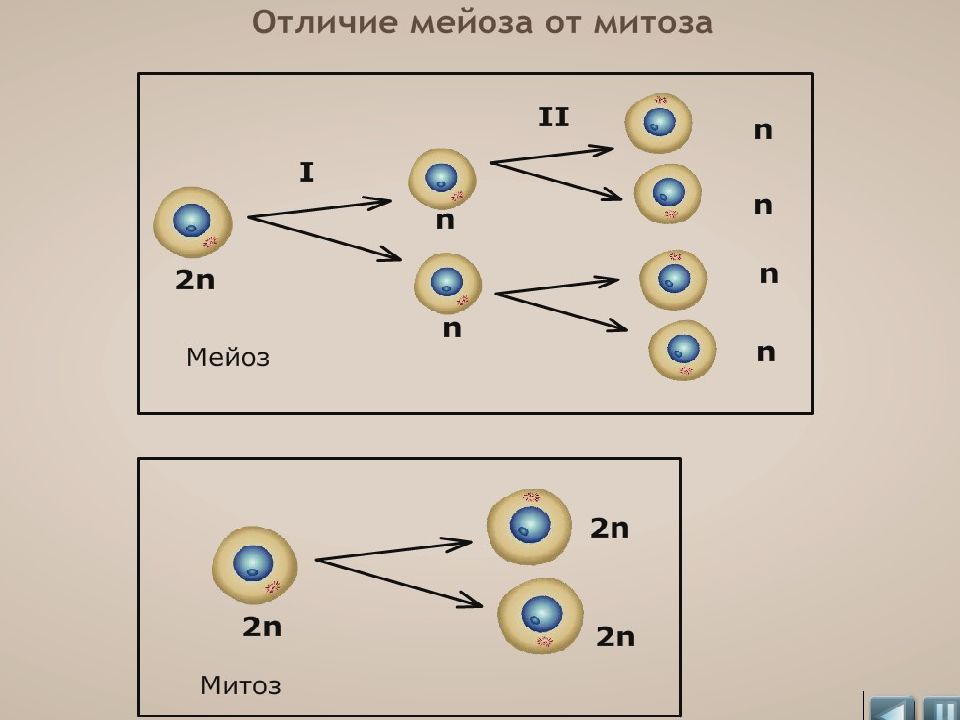 , 2004). Спорангии могут иметь терминальные, адаксиальные, абаксиальные или краевые участки на листьях (рис. 2В). За исключением лептоспорангиатных и венечных папоротников, питательные ткани тапетала возникают из неспорогенных тканей (Bower, 1935; Parkinson, 1987). Как и у мохообразных, генетическая основа диплоидного развития у ликофитов и монилофитов слабо охарактеризована. Примечательно, что экспрессия спорофитов KNOX является консервативной, а домены меристематической экспрессии предполагают вероятную роль в неопределенном росте (Bharathan et al., 2002; Харрисон и др. , 2005; Sano et al. , 2005), хотя репродуктивные роли еще не исследованы. Таким образом, структура и функции распространения спорангиев широко варьируются в зависимости от наземных растений, и контекст развития для инициации мейоза зависит от линии. Очевидна эволюционная тенденция к увеличению числа спор за счет изменений в плане тела, размере спорангиев и количестве спорангиев (Bower, 1935).
, 2004). Спорангии могут иметь терминальные, адаксиальные, абаксиальные или краевые участки на листьях (рис. 2В). За исключением лептоспорангиатных и венечных папоротников, питательные ткани тапетала возникают из неспорогенных тканей (Bower, 1935; Parkinson, 1987). Как и у мохообразных, генетическая основа диплоидного развития у ликофитов и монилофитов слабо охарактеризована. Примечательно, что экспрессия спорофитов KNOX является консервативной, а домены меристематической экспрессии предполагают вероятную роль в неопределенном росте (Bharathan et al., 2002; Харрисон и др. , 2005; Sano et al. , 2005), хотя репродуктивные роли еще не исследованы. Таким образом, структура и функции распространения спорангиев широко варьируются в зависимости от наземных растений, и контекст развития для инициации мейоза зависит от линии. Очевидна эволюционная тенденция к увеличению числа спор за счет изменений в плане тела, размере спорангиев и количестве спорангиев (Bower, 1935).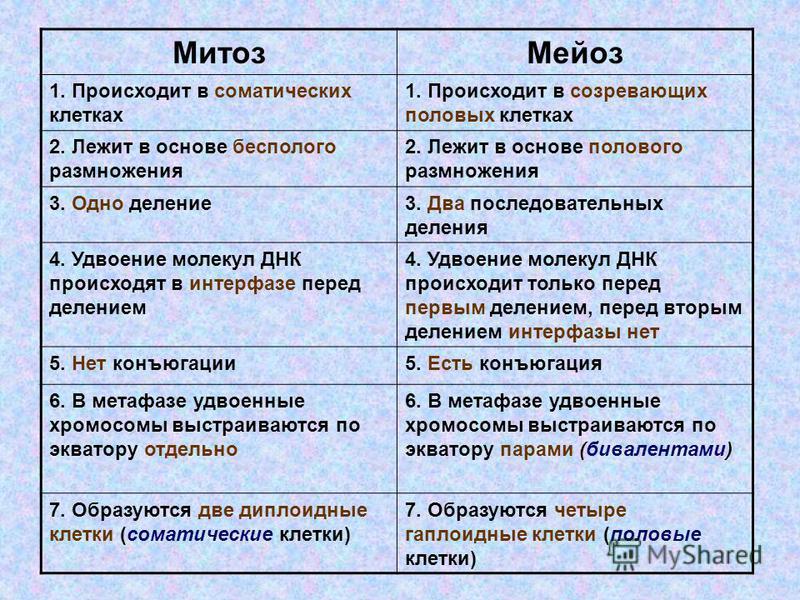
Развитие спорофитов семенных растений
У семенных растений (голосеменных и покрытосеменных) продолжительный период вегетативного роста сменяется репродуктивным переходом.Этот переход включает изменение идентичности меристемы и приводит к развитию шишек или цветков (Steeves and Sussex, 1989). Семена развиваются в контексте семяпочки после оплодотворения женской яйцеклетки мужским сперматозоидом, перенесенным в пыльцу, таким образом, функции распределения обеспечивают как гаплоидная пыльца, так и диплоидное семя. Семяпочки являются местом развития мегаспорангия (нуцеллуса), предшествующего мейозу. В то время как у голосеменных от одной до нескольких нуцеллярных клеток вступает в мейоз, у покрытосеменных одна материнская клетка мегаспоры подвергается мейозу с образованием тетрады, три члена которой дегенерируют с образованием единой функциональной мегаспоры, которая митотически делится с образованием зародышевого мешка (Campbell, 1940; Colombo et al.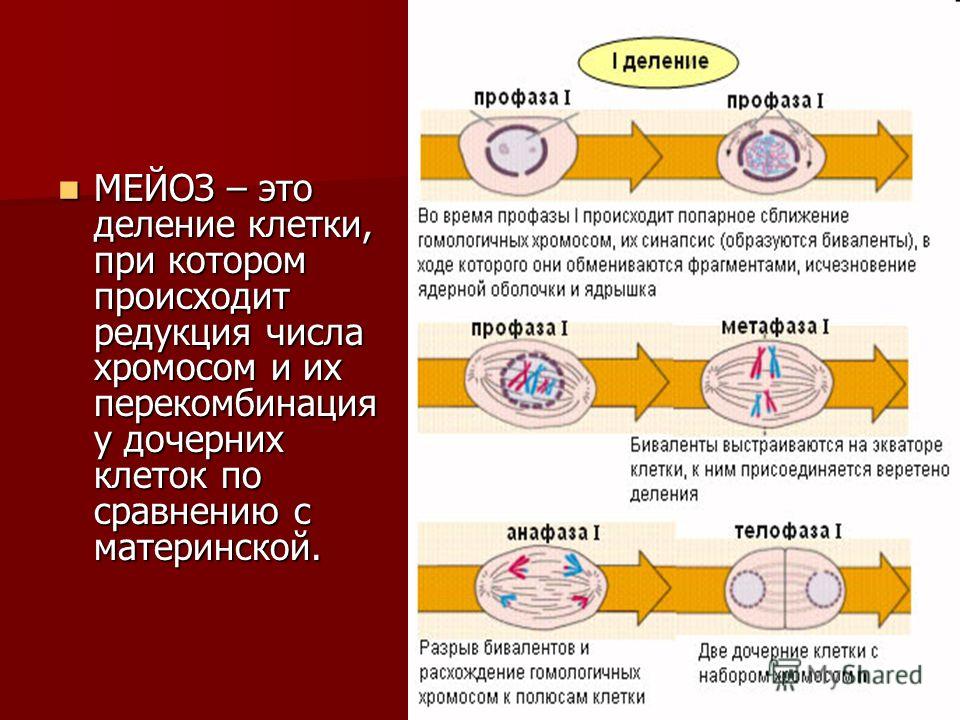 , 2008). Развитие пыльцевого мешка (микроспорангия) происходит из микроспорофилла или в пыльнике голосеменных и покрытосеменных растений соответственно. В обоих случаях субэпидермальные клетки определяются как археспориальные клетки, которые делятся периклинально с образованием слоя париетальных клеток, окружающих спорогенные клетки (Campbell, 1940; Feng and Dickinson, 2007). Затем спорогенные клетки могут либо напрямую проникать в мейоз, либо продолжать пролиферировать. Париетальные клетки далее делятся с образованием переменного числа концентрически расположенных клеточных слоев, самый внутренний из которых дифференцируется в питательный тапетум (Campbell, 1940; Feng and Dickinson, 2007).Во время мейоза спорогенные клетки заключаются в непроницаемую стенку каллозы ((1-3) -β-D-глюкана), которая позже разрушается, когда высвобождаются члены тетрад микроспор (Gifford and Foster, 1988). Каллоза, по-видимому, играет важную роль в спорогенезе, поскольку тапетальная экспрессия каллазы вызывает мужскую стерильность в табаке (Worrall et al.
, 2008). Развитие пыльцевого мешка (микроспорангия) происходит из микроспорофилла или в пыльнике голосеменных и покрытосеменных растений соответственно. В обоих случаях субэпидермальные клетки определяются как археспориальные клетки, которые делятся периклинально с образованием слоя париетальных клеток, окружающих спорогенные клетки (Campbell, 1940; Feng and Dickinson, 2007). Затем спорогенные клетки могут либо напрямую проникать в мейоз, либо продолжать пролиферировать. Париетальные клетки далее делятся с образованием переменного числа концентрически расположенных клеточных слоев, самый внутренний из которых дифференцируется в питательный тапетум (Campbell, 1940; Feng and Dickinson, 2007).Во время мейоза спорогенные клетки заключаются в непроницаемую стенку каллозы ((1-3) -β-D-глюкана), которая позже разрушается, когда высвобождаются члены тетрад микроспор (Gifford and Foster, 1988). Каллоза, по-видимому, играет важную роль в спорогенезе, поскольку тапетальная экспрессия каллазы вызывает мужскую стерильность в табаке (Worrall et al.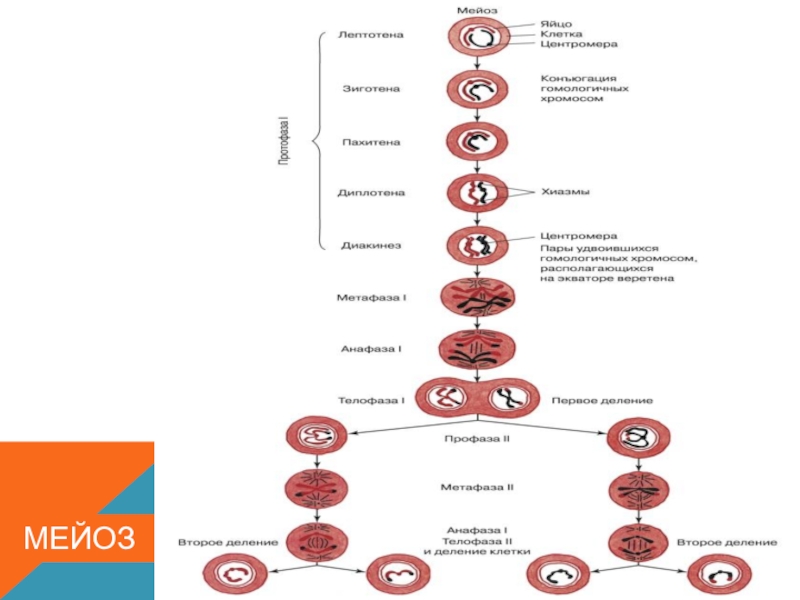 , 1992). После мейоза образующиеся гаплоидные микроспоры подвергаются митозу и дифференцируются в пыльцевые зерна.
, 1992). После мейоза образующиеся гаплоидные микроспоры подвергаются митозу и дифференцируются в пыльцевые зерна.
Генетический контроль вегетативного развития, репродуктивного перехода и образования спорангиев хорошо изучен у покрытосеменных A . Талиана . Активность класса I гена KNOX SHOOTMERISTEMLESS ( STM) необходима для установления неопределенной меристемы (Long et al. , 1996), а STM и BREVIPEDICELLUS ( BP) действуют избыточно, чтобы поддерживать неопределенность и подавлять детерминированное развитие листа (Byrne et al. , 2002). Белки KNOX класса I способствуют неопределенности путем димеризации с факторами транскрипции BEL и тройным bellringer , poundfoolish , Arabidopsis thaliana homeobox1 BEL мутантами phenocopy stm мутантами (Rutjens et al., 2009). Таким образом, в A . Гены thaliana KNOX и BEL играют ключевую роль в формировании диплоидного тела, обеспечивая контекст для более позднего репродуктивного развития и мейоза. Развитие цветков следует за превращением индетерминантных вегетативных меристем побегов в репродуктивные судьбы. Это переключение контролируется большой сетью генов, обеспечивающих координацию воспроизводства с условиями окружающей среды и развития (Baurle and Dean, 2006). Эти сигнальные пути сходятся на ключевом наборе факторов транскрипции, необходимых для идентичности меристемы цветков, включая LEAFY и APETALA1 (Baurle and Dean, 2006).Гены идентичности цветочных органов кодируют три функциональных класса факторов транскрипции MADS-бокса (A, B и C), которые экспрессируются в перекрывающихся доменах, чтобы определить четыре типа цветочных органов (Coen and Meyerowitz, 1991). Идентичность тычинок требует перекрывающейся экспрессии генов MADS классов B и C PISTILLATA и APETALA3 и AGAMOUS ( AG ) (Yanofsky et al. , 1990; Jack et al. , 1992; Goto и Мейеровиц, 1994). Идентичность Carpel требует активности гена C класса AG , который действует в сочетании с тремя дополнительными белками MADS, SEEDSTICK, SHATTERPROOF1 и SHATTERPROOF2 для определения идентичности яйцеклетки (Yanofsky et al.
Развитие цветков следует за превращением индетерминантных вегетативных меристем побегов в репродуктивные судьбы. Это переключение контролируется большой сетью генов, обеспечивающих координацию воспроизводства с условиями окружающей среды и развития (Baurle and Dean, 2006). Эти сигнальные пути сходятся на ключевом наборе факторов транскрипции, необходимых для идентичности меристемы цветков, включая LEAFY и APETALA1 (Baurle and Dean, 2006).Гены идентичности цветочных органов кодируют три функциональных класса факторов транскрипции MADS-бокса (A, B и C), которые экспрессируются в перекрывающихся доменах, чтобы определить четыре типа цветочных органов (Coen and Meyerowitz, 1991). Идентичность тычинок требует перекрывающейся экспрессии генов MADS классов B и C PISTILLATA и APETALA3 и AGAMOUS ( AG ) (Yanofsky et al. , 1990; Jack et al. , 1992; Goto и Мейеровиц, 1994). Идентичность Carpel требует активности гена C класса AG , который действует в сочетании с тремя дополнительными белками MADS, SEEDSTICK, SHATTERPROOF1 и SHATTERPROOF2 для определения идентичности яйцеклетки (Yanofsky et al.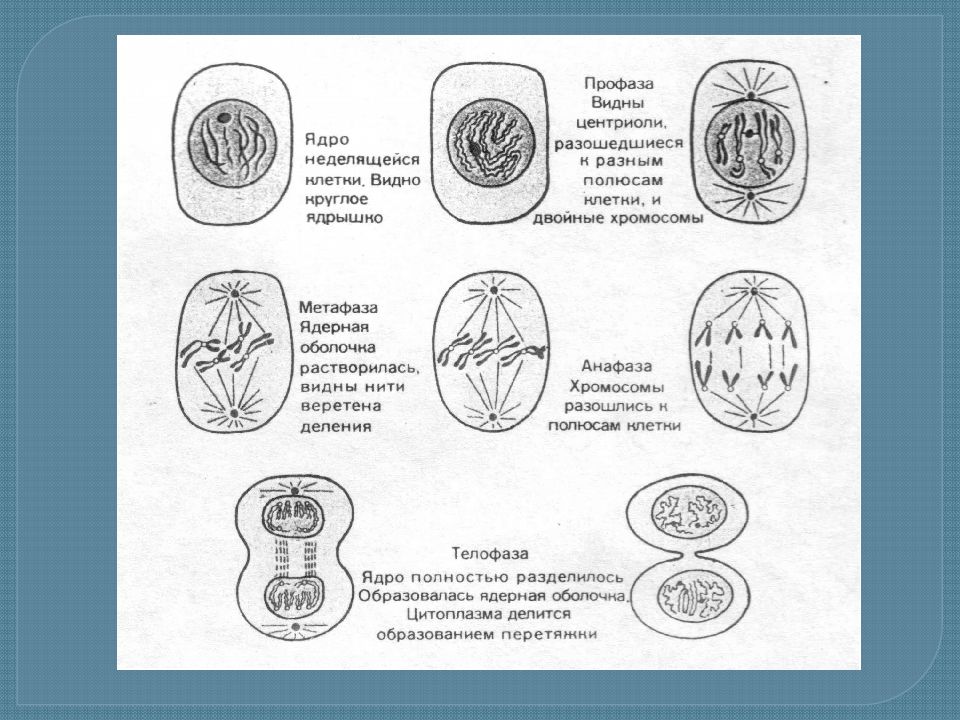 , 1990; Pinyopich et al. , 2003). Гены KNOX STM и KNAT2 и BEL1 гены также играют роль в спецификации идентичности плодолистиков и семяпочек (Modrusan et al. , 1994; Pautot et al. , 2001; Scofield ; Scofield и др., , 2007). Таким образом, гены, участвующие в идентичности меристемы, также играют роль в спецификации репродуктивной судьбы.
, 1990; Pinyopich et al. , 2003). Гены KNOX STM и KNAT2 и BEL1 гены также играют роль в спецификации идентичности плодолистиков и семяпочек (Modrusan et al. , 1994; Pautot et al. , 2001; Scofield ; Scofield и др., , 2007). Таким образом, гены, участвующие в идентичности меристемы, также играют роль в спецификации репродуктивной судьбы.
Как в микро-, так и в мегаспорангиях спецификация археспориальных клеток предшествует образованию спорангиев (Gifford and Foster, 1988).Механизмы спецификации арчеспориальных клеток плохо изучены, но один ген, SPOROCYTELESS / NOZZLE ( SPL / NZZ ), функционирует непосредственно после гена идентичности органа класса C AG , способствуя спорогенезу (Schiefthaler et al. ). , 1999; Ян и др. , 1999 b ; Ито и др. , 2004). SPL — это ядерный белок с отдаленной гомологией с факторами транскрипции MADS-бокса, который выполняет неизвестную функцию (Schiefthaler et al. , 1999; Ян и др. , 1999, b ). spl мутанты дифференцируют микроспорангиальные археспориальные клетки, которые делятся один раз, но не могут образовывать микроспороциты или тапетальные клетки, вызывая стерильность (Schiefthaler et al. , 1999; Yang et al. , 1999 b ). Мутанты spl / nzz также являются стерильными самками из-за дефектов нуцеллара, что означает, что археспориальные клетки не дифференцируются и мейоз не запускается (Schiefthaler et al., 1999; Ян и др. , 1999 б ). Эктопическая активация SPL у агамных мутантов достаточна для индукции развития стаминоидов и образования пыльцы (Ito et al. , 2004). Вместе это указывает на то, что SPL / NZZ выполняет вышестоящую мейотическую функцию как в мужском, так и женском развитии. Идентичность мужских спороцитов в A . thaliana также регулируется киназой рецептора с богатыми лейцином повторами (LRR) EXTRA SPOROGENOUS CELLS / EXCESS MICROSPOROCYTES1 (EXS / EMS1) в сочетании с его малым белковым лигандом TAPETUM DETERMINANT1 (TPD1) (Yang et al.
, 1999; Ян и др. , 1999, b ). spl мутанты дифференцируют микроспорангиальные археспориальные клетки, которые делятся один раз, но не могут образовывать микроспороциты или тапетальные клетки, вызывая стерильность (Schiefthaler et al. , 1999; Yang et al. , 1999 b ). Мутанты spl / nzz также являются стерильными самками из-за дефектов нуцеллара, что означает, что археспориальные клетки не дифференцируются и мейоз не запускается (Schiefthaler et al., 1999; Ян и др. , 1999 б ). Эктопическая активация SPL у агамных мутантов достаточна для индукции развития стаминоидов и образования пыльцы (Ito et al. , 2004). Вместе это указывает на то, что SPL / NZZ выполняет вышестоящую мейотическую функцию как в мужском, так и женском развитии. Идентичность мужских спороцитов в A . thaliana также регулируется киназой рецептора с богатыми лейцином повторами (LRR) EXTRA SPOROGENOUS CELLS / EXCESS MICROSPOROCYTES1 (EXS / EMS1) в сочетании с его малым белковым лигандом TAPETUM DETERMINANT1 (TPD1) (Yang et al. , 1999, b, , 2003; Canales et al. , 2002; Zhao et al. , 2002). Первое деление археспориальных клеток обычно отделяет судьбу репродуктивных спороцитов от судьбы нерепродуктивной стенки и тапетальных судеб. Развитие микроспорангии изменено у мутантов exs / ems1 и tpd1 , так что спорогенные клетки развиваются за счет тапетальных клеток (Yang et al. , 1999, b , 2003; Canales et al. , 2002; Zhao et al., 2002). Это означает, что передача сигналов киназы EXS / EMS1 важна либо для обеспечения тапетала, либо для репрессии идентичности спорогенных клеток. Хотя exs / ems1 мутации в A . thaliana демонстрируют нормальное мегаспорангиальное развитие, мутации в гомологе риса МНОЖЕСТВЕННЫЕ СПОРОЦИТЫ1 ( MSP1 ) обнаруживают сверхкомплектные спороциты как в пыльнике, так и в яйцеклетке, так же как и у множественных археспориальных клеток1 мутантных макроцитов Sheridan ().
, 1999, b, , 2003; Canales et al. , 2002; Zhao et al. , 2002). Первое деление археспориальных клеток обычно отделяет судьбу репродуктивных спороцитов от судьбы нерепродуктивной стенки и тапетальных судеб. Развитие микроспорангии изменено у мутантов exs / ems1 и tpd1 , так что спорогенные клетки развиваются за счет тапетальных клеток (Yang et al. , 1999, b , 2003; Canales et al. , 2002; Zhao et al., 2002). Это означает, что передача сигналов киназы EXS / EMS1 важна либо для обеспечения тапетала, либо для репрессии идентичности спорогенных клеток. Хотя exs / ems1 мутации в A . thaliana демонстрируют нормальное мегаспорангиальное развитие, мутации в гомологе риса МНОЖЕСТВЕННЫЕ СПОРОЦИТЫ1 ( MSP1 ) обнаруживают сверхкомплектные спороциты как в пыльнике, так и в яйцеклетке, так же как и у множественных археспориальных клеток1 мутантных макроцитов Sheridan ().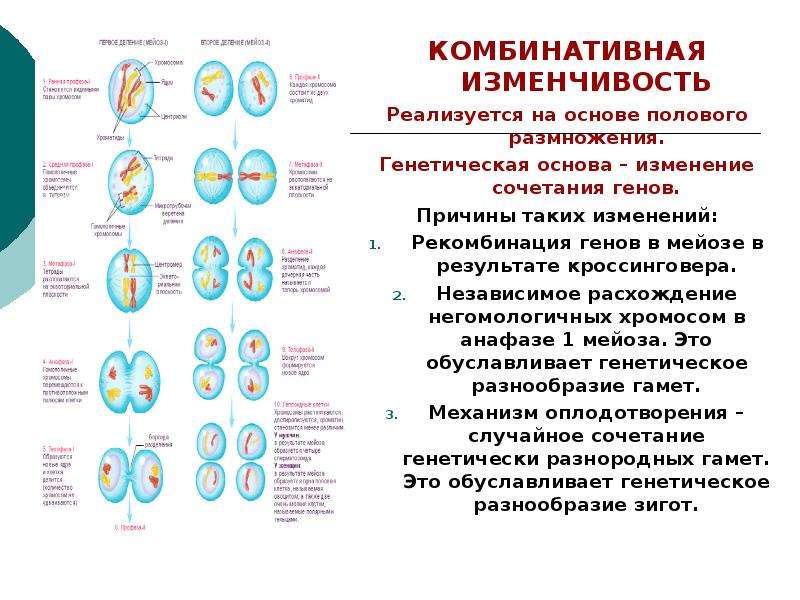 et al., 1996; Nonomura et al. , 2003). Интересно, что дополнительные киназы рецептора LRR также участвуют в правильной дифференцировке слоев клеток пыльника (Albrecht et al. , 2005; Colcombet et al. , 2005; Mizuno et al. , 2007; Hord et al. , 2008). Как эти сигнальные процессы организованы между типами клеток в развивающемся пыльнике, пока не ясно.
et al., 1996; Nonomura et al. , 2003). Интересно, что дополнительные киназы рецептора LRR также участвуют в правильной дифференцировке слоев клеток пыльника (Albrecht et al. , 2005; Colcombet et al. , 2005; Mizuno et al. , 2007; Hord et al. , 2008). Как эти сигнальные процессы организованы между типами клеток в развивающемся пыльнике, пока не ясно.
Перспективы на будущее
Генетические исследования развития в A . thaliana значительно продвинули наше понимание контекста, в котором возникает меоизис у растений. Будущие цели будут заключаться в том, чтобы связать воедино наше понимание контекста, инициации и развития мейоза в различных группах растений, чтобы потенциальные вариации могли быть переданы в селекцию. Во время диверсификации растений гены, которые, возможно, изначально участвовали в репродуктивном развитии, были адаптированы к путям вегетативного развития.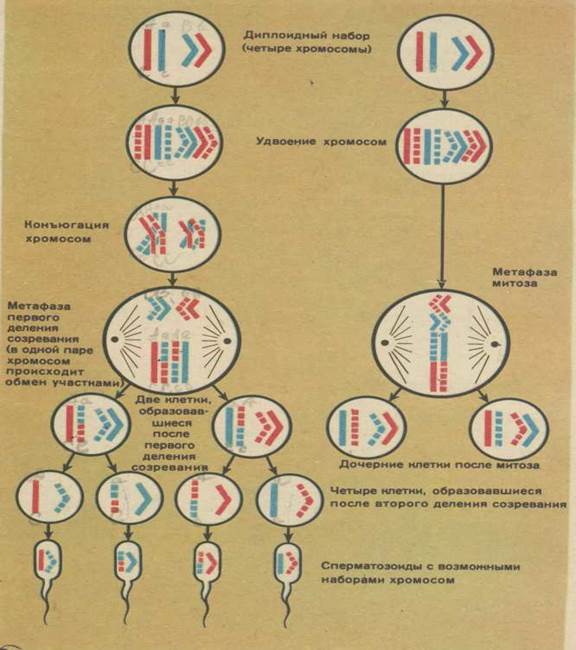 В то время как белки KNOX / BEL могут запускать мейоз у хлорофитных водорослей, их роль в харофитах и большинстве мохообразных неизвестна, и, таким образом, точки функциональной диверсификации еще предстоит определить.Механизмы развития археспориальных клеток еще не полностью изучены у цветковых растений и неизвестны у нецветковых растений. Происхождение питательных тканей тапетала в различных группах растений может быть, а может и не быть независимым от археспориальных клонов. Было бы интересно проверить гомологию между типами археспориальных и тапетальных клеток путем тестирования функции гомологов SPL , EXS и TPD1 в разных клонах. Вырисовывается подробная картина механизмов, которые контролируют спаривание мейотических хромосом растений, синапсис, рекомбинацию и сегрегацию в A . Талиана . Понимание того, как эти механизмы интегрируются во время развития мейотического клеточного цикла, будет сложной задачей. Точно так же картина горячих и холодных точек CO сложна, и механизмы, которые определяют частоту CO в заводе, еще предстоит определить.
В то время как белки KNOX / BEL могут запускать мейоз у хлорофитных водорослей, их роль в харофитах и большинстве мохообразных неизвестна, и, таким образом, точки функциональной диверсификации еще предстоит определить.Механизмы развития археспориальных клеток еще не полностью изучены у цветковых растений и неизвестны у нецветковых растений. Происхождение питательных тканей тапетала в различных группах растений может быть, а может и не быть независимым от археспориальных клонов. Было бы интересно проверить гомологию между типами археспориальных и тапетальных клеток путем тестирования функции гомологов SPL , EXS и TPD1 в разных клонах. Вырисовывается подробная картина механизмов, которые контролируют спаривание мейотических хромосом растений, синапсис, рекомбинацию и сегрегацию в A . Талиана . Понимание того, как эти механизмы интегрируются во время развития мейотического клеточного цикла, будет сложной задачей. Точно так же картина горячих и холодных точек CO сложна, и механизмы, которые определяют частоту CO в заводе, еще предстоит определить.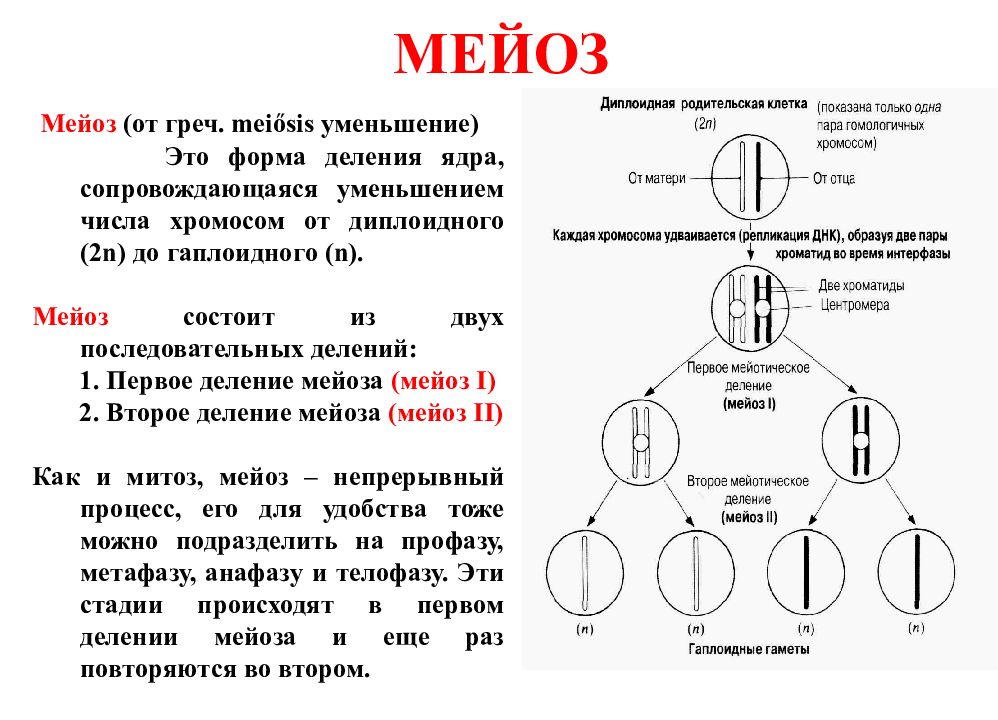 Знание этих механизмов может позволить нацелить CO во время селекции сельскохозяйственных культур и облегчить создание новых высокоурожайных сельскохозяйственных культур.
Знание этих механизмов может позволить нацелить CO во время селекции сельскохозяйственных культур и облегчить создание новых высокоурожайных сельскохозяйственных культур.
Мы благодарим Королевское общество и Благотворительный фонд Гэтсби за финансирование, Карен Ван Винкл-Свифт, Василия Канцлера, Ли Чжан, Дженни Моррис и Дайан Эдвардс за фотографии и двух анонимных рецензентов за полезные комментарии к рукописи.
Список литературы
,,.Идентификация и анализ DYAD : гена, необходимого для организации мейотических хромосом и мейотической прогрессии самок у Arabidopsi s
,Development
,2002
, vol.129
(стр.3935
—3943
),,,,,,.Подробное рассечение хромосомной области, содержащей локус Ph2 , в пшенице Triticum asestivum : с делеционными мутантами и профилированием экспрессии
,Annals of Botany
,2008
, vol.101
(стр.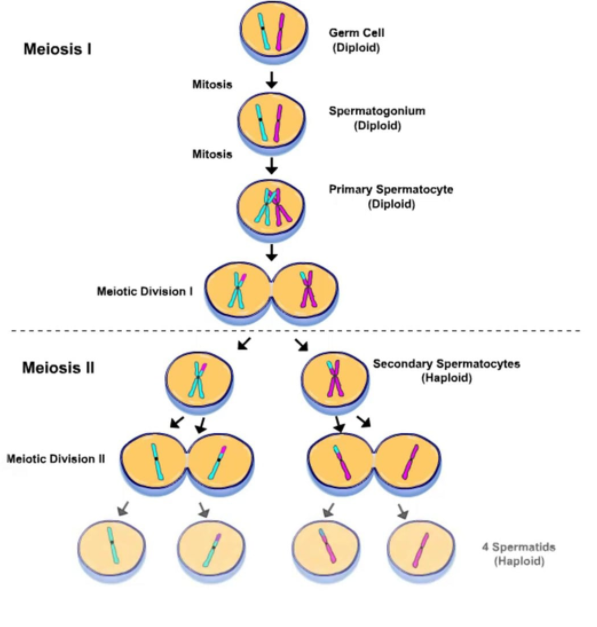
863
—872
),,,,.Arabidopsis thaliana СОМАТИЧЕСКИЕ КИНАЗЫ ЭМБРИОГЕНЕЗА 1 и 2 контролируют мужской спорогенез
,The Plant Cell
,2005
, vol.17
(стр.3337
—3349
),.Дифференциальная синхронизация и контроль рекомбинации некроссовера и кроссовера во время мейоза
,Cell
,2001
, vol.106
(стр.47
—57
),,,.Asy1, белок, необходимый для синапсиса мейотических хромосом, локализуется в связанном с осью хроматине в Arabidopsis и Brassica
,Journal of Cell Science
,2002
, vol.115
(стр.3645
—3655
),,.Цитологический анализ Arabidopsis thaliana мейотических хромосом
,Методы молекулярной биологии
,2009
, vol.558
(стр.131
—145
),,,,,,.Взаимодействие гомологов во время профазы I мейоза у Arabidopsis требует наличия гена SOLO DANCERS , кодирующего новый циклиноподобный белок
,EMBO Journal
,2002
, vol.
21
(стр.3081
—3095
),,,,,,.SKP1 соединяет регуляторы клеточного цикла с аппаратом протеолиза убиквитина через новый мотив, F-box
,Cell
,1996
, vol.86
(стр.263
—274
),,,,.Выделение и характеристика SYN1, гена, подобного RAD21, необходимого для мейоза у Arabidopsis
,The Plant Cell
,1999
, vol.11
(стр.417
—430
),.Время переходов в развитии растений
,Cell
,2006
, vol.125
(стр.655
—664
),.Стрептофиты и происхождение эмбриофитов
,Annals of Botany
,2009
, vol.103
(стр.999
—1004
),,,.Роль AtMUS81 в нечувствительных к помехам кроссоверах у
,A. thaliana. PLoS Genetics
,2007
,.Эволюция ограниченной рекомбинации в половых хромосомах
,Тенденции экологической эволюции
,2009
, т.24
(стр.94
—102
),,,,,.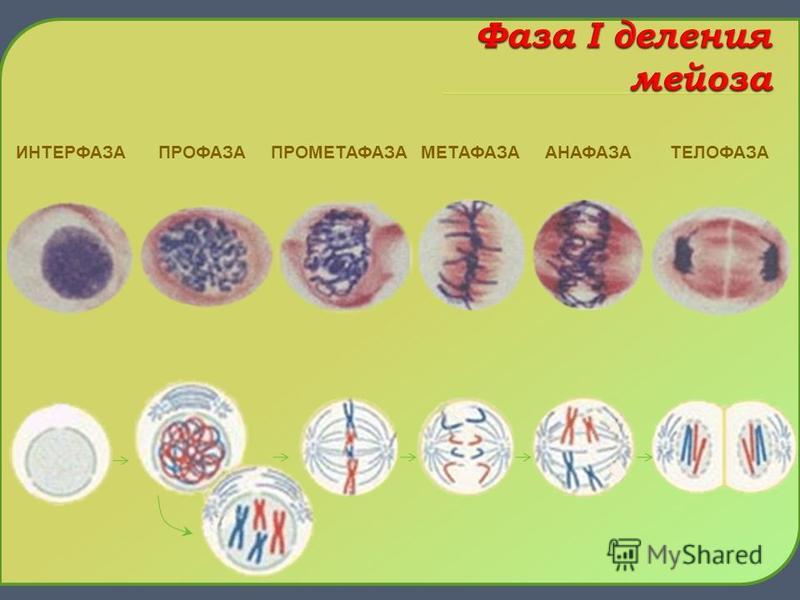
Гомологии в форме листа, полученные на основе экспрессии гена KNOXI во время развития
,Science
,2002
, vol.296
(стр.1858
—1860
),,.Мейоз растений: средство к 1N
,Trends in Plant Science
,2001
, vol.6
(стр.114
—121
),,,,,,,.Ген DIF1 Arabidopsis необходим для сегрегации мейотических хромосом и принадлежит к семейству генов когезина REC8 / RAD21
,The Plant Journal
,1999
, vol.19
(стр.463
—472
),,.Мейотические дефекты у мутанта Arabidopsis rad50 указывают на сохранение функции комплекса MRX на ранних стадиях мейотической рекомбинации
,Chromosoma
,2004
, vol.113
(стр.197
—203
),.Гомолог X rcc3 Arabidopsis играет важную роль в мейозе
,EMBO Journal
,2004
, vol.23
(стр.439
—449
),,,.TaASY1 способствует гомологичным хромосомным взаимодействиям, и на него влияет делеция Ph2
,The Plant Journal
,2009
, vol.57
(стр.487
—497
),,,,,.Триметилирование гистона h4 лизина 4 маркирует сайты инициации мейотической рекомбинации
,EMBO Journal
,2009
, vol.28
(стр.99
—111
),,.Кроссинговерная / некроссинговая дифференцировка, образование синаптонемных комплексов и регуляторный надзор за переходом лептотена / зиготена в мейоз
,Cell
,2004
, vol.117
(стр.29
—45
). ,Первобытные наземные растения, также известные как archegoniatae
,1935
Лондон
Macmillan and Co
.Насколько зеленым был Cooksonia ? Важность размера для понимания ранней эволюции физиологии в линии сосудистых растений
,Paleobiology
,2008
, vol.34
(стр.179
—194
),,,.Определенные модификации гистонов определяют инициацию и репарацию мейотической рекомбинации у мышей
,EMBO Journal
,2009
, vol.28
(стр.2616
—2624
),,.ASYMMETRIC LEAVES1 выявляет избыточность гена knox у Arabidopsis
,Development
,2002
, vol.129
(стр.1957
—1965
),,,.Белок когезина SYN1 арабидопсиса необходим для сцепления плеч сестринских хроматид и гомологичного спаривания хромосом
,Journal of Cell Science
,2003
, vol.116
(стр.2999
—3007
).,Эволюция наземных растений (зародыши)
,1940
Стэнфорд, Калифорния
Stanford University Press
,,,.EXS, предполагаемая киназа рецептора LRR, регулирует количество мужских клеток зародышевой линии и идентичность тапеталов и способствует развитию семян у Arabidopsis
,Current Biology
,2002
, vol.12
(стр.1718
—1727
),,,.Гомолог дрожжевого гена HOP1 инактивирован в мейотическом мутанте Arabidopsis asy1
,Chromosoma
,2000
, vol.109
(стр.62
—71
),,,,,,.Определение физических пределов локуса Brassica S с помощью рекомбинационного анализа
,The Plant Cell
,2000
, vol.12
(стр.23
—33
).Происхождение механизма рекомбинации и пола
,Наследственность
,2002
, т.88
(стр.125
—141
),.Происхождение генов KNOX, выявленное по гомологам мохообразных ( Physcomitrella patens )
,New Phytologist
,2001
, vol.150
(стр.23
—36
),,, и др.AtREC8 и AtSCC3 необходимы для монополярной ориентации кинетохор во время мейоза
,Journal of Cell Science
,2005
, vol.118
(стр.4621
—4632
),,,,,.Zip4 / Spo22 требуется для образования СО класса I, но не для завершения синапсиса у
,Arabidopsis thaliana. PLoS Genetics
,2007
, т.3
стр.e83
,,,,.Ген Arabidopsis ROCK-N-ROLLERS кодирует гомолог дрожжевой АТФ-зависимой ДНК-геликазы MER3 и необходим для нормального образования мейотического кроссовера.
,The Plant Journal
,2005
, vol.43
(стр.321
—334
),.Война завитков: генетические взаимодействия, контролирующие развитие цветов
,Nature
,1991
, vol.353
(стр.31
—37
),,,,.КИНАЗЫ РЕЦЕПТОРОВ СОМАТИЧЕСКОГО ЭМБРИОГЕНЕЗА Arabidopsis 1 и 2 необходимы для развития тапетума и созревания микроспор
,The Plant Cell
,2005
, vol.17
(стр.3350
—3361
),,.Развитие семяпочки Arabidopsis и ее эволюционное сохранение
,Тенденции в растениеводстве
,2008
, vol.13
(стр.444
—450
),,.Анализ рекомбинации по всему геному и функций центромер с тетрадами Arabidopsis
,Proceedings of the National Academy of Sciences, USA
,1998
, vol.95
(стр.247
—252
),,.Кроссовер-интерференция у Arabidopsis
,Genetics
,2002
, vol.160
(стр.1631
—1639
),,, и др.Генетическое определение и анализ последовательности центромер Arabidopsis
,Science
,1999
, vol.286
(стр.2468
—2474
),,,,,.Случайная сегрегация хромосом без остановки мейоза как в мужских, так и в женских мейоцитах мутанта dmc1 Arabidopsis
,The Plant Cell
,1999
, vol.11
(стр.1623
—1634
)d’Erfurth I, Jolivet S, Froger N, Catrice O, Novatchkova M, Mercier R
.Превращение мейоза в митоз
,PLoS Biology
,2009
« и др.Высокопроизводительный генетический скрининг выявляет новые функции ранней мейотической рекомбинации у
,Arabidopsis thaliana. PLoS Genetics
,2009
,,,,,.AtPRD1 необходим для образования мейотического двухцепочечного разрыва у Arabidopsis thaliana
,EMBO Journal
,2007
, vol.26
(стр.4126
—4137
),.miwi, мышиный гомолог piwi, кодирует цитоплазматический белок, необходимый для сперматогенеза
,Developmental Cell
,2002
, vol.2
(стр.819
—830
),.Преодоление разрыва между поколениями: гаметофиты цветущих растений и зародышевые линии животных обнаруживают неожиданное сходство
,Biological Review of the Cambridge Philosophical Socicety
,2009
, vol.84
(стр.589
—615
).Ключевые инновации, конвергенция и успех: макроэволюционные уроки филогении растений
,Палеобиология
,2005
, vol.31
(стр.77
—93
).Генетическая тонкая структура локуса BRONZE кукурузы
,Genetics
,1986
, т.113
(стр.1021
—1036
),.Рекомбинация происходит равномерно внутри гена бронзы, горячей точки мейотической рекомбинации в геноме кукурузы
,The Plant Cell
,1997
, vol.9
(стр.1633
—1646
),,, и др.Вариация скорости кроссинговера по хромосоме 4 Arabidopsis thaliana показывает наличие «горячих точек» мейотической рекомбинации
,Genome Research
,2006
, vol.16
(стр.106
—114
),,,,,,,,.Распределение кроссоверов по полу и вариации в уровне интерференции по хромосоме 4 Arabidopsis thaliana
,PLoS Genetics
,2007
, vol.3
стр.e106
,.Записи спорангиев типа Cooksonia из поздних слоев Венлока в Ирландии
,Nature
,1980
, vol.287
(стр.41
—42
),.Упаковка мужской зародышевой линии растений
,Тенденции в генетике
,2007
, vol.23
(стр.503
—510
),.Локус типа спаривания Chlamydomonas reinhardtii содержит сильно реаранжированные последовательности ДНК
,Cell
,1994
, vol.76
(стр.1135
—1145
),,,,,.Высокорекомбиногенный локус bz расположен в необычно богатой генами области генома кукурузы
,Proceedings of the National Academy of Sciences, USA
,2001
, vol.98
(стр.8903
—8908
),,.Скорости рекомбинации между соседними генными и ретротранспозонными областями кукурузы различаются на 2 порядка
,Proceedings of the National Academy of Sciences, USA
,2002
, vol.99
(стр.1082
—1087
),,,,,.Исключительный образец раннего наземного растения Cooksonia paranensis и гипотеза жизненного цикла самых ранних эвтрахеофитов
,Review of Palaeobotany and Palynology
,2006
, vol.142
(стр.123
—130
),. ,Морфология и эволюция сосудистых растений
,1988
Нью-Йорк
WH Freeman and Company
.,Биология развития
,1994
Сандерленд, Массачусетс, США
Sinauer Associates
,,,.Роль гена ameiotic1 в инициации мейоза и в последующих мейотических событиях у кукурузы
,Genetics
,1993
, vol.135
(стр.1151
—1166
),.Функция и регуляция гена цветочного гомеоза Arabidopsis PISTILLATA
,Genes and Development
,1994
, vol.8
(стр.1548
—1560
),,.Происхождение растений: изменения строения тела, способствующие серьезному эволюционному излучению
,Proceedings of the National Academy of Sciences, USA
,2000
, vol.97
(стр.4535
—4540
),,,.AtSPO11-1 необходим для эффективной мейотической рекомбинации у растений
,EMBO Journal
,2001
, vol.20
(стр.589
—600
),,,,,,,.Молекулярная характеристика Ph2 как основного локуса спаривания хромосом в полиплоидной пшенице
,Nature
,2006
, vol.439
(стр.749
—752
),,,,,,,.REC8-зависимое растение Shugoshin требуется для поддержания центромерной когезии во время мейоза и не имеет митотических функций
,Current Biology
,2005
, vol.15
(стр.948
—954
),,.Генетика мейотической профазы I у растений
,Annual Review of Plant Biology
,2006
, vol.57
(стр.267
—302
),,,,,.Независимое задействование консервативного механизма развития во время эволюции листа
,Nature
,2005
, vol.434
(стр.509
—514
),,,,,.Каталитически активные остатки тирозина как SPO11-1, так и SPO11-2 необходимы для индукции двухцепочечного разрыва мейоза в Arabidopsis
,The Plant Cell
,2007
, vol.19
(стр.3090
—3099
),,,.Гомолог Arabidopsis MutS AtMSh5 функционирует на ранней стадии рекомбинации: доказательства двух классов рекомбинации у Arabidopsis
,Genes and Development
,2004
, vol.18
(стр.2557
—2570
),,,.Экспрессия и функциональный анализ AtMUS81 в мейозе Arabidopsis выявляет роль во втором пути кроссинговера
,The Plant Journal
,2008
, vol.54
(стр.152
—162
),,,,.Белок синаптонемного комплекса Arabidopsis ZYP1 необходим для синапсиса хромосом и нормальной точности скрещивания
,Genes and Development
,2005
, vol.19
(стр.2488
—2500
),,,,,.AtMSH5 является партнером AtMSh5 в мейотическом перекрестном пути класса I в Arabidopsis thaliana , но не требуется для синапсов
,The Plant Journal
,2008
, vol.55
(стр.28
—39
),,,,,,.Регулирование развития ранних пыльников Arabidopsis с помощью митоген-активируемых протеинкиназ MPK3 и MPK6, а также ERECTA и родственных рецептор-подобных киназ
,Molecular Plant
,2008
, vol.1
(стр.645
—658
),.Клеточный цикл растений
,Current Opinion in Plant Biology
,1999
, vol.2
(стр.440
—446
),,,.Опосредованная Agrobacterium трансформация гаплоидной печеночника Marchantia plymorpha L. и новая модель для биологии растений
,Физиология растений и клетки
,2008
, vol.49
(стр.1084
—1091
),,,,,,,.Гомеотический белок AGAMOUS контролирует микроспорогенез путем регуляции SPOROCYTELESS
,Nature
,2004
, vol.430
(стр.356
—360
),,.Гомеотический ген APETALA3 из Arabidopsis thaliana кодирует MADS-бокс и экспрессируется в лепестках и тычинках
,Cell
,1992
, vol.68
(стр.683
—697
),,,,,.Снижение мейотических кроссоверов и задержка прогрессии профазы I у AtMLh4-дефицитных Arabidopsis
,EMBO Journal
,2006
, vol.25
(стр.1315
—1323
),.Интерполяционная гипотеза происхождения вегетативного спорофита наземных растений
,Таксон
,2005
, т.54
(стр.443
—450
). ,,.Теория телома
,Генетика развития и эволюция растений
,2002
Лондон
Тейлор и Фрэнсис
(стр.365
—387
),, и др.Гомолог Arabidopsis thaliana MND1 играет ключевую роль в мейотическом гомологичном спаривании, синапсисе и рекомбинации
,Journal of Cell Science
,2006
, vol.119
(стр.2486
—2496
),,,,,,,,.Спонтанные события нерасхождения MI и MII Х-хромосомы в ооцитах Drosophila melanogaster имеют разную рекомбинационную историю
,Nature Genetics
,1996
, vol.14
(стр.406
—414
),,, и др.Характеристика чувствительных конфигураций хиазмы, которые увеличивают риск материнского нерасхождения хромосомы 21
,Human Molecular Genetics
,1997
, vol.6
(стр.1391
—1399
),. .Переходы в развитии во время эволюции растений
,Пути эволюции: ключевые темы эволюционной биологии развития
,2008
Кембридж
Cambridge University Press
(стр.299
—319
),,,.Раннее половое происхождение гетеродимеризации гомеопротеинов и эволюция растений Семейство KNOX / BELL
,Cell
,2008
, vol.133
(стр.829
—840
).Зеленые водоросли и происхождение наземных растений
,Американский журнал ботаники
,2004
, vol.91
(стр.1535
—1556
),,,,,,.Ген AtRAD51 Arabidopsis необязателен для вегетативного развития, но необходим для мейоза
,Proceedings of the National Academy of Sciences, USA
,2004
, vol.101
(стр.10596
—10601
),,,,,,,,,.Мейотическая мутация мыши mei1 нарушает синапсис хромосом с сексуально диморфными последствиями для мейотической прогрессии
,Developmental Biology
,2002
, vol.242
(стр.174
—187
),,,,,,,,.Сайты вставки транспозона Mu и события мейотической рекомбинации совместно локализуются с эпигенетическими метками для открытого хроматина в геноме кукурузы
,PLoS Genetics
,2009
, vol.5
стр.e1000733
,.Arabidopsis separase AESP необходим для развития эмбриона и высвобождения когезина во время мейоза
,The Plant Cell
,2006
, vol.18
(стр.1213
—1225
),,,.Член класса гомеодоменных белков KNOTTED, кодируемых геном STM Arabidopsis
,Nature
,1996
, vol.379
(стр.66
—68
),,,,,,,,.Ковариация длины синаптонемного комплекса и скорости обмена мейоза у млекопитающих
,Science
,2002
, vol.296
(стр.2222
—2225
),,,,,,,,.SHOC1, белок, связанный с эндонуклеазой XPF, необходим для образования мейотических кроссоверов класса I.
,Current Biology
,2008
, vol.18
(стр.1432
—1437
),,,,.Ген Arabidopsis позднего асинхронного мейоза необходим для нормального темпа и синхронности деления клеток во время мужского мейоза
,Plant Physiology
,2001
, vol.127
(стр.1157
—1166
),,,.Протистские гомологи мейотического гена Spo11 и топоизомеразы VI раскрывают эволюционную историю дупликации гена и клон-специфической потери
,Molecular and Biological Evolution
,2007
, vol.24
(стр.2827
—2841
),.Подавление кроссинговера метилированием ДНК у
,Ascobolus. Гены и развитие
,1998
, т.12
(стр.1381
—1389
),,,,,.Гомологичное спаривание хромосом у пшеницы
,Journal of Cell Science
,1999
, vol.112
(стр.1761
—1769
),.Рекомбиназы Rad51 и Dmc1: неидентичные близнецовые отношения
,Trends in Biochemical Science
,2001
, vol.26
(стр.131
—136
),,.Происхождение харофитных водорослей и наземных растений
,Тенденции экологической эволюции
,2004
, vol.19
(стр.661
—666
),,.Синтез-зависимый отжиг цепей в мейозе
,PLoS Biology
,2007
, vol.5
стр.e299
,,,,,,,,.Мейотический белок SWI1 необходим для образования аксиальных элементов и инициации рекомбинации у Arabidopsis
,Development
,2003
, vol.130
(стр.3309
—3318
),, и др.Два класса мейотического кроссовера сосуществуют у Arabidopsis: один зависит от MER3, а другой — нет.
,Current Biology
,2005
, vol.15
(стр.692
—701
),,,,,,,.SWITCh2 (SWI1): новый белок, необходимый для установления когезии сестринских хроматид и для образования бивалентов в мейозе
,Genes and Development
,2001
, vol.15
(стр.1859
—1871
),,,.Дорога к кроссоверам: растения говорят
,Тенденции в генетике
,2007
, vol.23
(стр.91
—99
),.Геномика половых хромосом
,Current Opinion in Plant Biology
,2007
, vol.10
(стр.123
—130
),.Переход к наземной флоре: филогенетические взаимоотношения зеленых водорослей и мохообразных
,Кладистика
,1985
, т.1
(стр.305
—328
),,,,,,,.Рецептороподобная протеинкиназа 2 (RPK 2) — новый фактор, контролирующий развитие пыльников у Arabidopsis thaliana
,The Plant Journal
,2007
, vol.50
(стр.751
—766
),,,,.Гомеозная трансформация семяпочек в структуры, похожие на плодолистики у Arabidopsis
,The Plant Cell
,1994
, vol.6
(стр.333
—349
).Механизм скрещивания
,Американский натуралист
,1916
, т.50
(стр.193
—434
),.Контроль контрольных точек репликации мейотической ДНК у делящихся дрожжей
,Genes and Development
,1999
, vol.13
(стр.2581
—2593
),,,,.Основные хромосомные перестройки, индуцированные трансформацией Т-ДНК у Arabidopsis
,Genetics
,1998
, vol.149
(стр.641
—650
),,,,,,.Ген MSP1 необходим для ограничения количества клеток, вступающих в мужской и женский спорогенез, и для инициации форматина стенки пыльника у риса
,The Plant Cell
,2003
, vol.15
(стр.1728
—1739
),,,,,,.Новый ген ГОМОЛОГИЧЕСКАЯ АБЕРРАЦИЯ СПАР В МЕЙОЗЕ РИСА1 риса кодирует предполагаемый белок спиральной спирали, необходимый для гомологичного спаривания хромосом в мейозе
,The Plant Cell
,2004
, vol.16
(стр.1008
—1020
),,,,,,,,.Циклинзависимая киназа 2 необходима для мейоза, но не для деления митотических клеток у мышей
,Nature Genetics
,2003
, vol.35
(стр.25
—31
),,,,.Репликационный белок A (AtRPA1a) необходим для образования кроссовера класса I, но не требуется для репарации мейотических разрывов ДНК
,EMBO Journal
,2009
, vol.28
(стр.394
—404
),.Генетика и молекулярная биология синаптонемного комплекса
,Annual Review of Cell and Development Biology
,2004
, vol.20
(стр.525
—558
),,,,,,,,.At MND1 необходим для гомологичного спаривания во время мейоза у Arabidopsis
,BMC Molecular Biology
,2006
, vol.7
стр.24
.Тапетальная организация во время спорогенеза у Psilotum nudum
,Annals of Botany
,1987
, vol.60
(стр.353
—360
),,,,,,.KNAT2 : свидетельство связи между узловатыми генами и развитием плодолистиков
,The Plant Cell
,2001
, vol.13
(стр.1719
—1734
),,,,,.Координация мейотической рекомбинации, спаривания и синапсиса с помощью PHS1
,Science
,2004
, vol.303
(стр.89
—92
),,,,,,,,,.Кукуруза AMEIOTIC1 необходима для множественных ранних мейотических процессов и, вероятно, необходима для инициации мейоза
,Proceedings of the National Academy of Sciences, USA
,2009
, vol.106
(стр.3603
—3608
),,,,,,.Оценка избыточности генов MADS-бокса во время развития плодолистиков и семяпочек
,Nature
,2003
, vol.424
(стр.85
—88
),,.Контроль изменений конформации, связанных с узнаванием гомолога во время мейоза
,Теоретическая и прикладная генетика
,2005
, vol.111
(стр.505
—510
),,.Распознавание гомологов во время мейоза связано с изменением конформации хроматина
,Nature Cell Biology
,2004
, vol.6
(стр.906
—908
),,,,,.Филогения и эволюция папоротников (монилофитов) с акцентом на ранние лептоспорангиатные расхождения
,Американский журнал ботаники
,2004
, vol.91
(стр.1582
—1598
),,,,.Дефицит Mre11 у Arabidopsis связан с хромосомной нестабильностью в соматических клетках и Spo11-зависимой фрагментацией генома во время мейоза
,The Plant Cell
,2004
, vol.16
(стр.1968
—1978
),,, и др.Самые глубокие расхождения у наземных растений, выведенные из филогеномных данных
,Proceedings of the National Academy of Sciences, USA
,2006
, vol.103
(стр.15511
—15516
),,.Филогеномный перечень мейотических генов; доказательства пола у Giardia и раннего эукариотического происхождения мейоза
,Current Biology
,2005
, vol.15
(стр.185
—191
),,.Образование гамет без мейоза у Arabidopsis
,Nature
,2008
, vol.451
(стр.1121
—1124
).Геном Physcomitrella раскрывает эволюционное понимание завоевания земли растениями
,Science
,2008
, vol.319
(стр.64
—68
),,.Центромеры-проксимальные кроссоверы связаны с преждевременным разделением сестринских хроматид во время мейоза у Saccharomyces cerevisiae
,Genetics
,2006
, vol.174
(стр.1745
—1754
),,,.PHS регулирует мейотическую рекомбинацию и гомологичное спаривание, контролируя транспорт RAD50 к ядру
,Proceedings of the National Academy of Sciences, USA
,2009
, vol.106
(стр.20121
—20126
). ,Получение выгод: наука и устойчивое развитие мирового сельского хозяйства
,2009
Лондон
Королевское общество
,,,,,.Функция апикальной меристемы побегов у Arabidopsis требует комбинированной активности трех белков гомеодомена, подобных BEL1.
,The Plant Journal
,2009
, vol.58
(стр.641
—654
),,,,,.Подробные исследования рекомбинации вдоль хромосомы 3B дают новое представление о распределении кроссовера у пшеницы ( Triticum aestivum L.)
,Genetics
,2009
, vol.181
(стр.393
—403
),,,.Гены KNOX класса 1 не участвуют в развитии побегов у мха Physcomitrella patens , но действуют в развитии спорофитов
,Evolution and Development
,2008
, vol.10
(стр.555
—566
),,,.ASY1 опосредует AtDMC1-зависимую интергомологическую рекомбинацию во время мейоза у Arabidopsis
,Genes and Development
,2007
, vol.21
(стр.2220
—2233
),,,,,,.Гены гомеобоксаKNOX потенциально имеют сходные функции как в диплоидных одноклеточных, так и в многоклеточных меристемах, но не в гаплоидных меристемах
,Evolution and Development
,2005
, vol.7
(стр.69
—78
),,,,,.Молекулярный анализ NOZZLE , гена, участвующего в формировании паттерна и раннем спорогенезе во время развития половых органов у Arabidopsis thaliana
,Proceedings of the National Academy of Sciences, USA
,1999
, vol.96
(стр.11664
—11669
),, и др.Геном кукурузы B73: сложность, разнообразие и динамика
,Science
,2009
, vol.326
(стр.1112
—1115
),,,,.AHP2 необходим для образования бивалентов и сегрегации гомологичных хромосом в мейозе Arabidopsis
,The Plant Journal
,2003
, vol.36
(стр.1
—11
),,.Ген KNOX SHOOT MERISTEMLESS необходим для развития репродуктивных меристематических тканей у Arabidopsis
,The Plant Journal
,2007
, vol.50
(стр.767
—781
),.Филогения и диверсификация мохообразных
,Американский журнал ботаники
,2004
, т.91
(стр.1557
—1581
),,,,.Ген mac1 : контроль приверженности мейотическому пути у кукурузы
,Genetics
,1996
, vol.142
(стр.1009
—1020
),,,,,,,,.Arabidopsis SPO11-2 функционирует с SPO11-1 в мейотической рекомбинации
,The Plant Journal
,2006
, vol.48
(стр.206
—216
),. ,Модели в развитии растений
,1989
Кембридж, Великобритания
Cambridge University Press
.Поведение хромосом при изучении сцепления
,Zeitschrift für Induktive Abstammungs-u Vererbungslehre
,1915
, vol.13
(стр.234
—287
),.GEN1 / Yen1 и комплекс SLX4: решения проблемы разрешения соединения Холлидея
,Genes and Develoment
,2010
, vol.24
(стр.521
—536
),,,.Диверсификация функции гена: гомологи регулятора цветка FLO / LFY контролируют первое деление зиготических клеток у мха Physcomitrella patens
,Development
,2005
, vol.132
(стр.1727
—1736
),,,,,,,,,.Новый ген растения, необходимый для мейоза, связан с человеческим CtIP и дрожжевым COM1 / SAE2 геном
,EMBO Journal
,2007
, vol.26
(стр.5061
—5070
),,.Разделению сестринских хроматид в начале анафазы способствует расщепление субъединицы когезина Scc1
,Nature
,1999
, vol.400
(стр.37
—42
),,,,,,,.Взаимодействие RecA-родственных белков и комплекса MND1-HOP2 во время мейоза у Arabidopsis thaliana
,PLoS Genetics
,2007
, vol.3
(стр.1894
—1906
),.Откуда мейоз?
,Ячейка
,2001
, т.106
(стр.647
—650
).Систематические значения Psilotaceae
,Brittonia
,1977
, vol.29
(стр.54
—63
),,,.Прохождение мейоза I и мейоза II в пыльниках Arabidopsis регулируется циклином A-типа, преимущественно экспрессируемым в профазе I
,Plant Physiology
,2004
, vol.136
(стр.4127
—4135
).Шугошин: дух-хранитель центромеры
,Current Opinion in Cell Biology
,2005
, vol.17
(стр.590
—595
),,,,.Arabidopsis thaliana PARTING DANCERS Ген , кодирующий новый белок, необходим для нормальной мейотической гомологичной рекомбинации
,Molecular Biology of the Cell
,2006
, vol.17
(стр.1331
—1343
),,,,,.Преждевременное растворение каллозной стенки микроспороцитов вызывает мужскую стерильность у трансгенного табака
,The Plant Cell
,1992
, vol.4
(стр.759
—771
),,,,.Ген Arabidopsis SKP1-LIKE1 необходим для мужского мейоза и может контролировать разделение гомологов
,Proceedings of the National Academy of Sciences, USA
,1999
, vol.96
(стр.11416
—11421
),,,,,,,.Детерминант тапетума1 необходим для клеточной специализации пыльника Arabidopsis
,The Plant Cell
,2003
, vol.15
(стр.2792
—2804
),,,.Ген SPOROCYTELESS из Arabidopsis необходим для инициации спорогенеза и кодирует новый ядерный белок
,Genes and Development
,1999
, vol.13
(стр.2108
—2117
),,,,,.Белок, кодируемый гомеотическим геном Arabidopsis agamous , напоминает факторы транскрипции
,Nature
,1990
, vol.346
(стр.35
—39
),, и др.Полногеномное картирование с высоким разрешением и функциональный анализ метилирования ДНК у арабидопсиса
,Cell
,2006
, vol.126
(стр.1189
—1201
),,,,,,.ASK1, гомолог SKP1, необходим для ядерной реорганизации, пресинаптического сопоставления гомологов и правильного распределения когезина во время мейоза у Arabidopsis
,Plant Molecular Biology
,2006
, vol.62
(стр.99
—110
),,,.Избыток микроспороцитов1 Ген кодирует предполагаемую протеинкиназу рецептора с высоким содержанием лейцина, которая контролирует судьбу соматических и репродуктивных клеток в пыльнике Arabidopsis
,Genes and Development
,2002
, vol.16
(стр.2021
—2031
),,,.Эктопическая экспрессия Chlamydomonas mt + -специфического гомеодоменного белка в mt-гаметах инициирует развитие зиготы без слияния гамет
,Genes and Development
,2001
, vol.15
(стр.2767
—2777
),,,,.Полногеномный анализ метилирования ДНК Arabidopsis thaliana обнаруживает взаимозависимость между метилированием и транскрипцией
,Nature Genetics
,2007
, vol.39
(стр.61
—69
)© Автор [2010]. Опубликовано Oxford University Press [от имени Общества экспериментальной биологии]. Все права защищены.Для получения разрешений обращайтесь по электронной почте: [email protected]
.Мейоз цветковых растений и других зеленых организмов | Журнал экспериментальной ботаники
Аннотация
Половые эукариоты генерируют гаметы, используя специализированное деление клеток, называемое мейозом, которое служит как для уменьшения вдвое количества хромосом, так и для изменения генетической изменчивости, присутствующей в родительском организме. Здесь рассмотрены природа и механизм деления мейотических клеток у растений и его влияние на генетическую изменчивость.Поскольку цветы являются местом мейоза и оплодотворения покрытосеменных растений, мейотический контроль будет рассматриваться в этом контексте развития. Наконец, мы рассматриваем то, что известно о контроле мейоза у зеленых водорослей и нецветущих наземных растений, и обсуждаем эволюционные переходы, относящиеся к мейозу, которые произошли в линиях, дающих начало покрытосеменным.
Введение
Человек выбрал из естественных генетических вариаций виды сельскохозяйственных культур, полезных для сельского хозяйства.Еще предстоит полностью использовать значительное генетическое разнообразие, в том числе вариации, способные повысить урожайность и расширить спектр сельскохозяйственных культур. Для того, чтобы накормить 9 миллиардов человек, которые, по оценкам, будут существовать к 2050 году, потребуется устойчивое увеличение урожайности на 50% (Королевское общество, 2009). Чтобы повысить эффективность селекции сельскохозяйственных культур, важно понимать механизм, с помощью которого генерируются и передаются вариации. Вариации возникают в ходе специализированного редуктивного деления клеток, называемого мейозом, во время которого происходит рекомбинация между гомологичными хромосомами, называемая кроссовером (CO).Частота CO варьируется внутри и между видами и может быть ограничивающей, так что полезные вариации недоступны для разведения. Хотя большинство сельскохозяйственных культур представляют собой покрытосеменные растения, у которых мейоз происходит в органах цветков, нецветковые растения предоставили новое понимание контроля над мейозом растений. Здесь рассмотрены природа деления мейотических клеток у растений, генетические механизмы, которые способствуют изменчивости, и контекст развития, в котором происходит мейоз у наземных растений и их ближайших сестринских групп.
Деления мейотических клеток
Мейоз — это способ деления клеток, специфичный для эукариотических организмов, при котором четыре гаплоидные дочерние клетки образуются из одной диплоидной родительской клетки (Villeneuve and Hillers, 2001; Hamant et al. , 2006; Mezard et al. , 2007) . Это редуктивное деление достигается с помощью одного раунда репликации ДНК, за которым следуют два раунда сегрегации хромосом и деления клеток (мейоз-I и мейоз-II) (рис. 1). Мейоз, по-видимому, является наследственной чертой эукариот и, как предполагается, возник недалеко от происхождения группы (Villeneuve and Hillers, 2001; Cavalier-Smith, 2002).Эта идея подкрепляется наблюдениями, что многие одноклеточные эукариоты, которые когда-то считались бесполыми, с тех пор, как было обнаружено, обладают консервативными генами, специфичными для мейоза (Ramesh et al. , 2005; Malik et al. , 2007). Первое мейотическое деление резко отличается от митоза, поскольку гомологичные хромосомы спариваются до сегрегации. Во время второго деления сестринские хроматиды разделяются на противоположные полюса так же, как и во время митоза. В то время как гомологи спариваются во время мейоза-I, они тесно связаны посредством синаптонемного комплекса, который формируется по их длине (Page and Hawley, 2004).Специфическая для мейоза экспрессия эндонуклеазы, SPO11, вызывает большое количество двухцепочечных разрывов (DSB) вдоль парных хромосом (Villeneuve and Hillers, 2001). Подмножество этих сайтов разрыва репарируется посредством путей рекомбинации, которые приводят к физическому обмену между парными хромосомами (CO) (Villeneuve and Hillers, 2001; Hamant et al. , 2006; Mezard et al. , 2007). Поскольку парные хромосомы сегрегируют во время мейоза-I, сайты CO могут быть визуализированы цитологически как хиазмы (Armstrong et al., 2009). Независимая сегрегация материнских и отцовских наборов хромосом во время мейоза в сочетании с CO между хромосомами означает, что гаметы, вероятно, обладают новыми комбинациями генетических вариаций (Рис. 1).
Рис. 1.
Наследование хромосом при мейозе. (A) Материнские (белые) и отцовские (черные) унаследованные копии двух пар хромосом показаны в диплоидной родительской клетке. (B) Во время S-фазы мейоза-I реплицируется каждая хромосома.(C) Унаследованные по материнской и отцовской линии пары гомологичных хромосом физически связаны во время профазы мейоза-I. Одновременно со спариванием большое количество двухцепочечных разрывов ДНК (показано короткими вертикальными линиями) индуцируется эндонуклеазой SPO11. (D) В конце мейоза-I микротрубочки веретена прикрепляются к центромерам парных бивалентов, и события рекомбинации завершаются. (E) Члены гомологичных пар хромосом отделяются от противоположных полюсов клетки. (F) Мейоз-I дополняется равным количеством реплицированных рекомбинированных хромосом в дочерних клетках.(G) Во время мейоза-II сцепление теряется между реплицированными хроматидами, которые разделяются на противоположные полюсы клеток. (H) Четыре гаплоидные дочерние клетки производятся с новыми комбинациями наследуемой по материнской и отцовской линии генетической информации.
Рис. 1.
Наследование хромосом при мейозе. (A) Материнские (белые) и отцовские (черные) унаследованные копии двух пар хромосом показаны в диплоидной родительской клетке. (B) Во время S-фазы мейоза-I реплицируется каждая хромосома. (C) Унаследованные по материнской и отцовской линии пары гомологичных хромосом физически связаны во время профазы мейоза-I.Одновременно со спариванием большое количество двухцепочечных разрывов ДНК (показано короткими вертикальными линиями) индуцируется эндонуклеазой SPO11. (D) В конце мейоза-I микротрубочки веретена прикрепляются к центромерам парных бивалентов, и события рекомбинации завершаются. (E) Члены гомологичных пар хромосом отделяются от противоположных полюсов клетки. (F) Мейоз-I дополняется равным количеством реплицированных рекомбинированных хромосом в дочерних клетках. (G) Во время мейоза-II сцепление теряется между реплицированными хроматидами, которые разделяются на противоположные полюсы клеток.(H) Четыре гаплоидные дочерние клетки производятся с новыми комбинациями наследуемой по материнской и отцовской линии генетической информации.
Программируемый разрыв и восстановление ДНК
Важным первым шагом в достижении CO является генерация DSB во всем геноме с помощью SPO11. SPO11 родственен субъединице A архебактериальной топиоизомеразы IV, которая действует, снимая перекручивание ДНК, генерируя временные DSB (Villeneuve and Hillers, 2001; Cavalier-Smith, 2002).Следовательно, компоненты аппарата мейотической рекомбинации могут быть задействованы из механизмов репарации прокариотической ДНК. Два родственных ортолога SPO11-1 и SPO11-2 необязательно необходимы для мейотических DSB у Arabidopsis thaliana (Grelon et al. , 2001; Stacey et al. , 2006; Hartung et al. , 2007). У мутантов spo11-1 и spo11-2 отсутствуют мейотические DSB и обнаружено отсутствие спаривания гомологов и синапсиса, что означает, что одновалентные хромосомы сегрегируют в мейозе-I (Grelon et al., 2001; Стейси и др. , 2006; Hartung et al. , 2007). Поскольку одновалентные хромосомы сегрегируют независимо от своего гомологичного партнера, мутанты spo11 показывают высокую частоту хромосомно несбалансированных гамет (Grelon et al. , 2001; Stacey et al. , 2006; Hartung et al. , 2007) . ДЕФЕКТЫ ИНИЦИАЦИИ ПУТАТИВНОЙ РЕКОМБИНАЦИИ 1 ( PRD1 ), PRD2 и PRD3 гены также необходимы для SPO11 -зависимого образования DSB и вызывают одновалентную сегрегацию при мутации (De et al., 2007, 2009). PRD1 и PRD3 имеют сходство последовательностей с известными мейотическими белками, Mei1 млекопитающих и PAIR1 риса, соответственно, но выполняют неизвестные функции во время формирования DSB (Libby et al. , 2002; Nonomura et al. , 2004; De Muyt et al. , 2007, 2009).
Второй функциональный класс генов, включая MND1 , AHP2 , RAD50 , RAD51C , XRCC3 , MRE11 и COM1 / SAE2 хромосом с мутантным фенотипом мутантной фрагментации synapsis, который подавляется в сочетании с spo11 или prd3 .(Schommer et al. , 2003; Bleuyard et al. , 2004; Bleuyard and White, 2004; Puizina et al. , 2004; Li et al. , 2004; Kerzendorfer et al. , 2006; Panoli и др. , 2006; Uanschou и др. , 2007; Виньяр и др. , 2007). Это указывает на то, что эти белки действуют, чтобы обрабатывать DSB во время мейотической рекомбинации, а нерепарированные DSB вызывают фрагментацию хромосом. Процессинг мейотических DSB происходит посредством резекции участка разрыва с образованием 3′-одноцепочечной ДНК, которая используется для вторжения в интактный дуплекс парной гомологичной хромосомы (Bhatt et al., 2001; Вильнёв и Хиллерс, 2001; Hamant et al. , 2006; Mezard et al. , 2007). Для проникновения оцДНК в дуплексы ДНК требуются рекомбиназы DMC1 и RAD51, которые связаны с белками обмена нити ДНК прокариот RecA (Couteau et al. , 1999; Masson and West, 2001; Villeneuve and Hillers, 2001; Cavalier-Smith, 2002). ; Ли и др. , 2004). Хотя считается, что оба RAD51 и DMC1 действуют на стадии инвазии оцДНК, мутанты rad51 демонстрируют SPO11 -зависимую фрагментацию хромосомы, тогда как мутанты dmc1 демонстрируют одновалентную сегрегацию (Couteau et al., 1999; Ли и др. , 2004). Одним из объяснений этого различия может быть то, что DSB восстанавливаются с использованием сестринских хроматид в dmc1 , но не в rad51 (Couteau et al. , 1999; Li et al. , 2004).
DSBs приводят к CO посредством образования двойного соединения Холлидея (dHJ) между парными гомологичными дуплексами ДНК (Villeneuve and Hillers, 2001). Вслед за инвазией цепи необходим ряд событий для образования dHJ, включая захват второго конца и синтез и лигирование ДНК (Villeneuve and Hillers, 2001).Эти соединения в конечном итоге разрешаются в события CO посредством неизвестной dHJ резольвазы у растений, хотя структурно-специфические эндонуклеазы GEN1 / Yen1 и SLX4 выполняют эту функцию у животных (Svendsen and Harper, 2010). SPO11 генерирует избыток DSB по сравнению с количеством наблюдаемых событий CO. Остальные DSB репарируются посредством генной конверсии (также известной как непересекающийся, NCO) путем, который не включает обмен фланкирующими генетическими маркерами (Villeneuve and Hillers, 2001).Зависящий от синтеза путь отжига цепи, по-видимому, является основным механизмом образования NCO у Saccharomyces cerevisiae , который действует независимо от образования dHJ (McMahill et al. , 2007). В S . cerevisiae решение о восстановлении сайтов DSB как событий CO или NCO принимается на ранней стадии профазы-I, до образования dHJ, поэтому маловероятно, что выбор CO / NCO представляет собой альтернативный процессинг dHJs (Allers and Lichten, 2001; Borner et al., 2004).
Контроль частоты кроссовера мейоза
На положение CO могут влиять другие CO на той же хромосоме посредством явления, известного как интерференция. При интерференции одно событие подавляет формирование соседних событий зависимым от расстояния способом, что означает, что они более широко распределены, чем ожидалось случайным образом (Sturtevant, 1915; Muller, 1916; Copenhaver et al. , 2002). Однако также встречаются не мешающие СО, которые имеют случайное распределение (Copenhaver et al., 2002). В А . thaliana Мешающие СО класса I составляют большинство (~ 75–85%), а не мешающие СО класса II меньшинство (~ 15-25%) (Copenhaver et al. , 2002; Higgins et al. , 2004; Мерсье и др. , 2005; Берховиц и др. , 2007; Хиггинс и др. , 2008, и ). CO класса I в A . thaliana требует набора генов, включая MSh5 , MSH5 , MLh4 , MER3 / ROCK-N-ROLLERS , PARTING DANCERS , ZIP4 / SPO22 , RPA и Higgins et al., 2004, 2008 b ; Чен и др. , 2005; Mercier et al. , 2005; Джексон и др. , 2006; Wijeratne et al. , 2006; Челышева и др. , 2007; Macaisne et al. , 2008; Осман и др. , 2009). Нокаут этих генов приводит к резкому снижению частоты CO, а оставшиеся события распределяются случайным образом. Происхождение мейотических белков в репарации прокариотической ДНК снова очевидно, поскольку белки MSh5 и MSH5 родственны бактериальным белкам репарации несоответствия MutS (Villeneuve and Hillers, 2001; Cavalier-Smith, 2002).Неинтерферирующие СО класса II требуют наличия гена MUS81 , который кодирует белок, подобный структурно-специфическим эндонуклеазам (Berchowitz et al. , 2007; Higgins et al. , 2008 a ).
Парные хромосомы обычно показывают по крайней мере одно событие CO, облигатное CO, которое требуется для правильных паттернов хромосомной сегрегации в A . thaliana (Grelon et al. , 2001). Каждые A . thaliana хромосома показывает приблизительно 1.8 CO пермейоз и очень небольшое количество хромосом не показывают CO (Copenhaver et al. , 1998, 2002; Higgins et al. , 2004; Drouaud et al. , 2006, 2007). Положение CO сильно варьируется, а горячие и холодные точки частоты CO существуют вдоль хромосом (Copenhaver et al. , 1998, 1999; Drouaud et al. , 2006, 2007). Выраженное увеличение частоты CO и плотности генов наблюдается в направлении теломер хромосом пшеницы и кукурузы (Liu et al., 2009 г .; Saintenac et al. , 2009 г .; Schnable et al. , 2009). Горячая точка рекомбинации в локусе кукурузы Bronze ( Bz ) находится в богатой генами области, близкой к теломере. Эта область показывает в 40–80 раз более высокие уровни CO, чем в среднем по геному, и окружена большими участками вставок вложенных ретротранспозонов, которые нечасто перекрещиваются (Dooner and Martinez-Ferez, 1997; Fu et al. , 2001, 2002). Повторяющиеся области, фланкирующие центромеры, также подавлены для CO, а события, проксимальные центромеры, ассоциируются с неправильной сегрегацией хромосом (Koehler et al., 1996; Lamb et al. , 1997; Дэн и Линь, 2002; Rockmill и др. , 2006).
Различия в частоте кроссовера можно объяснить эпигенетической информацией. Например в мышке и S . cerevisiae h4 Триметилирование K4 маркирует горячие точки DSB, и нарушение этой модификации снижает DSB (Borde et al. , 2009; Buard et al. , 2009). И наоборот, в A . thaliana CO-холодные повторяющиеся последовательности, фланкирующие центромеру, транскрипционно подавляются с использованием эпигенетической информации, включая метилирование цитозина ДНК и целевое метилирование ДНК в Ascobolous immersus достаточно для подавления частоты CO в несколько сотен раз (Maloisel and Rossignol, 1998; Zhang et al. al., 2006; Зильберман и др. , 2007). Повторяющиеся вставки и инверсии также могут локально подавлять CO и играть важную функциональную роль в организации генома (Dooner, 1986; Nacry et al. , 1998). Это проиллюстрировано подавлением CO в половых хромосомах, локусах типа спаривания и локусах самонесовместимости, где важно поддерживать связь между генами, необходимую для противоположных типов спаривания / несовместимости (Ferris and G динаф, 1994; Casselman et al. , 2000; Мин и Мур, 2007; Бергеро и Чарльзуорт, 2009).Следовательно, частота CO, вероятно, будет определяться комбинацией локальной последовательности ДНК, транс -факторов и эпигенетической информации.
Контроль развития мейотического клеточного цикла
Мейоз требует модификации контроля митотического клеточного цикла, так что за одной S-фазой следуют два последовательных цикла хромосомной сегрегации. Прогрессирование по клеточному циклу контролируется циклинами, которые взаимодействуют с циклин-зависимыми киназами (CDK) и активируют их, которые опосредуют ступенчатые переходы по циклу посредством фосфорилирования (Huntley and Murray, 1999).Несколько генов, участвующих в регуляции мейотической прогрессии, были идентифицированы в A . Талиана . Новый циклиноподобный ген SOLO DANCERS ( SDS ) специфически экспрессируется во время мейоза, а мутанты sds обнаруживают дефекты в спаривании хромосом, сегрегации и CO (Azumi et al. , 2002). Недавно было обнаружено, что мутанты sds образуют DSB, но эффективно восстанавливают их, скорее всего, посредством RAD51-опосредованной межсестринской репарации (De Muyt et al., 2009). Новый ген ОТСУТСТВИЕ ВТОРОГО ДЕЛЕНИЯ1 ( OSD1 ) необходим для мейоза-II, а osd1 продуцирует диплоидные диадные продукты мейоза вместо гаплоидных тетрад (d’Erfurth et al. , 2009). Чувствительный к температуре аллель замены CYCLINA1; 2 , названный поздним асинхронным мейозом1 ( tam1 ), вызывает задержку мейотической прогрессии, что также приводит к образованию диад (Magnard et al. , 2001; Wang et al. al., 2004). Регуляция стабильности белков имеет решающее значение для контроля клеточного цикла, и SKP1-подобные F-бокс-белки действуют, способствуя убиквитинизации и разрушению белков-мишеней, включая циклины (Bai et al. , 1996). Соответственно, мутации в гене , родственном SKP1 ASK1 , обнаруживают дефекты сегрегации мейотических хромосом (Yang et al. , 1999, a ; Zhao et al. , 2006). У животных контрольные точки клеточного цикла заставляют более поздние события зависеть от завершения более ранних событий (Murakami and Nurse, 1999).Механизмы контрольных точек мейоза не были генетически определены в A . thaliana , хотя msh5 и asy1 обнаруживают значительную задержку мейоза, предполагая обратную связь по регуляции мейотической прогрессии (Higgins et al. , 2004; Sanchez-Moran et al. , 2007). Вместе эти результаты демонстрируют, что дефекты развития клеточного цикла могут нарушать мейоз.
Ключевые ранние события в мейозе — это идентификация гомологичных хромосомных партнеров, спаривание и образование синаптонемного комплекса (SC) (Page and Hawley, 2004).Идентификация гомологичного партнера происходит по неизвестным механизмам во время профазы-I. У полиплоидных видов спаривание является сложным, поскольку гомологи также должны избегать спаривания с родственными гомеологами (Martinez-Perez et al. , 1999). Например, в гексаплоидной пшенице Ph2 влияет на строгость распознавания гомолога / гомеолога, влияя на ремоделирование хроматина, связанное со спариванием и локализацией SC-компонента ASY1 (Martinez-Perez et al. , 1999; Prieto et al., 2004, 2005; Boden et al. , 2009). Ph2 картируется в повторяющийся локус, содержащий гены киназ, зависимых от клеточного цикла, что вызывает подавление несвязанных генов CDK (Griffiths et al. , 2006; Al-Kaff et al. , 2008). Поскольку родственные гены CDK у млекопитающих влияют на мейотическую прогрессию, транс -замалчивание CDK с помощью Ph2 может приводить к изменениям в спаривании гомологов (Ortega et al. , 2003).Сопряжение может зависеть от формирования DSB, как в A . thaliana или может происходить через ахиазматические механизмы, как у самок Drosophila melanogaster (Grelon et al. , 2001; Page and Hawley, 2004). SWITCh2 / DYAD кодирует новый белок, экспрессируемый во время профазы-I, необходимый для спаривания хромосом, синапсиса и рекомбинации, а у мутантов swi1 / dyad униваленты сегрегируют в мейозе-I. Исследования гомолога кукурузы, AMEIOTIC1 , показывают, что эти функции сохраняются у покрытосеменных (Голубовская et al., 1993; Mercier et al. , 2001, 2003; Agashe et al. , 2002; Рави и др. , 2008; Pawlowski et al. , 2009). ПОЛНЫЙ ГОМОЛОГИЧЕСКИЙ СИНАПСИС1 кодирует второй новый белок, необходимый для спаривания хромосом и синапсиса, который вызывает высокие уровни негомологичного спаривания при мутации (Pawlowski et al. , 2004; Ronceret et al. , 2009).
Совпадая со спариванием, SC образуется между гомологичными хромосомами (Page and Hawley, 2004) и компонентами SC, идентифицированными в A . thaliana включает ASYNAPTIC1 ( ASY1 ), ZYP1A , ZYP1B , SCC3 и REC8 / DIF1 / SYN1 (Bai et al., и др., , 1999; Кэрил и др. , 2000; Армстронг и др. , 2002; Цай и др. , 2003; Челышева и др. , 2005; Хиггинс и др. , 2005). ASY1 и ZYP1 обнаруживают отдаленную идентичность с животными белками HOP1 и ZIP1 SC, соответственно (Caryl et al., 2000; Армстронг и др. , 2002; Higgins et al. , 2005). Потеря белков SC вызывает нарушения в синапсисе и образовании CO и может привести к одновалентной сегрегации и фрагментации хромосом (Bai et al. , 1999; Bhatt et al. , 1999; Caryl et al. , 2000; Armstrong и др., , 2002; Cai и др., , 2003; Челышева, и др., , 2005; Хиггинс, и др., , 2005). Интересно, что увеличение частоты CO связано с увеличением общей длины SC по неизвестному механизму (Lynn et al., 2002; Drouaud et al. , 2007). Эти генетические механизмы позволяют по-новому взглянуть на взаимосвязанные процессы распознавания гомологов, образования пар и синапсов у растений.
Правильные паттерны сегрегации хромосом необходимы для создания сбалансированных гамет и зависят от регуляции SC и сцепления хромосом. Во время митоза когезиновый комплекс удерживает сестринские хроматиды вместе до тех пор, пока субъединица SCC1 не будет расщеплена SEPERASE1 в анафазе, что обеспечит сегрегацию хромосом (Uhlmann et al., 1999). REC8 / DIF1 / SYN1 является специфичным для мейоза ортологом SCC1, а мутант rec8 / dif1 / syn1 нарушает нормальную SC локализацию SCC3 (субъединица когезина, общая с митозом) (Bhatt et al. , 1999; Cai et al. др. , 2003; Челышева и др. , 2005). Как и в системах животных, A . thaliana REC8 расщепляется цистеиновой протеазой SEPERASE1 (ESP1) (Liu and Makaroff, 2006). Сплоченность в плечах хромосом высвобождается с помощью ESP1 в анафазе-I, но сохраняется в центромерах до анафазы-II (Liu and Makaroff, 2006).У кукурузы центромера REC8 / AFD1 защищена от разрушения ESP1 консервативным белком Shugoshin (SGO1) во время анафазы-I (Hamant et al. , 2005; Watanabe, 2005). Затем SGO1 удаляется, а REC8 разрушается в центромере во время анафазы-II, что обеспечивает расщепление хроматид. Таким образом, для правильных паттернов сегрегации и рекомбинации мейотических хромосом необходимо поэтапное образование и удаление связей между гомологами.
Контекст развития мейоза
Успешное завершение мейозного и полового жизненных циклов зависит от активации мейотического клеточного цикла в правильное время и место развития.У многих животных отделение выделенной линии зародышевых клеток от типов соматических клеток происходит во время эмбриогенеза, различие, не наблюдаемое в некоторых ранних расходящихся линиях животных и растений (Gilbert, 1994; Dickinson and Grant-Dadowon, 2009). В сестринских группах водорослей для высадки растений одноклеточные зиготы претерпевают мейоз сразу после оплодотворения (рис. 2А). Напротив, у всех наземных растений митотические подразделения предшествуют оплодотворению и мейозу, а мейоз происходит после периода диплоидного развития в специализированных структурах, называемых спорангиями, которые продуцируют многочисленные споры (Bower, 1935; Becker and Marin, 2009).Инициирование путей развития спорангиев часто следует за переключением идентичности меристемы с вегетативной на репродуктивную судьбу (Steeves and Sussex, 1989). Расположение и структура спорангиев варьируются в зависимости от группы растений и связаны с их вторичными функциями, а именно с распространением спор и питанием. Гетероморфные спорангии и споры эволюционировали в сосудистых растениях конвергентно и ассоциировали со специализированными функциями (рис. 2). Женские мегаспорангии имеют меньшее количество более крупных спор (мегаспор), которые могут оставаться внутри родительского растения после оплодотворения, тогда как мужские микроспорангии образуют множество мелких спор (микроспор), которые выполняют функцию рассеивания (Bower, 1935).Пол также может влиять на частоту CO (Drouaud et al. , 2007). Таким образом, инициация и прогрессирование мейоза зависят от особенностей развития ткани, в которой он активируется, что обсуждается группой растений ниже.
Рис. 2.
Филогенетическое распределение признаков, связанных с мейозом у растений. (A) Филогенетические отношения между основными группами растений, показывающими синапоморфии, связанные с мейозом. Гетероспоры имеют полифилетическое происхождение у ликофитов, монилофитов и сперматофитов, обозначенных звездочками.(B) Репродуктивные структуры представителей клад, показанных на (A), и вымершие ископаемые формы протрахеофитов. 1. Электронная микрофотография зигоспор Chlamydomonas monoica (фотография любезно предоставлена профессором Карен П. Ван Винкль-Свифт и с любезного разрешения John Wiley and Sons: см. VanWinkle-Swift KP, Rickoll WL. 1997. Зигоспорная стенка Chlamydomonas monoica (Chlorophyceae): морфогенез и доказательства присутствия спорополленина 1. Journal of Phycology 33, 655–665.) 2. Световая микрофотография гаплоидного растения и оогониума (вставка) у харофитной водоросли Chara sp. 3. Ползучий гаплоидный слоевище и диплоидный прямостоячий и детерминированный спорофит Pellia epiphylla (фотографии мохообразных любезно предоставлены Ли Чжан). 4. Гаплоидный листовой гаметофит Atrichum angustatum , несущий диплоидные неразветвленные детерминантные спорофиты. 5. Гаплоидное стелющееся слоевище Folioceros sp. с прямостоячими индетерминантными спорофитами. 6.Ископаемое спорофтье Cooksonia sp. показывает ветвление с терминальными спорангиями (фото любезно предоставлено Дженни Моррис и Дайан Эдвардс). 7. Ископаемый спорофит Zosterophyllum с боковыми спорангиями (фото любезно предоставлено Дженни Моррис и Дайан Эдвардс). 8. Спорофит Selaginella kraussiana , демонстрирующий вегетативное ветвление, неразветвленный репродуктивный стробил, а также мега- и микроспорангий (вставка). 9. Спорангии образовались на стебле Psilotum nudum .10. Вайя Adiantum mairisi , показывающая краевые сори, содержащие спорангии. 11. Концевые конусы Cupressus sp. содержащие мега- и микроспорангии. 12. Тычинки и плодолистики растения Magnolia sp. цветок, содержащий соответственно микро- и мегаспорангии.
Рис. 2.
Филогенетическое распределение признаков, связанных с мейозом у растений. (A) Филогенетические отношения между основными группами растений, показывающими синапоморфии, связанные с мейозом.Гетероспоры имеют полифилетическое происхождение у ликофитов, монилофитов и сперматофитов, обозначенных звездочками. (B) Репродуктивные структуры представителей клад, показанных на (A), и вымершие ископаемые формы протрахеофитов. 1. Электронная микрофотография зигоспор Chlamydomonas monoica (фотография любезно предоставлена профессором Карен П. Ван Винкль-Свифт и с любезного разрешения John Wiley and Sons: см. VanWinkle-Swift KP, Rickoll WL. 1997. Зигоспорная стенка Chlamydomonas monoica (Chlorophyceae): морфогенез и доказательства присутствия спорополленина1.Journal of Phycology 33, 655–665.) 2. Световая микрофотография гаплоидного растения и оогониума (вставка) харофитной водоросли Chara sp. 3. Ползучий гаплоидный слоевище и диплоидный прямостоячий и детерминированный спорофит Pellia epiphylla (фотографии мохообразных любезно предоставлены Ли Чжан). 4. Гаплоидный листовой гаметофит Atrichum angustatum , несущий диплоидные неразветвленные детерминантные спорофиты. 5. Гаплоидное стелющееся слоевище Folioceros sp. с прямостоячими индетерминантными спорофитами.6. Ископаемое спорофтье Cooksonia sp. показывает ветвление с терминальными спорангиями (фото любезно предоставлено Дженни Моррис и Дайан Эдвардс). 7. Ископаемый спорофит Zosterophyllum с боковыми спорангиями (фото любезно предоставлено Дженни Моррис и Дайан Эдвардс). 8. Спорофит Selaginella kraussiana , демонстрирующий вегетативное ветвление, неразветвленный репродуктивный стробил, а также мега- и микроспорангий (вставка). 9. Спорангии образовались на стебле Psilotum nudum .10. Вайя Adiantum mairisi , показывающая краевые сори, содержащие спорангии. 11. Концевые конусы Cupressus sp. содержащие мега- и микроспорангии. 12. Тычинки и плодолистики растения Magnolia sp. цветок, содержащий соответственно микро- и мегаспорангии.
Мейоз у хлорофитных и харофитных водорослей
В группах хлорофитов и харофитов, сестринских по отношению к наземным растениям водорослей, мейоз происходит сразу после оплодотворения (Becker and Marin, 2009).У одноклеточной хлорофитной водоросли Chlamydomonas reinhardtii два гаплоидных типа спаривания, плюс и минус , дифференцируются в гаметы, которые сливаются во время оплодотворения, образуя одноклеточную зиготу (рис. 2B) (Lee et al. , 2008). Идентичность гаметы плюс и минус определяется из локуса MATING-TYPE и требует накопления в цитоплазме белков гомеодомена классов BEL [GAMETE-SPECIFIC PLUS1 (GSP1)] и KNOX [GAMETE-SPECIFIC MINUS1 (GSM1)] соответственно (Феррис и Гуденаф, 1994; Ли и др., 2008). После оплодотворения GSP1 и GSM1 гетеродимеризуются, перемещаются в ядро и инициируют паттерны экспрессии зиготических генов (Lee et al. , 2008). Конститутивной экспрессии либо GSP1 , либо GSM1 в противоположном типе гамет достаточно для запуска развития зигот в отсутствие оплодотворения (Zhao et al. , 2001; Lee et al. , 2008). Стабильный C . reinhardtii диплоиды, которые не инициируют мейоз, также могут образовываться, и конститутивной экспрессии GSP1 / GSM1 вместе в этих клетках достаточно для индукции мейоза с нормальными паттернами рекомбинации (Lee et al., 2008). Это указывает на то, что белки гомеодомена GSP1 / GSM1 являются потенциальными триггерами мейоза у хлорофитных водорослей. В отличие от хлорофитов, харофиты имеют многоклеточное гаплоидное тело, которое генерирует свободно плавающие сперматозоиды в антеридиях и яйцеклетках, которые сохраняются в оогониуме родительского растения (рис. 2B). Задержка яиц (оогамия) — это инновация, присущая наземным растениям, которая, как считается, была ключевой адаптацией в их эволюции (McCourt et al. , 2004). Поскольку в настоящее время нет генетических моделей харофитов, потенциальные роли генов KNOX / BEL не изучены, а инициация мейоза у харофитов происходит через неизвестный механизм.
Развитие спорофитов и мейоз мохообразных
В отличие от своих собратьев по водорослям, все наземные растения имеют период многоклеточного диплоидного роста, степень которого варьируется в зависимости от группы растений (Lewis and McCourt, 2004; McCourt et al. , 2004; Becker and Marin, 2009). Сестринские группы мохообразных сосудистых растений демонстрируют ограниченное постэмбриональное развитие без неопределенного апикального роста (Mishler and Churchill, 1985; Shaw and Renzaglia, 2004; Donoghue, 2005).Спорофиты состоят из небольшого одиночного стебля с концевым спорангием, который представляет собой простейший базальный план тела наземного растения (Kenrick, 2002; Donoghue, 2005; Qiu et al. , 2006; Boyce, 2008) (рис. 2). У печеночников и мхов развитие спорангиев останавливает диплоидный рост, тогда как спорофиты роголистника вносят свой вклад в собственное питание и имеют спорангии, которые неопределенно растут из базальной меристемы (Boyce, 2008; Kato and Akiyama, 2005). Слой субэпидермальных арчеспориальных клеток определяется во время развития спорангиев и делится посредством мейоза с образованием спор (мхи) или споровых материнских клеток и вкраплений более высоких клеток, которые выполняют питательные или распределительные функции (печеночники и роголистники).Ткани, окружающие слой арчеспориальных клеток, выполняют распределительные функции, характерные для каждой группы мохообразных (Bower, 1935). Генетические механизмы и механизмы развития, которые регулируют развитие спорофитов мохообразных, в настоящее время плохо изучены, но в последнее время интерес усилился в связи с созданием моделей мха ( Physcomitrella patens ) и печеночника ( Marchantia polymorpha ) (Ishizaki et al. , 2008). ; Ренсинг, 2008). Два класса генов, которые влияют на развитие спорангии в P . патента являются гомологами A . thaliana LEAFY ( LFY ) и KNOX гены (Champagne and Ashton, 2001; Tanahashi et al. , 2005; Sakakibara et al. , 2008). Пара гомологов LFY избыточно контролирует первое зиготическое деление в P . Patens и двойные мутанты обнаруживают задержку развития зигот (Tanahashi et al. , 2005). У мутантов, которые не арестовываются, нарушается количество, инициация и развитие спорангиев.Эти дефекты могут возникать как следствие аномального развития спорофитов, хотя количество спор и их прорастание также сильно варьируют у мутантов, что указывает на дефекты мейоза (Tanahashi et al. , 2005). Аналогично мутанты класса I KNOX в P . патента имеют аномальные спорангии и уменьшенное количество спор (Sano et al. , 2005; Sakakibara et al. , 2008). Интересно, что экспрессия KNOX специфична для спорофитов в P . patens (Champagne and Ashton, 2001; Sakakibara et al. , 2008), и еще предстоит изучить потенциальную роль генов KNOX и BEL в развитии диплоидов между водорослями и мохообразными.
Протрахеофиты и сестринские группы семенных растений
Ключевые особенности, которые отличают сосудистые растения от мохообразных, — это формирование неопределенно растущего и ветвящегося диплоидного тела (Mishler and Churchill, 1985; Donoghue, 2005; Langdale and Harrison, 2008).Ископаемые растения, форма которых не представлена в живых растениях, такие как Cooksonia , имеют низкий порядок ветвления и могут иметь увеличенное количество спор за счет увеличения числа концевых спорангиев (рис. 2B) (Edwards and Feehan, 1980; Graham et al. , 2000; Донохью, 2005; Герриенн и др. , 2006). Эти окаменелости поднимают интересные вопросы о природе ассоциации между развитием оси, развитием спорангии и ветвлением, и, что любопытно, редкие ветвящиеся мутанты мохообразных поразительно напоминают спорофиты Cooksonia (рис.2Б). Альтернативные латеральные положения спорангиев кажутся независимыми от ветвления и, возможно, служили той же цели в других группах окаменелостей (Рис. 2B). Такое расположение проявляется у современных ликофитов, и спорангии возникают либо у основания листьев, либо от стебля через один или два субэпидермальных слоя арчеспориальных клеток. Эти археспориальные клетки дают начало спорогенной ткани ( Lycopodium ) или спорогенным и тапетальным тканям ( Selaginella , Isoetes ) (Bower, 1935).Спорангии монилофитов разнообразны по размеру, количеству спор, образующихся на спорангий, а также их количеству и положению на растении (рис. 2В). Базальная разновидность монилофитов, включающая мараттиоидные папоротники, хвощи, офиоглоссоидные папоротники и венчиковые папоротники, обладают спорангиями, которые развиваются из нескольких клеток и производят тысячи спор (Bower, 1935; Wagner, 1977; Parkinson, 1987; Pryer et al. , 2004). ). Напротив, лептоспорангиатные папоротники развивают многочисленные маленькие спорангии из отдельных клеток, которые обычно содержат десятки спор (Bower, 1935; Pryer et al., 2004). Спорангии могут иметь терминальные, адаксиальные, абаксиальные или краевые участки на листьях (рис. 2В). За исключением лептоспорангиатных и венечных папоротников, питательные ткани тапетала возникают из неспорогенных тканей (Bower, 1935; Parkinson, 1987). Как и у мохообразных, генетическая основа диплоидного развития у ликофитов и монилофитов слабо охарактеризована. Примечательно, что экспрессия спорофитов KNOX является консервативной, а домены меристематической экспрессии предполагают вероятную роль в неопределенном росте (Bharathan et al., 2002; Харрисон и др. , 2005; Sano et al. , 2005), хотя репродуктивные роли еще не исследованы. Таким образом, структура и функции распространения спорангиев широко варьируются в зависимости от наземных растений, и контекст развития для инициации мейоза зависит от линии. Очевидна эволюционная тенденция к увеличению числа спор за счет изменений в плане тела, размере спорангиев и количестве спорангиев (Bower, 1935).
Развитие спорофитов семенных растений
У семенных растений (голосеменных и покрытосеменных) продолжительный период вегетативного роста сменяется репродуктивным переходом.Этот переход включает изменение идентичности меристемы и приводит к развитию шишек или цветков (Steeves and Sussex, 1989). Семена развиваются в контексте семяпочки после оплодотворения женской яйцеклетки мужским сперматозоидом, перенесенным в пыльцу, таким образом, функции распределения обеспечивают как гаплоидная пыльца, так и диплоидное семя. Семяпочки являются местом развития мегаспорангия (нуцеллуса), предшествующего мейозу. В то время как у голосеменных от одной до нескольких нуцеллярных клеток вступает в мейоз, у покрытосеменных одна материнская клетка мегаспоры подвергается мейозу с образованием тетрады, три члена которой дегенерируют с образованием единой функциональной мегаспоры, которая митотически делится с образованием зародышевого мешка (Campbell, 1940; Colombo et al., 2008). Развитие пыльцевого мешка (микроспорангия) происходит из микроспорофилла или в пыльнике голосеменных и покрытосеменных растений соответственно. В обоих случаях субэпидермальные клетки определяются как археспориальные клетки, которые делятся периклинально с образованием слоя париетальных клеток, окружающих спорогенные клетки (Campbell, 1940; Feng and Dickinson, 2007). Затем спорогенные клетки могут либо напрямую проникать в мейоз, либо продолжать пролиферировать. Париетальные клетки далее делятся с образованием переменного числа концентрически расположенных клеточных слоев, самый внутренний из которых дифференцируется в питательный тапетум (Campbell, 1940; Feng and Dickinson, 2007).Во время мейоза спорогенные клетки заключаются в непроницаемую стенку каллозы ((1-3) -β-D-глюкана), которая позже разрушается, когда высвобождаются члены тетрад микроспор (Gifford and Foster, 1988). Каллоза, по-видимому, играет важную роль в спорогенезе, поскольку тапетальная экспрессия каллазы вызывает мужскую стерильность в табаке (Worrall et al. , 1992). После мейоза образующиеся гаплоидные микроспоры подвергаются митозу и дифференцируются в пыльцевые зерна.
Генетический контроль вегетативного развития, репродуктивного перехода и образования спорангиев хорошо изучен у покрытосеменных A . Талиана . Активность класса I гена KNOX SHOOTMERISTEMLESS ( STM) необходима для установления неопределенной меристемы (Long et al. , 1996), а STM и BREVIPEDICELLUS ( BP) действуют избыточно, чтобы поддерживать неопределенность и подавлять детерминированное развитие листа (Byrne et al. , 2002). Белки KNOX класса I способствуют неопределенности путем димеризации с факторами транскрипции BEL и тройным bellringer , poundfoolish , Arabidopsis thaliana homeobox1 BEL мутантами phenocopy stm мутантами (Rutjens et al., 2009). Таким образом, в A . Гены thaliana KNOX и BEL играют ключевую роль в формировании диплоидного тела, обеспечивая контекст для более позднего репродуктивного развития и мейоза. Развитие цветков следует за превращением индетерминантных вегетативных меристем побегов в репродуктивные судьбы. Это переключение контролируется большой сетью генов, обеспечивающих координацию воспроизводства с условиями окружающей среды и развития (Baurle and Dean, 2006). Эти сигнальные пути сходятся на ключевом наборе факторов транскрипции, необходимых для идентичности меристемы цветков, включая LEAFY и APETALA1 (Baurle and Dean, 2006).Гены идентичности цветочных органов кодируют три функциональных класса факторов транскрипции MADS-бокса (A, B и C), которые экспрессируются в перекрывающихся доменах, чтобы определить четыре типа цветочных органов (Coen and Meyerowitz, 1991). Идентичность тычинок требует перекрывающейся экспрессии генов MADS классов B и C PISTILLATA и APETALA3 и AGAMOUS ( AG ) (Yanofsky et al. , 1990; Jack et al. , 1992; Goto и Мейеровиц, 1994). Идентичность Carpel требует активности гена C класса AG , который действует в сочетании с тремя дополнительными белками MADS, SEEDSTICK, SHATTERPROOF1 и SHATTERPROOF2 для определения идентичности яйцеклетки (Yanofsky et al., 1990; Pinyopich et al. , 2003). Гены KNOX STM и KNAT2 и BEL1 гены также играют роль в спецификации идентичности плодолистиков и семяпочек (Modrusan et al. , 1994; Pautot et al. , 2001; Scofield ; Scofield и др., , 2007). Таким образом, гены, участвующие в идентичности меристемы, также играют роль в спецификации репродуктивной судьбы.
Как в микро-, так и в мегаспорангиях спецификация археспориальных клеток предшествует образованию спорангиев (Gifford and Foster, 1988).Механизмы спецификации арчеспориальных клеток плохо изучены, но один ген, SPOROCYTELESS / NOZZLE ( SPL / NZZ ), функционирует непосредственно после гена идентичности органа класса C AG , способствуя спорогенезу (Schiefthaler et al. ). , 1999; Ян и др. , 1999 b ; Ито и др. , 2004). SPL — это ядерный белок с отдаленной гомологией с факторами транскрипции MADS-бокса, который выполняет неизвестную функцию (Schiefthaler et al., 1999; Ян и др. , 1999, b ). spl мутанты дифференцируют микроспорангиальные археспориальные клетки, которые делятся один раз, но не могут образовывать микроспороциты или тапетальные клетки, вызывая стерильность (Schiefthaler et al. , 1999; Yang et al. , 1999 b ). Мутанты spl / nzz также являются стерильными самками из-за дефектов нуцеллара, что означает, что археспориальные клетки не дифференцируются и мейоз не запускается (Schiefthaler et al., 1999; Ян и др. , 1999 б ). Эктопическая активация SPL у агамных мутантов достаточна для индукции развития стаминоидов и образования пыльцы (Ito et al. , 2004). Вместе это указывает на то, что SPL / NZZ выполняет вышестоящую мейотическую функцию как в мужском, так и женском развитии. Идентичность мужских спороцитов в A . thaliana также регулируется киназой рецептора с богатыми лейцином повторами (LRR) EXTRA SPOROGENOUS CELLS / EXCESS MICROSPOROCYTES1 (EXS / EMS1) в сочетании с его малым белковым лигандом TAPETUM DETERMINANT1 (TPD1) (Yang et al., 1999, b, , 2003; Canales et al. , 2002; Zhao et al. , 2002). Первое деление археспориальных клеток обычно отделяет судьбу репродуктивных спороцитов от судьбы нерепродуктивной стенки и тапетальных судеб. Развитие микроспорангии изменено у мутантов exs / ems1 и tpd1 , так что спорогенные клетки развиваются за счет тапетальных клеток (Yang et al. , 1999, b , 2003; Canales et al. , 2002; Zhao et al., 2002). Это означает, что передача сигналов киназы EXS / EMS1 важна либо для обеспечения тапетала, либо для репрессии идентичности спорогенных клеток. Хотя exs / ems1 мутации в A . thaliana демонстрируют нормальное мегаспорангиальное развитие, мутации в гомологе риса МНОЖЕСТВЕННЫЕ СПОРОЦИТЫ1 ( MSP1 ) обнаруживают сверхкомплектные спороциты как в пыльнике, так и в яйцеклетке, так же как и у множественных археспориальных клеток1 мутантных макроцитов Sheridan (). et al., 1996; Nonomura et al. , 2003). Интересно, что дополнительные киназы рецептора LRR также участвуют в правильной дифференцировке слоев клеток пыльника (Albrecht et al. , 2005; Colcombet et al. , 2005; Mizuno et al. , 2007; Hord et al. , 2008). Как эти сигнальные процессы организованы между типами клеток в развивающемся пыльнике, пока не ясно.
Перспективы на будущее
Генетические исследования развития в A . thaliana значительно продвинули наше понимание контекста, в котором возникает меоизис у растений. Будущие цели будут заключаться в том, чтобы связать воедино наше понимание контекста, инициации и развития мейоза в различных группах растений, чтобы потенциальные вариации могли быть переданы в селекцию. Во время диверсификации растений гены, которые, возможно, изначально участвовали в репродуктивном развитии, были адаптированы к путям вегетативного развития. В то время как белки KNOX / BEL могут запускать мейоз у хлорофитных водорослей, их роль в харофитах и большинстве мохообразных неизвестна, и, таким образом, точки функциональной диверсификации еще предстоит определить.Механизмы развития археспориальных клеток еще не полностью изучены у цветковых растений и неизвестны у нецветковых растений. Происхождение питательных тканей тапетала в различных группах растений может быть, а может и не быть независимым от археспориальных клонов. Было бы интересно проверить гомологию между типами археспориальных и тапетальных клеток путем тестирования функции гомологов SPL , EXS и TPD1 в разных клонах. Вырисовывается подробная картина механизмов, которые контролируют спаривание мейотических хромосом растений, синапсис, рекомбинацию и сегрегацию в A . Талиана . Понимание того, как эти механизмы интегрируются во время развития мейотического клеточного цикла, будет сложной задачей. Точно так же картина горячих и холодных точек CO сложна, и механизмы, которые определяют частоту CO в заводе, еще предстоит определить. Знание этих механизмов может позволить нацелить CO во время селекции сельскохозяйственных культур и облегчить создание новых высокоурожайных сельскохозяйственных культур.
Мы благодарим Королевское общество и Благотворительный фонд Гэтсби за финансирование, Карен Ван Винкл-Свифт, Василия Канцлера, Ли Чжан, Дженни Моррис и Дайан Эдвардс за фотографии и двух анонимных рецензентов за полезные комментарии к рукописи.
Список литературы
,,.Идентификация и анализ DYAD : гена, необходимого для организации мейотических хромосом и мейотической прогрессии самок у Arabidopsi s
,Development
,2002
, vol.129
(стр.3935
—3943
),,,,,,.Подробное рассечение хромосомной области, содержащей локус Ph2 , в пшенице Triticum asestivum : с делеционными мутантами и профилированием экспрессии
,Annals of Botany
,2008
, vol.101
(стр.863
—872
),,,,.Arabidopsis thaliana СОМАТИЧЕСКИЕ КИНАЗЫ ЭМБРИОГЕНЕЗА 1 и 2 контролируют мужской спорогенез
,The Plant Cell
,2005
, vol.17
(стр.3337
—3349
),.Дифференциальная синхронизация и контроль рекомбинации некроссовера и кроссовера во время мейоза
,Cell
,2001
, vol.106
(стр.47
—57
),,,.Asy1, белок, необходимый для синапсиса мейотических хромосом, локализуется в связанном с осью хроматине в Arabidopsis и Brassica
,Journal of Cell Science
,2002
, vol.115
(стр.3645
—3655
),,.Цитологический анализ Arabidopsis thaliana мейотических хромосом
,Методы молекулярной биологии
,2009
, vol.558
(стр.131
—145
),,,,,,.Взаимодействие гомологов во время профазы I мейоза у Arabidopsis требует наличия гена SOLO DANCERS , кодирующего новый циклиноподобный белок
,EMBO Journal
,2002
, vol.21
(стр.3081
—3095
),,,,,,.SKP1 соединяет регуляторы клеточного цикла с аппаратом протеолиза убиквитина через новый мотив, F-box
,Cell
,1996
, vol.86
(стр.263
—274
),,,,.Выделение и характеристика SYN1, гена, подобного RAD21, необходимого для мейоза у Arabidopsis
,The Plant Cell
,1999
, vol.11
(стр.417
—430
),.Время переходов в развитии растений
,Cell
,2006
, vol.125
(стр.655
—664
),.Стрептофиты и происхождение эмбриофитов
,Annals of Botany
,2009
, vol.103
(стр.999
—1004
),,,.Роль AtMUS81 в нечувствительных к помехам кроссоверах у
,A. thaliana. PLoS Genetics
,2007
,.Эволюция ограниченной рекомбинации в половых хромосомах
,Тенденции экологической эволюции
,2009
, т.24
(стр.94
—102
),,,,,.Гомологии в форме листа, полученные на основе экспрессии гена KNOXI во время развития
,Science
,2002
, vol.296
(стр.1858
—1860
),,.Мейоз растений: средство к 1N
,Trends in Plant Science
,2001
, vol.6
(стр.114
—121
),,,,,,,.Ген DIF1 Arabidopsis необходим для сегрегации мейотических хромосом и принадлежит к семейству генов когезина REC8 / RAD21
,The Plant Journal
,1999
, vol.19
(стр.463
—472
),,.Мейотические дефекты у мутанта Arabidopsis rad50 указывают на сохранение функции комплекса MRX на ранних стадиях мейотической рекомбинации
,Chromosoma
,2004
, vol.113
(стр.197
—203
),.Гомолог X rcc3 Arabidopsis играет важную роль в мейозе
,EMBO Journal
,2004
, vol.23
(стр.439
—449
),,,.TaASY1 способствует гомологичным хромосомным взаимодействиям, и на него влияет делеция Ph2
,The Plant Journal
,2009
, vol.57
(стр.487
—497
),,,,,.Триметилирование гистона h4 лизина 4 маркирует сайты инициации мейотической рекомбинации
,EMBO Journal
,2009
, vol.28
(стр.99
—111
),,.Кроссинговерная / некроссинговая дифференцировка, образование синаптонемных комплексов и регуляторный надзор за переходом лептотена / зиготена в мейоз
,Cell
,2004
, vol.117
(стр.29
—45
). ,Первобытные наземные растения, также известные как archegoniatae
,1935
Лондон
Macmillan and Co
.Насколько зеленым был Cooksonia ? Важность размера для понимания ранней эволюции физиологии в линии сосудистых растений
,Paleobiology
,2008
, vol.34
(стр.179
—194
),,,.Определенные модификации гистонов определяют инициацию и репарацию мейотической рекомбинации у мышей
,EMBO Journal
,2009
, vol.28
(стр.2616
—2624
),,.ASYMMETRIC LEAVES1 выявляет избыточность гена knox у Arabidopsis
,Development
,2002
, vol.129
(стр.1957
—1965
),,,.Белок когезина SYN1 арабидопсиса необходим для сцепления плеч сестринских хроматид и гомологичного спаривания хромосом
,Journal of Cell Science
,2003
, vol.116
(стр.2999
—3007
).,Эволюция наземных растений (зародыши)
,1940
Стэнфорд, Калифорния
Stanford University Press
,,,.EXS, предполагаемая киназа рецептора LRR, регулирует количество мужских клеток зародышевой линии и идентичность тапеталов и способствует развитию семян у Arabidopsis
,Current Biology
,2002
, vol.12
(стр.1718
—1727
),,,.Гомолог дрожжевого гена HOP1 инактивирован в мейотическом мутанте Arabidopsis asy1
,Chromosoma
,2000
, vol.109
(стр.62
—71
),,,,,,.Определение физических пределов локуса Brassica S с помощью рекомбинационного анализа
,The Plant Cell
,2000
, vol.12
(стр.23
—33
).Происхождение механизма рекомбинации и пола
,Наследственность
,2002
, т.88
(стр.125
—141
),.Происхождение генов KNOX, выявленное по гомологам мохообразных ( Physcomitrella patens )
,New Phytologist
,2001
, vol.150
(стр.23
—36
),,, и др.AtREC8 и AtSCC3 необходимы для монополярной ориентации кинетохор во время мейоза
,Journal of Cell Science
,2005
, vol.118
(стр.4621
—4632
),,,,,.Zip4 / Spo22 требуется для образования СО класса I, но не для завершения синапсиса у
,Arabidopsis thaliana. PLoS Genetics
,2007
, т.3
стр.e83
,,,,.Ген Arabidopsis ROCK-N-ROLLERS кодирует гомолог дрожжевой АТФ-зависимой ДНК-геликазы MER3 и необходим для нормального образования мейотического кроссовера.
,The Plant Journal
,2005
, vol.43
(стр.321
—334
),.Война завитков: генетические взаимодействия, контролирующие развитие цветов
,Nature
,1991
, vol.353
(стр.31
—37
),,,,.КИНАЗЫ РЕЦЕПТОРОВ СОМАТИЧЕСКОГО ЭМБРИОГЕНЕЗА Arabidopsis 1 и 2 необходимы для развития тапетума и созревания микроспор
,The Plant Cell
,2005
, vol.17
(стр.3350
—3361
),,.Развитие семяпочки Arabidopsis и ее эволюционное сохранение
,Тенденции в растениеводстве
,2008
, vol.13
(стр.444
—450
),,.Анализ рекомбинации по всему геному и функций центромер с тетрадами Arabidopsis
,Proceedings of the National Academy of Sciences, USA
,1998
, vol.95
(стр.247
—252
),,.Кроссовер-интерференция у Arabidopsis
,Genetics
,2002
, vol.160
(стр.1631
—1639
),,, и др.Генетическое определение и анализ последовательности центромер Arabidopsis
,Science
,1999
, vol.286
(стр.2468
—2474
),,,,,.Случайная сегрегация хромосом без остановки мейоза как в мужских, так и в женских мейоцитах мутанта dmc1 Arabidopsis
,The Plant Cell
,1999
, vol.11
(стр.1623
—1634
)d’Erfurth I, Jolivet S, Froger N, Catrice O, Novatchkova M, Mercier R
.Превращение мейоза в митоз
,PLoS Biology
,2009
« и др.Высокопроизводительный генетический скрининг выявляет новые функции ранней мейотической рекомбинации у
,Arabidopsis thaliana. PLoS Genetics
,2009
,,,,,.AtPRD1 необходим для образования мейотического двухцепочечного разрыва у Arabidopsis thaliana
,EMBO Journal
,2007
, vol.26
(стр.4126
—4137
),.miwi, мышиный гомолог piwi, кодирует цитоплазматический белок, необходимый для сперматогенеза
,Developmental Cell
,2002
, vol.2
(стр.819
—830
),.Преодоление разрыва между поколениями: гаметофиты цветущих растений и зародышевые линии животных обнаруживают неожиданное сходство
,Biological Review of the Cambridge Philosophical Socicety
,2009
, vol.84
(стр.589
—615
).Ключевые инновации, конвергенция и успех: макроэволюционные уроки филогении растений
,Палеобиология
,2005
, vol.31
(стр.77
—93
).Генетическая тонкая структура локуса BRONZE кукурузы
,Genetics
,1986
, т.113
(стр.1021
—1036
),.Рекомбинация происходит равномерно внутри гена бронзы, горячей точки мейотической рекомбинации в геноме кукурузы
,The Plant Cell
,1997
, vol.9
(стр.1633
—1646
),,, и др.Вариация скорости кроссинговера по хромосоме 4 Arabidopsis thaliana показывает наличие «горячих точек» мейотической рекомбинации
,Genome Research
,2006
, vol.16
(стр.106
—114
),,,,,,,,.Распределение кроссоверов по полу и вариации в уровне интерференции по хромосоме 4 Arabidopsis thaliana
,PLoS Genetics
,2007
, vol.3
стр.e106
,.Записи спорангиев типа Cooksonia из поздних слоев Венлока в Ирландии
,Nature
,1980
, vol.287
(стр.41
—42
),.Упаковка мужской зародышевой линии растений
,Тенденции в генетике
,2007
, vol.23
(стр.503
—510
),.Локус типа спаривания Chlamydomonas reinhardtii содержит сильно реаранжированные последовательности ДНК
,Cell
,1994
, vol.76
(стр.1135
—1145
),,,,,.Высокорекомбиногенный локус bz расположен в необычно богатой генами области генома кукурузы
,Proceedings of the National Academy of Sciences, USA
,2001
, vol.98
(стр.8903
—8908
),,.Скорости рекомбинации между соседними генными и ретротранспозонными областями кукурузы различаются на 2 порядка
,Proceedings of the National Academy of Sciences, USA
,2002
, vol.99
(стр.1082
—1087
),,,,,.Исключительный образец раннего наземного растения Cooksonia paranensis и гипотеза жизненного цикла самых ранних эвтрахеофитов
,Review of Palaeobotany and Palynology
,2006
, vol.142
(стр.123
—130
),. ,Морфология и эволюция сосудистых растений
,1988
Нью-Йорк
WH Freeman and Company
.,Биология развития
,1994
Сандерленд, Массачусетс, США
Sinauer Associates
,,,.Роль гена ameiotic1 в инициации мейоза и в последующих мейотических событиях у кукурузы
,Genetics
,1993
, vol.135
(стр.1151
—1166
),.Функция и регуляция гена цветочного гомеоза Arabidopsis PISTILLATA
,Genes and Development
,1994
, vol.8
(стр.1548
—1560
),,.Происхождение растений: изменения строения тела, способствующие серьезному эволюционному излучению
,Proceedings of the National Academy of Sciences, USA
,2000
, vol.97
(стр.4535
—4540
),,,.AtSPO11-1 необходим для эффективной мейотической рекомбинации у растений
,EMBO Journal
,2001
, vol.20
(стр.589
—600
),,,,,,,.Молекулярная характеристика Ph2 как основного локуса спаривания хромосом в полиплоидной пшенице
,Nature
,2006
, vol.439
(стр.749
—752
),,,,,,,.REC8-зависимое растение Shugoshin требуется для поддержания центромерной когезии во время мейоза и не имеет митотических функций
,Current Biology
,2005
, vol.15
(стр.948
—954
),,.Генетика мейотической профазы I у растений
,Annual Review of Plant Biology
,2006
, vol.57
(стр.267
—302
),,,,,.Независимое задействование консервативного механизма развития во время эволюции листа
,Nature
,2005
, vol.434
(стр.509
—514
),,,,,.Каталитически активные остатки тирозина как SPO11-1, так и SPO11-2 необходимы для индукции двухцепочечного разрыва мейоза в Arabidopsis
,The Plant Cell
,2007
, vol.19
(стр.3090
—3099
),,,.Гомолог Arabidopsis MutS AtMSh5 функционирует на ранней стадии рекомбинации: доказательства двух классов рекомбинации у Arabidopsis
,Genes and Development
,2004
, vol.18
(стр.2557
—2570
),,,.Экспрессия и функциональный анализ AtMUS81 в мейозе Arabidopsis выявляет роль во втором пути кроссинговера
,The Plant Journal
,2008
, vol.54
(стр.152
—162
),,,,.Белок синаптонемного комплекса Arabidopsis ZYP1 необходим для синапсиса хромосом и нормальной точности скрещивания
,Genes and Development
,2005
, vol.19
(стр.2488
—2500
),,,,,.AtMSH5 является партнером AtMSh5 в мейотическом перекрестном пути класса I в Arabidopsis thaliana , но не требуется для синапсов
,The Plant Journal
,2008
, vol.55
(стр.28
—39
),,,,,,.Регулирование развития ранних пыльников Arabidopsis с помощью митоген-активируемых протеинкиназ MPK3 и MPK6, а также ERECTA и родственных рецептор-подобных киназ
,Molecular Plant
,2008
, vol.1
(стр.645
—658
),.Клеточный цикл растений
,Current Opinion in Plant Biology
,1999
, vol.2
(стр.440
—446
),,,.Опосредованная Agrobacterium трансформация гаплоидной печеночника Marchantia plymorpha L. и новая модель для биологии растений
,Физиология растений и клетки
,2008
, vol.49
(стр.1084
—1091
),,,,,,,.Гомеотический белок AGAMOUS контролирует микроспорогенез путем регуляции SPOROCYTELESS
,Nature
,2004
, vol.430
(стр.356
—360
),,.Гомеотический ген APETALA3 из Arabidopsis thaliana кодирует MADS-бокс и экспрессируется в лепестках и тычинках
,Cell
,1992
, vol.68
(стр.683
—697
),,,,,.Снижение мейотических кроссоверов и задержка прогрессии профазы I у AtMLh4-дефицитных Arabidopsis
,EMBO Journal
,2006
, vol.25
(стр.1315
—1323
),.Интерполяционная гипотеза происхождения вегетативного спорофита наземных растений
,Таксон
,2005
, т.54
(стр.443
—450
). ,,.Теория телома
,Генетика развития и эволюция растений
,2002
Лондон
Тейлор и Фрэнсис
(стр.365
—387
),, и др.Гомолог Arabidopsis thaliana MND1 играет ключевую роль в мейотическом гомологичном спаривании, синапсисе и рекомбинации
,Journal of Cell Science
,2006
, vol.119
(стр.2486
—2496
),,,,,,,,.Спонтанные события нерасхождения MI и MII Х-хромосомы в ооцитах Drosophila melanogaster имеют разную рекомбинационную историю
,Nature Genetics
,1996
, vol.14
(стр.406
—414
),,, и др.Характеристика чувствительных конфигураций хиазмы, которые увеличивают риск материнского нерасхождения хромосомы 21
,Human Molecular Genetics
,1997
, vol.6
(стр.1391
—1399
),. .Переходы в развитии во время эволюции растений
,Пути эволюции: ключевые темы эволюционной биологии развития
,2008
Кембридж
Cambridge University Press
(стр.299
—319
),,,.Раннее половое происхождение гетеродимеризации гомеопротеинов и эволюция растений Семейство KNOX / BELL
,Cell
,2008
, vol.133
(стр.829
—840
).Зеленые водоросли и происхождение наземных растений
,Американский журнал ботаники
,2004
, vol.91
(стр.1535
—1556
),,,,,,.Ген AtRAD51 Arabidopsis необязателен для вегетативного развития, но необходим для мейоза
,Proceedings of the National Academy of Sciences, USA
,2004
, vol.101
(стр.10596
—10601
),,,,,,,,,.Мейотическая мутация мыши mei1 нарушает синапсис хромосом с сексуально диморфными последствиями для мейотической прогрессии
,Developmental Biology
,2002
, vol.242
(стр.174
—187
),,,,,,,,.Сайты вставки транспозона Mu и события мейотической рекомбинации совместно локализуются с эпигенетическими метками для открытого хроматина в геноме кукурузы
,PLoS Genetics
,2009
, vol.5
стр.e1000733
,.Arabidopsis separase AESP необходим для развития эмбриона и высвобождения когезина во время мейоза
,The Plant Cell
,2006
, vol.18
(стр.1213
—1225
),,,.Член класса гомеодоменных белков KNOTTED, кодируемых геном STM Arabidopsis
,Nature
,1996
, vol.379
(стр.66
—68
),,,,,,,,.Ковариация длины синаптонемного комплекса и скорости обмена мейоза у млекопитающих
,Science
,2002
, vol.296
(стр.2222
—2225
),,,,,,,,.SHOC1, белок, связанный с эндонуклеазой XPF, необходим для образования мейотических кроссоверов класса I.
,Current Biology
,2008
, vol.18
(стр.1432
—1437
),,,,.Ген Arabidopsis позднего асинхронного мейоза необходим для нормального темпа и синхронности деления клеток во время мужского мейоза
,Plant Physiology
,2001
, vol.127
(стр.1157
—1166
),,,.Протистские гомологи мейотического гена Spo11 и топоизомеразы VI раскрывают эволюционную историю дупликации гена и клон-специфической потери
,Molecular and Biological Evolution
,2007
, vol.24
(стр.2827
—2841
),.Подавление кроссинговера метилированием ДНК у
,Ascobolus. Гены и развитие
,1998
, т.12
(стр.1381
—1389
),,,,,.Гомологичное спаривание хромосом у пшеницы
,Journal of Cell Science
,1999
, vol.112
(стр.1761
—1769
),.Рекомбиназы Rad51 и Dmc1: неидентичные близнецовые отношения
,Trends in Biochemical Science
,2001
, vol.26
(стр.131
—136
),,.Происхождение харофитных водорослей и наземных растений
,Тенденции экологической эволюции
,2004
, vol.19
(стр.661
—666
),,.Синтез-зависимый отжиг цепей в мейозе
,PLoS Biology
,2007
, vol.5
стр.e299
,,,,,,,,.Мейотический белок SWI1 необходим для образования аксиальных элементов и инициации рекомбинации у Arabidopsis
,Development
,2003
, vol.130
(стр.3309
—3318
),, и др.Два класса мейотического кроссовера сосуществуют у Arabidopsis: один зависит от MER3, а другой — нет.
,Current Biology
,2005
, vol.15
(стр.692
—701
),,,,,,,.SWITCh2 (SWI1): новый белок, необходимый для установления когезии сестринских хроматид и для образования бивалентов в мейозе
,Genes and Development
,2001
, vol.15
(стр.1859
—1871
),,,.Дорога к кроссоверам: растения говорят
,Тенденции в генетике
,2007
, vol.23
(стр.91
—99
),.Геномика половых хромосом
,Current Opinion in Plant Biology
,2007
, vol.10
(стр.123
—130
),.Переход к наземной флоре: филогенетические взаимоотношения зеленых водорослей и мохообразных
,Кладистика
,1985
, т.1
(стр.305
—328
),,,,,,,.Рецептороподобная протеинкиназа 2 (RPK 2) — новый фактор, контролирующий развитие пыльников у Arabidopsis thaliana
,The Plant Journal
,2007
, vol.50
(стр.751
—766
),,,,.Гомеозная трансформация семяпочек в структуры, похожие на плодолистики у Arabidopsis
,The Plant Cell
,1994
, vol.6
(стр.333
—349
).Механизм скрещивания
,Американский натуралист
,1916
, т.50
(стр.193
—434
),.Контроль контрольных точек репликации мейотической ДНК у делящихся дрожжей
,Genes and Development
,1999
, vol.13
(стр.2581
—2593
),,,,.Основные хромосомные перестройки, индуцированные трансформацией Т-ДНК у Arabidopsis
,Genetics
,1998
, vol.149
(стр.641
—650
),,,,,,.Ген MSP1 необходим для ограничения количества клеток, вступающих в мужской и женский спорогенез, и для инициации форматина стенки пыльника у риса
,The Plant Cell
,2003
, vol.15
(стр.1728
—1739
),,,,,,.Новый ген ГОМОЛОГИЧЕСКАЯ АБЕРРАЦИЯ СПАР В МЕЙОЗЕ РИСА1 риса кодирует предполагаемый белок спиральной спирали, необходимый для гомологичного спаривания хромосом в мейозе
,The Plant Cell
,2004
, vol.16
(стр.1008
—1020
),,,,,,,,.Циклинзависимая киназа 2 необходима для мейоза, но не для деления митотических клеток у мышей
,Nature Genetics
,2003
, vol.35
(стр.25
—31
),,,,.Репликационный белок A (AtRPA1a) необходим для образования кроссовера класса I, но не требуется для репарации мейотических разрывов ДНК
,EMBO Journal
,2009
, vol.28
(стр.394
—404
),.Генетика и молекулярная биология синаптонемного комплекса
,Annual Review of Cell and Development Biology
,2004
, vol.20
(стр.525
—558
),,,,,,,,.At MND1 необходим для гомологичного спаривания во время мейоза у Arabidopsis
,BMC Molecular Biology
,2006
, vol.7
стр.24
.Тапетальная организация во время спорогенеза у Psilotum nudum
,Annals of Botany
,1987
, vol.60
(стр.353
—360
),,,,,,.KNAT2 : свидетельство связи между узловатыми генами и развитием плодолистиков
,The Plant Cell
,2001
, vol.13
(стр.1719
—1734
),,,,,.Координация мейотической рекомбинации, спаривания и синапсиса с помощью PHS1
,Science
,2004
, vol.303
(стр.89
—92
),,,,,,,,,.Кукуруза AMEIOTIC1 необходима для множественных ранних мейотических процессов и, вероятно, необходима для инициации мейоза
,Proceedings of the National Academy of Sciences, USA
,2009
, vol.106
(стр.3603
—3608
),,,,,,.Оценка избыточности генов MADS-бокса во время развития плодолистиков и семяпочек
,Nature
,2003
, vol.424
(стр.85
—88
),,.Контроль изменений конформации, связанных с узнаванием гомолога во время мейоза
,Теоретическая и прикладная генетика
,2005
, vol.111
(стр.505
—510
),,.Распознавание гомологов во время мейоза связано с изменением конформации хроматина
,Nature Cell Biology
,2004
, vol.6
(стр.906
—908
),,,,,.Филогения и эволюция папоротников (монилофитов) с акцентом на ранние лептоспорангиатные расхождения
,Американский журнал ботаники
,2004
, vol.91
(стр.1582
—1598
),,,,.Дефицит Mre11 у Arabidopsis связан с хромосомной нестабильностью в соматических клетках и Spo11-зависимой фрагментацией генома во время мейоза
,The Plant Cell
,2004
, vol.16
(стр.1968
—1978
),,, и др.Самые глубокие расхождения у наземных растений, выведенные из филогеномных данных
,Proceedings of the National Academy of Sciences, USA
,2006
, vol.103
(стр.15511
—15516
),,.Филогеномный перечень мейотических генов; доказательства пола у Giardia и раннего эукариотического происхождения мейоза
,Current Biology
,2005
, vol.15
(стр.185
—191
),,.Образование гамет без мейоза у Arabidopsis
,Nature
,2008
, vol.451
(стр.1121
—1124
).Геном Physcomitrella раскрывает эволюционное понимание завоевания земли растениями
,Science
,2008
, vol.319
(стр.64
—68
),,.Центромеры-проксимальные кроссоверы связаны с преждевременным разделением сестринских хроматид во время мейоза у Saccharomyces cerevisiae
,Genetics
,2006
, vol.174
(стр.1745
—1754
),,,.PHS регулирует мейотическую рекомбинацию и гомологичное спаривание, контролируя транспорт RAD50 к ядру
,Proceedings of the National Academy of Sciences, USA
,2009
, vol.106
(стр.20121
—20126
). ,Получение выгод: наука и устойчивое развитие мирового сельского хозяйства
,2009
Лондон
Королевское общество
,,,,,.Функция апикальной меристемы побегов у Arabidopsis требует комбинированной активности трех белков гомеодомена, подобных BEL1.
,The Plant Journal
,2009
, vol.58
(стр.641
—654
),,,,,.Подробные исследования рекомбинации вдоль хромосомы 3B дают новое представление о распределении кроссовера у пшеницы ( Triticum aestivum L.)
,Genetics
,2009
, vol.181
(стр.393
—403
),,,.Гены KNOX класса 1 не участвуют в развитии побегов у мха Physcomitrella patens , но действуют в развитии спорофитов
,Evolution and Development
,2008
, vol.10
(стр.555
—566
),,,.ASY1 опосредует AtDMC1-зависимую интергомологическую рекомбинацию во время мейоза у Arabidopsis
,Genes and Development
,2007
, vol.21
(стр.2220
—2233
),,,,,,.Гены гомеобоксаKNOX потенциально имеют сходные функции как в диплоидных одноклеточных, так и в многоклеточных меристемах, но не в гаплоидных меристемах
,Evolution and Development
,2005
, vol.7
(стр.69
—78
),,,,,.Молекулярный анализ NOZZLE , гена, участвующего в формировании паттерна и раннем спорогенезе во время развития половых органов у Arabidopsis thaliana
,Proceedings of the National Academy of Sciences, USA
,1999
, vol.96
(стр.11664
—11669
),, и др.Геном кукурузы B73: сложность, разнообразие и динамика
,Science
,2009
, vol.326
(стр.1112
—1115
),,,,.AHP2 необходим для образования бивалентов и сегрегации гомологичных хромосом в мейозе Arabidopsis
,The Plant Journal
,2003
, vol.36
(стр.1
—11
),,.Ген KNOX SHOOT MERISTEMLESS необходим для развития репродуктивных меристематических тканей у Arabidopsis
,The Plant Journal
,2007
, vol.50
(стр.767
—781
),.Филогения и диверсификация мохообразных
,Американский журнал ботаники
,2004
, т.91
(стр.1557
—1581
),,,,.Ген mac1 : контроль приверженности мейотическому пути у кукурузы
,Genetics
,1996
, vol.142
(стр.1009
—1020
),,,,,,,,.Arabidopsis SPO11-2 функционирует с SPO11-1 в мейотической рекомбинации
,The Plant Journal
,2006
, vol.48
(стр.206
—216
),. ,Модели в развитии растений
,1989
Кембридж, Великобритания
Cambridge University Press
.Поведение хромосом при изучении сцепления
,Zeitschrift für Induktive Abstammungs-u Vererbungslehre
,1915
, vol.13
(стр.234
—287
),.GEN1 / Yen1 и комплекс SLX4: решения проблемы разрешения соединения Холлидея
,Genes and Develoment
,2010
, vol.24
(стр.521
—536
),,,.Диверсификация функции гена: гомологи регулятора цветка FLO / LFY контролируют первое деление зиготических клеток у мха Physcomitrella patens
,Development
,2005
, vol.132
(стр.1727
—1736
),,,,,,,,,.Новый ген растения, необходимый для мейоза, связан с человеческим CtIP и дрожжевым COM1 / SAE2 геном
,EMBO Journal
,2007
, vol.26
(стр.5061
—5070
),,.Разделению сестринских хроматид в начале анафазы способствует расщепление субъединицы когезина Scc1
,Nature
,1999
, vol.400
(стр.37
—42
),,,,,,,.Взаимодействие RecA-родственных белков и комплекса MND1-HOP2 во время мейоза у Arabidopsis thaliana
,PLoS Genetics
,2007
, vol.3
(стр.1894
—1906
),.Откуда мейоз?
,Ячейка
,2001
, т.106
(стр.647
—650
).Систематические значения Psilotaceae
,Brittonia
,1977
, vol.29
(стр.54
—63
),,,.Прохождение мейоза I и мейоза II в пыльниках Arabidopsis регулируется циклином A-типа, преимущественно экспрессируемым в профазе I
,Plant Physiology
,2004
, vol.136
(стр.4127
—4135
).Шугошин: дух-хранитель центромеры
,Current Opinion in Cell Biology
,2005
, vol.17
(стр.590
—595
),,,,.Arabidopsis thaliana PARTING DANCERS Ген , кодирующий новый белок, необходим для нормальной мейотической гомологичной рекомбинации
,Molecular Biology of the Cell
,2006
, vol.17
(стр.1331
—1343
),,,,,.Преждевременное растворение каллозной стенки микроспороцитов вызывает мужскую стерильность у трансгенного табака
,The Plant Cell
,1992
, vol.4
(стр.759
—771
),,,,.Ген Arabidopsis SKP1-LIKE1 необходим для мужского мейоза и может контролировать разделение гомологов
,Proceedings of the National Academy of Sciences, USA
,1999
, vol.96
(стр.11416
—11421
),,,,,,,.Детерминант тапетума1 необходим для клеточной специализации пыльника Arabidopsis
,The Plant Cell
,2003
, vol.15
(стр.2792
—2804
),,,.Ген SPOROCYTELESS из Arabidopsis необходим для инициации спорогенеза и кодирует новый ядерный белок
,Genes and Development
,1999
, vol.13
(стр.2108
—2117
),,,,,.Белок, кодируемый гомеотическим геном Arabidopsis agamous , напоминает факторы транскрипции
,Nature
,1990
, vol.346
(стр.35
—39
),, и др.Полногеномное картирование с высоким разрешением и функциональный анализ метилирования ДНК у арабидопсиса
,Cell
,2006
, vol.126
(стр.1189
—1201
),,,,,,.ASK1, гомолог SKP1, необходим для ядерной реорганизации, пресинаптического сопоставления гомологов и правильного распределения когезина во время мейоза у Arabidopsis
,Plant Molecular Biology
,2006
, vol.62
(стр.99
—110
),,,.Избыток микроспороцитов1 Ген кодирует предполагаемую протеинкиназу рецептора с высоким содержанием лейцина, которая контролирует судьбу соматических и репродуктивных клеток в пыльнике Arabidopsis
,Genes and Development
,2002
, vol.16
(стр.2021
—2031
),,,.Эктопическая экспрессия Chlamydomonas mt + -специфического гомеодоменного белка в mt-гаметах инициирует развитие зиготы без слияния гамет
,Genes and Development
,2001
, vol.15
(стр.2767
—2777
),,,,.Полногеномный анализ метилирования ДНК Arabidopsis thaliana обнаруживает взаимозависимость между метилированием и транскрипцией
,Nature Genetics
,2007
, vol.39
(стр.61
—69
)© Автор [2010]. Опубликовано Oxford University Press [от имени Общества экспериментальной биологии]. Все права защищены.Для получения разрешений обращайтесь по электронной почте: [email protected]
.Хиазматический и ахиазматический инвертированный мейоз растений с холоцентрическими хромосомами
Марстон, А. Л. Хромосомная сегрегация у почкующихся дрожжей: сцепление сестринских хроматид и связанные механизмы. Genetics 196 , 31–63 (2014).
CAS PubMed PubMed Central Google Scholar
Макниколл, Ф., Стивенс, М. и Джессбергер, Р. Когезин в гаметогенезе. Curr. Вверх. Dev. Биол. 102 , 1–34 (2013).
CAS PubMed Google Scholar
Кини, S. Spo11 и образование двухцепочечных разрывов ДНК в мейозе. Genome Dyn. Stab. 2 , 81–123 (2008).
PubMed PubMed Central Google Scholar
Кини, С.И Нил, М. Дж. Инициирование мейотической рекомбинации путем образования двухцепочечных разрывов ДНК: механизм и регуляция. Biochem. Soc. Пер. 34 , 523–525 (2006).
CAS PubMed Google Scholar
Эдлингер Б. и Шлогельхофер П. Имеют разрыв: детерминанты образования и процессинга двухцепочечных разрывов (DSB) мейотической ДНК в растениях. J. Exp. Бот. 62 , 1545–1563 (2011).
CAS PubMed Google Scholar
Пейдж, С. Л. и Хоули, Р. С. Хромосомная хореография: мейотический балет. Science 301 , 785–789 (2003).
ADS CAS PubMed Google Scholar
де Бур, Э. и Хейтинг, С. Различная роль поперечных нитей синаптонемных комплексов в мейозе. Хромосома 115 , 220–234 (2006).
PubMed Google Scholar
Хамант, О., Ма, Х. и Канде, У. З. Генетика мейотической профазы I у растений. Annu. Rev. Plant Biol. 57 , 267–302 (2006).
CAS PubMed Google Scholar
Хантер Н. в книге « Молекулярная генетика рекомбинации» 381–442 Спрингер (2007).
МакКим, К.С.и другие. Мейотический синапсис при отсутствии рекомбинации. Science 279 , 876–878 (1998).
ADS CAS PubMed Google Scholar
Dernburg, A. F. et al. Мейотическая рекомбинация у C. elegans инициируется консервативным механизмом и не обязательна для гомологичных синапсов хромосом. Cell 94 , 387–398 (1998).
CAS PubMed Google Scholar
Филлипс, К.M. et al. Идентификация мотивов последовательности хромосом, которые обеспечивают мейотическое спаривание и синапсис в C. elegans . Nat. Клетка. Биол. 11 , 934–942 (2009).
CAS PubMed PubMed Central Google Scholar
Лейк, К. М. и Хоули, Р. С. Молекулярный контроль мейотического хромосомного поведения: события в ранней профазе мейоза в ооцитах Drosophila . Annu. Ред.Physiol. 74 , 425–451 (2012).
CAS PubMed Google Scholar
Hughes, S.E. et al. Гетерохроматические нити соединяют колеблющиеся хромосомы во время прометафазы I в ооцитах Drosophila . PLoS Genet. 5 , e1000348 (2009).
PubMed PubMed Central Google Scholar
Цай, Дж. Х., Yan, R. & McKee, B.D. Спаривание гомологов и сцепление сестринских хроматид в гетерохроматине у самцов мейоза Drosophila I. Хромосома 120 , 335–351 (2011).
CAS PubMed Google Scholar
Цай, Дж. Х. и Макки, Б. Д. Гомологическое спаривание и роль центров спаривания в мейозе. J. Cell Sci. 124 , 1955–1963 (2011).
CAS PubMed Google Scholar
Hauf, S.& Ватанабе, Ю. Ориентация кинетохор в митозе и мейозе. Cell 119 , 317–327 (2004).
CAS PubMed Google Scholar
Shao, T. et al. OsREC8 важен для сцепления хроматид и монополярной ориентации метафазы I в мейозе риса. Plant Physiol. 156 , 1386–1396 (2011).
CAS PubMed PubMed Central Google Scholar
Ван, М.и другие. OsSGO1 поддерживает стабилизацию синаптонемного комплекса в дополнение к защите центромерной когезии во время мейоза риса. Plant J. 67 , 583–594 (2011).
CAS PubMed Google Scholar
Монже-Касас, Ф., Прабху, В. Р., Ли, Б. Х., Боселли, М. и Амон, А. Ориентация кинетохор во время мейоза контролируется Авророй В и комплексом монополина. Cell 128 , 477–490 (2007).
CAS PubMed PubMed Central Google Scholar
Li, X. X. & Dawe, R.K. Слитые сестринские кинетохоры инициируют редукционное деление в мейозе I. Nat. Cell Biol. 11 , 1103 – U1122 (2009 г.).
CAS PubMed Google Scholar
Исигуро, Т., Танака, К., Сакуно, Т. и Ватанабе, Ю. Шугошин-PP2A противодействует казеин-киназе-1-зависимому расщеплению Rec8 путем сепарации. Nat. Cell Biol. 12 , 500–506 (2010).
CAS PubMed Google Scholar
Мола, Л. М. и Папески, А. Г. Краткий обзор голокинетических хромосом. J. Basic Appl. Genet. 16 , 1–4 (2006).
Google Scholar
Guerra, M. et al. Неоцентрики и холокинетики (холоцентрики): хромосомы вне центромерных правил. Cytogenet. Genome Res. 129 , 82–96 (2010).
CAS PubMed Google Scholar
Мелтерс, Д. П., Палиулис, Л. В., Корф, И. Ф. и Чан, С. В. Голоцентрические хромосомы: конвергентная эволюция, мейотические адаптации и геномный анализ. Chromosome Res. 20 , 579–593 (2012).
CAS PubMed Google Scholar
Дернбург, А.F. Здесь, там и везде: кинетохоры функционируют на холоцентрических хромосомах. J. Cell Biol. 153 , F33 – F38 (2001).
CAS PubMed PubMed Central Google Scholar
Шварцштейн, М., Виньял, С. М. и Вильнёв, А. М. Координация сплоченности, соориентации и конгресса во время мейоза: уроки голоцентрических хромосом. Genes Dev. 24 , 219–228 (2010).
CAS PubMed PubMed Central Google Scholar
Martinez-Perez, E. et al. Кроссоверы запускают ремоделирование состава оси мейотических хромосом, которое связано с двухступенчатой потерей сцепления сестринских хроматид. Genes Dev. 22 , 2886–2901 (2008).
CAS PubMed PubMed Central Google Scholar
Wignall, S.М. и Вильнев, А. М. Боковые пучки микротрубочек способствуют выравниванию хромосом во время мейоза ацентросомных ооцитов. Nat. Cell Biol. 11 , 839 – U135 (2009).
CAS PubMed PubMed Central Google Scholar
Dumont, J., Oegema, K. & Desai, A. Независимый от кинетохор механизм управляет анафазным разделением хромосом во время ацентросомного мейоза. Nat. Cell Biol. 12 , 894–901 (2010).
CAS PubMed PubMed Central Google Scholar
Альбертсон Д. и Томсон Дж. Н. Сегрегация холоцентрических хромосом в мейозе нематод, Caenorhabditis elegans . Chromosome Res. 1 , 15–26 (1993).
CAS PubMed Google Scholar
Мальхейрос, Н., Кастро, Д. и Камара, А.Cromosomas sem centrómero localizado. O caso de Luzula purpurea Ссылка. Agron. Лусит. 9 , 51–73 (1947).
Google Scholar
Chandra, H. S. Обратный мейоз у триплоидных самок мучнистого клопа, Planococcus citri . Генетика 47 , 1441–1454 (1962).
CAS PubMed PubMed Central Google Scholar
Nordenskiold, H.Тетрадный анализ и ход мейоза у трех гибридов Luzula campestris . Hereditas 47 , 203–237 (1961).
Google Scholar
Pazy, B. & Plitmann, U. Персистирующие полибиваленты — уникальное мейотическое поведение в Cuscuta-babylonica choisy . Геном 29 , 63–66 (1987).
Google Scholar
Герра, М.И Гарсия, М.А. Распределение сайтов гетерохроматина и рДНК в холоцентрических хромосомах Cuscuta приближенно Bab . (Convolvulaceae). Геном 47 , 134–140 (2004).
CAS PubMed Google Scholar
Да Силва, К. Р. М., Гонсалес-Элизондо, М. С. и Ванзела, А. Л. Уменьшение числа хромосом у Eleocharis subarticulata (Cyperaceae) за счет множественных транслокаций. Bot.Дж. Линн. Soc. 149 , 457–464 (2005).
Google Scholar
Бонджорни, С., Фиоренцо, П., Пипполетти, Д. и Прантера, Г. Инвертированный мейоз и мейотический драйв мучнистых червецов. Хромосома 112 , 331–341 (2004).
PubMed Google Scholar
Кусанаги А. Механизм постредуктивного мейоза у Luzula . Jpn. J. Genet. 37 , 396–39 (1962).
Google Scholar
Кэрил, А. П., Армстронг, С. Дж., Джонс, Г. Х. и Франклин, Ф. С. Гомолог дрожжевого гена HOP1 инактивирован в мейотическом мутанте asy1 Arabidopsis. Хромосома 109 , 62–71 (2000).
CAS PubMed Google Scholar
Армстронг, С.J., Caryl, A.P., Jones, G.H. и Franklin, F.C. Asy1, белок, необходимый для синапсиса мейотических хромосом, локализуется в связанном с осью хроматине у Arabidopsis и Brassica. J. Cell Sci. 115 , 3645–3655 (2002).
CAS PubMed Google Scholar
Li, W. et al. Ген AtRAD51 арабидопсиса необязателен для вегетативного развития, но необходим для мейоза. Proc. Natl Acad. Sci. USA 101 , 10596–10601 (2004).
ADS CAS PubMed Google Scholar
Vanzela, A. L. L., Cuadrado, A., Jouve, N., Luceno, M. & Guerra, M. Множественные местоположения сайтов рДНК в голоцентрических хромосомах Rhynchospora (Cyperaceae). Chromosome Res. 6 , 345–349 (1998).
CAS PubMed Google Scholar
Vanzela, A. L.Л. и Герра, М. Дифференциация гетерохроматина в холоцентрических хромосомах Rhynchospora (Cyperaceae). Genet. Мол. Биол. 23 , 453–456 (2000).
Google Scholar
Герра М. Паттерны распределения гетерохроматина в хромосомах растений. Genet. Мол. Биол. 23 , 1029–1041 (2000).
Google Scholar
Соуза, А.и другие. Распределение сайтов 5S и 45S рДНК у растений с голокинетическими хромосомами и гипотеза «хромосомного поля». Микрон 42 , 625–631 (2011).
CAS PubMed Google Scholar
Fujiwara, H., Nakazato, Y., Okazaki, S. & Ninaki, O. Стабильность и теломерная структура хромосомных фрагментов у двух разных мозаичных штаммов тутового шелкопряда, Bombyx mori . Zool. Sci. 17 , 743–750 (2000).
Google Scholar
Сан-Мартин, Дж. А. Б., Андраде, К. Г. Т. Д., Мастроберти, А. А., Мариат, Дж. Э. Д. и Ванзела, А. Л. Асимметричный цитокинез определяет развитие псевдомонад у Rhynchospora pubera (Cyperaceae). Cell Biol. Int. 37 , 203–212 (2013).
CAS PubMed Google Scholar
Ванзела, А.Л. Л., Куадрадо А. и Герра М. Локализация 45S рДНК и теломерных сайтов на холоцентрических хромосомах звена Rhynchospora tenuis (Cyperaceae). Genet. Мол. Биол. 26 , 199–201 (2003).
CAS Google Scholar
Кастильоне, М. Р. и Кремонини, Р. Очаровательный остров: 2n¼4. Завод Биосист. 146 , 711–726 (2012).
Google Scholar
Прадилло, М.и другие. Анализ одновалентной сегрегации у мейотических мутантов Arabidopsis thaliana : возможная роль синаптонемного комплекса. Генетика 175 , 505–511 (2007).
CAS PubMed PubMed Central Google Scholar
Пази Б. Дополнительные хромосомы и их поведение в мейозе холоцентрического Cuscuta babylonica Choisy . Bot. Дж. Линн. Soc. 123 , 173–176 (1997).
Google Scholar
Viera, A., Page, J. & Rufas, J. в Meiosis Vol. 5 , 137–156Karger (2009).
Google Scholar
Папески, А.Г. и Мола, Л.М. Мейотические исследования у Acanonicus-Hahni (Stal) (Coreidae, Heteroptera) .1. Поведение унивалентов у десинаптических особей. Genetica 80 , 31–38 (1990).
Google Scholar
Heckmann, S. et al. Альтернативная мейотическая сегрегация хроматид у холоцентрического растения Luzulaelegans . Nat. Commun. 5 , 4979 (2014).
ADS CAS PubMed PubMed Central Google Scholar
Pedrosa, A., Sandal, N., Stougaard, J., Schweizer, D. & Bachmair, A. Хромосомная карта модельного бобового растения Lotus japonicus . Генетика 161 , 1661–1672 (2002).
CAS PubMed PubMed Central Google Scholar
Wanzenbock, EM, Schofer, C., Schweizer, D. & Bachmair, A. Единицы рибосомной транскрипции, интегрированные посредством трансформации Т-ДНК, ассоциируются с ядрышком и не требуют вышестоящих повторяющихся последовательностей для активности в Arabidopsis thaliana . Plant J. 11 , 1007–1016 (1997).
CAS PubMed Google Scholar
Демидов Д. и др. Антифосфорилированный гистон h3AThr120: универсальный микроскопический маркер центромерного хроматина моно- и холоцентрических видов растений. Cytogenet. Genome Res. 143 , 150–156 (2014).
CAS PubMed Google Scholar
Мансанеро, С., Арана, П., Пуэртас, М. Дж.& Houben, A. Хромосомное распределение фосфорилированного гистона h4 различается между растениями и животными при мейозе. Хромосома 109 , 308–317 (2000).
CAS PubMed Google Scholar
Челышева Л. и др. Простой протокол для изучения динамики хроматина и рекомбинационных белков во время мейоза Arabidopsis thaliana : иммунодетекция когезинов, гистонов и MLh2. Cytogenet.Genome Res. 129 , 143–153 (2010).
CAS PubMed Google Scholar
Пирсон, Б. Н., Боулинг, С. Э. и Макаров, С. А. Дефект синапсов вызывает мужскую стерильность у мутанта Arabidopsis thaliana , меченного Т-ДНК. Plant J. 11 , 659–669 (1997).
CAS PubMed Google Scholar
Нагаки, К.и другие. Секвенирование центромеры риса выявляет активные гены. Nat. Genet. 36 , 138–145 (2004).
CAS PubMed Google Scholar
Визуализация живых клеток мейоза Arabidopsis thaliana
Мейоз классически делится на девять фаз: профаза I, метафаза I, анафаза I, телофаза I, интеркинез, профаза II, метафаза II, анафаза II и телофаза II. Из-за резких изменений в структуре хроматина и динамики хромосом, а также из-за его продолжительности профаза I делится на пять подфаз, а именно лептотен, зиготен, пахитен, диплотен и диакинез.Эти фазы были получены при наблюдении фиксированного материала и разбросов хромосом, что привело к определениям, основанным в основном на конфигурациях хромосом, например, пахитена определяется наличием полностью синапсовых хромосом.
Используя репортерную линию KINGBIRD , мы смогли различить пять параметров мейоцитов: форма клетки, матрица МТ, положение ядра, положение ядрышка и конфигурации хромосом (конденсация и спаривание / синапсис) (рис. 3А). Некоторые из этих параметров могут быть идентифицированы как прямое считывание репортеров, например форма клетки и массив MT визуализируются тубулином, в то время как конфигурации хромосом выявляются REC8.Другие параметры могут быть определены косвенно, как положение ядра, которое определяется отсутствием MT, или положение ядрышка, которое соответствует области нуклеоплазмы, где присутствует REC8. Каждый параметр может принимать разные состояния, которые имеют различный порядок. Например, мы наблюдали, что форма ячеек всегда менялась с прямоугольной на трапециевидную, затем на овальную, на круговую, на треугольную и, наконец, приводила к тетрадам, состоящим из четырех треугольных ячеек, среди которых обычно только три могут быть идентифицированы в одной и той же фокальной плоскости ( Рисунок 3А).
Идентификация параметрических состояний мужских мейоцитов.
( A ) Схематическое изображение различных состояний пяти параметров, наблюдаемых во время мейотической прогрессии у WT и tam . В то время как положение ядрышка, клетки REC8 / хроматина и тапетума не меняют своего паттерна; Форма ячейки и массив MT принимают дополнительные состояния в tam .В соответствии с преждевременным выходом из мейоза, состояния параметров формы клетки, ядра и MT, ассоциированные со вторым мейотическим делением, отсутствуют у tam. ( B ) Тепловые карты одновременного появления различных состояний параметров в WT (слева) и там (справа). Чем темнее синий цвет, тем выше частота одновременного появления двух состояний параметров. Состояния клеток тапетума были включены только в анализ WT и не очень сильно коррелировали с какими-либо другими параметрами.Пурпурный прямоугольник выделяет отношения, которые становятся менее строгими в tam по сравнению с WT. Цифры относятся к схеме в A.
https://doi.org/10.7554/eLife.42834.008Массив MT — это параметр с наибольшим количеством состояний. В начале мейоза МТ равномерно распределены в цитоплазме (состояние 1), а затем постепенно образуют дуговую структуру, именуемую полумесяц , которая развивается на одной стороне ядра, которое одновременно перемещается в сторону угла. ячейки (состояния от 2 до 4).Затем полумесяц превращается в подобную полнолунию структуру, окружающую ядро (состояние 5), и сжимается, образуя предварительное веретено, подобное тому, что наблюдается при митозе (состояние 6). В момент разрушения ядерной оболочки пре-веретено разрушается (состояние 7), и MTs перестраиваются с образованием первого мейотического веретена (состояния 8 и 9). Состояния 10 и 11 присутствуют во время перехода между мейозом I и мейозом II, MTs реорганизуются радиально вокруг двух новых ядер, в то время как центральные MTs расширяют свое расположение, формируя структуру, подобную фрагмопласту.Второе мейотическое деление напоминает первый мейоз с образованием двух пре-веретен (состояние 12), за которыми следуют два веретена (состояние 13) и фрагмопластоподобные структуры (состояние 14), пока клетки не пройдут цитокинез и не сформируют тетраду (состояние 15). ).
Ядро и ядрышко характеризуются изменением своего положения. В начале мейоза ядро располагается в центре (состояние 1). Примерно во время формирования структуры полумесяца MT он затем перемещается в одну сторону от клетки (состояние 2), а в состоянии 3 ядро возвращается в центр клетки.Это состояние отличается от состояния 1 из-за размера ядра, которое теперь увеличено. Во время двух метафаз (состояния 4 и 6) ядерная структура исчезает, чтобы снова появиться в виде двух и четырех меньших ядер в следующих состояниях 5 и 7, соответственно.
Ядрышко становится видимым в начале мейоза вместе с накоплением REC8. Первоначально он располагается в центре ядра (состояние 2) и перемещается к периферии ядра во время развития профазы (состояние 3).В поздней профазе исчезает (состояние 4). Поскольку ядрышко видно только при экспрессии REC8, его повторное появление после хромосомной сегрегации невозможно было заметить.
Последний полученный параметр — это локализация REC8, которая коррелирует с конформацией хроматина во время первого деления мейоза. Выявленные состояния напоминают паттерн локализации REC8, описанный в экспериментах по иммунолокализации (Cai et al., 2003). Сначала в нуклеоплазме накапливается сигнал диффузной флуоресценции (состояние 2), который затем конденсируется, образуя нити, которые со временем утолщаются (состояния 3 и 4), указывая на спаривание хромосом.В состоянии 5 сигнал REC8 становится слабее, что соответствует началу удаления REC8 из хромосом с помощью профазного пути (Yang et al., 2019). Вскоре нити хромосом становятся неузнаваемыми, но слабое диффузное окрашивание REC8 сохраняется (состояние 6) до тех пор, пока в состоянии 7 не наблюдаются небольшие отчетливые точки, представляющие полностью конденсированные хромосомы. За состоянием 7 следует почти полное исчезновение REC8 (состояние 8), соответствующее наступлению анафазы I.
Важно отметить, что наши маркеры воспроизводили ранее описанные изменения положения ядрышка, локализации REC8 и организации цитоскелета МТ, подтверждая, что наша система визуализации не нарушает общий прогресс мейоза (Peirson et al., 1997; Stronghill et al., 2014; Wang et al., 2004b).
Анализ первого набора фильмов привел к возникновению гипотезы о том, что некоторые из состояний параметров связаны, например, ядрышко, по-видимому, растворяется только после того, как ядро переместилось на одну сторону мейоцита и вернулось в центральное положение. Чтобы оценить природу этих ассоциаций, мы проанализировали подмножество ячеек (n = 169 из 35 пыльников), присвоив комбинацию чисел, которая представляет состояние каждого параметра в каждый момент времени, когда был взят кадр, например 1-1-1- 2-2 описывает мейоцит прямоугольной формы, имеющий равномерно распределенный массив MT, центрально расположенное ядро с центрально расположенным ядрышком и с неконденсированными, но не спаренными хромосомами.Далее мы называем комбинацию всех пяти состояний параметров сотовым состоянием .
Последующий анализ 10 671 момента времени позволил нам судить, какие состояния параметров происходят вместе и с какой частотой (рис. 3B). С помощью этого метода мы могли подтвердить, что определенные состояния параметров действительно совпадают друг с другом весьма специфическим образом, например, состояние формы клетки 1, как обнаружено, связано только с состоянием положения ядра 1 (рис. 3B, тепловая карта WT), в то время как другие состояния параметров связаны только более слабо.
Этот анализ также показал, что из более чем 20 000 возможных состояний клетки только 101 фактически присутствовал в нашем наборе данных (рис. 4 — исходные данные 1). Однако их частоты были распределены в очень широком диапазоне (от 0,01% до 21,14% от общего количества наблюдений). Следовательно, важность определенного клеточного состояния не может быть выведена из абсолютной частоты возникновения, так как это сильно зависит от продолжительности соответствующего состояния, то есть комбинации параметров, которые отображают длинные фазы, такие как пахитены, присутствуют в большем количестве времени. точек, чем комбинации, изображающие короткие фазы, например, метафаза I.Чтобы идентифицировать биологически отличные клеточные состояния из наблюдаемых данных, мы определили локальный или соседний балл , который количественно определяет возникновение определенного клеточного состояния по сравнению с его соседними состояниями.
Соседнее состояние было определено как состояние клетки, которое находится на расстоянии одного перехода (-1 или +1) как минимум для одного, но не более двух состояний параметров по сравнению с анализируемым состоянием клетки. При этом 2-4-2-3-4, например, является соседом 2-3-2-3-4 и 3-3-2-3-4, но не является клеточным состоянием 2-2. -2-3-4, а не 3-3-2-3-3 (рисунок 4 — исходные данные 1).Примечательно, что мы учитывали только те состояния, которые действительно наблюдались. Затем оценка соседей сравнивалась с подмножеством соседних состояний , чтобы найти преобладающее состояние среди окружающих состояний, и определяется как:
Score = count (состояние) −mean (count (соседние состояния)) std (count (соседние состояния))
, где отсчетов, — количество раз, когда определенное состояние наблюдается в данных, а std. — стандартное отклонение.Этот анализ выявил 11 четко различных клеточных состояний, которые отличались от своих соседей с показателем выше единицы, что означает, что они возникали по крайней мере на одно стандартное отклонение чаще, чем среднее значение соседних стадий (рис. 4).
Матрица клеточных состояний.
Две схемы представляют матрицу наблюдаемых клеточных состояний и то, как они соотносятся друг с другом, в WT (верхняя схема) и там фоне (нижняя схема).Каждый кружок представляет клеточное состояние как функцию комбинации наблюдаемых состояний параметров. Область круга указывает количество наблюдений этой конкретной комбинации, в то время как цвет указывает соседнее значение оценки; чем теплее цвет, тем выше соседнее значение. Кружки с именем, отмеченные темным контуром, являются выбранными состояниями ориентира. Остальные кружки определены как переходные состояния. Стрелки представляют все прямые переходы между клеточными состояниями, наблюдаемыми в наборе данных, чем толще стрелки, тем больше количество наблюдений.Пунктирные линии представляют собой переходы, которые не соответствуют схеме ориентиров, например, трапециевидная ячейка (состояние формы ячейки 2) в паре с начальным состоянием полумесяца (состояние массива MT номер 3), но с центральным ядром (состояние номер 1). Большинство из этих состояний наблюдаются очень редко (всего 2,8%).
https://doi.org/10.7554/eLife.42834.009Эти 11 клеточных состояний (A1-A11) в дальнейшем называются мейотическими ориентирами, или ориентирами (Рисунок 4 и Рисунок 5).Состояния между ориентирами определяются как переходные состояния и часто представляют альтернативные маршруты к следующему ориентиру (Рисунок 4), например, форма ячейки может сначала измениться с прямоугольной на трапециевидную, а затем ядро перемещается из центрального положения в положение. сбоку от клетки, или сначала движется ядро, а затем изменяется форма клетки. Однако в конечном итоге ядро всегда располагается на меньшей стороне трапециевидной клетки, определяющей новое состояние ориентира. Результаты анализа соседних баллов были воспроизведены и подтверждены бутстрэппингом (рис. 4 — исходные данные 2).
Схема ориентира Иллюстрация 11 меток мейоза.
( A1-A11 ), идентифицированный по соседнему счету в мейозе самцов WT. В первом столбце представлена микроскопическая картина мейоцитов, отражающая каждое клеточное состояние. Состояние каждого параметра отдельно отображается в следующих столбцах, в крайнем правом столбце (наложении) отображается их комбинация.Справа классические этапы мейоза примерно соответствуют каждому ориентиру. Пурпурная и зеленая рамки идентифицируют ориентиры, полученные анализом TagRFP: TUB4 и REC8 отдельно.
https://doi.org/10.7554/eLife.42834.014Взятые вместе, мы заключаем, что этапы клеточной дифференцировки мейоза могут быть вариабельными, но затем сходятся в различных клеточных состояниях, ориентирах. Качественный набор ориентиров, возможно, их порядок, а также их продолжительность и степень изменчивости (номер и продолжительность переходного состояния) представляют новую систему для описания мейоза.
Превращение мейоза в митоз
Osd1 Мутанты продуцируют диплоидные гаметы, пропуская второе мейотическое деление
В рамках скрининга профилей экспрессии мейотических генов с использованием инструмента Expression Angler [10] с тканевым набором AtGenExpress [11], At3g57860 был выбран в качестве хорошего кандидата из-за его совместной регуляции с несколькими известными мейотическими генами. [12]. At3g57860 соответствует гену UVI4-Like ( UVI4-L ), который был кратко описан в исследовании его паралога, гена UVI4 [13].Из-за его роли в мейозе (см. Ниже) мы переименовали At3g57860 в ген OSD1, для пропуска второго деления . Белки OSD1 и UVI4 консервативны во всем царстве растений (рис. 2), но не содержат никаких очевидных консервативных известных функциональных доменов. За пределами царства растений гомологов не выявлено. Мы исследовали роль гена OSD1 путем выделения и характеристики двух мутантов. Инсерционные мутанты Ds osd1-1 (pst15307) [14] и osd1-2 (GT21481) [15], [16] Ds находятся в фонах Nooseen (No-0) и Landsberg (Ler), соответственно, и в обоих случаях вставка находится во втором экзоне гена OSD1 (рис. 2).В обоих независимых мутантах osd1 продуктами мужского мейоза были диады ( osd1-1 : 714/714; osd1-2 : 334/334) вместо тетрад (рис. 3A и 3B). Тесты комплементации между osd1-1 и osd1-2 подтвердили, что эти мутации являются аллельными ( osd1-1 / osd1- 2: 369 dyads / 369). Мутанты osd1 не показали каких-либо соматических дефектов развития, летальности мужских и женских гаметофитов или снижения фертильности (38 ± 11 семян / плод дикого типа; osd1 35 ± 6).Затем мы измерили уровни плоидности среди потомков диплоидных мутантов osd1 . Среди самоопыленных потомков были обнаружены тетраплоиды (4n) (84%) и триплоиды (3n) (16%), но не были обнаружены диплоидные (2n) растения ( osd1-1 : n = 56; osd1-2 : n = 24). Когда мутантную пыльцу использовали для удобрения растения дикого типа, все полученное потомство было триплоидным ( osd1-1 : n = 75). Когда мутантные семяпочки оплодотворяли пыльцевыми зернами дикого типа, мы выделили 12% диплоидных и 88% триплоидных растений ( n = 25).Это продемонстрировало, что мутанты osd1 продуцируют высокие уровни мужских (100%) и женских (~ 85%) диплоидных спор, что приводит к функциональным гаметам.
Рисунок 2. Ген и белок OSD1.
(A) Ген OSD1 содержит три экзона и два интрона и кодирует белок из 243 аминокислот. Положения двух вставок Ds обозначены треугольниками. (B) Показано множественное выравнивание последовательностей членов семейства OSD1 / UVI4, указывающее на сегменты наилучшей консервации вдоль OSD1.Особенно высокая консервативность наблюдается в центральном OSD1-мотиве, который является единственным участком с явным сходством последовательностей у мха и булавы. Предполагается, что консервативные С-концевые 40-60 аминокислот вносят вклад в альфа-спиральные структурные элементы. Все доступные гомологи включены для выбранного диапазона видов, причем вид происхождения указывается двухбуквенным кодом, предшествующим каждому идентификатору белка. Brassicaceae: Al, Arabidopsis lyrata; At, Arabidopsis thaliana; Br, Brassica rapa. Eurosids I: Gm, Glycine max; Pt, Populus trichocarpa. Poaceae: Os, Oryza sativa; Sb, Сорго двухцветное; Zm, Zea mays. Мхи: PP, Physcomitrella patens . (C) Некорневое филогенетическое дерево, выведенное из выравнивания семейства OSD1 / UVI4 с использованием алгоритма объединения соседей с попарным удалением пробелов. Полноразмерные последовательности включены в выравнивание, за исключением последовательностей Physcomitrella patens (Pp), для которых выравнивается только консервативный сегмент.Тот факт, что только выравнивающие части белков Pp использовались при реконструкции топологии консенсусного дерева, должен быть принят во внимание при интерпретации длины ветви Pp-узла. Основываясь на паралогическом группировании, можно предположить, что события дупликации генов происходили неоднократно в эволюции семейства OSD1 / UVI4 растений. Устойчивость топологии указывается уровнями достоверности начальной загрузки в процентах от 1000 повторений. Анализ проводился с помощью PHYLIPv3.66 (Felsenstein J (2006)), распространяемой автором.Департамент геномных наук Вашингтонского университета, Сиэтл, Соединенные Штаты Америки) и PHYLO_WINv2.0 [32].
https://doi.org/10.1371/journal.pbio.1000124.g002
Рис. 3. osd1 мутанты пропускают мейоз II.
(A и B) Продукты мужского мейоза, окрашенные толуидиновым синим. (А) Тетрада дикого типа. (B) Диада в мутанте osd1-1 . (C – D) Мужской мейоз в osd1 неотличим от мейоза дикого типа до телофазы I (сравните с рис. 4), но никаких фигур, характерных для второго деления, не наблюдалось.(C) Пахитены. (D) Диакинез. (E) Метафаза I. (F) Анафаза I. (G) Телофаза I. Наблюдаются два ядра, разделенные полосой митохондрий. (H) Метафаза I женского мейоза в osd1 .
https://doi.org/10.1371/journal.pbio.1000124.g003
Чтобы раскрыть механизмы, приводящие к образованию диад в osd1, , мы исследовали поведение хромосом во время мейоза. И мужской, и женский мейоз I были неотличимы от мейоза дикого типа (сравните рисунок 3 с рисунком 4).Примечательно, что наблюдались хиазмы, цитологическое проявление кроссоверов и бивалентов. Однако нам не удалось найти какие-либо цифры мейоза II (среди> 500 мужских мейоцитов от профазы до образования спор), что убедительно свидетельствует о том, что образование диад происходит из-за отсутствия второго мейотического деления. Если это второе деление не происходит, то любая гетерозиготность центромер будет потеряна в диплоидных гаметах из-за совместной сегрегации сестринских хроматид и разделения гомологов во время первого деления.Из-за рекомбинации любые локусы, которые не связаны с центромерами, будут расщепляться.
Рисунок 4. Мейоз дикого типа.
(А) Пахитена. Гомологичные хромосомы полностью синапсированы. (B) Диакинез. Наблюдаются пять пар гомологичных хромосом (двухвалентных), связанных хиазмами. (C) Метафаза I. Пять бивалентов выровнены на метафазной пластине. (D) Анафаза I. Гомологичные хромосомы разделены. (E) Телофаза I. (F) Метафаза II. Пары сестринских хроматид выстраиваются на метафазных пластинках.(G) Анафаза II. Сестринские хроматиды разделены. (H и I) Телофаза II. Формируются четыре гаплоидные споры (тетрады). Шкала шкалы = 10 мкм.
https://doi.org/10.1371/journal.pbio.1000124.g004
Мы проверили наше предположение, воспользовавшись преимуществами двух разных генетических фонов: osd1-1 (No-0) и osd1-2 мутанты (лер). Растения F1, несущие две мутации — мутант по osd1 и гетерозиготный по любому полиморфизму No-0 / Ler — были скрещены как мужские или женские с третьим генетическим фоном, Columbia (Col-0).Кариотипирование и генотипирование полученных растений по триморфным молекулярным маркерам дало прямую информацию о генетическом составе пыльцевых зерен и женских гаметофитов, продуцируемых мутантом. Все протестированные диплоидные гаметы имели предсказанные генетические характеристики (рис. 5А). Они были систематически гомозиготными по центромерам и сегрегацией — из-за рекомбинации — по другим локусам ( n = 48 для мужских диплоидных гамет и n = 41 для женских диплоидных гамет). Эти результаты подтвердили, что отсутствие второго мейотического деления действительно является причиной продукции 2n гамет в osd1. Этот механизм также подразумевает, что несбалансированная сегрегация хромосом в мейозе I дала бы начало несбалансированным диадам в osd1 ; это было подтверждено анализом двойного мутанта Atspo11-1 / osd1-1 (неопубликованные данные). Такой фенотип уже был описан у удлиненного мутанта кукурузы, у которого диплоидные женские гаметы продуцируются из-за неспособности пройти мейоз II, но соответствующий ген не был идентифицирован [17], [18].
Рис. 5. Генетический состав диплоидных гамет osd1 и MiMe .
(A) Триплоидное потомство osd-1 (No-0) / osd1-2 (Ler) × Col-0 скрещиваний было генотипировано по нескольким молекулярным маркерам. Каждая линия представляет одно растение. Для каждого маркера растения, несущие только аллель No-0, показаны зеленым, растения, несущие только аллель Ler, отмечены желтым цветом, а растения с аллелями как No-0, так и аллелями Ler показаны красным. Аллели Col-0 присутствуют во всех растениях, потому что он использовался в качестве мужского или женского родителя при скрещивании. Положение каждого маркера (красный) и центромеры (темно-синий) указано вдоль хромосом.(B) Аналогичным образом триплоидное потомство MiMe (лоскутное одеяло Col-0 из Atspo11-1 / Atrec8 и No-0 из osd1-1 ) × Le скрещиваний было генотипировано для молекулярных маркеров, которые были гетерозиготными в MiMe материнское растение. Все растения были гетерозиготными по каждому маркеру (Col-0 / No-0).
https://doi.org/10.1371/journal.pbio.1000124.g005
Интересно, что OSD1 paralogue UVI4 необходим для поддержания митотического состояния, а потеря функции UVI4 стимулирует эндо-редупликацию, тогда как OSD1 не требуется для этого процесса [13].На мейоз не влияет нарушение UVI4 (неопубликованные данные). Это предполагает, что UVI4 и OSD1 оба участвуют в регуляции клеточного цикла, выполняя специализированные функции в митозе и мейозе, соответственно. Переход от мейоза I к мейозу II требует баланса активности Cyclin-Cdk: она должна быть снижена в достаточной степени, чтобы выйти из мейоза I, но поддерживаться на достаточно высоком уровне, чтобы подавлять репликацию ДНК и способствовать вступлению в мейоз II [19], [20]. Два истощения белка генерируют фенотип, сходный с фенотипом osd1 : белок Mes1 делящихся дрожжей частично ингибирует деградацию циклина с помощью комплекса, способствующего анафазе (APC), и тем самым позволяет вступить в мейоз II [21], [22].Сходным образом экспрессия Erp1 / Emi2 в конце мейоза I важна для входа в мейоз II в ооцитах Xenopus [23], [24] и мыши [25], наиболее вероятно, путем ингибирования деградации циклина с помощью APC. Erp1 / Emi2-истощенные ооциты и мутант дрожжей mes1 не могут войти в мейоз II, что напоминает фенотип osd1 . Следовательно, одной из возможных функций OSD1 может быть также тонкая настройка активности APC / уровней циклина в конце мейоза I для обеспечения перехода к мейозу II.
Превращение мейоза в митоз
Из-за отсутствия второго мейотического деления мутанты osd1 продуцируют высокие частоты жизнеспособных диплоидных мужских и женских гаметофитов, которые после оплодотворения образуют жизнеспособные тетраплоидные растения. Однако это явление отличается от апомейоза тем, что произведенные гаметы генетически отличаются от материнского растения. Ранее мы сообщали, что у двойных мутантов Atspo11-1 / Atrec8 первое мейотическое деление заменяется митотическим делением, за которым следует несбалансированное второе деление, которое приводит к несбалансированным спорам и бесплодию [9].Были получены тройные osd1 / Atrec8 / Atspo11-1 мутанты, которые экспрессировали фенотип апомейоза, при котором мейоз полностью заменялся митотическим делением. Это было ожидаемо, потому что мутации Atspo11-1 и Atrec8 приводят к митотически-подобному первому мейотическому делению, а мутация osd1 предотвращает второе мейотическое деление. Мы назвали этот генотип MiMe для митоза вместо мейоза. Растения MiMe образуют диады (408/408) и являются фертильными (25 ± 6 семян на плод).Таким образом, мутация osd1 подавляла фенотип стерильности двойного мутанта Atspo11-1 / Atrec8 . Наблюдение за поведением хромосом во время мужского и женского мейоза выявило митотическое деление: десять унивалентов, выровненных на метафазной пластинке, и сестринские хроматиды, разделенные в анафазе (Рисунок 6). Самоопыленное потомство растений MiMe было систематически тетраплоидным ( n = 24), а при обратных скрещиваниях между диплоидными растениями MiMe и растениями дикого типа образовывались триплоидные растения независимо от того, были ли мужские ( n = 24) или женские () растения. n = 67) Использовали гамет MiMe , что показывает, что это митотическое деление дает начало функциональным диплоидным гаметам.Все гаметы (мужские и женские), протестированные аналогично описанному выше, систематически сохраняли гетерозиготность материнского растения по каждому протестированному генетическому маркеру (фиг. 5B) и, таким образом, были генетически идентичны материнскому растению. Эти результаты подтверждают, что растений MiMe подвергаются митотическому делению вместо нормального мейотического деления, не влияя на последующие половые процессы.
Рис. 6. Митозоподобные деления вместо мейоза у растений MiMe .
(A) Мужская метафаза I (B) Мужская анафаза I.Виньетка показывает диаду в MiMe . (C) Женская метафаза I. (D) Женская анафаза I. Масштабная полоса = 10 мкм.
https://doi.org/10.1371/journal.pbio.1000124.g006
Ожидается, что при замене мейоза митозом плоидность удваивается с каждым поколением. Действительно, в последовательных поколениях мы получили тетраплоид (4n, 20 хромосом, n = 26) и октоплоид (8n, 40 хромосом, n = 33) (рисунки 7 и 8). Плодовитость упала с 25 ± 6 семян / плод у 2n растений и с 19 ± 4 на 4n растений до <0.1 из 8n растений. Потребуются дальнейшие исследования, чтобы понять причину этого снижения фертильности, связанного с высоким уровнем плоидности.
Рисунок 7. Удвоение плоидности на каждом поколении в линейке MiMe .
В последующих поколениях плоидность растений MiMe удваивалась в каждом поколении, с 2n (A) (10 хромосом) до 4n (B) (20 хромосом) и 8n (C) (40 хромосом). В левом столбце показана митотическая метафаза, масштабная линейка = 10 мкм. В правом столбце показаны соответствующие четырехнедельные растения (масштабная линейка = 2 см) и цветы (масштабная линейка = 1 мм).
https://doi.org/10.1371/journal.pbio.1000124.g007
Рисунок 8. Мужской мейоз у растений 2n, 4n и 8n MiMe .
Растения MiMe подверглись митозоподобному делению вместо мейоза у растений 2n (A), 4n (B) и 8n (C). Мейотическая метафаза I, анафаза I и телофаза I показаны для каждого поколения. Шкала шкалы = 10 мкм.
https://doi.org/10.1371/journal.pbio.1000124.g008
К Апомиксису
Апомиксис можно разделить на три компонента развития: отсутствие или изменение мейоза, которое предотвращает редукцию (апомейоз), независимое от оплодотворения развитие эмбриона из яйцеклетки (партеногенез) и начало развития эндосперма с оплодотворением или без него [ 1].Здесь мы показали, что полностью пенетрантный апомейоз может быть индуцирован у полового растения, когда митотическое деление заменяет мейоз в генотипе MiMe . Предыдущий случай апомейоза был зарегистрирован у мутанта Arabidopsis dyad [26]. Однако только 0,2% семяпочек диады генерируют жизнеспособные гаметы, что делает их практически непригодными для использования в стратегии апомиксисной инженерии, в отличие от растений MiMe , которые продуцируют уровни квазидикого типа жизнеспособных — и апомейотических — семяпочек и пыльцевых зерен. .Три гена, отвечающих за генотип MiMe , строго консервативны среди растений, что позволяет предположить, что апомейоз может быть спроектирован у любых видов растений, включая сельскохозяйственные культуры. Кроме того, несколько других генов, необходимых для инициации рекомбинации, были описаны у растений [27], и соответствующие мутанты можно было использовать вместо spo11-1 для конструирования генотипа MiMe .
