Массовая доля — что это такое? Как найти? Формула
Что такое массовая доля
Начнем с примера: допустим, мы приготовили два раствора соли. Первый имеет массу 400 г и для него использовано 100 г соли. Масса второго 900 г и для него использовали 90 г соли. Какой раствор будет более концентрированным? Чтобы это понять, нужно выяснить процент соли в каждом растворе. Можно сказать иначе — нужно определить, какую долю в растворе занимает соль.
Массовая доля — это отношение растворенного вещества к массе раствора. Она может измеряться в процентах (от 0 до 100%) или в долях от единицы (от 0 до 1).
Как найти массовую долю растворенного вещества, расскажет формула:
где — обозначение массовой доли;
— масса вещества;
— масса раствора.
В нашем примере и без формул понятно, что в первом растворе соль занимает 25%, а в то втором — только 10%. А что будет, если в первый раствор добавить еще столько же соли и воды? Очевидно, что на концентрацию это не повлияет.
Массовая доля химического элемента — это отношение между относительной массой его атомов и относительной молекулярной массой соединения, частью которого является данный элемент.
Как видите, фактическая масса сложного вещества или его отдельного компонента не имеет значения. Если мы не знаем этих показателей, для расчетов берутся относительные величины.
Такое определение массовой доли элемента выражается формулой:
В данном случае:
— количество атомов искомого элемента;
— относительная атомная масса элемента;
— относительная молекулярная масса сложного вещества.
Если нужен показатель в процентах, результат надо умножить на 100%.
Относительная атомная и молекулярная масса
В формуле нахождения массовой доли мы видим две важные составляющие: относительную массу атома элемента (A
r) и относительную массу молекулы вещества (Mr). Разберемся, что это такое. И та, и другая величина — это отношение реальной массы к эталонной единице, за которую взята 1/12 массы атома углерода.
Разберемся, что это такое. И та, и другая величина — это отношение реальной массы к эталонной единице, за которую взята 1/12 массы атома углерода.
Относительная атомная масса элемента (Ar) говорит о том, насколько масса его атома больше 1/12 массы атома углерода. Для каждого элемента эта величина является постоянной и ее можно увидеть в таблице Менделеева.
Относительная молекулярная масса соединения (Mr) складывается из относительных атомных масс всех элементов в составе его молекулы. Она показывает, насколько молекула вещества больше 1/12 массы атома углерода.
Это не измеряемые величины, то есть они не имеют единиц измерения. Буква r в обозначениях относительной атомной и молекулярной массы восходит к английскому слову relative — «относительный».
Важно
Численно относительная молекулярная масса вещества равна его молярной массе, что удобно использовать в расчетах. Но путать эти два понятия не стоит. Относительная молекулярная масса характеризует 1 молекулу вещества, в то время как молярная масса — 1 моль вещества.
Относительная молекулярная масса характеризует 1 молекулу вещества, в то время как молярная масса — 1 моль вещества.
Как найти массовую долю элемента в веществе
Выше мы рассмотрели формулу для вычисления массовой доли химического элемента в веществе и узнали, откуда берутся ее составляющие. Применим эти знания на практике.
Пример 1
Оксид магния массой 8 г образовался при вступлении 4,8 г магния в реакцию с кислородом. Каковы массовые доли магния и кислорода в полученном оксиде?
Решение:
Для начала вычислим массу кислорода. Согласно закону сохранения массы веществ в соединении можно воспользоваться формулой m(O) = m(MgO) − m(Mg).
m(O) = 8 − 4,8 = 3,2 г
Вспоминаем, как найти массовую долю элемента в веществе: нужно понять, какую часть соединения оно составляет.
Зная массы каждого компонента оксида, сделать расчет несложно:
или .
или .
Ответ: массовые доли магния и кислорода в оксиде магния составляют 60% и 40% соответственно.
Пример 2
Потренируемся находить массовую долю элемента в сложном веществе. Определим, какую часть этилового спирта С2H6O составляет водород.
Решение:
В данном случае у нас нет конкретных указаний на массы элементов или всего вещества. Но мы можем воспользоваться другой формулой массовой доли в химии, которая позволяет работать с относительными величинами:
, значит .
Согласно таблице Менделеева относительная атомная масса водорода равна единице.
Ar(H) = 1.
Вычислим относительную молекулярную массу соединения С2H6O, которая складывается из соответствующих масс каждого элемента:
Mr(С2H6O) = 2M(C) + 6M(H) + M(O) = 212 + 6 1 + 16 = 46.
Полученные данные подставим в формулу и определим массовую долю элемента в соединении:
или .
Ответ: в этиловом спирте массовая доля водорода составляет 13%.
Как вычислить массовую долю вещества в растворе
Вспомним, что такое концентрация раствора. Она говорит о том, в каком соотношении находятся растворенное вещество и растворитель, а другими словами — сколько растворенного вещества содержится в единице объема или массы. Концентрация может быть безразмерной величиной и выражаться в процентах, но также ее можно выразить в массовых или в молярных долях.
Важно
Указание массовой доли вещества — один из способов выражения концентрации раствора.
В случае с растворами применима та же формула:
Если нужно значение в процентах, результат надо умножить на 100%.
Пример
Требуется приготовить 0,5 л раствора карбоната натрия плотностью 1,13 г/мл. Определите массу карбоната натрия при условии, что концентрация раствора должна быть 13%.
Решение:
Вначале нам нужно узнать массу раствора, что легко сделать, когда известны его объем и плотность. Воспользуется формулой m(р–ра) = ρ × V
m(р–ра) = 500 × 1,13 = 565 г.
Дальше вспомним, как находить массовую долю растворенного вещества:
, а значит .
Поскольку концентрация раствора — это и есть массовая доля растворенного вещества, подставим ее в уравнение:
m(Э) = 0,13 × 565 = 73,45 г.
Ответ: для раствора понадобится 73,45 г карбоната натрия.
Вопросы для самопроверки:
Как обозначается массовая доля и в чем она выражается?
В чем разница между молекулярной массой вещества и его молярной массой?
Как найти массовую долю элемента в веществе, если мы знаем массу элемента и массу вещества?
Как рассчитать массовую долю вещества в растворе?
В каких безразмерных и размерных величинах можно выразить концентрацию раствора?
Массовая доля элемента в сложном веществе
С
XIX
века химия перестала быть описательной наукой. Учёные широко стали использовать
методы измерения различных параметров веществ.
Массовая доля элемента – это отношение массы этого элемента в сложном веществе к массе всего вещества, выраженное в долях единицы (или в процентах).
Массовая доля элемента в веществе обозначается латинской буквой ω (дубль-вэ) и показывает долю (часть массы), приходящуюся на данный элемент в общей массе вещества. Массовая доля элемента в веществе выражается в долях единицы или в процентах. Часть от целого всегда меньше целого, как долька апельсина меньше всего апельсина.
Например, в состав оксида ртути HgO входит два элемента – ртуть и кислород. При нагревании этого вещества массой 50 г получается 46,3 г ртути и 3,7 г кислорода. Рассчитаем массовую долю ртути в сложном веществе:
Рассчитаем массовую долю кислорода в веществе. Для этого массу кислорода разделим на массу смеси. Подставим значения масс веществ. Получаем:
Учитывая, что сумма массовых долей элемента в веществе равна единице, или 100 %, массовую долю кислорода можно найти по разности:
Для
того, чтобы найти массовую долю элемента в веществе, нужно относительную
атомную массу этого элемента умножить на число атомов данного химического
элемента в веществе и разделить на относительную молекулярную массу вещества.
Определим массовую долю кислорода в серной кислоте. Для этого найдём относительную молекулярную массу серной кислоты. Необходимо значения все относительных атомных масс элементов сложить.
Mr (H2SO4) = Ar (H) · 2 + Ar (S) + Ar (O) · 4 = 1 · 2 + 32 + 16 · 4 = 98
Найдём массовую долю кислорода. Для этого нужно относительную атомную массу кислорода умножить на 4 и разделить на относительную молекулярную массу всего вещества. Получается 0,653, или 65,3 %.
Рассчитаем массовые доли элементов в метане, формула которого CH4. Для этого определим относительную молекулярную массу метана. Подставим значения относительных атомных масс и получим 16.
Mr (CH4) = Ar (C) + Ar (H) · 4 = 12 + 1 · 4 = 16
Затем
найдём массовую долю углерода в метане. Для этого 12 умножим на 1 и разделим на
16. В результате образуется 0,75, или 75 %.
Для того, чтобы найти массовую долю водорода в метане, следует от 1 вычесть массовую долю углерода. Получается 0,25, или 25 %.
Пирит, или золотая обманка, имеет ярко-жёлтый золотистый цвет, похож на золото, поэтому и получил название «золото дураков». Испанские завоеватели грабили индейцев ради изделий из пирита и увозили их домой в Европу. Пирит путали с золотом и во время золотой лихорадки на Аляске. Это хорошо описано в книге Джека Лондона. Минерал пирит, состоящий из 46,6 % железа и 53,4 % серы, внешним видом очень напоминает золото. Вычислим химическую формулу пирита.
Обозначим формулу пирита FexSy. Затем найдём соотношение индексов x и y. Для этого значения массовых долей разделим на относительные атомные массы элементов. Подставим значения и получим соотношение 0,0083 : 0,0167.
Приведём
соотношения индексов к целым числам. Для этого нужно каждое значение разделить
на меньшее число в соотношении. Получим 1 : 2. Значит,
формула пирита FeS2.
Для этого нужно каждое значение разделить
на меньшее число в соотношении. Получим 1 : 2. Значит,
формула пирита FeS2.
Что такое массовая доля элемента в веществе и для чего её вычисляют? | Химия. Шпаргалка, шпора, формула, закон, ГДЗ, опыты, тесты, сообщение, реферат, кратко, конспект, книга
Тема: Химические системы [смеси и растворы]
Что такое массовая доля элемента в веществе? Химические формулы — важный источник информации о веществах.
Также по формуле вещества можно рассчитать массовую долю каждого химического элемента, который входит в его состав.
Массовая доля элемента w(E) в соединении — это отношение массы этого элемента в соединении к массе соединения.
То есть
w(E) = n • Ar(E) / Mr (вещества),
где n — количество атомов химического элемента Е; Ar(E) — относительная атомная масса элемента; Мr (вещества) — относительная молекулярная масса вещества. Символ массовой доли произносят «дубль-вэ» или «дабл-ю».
Символ массовой доли произносят «дубль-вэ» или «дабл-ю».
Массовая доля не имеет размерности. Тем не менее довольно часто содержание химического элемента в веществе выражают в процентах.
Для чего вычисляют массовые доли? Понятие доли применимо не только для характеристики содержания химических элементов в составе вещества. Например — содержание (объемные доли) азота, кислорода и других газов в воздухе, массовая доля растворенного вещества в растворе.
Для золотых и серебряных сплавов указывают массовую долю драгоценного металла — так называемую пробу (рис. 10.1, 1-2). На этикетках лекарственных препаратов (рис. 10.1, 3) есть информация о содержании (массовой доле) компонентов.
Сведения о массовых долях металлических элементов в рудах нужны металлургам. А производители минеральных удобрений — аммиачной селитры, мочевины — обязательно указывают на упаковках массовую долю азота. Материал с сайта http://worldofschool.ru
Материал с сайта http://worldofschool.ru
| Рис. 10.1. 1. Памятная монета «Телец». На аверсе монеты из серебра — обозначение металла, его пробы: Ag 925 (w(Ag) = 92,5%). 2. Юбилейная монета «Киевский псалтырь». На аверсе этой монеты находятся обозначение и проба драгоценного металла Au 900 (w(Au) = 90,0%). 3. Лекарственные препараты |
-
Что такое массовая доля элемента в веществе.
Химия решебник процентная концентр растворов
Как узнать массовую долю элемента в веществе. Как найти массовую долю вещества по формуле
>>
Массовая доля элемента в сложном веществе
Материал параграфа поможет вам:
> выяснить, что такое массовая доля элемента в соединении, и определять ее значение;
> рассчитывать массу элемента в определенной массе соединения, исходя из массовой доли элемента;
> правильно оформлять решение химических задач.
Каждое сложное вещество (химическое соединение) образовано несколькими элементами. Знать содержание элементов в соединении необходимо для его эффективного использования. Например, лучшим азотным удобрением считают то, в котором содержится наибольшее количество Нитрогена (этот элемент необходим растениям). Аналогично оценивают качество металлической руды, определяя, насколько она «богата » на металлический элемент.
Содержание элемента в соединении характеризуют его массовой долей. Эту величину обозначают латинской буквой w («дубль-вэ»).
Выведем формулу для вычисления массовой доли элемента в соединении по известным массам соединения и элемента. Обозначим массовую долю элемента буквой х. Приняв во внимание, что масса соединения — это целое, а масса элемента — часть от целого, составляем пропорцию:
Заметим, что массы элемента и соединения нужно брать в одинаковых единицах измерения (например, в граммах).
Это интересно
В двух соединениях Сульфура- SO 2 и MoS 3 — массовые доли элементов одинаковы и составляют по 0,5 (или 50 %).
Массовая доля не имеет размерности. Ее часто выражают в процентах. В этом случае формула принимает такой вид:
Очевидным является то, что сумма массовых долей всех элементов в соединении равна 1 (или 100 %).
Приведем несколько примеров решения расчетных задач. Условие задачи и ее решение оформляют таким образом. Лист тетради или классную доску делят вертикальной линией на две неодинаковые части. В левой, меньшей, части сокращенно записывают условие задачи, проводят горизонтальную линию и под ней указывают то, что нужно найти или вычислить. В правой части записывают математические формулы, объяснение, расчеты и ответ.
В 80 г соединения содержится 32 г Оксигена . Вычислить массовую долю Оксигена в соединении.
Массовую долю элемента в соединении также вычисляют, используя химическую формулу соединения. Поскольку массы атомов и молекул пропорциональны относительным атомным и молекулярным массам, то
где N(E) — количество атомов элемента в формуле соединения.
По известной массовой доле элемента можно рассчитать массу элемента, которая содержится в определенной массе соединения. Из математической формулы для массовой доли элемента вытекает:
m(E) = w(E) m(соединения).
Какая масса Нитрогена содержится в аммиачной селитре (азотное удобрение) массой 1 кг, если массовая доля этого элемента в соединении равна 0,35?
Понятие «массовая доля» используют для характеристики количественного состава смесей веществ. Соответствующая математическая формула имеет такой вид:
Выводы
Массовая доля элемента в соединении — это отношение массы элемента к соответствующей массе соединения.
Массовую долю элемента в соединении вычисляют по известным массам элемента и соединения или по его химической формуле.
?
92. Как вычислить массовую долю элемента в соединении, если известны: а) масса элемента и соответствующая масса соединения; б) химическая формула соединения?
93. В 20 г вещества содержится 16 г Брома. Найдите массовую долю этого элемента в веществе, выразив ее обычной дробью, десятичной дробью и в процентах.
В 20 г вещества содержится 16 г Брома. Найдите массовую долю этого элемента в веществе, выразив ее обычной дробью, десятичной дробью и в процентах.
94. Вычислите (желательно устно) массовые доли элементов в соединениях с такими формулами: SO 2 , LiH, CrO 3 .
95. Сопоставляя формулы веществ, а также значения относительных атом ных масс, определите, в каком из веществ каждой пары массовая доля первого в формуле элемента больше:
a) N 2 O, NO; б) CO, CO 2 ; в) B 2 O 3 , B 2 S 3 .
96. Выполните необходимые вычисления для уксусной кислоты CH 3 COOH и глицерина C 3 H 5 (OH) 3 и заполните таблицу:
| C x H y O z | M r (C x H y O z) | w(C) | W(H) | W(O) |
97. Массовая доля Нитрогена в некотором соединении равна 28 %. В какой массе соединения содержится 56 г Нитрогена?
В какой массе соединения содержится 56 г Нитрогена?
98. Массовая доля Кальция в его соединении с Гидрогеном равна 0,952. Определите массу Гидрогена, которая содержится в 20 г соединения.
99. Смешали 100 г цемента и 150 г песка. Какова массовая доля цемента в приготовленной смеси?
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.
Содержание урока конспект урока и опорный каркас презентация урока интерактивные технологии акселеративные методы обучения Практика тесты, тестирование онлайн задачи и упражнения домашние задания практикумы и тренинги вопросы для дискуссий в классе Иллюстрации видео- и аудиоматериалы фотографии, картинки графики, таблицы, схемы комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты Дополнения рефераты шпаргалки фишки для любознательных статьи (МАН) литература основная и дополнительная словарь терминов Совершенствование учебников и уроков исправление ошибок в учебнике замена устаревших знаний новыми Только для учителей календарные планы учебные программы методические рекомендацииС XVII в. химия перестала быть описательной наукой. Ученые-химики стали широко использовать измерение вещества. Все более совершенствовалась конструкция весов, позволяющих определять массы образцов. Для газообразных веществ помимо массы измеряли также объем и давление. Применение количественных измерений дало возможность понять сущность химических превращений, определять состав сложных веществ.
химия перестала быть описательной наукой. Ученые-химики стали широко использовать измерение вещества. Все более совершенствовалась конструкция весов, позволяющих определять массы образцов. Для газообразных веществ помимо массы измеряли также объем и давление. Применение количественных измерений дало возможность понять сущность химических превращений, определять состав сложных веществ.
Как вы уже знаете, в состав сложного вещества входят два или более химических элементов. Очевидно, что масса всего вещества слагается из масс составляющих его элементов. Значит, на долю каждого элемента приходится определенная часть массы вещества.
Массовой долей элемента называется отношение массы этого элемента в сложном веществе к массе всего вещества, выраженное в долях единицы (или в процентах):
Массовая доля элемента в соединении обозначается латинской строчной буквой w
(«дубль-вэ») и показывает долю (часть массы), приходящуюся на данный элемент в общей массе вещества.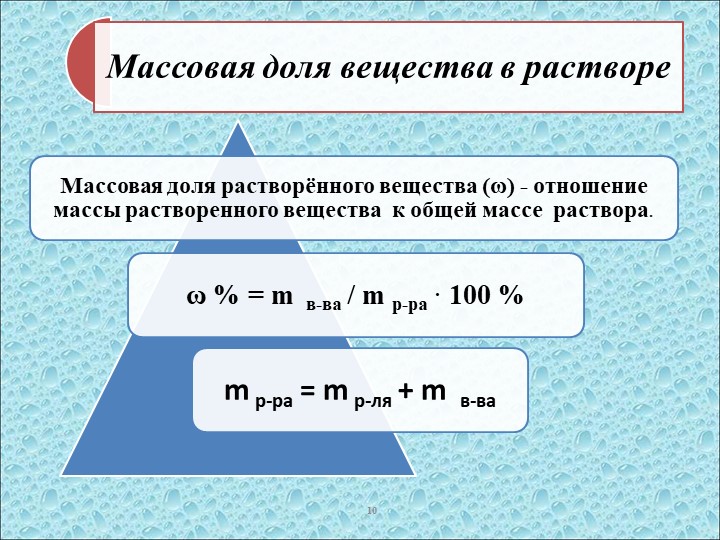 Эта величина может выражаться в долях единицы или в процентах. Конечно, массовая доля элемента в сложном веществе всегда меньше единицы (или меньше 100%). Ведь часть от целого всегда меньше целого, как долька апельсина меньше всего апельсина.
Эта величина может выражаться в долях единицы или в процентах. Конечно, массовая доля элемента в сложном веществе всегда меньше единицы (или меньше 100%). Ведь часть от целого всегда меньше целого, как долька апельсина меньше всего апельсина.
Например, в состав оксида ртути входят два элемента – ртуть и кислород. При нагревании 50 г этого вещества получается 46,3 г ртути и 3,7 г кислорода (рис. 57). Рассчитаем массовую долю ртути в сложном веществе:
Массовую долю кислорода в этом веществе можно рассчитать двумя способами. По определению массовая доля кислорода в оксиде ртути равна отношению массы кислорода к массе оксида:
Зная, что сумма массовых долей элементов в веществе равна единице (100%), массовую долю кислорода можно вычислить по разности:
w (O) = 1 – 0,926 = 0,074,
w (О) = 100% – 92,6% = 7,4%.
Для того чтобы найти массовые доли элементов предложенным способом, необходимо провести сложный и трудоемкий химический эксперимент по определению массы каждого элемента. Если же формула сложного вещества известна, та же задача решается значительно проще.
Если же формула сложного вещества известна, та же задача решается значительно проще.
Для расчета массовой доли элемента нужно его относительную атомную массу умножить на число атомов (n ) данного элемента в формуле и разделить на относительную молекулярную массу вещества:
Например, для воды (рис. 58):
M r (H 2 O) = 1 2 + 16 = 18,
Задача 1. Рассчитайте массовые доли элементов в аммиаке, формула которого NH 3 .
Дано:
вещество аммиак NH 3 .
Найти :
w (N), w (H).
Решение
1) Рассчитаем относительную молекулярную массу аммиака:
M r (NH 3) = A r (N) + 3A r (H) = 14 + 3 1 = 17.
2) Найдем массовую долю азота в веществе:
3) Вычислим массовую долю водорода в аммиаке:
w (H) = 1 – w (N) = 1 – 0,8235 = 0,1765, или 17,65%.
Ответ. w
(N) = 82,35%, w
(H) = 17,65%.
Задача 2. Рассчитайте массовые доли элементов в серной кислоте, имеющей формулу H 2 SO 4 .
Дано:
серная кислота H 2 SO 4 .
Найти :
w (H), w (S), w (O).
Решение
1) Рассчитаем относительную молекулярную массу серной кислоты:
M r (H 2 SO 4) = 2A r (H) + A r (S) + 4A r (O) = 2 1 + 32 + 4 16 = 98.
2) Найдем массовую долю водорода в веществе:
3) Вычислим массовую долю серы в серной кислоте:
4. Рассчитаем массовую долю кислорода в веществе:
w (O) = 1 – (w (H) + w (S)) = 1 – (0,0204 + 0,3265) = 0,6531, или 65,31%.
Ответ. w (H) = 2,04%, w (S) = 32,65%, w (O) = 65,31%.
Чаще химикам приходится решать обратную задачу: по массовым долям элементов определять формулу сложного вещества. То, как решаются подобные задачи, проиллюстрируем одним историческим примером.
Из природных минералов – тенорита и куприта – были выделены два соединения меди с кислородом (оксиды). Они отличались друг от друга по цвету и массовым долям элементов. В черном оксиде массовая доля меди составляла 80%, а массовая доля кислорода – 20%. В оксиде меди красного цвета массовые доли элементов составляли соответственно 88,9% и 11,1%. Каковы же формулы этих сложных веществ? Проведем несложные математические расчеты.
Пример 1. Расчет химической формулы черного оксида меди (w (Cu) = 0,8 и w (О) = 0,2).
х, у – по числу атомов химических элементов в его составе: Сu x O y .
2) Отношение индексов равно отношению частных от деления массовой доли элемента в соединении на относительную атомную массу элемента:
3) Полученное соотношение нужно привести к соотношению целых чисел: индексы в формуле, показывающие число атомов, не могут быть дробными. Для этого полученные числа разделим на меньшее (т.е. любое) из них:
Получилась формула – СuO.
Пример 2. Расчет формулы красного оксида меди по известным массовым долям w (Cu) = 88,9% и w (O) = 11,1%.
Дано:
w (Cu) = 88,9%, или 0,889,
w (O) = 11,1%, или 0,111.
Найти:
Решение
1) Обозначим формулу оксида Сu x O y .
2) Найдем соотношение индексов x и y :
3) Приведем соотношение индексов к отношению целых чисел:
Ответ . Формула соединения – Cu 2 O.
А теперь немного усложним задачу.
Задача 3. По данным элементного анализа состав прокаленной горькой соли, использовавшейся еще алхимиками в качестве слабительного средства, следующий: массовая доля магния – 20,0%, массовая доля серы – 26,7%, массовая доля кислорода – 53,3%.
Дано:
w (Mg) = 20,0%, или 0,2,
w (S) = 26,7%, или 0,267,
w (O) = 53,3%, или 0,533.
Найти:
Решение
1) Обозначим формулу вещества с помощью индексов x, y, z
: Mg x
S y
O z
.
2) Найдем соотношение индексов:
3) Определим значение индексов x, y, z :
Ответ. Формула вещества – MgSO 4 .
1. Что называется массовой долей элемента в сложном веществе? Как рассчитывается эта величина?
2.
Рассчитайте массовые доли элементов в веществах: а) углекислом газе CO 2 ;
б) сульфиде кальция СаS; в) натриевой селитре NaNO 3 ; г) оксиде алюминия Al 2 O 3 .
3. В каком из азотных удобрений массовая доля питательного элемента азота наибольшая: а) хлориде аммония NH 4 Cl; б) сульфате аммония (NH 4) 2 SO 4 ; в) мочевине (NH 2) 2 CO?
4. В минерале пирите на 7 г железа приходится 8 г серы. Вычислите массовые доли каждого элемента в этом веществе и определите его формулу.
5. Массовая доля азота в одном из его оксидов равна 30,43%, а массовая доля кислорода – 69,57%. Определите формулу оксида.
6.
В средние века из золы костра выделяли вещество, которое называли поташ и использовали для варки мыла. Массовые доли элементов в этом веществе: калий – 56,6%, углерод – 8,7%, кислород – 34,7%. Определите формулу поташа.
Массовые доли элементов в этом веществе: калий – 56,6%, углерод – 8,7%, кислород – 34,7%. Определите формулу поташа.
Зная химическую формулу, можно вычислить массовую долю химических элементов в веществе. элемента в вещества обозначается греч. буквой «омега» — ω Э/В и рассчитывается по формуле:
где k — число атомов этого элемента в молекуле.
Какова массовая доля водорода и кислорода в воде (Н 2 О)?
Решение:
M r (Н 2 О) = 2*А r (Н) + 1*А r (О) = 2*1 + 1* 16 = 18
2) Вычисляем массовую долю водорода в воде:
3) Вычисляем массовую долю кислорода в воде. Так как в состав воды входят атомы только двух химических элементов, массовая доля кислорода будет равна:
Рис. 1. Оформление решения задачи 1
Рассчитайте массовую долю элементов в веществе H 3 PO 4 .
1) Вычисляем относительную молекулярную массу вещества:
M r (Н 3 РО 4) = 3*А r (Н) + 1*А r (Р) + 4*А r (О)= 3*1 + 1* 31 +4*16 = 98
2) Вычисляем массовую долю водорода в веществе:
3) Вычисляем массовую долю фосфора в веществе:
4) Вычисляем массовую долю кислорода в веществе:
1. Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. — М.: АСТ: Астрель, 2006.
Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. — М.: АСТ: Астрель, 2006.
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.34-36)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§15)
4. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. — М.: Аванта+, 2003.
1. Единая коллекция цифровых образовательных ресурсов ().
2. Электронная версия журнала «Химия и жизнь» ().
4. Видеоурок по теме «Массовая доля химического элемента в веществе» ().
Домашнее задание
1. с.78 № 2
из учебника «Химия: 8-й класс» (П.А. Оржековский, Л.М. Мещерякова, Л. С. Понтак. М.: АСТ: Астрель, 2005).
С. Понтак. М.: АСТ: Астрель, 2005).
2. с. 34-36 №№ 3,5 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
Понятие «доли» наверняка вам уж знакомо.
Например, кусок арбуза, изображенный на рисунке, составляет одну четверть от целого арбуза, то есть его доля равна 1/4 или 25%.
Чтобы лучше понять, что такое массовая доля представьте себе килограмм конфет (1000г), который мама купила своим трем детям. Из этого килограмма самому младшему ребенку досталась половина всех конфет (несправедливо конечно!). Старшему — лишь 200г, а среднему — 300г.
Значит массовая доля конфет у младшего ребенка составит половину, или 1/2 или 50%. У среднего ребенка будет 30%, а у старшего — 20%. Следует подчеркнуть, что массовая доля может быть безразмерной величиной (четверть, половина, треть, 1/5, 1/6 и т.д.), а может измеряться в процентах (%). При решении расчетных задач массовую долю лучше переводить в безразмерную величину.
При решении расчетных задач массовую долю лучше переводить в безразмерную величину.
Массовая доля вещества в растворе
Любой раствор состоит из растворителя и растворенного вещества. Вода — самый распространенный неорганический растворитель. Органическими растворителями могут быть спирт, ацетон, диэтиловый эфир и др. Если в условии задачи не указана растворитель, раствор считается водным.
Массовая доля растворенного вещества рассчитывается по формуле:
$\omega_\text{в-ва}=\dfrac{m_\text{в-ва}}{m_\text{р-ра}}(\cdot 100\%)$
Рассмотрим примеры решения задач.
Сколько граммов сахара и воды нужно взять для приготовления 150г 10%-ного раствора сахара?
Решение
m(р-ра)=150г
$\omega$(сахара)=10%=0,1
m(сахара)=?
m(сахара) = $\omega\textrm{(сахара)} \cdot m(p-pa) = 0,1 \cdot 150 \textrm{г} = 15 \textrm{г}$
m(воды)=m(р-ра) — m(сахара) = 150г — 15г=135г.
ОТВЕТ: нужно взять 15г сахара и 135г воды.
Раствор объемом 350 мл. и плотностью 1, 142 г/мл содержит 28 г хлорида натрия. Найти массовую долю соли в растворе.
Решение
V(р-ра)=350 мл.
$\rho$(р-ра)=1,142 г/мл
$\omega(NaCl)$=?
m(р-ра) =V(р-ра) $\cdot \rho$(р-ра)=350 мл $\cdot$ 1,142 г/мл=400г
$\omega(NaCl)=\dfrac{m(NaCl)}{m\textrm{(р-ра)}}=\dfrac{28\textrm{г}} {400\textrm{г}} = 0,07$=7%
ОТВЕТ: массовая доля хлорида натрия $\omega(NaCl)$=7%
МАССОВАЯ ДОЛЯ ЭЛЕМЕНТА В МОЛЕКУЛЕ
Формула химического вещества, например $H_2SO_4$, несет в себе много важной информации. Она обозначает либо отдельную молекулу вещества, которая характеризуется относительной атомной массой, либо 1 моль вещества, который характеризуется молярной массой. Формула показывает качественный (состоит из водорода, серы и кислорода) и количественный состав (состоит из двух атомов водорода, атома серы и четырех атомов кислорода). По химической формуле можно найти массу молекулы в целом (молекулярную массу), а также вычислить соотношение масс элементов в молекуле: m(H) : m(S) : m(O) = 2: 32: 64 = 1: 16: 32. При вычислении соотношений масс элементов нужно учитывать их атомную массу и количество соответствующих атомов: $m(H_2)=1*2=2$, $m(S)=32*1=32$, $m(O_4)=16*4=64$
При вычислении соотношений масс элементов нужно учитывать их атомную массу и количество соответствующих атомов: $m(H_2)=1*2=2$, $m(S)=32*1=32$, $m(O_4)=16*4=64$
Принцип расчета массовой доли элемента аналогичен принципу расчета массовой доли вещества в растворе и находится по схожей формуле:
$\omega_\text{эл-та}=\dfrac{Ar_{\text{эл-та}}\cdot n_{\textrm(атомов)}}{m_\text{молекулы}}(\cdot 100\%)$
Найти массовую долю элементов в серной кислоте.
Решение
Способ 1 (пропорция):
Найдем молярную массу серной кислоты:
$M(H_2SO_4) = 1\cdot 2 + 32 + 16 \cdot 4=98\hspace{2pt}\textrm{г/моль}$
Одна молекула серной кислоты содержит один атом серы, значит масса серы в серной кислоте составит: $m(S) = Ar(S) \cdot n(S) = 32\textrm{г/моль} \cdot 1$= 32г/моль
Примем массу всей молекулы за 100%, а массу серы — за Х% и составим пропорцию:
$M(H_2SO_4)$=98 г/моль — 100%
m(S) = 32г/моль — Х%
Откуда $X=\dfrac{32\textrm{г/моль} \cdot 100\%}{98\textrm{г/моль}} =32, 65\% =32\%$
Способ 2 (формула):
$\omega(S)=\dfrac{Ar_{\text{эл-та}}\cdot n_{\textrm(атомов)}}{m_\text{молекулы}}(\cdot 100\%)=\dfrac{Ar(S)\cdot 1}{M(H_2SO_4)}(\cdot 100\%)=\dfrac{32\textrm{г/моль}\cdot 1}{98\textrm{г/моль}}(\cdot 100\%) \approx32, 7\%$
Аналогично по формуле рассчитаем массовые доли водорода и кислорода:
$\omega(H)=\dfrac{Ar(H)\cdot 2}{M(H_2SO_4)}(\cdot 100\%)=\dfrac{1\textrm{г/моль}\cdot 2}{98\textrm{г/моль}}(\cdot 100\%)\approx2\%$
$\omega(O)=\dfrac{Ar(O)\cdot 4}{M(H_2SO_4)}(\cdot 100\%)=\dfrac{16\textrm{г/моль}\cdot 4}{98\textrm{г/моль}}(\cdot 100\%)\approx65, 3\%$
ТЕМА УРОКА:
Массовая доля химического элемента в соединении.
ЦЕЛЬ УРОКА: Научить вычислять массовую долю элементов в соединении по формуле соединения и устанавливать химическую формулу сложного вещества по известным массовым долям химических элементов.
Основные понятия. Массовая доля химического элемента.
Планируемые результаты обучения
Предметные. Уметь рассчитывать массовую долю элемента в соединении по его формуле и устанавливать химическую формулу сложного вещества по известным массовым долям химических элементов.
Метапредметные . Формировать умения устанавливать аналогии, использовать алгоритмы для решения учебных и познавательных задач.
Основные виды деятельности учащихся. Рассчитывать массовую долю элемента в соединении по его формуле. Устанавливать химическую формулу сложного вещества по известным массовым долям химических элементов.
Структура урока
I . Организационный этап
II . Актуализация опорных знаний
III
. Изучение нового материала
Изучение нового материала
IV . Закрепление. Подведение итогов урока
V . Домашнее задание
Ход урока
Организационный момент.
Проверка домашнего задания.
Актуализация опорных знаний.
Дайте определения: относительной атомной массе, относительной молекулярной массе.
В каких единицах можно измерить относительную атомную массу.
В каких единицах можно измерить относительную молекулярную массу.
Изучение нового материала.
Работа с учебником. Рабочая тетрадь.
Ребята, допустим у нас есть вещество — серная кислота H 2 SO 4,
можем мы ли узнать какие атомы входят в состав соединения.
А их количество?
А в каком массовом соотношении они соединяются?
Вычисление массовых отношений химических
элементов в сложном веществе. (стр. 51)
А как можно узнать в каких массовых отношениях соединены элементы в соединении формула которого H 2 SO 4 ?
m
(H
):
m
(S
):
m
(O
)= 2*2 + 32 + 16*4= 2:32:64 = 1:16:32.
1+16+32 = 49, то есть 49 массовых частей серной кислоты, содержаться 1 массовая часть водорода, 16 массовых частей серы, 32 массовых частей кислорода.
Ребята, а как вы думаете, можем ли мы рассчитать долю каждого элемента в соединении?
Сегодня мы с вами познакомимся с новым понятием массовая доля элемента в соединении.
W — массовая доля элемента в соединении.
n — число атомов элемента.
Mr — относительная молекулярная масса.
Вычисление массовых долей химических элементов
в сложном веществе. (РТ)
1. Изучите алгоритм вычисления массовой доли элемента в соединении.
Задача №1 (РТ)
Вывод химических формул, если известны массовые доли химических элементов,
входящих в состав данного вещества. (РТ)
2. Изучите алгоритм вычисления массовой доли элемента в соединении.
Задача №5 (РТ)
Закрепление изученного материала.
РТ стр. 25 №2.
РТ стр. 27 №6.
Подведение итогов урока.
Какие новые понятия вы узнали сегодня на уроке?
Самостоятельная работа.
Домашнее задание:
изучить §15 стр. 51 — 53;
ответить на вопросы №3,4,7 стр. 53-54 (письменно).
П еречень использованной литературы.
Учебник. Химия 8 класс. авт. Г.Е. Рудзитис, Ф.Г. Фельдман. Издательство «Просвещение», 2014.
Рабочая тетрадь по химии. авт. Боровских Т.А.
Массовая доля элемента в веществе — Учебник по Химии. 7 класс. Григорович
Учебник по Химии. 7 класс. Григорович — Новая программа
Химическая формула вещества содержит определенную информацию. Она не только отображает качественный состав вещества (т. е. информацию о химических элементах, из которых она состоит), но и его количественный состав.
Например, в молекуле воды на два атома Гидрогена приходится один атом Оксигена. Суммарная относительная атомная масса атомов Гидрогена равна 2 (2 • Аr(Н) = 2 • 1 = 2), а относительная атомная масса атома Оксигена равна 16 (Аr(О) = 16). Следовательно, на 2 массовые части Гидрогена в воде приходится 16 массовых частей Оксигена.
Суммарная относительная атомная масса атомов Гидрогена равна 2 (2 • Аr(Н) = 2 • 1 = 2), а относительная атомная масса атома Оксигена равна 16 (Аr(О) = 16). Следовательно, на 2 массовые части Гидрогена в воде приходится 16 массовых частей Оксигена.
Чтобы описать количественный состав веществ, используют массовую долю элемента в соединении, которую можно вычислить по химической формуле. Массовая доля элемента показывает, какая часть массы вещества приходится на атомы данного элемента. Ее вычисляют как отношение атомной массы данного элемента с учетом числа его атомов в молекуле к относительной молекулярной массе вещества:
где w(Е) — массовая доля химического элемента Е, выраженная в долях единицы;
п — число атомов элемента Е, обозначенное индексом в формуле соединения;
А — относительная атомная масса элемента Е;
Мr — относительная молекулярная масса вещества.
Физическая суть массовой доли заключается в том, что она показывает массу атомов данного элемента в 100 г вещества. Массовая доля может выражаться в долях единицы или процентах. Чтобы перевести доли единицы в проценты, необходимо полученные по формуле значения умножить на 100 %. Сумма массовых долей всех элементов, которые входят в состав соединения, должна быть равна 1 или 100 %.
Массовая доля может выражаться в долях единицы или процентах. Чтобы перевести доли единицы в проценты, необходимо полученные по формуле значения умножить на 100 %. Сумма массовых долей всех элементов, которые входят в состав соединения, должна быть равна 1 или 100 %.
Пример 1. Вычислите массовые доли химических элементов в углекислом газе СO2.
Решение:
Вычислим относительную молекулярную массу углекислого газа:
Mr(СO2) = Ar(С) + 2 • Ar(О) = 12 + 2 • 16 = 44
Вычислим массовые доли Карбона и Оксигена:
Сумма массовых долей Карбона и Оксигена в углекислом газе должна быть равна 1, поэтому массовую долю Оксигена можно определить, вычитая из единицы массовую долю Карбона:
w(O) = 1 — w(С) = 1 — 0,273 = 0,727
Ответ: w(C) = 27,3 %, w(О) = 72,7 %
Пример 2. Вычислите массу атомов Оксигена, содержащихся в воде массой 1 кг.
Решение:
Вычислим массовую долю Оксигена в воде:
Массовая доля элемента показывает часть массы вещества, приходящуюся на данный элемент.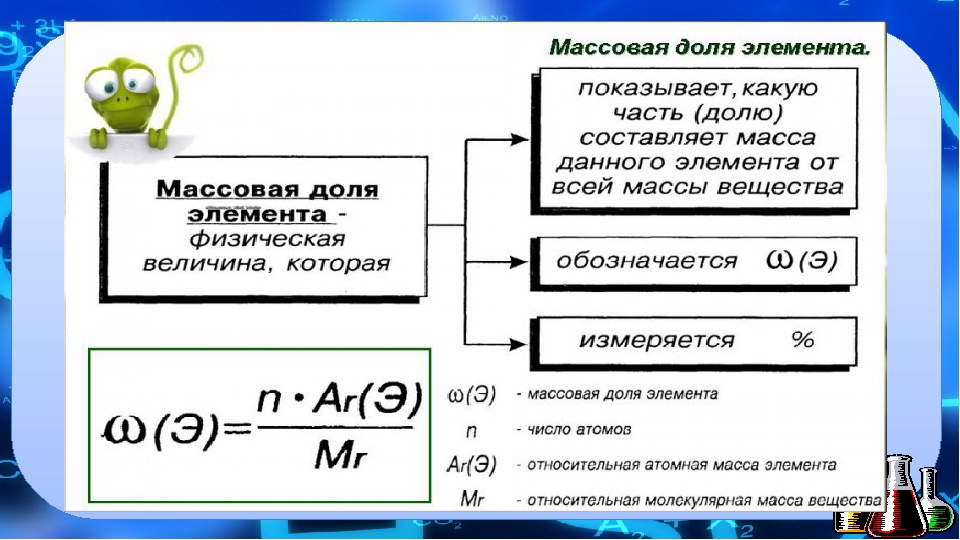 Вычислим массу атомов Оксигена в воде массой 1 кг:
Вычислим массу атомов Оксигена в воде массой 1 кг:
m(O) = w(O) • m(Н2O) = 0,889 • 1000 г = 889 г
Ответ: m(O) = 889 г.
Законы Пруста и Дальтона
До начала XIX в. измерениям масс веществ не придавали особого значения и в науке бытовала мысль, что состав вещества может изменяться в зависимости от способа его получения.
Жозеф Луи Пруст (1754-1826)
Выдающийся французский химик, сын аптекаря. С 11 лет изучал аптекарское дело. В лаборатории своего отца в одиночестве любил смешивать реактивы, в результате чего чуть не отравился ядовитым газом. С 14 лет изучал химию в Париже. Был руководителем кафедры химии в университете Мадрида. Пруст проводил исследования в различных областях химии — минералогии, фармации, аналитической химии, изучал пороховые смеси. Он изобрел лекарство от цинги и некоторые пищевые добавки, разработал технологию выделения сахара из винограда и свеклы. Открыл закон постоянства состава веществ.
И действительно, почему соединение всегда должно содержать, скажем, 4 г элемента X и 1 г элемента Y? Почему оно не может содержать 4,1 или 3,9 г X? Но если материя состоит из атомов, то соединение образуется в результате соединения одного атома X с одним атомом Y в одну молекулу, и никак иначе. В таком случае соотношения масс атомов X и Y должны быть постоянными и ни от чего не зависеть.
Проведя многочисленные опыты, французский химик Ж. Л. Пруст доказал постоянство соотношений масс элементов в различных веществах. На основании своих экспериментов он сформулировал закон постоянства состава вещества, который утверждает, что любое вещество имеет постоянный состав независимо от способа его получения. Например, кислород можно получить разложением разных веществ, но его формула всегда будет одинаковой — O2.
Позднее Дж. Дальтон определил, что атомы разных элементов могут соединяться в разных соотношениях, но эти соотношения всегда кратны относительным атомным массам элементов. Например, атомы Карбона и Оксигена могут образовывать молекулы СО (угарный газ) и СO2 (углекислый газ). Но в этом случае образуются разные вещества, для каждого из которых характерно постоянство состава. Эти исследования Дальтона со временем оформились в закон кратных соотношений.
Например, атомы Карбона и Оксигена могут образовывать молекулы СО (угарный газ) и СO2 (углекислый газ). Но в этом случае образуются разные вещества, для каждого из которых характерно постоянство состава. Эти исследования Дальтона со временем оформились в закон кратных соотношений.
Выводы:
1. Химическая формула содержит информацию о количественном составе вещества. По химической формуле можно определить соотношение масс атомов разных химических элементов в веществе.
2. По химической формуле вычисляют массовую долю элемента в веществе как отношение массы атомов данного элемента к относительной молекулярной массе вещества. Массовая доля элемента показывает, какая часть массы вещества приходится на данный химический элемент.
Контрольные вопросы
1. Каким способом можно определить количественный состав веществ?
2. Как определяется массовая доля элемента в веществе? Приведите формулу для ее вычисления.
3. Какова физическая суть понятия «массовая доля элемента в веществе»?
Какова физическая суть понятия «массовая доля элемента в веществе»?
4. Выберите правильные утверждения: а) по химической формуле можно узнать, какие химические элементы входят в состав вещества; б) по химической формуле можно узнать соотношение атомов разных элементов в веществе; в) по химической формуле можно узнать, сколько атомов каждого элемента входит в состав молекулы вещества; г) по химической формуле можно узнать форму молекулы вещества.
5. Выберите правильный ответ. Массовая доля элемента в веществе показывает; а) во сколько раз масса одного атома больше массы молекулы; б) массу атомов данного химического элемента в 100 г вещества;
в) отношение массы атомов данного химического элемента к молекулярной массе; г) сколько атомов каждого элемента входит в состав молекулы.
Задания для усвоения материала
1. Вычислите массовые доли всех элементов в соединениях со следующими химическими формулами; a) NO2; б) РbСl2; в) Na2CO3; г) H2SO4; Д) Ва3(РO4)2.
2. Формула глюкозы С6Н12O6, формула сахарозы С12Н22O11 В каком веществе массовая доля Оксигена больше?
3. Вычислите массу атомов Гидрогена, которые содержатся в аммиаке NH3 массой 10 г.
4. Масса воды на Земле оценивается приблизительно в 1,45 • 1018 тонн. Вычислите, какая масса атомов Гидрогена и Оксигена содержится в этой массе воды.
Интересно, что…
По соотношениям масс атомов в XIX в. были определены химические формулы почти всех известных к тому времени веществ. Возможность выражения состава вещества простыми соотношениями стала одним из доказательств существования атомов.
ГДЗ к учебнику можно найти тут. Массовая доля в химии. Вычисление массовой доли химического элемента в веществе
С XVII в. химия перестала быть описательной наукой. Ученые-химики стали широко использовать методы измерения различных параметров вещества. Все более совершенствовалась конструкция весов, позволяющих определять массы образцов для газообразных веществ, помимо массы, измеряли также объем и давление. Применение количественных измерений дало возможность понять сущность химических превращений, определять состав сложных веществ.
Все более совершенствовалась конструкция весов, позволяющих определять массы образцов для газообразных веществ, помимо массы, измеряли также объем и давление. Применение количественных измерений дало возможность понять сущность химических превращений, определять состав сложных веществ.
Как вы уже знаете, в состав сложного вещества входят два или более химических элемента. Очевидно, что масса всего вещества слагается из масс составляющих его элементов. Значит, на долю каждого элемента приходится определенная часть массы вещества.
Массовая доля элемента в веществе обозначается латинской строчной буквой w (дубль-вэ) и показывает долю (часть массы), приходящуюся на данный элемент в общей массе вещества. Эта величина может выражаться в долях единицы или в процентах (рис. 69). Конечно, массовая доля элемента в сложном веществе всегда меньше единицы (или меньше 100%). Ведь часть от целого всегда меньше целого, как долька апельсина меньше всего апельсина.
Рис. 69.
Диаграмма элементного состава оксида ртути
Например, в состав оксида ртути HgО входят два элемента — ртуть и кислород. При нагревании 50 г этого вещества получается 46,3 г ртути и 3,7 г кислорода. Рассчитаем массовую долю ртути в сложном веществе:
При нагревании 50 г этого вещества получается 46,3 г ртути и 3,7 г кислорода. Рассчитаем массовую долю ртути в сложном веществе:
Массовую долю кислорода в этом веществе можно рассчитать двумя способами. По определению массовая доля кислорода в оксиде ртути равна отношению массы кислорода к массе оксида ртути:
Зная, что сумма массовых долей элементов в веществе равна единице (100%), массовую долю кислорода можно вычислить по разности:
Для того чтобы найти массовые доли элементов предложенным способом, необходимо провести сложный и трудоемкий химический эксперимент по определению массы каждого элемента. Если же формула сложного вещества известна, та же задача решается значительно проще.
Для расчета массовой доли элемента нужно его относительную атомную массу умножить на число атомов данного элемента в формуле и разделить на относительную молекулярную массу вещества.
Например, для воды (рис. 70):
Давайте потренируемся в решении задач на вычисление массовых долей элементов в сложных веществах.
Задача 1. Рассчитайте массовые доли элементов в аммиаке, формула которого NH 3 .
Задача 2. Рассчитайте массовые доли элементов в серной кислоте, имеющей формулу H 2 SО 4 .
Чаще химикам приходится решать обратную задачу: по массовым долям элементов определять формулу сложного вещества.
То, как решаются подобные задачи, проиллюстрируем одним историческим примером.
Задача 3. Из природных минералов — тенорита и куприта (рис. 71) были выделены два соединения меди с кислородом (оксиды). Они отличались друг от друга по цвету и массовым долям элементов. В черном оксиде (рис. 72), выделенном из тенорита, массовая доля меди составляла 80%, а массовая доля кислорода — 20%. В оксиде меди красного цвета, выделенного из куприта, массовые доли элементов составляли соответственно 88,9% и 11,1% . Каковы же формулы этих сложных веществ? Решим эти две несложные задачи.
Рис. 71. Минерал куприт
Рис. 72. Оксид меди черного цвета, выделенный из минерала тенорита
3. Полученное соотношение нужно привести к значениям целых чисел: ведь индексы в формуле, показывающие число атомов, не могут быть дробными. Для этого полученные числа надо разделить на меньшее из них (в нашем случае они равны).
Полученное соотношение нужно привести к значениям целых чисел: ведь индексы в формуле, показывающие число атомов, не могут быть дробными. Для этого полученные числа надо разделить на меньшее из них (в нашем случае они равны).
А теперь немного усложним задачу.
Задача 4. По данным элементного анализа, прокаленная горькая соль имеет следующий состав: массовая доля магния 20,0%, массовая доля серы — 26,7% , массовая доля кислорода — 53,3% .
Вопросы и задания
- Что называется массовой долей элемента в сложном веществе? Как рассчитывается эта величина?
- Рассчитайте массовые доли элементов в веществах: а) углекислом газе СО 2 ; б) сульфиде кальция CaS; в) натриевой селитре NaNО 3 ; г) оксиде алюминия А1 2 О 3 .
- В каком из азотных удобрений массовая доля питательного элемента азота наибольшая: а) хлориде аммония NH 4 C1; б) сульфате аммония (NH 4) 2 SО 4 ; в) мочевине (NH 2) 2 СО?
- В минерале пирите на 7 г железа приходится 8 г серы.
 Вычислите массовые доли каждого элемента в этом веществе и определите его формулу.
Вычислите массовые доли каждого элемента в этом веществе и определите его формулу. - Массовая доля азота в одном из его оксидов равна 30,43%, а массовая доля кислорода — 69,57%. Определите формулу оксида.
- В средние века из золы костра выделяли вещество, которое называли поташ и использовали для варки мыла. Массовые доли элементов в этом веществе составляют: калий — 56,6%, углерод — 8,7%, кислород — 34,7%. Определите формулу поташа.
Массовая доля вещества – это отношение массы определенного вещества к массе смеси либо раствора, в котором находится данное вещество. Выражается в долях единицы либо в процентах.
Инструкция
1.
Массовая доля вещества находится по формуле: w = m(в)/m(см), где w – массовая доля вещества, m(в) – масса вещества, m(см) – масса смеси. Если же вещество растворено, то формула выглядит так: w = m(в)/m(р-ра), где m(р-ра) – масса раствора. Массу раствора при необходимости тоже дозволено обнаружить: m(р-ра) = m(в) + m(р-ля), где m(р-ля) – масса растворителя. При желании массовую долю дозволено умножить на 100%.
При желании массовую долю дозволено умножить на 100%.
2. Если в условии задачи не дано значения массы, то его дозволено рассчитать с поддержкой нескольких формул, предпочесть надобную помогут величины данные в условии. Первая формула для нахождения массы: m = V*p, где m – масса, V – объем, p – плотность. Дальнейшая формула выглядит так: m = n*M, где m – масса, n – число вещества, M – молярная масса. Молярная масса в свою очередь складывается из ядерных масс элементов, входящих в состав вещества.
3.
Для лучшего понимания данного материала решим задачу. Смесь медных и магниевых опилок массой 1,5 г обработали избытком серной кислоты. В итоге реакции выделился водород объемом 0,56 л (типичные данные). Вычислите массовую долю меди в смеси. В этой задаче проходит реакция, записываем ее уравнение. Из 2-х веществ с избытком соляной кислоты взаимодействует только магний: Mg + 2HCl = MgCl2 + h3. Дабы обнаружить массовую долю меди в смеси, нужно подставить значения в следующую формулу: w(Cu) = m(Cu)/m(см). Масса смеси дана, обнаружим массу меди: m(Cu) = m(см) – m(Mg). Ищем массу магния: m(Mg) = n(Mg)*M(Mg). Обнаружить число вещества магния поможет уравнение реакции. Находим число вещества водорода: n = V/Vm = 0,56/22,4 = 0,025 моль. По уравнению видно, что n(h3) = n(Mg) = 0,025 моль. Рассчитываем массу магния, зная что молярная масса магния равна 24 г/моль: m(Mg) = 0,025*24 = 0,6 г. Находим массу меди: m(Cu) = 1,5 – 0,6 = 0,9 г. Осталось вычислить массовую долю: w(Cu) = 0,9/1,5 = 0,6 либо 60%.
Масса смеси дана, обнаружим массу меди: m(Cu) = m(см) – m(Mg). Ищем массу магния: m(Mg) = n(Mg)*M(Mg). Обнаружить число вещества магния поможет уравнение реакции. Находим число вещества водорода: n = V/Vm = 0,56/22,4 = 0,025 моль. По уравнению видно, что n(h3) = n(Mg) = 0,025 моль. Рассчитываем массу магния, зная что молярная масса магния равна 24 г/моль: m(Mg) = 0,025*24 = 0,6 г. Находим массу меди: m(Cu) = 1,5 – 0,6 = 0,9 г. Осталось вычислить массовую долю: w(Cu) = 0,9/1,5 = 0,6 либо 60%.
Массовая доля показывает в процентах либо в долях оглавление вещества в каком–либо растворе либо элемента в составе вещества. Знание вычислить массовую долю благотворно не только на уроках химии, но и когда вы хотите приготовить раствор либо смесь, скажем, в кулинарных целях. Либо изменить процентное отношение, в теснее имеющемся у вас составе.
Инструкция
1.
Массовая доля вычисляется как отношение массы данного компонента к всеобщей массе раствора. Для приобретения итога в процентах, нужно полученное частное умножить на 100. Выглядит формула дальнейшим образом:?=m (растворенного вещества)/m (раствора)?, % = ?*100
Выглядит формула дальнейшим образом:?=m (растворенного вещества)/m (раствора)?, % = ?*100
2.
Разглядим для примера прямую и обратную задачи.Скажем, вы растворили в 100 граммах воды 5 грамм поваренной соли. Какой процентности раствор вы получили? Решение дюже примитивное. Массу вещества (поваренной соли) вы знаете, масса раствора будет равна сумме из масс воды и соли. Таким образом, следует 5 г поделить на 105 г и итог деления умножить на 100 – это и будет результат: 4,7%-ый раствор у вас получится.Сейчас обратная задача. Вы хотите приготовить 200 гр 10%-ого водного раствора чего желательно. Сколько вещества брать для растворения? Действуем в обратном порядке, массовую долю, выраженную в процентах (10%) разделяем на 100. Получим 0,1. Сейчас составим несложное уравнение, где надобное число вещества обозначим x и, следственно, массу раствора как 200 г+x. Наше уравнение будет выглядеть так: 0,1=x/200г+x. Когда мы его решим то получим что х равняется приблизительно 22,2 г. Проверяется итог решением прямой задачи.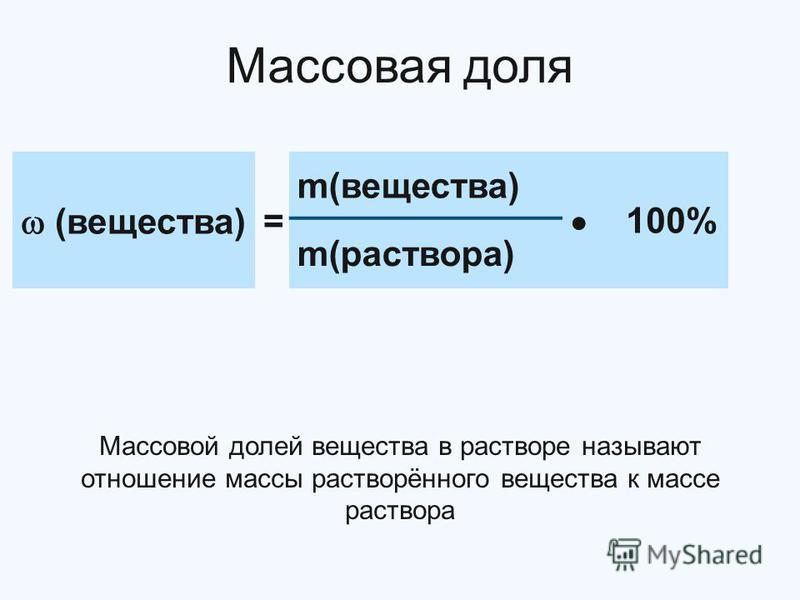
3. Труднее узнать какие числа растворов вестимой процентности нужно взять для приобретения определенного числа раствора с новыми заданными качествами. Тут требуется составить и решить теснее систему уравнений. В этой системе первое уравнение – это выражение знаменитой массы получаемой смеси, через две незнакомые массы начальных растворов. Скажем, если наша цель получить 150 гр раствора, уравнение будет иметь вид x+y=150 г. Второе уравнение – масса растворенного вещества приравненная к сумме этого же вещества, в составе 2-х смешиваемых растворов. Скажем, если хотите иметь 30%-ый раствор, а растворы, которые вы смешиваете 100%-ый, то есть чистое вещество, и 15%-ый, то второе уравнение будет иметь вид: x+0,15y = 45 г. Дело за малым, решить систему уравнение и узнать сколько нужно добавить вещества к 15%-ому раствору, дабы получить 30%-ый раствор. Испробуйте.
Видео по теме
Дабы рассчитать количество
вещества
, узнайте его массу с подмогой весов, выразите ее в граммах и поделите на молярную массу, которую дозволено обнаружить с поддержкой таблицы Менделеева. Для определения числа вещества
газа в типичных условиях примените закон Авогадро. Если газ находится в иных условиях, измерьте давление, объем и температуру газа, позже чего рассчитайте количество
вещества
в нем.
Для определения числа вещества
газа в типичных условиях примените закон Авогадро. Если газ находится в иных условиях, измерьте давление, объем и температуру газа, позже чего рассчитайте количество
вещества
в нем.
Вам понадобится
Инструкция
1.
Определение числа вещества
в твердом теле либо жидкости. Обнаружьте массу исследуемого тела при помощи весов, выразите ее в граммах. Определите, из какого вещества
состоит тело, после этого с поддержкой периодической таблицы Менделеева обнаружьте молярную массу вещества
. Для этого обнаружьте элементы, входящие в состав молекулы вещества
из которого состоит тело. По таблице определите их ядерные массы, если в таблице указывается дробное число, округлите его до целого. Обнаружьте сумму масс всех атомов, входящих в молекулу вещества
, получите молекулярную массу, которая численно равна молярной массе вещества
в граммах на моль. Позже этого, измеренную ранее массу поделите на молярную массу. В итоге получите количество
вещества
в молях (?=m/M).
В итоге получите количество
вещества
в молях (?=m/M).
2. Число вещества газа в типичных условиях. Если газ находится типичных условиях (0 градусов Цельсия и 760 мм рт. ст.), обнаружьте его объем. Для этого измерьте объем помещения, баллона либо сосуда, где он находится, от того что газ занимает каждый объем, ему предоставленный. Дабы получить его значение измерьте геометрические размеры сосуда, где он находится с поддержкой рулетки и с поддержкой математических формул, обнаружьте его объем. Особенно классическим случаем является комната в форме параллелепипеда. Измерьте ее длину, ширину и высоту в метрах, после этого перемножьте их и получите объем газа, тот, что в ней находится в кубических метрах. Дабы обнаружить количество вещества газа, полученный объем поделите на число 0,0224 – молярный объем газа при типичных условиях.
3.
Число вещества
газа с произвольными параметрами. Измерьте давление газа манометром в паскалях, его температуру в кельвинах, для чего к градусам Цельсия, в которых измеряет термометр, прибавьте число 273. Определите также объем газа в кубических метрах. Дабы обнаружить количество
вещества
произведение давления и объема поделите на температуру и число 8,31 (универсальную газовую непрерывную), ?=PV/(RT).
Определите также объем газа в кубических метрах. Дабы обнаружить количество
вещества
произведение давления и объема поделите на температуру и число 8,31 (универсальную газовую непрерывную), ?=PV/(RT).
Видео по теме
Многие жидкости представляют собой растворы. Именно таковы, в частности, кровь человека, чай, кофе, морская вода. Основой раствора является растворенное вещество. Существуют задачи на нахождение массовой доли этого вещества.
Инструкция
1.
Растворами именуются однородные гомогенные системы, которые состоят из 2-х и больше компонентов. Они делятся на три категории:- жидкие растворы;- твердые растворы;- газообразные растворы.К жидким растворам относится, скажем, разбавленная серная кислота, к твердым – сплав железа и меди, а к газообразным – всякие смеси газов. Самостоятельно от того, в каком агрегатном состоянии находится раствор, он состоит из растворителя и растворенного вещества. Растворителем почаще каждого обыкновенно является вода, которой разбавляют вещество. Состав растворов выражается разным образом, особенно зачастую для этого применяют значение массовой доли растворенного вещества. Массовая доля является безразмерной величиной, и она равна отношению массы растворенного вещества к всеобщей массе каждого раствора:?в=mв/mМассовую долю выражают в процентах либо десятичных дробях. Дабы вычислить данный параметр в процентах, применяйте следующую формулу:w(вещества)=mв/m (раствора)·100 %.Для нахождения того же параметра в виде десятичной дроби умножение на 100 % не осуществляйте.
Состав растворов выражается разным образом, особенно зачастую для этого применяют значение массовой доли растворенного вещества. Массовая доля является безразмерной величиной, и она равна отношению массы растворенного вещества к всеобщей массе каждого раствора:?в=mв/mМассовую долю выражают в процентах либо десятичных дробях. Дабы вычислить данный параметр в процентах, применяйте следующую формулу:w(вещества)=mв/m (раствора)·100 %.Для нахождения того же параметра в виде десятичной дроби умножение на 100 % не осуществляйте.
2. Масса каждого раствора представляет собой сумму масс воды и растворенного вещества. Следственно изредка формулу, указанную выше, записывают несколько другим образом:?в=mв/(mв+m(h3O)), где m (раствора)=mв+m(h3O)Скажем, разбавленная азотная кислота состоит из растворителя – воды, и растворенного вещества -кислоты. Из этого следует, что масса растворенного вещества вычисляется дальнейшим образом:?в=mHNO3/mHNO3+mh3O
3.
Если масса вещества неведома, а дана лишь масса воды, то в таком случае массовая доля находится по несколько другой формуле. Когда знаменит объем растворенного вещества, массу его находите по дальнейшей формуле:mв=V*?Из этого следует, что массовая доля вещества вычисляется дальнейшим образом:?в=V*?/V*?+m(h3O)
Когда знаменит объем растворенного вещества, массу его находите по дальнейшей формуле:mв=V*?Из этого следует, что массовая доля вещества вычисляется дальнейшим образом:?в=V*?/V*?+m(h3O)
4. Нахождение массовой доли вещества неоднократно осуществляется и в утилитарных целях. Скажем, при отбеливании какого-нибудь материала нужно знать концентрацию пергидроля в растворе перекиси. Помимо того, точное вычисление массовой доли изредка требуется во врачебной практике. Помимо формул и примерного вычисления массовой доли в медицине применяют еще и экспериментальную проверку с подмогой приборов, что дозволяет уменьшить вероятность ошибок.
5.
Существует несколько физических процессов, в ходе которых меняется массовая доля вещества и состав раствора. 1-й из них, называемый упариванием, представляет собой процесс, обратный растворению вещества в воде. При этом, растворенное вещество остается, а вода всецело упаривается. В этом случае массовая доля быть измерена не может – раствор отсутствует. Прямо противоположный процесс – разбавление концентрированного раствора. Чем огромнее он разбавляется, тем крепче уменьшается массовая доля вещества, растворенного в нем. Концентрирование представляет собой частичное упаривание, при котором испаряется не каждая вода, а лишь ее часть. Массовая доля вещества в растворе при этом возрастает.
Прямо противоположный процесс – разбавление концентрированного раствора. Чем огромнее он разбавляется, тем крепче уменьшается массовая доля вещества, растворенного в нем. Концентрирование представляет собой частичное упаривание, при котором испаряется не каждая вода, а лишь ее часть. Массовая доля вещества в растворе при этом возрастает.
Видео по теме
Что такое массовая доля элемента ? Из самого наименования дозволено осознать, что это величина, указывающая, в каком соотношении находятся масса элемента , входящего в состав вещества, и всеобщая масса этого вещества. Она выражается в долях единицы: процентах (сотых долях), промилле (тысячных) и т.д. Как дозволено вычислить массу какого-нибудь элемента ?
Инструкция
1.
Для наглядности разглядите отлично знаменитый каждому углерод, без которого не было бы органики. Если углерод представляет собою чистое вещество (скажем, алмаз), то его массовую долю
дозволено храбро принять за единицу либо за 100%. Разумеется, алмаз тоже содержит примеси других элементов, но в большинстве случаев, в столь мелких числах, что ими дозволено пренебречь. А вот в таких модификациях углерода, как каменный уголь либо графит, оглавление примесей достаточно высокое, и такое игнорирование неприемлемо.
Разумеется, алмаз тоже содержит примеси других элементов, но в большинстве случаев, в столь мелких числах, что ими дозволено пренебречь. А вот в таких модификациях углерода, как каменный уголь либо графит, оглавление примесей достаточно высокое, и такое игнорирование неприемлемо.
2. Если же углерод входит в состав трудного вещества, нужно делать дальнейшим образом: запишите точную формулу вещества, после этого, зная молярные массы всякого элемента , входящего в его состав, вычислите точную молярную массу этого вещества (разумеется, с учетом «индекса» всякого элемента ). Позже этого определить массовую долю , поделив всеобщую молярную массу элемента на молярную массу вещества.
3.
Скажем, надобно обнаружить массовую долю
углерода в уксусной кислоте. Напишите формулу уксусной кислоты: СН3СООН. Для упрощения подсчетов преобразуйте ее в вид: С2Н4О2. Молярная масса этого вещества складывается из молярных масс элементов: 24 + 4 + 32 = 60. Соответственно, массовая доля углерода в этом веществе вычисляется так: 24/60 = 0,4.
Соответственно, массовая доля углерода в этом веществе вычисляется так: 24/60 = 0,4.
4. Если надобно исчислить ее в процентном соотношении, соответственно, 0,4 * 100 = 40%. То есть в всяком килограмме уксусной кислоты содержится (примерно) 400 грамм углерода.
5. Разумеется, абсолютно аналогичным образом дозволено обнаружить массовые доли всех других элементов. Скажем, массовая доля кислорода в той же уксусной кислоте вычисляется так: 32/60 = 0,533 либо приблизительно 53,3%; а массовая доля водорода равна 4/60 = 0,666 либо приблизительно 6,7%.
6. Для проверки точности вычислений сложите процентные доли всех элементов:40% (углерод) + 53,3% (кислород) + 6,7% (водород) = 100%. Счет сошелся.
У вас есть двухсотлитровая бочка. Вы планируете ее всецело заправить дизельным топливом, которое используете для отопления своей мини-котельной. А сколько она будет весить, наполненная соляром? Теперь вычислим.
Вам понадобится
- – таблица удельной плотности веществ;
- – знание изготавливать простейшие математические вычисления.

Инструкция
1. Дабы обнаружить массу вещества по его объему, воспользуйтесь формулой удельной плотности вещества.p = m/vздесь p – удельная плотность вещества;m – его масса;v – занимаемый объем. Массу будем считать в граммах, килограммах и тоннах. Объемы в кубических сантиметрах, дециметрах и мерах. И удельную плотность, соответственно, в г/см3, кг/дм3, кг/м3, т/м3.
2. Выходит, по условиям задачи, у вас есть двухсотлитровая бочка. Это значит: бочка емкостью 2 м3. Двухсотлитровой ее называют, так как воды, с ее удельной плотностью равной единице, в такую бочку входит 200 литров.Вас волнует масса. Следственно выводите ее в представленной формуле на первое место.m = p*vВ правой части формулы незнакомо значение р – удельная плотность дизельного топлива. Обнаружьте его по справочнику. Еще проще – задать в поиск запрос в интернете «удельная плотность дизельного топлива».
3.
Обнаружили: плотность летнего дизельного топлива при t = +200 С – 860 кг/м3. Подставляйте значения в формулу:m = 860*2 = 1720 (кг)1 тонна и 720 кг – столько весят 200 литров летнего дизельного топлива. Завесив заблаговременно бочку, дозволено рассчитать всеобщий вес и прикинуть мощность стеллажа под бочку с соляром.
Подставляйте значения в формулу:m = 860*2 = 1720 (кг)1 тонна и 720 кг – столько весят 200 литров летнего дизельного топлива. Завесив заблаговременно бочку, дозволено рассчитать всеобщий вес и прикинуть мощность стеллажа под бочку с соляром.
4. В сельской местности пригодным бывает предварительно рассчитать массу нужных по кубатуре дров, дабы определиться с грузоподъемностью транспорта, на котором будут доставляться эти дрова. К примеру, вам на зиму нужен минимум в 15 куб. метров березовых дров. Ищите в справочной литературе плотность березовых дров. Это: 650 кг/м3.Вычисляйте массу, подставив значения в ту же формулу удельной плотности.m = 650*15 = 9750 (кг)Сейчас, исходя из грузоподъемности и вместимости кузова, вы можете определиться с видом транспортного средства и числом поездок.
Видео по теме
Обратите внимание!
Люди постарше огромнее знакомы с представлением удельного веса. Удельная плотность вещества – это то же, что и удельный вес.
Массовая доля вещества показывает его оглавление в больше трудной структуре, скажем, в сплаве либо смеси. Если знаменита всеобщая масса смеси либо сплава, то зная массовые доли составляющих веществ дозволено обнаружить их массы. Обнаружить массовую долю вещества, дозволено зная его массу и массу каждой смеси. Эта величина, может выражаться в дольных величинах либо процентах.
Вам понадобится
- весы;
- периодическая таблица химических элементов;
- калькулятор.
Инструкция
1.
Определите массовую долю вещества, которое находится в смеси через массы смеси и самого вещества. Для этого с поддержкой весов определите массы веществ, составляющих смесь либо сплав. После этого сложите их. Полученную массу примите за 100%. Дабы обнаружить массовую долю вещества в смеси, поделите его массу m на массу смеси M, а итог умножьте на 100% (?%=(m/M)?100%). Скажем, в 140 г воды растворяют 20 г поваренной соли. Дабы обнаружить массовую долю соли, сложите массы этих 2-х веществ М=140+20=160 г. После этого обнаружьте массовую долю вещества?%=(20/160)?100%=12,5%.
После этого обнаружьте массовую долю вещества?%=(20/160)?100%=12,5%.
2. Если требуется обнаружить оглавление либо массовую долю элемента в веществе с вестимой формулой, воспользуйтесь периодической таблицей химических элементов. По ней обнаружьте ядерные массы элементов, которые входят в состав вещества. Если один элемент встречается в формуле несколько раз, умножьте его ядерную массу на это число и сложите полученные итоги. Это будет молекулярная масса вещества. Дабы обнаружить массовую долю всякого элемента в таком веществе, поделите его массовое число в данной химической формуле M0 на молекулярную массу данного вещества M. Итог множьте на 100 % (?%=(M0/M)?100%).
3.
Скажем, определите массовую долю химических элементов в медном купоросе. Медный купорос (сульфат меди II), имеет химическую формулу CuSO4. Ядерные массы элементов, входящих в его состав равны Ar(Cu)=64, Ar(S)=32, Ar(O)=16, массовые числа этих элементов будут равны M0(Cu)=64, M0(S)=32, M0(O)=16?4=64, с учетом того, что в молекуле содержится 4 атома кислорода. Рассчитайте молекулярную массу вещества, она равна сумме массовых чисел составляющих молекулу веществ 64+32+64=160. Определите массовую долю меди (Cu) в составе медного купороса (?%=(64/160)?100%)=40%. По такому же тезису дозволено определить массовые доли всех элементов в этом веществе. Массовая доля серы (S) ?%=(32/160)?100%=20 %, кислорода (О) ?%=(64/160)?100%=40%. Обратите внимание на то, что сумма всех массовых долей вещества должна составить 100%.
Рассчитайте молекулярную массу вещества, она равна сумме массовых чисел составляющих молекулу веществ 64+32+64=160. Определите массовую долю меди (Cu) в составе медного купороса (?%=(64/160)?100%)=40%. По такому же тезису дозволено определить массовые доли всех элементов в этом веществе. Массовая доля серы (S) ?%=(32/160)?100%=20 %, кислорода (О) ?%=(64/160)?100%=40%. Обратите внимание на то, что сумма всех массовых долей вещества должна составить 100%.
Массовая доля — это процентное оглавление компонента в смеси либо элемента в веществе. С задачами на вычисление массовой доли сталкиваются не только школьники и студенты. Знание вычислять процентную концентрацию вещества находит абсолютно утилитарное использование и в реальной жизни – там, где требуется составление растворов – начиная со строительства и заканчивая кулинарией.
Вам понадобится
- – таблица Менделеева;
- – формулы для расчета массовой доли.
Инструкция
1. Рассчитайте массовую долю
по определению. Потому что масса вещества слагается из масс элементов, которые его составляют, то на долю
всякого составляющего элемента доводится некоторая часть массы вещества. Массовая доля раствора равна отношению массы растворенного вещества к массе каждого раствора.
Рассчитайте массовую долю
по определению. Потому что масса вещества слагается из масс элементов, которые его составляют, то на долю
всякого составляющего элемента доводится некоторая часть массы вещества. Массовая доля раствора равна отношению массы растворенного вещества к массе каждого раствора.
2. Масса раствора равна сумме масс растворителя (традиционно воды) и вещества. Массовая доля смеси равна отношению массы вещества к массе смеси, содержащей вещество. Полученный итог умножьте на 100%.
3.
Обнаружьте массовую долю
выхода с поддержкой формулы?=mд/mп, где mп и mд – величина полагаемого и действительного полученного выхода вещества (массы) соответственно. Вычисляйте полагаемую массу из уравнения реакции, пользуясь формулой m=nM, где n – химическое число вещества, M – молярная масса вещества (сумма ядерных масс всех элементов, входящих в вещество), либо формулой m=V?, где V- объем вещества, ? – его плотность. Число вещества в свою очередь при необходимости замените на формулу n=V/Vm либо также находите из уравнения реакции.
4. Массовую долю элемента трудного вещества вычислите с подмогой таблицы Менделеева. Сложите ядерные массы всех элементов, входящих в вещество, при необходимости домножая на индексы. Вы получите молярную массу вещества. Обнаружьте молярную массу элемента из таблицы Менделеева. Рассчитайте массовую долю , поделив молярную массу элемента на молярную массу вещества. Умножьте на 100%.
Полезный совет
Обращайте внимание на физический процесс, тот, что имеет место быть. При упаривании не рассчитывайте массовую долю, потому что раствора (воды либо другой всякий жидкости) нет. Не забывайте, что при концентрировании, напротив называемом частичным упариванием, массовая доля вещества возрастает. Если вы разбавляете концентрированный раствор, массовая доля уменьшается.
Массовая доля какого-нибудь компонента в веществе показывает, которая часть от всеобщей массы доводится на атомы именно этого элемента. Применяя химическую формулу вещества и периодическую таблицу Менделеева, дозволено определить массовую долю всего из входящих в формулу элементов. Полученная в итоге величина выражается обычной дробью либо процентами.
Полученная в итоге величина выражается обычной дробью либо процентами.
Инструкция
1. Если требуется по химической формуле определить массовую долю всякого элемента, составляющего ее, начните с вычисления числа атомов, которое доводится на весь из элементов. Скажем, химическую формулу этанола записывают так: CH?-CH?-OH. А химическая формула диметилового эфира – CH?-O-CH?. Число атомов кислорода (O) в всякой из формул равно единице, углерода (С) – двум, водорода (H) – шести. Обратите внимание, что это различные вещества, потому что идентичное число атомов всего элемента в их молекулах расположено по-различному. Тем не менее, массовые доли всего элемента в диметиловом эфире и этаноле будут идентичны.
2.
С применением периодической таблицы определите ядерную массу всякого элемента, входящего в химическую формулу. Это число умножьте на число атомов всякого элемента, рассчитанное на предыдущем шаге. В использованном выше примере формула содержит каждого один атом кислорода, а его атомарная масса из таблицы равна 15,9994. Атомов углерода в формуле два, его атомарная масса равна 12,0108, значит, суммарный вес атомов составит 12,0108*2=24,0216. Для водорода эти цифры равны соответственно 6, 1,00795 и 1,00795*6=6,0477.
Атомов углерода в формуле два, его атомарная масса равна 12,0108, значит, суммарный вес атомов составит 12,0108*2=24,0216. Для водорода эти цифры равны соответственно 6, 1,00795 и 1,00795*6=6,0477.
3. Определите всеобщую атомарную массу всей молекулы вещества – сложите полученные на предыдущем шаге числа. Для диметилового эфира и этанола эта величина должна быть равна 15,9994+24,0216+6,0477=46,0687.
4. Если итог требуется получить в долях единицы, составьте для всякого элемента, входящего в формулу, индивидуальную дробь. В ее числителе должна стоять величина, рассчитанная для этого элемента на втором шаге, а в знаменатель всей дроби поставьте число из третьего шага. Полученную обычную дробь дозволено округлить до надобной степени точности. В использованном выше примере массовая доля кислорода составляет 15,9994/46,0687?16/46=8/23, углерода – 24,0216/46,0687?24/46=12/23, водорода – 6,0477/46,0687?6/46=3/23.
5.
Для приобретения итога в процентах полученные обычные дроби переведите в формат десятичных и увеличьте в сто раз. В использованном примере массовая доля кислорода в процентах выражается числом 8/23*100?34,8%, углерода – 12/23*100?52,2%, водорода – 3/23*100?13,0%.
В использованном примере массовая доля кислорода в процентах выражается числом 8/23*100?34,8%, углерода – 12/23*100?52,2%, водорода – 3/23*100?13,0%.
Видео по теме
Обратите внимание!
Массовая доля не может быть огромнее единицы либо, если она выражается в процентах, огромнее 100%.
В статье рассматривается такое понятие, как массовая доля. Приводятся способы ее вычисления. Также описаны определения сходных по звучанию, но отличных по физическому смыслу величин. Это массовые доли для элемента и выхода.
Колыбель жизни — раствор
Вода — источник жизни на нашей прекрасной голубой планете. Это выражение можно встретить довольно часто. Однако мало кто, кроме специалистов, задумывается: на самом деле субстратом для развития первых биологических систем стал раствор веществ, а не химически чистая вода. Наверняка в популярной литературе или передаче читатель встречал выражение «первичный бульон».
Об источниках, давших толчок развитию жизни в виде сложных органических молекул, до сих пор спорят. Некоторые даже предполагают не просто естественное и весьма удачное стечение обстоятельств, а космическое вмешательство. Причем речь идет вовсе не о мифических пришельцах, а о специфических условиях для создания этих молекул, которые могут существовать только на поверхности малых космических тел, лишенных атмосферы, — кометах и астероидах. Таким образом, было бы правильнее говорить, что раствор органических молекул — колыбель всего живого.
Некоторые даже предполагают не просто естественное и весьма удачное стечение обстоятельств, а космическое вмешательство. Причем речь идет вовсе не о мифических пришельцах, а о специфических условиях для создания этих молекул, которые могут существовать только на поверхности малых космических тел, лишенных атмосферы, — кометах и астероидах. Таким образом, было бы правильнее говорить, что раствор органических молекул — колыбель всего живого.
Вода как химически чистое вещество
Несмотря на огромные соленые океаны и моря, пресные озера и реки, в химически чистом виде вода встречается крайне редко, в основном в специальных лабораториях. Напомним, в отечественной научной традиции химически чистое вещество — это субстанция, которая содержит не более десяти в минус шестой степени массовой доли примесей.
Получение абсолютно свободной от посторонних компонентов массы требует невероятных затрат и редко себя оправдывает. Применяется только в отдельных производствах, где даже один посторонний атом может испортить эксперимент. Отметим, что полупроводниковые элементы, которые составляют основу сегодняшней миниатюрной техники (в том числе смартфоны и планшеты), к примесям очень чувствительны. В их создании как раз и нужны совершенно незагрязненные растворители. Однако по сравнению со всей жидкостью планеты это ничтожно мало. Как же так получается, что распространенная, пронизывающая нашу планету насквозь вода так редко встречается в чистом виде? Объясним чуть ниже.
Отметим, что полупроводниковые элементы, которые составляют основу сегодняшней миниатюрной техники (в том числе смартфоны и планшеты), к примесям очень чувствительны. В их создании как раз и нужны совершенно незагрязненные растворители. Однако по сравнению со всей жидкостью планеты это ничтожно мало. Как же так получается, что распространенная, пронизывающая нашу планету насквозь вода так редко встречается в чистом виде? Объясним чуть ниже.
Идеальный растворитель
Ответ на поставленный в предыдущем разделе вопрос невероятно прост. Вода имеет полярные молекулы. Это значит, что в каждой мельчайше частице этой жидкости положительный и отрицательный полюсы не намного, но разнесены. При этом структуры, возникающие даже в жидкой воде, создают дополнительные (так называемые водородные) связи. И в общей сложности это дает следующий результат. Попадающее в воду вещество (не важно, какой заряд оно имеет) растаскивается молекулами жидкости. Каждая частичка растворенной примеси обволакивается либо отрицательными, либо положительными сторонами молекул воды. Таким образом, эта уникальная жидкость способна растворять очень большое количество самых разнообразных веществ.
Таким образом, эта уникальная жидкость способна растворять очень большое количество самых разнообразных веществ.
Понятие массовой доли в растворе
Получающийся раствор содержит некоторую часть примеси, имеющей название «массовая доля». Хотя такое выражение встречается не часто. Обычно используется другой термин — «концентрация». Массовая доля определяется конкретным соотношением. Формульное выражение приводить не будем, оно достаточно простое, объясним лучше физический смысл. Это соотношение двух масс — примеси к раствору. Массовая доля — величина безразмерная. Выражается по-разному в зависимости от конкретных задач. То есть в долях единицы, если в формуле есть только соотношение масс, и в процентах — если результат умножается на 100%.
Растворимость
Помимо Н 2 О применяются и другие растворители. Кроме того, есть вещества, которые принципиально не отдают свои молекулы воде. Зато с легкостью растворяются в бензине или горячей серной кислоте.
Существуют специальные таблицы, которые показывают, сколько того или иного материала останется в жидкости. Этот показатель называется растворимостью, и он зависит от температуры. Чем она выше, тем активнее двигаются атомы или молекулы растворителя, и тем больше примеси он способен поглотить.
Этот показатель называется растворимостью, и он зависит от температуры. Чем она выше, тем активнее двигаются атомы или молекулы растворителя, и тем больше примеси он способен поглотить.
Варианты определения доли растворенного вещества в растворе
Так как задачи у химиков и технологов, а также инженеров и физиков могут быть разными, часть растворенного вещества в воде определяется по-разному. Объемная доля вычисляется как объем примеси к общему объему раствора. Используется другой параметр, однако принцип остается тем же.
Объемная доля сохраняет безразмерность, выражаясь либо в долях единицы, либо в процентах. Молярность (по-другому еще называется «молярная объемная концентрация») — это число молей растворенного вещества в заданном объеме раствора. В этом определении участвуют уже два различных параметра одной системы, и размерность у данной величины другая. Она выражается в молях на литр. На всякий случай напомним, что моль — это количество вещества, содержащего примерно десять в двадцать третьей степени молекул или атомов.
Понятие массовой доли элемента
Эта величина имеет лишь косвенное отношение к растворам. Массовая доля элемента отличается от рассмотренного выше понятия. Любое сложное химическое соединение состоит из двух или более элементов. Каждый обладает своей относительной массой. Эту величину можно найти в химической системе Менделеева. Там она указана в нецелых числах, но для приблизительных задач значение можно округлить. В состав сложного вещества входит определенное количество атомов каждого вида. Например, в воде (Н 2 О) два атома водорода и один кислорода. Соотношение между относительной массой всего вещества и данного элемента в процентах и будет составлять массовую долю элемента.
Для неискушенного читателя эти два понятия могут показаться близкими. И достаточно часто их путают между собой. Массовая доля выхода относится не к растворам, а к реакциям. Любой химический процесс всегда протекает с получением конкретных продуктов. Их выход рассчитывается по формулам в зависимости от реагирующих веществ и условий процесса. В отличие от просто массовой доли, эту величину не так просто определить. Теоретические расчеты предлагают максимально возможное количество вещества продукта реакции. Однако практика всегда дает немного меньшее значение. Причины такого расхождения кроются в распределении энергий среди даже сильно нагретых молекул.
В отличие от просто массовой доли, эту величину не так просто определить. Теоретические расчеты предлагают максимально возможное количество вещества продукта реакции. Однако практика всегда дает немного меньшее значение. Причины такого расхождения кроются в распределении энергий среди даже сильно нагретых молекул.
Таким образом, всегда найдутся наиболее «холодные» частицы, которые не смогут вступить в реакцию и останутся в первоначальном состоянии. Физический смысл массовой доли выхода состоит в том, какой процент составляет реально полученное вещество от теоретически рассчитанного. Формула невероятно проста. Масса практически полученного продукта делится на массу практически рассчитанного, все выражение умножается на сто процентов. Массовая доля выхода определяется по количеству молей реагирующего вещества. Не стоит забывать об этом. Дело в том, что один моль вещества — определенное количество его атомов или молекул. По закону сохранения вещества из двадцати молекул воды не может получиться тридцать молекул серной кислоты, поэтому задачи вычисляются именно так. Из количества молей исходного компонента выводят массу, которая теоретически возможна для результата. Затем, зная, сколько продукта реакции на самом деле было получено, по описанной выше формуле определяют массовую долю выхода.
Из количества молей исходного компонента выводят массу, которая теоретически возможна для результата. Затем, зная, сколько продукта реакции на самом деле было получено, по описанной выше формуле определяют массовую долю выхода.
Даже в одном грамме вещества может содержаться до тысячи различных соединений. Каждое соединение отвечает за определенное свойство вещества, а бывает так, что это не определенное вещество, а смесь. В любом случае на производстве часто возникает ситуация утилизации химических отходов и задача использования вторичного сырья. Именно химические реакции, позволяющие найти и выделить определенное вещество являются главенствующими. Но для этого надо сначала узнать как найти массовую долю.
Понятие массовой доли вещества отражает его содержание и концентрацию в сложной химической структуре, будь то смесь или сплав. Зная общую массу сплава или смеси, можно найти массы составляющих их веществ, при условии, что известны их массовые доли. Как найти массовую долю, формула обычно выражается в виде дроби: массовая доля вещества масса вещества/масса всей смеси.
Давайте проведем небольшой эксперимент! Для этого нам понадобятся периодическая таблица химических элементов им. Менделеева, весы и калькулятор.
Как найти массовую долю вещества
Необходимо определить массовую долю вещества, вещество находится в виде смеси. Первоначально кладем на весы само вещество. Получили массу вещества. Зная определенную массу вещества в смеси мы с легкостью получим его массовую долю. К примеру есть 170г. воды. В них находится 30 грамм вишневого сока. Общая масса=170+30=230 грамм. Поделим массу вишневого сока к общей массе смеси: 30/200=0.15 или 15% .
Как найти массовую долю раствора
Решение данной проблемы может понадобиться при определении концентрации пищевых растворов(уксус) или лекарственных препаратов. Дана масса раствора KOH, он же гидроксид калия, массой в 400 грамм. KOH (масса самого вещества) составляет 80 грамм. Необходимо найти массовую долю желчи в полученном растворе. Формула нахождения решения: KOH (масса раствора гидроксида калия) 300 г, масса растворенного вещества (KOH) 40 г. Найдите KOH (массовую долю щелочи) в полученном растворе, t- массовая доля. m- масса, t (вещества) = 100%* m (вещества) / m (раствора (вещества). Таким образом KOH (массовая доля раствора гидроксида калия): t (KOH) = 80 г /400 г х 100% = 20 %.
Найдите KOH (массовую долю щелочи) в полученном растворе, t- массовая доля. m- масса, t (вещества) = 100%* m (вещества) / m (раствора (вещества). Таким образом KOH (массовая доля раствора гидроксида калия): t (KOH) = 80 г /400 г х 100% = 20 %.
Как найти массовую долю углерода в углеводороде
Для этого используем таблицу Менделеева. Ищем вещества в таблице. В таблице приведена атомная масса элементов. 6 углеродов с атомной массой 12 и 12 водородов с атомной массой равной 1. m (C6h22) = 6 х 12 + 12 х 1= 84 г/моль, ω (С) = 6 m1(С) / m (C6h22) = 6 х 12 / 84 = 85%
Определение массовой доли на производствах производится в специальных химических лабораториях. Для начала берется небольшой образец, на который испытывают различные химические реакции. Или внедряют лакмусовые бумажки, которые могут показать наличие того или иного компонента. После выяснения первоначальной структуры вещества можно начинать выделение компонентов. Это достигается за счет простых химических реакций, когда одно вещество контактирует с другим и получается новое, возможен осадок. Существуют и более продвинутые способы, такие как электролиз, нагревание, охлаждение, выпаривание. Для подобных реакций нужно большое промышленное оборудование. Производство, конечно, тяжело назвать экологически чистым, тем не менее современные технологии обработки отходов позволяют минимизировать нагрузку на природу.
Существуют и более продвинутые способы, такие как электролиз, нагревание, охлаждение, выпаривание. Для подобных реакций нужно большое промышленное оборудование. Производство, конечно, тяжело назвать экологически чистым, тем не менее современные технологии обработки отходов позволяют минимизировать нагрузку на природу.
Массовая доля элемента в веществе
Массовая доля элемента в сложном веществе — это отношение массы атомов данного элемента к массе молекулы (формульной единицы)
w = n*A
r/Mr * 100%Давайте порассуждаем вместе
1. Массовая доля кислорода в оксиде фосфора (V) равна
1) 56%
2) 23%
3) 67%
4) 44%
Ответ: №1, т.к. Mr(P2O5) = 2Ar(P) + 5Ar(O) = 2*31 + 5*16 = 142 и масса кислорода равна 5*16 =80,
рассчитаем массовую долю кислорода w (O) = 80/142 * 100% = 56%
2. Массовая доля кальция в карбонате кальция равна
Массовая доля кальция в карбонате кальция равна
1) 50%
2) 80%
3) 40%
4) 20%
Ответ: №3, т.к. Mr(CaCO3) = Ar(Ca) + Ar(C) + 3Ar(O) = 40+12 + 3*16 = 100,
w(Ca) = 40/100 *100% = 40%
3. Массовая доля фосфора в фосфорной кислоте равна
1) 65%
2) 16%
3) 30%
4) 32%
Ответ: №4, т.к. Mr(H3PO4) = 3Ar(H) + Ar(P) + 4Ar(O) = 3*1 + 31+ 4*16 = 98,
w(P)= 31/98 *100 = 32%
4. Массовая доля серы в сульфате алюминия равна
1) 84%
2) 56%
3) 28%
4) 42%
Ответ: № 3, т.
к. Mr(Al2(SO4)3) = 2Ar(Al) + 3Ar(S) + 12Ar(O) = 2*27 + 3*32 + 12*16 = 54 + 96 + 192 = 342,
w(S) = 96/342 *100 = 28%
Рекомендации по величинам, символам и единицам измерения для публикаций в ACQUAL
Неопределенность измерения, являющаяся частью результата измерения, здесь в результат не включается.
(a) Массовая концентрация свинца в пробе сточных вод составляет γ (Pb) = 12,8 мг/л (= 12,8 мг л −1 = 12,8 г/м 3 = 12,8 г м − 3 = 0,0128 г/л).
Для единицы объема «литр» используются как л, так и л. Строчная буква имеет тот недостаток, что ее легко спутать с цифрой.Поэтому предпочтительнее L.
(b) Массовая доля серы в пробе угля составляет w (S) = 0,0078 (= 0,0078 г/г = 7,8 мг/г = 7,8 г/кг = 7,8 г кг −1 ).
Такие комбинации, как 7,8 мг S/г угля, неприемлемы.
(c) Объемная концентрация этанола в образце вина составляет σ = 135 мл/л.
На этикетках винных бутылок используются такие обозначения, как «13,5% об.». Это не рекомендуется для сообщения результатов химических измерений.
(d) Суммарная концентрация (или концентрация) холестерина в образце сыворотки человека составляет c = 5.31 ммоль/л (= 5,31×10 -3 моль/л = 5,31 моль м -3 ).
В клинических измерениях и медицинской практике часто используется массовая концентрация в мг/дл, что также допустимо. В химии растворов (например, в титриметрии) иногда используются такие выражения, как: 0,1 M HCl (M для моль/л). Это не поощряется. Вместо этого следует использовать c (HCl) = 0,1 моль/л.
(e) Доля вещества CO 2 в калибровочной газовой смеси составляет x (CO 2 ) = 422 мкмоль/моль (= 422×10 −6 ).
Обозначения «ppm» для 10 −6 и «%» для 10 −2 не приветствуются, но могут быть приемлемыми, если нет сомнений в используемой единице измерения. Комбинации с такими количествами, как «ppmv» или «%(m/m)», неприемлемы.
Комбинации с такими количествами, как «ppmv» или «%(m/m)», неприемлемы.
(f) Вещественное содержание (или количественное содержание) Cd в пробе природной воды составляет κ (Cd) = 82,38 нмоль/кг.
(g) Моляльность Na 2 HPO 4 в буферном растворе составляет b (Na 2 HPO 4 ) = 0.03043 моль/кг.
Дополнительные примечания относительно некоторых величин, не включенных в Зеленую книгу ИЮПАК, 3-е изд. 1996) Метрология, 33:35–39. Количество «содержание суммы» также не включено в «Зеленую книгу». Это также было взято у Т. Цвиташа (та же ссылка). Вместо
k используется символ κ во избежание путаницы с коэффициентом охвата k .Обе величины важны для химических измерений.Молярная доля и массовая доля — одно и то же?
Что такое молярная доля?
Единицей концентрации в химии является молярная доля, которая равна количеству молей компонента, деленному на общее количество молей в растворе.
Молярная доля — это безразмерный термин, поскольку он представляет собой отношение между двумя значениями. В сумме молярная доля всех компонентов раствора равна 1.
Важно определить мольную долю при объединении двух реакционноспособных компонентов, так как известно соотношение двух компонентов, если известна мольная доля каждого из них.
Более того, молярная доля, умноженная на 100, дает только мольные проценты, что то же самое, что и молярная доля, но с другой точки зрения.
Различные концентрации, включая молярность, моляльность и состав в процентах по массе, могут давать мольные доли. Более того, при составлении фазовых диаграмм так часто используется мольная доля.
Кроме того, по сравнению с молярной концентрацией, он не зависит от температуры и не требует знания соответствующих фазовых плотностей.
Путем взвешивания соответствующих масс элементов можно получить смесь с известными молярными долями.
Для молярных долей x=0,1 и x=0,9 измерение симметрично, а роли «растворителя» и «растворенного вещества» обратимы.
Кроме того, молярная доля смеси идеальных газов может быть выражена как отношение парциального давления к полному давлению смеси.
Что такое массовая доля?
Отношение массы вещества к общей массе смеси является массовой долей вещества.
Также известен в процентном отношении как процент по массе или массовый процент. Поскольку массовая доля представляет собой отношение массы к массе, количество не имеет никакого измерения.
Массовая доля вещества, являющаяся интенсивной величиной, не зависит от давления, температуры и места нахождения материала.
Если не наблюдается химического изменения или чистой физической передачи какого-либо вещества, оно остается постоянным.
Таким образом, массовые проценты вещества будут одинаковыми во всем мире.
Кроме того, массовые доли мы также называем массовыми долями. Однако символ m/m представлен как массовая доля, а символ w/w соответствует массовой доле.
Таким же образом массовый процент часто называют массовым процентом. И символ m/m% используется для обозначения процентов по массе, а знак w/w% используется для обозначения процентов по массе.
И символ m/m% используется для обозначения процентов по массе, а знак w/w% используется для обозначения процентов по массе.
Разница между молярной долей и массовой долей?
Химическое соединение включает растворитель и растворенное вещество и образует химическую смесь при химическом анализе.
Однако терминология, используемая для выражения соотношений между различными компонентами соединения, представляет собой мольную долю и массовую долю.
Хотя обе фракции очень похожи и представляют соотношение между компонентами соединения, они не являются одинаковыми количествами или терминами.
Однако между мольной долей и массовой долей в химической смеси лежит важная связь.
Отношение массы растворенного вещества к общей массе смеси называется массовой долей.
Тем не менее, молярная доля относится к молям различных составных частей соединения, тогда как массовая доля относится к массам отдельных компонентов соединения, и это объясняет основную разницу между обеими величинами.
Кроме того, молярная доля и массовая доля могут быть взаимно преобразованы друг в друга для одного и того же соединения.
Может ли молярная доля быть больше 1?
Другой мерой концентрации в химии является мольная доля химического соединения.
Как мы узнали выше, молярная доля — это просто количество молей по отношению к общему количеству молей этого конкретного вещества.
Молярная доля вещества всегда находится в диапазоне от 0 до 1, поскольку она никогда не может превышать полного числа молей в смеси.
Таким образом, оно никогда не может быть больше 1. Обычно молярная доля выражается с использованием знака X, однако для вещества
i мольная доля определяется как
Xi=ni/nвсего
, где общее количество молей в смеси равно
.Надеемся, вам понравилась эта статья.Вы можете использовать калькулятор молекулярной массы на главной странице или найти другие полезные блоги в разделе блогов.
Как определить массовую долю
Возможны два варианта постановки задачи: 1) когда необходимо определить массовую долю элемента в веществе; 2) когда необходимо определить массовую долю растворенного вещества.
Необходимо
Вам необходимо определить, к какому варианту относится ваша задача.В случае первого варианта вам понадобится таблица Менделеева. В случае со вторым нужно знать, что раствор состоит из двух компонентов: растворенного вещества и растворителя. А масса раствора равна массам этих двух компонентов
Инструкции
Шаг 1
В случае первого варианта задачи:
По таблице Менделеева находим молярную массу вещества. Молярная масса равна сумме атомных масс элементов, входящих в состав вещества.
Например, молярная масса (Mr) гидроксида кальция Ca(OH)2: Mr(Ca(OH)2) = Ar(Ca) + (Ar(O) + Ar(H)) * 2 = 40 + ( 16 + 1) * 2 = 74.
Молярные массы атомов взяты из таблицы Менделеева.
Шаг 2
Рассчитаем массовую долю элемента (ω), например, кальция в гидроксиде кальция.
Массовая доля равна отношению атомной массы элемента к молярной массе вещества: ω = Ar: н
В случае гидроксида кальция: ω (Ca) = 40:74 = 0, 54. Это массовая доля элемента в долях единицы.
Это массовая доля элемента в долях единицы.
Шаг 3
В случае второго варианта задачи:
Определите, какие массы вам даны, а именно: масса растворенного вещества и масса раствора или масса растворенного вещества и масса растворителя.
Шаг 4
Если даны массы растворенного вещества и раствора, то массовая доля равна отношению массы растворенного (р.в.) вещества к массе раствора (р-ра).
ω = м (с.в.): м (р-ра)
Например, если масса соли 40 г, а масса раствора 100 г, то ω (соли) = 40: 100 = 0, 4. Это массовая доля растворенного вещества в долях единицы .
Шаг 5
Если даны массы растворенного вещества и растворителя, то сначала необходимо определить массу раствора. Масса раствора (раствора) равна сумме масс растворенного вещества (с.в.) и растворителя (раствора).
м (р-ра) = м (р.в.) + м (р-ла)
Например, если масса соли 40 г, а масса воды 60 г, то m (раствор) = 40 + 60 = 100 (г).
Затем рассчитывают массовую долю растворенного вещества так же, как и в предыдущем шаге.
Шаг 6
Чтобы найти массовую долю в процентах, нужно массовую долю в долях единицы умножить на 100.
ω (Ca) = 0,54 * 100 = 54%
Как узнать массовую долю элемента в веществе.Как найти массовую долю вещества по формуле
>>
Массовая доля элемента в комплексном веществе
Абзацный материал поможет вам:
> узнать, какова массовая доля элемента в соединении, и определить ее значение;
> вычислить массу элемента в определенной массе соединения, исходя из массовой доли элемента;
> Исправить решение химических задач.
Каждое сложное вещество (Химическое соединение) состоит из нескольких элементов. Знать содержание элементов в соединении необходимо для его эффективного использования. Например, лучшим азотным удобрением считается то, которое содержит наибольшее количество азота (этот элемент необходим растениям). Аналогично оценивают качество металлической руды, определяя, насколько « богат » на элемент металла.
Содержание элемента В соединении он характеризуется массовой долей.Эта величина обозначается латинской буквой W («Dubl-WE»).
Выведем формулу для расчета массовой доли элемента в соединении по известной массе соединения и элемента. Обозначим через массовую долю элемента букву х. Учитывая, что масса соединения — целое число, а масса элемента — часть целого, составим пропорцию:
Заметим, что массы элемента и соединения следует брать в одних и тех же единицах измерения измерения (например, в граммах).
Интересно
В двух соединениях сера-SO 2 и МОС 3 — массовые доли элементов одинаковы и составляют 0,5 (или 50%).
Массовая доля не имеет размерности. Часто выражается в процентах. В данном случае формула принимает вид:
Очевидно, что сумма массовых долей всех элементов в соединении равна 1 (или 100%).
Приведем несколько примеров решения расчетных задач.Условие задачи и ее решение составляется таким образом. Лист тетради или классная доска разделены вертикальной линией на две неравные части. В левой, меньшей, части сокращают условие задачи, проводят горизонтальную черту и указывают, что необходимо найти или вычислить. В правой части записываются математические формулы, объяснение, расчеты и ответ.
Лист тетради или классная доска разделены вертикальной линией на две неравные части. В левой, меньшей, части сокращают условие задачи, проводят горизонтальную черту и указывают, что необходимо найти или вычислить. В правой части записываются математические формулы, объяснение, расчеты и ответ.
В 80 г соединения содержится 32 г Оксиген . Рассчитайте массовую долю кислорода в соединении.
Массовая доля элемента в соединении также рассчитывается по формуле химического соединения. Поскольку массы атомов и молекул пропорциональны относительным атомным и молекулярным массам,
, где N (E) — число атомов элемента в формуле соединения.
По известной массовой доле элемента можно рассчитать массу элемента, содержащегося в определенной массе соединения.Из математической формулы массовой доли элемента следует:
m(E)=W(E)M(связи).
Какая масса азота содержится в аммиачной селитре (азотном удобрении) массой 1 кг, если массовая доля этого элемента в соединении равна 0,35?
Понятие «массовая доля» применяют для характеристики количественного состава смесей веществ. Соответствующая математическая формула имеет вид:
Соответствующая математическая формула имеет вид:
выводы
Массовая доля элемента в соединении представляет собой отношение массы элемента к соответствующей массе соединения.
Массовую долю элемента в соединении рассчитывают по известным массам элемента и соединения или по его химической формуле.
?
92. Как рассчитать массовую долю элемента в соединении, если известны: а) масса элемента и соответствующая масса соединения; б) Формула химического соединения?
93. В 20 г вещества содержится 16 г брома. Найдите массовую долю этого элемента в веществе, выразив ее обычной дробью, десятичной дробью и в процентах.
94. Рассчитать (желательно устно) массовые доли элементов в соединениях с такими формулами: SO 2 , LIH, CRO 3 .
относительных атомов, определите, в каком из веществ каждой пары массовая доля первого в формуле элемента больше:
а) N 2 O, NO; б) СО, СО 2 ; в) б 2 О 3, В 2 S 3.
96. Выполните необходимые расчеты для уксусной кислоты СН 3 СООН и глицерина С 3 Н 5 (ОН) 3 и заполните таблицу:
| C x H y o z | M R (C x H y o z) | W (C) | W (H) | W (O) |
97.Массовая доля азота в некоторых соединениях составляет 28%. В какой массе соединения содержится 56 г азота?
98. Массовая доля кальция в его соединении с водородом равна 0,952. Определите массу водорода, который содержится в 20 г соединения.
99. Смешать 100 г цемента и 150 г песка. Какова массовая доля цемента в приготовленной смеси?
П. П. П., Крыкл Л. С., Химия: Підрюч. за 7 кл.Загалиносвіт. нулевая шапка. — К.: АКАДЕМИЯ МЦ, 2008. — 136 с.: Іл.
Дизайн урока Конспект урока и система отсчета Презентация урока интерактивные технологии Ускоряющие методы обучения Практика Тесты, тестирование Онлайн-задания и упражнения Домашние задания Семинары и тренинги Вопросы для обсуждения в классе Иллюстрации Видео- и аудиоматериалы Фотографии, картинки, Таблицы, Комиксы-схемы, Пословицы, поговорки, кроссворды, анекдоты, анекдоты, цитаты Дополнения Сочинения Шпаргалки Фишки для любопытных статей (Мужчина) Литература Основной и Дополнительный словарь терминов Учебники и уроки Исправление ошибок в учебнике замена устаревших знаний новыми Только для учителей Календарь планов учебных программ методических указаний С XVII в. Химия перестала быть описательной наукой. Ученые-химики стали широко использовать для измерения вещества. Конструкция весов позволяла определять массы образцов. Для газообразных веществ кроме массы измерялись также объем и давление. Использование количественных измерений позволило понять сущность химических превращений, определить состав сложных веществ.
Химия перестала быть описательной наукой. Ученые-химики стали широко использовать для измерения вещества. Конструкция весов позволяла определять массы образцов. Для газообразных веществ кроме массы измерялись также объем и давление. Использование количественных измерений позволило понять сущность химических превращений, определить состав сложных веществ.
Как вы уже знаете, сложное вещество включает в себя два и более химических элемента.Очевидно, что масса всего вещества складывается из масс компонентов его элементов. Это означает, что на каждый элемент приходится определенная часть массы вещества.
Массовая доля элемента — отношение массы этого элемента в сложном веществе к массе всего вещества, выраженное в долях единицы (или процентах):
Массовая доля элемента в соединении обозначается строчной латинской буквой w. («Дубл-МЭ») и показывает долю (массовую часть), приходящуюся на этот элемент в общей массе Вещества. Это значение может быть выражено в долях единицы или в процентах. Разумеется, массовая доля элемента в сложном веществе всегда меньше единицы (или меньше 100%). Ведь часть целого всегда меньше целого, как долька апельсина меньше апельсина.
Разумеется, массовая доля элемента в сложном веществе всегда меньше единицы (или меньше 100%). Ведь часть целого всегда меньше целого, как долька апельсина меньше апельсина.
Например, оксид ртути включает в себя два элемента — ртуть и кислород. При нагревании 50 г этого вещества 46.Получается 3 г ртути и 3,7 г кислорода (рис. 57). Рассчитайте массовую долю ртути в сложном веществе:
Массовую долю кислорода в этом веществе можно рассчитать двумя способами. По определению массовая доля кислорода в оксиде ртути равна отношению массы кислорода к массе оксида:
Зная, что сумма массовых долей элементов в веществе равна единице (100%), по разности можно рассчитать массовую долю кислорода:
ш.(О) = 1 — 0,926 = 0,074,
ш. (О) = 100% — 92,6% = 7,4%.
Для нахождения массовых долей элементов предлагаемым методом необходимо провести сложный и трудоемкий химический опыт по определению массы каждого элемента. Если известна формула сложного вещества, та же задача решается намного проще.
Для расчета массовой доли элемента необходимо умножить его относительную атомную массу на число атомов ( н. ) этот элемент в формуле и разделен на относительную молекулярную массу Вещества:
Например, для воды (рис. 58):
М Р. (Н 2 О) = 1 2 + 16 = 18,
Задание 1. Рассчитать массовые доли элементов в аммиаке по формуле NH 3. .
Дано:
аммиак NH 3 вещество.
Чтобы найти :
ш. (Н), ш. (Н).
Решение
1) Рассчитайте относительную молекулярную массу аммиака:
М Р. (НХ 3) = А Р. (Н) + 3 А Р. (Н) = 14 + 3 1 = 17.
2) Найдем массовую долю азота в веществе:
3) рассчитываем массовую долю водорода в аммиаке:
ш. (Н) = 1 — ш. (Н) = 1 — 0,8235 = 0.1765 г., или 17,65%.
Ответ. В. (Н) = 82,35%, в. ч. (Н) = 17,65%.
ч. (Н) = 17,65%.
Задание 2. Рассчитайте массовые доли элементов в серной кислоте по формуле H 2 SO 4 .
Дано:
серная кислота H 2 SO 4.
Чтобы найти :
ш. (H), Ш. (S) Ш. (О).
Решение
1) Рассчитайте относительную молекулярную массу серной кислоты:
М Р. (H 2 SO 4) = 2 А р. (Н) + А р. (Т) + 4 А р. (О) = 2 1 + 32 + 4 16 = 98.
2) Найдем массовую долю водорода в веществе:
3) Рассчитайте массовую долю серы в серной кислоте:
4. Рассчитайте массовую долю кислорода в веществе:
ш. (О) = 1 — ( с. (Н) + с. (S)) = 1 — (0,0204 + 0,3265) = 0,6531, или 65,31%.
Ответ. W. (H) = 2,04%, w. (S) = 32,65%, вес. (О) = 65,31%.
Чаще химикам приходится решать обратную задачу: по массовым долям элементов определять формулу сложного вещества. Как решаются подобные задачи, проиллюстрируем на одном историческом примере.
Как решаются подобные задачи, проиллюстрируем на одном историческом примере.
Из природных минералов — тармиста и щепы — выделены два соединения меди с кислородом (оксиды). Они отличались друг от друга цветом и массовыми долями элементов.В черной окиси массовая доля меди составила 80 %, а массовая доля кислорода – 20 %. В красном оксиде меди массовые доли элементов составили соответственно 88,9 и 11,1 %. Каковы формулы этих сложных веществ? Проведем простые математические расчеты.
Пример 1. Расчет химической формулы черного оксида меди ( w. (Cu) = 0,8 и w. (O) = 0,2).
х, Ш. — по количеству атомов химических элементов в его составе: Cu Х. О. Г. .
2) отношение индексов равно отношению частного от деления массовой доли элемента в соединении на относительную атомную массу элемента:
3) Полученное отношение должно вести к отношению целых чисел: индексы в формуле, показывающей число атомов, не могут быть дробными. Для этого полученные числа делим на меньшее (то есть любое) из них:
Для этого полученные числа делим на меньшее (то есть любое) из них:
Получилась формула — Куо.
Пример 2. Расчет формулы красного оксида меди по известным массовым долям мас. (Cu) = 88,9% и вес. (О) = 11,1%.
Дано:
ш. (Cu) = 88,9%, или 0,889,
ш. (О) = 11,1%, или 0,111.
Найти:
Решение
1) Обозначим по формуле СУ оксид Х. О. г. .
2) Найдите отношение показателей х. и г. :
3) Приводим отношение индексов к отношению целых чисел:
Ответ . Формула соединения — Cu 2 O.
А теперь немного усложним задачу.
Задание 3. По данным элементного анализа состав кальцинированной горькой соли, применявшейся алхимиками в качестве слабительного средства, следующий: Массовая доля магния — 20.0%, массовая доля серы — 26,7%, массовая доля кислорода — 53,3%.
Дано:
ш. (Мг) = 20,0%, или 0,2,
ш. (S) = 26,7%, или 0,267,
ш. (О) = 53,3%, или 0,533.
Найти:
Решение
1) Обозначим по формуле вещества индексами х, Y, Z : Mg. X. S. Y. O. Z. .
2) Найдите соотношение индексов:
3) Определить значение индекса x, Y, Z :
Ответ. Формула вещества — MgSO 4.
1. Что называют массовой долей элемента в сложном веществе? Как рассчитывается это значение?
2.
Рассчитайте массовые доли элементов в веществах: а) углекислый газ СО 2 ;
б) ПАВ сульфид кальция; в) Натрий Селитра Нано 3; г) оксид алюминия Al 2 O 3.
3. В каких из азотных удобрений массовая доля азотистого азота больше всего: а) хлористого аммония NH 4 Cl; б) сульфат аммония (NH 4 ) 2 SO 4 ; в) мочевина (NH 2) 2 CO?
4. В минерале пирите на 7 г железа приходится 8 г серы. Вычислите массовые доли каждого элемента в этом веществе и определите его формулу.
В минерале пирите на 7 г железа приходится 8 г серы. Вычислите массовые доли каждого элемента в этом веществе и определите его формулу.
5. Массовая доля азота в одном из его оксидов равна 30,43%, а массовая доля кислорода равна 69.57%. Определите формулу оксида.
6. В Средние века вещество под названием Поташ выделяли из костра и использовали для приготовления пищи мыло. Массовые доли элементов в этом веществе: калия — 56,6 %, углерода — 8,7 %, кислорода — 34,7 %. Определите формулу калия.
Зная химическую формулу, можно вычислить массовую долю химических элементов в веществе. Элемент в веществе обозначается греч. Буква «Омега» — ω э/в и рассчитывается по формуле:
, где k — число атомов этого элемента в молекуле.
Какова массовая доля водорода и кислорода в воде (H 2 o)?
Решение:
М Р (Н 2 О) = 2 * А Р (Н) + 1 * А Р (о) = 2 * 1 + 1 * 16 = 18
2) Рассчитайте массовую долю водорода в воде:
3) Рассчитайте массовую долю кислорода в воде. Так как в состав воды входят атомы только двух химических элементов, то массовая доля кислорода будет равна:
Так как в состав воды входят атомы только двух химических элементов, то массовая доля кислорода будет равна:
Рис.1. Оформление задачи задачи 1
Рассчитать массовую долю элементов в веществе H 3 PO 4.
1) Рассчитайте относительную молекулярную массу вещества:
M R (H 3 PO 4) = 3 * A R (H) + 1 * и R (р) + 4 * и R (о) = 3 * 1 + 1 * 31 + 4 * 16 = 98
2) Рассчитайте массовую долю водорода в веществе:
3) Рассчитайте массовую долю фосфора в веществе:
4) Рассчитайте массовую долю кислорода в веществе:
1.Сборник задач и упражнений по химии: 8 класс: к учебнику П.А. Оржековский и др. Химия, 8 класс» / П.А. Ороековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006.
2. Ушакова О.В. Рабочая тетрадь по химии: 8 кл.: К учебнику П.А. Оржековский и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Ороековский; под. изд. проф. П.А. Ороековский — М.: АСТ: Астрель: ПрофиСдат, 2006. (с.34-36)
(с.34-36)
3. Химия: 8 класс: учеб. Для самообладания.Учреждения / П.А. Ороековский, Л.М. Мещерякова, Л.С. Поня. М.: АСТ: Астрель, 2005. (§15)
4. Энциклопедия для детей. Том 17. Химия / Главы. Ред.В.А. Володин, Вед. Научное изд. И. Леенсон. — М.: Аванта+, 2003.
1. Единая коллекция цифровых образовательных ресурсов ().
2. Электронная версия журнала «Химия и жизнь» ().
4. Видеоурок на тему «Массовая доля химического элемента в веществе» ().
Домашнее задание
1.С.78 № 2 из учебника «Химия: 8 класс» (П.А. Оржековский, Л.М. Мещерякова, Л.С. Понк. М.: Аст: Астрель, 2005).
2. с. 34-36 №№ 3,5 Из рабочей тетради по химии: 8 кл.: К учебнику П.А. Оржековский и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Ороековский; под. изд. проф. П.А. ОРЖЕКОВСКОГО — М.: АСТ: Астрель: ПрофиСдат, 2006.
Понятие «поделиться» вам наверняка знакомо.
Например, кусок арбуза, изображенный на рисунке, составляет одну четверть всего арбуза, то есть его доля составляет 1/4 или 25%.
Чтобы лучше понять, что такое массовая доля, представьте себе килограмм конфет (1000 г), которые мама купила своим троим детям. Из этого килограмма младшему ребенку досталась половина всех конфет (несправедливо!). Старший — всего 200г, а средний — 300г.
Значит, массовая доля конфет у младшего ребенка будет вдвое, или 1/2, или 50%. Средний ребенок будет 30%, а старший 20%. Следует подчеркнуть, что массовая доля может быть безразмерной величиной (четверть, половина, треть, 1/5, 1/6 и т.), и может быть измерена в процентах (%). При решении расчетных задач долю массы лучше переводить в безразмерную величину.
Массовая доля вещества в растворе
Любой раствор состоит из растворителя и растворенного вещества. Вода является наиболее распространенным неорганическим растворителем. Органическими растворителями могут быть спирт, ацетон, диэтиловый эфир и др. Если растворитель не указан в условии задания, раствором считается вода.
Массовая доля растворенного вещества рассчитывается по формуле:
$\omega_\Text(V-BA)=\DFRAC(M_\TEXT(V-BA))(M_\Text(RR))(\CDOT 100\%)$
Рассмотрим примеры решения задач.
Сколько граммов сахара и воды необходимо взять для приготовления 150 г 10% раствора сахара?
Решение
м (р-ра) = 150г
$\омега$(сахар)=10%=0,1
м (сахара) =?
м (сахар) = $\omega\textrm((сахар)) \Cdot M (P-PA) = 0,1\CDot 150\TextRM(g) = 15\TextRM(g) $
м (вода) = м (р-ра) — м (сахар) = 150г — 15г = 135г.
Ответ: Вам нужно взять 15 г сахара и 135 г воды.
Раствор 350 мл. и плотностью 1,142 г/мл содержит 28 г хлорида натрия. Найдите массовую долю соли в растворе.
Решение
В (р-ра) = 350 мл.
$\ро$(р-ра)=1,142 г/мл
$\омега(NaCl)$=?
м(р-ра)=V(Р-ра)$\cдот\ро$(р-ра)=350 мл$\cдот$1,142 г/мл=400г
$\omega(NaCl)=\DFRAC(M(NaCl))(M\TextRM((R-RA)))=\DFRAC(28\TextRM(g))(400\ ТекстРМ(г)) = 0.07$ = 7%
Ответ: Массовая доля хлорида натрия $\омега(NaCl)$=7%
Массовая доля элемента в молекуле
Формула химического вещества, например $H_2SO_4$, несет в себе много важной информации. Им обозначают либо отдельную молекулу вещества, которая характеризуется относительной атомной массой, либо 1 моль вещества, которое характеризуется молярной массой. Формула показывает качественный (состоит из водорода, серы и кислорода) и количественный состав (состоит из двух атомов водорода, атома серы и четырех атомов кислорода).По химической формуле можно найти массу молекул в целом (молекулярный вес), а также вычислить отношение масс элементов в молекуле: М(Н):М(Т):М(О)\ u003d 2:32:64 = 1:16:32. При расчете отношений масс элементов необходимо учитывать их атомную массу и число соответствующих атомов: $M(H_2)=1* 2 = 2$, $M(S)=32*1=32$, $M(O_4)=16*4=64$
Им обозначают либо отдельную молекулу вещества, которая характеризуется относительной атомной массой, либо 1 моль вещества, которое характеризуется молярной массой. Формула показывает качественный (состоит из водорода, серы и кислорода) и количественный состав (состоит из двух атомов водорода, атома серы и четырех атомов кислорода).По химической формуле можно найти массу молекул в целом (молекулярный вес), а также вычислить отношение масс элементов в молекуле: М(Н):М(Т):М(О)\ u003d 2:32:64 = 1:16:32. При расчете отношений масс элементов необходимо учитывать их атомную массу и число соответствующих атомов: $M(H_2)=1* 2 = 2$, $M(S)=32*1=32$, $M(O_4)=16*4=64$
Принцип расчета массовой доли элемента аналогичен принципу расчета массовой доли вещества в растворе и находится по аналогичной формуле:
$\Омега_\Текст (ЭЛЬ-ТА)\ u003d\DFRAC(AR\ТЕКСТ(ЭЛЬ-ТА))\Cdot N_(\TextRM(атомы)))(M_\Text(Molecules))(\CDOT 100\%)$
Найдите массовую долю элементов в серной кислоте.
Решение
Способ 1 (пропорция):
Находим молярную массу серной кислоты:
$M(H_2SO_4)=1\CDOT 2+32+16\CDOT 4=98\HSPACE(2PT)\TextRM (г/моль)
$Одна молекула серной кислоты содержит один атом серы, значит масса серы в серной кислоте будет: $M(S)=Ar(S)\Cdot n(S)=32\TextRM (г/моль) \CDot 1$ = 32г/моль
Принимаем массу всей молекулы за 100%, а массу серы — за х% и составляем пропорцию:
$М(H_2SO_4)$=98 г/моль — 100%
м(с) = 32г/моль — х%
Где $ х = \ dfrac (32 \ TextRM (г/моль) \ CDOT 100 \%) (98 \ TEXTRM (г/моль)) = 32, 65 \% = 32 \ \%$
Метод 2 (формула):
$\omega(S)=\DFRAC(AR _ (\Text(ЭЛ-ТА))\Cdot N _(\TextRM(атомы)))(M_\Text(молекулы))( \CDOT 100\%) = \DFRAC(Ar(s)\CDot 1)(M(H_2SO_4))(\CDOT 100\%)=\DFRAC(32\TextRM(g /моль)\CDot 1)(98\ТЕКСТРМ(г/моль))(\CDOT 100\%)\ОК32,7\%$
Аналогично по формуле вычисляем массовые доли водорода и кислорода:
$\omega(H)=\DFRAC(AR(H)\CDOT 2)(M(H_2SO_4))(\CDOT 100\%)=\DFRAC(1\TEXTRM(g /моль)\CDOT 2)(98\$\омега(O)=\DFRAC(AR(O)\CDOT 4)(M(H_2SO_4))(\CDOT 100\%)\ u003d\DFRAC(16\TextRM(г/моль)\CDOT 4)(98\Тема урока:
Массовая доля химического элемента в соединении.
ЦЕЛЬ УРОКА: Учить рассчитывать массовые доли элементов в соединении по формуле соединения и устанавливать химическую формулу сложного вещества по известным массовым долям химических элементов.
Основные понятия. Массовая доля химического элемента.
Планируемые результаты обучения Предмет.
Уметь рассчитывать массовую долю элемента в соединении по его формуле и устанавливать химическую формулу сложного вещества по известным массовым долям химических элементов.
Метапермет . Формировать умения устанавливать аналогии, использовать алгоритмы решения учебно-познавательных задач.
Основная деятельность студентов. Рассчитайте массовую долю элемента в соединении по его формуле. Установите химическую формулу сложного вещества по известным массовым долям химических элементов.
Структурный урок I.
. Организационный этап
II.. Актуализация
Поддерживающие знанияIII . Изучение нового материала
Изучение нового материала
IV.. Крепление. Подведение итогов урока
В.. Домашнее задание
Во время занятий Организационное время.
Проверьте свою домашнюю работу.
Актуализация эталонных знаний.
Дайте определения:
родственник
Атомная масса , относительная молекулярная масса. в каких единицах можно измерить относительную атомную массу.В каких единицах можно измерить относительную молекулярную массу.
Изучение нового материала.
Работа с учебником. Рабочая тетрадь.
{!ЯЗЫК-a6977949ea39455c6b142c0fb5ddc71c!}
{!LANG-ca357a62c2b60a3f1a2e9ed1cdea35f0!}
Ребята, допустим у нас есть вещество — серная кислотаH. 2 ТАК. 4,
мы можем узнать, какие атомы входят в состав соединения.
А их количество?
А в каком соотношении масс они соединяются?
Расчет объемных химических отношений
элементы в сложном веществе. (стр. 51)
(стр. 51)
А как узнать, в каких массовых соотношениях связаны элементы в соединении формулы Н. 2 ТАК. 4 ?
м.(В): РС.): м.(О.)= 2*2 + 32 + 16*4= 2:32:64 = 1:16:32.
1 + 16 + 32 = 49, то есть 49 массовых частей серной кислоты, содержат 1 массовую часть водорода, 16 массовых частей серы, 32 массовые части кислорода.
Ребята, как вы думаете, можно ли посчитать долю каждого элемента в соединении?
Сегодня мы познакомимся с новым понятием массовой доли элемента в соединении.
Вт. — массовая доля элемента в соединении.
н. — Количество атомов элемента.
г — относительная молекулярная масса.
Расчет массовых долей химических элементов
в сложном веществе. (РТ)
1. Изучить алгоритм расчета массовой доли элемента в соединении.
Задание №1 (РТ)
Вывод химических формул, если известны массовые доли химических элементов,
включены в это вещество. (РТ)
(РТ)
2. Изучить алгоритм расчета массовой доли элемента в соединении.
Задание №5 (РТ)
Закрепление изученного материала.
РТ с. 25 №2.
РТ с. 27 №6.
Подведение итогов урока.
Какие новые понятия вы узнали сегодня на уроке?
Самостоятельная работа.
Домашнее задание:
Р Бак для литературы.
Учебник. Химия 8 класс. Авто Г.Е. Рудзитис, Ф.Г. Фельдман. Издательство «Просвещение», 2014.
Рабочая тетрадь по химии. Авто Боровский ТП
преобразований концентрации | Нейтрий
В этой статье подробно описаны наиболее распространенные методы количественного определения концентрации компонента в смеси, а также способы преобразования этих концентраций. Концентрация обычно выражается в молях на объем, массе на объем, массовых процентах, объемных процентах, мольных процентах и частях на миллион.Используя свойства плотности и/или молекулярной массы, можно преобразовать любую из вышеперечисленных мер.
| : | : | : | Масса компонента | |||
| : | Молекулярный вес | |||||
| : | : | : | ||||
| : | Части на миллион, веса | |||||
| : | : | Части на миллион, база объема | ||||
| : | частей на миллион, моль | |||||
| : | : | объемная фракция | ||||
| : | : | Массовая фракция | ||||
| : | Мольная доля | |||||
| : | Плотность или масса на объемную концентрацию |
Ниже в таблице приведены преобразования концентрации между многими мерами концентрации.Во всех случаях мы описываем концентрацию вещества 1 в общем веществе, и это используется в нижних индексах в формулах ниже.
Нажмите, чтобы перейти к разделу для конвертации от:
моль фракция
| CONVERTION в | Типичные блоки | Конвертировать из моль / моль (x) | |
|---|---|---|---|
| объем / том * | — | — | |
| Молярная концентрация | Моль / л | G / L | |
| Части на миллион (PPM MOL) | μMol / MOL | ||
| частей на миллион (PPM вес) | мг / кг | ||
| частей на миллион (объем PPM) | мкл / л |
* Умножьте на 100 для массы, молей или объемных %.
массовая фракция
| преобразовать в | Типичные агрегаты | Увеличить от массы / масса (M) |
|---|---|---|
| — | ||
| Объем / Объем * | — | |
| Молярная фракция | Mol / L | |
| MASS / VOL | г / л | |
| частей на миллион (PPM MOL) | μMol / MOL | |
| миллион (весовых частей на миллион) | мг/кг | |
| частей на миллион (частей на миллион объемных) | мкл/л |
объемная фракция
| преобразовать в | типичных единиц | CONVERTION от VOL / VOL (?) |
|---|---|---|
| — | ||
| Масса / масса * | ||
| Молярная фракция | Mol / L | |
| MASS / VOL | г / л | |
| частей на миллион (PPM MOL) | μMol / MOL | |
| миллион (весовых частей на миллион) | мг/кг | |
| частей на миллион (частей на миллион объемных) | мкл/л |
Молярная концентрация
| преобразовать в | Типичные блоки | Convert из молярной концентрации (C) | |
|---|---|---|---|
| Mol / Mol * | — | ||
| Масса / масса * | — | ||
| Объем / Том * | — | — | |
| Mass / Vol | G / L | ||
| Запчасти на миллион (PPM MOL) | μMol / MOL | ||
| Запчасти на миллион (весовые части на миллион) | мг/кг | ||
| частей на миллион (объемных частей на миллион) | мкл/л |

Масса по объему
| 9114 | Типичные агрегаты | Конвертировать от массы / объема (M 1 / V Tot ) | |
|---|---|---|---|
| 3 Mol / Mol * | — | ||
| Масса / Масса * | — | ||
| Объем / Объем * | — | ||
| Молярная фракция | Mol / L | ||
| Запчасти на миллион (PPM MOL) | μMol / MOL | ||
| Части на миллион (Вес PPM) (PPM Вес) | мг / кг | ||
| Части на миллион (объем PPM) | мкл / л |
| преобразовать в | Типичные блоки | Конвертировать из PPM MOL |
|---|---|---|
| 3 MOL / MOL * | μMol / Mol | |
| Масса / масса * | — | 3 —|
| Объем / Объем * | — | |
| Молярная фракция | Mol / L | MASS / VOL | г / л |
| частей на миллион ( ppm вес) | мг/кг | |
| частей на миллион (частей на миллион по объему) | мкл/л |
* умножить на 100 для получения массы, моль или объем
частей на миллион (вес PPM)
| преобразовать в | Типичные блоки | CONVERTION от PPM Вес | — |
|---|---|---|---|
| Масса / масса * | — | ||
| объем / том * | — | — | |
| Молярная фракция | Mol / L | G / L | |
| частей на миллион (PPM MOL ) | мкмоль/моль | ||
| частей на миллион (частей на миллион по объему) | мкл/л |
Части на миллион (объем PPM)
| CONVERTIONT в | Типичные блоки | CONVERTION от PPM том |
|---|---|---|
| — | ||
| Mass / Mass * | — | |
| объем / том * | — | Молярная фракция | Моль / л |
| частей на миллион (PPM MOL) | μMol / Mol | |
| объем | г/л | |
| частей на миллион (млн вес) | мг/кг |
* умножить на 100 для массы, моль или объем %.
Метки статьи
Частей на миллион — ppm
Частей на миллион — ppm — обычно используется как безразмерная мера малых уровней (концентраций) загрязняющих веществ в воздухе, воде, жидкостях организма, и т.д.
Частей на миллион – это молярная масса, объем или массовое соотношение между загрязняющим компонентом и раствором. PPM определяется как
ppm = 1 000 000 к / с
= 10 6 C / S C / S (1)
, где
C = молярная масса, объем или масса компонента (моль, м 3 , фут 3 , кг, фунт м )
s = молярная масса, объем или масса раствора 90 , FT 3 , кг, LB M )
в метрической системе PPM для массы могут быть выражены в терминах миллиграммов против кг где
- 1 мг /кг = 1 часть на миллион
частей на миллион также можно выразить как
- 1 часть на миллион = 10 -6 = 0.
 0001% = 0.001 ‰
0001% = 0.001 ‰
- 1 000 ppm = 0,1 %
- 10 000 ppm = 1%
Скачать и распечатать PPM vs. Процент и мг / л Диаграмма
— Сопутствующие массовые агрегаты для измерения очень небольших уровней концентрации:
- PPB — Части на миллиард (1/100 000 000 или 10 -9 )
- PPT — Части на триллион (1/100 000 000 000 или 10 -12 )
-
- PPQ — Запчасти на квадриллион (1/100 000 000 000 000 или 10 -15 )
Альтернативно массовая единица для измерения больших уровней концентрации составляет мас.% , которые могут быть выражены как
весовых процентов = 100 м c / м s (2)
ppm vs.Масса на единицу объема
Концентрация компонента может быть измерена как масса на единицу объема – например, мг/л, мг/см 3 и т. д.
д.
Масса вещества, добавленного к одной единице объема воды для получения Часть на миллион (PPM)
1 PPM
= 2,72 фунта на акр-ноги
= 1,233 грамм на акр-ноги
= 1,233 килограмма на акр-ноги
= 0.0283 грамм на кубический ногой
= 0.0000624 фунтов на кубический фут
= 0,0038 грамм нами галлон
= 0,058419 зерна на американский галлон
= 0,07016 зерна на имперский галлон
= 1 миллиграмм на литр (мг/л)
= 1 микролитр (мкл) на литр
= 0,001 грамм на литр
8 .345 фунтов на миллион галлонов воды
Пример – объемная концентрация двуокиси углерода в воздухе
Концентрация двуокиси углерода в воздухе составляет прибл. 400 частей на миллион . Объем углекислого газа в один 1 м 3 воздуха может быть рассчитан путем модификации (1) до
C = PPM S / 10 6
= (400 частей на миллион) (1 м 3 ) / 10 6
= 0.
0004 м 3 /м 3
Объемные проценты
Объемные проценты могут быть выражены как объем на единицу объема: S ) (3)
V C = Объемный компонент = 1000006
V S = Объемный растворитель
Моли
Младородность — это количество молей растворенности ( интересующее вещество — загрязнение и т. д.) растворяют в одном литре (объеме) раствора.
Моляльность
Моляльность – это количество молей растворенного вещества, деленное на килограммы растворителя.
Концентрация — Steffen’s Chemistry Pages
1 Молярная концентрация
Молярная концентрация вещества B в растворе от отношения количества молей вещества B к объему раствора Lg. Соответствующая единица СИ – 1 моль/м³. Кроме того, допустимы моль/л, моль/дм³, ммоль/л, моль/мл, кмоль/м³.Раствор с молярной концентрацией 1 моль/л также называют 1 молярным (сокращенно 1 М).
c B = n B / v Lg
2 Эквивалентная концентрация
Эквивалентная концентрация, также называемая нормой, вещества В в растворе определяется как отношение Соффменжа к эквиваленту (количество эквивалентов определяется стехиометрическим значением z молекулы) и объем раствора. Используйте те же единицы, что и для молярной концентрации.
Раствор с эквивалентной концентрацией c Ä, B 1 моль/л обозначается как 1 нормальный (сокращенно 1N).
c A, B = n A, B / v Lg = c B * z = (n B * z) / v Lg
3 Моляльность
Моляльность вещества B в растворе определяется как отношение количества молей вещества B к массе растворителя Lm. Полученная действительная единица СИ равна 1 моль/кг.
Раствор с моляльностью m c, B = 1 моль/кг также обозначается как 1 моляль.
c м, B = n B / м Lm
4 Массовая концентрация
Массовая концентрация вещества В в растворе определяется как отношение массы вещества В к объему раствора.
Единицей СИ является 1 кг/м³. Кроме того, допускаются следующие единицы измерения: г/л, мг/мл, мг/л, г/см³, мкг/мл. Не допускаются такие единицы соотношения, как %, ‰, ppb и ppm, а также мг% и г% (= г/100 мл)
ρ B = m B / v Lg
5 Объемная концентрация
Объемная концентрация вещества B на стадии смешивания определяется как отношение объема вещества B к общему объему фазы смешивания.
Соответствующая единица СИ – м³ / м³. Кроме того, разрешены л/л, л/м³, см³/л и л/гл.
σ B = v B / v tot
6 Количество вещества
Количество вещества (молярная доля) вещества В в смешанной фазе определяется как отношение молярного количества вещества В к сумме молярных количеств всех компонентов смешанная фаза.
Единицей СИ является моль/моль, а ммоль/моль, моль/кмоль, %‰, ppm и ppb допускаются.
χ B = n B / n Σ i
7 Массовая доля
Массовая доля (также называемая массовой долей) вещества В в смешанной фазе определяется как отношение массы вещества В и суммы масс всех компонентов смешанной фазы .
Соответствующие единицы СИ: кг/кг, г/кг, мг/г, мг/кг, г/г% ‰, также разрешены части на миллион и части на миллиард.
w B = m B / m Σ i
8 Объемная доля
Объемная доля (также называемая объемной долей) вещества В на стадии смешивания определяется как отношение объема вещества В к сумме объемов всех компонентов смешанной фазы .
Единицей СИ является м³ / м³. Кроме того, допускаются: л/л, л/м³, см³/л, мл/л, %, ‰, ppm и ppb.
φ B = v B / v Σ i
Преобразование переменных концентрации
.
