Страница не найдена — Портал Продуктов Группы РСС
Сообщите нам свой адрес электронной почты, чтобы подписаться на рассылку новостного бюллетеня. Предоставление адреса электронной почты является добровольным, но, если Вы этого не сделаете, мы не сможем отправить Вам информационный бюллетень. Администратором Ваших персональных данных является Акционерное Общество PCC Rokita, находящееся в Бжег-Дольном (ул. Сенкевича 4, 56-120 Бжег-Дольный, Польша ). Вы можете связаться с нашим инспектором по защите личных данных по электронной почте: .
Мы обрабатываем Ваши данные для того, чтобы отправить Вам информационный бюллетень — основанием для обработки является реализация нашей законодательно обоснованной заинтересованности или законодательно обоснованная заинтересованность третьей стороны – непосредственный маркетинг наших продуктов / продуктов группы PCC .
Как правило, Ваши данные мы будем обрабатывать до окончания нашего с Вами общения или же до момента, пока Вы не выразите свои возражения, либо если правовые нормы будут обязывать нас продолжать обработку этих данных, либо мы будем сохранять их дольше в случае потенциальных претензий, до истечения срока их хранения, регулируемого законом, в частности Гражданским кодексом.
В любое время Вы имеете право:
- выразить возражение против обработки Ваших данных;
- иметь доступ к Вашим данным и востребовать их копии;
- запросить исправление, ограничение обработки или удаление Ваших данных;
- передать Ваши персональные данные, например другому администратору, за исключением тех случаев, если их обработка регулируется законом и находится в интересах администратора;
- подать жалобу Президенту Управления по защите личных данных.
Получателями Ваших данных могут быть компании, которые поддерживают нас в общении с Вами и помогают нам в ведении веб-сайта, внешние консалтинговые компании (такие как юридические, маркетинговые и бухгалтерские) или внешние специалисты в области IT, включая компанию Группы PCC .
Больше о том, как мы обрабатываем Ваши данные Вы можете узнать из нашего Полиса конфиденциальности.
Кислоты в химии — классификация, получение, свойства, формулы и определения с примерами
Содержание:
Понятие о кислотах:
Из курса природоведения вы знаете об уксусной кислоте, в 7 классе упоминалась серная кислота. Кислый вкус лимонам придает именно лимонная кислота. Обратите внимание, слово «кислота» есть в каждом из этих словосочетаний. Это потому, что эти вещества принадлежат к одной группе сложных веществ — кислотам. При этом, серная кислота — неорганическое вещество, а уксусная и лимонная — органические.
Кислый вкус лимонам придает именно лимонная кислота. Обратите внимание, слово «кислота» есть в каждом из этих словосочетаний. Это потому, что эти вещества принадлежат к одной группе сложных веществ — кислотам. При этом, серная кислота — неорганическое вещество, а уксусная и лимонная — органические.
Кислоты — сложные вещества. Подобно оксидам, они состоят из двух частей, а объединить их в одну группу позволяет наличие атомов водорода.
Ознакомимся с приведенными формулами кислот:
Качественный состав этих формул подтверждает наличие одного или нескольких атомов водорода.
Разделим формулы кислот черточкой на две части так, чтобы в первой были атомы водорода:
Оставшуюся часть называют кислотным остатком.
Вторая часть формул кислот отличается от первой части по составу.
Атомы водорода есть и в составе аммиака но он не относится к классу кислот. Ведь кислотам свойственен еще один общий признак — способность атомов водорода замещаться атомами металлов и образовывать при этом соли.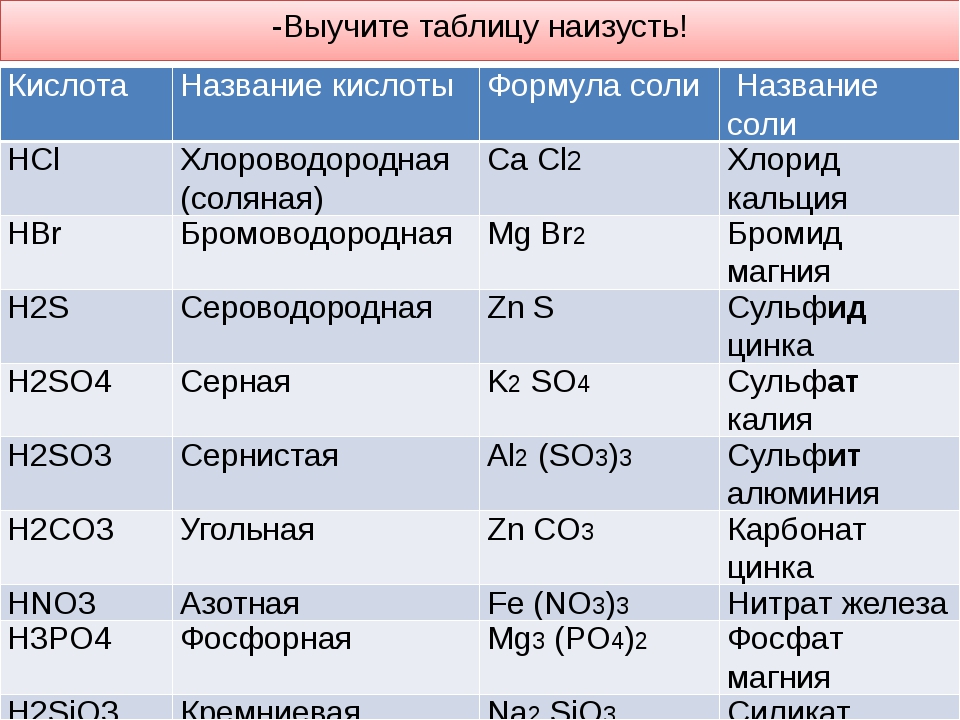
Кислоты — это сложные вещества, которые содержат атомы водорода, способные замещаться металлом, и кислотный остаток.
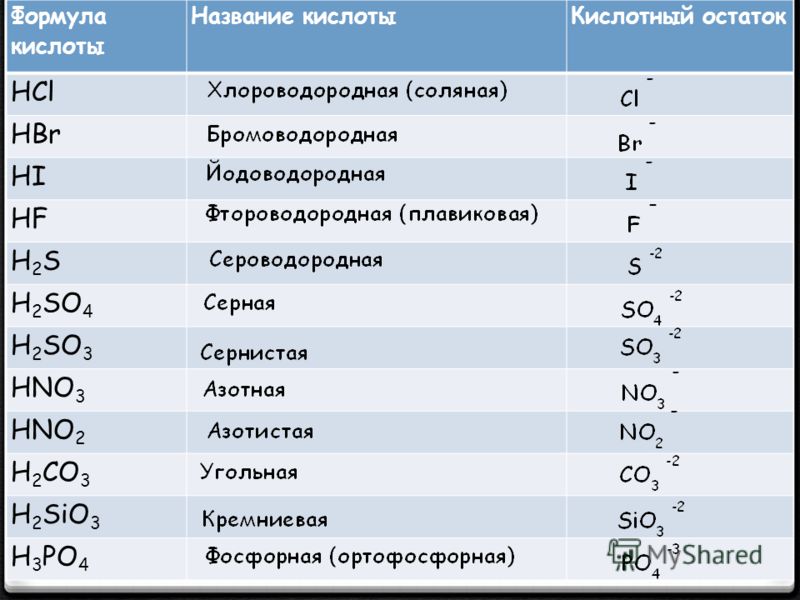
Названия кислотОзнакомьтесь с таблицей 1, в нее внесены неорганические кислоты, с которыми вы будете сталкиваться чаще всего.
До сих пор вы рассматривали валентность как способность атомов одного химического элемента соединяться или замещать определенное количество атомов другого элемента. Отныне ваши знания об этой физической характеристике атомов пополнятся информацией о валентности кислотных остатков. Оказывается, что кислотные остатки также способны совмещать определенное количество атомов или групп атомов.
Запись общей формулы кислот имеет такой вид:
Таким образом, валентность кислотного остатка равна количеству атомов водорода.
Физические свойства кислотНеорганические кислоты, в основном, — жидкости. Среди них совсем мало твердых веществ (из приведенных в таблице 1 лишь ортофосфорная), нет газообразных.
Кислоты бесцветны, плотность всех кислот больше единицы. Они хорошо растворяются в воде (за исключением некоторых, в частности кремниевой).
И название класса соединений —
Запомните! В химическом кабинете ни в коем случае нельзя пробовать кислоты и любые другие вещества на вкус! Это очень опасно!
Кислоты повреждают слизистые оболочки органов пищеварения, при вдыхании паров раздражают слизистые оболочки органов дыхания, попадая на кожу, вызывают покраснения, болевые ощущения, а при большой концентрации — тяжелые ожоги. Кислоты портят одежду — на месте их попадания сразу или со временем появляется дыра. Некоторые кислоты имеют резкий неприятный запах, например соляная, серная, азотная.
Однако работа с кислотами в школьном химическом кабинете безопасна, так как учащиеся работают с разбавленными кислотами, а не с чистыми веществами. При этом нельзя допускать попадания кислот на одежду или тело и особенно в глаза.
Плотности всех кислот больше единицы, то есть они тяжелее воды. Существует правило приготовления растворов кислот: кислоту льют в воду (не наоборот!) небольшими порциями, помешивая стеклянной палочкой. Почему именно так? Имея плотность большую, чем плотность воды, кислота проходит сквозь толщу воды на дно сосуда и смешивается с водой. Если же сделать наоборот — воду лить в кислоту, — вода будет скапливаться на поверхности кислоты, от сильного разогревания (в результате химического взаимодействия) она закипит, а ее брызги могут попасть на тело или одежду. Если так приготовить раствор серной кислоты, то в результате сильного разогревания стеклянный сосуд может даже треснуть.
Однако кислоты не разрушают стекло (исключение — плавиковая кислота некоторые пластмассы и резину.
Как вы уже знаете, структурные формулы показывают не только количественный и качественный состав молекул, но и порядок соединения атомов в них. Как записывать структурные формулы кислот?
Пример 1. Записать структурную формулу соляной кислоты
Зная, что одна черточка в структурной формуле соответствует одной единице валентности, а водород и кислотный остаток этой кислоты одновалентны, записываем:
Пример 2. Записать структурную формулу серной кислоты.
Чтобы правильно записать структурную формулу кислоты, молекулярная формула которой следует помнить, что в молекулах кислородсодержащих кислот атомы водорода соединены с атомами кислорода:
Итоги:
- Кислоты — класс неорганических соединений, молекулы которых состоят из атомов водорода, способных замещаться атомами металлов, и кислотного остатка.

- Валентность кислотного остатка определяется количеством атомов водорода, которые могут быть замещены атомами металла.
- Работая с кислотами, необходимо помнить об их химических свойствах и строго придерживаться правил безопасной работы с ними.
Тривиальные названия кислот (серная, соляная и др.) появились в последнем десятилетии XVIII ст., когда в 1792 году о них сообщил от имени своих коллег-химиков французский ученый Антуан Лавуазье на заседании Парижской академии. А до этого кислоты назывались произвольно. Среди нескольких названий серной кислоты было и название «купоросная», карбонатной — «воздушная».
Новая химическая номенклатура внедрялась медленно. В России к предложенным названиям обратились лишь через 100 лет. В частности, еще в 1875 г. в Петербургской академии наук обсуждалась возможность применения для кислоты названия «Водород серович четырехкислов», подобно фамилии, имени и отчеству человека.
Способность металлов вытеснять водород из кислот
Вернемся к определению кислот как сложных веществ, в молекулах которых атомы водорода способны замещаться атомами металлов, и подтвердим это опытным путем.
Опыт 1. Поместим в пробирку немного магниевых опилок, дольем к ним воды и будем наблюдать. При комнатной температуре никаких изменений не происходит.
Опыт 2. Поместим в пробирку немного магниевых опилок, дольем к ним разбавленного раствора серной кислоты (1 часть кислоты и приблизительно 5 частей воды) и быстро закроем пробирку пробкой с газоотводной трубкой. При комнатной температуре магний активно взаимодействует с кислотой, о чем свидетельствует выделение пузырьков газообразного вещества.
Соберем газ способом вытеснения воды и испытаем его. Для этого наполненную газом пробирку закроем под водой стеклянной пластиной и извлечем пробирку из сосуда.
Выясним, какой газ мы собрали. Вам известно, что кислород поддерживает горение и в сосуде с ним горящая спичка или тлеющая щепка ярко загорятся. Наличие водорода также можно установить с помощью горящей спички — пламени ее достаточно, чтобы поджечь водород. Исходя из того, что в составе серной кислоты есть и атомы водорода, и атомы кислорода, проверим, какой газ — водород или кислород — мы собрали: поднеся зажженную спичку к отверстию пробирки, услышим приглушенный хлопок (взрыв). Окисление водорода спровоцировало небольшой взрыв, а яркого горения спички не наблюдалось.
Окисление водорода спровоцировало небольшой взрыв, а яркого горения спички не наблюдалось.
Магний вытеснил из кислоты не кислород, а водород, о чем свидетельствует продукт реакции — водород:
Следовательно, в результате реакции образовалось простое газообразное вещество. Оно не имеет запаха и цвета, потому мы и обнаружили его только после сожжения образовавшегося водорода.
Проанализируйте состав другого продукта этой реакции и сделайте вывод, простое это вещество или сложное. Образованное вещество относится к классу неорганических соединений — солям. С представителем этого класса соединений — поваренной солью — вы уже встречались, разделяя смесь соли и воды испарением. Воспользуемся этим способом и проверим опытным путем наличие соли в растворе. Для этого несколько капель образовавшегося после реакции раствора выпарим на стеклянной пластине. После испарения воды на ней останется небольшое количество соли белого цвета.
Продолжим исследование способности атомов металлических элементов замещать атомы водорода в молекулах кислот, но уже на примере других металлов, и проделаем опыт с соляной кислотой и цинком.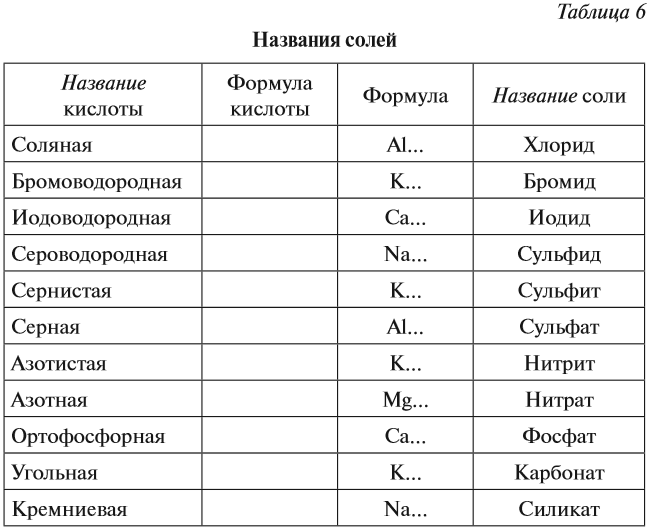
Опыт 3. Поместим (осторожно!) на дно пробирки несколько гранул металла цинка, дольем к ним разбавленную соляную кислоту и будем наблюдать. Довольно быстро поверхность гранул покроется пузырьками газообразного вещества. Подогреем содержимое пробирки, и газ станет выделяться активнее. (Вспомните, как определяется относительная плотность газов по воздуху. Вычислите плотность водорода по воздуху и предложите, как нужно правильно держать пробирку, чтобы она наполнилась водородом.) Расчеты подтверждают, что водород в 14,5 раза легче воздуха. Следовательно, чтобы наполнить пробирку водородом, ее нужно держать вверх дном. Соберем водород в сухую пробирку способом вытеснения воздуха и испытаем его.
Как и в предыдущем опыте, раздается приглушенный хлопок. Следовательно, цинк вытеснил атомы водорода из молекул соляной кислоты, из атомов образовались молекулы водорода, и опыт это только что подтвердил:
На стенках пробирки появились капельки воды — продукта окисления водорода:
Запомните! Реакция горения водорода сопровождается взрывом. Поэтому для безопасности ее проведения объем водорода не должен превышать вместимости пробирки.
Поэтому для безопасности ее проведения объем водорода не должен превышать вместимости пробирки.
Опыт 4. К медным опилкам добавим разбавленную соляную кислоту. Наблюдение показывает, что реакции не происходит: цвет меди и раствора не изменился, образования газообразного вещества не наблюдается. Подогреем содержимое пробирки и еще раз убедимся в отсутствии каких-либо изменений, т. е. медь не вытесняет водород из кислоты.
Таким образом, опытным путем мы выяснили, что одни металлы способны вытеснять водород из кислот, другие — нет. Это свойство металлов исследовал русский ученый Николай Николаевич Бекетов и по способности металлов вытеснять водород из кислот составил в 1863 г. вытеснительный ряд металлов, или ряд активности металлов:
Николай Николаевич Бекетов (1827 — 1911) — известный ученый в области физики и химии, русский по происхождению. Много лет работал профессором Харьковского университета (в настоящее время Харьковский национальный университет имени В.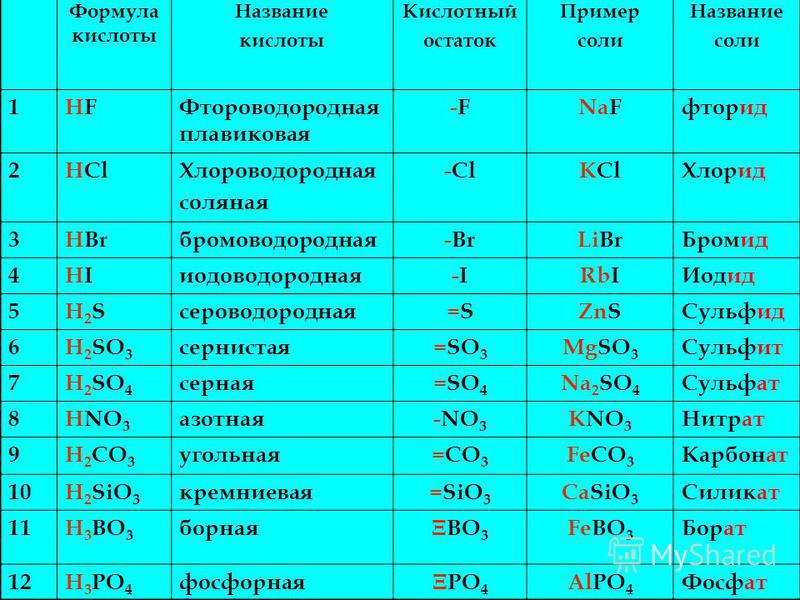 Н. Каразина). Ученый стоял у истоков одной из отраслей химической науки — физической химии. Ему принадлежит открытие одного из способов добычи металлов из руд-оксидов — алюминотермия. При этом способе используют свойства алюминия при определенной температуре вступать в реакцию с оксидом металла с последующим окислением. В результате выделяется металл в виде простого вещества высокой степени чистоты. Так добывают высокой чистоты железо, хром, кобальт, никель, марганец.
Н. Каразина). Ученый стоял у истоков одной из отраслей химической науки — физической химии. Ему принадлежит открытие одного из способов добычи металлов из руд-оксидов — алюминотермия. При этом способе используют свойства алюминия при определенной температуре вступать в реакцию с оксидом металла с последующим окислением. В результате выделяется металл в виде простого вещества высокой степени чистоты. Так добывают высокой чистоты железо, хром, кобальт, никель, марганец.
В 1863 г. Бекетов составил вытеснительный ряд металлов (ряд активности металлов).
Все металлы, расположенные в ряду активности металлов слева от водорода, вытесняют водород из кислот. Эта способность металлов ослабевает от лития к свинцу. Металлы, расположенные в вытеснительном ряду после водорода, не вытесняют водород из кислот, т. е. не взаимодействуют с кислотами. Эта закономерность не распространяется на азотную кислоту, которая взаимодействует с металлами, расположенными не только до водорода, но и после него, однако одним из продуктов реакции является не водород, а вода. Аналогично реагирует с металлами и концентрированная серная кислота.
Аналогично реагирует с металлами и концентрированная серная кислота.
Наличие в ряду активности металлов водорода дает возможность сделать вывод о том, будет ли взаимодействовать металл с кислотой.
Следует также знать, что металлы вытесняют водород не только из кислот, но и из воды, в которой кислота растворена, поэтому запись лишь одного уравнения (металл + кислота) не всегда отвечает действительности.
В проведенных нами опытах активность металлов изменялась так:
Выясним место металлов в ряду активности и убедимся, что результаты этих опытов отвечают закономерности, установленной М. М. Бекетовым. Поэтому можем представить полученные результаты в виде химических уравнений:
Понятие об индикаторахИндикаторами называют вещества или тела, с помощью которых обнаруживают конкретный признак другого вещества, тела или материала. Например, у электромонтеров есть прибор, который называется индикатором электрического тока.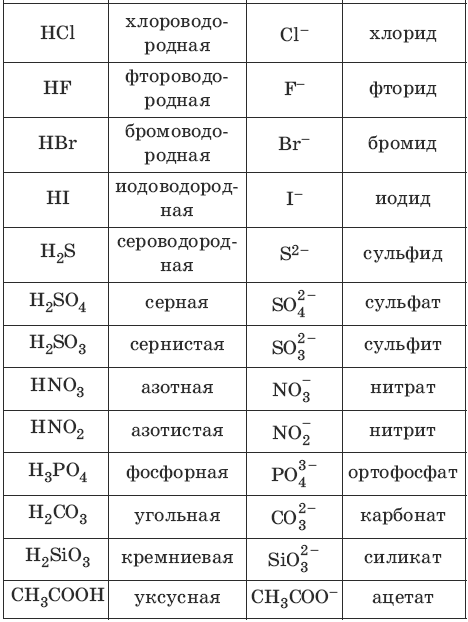 В химической лаборатории, а также лабораториях, где проверяют качество продуктов питания, также нужны индикаторы — вещества, с помощью которых определяют наличие кислот или оснований в растворе.
В химической лаборатории, а также лабораториях, где проверяют качество продуктов питания, также нужны индикаторы — вещества, с помощью которых определяют наличие кислот или оснований в растворе.
В школьной химической лаборатории пользуются в основном такими индикаторами: лакмусом, метиловым оранжевым (метилоранжем), фенолфталеином. Используют или их растворы, или индикаторные бумажные полоски (пропитанная индикатором бумага с последующим ее высушиванием).
На чем основывается применение индикаторов? Они приобретают различную окраску в воде, растворах кислот и оснований.
В воде лакмус приобретает фиолетовый цвет, метилоранж, — оранжевый, фенолфталеин — бесцветен.
Под воздействием кислот или оснований индикаторы изменяют свой цвет. При этом происходят сложные химические реакции, уравнения которых мы записывать не будем. А вот явлением, которое их сопровождает — изменением цвета, — воспользуемся уже при выполнении лабораторного опыта 1.
Итоги:
- Вытеснительный ряд металлов, или ряд активности металлов — это ряд, в котором металлы расположены по их способности вытеснять водород из кислот.
- Металлы, расположенные в ряду активности до водорода, вытесняют водород из кислот, металлы, расположенные в ряду активности после водорода,— не вытесняют.
- Качественной реакцией на водород является его взаимодействие с кислородом, во время которого слышится приглушенный хлопок — взрыв. Чтобы эта реакция состоялась, достаточно зажженную спичку поднести к отверстию пробирки с водородом.
- Кислоту в растворе можно обнаружить с помощью индикаторов лакмуса и метилового оранжевого.
Как было выяснено опытным путем, в растворах разных кислот все индикаторы имеют одинаковый цвет. Это свидетельствует о том, что к изменению цвета индикаторов причастен водород, потому что он входит в состав всех кислот, тогда как кислотные остатки у них разные. Действие на индикаторы оказывают не нейтральные атомы водорода, а его положительно заряженные ионы (Вспомните, как в 7 классе вы научились различать атомы и ионы.) Если вы были внимательны, то обратили внимание на то, что в каждом опыте использовались водные растворы кислот, потому что чистые кислоты не действуют на индикаторы.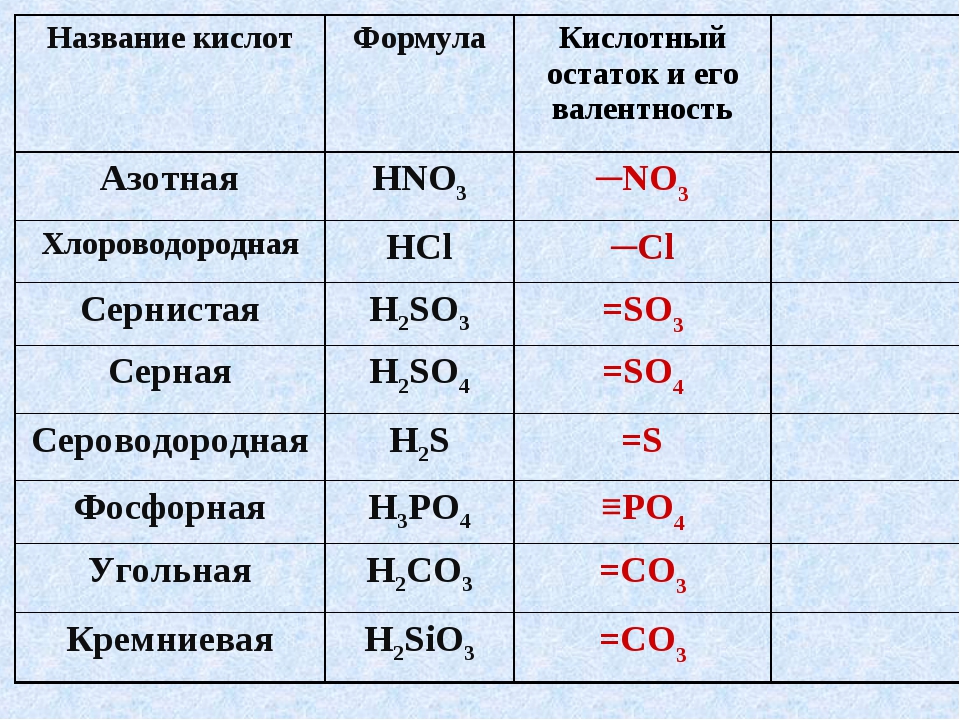 Вода нужна для того, чтобы молекула кислоты распалась на положительно заряженные ионы (катионы) водорода и негативно заряженные ионы (анионы) кислотного остатка. При этом число образованных из одной молекулы кислоты катионов водорода равно числу его атомов в составе молекулы кислоты, в то время как анион кислотного остатка образуется один:
Вода нужна для того, чтобы молекула кислоты распалась на положительно заряженные ионы (катионы) водорода и негативно заряженные ионы (анионы) кислотного остатка. При этом число образованных из одной молекулы кислоты катионов водорода равно числу его атомов в составе молекулы кислоты, в то время как анион кислотного остатка образуется один:
Стрелки в обоих направлениях вместо знака «равенства» означают, что происходит не только образование ионов, но и обратный процесс, — ионы объединяются в молекулы.
Обратите внимание: каким бы сложным не был кислотный остаток, он образует единый ион и сохраняет свою целостность.
Итак, с помощью лакмуса, метилового оранжевого, универсального бумажного индикатора можно определить присутствие в растворе катионов водорода, или созданную ими кислую среду.
Определение кислотПрочитав название параграфа, кое-кто вспомнит вкус лимона или апельсина. В самом деле, такой вкус обусловливают соединения, общее название которых — кислоты (рис. 10).
10).
Кислота — соединение, молекула которого содержит один или несколько атомов Гидрогена, способных при химических реакциях замещаться на атомы металлического элемента.
Все кислоты имеют молекулярное строение. Для них существуют две общие формулы — Кислот, которые отвечают первой формуле, немного. Их образуют неметаллические элементы VI и VII групп периодической системы.
Примеры химических формул кислот:
При замещении атомов Гидрогена в молекулах кислот, например, на атомы Натрия, образуются соединения* с такими формулами:
Часть молекулы кислоты, соединенную с атомом (атомами) Гидрогена, называют кислотным остатком. Для кислоты с формулой кислотным остатком является атом Хлора, для кислоты — группа атомов
Количество атомов Гидрогена в молекуле кислоты определяет валентность кислотного остатка. Например, кислотный остаток одновалентный (молекула содержит один атом Гидрогена), а остаток — двухвалентный (в молекуле два атома Гидрогена). Таким образом, понятие «валентность» применяют не только для атомов, но и для групп соединенных между собой атомов.
Таким образом, понятие «валентность» применяют не только для атомов, но и для групп соединенных между собой атомов.
Элемент, который образует кислоту, называют кислотообразующим. Покажем, как можно определять значение его валентности в кислотах с общей формулой В качестве примера возьмем соединение, имеющее формулу
* — Общее название этих соединений — соли.
Запишем над символами Гидрогена и Оксигена значения валентности этих элементов:
Количество единиц валентности для 4-х атомов Оксигена составляет а для 2-х атомов Гидрогена — Значение валентности атома Сульфура равно разнице между первым и вторым числом, т. е.
Поскольку кислоты — молекулярные соединения, то для них используют графические формулы. Составлять такие формулы для молекул кислот с общей формулой очень просто. Покажем, как это сделать для молекулы кислоты, которая состоит из атомов трех элементов, а также для ее кислотного остатка.
Пример №
Составить графические формулы молекулы кислоты и ее кислотного остатка.
Решение
Способ 1. Мы только что выяснили, что элемент Сульфур в кислоте шестивалентен. Записываем вокруг кислотообразующего атома 6 черточек:
Все эти черточки (единицы валентности) должны также «принадлежать» 4-м двухвалентным атомам Оксигена. Размещаем атомы Оксигена вокруг атома Сульфура. Двум атомам Оксигена «выделяем» по две черточки, а для двух других остается по одной:
черточке (Оксиген — двухвалентный элемент). Записываем эти черточки и получаем графическую формулу кислотного остатка
Из этой формулы видно, что остаток кислоты двухвалентен. Дописываем слева и справа по атому Гидрогена и получаем графическую формулу молекулы кислоты
Способ 2. Записываем химическую формулу соединения, выделив в ней группы атомов (гидроксильные группы):
Гидроксильная группа одновалентна: Соединяем черточкой каждую группу с атомом Сульфура:
Поскольку атом Сульфура шестивалентный, размещаем вокруг него еще четыре черточки и к каждой их паре записываем по атому Оксигена:
Классификация кислотКислоты отличаются друг от друга. Их делят на несколько групп. К каждой группе принадлежат кислоты, сходные по определенным признакам.
Их делят на несколько групп. К каждой группе принадлежат кислоты, сходные по определенным признакам.
Существуют безоксигеновые и оксигенсодержащие кислоты. Названия этих групп кислот указывают на отсутствие или наличие в молекулах соединений атомов Оксигена.
Примеры кислот каждой группы:
Безоксигеновых кислот известно немного. Их общая формула — Это не чистые вещества, а водные растворы газообразных соединений некоторых неметаллических элементов с Гидрогеном:
Оксигенсодержащих кислот намного больше. Они имеют общую формулу
Другой признак для классификации кислот — количество атомов Гидрогена в молекуле соединения. Соответствующую характеристику кислоты называют основностью. Существуют одно-, двух-, трехосновные кислоты, а также несколько кислот с более высокой основностью. Примеры кислот соответствующих групп:
По химической активности кислоты делят на сильные и слабые. Сильные кислоты, в отличие от слабых, активно взаимодействуют со многими веществами. Известны также несколько кислот средней силы. Примеры кислот различной активности (см. также форзац 2):
Известны также несколько кислот средней силы. Примеры кислот различной активности (см. также форзац 2):
Кислоты имеют химические и тривиальные названия. Формулы и названия важнейших кислот указаны в таблице 1.
Это интересно. Цианидная кислота HCN — безоксигеновая кислота, образованная тремя элементами. Она является сильным ядом.
Химические названия кислот состоят из двух слов. Второе слово во всех названиях — кислота. Корень первого слова происходит от названия элемента, который образует кислоту (хлоридная кислота — соединение Хлора). Первое слово названия безоксигеновой кислоты имеет суффикс «ид» ( — сульфидная кислота). Для оксигенсодержащей кислоты это слово может иметь разные суффиксы. Если кислотообразующий элемент проявляет в соединении наивысшую валентность, то используют суффикс «ат» — сульфатная кислота), а если низшую — «ит» — сульфитная кислота). В химических названиях кислот есть еще и приставки «мета», «орто» (табл.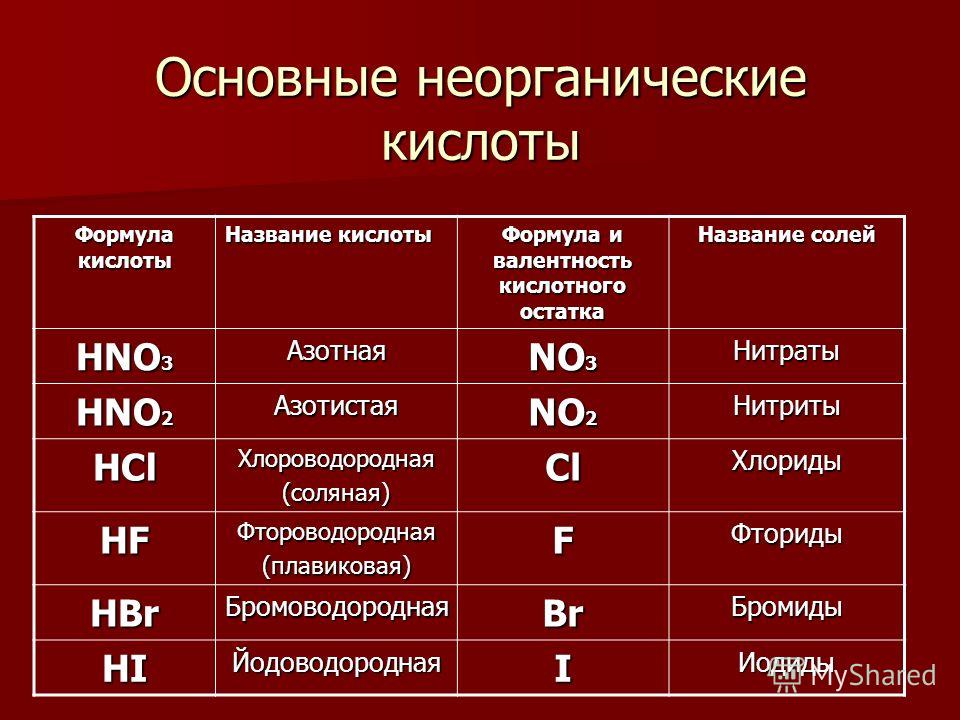 1).
1).
Тривиальные названия большинства кислот происходят от названий простых веществ или соединений элементов с Гидрогеном.
Кислота кислотный оксид. Для каждой оксигенсодержащей кислоты существует оксид. Его называют кислотным оксидом. Значение валентности кислотообразующего элемента в кислоте и в соответствующем оксиде — одно и то же:
Распространенность в природеНа нашей планете встречается немало кислот. Карбонатная кислота образуется в результате растворения в природной воде углекислого газа Во время извержений вулканов в атмосферу поступают сероводород и сернистый газ Первое соединение, растворяясь в воде, образует сульфидную кислоту, а второе, реагируя с водой, — сульфитную.
Растительный и животный мир богат на кислоты, которые принадлежат к органическим соединениям. Лимонная, яблочная, щавелевая кислоты содержатся в некоторых фруктах, ягодах, овощах (рис.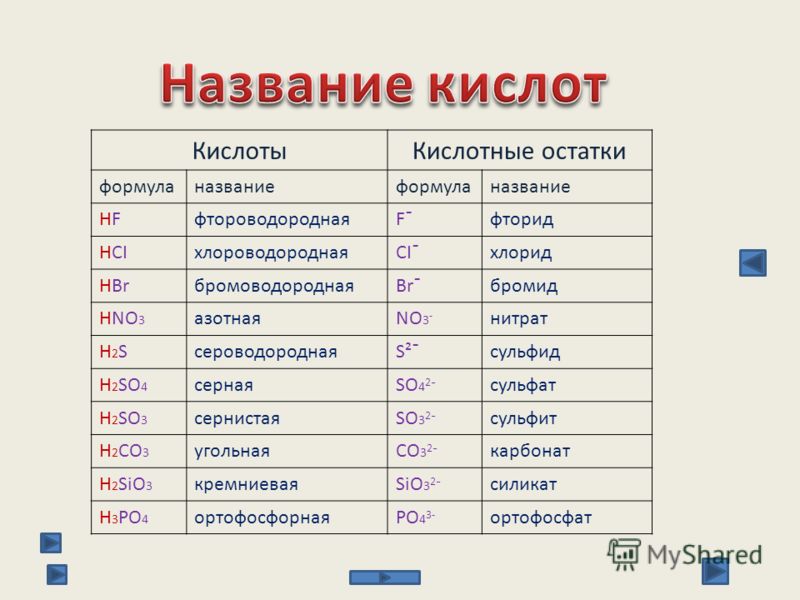 11), муравьиная кислота — в муравьях (поэтому их укусы ощутимы), пчелином яде, крапиве. При скисании молока, вина, фруктовых и ягодных соков образуются соответственно молочная и уксусная кислоты. Молочная кислота содержится также в квашеной капусте, силосе для скота; она накапливается в мышцах во время их работы. В желудочном соке есть неорганическая кислота — хлоридная.
11), муравьиная кислота — в муравьях (поэтому их укусы ощутимы), пчелином яде, крапиве. При скисании молока, вина, фруктовых и ягодных соков образуются соответственно молочная и уксусная кислоты. Молочная кислота содержится также в квашеной капусте, силосе для скота; она накапливается в мышцах во время их работы. В желудочном соке есть неорганическая кислота — хлоридная.
Выводы:
Кислота — соединение,молекула которого содержит один или несколько атомов Гидрогена, способных в результате реакций замещаться на атомы металлического элемента. Для кислот существуют две общие формулы — и
Часть молекулы кислоты, соединенную с атомом (атомами) Гидрогена, называют кислотным остатком.
Все кислоты имеют молекулярное строение.
Существуют безоксигеновые и оксигенсодержащие кислоты. По количеству атомов Гидрогена в молекуле различают одноосновные, двухосновные, трехосновные кислоты, а по химической активности — сильные и слабые.
Каждой оксигенсодержащей кислоте соответствует оксид, который называют кислотным. В оксиде и кислоте значение валентности кислотообразующего элемента одно и то же.
В оксиде и кислоте значение валентности кислотообразующего элемента одно и то же.
Кислоты имеют химические и тривиальные названия.
Кислоты распространены в природе.
Свойства и применение кислотФизические свойства кислот: Молекулярное строение кислот обусловливает их физические свойства. Молекулы в кислоте притягиваются друг к другу слабо (в отличие от противоположно заряженных ионов в основном оксиде или основании). Поэтому кислоты имеют низкие температуры плавления, почти все в обычных условиях являются жидкостями. Они растворяются в воде (кроме кислоты ), во многих случаях — неограниченно, т. е. смешиваются с водой в любых соотношениях с образованием растворов. При растворении некоторых кислот выделяется значительное количество теплоты (рис. 24).
Вам известно, что безоксигеновые кислоты представляют собой водные растворы газов — соединений некоторых неметаллических элементов с Гидрогеном (например, ). Эти газы выделяются из своих растворов даже в обычных условиях.
Летучей кислотой, т. е. такой, которая переходит в газообразное состояние при умеренном нагревании, является нитратная кислота а также несколько других. Летучие кислоты имеют запах.
Ортофосфатная кислота ортоборатная (борная) метасиликатная 3 — твердые вещества. Они, а также сульфатная кислота нелетучи.
Карбонатная и сульфитная кислоты существуют лишь в водном растворе. Соответствующие им оксиды взаимодействуют с водой не полностью, а кислоты, которые образуются, частично разлагаются на оксиды и воду:
Большинство кислот токсичны. Они вызывают серьезные отравления, ожоги кожи. Поэтому работать с кислотами надо очень осторожно, соблюдая правила техники безопасности. При попадании раствора кислоты на руку следует сначала смыть его проточной водой, затем обработать кожу разбавленным раствором соды (для удаления остатков кислоты) и хорошо промыть руку водой.
Химические свойства кислот: Способность кислот реагировать с другими веществами в значительной мере зависит от их устойчивости, летучести, растворимости в воде. Это необходимо учитывать, рассматривая химические свойства кислот.
Это необходимо учитывать, рассматривая химические свойства кислот.
Действие па индикаторы: Кислоты в водных растворах изменяют окраску индикаторов (рис. 25), но не всех и не так, как щелочи.
Большинство известных вам кислот реагируют с металлами с выделением водорода и образованием солей (рис. 26). Среди них — все безоксигеновые кислоты, сульфатная (в разбавленном растворе):
В этих реакциях атомы металлического элемента, которые содержатся в простом веществе, замещают атомы другого элемента (Гидрогена) в сложном веществе.
Реакцию между простым и сложным веществами, в результате которой образуются новые простое и сложное вещества, называют реакцией замещения.
С названными кислотами взаимодействуют не все металлы. Возможность осуществления реакции между металлом и кислотой можно определить, используя ряд активности металлов. Его составил отечественный химик Н. Н. Бекетов на основании результатов изучения многих реакций металлов с кислотами и солями. Приводим большую часть этого ряда в современном виде (см. также форзац 2):
Н. Бекетов на основании результатов изучения многих реакций металлов с кислотами и солями. Приводим большую часть этого ряда в современном виде (см. также форзац 2):
Формула неметалла водорода делит ряд на две части. Металлы, размещенные в левой части ряда, взаимодействуют с названными выше кислотами (при этом выделяется водород), а размещенные справа — не реагируют с ними (рис. 27):
Николай Николаевич Бекетов (1827—1911)
Выдающийся русский и украинский химик, академик Петербургской академии наук. Исследовал реакции солей с металлами и водородом в водных растворах. Предложил вытеснительный ряд, или ряд активности металлов (1865). Дал формулировку закона действующих масс, сходную с современной. Открыл и описал металлотермию — один из методов получения металлов. Проводил термохимические исследования. Содействовал становлению физической химии — одной из важнейших химических наук. Работал профессором в Харьковском университете (1855—1887), впервые читал курс лекций по физической химии как самостоятельной научной дисциплине.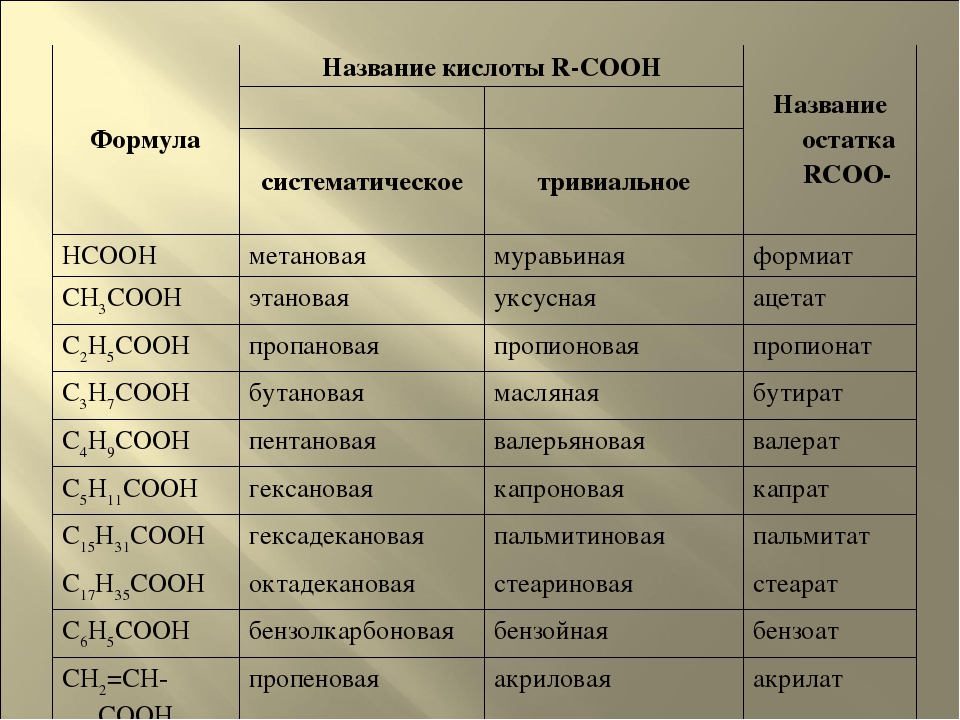 Был президентом Русского физико-химического общества.
Был президентом Русского физико-химического общества.
Во время реакций нитратной, а также концентрированного раствора сульфатной кислоты с металлами вместо водорода образуются другие вещества (рис. 28).
Реакции с основными оксидами и основаниямиХарактерным свойством всех кислот является способность взаимодействовать с соединениями противоположного типа — основными оксидами и основаниями. Продуктами каждой реакции являются соль и вода. Эти химические превращения были рассмотрены в предыдущих параграфах. Примеры соответствующих химических уравнений:
Реакции с солямиРеакции кислот с солями относят к реакциям обмена. Не все они возможны. Назовем случаи, когда эти реакции происходят (рис. 29).
• Продукт реакции — соль или кислота — выпадает в осадок (это выясняем по таблице растворимости):
• Кислота-продукт является летучей, происходит от газообразного соединения или разлагается с образованием газа:
(Сокращение «тв» означает «твердое вещество >>, а «конц» — «концентрированный раствор».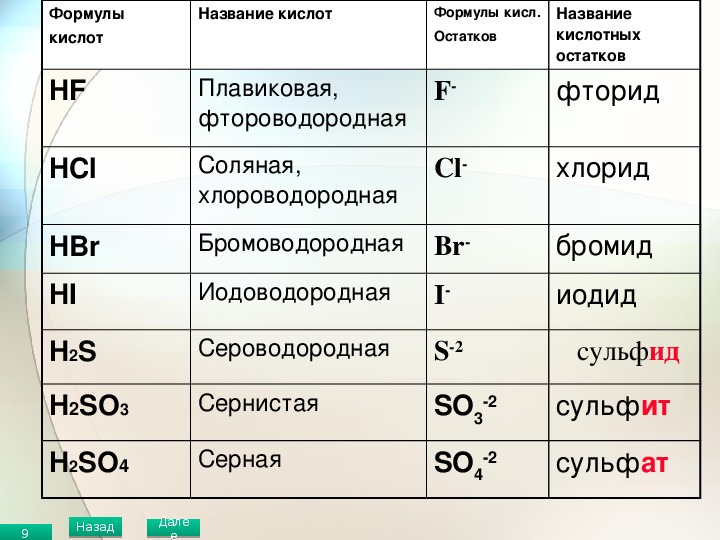 )
)
• Кислота, которая вступает в реакцию, является сильной, а кислота, которая образуется, — слабой. Примерами могут служить три последние реакции.
Оксигенсодержащие кислоты при нагревании, а карбонатная и сульфитная — в обычных условиях, разлагаются с образованием соответствующих кислотных оксидов и воды:
Одним из продуктов разложения сульфатной кислоты при умеренном нагревании является сульфур(VI) оксид, а при сильном нагревании этот оксид сам начинает разлагаться:
Реакция термического разложения нитратной кислоты имеет свою особенность. Это соединение разлагается на три вещества — нитроген(VI) оксид, кислород и воду (оксид соответствующий нитратной кислоте, весьма неустойчив):
Изложенный материал обобщен в схеме 3.
Схема 3. Химические свойства кислот
Применение кислот:
Наибольшее применение получили сульфатная, хлоридная, нитратная и ортофосфатная кислоты (табл. 4). Их получают на химических заводах в большом количестве.
4). Их получают на химических заводах в большом количестве.
Наверное, в каждой семье в домашнем хозяйстве есть уксус. Это — разбавленный водный раствор уксусной кислоты
(Подготовьте рассказ о том, для чего используют уксус.) В быту, повседневной жизни применяются и другие кислоты. Лимонная кислота является пищевым продуктом и консервантом, аскорбиновая — витамином С. (Уксусная, лимонная и аскорбиновая кислоты — органические соединения.) Раствор борной кислоты применяют как дезинфицирующее средство, а раствор сульфатной кислоты заливают в аккумуляторы автомобилей.
Выводы:
Кислоты — молекулярные вещества, растворимые в воде. Они изменяют окраску индикаторов, но не так, как щелочи.
Кислоты взаимодействуют с большинством металлов с выделением водорода и образованием солей. Такие реакции называют реакциями замещения. Возможность их осуществления определяют с помощью ряда активности металлов.
Кислоты реагируют с основными оксидами и основаниями с образованием солей и воды, а также с солями (продукты реакции — другие кислота и соль). Оксигенсодержащие кислоты разлагаются при нагревании.
Оксигенсодержащие кислоты разлагаются при нагревании.
Кислоты находят широкое применение в различных сферах.
Способы получения кислотПрежде чем выбрать способ получения кислоты, нужно выяснить, безоксигеновой или оксигенсодержащей она является, а также — сильной или слабой, летучей или нелетучей, растворимой или нерастворимой в воде.
Реакция между водородом и неметалломЭто способ получения безоксигеновых кислот:
Продукты таких реакций — хлороводород, сероводород, другие газообразные соединения неметаллических элементов VI или VII группы с Гидрогеном — растворяют в воде и получают кислоты.
На взаимодействии хлора с водородом основано промышленное производство хлоридной кислоты.
Реакция между кислотным оксидом и водойТакую реакцию используют для получения оксигенсодержащих кислот:
Первая реакция происходит на завершающей стадии производства сульфатной кислоты.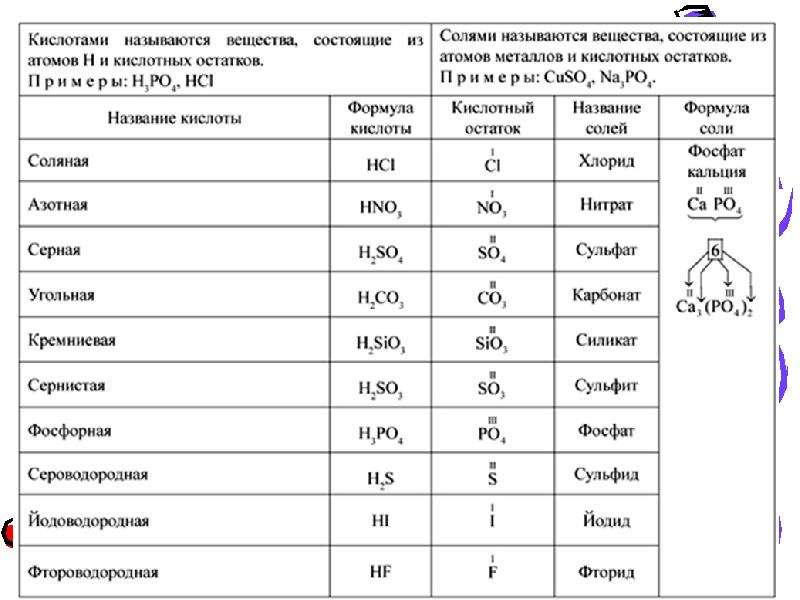 Осуществлять аналогичную реакцию между оксидом и водой для промышленного получения нитратной кислоты нецелесообразно, так как этот оксид неустойчив. Исходным веществом служит нитроген(IV) оксид:
Осуществлять аналогичную реакцию между оксидом и водой для промышленного получения нитратной кислоты нецелесообразно, так как этот оксид неустойчив. Исходным веществом служит нитроген(IV) оксид:
На этой реакции основан общий способ получения кислот — и безоксигеновых, и оксигенсодержащих. Продуктами являются другие соль и кислота.
Такую реакцию обмена можно осуществить с использованием растворов соли и кислоты, если удовлетворяется одно из двух условий:
• продукт реакции — новая соль или новая кислота — нерастворим в воде (это определяем по таблице растворимости):
• кислота, которую нужно получить, является слабой, а кислота, которая вступает в реакцию, — сильной (соответствующая информация помещена в §7):
Для получения сильной и летучей кислоты (в том числе и безоксигеновой) реакцию проводят не в растворе, а между твердой солью и нелетучей кислотой. Взаимодействию веществ способствует нагревание:
Пример №
Можно ли получить хлоридную кислоту с помощью реакции между калий хлоридом и сульфатной кислотой? Если да, то в каких условиях?
Решение
Продуктами реакции должны быть новые соль и кислота:
По таблице растворимости определяем, что все соединения растворимы в воде. Сульфатная и хлоридная кислоты — сильные, но отличаются по физическим свойствам: первая — нелетучая, а вторая — летучая (это водный раствор газа хлороводорода).
Сульфатная и хлоридная кислоты — сильные, но отличаются по физическим свойствам: первая — нелетучая, а вторая — летучая (это водный раствор газа хлороводорода).
Реакцию можно осуществить только в отсутствие воды. Тогда хлороводород будет выделяться из реакционной смеси.
Итак, для получения хлороводорода и хлоридной кислоты нужно взять твердый калий хлорид и чистую сульфатную кислоту или ее концентрированный раствор. Чтобы ускорить взаимодействие твердого и жидкого веществ, необходимо нагревание (в растворе реакции обмена происходят мгновенно).
Запишем соответствующее химическое уравнение, указав условия осуществления реакции (рис. 41):
Изложенное обобщено в схеме 8.
Выводы:
Безоксигеновые кислоты получают с помощью реакций водорода с неметаллами с последующим растворением продуктов в воде.
Оксигенсодержащие кислоты получают взаимодействием кислотных оксидов с водой. Общий метод получения кислот основан на реакции обмена между солью и кислотой.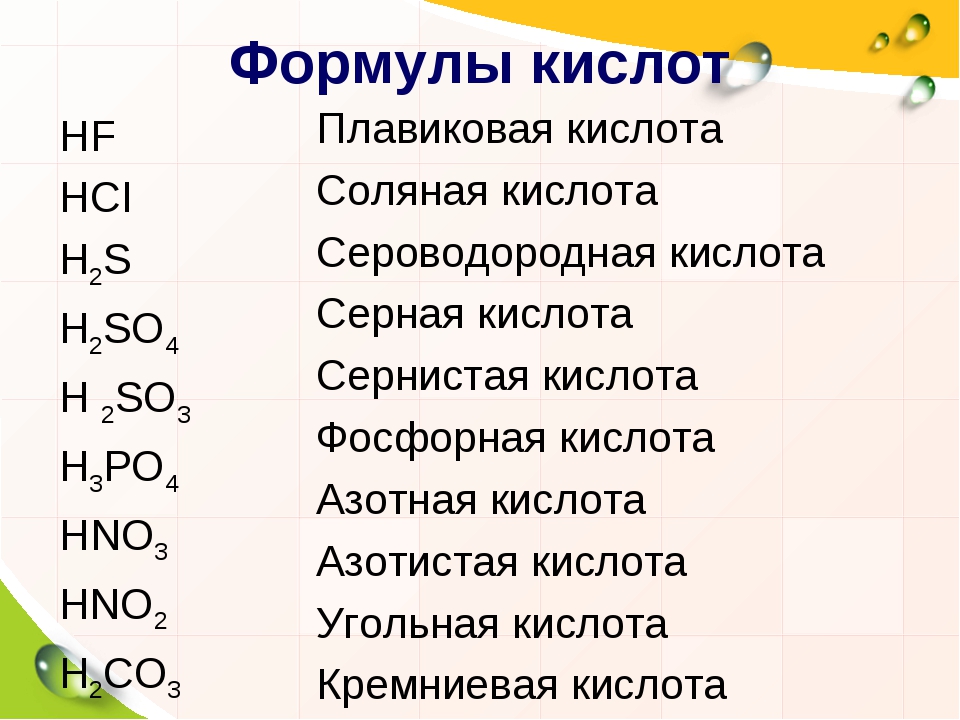
Классификация кислот
Ваших знаний о кислотах вполне достаточно, чтобы рассмотреть классификацию соединений этого класса. Прежде всего существуют кислоты, кислотные остатки которых содержат кислород, а есть кислотные остатки без атомов кислорода. Это дало возможность разделить кислоты на кислородсодержащие (например: и бескислородные (например:
Кроме того, в составе молекул разных кислот может быть неодинаковое число атомов водорода, которые в реакциях с основаниями замещаются металлическим элементом. Это дало возможность классифицировать кислоты на одноосновные и многоосновные. (Подумайте и приведите примеры одноосновных и многоосновных кислот.)
Химические свойства кислотКислоты проявляют достаточно высокую химическую активность с металлами, оксидами металлов, гидроксидами, а во многих случаях и солями. При этом кислотный остаток выступает единым целым и в неизменном виде переходит из состава кислоты в состав образовавшейся соли.
Обобщим известные вам свойства кислот и дополним их новыми.
Действие растворов кислот на индикаторыКак индикаторы кислой среды используются: лакмус (водный раствор), метиловый оранжевый (водный раствор), лакмусовые и универсальные бумажные индикаторы. Последние изготавливают способом пропитки специальной бумаги не одним, а несколькими чувствительными к кислой и щелочной средам веществами. Поэтому ими можно сразу обнаружить обе среды.
Ранее вы узнали о таком индикаторе, как фенолфталеин. Обратите внимание — это вещество не является индикатором кислой среды. Как известно, лакмус и метиловый оранжевый (метилоранж) в кислой среде имеют розово-красный цвет, универсальный индикатор — от оранжевого до темно-красного (зависит от содержания кислоты в растворе — если кислота очень разбавлена, то цвет оранжевый, если в растворе содержимое кислоты значительное, то — темно-красный или близкий к нему).
Заметим, что на индикаторы действуют, изменяя их цвет, лишь водные растворы кислот.
Взаимодействие кислот с металламиВы уже знакомы с опытами, которые подтверждают, что металлы, размешенные в вытеснительном ряду до водорода, замещают водород в молекулах кислот, в результате чего образуется соль и выделяется газообразное вещество водород. Тогда как металлы, размещенные в вытеснительном ряду после водорода, не замещают водород в молекулах кислот (вспомните, что азотная кислота является исключением):
В 7 классе вы узнали о реакциях замещения. Взаимодействие металлов с кислотами относится к этому типу реакций, ведь атомы металла, то есть простого вещества, замещают атомы водорода в молекуле кислоты, которая относится к сложным веществам.
Реакции замещения — это реакции, при которых атомы простого вещества замещают атомы одного из элементов сложного вещества.
Схематически это можно записать так:
Взаимодействие кислот с оксидами металловКислоты взаимодействуют с оксидами металлов (как с основными, так и с амфотерными), независимо от места расположения металла в вытеснительном ряду. В результате взаимодействия образуются соль и вода:
В результате взаимодействия образуются соль и вода:
К какому типу реакций относится это взаимодействие?
Из уравнений реакций видно, что простых веществ нет, есть лишь сложные, которые при реакции обменялись своими составными частями. Следовательно, взаимодействие кислот с оксидами металлов относится к реакциям обмена.
Взаимодействие кислот с основаниямиИсследуем это взаимодействие, поскольку его вы еще не изучали.
Опыт 1. Нальем в химический стакан раствор гидроксида натрия и измерим его температуру. Прибавим к нему соляной кислоты (вполне понятно, что до реакции ее температура равна температуре раствора щелочи и температуре воздуха в комнате).
Видимых внешне изменений не наблюдается. Но измерив температуру раствора в химическом стакане, видим, что она возросла. То есть выделилось тепло, а это является одним из признаков химической реакции.
Запишем уравнение наблюдаемого химического явления:
Опыт 2. Нальем в химический стакан раствор гидроксида калия и капнем несколько капель фенолфталеина (рис. 9, а). Раствор сразу стал малиновым. В закрепленной в штативе бюретке (рис. 9, б), наполненной раствором серной кислоты, откроем кран настолько, чтобы кислота не лилась струей, а падала отдельными каплями в стакан со щелочью, и понаблюдаем за тем, что будет происходить в стакане с гидроксидом калия. Вскоре отметим, что первоначальная ярко-малиновая окраска раствора в стакане становится менее яркой, а затем и вовсе исчезает.
Нальем в химический стакан раствор гидроксида калия и капнем несколько капель фенолфталеина (рис. 9, а). Раствор сразу стал малиновым. В закрепленной в штативе бюретке (рис. 9, б), наполненной раствором серной кислоты, откроем кран настолько, чтобы кислота не лилась струей, а падала отдельными каплями в стакан со щелочью, и понаблюдаем за тем, что будет происходить в стакане с гидроксидом калия. Вскоре отметим, что первоначальная ярко-малиновая окраска раствора в стакане становится менее яркой, а затем и вовсе исчезает.
Это доказывает, что щелочи в стакане не осталось. Запишем уравнение реакции и выясним, какие вещества образовались из гидроксида калия и серной кислоты:
Как и в первом опыте, щелочь и кислота обменялись составными частями, о чем свидетельствуют продукты реакции — сложные вещества соль и вода. Следовательно, реакции между основаниями и кислотами относятся к реакциям обмена.
До сих пор для проведения опытов мы использовали растворимые в воде основания — щелочи. Реагируют ли кислоты с нерастворимыми основаниями? Выясним это опытным путем.
Опыт 3. В две пробирки поместим немного гидроксида меди — твердого вещества голубого цвета. К одной дольем 2—3 мл воды, а ко второй — столько же серной кислоты. Содержимое обеих пробирок подогреем. В пробирке с основанием и водой изменения не происходят, а в пробирке с основанием и кислотой раствор стал синего цвета. Появление окраски — признак химического явления:
Опытным путем мы установили, что кислоты вступают в реакцию обмена как с растворимыми основаниями (щелочами), так и с нерастворимыми.
Реакция между кислотой и основанием с образованием соли и волы называется реакцией нейтрализации.
«Нейтральный» значит — тот, который не принадлежит ни одному ни другому. Относительно реакции кислот с основаниями это означает, что после реакции не остается ни кислой, ни щелочной среды, а она становится нейтральной.
Взаимодействие кислот с солямиКислоты взаимодействуют с солями, если среди продуктов реакции есть осадок или газ.
Опыт 4. В химический стакан нальем серной кислоты и прибавим раствор нитрата бария. Сразу же наблюдаем образование белого осадка. Запишем уравнение реакции и выясним, какой из продуктов реакции образовал осадок:
Соляная кислота не может быть осадком, а следовательно, в осадке находится сульфат бария. Проверим наше предположение по таблице растворимости солей, кислот и оснований в воде. Действительно, сульфат бария — это нерастворимая соль.
Опыт 5. В химический стакан положим кусочек мела и дольем азотной кислоты. Сразу же начинается реакция, которая сопровождается выделением газообразного вещества. (Какое это вещество?) Поскольку карбонат кальция — соль угольной кислоты, а ей отвечает оксид углерода можем предположить, что выделяется именно этот оксид. Соляная кислота содержит атомы водорода, из них может образоваться водород. Поэтому проведем качественное определение газа, который выделяется. Поднесенная к отверстию химического стакана спичка сразу же гаснет, и этот процесс не сопровождается приглушенным хлопком.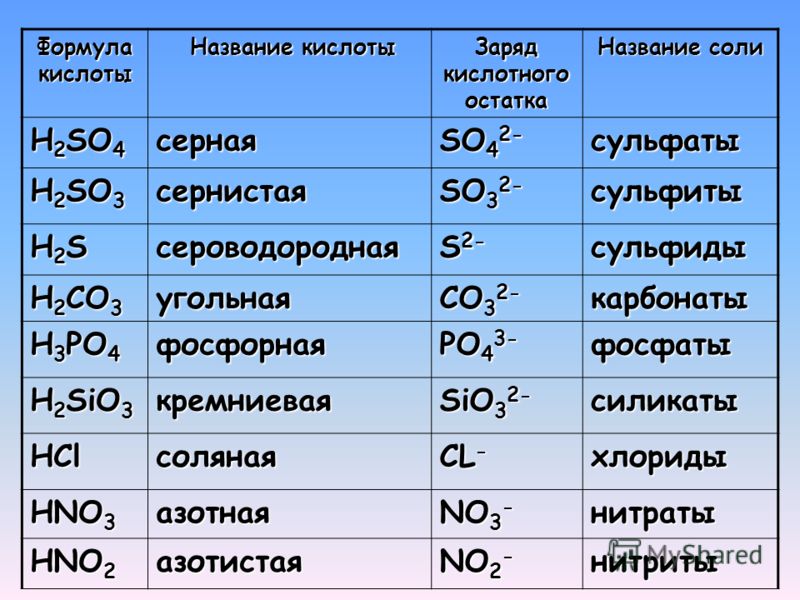 Следовательно, выделяется углекислый газ. Запишем уравнение реакции:
Следовательно, выделяется углекислый газ. Запишем уравнение реакции:
Рассмотрите уравнения реакций, которые происходили в опытах 4 и 5, и сделайте вывод, к какому типу реакций они относятся.
Итоги:
- Классификация кислот.
- Общие свойства кислот:
- В реакциях обмена кислотный остаток кислот переходит из состава кислоты в состав соли как единое целое.
В отличие от растворов других кислот, азотная кислота взаимодействует почти со всеми металлами, за исключением золота, платины. При этом образуется не два, а три продукта реакции. Для всех реакций общим является образование соли и воды. Что же касается третьего вещества, то в зависимости от активности металла и содержания кислоты в растворе это могут быть оксиды азота с разной его валентностью простое вещество азот или аммиак Например:
Характерно, что растворы со значительным содержимым азотной кислоты (свыше 60 %) не взаимодействуют с железом. Поэтому по железной дороге такую кислоту транспортируют в стальных цистернах.
Поэтому по железной дороге такую кислоту транспортируют в стальных цистернах.
Получение соляной кислоты и ее свойства
Изучая свойства оксидов, вы выяснили, что кислотные оксиды (за некоторым исключением, в частности оксид кремния вступают в реакцию соединения с водой и образуют кислоты:
Но все это — кислородсодержащие кислоты. А как получают бескислородные кислоты, например соляную? Способы ее получения в промышленности и в лаборатории разные. Рассмотрим их.
Вы, наверное, обратили внимание, что в тексте учебника ни разу не было написано «раствор соляной кислоты», потому что эта кислота является ничем иным, как раствором газообразного хлорида водорода (хлороводорода) в воде. Поэтому, чтобы получить соляную кислоту, нужны хлороводород и вода-раство-ритель.
В промышленности хлороводород получают в специально построенных печах синтеза (от гр. синтез — составление, соединение), где происходит реакция соединения водорода с хлором, сопровождающаяся выделением света и тепла (вспомните, какое общее название имеют реакции с такими признаками):
Полученный таким способом газ растворяют в воде (точнее — в соляной кислоте с низким содержанием хлороводорода). Благодаря высокой растворимости хлороводорода в воде удается получить соляную кислоту с содержанием этого газа до 40 % по массе.
Благодаря высокой растворимости хлороводорода в воде удается получить соляную кислоту с содержанием этого газа до 40 % по массе.
Существует лабораторный способ получения соляной кислоты. Получают ее в приборе, изображенном на рисунке 10, из твердой кристаллической соли хлорида натрия, действуя на нее раствором серной кислоты с высоким содержанием (60— 70 %) растворенного вещества. Такие растворы называют концентрированными. Растворы с низким содержанием растворенного вещества получили название разбавленных.
Реакцию проводят при нагревании:
Опыт 1. Заполним 1/4 объема пробирки хлоридом натрия и добавим серной кислоты столько, чтобы она смочила соль. Поскольку хлороводород — газообразное вещество, то благодаря нагреванию его молекулы активно двигаются, оставляют сосуд, где они образовались, и по газоотводной трубке попадают в пробирку, заполненную на 1/3 водой.
Обратите внимание, прибор собран так, что конец газоотводной трубки не касается воды.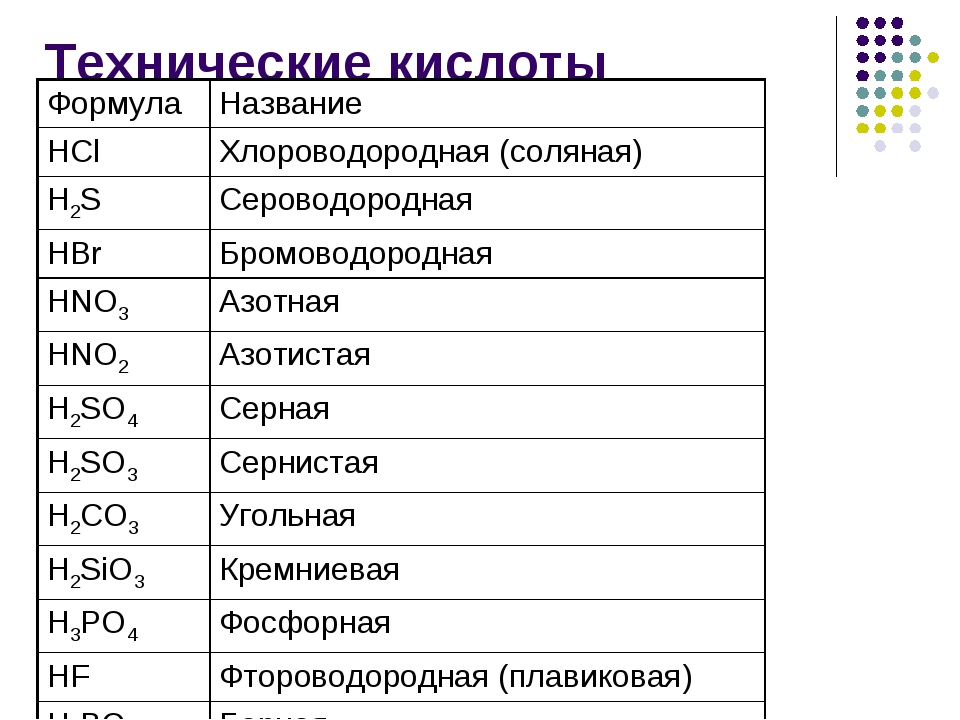 Поскольку тяжелее воздуха и воды, он направляется в сосуд с водой и растворяется в ней (видно, как образованная кислота струится вниз).
Поскольку тяжелее воздуха и воды, он направляется в сосуд с водой и растворяется в ней (видно, как образованная кислота струится вниз).
Хлороводород хорошо растворяется в воде, поэтому можно быстро получить соляную кислоту, необходимую для проведения последующих опытов.
Опыт 2. Отольем немного полученного раствора хлороводо-рода в чистую пробирку и испытаем его на наличие кислой среды с помощью индикатора, например метилового оранжевого. Раствор приобретает розовую окраску.
Воспользуемся полученной соляной кислотой для последующих опытов.
Опыт 3. К пробирке с кислотой и индикатором прибавим щелочь. Розовая окраска раствора изменяется на оранжевую. Следовательно, произошла нейтрализация кислоты щелочью:
Опыт 4. Поместим в пробирку немного карбоната натрия и прибавим к нему часть полученной соляной кислоты. Активное выделение газа свидетельствует о химическом явлении. Поднесенная к отверстию пробирки спичка гаснет. Следовательно, выделяется углекислый газ:
Опыт 5. К остальной кислоте прибавим раствор нитрата серебра Сразу же образуется белый творожистый осадок (подобный скипевшемуся молоку):
К остальной кислоте прибавим раствор нитрата серебра Сразу же образуется белый творожистый осадок (подобный скипевшемуся молоку):
Образованный осадок не растворяется в воде и не взаимодействует с другими кислотами. На основании проведенных наблюдений делаем вывод.
С помощью раствора нитрата серебра можно отличить соляную кислоту от других кислот.
Взаимодействие соляной кислоты с металлами исследуйте самостоятельно, выполнив в классе лабораторный опыт 2, описанный в рубрике «Страница естествоиспытателя».
По рисункам 11 и 12 узнайте о распространенности кислот в природе и их применении.
- — производство химических волокон, взрывчатых веществ, удобрений, моющих средств, красок, лекарственных препаратов, эфиров, сульфатов; в гальванических элементах и аккумуляторах.
- — травление, паяние металлов, получение хлоридов, добыча металлов из руд
- — производство удобрений, взрывчатых веществ, целлюлозы, получение разных солей
- — получение ортофосфатов; изготовление полировочных смесей, катализаторов, лекарственных средств, безалкогольных напитков
Итоги:
- Соляная кислота — одноосновная бескислородная кислота, которая проявляет все общие свойства кислот.
- В промышленности соляную кислоту получают из водорода и хлора, растворяя образовавшийся газообразный продукт реакции хлороводород в воде.
- В лаборатории соляную кислоту получают взаимодействием кристаллического хлорида натрия и концентрированной серной кислоты.
- Наличие соляной кислоты можно обнаружить не только с помощью индикаторов, но и добавлением раствора нитрата серебра. Образуется нерастворимый в воде и других кислотах творожистый осадок белого цвета — хлорид серебра
В XV ст. кислота состава поражала воображение алхимиков тем, что дымила на воздухе, обжигала язык, вызывала кашель, разъедала металлы и разрушала ткани. Называли ее в ту пору «кислым спиртом». В XVII ст. бытовало другое, достаточно необычное название — «дух из солей». Происхождение названия легко объясняется. Дело в том, что кислоту тогда получали способом, которым мы сегодня получили ее в лаборатории, — из хлорида натрия и концентрированной серной кислоты. Кстати, этот способ, как промышленный, продержался с конца XVII в. до 60-х годов XX века.
до 60-х годов XX века.
Бескислородные и кислородсодержащие кислоты получают соединением простых и сложных веществ.
1. При получении бескислородных кислот водород взаимодействует с неметаллом, а полученное газообразное вещество растворяется в воде:
2. Кислородсодержащие кислоты образуются в результате взаимодействия кислотного оксида и воды:
Классификация| Кислота | Название кислоты | Кислотный остаток | Валентность кислотного остатка |
| H3PO4 | ? | ? | ? |
| ? | ? | ? | |
| ? | Метакремниевая кислота | ? | ? |
Какие кислоты вы знаете? Приведите примеры кислотных остатков. Какие методы получения кислот вы знаете?
В VII классе при изучении темы водорода вы ознакомились с некоторыми представителями кислот (соляная и серная кислоты).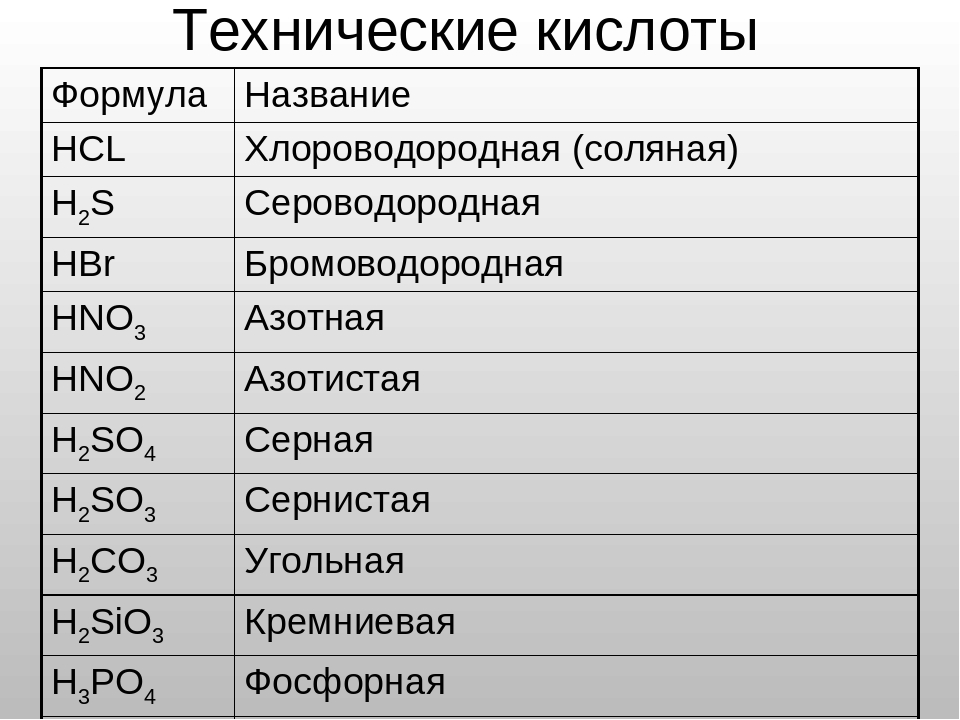 Теперь же вы более подробно ознакомитесь со всеми представителями кислот.
Теперь же вы более подробно ознакомитесь со всеми представителями кислот.
Классификация: Атомы или группы атомов, соединенные с водородом в молекулах кислот, называются кислотными остатками. Заряд кислотного остатка всегда отрицательный ( ) и по своему числовому значению он равен основности кислоты.
Кислоты классифицируются по составу, основности и по силе.
Активность кислот определяется степенью концентрации ионов водорода, образовавшихся в их водных растворах (моль/л).
Число атомов водорода, способных замещаться атомами металла в молекуле кислоты, показывает основность кислоты и соответствует валентности кислотного остатка.
Количество атомов водорода, соединенных с атомом кислорода в кислородсодержащих кислотах, и количество атомов водорода, соединенных с атомами неметаллов в бескислородных кислотах, соответствует основности кислоты.
НоменклатураНазвания кислот заимствованы из латинского названия образующих их неметаллов. В бескислородных кислотах к окончанию названий элементов, образующих кислоты, добавляется суффикс «ид». Если в кислородсодержащих кислотах элемент, образующий кислоту, обладает высокой валентностью, то к его окончанию добавляется суффикс «ат», а если средней валентностью то суффикс «ит».
В бескислородных кислотах к окончанию названий элементов, образующих кислоты, добавляется суффикс «ид». Если в кислородсодержащих кислотах элемент, образующий кислоту, обладает высокой валентностью, то к его окончанию добавляется суффикс «ат», а если средней валентностью то суффикс «ит».
| сульфид (сероводородная кислота) |
сульфит (сернистая кислота) |
сульфат (серная кислота) |
Если кислотообразующий элемент образует несколько кислот с одинаковой валентностью (степенью окисления), то к началу названия кислоты, у которой к одному атому данного элемента присоединено наибольшее количество атомов кислорода, добавляется приставка «орто», а при наименьшем количестве атомов кислорода приставка «мета». К названию же кислородсодержащих кислот, полученных путем нагревания этих кислот, добавляется приставка «пиро».
| метафосфорная кислота |
пирофосфорная кислота |
ортофосфорная кислота |
| IP 3O | IP 3,5O | IP 4O |
При образовании элементами более двух кислородсодержащих кислот пользуются названиями с добавлением суффиксов -н-, -ат-, -новат-, -ист-, -новагист-.
хлорноватистая кислота |
хлористая кислота |
хлорноватая кислота |
хлорная кислота |
Последовательность расположения элементов в молекулах кислот можно проследить по их графическим формулам.
угольная кислота |
серная кислота |
ортофосфорная кислота |
хлорная кислота |
Линии между атомами в этих формулах выражают валентность элементов.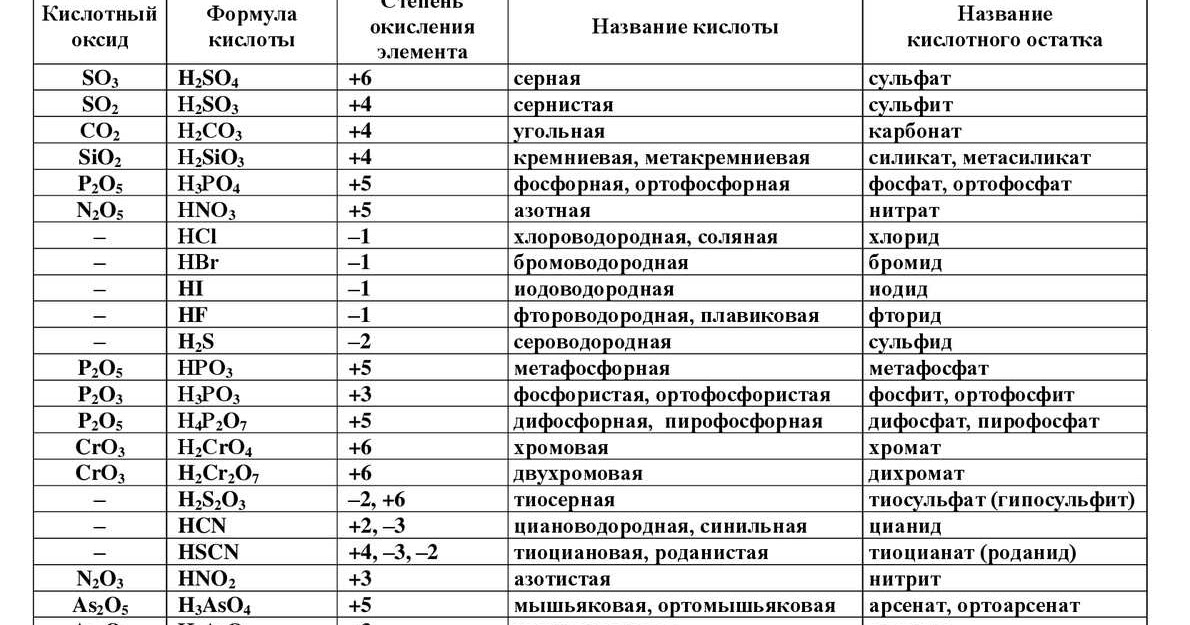
При непосредственном взаимодействии неметаллов с водородом
| H2 + F2 → 2HF | H2 +Cl2 2НС1 |
| H2 +Br2 2HBr | H2 + I2 — 2HI |
Кислотные оксиды, непосредственно взаимодействуя с водой, образуют соответствующую кислоту. SiO2 не вступает в реакцию с водой.
SO3 +H2O→ H2SO4 CO2 + H2O → H2CO3
При вступлении в реакцию с водой NO2 и P2Os, в зависимости от условий, образуются различные продукты.
При взаимодействии солей с кислотами
Наиболее часто применяемый способ получения кислот взаимодействие солей с кислотами.
органические кислоты, H2CO3, H2S, H2SiO3
В этом ряду каждая кислота вытесняет из солей следующую за ней кислоту. Поскольку HCl, HNO3, Н3РО4 одинаково сильные кислоты, они не вытесняют друг друга.
Поскольку HCl, HNO3, Н3РО4 одинаково сильные кислоты, они не вытесняют друг друга.
При получении кислот подобным способом исходные вещества соль должна быть в твёрдом состоянии, а кислота более концентрированной и малолетучей. Серная кислота более сильная и малолетучая. Вот почему обычно при получении других кислот используют именно эту кислоту
2NaCl(тв.) + H2SO4(конц.) Na2SO4 + 2HC1↑
Ca3(PO4)2(тв.) + 3H2SO4(конц.) 3CaSO4↓ + 2H3PO4
Физические и химические свойства кислотОпределите типы химических реакций.
На основе какого правила был составлен ряд активности металлов? В получении какого простого вещества применяется реакция металлов с разбавленными кислотами (кромеразбавленного HNO3)?
Физические свойства:
По своему агрегатному состоянию кислоты классифицируются следующим образом. Кислоты хорошо растворяются в воде (кроме мегакремниевой кислоты).
Кислоты хорошо растворяются в воде (кроме мегакремниевой кислоты).
Водные растворы газообразных хлорида водорода (хлороводорода), бромида водорода (бромоводорода) и йодида водорода (йодоводорода) образуют соответствующие кислоты. Водные растворы кислот имеют кислый вкус. Кислоты, как и щелочи, меняют цвет индикаторов.
| Кислый вкус ряда употребляемых нами плодов (яблок, алычи, лимона и др.) и ягод объясняется наличием в их составе органических кислот. Зачастую эти кислоты носят названия тех плодов, в составе которых они содержатся. Например, яблочная кислота, лимонная кислота и др. |
При хранении в открытом сосуде неустойчивых кислот (HNO3, H2CO3, H2SO3 и др.), а также кислот, полученных при растворении газов, их масса уменьшается или в результате разложения, или же за счет выделения газа из раствора. При хранении в отрытом сосуде растворов гигроскопических (водопоглощающих) кислот (например, H2SO4 (конц. ) ,) их масса увеличивается.
) ,) их масса увеличивается.
|
Возьмите четыре пробирки. Поместите в каждую из пробирок по отдельному куску металлов Mg, Zn, Fe u Си и добавьте к ним немного 20% него раствора соляной кислоты. Что вы наблюдаете? Запишите уравнения реакций. |
В результате изучения взаимодействия кислот с металлами был составлен ряд активности металлов.
Li, К, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au
Химическая активность уменьшается
C уменьшением активности металлов уменьшается и скорость протекания их реакций с одной и той же кислотой. Металлы, расположенные в ряду активности до водорода, при вступлении в реакцию с разбавленными кислотами (кроме разбавленной HNО3) вытесняют из них водород. А металлы, расположенные в ряду активности после водорода, не вступают в реакцию с разбавленными кислотами (кроме разбавленной HNO3).
Cu + H2SO4(разб.) реакция не протекает Fe + H2SO4(разб.) → FeSO4 + H2 ↑
Взаимодействие кислот с неметаллами
C+4HNO3(конц.) CO2 +4NO2 + 2H2O
ЗР + SHNO3(конц.) + 2H2O ЗН3PO4 + 5NO
Взаимодействие кислот с аммиаком. Кислоты вступают с аммиаком в реакцию соединения. При вступлении в реакцию одноосновных кислот с аммиаком, независимо от соотношения молей, всегда получается нормальная соль.
NH3+ HNO3→ NH4NO3
В результате реакции соединения многоосновных кислот с аммиаком, в зависимости от соотношения молей, образуются разные соли.
2NH3 +H2SO4 → (NH4)2SO4
Разложение кислот. Некоторые кислоты разлагаются с выделением воды.
H2SiO3SiO2+ H2O
Яблочная кислота, структурная формула, химические свойства
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.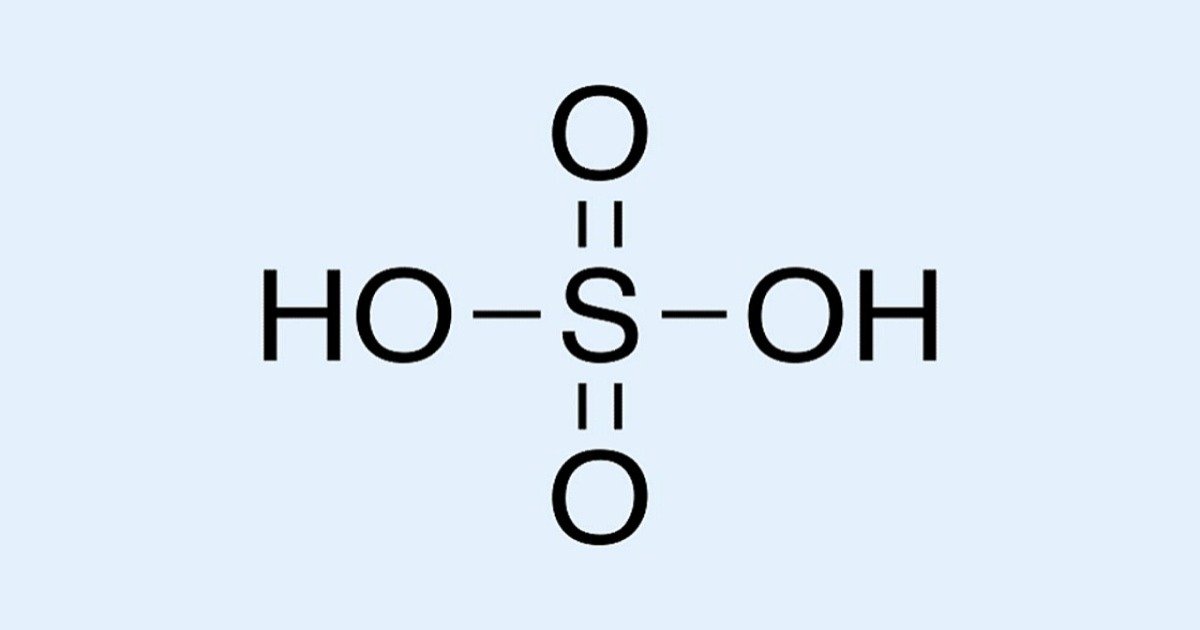
Чтобы получить подробное описание элемента, кликните по его названию.
Кислотные Названия Формулы
Кислотные Названия Формулы Полный список неорганических кислот| Кислотное имя | ||||
|---|---|---|---|---|
| формула | ||||
| уксусная кислота | CH4COOH | |||
| Антимоносная кислота | HSBO3 | Антимонная кислота | HSBO3 | 0 H4SBO3|
| Арсеновая кислота | H4ASO4 | |||
| Борная кислота | H4BO3 | |||
| Бромическая кислота | HBRO3 | |||
| Бромальная кислота | HBRO2 | HBRO2 | ||
| H3CO3 | ||||
| H3CO2 | ||||
| хлорная кислота | HCLO3 | |||
| хлорная кислота | HCLO2 | |||
| Хромовая кислота | H3CRO4 | |||
| Хидромасляная кислота | H30010 | |||
| Лимонная кислота | C6H8O7 | |||
| Cycano | HCNO | |||
| дихромическая кислота | H3CR2O7 | |||
| Носульпасовая кислота | H3S2O5 | |||
| Дитионная кислота | H3S2O4 | |||
| Diouranic Coide | H3U2O7 | |||
| феррициановая кислота | H4 [F3 (CN) 6] | |||
| фториновая кислота | HFO3 | |||
| Тормовая кислота | HFO2 | |||
| HCOOH | Гидроресурсная кислота | H4AS | H4AS | |
| HBR | HBR | |||
| Гидрохлорическая кислота | HCL | |||
| Гидроцианальная кислота | HCN | HCN | ||
| Гидрофторическая кислота | HF | Гидродиадическая кислота | HI | |
| Гидроноизовая кислота | HN3 | |||
| Гидрофосфорная кислота | H4P | |||
| Гидроселеновая кислота | h3Se 900 11 | |||
| сероводородной кислота | h3S | |||
| бромноватистая кислота | HBrO | |||
| Hypocarbonous кислота | h3CO | |||
| хлорноватистой кислоты | HClO | |||
| Hypochromous кислота | h3CrO2 | |||
| Hypofluorous кислота | ТДТ | |||
| иодноватистая кислота | СМО | |||
| азотноватистая кислота | HNO | |||
| Hypooxalous кислота | h3C2O2 | |||
| фосфорноватая кислота | h5P2O6 | |||
| Hypophosphous кислота | h4PO2 | |||
| Гипосулирующая кислота | H3SO2 | |||
| HIO3 | IODOUS CIDES | HIO2 | ||
| Марганическая кислота | H3MNO4 | |||
| Метастантическая кислота | H3SNO3 9001 1 | |||
| молибденовой кислоты | h3MoO4 | |||
| Азотная кислота | HNO3 | |||
| азотистой кислоты | HNO2 | |||
| Щавелевая кислота | h3C2O4 | |||
| перугольных кислота | h3CO4 | |||
| хлорной Кислота | HCLO4 | |||
| H3CRO5 | ||||
| перфторористая кислота | HFO4 | HFO4 | ||
| Периодическая кислота | HIO4 | |||
| Пермангановая кислота | HMNO4 | |||
| Pernitric Aide | HNO4 | |||
| пероксодисерная кислота | ||||
| Perphosphoric кислота | ||||
| надсерной кислота | ||||
| технециевая кислота | ||||
| Perxenic кислота | Фосфорная кислота | h4PO4 | ||
| Фосфорная кислота | h4PO3 | |||
| Pyroantimonic кислота | h5Sb2O7 | |||
| Пирофосфорная кислота | h5P2O7 | |||
| Pyrosulfuric кислота | h3S2O7 | |||
| селеновая кислота | h3SeO4 | |||
| селенистая кислота | h3SeO3 | |||
| Кремниевая кислота | h3SiO3 | |||
| Silicofluoric кислота | h3SiF6 | |||
| Silicous кислота | h3SiO2 | |||
| Серная кислота | h3SO4 | |||
| серующая кислота | H3SO3 | |||
| Телеруновая кислота | H6TEO6 | H6TEO6 | ||
| TILLUROUS CILLUROUS | H3TEO3 | |||
| тетрабровавая кислота | H3B4O7 | |||
| Тетратионная кислота | H3S4O6 | |||
| тиоциановая кислота | HSCN | |||
| Thiosulfurous кислота | h3S2O2 | |||
| титановой кислота | h3TiO3 | |||
| вольфрамовая кислота | h3WO4 | |||
| урановая кислота | h3UO4 | |||
| ксеноновой кислота | h3XeO4 |
| кислоты Имя | Формула | ||
|---|---|---|---|
| Уксусная кислота | Ch4COOH | ||
| Ацетилсалициловая кислота | HC9H7O4 | ||
| Аскорбиновая кислота | HC6H7O6 | ||
| азелаиновая кислота | h3C9h24O4 | ||
| барбитуровой кислоты | HC4h4N2O3 | ||
| Бензиловую кислота | HC14h21O3 | ||
| коричная кислота | C9H8O2 | ||
| Лимонная кислота | h3C6H6O7 | ||
| Фолиевая кислота | C19h29N7O6 | ||
| фумаровая кислота | C4h5O4 | ||
| галл Кислоты | HC7H5O5 | ||
| Глюконовая кислота | C6H22O7 | C6H22O7 | |
| HC5H8NO4 | HC5H8NO4 | ||
| Глютарическая кислота | C5H8O4 | ||
| Гиксановая кислота | C5H21COOH | 9000 8||
| Молочная кислота | HC3H5O3 | ||
| MALICALIC | H3C4H5O5 | 0||
| CH3 (COOH) 2 | CH3 (COOH) 2 | ||
| Олеиновая кислота | HC18H43O2 | ||
| Фталевая кислота | H3C8H5O4 | ||
| пропиоловой кислота | HC2COOH | ||
| пропионовая кислота | Ch4Ch3COOH | ||
| Rosolic кислота | C19h24O3 | ||
| стеариновая кислота | C17h45COOH | ||
| дубильной кислоты | C76H53O46 | ||
| Tartartic кислота | h3C4h5O6 | ||
| Трифторуксусная кислота | C2HF3O2 | ||
| Мочевая кислота | h3C5h3N4O3 |
Кислоты и основания Бренстед-Лоури Определение (1923) — Определение
кислот и оснований с участием ионов водорода и гидроксида соответственно
слишком ограничивает.
Определение вещества как кислоты Бренстеда-Лоури
или основание можно сделать, только наблюдая за реакцией. Ссылка на перезвон анимация переноса ионов аммония в воду — Джереми Харви, Бристольский университет, Англия См. пример на рисунке слева: Чтобы определить, является ли вещество кислотой или основанием, посчитайте атомы водорода каждого вещества до и после реакции.Если число атомов водорода уменьшилось, это вещество является кислота (отдает ионы водорода). Если число атомов водорода увеличивается, что вещество является основанием (принимает ионы водорода). Эти определения обычно применяются к реагентам на левый. Если рассматривать реакцию в обратном порядке, новые кислота и основание могут
быть идентифицированы. Вещества в правой части уравнения
называются сопряженными кислотой и сопряженным основанием по сравнению с
слева. Также обратите внимание, что исходная кислота превращается в сопряженное основание после окончания реакции. Формула соляной кислоты – химическая формула, свойства, применение и часто задаваемые вопросыМногие люди использовали соляную кислоту в своих домах. В основном используется в качестве чистящего средства для плитки, туалетных принадлежностей и мрамора, это общее название соляной кислоты. Соляная кислота или газообразный хлористый водород представляют собой ионное соединение, образованное переносом электронов между ионами водорода и хлорида.В этой связи отрицательно заряженный ион хлорида принимает свободный электрон от положительно заряженного иона водорода, образуя ионную связь между ними. Однако газообразный хлороводород является полярным ковалентным соединением. Какова химическая формула соляной кислоты? Молекулярная формула соляной кислоты: HCl. Он содержит атом водорода, связанный с атомом хлора. Структурная формула соляной кислотыСоляная кислота представляет собой простое соединение, состоящее из двух атомов. Валентный угол равен 180 градусов.Это sp 3 , гибридизированный. [Изображение будет загружено в ближайшее время] Рис. Структура соляной кислоты. Каковы свойства соляной кислоты? Максимальная концентрация соляной кислоты составляет 38%. Кислота промышленного качества может иметь максимальную концентрацию 35%. Соляная кислота является сильной кислотой, поскольку она легко выделяет ионы водорода в водных растворах. Формула разбавленной соляной кислоты: H+-Cl-. Это широко используемый лабораторный и коммерческий реагент, поскольку он реагирует с несколькими металлами и соединениями. Каково применение соляной кислоты?
ЗаключениеСоляная кислота представляет собой простую двухатомную кислоту, природа связи которой зависит от окружающей среды. Это полярное ковалентное соединение в газообразной форме, а в водном растворе — ионное.Строение соединения определяет его физические и химические свойства. Кислота обладает высокой реакционной способностью и используется в качестве обычного лабораторного и промышленного реагента. Он также используется для чистки предметов домашнего обихода. Как рассчитать pH в химии Внимание: Этот пост был написан несколько лет назад и может не отражать последние изменения в программе AP®. Abstract: pH – единица измерения, часто используемая в концепциях фундаментальной химии.«Как рассчитать pH» объясняет его категории, научную математику и роль pH в нашей жизни. Термины, с которыми необходимо ознакомиться:
Что такое рН? Термин «pH» является аббревиатурой «потенциала водорода». pH — это единица измерения, которая представляет собой концентрацию ионов водорода в растворе.Эта единица была введена биохимиком Сореном Петером Лаурицем Соренсеном в 1909 году. Это был простой способ представить концентрацию ионов водорода в растворе во время титрования. Когда к воде добавляют кислоту или основание, это соединение диссоциирует на ионы. Шкала pH: кислая, нейтральная и основнаяШкала рН характеризует кислотность раствора: кислая, нейтральная или щелочная. Раствор с рН менее 7 является кислотным, ровно 7 — нейтральным раствором, а выше 7 — щелочным. В основаниях меньше ионов водорода, но больше гидроксид-ионов, представленных pOH или «потенциалом гидроксид-ионов». Таблица 1. Шкала pH
Многие другие ученые изучали свойства кислот и оснований, исходя из идей Серенсена и Аррениуса, и придумали свои определения. В лаборатории pH можно определить с помощью pH-индикатора, такого как pH-бумага. Бумага для измерения pH обычно содержит слабую кислоту или слабое основание, которые реагируют изменением цвета при определенном значении pH. Этот метод часто используется как дешевый и быстрый способ определения рН, а не с использованием рН-метров, которые требуют частой калибровки и обслуживания. Имейте в виду, что растворы с очень низким или очень высоким значением pH могут быть очень едкими, и с ними следует обращаться осторожно. Практические задачиОпределите, является ли следующий раствор кислотным, нейтральным или щелочным.
Ответы:
Концентрации H + и OH –Концентрация – это количество растворенного вещества по отношению к общему количеству раствора.Большое количество растворенного вещества соответствует высокой концентрации, а меньшее количество растворенного вещества соответствует низкой общей концентрации. Когда кислоту или основание помещают в растворитель, это соединение диссоциирует на ионы. Концентрация H + (ионы водорода) в растворе будет определять кислотность или щелочность раствора. Например, в соляной кислоте (обычная кислота, представляющая собой водный раствор HCl) молекулы HCl диссоциируют на два вида ионов: H + и Cl – . Эта диссоциация дает высокую концентрацию H + , что является свойством кислого раствора. То же самое можно увидеть в основных растворах, где низкая концентрация H + из-за высокой концентрации OH – (гидроксид-ион). Например, когда NaOH (гидроксид натрия, обычное основание) помещают в воду, он диссоциирует на два вида ионов: Na + и OH – .Высокая концентрация ОН – , соответствующая низкой концентрации Н + , является свойством основного раствора. Таблица 2. Связь между pH и pOH
Определение pH и pOH будет рассчитываться с использованием концентрации ионов водорода и ионов гидроксида соответственно. Значение рН 1,00 указывает на очень кислый раствор. В примерах 1 и 2 мы можем использовать концентрацию кислоты как концентрацию иона H + , потому что каждая молекула кислоты диссоциирует, тем самым высвобождая ион H + . Эти типы кислот называются «сильными кислотами». Для «слабых кислот» большая часть молекул кислоты не диссоциирует, поэтому для расчета рН растворов слабых кислот пришлось бы использовать более сложные методы. В этой статье мы остановимся на сильных кислотах и основаниях, а слабые кислоты и основания рассмотрим в другой статье.{-рОН} рОН — это другой способ описания кислотности и щелочности, поэтому будьте осторожны, чтобы не перепутать его с рН. Описание растворов по шкале рОН приведено в таблице 2. Таблица 3. Шкала pOH
Определение концентрации гидроксид-ионов и рОН позже будет использовано для демонстрации взаимосвязи между рН и рОН. Расчет отношения между pH и pOHВ разделе «Концентрации H + и OH – » мы обсуждали, что высокая концентрация ионов гидроксида оставляет мало места для ионов водорода и наоборот. Соотношение рН и рОН таково, что оба значения будут равны 14,00. Это можно представить в следующем уравнении: рН + рОН = 14,00 Вы можете проверить свою работу, добавив pH и pOH, чтобы убедиться, что сумма равна 14.00. Это также отличное представление концепции нейтральности pH, где равные концентрации [H + ] и [OH – ] приводят к тому, что pH и pOH равны 7. pH+pOH=14,00 рН=14-рОН pH=14-pH Пример 1: Каково значение pH раствора с pOH 12,40?Имейте в виду, что отношение pH и pOH равно 14. pH+pOH = 14,00 рОН = 12,40 рН= неизвестно рН +12.40 = 14.00 pH = 1,60 Проверьте свою работу: 1,60 + 12,40 = 14,00 Пример 2: Каково значение pOH раствора, содержащего [H + ] 0,100 М HCl? Сначала определите значение pH и используйте это значение с соотношением pH и pOH. pH+pOH = 14,00 pH = -log[0,1000] = 1,00 1,00 + рОН = 14,00 рОН = 13,00 Проверьте свою работу: 1.00 + 13.00 = 14.00 Пример 3: Каково значение pOH раствора с pH 3.40?Имейте в виду, что отношение pH и pOH равно 14,00. pH+pOH = 14,00 рН = 3,40 рОН = неизвестно рОН+3,40 = 14,00 рОН=10,60 = рН 10,60 Проверьте свою работу: 10,60 + 3,40 = 14,00 Значение pH pH окружает нас повсюду. Важно, чтобы жизненно важные растворы, такие как вода, желудочная кислота и кровь, поддерживали постоянный уровень pH. Вода с нейтральным pH около 7 определяет растворимость многих соединений.Без соответствующего рН воды многие химические реакции не происходили бы. Это также можно увидеть в естественных явлениях, таких как кислотные дожди. Высококислотные осадки могут вызвать эрозию и другие опасные последствия для окружающей среды. pH играет важную роль в растворах в организме человека. Конкретные значения pH жизненно важны для таких растворов, как слюна, желудочная кислота и кровь. Производство слюны во рту известно как первый этап пищеварения.На всем протяжении пищеварительного тракта пища должна расщепляться кислыми растворами. Важно, чтобы рН слюны был в пределах 6,5-7,5, слегка кислым, чтобы начать этот процесс. В дальнейшем желудочная кислота действует и в пищеварительной системе. Важно, чтобы желудочная кислота имела очень кислый рН, примерно от 1,5 до 3,5, из-за секреции HCl и высокой концентрации ионов водорода. Эта сильнокислая среда запускает пищеварение и начинает расщеплять частицы пищи, готовясь к процессу выделения. Здоровая кровь имеет рН 7,4. В кровотоке происходят сотни реакций, таких как ферменты, которые требуют определенного pH. Кровь с более высоким или более низким pH может привести к негативным симптомам. Ацидоз является симптомом состояния, при котором значение pH крови слишком низкое, а алкалоз указывает на кровь со слишком высоким значением pH. Люди — не единственные организмы, которые полагаются на соответствующие уровни pH. Некоторые виды процветают только в щелочной (основной) среде и не смогут выжить в нейтральной или кислой среде.Целые экосистемы вращаются вокруг рН. Вопросы для обсуждения
Еще о pH: Кислотно-щелочное равновесие, титрование, буферы, pKa, константа равновесия, нейтрализация, сопряженные кислоты, сопряженное основание. Ищете практику по химии?Ознакомьтесь с другими нашими статьями по химии. Вы также можете найти тысячи практических вопросов на Albert.io. Albert.io позволяет вам настроить учебный процесс так, чтобы он ориентировался на практику, в которой вам больше всего нужна помощь. Начните тренироваться здесь . Вы учитель или администратор, заинтересованный в повышении успеваемости учащихся по химии? Узнайте больше о наших школьных лицензиях здесь . Ионы водорода и гидроксида — Кислоты и основания — National 5 Chemistry RevisionКислые и щелочные растворы могут проводить электричество, поскольку в них есть ионы, которые могут нести заряд. Посмотрите на формулы этих кислот. Все они содержат ионы H + .
При разбавлении кислоты концентрация ионов H + снижается, а pH увеличивается до 7. Посмотрите на формулы этих щелочей. Все они содержат ионы ОН — .
0.0.0.1:0.1.0.$0.$1.$8″> Чем более концентрирована кислота или щелочь, тем лучше они проводят ток.При разбавлении щелочи концентрация ионов OH — уменьшается, а pH уменьшается до 7. Химические формулы используемых органических кислот все гипергенные рудные месторождения. Наиболее распространенной фазой FeO/OH в гипергенных средах является гетит, хотя также могут встречаться гематит, лепидокрокит, ферригидрит и маггемит. Природные соединения FeO/OH редко бывают химически чистыми, поскольку ряд катионов металлов может быть легко включен в их минеральную структуру.Хотя существует обширная литература по очищающему действию синтетических FeO/OH, в целом не хватает исследований природных систем и, в частности, исследований, посвященных геохимии микроэлементов в FeO/OH, связанных с гипергенными рудами. Кроме того, хотя известно, что FeO/OH в гипергенных рудных системах обычно содержат повышенные уровни полезных металлов, таких как РЗЭ, Sc, V, Co, Mn, Cr и Ni, в большинстве случаев эти фазы рассматриваются как пустая порода и, следовательно, металлы не восстанавливаются. Только в случае месторождений Ni(Co)-латерита FeO/OH часто эксплуатируются для Ni и Co, а иногда и для Sc.
Большинство предыдущих работ по месторождениям Ni(Co)-латерита были сосредоточены на процессе латеритизации материнских пород и минералогии образующихся минералов, содержащих Ni(Co). Лишь в редких случаях публиковались исследования, посвященные поведению РЗЭ, V, Sc и PGE в составе FeO/OH.
В этом исследовании мы описываем новые минералогические и химические данные (XRPD, SEM-EDS, EPMA, ICP-AES, LA-ICP-MS и TEM-HRTEM), полученные из ряда природных образцов FeO/OH, собранных из четырех важных Ni Месторождения (ко)-латерита, а именно Вингеллина (Западная Австралия), Пиауи (Бразилия), Карачам и Чалдаг (Турция).В ходе этого исследования мы исследовали геохимию гетита и гематита в пределах зоны окисления соответствующих профилей латерита, оценивая поведение второстепенных металлов, таких как Ti, Sc, Cr, Ni, Co, V, Zn и Mn.
Хотя собранные образцы FeO/OH получены из разных материнских пород, расположенных в разных географических районах, они имеют ряд общих черт. Только в случае месторождений Ni(Co)-латерита FeO/OH часто эксплуатируются для Ni и Co, а иногда и для Sc.
Большинство предыдущих работ по месторождениям Ni(Co)-латерита были сосредоточены на процессе латеритизации материнских пород и минералогии образующихся минералов, содержащих Ni(Co). Лишь в редких случаях публиковались исследования, посвященные поведению РЗЭ, V, Sc и PGE в составе FeO/OH.
В этом исследовании мы описываем новые минералогические и химические данные (XRPD, SEM-EDS, EPMA, ICP-AES, LA-ICP-MS и TEM-HRTEM), полученные из ряда природных образцов FeO/OH, собранных из четырех важных Ni Месторождения (ко)-латерита, а именно Вингеллина (Западная Австралия), Пиауи (Бразилия), Карачам и Чалдаг (Турция).В ходе этого исследования мы исследовали геохимию гетита и гематита в пределах зоны окисления соответствующих профилей латерита, оценивая поведение второстепенных металлов, таких как Ti, Sc, Cr, Ni, Co, V, Zn и Mn.
Хотя собранные образцы FeO/OH получены из разных материнских пород, расположенных в разных географических районах, они имеют ряд общих черт. В частности, есть общие черты в текстурах руд, минералогии и поведении металлов. На основе многомерного статистического анализа химический состав изученных соединений FeO/OH определяет три основные ассоциации элементов: i) Mn–Al–Ti–Sc–V, как видно из образцов гетита из Вингеллины; ii) Mg-Ni-Si-Zn на примере образцов из Карачама и Пиауи, и iii) Cr-V на примере образцов из Чалдага.Эти контрастные геохимические следы можно объяснить с точки зрения контроля первого и второго порядка с химическим составом материнской породы, представляющим первый порядок, и благоприятными условиями pH для фиксации микроэлементов в пределах FeO / OH, представляющих второй порядок. контроль. Сезонность и созревание могут быть дополнительными факторами, влияющими на минералогию FeO/OH, поскольку периоды засушливого климата могли способствовать дегидратации некоторых FeO/OH с образованием более стабильных видов (например, от гетита до гематита) с течением времени.Таким образом, наши наблюдения помогли лучше понять модель отложения руды, относящуюся к системам поверхностного выветривания, а также установили параметры, которые контролируют распределение экономически значимых побочных металлов в FeO/OH в различных условиях во время образования Ni(Co). В частности, есть общие черты в текстурах руд, минералогии и поведении металлов. На основе многомерного статистического анализа химический состав изученных соединений FeO/OH определяет три основные ассоциации элементов: i) Mn–Al–Ti–Sc–V, как видно из образцов гетита из Вингеллины; ii) Mg-Ni-Si-Zn на примере образцов из Карачама и Пиауи, и iii) Cr-V на примере образцов из Чалдага.Эти контрастные геохимические следы можно объяснить с точки зрения контроля первого и второго порядка с химическим составом материнской породы, представляющим первый порядок, и благоприятными условиями pH для фиксации микроэлементов в пределах FeO / OH, представляющих второй порядок. контроль. Сезонность и созревание могут быть дополнительными факторами, влияющими на минералогию FeO/OH, поскольку периоды засушливого климата могли способствовать дегидратации некоторых FeO/OH с образованием более стабильных видов (например, от гетита до гематита) с течением времени.Таким образом, наши наблюдения помогли лучше понять модель отложения руды, относящуюся к системам поверхностного выветривания, а также установили параметры, которые контролируют распределение экономически значимых побочных металлов в FeO/OH в различных условиях во время образования Ni(Co). )-латериты. )-латериты. Произошла ошибка при настройке пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт. Настройка браузера на прием файлов cookieСуществует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
Почему этому сайту требуются файлы cookie?Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня. Что сохраняется в файле cookie? Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется. |

 Более широкое определение было предложено Бронстедом.
и Лоури в 1923 г. Основной эффект определения заключается в увеличении
количество веществ, играющих роль оснований.
Более широкое определение было предложено Бронстедом.
и Лоури в 1923 г. Основной эффект определения заключается в увеличении
количество веществ, играющих роль оснований.  В этом случае
HOH является основанием в первом случае и кислотой во втором.
второй случай.
В этом случае
HOH является основанием в первом случае и кислотой во втором.
второй случай. 
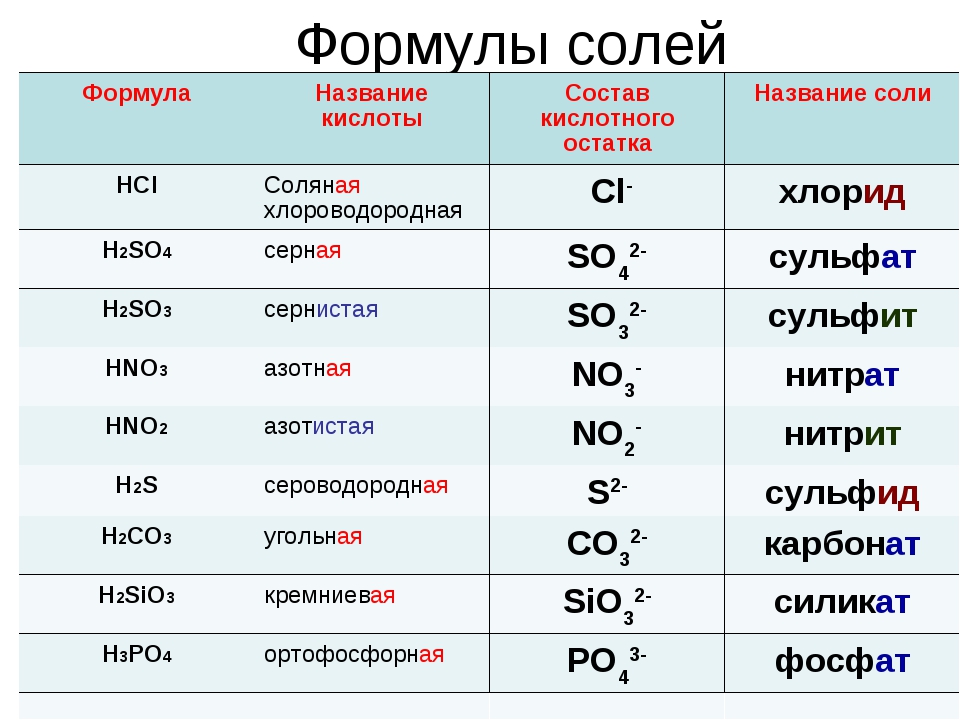 Тип связи, образующейся между двумя ионами, зависит от электроотрицательности двух ионов. Такая разница также определяется средой, в которой формируется связь.Например, разница в электроотрицательности двух ионов в газовой фазе такова, что создает полярную ковалентную связь. Следовательно, газообразный хлороводород является ковалентным. Однако в водном растворе, таком как вода, эта разница в электроотрицательности двух ионов увеличивается до такой степени, что начинает образовываться ионная связь.
Тип связи, образующейся между двумя ионами, зависит от электроотрицательности двух ионов. Такая разница также определяется средой, в которой формируется связь.Например, разница в электроотрицательности двух ионов в газовой фазе такова, что создает полярную ковалентную связь. Следовательно, газообразный хлороводород является ковалентным. Однако в водном растворе, таком как вода, эта разница в электроотрицательности двух ионов увеличивается до такой степени, что начинает образовываться ионная связь. 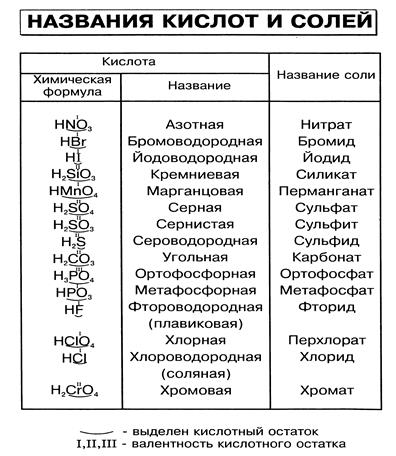 Для коммерческих целей соляную кислоту в основном готовят в концентрации 28-32%. Физические свойства соляной кислоты меняются в зависимости от концентрации. Например, плотность, вязкость и давление паров соляной кислоты увеличиваются с увеличением концентрации кислоты.Температура плавления, точка кипения и удельная теплоемкость уменьшаются с концентрацией. pH соляной кислоты находится в кислом диапазоне от -0,5 до -1,1, в зависимости от концентрации кислоты.
Для коммерческих целей соляную кислоту в основном готовят в концентрации 28-32%. Физические свойства соляной кислоты меняются в зависимости от концентрации. Например, плотность, вязкость и давление паров соляной кислоты увеличиваются с увеличением концентрации кислоты.Температура плавления, точка кипения и удельная теплоемкость уменьшаются с концентрацией. pH соляной кислоты находится в кислом диапазоне от -0,5 до -1,1, в зависимости от концентрации кислоты. 
 Мы постепенно обновляем эти сообщения и удалим это заявление об отказе от ответственности при обновлении этого сообщения. Спасибо за ваше терпение!
Мы постепенно обновляем эти сообщения и удалим это заявление об отказе от ответственности при обновлении этого сообщения. Спасибо за ваше терпение!  Для кислот одним из этих ионов является ион водорода (H + ), а для оснований одним из ионов является ион гидроксида (OH – ). Это описание кислот и оснований известно как теория Аррениуса. Концентрацию ионов водорода часто описывают по шкале рН как числовое значение.
Для кислот одним из этих ионов является ион водорода (H + ), а для оснований одним из ионов является ион гидроксида (OH – ). Это описание кислот и оснований известно как теория Аррениуса. Концентрацию ионов водорода часто описывают по шкале рН как числовое значение. Известная теория известна как теория Бренстеда-Лоури. Теория Бренстеда-Лоури — это концепция, включающая кислоты и основания, которая предполагает, что кислоты действуют как доноры протонов. Поскольку нейтральные атомы водорода обычно состоят из одного протона и одного электрона, положительный ион водорода часто называют протоном. Эти протоны несут положительный заряд и отдаются основаниям. Основания, согласно этой логике, являются акцепторами протонов. Основания, несущие неподеленные пары электронов, притягивают положительные ионы водорода (протоны).
Известная теория известна как теория Бренстеда-Лоури. Теория Бренстеда-Лоури — это концепция, включающая кислоты и основания, которая предполагает, что кислоты действуют как доноры протонов. Поскольку нейтральные атомы водорода обычно состоят из одного протона и одного электрона, положительный ион водорода часто называют протоном. Эти протоны несут положительный заряд и отдаются основаниям. Основания, согласно этой логике, являются акцепторами протонов. Основания, несущие неподеленные пары электронов, притягивают положительные ионы водорода (протоны).
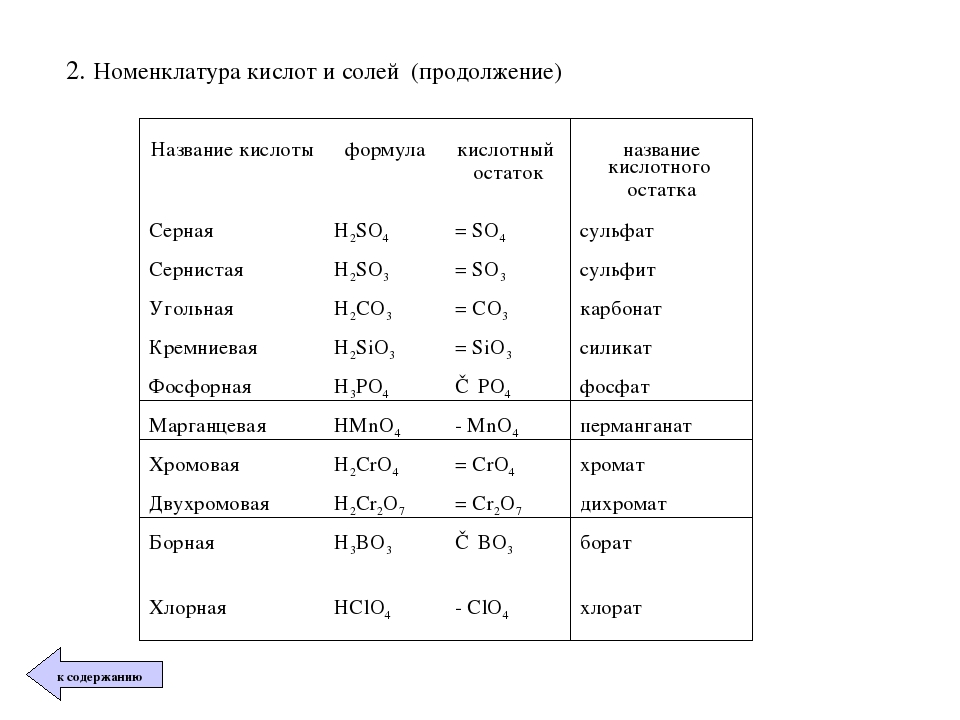 Высокая концентрация H + будет означать кислый раствор, а низкая концентрация H + будет означать щелочной раствор.
Высокая концентрация H + будет означать кислый раствор, а низкая концентрация H + будет означать щелочной раствор.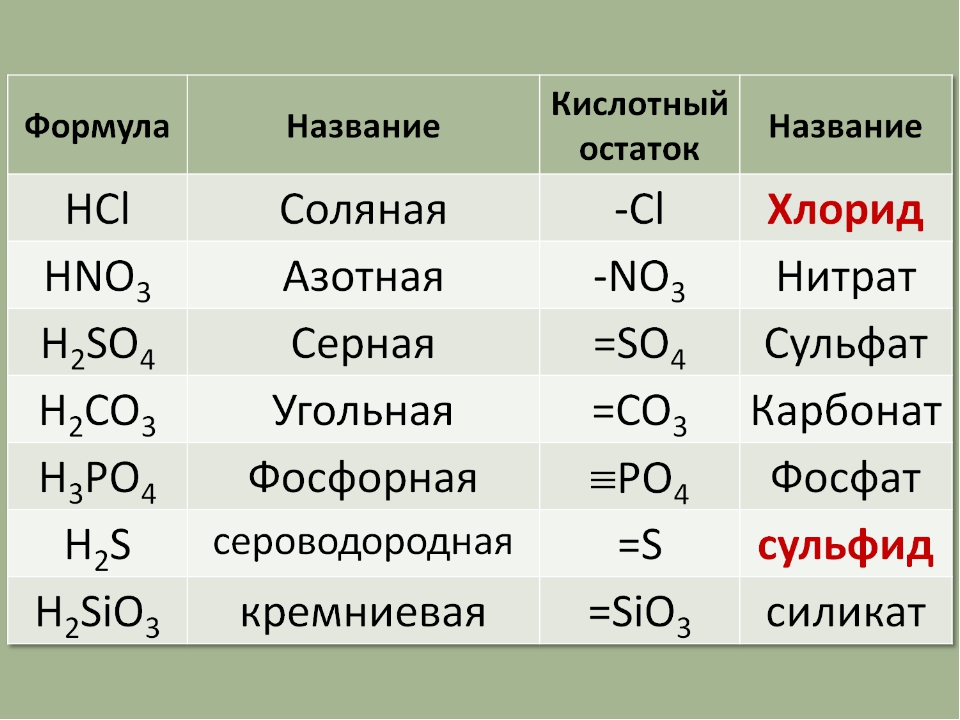 { + } \right] } = log (0.100) = 1,00
{ + } \right] } = log (0.100) = 1,00
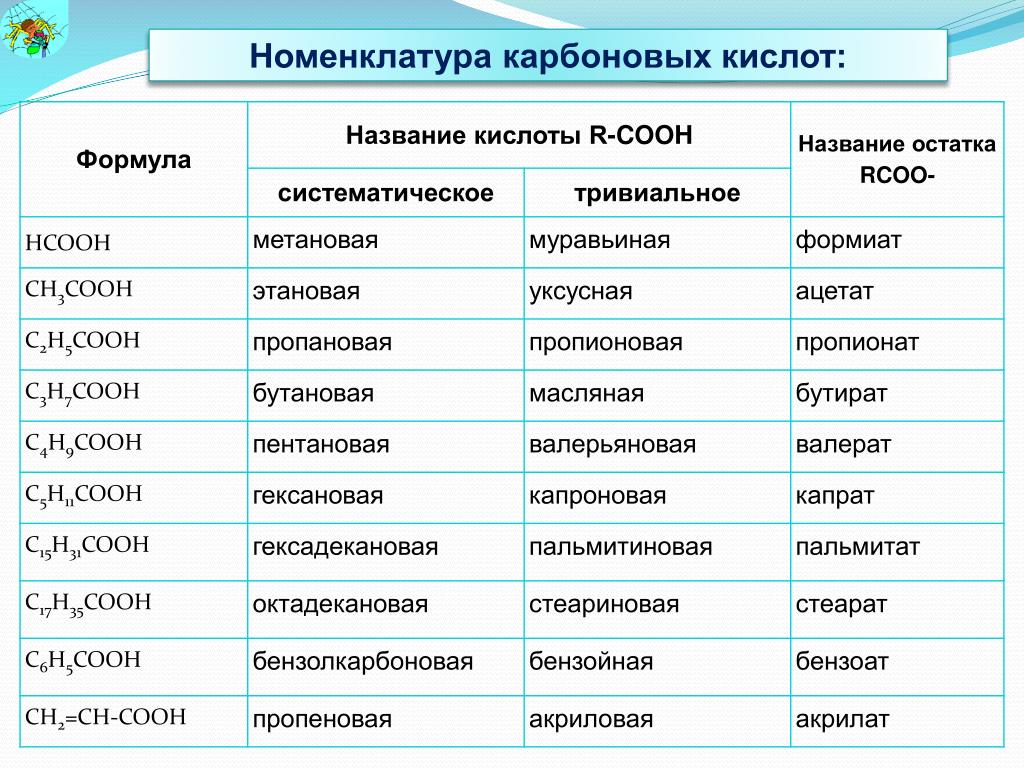 {-12}
{-12}
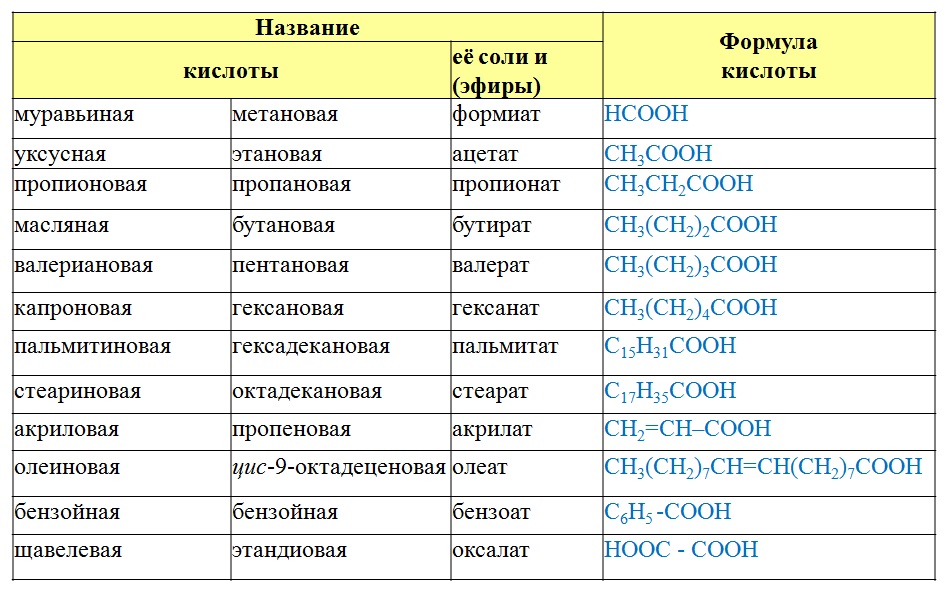


 Мы дадим вам сложные практические вопросы, которые помогут вам достичь мастерства в химии.
Мы дадим вам сложные практические вопросы, которые помогут вам достичь мастерства в химии.  Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
