Основные свойства металлических радиусов — Справочник химика 21
Свойства элементов и простых веществ закономерно изменяются в подгруппе с ростом радиуса атомов и уменьшением энергии ионизации, как это можно видеть из табл. 27. Азот и фосфор — типичные неметаллы, т. е. кислотообразователи. Различия в строении предвнеш-него электронного уровня у атомов фосфора и мышьяка меньше сказываются на изменении свойств элементов, чем при переходе от кремния к германию в IVA-подгруппе. У мышьяка сильнее выражены неметаллические свойства. У сурьмы неметаллические и металлические свойства проявляются приблизительно в одинаковой степени. Для висмута характерно преобладание металлических (основных) свойств. [c.339]Электронное строение атома бериллия в газообразном состоянии — 15 25% Увеличение заряда ядра атома бериллия по сравнению с зарядом ядра атома лития наряду с тем, что 25-электроны только частично экранируют друг друга, приводит к двум эффектам 1) атом Ве имеет металлический радиус только 0,89 А, значительно меньше, чем в случае лития (1,22 А) 2) потенциалы ионизации Ве, 9,32 и 18,21 эв, гораздо большие, чем у Ы (5,39 эе), делают Ве значительно менее электроположительным, если рассматривать его хилшческие свойства в сравнении со свойствами Действительно, не существует никаких кристаллических соединений или растворов, в которых ионы Ве + существовали бы как таковые.

Химические свойства оксидов и гидроксидов зависят как от положения соответствующего элемента в периодической системе химических элементов Д. И. Менделеева, так и от его степени окисления. Вам уже известно, что в группах сверху вниз увеличиваются атомные радиусы элементов и, следовательно, возрастают металлические свойства. Особенно это характерно для элементов главных подгрупп. В том же направлении усиливаются основные свойства оксидов и гидроксидов соответству-ЮШ. ИХ элементов. В этом можно убедиться при сравнении свойств элементов, их оксидов и гидроксидов, отраженных в таблице 19. [c.116]
ИХ элементов. В этом можно убедиться при сравнении свойств элементов, их оксидов и гидроксидов, отраженных в таблице 19. [c.116]
Элементы подгруппы углерода образуют оксиды общей формулы КОа и КО, а водородные соединения —формулы НН4. Гидраты высших оксидов углерода и кремния обладают кислотными свойствами, гидраты остальных элементов амфотерны, причем кислотные свойства сильнее выражены у гидратов германия, а основнью — у гидратов свинца. От углерода к свинцу уменьшается прочность водородных соединений КН4 СН — прочное вещество, а РЬН в свободном виде не выделено. В подгруппе с ростом порядкового номера уменьшается энергия ионизации атома и увеличивается атомный радиус (п. 3 и 6 табл. 11.1), т. е. неметаллические свойства ослабевают, а металлические усиливаются.
Валентное состояние элементов главной подгруппы II группы определяется относительной легкостью отщепления их нейтральными атомами двух электронов с ns-электронной оболочки (см.
 табл. 1.3). В связи с этим кроме металлического состояния для элементов подгруппы Ве — Ra характерно образование двухзарядных катионов, имеющих относительно малые размеры и большую, особенно у легких элементов подгруппы, плотность положительного заряда. Уникальные характеристики имеет ион Ве2+, отношение заряда к радиусу у него в пять раз больше, чем у Mg +. С этим связано очень высокое поляризующее действие иона Ве +, его склонность к образованию ковалентных связей и, как полагают, его высокая токсичность [1, с. 182]. Сверху вниз но подгруппе плотность положительного заряда и поляризующее действие двухзарядных катионов падает. В связи с этим растут ионный характер и основные свойства большинства соединений этих элементов, которые по праву называют типичными элементами-металлами.
[c.27]
табл. 1.3). В связи с этим кроме металлического состояния для элементов подгруппы Ве — Ra характерно образование двухзарядных катионов, имеющих относительно малые размеры и большую, особенно у легких элементов подгруппы, плотность положительного заряда. Уникальные характеристики имеет ион Ве2+, отношение заряда к радиусу у него в пять раз больше, чем у Mg +. С этим связано очень высокое поляризующее действие иона Ве +, его склонность к образованию ковалентных связей и, как полагают, его высокая токсичность [1, с. 182]. Сверху вниз но подгруппе плотность положительного заряда и поляризующее действие двухзарядных катионов падает. В связи с этим растут ионный характер и основные свойства большинства соединений этих элементов, которые по праву называют типичными элементами-металлами.
[c.27] Атомы элементов третьей группы являются электронными аналогами, так как все они имеют одинаковое строение внешнего уровня s p (и одинаковое число электронов на нем). Металлические свойства у них выражены слабее, чем у элементов I и II главной подгрупп, а у бора, характеризующегося малым радиусом и наличием двух квантовых слоев, преобладают неметаллические свойства.
Соединения Ре+ получают действием окислителей на металлическое железо или окислением соединений двухвалентного железа. По кислотно-основным свойствам, составу и строению кристаллогидратов, растворимости и другим характеристикам многие соединения Ре+ похожи на соединения Al+ что обусловлено близостью ионных радиусов у Ре+ а = 64 пм, у А1+ г = 51 пм. [c.566]
Основные характеристики элементов главной подгруппы II группы периодической системы (табл. 1.3) изменяются в ряду Ве—Ra закономерно как и следовало олвеличины атомных и ионных радиусов растут, величины потенциалов нонизацпи уменьшаются, атомная масса увеличивается, металлические и кислотно-основные свойства становятся все более явными.
Все элементы в соответствии с электронным строением атомов можно подразделить на металлы и неметаллы. Такая дифференциация элементов относительна. Б каждом элементе представлены в той или иной мере оба противоположных качества. Металлические свой-, ства элементов определяются способностью атомов при взаимодействии частично или полностью смещать электронные облака к другим атомам ( отдавать электроны), проявлять восстановительную активность. К самым активным металлам относятся элементы с меньшей энергией ионизации и электроотрицательностью, максимально большими радиусами атомов и малым числом внешних электронов (например, щелочные металлы). Неметаллические свойства определяются способностью атомов принимать электроны, проявлять при взаимодействии окислительную активность. К наиболее активным неметаллам (окислителям) относятся элементы с большой энергией ионизации атомов, большим сродством к электрону и минимально возможными радиусами атомов (галогены, кислород, сера).
ОСНОВНЫЕ СВОЙСТВА МЕТАЛЛИЧЕСКИХ РАДИУСОВ [c.70]
Для интерметаллических карбидов характерны высокие температуры плавления (от 3000 до 4200 °С), большая твердость (9—10 по шкале Мооса) и металлический тип проводимости. Электронная структура и другие характерные свойства металлов в основном сохраняются при внедрении атомов углерода в кристаллическую решетку. Атомы металлов, образующие интерметаллические соединения, имеют радиус 0,13 нм. Это — более тяжелые элементы побочных подгрупп четвёртой, пятой и шестой групп. Здесь Следует назвать ТаС (4150 °С),, 2гС (3800°С), и в особенности смешанный карбид 4ТаС + 2гС с самой высокой известной в настоящее время температурой плавления (4215°С).
[c. 556]
556]
Одинаковое строение внешней электронной оболочки атома бора и алюминия обусловливает сходство в свойствах этих элементов. Так, для алюминия, как и для бора, характерна только степень окисления +3. Однако при переходе от бора к алюминию сильно возрастает радиус атома (от 91 до 143 пм) и, кроме того, появляется еще один промежуточный восьмиэлектронный слой, экранирующий ядро. Все это приводит к ослаблению связи внешних электронов с ядром и к уменьшению энергии ионизации атома (см. табл. 15.2). Поэтому у алюминия металлические свойства выражены гораздо сильнее, чем у бора. Тем не менее химические связи, образуемые алюминием с другими элементами, имеют в основном ковалентный характер.
Металлические свойства их выражены значительно слабее, чем у элементов главных подгрупп I и II групп, причем бор, атомы которого имеют наименьший радиус, в основном проявляет неметаллические свойства и относится к группе неметаллов.
 С возрастанием атомной массы и порядкового номера внутри подгруппы металлические свойства элементов усиливаются. Так, бор в основном слабый неметалл алюминий, галлий и индий — металлы с амфотерными свойствами. У галлия металлические свойства наиболее выражены, причем в одновалентных соединениях он близок по свойствам к щелочным металлам.
[c.388]
С возрастанием атомной массы и порядкового номера внутри подгруппы металлические свойства элементов усиливаются. Так, бор в основном слабый неметалл алюминий, галлий и индий — металлы с амфотерными свойствами. У галлия металлические свойства наиболее выражены, причем в одновалентных соединениях он близок по свойствам к щелочным металлам.
[c.388]Степень основности (сила) их гидратов окислов возрастает с увеличением ионного радиуса поэтому наиболее резко металлические свойства выражены у лантана у следующих за ним редкоземельных элементов основные свойства ослабляются с возрастанием порядкового номера. На примере лантана и познакомимся со свойствами редкоземельных металлов. [c.665]
Некоторые выводы мы можем сделать на основании одного простого примера. Рассмотрим металл литий с кристаллической структурой о. ц. к. и кратчайшим возможным расстоянием между ядрами, равным 3,03 А. В атоме лития имеются только три электрона, основное состояние которых (ls) (2s) радиус иона Ы+(15)2 (табл. 28 на стр. 337) равен всего лишь 0,60 А. На внутренние сильно связанные электроны другие атомы лития почти не будут оказывать влияния, поэтому мы приходим к выводу, что один и только один валентный электрон каждого атома сообщает кристаллу металлические свойства. Все связи атома с его ближайшими четырнадцатью соседями обязаны своим существованием этому единственному (на каждый атом) электрону, связывающая сила которого, таким образом, размазана . Это следует также из сравнения длины связи, (2,67 А) в двухатомной молекуле Ыг с кратчайшим возможным расстоянием (3,03 А) между атомами в металле. Увеличенная длина связи в металле означает, что последняя ослаблена в то же время число связей в металле больше, вследствие чего полная энергия связи на один атом возрастает от 13 ккал/моль в молекуле до 39 ккал/моль в металле. Валентные электроны, или электроны проводимости, таким образом, связаны в металле сильнее, чем в молекуле, но их связывающая сила распределена между большим числом объектов.
28 на стр. 337) равен всего лишь 0,60 А. На внутренние сильно связанные электроны другие атомы лития почти не будут оказывать влияния, поэтому мы приходим к выводу, что один и только один валентный электрон каждого атома сообщает кристаллу металлические свойства. Все связи атома с его ближайшими четырнадцатью соседями обязаны своим существованием этому единственному (на каждый атом) электрону, связывающая сила которого, таким образом, размазана . Это следует также из сравнения длины связи, (2,67 А) в двухатомной молекуле Ыг с кратчайшим возможным расстоянием (3,03 А) между атомами в металле. Увеличенная длина связи в металле означает, что последняя ослаблена в то же время число связей в металле больше, вследствие чего полная энергия связи на один атом возрастает от 13 ккал/моль в молекуле до 39 ккал/моль в металле. Валентные электроны, или электроны проводимости, таким образом, связаны в металле сильнее, чем в молекуле, но их связывающая сила распределена между большим числом объектов.
Основной метод получения Основные свойства Проявление отрицательной валентности уменьшается с увеличением радиуса атома усиливаются металлические свойства Метод окисления Окислители (окислительная способность уменьшается) [c.240]
Характеристика элементов. Подобно галлию, индий и таллий в периодической системе следуют непосредственно за -элементами, поэтому на их свойствах сказывается -сжатие, а на свойствах таллия еще и /-сжатие. Р1х атомные радиусы увеличиваются незначительно, а потенциал ионизации даже несколько возрастает у таллия. Остальные свойства изменяются в той же последовательности, что и в подгруппах других р-элементов. Особенностью их является усиление инертности бх -электронной пары. Если для галлия характерна степень окисления -ЬЗ, то у индия и таллия тенденция в проявлении степеней окисления -ЬЗ и -)-1 смещается в сторону последней и для таллия -Ь1 становится основной. Металлические качества растут и связи в соединениях приобретают более ионный характер, хотя некоторая амфотерность соединений остается. Увеличение экранирования ядра близлежащими электронными слоями уменьшает акцепторные способности элементов 1п и Т1, что снижает число образуемых ими комплексов. В то же время увеличение радиуса атомов и ионов приводит к росту координационного числа, так как возрастает участие — и /-орбиталей в образовании координационной связи. Для индия типичны sp 2- и хр -гибридизации с соответствующими числами 6 и 4, а для таллия еще и /-гиб- [c.320]
Увеличение экранирования ядра близлежащими электронными слоями уменьшает акцепторные способности элементов 1п и Т1, что снижает число образуемых ими комплексов. В то же время увеличение радиуса атомов и ионов приводит к росту координационного числа, так как возрастает участие — и /-орбиталей в образовании координационной связи. Для индия типичны sp 2- и хр -гибридизации с соответствующими числами 6 и 4, а для таллия еще и /-гиб- [c.320]
Вопросы для самопроверки 1. Какова современная формулировка периодического закона Д. И. Менделеева 2. Какая закономерность позволила доказать, что заряд ядра атома элемента равен порядковому номеру элемента в периодической системе элементов 3. Что такое энергия ионизации и энергия сродства к электрону Какое свойство атома они характеризуют 4. Что такое электроотрицательность 5. Как изменяются металлические и неметаллические свойства элементов с увеличением порядкового номера в малых и больших периодах 6. Как изменяются металлические свойства элементов в главных подгруппах в связи с изменением радиуса атома элемента 7.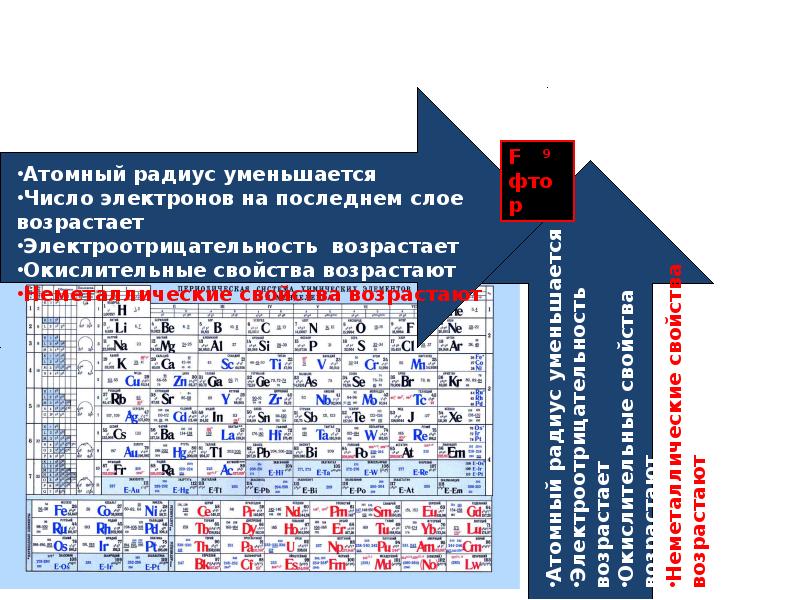 Каков порядок заполнения электронных слоев атомов элементов в малых и больших периодах С атомов каких элементов начинают формироваться 3(1-, 4 -, 4/-, 5й-, 5/- и 6 -подуровни 8, На какие электронные семейства классифицируются элементы в зависимости от характера заполнения электронных оболочек 9. Какие элементы называются типическими Какие элементы называются электронными аналогами (полными и неполными) 10. Какие свойства элементов изменяются периодически и какие непериодически с увеличением заряда ядра атома элемента 11. Как изменяются основные и кислотные свой- [c.14]
Каков порядок заполнения электронных слоев атомов элементов в малых и больших периодах С атомов каких элементов начинают формироваться 3(1-, 4 -, 4/-, 5й-, 5/- и 6 -подуровни 8, На какие электронные семейства классифицируются элементы в зависимости от характера заполнения электронных оболочек 9. Какие элементы называются типическими Какие элементы называются электронными аналогами (полными и неполными) 10. Какие свойства элементов изменяются периодически и какие непериодически с увеличением заряда ядра атома элемента 11. Как изменяются основные и кислотные свой- [c.14]
В ряду Аз(ОН)з—5Ь(ОН)з—В1(0Н)з происходит усиление основных свойств, связанное с увеличением радиуса иона и усилением металлических свойств. [c.236]
Первым двум соответствуют кислоты. По ряду As—Sb—Bi химические свойства гидроксидов Э(ОН)з изменяются весьма закономерно. Все они амфотерны, причем у As (ОН) а преобладает кислотный характер, у 5Ь(ОН)з — основный. У гидроксида же висмута В1(0Н)з кислотная функция практически не выражена. Таким образом, кислотный характер гидроксидов, ясно выраженный у элементов семейства азота, быстро падает по ряду As—Sb—Bi. Это находится в полном соответствии с закономерностью, не раз уже приводившейся с нарастанием числа электронных оболочек в атомах элементов данной главной подгруппы, с возрастанием эффективного их радиуса неметаллические свойства элементов падают, металлические же возрастают. [c.132]
Таким образом, кислотный характер гидроксидов, ясно выраженный у элементов семейства азота, быстро падает по ряду As—Sb—Bi. Это находится в полном соответствии с закономерностью, не раз уже приводившейся с нарастанием числа электронных оболочек в атомах элементов данной главной подгруппы, с возрастанием эффективного их радиуса неметаллические свойства элементов падают, металлические же возрастают. [c.132]
Необходимость этого условия в даи ном случае объясняется тем, что вхождение в структуру шпинели новых катионов с меньшим ионным радиусом будет уменьшать параметры решетки, а следовательно, затруднять диффузию для кислорода и металлических ионов (в особенности более крупных ионов основного металла). Очевидно, что легирование компонентом с большим ионным радиусом будет уменьшать защитные свойства шпинельных окислов. [c.95]
Редкоземельные элементы.— резко выраженные металлы по степени мет-алличности они уступают лишь щелочным и щелочноземельным металлам. Степень основности (сила) их гидратов окислов возрастает с увеличением ионного радиуса поэтому наиболее резко металлические свойства выражены у лантана у следующих за ним редкоземельных элементов основные свойства ослабляются с Ьозрастаиием порядкового номера. На примере лантана и познакомимся со свойствами редкоземельных металлов. [c.477]
Степень основности (сила) их гидратов окислов возрастает с увеличением ионного радиуса поэтому наиболее резко металлические свойства выражены у лантана у следующих за ним редкоземельных элементов основные свойства ослабляются с Ьозрастаиием порядкового номера. На примере лантана и познакомимся со свойствами редкоземельных металлов. [c.477]
Величина энергии ионизации зависит в основном от заряда ядра и от атомного радиуса, который характеризует расстояние от ядра до наиболее удаленного электрона в наружном слое. Чем больше радиус атома, тем слабее притягивается электрон к ядру и, следовательно, тем меньше энергия ионизации, т. е. тем меньше энергии нужно затратить на отрыв электрона и превращение атома в положительно заряженный ион. Поэтому энергия ионизации может слу окить мерой способности элемента проявлять металлические свойства. Мерой способности элемента проявлять неметаллические [c.56]
Условия формирования продукта из газовой фазы (см. главы 10, 11) позволяют получать порошки с частицами сколь угодно малых размеров, вплоть до размеров, отвечаюш их радиусу критического зародыша. Радиус критического зародыша составляет 10 см. Размеры частиц, при которых проявляются особые свойства ультрадисперсных систем, начинаются с 10 см [1] они определяются характером состояний атомов и ионов в малых частицах, которые можно считать особым состоянием конденсированных фаз. При получении ультра-диснерсных порошков в нлазменных процессах, когда конденсация металлических или керамических порошков происходит при высоких пересьщениях системы, а пересьщение снимается в основном за счет образования зародышей конденсированной фазы, размер частиц часто находится ниже 10 см и проявляется неравновесная структура [c.631]
Элементы главной подгруппы И группы относятся к s-элементам и обладают (кроме бериллия) ярко выраженными металлическими свойствами, уступая в этом отношении только щелочным металлам. Основной характер элементов усиливается от бериллия к радию вследствие последовательного увеличения радиусов их атомов и ионов и ослабления сил связи между валентными электронами и ядром, поэтому барий, в отличие от кальция, бурно взаимодействует с водой. В той же последовательности происходит повышение растворимости гидроксидов в воде. Так, растворимость Э(ОН)г при 20°С увеличивается от Mg(0H)2 (83-10- моль1л) к Ва(ОН)г (2,8-10 моль/л). Гидроксиды бария Ва(ОН)г и радия Ra(0H)2 — самые сильные основания и хорошо диссоциируют в водных растворах [c.419]
В той же последовательности происходит повышение растворимости гидроксидов в воде. Так, растворимость Э(ОН)г при 20°С увеличивается от Mg(0H)2 (83-10- моль1л) к Ва(ОН)г (2,8-10 моль/л). Гидроксиды бария Ва(ОН)г и радия Ra(0H)2 — самые сильные основания и хорошо диссоциируют в водных растворах [c.419]
Подобные зависимости проявляют и металлические элементы переходных групп. Если мы аналогично сопоставим кислородные соединения одного элемента, то заметим увеличение кислотности, которое можно, с одной стороны, приписать влиянию отрицательных групп в молекуле, а с другой стороны, — уменьшению размеров атома элемента, связанного с кислородом. Так как чем меньше радиус этого атома и чем больше его положительный заряд, тем сильнее его влияние на электронные оболочки кислорода. Большая плотность положительного заряда вызывает усиленное притяжение электронов к центральному атому, что облегчает диссоциацию с отщеплением протона. Иллюстрацией может служить хром. В степени окисления II [СгСОН) ] хром является явно основным элементом, в степени окисления Ш[Сг(ОН)з] — амфотерным, а в степени окисления VI [ СгОд] — сильно кислотным. Ионные радиусы хрома соответственно составляют = 0,80 А, г з = 0,64 К и = 0,52 А. Аналогичные изменения свойств проявляют и соединения марганца [c.212]
Ионные радиусы хрома соответственно составляют = 0,80 А, г з = 0,64 К и = 0,52 А. Аналогичные изменения свойств проявляют и соединения марганца [c.212]
Еще более защитными будут являться сложные шпинели типа РеО МбгОз или Рб20з МеО, особеьно, если легирующий компонент Ме) будет иметь меньший ионный радиус по сравнению с железом. Необходимость этого ус,повия в данном случае объясняется тем, чго вхождение в структуру шпинели новых катионов с меньшим ионным радиусом будет уменьшать параметры решетки, а следовательно, уменьшать диффузионные возможности для кислорода и металлических ионов (особенно в отношении более крупных ионов основного металла). Очевидно, что легирование компонентом с большим ионным радиусом будет смещать защитные свойства шпинельных окислов в не благоприятную сторону. [c.70]
ОГЭ (вопросы). Периодический закон и Периодическая система элементов
Вопрос 1.
Как изменяются металлические свойства простых веществ следующих элементов? Алюминий, магний, натрий.
Ответ: увеличиваются. Металлические свойства увеличиваются в периодах справа налево и в группах сверху вниз.
Вопрос 2.
Как изменяется атомный радиус в периодах и группах?
Показать ответОтвет: в периодах атомный радиус увеличивается справа налево, в группах — сверху вниз.
Вопрос 3.
Как изменяются основные свойства оксидов в периодах и группах?
Показать ответОтвет: в периодах основные свойства оксидов увеличивается справа налево, в группах сверху вниз (аналогично основным свойствам простых веществ соответствующих элементов).
Вопрос 4.
Как изменяются кислотные свойства оксидов в периодах и группах?
Показать ответОтвет: в периодах кислотные свойства оксидов увеличивается слева направо, в группах снизу вверх (аналогично кислотным свойствам простых веществ соответствующих элементов).
Вопрос 5.
Основные свойства оксида магния выражены сильнее или слабее, чем основные свойства оксида натрия?
Показать ответОтвет: слабее, так как магний находится правее натрия в периодической таблице.
Вопрос 6.
Неметаллические свойства углерода выражены сильнее или слабее, чем неметаллические свойства азота?
Показать ответОтвет: слабее, так как азот находится правее углерода и ближе к фтору (элементу с самыми сильными неметаллическими свойствами).
Вопрос 7.
Что такое электроотрицательность?
Показать ответОтвет: способность атомов притягивать к себе электроны других атомов.
Вопрос 8.
Электроотрицательность хлора выше или ниже, чем электроотрицательность брома?
Показать ответОтвет: выше, так как хлор находится выше брома в периодической таблице и ближе к фтору (элементу с самыми сильными неметаллическими свойствами).
Вопрос 9.
Напишите формулу летучих водородных соединений селена и германия. Определите валентность этих элементов.
Показать ответОтвет: H2Se (валентность II), GeH4 (валентность IV).
Оксиды и гидроксиды металлов
Для всех металлов известны их оксиды и гидроксиды, а у d-элементов различные степени окисления, поэтому они образуют множество оксидов и гидроксидов. Свойства этих оксидов и гидроксидов зависят от положения металла в периодической системе, от его активности и степени окисления металла. Таким образом, все металлы образуют солеобразующие оксиды.
Известно, что чем ярче выражены металлические свойства, тем сильнее основные свойства оксидов и гидроксидов.
Для s- и p-элементов слева направо по периоду уменьшаются металлические свойства, а значит и основные свойства оксидов и гидроксидов металлов. В IA группе сверху вниз увеличиваются радиусы атомов, при отдаче электронов с внешнего уровня образуются катионы. Естественно, что степень окисления у этих элементов не изменяется, а основный характер оксидов усиливается.
Если
рассмотреть изменение свойств оксидов элементов по периоду на примере элементов
3 периода, то следует отметить, что в атомах этих элементов количество
энергетических уровней одинаковое, но степень окисления изменяется, то есть она
возрастает, а радиус иона уменьшается, поэтому характер оксидов изменяется от
основного через амфотерные к кислотному.
Например, оксиды и гидроксиды щелочных и щелочноземельных металлов проявляют ярко выраженные основные свойства, а уже оксид алюминия проявляют амфотерные свойства.
Так, оксид натрия – это основный оксид, поэтому он будет реагировать с кислотными и амфотерными оксидами, с кислотами. Например, в реакции оксида натрия с оксидом углерода (IV) образуется соль – карбонат натрия, в реакции оксида натрия с соляной кислотой образуется соль – хлорид натрия и вода.
По группе сверху вниз металлические свойства s- и p-элементов усиливаются, поэтому усиливаются и основные свойства их оксидов.
Например,
в группе II A оксид бериллия проявляет амфотерные свойства, поэтому он
легко растворяется в растворах кислот и щелочей. Например, в реакции оксида
бериллия с соляной кислотой образуется соль – хлорид бериллия и вода, в реакции
оксида бериллия с раствором гидроксида натрия образуется комплексная соль –
тетрагидроксобериллат натрия.
Соединения бария и радия имеют уже ярко выраженные основные свойства, поэтому они будут реагировать с кислотными и амфотерными оксидами, а также с кислотами. Так, в реакции оксида бария с азотной кислотой образуется соль – нитрат бария и вода.
Характер гидроксида зависит также от степени окисления и радиуса иона. Чем больше степень окисления, тем меньше радиус иона.
Поэтому в ряду от гидроксида натрия до гидроксида алюминия идёт ослабление основных свойств и усиление кислотных, так как возрастает степень окисления и уменьшается радиус иона.
Например, в I A группе сверху вниз увеличивается радиус иона, степень окисления не изменяется, поэтому усиливаются основные свойства. В ряду от гидроксида лития до гидроксида цезия основные свойства будут усиливаться.
Переходные элементы, расположенные в малых периодах – это Be, Al образуют оксиды и гидроксиды, проявляющие амфотерные свойства.
Получим
гидроксид алюминия и исследуем его свойства. Сначала в растворимую соль
алюминия добавим щелочь, в результате у нас образуется осадок – это гидроксид
алюминия.
Сначала в растворимую соль
алюминия добавим щелочь, в результате у нас образуется осадок – это гидроксид
алюминия.
Затем разделим этот осадок на две части: к первой части добавим соляную кислоту, осадок растворяется из-за образования растворимой соли – хлорида алюминия. Ко второй части осадка добавим гидроксид калия – осадок также растворяется, потому что образуется растворимая соль – тетрагидроксоалюминат калия.
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + KOH = K[Al(OH)4]
Амфотерные оксиды и гидроксиды вступают в реакции не только с растворами щелочей, но и с твёрдыми основаниями при сплавлении.
Например,
при сплавлении гидроксида хрома (III) с гидроксидом
калия образуется соль – метахромит калия и вода, при сплавлении гидроксида
хрома (III) с оксидом калия образуется метахромит калия
и вода, при сплавлении гидроксида хрома (III) с
карбонатом калия также образуется соль метахромит калия, вода и углекислый газ.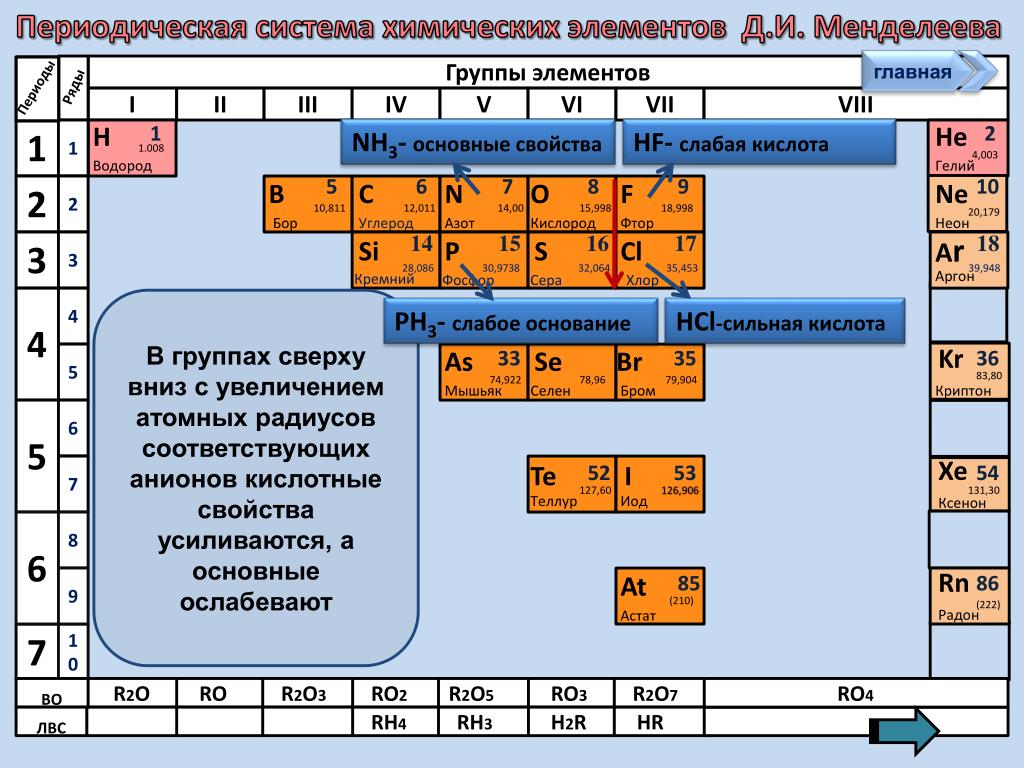
Аналогично оксид и гидроксид алюминия ведёт себя: при сплавлении оксида алюминия и гидроксида калия образуется соль – металюминат калия и вода, при сплавлении гидроксида алюминия и гидроксида калия образуется соль – метаалюминат калия и вода.
Оксид и гидроксид бериллия также проявляет амфотерные свойства, потому что они реагирует с кислотами, щелочами. Так, в реакции оксида бериллия с соляной кислотой образуется соль – хлорид бериллия и вода, в реакции гидроксида бериллия и серной кислоты образуется соль – сульфат бериллия и вода.
Большое влияние на кислотно-основные свойства оксидов и гидроксидов d-элементов оказывает степень окисления металла, поэтому с увеличением степени окисления металла кислотные свойства соответствующего оксида и гидроксида усиливаются. Например, хром образует оксиды и гидроксиды, в которых атомы хрома проявляют степени окисления +2, +3 и +6.
В
оксиде CrO и гидроксиде Cr(OH)2 степень окисления
хрома +2, поэтому этот оксид и гидроксид будут проявлять основные свойства. В оксиде Cr2O3
и гидроксиде Cr(OH)3
окисления хрома +3, поэтому оксид и гидроксид в этой степени окисления будут
проявлять амфотерные свойства, в оксиде CrO3
и гидроксиде H2CrO4
степень окисления хрома +6 – это высшая степень окисления для атома хрома,
поэтому этот оксид и гидроксид проявляют кислотные свойства.
В оксиде Cr2O3
и гидроксиде Cr(OH)3
окисления хрома +3, поэтому оксид и гидроксид в этой степени окисления будут
проявлять амфотерные свойства, в оксиде CrO3
и гидроксиде H2CrO4
степень окисления хрома +6 – это высшая степень окисления для атома хрома,
поэтому этот оксид и гидроксид проявляют кислотные свойства.
Тоже
самое наблюдается и в соединениях марганца. Например, в оксиде MnO и в гидроксиде Mn(OH)2 степень окисления марганца +2 – это низшая
степень оксиления, поэтому эти соединения проявляют основные свойства, в
оксиде MnO2 и гидроксиде Mn(OH)4 марганец имеет степень окисления равную +4 –
это промежуточная степень окисления, поэтому эти соединения будут проявлять амфотерные
свойства. Если у марганца будет степень окисления +6 или +7, то его оксиды
и гидроксиды будут проявлять кислотные свойства. Это такие оксиды, как MnO3 и Mn2O7, а также их гидроксиды H2MnO4 и HMnO4.
Таким образом, с увеличением степени окисления металла происходит уменьшение радиуса иона металла, свойства оксидов и гидроксидов металлов изменяются от основных через амфотерные к кислотным.
Урок по теме «Свойства оксидов и гидроксидов элементов III периода»
Цель урока: Изучить свойства оксидов и гидроксидов элементов III периода.
Задачи урока.
- Образовательная. Используя проблемно-интегративный подход к обучению с применением исследовательского эксперимента, направить поисковую деятельность учащихся на установление закономерности в изменении свойств оксидов и гидроксидов элементов III периода, сформировать понятие об амфотерности.
- Воспитательная. Формировать научное мировоззрение, творчество мышления, радость познания.
- Развивающая. Развить познавательную активность, интеллектуальные способности и логическое мышление учащихся.

Оборудование:Таблицы «Периодическая система химических элементов Д.И Менделеева», «Растворимость кислот и оснований в воде», «Относительная электроотрицательность элементов». Компьютеры, мультимедийный проектор. Демонстрационный штатив с пробирками, капельница.
Химреактивы: Гидроксиды элементов III периода, индикаторы, соляная кислота, раствор хлорида алюминия.
Ход урока I этап. Актуализация опорных знаний учащихся.Использую наиболее традиционный вариант реализации этого этапа – фронтальную беседу с применением необходимых средств наглядности, исследовательский эксперимент, выполнение упражнений.
Проецируем на экран вопросы, на которые учащиеся должны ответить:
- Что такое ионная связь? Приведите примеры веществ с ионной связью.
- Что такое ковалентная связь? Назовите два вида ковалентной связи. Приведите примеры.
- Как вы понимаете термин «Относительная электроотрицательность элементов»? Электроотрицательность какого элемента условно принята за единицу?
- Как изменяется электроотрицательность элементов в периодах с увеличением порядковых номеров элементов, в А – подгруппах?
- Свяжите понятия «Электроотрицательность» и «Химическая связь».
- Как изменяются размеры атомов в периодах с увеличением порядковых номеров элементов?
После повторения предлагаю учащимся составить формулы оксидов элементов III периода и определить вид химической связи в каждом случае:
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 |
Отдельным учащимся заранее предложена работа на компьютерах по составлению электронных формул оксидов с ионной и ковалентной связью.
| Na2+ []2- | Mg2+ []2- | |
| ионная связь | ионная связь | |
| ковалентная полярная связь | ковалентная полярная связь |
После проекции этих формул на экран предлагаю учащимся определить характер данных оксидов: (оксиды натрия и магния – основные по характеру, оксиды фосфора (V) и хлора (VII) – кислотные).
Формулируем вывод по данной части работы: основные оксиды – ионные соединения, кислотные оксиды – ковалентные.
Используя опорный конспект (приложение 1), предлагаю учащимся охарактеризовать свойства основных и кислотных оксидов, выполнив упражнение:
| 1) MgO + HCl → | 2) SO3 + NaOH→ | |
| 3) Na2O + H2O→ | 4) P2O5+H2O→ |
Акцентирую внимание учащихся на то, что основные оксиды взаимодействуют с кислотами, кислотные — со щелочами с образованием соли и воды. При взаимодействии основных оксидов элементов I-A и II – А групп образуются гидроксиды — щелочи. При взаимодействии кислотных оксидов с водой образуются гидроксиды – кислоты.
?Что же такое гидроксид? (Это продукт соединения оксида с водой)
Учитель. Однако не все гидроксиды можно получить реакцией оксида с водой. Например,
Например,
SiO2+ H2O ≠ реакция не идет
Al2O3+ H2O ≠ реакция не идет
Гидроксид кремния (кремниевую кислоту) и гидроксид алюминия получают другими способами. Об этом мы поговорим несколько позже.
Далее предлагаю учащимся продолжить работу над схемой: под формулами оксидов элементов III периода записать формулы их гидроксидов.
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 | ||||||
| NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 |
По таблице «Растворимость кислот, оснований и солей в воде» определяем растворимость гидроксидов в воде.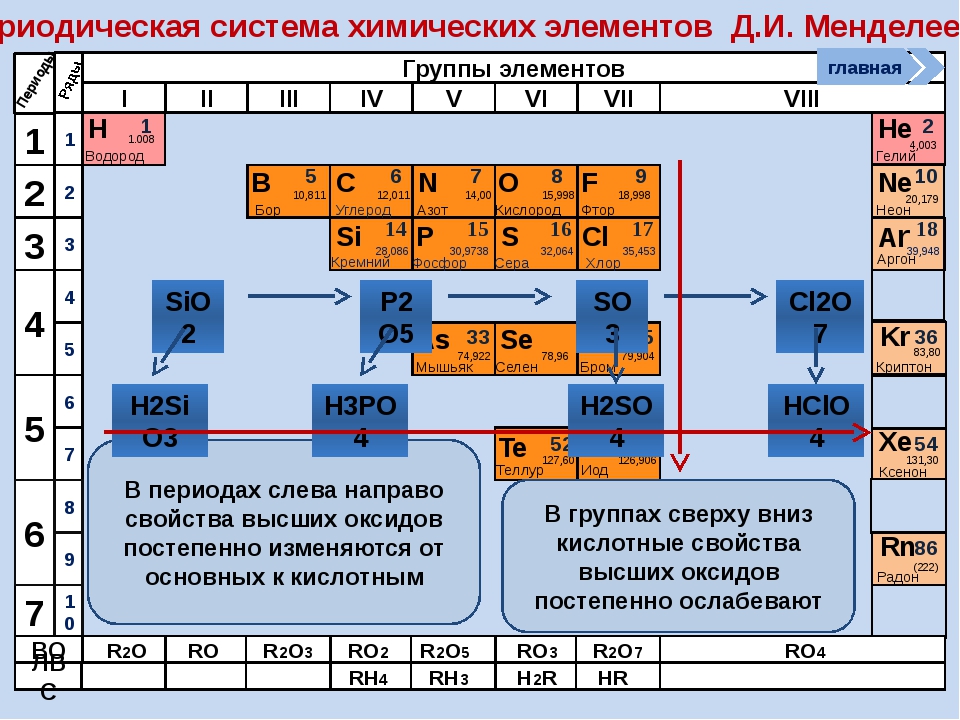
? С помощью каких веществ можно доказать принадлежность гидроксида к основаниям или кислотам?
Учащиеся вспоминают, что для этого есть индикаторы.
Предлагаю испытать раствором лакмуса каждый из предложенных гидроксидов:
| NaOH | Mg(OH)2 | H3PO4 | H2SO4 |
По ходу проведения опытов учащиеся комментируют их и делают вывод, что в растворах гидроксидов металлов фиолетовый лакмус изменяет окраску в синий цвет, а в растворах кислот – в красный. Составляем уравнение электролитической диссоциации щелочи и кислоты.
NaOH ↔ Na++OH— (образуется гидроксид –ион, изменяющий окраску лакмуса в синий цвет)
H2SO4+H2O↔H3O++HSO4— (образуется ион оксония, т.е. гидратированный протон Н+(Н2О), изменяющий окраску лакмуса в красный цвет).
Учитель. Подумайте, почему я не предложила испытать индикатором гидроксиды кремния и алюминия? (Они не растворимы в воде).
Предлагаю продолжить работу со схемой, отметив характер гидроксидов их растворимость в воде.
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 | ||||||
| NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 | ||||||
| Щелочь | Малораств. основание |
Нерастворимые вещества | растворимые кислоты | |||||||||
В процессе беседы устанавливаем закономерность изменения свойств гидроксидов:
- Какое основание сильнее NaOH или Mg(OH)2
- Сравните силу кислот как электролитов. Назовите самую слабую из них и самую сильную.
- Отметьте на схеме, как изменяются основные и кислотные свойства гидроксидов с увеличением порядковых элементов III периода
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 | ||||||
| NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 | ||||||
| Щелочь | Малораств. основание |
Нерастворимые вещества | растворимые кислоты | |||||||||
| Основные свойства ослабевают —> | кислотные свойства усиливаются —> | |||||||||||
Почему основные свойства гидроксидов элементов III периода ослабевают, а кислотные – усиливаются?
IV этап. Решение учебной проблемы.Учитель. Попытаемся найти ответ на этот вопрос, используя знания об относительной электроотрицательности элементов, видах химической связи и сравнивая размеры атомов (ионов).
Проецируем на экран электронные формулы гидроксидов элементов III периода (приложение 2).
Путем фронтальной беседы по вопросам, приведенным ниже, устанавливаем, почему гидроксид натрия обладает большим основным характером, чем гидроксид магния.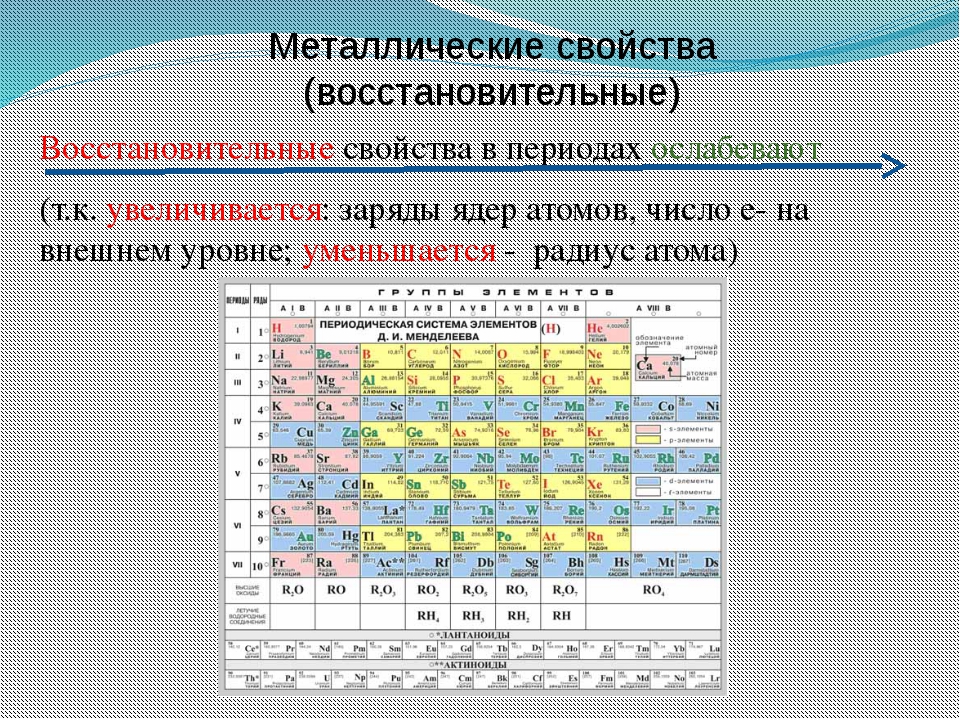
- Из каких частиц состоят эти вещества? (Из катионов металла и гидроксид-анионов)
- Какая связь образуется между ионами? (ионная).
- Составьте уравнение реакции диссоциации гидроксида натрия.
- Почему химическая связь разрывается между натрием и кислородом?
Учитель. Кислород – сильноэлектроотрицательный элемент, он оттягивает электронную плотность связи с натрием на себя, атом натрия превращается в ион. Кроме того, ион натрия имеет большой размер (обращаю внимание учащихся на рисунок 18.7 в учебнике Л.С. Гузей), следовательно, длина связи натрия с кислородом большая, поэтому связь слабая. Этим объясняется хорошая растворимость гидроксида натрия и распад электролита на ионы с освобождение гидроксид-аниона. - Сравните размеры ионов натрия и магния, а также величины из зарядов.
Учащиеся дают ответ, что размер иона натрия больше, а величина заряда иона натрия меньше, чем у иона магния.
- Подумайте, в каком случае будет прочнее связь: между катионом натрия и гидроксид-анионом, или между катионом магния и гидроксид-анионом? Почему?
Учащиеся находят правильный ответ: между катионом магния и гидроксид-анионом связь более прочная, т.к. заряд катиона магния больше, а размер меньше. Поэтому способность катиона магния удерживать гидроксид-анион больше, т.е. процесс распада его как электролита затруднен по сравнению с гидроксидом натрия. Гидроксид магния более слабое и мене растворимое основание, чем гидроксид натрия. - Что же тогда можно сказать о свойстве гидроксида алюминия? (По причине увеличения заряда катиона алюминия Al3+ и уменьшения его размера отрыв гидроксид-аниона еще более затруднен. Гидроксид алюминия нерастворимое и малодиссоциирующее в воде вещество).
Получение гидроксида алюминия и исследование его свойств.
Предлагаю учащимся получить гидроксид алюминия реакцией ионного обмена. Подбираем вещества, проводим опыт, составляем уравнение реакций:
Подбираем вещества, проводим опыт, составляем уравнение реакций:
Al3++3OH— =Al (OH)3↓ (это нерастворимое в воде основание)
Прошу исследовать свойства гидроксида алюминия:
1) В одну пробирку со свежеосажденным гидроксидом алюминия добавляем раствор соляной кислоты – наблюдаем растворение осадка. Составляем уравнения реакций:
Al(OH)3+3HCl= AlCl3+3H2O
Al(OH)3+3H+=Al3++3H2O
Делаем вывод, что гидроксид алюминия проявил себя, как основание.
2) В другую пробирку с гидроксидом алюминия добавляем раствор щелочи – наблюдаем растворение осадка. В этом случае гидроксид алюминия проявил свойства кислоты. Подумайте, как это можно объяснить? Сопоставьте размеры ионов магния и алюминия, величины их зарядов, а также относительные электроотрицательности элементов.
Учащиеся отмечают, что размер катиона алюминия меньше размера катиона магния, а величина заряда и электроотрицательность – больше, чем у магния.
? К чему это приводит? (К уменьшению заряда на атоме кислорода гидроксогруппы, и, следовательно, к облегчению отщепления катиона водорода. Вот почему гидроксид алюминия проявляет свойства кислоты).
Учитель. Существует кислотная форма гидроксида алюминия HAlO2 – металюминиевая кислота. Это очень слабая кислота, но она взаимодействует со щелочью с образованием соли и воды:
Таким образом, гидроксид алюминия проявляет как свойства основания, так и свойства кислоты, т. е. является амфолитом или амфотерным соединением (вносим эту информацию в схему).
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 | ||||||
| NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 | ||||||
| Щелочь | Малораств. основание |
Нерастворимые вещества | растворимые кислоты | |||||||||
| амфотерный гидроксид |
||||||||||||
| Основные свойства ослабевают —> | кислотные свойства усиливаются —> | |||||||||||
Учитель. Теперь ответим на вопрос, почему кислотные свойства гидроксидов элементов III периода усиливаются.
Провожу беседу по вопросам:
-
Как вы считаете, в молекулах кислот связи ковалентные или ионные? (ковалентные полярные).
-
Почему они полярные? (Соединяются элементы с различной электроотрицательностью).

-
Сравните значение относительных электроотрицательностей элементов Si, P, S, Cl. Как они изменяются? (увеличиваются). Обратите внимание на значение относительной электроотрицательности элемента кислорода (оно больше, чем у Si, P, S, Cl)
Связь считается боле полярной, если разность значений электротрицательностей соединяющихся элементов больше. -
Определите, в какой из кислот степень полярности ковалентной связи атома неметалла с атомом кислорода больше: в кремниевой или в фосфорной?
Учащиеся путем простого подсчета приходят к выводу: что связь атомов кремния и кислорода более полярная.
Учитель. Электронная плотность связи кремния с кислородом сильно смещена к атому кислорода, поэтому он приобретает большой отрицательный заряд. По этой причине атом водорода сильно притягивается к атому кислорода, что делает связь О-Н более прочной. Это препятствует процессу диссоциации. Кремниевая кислота практически не диссоциирует на ионы и в воде нерастворима.
Кремниевая кислота практически не диссоциирует на ионы и в воде нерастворима. -
Как изменяется полярность связи Р-О в молекуле фосфорной кислоты?
Учащиеся отвечают, что она уменьшается, т. е. электронная плотность на атоме кислорода становится меньше, прочность связи атомов кислорода и водорода ослабевает. -
Как это влияет на свойства фосфорной кислоты?
Учащиеся отвечают, что фосфорная кислота электролит средней силы и в воде растворяется.
Н3РО4+Н2О ↔ Н3О++Н2РО4—
Учитель. Считаю, что теперь вы сможете ответить на вопрос, почему серная и хлорная кислоты являются сильными электролитами. Покажите смещение электронной плотности связей на электронных формулах и объясните, почему серная кислота сильнее фосфорной.
Теперь мы ответили на вопрос, почему кислотные свойства гидроксидов элементов III периода усиливаются.
Такая же закономерность в изменении свойств характерна и для оксидов
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 | ||||||
| Основные оксиды | амфотерный гидроксид |
кислотные оксиды | ||||||||||
Обсужденные закономерности наблюдаются во всех периодах периодической системы химических элементов:
При переходе от элемента к элементу слева направо по периоду свойства их оксидов и гидроксидов закономерно меняются от основных через амфотерные к кислотным.
На данном этапе считаю целесообразным выполнение тестовых заданий, чтобы учащиеся могли применять на практике только что усвоенную информацию (приложение 3)
VI этап. Рефлексия. Оценка деятельности класса.Подвожу итог урока. Отмечаю, что учащиеся с помощью применения ранее приобретенных знаний и проведенных исследований пытались овладеть самым главным в процессе познания – умением находить истину.
Даю оценку деятельности учащихся и объясняю домашнее задание.
Приложения
Периодические тренды и оксиды
Оксиды
Основные оксиды
Оксид-ион является очень сильно основным анионом из-за его очень малого размера и высокого заряда. Поскольку ион гидроксида является самым сильным основанием, которое может сохраняться в воде, ион оксида количественно реагирует с водой с образованием ионов гидроксида. Это пример выравнивающего свойства очень прочных оснований.
Это пример выравнивающего свойства очень прочных оснований. Согласно обобщенным правилам растворимости, в воде растворяются только оксиды металлов некислотного и слабокислотного катиона.Растворение является сильно экзотермическим с образованием гидроксида катиона. Эти водные растворы являются сильно щелочными. Оксиды металлов, которые проявляют такое поведение, называются основными оксидами, потому что они действуют как основания. Оксиды некислотных катионов настолько реагируют с водой, что их редко можно увидеть. Эти оксиды нельзя получить путем обезвоживания гидроксида при высокой температуре.
Более распространены оксиды слабокислых катионов. Например, известь, CaO. Известь можно получить в промышленных масштабах путем термического разложения известняка.
Оксиды слабокислых катионов экзотермически реагируют с водой с образованием гидроксида.
Гидроксиды слабокислых катионов не расплываются.
Оксиды слабокислых катионов и умереннокислых катионов нерастворимы в воде. Эти оксиды не вносят в раствор значительных количеств иона O 2-, поэтому ионы гидроксида не образуются. Хотя эти оксиды существенно не изменяют рН воды, они все же являются основаниями и нейтрализуют сильные кислоты.
Эти оксиды не вносят в раствор значительных количеств иона O 2-, поэтому ионы гидроксида не образуются. Хотя эти оксиды существенно не изменяют рН воды, они все же являются основаниями и нейтрализуют сильные кислоты.
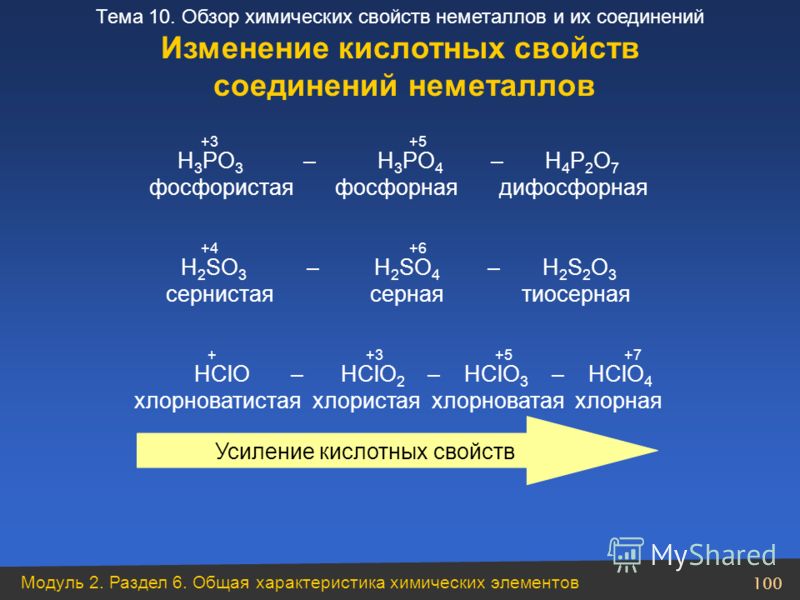
Оксиды кислот (ангидриды кислот)
Многие из ковалентных оксидов очень кислых катионов (гипотетических) проявляют кислотные свойства. Многие из этих оксидов растворяются в воде с образованием оксоаниона, в котором элемент имеет ту же степень окисления, что и оксид. Оксид будет растворим, если при его реакции с водой образуется сильная или очень сильная кислота, поскольку эти кислоты полностью ионизируются, сдвигая равновесие в сторону растворения.Если реакция с водой дает умеренно кислую оксокислоту, оксид может быть или не быть растворимым. Если образующаяся оксокислота является слабокислой, оксид обычно, но не всегда, нерастворим в воде.Некоторые кислотные оксиды, такие как оксиды серы и азота, загрязняют воздух, потому что они реагируют с влагой в воздухе, вызывая кислотные дожди.

Нерастворимые в воде оксиды классифицируются как кислотные, если они реагируют с основаниями с образованием солей.
Есть несколько оксидов, таких как NO 2 и ClO 2 , в которых центральный атом степень окисления не соответствует степени окисления этого элемента в стабильном или известная оксокислота.Такие оксиды при диспропорционировании образуют смесь оксокислот или анионов.
Оксиды амфотерные
Некоторые оксиды проявляют как кислотные, так и основные свойства.Общие правила
В общем, электроположительный характер центрального атома оксида будет определять, будет ли оксид будет кислотным или основным. Чем более электроположителен центральный атом, тем более основным является оксид.Чем более электроотрицательным является центральный атом, тем более кислым является оксид. Электроположительный характер увеличивается справа влево по периодической таблице и увеличивается вниз по столбцу.Результирующая граница между основными и кислотными оксидами проходит по диагонали.

| Свойства с — и р — Блочные элементы | ||||||
| Ли | Быть | Б | С | Н | О | Ф |
| Нет данных | мг | Ал | Си | Р | С | Кл |
| К | Са | Га | Гэ | Как | Se | Бр |
| Руб | Старший | В | Сн | Сб | Те | я |
| Цз | Ба | Тл | Пб | Би | По | В |
| Основные оксиды | Амфотерные оксиды | Кислотные оксиды | ||||
Есть три оксида неметаллов из верхней правой части периодической таблицы, CO, NO и N 2 O, которые имеют
такие низкие степени окисления центрального атома, что они дают нейтральные водные растворы.
Поскольку кислотность катиона быстро возрастает с увеличением заряда, d — блокируют элементы, которые проявляют широкий спектр степеней окисления, могут иметь один или несколько оксидов, проявляющих только основные свойства и один или несколько оксидов, проявляющих только кислотные свойства. Чем выше степень окисления тем более кислый соответствующий оксид. Хром является примером такого элемента.
| Оксид | Номер окисления | Категория |
| CrO | Кр 2+ | базовый |
| Кр 2 О 3 | Кр 3+ | амфотерный |
| CrO 3 | Кр 6+ | кислая |
Основные оксиды реагируют с кислыми оксидами с образованием солей оксоанионов.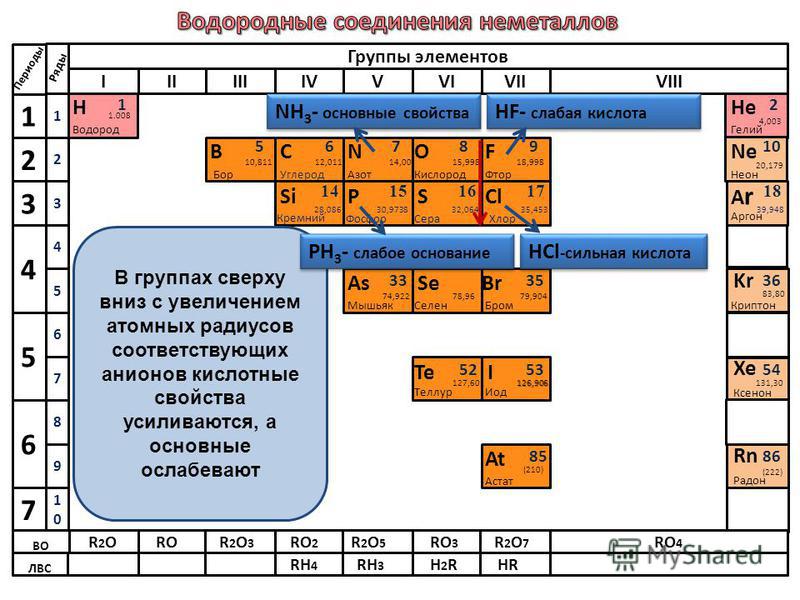
Поскольку вода не содержит солей оксо-анионов, которые являются слишком основными, чтобы сохраняться в может образовываться вода. Эти реакции кислотных и основных анионов имеют важное практическое значение. применения, такие как контроль газообразных кислотных оксидов, которые при выбросе в атмосферу приводят к кислотным дождям. Ca(OH) 2 + SO 2 + 1/2 O 2 CaSO 4 + H 2 O
Эти реакции также используются в производстве таких материалов, как бетон, стекло и керамика.
Периодические изменения свойств элементов – химия
OpenStaxCollege
[латексная страница]
Цели обучения
К концу этого раздела вы сможете:
- Опишите и объясните наблюдаемые тенденции в размерах атомов, энергии ионизации и сродстве элементов к электрону
Элементы в группах (вертикальных столбцах) периодической таблицы демонстрируют сходное химическое поведение. Это сходство возникает из-за того, что члены группы имеют одинаковое количество и распределение электронов в своих валентных оболочках.Однако в периодической таблице есть и другие закономерности химических свойств. Например, по мере продвижения вниз по группе металлический характер атомов возрастает. Кислород в верхней части группы 16 (6А) представляет собой бесцветный газ; в середине группы селен — твердое полупроводниковое вещество; а внизу полоний — серебристо-серое твердое вещество, проводящее электричество.
Это сходство возникает из-за того, что члены группы имеют одинаковое количество и распределение электронов в своих валентных оболочках.Однако в периодической таблице есть и другие закономерности химических свойств. Например, по мере продвижения вниз по группе металлический характер атомов возрастает. Кислород в верхней части группы 16 (6А) представляет собой бесцветный газ; в середине группы селен — твердое полупроводниковое вещество; а внизу полоний — серебристо-серое твердое вещество, проводящее электричество.
Проходя период слева направо, мы добавляем протон к ядру и электрон к валентной оболочке с каждым последующим элементом.По мере того, как мы спускаемся по элементам в группе, число электронов на валентной оболочке остается постоянным, но главное квантовое число каждый раз увеличивается на единицу. Понимание электронной структуры элементов позволяет нам изучить некоторые свойства, определяющие их химическое поведение. Эти свойства периодически меняются по мере изменения электронной структуры элементов. Это (1) размер (радиус) атомов и ионов, (2) энергия ионизации и (3) сродство к электрону.
Это (1) размер (радиус) атомов и ионов, (2) энергия ионизации и (3) сродство к электрону.
Изучите визуализацию периодических тенденций, обсуждаемых в этом разделе (и многих других тенденций).Всего несколькими щелчками мыши вы можете создавать трехмерные версии периодической таблицы, показывающие размер атомов или графики энергий ионизации для всех измеренных элементов.
Квантово-механическая картина затрудняет установление определенного размера атома. Однако существует несколько практических способов определения радиуса атомов и, таким образом, определения их относительных размеров, дающих примерно одинаковые значения. Мы будем использовать ковалентный радиус ([ссылка]), который определяется как половина расстояния между ядрами двух одинаковых атомов, когда они соединены ковалентной связью (это измерение возможно, потому что атомы внутри молекул все еще сохраняют большую часть своего атомная идентичность).Мы знаем, что при просмотре группы главное квантовое число n увеличивается на единицу для каждого элемента. Таким образом, электроны добавляются в область пространства, которая все больше удаляется от ядра. Следовательно, размер атома (и его ковалентный радиус) должен увеличиваться по мере того, как мы увеличиваем расстояние от самых удаленных электронов от ядра. Эта тенденция проиллюстрирована для ковалентных радиусов галогенов в [ссылка] и [ссылка]. Тенденции для всей таблицы Менделеева можно увидеть в [ссылка].
Таким образом, электроны добавляются в область пространства, которая все больше удаляется от ядра. Следовательно, размер атома (и его ковалентный радиус) должен увеличиваться по мере того, как мы увеличиваем расстояние от самых удаленных электронов от ядра. Эта тенденция проиллюстрирована для ковалентных радиусов галогенов в [ссылка] и [ссылка]. Тенденции для всей таблицы Менделеева можно увидеть в [ссылка].
| Ковалентные радиусы элементов группы галогенов | ||
|---|---|---|
| Атом | Ковалентный радиус (пм) | Ядерный заряд |
| Ф | 64 | +9 |
| Класс | 99 | +17 |
| Бр | 114 | +35 |
| я | 133 | +53 |
| В | 148 | +85 |
(а) Радиус атома определяется как половина расстояния между ядрами в молекуле, состоящей из двух одинаковых атомов, соединенных ковалентной связью. Атомный радиус галогенов увеличивается вниз по группе по мере увеличения n . (b) Ковалентные радиусы элементов показаны в масштабе. Общая тенденция заключается в том, что радиусы увеличиваются вниз по группе и уменьшаются по периоду.
Атомный радиус галогенов увеличивается вниз по группе по мере увеличения n . (b) Ковалентные радиусы элементов показаны в масштабе. Общая тенденция заключается в том, что радиусы увеличиваются вниз по группе и уменьшаются по периоду.
Внутри каждого периода тренд атомного радиуса уменьшается по мере увеличения Z ; например, от К до Кр. Внутри каждой группы (например, щелочные металлы, показанные фиолетовым) наблюдается тенденция к увеличению атомного радиуса по мере увеличения Z .
Как показано в [ссылка], при движении по периоду слева направо мы обычно обнаруживаем, что каждый элемент имеет меньший ковалентный радиус, чем предшествующий ему элемент. Это может показаться нелогичным, поскольку подразумевает, что атомы с большим количеством электронов имеют меньший атомный радиус. Это можно объяснить с помощью концепции эффективного заряда ядра Z эфф .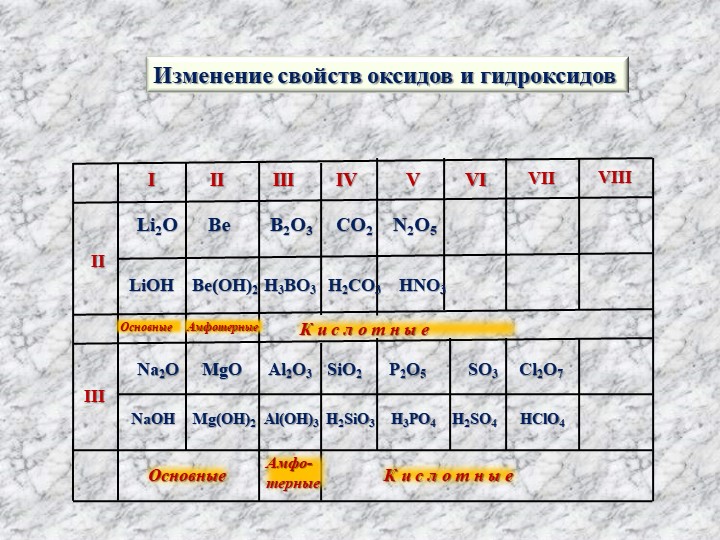 Это притяжение, оказываемое ядром на конкретный электрон с учетом любых электрон-электронных отталкиваний.У водорода есть только один электрон, поэтому заряд ядра ( Z ) и эффективный заряд ядра ( Z эфф ) равны. Для всех других атомов внутренние электроны частично экранируют внешние электроны от притяжения ядра, и, таким образом:
Это притяжение, оказываемое ядром на конкретный электрон с учетом любых электрон-электронных отталкиваний.У водорода есть только один электрон, поэтому заряд ядра ( Z ) и эффективный заряд ядра ( Z эфф ) равны. Для всех других атомов внутренние электроны частично экранируют внешние электроны от притяжения ядра, и, таким образом:
\({Z}_{\text{eff}}=Z-экранирование\)
Экранирование определяется вероятностью того, что другой электрон окажется между интересующим электроном и ядром, а также электрон-электронным отталкиванием, с которым сталкивается интересующий электрон.Электроны ядра умеют экранировать, в то время как электроны в одной и той же валентной оболочке не так эффективно блокируют ядерное притяжение, которое испытывают друг друга. Таким образом, каждый раз, когда мы переходим от одного элемента к другому в течение периода, Z увеличивается на единицу, но экранирование увеличивается лишь незначительно. Таким образом, Z эфф увеличивается, когда мы движемся слева направо по периоду. Более сильное притяжение (более высокий эффективный ядерный заряд), испытываемое электронами в правой части периодической таблицы, притягивает их ближе к ядру, уменьшая ковалентные радиусы.
Таким образом, Z эфф увеличивается, когда мы движемся слева направо по периоду. Более сильное притяжение (более высокий эффективный ядерный заряд), испытываемое электронами в правой части периодической таблицы, притягивает их ближе к ядру, уменьшая ковалентные радиусы.
Таким образом, как и следовало ожидать, самые внешние или валентные электроны удалить легче всего, потому что они имеют самые высокие энергии, больше экранированы и находятся дальше всего от ядра. Как правило, когда репрезентативные элементы образуют катионы, они делают это за счет потери нс или нп электронов, которые были добавлены последними в процессе Ауфбау. Переходные элементы, с другой стороны, теряют 90 245 нс 90 246 электронов до того, как они начинают терять ( 90 245 n 90 246 – 1) 90 245 d 90 246 электронов, хотя 90 245 нс 90 246 электронов добавляются первыми, согласно принципу Ауфбау.
Sorting Atomic Radii
Предсказать порядок увеличения ковалентного радиуса для Ge, Fl, Br, Kr.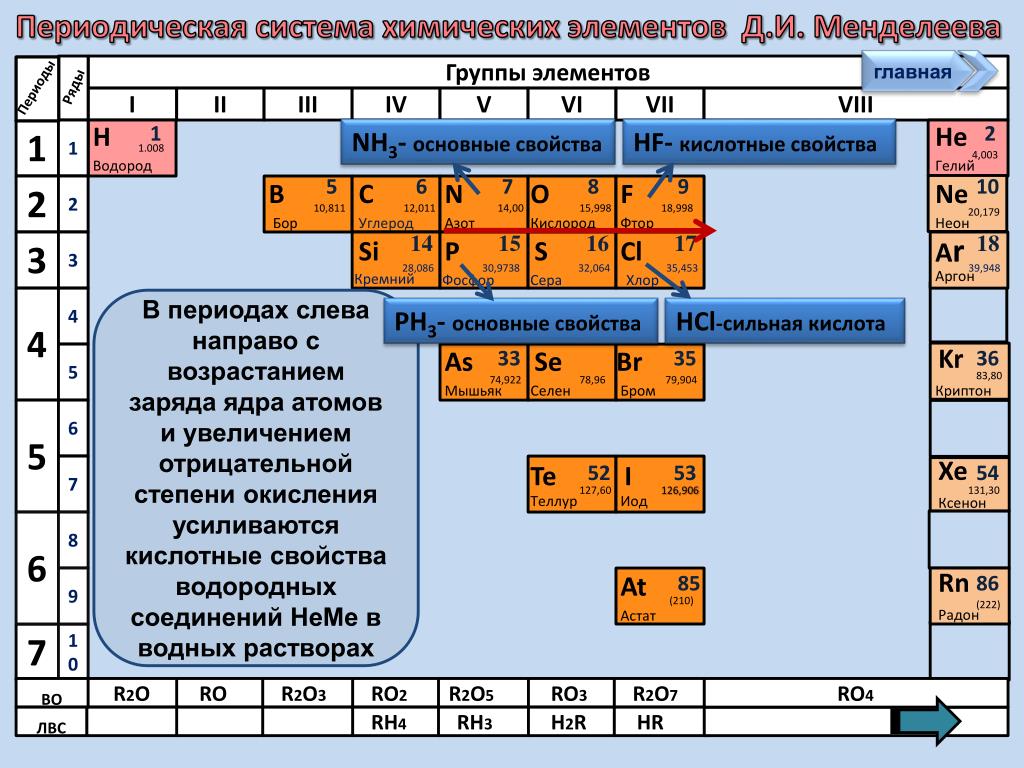
Решение
Радиус увеличивается по мере продвижения вниз по группе, поэтому Ge < Fl (Примечание: Fl — это символ флеровия, элемента 114, а НЕ фтора). Радиус уменьшается по мере продвижения по периоду, поэтому Kr < Br < Ge. Складывая тренды, получаем Kr < Br < Ge < Fl.
Проверьте свои знания
Приведите пример атома, размер которого меньше размера фтора.
Ионный радиус — это мера, используемая для описания размера иона. У катиона всегда меньше электронов и такое же количество протонов, как у родительского атома; он меньше атома, из которого он получен ([ссылка]). Например, ковалентный радиус атома алюминия (1 S 2 2 S 2 2 P 6 3 S 2 3 P 1 ) 118 вечера , тогда как ионный радиус Al 3+ (1 s 2 2 s 2 2 p 6 ) составляет 68 пм. Когда электроны удаляются с внешней валентной оболочки, оставшиеся электроны ядра, занимающие меньшие оболочки, испытывают больший эффективный ядерный заряд Z eff (как обсуждалось) и притягиваются еще ближе к ядру.
Когда электроны удаляются с внешней валентной оболочки, оставшиеся электроны ядра, занимающие меньшие оболочки, испытывают больший эффективный ядерный заряд Z eff (как обсуждалось) и притягиваются еще ближе к ядру.
Радиус катиона меньше, чем у родительского атома (Al), из-за потерянных электронов; радиус аниона больше, чем у исходного (S), из-за полученных электронов.
Катионы с большим зарядом меньше катионов с меньшим зарядом (например,g., V 2+ имеет ионный радиус 79 пм, а V 3+ — 64 пм). Проходя вниз по группам периодической таблицы, мы обнаруживаем, что катионы последовательных элементов с одинаковым зарядом обычно имеют больший радиус, соответствующий увеличению главного квантового числа n .
Анион (отрицательный ион) образуется путем присоединения одного или нескольких электронов к валентной оболочке атома. Это приводит к большему отталкиванию электронов и уменьшению Z эфф на электрон. Оба эффекта (увеличение количества электронов и уменьшение Z эфф ) приводят к тому, что радиус аниона становится больше, чем у родительского атома ([ссылка]). Например, атом серы ([Ne]3 s 2 3 p 4 ) имеет ковалентный радиус 104 пм, тогда как ионный радиус сульфидного аниона ([Ne]3 s 2 3 p 6 ) составляет 170 часов. Для последовательных элементов, идущих вниз по любой группе, анионы имеют большие главные квантовые числа и, следовательно, большие радиусы.
Оба эффекта (увеличение количества электронов и уменьшение Z эфф ) приводят к тому, что радиус аниона становится больше, чем у родительского атома ([ссылка]). Например, атом серы ([Ne]3 s 2 3 p 4 ) имеет ковалентный радиус 104 пм, тогда как ионный радиус сульфидного аниона ([Ne]3 s 2 3 p 6 ) составляет 170 часов. Для последовательных элементов, идущих вниз по любой группе, анионы имеют большие главные квантовые числа и, следовательно, большие радиусы.
Атомы и ионы, имеющие одинаковую электронную конфигурацию, называются изоэлектронными. Примерами изоэлектронных частиц являются N 3–, O 2–, F –, Ne, Na + , Mg 2+ и Al 3+ 2 1 9014 6 с 2 2 р 6 ).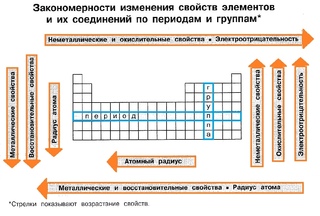 Другим изоэлектронным рядом является P 3–, S 2–, Cl –, Ar, K + , Ca 2+ и Sc 3+ ([Ne]3 s 3 р 6 ).Для атомов или ионов, которые являются изоэлектронными, количество протонов определяет размер. Чем больше заряд ядра, тем меньше радиус в ряду изоэлектронных ионов и атомов.
Другим изоэлектронным рядом является P 3–, S 2–, Cl –, Ar, K + , Ca 2+ и Sc 3+ ([Ne]3 s 3 р 6 ).Для атомов или ионов, которые являются изоэлектронными, количество протонов определяет размер. Чем больше заряд ядра, тем меньше радиус в ряду изоэлектронных ионов и атомов.
Количество энергии, необходимое для удаления наиболее слабо связанного электрона из атома газа в его основном состоянии, называется его первой энергией ионизации (IE 1 ). Первая энергия ионизации элемента X — это энергия, необходимая для образования катиона с зарядом +1:
.\(\text{X}\left(g\right)\phantom{\rule{0.{-}\phantom{\rule{2em}{0ex}}{\text{IE}}_{2}\)
Энергия, необходимая для удаления третьего электрона, представляет собой третью энергию ионизации и так далее. Для удаления электронов из атомов или ионов всегда требуется энергия, поэтому процессы ионизации являются эндотермическими, а значения IE всегда положительны.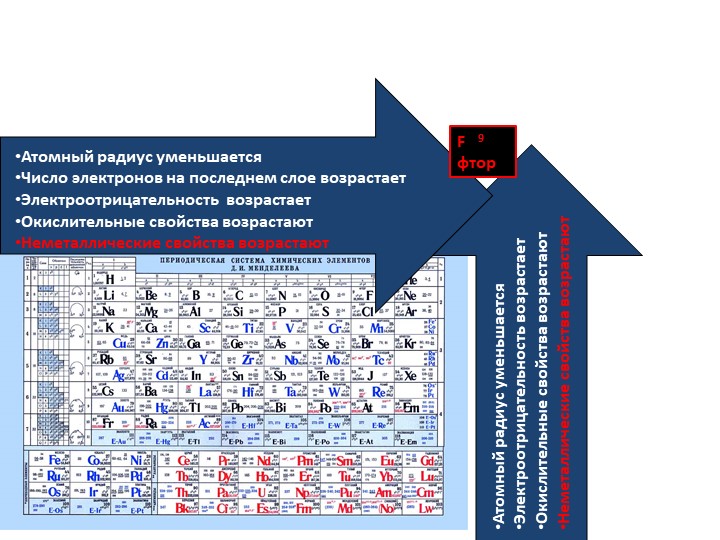 Для более крупных атомов наиболее слабо связанный электрон расположен дальше от ядра, и поэтому его легче удалить. Таким образом, с увеличением размера (радиуса атома) энергия ионизации должна уменьшаться. Соотнося эту логику с тем, что мы только что узнали о радиусах, мы ожидаем, что первая энергия ионизации будет уменьшаться по группе и увеличиваться по периоду.
Для более крупных атомов наиболее слабо связанный электрон расположен дальше от ядра, и поэтому его легче удалить. Таким образом, с увеличением размера (радиуса атома) энергия ионизации должна уменьшаться. Соотнося эту логику с тем, что мы только что узнали о радиусах, мы ожидаем, что первая энергия ионизации будет уменьшаться по группе и увеличиваться по периоду.
[ссылка] отображает зависимость между первой энергией ионизации и атомным номером нескольких элементов. Значения первой энергии ионизации для элементов приведены в [ссылка]. В течение периода IE 1 обычно увеличивается с увеличением Z . Вниз по группе значение IE 1 обычно уменьшается с увеличением Z . Однако существуют некоторые систематические отклонения от этой тенденции. Обратите внимание, что энергия ионизации бора (атомный номер 5) меньше, чем у бериллия (атомный номер 4), хотя заряд ядра бора больше на один протон.Это можно объяснить тем, что энергия подоболочек увеличивается по мере увеличения 90 245 l 90 246 из-за проникновения и экранирования (как обсуждалось ранее в этой главе). Внутри любой оболочки s электронов имеют меньшую энергию, чем p электронов. Это означает, что s электрон труднее удалить из атома, чем p электрон в той же оболочке. Электрон, удаленный при ионизации бериллия ([He]2 s 2 ), представляет собой s электрон, тогда как электрон, удаленный при ионизации бора ([He]2 s 2 2 p 1 ) представляет собой p электрон; это приводит к более низкой первой энергии ионизации бора, хотя заряд его ядра больше на один протон.Таким образом, мы видим небольшое отклонение от предсказанной тенденции, происходящее каждый раз, когда начинается новая подоболочка.
Внутри любой оболочки s электронов имеют меньшую энергию, чем p электронов. Это означает, что s электрон труднее удалить из атома, чем p электрон в той же оболочке. Электрон, удаленный при ионизации бериллия ([He]2 s 2 ), представляет собой s электрон, тогда как электрон, удаленный при ионизации бора ([He]2 s 2 2 p 1 ) представляет собой p электрон; это приводит к более низкой первой энергии ионизации бора, хотя заряд его ядра больше на один протон.Таким образом, мы видим небольшое отклонение от предсказанной тенденции, происходящее каждый раз, когда начинается новая подоболочка.
Энергия первой ионизации элементов в первые пять периодов нанесена в зависимости от их атомного номера.
Эта версия периодической таблицы показывает первую энергию ионизации (IE 1 ) в кДж/моль выбранных элементов.
Другое отклонение происходит, когда орбитали заполняются более чем наполовину. Первая энергия ионизации кислорода немного меньше, чем у азота, несмотря на тенденцию к увеличению значений IE 1 за период.Глядя на орбитальную диаграмму кислорода, мы видим, что удаление одного электрона устранит электрон-электронное отталкивание, вызванное спариванием электронов на орбитали 2 p , и приведет к полузаполненной орбитали (что энергетически выгодно). Аналогичные изменения происходят и в последующие периоды (обратите внимание на падение серы после фосфора в [ссылка]).
Удаление электрона из катиона сложнее, чем удаление электрона из нейтрального атома из-за большего электростатического притяжения к катиону.Точно так же удалить электрон из катиона с более высоким положительным зарядом сложнее, чем удалить электрон из иона с более низким зарядом. Таким образом, последовательные энергии ионизации одного элемента всегда возрастают. Как видно из [ссылка], для каждого элемента наблюдается значительное увеличение энергии ионизации (изменение цвета). Этот скачок соответствует удалению остовных электронов, которые удалить труднее, чем валентные электроны. Например, Sc и Ga имеют по три валентных электрона, поэтому быстрое увеличение энергии ионизации происходит после третьей ионизации.
Таким образом, последовательные энергии ионизации одного элемента всегда возрастают. Как видно из [ссылка], для каждого элемента наблюдается значительное увеличение энергии ионизации (изменение цвета). Этот скачок соответствует удалению остовных электронов, которые удалить труднее, чем валентные электроны. Например, Sc и Ga имеют по три валентных электрона, поэтому быстрое увеличение энергии ионизации происходит после третьей ионизации.
| Энергии последовательной ионизации для выбранных элементов (кДж/моль) | |||||||
|---|---|---|---|---|---|---|---|
| Элемент | ИЭ 1 | ИЭ 2 | ИЭ 3 | ИЭ 4 | ИЭ 5 | ИЭ 6 | ИЭ 7 |
| К | 418.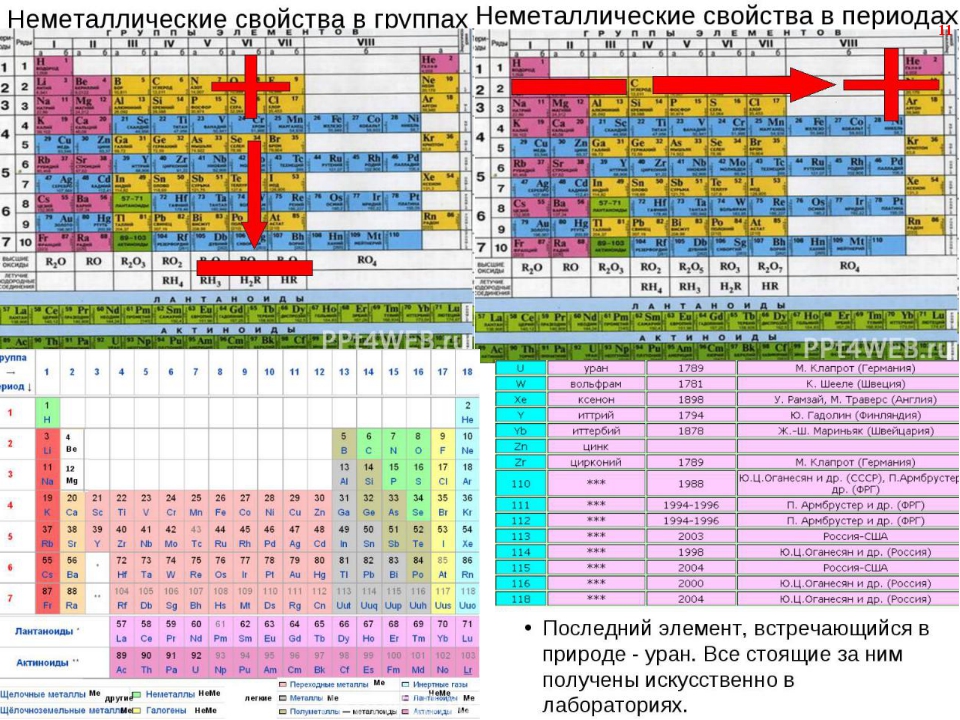 8 8 |
3051,8 | 4419.6 | 5876,9 | 7975,5 | 9590.6 | 11343 |
| Ca | 589,8 | 1145.4 | 4912.4 | 6490.6 | 8153.0 | 10495.7 | 12272,9 |
| Sc | 633.1 | 1235.0 | 2388,7 | 7090.6 | 8842.9 | 10679.0 | 13315.0 |
| Га | 578.8 | 1979.4 | 2964,6 | 6180 | 8298.7 | 10873,9 | 13594.8 |
| Ге | 762,2 | 1537,5 | 3302.1 | 4410.6 | 9021.4 | Нет в наличии | Нет в наличии |
| Как | 944,5 | 1793,6 | 2735,5 | 4836,8 | 6042.9 | 12311.5 | Нет в наличии |
Ранжирование энергий ионизации
Предсказать порядок увеличения энергии для следующих процессов: IE 1 для Al, IE 1 для Tl, IE 2 для Na, IE 3 для Al.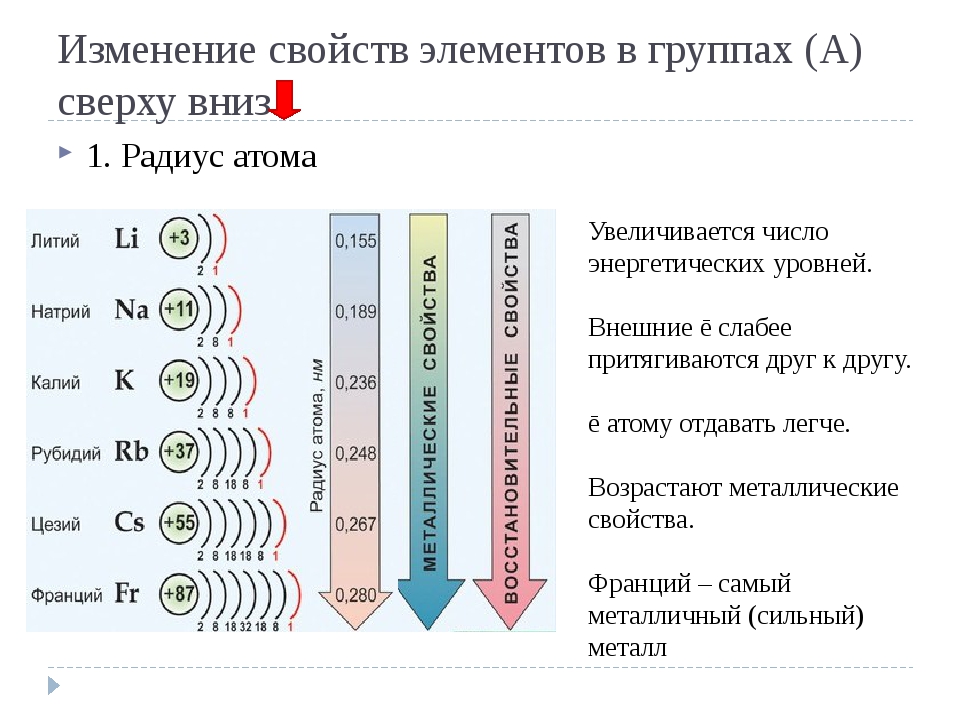 {\text{-}}\right)\) требует больше энергии, потому что катион Al 2+ оказывает большее притяжение на электрон, чем нейтральный атом Al, поэтому IE 1 (Al) < IE 3 ( Ал). Вторая энергия ионизации натрия удаляет остовный электрон, что представляет собой гораздо более энергетический процесс, чем удаление валентных электронов. Сложив все это вместе, мы получаем: ИЭ 1 (Tl) < ИЭ 1 (Al) < ИЭ 3 (Al) < ИЭ 2 (Na).
{\text{-}}\right)\) требует больше энергии, потому что катион Al 2+ оказывает большее притяжение на электрон, чем нейтральный атом Al, поэтому IE 1 (Al) < IE 3 ( Ал). Вторая энергия ионизации натрия удаляет остовный электрон, что представляет собой гораздо более энергетический процесс, чем удаление валентных электронов. Сложив все это вместе, мы получаем: ИЭ 1 (Tl) < ИЭ 1 (Al) < ИЭ 3 (Al) < ИЭ 2 (Na).
Проверьте свои знания
Что имеет наименьшее значение для IE 1 : O, Po, Pb или Ba?
Сродство к электрону [EA] представляет собой изменение энергии в процессе присоединения электрона к атому газа с образованием аниона (отрицательного иона).{\ text {−}} \ left (g \ right) \ phantom {\ rule {2em} {0ex}} {\ text {EA}} _ {1} \)
Этот процесс может быть эндотермическим или экзотермическим, в зависимости от элемента. Советник некоторых элементов приведен в [ссылка]. Вы можете видеть, что многие из этих элементов имеют отрицательные значения EA, что означает, что энергия высвобождается, когда газообразный атом принимает электрон. Однако для некоторых элементов требуется энергия, чтобы атом стал отрицательно заряженным и значение их EA положительно. Как и в случае с энергией ионизации, последующие значения EA связаны с образованием ионов с большим зарядом.Второй ЭА — это энергия, связанная с присоединением электрона к аниону с образованием иона -2 и так далее.
Вы можете видеть, что многие из этих элементов имеют отрицательные значения EA, что означает, что энергия высвобождается, когда газообразный атом принимает электрон. Однако для некоторых элементов требуется энергия, чтобы атом стал отрицательно заряженным и значение их EA положительно. Как и в случае с энергией ионизации, последующие значения EA связаны с образованием ионов с большим зарядом.Второй ЭА — это энергия, связанная с присоединением электрона к аниону с образованием иона -2 и так далее.
Как мы могли предсказать, становится легче добавить электрон к ряду атомов по мере того, как увеличивается эффективный ядерный заряд атомов. Мы обнаруживаем, что по мере продвижения слева направо по периоду СР имеют тенденцию становиться более отрицательными. Исключения среди элементов группы 2 (2А), группы 15 (5А) и группы 18 (8А) можно понять, исходя из электронной структуры этих групп.Инертные газы группы 18 (8А) имеют полностью заполненную оболочку и прилетающий электрон должен добавляться на более высокий уровень n , что сделать сложнее. Группа 2 (2A) имеет заполненную подоболочку нс , и поэтому следующий добавленный электрон переходит в более высокую энергию np , поэтому, опять же, наблюдаемое значение EA не соответствует прогнозируемому тренду. Наконец, группа 15 (5A) имеет наполовину заполненную подоболочку np , и следующий электрон должен быть в паре с существующим электроном np .Во всех этих случаях исходная относительная стабильность электронной конфигурации нарушает ход ЭА.
Группа 2 (2A) имеет заполненную подоболочку нс , и поэтому следующий добавленный электрон переходит в более высокую энергию np , поэтому, опять же, наблюдаемое значение EA не соответствует прогнозируемому тренду. Наконец, группа 15 (5A) имеет наполовину заполненную подоболочку np , и следующий электрон должен быть в паре с существующим электроном np .Во всех этих случаях исходная относительная стабильность электронной конфигурации нарушает ход ЭА.
Мы также можем ожидать, что атом в верхней части каждой группы будет иметь самый большой EA; их первые потенциалы ионизации предполагают, что эти атомы имеют самые большие эффективные ядерные заряды. Однако, продвигаясь вниз по группе, мы видим, что второй элемент в группе чаще всего имеет наибольший EA. Уменьшение ЭА первого члена можно объяснить малым размером оболочки n = 2 и обусловленными этим большими электрон-электронными отталкиваниями.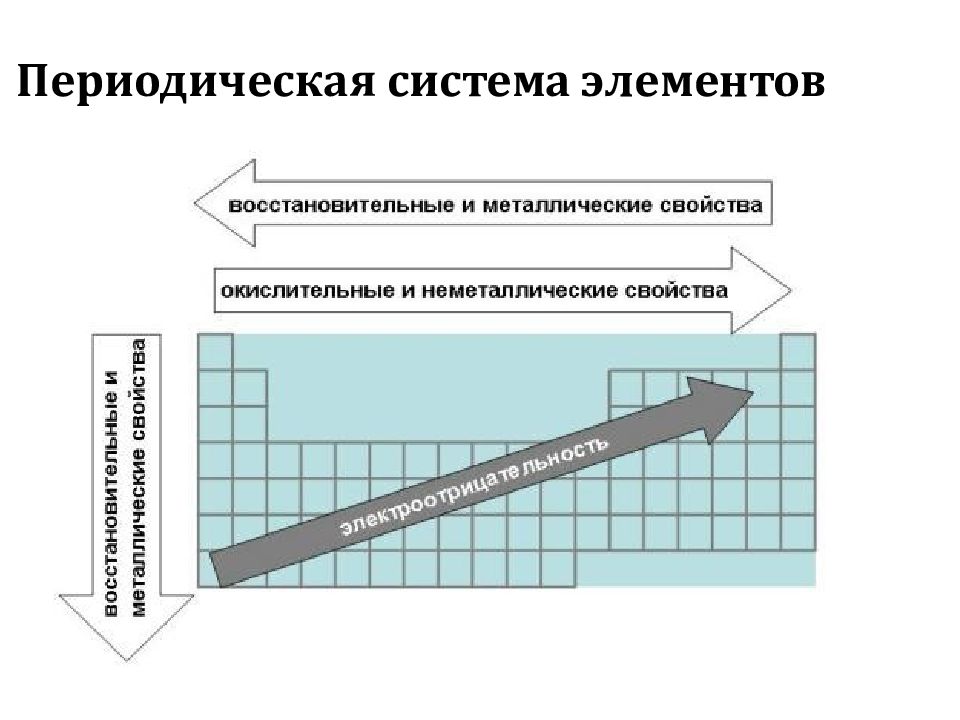 Например, хлор со значением EA –348 кДж/моль имеет самое высокое значение среди всех элементов периодической таблицы. ЭА фтора составляет –322 кДж/моль. Когда мы присоединяем электрон к атому фтора с образованием аниона фтора (F – ), мы добавляем электрон на оболочку n = 2. Электрон притягивается к ядру, но также происходит значительное отталкивание от других электронов, уже присутствующих в этой небольшой валентной оболочке. Атом хлора имеет такую же электронную конфигурацию на валентной оболочке, но поскольку входящий электрон идет на оболочку n = 3, он занимает значительно большую область пространства и электрон-электронные отталкивания уменьшаются.Входящий электрон не испытывает такого сильного отталкивания, и атом хлора легче принимает дополнительный электрон.
Например, хлор со значением EA –348 кДж/моль имеет самое высокое значение среди всех элементов периодической таблицы. ЭА фтора составляет –322 кДж/моль. Когда мы присоединяем электрон к атому фтора с образованием аниона фтора (F – ), мы добавляем электрон на оболочку n = 2. Электрон притягивается к ядру, но также происходит значительное отталкивание от других электронов, уже присутствующих в этой небольшой валентной оболочке. Атом хлора имеет такую же электронную конфигурацию на валентной оболочке, но поскольку входящий электрон идет на оболочку n = 3, он занимает значительно большую область пространства и электрон-электронные отталкивания уменьшаются.Входящий электрон не испытывает такого сильного отталкивания, и атом хлора легче принимает дополнительный электрон.
Эта версия периодической таблицы отображает значения сродства к электрону (в кДж/моль) для выбранных элементов.
Свойства, обсуждаемые в этом разделе (размер атомов и ионов, эффективный заряд ядра, энергия ионизации и сродство к электрону), являются центральными для понимания химической реактивности. Например, поскольку фтор имеет энергетически выгодную ЭА и большой энергетический барьер ионизации (ИЭ), анионы фтора образуются гораздо легче, чем катионы.Металлические свойства, включая проводимость и ковкость (способность формироваться в листы), зависят от наличия легко удаляемых электронов. Таким образом, металлический характер увеличивается по мере продвижения вниз по группе и уменьшается по периоду в той же тенденции, что и для размера атома, потому что легче удалить электрон, который находится дальше от ядра.
Например, поскольку фтор имеет энергетически выгодную ЭА и большой энергетический барьер ионизации (ИЭ), анионы фтора образуются гораздо легче, чем катионы.Металлические свойства, включая проводимость и ковкость (способность формироваться в листы), зависят от наличия легко удаляемых электронов. Таким образом, металлический характер увеличивается по мере продвижения вниз по группе и уменьшается по периоду в той же тенденции, что и для размера атома, потому что легче удалить электрон, который находится дальше от ядра.
электронов позволяют нам понять многие периодические тренды. Ковалентный радиус увеличивается по мере продвижения вниз по группе, потому что увеличивается уровень n (размер орбиты).Ковалентный радиус в основном уменьшается, когда мы движемся слева направо по периоду, потому что эффективный ядерный заряд, испытываемый электронами, увеличивается, и электроны сильнее притягиваются к ядру. Радиусы анионов больше, чем у родительского атома, а радиусы катионов меньше, потому что число валентных электронов изменилось, а заряд ядра остался постоянным. Энергия ионизации (энергия, связанная с образованием катиона) уменьшается по группе и в основном увеличивается по периоду, потому что легче удалить электрон с большей орбиты с более высокой энергией.Сродство к электрону (энергия, связанная с образованием аниона) является более благоприятным (экзотермическим), когда электроны помещаются на орбитали с более низкой энергией, ближе к ядру. Следовательно, сродство к электрону становится все более отрицательным по мере того, как мы движемся слева направо по периодической таблице, и уменьшается по мере того, как мы движемся вниз по группе. Как для данных IE, так и для данных сродства к электрону существуют исключения из тенденций, когда речь идет о полностью или наполовину заполненных подоболочках.
Энергия ионизации (энергия, связанная с образованием катиона) уменьшается по группе и в основном увеличивается по периоду, потому что легче удалить электрон с большей орбиты с более высокой энергией.Сродство к электрону (энергия, связанная с образованием аниона) является более благоприятным (экзотермическим), когда электроны помещаются на орбитали с более низкой энергией, ближе к ядру. Следовательно, сродство к электрону становится все более отрицательным по мере того, как мы движемся слева направо по периодической таблице, и уменьшается по мере того, как мы движемся вниз по группе. Как для данных IE, так и для данных сродства к электрону существуют исключения из тенденций, когда речь идет о полностью или наполовину заполненных подоболочках.
Основываясь на их положениях в периодической таблице, предскажите, у каких атомов наименьший радиус: Mg, Sr, Si, Cl, I.
Основываясь на их позициях в периодической таблице, предскажите, у какого атома наибольший радиус: Li, Rb, N, F, I.
Основываясь на их позициях в периодической таблице, предскажите, у какого из них наибольшая энергия первой ионизации: Mg, Ba, B, O, Te.
Основываясь на их позициях в таблице Менделеева, предскажите, какая из них имеет наименьшую энергию первой ионизации: Li, Cs, N, F, I.
На основании их положения в периодической таблице расположите следующие атомы в порядке возрастания энергии первой ионизации: F, Li, N, Rb
На основании их положения в периодической таблице расположите следующие атомы или соединения в порядке возрастания энергии первой ионизации: Mg, O, S, Si
Атомы какой группы периодической таблицы имеют электронную конфигурацию валентной оболочки нс 2 нп 3 ?
Атомы какой группы периодической таблицы имеют электронную конфигурацию валентной оболочки нс 2 ?
На основании их положения в периодической таблице перечислите следующие атомы в порядке увеличения радиуса: Mg, Ca, Rb, Cs.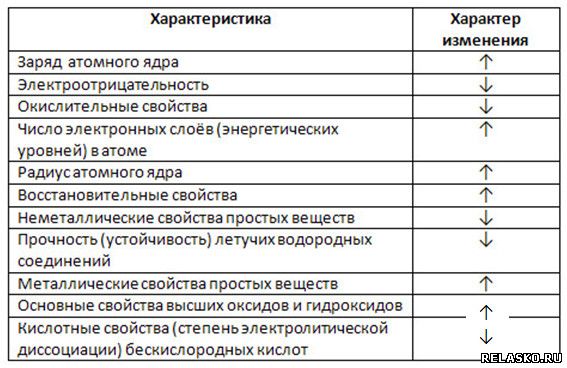
На основании их положения в периодической таблице перечислите следующие атомы в порядке увеличения радиуса: Sr, Ca, Si, Cl.
Основываясь на их позициях в периодической таблице, перечислите следующие ионы в порядке увеличения радиуса: K + , Ca 2+ , Al 3+ , Si 4+ .
Перечислите следующие ионы в порядке увеличения радиуса: Li + , Mg 2+ , Br – , Te 2– .
Какой атом и/или ион изоэлектронен Br + : Se 2+ , Se, As – , Kr, Ga 3+ , Cl – ?
Какой из следующих атомов и ионов изоэлектронен S 2+ : Si 4+ , Cl 3+ , Ar, As 3+ , Si, Al 3+ ?
Сравните количество протонов и электронов, присутствующих в каждом из них, чтобы расположить следующие ионы в порядке увеличения радиуса: As 3–, Br –, K + , Mg 2+ . {-}\)
{-}\)
Ионные радиусы ионов S 2– , Cl – и K + равны 184, 181 и 138 пм соответственно. Объясните, почему эти ионы имеют разные размеры, хотя они содержат одинаковое число электронов.
У атома какой основной группы ожидается наименьшая вторая энергия ионизации?
Объясните, почему Ал принадлежит к группе 13, а не к группе 3?
Глоссарий
- ковалентный радиус
- половина расстояния между ядрами двух одинаковых атомов, когда они соединены ковалентной связью
- эффективный ядерный заряд
- заряд, который приводит к кулоновской силе, действующей ядром на электрон, рассчитывается как заряд ядра минус экранирование
- сродство к электрону
- энергия, необходимая для присоединения электрона к атому газа с образованием аниона
- энергия ионизации
- энергии, необходимой для отрыва электрона от газообразного атома или иона.
 Соответствующее число (например, вторая энергия ионизации) соответствует заряду образовавшегося иона (X 2+ )
Соответствующее число (например, вторая энергия ионизации) соответствует заряду образовавшегося иона (X 2+ )
- изоэлектронный
- группа ионов или атомов с идентичными электронными конфигурациями
Что такое свойства элементов?
Периодическая таблица представляет собой табличное отображение различных химических элементов, расположенных в соответствии с их электронной конфигурацией, атомным номером и общими химическими свойствами. Существуют определенные тенденции, общие для всех групп и периодов.
Строки называются периодами, а периодическая таблица имеет 7 периодов. Металлы представлены в левых рядах, а ближе к правой стороне — неметаллы. Принимая во внимание, что столбцы называются группами. В группах элементы имеют различное химическое поведение. Существует 18 групп, галогены входят в группу 17, а благородные газы — в группу 18.
Периодические тенденции
Особые закономерности свойств химических элементов, присутствующих в периодической таблице, известны как периодические тенденции. Важные тенденции
Важные тенденции
1. Ионизационная энергия
2. Металлический характер
3. Атомный радиус
4. Электронегативность
5. Ионный радиус
6. Аффизирование электронов
7. Химическая реактивность
8. Эффект экранирования
Эти тенденции возникают вследствие изменения строения атомов элементов внутри их групп и периодов. Существует несколько исключений, например, энергия ионизации групп 3 и 6.
Периодический закон
Периодический закон формирует основу для периодических тенденций. Согласно периодическому закону, «химические элементы расположены в порядке возрастания атомного номера, и основные свойства при этом претерпевают циклические изменения. Элементы, имеющие сходные химические свойства, повторяются через равные промежутки времени»
Этот принцип сформулировал Дмитрий Менделеев. Он также заявил, что периодическая таблица основана не только на атомном весе, но и на различных физических и химических свойствах элементов.
Он также заявил, что периодическая таблица основана не только на атомном весе, но и на различных физических и химических свойствах элементов.
Позже также было обнаружено, что повторение свойств обусловлено повторением подобных электронных конфигураций во внешних оболочках атомов.
1. Энергия ионизации
Потенциал ионизации можно определить как
«Минимальная энергия, необходимая изолированному атому для удаления одного электрона в нейтральном или газообразном состоянии» . Причина в том, что заряд ядра по периоду увеличивается, и, таким образом, электроны сильно удерживаются ядром.
Но по мере продвижения вниз по группе энергия ионизации уменьшается по группе. Причина этого в том, что по группе валентные электроны удаляются дальше от ядра, поэтому заряд ядра уменьшается.
Факторы, влияющие на энергию ионизации
Существуют различные факторы, влияющие на уровни энергии ионизации
• Заряд ядра
Чем ниже заряд ядра, тем ниже сила притяжения между ядром и валентными электронами, поэтому энергия ионизации ниже .
• Экранирующий эффект
Экранирующий эффект увеличивается по мере увеличения заряда ядра, таким образом, с увеличением экранирующего эффекта увеличивается и энергия ионизации.
• Атомный радиус
По мере увеличения атомного радиуса сила притяжения между ядром и валентными электронами также уменьшается. Таким образом, с увеличением атомного радиуса ионизация уменьшается.
• Полузаполненные валентные оболочки
Псевдозаполненные или наполовину заполненные валентные оболочки имеют высокую энергию ионизации.
Простой принцип, который можно использовать, заключается в том, что если главное квантовое число низкое, то число ионизации для электрона, присутствующего в этой оболочке, будет высоким.
Исключения
Все элементы семейства кислорода и бора являются исключением из указанной выше периодической тенденции. Они требуют немного меньше энергии, чем обычный тренд.
Они требуют немного меньше энергии, чем обычный тренд.
2. Металлическое свойство
Металлическое свойство элемента можно определить как его способность проводить электричество.Металлические свойства увеличиваются вниз по группе по мере уменьшения заряда ядра вниз по группе. Поскольку валентный электрон слабо связан с ядрами, они способны хорошо проводить электричество.
Но с течением времени металлический характер уменьшается по мере увеличения заряда ядра. Это вызывает увеличение силы притяжения между валентными электронами и ядрами, тем самым препятствуя их проведению электричества или тепла.
3. Атомные радиусы
Атомный радиус – это расстояние между атомным ядром и внешней стабильной электронной орбиталью атома, находящегося в равновесии.В течение периода радиус атома уменьшается по мере увеличения заряда ядра. Причина уменьшения заключается в том, что по мере увеличения заряда ядра сила притяжения между ядром и валентными электронами также увеличивается, и ядро крепко удерживает электрон, тем самым уменьшая атомные радиусы.
В группе атомный радиус увеличивается вниз по группе. Причина в том, что добавляются новые снаряды и таким образом уменьшается ядерный заряд. Но атомные радиусы также увеличиваются по диагонали, вызывая некоторое исключение.
Пример
Вдоль периода – Li> Be > B > C > N > O > F
Вниз по Grp – Li < Na < K < Rb < Cs
4 4 Электроотрицательность можно определить как способность атома или молекулы притягивать пару электронов. Образующаяся за счет этого связь в основном определяется разницей между электроотрицательностью атомов.
В течение периода электроотрицательность увеличивается по мере увеличения заряда ядра.Двигаясь вниз по группе, электроотрицательность уменьшается по мере уменьшения заряда ядра. Причина в том, что расстояние между ядром атома и валентными электронами велико, и поэтому электроны легко теряются.
Пример
вдоль периода- Li вниз по GRP — Li> Na> K> RB> CS Исключение Элементы группы 13 являются исключением, поэтому электроотрицательность увеличивается от алюминия к таллию.Также в группе 14 электроотрицательность олова выше, чем у свинца. Сродство к электрону можно определить как тенденцию атома принимать электрон или электронную пару. Это характерная черта неметаллов, поскольку они приобретают электроны, превращаясь в анионы. В течение периода сродство к электрону увеличивается по мере увеличения заряда ядра Вниз по группе оно уменьшается по мере уменьшения заряда ядра. Фтор имеет наибольшую электроотрицательность и благородные газы сюда не входят. Его можно определить как отталкивание внешнего электрона внутренними электронами. Его также можно использовать для объяснения того, сколько ядер могут управлять внешними электронами. Эффективный заряд ядра уменьшается вниз по группе из-за увеличения экранирующего эффекта. В течение периода эффективный заряд ядра увеличивается по мере увеличения заряда ядра. Подводя итог, можно сделать следующие выводы. Характеристика Период Группа Энергия ионизации Увеличивает Понижает Metallic недвижимость Уменьшает Увеличивает атомный радиус Уменьшает Увеличивает Электронно негативность Увеличивает Уменьшает Электрон-аффинность Увеличение Уменьшение Увеличивается Уменьшение Ион состоит из электронов в своих многочисленных оболочках и ядра. Расстояние между ядром и электроном в последней самой внешней оболочке иона известно как ионный радиус иона. Основываясь на ионном радиусе различных элементов, можно определить тенденцию в периодической таблице. По сути, эту тенденцию можно рассматривать как; Если мы перейдем от вершины таблицы Менделеева к ее основанию, ионный радиус элементов будет увеличиваться.Это происходит потому, что по мере продвижения вниз по периодической таблице количество слоев или оболочек электронов увеличивается. Если двигаться в периодической таблице слева направо, то ионный радиус имеет тенденцию к уменьшению. Хотя кажется странным, что размер иона будет уменьшаться по мере добавления большего количества протонов, электронов и нейтронов. Однако это происходит потому, что когда мы двигаемся боком по периодической таблице, металл сбрасывает свои внешние электронные слои, чтобы сформировать катионы. Эта тенденция относится не только к ионному радиусу, но и к атомному радиусу; однако они отличаются друг от друга. 8. Химическая реактивность Реакционная способность элемента относится к способности атома вступать в реакцию с любым другим веществом. Химическая активность часто регулируется энергией ионизации (как просто электроны сбрасываются с самого внешнего слоя) и электроотрицательностью (насколько быстро атом принимает электроны другого атома).Этот процесс переноса и обмена электронами является принципом, по которому происходит тенденция химической активности в периодической таблице. В металлах химическая активность уменьшается по мере того, как мы двигаемся в горизонтальном направлении слева направо по периодической таблице. В неметаллах все наоборот. Химическая активность увеличивается по мере продвижения слева направо по таблице. И реактивность уменьшается по мере продвижения к нижним группам от верхних групп. Чем дальше вверх или вправо, тем легче атомам сбрасывать свои электроны в обмен на другие электроны, увеличивая электроотрицательность, что, в свою очередь, делает химическую реактивность элементов более строгой. Наиболее благородные газы — гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn). )- имеют нулевую электроотрицательность, потому что они чрезвычайно стабильны. Из 118 элементов таблицы Менделеева 90 можно найти в природе, а остальные 28 созданы человеком. В то время как водород (H) является самым легким элементом в периодической таблице (его можно найти в верхнем левом углу), оганесон (Og) является самым тяжелым элементом (можно найти в правом нижнем углу) Почти 75% элементов периодической таблицы — это металлы.В то время как есть только несколько неметаллов. Единственными двумя элементами, которые являются жидкими при комнатной температуре, являются бром и ртуть. Если периодическую таблицу сложить пополам вдоль ее группы 4 элементов, то группы, лежащие друг над другом, могут идеально слиться друг с другом, потому что они имеют гармонирующую электронную структуру. Friedel, C. Sur une combinaison naturelle des oxydes de fer et de cuivre, et sur la воспроизводство атакамита. Комп. Ренд. акад. науч. Париж 77 , 211 (1873).
Google Scholar
Роджерс, А. Ф. Делафоссит, медный метаферрит из Бисби, Аризона. амер. жур. науч. 35 , 90 (1913).
Google Scholar
Шеннон, Р. Д., Роджерс, Д. Б. и Превитт, К. Т. Химия оксидов благородных металлов. I. Синтез и свойства соединений делафосита ABO 2 . Неорг. хим. 10 , 713 (1971). КАС
Статья
Google Scholar
Prewitt, C.T., Shannon, R.D. & Rogers, D.B. Химия оксидов благородных металлов. Артикул
Google Scholar
Rogers, D.B., Shannon, R.D. & Prewitt, C.T. Химия оксидов благородных металлов. III. Электротранспортные свойства и кристаллохимия соединений ABO 2 со структурой делафоссита. Неорг. хим. 10 , 723 (1971). Артикул
Google Scholar
Анисимов В.И., Потеряев А.И., Коротин М.А., Анохин А.О., Котляр Г. Расчеты электронной структуры и спектров сильнокоррелированных систем из первых принципов: динамическая теория среднего поля. J. Phys.: Condens. Материя 9 , 7359 (1997). КАС
Google Scholar
Лихтенштейн А. И., Кацнельсон М. И. Ab initio расчеты зонной структуры квазичастиц в коррелированных системах: подход LDA++. КАС
Статья
Google Scholar
Котляр Г. и др. Расчеты электронной структуры с помощью динамической теории среднего поля. Ред. Мод. физ. 78 , 865 (2006). КАС
Статья
Google Scholar
Kawazoe, H. et al. Электропроводность р-типа в прозрачных тонких пленках CuAlO 2 . Природа 389 , 939 (1997). КАС
Статья
Google Scholar
Daou, R., Frésard, R., Eyert, V., Hébert, S. & Maignan, A. Нетрадиционные аспекты электронного транспорта в оксидах делафоссита. Науч. Технол. Доп. Матер. 18 , 919 (2017). КАС
Статья
Google Scholar
Маккензи, А.П. Свойства сверхчистых металлов делафосситов. Респ. прог. КАС
Статья
Google Scholar
Нох, Х.-Дж. Прямое наблюдение локализованного спинового антиферромагнитного перехода в PdCrO 2 с помощью фотоэмиссионной спектроскопии с угловым разрешением. Науч. Респ. 4 , 3680 (2014). Артикул
КАС
Google Scholar
Lechermann, F. Скрытый изолятор Мотта из металлического PdCrO 2 . Физ. Преподобный Матер. 2 , 085004 (2018а). КАС
Статья
Google Scholar
Сунко, В. Исследование спиновых корреляций с использованием фотоэмиссии с угловым разрешением в связанной системе металл/изолятор Мотта. Науч. Доп. 6 , eaaz0611 (2020a). КАС
Статья
Google Scholar
Худа, М. Н., Ян, Ю., Уолш, А., Вей, С.-Х. и Аль-Джассим, М. М. Делафосзиты группы IIIA по сравнению с делафосситами IIIB: исследование электронной структуры. Физ. Ред. B 80 , 035205 (2009 г.). Артикул
КАС
Google Scholar
Сешадри, Р., Фельсер, К., Тиме, К. и Тремель, В. Связь металл-металл и поведение металлов в некоторых делафосситах ABO 2 . Хим. Матер. 10 , 2189 (1998). КАС
Статья
Google Scholar
Листы, W. C. Оксиды делафоссита серебра. Неорг. хим. 47 , 2696 (2008). КАС
Статья
Google Scholar
Имада М., Фухимори А. и Токура Ю. Переходы металл-изолятор. Ред. Мод. физ. 70 , 1039 (1998). КАС
Статья
Google Scholar
Zaanen, J., Sawatzky, G.A. & Allen, J.W. Запрещенные зоны и электронная структура соединений переходных металлов. Физ. Преподобный Летт. 55 , 418 (1985). КАС
Статья
Google Scholar
Анисимов В.И., Некрасов И.А., Кондаков Д.Е., Райс Т.М., Сигрист М. Орбитально-селективный переход Мотта-изолятора в Ca 2− x Sr x 9 4 . евро. физ. J. B 25 , 191 (2002). КАС
Google Scholar
Бирман С., Потеряев А., Лихтенштейн А. И. и Жорж А. Динамические синглеты и переход Пайерлса с корреляцией в VO 2 . Физ. Преподобный Летт. 94 , 026404 (2005). КАС
Статья
Google Scholar
Лехерманн, Ф., Хан, К. и Миллис, А.Дж. Пространственная неоднородность и переход металл-изолятор в Ca 3 (Ru 1− x Ti x ) 2 O 7 7 Физ. КАС
Статья
Google Scholar
Жорж, А., де Медичи, Л. и Мравлье, Дж. Сильные корреляции из связи Хунда. Энн. Преподобный Конденс. Материя физ. 4 , 137 (2013). КАС
Статья
Google Scholar
Georges, A. Сильно коррелированные электронные материалы: теория динамического среднего поля и электронная структура , (Протоколы конференции AIP 715, 2004 г.) Глава. 3. Лехерманн, Ф. Самосогласованность заряда в коррелированных расчетах электронной структуры , (DMFT: от бесконечных измерений к реальным материалам, Forschungszentrum Jülich GmbH, 2018) Глава.6. Мецнер В. и Фоллхардт Д. Коррелированные решетчатые фермионы в d = ∞ измерениях. Физ. Преподобный Летт. 62 , 324 (1989). КАС
Статья
Google Scholar
Жорж А. и Котляр Г. Модель Хаббарда в бесконечных измерениях. Физ. B 45 , 6479 (1992). КАС
Статья
Google Scholar
Жорж А., Котляр Г., Краут В. и Розенберг М. Дж. Динамическая теория среднего поля сильно коррелированных фермионных систем и предел бесконечных измерений. Ред. Мод. физ. 68 , 13 (1996). КАС
Статья
Google Scholar
Джаррелл, М. и Губернатис, Дж. Э. Байесовский вывод и аналитическое продолжение квантовых данных Монте-Карло в мнимом времени. Отчеты по физике 269 , 133 (1996). КАС
Статья
Google Scholar
Згид, Д. и Чан, Г.К.-Л. Динамическая теория среднего поля с точки зрения квантовой химии. J. Chem. физ. 134 , 094115 (2011). Артикул
КАС
Google Scholar
Лин, Н., Марианетти, К.А., Миллис, А.Дж. и Райхман, Д.Р. Теория динамического среднего поля для квантовой химии. Физ. Преподобный Летт. 106 , 096402 (2011). Артикул
КАС
Google Scholar
Aryasetiawan, F. et al. Зависящие от частоты локальные взаимодействия и низкоэнергетические эффективные модели из расчетов электронной структуры. Физ. Ред. B 70 , 195104 (2004 г.). Артикул
КАС
Google Scholar
Саврасов С.Ю., Котляр Г. и Абрахамс Э. Коррелированные электроны в δ плутонии в динамической картине среднего поля. Природа 410 , 793 (2001). КАС
Статья
Google Scholar
Minár, J. et al. Формализм многократного рассеяния для коррелированных систем: подход KKR-DMFT. Физ. Ред. B 72 , 045125 (2005 г. Артикул
КАС
Google Scholar
Пуровский Л.В., Амадон Б., Бирманн С. и Жорж А. Самосогласованность по плотности заряда в динамической теории среднего поля: линейная булочная реализация и некоторые физические следствия. Физ. Ред. B 76 , 235101 (2007 г.). Артикул
КАС
Google Scholar
Grieger, D., Piefke, C., Peil, O.E. & Lechermann, F. Приближение к фазовым диаграммам конечной температуры сильнокоррелированных материалов: тематическое исследование для V 2 O 3 . Физ. Ред. B 86 , 155121 (2012 г.). Артикул
КАС
Google Scholar
Амадон, Б. и др. Расчеты электронной структуры коррелированных материалов на основе плоских волн с использованием динамической теории среднего поля и прогнозируемых локальных орбиталей. Артикул
КАС
Google Scholar
Лехерманн, Ф. Динамическая теория среднего поля с использованием функций Ваннье: гибкий путь к расчетам электронной структуры сильно коррелированных материалов. Физ. Ред. B 74 , 125120 (2006 г.). Артикул
КАС
Google Scholar
Potthoff, M. & Nolting, W. Переход поверхности металл-изолятор в модели Хаббарда. Физ. B 59 , 2549 (1999). КАС
Статья
Google Scholar
Elsässer, C. et al. Релятивистские эффекты на свойства переходных металлов 4d и 5d в основном состоянии. J. Phys.: Condens. Материя 2 , 4371 (1990).
Google Scholar
Lechermann, F. Исследование функционала плотности Fe 3 Al: LSDA в сравнении с GGA. Артикул
КАС
Google Scholar
Мейер, Б., Эльзассер, К., Лехерманн, Ф. и Фенле, М. FORTRAN 90 Программа для смешанных расчетов псевдопотенциала для кристаллов , Макс-Планк-Институт металлургии, Штутгарт (1998). Пердью, Дж. П., Берк, К. и Эрнзерхоф, М. Простое приближение обобщенного градиента. Физ. Преподобный Летт. 77 , 3865 (1996). КАС
Статья
Google Scholar
Анисимов В.И. Полная орбитальная схема расчета материалов с сильно коррелированными электронами. Физ. Ред. B 71 , 125119 (2005 г.). Артикул
КАС
Google Scholar
Коротин М.А., Анисимов В.И., Хомский Д.И., Савацкий Г.А. CrO 2 : самолегированный двойной обменный ферромагнетик. Физ. Преподобный Летт. КАС
Статья
Google Scholar
Лехерманн, Ф. Корреляционные эффекты на легированной треугольной решетке с точки зрения физики богатого натрием Na x CoO 2 . Физ. Преподобный Летт. 102 , 046403 (2009). Артикул
КАС
Google Scholar
Рубцов А. Н., Савкин В. В., Лихтенштейн А. И. Квантовый метод Монте-Карло с непрерывным временем для фермионов. Физ. Ред. B 72 , 035122 (2005 г.). Артикул
КАС
Google Scholar
Вернер П., Команак А., Медичи Л., Тройер М. и Миллис А. Дж. Решатель с непрерывным временем для квантовых моделей примесей. Физ. Преподобный Летт. 97 , 076405 (2006). Артикул
КАС
Google Scholar
Parcollet, O. TRIQS: набор инструментов для исследования взаимодействующих квантовых систем. Вычисл. физ. коммун. 196 , 398 (2015). КАС
Статья
Google Scholar
Сет, П., Кривенко, И., Ферреро, М. и Парколлет, О. TRIQS/CTHYB: Решатель квантового гибридизационного метода Монте-Карло с непрерывным временем для задач квантовых примесей. Вычисл. физ. коммун. 200 , 274 (2016). КАС
Статья
Google Scholar
Анисимов В.И., Соловьев И.В., Коротин М.А., Чижик М.Т., Савацкий Г.А. Теория функционала плотности и фотоэмиссионные спектры NiO. Физ. B 48 , 16929 (1993). КАС
Статья
Google Scholar
Видберг, Х. Дж. и Серен, Дж. В. Решение уравнений Элиашберга с помощью N-точечных аппроксимаций Паде. J Low Temp Phys 29 , 179 (1977). КАС
Статья
Google Scholar
Hicks, C.W. et al. Квантовые осцилляции и высокая подвижность носителей в делафоссите PdCoO 2 . Физ. Преподобный Летт. 109 , 116401 (2012). Артикул
КАС
Google Scholar
Moll, PJW, Kushwaha, P., Nandi, N., Schmidt, B. & Mackenzie, A.P. Доказательства гидродинамического потока электронов в PdCoO 2 . Наука 351 , 1061 (2016). КАС
Статья
Google Scholar
Андреев А.В., Кивельсон С.А., Спивак Б. Гидродинамическое описание транспорта в сильно коррелированных электронных системах. Физ. Преподобный Летт. 106 , 256804 (2011). КАС
Статья
Google Scholar
Гуржи Р. Минимум сопротивления в беспримесных проводниках. КАС
Google Scholar
Скаффиди, Т., Нанди, Н., Шмидт, Б., Маккензи, А. П. и Мур, Дж. Э. Гидродинамический поток электронов и холловская вязкость. Физ. Преподобный Летт. 118 , 226601 (2017). Артикул
Google Scholar
Варнавидес Г., Джермин А. С., Аникеева П., Фельсер К. и Наранг П. Электронная гидродинамика в анизотропных материалах. Нац. коммун. 11 , 4710 (2020). КАС
Статья
Google Scholar
Оуян, С. и др. Корреляция кристаллической структуры, электронного строения и фотокаталитических свойств ряда оксидов на основе Ag: AgAlO 2 , AgCrO 2 и Ag 2 CrO 4 . J. Phys. хим. С 112 , 3134 (2008). КАС
Статья
Google Scholar
Меката М., Сугино Т., Охара А., Охара Ю. и Йошизава Х. Магнитная структура антиферромагнитного PdCrO 2 возможные вырожденные спирали на ромбоэдрической решетке. Physica B 213 , 221 (1995). Артикул
Google Scholar
Оохара Ю. Магнитный фазовый переход в AgCrO 2 . J. Phys. соц. Япония. 63 , 847 (1994). КАС
Статья
Google Scholar
Seki, S., Onose, Y. & Tokura, Y. Спиновое сегнетоэлектричество в антиферромагнетиках с треугольной решеткой ACrO 2 (A=Cu, Ag, Li или Na). Физ. Преподобный Летт. 101 , 067204 (2008). КАС
Статья
Google Scholar
Эйерт, В., Фресар, Р. и Меньян, А. О металлической проводимости делафосситов PdCoO 2 и PtCoO 2 . Хим. Матер. 20 , 2370 (2008 г. КАС
Статья
Google Scholar
Онг, К.П., Чжан Дж., Це Дж. С. и Ву П. Происхождение анизотропии и металлического поведения в делафоссите PdCoO 2 . Физ. B 81 , 115120 (2010 г.). Артикул
КАС
Google Scholar
Онг, К.П. и Сингх, Д.Дж. Трехмерный магнетизм и связь с электронами проводимости в PdCrO 2 . Физ. B 85 , 134403 (2012). Артикул
КАС
Google Scholar
Собота, Дж. А. Электронная структура металлического антиферромагнетика PdCrO 2 , измеренная с помощью фотоэмиссионной спектроскопии с угловым разрешением. Физ. Ред. B 88 , 125109 (2013 г.). Артикул
КАС
Google Scholar
Грюнер М.Е., Эккерн У. и Пенчева Р. Артикул
КАС
Google Scholar
Биллингтон Д. Магнитная фрустрация, короткодействующие корреляции и роль парамагнитной поверхности Ферми PdCrO 2 . Науч. Респ. 5 , 12428 (2015). Артикул
Google Scholar
Нох, Х.-Дж. Анизотропная электропроводность делафоссита PdCoO 2 , изученная методом фотоэмиссионной спектроскопии с угловым разрешением. Физ. Преподобный Летт. 102 , 256404 (2009 г.). Артикул
КАС
Google Scholar
Ок, Дж. М. Квантовые колебания металлического антиферромагнетика с треугольной решеткой PdCrO 2 . Артикул
КАС
Google Scholar
Hicks, C.W. Квантовые колебания и магнитная реконструкция в делафоссите PdCrO 2 . Физ. Ред. B 92 , 014425 (2015). Артикул
КАС
Google Scholar
Лехерманн Ф. и Рихтер Р. Теоретический дизайн высококоррелированных электронных состояний в гетероструктурах делафоссита. Физ. Rev. Research 2 , 013352 (2020 г.). КАС
Статья
Google Scholar
Такацу Х., Ёсидзава Х., Йонезава С. и Маэно Ю. Критическое поведение металлического антиферромагнетика Гейзенберга с треугольной решеткой PdCrO 2 . Физ. Ред. B 79 , 104424 (2009 г.). Артикул
КАС
Google Scholar
Лехерманн, Ф., Кёрнер, В., Урбан, Д.Ф. и Эльзессер, К. Взаимодействие переноса заряда и физики Мотта-Хаббарда, приближенное к эффективному сочетанию коррекции самодействия и динамической теории среднего поля . Физ. B 100 , 115125 (2019 г.). КАС
Статья
Google Scholar
Mott, N. Редкоземельные соединения со смешанной валентностью. Философский журнал 30 , 403 (1974). КАС
Статья
Google Scholar
Дониач С. Решетка Кондо и слабый антиферромагнетизм. Physica B 91 , 231 (1977). Артикул
Google Scholar
Комлева Е.В., Ирхин В.Ю., Соловьев И.В., Кацнельсон М.И., Стрельцов С.В. Нетрадиционный магнетизм и электронное состояние в фрустрированной слоистой системе PdCrO 2 . Физ. Ред. B 102 , 174438 (2020 г. КАС
Статья
Google Scholar
Беднорц, Дж. Г. и Мюллер, К.A. Возможная высокотемпературная сверхпроводимость в системе Ba-La-Cu-O. Z. Physik B — Condensed Matter 64 , 189 (1986). КАС
Статья
Google Scholar
Зубко, П., Гарильо, С., Габай, М., Госез, П. и Трисконе, Ж.-М. Физика интерфейса в сложных оксидных гетероструктурах. год. Преподобный Конденс. Материя физ. 2 , 141 (2011). КАС
Статья
Google Scholar
Hwang, H.Y. et al. Возникающие явления на границах раздела оксидов. Природные материалы 11 , 103 (2012). КАС
Статья
Google Scholar
Мазин И.И. Теоретическое предсказание сильнокоррелированного дираковского металла. Нац. коммун. КАС
Статья
Google Scholar
Е, Л.Массивные фермионы Дирака в ферромагнитном металле кагоме. Природа 555 , 638 (2018). КАС
Статья
Google Scholar
Гимире Н.Дж. и Мазин И.И. Топология и корреляции на решетке кагоме. Нац. Матер. 19 , 137 (2020). КАС
Статья
Google Scholar
Piefke, C., Boehnke, L., Жорж А. и Лехерманн Ф. Значительные нелокальные электронные корреляции в сильно легированном Na x CoO 2 . Физ. Ред. B 82 , 165118 (2010 г.). Артикул
КАС
Google Scholar
Peil, O.E., Georges, A. & Lechermann, F. Сильные корреляции, усиленные упорядочением заряда в сильно легированных кобальтатах. Артикул
КАС
Google Scholar
Уоллес П. Р. Зонная теория графита. Физ. 71 , 622 (1947). КАС
Статья
Google Scholar
Li, G. Модификация in situ объемного монокристалла PdCoO 2 типа делафоссита для обратимой сорбции водорода и быстрого выделения водорода. ACS Energy Письмо. 4 , 2185 (2019). КАС
Статья
Google Scholar
Harada, T., Fujiwara, K. & Tsukazaki, A. Высокопроводящие PdCoO 2 ультратонкие пленки для прозрачных электродов. АПЛ Матер. 6 , 046107 (2018). Артикул
КАС
Google Scholar
Бралек М. Рост металлического делафосита PdCoO 2 методом молекулярно-лучевой эпитаксии. КАС
Статья
Google Scholar
Йорданов П. Большая анизотропия термоЭДС в тонких пленках PdCoO 2 . Физ. Ред. Материалы 3 , 085403 (2019 г.). КАС
Статья
Google Scholar
Sun, J. Рост PdCoO 2 методом молекулярно-лучевой эпитаксии с озоном. АПЛ Матер. 7 , 121112 (2019а). Артикул
КАС
Google Scholar
Ок, Дж. М. Импульсно-лазерная эпитаксия металлических пленок делафоссита PdCrO 2 . АПЛ Матер. 8 , 051104 (2020). КАС
Статья
Google Scholar
Wei, R. Обрабатываемые раствором эпитаксиальные пленки металлического оксида делафоссита. Доп. Функц. Матер. КАС
Статья
Google Scholar
Harada, T. et al. Определение длины фазовой когерентности наноструктур PdCoO 2 методом анализа флуктуаций проводимости. Физ. B 103 , 045123 (2021 г.). КАС
Статья
Google Scholar
Сунко В.Максимальное расщепление спина по типу Рашбы за счет нарушения инверсионной симметрии, связанного с кинетической энергией. Природа 549 , 492 (2017). Артикул
Google Scholar
Mazzola, F. Перемещающийся ферромагнетизм Pd-терминированной полярной поверхности PdCoO 2 . ПНАС 115 , 12956 (2018). КАС
Статья
Google Scholar
Харада, Т. Аномальный эффект Холла на спонтанно легированной электронами полярной поверхности сверхтонких пленок PdCoO 2 . КАС
Статья
Google Scholar
Сунко В. Контролируемое введение дефектов в делафосситные металлы с помощью электронного облучения. Физ. X 10 , 021018 (2020b). КАС
Google Scholar
Танака, М., Хасегава, М. и Такеи, Х. Рост и характеристика Pd типа делафоссита (Co 1− x Mn x )O 2 (x = 0,04, 0,11) монокристаллы. Journal of Crystal Growth 203 , 400 (1999). КАС
Статья
Google Scholar
Wawrzyńska, E. Орбитальное вырождение, снятое зарядовым порядком в треугольном антиферромагнетике AgNiO 2 . Физ. Преподобный Летт. 99 , 157204 (2007 г.). Артикул
КАС
Google Scholar
Ралко А., Мерино Дж. и Фратини С. Жидкая фаза Пинбола из реакции Хунда в фрустрированных оксидах переходных металлов. Физ. B 91 , 165139 (2015). Артикул
КАС
Google Scholar
Кан, Э. Дж., Сян, Х.Дж., Чжан Ю., Ли К. и Вангбо М.-Х. Анализ функционала плотности спинового обмена и сегнетоэлектрической поляризации в AgCrO 2 . Физ. Ред. B 80 , 104417 (2009 г.). Артикул
КАС
Google Scholar
Арсеньевич, С. Аномальная магнитотермоэдс в металлическом фрустрированном антиферромагнетике. Физ. Преподобный Летт. 116 , 087202 (2016). Артикул
КАС
Google Scholar
Ганнадзаде, С. Одновременная потеря межслоевой когерентности и дальнодействующего магнетизма в квазидвумерном PdCrO 2 . Нац. коммун. КАС
Статья
Google Scholar
Ле, М. Д. Магнитные взаимодействия в PdCrO 2 и их влияние на его магнитную структуру. Физ. B 98 , 024429 (2018 г.). КАС
Статья
Google Scholar
Сан, Д. Магнитная фрустрация и спонтанное нарушение вращательной симметрии в PdCrO 2 . Физ. Ред. B 100 , 094414 (2019b). КАС
Статья
Google Scholar
Park, C. & Yu, J. Скрученные двухслойные хиральные спиновые структуры в антиферромагнитном делафоссите PdCrO 2 , Препринт на https://arxiv.org/abs/2001.06834 (2020) . Кудасов, Ю. Б. Косозонная структура и аномальная проводимость PdCrO 2 , Препринт на https://arxiv.org/abs/2006.05453 (2020). Boehnke, L. & Lechermann, F. Конкурирующие порядки в Na x CoO 2 из сильных корреляций на уровне двух частиц. Физ. B 85 , 115128 (2012 г.). Артикул
КАС
Google Scholar
Chem Soc Rev.Авторская рукопись; доступно в PMC 2014 21 января. Опубликовано в окончательной отредактированной форме как: PMCID: PMC3641858 NIHMSID: NIHMS421298 Факультет фармацевтики и фармацевтических наук Университета Монашарквилля, Университет Монаш 381 Royal Parade, Parkville, VIC 3052, Австралия Медицинский факультет Университета Нью-Мексико, факультет внутренних болезней, отдел трансляционной информатики, комплекс инновационных открытий и обучения, MSC10 5550, Альбукерке, NM 87131, США В то время как ученые, занимающиеся открытием новых лекарств, обращают внимание на различные руководства, касающиеся свойств наркотиков, влияние кислотно-щелочных свойств часто остается недостаточно изученным. Константы ионизации (значения pK и ) имеют основополагающее значение для изменчивости биофармацевтических характеристик лекарств и для основных параметров, таких как logD и растворимость. Значения p K a влияют на физико-химические свойства, такие как растворимость в воде, что, в свою очередь, влияет на подходы к составлению лекарственных препаратов.Что еще более важно, абсорбция, распределение, метаболизм, экскреция и токсичность (ADMET) сильно зависят от состояния заряда соединений при различных условиях pH. Рассмотрение значений p K a в сочетании с другими молекулярными свойствами имеет большое значение и может быть использовано для дальнейшего повышения эффективности открытия лекарств. С экономической точки зрения стало совершенно ясно, что фармацевтические компании испытывают трудности, несмотря на увеличение расходов на исследования и разработки. К счастью, обширное доклиническое профилирование помогло снизить количество отказов от лекарств из-за плохой фармакокинетики у человека. Однако в последнее время причины выпадения лекарств из клинической разработки были основаны на коммерческих решениях, а также на проблемах с рецептурой и токсичностью.Другие факторы, такие как более строгий контроль со стороны регулирующих органов и нехватка простых (и поддающихся лечению) целей, также способствовали снижению производительности отрасли. 1 Некоторые комментаторы даже сомневаются в долгосрочной жизнеспособности фармацевтической промышленности. Чтобы решить проблему высоких показателей текучести кадров и в соответствии с надлежащей практикой управления, анализ всего процесса разработки лекарств был необходим, чтобы помочь компаниям конкурировать в текущих условиях.Медицинские химики также принимали активное участие в изучении неэффективности лекарств, исследуя и определяя физико-химические свойства соединений, которые предсказывают успешные результаты. 1 Целью этих анализов является улучшение качества соединений, которые проходят клинические испытания, и все же есть некоторые споры о том, насколько соблюдаются эти рекомендации. 2 Оптимизация, основанная на свойствах, имеет чрезвычайно важное значение для отрасли, так как есть четкие доказательства того, что работа с крупными и липофильными молекулами связана с проблемами, касающимися распущенности, метаболизма, биодоступности, оттока, растворимости и связывания с белками плазмы. 3-5 Ключевое значение в поведении лекарств имеет их кислотно-щелочной характер, который влияет на их биофармацевтические свойства и состав. Имея в виду конкретное болезненное состояние, процесс открытия лекарств обычно начинается с идентификации и проверки конкретной макромолекулярной мишени. Разработка экранов позволяет тестировать соединения для выявления совпадений и потенциальных клиентов, которые соответствуют набору заранее определенных критериев, касающихся таких атрибутов, как эффективность, функциональная активность и физико-химические свойства. Если требуется пероральная биодоступность, то тестирование на этом этапе может помочь определить качество этих лигандов. Процесс открытия лекарств. Важно отметить, что кислотно-щелочной профиль соединения оказывает прямое влияние на липофильность вещества, определяемую константами ионизации (значения p K и ) ключевых функциональных групп.Таким образом, абсолютно необходимы дальнейшие исследования и знание кислотно-щелочных профилей для исследовательских соединений, клинических кандидатов и лекарств, если мы хотим понять и контролировать липофильность. иллюстрирует четыре важных аспекта разработки лекарств, на которые влияет кислотно-основное равновесие лекарства. Действительно, кислотно-щелочной характер влияет на активность и селективность лекарственного средства и оказывает большое влияние как на фармакокинетические, так и на биофармацевтические свойства. Диаграмма, иллюстрирующая основные свойства, на которые влияет кислотно-щелочной характер наркотиков.Каждый узел подчеркивает важный аспект открытия и разработки лекарств. Усилия по определению физико-химических свойств, которые относятся к долгосрочной жизнеспособности соединения, были предприняты совместно со сбором биологических данных о таких атрибутах, как: клеточная токсичность, склонность к оттоку, метаболическая стабильность или ингибирование, клеточная проницаемость, биодоступность, Проницаемость ЦНС, связывание с белками, связывание с тканями головного мозга, распущенность, клиренс и объемы распределения.Вооружившись этими данными, были проведены поиски взаимосвязей с рядом простых физико-химических свойств. Большая часть этого внимания была уделена легко вычисляемым параметрам, таким как молекулярная масса (MW), ClogP, площадь полярной поверхности (PSA), количество доноров/акцепторов водородных связей, ароматический характер и количество вращающихся связей. Одним из первых появившихся общих исследований является хорошо известная работа Lipinski et al. 9 , в которой подчеркивалось, что проблемы с пероральным всасыванием могут возникнуть, если соединение отвечает двум или более из следующих критериев: молекулярный масса > 500, ClogP > 5, доноры Н-связи > 5 и акцепторы Н-связи > 10.Более поздняя работа позволила уточнить эти рекомендации, и в этом обзоре будет освещена только часть этого исследования. Для всестороннего анализа этой темы мы отсылаем читателя к обзору Meanwell. 1 Простые расчеты ClogP можно улучшить, рассматривая состояние заряда в порядке биологически значимых значений pH. Обычно это принимает форму оценки коэффициента распределения октанол/вода при физиологическом pH (7,4), известного как ClogD 7,4 . Например, компания Pfizer также использовала большое количество внутренних данных о проницаемости клеток и клиренсе in vitro , чтобы обеспечить полезную связь с физико-химическими свойствами. Дальнейший анализ Wager et al. на препараты для ЦНС привели к методу оценки, который учитывал следующие свойства: MW, ClogP, ClogD 7.4 , количество доноров водородных связей, PSA и наиболее основных p K a . 11 Метод оценки многопараметрической оптимизации центральной нервной системы (CNSMPO) показал вероятность успешного применения соединения в клинике. Это было в первую очередь направлено на препараты для ЦНС, но существовала общая (подобная лекарствам) взаимосвязь между оценкой и ключевыми атрибутами in vitro , такими как метаболическая стабильность, проницаемость, токсичность и отток. Руководящие принципы и наблюдения, изложенные выше, охватывают широкие характеристики лекарственных препаратов, и большинство фармацевтических компаний применяют вариации этих правил для оценки своих соединений. Чтобы адекватно обсудить состояние заряда и значения p K a , необходимо указать, что подразумевается под кислотным, основным и нейтральным.Большинство исследований, обсуждаемых в этом обзоре, в которых изучались свойства состояния заряда лекарств, классифицируют соединения как кислоты, основания, нейтральные или цвиттерионные. Кислотная диссоциация.HA+h3O⇄A+h4O+Основная диссоциация.B+h3O⇄BH++OH Для наших собственных исследований зарядовых состояний и p K a распределения 7 мы также определили различные ионизации категории с использованием значений p K a . Предполагалось, что наши определения будут более широкими, чтобы охватить состояния заряда в пределах диапазона значений pH, наблюдаемых как физиологически, так и тех, которые встречаются при составлении лекарственных препаратов. В дополнение к категориям, указанным выше, мы классифицировали некоторые соединения как «всегда ионизированные», такие как четвертичные основания и кислоты со значениями p K a ниже 0.0 или основания со значениями pK a выше 12,0. Амфолиты также классифицировали на группы по количеству кислотных и основных групп. Простые амфолиты содержат одну кислоту и одно основание, а сложные амфолиты содержат другие комбинации кислот и оснований. Общие кислотные группы включают: карбоксилаты, фенолы, сульфаниламиды, гетероциклические атомы азота, гидроксаматы и реже карбоновые кислоты, фосфаты, тетразолы, тиолы, спирты, кислые амиды, кислые анилины, карбаматы, гидразиды, имиды и сульфаты.С другой стороны, основания включают гетероциклические атомы азота, алифатические амины, гуанидины, амидины, анилины и основные амиды. Дополнительная информация, содержащая определение p K a , приведена в рамке 1. ), мы можем выразить константу ионизации кислоты ( K a ), используя уравнение (2). Чаще используется отрицательная логарифмическая форма константы ионизации кислоты (3).Преобразование уравнения (3) дает уравнение Хендерсона-Хассельбаха (4). Аналогичным образом мы можем использовать эти уравнения для сопряженных кислотных форм основных функциональных групп (5).
HA + H 2 O ⇌ A + H 3 O + (1) (1) BH + + H 2 o ⇌ B + H 3 O + (5) График зависимости % протонированных соединений от pH для соединения с одной кислотной группой (p K a 4. График, показывающий % протонированных соединений в зависимости от pH для соединения с одной основной группой (p K a 9,0). Значительные исследования были направлены на понимание факторов, влияющих на всасывание лекарств через кишечные мембраны. Ранние исследования Brodie, Hogben и соавт. 14 детализировали их «гипотезу разделения pH», которая ясно продемонстрировала влияние состояния ионизации на скорость всасывания лекарств из тонкого кишечника.В этой новаторской работе они показали, что кислоты со значениями p K a ниже 3 и основания со значениями p K a выше 8 плохо всасываются. После этого исследования были предприняты другие исследования, в которых упоминались p K a и поведение ADME. Например, Палм и др. 15 расширил вышеприведенную работу, показав, что перенос молекул через мембраны происходит быстрее для незаряженных частиц. Пример, демонстрирующий этот принцип, был показан с серией из трех структурно родственных антагонистов рецепторов AT 1 , обладающих небольшими различиями в состоянии ионизации при pH 6.0 и 7.4. 16 При pH 7,4 все молекулы были ионизированы, что приводило к плохой проницаемости в модельных системах с использованием камер Ussing, перфузии петли тощей кишки или исследований переноса Caco-2. Наоборот, при рН 6,0 только одна молекула была в значительной степени незаряженной, и одно это соединение значительно абсорбировалось. Помимо подчеркивания осторожности, необходимой при использовании этих модельных систем, в этой работе также предлагалось уделить пристальное внимание профилям ионизации исследуемых соединений. 16 В другом примере Кастро и его коллеги 17 создали ряд соединений для решения проблемы плохого перорального всасывания соединения свинца. Свинец имел хороший профиль in vitro , однако менее 5% поглощалось пероральным путем. Уровень заряда также был отмечен Мартином как важный фактор в прогнозировании биодоступности у крыс. 12 В более крупном исследовании компания Gleeson 4 исследовала как проницаемость с использованием анализа искусственной мембраны (PAMPA), так и биодоступность для большого количества соединений собственной разработки GSK.Было обнаружено, что ранговый порядок проницаемости: нейтральные > основания > цвиттер-ионы > кислоты. Это объяснялось анионной природой используемых мембран и, таким образом, объяснялось электростатическими соображениями. Простая классификация соединений на кислоты и основания не принимает во внимание степень ионизации, которая рассматривалась предыдущими исследователями с использованием значений p K a . «медицинские химики, которые не заботились о значениях pK a своих кислот или оснований, теперь хорошо осведомлены о рисках, которые возникают из-за того, что эти значения слишком далеки от 7, нейтрального значения pH». Ясно, что когда мы рассматриваем природу мембран и их липофильный характер, приведенные выше обобщения относительно неионизированных состояний и проницаемости становятся полностью понятными.Нейтральные молекулы легче проникают через неполярную липидную среду мембраны, в отличие от заряженных соединений, где этот процесс энергетически невыгоден. Несмотря на эти исследования и общую догму о том, что нейтральные частицы обладают большим преимуществом при пассивном переносе через мембраны, существуют данные, свидетельствующие о том, что часть заряженных молекул способна поглощаться. В одном исследовании использовали монослои клеток Caco-2, чтобы предположить, что ионные частицы могут способствовать общему транспорту лекарств. Хотя лекарство может всасываться адекватно, другие свойства могут приводить к тому, что оно плохо распределяется или быстро выводится, так что оно не может вызвать адекватный фармакологический ответ. Компании, участвующие в исследованиях новых лекарств, заинтересованы в проницаемости исследуемых соединений для ЦНС и в том, насколько хорошо они связываются с тканью головного мозга. Компании, разрабатывающие лекарства, нацеленные на мишени в ЦНС, знают, что фармакологический ответ соединения напрямую связан со свободной фракцией в ЦНС, доступной для связывания с необходимой макромолекулой. 24 Если соединение сильно связано с белком, то оно должно иметь достаточную активность, чтобы компенсировать небольшую долю свободно доступного лекарства.Что касается связывания с тканями головного мозга, были обнаружены незначительные различия между связыванием кислых, основных, нейтральных и цвиттер-ионных веществ, в отличие от отчетливого паттерна, наблюдаемого для связывания с белками плазмы. Еще один широко изучаемый аспект исследований лекарственных средств для ЦНС касается способности лекарств проходить через ГЭБ. С физиологической точки зрения ГЭБ представляет собой существенное препятствие для поступления лекарств в ЦНС.Между эпителиальными клетками ГЭБ существуют плотные контакты, и имеются значительные популяции насосов оттока для противодействия проникновению лекарств. Простые модели, которые оценивают степень проникновения лекарств в ЦНС, ограничены качеством данных, и, как указано выше, в большинстве исследований для исследовательских целей соединения разделяют на различные состояния заряда. 25 В то время как молекулярная масса, липофильность и способность донора водородных связей являются важными факторами, влияющими на проникновение ГЭБ 26 , состояние ионизации также играет ключевую роль. Существует множество систем оттока для защиты организма от вредных веществ.Ключевым примером является P-гликопротеин (P-gp), который представляет собой связанный с мембраной белок, находящийся на апикальной поверхности кишечного эпителия и мембран астроцитов ГЭБ. Фармацевтическая промышленность проявляет значительный интерес к переносчикам, таким как P-gp, поскольку этот насос для оттока может серьезно ограничивать пероральное всасывание соединений или препятствовать доступу к ЦНС. Полезная прогностическая модель аффинности ингибитора P-gp была создана с использованием полей молекулярного взаимодействия 29 , и существуют четкие взаимосвязи между аффинностью к P-gp и размером молекулы 4, 30 , а также числом доноров водородных связей. 31 Напоминая многие ферменты метаболизма, P-gp не различает субстраты для этого белка. В кишечнике как P-gp, так и ферменты метаболизма в значительной степени расположены вместе, выполняя одну и ту же функцию, которая заключается в предотвращении воздействия нежелательных и потенциально вредных веществ. Состояния ионизации также играют роль: кислоты имеют более низкие коэффициенты истечения, чем нейтральные и основные соединения, в то время как цвиттер-ионы имеют более высокие коэффициенты истечения. 4 В целях упрощения классификации соединений было разработано «правило 4» для приблизительного описания субстратной специфичности P-gp. 33 Это правило использует свойства; MW, p K a значений и сумма числа атомов азота и кислорода (N+O). Короче говоря, было обнаружено, что соединение с параметрами (N+O) ≥ 8, MW > 400 и кислотностью p K a > 4, вероятно, является субстратом P-gp, в то время как соединения с параметрами (N +O) ≤ 4, MW < 400 и основание p K a < 8 с меньшей вероятностью является субстратом. 33 Эти рекомендации полезны и позволяют исследователям контролировать конкретные физико-химические свойства, а также состояние заряда для измерения чувствительности P-gp. Большое значение для фармацевтической промышленности при разработке лекарств имеет необходимость избегать соединений, которые блокируют калиевый канал hERG. Ингибирование каналов hERG может вызвать серьезные побочные эффекты, такие как удлинение интервала QT, что в тяжелых случаях может привести к сердечной аритмии и смерти.Недавно были разработаны улучшенные модели канала hERG, что привело к более точному прогнозированию сродства каналов. 34 Многие из моделей, которые были разработаны для прогнозирования сродства hERG, описывают взаимосвязь между наличием основной группы и блокадой канала. 34 Действительно, наличие основного алифатического азота является для химиков-медиков поводом для раннего тестирования сродства к hERG. 35 Исследование 35 200 молекул, протестированных на ингибирование hERG, показало, что основные соединения обладают более высоким сродством к каналам hERG, чем цвиттер-ионные соединения, в то время как кислые и нейтральные соединения показали самое слабое сродство. Электрофизиологические исследования обеспечивают более точную оценку, чем связывание радиолиганда, и компания AstraZeneca протестировала 7685 соединений, сосредоточив внимание как на состоянии заряда, так и на липофильности, чтобы разработать рекомендации по предотвращению ингибирования hERG. 36 Молекулы были классифицированы как кислые, основные, нейтральные или цвиттер-ионные на основе их состояния заряда при физиологическом pH, тогда как значения logD были либо оценены in silico , либо измерены экспериментально. В соответствии с выводами GSK 4 было обнаружено, что основные соединения с большей вероятностью ингибируют hERG, и это ингибирование также сильно обусловлено липофильностью. 36 Waring and Johnstone 36 определили верхний предел липофильности для прогнозирования 70% вероятности образования соединения с hERG IC 50 более 10 мкМ (). Еще 5748 соединений были протестированы в сравнении с этой моделью, демонстрируя, что предложенные пределы logP/logD 7,4 могут быть успешно предсказаны на уровне 70%. Связь между состоянием заряда, липофильностью и ингибированием hERG мкМ
Фосфолипидоз характеризуется избытками фосфолипидов в клетках, дающих им пенный вид и известно индуцироваться определенными соединениями, которые являются катионными амфифилами. Хотя это управляемый побочный эффект некоторых лекарств, он создает проблемы во время разработки лекарств, поскольку необходимы дальнейшие исследования, чтобы показать, что эффекты обратимы. Другие исследователи также искали простые алгоритмы для прогнозирования фосфолипидоза. Используя модель in vitro , Tomizawa et al. . показал связь для основных соединений между ClogP, p K a и фосфолипидозом. 39 Чтобы распространить это на другие классы соединений, они построили график суммарного заряда (NC) при pH 4,0 в зависимости от ClogP и разработали прогностическую схему для фосфолипидоза (). Для более сложных случаев разработки лекарств, когда доступна информация об объеме распределения, Ханумеговда и его коллеги разработали модель, которая лучше, чем использование только значений p K a и ClogP. 5. Сродство к электрону
 Причина в том, что они имеют полную валентную оболочку и поэтому не могут ни приобретать, ни терять электроны.
Причина в том, что они имеют полную валентную оболочку и поэтому не могут ни приобретать, ни терять электроны. 6. Экранирующий эффект
2 153 7.
 Ионный радиус
Ионный радиус
 Для неметаллов ионный радиус увеличивается по мере того, как количество электронов, присутствующих в ионе, превышает количество протонов, вызывая значительное уменьшение заряда ядра.
Для неметаллов ионный радиус увеличивается по мере того, как количество электронов, присутствующих в ионе, превышает количество протонов, вызывая значительное уменьшение заряда ядра.
 Принимая во внимание, что реактивность увеличивается по мере продвижения от верхних к нижним группам таблицы. Чем дальше вниз или влево мы движемся, тем легче и быстрее становится обмен электронами, увеличивая химическую активность элементов.
Принимая во внимание, что реактивность увеличивается по мере продвижения от верхних к нижним группам таблицы. Чем дальше вниз или влево мы движемся, тем легче и быстрее становится обмен электронами, увеличивая химическую активность элементов. Факты, основанные на тенденциях периода и периодических таблицах
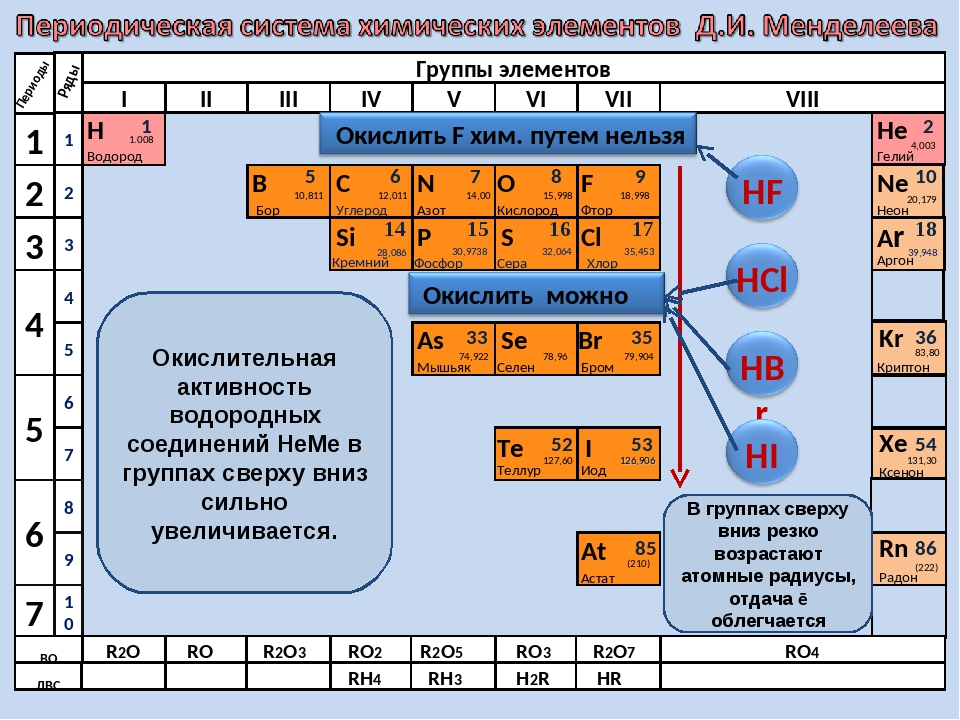 У них есть полностью валентные электронные слои, из-за которых они не теряют и не приобретают электроны легко.
У них есть полностью валентные электронные слои, из-за которых они не теряют и не приобретают электроны легко. 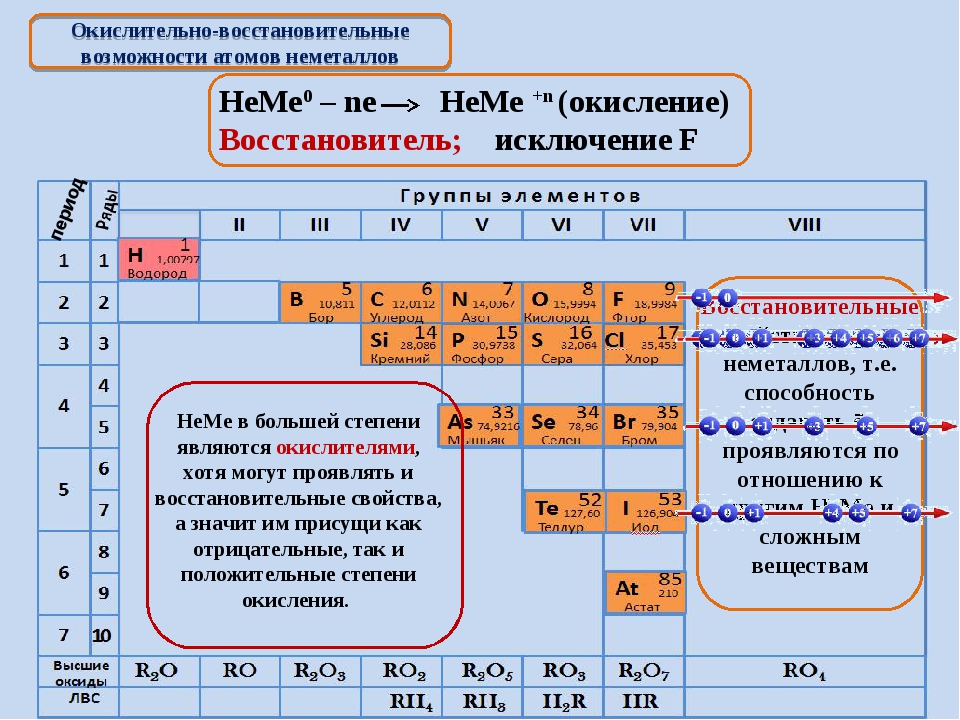 Следовательно, они сочетаются друг с другом в полной стабильности.
Следовательно, они сочетаются друг с другом в полной стабильности. От основных свойств к схеме Мотта коррелированных делафосситов
 II. Кристаллические структуры диоксида платины-кобальта, диоксида палладия-кобальта, диоксида железа-меди и диоксида железа-серебра. Неорг. хим. 10 , 719 (1971).
II. Кристаллические структуры диоксида платины-кобальта, диоксида палладия-кобальта, диоксида железа-меди и диоксида железа-серебра. Неорг. хим. 10 , 719 (1971). 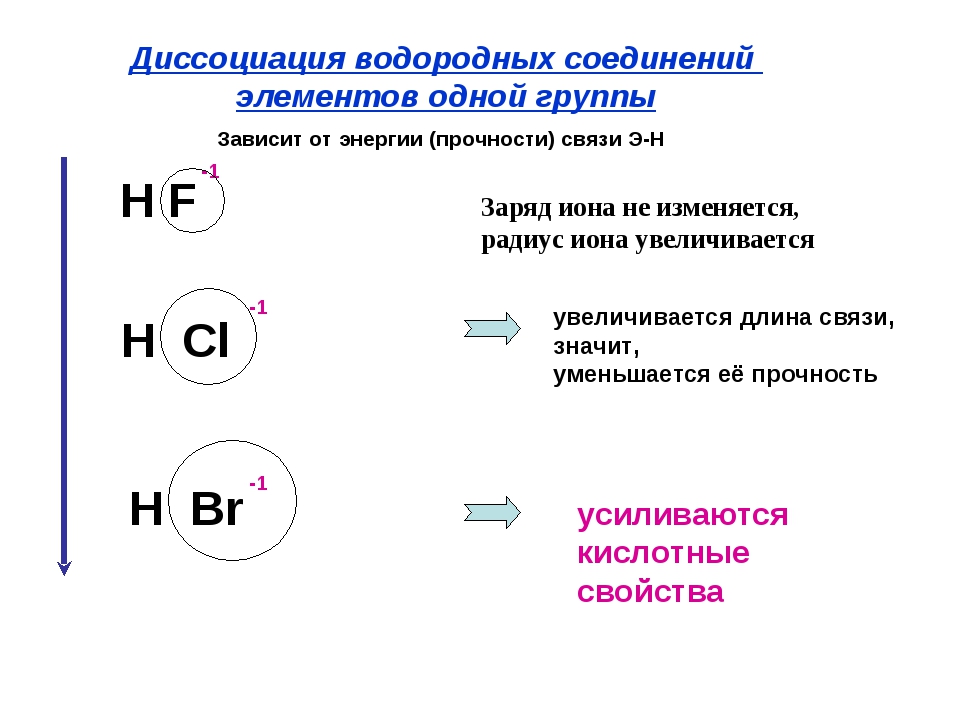 Физ. B 57 , 6884 (1998).
Физ. B 57 , 6884 (1998).  физ. 80 , 032501 (2017).
физ. 80 , 032501 (2017). 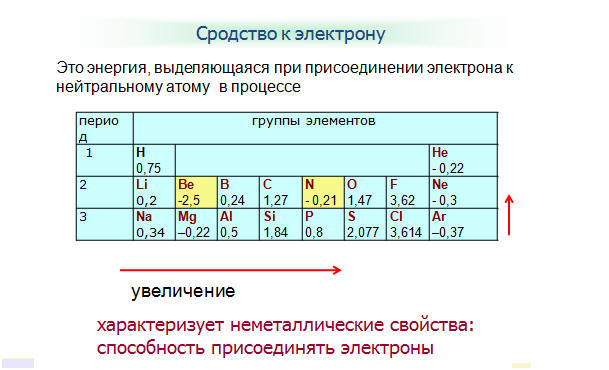

 Преподобный Рез. 2 , 033490 (2020).
Преподобный Рез. 2 , 033490 (2020). 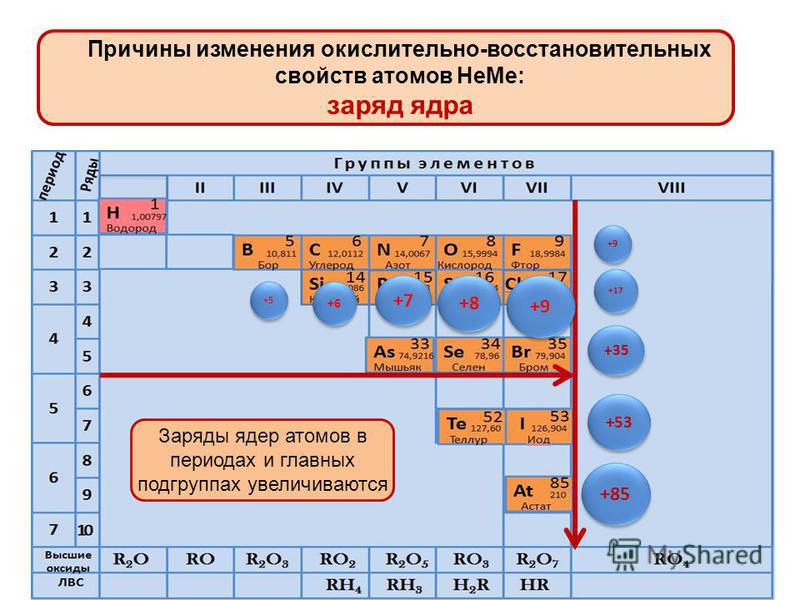

 ).
).  Физ. B 77 , 205112 (2008 г.).
Физ. B 77 , 205112 (2008 г.).  Физ. B 65 , 132104 (2002).
Физ. B 65 , 132104 (2002).  80 , 4305 (1998).
80 , 4305 (1998). 

 Сов. физ. JETP 44 , 771 (1963).
Сов. физ. JETP 44 , 771 (1963). 
 ).
).  Влияние индуцированного деформацией электронного топологического перехода на термоэлектрические свойства PtCoO 2 и PdCoO 2 . Физ. B 92 , 235140 (2015 г.).
Влияние индуцированного деформацией электронного топологического перехода на термоэлектрические свойства PtCoO 2 и PdCoO 2 . Физ. B 92 , 235140 (2015 г.).  Физ. Преподобный Летт. 111 , 176405 (2013).
Физ. Преподобный Летт. 111 , 176405 (2013). 
 ).
).  5 , 4261 (2014).
5 , 4261 (2014).  Физ. Преподобный Летт. 107 , 236404 (2011).
Физ. Преподобный Летт. 107 , 236404 (2011). Физ. Ред. Материалы 3 , 0 (2019 г.).
Физ. Ред. Материалы 3 , 0 (2019 г.).  30 , 2002375 (2020).
30 , 2002375 (2020).  Физ. Rev. Research 2 , 013282 (2020 г.).
Физ. Rev. Research 2 , 013282 (2020 г.). 
 8 , 15001 (2017).
8 , 15001 (2017). 
Значение кислотно-основных свойств при открытии лекарств
 другие статьи в PMC, в которых цитируется опубликованная статья.
другие статьи в PMC, в которых цитируется опубликованная статья. Abstract
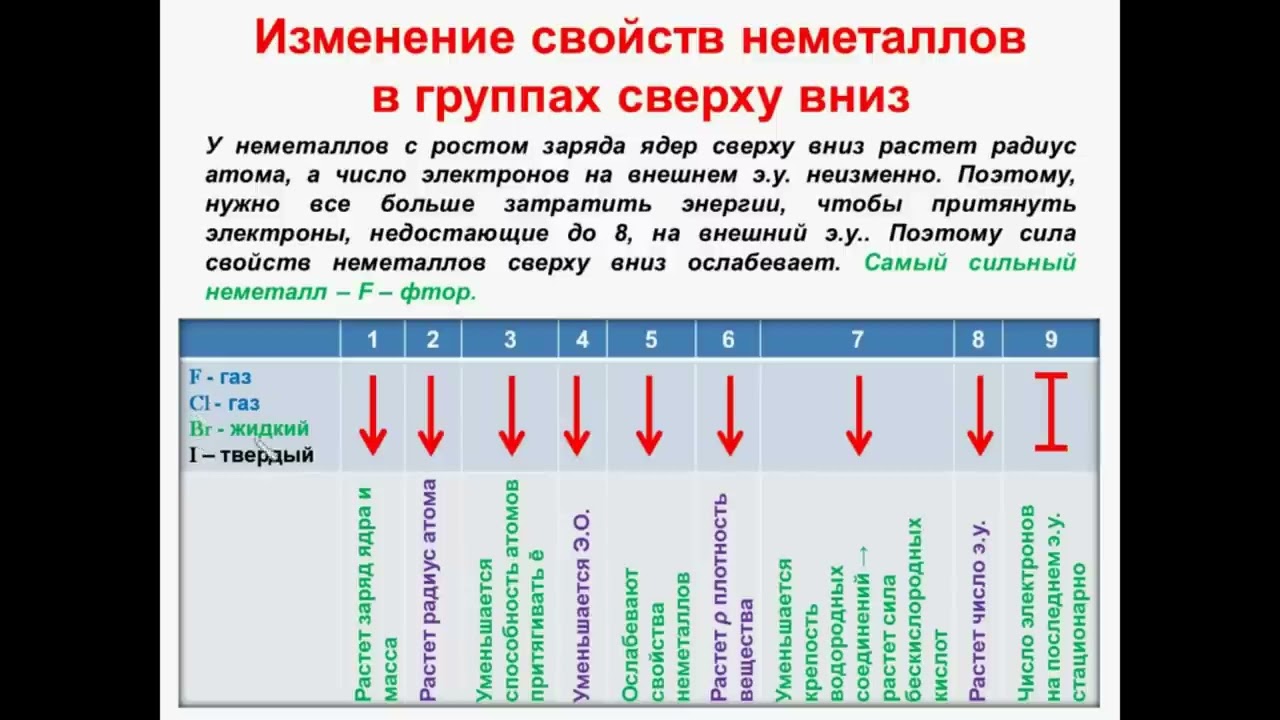 Учитывая недавний низкий ежегодный выпуск новых лекарств фармацевтическими компаниями, этот обзор будет своевременным напоминанием о важном молекулярном свойстве, влияющем на клинический успех.
Учитывая недавний низкий ежегодный выпуск новых лекарств фармацевтическими компаниями, этот обзор будет своевременным напоминанием о важном молекулярном свойстве, влияющем на клинический успех. Введение

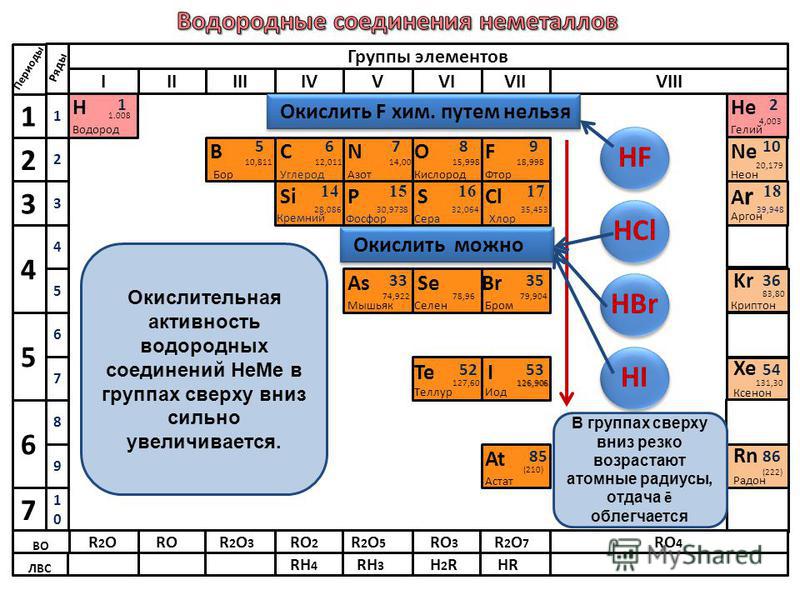 При открытии лекарств часто анализируются многие физико-химические свойства, и вновь возникает интерес к профилям ионизации. 1, 4-8 В этом обзоре будет представлен обзор свойств, связанных с клиническим успехом, и их связь с кислотно-основными свойствами. В частности, мы рассмотрим, как состояние заряда влияет на взаимодействие лекарство-рецептор, фармакокинетические параметры и биофармацевтические свойства кандидатов в лекарства.
При открытии лекарств часто анализируются многие физико-химические свойства, и вновь возникает интерес к профилям ионизации. 1, 4-8 В этом обзоре будет представлен обзор свойств, связанных с клиническим успехом, и их связь с кислотно-основными свойствами. В частности, мы рассмотрим, как состояние заряда влияет на взаимодействие лекарство-рецептор, фармакокинетические параметры и биофармацевтические свойства кандидатов в лекарства. Открытие лекарств
 Последующий процесс превращения ведущего соединения в лекарство включает многофакторную оптимизацию эффективности, селективности и биофармацевтических свойств, таких как абсорбция, распределение, метаболизм, экскреция и токсичность 1, 4 (ADMET) ().
Последующий процесс превращения ведущего соединения в лекарство включает многофакторную оптимизацию эффективности, селективности и биофармацевтических свойств, таких как абсорбция, распределение, метаболизм, экскреция и токсичность 1, 4 (ADMET) (). 
Биофармацевтические свойства

 10 Это включало нанесение биологических данных на график зависимости logD от MW, чтобы продемонстрировать, что соединения, имеющие приемлемые значения, попадают в область, называемую «золотым треугольником». Примечательно, что по мере увеличения молекулярной массы полоса липофильности становится гораздо более узкой, что может удовлетворять атрибутам приемлемой проницаемости и клиренса.
10 Это включало нанесение биологических данных на график зависимости logD от MW, чтобы продемонстрировать, что соединения, имеющие приемлемые значения, попадают в область, называемую «золотым треугольником». Примечательно, что по мере увеличения молекулярной массы полоса липофильности становится гораздо более узкой, что может удовлетворять атрибутам приемлемой проницаемости и клиренса.  При исследовании особое внимание уделялось основности соединений и основным значениям p K a выше 8.4 не повлияло на общий балл CNSMPO. Важно отметить, что для определения значений ClogD 7,4 для каждого вещества требовались оценки значений p K a . Было показано, что основные молекулы с высокими значениями p K a имеют два потенциальных недостатка в качестве лекарственных средств для ЦНС. Во-первых, заряженные катионные препараты имеют пониженное проникновение через гематоэнцефалический барьер (ГЭБ). Кроме того, эти основные соединения имеют более высокую вероятность блокирования каналов hERG. В этом исследовании Вейгер и его коллеги 11 , ClogD 7.4 значений получили оптимальный диапазон от 2,0 до 4,0 для сходства с наркотиками ЦНС.
При исследовании особое внимание уделялось основности соединений и основным значениям p K a выше 8.4 не повлияло на общий балл CNSMPO. Важно отметить, что для определения значений ClogD 7,4 для каждого вещества требовались оценки значений p K a . Было показано, что основные молекулы с высокими значениями p K a имеют два потенциальных недостатка в качестве лекарственных средств для ЦНС. Во-первых, заряженные катионные препараты имеют пониженное проникновение через гематоэнцефалический барьер (ГЭБ). Кроме того, эти основные соединения имеют более высокую вероятность блокирования каналов hERG. В этом исследовании Вейгер и его коллеги 11 , ClogD 7.4 значений получили оптимальный диапазон от 2,0 до 4,0 для сходства с наркотиками ЦНС.  Этот подход направлен на повышение вероятности успеха за счет работы в областях с низким уровнем риска и раннего выявления потенциальных проблемных соединений. Опасность предоставления правил заключается в том, что им можно бездумно следовать, не полностью понимая, как их следует применять или их ограничения.Ясно, что кислотно-щелочные характеристики соединений при открытии лекарств рассматривались, однако константы ионизации, по-видимому, в значительной степени не изучались. В разделах ниже специально рассматриваются доказательства того, что кислотно-щелочные свойства влияют на определенные атрибуты поведения соединения.
Этот подход направлен на повышение вероятности успеха за счет работы в областях с низким уровнем риска и раннего выявления потенциальных проблемных соединений. Опасность предоставления правил заключается в том, что им можно бездумно следовать, не полностью понимая, как их следует применять или их ограничения.Ясно, что кислотно-щелочные характеристики соединений при открытии лекарств рассматривались, однако константы ионизации, по-видимому, в значительной степени не изучались. В разделах ниже специально рассматриваются доказательства того, что кислотно-щелочные свойства влияют на определенные атрибуты поведения соединения. Состояние заряда
 Обычно этого достаточно, чтобы обобщить поведение соединений по отношению к их физико-химическим свойствам. 4-6, 8, 12, 13 В то время как в этой предыдущей работе для классификации каждого соединения использовались значения p K a , 4-6, 8, 12, 13 основное внимание уделялось природе соединений на физиологический рН. Что касается термина «нейтральный», соединение может иметь нейтральный заряд в своей изоэлектрической точке, даже если молекула содержит кислотную или основную функциональную группу.Напротив, соединение классифицируется здесь как нейтральное, если оно не имеет (физиологически) релевантной ионизируемой группы (кислой или основной). Поэтому основное внимание уделяется наличию кислотных и основных групп в молекуле и обсуждаемому рН. Кислота была просто классифицирована как разновидность HA, которая при pH выше p K a будет диссоциировать на анионную A-форму и протон (для простого монопротонного случая). Точно так же основное вещество можно изобразить как вид B, который будет принимать протон ниже значения p K a для образования катионных видов.
Обычно этого достаточно, чтобы обобщить поведение соединений по отношению к их физико-химическим свойствам. 4-6, 8, 12, 13 В то время как в этой предыдущей работе для классификации каждого соединения использовались значения p K a , 4-6, 8, 12, 13 основное внимание уделялось природе соединений на физиологический рН. Что касается термина «нейтральный», соединение может иметь нейтральный заряд в своей изоэлектрической точке, даже если молекула содержит кислотную или основную функциональную группу.Напротив, соединение классифицируется здесь как нейтральное, если оно не имеет (физиологически) релевантной ионизируемой группы (кислой или основной). Поэтому основное внимание уделяется наличию кислотных и основных групп в молекуле и обсуждаемому рН. Кислота была просто классифицирована как разновидность HA, которая при pH выше p K a будет диссоциировать на анионную A-форму и протон (для простого монопротонного случая). Точно так же основное вещество можно изобразить как вид B, который будет принимать протон ниже значения p K a для образования катионных видов.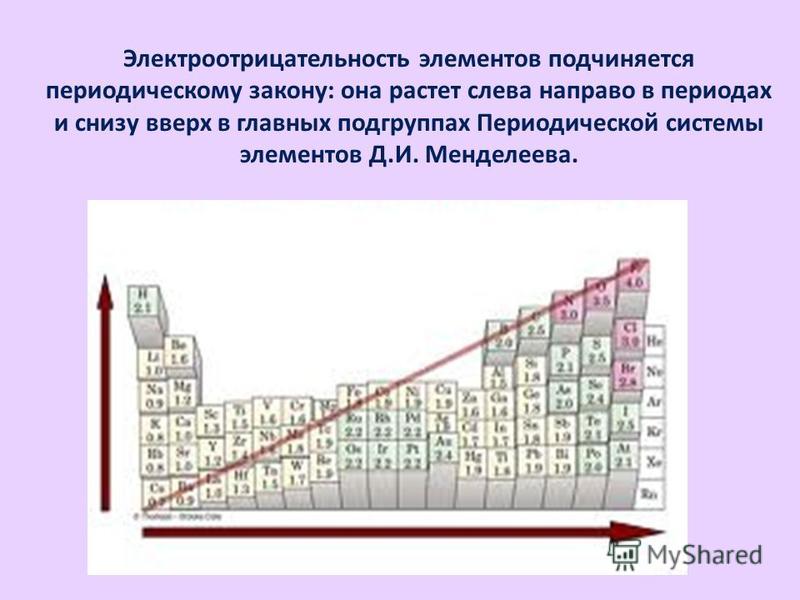

 0).
0). Всасывание, проницаемость и биодоступность

 Считалось, что проблемой является основная аминогруппа со значением p K a , близким к 9,7. Были синтезированы фторированные аналоги, которые снизили значения p K a амина до 8.0 и 8.8. Последующие испытания показали значительное улучшение пероральной абсорбции фторированных производных. Увеличение всасывания было связано с более высокой долей нейтральных частиц в кишечнике.
Считалось, что проблемой является основная аминогруппа со значением p K a , близким к 9,7. Были синтезированы фторированные аналоги, которые снизили значения p K a амина до 8.0 и 8.8. Последующие испытания показали значительное улучшение пероральной абсорбции фторированных производных. Увеличение всасывания было связано с более высокой долей нейтральных частиц в кишечнике.  Исследование Глисона также показало, что биодоступность было труднее интерпретировать, чем проницаемость, поскольку в первой присутствуют компоненты как абсорбции, так и клиренса. Состояние ионизации оказало лишь незначительное влияние на биодоступность, однако было обнаружено, что кислоты в среднем более биодоступны, что контрастировало с данными о кислотной проницаемости в целом.Его исследование интересно совпало с предыдущими исследованиями, показавшими, что кислоты имеют более высокую пероральную биодоступность и, вероятно, являются результатом лучшей растворимости и более низкого клиренса. 4 Основания, как правило, протонируются в желудочно-кишечном тракте и, следовательно, имеют более высокую полярность и пониженную липофильность, что ограничивает пассивное всасывание через биомембраны.
Исследование Глисона также показало, что биодоступность было труднее интерпретировать, чем проницаемость, поскольку в первой присутствуют компоненты как абсорбции, так и клиренса. Состояние ионизации оказало лишь незначительное влияние на биодоступность, однако было обнаружено, что кислоты в среднем более биодоступны, что контрастировало с данными о кислотной проницаемости в целом.Его исследование интересно совпало с предыдущими исследованиями, показавшими, что кислоты имеют более высокую пероральную биодоступность и, вероятно, являются результатом лучшей растворимости и более низкого клиренса. 4 Основания, как правило, протонируются в желудочно-кишечном тракте и, следовательно, имеют более высокую полярность и пониженную липофильность, что ограничивает пассивное всасывание через биомембраны.  14-16 Kubinyi 18 обобщил эту концепцию следующим заявлением:
14-16 Kubinyi 18 обобщил эту концепцию следующим заявлением:
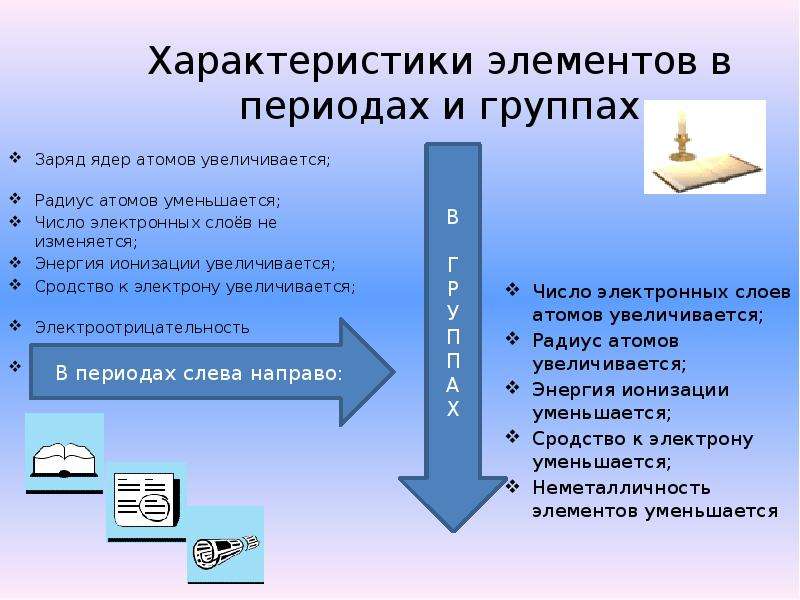 19 Хотя Palm и др. . также показали отчетливое увеличение коэффициентов проницаемости с увеличением доли неионизированного (f(u)) лекарственного средства, они также подчеркнули, что в случаях, когда f(u) было ниже 0,1, вклад ионизированной формы был значительным. 15 Совершенно очевидно, что всасывание включает ряд процессов и усложняет нашу способность обобщать свойства лекарств. Кислотный/основной характер и значения p K a являются важными детерминантами абсорбции и проникновения, однако необходимо принимать во внимание и другие факторы, такие как: липофильность, размер, метаболическая лабильность, механизмы оттока и гидрофильность, которые были рассмотрены ранее. . 9, 20
19 Хотя Palm и др. . также показали отчетливое увеличение коэффициентов проницаемости с увеличением доли неионизированного (f(u)) лекарственного средства, они также подчеркнули, что в случаях, когда f(u) было ниже 0,1, вклад ионизированной формы был значительным. 15 Совершенно очевидно, что всасывание включает ряд процессов и усложняет нашу способность обобщать свойства лекарств. Кислотный/основной характер и значения p K a являются важными детерминантами абсорбции и проникновения, однако необходимо принимать во внимание и другие факторы, такие как: липофильность, размер, метаболическая лабильность, механизмы оттока и гидрофильность, которые были рассмотрены ранее. . 9, 20 Объем распределения, связывание с белками плазмы
 Параметр, объем распределения (V d ), представляет собой теоретическое свойство, при котором большие значения указывают на то, что лекарство широко распространено, а малые значения (например, от 0,1 до 0,2 л/кг) указывают на то, что соединение в основном находится в большом круге кровообращения. .Объем распределения является ключевым фактором, определяющим фармакокинетические свойства, и вместе с информацией о клиренсе можно определить биологический период полувыведения лекарственного средства (период полувыведения = 0,693 × V d /клиренс). Соединения с более высокой липофильностью обычно имеют более высокие значения V d . Что еще более важно, связывание с белками плазмы крови оказывает значительное влияние на объем распределения. Плазма человека содержит более 60 белков, однако только на три из них приходится большая часть связывания лекарств: альбумин (переносит в основном анионные препараты, некоторые катионные и нейтральные препараты), α 1 -кислотный гликопротеин (AAG) (катионные и нейтральные препараты) и липопротеины (катионные и нейтральные препараты).
Параметр, объем распределения (V d ), представляет собой теоретическое свойство, при котором большие значения указывают на то, что лекарство широко распространено, а малые значения (например, от 0,1 до 0,2 л/кг) указывают на то, что соединение в основном находится в большом круге кровообращения. .Объем распределения является ключевым фактором, определяющим фармакокинетические свойства, и вместе с информацией о клиренсе можно определить биологический период полувыведения лекарственного средства (период полувыведения = 0,693 × V d /клиренс). Соединения с более высокой липофильностью обычно имеют более высокие значения V d . Что еще более важно, связывание с белками плазмы крови оказывает значительное влияние на объем распределения. Плазма человека содержит более 60 белков, однако только на три из них приходится большая часть связывания лекарств: альбумин (переносит в основном анионные препараты, некоторые катионные и нейтральные препараты), α 1 -кислотный гликопротеин (AAG) (катионные и нейтральные препараты) и липопротеины (катионные и нейтральные препараты). 21 Большинство вычислительных исследований, которые связывают связывание белков плазмы и кислотно-основные характеристики, были ограничены моделированием соединений с использованием следующих широких категорий при физиологическом рН: кислые, основные, нейтральные или цвиттерионные. 22, 23 Как правило, основные соединения имеют большие значения V d , в то время как кислотные соединения имеют меньшие значения. Таким образом, количество препарата, попадающего в печень и почки, значительно различается между кислотами и основаниями. Связанные с тканями соединения, такие как основания, склонны к взаимодействию с кислотными головными группами (фосфо)липидов, тогда как кислоты легко связываются с остатками лизина в белках плазмы крови.Недавнее исследование, проведенное в GlaxoSmithKline 4 , подтвердило эти установленные данные, продемонстрировав, что основные соединения более широко распределяются по всему телу. 23 Это исследование также показало, что кислоты имеют более низкие значения V d , чем нейтральные или цвиттерионные соединения.
21 Большинство вычислительных исследований, которые связывают связывание белков плазмы и кислотно-основные характеристики, были ограничены моделированием соединений с использованием следующих широких категорий при физиологическом рН: кислые, основные, нейтральные или цвиттерионные. 22, 23 Как правило, основные соединения имеют большие значения V d , в то время как кислотные соединения имеют меньшие значения. Таким образом, количество препарата, попадающего в печень и почки, значительно различается между кислотами и основаниями. Связанные с тканями соединения, такие как основания, склонны к взаимодействию с кислотными головными группами (фосфо)липидов, тогда как кислоты легко связываются с остатками лизина в белках плазмы крови.Недавнее исследование, проведенное в GlaxoSmithKline 4 , подтвердило эти установленные данные, продемонстрировав, что основные соединения более широко распределяются по всему телу. 23 Это исследование также показало, что кислоты имеют более низкие значения V d , чем нейтральные или цвиттерионные соединения. Опять же, другие факторы играют роль в степени связывания лекарств с белками, в частности, липофильность, и вместе с кислотно-основными свойствами они сильно влияют на клиренс и воздействие на органы-мишени.
Опять же, другие факторы играют роль в степени связывания лекарств с белками, в частности, липофильность, и вместе с кислотно-основными свойствами они сильно влияют на клиренс и воздействие на органы-мишени. Связывание тканей головного мозга, проницаемость гематоэнцефалического барьера
 Вместо этого было обнаружено, что на связывание с тканями головного мозга в основном влияют неспецифические явления, особенно липофильность. 4
Вместо этого было обнаружено, что на связывание с тканями головного мозга в основном влияют неспецифические явления, особенно липофильность. 4  Fischer и соавт. 27 подчеркнули отсутствие препаратов для ЦНС с кислой p K a < 4 или основных групп с p K a > 10. Fan et al . 25 показали, что кислые препараты обладают наименьшей пенетрантностью (среднее значение logBB -2,0), в то время как основные и нейтральные соединения показали аналогичные средние значения ca . -0,5. (обратите внимание, logBB = log([мозг]/[кровь])). Броккателли и др. . 28 также обнаружили, что кислотные соединения со значениями p K a ниже 5.5, согласно нашим выводам, с меньшей вероятностью были проникающими в ЦНС. 7 Их работа по моделированию, которая была направлена на прогнозирование проникновения в ЦНС, позволяла учитывать состояния ионизации с использованием молекулярных дескрипторов VolSurf (http://www.moldiscovery.com/soft_volsurf.php). В совокупности приведенная выше информация может быть использована для разработки лигандов, где требуется проникновение в ЦНС, или в случаях, когда необходимо исключение ЦНС для минимизации побочных эффектов.
Fischer и соавт. 27 подчеркнули отсутствие препаратов для ЦНС с кислой p K a < 4 или основных групп с p K a > 10. Fan et al . 25 показали, что кислые препараты обладают наименьшей пенетрантностью (среднее значение logBB -2,0), в то время как основные и нейтральные соединения показали аналогичные средние значения ca . -0,5. (обратите внимание, logBB = log([мозг]/[кровь])). Броккателли и др. . 28 также обнаружили, что кислотные соединения со значениями p K a ниже 5.5, согласно нашим выводам, с меньшей вероятностью были проникающими в ЦНС. 7 Их работа по моделированию, которая была направлена на прогнозирование проникновения в ЦНС, позволяла учитывать состояния ионизации с использованием молекулярных дескрипторов VolSurf (http://www.moldiscovery.com/soft_volsurf.php). В совокупности приведенная выше информация может быть использована для разработки лигандов, где требуется проникновение в ЦНС, или в случаях, когда необходимо исключение ЦНС для минимизации побочных эффектов.
Механизмы оттока
32
 Хотя эти результаты важны, сродство P-gp для каждого структурного класса будет различаться, и на ранней стадии требуется лабораторное тестирование для установления каких-либо ограничений.
Хотя эти результаты важны, сродство P-gp для каждого структурного класса будет различаться, и на ранней стадии требуется лабораторное тестирование для установления каких-либо ограничений. Связывание hERG
 4
4 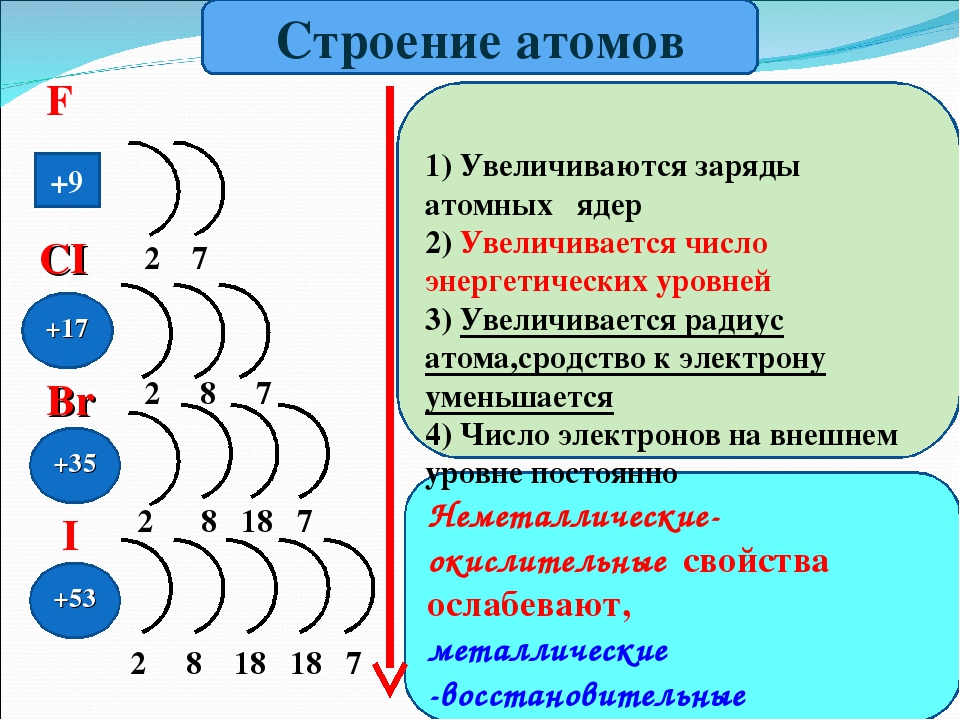 36 Исследования, специально использующие значения p K a для оценки риска ингибирования каналов hERG, еще не проводились, и хотя не было продемонстрировано никакой конкретной связи с p K a , Wager и соавторы 11 проанализировали внутренние данные, чтобы сделать вывод, что риск блокады канала hERG был выше, когда молекула имела основной центр с ap K a выше 8.4.
36 Исследования, специально использующие значения p K a для оценки риска ингибирования каналов hERG, еще не проводились, и хотя не было продемонстрировано никакой конкретной связи с p K a , Wager и соавторы 11 проанализировали внутренние данные, чтобы сделать вывод, что риск блокады канала hERG был выше, когда молекула имела основной центр с ap K a выше 8.4. Таблица 1
Кислоты Базы Базы Neightles Zwittrions 4 Logd 7.  4
4 > 4 1.4 3.3 3.3 2.3 2,3 CLOGP > 9 1,9 1,9 4,4 4,4 Фосфолипидоз
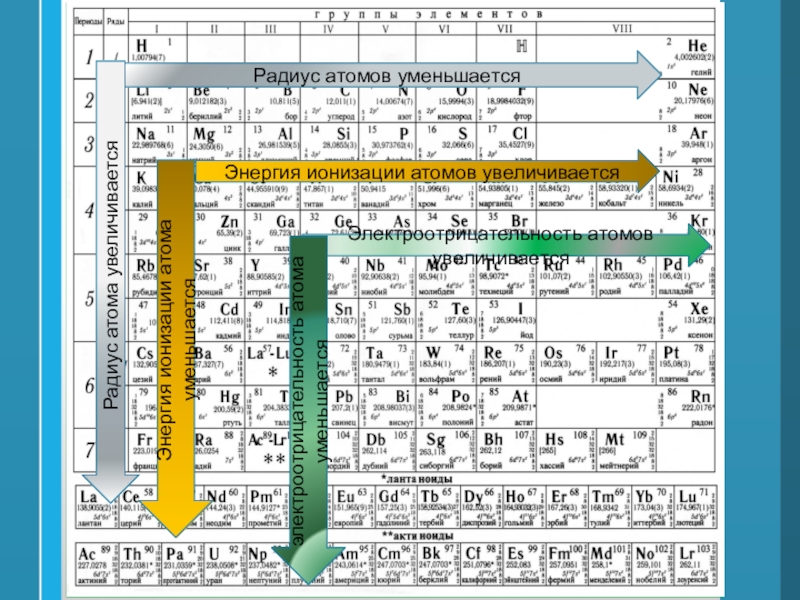 Плоемен и его коллеги 37 разработали модель для прогнозирования способности катионных соединений вызывать фосфолипидоз. Позднее эта модель была обновлена 38 до следующего простого расчета, ориентированного как на липофильность, так и на p K a основной группы. Соединение потенциально может вызывать фосфолипидоз, если (ClogP) 2 + (расчетное основное p K a ) 2 ≥ 50, пока ClogP > 2 и p K a > 6018
Плоемен и его коллеги 37 разработали модель для прогнозирования способности катионных соединений вызывать фосфолипидоз. Позднее эта модель была обновлена 38 до следующего простого расчета, ориентированного как на липофильность, так и на p K a основной группы. Соединение потенциально может вызывать фосфолипидоз, если (ClogP) 2 + (расчетное основное p K a ) 2 ≥ 50, пока ClogP > 2 и p K a > 6018 40 Индукторы фосфолипидоза были предсказаны с точностью 82%, если самые основные значения p K a * V d * ClogP превышали 180. Эти простые модели используют значения p K a для прогнозирования соединения токсичность и может быть легко применена при поиске новых лекарств.
40 Индукторы фосфолипидоза были предсказаны с точностью 82%, если самые основные значения p K a * V d * ClogP превышали 180. Эти простые модели используют значения p K a для прогнозирования соединения токсичность и может быть легко применена при поиске новых лекарств. Таблица 2
Таблица 2
| CLOGP | Чистый заряд | Чистый заряд | ||||
|---|---|---|---|---|---|---|
| <1 | 1 2 | 1 | ||||
|
| ||||||
| < 1.61 | Отсутствует | Низких | Высокого | |||
| 1,61 ≤ ClogP <2,75 | Отсутствует | Среднего | Высокого | |||
| ≥ 2,75 | Отсутствует | Высокого | высокого | |||
митохондриальная дисфункция
Нарушение митохондриальных процессов недавно было признано причиной нецелевой лекарственной токсичности и привело к изъятию нескольких соединений из клиники. В частности, два соединения, троглитазон и церивастатин, были исключены из списка из-за их влияния на митохондриальное окислительное фосфорилирование. 41 Основной функцией митохондрий является производство энергии для клетки в форме аденозинтрифосфата (АТФ). Соединения, которые резко снижают выработку АТФ, вызывают ряд симптомов, таких как лактоацидоз, который клинически проявляется тошнотой, рвотой и болью в животе. Чтобы предотвратить попадание этих соединений в тесты на животных или людях, были разработаны методы доклинического скрининга для выявления молекул, которые мешают функции митохондрий. 42 Исследование более 2000 соединений, проведенное Naven et al . показал, что кислые препараты представляют наибольшие проблемы. 43 Они также показали более высокую склонность к разобщающей активности при повышенной липофильности. Ряд кислотных функциональных групп был отмечен как особенно проблемный, например, антраниловые кислоты, тиазолиндионы, фторметилсульфонанилиды, салицилаты и ациклиндолоны.
В частности, два соединения, троглитазон и церивастатин, были исключены из списка из-за их влияния на митохондриальное окислительное фосфорилирование. 41 Основной функцией митохондрий является производство энергии для клетки в форме аденозинтрифосфата (АТФ). Соединения, которые резко снижают выработку АТФ, вызывают ряд симптомов, таких как лактоацидоз, который клинически проявляется тошнотой, рвотой и болью в животе. Чтобы предотвратить попадание этих соединений в тесты на животных или людях, были разработаны методы доклинического скрининга для выявления молекул, которые мешают функции митохондрий. 42 Исследование более 2000 соединений, проведенное Naven et al . показал, что кислые препараты представляют наибольшие проблемы. 43 Они также показали более высокую склонность к разобщающей активности при повышенной липофильности. Ряд кислотных функциональных групп был отмечен как особенно проблемный, например, антраниловые кислоты, тиазолиндионы, фторметилсульфонанилиды, салицилаты и ациклиндолоны.
Клиренс, метаболизм и ферменты цитохрома Р450
Рассмотрение клиренса лекарственного средства должно охватывать как почечный, так и печеночный пути.Также необходимо включить билиарные системы, и в совокупности эти пути влияют на фармакокинетические параметры, такие как период полувыведения. Липофильность является доминирующим фактором клиренса, так как она определяет проницаемость лекарственного средства через мембраны, особенно в почечной системе. Водный компонент крови фильтруется почками, и реабсорбция соединений зависит от их logD. Положительные значения logD 7,4 предсказывают реабсорбцию соединения, в то время как значения со значениями ниже 0.0 очищаются легче. Состояние ионизации играет роль в клиренсе и особенно зависит от связывания с белками. Поскольку анионная форма кислот может сильно связываться с белками плазмы, они с меньшей вероятностью выводятся, тогда как основания, как правило, демонстрируют более высокие скорости выведения. 4
Следует также учитывать вторичный метаболизм, поскольку начальный метаболизм часто может генерировать ионизируемые функциональные группы. Например, соединения, содержащие карбоновые кислоты, подвержены ацилглюкуронированию, что влияет на их химическую реакционную способность и профиль побочных эффектов. 44 Несмотря на это, около 19% лекарств содержат карбоксилат (неопубликованные наблюдения за лекарствами, одобренными FDA), и он остается важной функциональной группой для медицинских химиков.
Например, соединения, содержащие карбоновые кислоты, подвержены ацилглюкуронированию, что влияет на их химическую реакционную способность и профиль побочных эффектов. 44 Несмотря на это, около 19% лекарств содержат карбоксилат (неопубликованные наблюдения за лекарствами, одобренными FDA), и он остается важной функциональной группой для медицинских химиков.
Поскольку липофильные соединения реабсорбируются в почках, необходим метаболизм, чтобы сделать их более растворимыми в воде. Лекарства и другие экзогенные химические вещества часто метаболизируются ферментами цитохрома Р450, при этом большинство лекарств метаболизируются изоформами цитохрома Р450 1А2, 2С9, 2С19, 2D6 и 3А4. 45 В области разработки лекарств часто предпринимаются усилия по снижению метаболизма лекарств с помощью ферментов P450. Причины этого связаны с уменьшением производства потенциально токсичных метаболитов и с целью избежать вмешательства в метаболизм других лекарств, что может привести к лекарственным взаимодействиям. Уменьшение метаболизма лекарственного средства также позволяет увеличить период полувыведения и менее частые режимы дозирования. Изоформы P450, на которые больше всего влияет состояние заряда, включают 2C9 и 2D6, в то время как для остальных изоформ было показано, что состояние ионизации играет меньшую роль. 4 Другие факторы играют роль в предпочтении изоформ цитохрома P450 для органических соединений и включают MW и logP. Ферменты цитохрома Р450 и другие ферменты, метаболизирующие лекарственные средства, могут давать биологически активные метаболиты, процесс, известный как биоактивация. К счастью, трехмерная структурная информация о белках начинает помогать нам оценивать предпочтения субстрата, хотя эти ферменты, как известно, неразборчивы в связях. Это понятно, если вспомнить об их широкой роли в метаболизме как эндогенных, так и экзогенных соединений. 46, 47
Уменьшение метаболизма лекарственного средства также позволяет увеличить период полувыведения и менее частые режимы дозирования. Изоформы P450, на которые больше всего влияет состояние заряда, включают 2C9 и 2D6, в то время как для остальных изоформ было показано, что состояние ионизации играет меньшую роль. 4 Другие факторы играют роль в предпочтении изоформ цитохрома P450 для органических соединений и включают MW и logP. Ферменты цитохрома Р450 и другие ферменты, метаболизирующие лекарственные средства, могут давать биологически активные метаболиты, процесс, известный как биоактивация. К счастью, трехмерная структурная информация о белках начинает помогать нам оценивать предпочтения субстрата, хотя эти ферменты, как известно, неразборчивы в связях. Это понятно, если вспомнить об их широкой роли в метаболизме как эндогенных, так и экзогенных соединений. 46, 47
Кислотно-щелочной профиль пероральных препаратов
Наш анализ кислотно-щелочного профиля малых органических веществ специально исследовал p K a каждой функциональной группы, чтобы классифицировать каждое соединение. В первом из наших исследований рассматривался набор опубликованных значений p K a для серии старых препаратов (см. ссылку 7 ). Хотя это было информативно, впоследствии был исследован более широкий набор соединений, включающих соединения, используемые в настоящее время в клинической практике. 7 Это последнее исследование предоставило несколько уровней анализа, охватывающих долю классов состояния заряда в распределениях кислот и оснований p K a . Кроме того, соединения были разделены на пероральные препараты и препараты, воздействующие на ЦНС, чтобы можно было провести сравнение между этими группами. Опросы такого рода дают представление о наркотиках в целом, и наблюдения могут быть применены на ранней стадии исследовательской работы.
В первом из наших исследований рассматривался набор опубликованных значений p K a для серии старых препаратов (см. ссылку 7 ). Хотя это было информативно, впоследствии был исследован более широкий набор соединений, включающих соединения, используемые в настоящее время в клинической практике. 7 Это последнее исследование предоставило несколько уровней анализа, охватывающих долю классов состояния заряда в распределениях кислот и оснований p K a . Кроме того, соединения были разделены на пероральные препараты и препараты, воздействующие на ЦНС, чтобы можно было провести сравнение между этими группами. Опросы такого рода дают представление о наркотиках в целом, и наблюдения могут быть применены на ранней стадии исследовательской работы.
Сосредоточение внимания на пероральных препаратах показало, что 78.6% соединений содержали ионизируемую группу, 11,9% были нейтральными, 4,3% всегда ионизированными, а остальные (5,2%) состояли из солей, различных соединений (например, смесей) и высокомолекулярных веществ. 7 показывает, что ионизируемые соединения преимущественно состоят из молекул с одной кислотной или основной группой, а также из простых амфолитов, содержащих одну кислоту и одно основание. Большая доля ионизируемых соединений была интересной статистикой, которая является отражением процесса оптимизации, который обеспечивает необходимые свойства, подходящие для взаимодействия с сайтом связывания, и биофармацевтические свойства.
7 показывает, что ионизируемые соединения преимущественно состоят из молекул с одной кислотной или основной группой, а также из простых амфолитов, содержащих одну кислоту и одно основание. Большая доля ионизируемых соединений была интересной статистикой, которая является отражением процесса оптимизации, который обеспечивает необходимые свойства, подходящие для взаимодействия с сайтом связывания, и биофармацевтические свойства.
(A), Доля категорий соединений для ионизируемых пероральных препаратов. 7 (B), p K a дистрибутивов пероральных препаратов, содержащих одну кислотную функциональную группу или (C) одну основную функциональную группу. Соединения со следующими критериями классифицировались как всегда ионизированные: кислоты со значениями p K a < 0 и основания со значениями p K a > 12, а также соединения с постоянно заряженными группами (например, четвертичными атомами азота). .Кислоты со значениями p K a выше 10 или основания со значениями p K a ниже 0,0 считались нейтральными. Остальные ионизируемые соединения (кислота p K a диапазон 0-10 и основание p K a диапазон 0-12) были разделены на следующие группы: вещества, содержащие отдельные кислоты, вещества, содержащие отдельные основания, соединения с двумя кислотными группами, соединения с двумя основными группами, простые амфолиты (одна кислотная и одна основная группа) и другие сложные сочетания кислотных и основных групп (сложные амфолиты).p K a значений были объединены в диапазоны единичных логарифмических единиц (т. е. 0,0 < X ≤ 1,0, 1,0 < X ≤ 2,0 и т. д.). Высота столбца гистограммы выражается в процентах.
Остальные ионизируемые соединения (кислота p K a диапазон 0-10 и основание p K a диапазон 0-12) были разделены на следующие группы: вещества, содержащие отдельные кислоты, вещества, содержащие отдельные основания, соединения с двумя кислотными группами, соединения с двумя основными группами, простые амфолиты (одна кислотная и одна основная группа) и другие сложные сочетания кислотных и основных групп (сложные амфолиты).p K a значений были объединены в диапазоны единичных логарифмических единиц (т. е. 0,0 < X ≤ 1,0, 1,0 < X ≤ 2,0 и т. д.). Высота столбца гистограммы выражается в процентах.
Графики распределения p K a веществ, содержащих одну кислоту и одно основание, показаны на . Интересно, что для кислот существует двухфазное распределение, показывающее малое количество кислот со значениями p K a между 6 и 7. Это можно объяснить преобладанием карбоксилатных и фенольных веществ в этом наборе и диапазоном значений p . K a значений, обычно встречающихся для этих групп.С другой стороны, основания имеют распределение, показывающее, что большинство этих веществ имеют значения p K a выше 6,0. Опять же, это можно объяснить большим количеством алифатических аминов в этом наборе, которые в основном нацелены на GPCR. На общий состав классов соединений и их распределения влияют многочисленные факторы. 7 Учитывая, что это признанные препараты, свойства ADMET являются доминирующими факторами, а также необходимостью соблюдения необходимых взаимодействий сайтов связывания.Ценность этой работы заключалась в том, чтобы предоставить дополнительную информацию помимо стандартных физико-химических свойств, которые могут повлиять на выбор скрининговых коллекций и разнообразие ионизируемых функциональных групп в этих соединениях. Наш анализ скрининга соединений и наборов данных хемогеномики дополняет эту работу по наркотикам, и рукопись по этой теме находится в стадии подготовки.
K a значений, обычно встречающихся для этих групп.С другой стороны, основания имеют распределение, показывающее, что большинство этих веществ имеют значения p K a выше 6,0. Опять же, это можно объяснить большим количеством алифатических аминов в этом наборе, которые в основном нацелены на GPCR. На общий состав классов соединений и их распределения влияют многочисленные факторы. 7 Учитывая, что это признанные препараты, свойства ADMET являются доминирующими факторами, а также необходимостью соблюдения необходимых взаимодействий сайтов связывания.Ценность этой работы заключалась в том, чтобы предоставить дополнительную информацию помимо стандартных физико-химических свойств, которые могут повлиять на выбор скрининговых коллекций и разнообразие ионизируемых функциональных групп в этих соединениях. Наш анализ скрининга соединений и наборов данных хемогеномики дополняет эту работу по наркотикам, и рукопись по этой теме находится в стадии подготовки.
Другие группы также рассматривали состояние заряда лекарств, которое было включено в их общий анализ физико-химических свойств. 6, 13 Bocker и др. . особое внимание уделялось карбоксилатам, но также давало сравнение стандартных физико-химических свойств, разделяя лекарства на кислоты, основания, нейтралы и цвиттер-ионы. 13 Между группами наблюдались незначительные различия, однако было обнаружено, что нейтральные препараты имеют меньше вращающихся связей, а основные препараты имеют значительно меньшее количество акцепторов водородных связей. Их исследование завершилось рядом наблюдений, которые могли предсказать, будет ли соединение, содержащее карбоновую кислоту, демонстрировать приемлемые свойства ADME. 13 Следующий список обеспечивает желаемые свойства, и в этом случае не должно быть нарушено более одного порогового значения: -бопонды ≤ 6
# Rotatable Bonds ≤ 9
#
Clogp <3
-1. 5
5
60
P K a (COOH) > 3
Более обширный анализ молекулярных свойств и зарядовых состояний был проведен Лисоном и его коллегами 6 , которые также изучили изменения этих параметров за последние несколько десятилетий.Соединения снова были разделены на кислоты, основания, нейтралы и цвиттер-ионы, однако для четвертичных аминов был включен дополнительный класс «катионов». Был сравнен широкий спектр свойств в поисках тенденций, чтобы определить, достигли ли определенные характеристики консенсуса с течением времени. Например, было показано, что липофильность нейтральных и кислых пероральных препаратов со временем увеличивается, в то время как основные препараты уже достигли диапазона липофильности, характерного для других классов. Другие выводы показали, что 6 :
- :
-
МВт увеличивается во всех классах со временем
-
# Доноры H-Bond стабильны
-
# H-связи акцепторы увеличиваются со временем
-
ароматический атом count – sp 3 количество атомов (Ar-sp 3 ) постоянно со временем.
 (Ar-sp 3 описывает форму или ароматический/алифатический баланс)
(Ar-sp 3 описывает форму или ароматический/алифатический баланс) -
ACD Labs/pKa (ACD Labs, http://www.acdlabs.com/home/)
-
ADME Boxes (Pharma) ://фарма-алгоритмы.com/)
-
ADMET Predictor (Simulations Plus, http://www.simulations-plus.com/)
-
CSpKa (ChemSilico, http://www.chemsilico.com/)
-
Marvin (ChemAxon, http://www.chemaxon.com/)
-
MoKa (Molecular Discovery, http://www.moldiscovery.com/)
-
Pipeline Pilot (Accelrys, http://accelrys.com /)
-
pKalc (CompuDrug, http://www.compudrug.com/)
-
QikProp и Epik (Schrödinger, http://www.schrodinger.com/)
-
Quacpac (OpenEye, http://www.eyesopen.com/)
-
SPARC (ARChem, http://archemcalc.
 com/sparc/)
com/sparc/) - Душан STOSIC
- Основные свойства катализаторов uuid:255b29a3-5290-40d0-b2d1-fe32d4bcf878uuid:99a23d33-e58c-4585-b208-be252a47bde6Acrobat Distiller 10.1.5 (Windows) конечный поток эндообъект 8 0 объект > эндообъект 9 0 объект > эндообъект 10 0 объект > эндообъект 11 0 объект > эндообъект 12 0 объект > эндообъект 13 0 объект > эндообъект 14 0 объект > эндообъект 15 0 объект > эндообъект 16 0 объект > эндообъект 17 0 объект > эндообъект 18 0 объект > эндообъект 19 0 объект > эндообъект 20 0 объект > эндообъект 21 0 объект > эндообъект 22 0 объект > эндообъект 23 0 объект > эндообъект 24 0 объект > эндообъект 25 0 объект > эндообъект 26 0 объект > эндообъект 27 0 объект > эндообъект 28 0 объект > эндообъект 29 0 объект > эндообъект 30 0 объект > эндообъект 31 0 объект > эндообъект 32 0 объект > эндообъект 33 0 объект > эндообъект 34 0 объект > эндообъект 35 0 объект > эндообъект 36 0 объект > эндообъект 37 0 объект > эндообъект 38 0 объект > эндообъект 39 0 объект > эндообъект 40 0 объект > эндообъект 41 0 объект > эндообъект 42 0 объект > эндообъект 43 0 объект > эндообъект 44 0 объект > эндообъект 45 0 объект > эндообъект 46 0 объект > эндообъект 47 0 объект > эндообъект 48 0 объект > эндообъект 49 0 объект > эндообъект 50 0 объект > эндообъект 51 0 объект > эндообъект 52 0 объект > эндообъект 53 0 объект > эндообъект 54 0 объект > эндообъект 55 0 объект > эндообъект 56 0 объект > эндообъект 57 0 объект > эндообъект 58 0 объект > эндообъект 59 0 объект > эндообъект 60 0 объект > эндообъект 61 0 объект > эндообъект 62 0 объект > эндообъект 63 0 объект > эндообъект 64 0 объект > эндообъект 65 0 объект > эндообъект 66 0 объект > эндообъект 67 0 объект > эндообъект 68 0 объект > эндообъект 69 0 объект > эндообъект 70 0 объект > эндообъект 71 0 объект > эндообъект 72 0 объект > эндообъект 73 0 объект > эндообъект 74 0 объект > эндообъект 75 0 объект > эндообъект 76 0 объект > эндообъект 77 0 объект > эндообъект 78 0 объект > эндообъект 79 0 объект > эндообъект 80 0 объект > эндообъект 81 0 объект > эндообъект 82 0 объект > эндообъект 83 0 объект > эндообъект 84 0 объект > эндообъект 85 0 объект > эндообъект 86 0 объект > эндообъект 87 0 объект > эндообъект 88 0 объект > эндообъект 89 0 объект > эндообъект 90 0 объект > эндообъект 91 0 объект > эндообъект 92 0 объект > эндообъект 93 0 объект > эндообъект 94 0 объект > эндообъект 95 0 объект > эндообъект 96 0 объект > эндообъект 97 0 объект > эндообъект 98 0 объект > эндообъект 99 0 объект > эндообъект 100 0 объект > эндообъект 101 0 объект > эндообъект 102 0 объект > эндообъект 103 0 объект > эндообъект 104 0 объект > эндообъект 105 0 объект > эндообъект 106 0 объект > эндообъект 107 0 объект > эндообъект 108 0 объект > эндообъект 109 0 объект > эндообъект 110 0 объект > эндообъект 111 0 объект > эндообъект 112 0 объект > эндообъект 113 0 объект > эндообъект 114 0 объект > эндообъект 115 0 объект > эндообъект 116 0 объект > эндообъект 117 0 объект > эндообъект 118 0 объект > эндообъект 119 0 объект > эндообъект 120 0 объект > эндообъект 121 0 объект > эндообъект 122 0 объект > эндообъект 123 0 объект > эндообъект 124 0 объект > эндообъект 125 0 объект > эндообъект 126 0 объект > эндообъект 127 0 объект > эндообъект 128 0 объект > эндообъект 129 0 объект > эндообъект 130 0 объект > эндообъект 131 0 объект > эндообъект 132 0 объект > эндообъект 133 0 объект > эндообъект 134 0 объект > эндообъект 135 0 объект > эндообъект 136 0 объект > эндообъект 137 0 объект > эндообъект 138 0 объект > эндообъект 139 0 объект > эндообъект 140 0 объект > эндообъект 141 0 объект > эндообъект 142 0 объект > эндообъект 143 0 объект > эндообъект 144 0 объект > эндообъект 145 0 объект > эндообъект 146 0 объект > эндообъект 147 0 объект > эндообъект 148 0 объект > эндообъект 149 0 объект > эндообъект 150 0 объект > эндообъект 151 0 объект > эндообъект 152 0 объект > эндообъект 153 0 объект > эндообъект 154 0 объект > эндообъект 155 0 объект > эндообъект 156 0 объект > эндообъект 157 0 объект > эндообъект 158 0 объект > эндообъект 159 0 объект > эндообъект 160 0 объект > эндообъект 161 0 объект > эндообъект 162 0 объект > эндообъект 163 0 объект > эндообъект 164 0 объект > эндообъект 165 0 объект > эндообъект 166 0 объект > эндообъект 167 0 объект > эндообъект 168 0 объект > эндообъект 169 0 объект > эндообъект 170 0 объект > эндообъект 171 0 объект > эндообъект 172 0 объект > эндообъект 173 0 объект > эндообъект 174 0 объект > эндообъект 175 0 объект > эндообъект 176 0 объект > эндообъект 177 0 объект > эндообъект 178 0 объект > эндообъект 179 0 объект > эндообъект 180 0 объект > эндообъект 181 0 объект > эндообъект 182 0 объект > эндообъект 183 0 объект > эндообъект 184 0 объект > эндообъект 185 0 объект > эндообъект 186 0 объект > эндообъект 187 0 объект > эндообъект 188 0 объект > эндообъект 189 0 объект > эндообъект 190 0 объект > эндообъект 191 0 объект > эндообъект 192 0 объект > эндообъект 193 0 объект > эндообъект 194 0 объект > эндообъект 195 0 объект > эндообъект 196 0 объект > эндообъект 197 0 объект > эндообъект 198 0 объект > эндообъект 199 0 объект > эндообъект 200 0 объект > эндообъект 201 0 объект > /ProcSet [/PDF /Text /ImageC /ImageB /ImageI] >> эндообъект 202 0 объект > ручей xڝXn$7+J#Q;Cm-\ӹ|(ՎRQH=.+sb*#» !յϭw4Hz!]c4cp h21vz]کRГ_]]Z\e@7’ŽEg>SZJx5tYۉ 8{ǎ; 23″A
Эта форма анализа очень полезна для выявления тенденций в том, как проводится медицинская химия и открытие лекарств, и может применяться для изучения тенденций между отдельными организациями. Было высказано предположение, что в случае кислот и нейтральных лекарственных средств существует потенциальная устойчивость к большей липофильности. Похоже, что отслеживание липофильности, количества доноров Н-связей и молекулярной формы жизненно важно для разработки перорально активных соединений, которые могут выдержать суровые условия разработки лекарств.
Взаимодействия лекарство-рецептор
Сайты связывания лекарства в макромолекулярных мишенях состоят из гидрофобных и гидрофильных участков, где последние могут участвовать в связывании с лигандами посредством электростатических взаимодействий, включая ионное связывание, водородное связывание, диполь-дипольные взаимодействия, ион-дипольные взаимодействия взаимодействия и взаимодействия катион-π. Исследования этих взаимодействий позволили глубже понять геометрию и силу этих связей, чтобы помочь разработчикам лекарств. 48 Ионизируемые группы в лекарствах могут взаимодействовать с комплементарными группами в макромолекулах, образуя сильные взаимодействия, однако сила может быть снижена из-за конкурирующих явлений гидратации и энтропии.Медицинские химики могут улучшить активность свинца, влияя либо на энтальпийные, либо на энтропийные термодинамические компоненты. Самый простой способ — добавить липофильности или увеличить количество взаимодействующих групп. Этот подход получил название «молекулярное ожирение» и ведет исследователя в направлении, которое, вероятно, приведет к будущим проблемам ADMET или растворимости. 3 Поиск более специфических взаимодействий, например, через Н-связь, требует оптимального размещения функциональной группы в сайте связывания, при этом следует помнить, что десольватация может привести к энтропийным штрафам.С точки зрения энергии, десольватация неполярной группы требует в 10 раз меньше энергии, поэтому медицинские химики добавляют гидрофобные группы в своих усилиях по повышению эффективности.
Исследования этих взаимодействий позволили глубже понять геометрию и силу этих связей, чтобы помочь разработчикам лекарств. 48 Ионизируемые группы в лекарствах могут взаимодействовать с комплементарными группами в макромолекулах, образуя сильные взаимодействия, однако сила может быть снижена из-за конкурирующих явлений гидратации и энтропии.Медицинские химики могут улучшить активность свинца, влияя либо на энтальпийные, либо на энтропийные термодинамические компоненты. Самый простой способ — добавить липофильности или увеличить количество взаимодействующих групп. Этот подход получил название «молекулярное ожирение» и ведет исследователя в направлении, которое, вероятно, приведет к будущим проблемам ADMET или растворимости. 3 Поиск более специфических взаимодействий, например, через Н-связь, требует оптимального размещения функциональной группы в сайте связывания, при этом следует помнить, что десольватация может привести к энтропийным штрафам.С точки зрения энергии, десольватация неполярной группы требует в 10 раз меньше энергии, поэтому медицинские химики добавляют гидрофобные группы в своих усилиях по повышению эффективности. Рабский поиск потенции в таких ситуациях означает, что химик часто идет по ложному пути.
Рабский поиск потенции в таких ситуациях означает, что химик часто идет по ложному пути.
Чтобы избежать проблем молекулярного ожирения и специально контролировать качество соединений свинца, был разработан ряд параметров. Например, во время оптимизации свинца мерой потенциала разработки соединения является мониторинг эффективности лиганда (LE). 49 Этот параметр учитывает как активность, так и молекулярную массу соединения, чтобы дать свободную энергию связи на тяжелый (т. е. неводородный) атом. Было описано несколько показателей эффективности лиганда, и в настоящее время они популярны в сообществе медицинской химии. 1 В соответствии с энергиями связи Эндрюса 50 , на эффективность лиганда в соединениях с очень малой молекулярной массой влияют заряженные группы, которые могут обеспечить значительное увеличение LE. 51 В качестве альтернативы эффективность лиганда можно обменять на включение заряженной функциональной группы, которая может потребоваться для улучшения биофармацевтических характеристик или растворимости лиганда. 51
51
Нецелевая активность
Главной задачей ученого, разрабатывающего новое лекарство, является обеспечение селективности в отношении намеченной цели. Хотя в некоторых случаях требуется взаимодействие с более чем одной макромолекулой, нецелевая активность может привести к токсичности и побочным эффектам. Ряд исследований рассматривал эту проблему, пытаясь найти взаимосвязь с простыми физико-химическими свойствами. 5, 8, 11, 52, 53 Основные соединения ясно показали, что они часто взаимодействуют с более чем одной мишенью 8, 53 , в то время как кислоты, нейтралы и цвиттер-ионы показали пониженную склонность к нецелевой активности. 8 Хотя некоторые из этих исследований предполагают связь между MW, ClogP и беспорядочными половыми связями 8, 11, 54 , необходимо соблюдать осторожность со статистикой. Повышенная сложность соединения с более высоким ClogP и MW предполагает, что может быть повышенная вероятность взаимодействия с другими мишенями. 3 Нецелевая активность является еще одной причиной для тщательного изучения размера и липофильности, а когда задействованы ионизируемые группы, необходимо контролировать значения logD 7,4 .
3 Нецелевая активность является еще одной причиной для тщательного изучения размера и липофильности, а когда задействованы ионизируемые группы, необходимо контролировать значения logD 7,4 .
Состав
Значения p K a лекарства могут критически повлиять на аспекты его состава, особенно для лекарств, которые необходимо вводить в растворе. В частности, значения p K a оказывают большое влияние на растворимость лекарства в воде, и в целом ионизированная форма лекарства значительно лучше растворима в воде. Растворимость является чрезвычайно важным физико-химическим параметром, который обычно исследуется в фармацевтической промышленности.Полярность из-за влияния, которое она оказывает на взаимодействие растворенного вещества с растворителем, является одним из двух основных факторов, влияющих на растворимость лекарственного средства в воде. Другой — энергетическая природа твердого тела, в частности энергия кристаллической решетки, которая варьируется от одной структуры лекарства к другой, а также между полиморфными формами одной и той же структуры.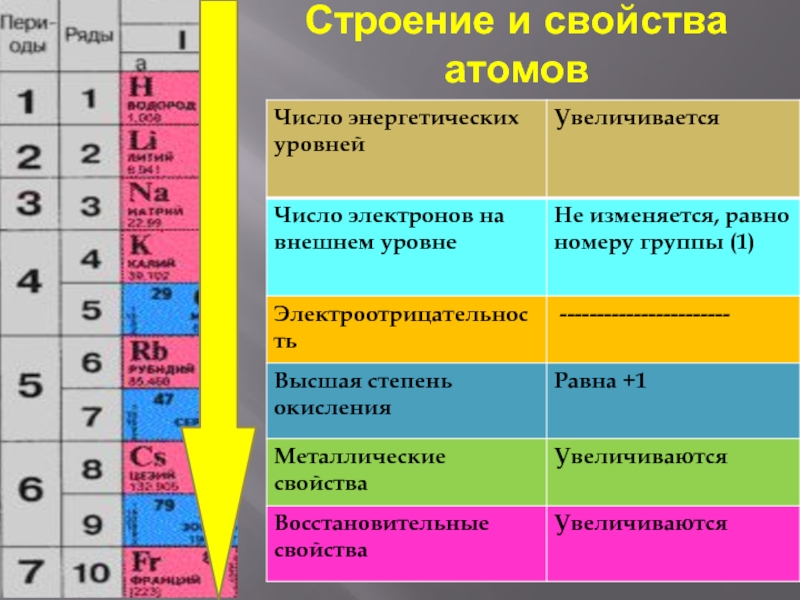 Как правило, лекарствам необходима подходящая степень липофильности, чтобы: (а) достичь места действия, начиная с абсорбции из желудочно-кишечного тракта, и (б) взаимодействовать с соответствующим рецептором.Следовательно, растворимость в воде часто в некоторой степени снижается из-за желаемой липофильности. Кислотно-щелочной характер лекарственного средства играет важную роль в определении растворимости, но она часто в значительной степени зависит от рН состава в виде раствора, вызывая переменную полярность в водном растворе. Существует множество информации о растворимости лекарств, и читатель отсылается к двум важным текстам. 55, 56
Как правило, лекарствам необходима подходящая степень липофильности, чтобы: (а) достичь места действия, начиная с абсорбции из желудочно-кишечного тракта, и (б) взаимодействовать с соответствующим рецептором.Следовательно, растворимость в воде часто в некоторой степени снижается из-за желаемой липофильности. Кислотно-щелочной характер лекарственного средства играет важную роль в определении растворимости, но она часто в значительной степени зависит от рН состава в виде раствора, вызывая переменную полярность в водном растворе. Существует множество информации о растворимости лекарств, и читатель отсылается к двум важным текстам. 55, 56
Поскольку растворы для инъекций предпочтительно являются водными, ключевым требованием для преодоления ограничений, связанных с липофильностью при разработке лекарств, является наличие одной или нескольких ионизируемых групп, для которых полярность, основанная на степени ионизации, может контролироваться с помощью рН среды, будь то в биологической среде или в приготовленном растворе. Однако необходимо обеспечить, чтобы ключевая роль кислотно-основных функциональных групп во взаимодействиях с рецепторами не была поставлена под угрозу за счет корректировки кислотно-основного поведения с целью изменения растворимости, что также может быть достигнуто с помощью неионизируемых полярных групп.
Однако необходимо обеспечить, чтобы ключевая роль кислотно-основных функциональных групп во взаимодействиях с рецепторами не была поставлена под угрозу за счет корректировки кислотно-основного поведения с целью изменения растворимости, что также может быть достигнуто с помощью неионизируемых полярных групп.
Давно принято, что pH растворов для инъекций не должен выходить за пределы диапазона 4–9, в основном по причинам, связанным с болью или повреждением тканей при инъекции. Для приготовления ионизируемого плохо растворимого в воде лекарственного средства может потребоваться крайнее значение pH, чтобы получить достаточную растворимость.Разумный выбор ионизируемой группы или групп (на этапе проектирования) может значительно помочь в решении этой проблемы растворимости. Чтобы быть эффективной, введенная группа должна быть значительно ионизирована в носителе состава, а в идеале также в физиологических условиях. Хотя это трудно обобщить, эффективные значения p K a для повышения растворимости должны находиться в диапазоне 4-9, чтобы обеспечить достаточную долю ионизированного лекарственного средства для достижения адекватной растворимости в воде. Для оснований значения p K a должны быть ближе к верхнему пределу этого диапазона, тогда как значения для кислот должны быть ближе к нижнему пределу. Конечно, относительно растворимое в воде лекарство будет легче приготовить, чем лекарство с предельной растворимостью. Еще одна проблема, связанная с инъекционными и офтальмологическими препаратами, заключается в осмотическом эффекте, который контролируется лекарственным веществом p K a и рН раствора. Это важно, когда концентрация лекарства высока, так что само лекарство является основной осмотической детерминантой.
Для оснований значения p K a должны быть ближе к верхнему пределу этого диапазона, тогда как значения для кислот должны быть ближе к нижнему пределу. Конечно, относительно растворимое в воде лекарство будет легче приготовить, чем лекарство с предельной растворимостью. Еще одна проблема, связанная с инъекционными и офтальмологическими препаратами, заключается в осмотическом эффекте, который контролируется лекарственным веществом p K a и рН раствора. Это важно, когда концентрация лекарства высока, так что само лекарство является основной осмотической детерминантой.
Другим аспектом влияния p K a на рецептуру является потенциальное влияние состояния ионизации на стабильность лекарственного средства. Например, при pH > 6 морфин разлагается по двум путям окисления, один из которых включает форму свободного основания алициклического азота 3°, а другой — анионную форму фенольной группы 3-ОН. 57 В обоих случаях скорость окисления увеличивается при депротонировании каждой функциональной группы.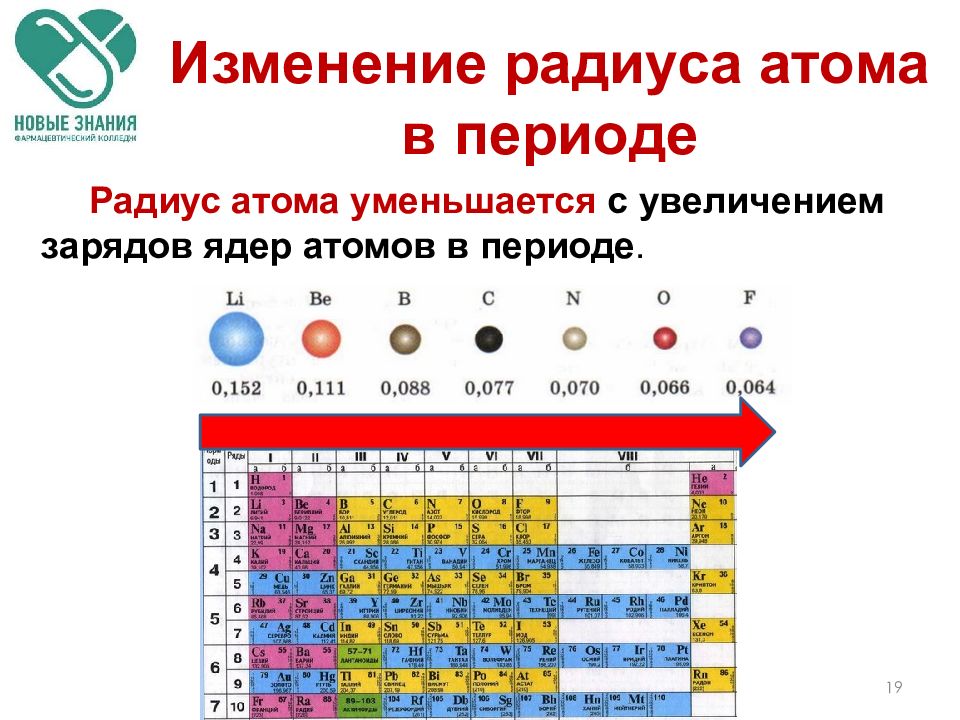 Для обоих типов пути деградации, если соображения дизайна лекарственного средства приводят к окисляемым группам со значениями p K a , близкими к физиологически значимому диапазону, то окислительная деградация может быть ускорена.
Для обоих типов пути деградации, если соображения дизайна лекарственного средства приводят к окисляемым группам со значениями p K a , близкими к физиологически значимому диапазону, то окислительная деградация может быть ускорена.
p
K a Методы прогнозирования Важно отметить, что основной интерес к кислотно-основным равновесиям лекарственных средств относится к водным биологическим системам. Механизм, с помощью которого кислотно-щелочное поведение влияет на эти системы, заключается в изменениях, происходящих в свойствах водных растворов лекарственных средств, когда полярность молекулы изменяется в результате измененной ионизации (реакций протонирования-депротонирования) одной или нескольких функциональных групп. Другим важным аспектом при рассмотрении кислотно-основного характера является обоснованное предсказание или точное измерение значений p K a , что также влияет на оценку значений logD.Доступен ряд пакетов программного обеспечения для оценки значений p K a в водной среде, и они различаются как по точности, так и по применяемому алгоритму. Учитывая широту этой темы, мы отсылаем читателя к Lee и Crippen 58 , которые обсуждают различные методы и доступное программное обеспечение.
Учитывая широту этой темы, мы отсылаем читателя к Lee и Crippen 58 , которые обсуждают различные методы и доступное программное обеспечение.
Коммерческий p K a Пакеты программного обеспечения для прогнозирования:
p
6 p
6 p 6 Методы прогнозирования
a также были оценены на предмет их точности. 58, 59 Одна проблема, которую необходимо учитывать при этих расчетах, касается выбора подходящего таутомерного состояния для молекулы, так как это сильно повлияет на предсказания p K a . 60 Другим фактором, который следует учитывать, является точность экспериментальных данных, которые используются для проверки p K a моделей прогнозирования. Эти данные часто ненадежны, либо экспериментальный метод требует тщательной проверки. Более поздняя компиляция предоставила много значений, в которых была оценена надежность экспериментальной техники. 61 Наконец, в последние годы были разработаны приборы с более высокой пропускной способностью для измерения значений p K a , и за дополнительной информацией читатель может обратиться к обзору Comer. 62 Выводы
В любой отрасли требуется постоянная оценка ключевых процессов для поддержания эффективности и конкурентоспособности. Некоторые идеи могут иметь длительное и существенное влияние, например, наблюдения Липински и его коллег. 9 С тех пор, как появилась их публикация, возникли дополнительные рекомендации относительно природы химического пространства, имеющего отношение к открытию лекарств. 1 Фармацевтические компании часто проводили это исследование, пытаясь понять и снизить скорость истощения соединений при разработке лекарств. 1, 4, 5, 8, 9, 11, 52 Этот обзор и наши последние кислотно-щелочные анализы 7 призваны своевременно напомнить о важности кислотно-щелочных профилей и p K a ценности. Учитывая, что они влияют на все аспекты открытия лекарств, полезно еще раз проанализировать кислотно-основные свойства, чтобы добавить это к нашим знаниям о химическом пространстве. Таким образом, рассмотрение кислотно-основных свойств представляет собой еще одну возможность улучшить процессы поиска лекарств.
Некоторые идеи могут иметь длительное и существенное влияние, например, наблюдения Липински и его коллег. 9 С тех пор, как появилась их публикация, возникли дополнительные рекомендации относительно природы химического пространства, имеющего отношение к открытию лекарств. 1 Фармацевтические компании часто проводили это исследование, пытаясь понять и снизить скорость истощения соединений при разработке лекарств. 1, 4, 5, 8, 9, 11, 52 Этот обзор и наши последние кислотно-щелочные анализы 7 призваны своевременно напомнить о важности кислотно-щелочных профилей и p K a ценности. Учитывая, что они влияют на все аспекты открытия лекарств, полезно еще раз проанализировать кислотно-основные свойства, чтобы добавить это к нашим знаниям о химическом пространстве. Таким образом, рассмотрение кислотно-основных свойств представляет собой еще одну возможность улучшить процессы поиска лекарств.
Благодарности
Мы признательны ряду первоисточников, которые не могут быть включены явно из-за нехватки места, но цитируются косвенно. Эта работа была частично поддержана грантами NIH GM-095952 и MH-084690 (TIO).
Эта работа была частично поддержана грантами NIH GM-095952 и MH-084690 (TIO).
Ссылки
6. Leeson PD, St-Gallay SA, Wenlock MC. Медхимком. 2011;2:91–105. [Google Академия]9. Липински К.А., Ломбардо Ф., Домини Б.В., Фини П.Дж. Adv Drug Del Rev. 1997; 46:3–26. [PubMed] [Google Scholar] 10. Джонсон Т.В., Платье К.Р., Эдвардс М. Bioorg Med Chem Lett. 2009;19:5560–5564. [PubMed] [Google Scholar] 13. Бокер А., Бонно П.Р., Хьюк О., Джакалян А., Эдвардс П.Дж. ХимМедХим. 2010;5:2102–2113. [PubMed] [Google Scholar] 14.Schanker LS, Tocco DJ, Brodie BB, Hogben CA. J Pharmacol Exp Ther. 1958; 123: 81–88. [PubMed] [Google Scholar] 15. Palm K, Luthman K, Ros J, Grasjo J, Artursson P. J Pharmacol Exp Ther. 1999; 291:435–443. [PubMed] [Google Scholar] 16. Буассе М., Ботам Р.П., Хегеле К.Д., Ленфант Б., Пахот Д.И. Eur J Pharm Sci. 2000; 10: 215–224. [PubMed] [Google Scholar] 17. Кастро Дж.Л., Коллинз И., Рассел М.Г., Ватт А.П., Сохал Б., Рэтбоун Д., Бир М.С., Стэнтон Дж.А. J Med Chem. 1998;41:2667–2670. [PubMed] [Google Scholar] 18. Кубинский Х.В: Вычислительные подходы к разработке лекарств на основе структуры. Страуд Р.М., редактор. Королевское химическое общество; Лондон: 2007. С. 24–45. [Google Академия] 19. Pagliara A, Reist M, Geinoz S, Carrupt PA, Testa B. J Pharm Pharmacol. 1999;51:1339–1357. [PubMed] [Google Scholar] 20. Вит М., Сигел М.Г., Хиггс Р.Е., Уотсон И.А., Робертсон Д.Х., Савин К.А., Дерст Г.Л., Хипскинд П.А. J Med Chem. 2004; 47: 224–232. [PubMed] [Google Scholar] 23. Глисон М.П., Уотерс, Нью-Джерси, Пейн С.В., Дэвис А.М. J Med Chem. 2006; 49:1953–1963. [PubMed] [Google Scholar] 25.Fan Y, Unwalla R, Denny RA, Di L, Kerns EH, Diller DJ, Humblet C. J Chem Inf Model. 2010;50:1123–1133. [PubMed] [Google Scholar] 30. Гомбар В.К., Полли Дж.В., Хамфрис Дж.Е., Ринг С.А., Серабжит-Сингх С.С. Дж. Фарм. 2004; 93: 957–968. [PubMed] [Google Scholar] 33. Дидзиапетрис Р., Япертас П., Авдеев А., Петраускас А. Дж. Лекарственная мишень. 2003; 11: 391–406. [PubMed] [Google Scholar] 34. Raschi E, Ceccarini L, De Ponti F, Recanatini M. Экспертное мнение о наркотиках Metab Toxicol. 2009;5:1005–1021. [PubMed] [Google Scholar] 37. Пломен Дж.П., Келдер Дж., Хафманс Т., ван де Сандт Х., ван Бургстеден Дж.А., Салеминки П.Дж., ван Эш Э.Опыт Токсикол Патол. 2004; 55: 347–355. [PubMed] [Google Scholar] 38. Pelletier DJ, Gehlhaar D, Tilloy-Ellul A, Johnson TO, Greene N. J Chem Inf Model. 2007;47:1196–1205. [PubMed] [Google Scholar] 39. Tomizawa K, Sugano K, Yamada H, Horii I. J Toxicol Sci. 2006; 31: 315–324. [PubMed] [Google Scholar]40. Ханумеговда У.М., Венке Г., Регейро-Рен А., Йорданова Р., Корради Д.П., Адамс С.П. Хим. Рез. Токсикол. 2010; 23:749–755. [PubMed] [Google Scholar]42. Nadanaciva S, Dykens JA, Bernal A, Capaldi RA, Will Y. Toxicol Appl Pharmacol.2007; 223: 277–287. [PubMed] [Google Scholar]43. Naven RT, Swiss R, McLeod JK, Will Y, Greene N. Toxicol Sci. 2012 [Google Scholar]44. Сконберг С., Олсен Дж., Мэдсен К.Г., Хансен С.Х., Грилло М.П. Мнение эксперта Препарат Метаб Токсикол. 2008; 4: 425–438. [PubMed] [Google Scholar]45. Денисов И.Г., Макрис Т.М., Слигар С.Г., Schlichting I. Chem Rev. 2005;105:2253–2277. [PubMed] [Google Scholar]47. Уильямс П.А., Косме Дж., Уорд А., Ангов Х.К., Матак Винкович Д., Джоти Х. Природа. 2003; 424:464–468. [PubMed] [Google Scholar]52. Хьюз Д.Д., Блэгг Дж., Прайс Д.А., Бейли С., Декрещенцо Г.А., Деврадж Р.В., Эллсуорт Э., Фобиан Ю.М., Гиббс М.Е., Жиль Р.В., Грин Н., Хуанг Э., Кригер-Берк Т., Лозель Дж., Уэйджер Т., Уайтли Л., Чжан Ю.Bioorg Med Chem Lett. 2008; 18:4872–4875. [PubMed] [Google Scholar]53. Peters JU, Schnider P, Mattei P, Kansy M. ChemMedChem. 2009; 4: 680–686. [PubMed] [Google Scholar]54. Хопкинс А.Л., Мейсон Дж.С., Оверингтон Дж.П. Curr Opin Struct Biol. 2006; 16: 127–136. [PubMed] [Google Scholar]55. Грант DJW, Хигучи Т. Растворимость органических соединений. Уайли; Нью-Йорк: 1990. [Google Scholar]56. Авдеев А, редактор. Поглощение и разработка лекарств: растворимость, проницаемость и состояние заряда. Уайли; Хобокен: 2003.[Google Академия] 57. Коннорс К.А., Амидон Г.Л., Стелла В.Дж. Химическая стабильность лекарственных средств. 2. Wiley-Interscience; Нью-Йорк: 1986. [Google Scholar]59. Manchester J, Walkup G, Rivin O, You Z. J Chem Inf Model. 2010; 50: 565–571. [PubMed] [Google Scholar]61. Пракерд Р.Дж. Критическая подборка значений pKa для фармацевтических субстанций. Академическая пресса Эльзевира; Амстердам: 2007. [Google Scholar]62. Комер JEA. В: Комплексная медицинская химия. Triggle DJ, редактор. Том. 5. Эльзевир; 2007. с.357–397. [Google Scholar]
[PubMed] [Google Scholar] 18. Кубинский Х.В: Вычислительные подходы к разработке лекарств на основе структуры. Страуд Р.М., редактор. Королевское химическое общество; Лондон: 2007. С. 24–45. [Google Академия] 19. Pagliara A, Reist M, Geinoz S, Carrupt PA, Testa B. J Pharm Pharmacol. 1999;51:1339–1357. [PubMed] [Google Scholar] 20. Вит М., Сигел М.Г., Хиггс Р.Е., Уотсон И.А., Робертсон Д.Х., Савин К.А., Дерст Г.Л., Хипскинд П.А. J Med Chem. 2004; 47: 224–232. [PubMed] [Google Scholar] 23. Глисон М.П., Уотерс, Нью-Джерси, Пейн С.В., Дэвис А.М. J Med Chem. 2006; 49:1953–1963. [PubMed] [Google Scholar] 25.Fan Y, Unwalla R, Denny RA, Di L, Kerns EH, Diller DJ, Humblet C. J Chem Inf Model. 2010;50:1123–1133. [PubMed] [Google Scholar] 30. Гомбар В.К., Полли Дж.В., Хамфрис Дж.Е., Ринг С.А., Серабжит-Сингх С.С. Дж. Фарм. 2004; 93: 957–968. [PubMed] [Google Scholar] 33. Дидзиапетрис Р., Япертас П., Авдеев А., Петраускас А. Дж. Лекарственная мишень. 2003; 11: 391–406. [PubMed] [Google Scholar] 34. Raschi E, Ceccarini L, De Ponti F, Recanatini M. Экспертное мнение о наркотиках Metab Toxicol. 2009;5:1005–1021. [PubMed] [Google Scholar] 37. Пломен Дж.П., Келдер Дж., Хафманс Т., ван де Сандт Х., ван Бургстеден Дж.А., Салеминки П.Дж., ван Эш Э.Опыт Токсикол Патол. 2004; 55: 347–355. [PubMed] [Google Scholar] 38. Pelletier DJ, Gehlhaar D, Tilloy-Ellul A, Johnson TO, Greene N. J Chem Inf Model. 2007;47:1196–1205. [PubMed] [Google Scholar] 39. Tomizawa K, Sugano K, Yamada H, Horii I. J Toxicol Sci. 2006; 31: 315–324. [PubMed] [Google Scholar]40. Ханумеговда У.М., Венке Г., Регейро-Рен А., Йорданова Р., Корради Д.П., Адамс С.П. Хим. Рез. Токсикол. 2010; 23:749–755. [PubMed] [Google Scholar]42. Nadanaciva S, Dykens JA, Bernal A, Capaldi RA, Will Y. Toxicol Appl Pharmacol.2007; 223: 277–287. [PubMed] [Google Scholar]43. Naven RT, Swiss R, McLeod JK, Will Y, Greene N. Toxicol Sci. 2012 [Google Scholar]44. Сконберг С., Олсен Дж., Мэдсен К.Г., Хансен С.Х., Грилло М.П. Мнение эксперта Препарат Метаб Токсикол. 2008; 4: 425–438. [PubMed] [Google Scholar]45. Денисов И.Г., Макрис Т.М., Слигар С.Г., Schlichting I. Chem Rev. 2005;105:2253–2277. [PubMed] [Google Scholar]47. Уильямс П.А., Косме Дж., Уорд А., Ангов Х.К., Матак Винкович Д., Джоти Х. Природа. 2003; 424:464–468. [PubMed] [Google Scholar]52. Хьюз Д.Д., Блэгг Дж., Прайс Д.А., Бейли С., Декрещенцо Г.А., Деврадж Р.В., Эллсуорт Э., Фобиан Ю.М., Гиббс М.Е., Жиль Р.В., Грин Н., Хуанг Э., Кригер-Берк Т., Лозель Дж., Уэйджер Т., Уайтли Л., Чжан Ю.Bioorg Med Chem Lett. 2008; 18:4872–4875. [PubMed] [Google Scholar]53. Peters JU, Schnider P, Mattei P, Kansy M. ChemMedChem. 2009; 4: 680–686. [PubMed] [Google Scholar]54. Хопкинс А.Л., Мейсон Дж.С., Оверингтон Дж.П. Curr Opin Struct Biol. 2006; 16: 127–136. [PubMed] [Google Scholar]55. Грант DJW, Хигучи Т. Растворимость органических соединений. Уайли; Нью-Йорк: 1990. [Google Scholar]56. Авдеев А, редактор. Поглощение и разработка лекарств: растворимость, проницаемость и состояние заряда. Уайли; Хобокен: 2003.[Google Академия] 57. Коннорс К.А., Амидон Г.Л., Стелла В.Дж. Химическая стабильность лекарственных средств. 2. Wiley-Interscience; Нью-Йорк: 1986. [Google Scholar]59. Manchester J, Walkup G, Rivin O, You Z. J Chem Inf Model. 2010; 50: 565–571. [PubMed] [Google Scholar]61. Пракерд Р.Дж. Критическая подборка значений pKa для фармацевтических субстанций. Академическая пресса Эльзевира; Амстердам: 2007. [Google Scholar]62. Комер JEA. В: Комплексная медицинская химия. Triggle DJ, редактор. Том. 5. Эльзевир; 2007. с.357–397. [Google Scholar] Proprietes acido basiques de catalyseurs
%PDF-1.4
%
1 0 объект
>
эндообъект
7 0 объект
/Заголовок
/Предмет
/Автор
/Режиссер
/Ключевые слова
/CreationDate (D:20211216165304-00’00’)
/ModDate (D:20140210152153+01’00’)
>>
эндообъект
2 0 объект
>
эндообъект
3 0 объект
>
эндообъект
4 0 объект
>
эндообъект
5 0 объект
>
эндообъект
6 0 объект
>
ручей
2014-02-10T15:21:53+01:002014-02-10T15:21:53+01:002012-12-21T14:11:44+01:00Adobe Acrobat Pro 9.0.0application/pdf
Периодическая таблица — Тенденции в Периодической таблице
Тенденции в Периодической таблице
Периодическая таблица в моде
К этому моменту мы рассмотрели различные элементы периодической таблицы. Доверьтесь нам, понимая общие тенденции в семьях пригодится однажды, либо на тесте, либо при игре Jeopardy!. Но это не все, что может предложить периодическая таблица. Правда в том, что если вы посмотрите на таблицу в целом, некоторые даже более мощные начинают проявляться тенденции, которые могут помочь нам сравнить свойства элементов и даже предсказать реакционную способность.Это как иметь плоский гигантский хрустальный шар.
Атомный радиус
По определению, атомный радиус равен половине расстояния между ядрами двух атомов. Другими словами, атомные радиусы используются для измерения размера атомов. Как правило, размер атома уменьшается по мере того, как мы движемся слева направо по таблице Менделеева. Это может немного сбивать с толку, но мы вас предусмотрели — читайте дальше.
Двигаясь слева направо по периоду, мы также наблюдаем увеличение атомного заряда (число протонов увеличивается).Это большее ядерное притяжение притягивает электроны ближе, и атомные радиусы фактически уменьшаются. Думайте об этом как о большом ядерном объятии. Чем больше протонов, тем больше любви, а электроны притягиваются ближе к ядру.
Переход вниз по группе, атомные радиусы увеличиваются. На этот раз мы сравниваем электроны в 92 535 различных оболочках из 90 246. Электроны на 1s-орбитали ближе к ядру, чем электроны на 2s-орбитали. По сути, электроны во внешних оболочках не так сильно «чувствуют» притяжение ядра, как те, что ближе к ядру.Подумайте обо всех причудливых магнитах, которые вы держите на холодильнике. Вы используете один из магнитов, чтобы держать свой ценный рисунок в учебном зале. Нет проблем — магнит легко удерживает лист бумаги. Но затем вы начинаете добавлять все больше и больше кусочков бумаги. (На этой неделе вы создали несколько безумно крутых рисунков.) В конце концов, по мере того, как вы добавляете все больше и больше слоев, магнит теряет свою хватку и падает. Это похоже на идею электронного экранирования. По мере того, как мы добавляем все больше и больше орбиталей, внешние выборы ощущают меньшее притяжение от ядра и могут удаляться дальше — отсюда и большие атомные радиусы по мере того, как мы спускаемся по группе.
Тенденции атомных радиусов в периодической таблице.
Электроотрицательность
Электроотрицательность — это свойство, описывающее способность атома притягивать электрон. Электроны притягиваются к элементам с высокой электроотрицательностью, как Тейлор Свифт притягивается к бойфрендам. Помните, элементы просто умирают, чтобы иметь стабильную конфигурацию благородного газа. Элементы, которым нужен только один или два дополнительных электрона, чтобы перейти в это состояние, являются наиболее электроотрицательными — им нужны электроны, и они сделают все, чтобы их получить.
По мере продвижения вправо по периоду элементов электроотрицательность увеличивается. Атомы могут либо приобретать электроны, либо терять электроны. Когда валентная оболочка атома заполнена менее чем наполовину, легче потерять электрон. (Эти элементы хотят уменьшить размер, поэтому они практически отдают электроны.) Когда валентная оболочка атома заполнена более чем наполовину, легче получить электрон; эти элементы попытаются получить полную оболочку, добавив on.
По мере продвижения вниз по группе электроотрицательность уменьшается.По мере того, как мы перемещаемся вниз по группе, атомы становятся все больше и больше с большим количеством электронов. Это означает, что самые внешние электроны удаляются все дальше и дальше от положительно заряженного ядра. Следствие? Электроотрицательность уменьшается. Опять же, подумайте о магните, защищенном всеми этими страницами-каракулями.
Тенденции электроотрицательности в периодической таблице.
Очень важно помнить, что это всего лишь тенденции, а не правила. Всегда есть исключения. Например, благородные газы имеют незначительные значения электроотрицательности, несмотря на то, что они находятся в самой правой части периодической таблицы, а переходные металлы имеют очень небольшие различия в своих значениях электроотрицательности.
Зная то, что мы знаем, какой самый электроотрицательный элемент?
Обе стрелки указывают на фтор.
Энергия ионизации
Энергия ионизации — это количество энергии, необходимое для отрыва электрона от атома. Элементы в левой части периодической таблицы, такие как щелочные и щелочноземельные металлы, имеют низкую энергию ионизации, потому что потеря электрона (или двух) приведет к тому, что они достигнут конфигурации благородного газа. Иногда проще уменьшить размер до более низкой оболочки, особенно когда для этого нужно потерять всего пару электронов.Элементы в правой части таблицы имеют более высокие энергии ионизации, потому что им нужно на 92 535 больше 90 246 электронов, а не меньше. Думайте об элементах справа как о Голлуме, а золотое кольцо представляет электроны. Их электроны драгоценны, и чтобы их забрать, потребуется много энергии. Таким образом, энергии ионизации возрастают слева направо по таблице — левая сторона дает, правая — Голлум.
Мы уже выяснили, что по мере того, как мы спускаемся по группе, атомы становятся больше, а самые внешние электроны удаляются от положительно заряженного ядра.Что сильнее, отношения на расстоянии или отношения на расстоянии? Как известно любому поклоннику романтических комедий, отношения на расстоянии редко сохраняются. Ответ тот же для электронов. Электроны, находящиеся дальше от ядра, связаны не так прочно, как электроны, находящиеся ближе; поэтому по мере продвижения вниз по группе энергия ионизации становится меньше.
Тренды энергии ионизации в периодической таблице.
Сродство к электрону
Как следует из названия, сродство к электрону является мерой того, насколько атом «хочет» другого электрона.Когда атом принимает дополнительный электрон, он либо приобретает, либо теряет энергию. Сродство к электрону является количественной мерой этого изменения энергии.
Сродство к электрону увеличивается слева направо в периодической таблице. Это связано с уменьшением атомного радиуса. Как мы уже объяснили, двигаясь слева направо по периоду, атомы становятся все меньше и меньше по мере увеличения атомного номера. Это заставляет электрон приближаться к ядру, тем самым увеличивая сродство к электрону.
Сродство к электрону уменьшается по мере продвижения вниз по группе. Это опять же вызвано увеличением атомного радиуса (больше орбиталей). Когда электрон присоединяется к атому с большим атомным радиусом, электрон не сильно притягивается к удаленному ядру. Напротив, когда электрон присоединяется к атому с малым атомным радиусом, электрон безжалостно притягивается к очень близкому ядру.
Тенденции сродства к электрону в периодической таблице.
Тенденции электроотрицательности, энергии ионизации и сродства к электрону устрашающе схожи.
 Некоторые идеи могут иметь длительное и существенное влияние, например, наблюдения Липински и его коллег. 9 С тех пор, как появилась их публикация, возникли дополнительные рекомендации относительно природы химического пространства, имеющего отношение к открытию лекарств. 1 Фармацевтические компании часто проводили это исследование, пытаясь понять и снизить скорость истощения соединений при разработке лекарств. 1, 4, 5, 8, 9, 11, 52 Этот обзор и наши последние кислотно-щелочные анализы 7 призваны своевременно напомнить о важности кислотно-щелочных профилей и p K a ценности. Учитывая, что они влияют на все аспекты открытия лекарств, полезно еще раз проанализировать кислотно-основные свойства, чтобы добавить это к нашим знаниям о химическом пространстве. Таким образом, рассмотрение кислотно-основных свойств представляет собой еще одну возможность улучшить процессы поиска лекарств.
Некоторые идеи могут иметь длительное и существенное влияние, например, наблюдения Липински и его коллег. 9 С тех пор, как появилась их публикация, возникли дополнительные рекомендации относительно природы химического пространства, имеющего отношение к открытию лекарств. 1 Фармацевтические компании часто проводили это исследование, пытаясь понять и снизить скорость истощения соединений при разработке лекарств. 1, 4, 5, 8, 9, 11, 52 Этот обзор и наши последние кислотно-щелочные анализы 7 призваны своевременно напомнить о важности кислотно-щелочных профилей и p K a ценности. Учитывая, что они влияют на все аспекты открытия лекарств, полезно еще раз проанализировать кислотно-основные свойства, чтобы добавить это к нашим знаниям о химическом пространстве. Таким образом, рассмотрение кислотно-основных свойств представляет собой еще одну возможность улучшить процессы поиска лекарств.  Эта работа была частично поддержана грантами NIH GM-095952 и MH-084690 (TIO).
Эта работа была частично поддержана грантами NIH GM-095952 и MH-084690 (TIO). Тенденции атомных радиусов в периодической таблице.
Тенденции электроотрицательности в периодической таблице.
Тренды энергии ионизации в периодической таблице.
Тенденции сродства к электрону в периодической таблице.
