Общая характеристика кислот — урок. Химия, 8–9 класс.
Кислотами называют сложные вещества, состоящие из атомов водорода, способных замещаться металлами, и кислотных остатков.
Кислотным остатком называют часть молекулы кислоты, соединённую с атомами водорода.
При замещении водорода в кислотах металлами в состав образующихся солей кислотные остатки переходят в неизменном виде. Если кислотный остаток в кислоте соединён с одним атомом водорода, то он одновалентен, если с двумя — двухвалентен, если с тремя — трёхвалентен и т. д.
Валентность кислотного остатка определяется количеством атомов водорода, способных замещаться металлами.
Формулы и названия некоторых кислот приведены в таблице.
Важнейшие неорганические кислоты
Название кислоты | Формула кислоты | Формула кислотного остатка | Название соли этой кислоты |
| Фтороводородная (плавиковая) | HF | −F | Фторид |
| Хлороводородная (соляная) | HCl | −Cl | Хлорид |
| Бромоводородная | HBr | −Br | Бромид |
| Угольная | h3CO3 | =CO3 | Карбонат |
| Кремниевая | =SiO3 | Силикат | |
| Азотная | HNO3 | −NO3 | Нитрат |
Ортофосфорная (фосфорная) | h4PO4 | ≡PO4 | Ортофосфат (фосфат) |
| Серная | h3SO4 | =SO4 | Сульфат |
| Сернистая | h3SO3 | Сульфит | |
| Сероводородная | h3S | =S | Сульфид |
Представителем органических кислот является уксусная кислота Ch4COOH.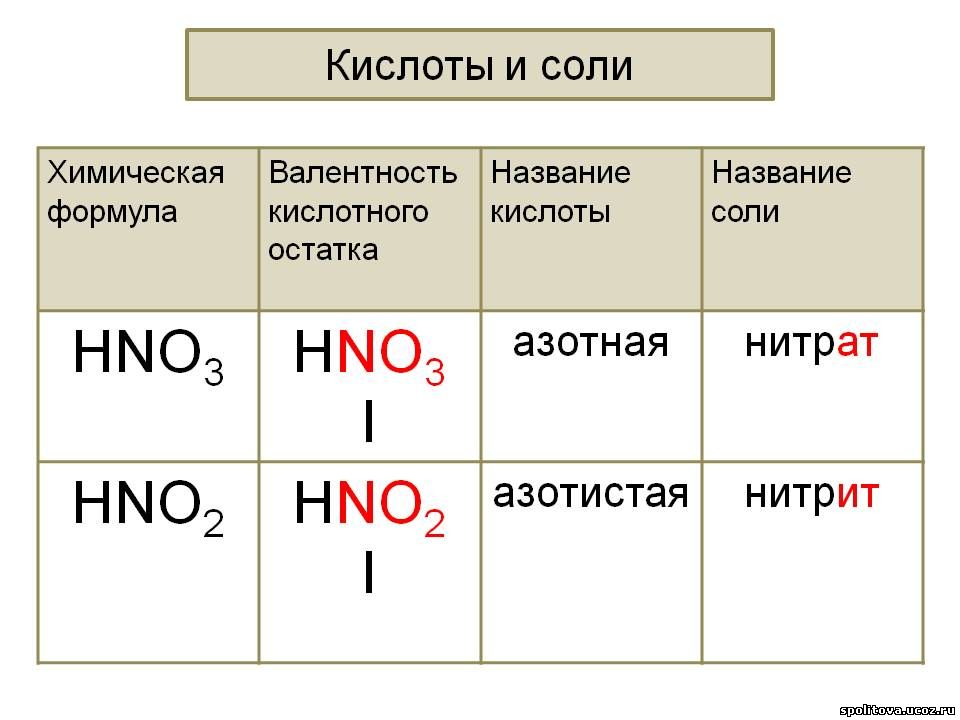 Хотя в молекуле этой кислоты — четыре атома водорода, только один из них (входящий в состав группы СООН) может быть замещён металлом. Поэтому кислотный остаток уксусной кислоты является одновалентным.
Хотя в молекуле этой кислоты — четыре атома водорода, только один из них (входящий в состав группы СООН) может быть замещён металлом. Поэтому кислотный остаток уксусной кислоты является одновалентным.
кислота | соли | ||
Название | Формула | Кислотный остаток | Название аниона |
КИСЛОРОДСОДЕРЖАЩИЕ кислоты и их соли | |||
Азотная | HNO3 | NO3— | Нитрат |
Азотистая | HNO2 | NO2— | Нитрит |
Алюминиевая (орто) | H3AlO3 | AlO33- | Орто-алюминат |
Алюминиевая (мета) | HAlO2 | AlO2— | Мета-алюминат |
Бериллиевая | H2BeO2 | BeO22- | Бериллат |
Борная (орто) | H3BO3 | BO33- | Орто-борат |
Борная (мета) | HBO2 | BO2— | Мета-борат |
Борная (тетра) | H2B4O7 | B4O72- | Тетраборат |
Висмутовая | HBiO3 | BiO3— | Висмутат |
Вольфрамовая | H2WO4 | WO42- | Вольфрамат |
Железная | H2FeO4 | FeO42- | Феррат |
Железистая (мета) | HFeO2 | FeO2— | Феррит |
Кремниевая (орто) | H4SiO4 | SiO44- | Орто-силикат |
Кремниевая (мета) | H2SiO3 | SiO32- | Мета-силикат |
Марганцовая | HMnO4 | MnO4— | Перманганат |
Марганцовистая | H2MnO4 | MnO42- | Манганат |
Марганцоватистая | H2MnO3 | MnO32- | Манганит |
Молибденовая | H2MoO4 | MoO42- | Молибдат |
Мышьковая (орто) | H3AsO4 | AsO43- | Орто-арсенат |
Мышьяковая (мета) | HAsO3 | AsO3— | Мета-арсенат |
Димышьяковая | H4As2O7 | As2O74- | Диарсенат |
Оловянная (орто) | H4SnO4 | SnO44- | Орто-станнат |
Оловянная (мета) | H2SnO3 | SnO32- | Мета-станнат |
Оловянистая | H2SnO2 | SnO22- | Станнит |
Селеновая | H2SeO4 | SeO42- | Селенат |
Селенистая | H2SeO3 | SeO32- | Селенит |
Свинцовая (орто) | H4PbO4 | PbO44- | Орто-плюмбат |
Свинцовая (мета) | H2PbO3 | PbO32- | Мета-плюмбат |
Свинцовистая | H2PbO2 | PbO22- | Плюмбит |
Серная | H2SO4 | SO42- | Сульфат |
Дисерная | H2S2O7 | S2O72- | Дисульфат |
Надсерная | H2S2O8 | S2O82- | Пероксодисульфат |
Тиосерная | H2S2O3 | S2O32- | Тио-сульфат |
Дитионовая | H2S2O6 | S2O62- | Дитионат |
Тетратионовая | H2S4O6 | S4O62- | Тетратионат |
Сернистая | H2SO3 | SO32- | Сульфит |
Сурьмяная (орто) | H3SbO4 | SbO43- | Орто-антимонат |
Сурьмяная (мета) | HSbO3 | SbO3— | Мета-антимонат |
Теллуровая | H2TeO4 | TeO42- | Теллурат |
Угольная | H2CO3 | CO32- | Карбонат |
Муравьиная | HCOOH | HCOO— | Формиат |
Уксусная | CH3COOH | CH3COO— | Ацетат |
Фосфорная (орто) | H3PO4 | PO43- | Орто-фосфат |
Фосфорная (мета) | HPO3 | PO3— | Мета-фосфат |
Дифосфорная | H4P2O7 | P2O74- | Дифосфат |
Фосфористая (орто) | H3PO3 | Н2PO3—иHPO32- | Ди- и ГИДРО-фосфиты |
Фосфористая (мета) | HPO2 | PO2— | Мета-фосфит |
Фосфорноватистая | H3PO2 | H2PO2— | Дигидро-гипо-фосфит |
Хромовая | H2CrO4 | CrO42- | Хромат |
Дихромовая | H2Cr2O7 | Cr2O72- | Дихромат |
Хромистая (орто) | H3CrO3 | CrO33- | Орто-хромит |
Хромистая (мета) | HCrO2 | CrO2— | Мета-хромит |
ОКСО-кислоты и -соли элементов Cl,Br,I– ПОДОБНЫ. | |||
Хлорная | HClO4 | ClO4— | Пер-хлорат |
Хлорноватая | HClO3 | ClO3— | Хлорат |
Хлористая | HClO2 | ClO2— | Хлорит |
Хлорноватистая | HClO | ClO— | Гипо-хлорит |
Бромная | HBrO4 | BrO4— | Пер-бромат |
Бромноватая | HBrO3 | BrO3— | Бромат |
Бромристая | HBrO2 | BrO2— | Бромит |
Бромноватистая | HBrO | BrO— | Гипо-бромит |
Иодная | HIO4 | IO4— | Пер-иодат |
Иодноватая | HIO3 | IO3— | Иодат |
Иодистая | HIO2 | IO2— | Иодит |
Иодноватистая | HIO | IO— | Гипо-иодит |
БЕСКИСЛОРОДНЫЕ кислоты и их соли | |||
Фтороводородная | HF | F— | Фторид |
Хлороводородная | HCl | Cl— | Хлорид |
Бромоводородная | HBr | Br— | Бромид |
Иодоводородная | HI | I— | Иодид |
Циановодородная | HCN | CN— | Цианид |
Тиоциановодородная | HSCN | SCN— | Тио-цианид |
Селеноводородная | H2Se | Se2- | Селенид |
Сероводородная | H2S | S2- | Сульфид |
Теллуроводородная | H2Te | Te2- | Теллурид |
Муниципальное бюджетное общеобразовательное учреждение средняя общеобразовательная школа № 12
Предмет: ХИМИЯ
Дата: 10.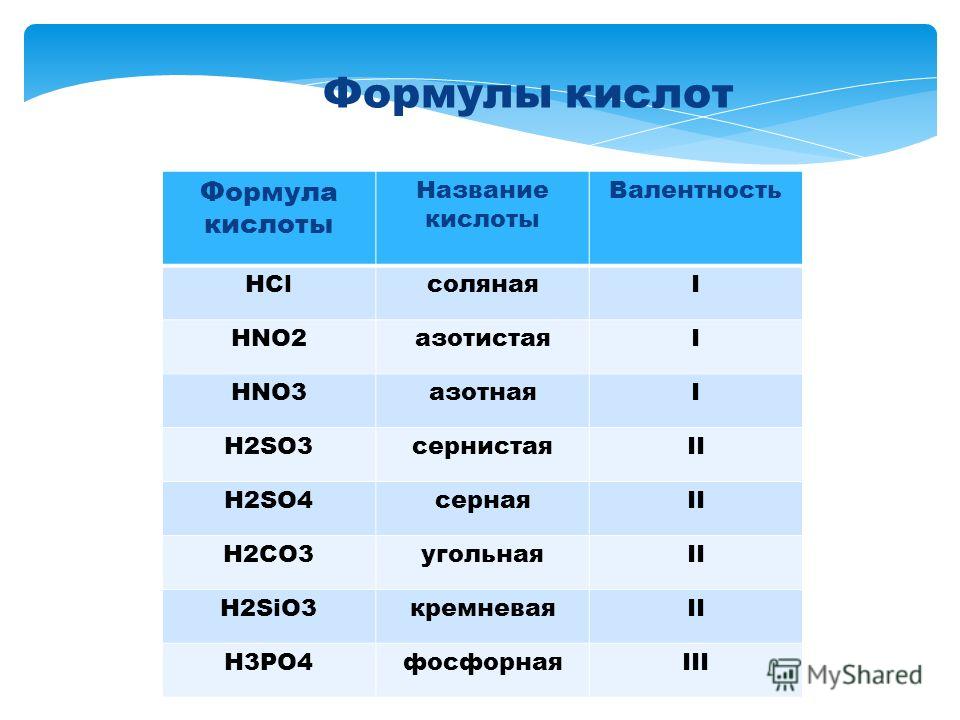 02.2016г
02.2016г
Пользуясь образцом выполнения варианта №1 таблицы 20 на стр.144 (приложение 1), выполнить вариант №2
Приложение 1.
|
Вариант 1 |
а) |
б) |
в) |
г) |
д) |
|
Формула вещества |
Принадлежит к классу |
Название вещества |
Валентность кислотного остатка (в кислоте, соли) |
Растворимость (по таблице растворимости на форзаце 2 учебника) |
Физические свойства знакомых (агрегатное состояние, цвет, запах, растворимость в воде) |
|
CaO |
Оксид основный |
Оксид кальция |
|
|
твёрд. |
|
H2S |
Кислота |
Сероводородная кислота |
II |
Р(растворимое вещество) |
|
|
NaCl |
Соль |
Хлорид натрия (повареная соль) |
I |
Р |
твёрд., белый, растворим. |
|
Ca3(PO4)2 |
Соль |
Фосфат кальция |
III |
Н (нерастворимое вещество) |
|
|
N2O5 |
Оксид кислотный |
Оксид азота (V) |
|
|
|
|
AgNO3 |
Соль |
Нитрат серебра |
I |
|
|
|
Mg |
Металл |
Магний |
|
|
твёрд. |
|
FeSO4 |
Соль |
Сульфат железа (II) |
II |
Р |
|
|
HNO3 |
Кислота |
Азотная кислота |
I |
Р |
|
Если тетрадь в школе, выполняете все задания в новой тетради!
Дата: 04.02.2016г
Изучить §33, Используя алгоритм на стр. 143, выполнить в тетради №2,№3 на стр.144
Предмет: ХИМИЯ
Дата: 04.02.2016г
Изучить §33, Используя алгоритм на стр. 143, выполнить в тетради №2,№3 на стр. 144
144
Предмет: ХИМИЯ
Дата: 03.02.2016г
Выучить наизусть формулы и название кислот, кислотных остатков, оксидов, соответствующих кислотам по таблице №1:
Таблица №1
|
Формула кислоты |
Название кислоты |
Формула кислотного остатка |
Валентность кислотного остатка |
Название кислотного остатка |
Оксид, соответствующий кислоте |
|
HCl |
Хлороводородная (соляная) |
Cl |
I |
Хлорид |
— |
|
HF |
Фтороводородная (плавиковая) |
F |
I |
Фторид |
— |
|
HBr |
Бромоводородная |
Br |
I |
Бромид |
— |
|
HI |
Иодоводородная |
I |
I |
Иодид |
— |
|
H2S |
Сероводородная |
S |
II |
Сульфид |
— |
|
H2SO3 |
Сернистая |
SO3 |
II |
Сульфит |
SO2 |
|
H2SO4 |
Серная |
SO4 |
II |
Сульфат |
SO3 |
|
HNO2 |
Азотистая |
NO2 |
I |
Нитрит |
N2O3 |
|
HNO3 |
Азотная |
NO3 |
I |
Нитрат |
N2O5 |
|
H2CO3 |
Угольная |
CO3 |
II |
Карбонат |
CO2 |
|
H2SiO3 |
Кремниевая |
SiO3 |
II |
Силикат |
SiO2 |
|
H3PO4 |
Фосфорная (Ортофосфорная) |
PO4 |
III |
Фосфат (Ортофосфат) |
P2O5 |
Выполните следующее задание в тетради:
Начертите таблицу и заполните свободные клеточки (впишите формулу или название) в таблице №2 (по памяти, не пользуясь таблицей №1)
Таблица №2
|
Формула кислоты |
Название кислоты |
Формула кислотного остатка |
Валентность кислотного остатка |
Название кислотного остатка |
Оксид, соответствующий кислоте |
|
HNO3 |
|
|
|
Нитрат |
N2O5 |
|
|
Иодоводородная |
|
|
|
— |
|
H3PO4 |
|
|
|
|
|
|
|
Сернистая |
SO3 |
|
|
|
|
H2CO3 |
|
|
|
|
|
|
|
|
|
|
Хлорид |
— |
|
|
Кремниевая |
|
|
|
|
|
HF |
|
|
|
|
— |
|
|
|
|
|
Сульфид |
— |
|
|
|
|
|
Бромид |
— |
|
|
Серная |
|
|
|
|
|
HNO2 |
Азотистая |
NO2 |
I |
Нитрит |
N2O3 |
Все работы, выполненные в дни карантина, будут проверены и оценены. Выполнение работ — обязательно! Это дистанционное обучение. Просьба качественно отработать этот материал.
Выполнение работ — обязательно! Это дистанционное обучение. Просьба качественно отработать этот материал.
Предмет: ХИМИЯ
Дата: 28.01.2016г
Изучить §32, записать в тетради основные понятия:
Кислотами называются сложные вещества ………..
Валентность кислотного остатка находят ………..
К бескислородным кислотам относят: ….., ……, ……, …..
К кислородсодержащим кислотам относят: …, …,…..,….,….,….,…..
Выучить наизусть формулы и название кислот (таблица 19 на стр.141)
Выполните в тетради задания:
№1. Распределите химические формулы кислот из перечня формул веществ в таблицу. Дайте им названия:
LiOH, Mn2O7, CaO, Na3PO4, H2S, MnO, Fe(OH)3, Cr2O3, HI , HClO4 ,HBr , CaCl2, Na2O, HCl , H2SO4 , HNO3 , HMnO4 , Ca(OH)2, SiO2, H2SO3 , Zn(OH)2, H3PO4 , HF , HNO2,H2CO3 , N2O, NaNO3 ,H2S , H2SiO3
|
Кислоты |
||||||
|
Бес-кисло- родные |
Кислород- содержащие |
растворимые
|
нераст-воримые |
одно- основные |
двух-основные |
трёх-основные |
Выполните задания №1, №2, №3 на стр. 142
142
При изучении нового материала можно воспользоваться дополнительным материалом:
Урок по теме: Кислоты: классификация, номенклатура, физические и химические свойства
Кислоты — сложные вещества, состоящие из одного или нескольких атомов водорода,
способных замещаться на атома металлов, и кислотных остатков.
Классификация кислот
По числу атомов водорода:число атомов водорода (n) определяет основность кислот:
n = 1 одноосновная
n = 2 двухосновная
n = 3 трехосновная
По составу:
а) Таблица кислородсодержащих кислот, кислотных остатков и соответствующих
кислотных оксидов:
|
Кислота (НnА) |
Кислотный остаток (А) |
Соответствующий кислотный оксид |
|
HClO4 хлорная |
ClO4 (I) перхлорат |
Cl2O7 оксид хлора (VII ) |
|
H2SO4 серная |
SO4 (II) сульфат |
SO3 оксид серы (VI ), серный ангидрид |
|
HNO3 азотная |
NO3 (I) нитрат |
N2O5 оксид азота ( V ) |
|
HMnO4 марганцевая |
MnO4 (I) перманганат |
Mn2O7 оксид марганца (VII ) |
|
H2SO3 сернистая |
SO3 (II) сульфит |
SO2 оксид серы (IV ) |
|
H3PO4 ортофосфорная |
PO4 (III) ортофосфат |
P2O5 оксид фосфора (V ) |
|
HNO2 азотистая |
NO2 (I) нитрит |
N2O3 оксид азота (III ) |
|
H2CO3 угольная |
CO3 (II) карбонат |
CO2 оксид углерода ( IV), углекислый газ |
|
H2SiO3 кремниевая |
SiO3 (II) силикат |
SiO2 оксид кремния (IV) |
б) Таблица бескислородных кислот
|
Кислота (НnА) |
Кислотный остаток (А) |
|
HCl соляная, хлороводородная |
Cl (I) хлорид |
|
H2S сероводородная |
S(II) сульфид |
|
HBr бромоводородная |
Br (I) бромид |
|
HI йодоводородная |
I(I) йодид |
|
HF фтороводородная,плавиковая |
F(I) фторид |
Физические свойства кислот
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны
известны
также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все
кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3.
Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый
вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
Способы получения кислот
|
бескислородные |
кислородсодержащие |
|
HCl, HBr, HI, HF, H2S |
HNO3, H2SO4 и другие |
|
ПОЛУЧЕНИЕ |
|
|
1. Прямое взаимодействие неметаллов H2 + Cl2 = 2 HCl |
1. SO3 + H2O = H2SO4 |
|
2. Реакция обмена между солью и менее летучей кислотой 2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl |
|
Предмет: ХИМИЯ
Дата: 27.01.2016г
Изучить §31, записать в тетради основные понятия:
Основаниями называются …………
По характеру свойств различают ………
К щелочам относят …………….
Исторически сложившиеся названия щелочей:
KOH – едкое кали
NaOH – …..
Ca(OH)2 – ……..
Ba(OH)2– ……..
Ca(OH)2– ……..
ВЫПОЛНИТЕ ЗАДАНИЯ:
№1. Распределите химические формулы в таблицу :
LiOH , NO , Al 2 O 3, Zn(OH)2, CaO , SiO 2, CrO , NaOH , Mn 2 O 7, Fe(OH)2, Cr 2 O 3
|
Основный оксид |
Кислотный оксид |
Амфотерный оксид |
Безразличный оксид |
Щёлочь |
Нерастворимое основание |
№2.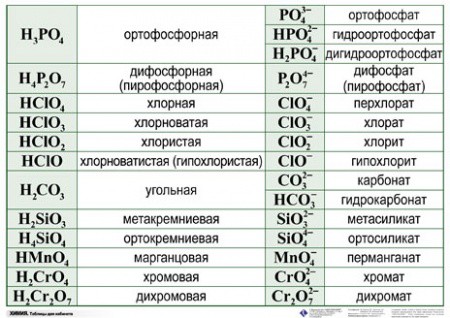 Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P2O5, Ca(OH)2, CO, Al(OH)3, BeO, Mg(OH)2,K2O, ZnO, KOH, CrO3
Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P2O5, Ca(OH)2, CO, Al(OH)3, BeO, Mg(OH)2,K2O, ZnO, KOH, CrO3
При изучении нового материала можно использовать дополнительный материал:
Урок по теме: Основания: классификация, номенклатура, получение
|
ОСНОВАНИЯ Основания — это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксильными группами — ОН. Общая формула:
По номенклатуре основания называют гидроксидами. Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента:
Классификация оснований
Щёлочи – это основания растворимые в воде. Классификация оснований по числу групп ОН: n=1 однокислотное n=2 двухкислотное n=3 трехкислотное Физические свойства Большинство оснований – твёрдые вещества с различной растворимостью в воде. СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ ЩЁЛОЧЕЙ 1. Металл + H2O = ЩЁЛОЧЬ + Н2↑ 2Na + 2H2O = 2NaOH + H2 Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba,Ra) 2. Na2O + H2O = 2 NaOH Здесь, ОКСИД МЕТАЛЛА (основный оксид, растворимый в воде) – щелочного металла (Li,Na, K, Rb, Cs) или щелочноземельного (Ca, Ba, Ra) НЕРАСТВОРИМЫХ ОСНОВАНИЙ СОЛЬ(р-р) + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ МехАу+ Ме*(OH)n = Me(OH)у↓+Ме*хАn CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
|
Химические формулы, порошки и кислоты: в Крыму полицейские накрыли подпольную нарколабораторию (ВИДЕО) » Керчь ИНФО
Химические формулы, порошки и кислоты: в Крыму полицейские накрыли подпольную нарколабораторию (ВИДЕО)
Задержанному 23-летнему крымчанину грозит наказание в виде лишения свободны на срок до 20 лет.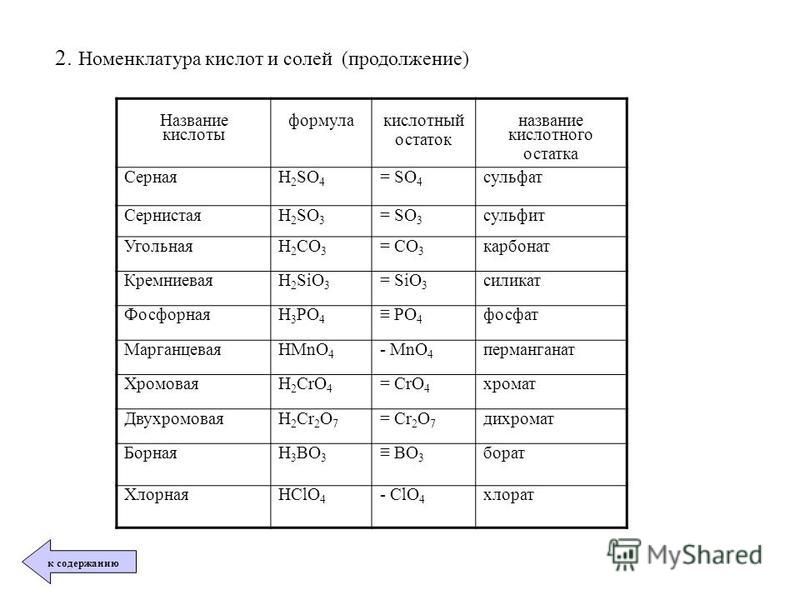
Сотрудники Управления по контролю за оборотом наркотиков МВД по Республике Крым пресекли работу подпольной нарколаборатории. Кустарный цех по изготовлению запрещенных веществ был организован в одном из нежилых помещений, расположенных на окраине города Симферополя. Сообщает пресс-служба МВД Крыма.
«В ходе проведенных оперативно-розыскных мероприятий установлено, что организаторы поставили на поток производство высококонцентрированного синтетического наркотика – производного от «мефедрона», который относится к так называемым «клубным» психостимуляторам», — говорится в сообщении.
По результатам ряда проведенных оперативных мероприятий сотрудниками полиции задержан 23-летний молодой человек, причастный к организации нелегального производства.
Помещение, в котором осуществлялось химическое производство по синтезированию порошка, выглядело как частная постройка.
«В ходе обыска изъято специальное химическое оборудование и материалы, необходимые для лабораторного производства наркотиков, химические реактивы в виде порошков, кислот и щелочей. Помимо этого, в отдельных резервуарах, принадлежащих задержанному, сотрудники полиции обнаружили готовый, только что произведенный порошок», -отмечают в ведомстве.
Помимо этого, в отдельных резервуарах, принадлежащих задержанному, сотрудники полиции обнаружили готовый, только что произведенный порошок», -отмечают в ведомстве.
Также известно, что в результате проведённых мероприятий из незаконного оборота изъято около 1,5 кг. готового порошка. Всего благодаря профессиональной работе крымских полицейских на улицы и во дворы не попало более 2 тысяч средне-разовых доз наркотиков.
Помимо этого, в помещении оперативниками обнаружены химические формулы и записи с отражением алгоритма по производству синтетических наркотиков.
Читайте: Евпаторийский чиновник получил реальный срок за злоупотребление должностными полномочиями
Стражи порядка установили, что задержанный также осуществлял сбыт произведенных им запрещенных веществ через ряд посредников и мелких наркосбытчиков с использованием сети Интернет и электронных мессенджеров.
В отношении злоумышленника собрана доказательственная база не только в связи с изготовлением наркотиков, но и их сбыта в крупном размере.
Следственным Управлением МВД по Республике Крым в отношении мужчины возбуждено уголовное дело по признакам преступления, предусмотренного ч. 3 ст. 30, п. «г» ч. 4 ст. 228.1 УК РФ – покушение на сбыт наркотических средств в крупном размере. С учетом ряда отягчающих обстоятельств задержанному грозит наказание в виде лишения свободны на срок до 20 лет.
Состав кислот. Соли
I. Состав кислот. Соли.
Образовательные задачи:
Знать состав кислот, солей;
Определение кислоты и соли.
Уметь составлять химические формулы солей, давать им название, сравнивать по составу кислоты и соли.
Воспитательные задачи:
Продолжить формирование диалектико-материалистического мировоззрения учащихся.
Содействовать трудовому и эстетическому воспитанию учеников.
Формировать умение работать в коллективе, где развиваются чувства товарищества, доброжелательности и требовательности к себе и своему товарищу.
Развивающие задачи:
Развивать познавательный интерес и эмоции школьников, уметь выделять главное, сравнивать, обобщать, логически излагать мысли.
Тип урока:
Урок усвоения новых знаний.
Оборудование:
Образцы кислот и солей.
Ход урока:
1. Учитель знакомит учащихся с темой урока и его задачами, с порядком проведения урока.
2. Изучение новой темы.
Состав кислот.
Кислоты – это одни из важнейших
продуктов химической технологии, которые
находят широкое применение.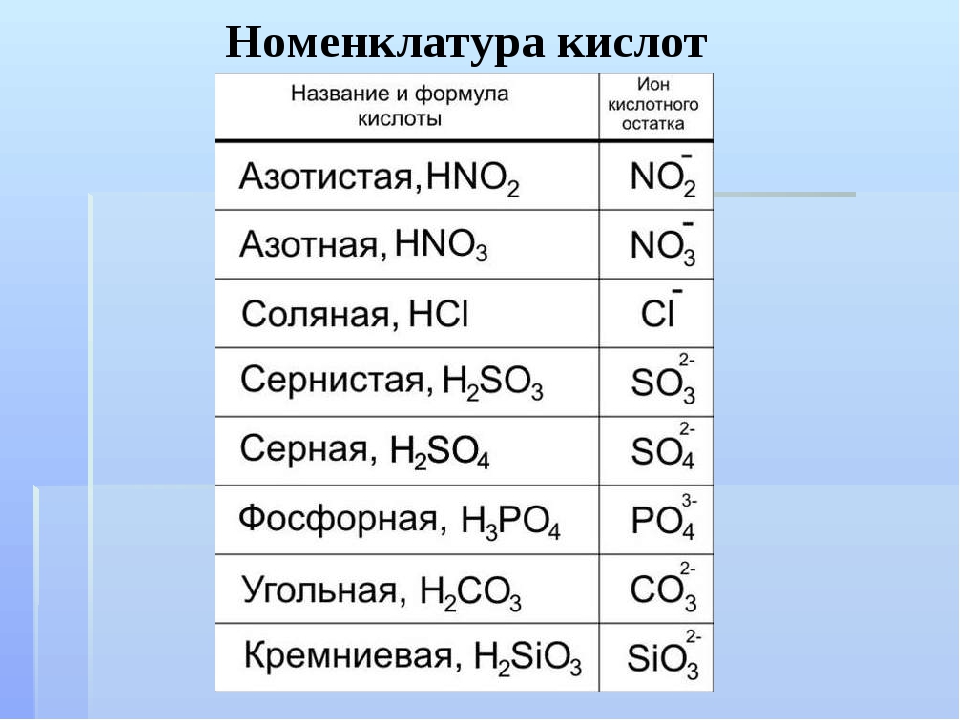 Чтобы разумно
использовать вещества, прежде всего необходимо
знать их состав, строение и свойства.
Чтобы разумно
использовать вещества, прежде всего необходимо
знать их состав, строение и свойства.
Составьте уравнения химических реакций железа с соляной кислотой и серной кислотой. Вспомним один из способов получения водорода в лаборатории.
К доске выходит ученик и составляет уравнения химических реакций. Класс помогает ему в ответах.
Кроме соляной и серной кислот существуют еще большое количество различных кислот (смотрим и работаем с таблицей № 1)
Учитель демонстрирует на столе кислоты,
Таблица № 1
Формулы некоторых кислот и кислотных остатков.
Название кислоты |
Формула кислоты |
Кислотный остаток и его валентность |
Название соли |
Соляная кислота |
НСl |
С1 — |
Хлориды |
Серная кислота |
H2SO4 |
SO4 = |
Сульфаты |
Сернистая кислота |
Н2SО3 |
SO3= |
Сульфиты |
Азотная кислота |
НNО3 |
NO3 — |
Нитраты |
Ортофосфорная кислота |
Н3РO4 |
РO4= |
Ортофосфаты |
Сероводородная кислота |
H2S |
S = |
Сульфиды |
Угольная кислота |
Н2СО3 |
СOз= |
Карбонаты |
Кремниевая кислота |
Н2SiO3 |
SiO3 = |
Силикаты |
Бромоводородная кислота |
НВr |
Br — |
Бромиды |
Фтороводородная кислота |
HF |
F — |
Фториды |
Иодоводородная кислота |
HI |
I — |
Иодиды |
Фронтальная беседа с классом:
Теперь посмотрите на формулы кислот.
- Из чего состоят кислоты?
- Дайте определение — что такое кислоты?
- Теперь посмотрим на уравнения химических реакций железа с соляной и серной кислотами. И даем полное определение кислотам.
- Как узнать валентность кислотного остатка?
- Посмотрим на уравнение химической реакции взаимодействия железа с кислотами и ответим на следующий вопрос: Разрушаются кислотные остатки в ходе химических реакций?
II. Классификация кислот.
По составу кислоты делят на кислородосодержащие и бескислородные, а по числу содержащихся в них атомов водорода, способных замещаться на металл, — на одноосновные, двухосновные и трехосновные” Ученики работают с таблицей № 2.
Таблица № 2
Кислоты |
|
Бескислородные |
Кислородсодержащие |
HCl, HBr, HY (одноосновные) H2S (двухосновная) |
HNO3 (одноосновная), H2SO4 (двухосновная), H3PO4 (трехосновные) |
III. Закрепление изученного материала.
Закрепление изученного материала.
1. Выполним работу №1 по группам: 1 ряд – 1 группа, 2 ряд – 2 группа, 3 ряд – 3 группа.
Цель:
Сформировать умение определять валентность кислотного остатка по формуле кислоты.
1. В приведенных формулах кислот подчеркните кислотный остаток, обозначьте римской цифрой величину его валентности:
Задание 1 группы
- азотная кислота – НNО3
- серная кислота – H2SО4
- ортофосфорная кислота – НзРО4
- метафосфорная кислота – НРО3
Задание 2 группы
- сероводородная кислота – H2S
- хлорная кислота – НClO4
- соляная кислота – НС1
- мышьяковая кислота – Н3АsO4
Задание 3 группы
- сернистая кислота – Н2SО3
- бромоводородная кислота – НВr
- кремниевая кислота – Нг8Юз
- пирофосфорная кислота – Н4Р2О7
2. Проверьте правильность ответов
внутри группы.
Проверьте правильность ответов
внутри группы.
3. Проверяем правильность ответов каждой из групп.
IV. Изучение новой темы.
1. Соли, состав, название.
А) Состав солей.
В результате взаимодействия металлов с кислотами образуются соли. Вспомним реакцию железа с кислотами.
FeCl2, FeSO4.
Дайте определение соли?
Демонстрируем образцы солей.
Б) Название солей.
Класс работает с таблицей № 1.
В) Составление формул солей.
2. Что такое валентность химических элементов?
V. Закрепление изученного материала.
Работа 2 (по группам)
1 ряд – 1 группа,
2 ряд – 2 группа,
3 ряд – 3 группа.
Цель: Выработать умение составлять формулы солей по валентности металла и кислотного остатка.
1. Заполнить клетки таблицы формулами солей, образованных указанными кислотами и металлами.
2. Под формулами солей укажите их названия.
Задание № 2 для первой группы
А)
Формула металла |
Формула кислоты |
|||
HCl |
H2SO4 |
HNO3 |
H3PO4 |
|
K (I) |
||||
Al (III) |
||||
Б) по названию составьте формулы солей: сульфид натрия, карбонат кальция, силикат калия, нитрат хрома (II)
Задание № 2 для второй группы
А)
Формула металла |
Формула кислоты |
|||
HCl |
H2SO4 |
HNO3 |
H3PO4 |
|
Ag (I) |
||||
Cu (II) |
||||
Б) по названию составьте формулы солей: иодид кальция, сльфит калия, силикат лития, сульфат хрома (III).
Задание 2 для третьей группы
А)
Формула металла |
Формула кислоты |
|||
HCl |
H2SO4 |
HNO3 |
H3PO4 |
|
Fe (II) |
||||
Fe (III) |
||||
Б) по названию составьте формулы солей: карбонат натрия, бромид магния, сульфид калия, сульфат марганца (II).
3. Проверьте правильность ответов внутри группы.
4. Проверяем правильность ответов каждой из групп.
VI. Домашнее задание:
§ 32. Состав и классификация кислот.
§ 33. Состав, название солей.
Учебник: Рудзитис Г.Е. Фельдман Ф.Г. Химия. 8 класс средней школы. М.: Просвещение., 1993г.
VIII. Подведение итогов урока.
Учитель объявляет оценки классу и отдельным ученикам.
Урок химии в 8 классе по теме «Кислоты»
Приложение 1
Таблица кислот
Формула соли
Фтороводородная кислота
( плавиковая)
HF
фторид
Хлороводородная кислота
( соляная)
HCl
хлорид
Бромоводородная кислота
HBr
бромид
Иодоводородная кислота
HI
иодид
Сероводородная кислота
H2S
сульфид
Серная кислота
H2SO4
сульфат
Сернистая кислота
H2SO3
сульфит
Азотная кислота
HNO3
нитрат
Азотистая кислота
НNO2
нитрит
Фосфорная кислота
H3PO4
фосфат
Угольная кислота
H2CO3
карбонат
Кремниевая кислота
H2SiO3
силикат
Приложение 1
Таблица кислот
Формула соли
Фтороводородная кислота
( плавиковая)
HF
фторид
Хлороводородная кислота
( соляная)
HCl
хлорид
Бромоводородная кислота
HBr
бромид
Иодоводородная кислота
HI
иодид
Сероводородная кислота
H2S
сульфид
Серная кислота
H2SO4
сульфат
Сернистая кислота
H2SO3
сульфит
Азотная кислота
HNO3
нитрат
Азотистая кислота
НNO2
нитрит
Фосфорная кислота
H3PO4
фосфат
Угольная кислота
H2CO3
карбонат
Кремниевая кислота
H2SiO3
силикат
Приложение 2
«Почему кислоты получили такое название?»
Из своего жизненного опыта вы знаете, что многие продукты питания обладают кислым вкусом. Кислый вкус этим продуктам придают кислоты. Кислый вкус лимону придает лимонная кислота, яблоку – яблочная кислота, скисшему молоку – молочная кислота. Щавель имеет кислый вкус благодаря наличию в его листьях щавелевой кислоты.
«Правила техники безопасности при работе с кислотами»
Что нужно помнить при работе с кислотами?
1) Прежде всего: Кислоту надо приливать к воде, а не наоборот!
В связи с выделением большого количества теплоты при растворении концентрированной серной кислоты в воде нельзя вливать воду в кислоту. В этом случае вода, имеющая меньшую плотность, окажется на поверхности, закипит и её брызги вместе с кислотой могут обжечь руки и лицо.
2) Запомните: В случае попадания кислоты на кожу следует промыть её водой и 5% раствором соды.
3) Можно ли пробовать на вкус кислоты или другие вещества в лаборатории?
Ни один химик и ни один грамотный человек даже и не подумает пробовать и распознавать кислоты на вкус — это может быть смертельно опасно.
«Кислоты вокруг нас»
Кислоты постоянно присутствуют вокруг нас. Например, дождевая вода на первый взгляд кажется чистой. На самом деле в ней присутствует немало других веществ. За счет растворения углекислого газа из атмосферы она является раствором угольной кислоты. После летней грозы в ней оказывается еще и азотная кислота.
Муравей впрыскивает в ранку яд, содержащий муравьиную кислоту. Муравьиной кислотой обусловлено жжение крапивы, ее выделяют некоторые гусеницы. Голожаберные моллюски в порядке самообороны выстреливают парами серной кислоты.
Мухоморы в качестве ядовитых токсинов «используют» иботеновую кислоту. Это вещество так ядовито, что мухомору незачем прятаться.
Значительная функция лишайниковых кислот в природе состоит в разрушении ими горных пород и образовании почвы.
Важна роль кислот и в человеческом организме:
аскорбиновая кислота – поставщик витамина С,
фолиевая кислота – витамин В9,
аминокислоты образуют множество белков,
соляная кислота – сильнейший бактерицид, находящийся у нас в желудке, помогает переваривать пищу,
ацетилсалициловая кислота – жаропонижающее средство,
молочная кислота образуется в мышцах при физической нагрузке,
гиалуроновая кислота входит в состав многих тканей (кожа, хрящи, стекловидное тело), используется в косметике, как составная часть средств ухода за кожей: кремов, губной помады, лосьонов и пр.
Приложение 2
«Почему кислоты получили такое название?»
Из своего жизненного опыта вы знаете, что многие продукты питания обладают кислым вкусом. Кислый вкус этим продуктам придают кислоты. Кислый вкус лимону придает лимонная кислота, яблоку – яблочная кислота, скисшему молоку – молочная кислота. Щавель имеет кислый вкус благодаря наличию в его листьях щавелевой кислоты.
«Правила техники безопасности при работе с кислотами»
Что нужно помнить при работе с кислотами?
1) Прежде всего: Кислоту надо приливать к воде, а не наоборот!
В связи с выделением большого количества теплоты при растворении концентрированной серной кислоты в воде нельзя вливать воду в кислоту. В этом случае вода, имеющая меньшую плотность, окажется на поверхности, закипит и её брызги вместе с кислотой могут обжечь руки и лицо.
2) Запомните: В случае попадания кислоты на кожу следует промыть её водой и 5% раствором соды.
3) Можно ли пробовать на вкус кислоты или другие вещества в лаборатории?
Ни один химик и ни один грамотный человек даже и не подумает пробовать и распознавать кислоты на вкус — это может быть смертельно опасно. \
«Кислоты вокруг нас»
Кислоты постоянно присутствуют вокруг нас. Например, дождевая вода на первый взгляд кажется чистой. На самом деле в ней присутствует немало других веществ. За счет растворения углекислого газа из атмосферы она является раствором угольной кислоты. После летней грозы в ней оказывается еще и азотная кислота.
Муравей впрыскивает в ранку яд, содержащий муравьиную кислоту. Муравьиной кислотой обусловлено жжение крапивы, ее выделяют некоторые гусеницы. Голожаберные моллюски в порядке самообороны выстреливают парами серной кислоты.
Мухоморы в качестве ядовитых токсинов «используют» иботеновую кислоту. Это вещество так ядовито, что мухомору незачем прятаться.
Значительная функция лишайниковых кислот в природе состоит в разрушении ими горных пород и образовании почвы.
Важна роль кислот и в человеческом организме:
аскорбиновая кислота – поставщик витамина С,
фолиевая кислота – витамин В9,
аминокислоты образуют множество белков,
соляная кислота – сильнейший бактерицид, находящийся у нас в желудке, помогает переваривать пищу,
ацетилсалициловая кислота – жаропонижающее средство,
молочная кислота образуется в мышцах при физической нагрузке,
гиалуроновая кислота входит в состав многих тканей (кожа, хрящи, стекловидное тело), используется в косметике, как составная часть средств ухода за кожей: кремов, губной помады, лосьонов и пр.
|
|
Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Химический справочник / / «Химический алфавит (словарь)» — названия, сокращения, приставки, обозначения веществ и соединений. / / Таблица названий (наименований) кислот и их солей.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Нашли ошибку? Есть дополнения? Напишите нам об этом, указав ссылку на страницу. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
TehTab.ru
Реклама, сотрудничество: [email protected] |
Обращаем ваше внимание на то, что данный интернет-сайт носит исключительно информационный характер. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Все риски за использование информаци с сайта посетители берут на себя. Проект TehTab.ru является некоммерческим, не поддерживается никакими политическими партиями и иностранными организациями. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Именование кислот и оснований | Введение в химию
Цель обучения
- Преобразование между структурой кислоты или основания и ее химическим названием
Ключевые моменты
- Кислоты названы на основе их аниона — иона, присоединенного к водороду. В простых бинарных кислотах один ион присоединен к водороду. Названия таких кислот состоят из приставки «гидро-», первого слога аниона и суффикса «-ic».
- Сложные кислотные соединения содержат кислород. Для кислоты с многоатомным ионом суффикс «-ат» от иона заменяется на «-ic».
- Многоатомные ионы с одним дополнительным кислородом (по сравнению с типичным многоатомным ионом) имеют префикс «per-» и суффикс «-ic».
- Многоатомные ионы с на один кислород меньше имеют суффикс «-ous»; ионы с двумя меньшими числами имеют префикс «гипо-» и суффикс «-ous».
- Сильные основания с группами «-ОН» (гидроксид) называются как ионные соединения.Слабые основания называют молекулярными соединениями или органическими соединениями.
Срок
- многоатомный ион Заряженная разновидность (ион), состоящая из двух или более атомов, ковалентно связанных. Также известен как молекулярный ион.
Обозначение кислот
Кислоты названы по аниону, который они образуют при растворении в воде. В зависимости от того, к какому аниону присоединен водород, кислоты будут иметь разные названия.
Простые кислоты, известные как бинарные кислоты, содержат только один анион и один водород.Эти анионы обычно имеют окончание «-ид». Эти соединения называются кислотами, начиная с префикса «гидро-», затем добавляя первый слог аниона, а затем суффикс «-ic». Например, HCl, представляющий собой водород и хлор, называется соляной кислотой.
Номенклатура распространенных кислот В этой таблице представлена номенклатура некоторых распространенных анионов и кислотВ составе более сложных кислот есть кислород. Для этих кислот существует простой набор правил.
- Любой многоатомный ион с суффиксом «-ат» использует суффикс «-ic» как кислоту.Итак, HNO 3 будет азотной кислотой.
- Если у вас есть многоатомный ион, у которого на один кислород больше, чем у «-атного» иона, тогда ваша кислота будет иметь префикс «per-» и суффикс «-ic». Например, хлорат-ион — это ClO 3 —. Поэтому HClO 4 называется хлорной кислотой.
- Если у кислоты на один кислород меньше, чем у «-атного» иона, то у кислоты будет суффикс «-ous». Например, хлористая кислота — HClO 2 .
- Если у иона «-ат» на два кислорода меньше, префикс будет «гипо-», а суффикс «-ous».«Например, вместо бромной кислоты HBrO 3 у нас есть гипобромистая кислота HBrO.
Именование базы
Наиболее сильные основания содержат гидроксид, многоатомный ион. Поэтому сильные основания называют в соответствии с правилами наименования ионных соединений. Например, NaOH — это гидроксид натрия, KOH — гидроксид калия, а Ca (OH) 2 — гидроксид кальция. Слабые основания, состоящие из ионных соединений, также называют с использованием ионной системы именования. Например, NH 4 OH — гидроксид аммония.
Слабые основания также иногда являются молекулярными соединениями или органическими соединениями, поскольку они имеют ковалентные связи. Поэтому их называют в соответствии с правилами для молекулярных или органических соединений. Например, метиламин (CH 3 NH 2 ) является слабым основанием. Некоторые слабые базы имеют «общие» имена. Например, NH 3 называется аммиаком; его название не получено из какой-либо системы именования.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
Что такое кислоты и основания?
Что такое кислоты и основания?
Хотя я уже говорил вам, что кислоты и основания не сложно понять, у меня плохие новости: для описания кислот и оснований используется не одно, а три общих определения: кислоты и основания Аррениуса, кислоты Бренстеда-Лоури. и основания, и кислоты и основания Льюиса. Хотя это звучит так, будто вам придется узнать о кислотах и основаниях трижды, хорошая новость заключается в том, что для многих практических целей эти три определения примерно эквивалентны.
Аррениусовские кислоты и основания
Еще в конце 1800-х годов наш старый друг Сванте Аррениус придумал определения кислот и оснований, работая над проблемами кинетики.
Согласно Аррениусу, кислоты — это соединения, которые распадаются в воде с выделением ионов гидроксония (H + ). Типичным примером кислоты Аррениуса является соляная кислота (HCl):
Формулы кислот обычно начинаются с водорода, хотя органические кислоты являются заметным исключением. Названия и формулы некоторых распространенных кислот приведены в таблице ниже:
| Название кислоты | Формула | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| соляная кислота | HCl | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| азотная кислота | HNO 10 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| H 3 PO 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| серная кислота | H 2 SO 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| уксусная кислота | C 2 H 4 O 2 | 9010|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Название основания | Формула |
|---|---|
| аммиак | NH 3 |
| гидроксид калия | KOH |
| бикарбонат натрия | NaHCO 3 |
| карбонат натрия | |
| карбонат натрия | |
| гидроксид натрия | NaOH |
Некоторые оксиды образуют кислоты или основания при добавлении воды.Поскольку эти соединения не содержат ионов H + или OH —, если они не вступают в реакцию с водой, их называют «ангидридами». Обычно оксиды неметаллов представляют собой ангидриды кислот (они образуют кислоту при помещении в воду), а оксиды металлов — ангидриды оснований (образующие основание при помещении в воду).
Кислоты и основания Брнстеда-Лоури
В начале 1900-х годов Йоханнесом Брнстедом и Томасом Лоури было предложено альтернативное определение кислот и оснований, чтобы учесть тот факт, что аммиак может нейтрализовать кислотность HCl, даже если воды нет. .Это явление показало им, что аммиак является основанием, даже когда нет воды для образования гидроксид-ионов.
Крот говорит
Есть много разных названий и формул, используемых для описания иона гидроксония. Хотя формула была показана ранее как «H + », иногда ее записывают как «H 3 O», потому что это ион, образующийся при соединении H + с водой. Другой распространенный способ обозначения ионов гидроксония — просто называть их «протонами». Это название происходит от того факта, что H + представляет собой атом водорода (один протон и один электрон), который потерял свой электрон, оставив после себя только голый протон.
Кислота Брнстеда-Лоури определяется как соединение, которое отдает ионы гидроксония другому соединению, например, соляная кислота отдает ионы H + соединениям, с которыми она взаимодействует. Основания Брнстеда-Лоури — это соединения, которые могут принимать ионы гидроксония — когда аммиак получает ион гидроксония из HCl, он образует ион аммония.
Следующее уравнение представляет реакцию кислоты Брнстеда-Лоури с основанием Брнстеда-Лоури:
В этой реакции азотная кислота ведет себя как кислота, потому что она отдает протон аммиаку.Аммиак действует как основание, поскольку он принимает протон из азотной кислоты.
Однако, если вы посмотрите на другую сторону уравнения, мы найдем ионы нитрата и аммония. Поскольку нитрат-ион может принимать протоны от иона аммония (с образованием HNO 3 ), нитрат-ион является очень слабым основанием Брнстеда-Лоури. Поскольку ион аммония может отдать дополнительный протон (в данном случае нитрат-ион), это кислота Брнстеда-Лоури.
Нитрат-ион основан на молекуле азотной кислоты, поэтому мы говорим, что это конъюгат основания азотной кислоты.Аналогичным образом ион аммония представляет собой , сопряженную с кислотой аммиака. Вместе кислота с ее сопряженным основанием (например, HNO 3 и NO 3 —) или основание с сопряженной кислотой (например, NH 3 и NH 4 + ) относятся к в виде сопряженной пары кислота-основание.
Кислоты и основания Льюиса
В определении кислот и оснований Бренстеда-Лоури основание определяется как соединение, которое может принимать протон. Однако , как принимает протон?
Основания Брнстеда-Лоури имеют одну общую черту, заключающуюся в том, что они имеют неподеленную пару электронов.Когда ион гидроксония проходит мимо молекулы, иногда неподеленные пары протягивают руку и захватывают ее. Примером этого является случай, когда аммиак принимает протон в кислотном растворе:
Рис. 23.1 Аммиак может захватить протон из азотной кислоты с помощью своей неподеленной пары электронов.
Один из способов взглянуть на этот процесс состоит в том, что атом аммиака отдает свою неподеленную пару протону. Поскольку неподеленные пары управляют этой химической реакцией, у нас есть новое определение кислотности и основности, которое называется «кислотность / основность по Льюису».«Основание Льюиса представляет собой соединение, которое отдает электронную пару другому соединению (аммиак в нашем примере). Кислота Льюиса представляет собой соединение, которое принимает электронную пару (ион H + в нашем примере).
Молекулярные значения
Основания Льюиса — это химические вещества, которые могут отдавать электронные пары.
Кислоты Льюиса — химические вещества, которые могут их принимать. аммиак также может реагировать со многими другими соединениями.Например, аммиак может отдать свою неподеленную пару электронов BH 3 следующим образом:Рис. 23.2 Неподеленная пара на аммиаке присоединяется к BH 3 .
В этом процессе аммиак является основанием Льюиса, а BH 3 — кислотой Льюиса.
Как правило, определение кислот и оснований Льюиса является наиболее полезным, поскольку оно является наиболее всеобъемлющим из трех определений. Например, определение кислоты Брнстедом-Лоури включает HF, но не BH 3 , который не теряет протон при присоединении неподеленными парами на основании Льюиса.
Выдержка из Полное руководство для идиотов по химии 2003 Яна Гуча. Все права защищены, включая право на полное или частичное воспроизведение в любой форме. Используется по договоренности с Alpha Books , членом Penguin Group (USA) Inc.
Чтобы заказать эту книгу непосредственно у издателя, посетите веб-сайт Penguin USA или позвоните по телефону 1-800-253-6476. Вы также можете приобрести эту книгу на Amazon.com и Barnes & Noble.
Формулы общих кислот и оснований
Кислоты и основания используются во многих химических реакциях.Они ответственны за большинство реакций изменения цвета и используются для регулирования pH химических растворов. Вот названия некоторых распространенных кислот и оснований и формулы, связанные с ними.
Формулы бинарных кислот
Бинарное соединение состоит из двух элементов. Бинарные кислоты имеют префикс hydro перед полным названием неметаллического элемента. У них окончание -ic . Примеры включают хлористоводородную кислоту, а фтористоводородная кислота включает:
Плавиковая кислота — HF
Соляная кислота — HCl
Бромистоводородная кислота — HBr
Водородная кислота — HI
Сероводородная кислота — H 2 S
Формулы тройных кислот
Трехкомпонентные кислоты обычно содержат водород, неметалл и кислород.Название наиболее распространенной формы кислоты состоит из неметаллического корня с окончанием -ic . Кислота, содержащая на один атом кислорода меньше, чем наиболее распространенная форма, обозначается окончанием из . Кислота, содержащая на один атом кислорода меньше, чем -содержащая кислота , имеет префикс -гипо- и окончание -содержащей . Кислота, содержащая на один кислород больше, чем наиболее распространенная кислота, имеет префикс per- и окончание -ic .
Азотная кислота — HNO3
Азотистая кислота — HNO2
Хлорноватистая кислота — HClO
Хлорноватистая кислота — HClO2
Хлорная кислота — HClO3
Хлорная кислота — HClO4
Серная кислота — h3SO4
Сернистая кислота — h3SO4
Сернистая кислота 90PO4
серная кислота 90PO3 Угольная кислота — h3CO3
Уксусная кислота — HC2h4O2
Щавелевая кислота — h3C2O4
Борная кислота — h4BO3
Кремниевая кислота — h3SiO3
Формулы общих оснований
Вот формулы для 11 распространенных оснований:
Гидроксид натрия — NaOH
Гидроксид калия — KOH
Гидроксид аммония — Nh5OH
Гидроксид кальция — Ca (OH) 2
Гидроксид магния — Mg (OH) 2
Гидроксид бария — Ba (OH) 2
Гидроксид алюминия — Al (OH) 3
Гидроксид железа или гидроксид железа (II) — Fe (OH) 2
Гидроксид железа или гидроксид железа (III) — Fe (OH) 3
Гидроксид цинка — Zn (OH) 2
Гидроксид лития — LiOH
3.6b: Названия кислот и оснований
Целью обучения этого модуля является определение и обозначение некоторых распространенных кислот и оснований.
Для наших целей в этом месте текста мы можем определить кислоту как вещество, по крайней мере, с одним атомом водорода, которое может диссоциировать с образованием аниона и иона H + (протона) в водном растворе, тем самым образуя кислый раствор. Мы можем определить основания как соединения, которые производят гидроксид-ионы (OH — ) и катион при растворении в воде, образуя, таким образом, щелочной раствор.Растворы, которые не являются ни щелочными, ни кислыми, являются нейтральными. Мы обсудим химию кислот и оснований более подробно позже, но в этом разделе мы опишем номенклатуру обычных кислот и определим некоторые важные основания, чтобы вы могли узнать их в будущих обсуждениях. Чистые кислоты и основания и их концентрированные водные растворы обычно встречаются в лаборатории. Обычно они очень едкие, поэтому с ними нужно обращаться осторожно.
Кислоты
Названия кислот различаются между (1) кислотами, в которых ион H + присоединен к атому кислорода многоатомного аниона (они называются оксокислотами, или иногда оксикислотами), и (2) кислотами, в которых ион H + Ион присоединен к какому-то другому элементу.В последнем случае название кислоты начинается с гидро- и заканчивается на -ic, с корнем названия другого элемента или иона между ними. Напомним, что название аниона, производного от этой кислоты, всегда оканчивается на -ид. Таким образом, газообразный хлористый водород (HCl) растворяется в воде с образованием соляной кислоты (которая содержит ионы H + и Cl —), газ цианистого водорода (HCN) образует синильную кислоту (которая содержит H + и CN —. ионы) и т. д. (Таблица 2.8). Примеры такого типа кислоты встречаются часто и очень важны. Например, ваш желудок содержит разбавленный раствор соляной кислоты, который помогает переваривать пищу. Когда механизмы, препятствующие перевариванию желудка, не работают, кислота разрушает слизистую оболочку желудка и образуется язва.
| Обратите внимание на узор |
|---|
|
Кислоты различаются по тому, присоединен ли ион H + к атому кислорода многоатомного аниона или к какому-либо другому элементу. |
Таблица 2.8 Некоторые распространенные кислоты, не содержащие кислород
| Формула | Название в водном растворе | Название газообразных видов |
|---|---|---|
| HF | плавиковая кислота | фтороводород |
| HCl | соляная кислота | хлористый водород |
| HBr | бромистоводородная кислота | водород бромистый |
| HI | иодистоводородная кислота | иодистый водород |
| HCN | синильная кислота | цианистый водород |
| H 2 S | Кислота сероводородная | сероводород |
Если кислота содержит один или несколько ионов H + , прикрепленных к кислороду, это производное одного из обычных оксоанионов, такого как сульфат (SO 4 2-) или нитрат (NO 3 — ).Эти кислоты содержат столько ионов H +, сколько необходимо для уравновешивания отрицательного заряда аниона, в результате чего образуются нейтральные частицы, такие как H 2 SO 4 и HNO 3 .
Названия кислот образованы от названий анионов в соответствии со следующими правилами:
- Если название аниона оканчивается на -ат, то название кислоты оканчивается на -ик. Например, поскольку NO 3 — — это нитрат-ион, HNO 3 — это азотная кислота.Точно так же ClO 4 — — это перхлорат-ион, поэтому HClO 4 — это хлорная кислота. Двумя важными кислотами являются серная кислота (H 2 SO 4 ) из сульфат-иона (SO 4 2-) и фосфорная кислота (H 3 PO 4 ) из фосфат-иона (PO ). 4 3−). Эти два названия используют небольшой вариант корня названия аниона: сульфат становится серным, а фосфат становится фосфорным.
- Если название аниона оканчивается на -ite, то название кислоты оканчивается на -ous.Например, OCl — — это ион гипохлорита, а HOCl — хлорноватистая кислота; NO 2 — — нитрит-ион, а HNO 2 — азотистая кислота; и SO 3 2- представляет собой сульфит-ион, а H 2 SO 3 представляет собой сернистую кислоту. Используются одни и те же корни независимо от того, заканчивается ли название кислоты на -ic или -ous; таким образом, сульфит становится сернистым.
Взаимосвязь между названиями оксокислот и исходных оксоанионов проиллюстрирована на рисунке 2.20, а некоторые распространенные оксокислоты представлены в таблице 2.9.
Рисунок 2.20 Связь между названиями оксокислот и названиями родительских оксоанионов
Таблица 2.9 Некоторые распространенные оксокислоты
| Формула | Имя |
|---|---|
| \ (HNO_2 \) | азотистая кислота |
| \ (HNO_3 \) | азотная кислота |
| \ (H_2SO_3 \) | сернистая кислота |
| \ (H_2SO_4 \) | серная кислота |
| \ (H_3PO_4 \) | фосфорная кислота |
| \ (H_2CO_3 \) | угольная кислота |
| \ (HClO \) | Кислота хлорноватистая |
| \ (HClO_2 \) | хлорноватистая кислота |
| \ (HClO_3 \) | хлорная кислота |
| \ (HClO_4 \) | хлорная кислота |
|
Пример 11 |
|---|
|
Назовите и дайте формулу каждой кислоты. а. кислота, образующаяся при добавлении протона к иону гипобромита (OBr — ) г. кислота, образованная добавлением двух протонов к селенат-иону (SeO 4 2-) Дано : анион Запрошено : исходная кислота Стратегия : См. Таблицу 2.8 «Некоторые распространенные кислоты, не содержащие кислород» и Таблицу 2.9 «Некоторые распространенные оксокислоты», чтобы найти название кислоты.Если кислоты нет в списке, воспользуйтесь приведенными ранее рекомендациями. Решение : Ни один из видов не указан в таблице 2.8 «Некоторые распространенные кислоты, не содержащие кислород» или в таблице 2.9 «Некоторые распространенные оксокислоты», поэтому мы должны использовать информацию, приведенную ранее, чтобы получить название кислоты из названия многоатомного аниона. а. Название аниона, гипобромит, оканчивается на -ит, поэтому название исходной кислоты оканчивается на -ит. Таким образом, кислота представляет собой гипобромистую кислоту (HOBr). г. Селенат оканчивается на -ate, поэтому название исходной кислоты заканчивается на -ic. Следовательно, кислота представляет собой селеновую кислоту (H 2 SeO 4 ). Упражнение Назовите и дайте формулу каждой кислоты. а. кислота, образованная добавлением протона к пербромат-иону (BrO 4 — ) г. кислота, образованная добавлением трех протонов к иону арсенита (AsO 3 3-) Ответ : а.надбромовая кислота; HBrO 4 г. мышьяковистая кислота; H 3 AsO 3 |
Многие органические соединения содержат карбонильную группу, в которой имеется двойная связь углерод-кислород. В карбоновых кислотах группа –ОН ковалентно связана с атомом углерода карбонильной группы. Их общая формула — RCO 2 H, иногда обозначаемая как RCOOH:
., где R может быть алкильной группой, арильной группой или атомом водорода.Простейшим примером HCO 2 H является муравьиная кислота, названная так потому, что она содержится в выделениях жалящих муравьев (от латинского formica, что означает «муравей»). Другой пример — уксусная кислота (CH 3 CO 2 H), которая содержится в уксусе. Как и многие кислоты, карбоновые кислоты имеют резкий запах. Например, масляная кислота (CH 3 CH 2 CH 2 CO 2 H) отвечает за запах прогорклого масла, а характерный запах кислого молока и рвоты возникает из-за молочной кислоты [CH 3 CH (OH) CO 2 H].Некоторые распространенные карбоновые кислоты показаны на рис. 2.21.
Рисунок 2.21 Некоторые общие карбоновые кислоты
Хотя карбоновые кислоты являются ковалентными соединениями, когда они растворяются в воде, они диссоциируют с образованием ионов H + (как и любая другая кислота) и ионов RCO 2 —. Обратите внимание, что только водород, присоединенный к атому кислорода группы CO 2 , диссоциирует с образованием иона H + . Напротив, атом водорода, присоединенный к атому кислорода спирта, не диссоциирует с образованием иона H + , когда спирт растворяется в воде.Причины разницы в поведении карбоновых кислот и спиртов будут обсуждаться в главе 8 «Ионная связь в сравнении с ковалентной связью».
Обратите внимание на узор
Только водород, присоединенный к атому кислорода группы CO 2 , диссоциирует с образованием иона H + .
Базы
Мы представим более исчерпывающие определения оснований в следующих главах, но фактически каждое основание, с которым вы столкнетесь, будет ионным соединением, таким как гидроксид натрия (NaOH) и гидроксид бария [Ba (OH) 2 ], которые содержат гидроксид-ион и катион металла.Они имеют общую формулу M (OH) n. Важно понимать, что спирты с общей формулой ROH являются ковалентными соединениями, а не ионными соединениями; следовательно, они не диссоциируют в воде с образованием основного раствора (содержащего ионы OH — ). Когда основание вступает в реакцию с любой из рассмотренных кислот, оно принимает протон (H + ). Например, гидроксид-ион (OH — ) принимает протон с образованием H 2 O. Таким образом, основания также называют акцепторами протонов.
Концентрированные водные растворы аммиака (NH 3 ) содержат значительные количества гидроксид-иона, хотя растворенное вещество не является в первую очередь гидроксидом аммония (NH 4 OH), как часто указывается на этикетке. Таким образом, водный раствор аммиака также является обычным основанием. Замена атома водорода Nh4 на алкильную группу приводит к амину (RNH 2 ), который также является основанием. Амины имеют резкий запах — например, метиламин (CH 3 NH 2 ) является одним из соединений, вызывающих неприятный запах, связанный с испорченной рыбой.На физиологическое значение аминов указывает слово «витамин», которое происходит от словосочетания «жизненно важные амины». Это слово было придумано для описания пищевых веществ, которые были эффективны при предотвращении цинги, рахита и других заболеваний, потому что эти вещества считались аминами. Впоследствии было подтверждено, что некоторые витамины являются аминами.
Обратите внимание на узор
Гидроксиды металлов (MOH) дают ионы OH — и являются основаниями, спирты (ROH) не образуют ионы OH — или H + и являются нейтральными, а карбоновые кислоты (RCO 2 H) дают H + ионов и кислоты.
Сводка
Обычные кислоты и производные от них многоатомные анионы имеют свои собственные названия и правила номенклатуры. Номенклатура кислот различает оксикислоты, в которых ион H + присоединен к атому кислорода многоатомного иона, и кислоты, в которых ион H + присоединен к другому элементу. Карбоновые кислоты — важный класс органических кислот. Аммиак является важным основанием, как и его органические производные амины.
Ключевые вынос
Обычные кислоты и производные от них многоатомные анионы имеют свои собственные названия и правила номенклатуры.
| Концептуальные проблемы |
|---|
|
1. Назовите каждую кислоту. а. HCl г. HBrO 3 г. HNO 3 г. H 2 SO 4 e. HIO 3 |
2. Назовите каждую кислоту.
а. HBr
г. H 2 SO 3
г.HClO 3
г. HCN
e. H 3 PO 4
3. Назовите водную кислоту, соответствующую каждому газу.
а. бромистый водород
г. цианистый водород
г. йодистый водород
4. Для каждой структурной формулы запишите сокращенную формулу и название соединения.
а.
г.
5.Для каждой структурной формулы напишите сокращенную формулу и название соединения.
а.
г.
6. Когда каждое соединение добавляется в воду, является ли полученный раствор кислотным, нейтральным или основным?
а. Канал 3 Канал 2 ОН
г. Мг (ОН) 2
г. C 6 H 5 CO 2 H
г. LiOH
e. C 3 H 7 CO 2 H
ф.H 2 SO 4
7. Изобразите структуру простейшего примера каждого типа соединения.
а. алкан
г. алкен
г. алкин
г. ароматический углеводород
e. алкоголь
ф. карбоновая кислота
г. амин
ч. циклоалкан
8. Определите класс органических соединений, представленных каждым соединением.
а.
г. Канал 3 Канал 2 ОН
г. HC≡CH
г.
e. C 3 H 7 NH 2
ф. CH 3 CH = CHCH 2 CH 3
г.
ч.
9. Определите класс органических соединений, представленных каждым соединением.
а.
г.
г.
г.
e.
ф. CH 3 CCH
г.
ч.
| Числовые задачи |
|---|
|
1. Напишите формулы для каждого соединения. а. хлорноватистая кислота г. пербромовая кислота г. бромистоводородная кислота г. сернистая кислота e. пербромат натрия |
2.Напишите формулу для каждого соединения.
а. йодистоводородная кислота
г. сероводород
с фосфорной кислотой
г. хлорная кислота
e. гипобромит кальция
3. Назовите каждое соединение.
а. HBr
г. H 2 SO 3
г. HCN
г. HClO 4
e. NaHSO 4
4.Назовите каждое соединение.
а. H 2 SO 4
г. HNO 2
г. К 2 HPO 4
г. H 3 PO 3
e. Ca (H 2 PO 4 ) 2 · H 2 O
Авторы и авторство
14.2: Кислоты: свойства и примеры
Цели обучения
- Изучить свойства кислот.
Многие люди любят пить кофе. Чашка с утра помогает начать день. Но содержать кофеварку в чистоте может быть проблемой. Через некоторое время накапливаются известковые отложения, которые замедляют процесс пивоварения. Лучшее лекарство от этого — налить в кастрюлю уксус (разбавленную уксусную кислоту) и пропустить его через цикл заваривания. Уксус растворяет отложения и очищает кофеварку, что ускоряет процесс пивоварения до исходной скорости. Только не забудьте пропустить воду в процессе заваривания после уксуса, иначе вы получите действительно ужасный кофе.
Кислоты
Кислоты очень часто встречаются в некоторых продуктах, которые мы едим. Цитрусовые, такие как апельсины и лимоны, содержат лимонную кислоту и аскорбиновую кислоту, более известную как витамин С. Газированные газированные напитки содержат фосфорную кислоту. Уксус содержит уксусную кислоту. Ваш собственный желудок использует соляную кислоту для переваривания пищи. Кислоты представляют собой отдельный класс соединений из-за свойств их водных растворов, как указано ниже:
- Водные растворы кислот являются электролитами, то есть проводят электрический ток.Некоторые кислоты являются сильными электролитами, потому что они полностью ионизируются в воде, давая большое количество ионов. Другие кислоты представляют собой слабые электролиты, которые существуют в основном в неионизированной форме при растворении в воде.
- Кислоты имеют кислый вкус. Лимоны, уксус и кислые конфеты содержат кислоты.
- Кислоты изменяют цвет определенных кислотно-щелочных индикаторов. Два общих индикатора — это лакмусовая бумажка и фенолфталеин. Синий лакмус становится красным в присутствии кислоты, а фенолфталеин становится бесцветным.
- Кислоты реагируют с активными металлами с образованием газообразного водорода. Напомним, что серия активности — это список металлов в порядке убывания их реакционной способности. Металлы, которые находятся выше водорода в ряду активности, будут заменять водород кислоты в реакции однократного замещения, как показано ниже:
\ [\ ce {Zn} \ left (s \ right) + \ ce {H_2SO_4} \ left (aq \ right) \ rightarrow \ ce {ZnSO_4} \ left (aq \ right) + \ ce {H_2} \ left (g \ right) \ label {eq1} \] - Реакция взаимодействия кислоты и основания с образованием соединения соли и воды.Когда равные моли кислоты и основания объединяются, кислота нейтрализуется основанием. Продуктами этой реакции являются ионное соединение, обозначенное как соль, и вода.
Вам не составит труда назвать несколько распространенных кислот (но вы можете обнаружить, что перечисление оснований немного сложнее). Ниже приведен частичный список некоторых распространенных кислот, а также некоторые химические формулы:
|
Имя химика |
Общее название | Использует |
|---|---|---|
|
соляная кислота, HCl |
соляная кислота (используется в бассейнах) и желудочная кислота — HCl | Используется при очистке (рафинировании) металлов, при обслуживании бассейнов и для уборки в домашних условиях. |
|
серная кислота, H 2 SO 4 |
Используется в автомобильных аккумуляторах и при производстве удобрений. | |
|
азотная кислота, HNO 3 |
Используется при производстве удобрений, взрывчатых веществ и при добыче золота. | |
|
уксусная кислота, HC 2 H 3 O 2 |
уксус | Основной ингредиент уксуса. |
|
угольная кислота, H 2 CO 3 |
отвечает за «шипение» в газированных напитках | В качестве ингредиента газированных напитков. |
|
лимонная кислота, C 6 H 8 O 7 |
Используется в продуктах питания и диетических добавках. Также добавляется в качестве подкислителя в кремы, гели, жидкости и лосьоны. | |
|
ацетилсалициловая кислота, C 6 H 4 (OCOCH 3 ) CO 2 H |
аспирин | Активный ингредиент аспирина. |
Что именно делает кислоту кислотой и что заставляет основание действовать как основание? Взгляните на формулы, приведенные в таблице выше, и сделайте предположение.
соляная кислота
Соляная кислота — это сильная коррозионная минеральная кислота, которая используется во многих промышленных целях.{-} (водн.)} \]
Соляная кислота поэтому может использоваться для получения хлоридных солей. Соляная кислота — сильная кислота, так как полностью диссоциирует в воде. Соляная кислота является предпочтительной кислотой при титровании для определения количества оснований.
Серная кислота
Серная кислота — это сильная коррозионная сильная минеральная кислота с молекулярной формулой \ (\ ce {h3SO4} \). Серная кислота является дипротоновой кислотой и имеет широкий спектр применения, включая использование в бытовых кислотных очистителях канализации, [ в качестве электролита в свинцово-кислотных аккумуляторах и в различных чистящих средствах.Это также центральное вещество в химической промышленности.
Рисунок \ (\ PageIndex {1} \): Капли концентрированной серной кислоты быстро разлагают кусок хлопкового полотенца путем обезвоживания. (CC BY-SA 3.0; Токсичный ходок).Поскольку гидратация серной кислоты термодинамически благоприятна (и сильно экзотермична), а ее сродство к воде достаточно велико, серная кислота является отличным дегидратирующим агентом. Концентрированная серная кислота обладает очень сильным обезвоживающим свойством, удаляя воду (\ (\ ce {h3O} \)) из других соединений, включая сахар и другие углеводы, и выделяя углерод, тепло и пар.Серная кислота ведет себя как обычная кислота в реакции с большинством металлов, выделяя газообразный водород (уравнение \ ref {Eq1}).
\ [\ ce {M + h3SO4 → M (SO4) + h3} \ label {Eq1} \]
Азотная кислота
Азотная кислота (\ (\ ce {HNO3} \)) — это очень коррозионная минеральная кислота, которая также широко используется в качестве сильного окислителя. Азотная кислота обычно считается сильной кислотой при температуре окружающей среды. Азотную кислоту можно получить путем реакции диоксида азота (\ (\ ce {NO_2 (g)} \)) с водой.
\ [\ ce {3 NO2 (г) + h3O (l) → 2 HNO3 (ag) + NO (г)} \]
Азотная кислота реагирует с большинством металлов, но детали зависят от концентрации кислоты и природы металла. Разбавленная азотная кислота ведет себя как обычная кислота в реакции с большинством металлов (например, азотная кислота с магнием, марганцем или цинком выделяет газ \ (\ ce {h3} \)):
\ [\ ce {Mg + 2 HNO3 → Mg (NO3) 2 + h3} \]
\ [\ ce {Mn + 2 HNO3 → Mn (NO3) 2 + h3} \]
\ [\ ce {Zn + 2 HNO3 → Zn (NO3) 2 + h3} \]
Азотная кислота — это едкая кислота и мощный окислитель.Основная опасность, которую он представляет, — это химический ожог, так как он осуществляет кислотный гидролиз с белками (амидом) и жирами (сложным эфиром), что, следовательно, разлагает живую ткань (Рисунок \ (\ PageIndex {2} \)). Концентрированная азотная кислота окрашивает кожу человека в желтый цвет из-за реакции с кератином
. Рисунок \ (\ PageIndex {2} \): ожог второй степени, вызванный азотной кислотой. (CC BY-SA 3.0; Алькаман).Угольная кислота
Угольная кислота представляет собой химическое соединение с химической формулой \ (\ ce {h3CO3} \), а также иногда называют растворы углекислого газа в воде (газированная вода), потому что такие растворы содержат небольшие количества \ (\ ce {h3CO3 (водн.)} \).Угольная кислота, которая является слабой кислотой, образует два вида солей: карбонаты и бикарбонаты. В геологии углекислота вызывает растворение известняка с образованием бикарбоната кальция, что приводит к образованию многих особенностей известняка, таких как сталактиты и сталагмиты. Угольная кислота представляет собой полипротонную кислоту, в частности, она дипротонна, что означает, что она имеет два протона, которые могут диссоциировать от исходной молекулы.
Когда диоксид углерода растворяется в воде, он находится в химическом равновесии (обсуждается в главе 15), образуя угольную кислоту:
\ [\ ce {CO2 + h3O <=> h3CO3} \]
Реакцию можно подтолкнуть к тому, чтобы реагенты генерировали \ (\ ce {CO2 (g)} \) из раствора, что является ключом к пузырькам, наблюдаемым в газированных напитках (рисунок \ (\ PageIndex {3} \)).
Рисунок \ (\ PageIndex {3} \): стакан газированной воды. (CC BY-SA 3.0; Невит Дильмен).Муравьиная кислота
Муравьиная кислота (\ (\ ce {HCO2H} \)) представляет собой простейшую карбоновую кислоту и является важным промежуточным продуктом в химическом синтезе и встречается в природе, особенно у некоторых муравьев. Слово «муравейник» происходит от латинского слова «муравей», formica, что указывает на его раннее выделение путем перегонки муравьиных тел. Муравьиная кислота широко встречается в природе в виде конъюгированного с ней формиата основания.
Лимонная кислота
Лимонная кислота (\ (\ ce {C6H8O7} \)) — слабая органическая трикарбоновая кислота, которая в природе встречается в цитрусовых.Цитрат-ион является промежуточным звеном в цикле TCA (цикл Кребса), центральном метаболическом пути для животных, растений и бактерий. Поскольку это одна из наиболее сильных пищевых кислот, лимонная кислота чаще всего используется в качестве ароматизатора и консерванта в продуктах питания и напитках, особенно в безалкогольных напитках.
Рисунок \ (\ PageIndex {4} \): лимоны, апельсины, лаймы и другие цитрусовые содержат высокую концентрацию лимонной кислоты (CC BY-SA 2.5; Андре Карват).Ацетилсалициловая кислота
Ацетилсалициловая кислота (также известная как аспирин) — это лекарство, используемое для лечения боли, лихорадки и воспалений.Аспирин в виде листьев ивы использовался для улучшения здоровья уже не менее 2400 лет.
Рисунок \ (\ PageIndex {5} \): шариковая модель молекулы аспирина. (Общественное достояние; Бен Миллс).Аспирин — белое кристаллическое слабокислотное вещество.
Сводка
Был дан краткий обзор ключевых аспектов некоторых кислот, с которыми обычно сталкиваются студенты. Кислоты представляют собой особый класс соединений из-за свойств их водных растворов.
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или всесторонне) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
кислотно-основная реакция | Определение, примеры, формулы и факты
Кислотно-основная реакция , тип химического процесса, типичным примером которого является обмен одного или нескольких ионов водорода, H + , между частицами, которые могут быть нейтральными (молекулы, такие как вода , H 2 O; или уксусная кислота, CH 3 CO 2 H) или электрически заряженные (ионы, такие как аммоний, NH 4 + ; гидроксид, OH —; или карбонат, CO 3 2−).Он также включает аналогичное поведение молекул и ионов, которые являются кислотными, но не отдают ионы водорода (хлорид алюминия, AlCl 3 и ион серебра AG + ).
сульфат натрияСульфат натрия, также называемый глауберовской солью, является, как и другие соли, продуктом кислотно-щелочной реакции.
Martin WalkerПопулярные вопросы
Что такое кислоты и основания?
Кислоты — это вещества, содержащие один или несколько атомов водорода, которые в растворе выделяются в виде положительно заряженных ионов водорода.Кислота в водном растворе имеет кислый вкус, меняет цвет голубой лакмусовой бумаги на красный, вступает в реакцию с некоторыми металлами (например, с железом) с выделением водорода, реагирует с основаниями с образованием солей и способствует определенным химическим реакциям (кислотный катализ). Основания — вещества, которые имеют горький вкус и меняют цвет красной лакмусовой бумаги на синий. Основания реагируют с кислотами с образованием солей и способствуют определенным химическим реакциям (щелочной катализ).
Как измеряются кислоты и основания?
Кислотам и основаниям присваивается значение от 0 до 14, значение pH, в зависимости от их относительной силы.Чистая вода, которая является нейтральной, имеет pH 7. Раствор с pH менее 7 считается кислым, а раствор с pH более 7 считается щелочным или щелочным. Сильные кислоты имеют более высокую концентрацию ионов водорода, и им присваиваются значения, близкие к 0. И наоборот, сильные основания имеют более высокие концентрации гидроксид-ионов, и им присваиваются значения, близкие к 14. Более слабые кислоты и основания ближе к значению pH 7, чем их более сильные собратья.
Что происходит во время кислотно-щелочной реакции?
Кислотно-основная реакция — это тип химической реакции, которая включает обмен одним или несколькими ионами водорода, H + , между частицами, которые могут быть нейтральными (молекулы, такие как вода, H 2 O) или электрически. заряженные (ионы, такие как аммоний, NH 4 + ; гидроксид, OH —; или карбонат, CO 3 2-).Он также включает аналогичные процессы, которые происходят в молекулах и ионах, которые являются кислотными, но не отдают ионы водорода.
Как кислоты и основания нейтрализуют друг друга (или нейтрализуют друг друга)?
Различные реакции дают разные результаты. Реакции между сильными кислотами и сильными основаниями более полно разлагаются на ионы водорода (протоны, положительно заряженные ионы) и анионы (отрицательно заряженные ионы) в воде. Для слабой кислоты и слабого основания нейтрализация более подходящим образом включает прямой перенос протонов от кислоты к основанию.Если один из реагентов присутствует в большом избытке, реакция может привести к образованию соли (или ее раствора), которая может быть кислой, основной или нейтральной в зависимости от силы кислот и оснований, взаимодействующих друг с другом.
Кислоты — это химические соединения, которые в водном растворе проявляют резкий вкус, разъедающее действие на металлы и способность окрашивать некоторые синие растительные красители в красный цвет. Основания — это химические соединения, которые в растворе становятся мыльными на ощупь и окрашивают красные растительные красители в синий цвет. При смешивании кислоты и основания нейтрализуют друг друга и образуют соли, вещества с солоноватым вкусом, не обладающие характерными свойствами ни кислот, ни оснований.
Идея о том, что одни вещества являются кислотами, а другие — основаниями, почти так же стара, как и химия, и термины кислота , основание и соль встречаются очень рано в трудах средневековых алхимиков. Кислоты, вероятно, были первыми из них, которые были распознаны, по-видимому, из-за их кислого вкуса. Английское слово acid , французское acide , немецкое Säure и русское kislota образованы от слов, означающих кислый (лат. acidus , немецкий sauer , древнескандинавский sūur и Русский кислый ).К другим свойствам, которые в свое время связывали кислоты, относились их растворяющее или коррозионное действие; их действие на растительные красители; и вспенивание, возникающее при нанесении их на мел (образование пузырьков углекислого газа). Основания (или щелочи) характеризовались, главным образом, их способностью нейтрализовать кислоты и образовывать соли, причем последние довольно слабо характеризовались как кристаллические вещества, растворимые в воде и имеющие соленый вкус.
Несмотря на их неточный характер, эти идеи служили для корреляции значительного диапазона качественных наблюдений, и многие из самых обычных химических материалов, с которыми сталкивались ранние химики, можно было классифицировать как кислоты (соляная, серная, азотная и угольная кислоты), основания (сода, поташ, известь, нашатырный спирт) или соли (поваренная соль, нашатырный спирт, селитра, квасцы, бура).Отсутствие какой-либо очевидной физической основы для рассматриваемого явления затрудняло количественный прогресс в понимании кислотно-основного поведения, но способность фиксированного количества кислоты нейтрализовать фиксированное количество основания была одним из первых примеров химической эквивалентности. : идея о том, что определенная мера одного вещества в некотором химическом смысле равна разному количеству второго вещества. Кроме того, довольно рано было обнаружено, что одну кислоту можно заменить из соли другой кислотой, и это позволило расположить кислоты в приблизительном порядке силы.Вскоре также стало ясно, что многие из этих смещений могут происходить в любом направлении в соответствии с экспериментальными условиями. Это явление свидетельствует о том, что кислотно-основные реакции обратимы, то есть продукты реакции могут взаимодействовать для регенерации исходного материала. Он также ввел концепцию равновесия в кислотно-щелочную химию: эта концепция гласит, что обратимые химические реакции достигают точки баланса или равновесия, в которой исходные материалы и продукты регенерируются каждой из двух реакций так же быстро, как и они. потребляются другим.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасПомимо теоретического интереса, кислоты и основания играют большую роль в промышленной химии и в повседневной жизни. Серная кислота и гидроксид натрия входят в число продуктов, производимых в наибольших количествах химической промышленностью, и большой процент химических процессов включает кислоты или основания в качестве реагентов или катализаторов. Почти каждый биологический химический процесс тесно связан с кислотно-щелочным равновесием в клетке или в организме в целом, и кислотность или щелочность почвы и воды имеют большое значение для растений или животных, живущих в них.И идеи, и терминология кислотно-щелочной химии пронизывают повседневную жизнь, и термин соль особенно распространен.
Кислоты
3.5 Кислоты
Цели обучения
- Определить кислота .
- Назовите простую кислоту.
Есть еще одна важная для нас группа соединений — кислоты — и эти соединения обладают интересными химическими свойствами. Сначала мы определим кислотное ионное соединение катиона H +, растворенное в воде.в виде ионного соединения катиона H + , растворенного в воде. (Мы расширим это определение в главе 12 «Кислоты и основания».) Чтобы указать, что что-то растворено в воде, мы будем использовать метку фазы (aq) рядом с химической формулой (где aq означает «водный», a слово, описывающее что-то растворенное в воде). Если в формуле нет этой метки, то соединение рассматривается как молекулярное соединение, а не как кислота.
Кислоты имеют собственную систему номенклатуры.Если кислота состоит только из водорода и еще одного элемента, ее имя будет гидро- + основа другого элемента + -ная кислота . Например, соединение HCl (водн.) Представляет собой соляную кислоту, а H 2 S (водн.) Представляет собой сероводородную кислоту. (Если бы эти кислоты не были растворены в воде, эти соединения были бы названы хлористым водородом и сероводородом соответственно. Оба эти вещества хорошо известны как молекулярные соединения; однако при растворении в воде они рассматриваются как кислоты.)
Если соединение состоит из ионов водорода и многоатомного аниона, то название кислоты происходит от основы названия многоатомного иона. Обычно, если название аниона оканчивается на -ат, название кислоты представляет собой основу названия аниона плюс -иновая кислота ; если название связанного аниона оканчивается на -ite, название соответствующей кислоты является основой названия аниона плюс -лярная кислота . В Таблице 3.9 «Названия и формулы кислот» перечислены формулы и названия различных кислот, с которыми вам следует знать.Вы должны узнать большинство анионов в формулах кислот.
Таблица 3.9 Названия и формулы кислот
| Формула | Имя |
|---|---|
| HC 2 H 3 O 2 | кислота уксусная |
| HClO 3 | хлорная кислота |
| HCl | соляная кислота |
| HBr | бромистоводородная кислота |
| HI | иодоводородная кислота |
| HF | плавиковая кислота |
| HNO 3 | азотная кислота |
| H 2 C 2 O 4 | щавелевая кислота |
| HClO 4 | хлорная кислота |
| H 3 PO 4 | фосфорная кислота |
| H 2 SO 4 | серная кислота |
| H 2 SO 3 | сернистая кислота |
| Примечание. Метка «aq» опущена для ясности. | |
Пример 10
Назовите каждую кислоту без консультации с таблицей 3.9 «Названия и формулы кислот».
- HBr
- H 2 SO 4
Решение
- Как бинарная кислота, название кислоты — гидро- + название основы + -овая кислота . Поскольку эта кислота содержит атом брома, она называется бромистоводородной кислотой.
- Поскольку эта кислота является производным сульфат-иона, название кислоты является основой названия аниона + -овая кислота . Название этой кислоты — серная кислота.
Проверьте себя
Назовите каждую кислоту.
- ВЧ
- HNO 2
Ответы
- фтористоводородная кислота
- азотистая кислота
Все кислоты обладают схожими свойствами.Например, кислоты имеют кислый вкус; Фактически, кислый вкус некоторых наших продуктов, таких как цитрусовые и уксус, вызван присутствием кислот в пище. Многие кислоты реагируют с некоторыми металлическими элементами с образованием ионов металлов и элементарного водорода. Кислоты заставляют определенные растительные пигменты менять цвет; действительно, созревание некоторых фруктов и овощей происходит из-за образования или разрушения избытка кислоты в растении. В главе 12 «Кислоты и основания» мы исследуем химическое поведение кислот.
Кислоты очень распространены в окружающем нас мире. Мы уже упоминали, что цитрусовые содержат кислоту; среди других соединений они содержат лимонную кислоту, H 3 C 6 H 5 O 7 (водн.). Щавелевая кислота, H 2 C 2 O 4 (водн.), Содержится в шпинате и других зеленолистных овощах. Соляная кислота не только содержится в желудке (желудочная кислота), но также может быть куплена в строительных магазинах в качестве очистителя для бетона и кирпичной кладки.Фосфорная кислота входит в состав некоторых безалкогольных напитков.
Основные выводы
- Кислота — это соединение иона H + , растворенное в воде.
- Acids имеют свою собственную систему наименований.
- Кислоты обладают определенными химическими свойствами, которые отличают их от других соединений.
Упражнения
-
Приведите формулу каждой кислоты.
- хлорная кислота
- иодоводородная кислота
-
Приведите формулу каждой кислоты.
- Кислота сероводородная
- фосфорная кислота
-
Назовите каждую кислоту.
- ВЧ (водн.)
- HNO 3 (водн.)
- H 2 C 2 O 4 (водн.)
-
Назовите каждую кислоту.
- H 2 SO 4 (водн.)
- H 3 PO 4 (водн.)
- HCl (водн.)
-
Назовите кислоту, содержащуюся в пище.
-
Назовите некоторые общие свойства кислот.
ответы
-
- плавиковая кислота
- азотная кислота
- щавелевая кислота
-
щавелевая кислота (ответы могут быть разными)


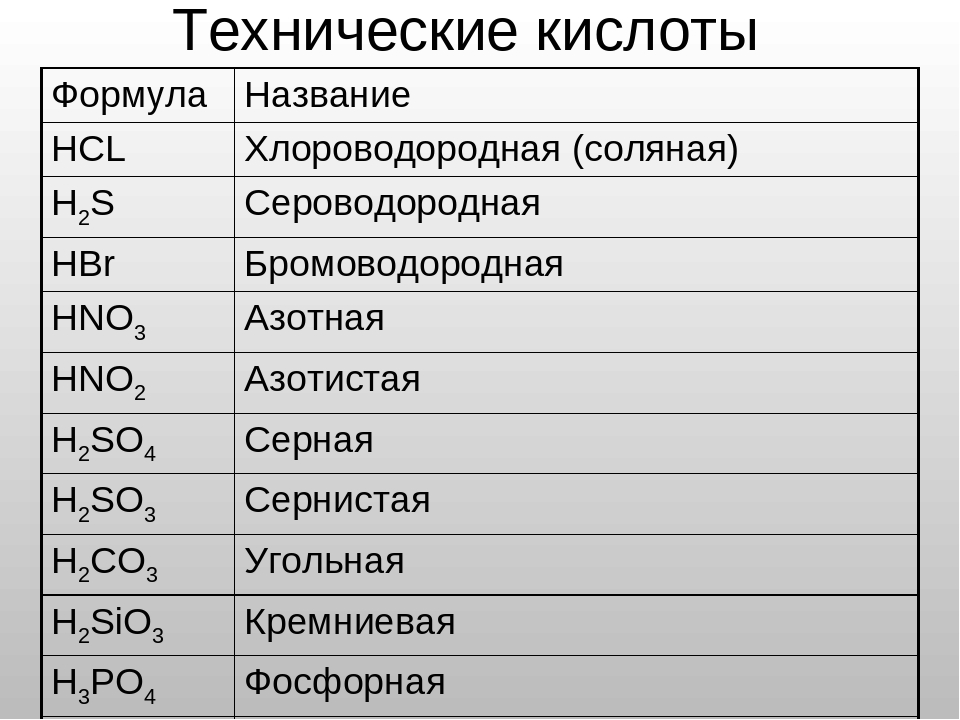 , серебристого цвета
, серебристого цвета Кислотный оксид + вода = кислота
Кислотный оксид + вода = кислота  К щелочам относят гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2. Остальные — нерастворимые.
К щелочам относят гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2. Остальные — нерастворимые. ОКСИД МЕТАЛЛА + H2O = ЩЁЛОЧЬ
ОКСИД МЕТАЛЛА + H2O = ЩЁЛОЧЬ