КАТАЛИЗ — это… Что такое КАТАЛИЗ?
Существенно, что третичные карбений-ионы более стабильны, чем первичные или вторичные. Вследствие этого на поверхности катализатора присутствуют в основном именно они, а потому основным продуктом изомеризации бутана является изобутан. Кислотные катализаторы широко применяются при переработке нефти — крекинге, алкилировании, полимеризации и изомеризации углеводородов
(см. также
).
Установлен механизм действия карбений-ионов, играющих роль катализаторов в этих процессах. При этом они участвуют в целом ряде реакций, включая образование малых молекул путем расщепления больших, соединение молекул (олефина с олефином или олефина с изопарафином), структурную перегруппировку путем изомеризации, образование парафинов и ароматических углеводородов путем переноса водорода. Одно из последних применений кислотного катализа в промышленности — получение этилированных топлив присоединением спиртов к изобутилену или изоамилену. Добавление кислородсодержащих соединений в бензин уменьшает концентрацию оксида углерода в выхлопных газах. Метил-трет-бутиловый эфир (МТБЭ) с октановым числом смешения 109 тоже позволяет получить высокооктановое топливо, необходимое для работы автомобильного двигателя с высокой степенью сжатия, не прибегая к введению в бензин тетраэтилсвинца. Организовано также производство топлив с октановыми числами 102 и 111.
Активность катализаторов обусловливается их основными свойствами. Давним и хорошо известным примером таких катализаторов является гидроксид натрия, применяющийся для гидролиза или омыления жиров при получении мыла, а один из последних примеров — катализаторы, используемые при производстве полиуретановых пластиков и пенопластов. Уретан образуется при взаимодействии спирта с изоцианатом, а ускоряется эта реакция в присутствии оснвных аминов. В ходе реакции происходит присоединение основания к атому углерода в молекуле изоцианата, в результате чего на атоме азота появляется отрицательный заряд и его активность по отношению к спирту повышается. Особенно эффективным катализатором является триэтилендиамин. Полиуретановые пластики получают при взаимодействии диизоцианатов с полиолами (полиспиртами). Когда изоцианат реагирует с водой, ранее образовавшийся уретан разлагается с выделением CO2. При взаимодействии смеси полиспиртов и воды с диизоцианатами образующийся пенополиуретан вспенивается газообразным CO2.
Эти катализаторы ускоряют реакции двух типов и дают лучшие результаты, чем при пропускании реагентов последовательно через два реактора, каждый из которых содержит только один тип катализатора. Это связано с тем, что активные центры катализатора двойного действия находятся очень близко друг к другу, и промежуточный продукт, образующийся на одном из них, тут же превращается в конечный продукт на другом. Хороший результат дает объединение катализатора, активирующего водород, с катализатором, способствующим изомеризации углеводородов. Активацию водорода осуществляют некоторые металлы, а изомеризацию углеводородов — кислоты. Эффективным катализатором двойного действия, который применяется при переработке нефти для превращения нафты в бензин, является мелкодисперсная платина, нанесенная на кислый глинозем. Конверсия таких составляющих нафты, как метилциклопентан (МЦП), в бензол повышает октановое число бензина. Сначала МЦП дегидрируется на платиновой части катализатора в олефин с тем же углеродным остовом; затем олефин переходит на кислотную часть катализатора, где изомеризуется до циклогексена. Последний переходит на платиновую часть и дегидрируется до бензола и водорода. Катализаторы двойного действия существенно ускоряют риформинг нефти. Их используют для изомеризации нормальных парафинов в изопарафины. Последние, кипящие при тех же температурах, что и бензиновые фракции, ценны тем, что обладают более высоким октановым числом по сравнению с неразветвленными углеводородами. Кроме того, превращение н-бутана в изобутан сопровождается дегидрированием, способствуя получению МТБЭ.
Важной вехой в истории катализа явилось открытие каталитической полимеризации a-олефинов с образованием стереорегулярных полимеров. Катализаторы стереоспецифической полимеризации были открыты К.Циглером, когда он пытался объяснить необычные свойства полученных им полимеров. Другой химик, Дж.Натта, предположил, что уникальность полимеров Циглера определяется их стереорегулярностью. Эксперименты по дифракции рентгеновских лучей показали, что полимеры, полученные из пропилена в присутствии катализаторов Циглера, высококристалличны и действительно имеют стереорегулярную структуру. Для описания таких упорядоченных структур Натта ввел термины «изотактический» и «синдиотактический». В том случае, когда упорядоченность отсутствует, используется термин «атактический»:
Стереоспецифическая реакция протекает на поверхности твердых катализаторов, содержащих переходные металлы групп IVA-VIII (такие, как Ti, V, Cr, Zr), находящиеся в неполностью окисленном состоянии, и какое-либо соединение, содержащее углерод или водород, который связан с металлом из групп I-III. Классическим примером такого катализатора является осадок, образующийся при взаимодействии TiCl4 и Al(C2H5)3 в гептане, где титан восстановлен до трехвалентного состояния. Эта исключительно активная система катализирует полимеризацию пропилена при обычных температуре и давлении.
Катализаторы гетерогенного окисления. Эти катализаторы обычно являются сложными твердыми оксидами. Каталитическое окисление проходит в два этапа. Сначала кислород оксида захватывается адсорбированной на поверхности оксида молекулой углеводорода. Углеводород при этом окисляется, а оксид восстанавливается. Восстановленный оксид взаимодействует с кислородом и возвращается в исходное состояние. Используя ванадиевый катализатор, неполным окислением нафталина или бутана получают фталевый ангидрид.
Получение этилена путем дегидродимеризации метана. Синтез этилена посредством дегидродимеризации позволяет превращать природный газ в более легко транспортируемые углеводороды. Реакцию 2Ch5 + 2O2 -> C2h5 + 2h3O проводят при 850° С с использованием различных катализаторов; наилучшие результаты получены с катализатором Li-MgO. Предположительно реакция протекает через образование метильного радикала путем отщепления атома водорода от молекулы метана. Отщепление осуществляется неполностью восстановленным кислородом, например О22-. Метильные радикалы в газовой фазе рекомбинируют с образованием молекулы этана и в ходе последующего дегидрирования превращаются в этилен. Еще один пример неполного окисления — превращение метанола в формальдегид в присутствии серебряного или железомолибденового катализатора.
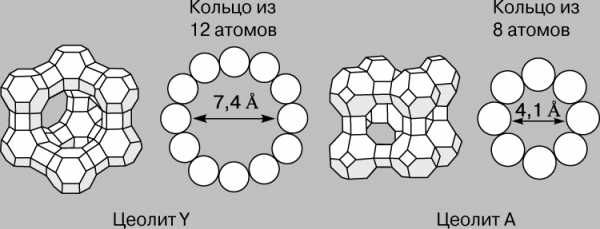
Рис. 2. СТРУКТУРА ЦЕОЛИТОВ с большими и малыми порами.

Рис. 3. ЦЕОЛИТ ZSM-5. Схематическое представление структуры в виде пересекающихся трубок.
Катализаторы, составляющие группу Y-цеолитов, существенно повышают эффективность каталитического крекинга благодаря в первую очередь своим необычным кислотным свойствам. Замена алюмосиликатов цеолитами позволяет увеличить выход бензина более чем на 20%. Кроме того, цеолиты обладают селективностью в отношении размера реагирующих молекул. Их селективность обусловлена размером пор, через которые могут проходить молекулы лишь определенных размеров и формы. Это касается как исходных веществ, так и продуктов реакции. Например, вследствие стерических ограничений пара-ксилол образуется легче, чем более объемные орто- и мета-изомеры. Последние оказываются «запертыми» в порах цеолита (рис. 4).
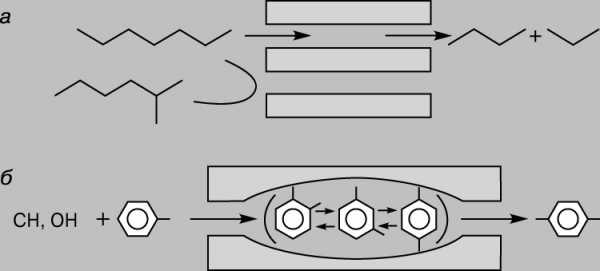
Рис. 4. СХЕМА, объясняющая селективность цеолитов в отношении реагентов (а) и продуктов (б).
Применение цеолитов произвело настоящую революцию в некоторых промышленных технологиях — депарафинизации газойля и машинного масла, получении химических полупродуктов для производства пластмасс алкилированием ароматических соединений, изомеризации ксилола, диспропорционировании толуола и каталитическом крекинге нефти. Особенно эффективен здесь цеолит ZSM-5.
Катализаторы и охрана окружающей среды. Применение катализаторов для уменьшения загрязнения воздуха началось в конце 1940-х годов. В 1952 А. Хаген-Смит установил, что углеводороды и оксиды азота, входящие в состав выхлопных газов, реагируют на свету с образованием оксидантов (в частности, озона), которые оказывают раздражающее действие на глаза и дают другие нежелательные эффекты. Примерно в это же время Ю.Хоудри разработал способ каталитической очистки выхлопных газов путем окисления CO и углеводородов до CO2 и Н2О. В 1970 была сформулирована Декларация о чистом воздухе (уточненная в 1977, расширенная в 1990), согласно которой все новые автомобили, начиная с моделей 1975, должны снабжаться каталитическими нейтрализаторами выхлопных газов. Были установлены нормы для состава выхлопных газов. Поскольку соединения свинца, добавляемые в бензин, отравляют катализаторы, принята программа поэтапного отказа от них. Обращалось внимание и на необходимость снижения содержания оксидов азота. Специально для автомобильных нейтрализаторов созданы катализаторы, в которых активные компоненты нанесены на керамическую подложку с сотовой структурой, через ячейки которой проходят выхлопные газы. Подложку покрывают тонким слоем оксида металла, например Al2O3, на который наносят катализатор — платину, палладий или родий. Содержание оксидов азота, образующихся при сжигании природных топлив на теплоэлектростанциях, можно уменьшить добавлением в дымовые газы малых количеств аммиака и пропусканием их через титанованадиевый катализатор.
ТЕХНОЛОГИЧЕСКИЕ АСПЕКТЫ
Современные технологии невозможно представить без применения катализаторов. Каталитические реакции могут протекать при температурах до 650° С и давлениях 100 атм и более. Это заставляет по-новому решать проблемы, связанные с контактированием между газообразными и твердыми веществами и с переносом частиц катализатора. Чтобы процесс был эффективным, при его моделировании необходимо учитывать кинетические, термодинамические и гидродинамические аспекты. Здесь широко используются компьютерное моделирование, а также новые приборы и методы контроля за технологическими процессами. В 1960 был достигнут значительный прогресс в производстве аммиака. Применение более активного катализатора позволило понизить температуру получения водорода при разложении водяного пара, благодаря чему удалось понизить давление и, следовательно, уменьшить производственные затраты, например за счет применения более дешевых центробежных компрессоров. В результате стоимость аммиака упала более чем вдвое, произошло колоссальное увеличение его производства, а в связи с этим — увеличение производства пищевых продуктов, поскольку аммиак — ценное удобрение.
Методы. Исследования в области катализа проводят с использованием как традиционных, так и специальных методов. Применяются радиоактивные метки, рентгеновская, инфракрасная и рамановская (КР) спектроскопия, электронно-микроскопические методы; проводятся кинетические измерения, изучается влияние способов получения катализаторов на их активность. Большое значение имеет определение площади поверхности катализатора по методу Брунауэра — Эммета — Теллера (метод БЭТ), основанному на измерении физической адсорбции азота при разных давлениях. Для этого определяют количество азота, необходимого для образования монослоя на поверхности катализатора, и, зная диаметр молекулы N2, вычисляют суммарную площадь. Помимо определения общей площади поверхности проводят хемосорбцию разных молекул, что позволяет оценить число активных центров и получить информацию об их свойствах. В распоряжении исследователей имеются разные методы изучения структуры поверхности катализаторов на атомном уровне. Уникальную информацию позволяет получить метод EXAFS. Среди спектроскопических методов все шире применяются УФ-, рентгеновская и оже-фотоэлектронная спектроскопия. Большой интерес представляет масс-спектрометрия вторичных ионов и спектроскопия ионного рассеяния. Для исследования природы каталитических комплексов применяются измерения ЯМР. Сканирующий туннельный микроскоп позволяет увидеть расположение атомов на поверхности катализатора.
ПЕРСПЕКТИВЫ
Масштабы каталитических процессов в промышленности увеличиваются с каждым годом. Все более широкое применение находят катализаторы для нейтрализации веществ, загрязняющих окружающую среду. Возрастает роль катализаторов в производстве углеводородов и кислородсодержащих синтетических топлив из газа и угля. Весьма перспективным представляется создание топливных элементов для экономичного преобразования энергии топлива в электрическую энергию. Новые концепции катализа позволят получать полимерные материалы и другие продукты, обладающие многими ценными свойствами, усовершенствовать методы получения энергии, увеличить производство пищевых продуктов, в частности путем синтеза белков из алканов и аммиака с помощью микроорганизмов. Возможно, удастся разработать генно-инженерные способы получения ферментов и металлоорганических соединений, приближающихся по своей каталитической активности и селективности к природным биологическим катализаторам.
ЛИТЕРАТУРА
Гейтс Б.К. Химия каталитических процессов. М., 1981 Боресков Г.К. Катализ. Вопросы теории и практики. Новосибирск, 1987 Ганкин В.Ю., Ганкин Ю.В. Новая общая теория катализа. Л., 1991 Токабе К. Катализаторы и каталитические процессы. М., 1993
Энциклопедия Кольера. — Открытое общество. 2000.
dic.academic.ru
Катализ и катализаторы — Энциклопедия wiki.MPlast.by
Катализ – это процесс изменения скорости химической реакции при помощи катализаторов – веществ, принимающих участие в химической реакции, но в состав конечных продуктов не входящих и в результате реакции не расходующихся.
Одни катализаторы ускоряют реакцию (положительный катализ), другие – замедляют (отрицательный катализ). Отрицательный катализ называют ингибированием, а катализаторы, понижающие скорость химической реакции – ингибиторами.
Различают гомогенный и гетерогенный катализ.
Гомогенный катализ.
При гомогенном (однородном) катализе реагирующие вещества и катализатор находятся в одинаковом агрегатном состоянии и между ними отсутствует поверхность раздела. Пример гомогенного катализа – реакция окисления SO2 и SO3 в присутствии катализатора NO (реагирующие вещества и катализатор являются газами).
Гетерогенный катализ.
В случае гетерогенного (неоднородного) катализа реагирующие вещества и катализатор находятся в различных агрегатных состояниях и между ними существует поверхность (граница) раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы. Пример гетерогенного катализа – окисление NN3 до NO в присутствии Pt (катализатор – твердое вещество).
Механизм действия катализаторов
Действие положительных катализаторов сводится к понижению энергии активации реакции Еа(исх), действие ингибиторов – противоположное.
Так, для реакции 2HI = H2+I2 Еа(исх)=184 кДж/моль. Когда же эта реакция протекает в присутствии катализатора Au или Pt, то Еа(исх)=104 кДж/моль, соответственно.
Механизм действия катализатора при гомогенном катализе объясняется образованием промежуточных соединений между катализатором и одним из реагирующих веществ. Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него.
Например, реакция:
SO2 +1/2 O2 = SO3 протекает очень медленно, а если использовать катализатор NO
то реакции NO +1/2О2 = NO2 и NO2 +SO2 = SO3 +NO протекают быстро.
Механизм действия катализатора при гетерогенном катализе иной. В этом случае реакция протекает вследствие адсорбции молекул реагирующих веществ поверхностью катализатора (поверхность катализатора неоднородна: на ней имеются так называемые активные центры, на которых и адсорбируются частицы реагирующих веществ.). Увеличение скорости химической реакции достигается, в основном, за счет понижения энергии активации адсорбированных молекул, а также, отчасти, за счет увеличения концентрации реагирующих веществ в местах, где произошла адсорбция.
Каталитические яды и промоторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора, такие вещества называют каталитическими ядами. Например, небольшие примеси серы (0,1%) полностью прекращает каталитическое действие металлического катализатора (губчатого железа), использующегося при синтезе аммиака. Вещества, повышающие активность катализатора, называют промоторами. Например, каталитическая активность губчатого железа значительно возрастает при добавлении примерно 2% метаалюмината калия KAlO2.
Применение катализаторов
Действие катализатора избирательно и специфично. Это означает, что, применяя различные катализаторы, из одних и тех же веществ можно получить различные продукты. Это особенно характерно для реакций органических веществ. Например, в присутствии катализатора AlO3 происходит дегидратация этилового спирта, в присутствии Cu – дегидрирование:
Биологические катализаторы, принимающие участие в сложных химических превращениях, протекающих в организме, называются ферментами.
Катализаторы широко используются в производстве серной кислоты, аммиака, каучука, пластмасс и др. веществ.
Автор: Метельский А.В
Источник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 год
Дата в источнике: 1999 год
mplast.by
Катализ — это… Что такое Катализ?
Ката́лиз (греч. κατάλυσις восходит к καταλύειν — разрушение) — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.[1]
Термин «катализ» был введён в 1835 году шведским учёным Йёнсом Якобом Берцелиусом.
Явление катализа распространено в природе (большинство процессов, происходящих в живых организмах, являются каталитическими) и широко используется в технике (в нефтепереработке и нефтехимии, в производстве серной кислоты, аммиака, азотной кислоты и др.). Большая часть всех промышленных реакций — каталитические.
Основные принципы катализа
Катализатор изменяет механизм реакции на энергетически более выгодный, то есть снижает энергию активации. Катализатор образует с молекулой одного из реагентов промежуточное соединение, в котором ослаблены химические связи. Это облегчает его реакцию со вторым реагентом. Важно отметить, что катализаторы ускоряют обратимые реакции, как в прямом, так и в обратном направлениях.
Типы катализа
По влиянию на скорость реакции катализ многие источники делят на положительный (скорость реакции растет) и отрицательный (скорость реакции падает). В последнем случае происходит процесс ингибирования, который нельзя считать ‘отрицательным катализом’, поскольку ингибитор в ходе реакции расходуется.
Катализ бывает гомогенным и гетерогенным (контактным). В гомогенном катализе катализатор состоит в той же фазе, что и реактивы реакции, в то время, как гетерогенные катализаторы отличаются фазой.
Гомогенный катализ
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
H2О2 + I → H2О + IO H2О2 + IO → H2О + О2 + IПри гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
Гетерогенный катализ
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
- Диффузия реагирующих веществ к поверхности твердого вещества
- Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их
- Химическая реакция между реагирующими молекулами
- Десорбция продуктов с поверхности катализатора
- Диффузия продукта с поверхности катализатора в общий поток
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод).
Носитель катализатора
Металлическая платина (показана стрелками), стабилизированная на носителе — оксиде алюминияНоситель катализатора, иначе подложка (катализатора) (англ. carrier или support) — инертный или малоактивный материал, служащий для стабилизации на его поверхности частиц активной каталитической фазы.
Роль носителя в гетерогенном катализе состоит в предотвращении агломерации или спекания активного компонента, что позволяет поддерживать высокую площадь контакта активного вещества (см. активная каталитическая фаза) и реагентов. Количество носителя, как правило, гораздо больше количества нанесенного на него активного компонента. Основными требованиями к носителям являются большая площадь поверхности и пористость, термическая стабильность, химическая инертность, высокая механическая прочность. В ряде случаев носитель влияет на свойства активной фазы (эффект «сильного взаимодействия металл–носитель»). В качестве носителей применяют как природные (глины, пемза, диатомит, асбест и др.), так и синтетические материалы (активные угли, силикагель, алюмосиликаты, оксиды алюминия, магния, циркония и др.)[2].
Химия катализа
Химия катализа изучает вещества, изменяющие скорость химических реакций. Вещества, замедляющие реакции, называются ингибиторами. Ферменты — это биологические катализаторы. Катализатор не находится в стехиометрических отношениях с продуктами и регенерируется после каждого цикла превращения реагентов в продукты. Несмотря на появление новых способов активации молекул (плазмохимия, радиационное и лазерное воздействия и другие), катализ − основа химических производств (относительная доля каталитических процессов составляет 80-90 %).
Реакция, накормившая человечество (решение проблемы связанного азота) — цикл Габера-Боша. Аммиак получают с катализатором — пористым железом. Протекает при Р = 30 МПа и Т = 420—500 °C
3Н2 + N2 = 2NH3
Водород для синтеза NH3 получают путем двух последовательных каталитических процессов: конверсии СН4(СН4 + Н2О → СО + 3Н2) на Ni−катализаторах и конверсии образующегося оксида углерода (СО + Н2О → СО2 + Н2). Для достижения высоких степеней превращения последнюю реакцию осуществляют в две стадии: высокотемпературная (315—480 °C) — на Fe−Cr−оксидных катализаторах и низкотемпературная (200—350 °C) — на Cu−Zn−оксидных катализаторах. Из аммиака получают азотную кислоту и другие соединения азота — от лекарств и удобрений до взрывчатых веществ.
Различают катализы »гомогенный, гетерогенный, межфазный, мицеллярный, ферментативный.
Энергия активации E каталитических реакций значительно меньше, чем для той же реакций в отсутствие катализатора. Например, для некаталитического разложения NH3 на N2 + Н2 E ~ 320 кДж/моль, для того же разложения в присутствии Pt Е ~ 150 кДж/моль. Благодаря снижению E обеспечивается ускорение каталитических реакций по сравнению с некаталитическими.
Литература
- Боресков Г. К. Катализ. Вопросы теории и практики. — Новосибирск, 1987.
- Гейтс Б. Химия каталитических процессов / Б. Гейтс, Дж. Кетцир.
- Журнал «Кинетика и катализ».
- Колесников И. М. Катализ и производство катализаторов. — М.: Техника, 2004. — 399 с.
- Шуйт Г. — М.: Мир, 1981. — 551 с.
- Яблонский Г. С., Быков В. И., Горбань А. Н. Кинетические модели каталитических реакций. — Новосибирск: Наука (Сиб. отделение), 1983. — 255 c.
См. также
Ссылки
dic.academic.ru
КАТАЛИЗ — это… Что такое КАТАЛИЗ?
(от греч. katalysis — разрушение), изменение скорости хим. р-ции при воздействии в-в ( катализаторов), к-рые участвуют в р-ции, но не входят в состав продуктов. Катализатор не находится в стехиометрич. отношениях с продуктами и регенерируется после каждого цикла превращ. реагентов в продукты. Различают положительный и отрицательный К., в зависимости от того, ускоряет катализатор р-цию или замедляет ее. Как правило, термин «К.» относят к ускорению р-ции; в-ва, замедляющие р-цию, наз. ингибиторами. Каталитич. действие на р-цию могут оказывать образующиеся в ходе р-ции промежут. в-ва или продукты (см. Автокатализ).Для К. характерно, что небольшие кол-ва катализатора ускоряют превращ. больших кол-в реагирующих в-в. Так, 1 мас. ч. Pt-катализатора вызывает превращ. 104 мас. ч. SO3 в SO2 или 106 мас. ч. NH3 в NO. Ускоряющее действие р-рителя на р-цию в р-рах обычно не относят к К. на том основании, что кол-во р-рителя, как правило, значительно превышает кол-во растворенных реагирующих в-в. Известны, однако, случаи ускорения р-ций в присут. очень малых добавок р-рителя, напр. воды. Неизменность хим. состава и структуры катализатора по окончании процесса вряд ли может служить обязательным признаком К. Известно, что хим. состав выгруженного из реактора катализатора существенно иной, чем у загруженного; на состав и структуру катализатора влияет состав реакц. смеси. Неизменность хим. состава и структуры катализатора имеет смысл рассматривать по отношению к той из элементарных стадий сложной каталитич. р-ции, в к-рой непосредственно участвует катализатор, однако для этого необходимо надежно установить механизм р-ции, что не всегда возможно. Термин «К.» введен И. Берцелиусом в 1835. При гомогенном катализе катализатор и реагирующие в-ва находятся в одной фазе в молекулярно-дисперсном состоянии. При гетерогенном катализе катализатор образует самостоят. фазу, отделенную границей раздела от фазы, в к-рой находятся реагирующие в-ва. Выделяют также гетерогенно-гомогенный К., при к-ром р-ция начинается на пов-сти твердого катализатора, а затем продолжается в объеме. Межфазным катализом принято называть К. на границе двух несмешивающихся жидкостей; при этом роль катализатора состоит в переносе реагентов между фазами. Промежут. положение между гомогенным и гетерогенным К. занимает микрогетерогенный К. коллоидными частицами в жидкой фазе. Ускорение р-ций в присут. мицелл ПАВ наз. мицеллярным катализом. Исключительную роль в процессах в живых организмах играет ферментативный катализ, обусловленный действием ферментов. Важным компонентом пром. катализаторов являются промоторы — в-ва, добавление к-рых к катализатору в малых кол-вах (проценты или доли процента) увеличивает его активность, селективность или устойчивость. Если промотор добавляется к катализатору в больших кол-вах или сам по себе каталитически активен, катализатор наз. смешанным. В-ва, воздействие к-рых на катализатор приводит к снижению его активности или полному прекращению каталитич. действия, наз. ядами каталитическими. Встречаются случаи, когда одна и та же добавка к катализатору при одних концентрациях и т-рах является промотором, при других — ядом. В гетерог. К. широко применяют носители — в-ва, сами по себе каталитически неактивные или малоактивные. Нанесение на них катализатора значительно повышает его активность, гл. обр. вследствие увеличения пов-сти катализатора или предохранения его частиц от спекания (см. Нанесенные катализаторы).Общие закономерности катализа. Все каталитич. р-ции -самопроизвольные процессы, т. е. протекают в направлении убыли энергии Гиббса системы. Катализатор не смещает положения равновесия хим. р-ции, если не считать его влияния на коэф. активности реагирующих в-в в р-рах (или коэф. летучести, в случае р-ций в газовой фазе при высоких давлениях). Вблизи от равновесия один и тот же катализатор ускоряет прямую и обратную р-ции в равной степени, вдали от равновесия этого может и не быть. Из неск. возможных р-ций катализатор ускоряет не обязательно термодинамически наиб. выгодную, т. е. ту, для к-рой убыль энергии Гиббса максимальна. Напр., в присут. Bi2O3.MoO3 пропилен окисляется частично (до акролеина), в присут. Со 3 О 4 происходит полное окисление (до СО 2 и Н 2 О). Мерой селективности (избирательности действия) катализатора является отношение скорости i р-ции, ведущей к накоплению i-го продукта, к суммарной скорости превращ. исходных в-в во всех возможных р-циях, т. е. i/Si. Расчет скорости каталитич. р-ции возможен на основе ряда моделей и приближений относительно ее механизма и режима протекания; для простейших случаев гомогенного и гетерогенного К. подход к расчету скорости изложен в ст. Каталитических реакций кинетика. Энергия активации Екаталитич. р-ции значительно меньше, чем для той же р-ции в отсутствие катализатора. Напр., для некаталитич. разложения NH3 на N2 + Н 2 E ~ 320 кДж/моль, для того же разложения в присут. Pt Е ~ 150 кДж/моль. Благодаря снижению E обеспечивается ускорение каталитич. р-ций по сравнению с некаталитическими. Снижение E объясняется тем, что при К. р-ция протекает по новому механизму, складывающемуся из элементарных р-ций с меньшими энергиями активации, чем некаталитич. р-ция. При т. наз. стадийном механизме К. (кривая 1 на рис.) р-ция типа А : В (энергия активации E1) заменяется совокупностью стадий: 1) А + К : АК, 2) АК : В + К (энергии активации E2 и E3 соотв.), где К — катализатор, АК — устойчивое промежут. соед. реагента с катализатором. Для бимолекулярной р-ции А + В : С + D стадийный механизм может осуществляться по схеме: 1) А + К : АК, 2) АК + B : K + C + D. По такой схеме протекает, напр., окисление Н 2 на металлич. катализаторе М: 1) М + 1/2O2 : МО, 2) МО + Н 2 : М + Н 2 О. Одностадийные процессы К. (их наз. также ассоциативными или слитными) протекают по схеме: А + К : АК* : В + К. В этом случае (кривая 2 на рис.) катализатор не образует устойчивых промежут. соед. с реагентами, но входит в активир. комплекс АК*. Р-ция происходит с преодолением одного потенциального барьера, разделяющего начальное и конечное состояния системы, как и некаталитич. р-ция, но с пониженным значением энергии активации (E4 на рис.). Большая скорость каталитич. р-ции м. б. обусловлена не только снижением энергии активации вследствие протекания р-ции по новому механизму, но и осуществлением под действием катализатора цепного механизма р-ции. Напр., каталитич. действие паров воды на газофазное окисление СО объясняется образованием реакц. цепей с участием активных частиц Н и ОН. В гетерогенно-гомог. К. на пов-сти образуются активные частицы (напр., своб. радикалы НО 2 и RO2 при окислении углеводородов RH), к-рые затем вылетают в газовую фазу и продолжают там цепь.
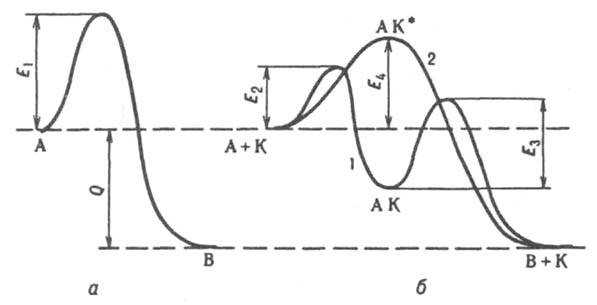
Энергетическая диаграмма реакции типа А : В; а — без катализатора, б — с катализатором К; 1 — при сталийном механизме, 2 — при ассоциативном механизме катализа: E1, E2,E4, E4 потенциальные барьеры, разделяющие исходное и конечное состояния системы, Q — тепловой эффект р-ции.
Доказано образование цепей на пов-сти катализатора при полимеризации олефинов и синтезе углеводородов из СО и Н 2. Для мн. других гетерогенно-каталитич. р-ций обнаружены особенности, характерные для цепных р-ций: генерирование активных центров (чередование заполнения мест на пов-сти и их освобождение), образование активных промежут. частиц в сверхравновесных концентрациях (что способствует преодолению барьера энергетически невыгодных стадий), достижение макс. скорости р-ции спустя нек-рое время после ее начала. Каталитич. и цепные р-ции сближает также явление кинетич. сопряжения. Если превращ. катализатора при взаимод. с реагентами сопряжены с самой каталитич. р-цией (т. е. имеют общее промежут. в-во или активир. комплекс), становится возможным образование сверхравновесных концентраций активных центров на пов-сти катализатора и др. эффекты, типичные для цепных процессов.
Основные механизмы катализа. Каталитич. процессы, обусловленные переносом электрона (окисление, восстановление, гидрирование, дегидрирование, разложение нестойких кислородсодержащих соединений), относят к окислительно-восстановительному катализу. Типичными катализаторами для них являются переходные металлы и их соед.: простые оксиды (V2O5, MnO2, МоО 3, Сr2 О 3), шпинели (Fe3O4, CuCr2O4), сульфиды (MoS2, WS2) и др.; для р-ций в р-рах — соли и комплексные соед. переходных металлов. Высокая каталитич. активность этих в-в объясняется тем, что атомы переходных металлов могут существовать в разл. степенях окисления, изменение к-рых не требует больших энергетич. затрат. В результате перенос электрона от реагента к катализатору осуществляется легче, чем в отсутствие катализатора от восстановителя к окислителю. При одноэлектронном переходе образуются своб. радикалы, далее участвующие в р-ции. Напр., при переходе одного электрона от активного центра молибденового катализатора к кислороду образуется ион-радикал О 2, участвующий далее в каталитич. окислении (Мо 5+ + О 2 : Мо 6+ + О 2; О 2 +С n Н m : продукт). Существует окислит.-восстановит. К. с многоэлектронным механизмом, при к-ром не образуются своб. радикалы в качестве промежут. частиц. Многоэлектронные переходы между катализатором и реагирующими молекулами возможны, если в активный центр катализатора входят неск. атомов переходного металла. Напр., в разложении Н 2 О 2 активны комплексные соед., содержащие 2 иона Fe3+; в восстановлении мол. азота до N2H4 — комплексные соед., содержащие 2 или более ионов V2+. К процессам кислотно-основного катализа относятся каталитич. крекинг, гидратация, дегидратация, мн. р-ции изомеризации, конденсации орг. в-в. Типичные катализаторы для этого класса процессов — в-ва, способные передавать или принимать протон от реагентов или же способные к гетеролитич. взаимод. с реагентами (без разделения пары электронов). Среди этих в-в — протонные (H2SO4, CH3COOH, HF) и апротонные (BF3, AlCl3) к-ты, аморфные и кристаллич. алюмосиликаты, Аl2 О 3, фосфаты, сульфаты. Активными центрами в них является протонный центр Н + (центр Брёнстеда) или акцептор электронной пары, напр., атом Аl (центр Льюиса). Реже применяются катализаторы основного характера (растворенные основания, твердые CaO, MgO и др.). В случае т. наз. полифункциональных катализаторов отдельные этапы сложных каталитич. процессов окислит.-восстановительные и кислотно-основные — протекают на разных составных частях многокомпонентной многофазной системы. Напр., при неполном окислении непредельных альдегидов в непредельные к-ты в присут. оксидов Мо и V в элементарном акте происходят окислит.-восстановит. превращения катализатора:
V2O5 + СН 2=СНСНО : СН 2=СНСООН +V2O4;
2МоО 3 + СН 2=СНСНО : СН 2=СНСООН + Мо 2 О 5;
V2O4 + 1/2 О 2 : V2O5, Mo2O5 + V2 O2 : 2МоО 3
Конечная стадия р-ций — десорбция к-ты — происходит на пов-стях V2O5 и МоО 3, обладающих слабокислотными св-вами. В водных р-рах каталитич. активность солей или комплексных соед. переходных металлов проявляется в определенном интервале рН. Это объясняется не только устойчивостью комплексных соед. при определенном рН, но и участием ионов Н + и ОН — в элементарных стадиях К.
Катализ в промышленности. Несмотря на появление новых способов активации молекул (плазмохимия, радиац. химия, лазерная химия и др.), К. остается основой хим. произ-в. Относит. доля каталитич. процессов составляет 80-90% и продолжает возрастать; в общем объеме мирового пром. произ-ва каталитич. процессы дают ок. 18% стоимости всей продукции. В неорганическом синтезе важнейшими каталитич. процессами являются произ-во H2SO4, синтез NH3 из N2 и Н 2, произ-во HNO3. В старейшем газофазном (нитрозном) способе произ-ва H2SO4 окисление SO2 в SO3 осуществлялось в присут. оксидов азота. В кон. 19 в. возник контактный процесс, при к-ром окисление SO2 в SO3 протекало в присут. Pt, нанесенной на разл. носители. Впоследствии Pt была заменена V2O5 с добавкой К 2 О и др. оксидов. Контактным способом получают десятки млн. т H2SO4 ежегодно. Пром. синтез NH3 из N2 и Н 2 был осуществлен в результате работ Ф. Габера и К. Боша в нач. 20 в. на железных катализаторах при давлениях ок. 300 атм и т-ре 450-500 °С. В настоящее время используют более активные Fe-катализаторы, промотированные V2O5, CaO, Аl2 О 3 и др. оксидами, что позволяет вести процесс при более низких давлениях и т-рах. Водород для синтеза NH3 получают путем двух последоват. каталитич. процессов: конверсии СН 4 или др. углеводородов (СН 4 + Н 2 О : СО + 3Н 2) на Ni-катализаторах и конверсии образующегося оксида углерода (СО + Н 2 О : СО 2 + Н 2). Для достижения высоких степеней превращения последнюю р-цию осуществляют в две стадии: высокотемпературной (315-480°С) — на Fe-Cr-оксидных катализаторах и низкотемпературной (200-350°С) — на Cu-Zn-оксидных катализаторах. Hаиб. крупный потребитель NH3 — произ-во HNO3 окислением NH3 до NO на Pt и Pt-Rh сетках при 900-950 °С. В органическом синтезе широкое применение К. началось в 1-й трети 20 в. благодаря работам П. Сабатье, В. Н. Ипатьева, Н. Д. Зелинского и др. Многочисл. р-ции гидрирования С=С, , С=О, NO2 -групп протекают на Ni-катализаторах, в числе к-рых Ni на носителях (кизельзуре, Аl2 О 3) и скелетный Ni — высокопористый катализатор, получаемый выщелачиванием Ni-Al сплавов. Реже применяют Сu, Со, Pt, Pd. К крупным пром. процессам относится гидрогенизация жиров, превращ. бензола в циклогексан, нитробензола в анилин. В результате работ С. В. Лебедева и его учеников было создано произ-во синтетич. каучука. В его основе лежало получение мономера — бутадиена из этилового спирта по р-ции 2С 2 Н 5 ОН : С 4 Н б + 2Н 2 О + Н 2 на смешанном оксидном катализаторе, сочетающем дегидратирующую, дегидрирующую и конденсирующую ф-ции, необходимые для всех стадий р-ции. Впоследствии мономеры в произ-ве синтетич. каучука — бутадиен, изопрен, стирол -стали получать каталитич. дегидрированием соответствующих парафинов и олефинов на Al-Cr-оксидных катализаторах. Началось пром. применение экономически еще более выгодного процесса получения мономеров окислит. дегидрированием на разл. оксидах переходных металлов (RCH2CH3 + 1/2O2 : RCH=CH2 + Н 2 О). Широкое развитие в сер. 20 в. получили процессы каталитич. нефтепереработки; среди них — крекинг углеводородов нефти, для к-рого вначале основными катализаторами были аморфные алюмосиликаты, впоследствии цеолиты, отличающиеся более высокой активностью и большей селективностью по выходу парафиновых и ароматич. углеводородов. Для получения высококачеств. бензинов, дизельных и реактивных топлив применяют каталитич. риформинг, алкилирование, гидрокрекинг и гидроочистку. Катализаторы риформинга — Аl2 О 3, биметаллич. системы (Pt-Re на Аl2 О 3), реже оксиды Мо или Сr на Аl2 О 3; алкилирования — Н 2SО 4, HF, AlCl3, BF3; гидрокрекинга (переработки высококипящих фракций нефти под давлением Н 2 в низкокипящие) — Аl-Со-Мо- и Al-Ni-W-системы. Близкие по составу катализаторы применяют в процессах гидроочистки, в к-рых под давлением Н 2 тяжелые фракции нефти подвергаются обессериванию с выделением H2S; удаляются также азот- и кислородсодержащие соед. в результате гидрогенолиза соответствующих хим. связей. В условиях гидроочистки металлич. Ni-, Со-, Мо-, W-катализаторы превращаются в сульфиды (подробнее см. в статьях Каталитический крекинг, Каталитический риформинг). Каталитич. переработка угля в моторное топливо началась в 20-30-х гг. 20 в. в двух вариантах: прямая гидрогенизация угольной пасты и синтез углеводородов по Фишеру-Тропшу на Со- и Fe-содержащих катализаторах. После 2-й мировой войны в связи с быстрым развитием нефтепереработки эти процессы утратили свое значение, однако затем интерес к каталитич. переработке угля возобновился в связи с начавшимся истощением запасов нефти. Появились новые катализаторы, были созданы опытно-пром. и отдельные пром. установки. наиб. перспективен т. наз. Мобил-процесс, включающий газификацию угля, синтез метанола и послед. превращ. его в смесь углеводородов с большим выходом ароматич. углеводородов С 8 -С 12 на высококремнистых цеолитах с сечением пор, приближающимся к поперечному размеру соответствующих ароматич. молекул. К наиб. крупнотоннажным процессам каталитич. окисления относятся: окисление этилена в этиленоксид на серебряных катализаторах, окисление метанола в формальдегид на серебре или молибдате Fe, окисление пропилена в акролеин и окислит. аммонолиз пропилена с получением акрилонитрила на молибдате Bi. Высокая селективность последних двух процессов достигается за счет введения в катализатор оксидных добавок; применяют шести- и даже восьмикомпонентные оксидные катализаторы. Из гомог. жидкофазных процессов в пром-сти применяют окисление этилена в ацеталъдегид в водном р-ре, содержащем соли Сu и Pd, получение винилацетата окислением смеси С 2 Н 4 и СН 3 СООН в присут. аналогичного катализатора и др. Каталитич. полимеризация получила развитие после открытия в 50-х гг. 20 в. К. Циглером и Дж. Наттой стереоспецифич. полимеризации олефинов на галогенидах, оксидах и др. соед. металлов IV-VIII групп (Ti, Zr, V, Сr, Мо и др.) с сокатализаторами — металлоорг. соед. Аl и нек-рых др. металлов I-III групп. В этих процессах получают кристаллич. полиолефины с регулярной структурой — полиэтилен, полипропилен, полибутадиен и др. (подробнее см. в статьях Катализаторы окисления, Катализаторы полимеризации, Катализаторы процессов нефтепереработки). Каталитич. синтезы на основе СО быстро развиваются в связи с возрастающим значением ненефтяного сырья. Разработан пром. процесс получения уксусной к-ты карбонилированием метанола в присут. очень малых кол-в солей Rh. Быстро возрастает применение К. для очистки отходящих пром. газов доокислением вредных орг. примесей в СО 2 на катализаторах глубокого окисления: металлах, простых оксидах (MnO2, Fe2O3), шпинелях (СuСr2 О 4, СоСr2 О 4) и др. Перспективна также разработка катализаторов, селективно удаляющих вредные серосодержащие примеси (H2S, SO2) из отходящих пром. газов и прир. газа. В 70-х гг. 20 в. возникло новое направление каталитич. очистки — удаление примесей из выхлопных газов автомобилей. Катализатор в дожигателях выхлопных газов должен доокислять примеси углеводородов и СО до СО 2, а также восстанавливать оксиды азота до N2. Используют в дожигателях Pt, Pd, Rh, нанесенные на носители. Лит.: Проблемы кинетики и катализа, т. 1-19, Л.-М., 1935-85; Боресков Г. К., Катализ, ч. 1-2, Новосиб., 1971; Томас Ч., Промышленные каталитические процессы и эффективные катализаторы, пер. с англ., М.. 1973; Гейтс Б., Кетцир Дж., Шуйт Г., Химия каталитических процессов, пер. с англ., М., 1981; Крылов О. В., «Кинетика и катализ», 1985, т. 26, № 2, с. 263-74; Advances in catalysis, v. 1-35, N.Y.-L, 1948-87. О. В. Крылов.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
dic.academic.ru
КАТАЛИЗ | Энциклопедия Кругосвет
Содержание статьиКАТАЛИЗ, ускорение химических реакций под действием малых количеств веществ (катализаторов), которые сами в ходе реакции не изменяются. Каталитические процессы играют огромную роль в нашей жизни. Биологические катализаторы, называемые ферментами, участвуют в регуляции биохимических процессов. Без катализаторов не могли бы протекать многие промышленные процессы.
Важнейшее свойство катализаторов – селективность, т.е. способность увеличивать скорость лишь определенных химических реакций из многих возможных. Это позволяет осуществлять реакции, протекающие в обычных условиях слишком медленно, чтобы им можно было найти практическое применение, и обеспечивает образование нужных продуктов.
Применение катализаторов способствовало бурному развитию химической промышленности. Они широко используются при переработке нефти, получении различных продуктов, создании новых материалов (например, пластмасс), нередко более дешевых, чем применявшиеся прежде. Примерно 90% объема современного химического производства основано на каталитических процессах. Особую роль играют каталитические процессы в охране окружающей среды.
В 1835 шведский химик Й.Берцелиус установил, что в присутствии определенных веществ скорость некоторых химических реакций существенно возрастает. Для таких веществ он ввел термин «катализатор» (от греч. katalysis – расслабление). Как считал Берцелиус, катализаторы обладают особой способностью ослаблять связи между атомами в молекулах, участвующих в реакции, облегчая таким образом их взаимодействие. Большой вклад в развитие представлений о работе катализаторов внес немецкий физикохимик В.Оствальд, который в 1880 дал определение катализатора как вещества, которое изменяет скорость реакции.
Согласно современным представлениям, катализатор образует комплекс с реагирующими молекулами, стабилизируемый химическими связями. После перегруппировки этот комплекс диссоциирует с высвобождением продуктов и катализатора. Для мономолекулярной реакции превращения молекулы X в Y весь этот процесс можно представить в виде
X + Кат. ® X-Кат. ® Y-Кат. ® Y + Кат.
Высвободившийся катализатор вновь связывается с X, и весь цикл многократно повторяется, обеспечивая образование больших количеств продукта – вещества Y.
Многие вещества при обычных условиях не вступают в химическую реакцию друг с другом. Так, водород и оксид углерода при комнатной температуре не взаимодействуют между собой, поскольку связь между атомами в молекуле H2 достаточно прочная и не разрывается при атаке молекулой CO. Катализатор сближает молекулы H2 и CO, образуя с ними связи. После перегруппировки комплекс катализатор – реагенты диссоциирует с образованием продукта, содержащего атомы C, H и O.
Нередко при взаимодействии одних и тех же веществ образуются разные продукты. Катализатор может направить процесс по пути, наиболее благоприятному для образования определенного продукта. Рассмотрим реакцию между CO и H2. В присутствии медьсодержащего катализатора практически единственным продуктом реакции является метанол:
Вначале молекулы СО и Н2 адсорбируются на поверхности катализатора. Затем молекулы СО образуют с катализатором химические связи (происходит хемосорбция), оставаясь в недиссоциированной форме. Молекулы водорода также хемосорбируются на поверхности катализатора, но при этом диссоциируют. В результате перегруппировки образуется переходный комплекс Н-Кат.-CH2OH. После присоединения атома H комплекс распадается с высвобождением CH3OH и катализатора.
В присутствии никелевого катализатора как СО, так и Н2 хемосорбируются на поверхности в диссоциированной форме, и образуется комплекс Кат.-СН3. Конечными продуктами реакции являются СН4 и Н2О:
Большинство каталитических реакций проводят при определенных давлении и температуре, пропуская реакционную смесь, находящуюся в газообразном или жидком состоянии, через реактор, заполненный частицами катализатора. Для описания условий проведения реакции и характеристики продуктов используются следующие понятия. Объемная скорость – объем газа или жидкости, проходящий через единицу объема катализатора в единицу времени. Каталитическая активность – количество реагентов, превращенных катализатором в продукты в единицу времени. Конверсия – доля вещества, превращенного в данной реакции. Селективность – отношение количества определенного продукта к суммарному количеству продуктов (обычно выражается в процентах). Выход – отношение количества данного продукта к количеству исходного материала (обычно выражается в процентах). Производительность – количество продуктов реакции, образующихся в единице объема в единицу времени.
ТИПЫ КАТАЛИЗАТОРОВ
Катализаторы классифицируют исходя из природы реакции, которую они ускоряют, их химического состава или физических свойств. Каталитическими свойствами обладают в той или иной степени практически все химические элементы и вещества – сами по себе или, чаще, в различных сочетаниях. По своим физическим свойствам катализаторы делятся на гомогенные и гетерогенные. Гетерогенные катализаторы – это твердые вещества, гомогенные диспергированы в той же газовой или жидкой среде, что и реагирующие вещества.
Многие гетерогенные катализаторы содержат металлы. Некоторые металлы, особенно относящиеся к VIII группе периодической системы элементов, обладают каталитической активностью сами по себе; типичный пример – платина. Но большинство металлов проявляют каталитические свойства, находясь в составе соединений; пример – глинозем (оксид алюминия Al2O3).
Необычным свойством многих гетерогенных катализаторов является большая площадь их поверхности. Они пронизаны многочисленными порами, суммарная площадь которых иногда достигает 500 м2 на 1 г катализатора. Во многих случаях оксиды с большой площадью поверхности служат подложкой, на которой в виде небольших кластеров осаждаются частички металлического катализатора. Это обеспечивает эффективное взаимодействие реагентов в газовой или жидкой фазе с каталитически активным металлом. Особый класс гетерогенных катализаторов составляют цеолиты – кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия). Хотя многие гетерогенные катализаторы обладают большой площадью поверхности, обычно они имеют лишь небольшое число активных центров, на долю которых приходится малая часть суммарной поверхности. Катализаторы могут утрачивать свою активность в присутствии небольших количеств химических соединений, называемых каталитическими ядами. Эти вещества связываются с активными центрами, блокируя их. Определение структуры активных центров является предметом интенсивных исследований.
Гомогенные катализаторы имеют различную химическую природу – кислоты (Н2SO4 или Н3РО4), основания (NaOH), органические амины, металлы, чаще всего переходные (Fe или Rh), в форме солей, металлоорганических соединений или карбонилов. К катализаторам относятся также ферменты – белковые молекулы, регулирующие биохимические реакции. Активный центр некоторых ферментов содержит атом металла (Zn, Cu, Fe или Mo). Металлсодержащие ферменты катализируют реакции с участием малых молекул (О2, CO2 или N2). Ферменты обладают очень высокой активностью и селективностью, но работают только при определенных условиях, таких, в которых протекают реакции в живых организмах. В промышленности часто используют т.н. иммобилизованные ферменты.
КАК РАБОТАЮТ КАТАЛИЗАТОРЫ
Энергетика.
Любая химическая реакция может протекать лишь при условии, что реагенты преодолеют энергетический барьер, а для этого они должны приобрести определенную энергию. Как мы уже говорили, каталитическая реакция X ® Y состоит из ряда последовательных стадий. Для протекания каждой из них необходима энергия E, называемая энергией активации. Изменение энергии вдоль координаты реакции представлено на рис. 1.
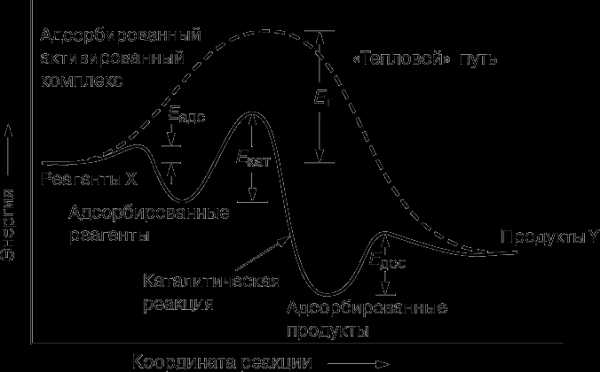
Рассмотрим сначала некаталитический, «тепловой» путь. Чтобы реакция смогла осуществиться, потенциальная энергия молекул X должна превысить энергетический барьер Eт. Каталитическая же реакция состоит из трех стадий. Первая – образование комплекса Х-Кат. (хемосорбция), энергия активации которой равна Еадс. Вторая стадия – перегруппировка Х-Кат. ® Y-Кат. с энергией активации Екат, и наконец, третья – десорбция с энергией активации Едес; Еадс, Екат и Едес много меньше Ет. Поскольку скорость реакции экспоненциально зависит от энергии активации, каталитическая реакция протекает значительно быстрее тепловой при данной температуре.
Катализатор можно уподобить инструктору-проводнику, который ведет альпинистов (реагирующие молекулы) через горный хребет. Он проводит одну группу через перевал и затем возвращается за следующей. Путь через перевал лежит значительно ниже того, который лежит через вершину (тепловой канал реакции), и группа совершает переход быстрее, чем без проводника (катализатора). Возможно даже, что самостоятельно группа вообще не смогла бы преодолеть хребет.
Теории катализа.
Для объяснения механизма каталитических реакций были предложены три группы теорий: геометрические, электронные и химическая. В геометрических теориях основное внимание обращено на соответствие между геометрической конфигурацией атомов активных центров катализатора и атомов той части реагирующих молекул, которая ответственна за связывание с катализатором. Электронные теории исходят из представления, что хемосорбция обусловливается электронным взаимодействием, связанным с переносом заряда, т.е. эти теории связывают каталитическую активность с электронными свойствами катализатора. Химическая теория рассматривает катализатор как химическое соединение с характерными свойствами, которое образует химические связи с реагентами, в результате чего формируется нестабильный переходный комплекс. После распада комплекса с высвобождением продуктов катализатор возвращается в исходное состояние. Последняя теория считается сейчас наиболее адекватной.
На молекулярном уровне каталитическую газофазную реакцию можно представить следующим образом. Одна реагирующая молекула связывается с активным центром катализатора, а другая взаимодействует с ней, находясь непосредственно в газовой фазе. Возможен и альтернативный механизм: реагирующие молекулы адсорбируются на соседних активных центрах катализатора, а потом взаимодействуют друг с другом. По-видимому, именно таким образом протекает большинство каталитических реакций.
Другая концепция предполагает, что существует связь между пространственным расположением атомов на поверхности катализатора и его каталитической активностью. Скорость одних каталитических процессов, в том числе многих реакций гидрирования, не зависит от взаимного расположения каталитически активных атомов на поверхности; скорость других, напротив, существенно изменяется при изменении пространственной конфигурации поверхностных атомов. В качестве примера можно привести изомеризацию неопентана в изопентан и одновременный крекинг последнего до изобутана и метана на поверхности катализатора Pt-Al2O3.
ПРИМЕНЕНИЕ КАТАЛИЗА В ПРОМЫШЛЕННОСТИ
Тот бурный промышленный рост, который мы сейчас переживаем, был бы невозможен без развития новых химических технологий. В значительной мере этот прогресс определяется широким применением катализаторов, с помощью которых низкосортное сырье превращается в высокоценные продукты. Образно говоря, катализатор – это философский камень современного алхимика, только он превращает не свинец в золото, а сырье в лекарства, пластмассы, химические реактивы, топливо, удобрения и другие полезные продукты.
Пожалуй, самый первый каталитический процесс, который человек научился использовать, – это брожение. Рецепты приготовления алкогольных напитков были известны шумерам еще за 3500 до н.э. См. ВИНО; ПИВО.
Значительной вехой в практическом применении катализа стало производство маргарина каталитическим гидрированием растительного масла. Впервые эта реакция в промышленном масштабе была осуществлена примерно в 1900. А начиная с 1920-х годов один за другим были разработаны каталитические способы получения новых органических материалов, прежде всего пластмасс. Ключевым моментом стало каталитическое получение олефинов, нитрилов, эфиров, кислот и т.д. – «кирпичиков» для химического «строительства» пластмасс.
Третья волна промышленного использования каталитических процессов приходится на 1930-е годы и связана с переработкой нефти. По своему объему это производство вскоре оставило далеко позади все другие. Переработка нефти состоит из нескольких каталитических процессов: крекинга, риформинга, гидросульфирования, гидрокрекинга, изомеризации, полимеризации и алкилирования.
И наконец, четвертая волна в использовании катализа связана с охраной окружающей среды. Наиболее известное достижение в этой области – создание каталитического нейтрализатора выхлопных газов автомобилей. Каталитические нейтрализаторы, которые устанавливают на автомобили с 1975, сыграли большую роль в улучшении качества воздуха и сберегли таким образом много жизней.
За работы в области катализа и смежных областей было присуждено около десятка Нобелевских премий.
О практической значимости каталитических процессов свидетельствует тот факт, что на долю азота, входящего в состав полученных промышленным путем азотсодержащих соединений, приходится около половины всего азота, входящего в состав пищевых продуктов. Количество соединений азота, образующихся естественным путем, ограничено, так что производство пищевого белка зависит от количества азота, вносимого в почву с удобрениями. Невозможно было бы прокормить и половину человечества без синтетического аммиака, который получают почти исключительно с помощью каталитического процесса Габера – Боша.
Область применения катализаторов постоянно расширяется. Важно и то, что катализ позволяет значительно повысить эффективность ранее разработанных технологий. В качестве примера можно привести усовершенствование каталитического крекинга благодаря использованию цеолитов.
Гидрирование.
Большое число каталитических реакций связано с активацией атома водорода и какой-либо другой молекулы, приводящей к их химическому взаимодействию. Этот процесс называется гидрированием и лежит в основе многих этапов переработки нефти и получения жидкого топлива из угля (процесс Бергиуса).
Производство авиационного бензина и моторного топлива из угля было развито в Германии во время Второй мировой войны, поскольку в этой стране нет нефтяных месторождений. Процесс Бергиуса заключается в непосредственном присоединении водорода к углю. Уголь нагревают под давлением в присутствии водорода и получают жидкий продукт, который затем перерабатывают в авиационный бензин и моторное топливо. В качестве катализатора используют оксид железа, а также катализаторы на основе олова и молибдена. Во время войны на 12 заводах Германии с помощью процесса Бергиуса получали примерно 1400 т жидкого топлива в сутки.
Другой процесс, Фишера – Тропша, состоит из двух стадий. Вначале уголь газифицируют, т.е. проводят реакцию его с водяным паром и кислородом и получают смесь водорода и оксидов углерода. Эту смесь превращают в жидкое топливо с помощью катализаторов, содержащих железо или кобальт. С окончанием войны производство синтетического топлива из угля в Германии было прекращено.
В результате повышения цен на нефть, последовавшего за нефтяным эмбарго в 1973–1974, были предприняты энергичные усилия по разработке экономически выгодного способа получения бензина из угля. Так, прямое ожижение угля можно проводить более эффективно, используя двухстадийный процесс, в котором сначала уголь контактирует с алюмокобальтомолибденовым катализатором при относительно низкой, а затем при более высокой температуре. Стоимость такого синтетического бензина выше, чем получаемого из нефти.
Аммиак.
Один из самых простых с химической точки зрения процессов гидрирования – синтез аммиака из водорода и азота. Азот весьма инертное вещество. Для разрыва связи N–N в его молекуле необходима энергия порядка 200 ккал/моль. Однако азот связывается с поверхностью железного катализатора в атомарном состоянии, и для этого нужно всего 20 ккал/моль. Водород связывается с железом еще более охотно. Синтез аммиака протекает следующим образом:
Этот пример иллюстрирует способность катализатора ускорять в равной степени как прямую, так и обратную реакцию, т.е. тот факт, что катализатор не изменяет положение равновесия химической реакции.
Гидрирование растительного масла.
Одна из важнейших в практическом отношении реакций гидрирования – неполное гидрирование растительных масел до маргарина, кулинарного жира и других пищевых продуктов. Растительные масла получают из соевых бобов, семян хлопчатника и других культур. В их состав входят эфиры, а именно триглицериды жирных кислот с разной степенью ненасыщенности. Олеиновая кислота СН3(СН2)7СН=СН(СН2)7СООН имеет одну двойную связь С=С, линолевая кислота – две и линоленовая – три. Присоединение водорода с разрывом этой связи предотвращает окисление масел (прогоркание). При этом повышается их температура плавления. Твердость большинства получаемых продуктов зависит от степени гидрирования. Гидрирование проводят в присутствии мелкодисперсного порошка никеля, нанесенного на подложку, или никелевого катализатора Ренея в атмосфере водорода высокой степени очистки.
Дегидрирование.
Дегидрирование – это тоже важная в промышленном отношении каталитическая реакция, хотя масштабы ее применения несравнимо меньше. С ее помощью получают, например, стирол – важный мономер. Для этого дегидрируют этилбензол в присутствии катализатора, содержащего оксид железа; протеканию реакции способствуют также калий и какой-нибудь структурный стабилизатор. В промышленных масштабах осуществляют дегидрирование пропана, бутана и других алканов. Дегидрированием бутана в присутствии алюмохромового катализатора получают бутены и бутадиен.
Кислотный катализ.
Каталитическая активность большого класса катализаторов обусловливается их кислотными свойствами. Согласно И.Брёнстеду и Т.Лоури, кислота – это соединение, способное отдавать протон. Сильные кислоты легко отдают свои протоны основаниям. Концепция кислотности получила дальнейшее развитие в работах Г.Льюиса, который дал определение кислоты как вещества, способного принимать электронную пару от вещества-донора с образованием ковалентной связи за счет обобществления этой электронной пары. Эти идеи вместе с представлениями о реакциях с образованием карбений-ионов помогли понять механизм разнообразных каталитических реакций, особенно тех, в которых участвуют углеводороды.
Силу кислоты можно определить с помощью набора оснований, изменяющих цвет при присоединении протона. Оказывается, некоторые промышленно важные катализаторы ведут себя как очень сильные кислоты. К ним относится катализатор процесса Фриделя – Крафтса, такой, как HCl-AlCl2O3 (или HAlCl4), и алюмосиликаты. Сила кислоты – это очень важная характеристика, поскольку от нее зависит скорость протонирования – ключевого этапа процесса кислотного катализа.
Активность таких катализаторов, как алюмосиликаты, применяющихся при крекинге нефти, определяется присутствием на их поверхности кислот Брёнстеда и Льюиса. Их структура аналогична структуре кремнезема (диоксида кремния), в котором часть атомов Si4+ замещена атомами Al3+. Лишний отрицательный заряд, возникающий при этом, может быть нейтрализован соответствующими катионами. Если катионами являются протоны, то алюмосиликат ведет себя как кислота Брёнстеда:
Активность кислотных катализаторов обусловливается их способностью реагировать с углеводородами с образованием в качестве промежуточного продукта карбений-иона. Алкилкарбений-ионы содержат положительно заряженный углеродный атом, связанный с тремя алкильными группами и/или атомами водорода. Они играют важную роль как промежуточные продукты, образующиеся во многих реакциях с участием органических соединений. Механизм действия кислотных катализаторов можно проиллюстрировать на примере реакции изомеризации н-бутана в изобутан в присутствии HCl-AlCl3 или Pt-Cl-Al2O3. Сначала малое количество олефина С4Н8 присоединяет положительно заряженный ион водорода кислотного катализатора с образованием третичного карбений-иона. Затем отрицательно заряженный гидрид-ион Н– отщепляется от н-бутана с образованием изобутана и вторичного бутилкарбений-иона. Последний в результате перегруппировки превращается в третичный карбений-ион. Эта цепочка может продолжаться с отщеплением гидрид-иона от следующей молекулы н-бутана и т.д.:
Существенно, что третичные карбений-ионы более стабильны, чем первичные или вторичные. Вследствие этого на поверхности катализатора присутствуют в основном именно они, а потому основным продуктом изомеризации бутана является изобутан.
Кислотные катализаторы широко применяются при переработке нефти – крекинге, алкилировании, полимеризации и изомеризации углеводородов (см. также ХИМИЯ И МЕТОДЫ ПЕРЕРАБОТКИ НЕФТИ). Установлен механизм действия карбений-ионов, играющих роль катализаторов в этих процессах. При этом они участвуют в целом ряде реакций, включая образование малых молекул путем расщепления больших, соединение молекул (олефина с олефином или олефина с изопарафином), структурную перегруппировку путем изомеризации, образование парафинов и ароматических углеводородов путем переноса водорода.
Одно из последних применений кислотного катализа в промышленности – получение этилированных топлив присоединением спиртов к изобутилену или изоамилену. Добавление кислородсодержащих соединений в бензин уменьшает концентрацию оксида углерода в выхлопных газах. Метил-трет-бутиловый эфир (МТБЭ) с октановым числом смешения 109 тоже позволяет получить высокооктановое топливо, необходимое для работы автомобильного двигателя с высокой степенью сжатия, не прибегая к введению в бензин тетраэтилсвинца. Организовано также производство топлив с октановыми числами 102 и 111.
Основной катализ.
Активность катализаторов обусловливается их основными свойствами. Давним и хорошо известным примером таких катализаторов является гидроксид натрия, применяющийся для гидролиза или омыления жиров при получении мыла, а один из последних примеров – катализаторы, используемые при производстве полиуретановых пластиков и пенопластов. Уретан образуется при взаимодействии спирта с изоцианатом, а ускоряется эта реакция в присутствии оснóвных аминов. В ходе реакции происходит присоединение основания к атому углерода в молекуле изоцианата, в результате чего на атоме азота появляется отрицательный заряд и его активность по отношению к спирту повышается. Особенно эффективным катализатором является триэтилендиамин. Полиуретановые пластики получают при взаимодействии диизоцианатов с полиолами (полиспиртами). Когда изоцианат реагирует с водой, ранее образовавшийся уретан разлагается с выделением CO2. При взаимодействии смеси полиспиртов и воды с диизоцианатами образующийся пенополиуретан вспенивается газообразным CO2.
Катализаторы двойного действия.
Эти катализаторы ускоряют реакции двух типов и дают лучшие результаты, чем при пропускании реагентов последовательно через два реактора, каждый из которых содержит только один тип катализатора. Это связано с тем, что активные центры катализатора двойного действия находятся очень близко друг к другу, и промежуточный продукт, образующийся на одном из них, тут же превращается в конечный продукт на другом.
Хороший результат дает объединение катализатора, активирующего водород, с катализатором, способствующим изомеризации углеводородов. Активацию водорода осуществляют некоторые металлы, а изомеризацию углеводородов – кислоты. Эффективным катализатором двойного действия, который применяется при переработке нефти для превращения нафты в бензин, является мелкодисперсная платина, нанесенная на кислый глинозем. Конверсия таких составляющих нафты, как метилциклопентан (МЦП), в бензол повышает октановое число бензина. Сначала МЦП дегидрируется на платиновой части катализатора в олефин с тем же углеродным остовом; затем олефин переходит на кислотную часть катализатора, где изомеризуется до циклогексена. Последний переходит на платиновую часть и дегидрируется до бензола и водорода.
Катализаторы двойного действия существенно ускоряют риформинг нефти. Их используют для изомеризации нормальных парафинов в изопарафины. Последние, кипящие при тех же температурах, что и бензиновые фракции, ценны тем, что обладают более высоким октановым числом по сравнению с неразветвленными углеводородами. Кроме того, превращение н-бутана в изобутан сопровождается дегидрированием, способствуя получению МТБЭ.
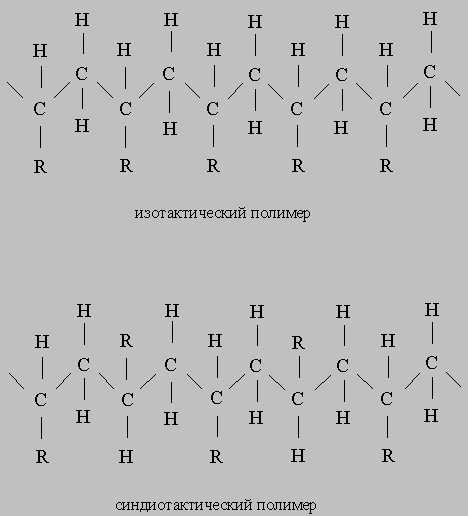
Стереоспецифическая полимеризация.
Важной вехой в истории катализа явилось открытие каталитической полимеризации a-олефинов с образованием стереорегулярных полимеров. Катализаторы стереоспецифической полимеризации были открыты К.Циглером, когда он пытался объяснить необычные свойства полученных им полимеров. Другой химик, Дж.Натта, предположил, что уникальность полимеров Циглера определяется их стереорегулярностью. Эксперименты по дифракции рентгеновских лучей показали, что полимеры, полученные из пропилена в присутствии катализаторов Циглера, высококристалличны и действительно имеют стереорегулярную структуру. Для описания таких упорядоченных структур Натта ввел термины «изотактический» и «синдиотактический». В том случае, когда упорядоченность отсутствует, используется термин «атактический»:

Стереоспецифическая реакция протекает на поверхности твердых катализаторов, содержащих переходные металлы групп IVA–VIII (такие, как Ti, V, Cr, Zr), находящиеся в неполностью окисленном состоянии, и какое-либо соединение, содержащее углерод или водород, который связан с металлом из групп I–III. Классическим примером такого катализатора является осадок, образующийся при взаимодействии TiCl4 и Al(C2H5)3 в гептане, где титан восстановлен до трехвалентного состояния. Эта исключительно активная система катализирует полимеризацию пропилена при обычных температуре и давлении.
Каталитическое окисление.
Применение катализаторов для управления химизмом процессов окисления имеет большое научное и практическое значение. В некоторых случаях окисление должно быть полным, например при нейтрализации СО и углеводородных загрязнений в выхлопных газах автомобилей. Однако чаще нужно, чтобы окисление было неполным, например во многих широко применяемых в промышленности процессах превращения углеводородов в ценные промежуточные продукты, содержащие такие функциональные группы, как –СНО, –СООН, –С–СО, –СN. При этом применяются как гомогенные, так и гетерогенные катализаторы. Примером гомогенного катализатора является комплекс переходного металла, который используется для окисления пара-ксилола до терефталевой кислоты, эфиры которой служат основой производства полиэфирных волокон.
Катализаторы гетерогенного окисления.
Эти катализаторы обычно являются сложными твердыми оксидами. Каталитическое окисление проходит в два этапа. Сначала кислород оксида захватывается адсорбированной на поверхности оксида молекулой углеводорода. Углеводород при этом окисляется, а оксид восстанавливается. Восстановленный оксид взаимодействует с кислородом и возвращается в исходное состояние. Используя ванадиевый катализатор, неполным окислением нафталина или бутана получают фталевый ангидрид.
Получение этилена путем дегидродимеризации метана.
Синтез этилена посредством дегидродимеризации позволяет превращать природный газ в более легко транспортируемые углеводороды. Реакцию 2CH4 + 2O2® C2H4 + 2H2O проводят при 850° С с использованием различных катализаторов; наилучшие результаты получены с катализатором Li-MgO. Предположительно реакция протекает через образование метильного радикала путем отщепления атома водорода от молекулы метана. Отщепление осуществляется неполностью восстановленным кислородом, например О22–. Метильные радикалы в газовой фазе рекомбинируют с образованием молекулы этана и в ходе последующего дегидрирования превращаются в этилен. Еще один пример неполного окисления – превращение метанола в формальдегид в присутствии серебряного или железомолибденового катализатора.
Цеолиты.
Цеолиты составляют особый класс гетерогенных катализаторов. Это алюмосиликаты с упорядоченной сотовой структурой, размер ячеек которой сравним с размером многих органических молекул. Их называют еще молекулярными ситами. Наибольший интерес представляют цеолиты, поры которых образованы кольцами, состоящими из 8–12 ионов кислорода (рис. 2). Иногда поры перекрываются, как у цеолита ZSМ-5 (рис. 3), который используется для высокоспецифичного превращения метанола в углеводороды бензиновой фракции. Бензин содержит в значительных количествах ароматические углеводороды и поэтому имеет высокое октановое число. В Новой Зеландии, например, с помощью этой технологии получают треть всего потребляемого бензина. Метанол же получают из импортируемого метана.
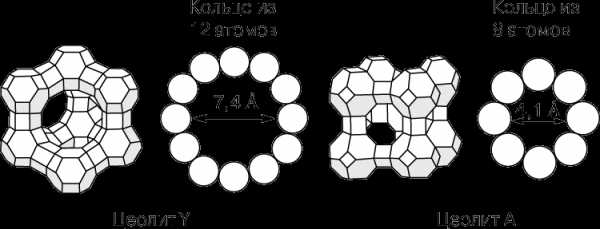

Катализаторы, составляющие группу Y-цеолитов, существенно повышают эффективность каталитического крекинга благодаря в первую очередь своим необычным кислотным свойствам. Замена алюмосиликатов цеолитами позволяет увеличить выход бензина более чем на 20%.
Кроме того, цеолиты обладают селективностью в отношении размера реагирующих молекул. Их селективность обусловлена размером пор, через которые могут проходить молекулы лишь определенных размеров и формы. Это касается как исходных веществ, так и продуктов реакции. Например, вследствие стерических ограничений пара-ксилол образуется легче, чем более объемные орто— и мета-изомеры. Последние оказываются «запертыми» в порах цеолита (рис. 4).
Применение цеолитов произвело настоящую революцию в некоторых промышленных технологиях – депарафинизации газойля и машинного масла, получении химических полупродуктов для производства пластмасс алкилированием ароматических соединений, изомеризации ксилола, диспропорционировании толуола и каталитическом крекинге нефти. Особенно эффективен здесь цеолит ZSM-5.
Катализаторы и охрана окружающей среды.
Применение катализаторов для уменьшения загрязнения воздуха началось в конце 1940-х годов. В 1952 А.Хаген-Смит установил, что углеводороды и оксиды азота, входящие в состав выхлопных газов, реагируют на свету с образованием оксидантов (в частности, озона), которые оказывают раздражающее действие на глаза и дают другие нежелательные эффекты. Примерно в это же время Ю.Хоудри разработал способ каталитической очистки выхлопных газов путем окисления CO и углеводородов до CO2 и Н2О. В 1970 была сформулирована Декларация о чистом воздухе (уточненная в 1977, расширенная в 1990), согласно которой все новые автомобили, начиная с моделей 1975, должны снабжаться каталитическими нейтрализаторами выхлопных газов. Были установлены нормы для состава выхлопных газов. Поскольку соединения свинца, добавляемые в бензин, отравляют катализаторы, принята программа поэтапного отказа от них. Обращалось внимание и на необходимость снижения содержания оксидов азота.
Специально для автомобильных нейтрализаторов созданы катализаторы, в которых активные компоненты нанесены на керамическую подложку с сотовой структурой, через ячейки которой проходят выхлопные газы. Подложку покрывают тонким слоем оксида металла, например Al2O3, на который наносят катализатор – платину, палладий или родий. Содержание оксидов азота, образующихся при сжигании природных топлив на теплоэлектростанциях, можно уменьшить добавлением в дымовые газы малых количеств аммиака и пропусканием их через титанованадиевый катализатор.
Ферменты.
Ферменты – это природные катализаторы, регулирующие биохимические процессы в живой клетке. Они участвуют в процессах энергообмена, расщеплении питательных веществ, реакциях биосинтеза. Без них не могут протекать многие сложные органические реакции. Ферменты функционируют при обычных температуре и давлении, обладают очень высокой селективностью и способны увеличивать скорость реакций на восемь порядков. Несмотря на эти преимущества, лишь ок. 20 из 15 000 известных ферментов применяются в широких масштабах.
Человек тысячелетиями использовал ферменты при выпечке хлеба, получении алкогольных напитков, сыра и уксуса. Сейчас ферменты применяются и в промышленности: при переработке сахара, получении синтетических антибиотиков, аминокислот и белков. Протеолитические ферменты, ускоряющие процессы гидролиза, добавляют в детергенты.
С помощью бактерий Clostridium acetobutylicum Х.Вейцман осуществил ферментативное превращение крахмала в ацетон и бутиловый спирт. Этот способ получения ацетона широко использовался в Англии во время Первой мировой войны, а во время Второй мировой войны с его помощью в СССР изготавливали бутадиеновый каучук.
Исключительно большую роль сыграло применение ферментов, продуцируемых микроорганизмами, для синтеза пенициллина, а также стрептомицина и витамина B12.
Этиловый спирт, получаемый ферментативным путем, широко используют в качестве автомобильного топлива. В Бразилии более трети из примерно 10 млн. автомобилей работают на 96%-ном этиловом спирте, получаемом из сахарного тростника, а остальные – на смеси бензина и этилового спирта (20%). Хорошо отработана технология производства топлива, представляющего собой смесь бензина и спирта, в США. В 1987 из зерен кукурузы было получено ок. 4 млрд. л спирта, из них примерно 3,2 млрд. л было использовано в качестве топлива. Разнообразное применение находят и т.н. иммобилизованные ферменты. Эти ферменты связаны с твердым носителем, например силикагелем, над которым пропускают реагенты. Преимущество этого метода состоит в том, что он обеспечивает эффективное контактирование субстратов с ферментом, разделение продуктов и сохранение фермента. Один из примеров промышленного использования иммобилизованных ферментов – изомеризация D-глюкозы во фруктозу.
ТЕХНОЛОГИЧЕСКИЕ АСПЕКТЫ
Современные технологии невозможно представить без применения катализаторов. Каталитические реакции могут протекать при температурах до 650° С и давлениях 100 атм и более. Это заставляет по-новому решать проблемы, связанные с контактированием между газообразными и твердыми веществами и с переносом частиц катализатора. Чтобы процесс был эффективным, при его моделировании необходимо учитывать кинетические, термодинамические и гидродинамические аспекты. Здесь широко используются компьютерное моделирование, а также новые приборы и методы контроля за технологическими процессами.
В 1960 был достигнут значительный прогресс в производстве аммиака. Применение более активного катализатора позволило понизить температуру получения водорода при разложении водяного пара, благодаря чему удалось понизить давление и, следовательно, уменьшить производственные затраты, например за счет применения более дешевых центробежных компрессоров. В результате стоимость аммиака упала более чем вдвое, произошло колоссальное увеличение его производства, а в связи с этим – увеличение производства пищевых продуктов, поскольку аммиак – ценное удобрение.
Методы.
Исследования в области катализа проводят с использованием как традиционных, так и специальных методов. Применяются радиоактивные метки, рентгеновская, инфракрасная и рамановская (КР) спектроскопия, электронно-микроскопические методы; проводятся кинетические измерения, изучается влияние способов получения катализаторов на их активность. Большое значение имеет определение площади поверхности катализатора по методу Брунауэра – Эммета – Теллера (метод БЭТ), основанному на измерении физической адсорбции азота при разных давлениях. Для этого определяют количество азота, необходимого для образования монослоя на поверхности катализатора, и, зная диаметр молекулы N2, вычисляют суммарную площадь. Помимо определения общей площади поверхности проводят хемосорбцию разных молекул, что позволяет оценить число активных центров и получить информацию об их свойствах.
В распоряжении исследователей имеются разные методы изучения структуры поверхности катализаторов на атомном уровне. Уникальную информацию позволяет получить метод EXAFS. Среди спектроскопических методов все шире применяются УФ-, рентгеновская и оже-фотоэлектронная спектроскопия. Большой интерес представляет масс-спектрометрия вторичных ионов и спектроскопия ионного рассеяния. Для исследования природы каталитических комплексов применяются измерения ЯМР. Сканирующий туннельный микроскоп позволяет увидеть расположение атомов на поверхности катализатора.
ПЕРСПЕКТИВЫ
Масштабы каталитических процессов в промышленности увеличиваются с каждым годом. Все более широкое применение находят катализаторы для нейтрализации веществ, загрязняющих окружающую среду. Возрастает роль катализаторов в производстве углеводородов и кислородсодержащих синтетических топлив из газа и угля. Весьма перспективным представляется создание топливных элементов для экономичного преобразования энергии топлива в электрическую энергию.
Новые концепции катализа позволят получать полимерные материалы и другие продукты, обладающие многими ценными свойствами, усовершенствовать методы получения энергии, увеличить производство пищевых продуктов, в частности путем синтеза белков из алканов и аммиака с помощью микроорганизмов. Возможно, удастся разработать генно-инженерные способы получения ферментов и металлоорганических соединений, приближающихся по своей каталитической активности и селективности к природным биологическим катализаторам.
www.krugosvet.ru
катализ — это… Что такое катализ?
КАТАЛИЗ — КАТАЛИЗ, катализаторы. Катал и з ат о р название, введенное в науку Бер целиусом (Berzelius; 1835) для обозначения веществ, к рые вызывают или ускоряют хим. процессы, не принимая в них видимого участия.Позднее Оствальд(СЫ а1с1)и его школа… … Большая медицинская энциклопедия
КАТАЛИЗ — (от греч. katalysis разрушение) ускорение химической реакции в присутствии веществ катализаторов, которые взаимодействуют с реагентами, но в реакции не расходуются и не входят в состав продуктов. При гомогенном катализе исходные реагенты и… … Большой Энциклопедический словарь
КАТАЛИЗ — КАТАЛИЗ, изменение скорости протекания химической реакции посредством добавки вещества КАТАЛИЗАТОРА, которое не участвует в реакции. Каталитическое воздействие позволяет прояснить механизм реакции; во многих промышленных процессах используют… … Научно-технический энциклопедический словарь
КАТАЛИЗ — (от греческого katalysis разрушение), ускорение химической реакции в присутствии вещества катализатора, который взаимодействует с реагентами, но в реакции не расходуется и не входит в состав конечных продуктов. Использование катализаторов… … Современная энциклопедия
КАТАЛИЗ — КАТАЛИЗ, катализа, муж. (от греч. katalysis роспуск) (хим.). Ускорение или замедление химической реакции под влиянием катализаторов. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
катализ — сущ., кол во синонимов: 4 • автокатализ (2) • биокатализ (1) • фотокатализ (1) … Словарь синонимов
КАТАЛИЗ — ускорение или замедление хим. реакции с помощью некоторых специфически действующих веществ (катализаторов), способных многократно вступать в кратковременное взаимодействие с реагирующими соединениями, облегчая течение реакции. Сущность действия… … Геологическая энциклопедия
катализ — а, м. catalyse f. <гр. katalysis прекращение. Изменение скорости химической реакции под влиянием некоторых веществ (катализаторов). БАС 1. Заимствовано из фр. яз. в 1837 г. Впервые фиксируется в Горном журнале 1837 г. (2 5 380) в переведенной… … Исторический словарь галлицизмов русского языка
катализ — — [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN catalysis … Справочник технического переводчика
катализ — – изменение скорости или возбуждение химической реакции веществами катализаторами. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Катализ — [гр. katalysis разрушение] явление увеличения скорости химических реакций в присутствии вещества, которое не претерпевает изменений в ходе реакции. [Ушеров Маршак А. В. Бетоноведение: лексикон. М.: РИФ Стройматериалы. 2009. – 112 с.]… … Энциклопедия терминов, определений и пояснений строительных материалов
dic.academic.ru
катализ — это… Что такое катализ?
КАТА́ЛИЗ -а; м. [от греч. katalysis — роспуск, разрушение] Хим. Возбуждение химической реакции или изменение её скорости под влиянием катализатора.
◁ Каталити́ческий, -ая, -ое. К-ая реакция. К-ая активность.
* * *
катали́з(от греч. katálysis — разрушение), ускорение химическая реакции в присутствии веществ — катализаторов, которые взаимодействуют с реагентами, но в реакции не расходуются и не входят в состав продуктов. При гомогенном катализе исходные реагенты и катализатор находятся в одной фазе (газовой или жидкой), при гетерогенном — газообразные или жидкие реагенты взаимодействуют на поверхности твердого катализатора. Катализ обусловливает высокие скорости реакций при небольших температурах, предпочтительное образование определенного продукта из ряда возможных. Каталитические реакции являются основой многих химико-технологических процессов (например, производства серной кислоты, некоторых полимеров, аммиака). Большинство процессов, происходящих в живых организмах, также являются каталитическими (ферментативными).
* * *
КАТАЛИЗКАТА́ЛИЗ (от греч. katalysis — разрушение), ускорение химической реакции в присутствии веществ — катализаторов, которые взаимодействуют с реагентами, но в реакции не расходуются и не входят в состав продуктов. При гомогенном катализе исходные реагенты и катализатор находятся в одной фазе (газовой или жидкой), при гетерогенном — газообразные или жидкие реагенты взаимодействуют на поверхности твердого катализатора. Катализ обусловливает высокие скорости реакций при небольших температурах; предпочтительно образование определенного продукта из ряда возможных. Каталитические реакции являются основой многих химико-технологических процессов (напр., производства серной кислоты, некоторых полимеров, аммиака). Большинство процессов, происходящих в живых организмах, также являются каталитическими (ферментативными).
Энциклопедический словарь. 2009.
dic.academic.ru
