А. Карбоновые кислоты / Биохимия
Жирными кислотами называются карбоновые кислоты с углеводородной цепью не менее 4 атомов углерода. Они присутствуют в организмах всех видов в виде сложных эфиров (например, с глицерином и холестерином) и служат структурными элементами жиров и мембранных липидов. Свободные жирные кислоты (сокращённо СЖК) присутствуют в организме в небольших количествах, например в крови.В таблице приведён ряд алифатических карбоновых кислот, обнаруженных в растительных и животных тканях. В высших растениях и животных содержатся главным образом жирные кислоты с длинной и неразветвлённой цепью из 16 и 18 углеродных атомов, а именно пальмитиновая и стеариновая. Все длинноцепочечные природные жирные кислоты состоят из чётного числа углеродных атомов, что обусловлено биосинтезом этих соединений из C2-предшественников (см. Питание. Органические вещества).
Многие жирные кислоты имеют одну или несколько двойных связей. К наиболее распространённым ненасыщенным кислотам относятся олеиновая и линолевая. Из двух возможных цис- и транс-конфигураций двойной связи (см. Углеводы) в природных липидах присутствует лишь цис-форма. Разветвлённые жирные кислоты встречаются только в бактериях. Для обозначения жирных кислот иногда применяют сокращённые названия, где первая цифра означает число углеродных атомов, вторая цифра указывает число двойных связей, а последующие — положение этих связей. Как обычно, нумерация атомов углерода начинается с наиболее окисленной группы (карбоксигруппа = C-1). Для этих целей используются также буквы греческого алфавита (α = C-2, β = C-3, ω = последний C-атом).
К наиболее распространённым ненасыщенным кислотам относятся олеиновая и линолевая. Из двух возможных цис- и транс-конфигураций двойной связи (см. Углеводы) в природных липидах присутствует лишь цис-форма. Разветвлённые жирные кислоты встречаются только в бактериях. Для обозначения жирных кислот иногда применяют сокращённые названия, где первая цифра означает число углеродных атомов, вторая цифра указывает число двойных связей, а последующие — положение этих связей. Как обычно, нумерация атомов углерода начинается с наиболее окисленной группы (карбоксигруппа = C-1). Для этих целей используются также буквы греческого алфавита (α = C-2, β = C-3, ω = последний C-атом).
На схеме приведено полное строение капроновой кислоты. Молекула в целом неполярна, исключение составляет карбоксигруппа. К незаменимым жирным кислотам относятся те из них, которые не синтезируются в организме и должны поступать с пищей. Речь идёт о сильно ненасыщенных кислотах, в частности арахидоновой (20:4;5,8,11,14), линолевой (18:2;9,12) и линоленовой (18:3;9,12,15). Арахидоновая кислота является предшественником эйкозаноидов (простагландинов и лейкотриенов) (см. Эйкозаноиды) и поэтому обязательно должна присутствовать в пищевом рационе. Линолевая и линоленовая кислоты, имеющие более короткую углеродную цепь, могут превращаться в арахидоновую за счёт наращивания цепи, и, следовательно, являются её заменителями.
Арахидоновая кислота является предшественником эйкозаноидов (простагландинов и лейкотриенов) (см. Эйкозаноиды) и поэтому обязательно должна присутствовать в пищевом рационе. Линолевая и линоленовая кислоты, имеющие более короткую углеродную цепь, могут превращаться в арахидоновую за счёт наращивания цепи, и, следовательно, являются её заменителями.
Статьи раздела «Жирные кислоты и нейтральные жиры»:
— Следущая статья | — Вернуться в раздел
Жирные кислоты также Карбоновые кислоты
Существует определенная связь между химическим строением и свойствами поверхностно-активных веществ — эмульгаторов. Так, соли карбоновых кислот (растворимые в воде) со щелочными металлами, аммиаком или аминами обычно способствуют образованию эмульсий типа масло в воде, а их кальциевые, магниевые или алюминиевые соли — эмульсий типа вода в масле. Сложные эфиры жирных кислот с полиспиртами (гликолями) также способствуют образованию эмульсий типа вода в масле.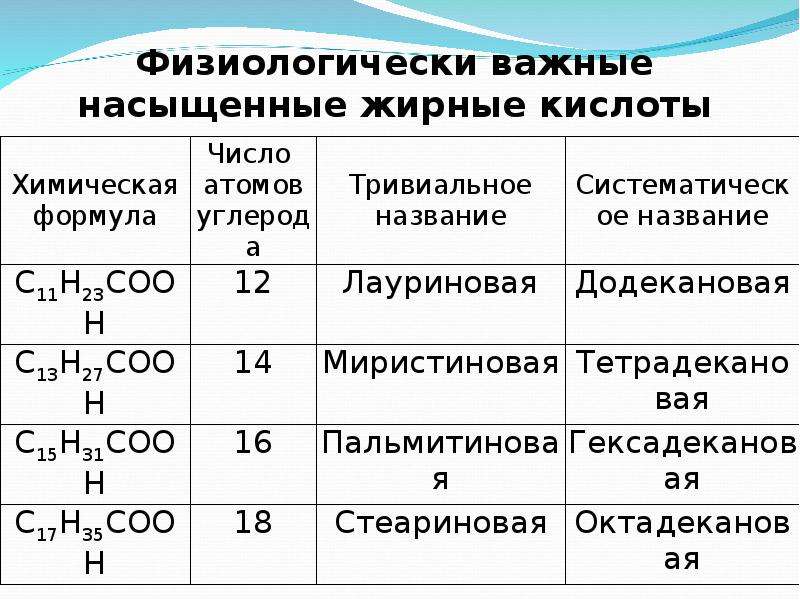 [c.336]
[c.336]
Свойства. Непредельные кислоты представляют собой или ЖИДКОСТИ, ИЛИ кристаллические вещества. Низшие кислоты растворимы в воде и обладают острым кислотным запахом. Кислоты этого ряда являются значительно более сильными кислотами (особенно те, у которых двойная связь находится рядом с карбоксильной группой), чем предельные жирные кислоты. Непредельные кислоты обладают всеми характерными свойствами органических кислот, т. е. способностью давать соли, хлорангидриды, ангидриды, сложные эфиры, амиды и прочие производные карбоновых кислот. Но, кроме того, наличие этиленовой связи придает этим кислотам способность вступать з свойственные этиленовым углеводородам реакции присоединения, а также способность легко расщепляться при реакциях окисления.
Жирные кислоты, пригодные для производства синтетических пищевых жиров, должны подвергаться особой очистке. В настоящее время длительными опытами точно установлено, что присутствующие в этих жирах кислоты с нечетным числом атомов углерода усваиваются человеческим организмом так же, как кислоты с четным числом поэтому нет никаких оснований удалять жирные кислоты с нечетным числом углеродных атомов из смеси синтетических жирных кислот.
Исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.), животные жиры, а также гидроксид натрия или кальцинированная сода.
Алифатические амины можно получать не только ранее упомянутым восстановлением нитропарафинов, но главным образом каталитическим гидрированием нитрилов. Поскольку при этом легко отщепляется ЫНд и образуется смесь первичных, вторичных и третичных аминов, гидрирование часто проводят в среде газообразного ЫНд в присутствии никелевого или кобальтового катализатора при 200—210°. В этих условиях образуются преимущественно первичные амины. Как известно, нитрилы легко получаются каталитической дегидратацией аммониевых солей жирных кислот. Для этого пары карбоновых кислот можно пропускать в смеси с избытком циркулирующего аммиака при 320—400° над катализатором, например силикагелем, фосфатом или окисью алюминия особенно эффективным катализатором является фосфат бора.
 Таким способом из уксусной кислоты получается ацетонитрил, из стеариновой кислоты—нитрил стеариновой кислоты, из адипиновой кислоты—нитрил адипиновой кислоты (выход его составляет всего 75%). Предложены новые пути получения нитрила адипиновой кислоты с лучшими выходами, например из ацетилена. Амины могут быть получены также непосредственно из кислот и аммиака на специальных катализаторах, в присутствии которых одновременно протекают дегидратация и гидрирование. [c.237]
Таким способом из уксусной кислоты получается ацетонитрил, из стеариновой кислоты—нитрил стеариновой кислоты, из адипиновой кислоты—нитрил адипиновой кислоты (выход его составляет всего 75%). Предложены новые пути получения нитрила адипиновой кислоты с лучшими выходами, например из ацетилена. Амины могут быть получены также непосредственно из кислот и аммиака на специальных катализаторах, в присутствии которых одновременно протекают дегидратация и гидрирование. [c.237] Исследуя кислоты, полученные при окислении парафиновых углеводородов изостроения, можно составить представление о пунктах окислительной атаки кислорода. Последний действует преимущественно на точку разветвления, иначе говоря, на третичный атом водорода, В результате отщепления боковых цепей образуются в основном кислоты с прямой цепью. Тем не менее парафины с сильно разветвленным угле- родным скелетом продолжают оставаться непонгодными для промышленных целей сырьем [42], При их окислении получают главным обраэом низкомолекулярные и более глубоко окисленные карбоновые кислоты с числом атомов углерода меньше 12, не говоря уже о значительных количествах кислот с разветвленным скелетом.
Окисление парафина воздухом при повышенных температурах значительно ускоряется в присутствии катализаторов [58, 59]. В качестве катализаторов применяют соли тяжелых металлов высших жирных кислот, а также высокомолекулярные спирты и кетоны, выделенные из продуктов окисления парафина. В этом случае окисление идет более глубоко, и в качестве основных продуктов реакции образуются карбоновые кислоты и нейтральные карбонильные соединения. [c.60]
Нафтеновые кислоты представляют собой карбоновые кислоты циклического строения и являются производными главным образом цикланов, в частности, пятичленных. В некоторых нефтях существуют нафтеновые кислоты би-, три- и тетра-циклического строения, а по данным А. Е. Чичибабина также карбоновые кислоты жирного ряда. [c.36]
Е. Чичибабина также карбоновые кислоты жирного ряда. [c.36]
Выбор между схемами 4 и 5 определяется требованиями к качеству товарных жирных кислот, качество которых жестко нормировано по двум показателям массовой доле смоляных кнслот н неомыляемых веществ. При отборе жирно-кислотной фракции из низа третьей колонны, как это предусмотрено схемой 5, в этом целевом продукте концентрируются смоляные кислоты, приходящие с исходной смесью в колонну, а также труднолетучие неомыляемые вещества, в том числе ангидриды кислот. Кроме того, в продуктах содержится некоторое остаточное количество легколетучих неомыляемых веществ, основная часть которых отбирается с легким маслом из верха той же колонны. Попытки снижения массовой доли смоляных кислот в жирно-кислотной фракции за счет интенсификации разделения во второй колонне путем увеличения высоты колонны, флегмового числа, подвода теплоты в испаритель неизбежно приводят к усилению термической деструкции компонентов в этой колонне.
В этой главе описывается разделение низших карбоновых и среднемолекулярных жирных кислот (разделению высших жирных кислот посвящена гл. 26), а также ди- и трикарбоновых кислот и кетокислот (алифатических, ароматических и циклических).
 Однако механизмы разделения не позволяют провести более детальную классификацию внутри классов в соответствии с различными типами соединений и, следовательно, более удобна классификация, основанная на различных механизмах разделения (1). В большинстве работ, рассматриваемых в этой главе, фактически все типы кислот, которые встречаются в смесях, разделялись одним из нижеописанных методов. Разделение сахарных кислот детально обсуждалось в главе, посвященной углеводам (гл. 22). В этой главе обсуждаются только те работы, в которых описано хроматографическое разделение смесей сахарных с другими типами кислот.
Однако механизмы разделения не позволяют провести более детальную классификацию внутри классов в соответствии с различными типами соединений и, следовательно, более удобна классификация, основанная на различных механизмах разделения (1). В большинстве работ, рассматриваемых в этой главе, фактически все типы кислот, которые встречаются в смесях, разделялись одним из нижеописанных методов. Разделение сахарных кислот детально обсуждалось в главе, посвященной углеводам (гл. 22). В этой главе обсуждаются только те работы, в которых описано хроматографическое разделение смесей сахарных с другими типами кислот. Введение галоида в жирные кислоты не вызывает коренного изменения типа соединения, как это установил Дюма еще в 1839 г. Однако галоидированные жирные кислоты, особенно содержащие галоид в а-положении к карбоксильной группе, все же обладают значительно повышенной кислотностью. Это является, как мы уже указывали выше (см. стр. 146), следствием индуктивного эффекта заместителя.
Некоторые из кислот, содержащихся в нефтях, в частности низшие жирные кислоты, могут, конечно, образоваться из углеводородов в процессах добычи, хранения и переработки нефти. Однако, как показали многочисленные исследования карбоновых кислот, выделенных из нефтепродуктов и из сырых нефтей, большая часть нефтяных кислот уже содержится в сырой нефти следовательно, они образовались из первичного материнского вещества (растительного и животного происхождения), из которого возникла и основная часть нефти — нефтяные углеводороды.
Над специальными катализаторами синтезы углеводородов можно проводить и при очень высоких давлениях. Так, например, над Ru-катализатором можно получать твердые парафины с молекулярным весом до 23 ООО и т. пл. до 133° (стр. 692). Такие парафины либо применяют как очень хороший изолирующий материал, либо путем окислительного крекинга превращают в твердые жирные карбоновые кислоты для мыл. Так называемый изосинтез (стр. 694) проводят при 450 и 300 ат. Некоторые Fe-катализаторы также работают при 100—300 ат. [c.687]
В реакционной воде, составляющей почти 50% от жидких углеводородов, содержится 1,5—2% кислородсодержащих соединений спирты, альдегиды и кетоны, а также жирные карбоновые кислоты (от уксусной до ундециловой). [c.688]
[c.688]
При синтезах, которые должны были бы привести к образованию (-оксикарбоновых кислот, часто вместо них получаются непосредственно 7-лактоны например, лактоны образуются при восстановлении 7-кето-карбоновых кислот и циклических ангидридов кислот амальгамой натрия в кислом растворе, а также при кипячении -(-галоидзамещенных жирных кислот с водой [c.325]
Желчные кислоты 867, 870, 871, 872 Женевская номенклатура 28, 29, 59, 76, 108, 109, 240 Жирные кислоты 38, 84, 238 и сл. см. также Карбоновые кислоты высшие 252 и сл. [c.1174]
В качестве исходного органического сырья в этих процессах конденсации используются главным образом замещенные и незамещенные ароматические углеводороды (бензол, толуол, хлорбензол и т. д.), а также ангидриды и хлорангидриды карбоновых кислот жирного и ароматического ряда. Конденсирующим реагентом в этих процессах служит безводный хлористый алюминий, по возможности не содержащий примесей.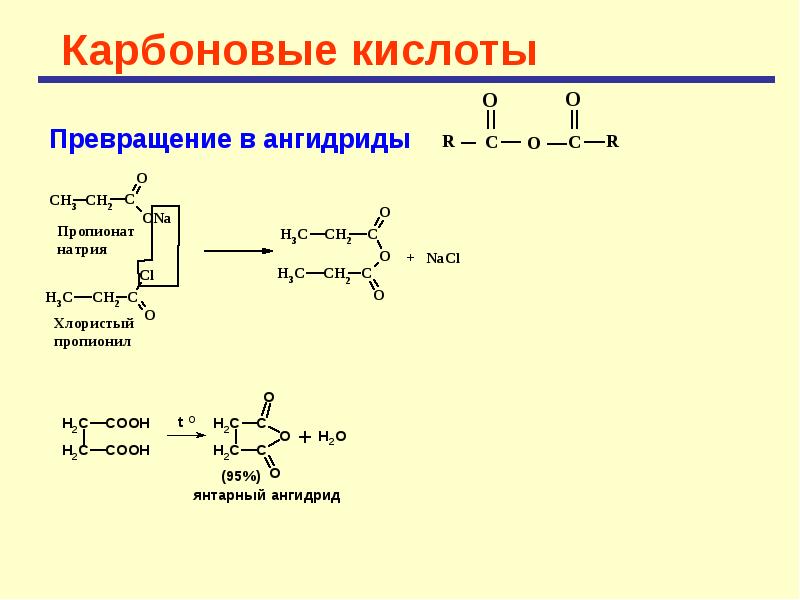 [c.342]
[c.342]
Исследования обнаружили также наличие в обычных нафтеновых кислотах значительных количеств карбоновых кислот парафинового ряда. Так, Танака и Кувата установили присутствие пальмитиновой, стеариновой, миристиновой и арахиновои кислот в нафтеновых кислотах, выделенных из одной японской нефти, причем количество жирных кислот составляло около / от общего веса кислот. Жирные карбоновые кислоты были обнаружены также в советских нефтях, в частности в низкокипящих фракциях бакинских нафтеновых кислот. [c.28]
Номенклатура. Алифатические карбоновые кислоты называются часто жирными кислотами, так как многие средние и высшие члены этого ряда встречаются в жирах и были из последних выделены Большинство карбоновых кислот имеет тривиальные названия (муравь иная кислота, уксусная кислота, масляная кислота, стеариновая кис лота и т. д.). Можно, конечно, рассматривая кислоты как карбоксиль ные производные углеводородов, дать им также названия метанкарбо новая кислота СН3СООН, этанкарбоновая кислота С2Н5СООН и т. д [c.239]
д [c.239]
Производные пиридина встречаются в природе, и о некоторых из них пойдет речь в т. 2, разд. 17.5 и 17.7. Мы, однако, можем сразу же отметить тот факт, что очень важный биохимический окислительно-восстановительный процесс включает четвертичную соль амида никотиновой кислоты (никоти-намид, витамин РР). Биохимики называют это сложное соединение НАД (со-кращенпе от дкотиндмидаденинЗинуклеотид), и оно, вместе с подобным ему веществом Н А ДФ, играет значительную роль в процессах клеточного дыхания, фотосинтеза, синтеза карбоновых кислот с длинной углеродной цепью ( жирных кислот ), а также в процессе зрения. Ниже представлена схема процесса превращения НАД в его восстановленную форму. Заметьте, что окислительно- [c.635]
Тесная связь строения углеводородной и кислотной частей нефти с близким числом атомов углерода в молекуле проявлялась также и в том, что содержание нафтеновых кислот повышается при переходе от нефтей менее цикличных, т. е. парафинистых, к нефтям нафтенового основания. Появилось значительное число экспериментальных данных, свидетельствующих о том, что среди кислот, выделенных из бензино-керосиновых фракций, присутствуют наряду с нафтеновыми кислотами низшие гомологи (С —С7) жирных кислот. Содержание этих кислот в нефтях значительно меньше, чем нафтеновых кислот, причем с увеличением молекулярных весов нефтяных фракций оно снижается точно так же, как снижается и доля парафиновых углеводородов в этих фракциях. Жирные кислоты никак нельзя было подвести под определение нафтеновые кислоты, поэтому еще Аскан предложил в качестве общего понятия, охватывающего все выделяемые из нефти карбоновые кислоты, ввести понятие более широкое, а именно нефтяные кислоты. Это предложение Аскана позже было поддержано Гурвичем. Что касается часто употребляемого названия нефтяные кислоты ( Ре1го1заиге ), — пишет Гурвич, то, по предложению Аскана, его следует оставить для обозначения вообще всех кислот, встречающихся в нефти, а в ней, кроме нафтеновых, попадаются, хотя и в небольших количествах, и некоторые кислоты жирного ряда муравьиная, уксусная и т.
е. парафинистых, к нефтям нафтенового основания. Появилось значительное число экспериментальных данных, свидетельствующих о том, что среди кислот, выделенных из бензино-керосиновых фракций, присутствуют наряду с нафтеновыми кислотами низшие гомологи (С —С7) жирных кислот. Содержание этих кислот в нефтях значительно меньше, чем нафтеновых кислот, причем с увеличением молекулярных весов нефтяных фракций оно снижается точно так же, как снижается и доля парафиновых углеводородов в этих фракциях. Жирные кислоты никак нельзя было подвести под определение нафтеновые кислоты, поэтому еще Аскан предложил в качестве общего понятия, охватывающего все выделяемые из нефти карбоновые кислоты, ввести понятие более широкое, а именно нефтяные кислоты. Это предложение Аскана позже было поддержано Гурвичем. Что касается часто употребляемого названия нефтяные кислоты ( Ре1го1заиге ), — пишет Гурвич, то, по предложению Аскана, его следует оставить для обозначения вообще всех кислот, встречающихся в нефти, а в ней, кроме нафтеновых, попадаются, хотя и в небольших количествах, и некоторые кислоты жирного ряда муравьиная, уксусная и т. д. под нафтеновыми же следует подразумевать исключительно карбоновые кислоты, производящиеся от нафтеновых углеводородов [14]. Наметкин нефтяными кислотами называет кислоты, выделяемые из нефти щелочной обработкой, хотя он тут же подчеркивает И по составу и по свойствам нефтяные кислоты вполне соответствуют нафтеновым кислотам, т. е. синтетическим кислотам, являющимся производными нафтенов [15]. [c.310]
д. под нафтеновыми же следует подразумевать исключительно карбоновые кислоты, производящиеся от нафтеновых углеводородов [14]. Наметкин нефтяными кислотами называет кислоты, выделяемые из нефти щелочной обработкой, хотя он тут же подчеркивает И по составу и по свойствам нефтяные кислоты вполне соответствуют нафтеновым кислотам, т. е. синтетическим кислотам, являющимся производными нафтенов [15]. [c.310]
Роль ангидрида и соли кислоты в этой реакции оценивается различно. Первоначально считали более вероятным, что ангидрид нужен лишь для отнятия воды и что реагирующим веществом является только соль жирной кислоты. Более поздними работами было показано важное значение ангидрида кислоты, который и является, как полагал еще Перкин, активным участником конденсации. Оказалось возможным заменить соль другими веществами, не имеющими ничего общего с карбоновыми кислотами и играющими, как и соль кислоты, роль катализаторов в этом процессе конденсации. Такими катализаторами являются третичные основания пиридин, хинолин и т. п., а также щелочнореагирующие соли, например поташ. Действие катализаторов, повидимому, заключается в энолизации ангидрида кислоты или пр0дукт днца 1ин ния его к ароматическому альдегиду [c.718]
п., а также щелочнореагирующие соли, например поташ. Действие катализаторов, повидимому, заключается в энолизации ангидрида кислоты или пр0дукт днца 1ин ния его к ароматическому альдегиду [c.718]
Аналогичную полярно-неполярную структуру с длинными алкильными цепями на одном конце молекул имеют и антикоррозионные добавки к смазочным маслам. Как и влияние ингибиторов коррозии, добавляемых к кислоте при травлении стали, эффективность этих веществ обусловлена адсорбцией их поверхностью металла, так что многие из соединений, используемых в качестве добавок для высоких давлений, могут выполнять также функцию ингибиторов коррозии, и наоборот. В качестве таких веществ были предложены следующие типы соединения соли тяжелых металлов алкилированных моноамидов фталевой и янтарной кислот, соли высших алкиламинов и фосфорной кислоты или кислые алкилфосфаты, металлические соли алкилтио-фосфорных кислот, соли тяжелых металлов растворимых в масле нефтяных сульфокислот, диалкил фенол сульфиды, соли высших аминов жирных кислот и нафтеновых кислот, алкилированные ароматические карбоновые кислоты, а также металлические соли алкилированных фенолов [10].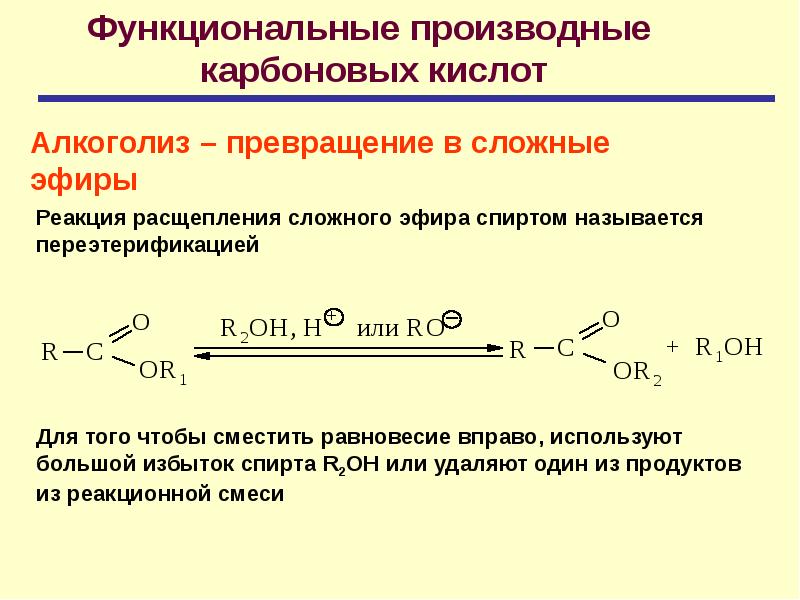 [c.485]
[c.485]
Амиды низших жирных кислот не являются подходящими производными при работе с микро- и полумикроколичествами. Помимо их заметной растворимости в водно-спиртовых смесях, приготовление этих производных аммонолизом в воде сопровождается потерями вследствие гидролиза галоид-ангидрида. Аммонолиз в безводной среде приводит к потерям при выделении и очистке. п-Толуидиды и анилиды являются более подходящими производными. п-Толуидиды карбоновых кислот, имеющих менее 8 атомов углерода в цепи, можно получить, нагревая кислоту с /г-толуидином. Для характеристики жирных кислот, имеющих более 10 атомов углерода в цепи, рекомендуются диамиды, образующиеся при реакции с 4,4 -диаминодифенил-метаном. Среди замещенных амидов следует отметить 2-алкилбензимидазолы [216—218], образующиеся путем конденсации карбоновых кислот с о-фе-нилендиамином. К этой группе можно отнести также фенилгидразиды КСОЫНЫНСвНй, однако они рассматриваются в следующем разделе при обсуждении солей фенилгидразина.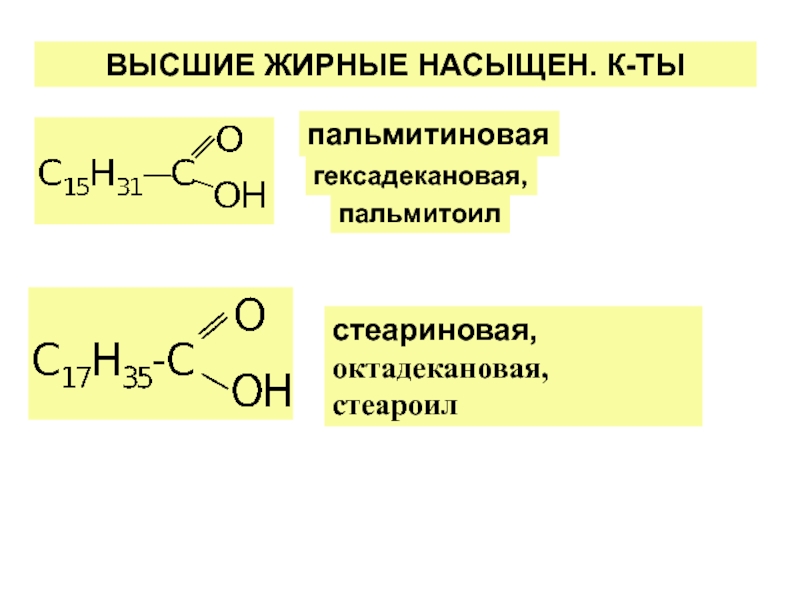 [c.448]
[c.448]
Отдельную группу составляют алкиламины карбоновых кислот (например, триэтаноламиннафтенат), являющиеся уже катионоактивными или электроней-тральными ПАВ. Эти ПАВ широко используются как эмульгаторы, а также как смачиватели и диспергаторы. К этому типу примыкают ПАВ, являющиеся четвертичными аммониевыми солями жирных кислот. [c.57]
Многие карбоновые кислоты успешно поддаются декарбоксилированию, либо в свободном виде, либо в виде солей, однако это не распространяется на простые жирные кислоты [350]. Исключение составляет уксусная кислота, которая в виде ацетата при нагревании с основанием с хорошим выходом дает метан. Декарбоксилированию успешно подвергаются те алифатические кислоты, которые содержат определенные функциональные группы, а также двойную или тройную связь в а- или -положении. Некоторые из них приведены в табл. 12.2. Декарбоксилирование ароматических кислот см. реакцию 11-41. При декарбоксилировании а-цианокислот могут образовываться или нитрилы, или карбоновые кислоты в зависимости от того, гидролизуется или нет цианогруппа в ходе реакции. Помимо соединений, перечисленных в табл. 12.2, декарбоксилирование можно провести для а,р-ненасыщенных и а,р-ацетиленовых кислот. Декарбоксилирование а-галогенозамещенных кислот сопровождается элиминированием [351] [c.469]
Помимо соединений, перечисленных в табл. 12.2, декарбоксилирование можно провести для а,р-ненасыщенных и а,р-ацетиленовых кислот. Декарбоксилирование а-галогенозамещенных кислот сопровождается элиминированием [351] [c.469]
Хлорфенолы и другие хлорсодержащие соединения, жирные спирты и карбоновые кислоты, красители, ПАВ, серусодержащие соединения, цианиды, нитриты также окисляются пероксидом водорода или реактивом Фентона. Деструкция таких органических веществ, как полимерные материалы, протекает в результате автокаталитических реакций с кислородом, инициируемых катализаторами. Скорость деградации полимера в значительной степени зависит от его структуры. Окислительная деструкция протекает по механизму цепной реакции. Автоокисление инициирует образование радикалов, продолжение цепи, при этом кислород взаимодействует со свободным радикалом полимера с образованием гидропероксидов. В результате обрыва цепи образуются нереакционные продукты. Соединения металлов и Н2О2 могут ускорять автоокисление.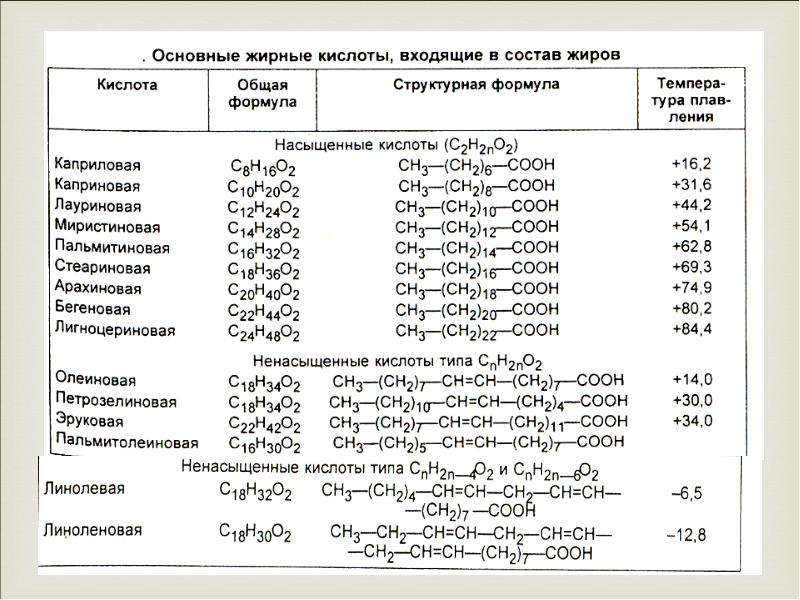 Вследствие разрыва достаточно большого количества связей в полимерных материалах образуются низкомолекулярные продукты, которые поступают в окружающую среду. [c.293]
Вследствие разрыва достаточно большого количества связей в полимерных материалах образуются низкомолекулярные продукты, которые поступают в окружающую среду. [c.293]
Кислые сточные воды производства синтетических жирных кислот содержат до 207о низкомолекулярных кислот (муравьиной, уксусной, пропиоповой и масляной), а также соединения эфирного и карбонильного характера, примеси высокомолекулярных карбоновых кислот, нейтральные соединения. [c.165]
Основными достоинствами анионных моющих веществ, содержащих гидрофильные сульфогруппы (кислые сложиЬю эфиры серной кислоты, алкилсульфо- и алкиларилсуль-фокислоты), являются большая растворимость в воде их кальциевых и магниевых солей, чем растворимость солей карбоновых кислот этих же металлов. Это позволяет использовать их в жесткой воде, так как образующиеся соли не мешают процессу мойки. Стабильность этих соединений в кислой среде также больше, чем стабильность солей карбоновых кислот, которые представляют собою соли слабых кислот и сильных оснований. (При использовании мыл карбоновых кислот в кислых средах выделяются жирные кислоты, оставляя пятна на очищаемых волокнах. Карбоновые мыла гидролизуют-также отрицательно влияет на во- [c.336]
(При использовании мыл карбоновых кислот в кислых средах выделяются жирные кислоты, оставляя пятна на очищаемых волокнах. Карбоновые мыла гидролизуют-также отрицательно влияет на во- [c.336]
Нафтеновые кислоты представляют собой карбоновые кислоти циклического строения, главным образом производные пятичленных нафтеновых углеводородов. В отдельных нефтях найдены би-, три- и тетрациклические нафтеновые кислоты, а также и карбоновые кислоты жирного ряда. Содержание нафтеновых кислот в нефтях невелико. Наименьшее количество нафтеновых кислот содержится в парафинистых нефтях и их фракциях, наибольшее — в смолистых нефтях. В Советском Союзе наибольшее количество нафтеновых кислот найдено в нефтях о-ва Сахалин (4,8 вес. % в одоптинскон и 2,8 вес. % в горской), в нефтях Азербайджана (1,67 вес. % в балаханской, 1,34 вес. % в бинагадинской и 0,3 вес. % в биби-эйбатской), Северного Кавказа (1,0 вес. % в грозненской беспарафиновой) и Эмбы (0,8 вес. % в доссорской). Распределение нафтеновых кислот по фракциям крайне неравномерно.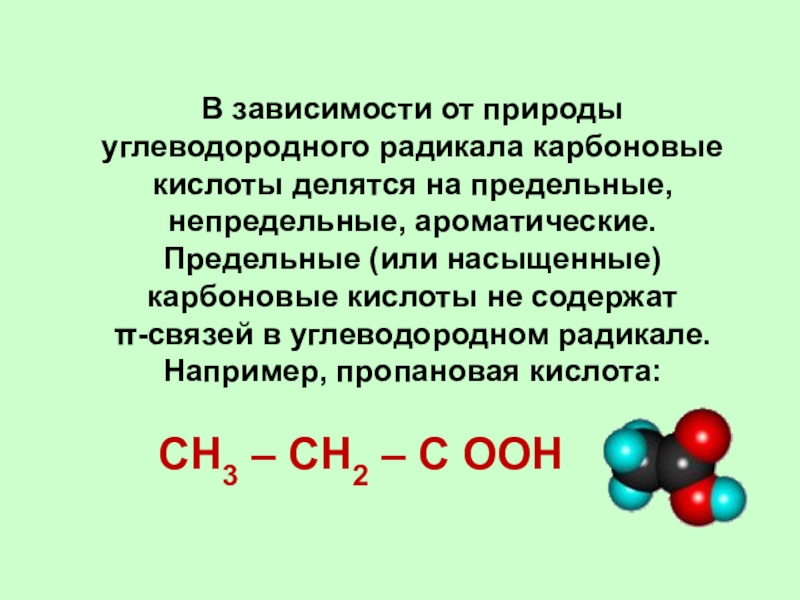 Преимущественно они сосредоточены в легких и средних газойлевых фракциях, значительно беднее ими бензино-керосиновые и тяжелые дистилляты. [c.31]
Преимущественно они сосредоточены в легких и средних газойлевых фракциях, значительно беднее ими бензино-керосиновые и тяжелые дистилляты. [c.31]
Несмотря на то, что практическое значение простых алифатических сульфокислот в настоящее время сравнительно невелико, они хорошо описаны в литературе, и некоторые из их производных являются интересными с промышленной точки зрения. Наибольшее внимание было уделено исследованию производных метана, этана и карбоновых кислот. Эфиры, полученные из жирных кислот и 2-01 иэтан-1-сульфокислоты (изэтионовой кислоты), а также амиды 2-амипоэтан-1-сульфокислоты (таурина) нашли применение в качестве детергентов и смачивающих агентов. Сульфокислоты присутствуют в некотором количестве в сульфированных маслах , используемых для различных целей в текстильной промышленности. Строение продуктов сульфирования такого типа в большинстве случаев неизвестно, в связи с чем эта область богата интересными возможностями для исследования. Существующие данные носят главным образом эмпирический характер, и представляется затруднительным отличить факты от предположений в обширной патентной литературе. [c.105]
[c.105]
В качестве противокоррозионных присадок к бензинам предложены высшие жирные кислоты и их олигомеры, простые и сложные эфиры, некоторые комплексные соли высших жирных и нафтеновых кислот и аминов или амидов. Используются также среднемолекулярные сульфонаты двухвалентных металлов кальция, магния, бария. Однако сульфонаты обладают повышенной зольностью, увеличивающей износ деталей двигателя. Поэтому предпочтение отдается беззольным присадкам, к которым относятся смешанные соли карбоновых кислот, диаминов и ароматических сульфокислот, алкилянтарные кислоты, нит- [c.373]
Однако возможно также прогоркание жиров под влиянием бактерий и плесневых грибков. Этому разлол ению подвергаются и жиры, содержащие насыигенные жирные кислоты. Плесневые грибки действуют на насыщенные карбоновые кислоты, расщепляя их по принципу р-окнсления, причем здесь, по-видимому, не образуется -окси-кислот в качестве промежуточных продуктов, как при классическом 3-окислении (стр. 245), поскольку -оксикислоты не превращаются в кетоны при действии плесневых грибков [c.270]
245), поскольку -оксикислоты не превращаются в кетоны при действии плесневых грибков [c.270]
А. И кетоны называют также оксосо-единениями. По старой (тривиальной) номенклатуре названия А. производят от названий соответствующих карбоновых кислот, которые могут образоваться в результате окисления А муравьиный А., или формальдегид,— простейший член ряда жирных А.— соответствует муравьиной кислоте, уксусный А., или ацетальдегид,— уксусной кислоте и т. д. По современной научной международной номенклатуре названия производят от названий предельных углеводородов с тем же строением углеродного скелета и окончанием -ал(-аль) Н—СНО — метаналь, СНд—СНО — эта-наль и т. д. Наиболее распространенные методы получения А.— окисление первичных спиртов или восстановление производных кислот. Промышленное значение имеет синтез ацетальдегида, в основе которого лежит реакция Кучеро-ва — присоединение воды к ацетилену в присутствии солей ртути (И) [c.20]
Окисление углеводородов. Этот метод получения карбоновых кислот представляет большой практический интерес, так как углеводороды являются доступным сырьем. Непредельные углеводороды, как известно (стр. 73), могут легко окисляться с распадом молекулы по месту двойной связи в качестве продуктов окисления при этом получаются и кислоты. Предельные углеводороды окисляются также с распадом молекулы, но значительно труднее, причем разрыв углеродной цепи может происходить в различных ее местах поэтому в результате образуются сложные смеси карбоновых кислот. В настоящее время разработано каталитическое окисление предельных углеводородов кислородом воздуха при умеренных температурах при этом наблюдается значительно меньший распад цепей и образуются главным образом высшие жирные кислоты. Так, из высокомолекулярных углеводородов нефти (пара(1зина) получают высшие жирные кислоты (стр. 54). [c.162]
Этот метод получения карбоновых кислот представляет большой практический интерес, так как углеводороды являются доступным сырьем. Непредельные углеводороды, как известно (стр. 73), могут легко окисляться с распадом молекулы по месту двойной связи в качестве продуктов окисления при этом получаются и кислоты. Предельные углеводороды окисляются также с распадом молекулы, но значительно труднее, причем разрыв углеродной цепи может происходить в различных ее местах поэтому в результате образуются сложные смеси карбоновых кислот. В настоящее время разработано каталитическое окисление предельных углеводородов кислородом воздуха при умеренных температурах при этом наблюдается значительно меньший распад цепей и образуются главным образом высшие жирные кислоты. Так, из высокомолекулярных углеводородов нефти (пара(1зина) получают высшие жирные кислоты (стр. 54). [c.162]
Из электрохимических производств, основанных на использовании электролиза для проведения окислительных или восстановительных реакций, можно назвать электрохимическое окисление Na l в Na lOa производство перхлоратов окислением хлоратов электрохимическое получение хлорной кислоты при обессоливании морской и минерализованных вод электролизным методом получение диоксида хлора и т. д. В органической химии процессы электролиза используются в реакциях катодного восстановления нитросоединений, иминов, имидоэфиров, альдегидов и кетонов, карбоновых кислот, сложных эфиров, а также в реакциях анодного окисления жирных кислот и их солей, ненасыщенных кислот ароматического ряда, ацетилирова-ния, алкилирования и др. [c.357]
д. В органической химии процессы электролиза используются в реакциях катодного восстановления нитросоединений, иминов, имидоэфиров, альдегидов и кетонов, карбоновых кислот, сложных эфиров, а также в реакциях анодного окисления жирных кислот и их солей, ненасыщенных кислот ароматического ряда, ацетилирова-ния, алкилирования и др. [c.357]
5.3.3. Олигоэфиры, модифицированные синтетическими жирными кислотами с линейной и a-разветвленной цепью
Синтетические жирные кислоты, относящиеся к этой группе, — предельные одноосновные карбоновые кислоты.
Насыщенные кислоты в последние годы все шире применяются для модификации алкидов. Это объясняется более высокой светостойкостью покрытий на их основе. Для модификации алкидов используют синтетические жирные кислоты с линейной и разветвленной цепью. Синтетические жирные кислоты с линейной цепью – продукты окисления парафинов, представляющие собой смесь кислот с различным числом атомов углерода. В промышленности их выпускают в виде фракций, например С10-С13, С10-С16. Данные о составе этих фракций приведены в табл. 4.
Данные о составе этих фракций приведены в табл. 4.
Таблица 4. Состав промышленно выпускаемых фракций синтетических жирных кислот
| Кислота | Содержание фракции С10 — С13, % | Содержание фракции С10-С16, % |
| Каприловая (С8) | 0,2 | 3,4 |
| Пеларгоновая (С9) | 7,0 | 10,3 |
| Каприновая (С10) | 14,0 | 11,1 |
| Ундекановая (С11) | 25,5 | 14,8 |
| Лауриновая (С12) | 27,1 | 14,2 |
| Тридексеновая (С13) | 18,7 | 14,3 |
| Миристиновая (С14) | 7,5 | 11,3 |
| Пентадекановая (С15) | — | 8,9 |
| Пальмитиновая (С15) | — | 8,1 |
| Маргариновая (С17) | — | 3,4 |
Жирные кислоты такого типа в промышленности называют СЖК.
Синтетические жирные кислоты с a-разветвленной цепью можно получать теломеризацией этилена или других a-олефинов при участии кислот, инициируемой пероксидами. Образование a-разветвленных кислот по этому методу обусловлено перегруппировкой радикалов с 1,5-миграцией водорода по схеме
перегруппировка
Кислоты, полученные по этой схеме, обычно содержат от девяти до пятнадцати атомов углерода. Их называют высшими изомерными карбоновыми кислотами (ВИКК).
Другой метод получения a-разветвленных кислот – оксосинтез: карбоксилирование олефинов оксидом углерода и водой в присутствии кислых катализаторов:
Этим методом получают a-разветвленную кислоту С10.
СЖК используют для модификации алкидов как в сочетании с растительными маслами, так и без них. На основе a-разветвленных кислот преимущественно синтезируют безмасляные алкиды.
Олигоэфиры, модифицированные СЖК. С целью уменьшения доли дефицитных растительных масел в составе алкидов часть их заменяют СЖК. Одновременно это улучшает свето — и атмосферостойкость получаемых продуктов. Как правило, такие алкиды сохраняют способность к высыханию за счет окислительной полимеризации остатков непредельных жирных кислот растительных масел, входящих в их состав. Синтез алкидов, одновременно модифицированных СЖК и растительными маслами, проводят комбинированным методом. Он включает элементы жирнокислотного и глицеридного методов. Процесс ведут в две стадии:
Одновременно это улучшает свето — и атмосферостойкость получаемых продуктов. Как правило, такие алкиды сохраняют способность к высыханию за счет окислительной полимеризации остатков непредельных жирных кислот растительных масел, входящих в их состав. Синтез алкидов, одновременно модифицированных СЖК и растительными маслами, проводят комбинированным методом. Он включает элементы жирнокислотного и глицеридного методов. Процесс ведут в две стадии:
1) на первой стадии проводят одновременно реакции алкоголиза растительного масла многоатомным спиртом и частичную этерификацию свободных гидроксильных групп СЖК;
2)
на второй – осуществляют взаимодействие полученных продуктов с фталевым ангидридом и поликонденсацию:
Масло СЖК
(поликонденсация) Олигомер
Алкиды, в состав которых входят растительные масла и СЖК, применяют для тех же целей, что и рассмотренные выше алкиды, модифицированные растительными маслами. Они так же могут быть органорастворимыми и водоразбавляемыми.
Они так же могут быть органорастворимыми и водоразбавляемыми.
Безмасляные, модифицированные СЖК алкиды не способны к окислительной полимеризации и поэтому используются, в основном, в композициях с меламиноформальдегидными олигомерами для покрытий горячего отверждения. Их синтез осуществляется жирнокислотным способом в одну или две стадии.
Олигоэфиры, модифицированные a-разветвленными кислотами. Мы уже знаем, что с использованием a-разветвленных кислот получают исключительно безмасляные алкиды. Их применяют для получения полиуретановых и алкидно-меламиновых лакокрасочных материалов, содержащих до 70% основного вещества. Покрытия, в состав которых входят алкиды с a-разветвленными кислотами, обладают хорошими декоративными свойствами.
Известно, что разветвления углеродной цепи в a-положении приводят к значительному снижению реакционной способности карбоновых кислот. Низкая реакционная способность этих кислот привела к появлению оригинального способа их введения в структуру алкидного полимера – через глицидиловые эфиры:
, где R – остаток a-разветвленной кислоты.
Иногда используют и обычный жирнокислотный метод получения этих алкидов, однако процесс в этом случае ведут при более высокой температуре (240°С вместо 210°С), что отражается на качестве получаемых продуктов.
Синтез алкидов через глицидиловые эфиры проводят азеотропным способом с постадийной загрузкой фталевого ангидрида и глицидилового эфира. На первой стадии протекают следующие реакции:
— взаимодействие полиатомного спирта с фталевым ангидридом, приводящее к образованию неполных кислых эфиров:
— этерификация свободных карбоксильных групп глицидиловым эфиром и гомополиконденсация образующегося продукта:
(продукт 1)
Продукт (1) ®(гомополиконденсация):
Процесс на этой стадии ведут при постепенном повышении температуры от 150 до 210°С.
На второй стадии полученный олигомер обрабатывают фталевым ангидридом и глицидиловым эфиром при 150°С; при этом образуется продукт структуры
Такой метод синтеза позволяет получать алкидные олигомеры регулярной структуры с упорядоченным расположением гидроксильных групп и модифицирующих остатков в макромолекуле, что способствует в дальнейшем более полному отверждению этих алкидов в полиуретановых и алкидно-меламиновых композициях.
Для получения алкидноуретановых материалов используются олигомеры с очень низким кислотным (2-3) и высоким гидроксильным (180-240 мг КОН/г) числами. Выпускаются они в виде 50%-ных растворов в циклогексаноне или этилацетате.
Для применения в алкидно-меламиновых материалах синтезируют алкиды с кислотным числом от 6 до 17, а гидроксильным — от 60 до 100 мг КОН/г. Выпускают их в виде лаков с высоким содержанием основного вещества (60-70%-ные растворы в смеси сольвента и ксилола).
Где применяется карбоновая кислота? | Новости и статьи ООО ДХЗ
Опубликовано: 08.02.2022 Время чтения: 3 минуты 168
Как известно концентрированная уксусная кислота относится к карбоновым (жирным) кислотам. Жирные кислоты представляют собой обширный класс определяемых веществ, который постоянно изучается в течение многих лет. Для удобства жирные кислоты подразделяют натри группы: с короткой цепью (длина цепи < С12 с длинной цепью (С12-С24) и с очень длинной цепью (> С24).
Жирные кислоты представляют собой обширный класс определяемых веществ, который постоянно изучается в течение многих лет. Для удобства жирные кислоты подразделяют натри группы: с короткой цепью (длина цепи < С12 с длинной цепью (С12-С24) и с очень длинной цепью (> С24).
Уровень содержания моно-, ди- и трихлоруксусной кислот и моно- и дибром-уксусной кислот контролировали в воде. Разделение осуществляли на колонке С18 с использованием подвижной фазы метанол/вода (50 мМ раствор хлорида тетрабутипаммония с pH 5,0) в объемном отношении 50:50. При данных условиях монобромуксусная кислота элюировалась на плече пика нитрата. Полное элюирование заняло 15 мин. Пределы обнаружения составили от 0,15 до 3 мг/л.
Вследствие низких молярных коэффициентов поглощения жирных кислот в области выше 205 нм и, напротив, ограниченного числа растворителей с достаточно низкими молярными коэффициентами поглощения в области ниже 205 нм, карбоновые кислоты с короткой цепью и их длинноцепочечные аналоги, жирные кислоты, а также другие насыщенные соединения обычно подвергают дериватизации перед хроматографическим процессом или в ходе него. В качестве альтернативы можно использовать «универсальный» детектор (например, детектор по показателю преломления (ДПП) или испарительный детектор по рассеянию света (ИДРС)). Преимущество дериватизации заключается в том, что хромофорные производные могут обеспечить пределы обнаружения на порядки величины более низкие, чем при применении ДПП и ИДРС.
В качестве альтернативы можно использовать «универсальный» детектор (например, детектор по показателю преломления (ДПП) или испарительный детектор по рассеянию света (ИДРС)). Преимущество дериватизации заключается в том, что хромофорные производные могут обеспечить пределы обнаружения на порядки величины более низкие, чем при применении ДПП и ИДРС.
Как получить карбоновые кислоты?
Карбоновые кислоты (например, молочную, уксусную, винную, яблочную, янтарную, лимонную) определяли в вине в виде их фенацилбромидных производных при 30 °С на колонке С18. Все соединения были полностью разделены менее чем за 18 мин с использованием градиентного элюирования подвижной фазой метанол/вода в объемном отношении 30:70-90:10. Пики имели отличную форму. Авторы оптимизировали разделение, применив триангуляционный метод.
В качестве вершин треугольника использовали смеси метанол/вода, ацетонитрил/вода и ТГФ/вода. Наилучшие результаты получили для четырехкомпонентного растворителя.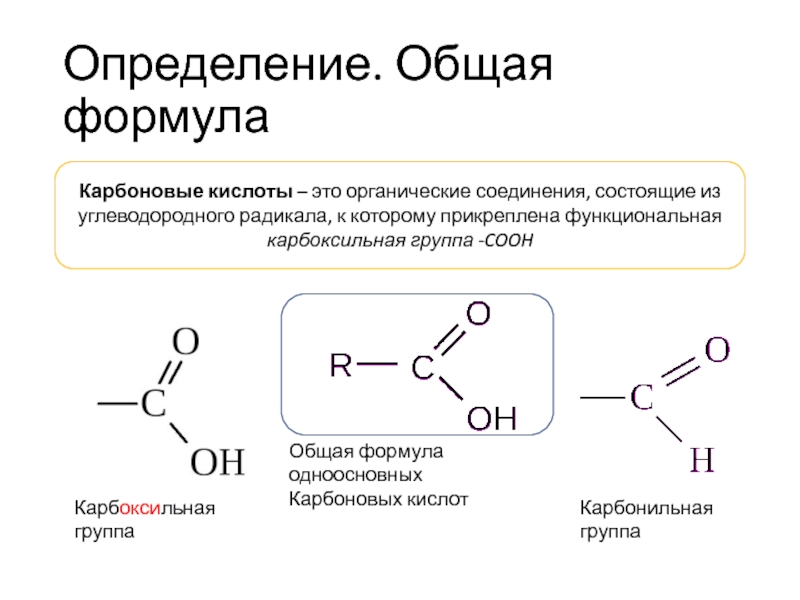 Те же авторы оптимизировали дериватизацию и разделение вышеперечисленных кислот, ацетона и метилмалоновой кислоты. Наилучшие результаты получили на колонке при 20-минутном градиентном элюировании подвижной фазой метанол/вода в объемном отношении 40:60-75:25.
Те же авторы оптимизировали дериватизацию и разделение вышеперечисленных кислот, ацетона и метилмалоновой кислоты. Наилучшие результаты получили на колонке при 20-минутном градиентном элюировании подвижной фазой метанол/вода в объемном отношении 40:60-75:25.
Двадцать пять нафтацильных производных жирных кислот разделили на колонке С18 при 30°С 45-минутным градиентным элюированием подвижной фазой метанол/ацетонитрил/вода в объемном отношении 80:10:10-86:10:4 (при 30 мин) —>90:10:0 (при 40 мин, выдерживали 5 мин). Пики имели отличную форму, и разрешение было исключительно хорошим в ходе всего анализа.
Два аннатосоединения (природные красители), биксин и норбиксин экстрагировали из повседневных продуктов с высоким содержанием жиров и разделили на колонке C18. При использовании 100% метанола в качестве подвижной фазы пики не были разрешены и имели сильно вытянутый передний фронт. Однако применение смеси метанол/вода (2% уксусной кислоты) в объемном отношении 90:10 обеспечило отличное разрешение и хорошую форму пиков.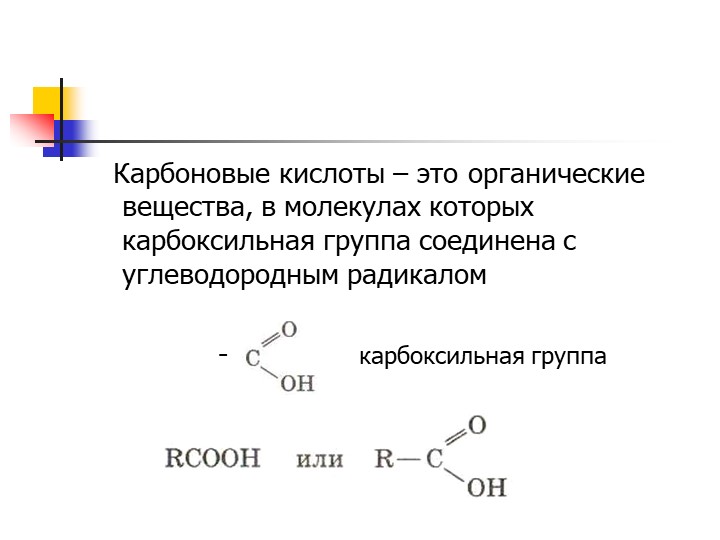 Уксусная кислота, очевидно, полностью протонировала определяемые соединения, что и позволило получить симметричные пики. Анализ занял меньше 10 мин. Для всех соединений получили пределы обнаружения 5 нг/г, линейный диапазон вплоть до 450 мкг/г.
Уксусная кислота, очевидно, полностью протонировала определяемые соединения, что и позволило получить симметричные пики. Анализ занял меньше 10 мин. Для всех соединений получили пределы обнаружения 5 нг/г, линейный диапазон вплоть до 450 мкг/г.
Миколевые кислоты, диагностические маркеры для группы туберкулезных микобактерий, исследовали в виде л-бромфенацилбромидных (БФБ) и 4-метил-6,7-диметоксикумариновых (МДК) производных; кроме того, изучили две флуоресцентные метки. 20-минутным градиентным элюированием на колонке С18 подвижной фазой метанол/ИПС в объемном отношении 60:40-6:94 получили воспроизводимые и характеристические профили элюирования индивидуальных бактерий.
Свободные жирные кислоты — НЭЖК или СЖК (14 показателей): Общие жирные кислоты, уксусная кислота (С2), пропионовая (С3), маслянная (С4), валериановая (С5), капроновая (С6), лауриновая кислота С12:0, миристиновая кислота С14:0, миристоолеиновая кислота С14
Жирные кислоты (далее-ЖК) ? органические соединения, относящиеся к группе карбоновых кислот, молекулы которых содержат разное количество атомов углерода (~ от 10 до 20).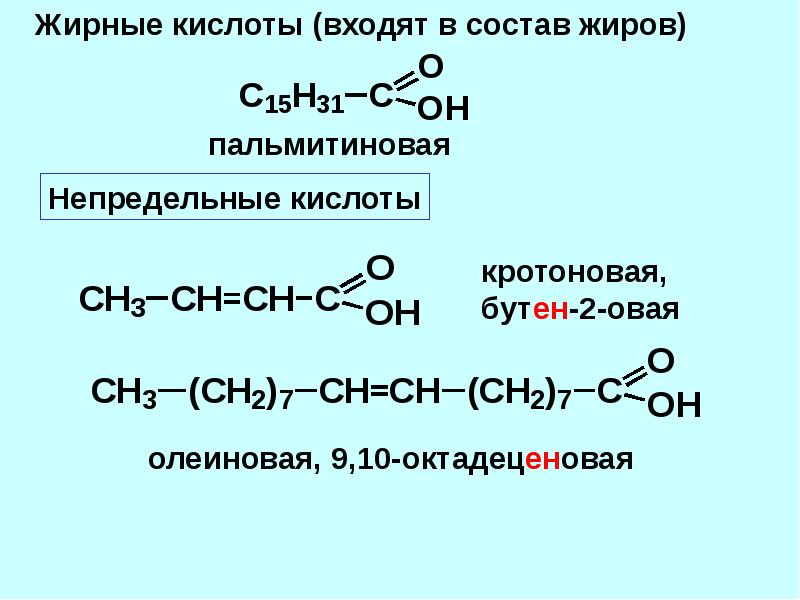 По характеру связей между соседними атомами углерода ЖК делят на насыщенные (имеют только одинарные связи), мононенасыщенные (с одной двойною связью) и полиненасыщенные (с несколькими двойными связями).
По характеру связей между соседними атомами углерода ЖК делят на насыщенные (имеют только одинарные связи), мононенасыщенные (с одной двойною связью) и полиненасыщенные (с несколькими двойными связями).
ЖК входят в состав триглицеридов (далее-ТГ) жировой ткани, фосфолипидов (далее-ФЛ) клеточных мембран и эфиров холестерола липопротеинов высокой плотности. Уровень свободных ЖК в крови и встроенных в структуру ФЛ биомембран позволяет оценить обмен ЖК в организме.
Соотношение насыщенных и ненасыщенных ЖК определяет физико-химические свойства биомембран. Дефицит ненасыщенных ЖК приводит к уменьшению вязкости, гибкости, проницаемости и электропроводимости биомембран. Следствием этого может стать снижение активности клеточных белков-рецепторов, белков-транспортеров, мембраносвязанных ферментов, внутри- и межклеточного обмена веществ.
Анализ используется для мониторинга баланса основных жирных кислот, которые находятся в организме человека, а также для диагностики, прогноза и оценки назначенного лечения дислипидемий, ишемической болезни сердца и онкологических заболеваний.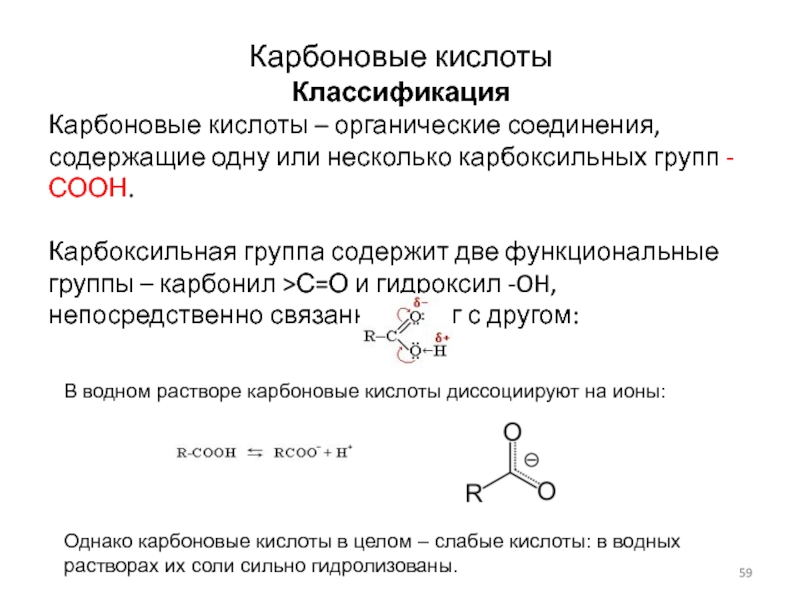
Метод газовой хроматографи/масс-спектрометрии (ГХ/МС) является быстровыполнимым и высокоточным для количественно определения маркерного вещества жирных кислот.
Показания к назначению:
1) Оценка нутриентного статус;
2) Наличие дислипидемии, ишемической болезни сердца, некоторые онкозаболевания (аденокарцинома толстой кишки, поджелудочной железы, простаты и молочной железы)
Интерпретация результатов:
Повышение уровня наблюдается при соблюдении пациентом диеты с очень высоким уровнем насыщенных и мононенасыщенных жирных кислот.
Снижение уровня встречается у людей употребляющих пищу с низким содержанием различных жирных кислот.
Результаты проведенного анализа отличаются у мужчин и женщин.
На результаты анализа могут влиять: возраст, особенности питания, сопутствующие заболевания и физическая активность пациента.
Подготовка
- Кровь берется строго натощак, между последним приемом пищи и взятием крови должно пройти не менее 8 часов.
 Прием воды на показатели крови влияние не оказывает.
Прием воды на показатели крови влияние не оказывает. - За 1-2 дня до обследования желательно исключить из рациона жирное, жареное и алкоголь. За пару часов до взятия крови воздержаться от курения.
- За один день до сдачи крови желательно избегать физических нагрузок, также нужно исключить физическое напряжение (бег, подъем по лестнице) и эмоциональное возбуждение перед сдачей крови. Перед процедурой следует отдохнуть 10-15 минут, успокоиться.
- Кровь не следует сдавать сразу после рентгенологического, ультразвукового исследования, массажа, рефлексотерапии или физиотерапевтических процедур.
Значение полиненасыщенных жирных кислот в организме человека
Как приблизительно выглядит концентрат энергии?
В питании человека жиры являются наиболее сконцентрированным источником энергии. Получаем почти в два раза больше энергии из жиров, чем из углеводов. К жирам в организме человека относим: насыщенные и ненасыщенные жирные кислоты, жирорастворимые витамины и много других липидных соединений.
Концентрат энергии под лупой
Жиры являются соединениями глицерина (один из спиртов) и жирных кислот. Независимо от того получен ли жир из источника животного, или из растительного, он является композицией различных жирных кислот. Их химическое строение отвечает одному принципу: все жирные кислоты состоят из молекул углерода (C ) и водорода (H), которые присоединяют одну или две молекулы кислорода О, для того чтобы в результате превратиться в органическую кислоту, которая называется карбоновой кислотой (кислотный остаток COOH).
Жирные кислоты, которые содержатся в натуральных жирах, всегда имеют чётное количество атомов углерода. Атомы углерода соединены между собой, как правило, подобно жемчужинам в бусах.
Жиры насыщенные и ненасыщенные, но чем?
В дискуссии о биологическом значении питания для человека важную роль играют две главные группы жирных кислот: насыщенные и ненасыщенные жирные кислоты.
Когда водород насытит все связи в цепи молекул углерода, такая кислота называется насыщенной. Например, масляная кислота:
Ch4Ch3Ch3COOH
Когда два атома углерода имеют двойную связь (=), то каждый из них должен присоединить на одну молекулу водорода меньше. Тогда говорится, что это моно ненасыщенные жирные кислоты, например олеиновая кислота (18: 1)
Ch4(Ch3)7CH = CH(Ch3)7COOH
Существуют также полиненасыщенные жирные кислоты, у которых минимум две двойные связи, напр. линолевая кислота (C18:2, Ω- 6):
Ch4(Ch3)4CH = CHCh3CH = CH(Ch3)7COOH
Как найти сокращения для названий кислот?
Названия жирных кислот включают вначале обозначения количества атомов углерода (C) в цепи, которые входят в состав кислоты.
Как пример, возьмём вышеупомянутую линолевую кислоту. Количество атомов углерода — 18. После двоеточия указывается количество двойных связей. В линолевой кислоте — их две. Получаем в записи 18:2. Информация о том, в каком месте цепи находится двойная связь (считаем с левой стороны), называется позицией омега (Ω) или же в новой номенклатуре может обозначаться буквой «n». Получаем два правильных варианта написания обозначения линолевой кислоты — один C18:2, Ω- 6 и другой C18: 2, n- 6.
В линолевой кислоте — их две. Получаем в записи 18:2. Информация о том, в каком месте цепи находится двойная связь (считаем с левой стороны), называется позицией омега (Ω) или же в новой номенклатуре может обозначаться буквой «n». Получаем два правильных варианта написания обозначения линолевой кислоты — один C18:2, Ω- 6 и другой C18: 2, n- 6.
О всемогущей альфа и омеге и почему кислоты соревнуются
Выше мы занимались семьей Ω- 6, а ниже находится предшественник всех жирных кислот, включенных в ряд Ω, — 3, с полным наименованием α-линоленовая кислота. Имеет три ненасыщенные связи:
Ch4Ch3CH = CHCh3CH = CHCh3CH =CH(Ch3)7COOH
α-линоленовая кислота C18:3 Ω-3
В метаболических обменах линолевая кислота (Ω- 6) и α-линоленовая кислота (Ω- 3) конкурируют за одни и те же пищеварительные энзимы (ферменты). Поэтому избыток линолевой кислоты в питании тормозит синтез кислот ЭПК и ДГК и увеличивает синтез арахидоновой кислоты (AрК). ЭПК и ДГК это жирные кислоты, которые получаются в преобразованиях из линолевой кислоты. Избыток арахидоновой кислоты может нарушить равновесие физиологичных процессов в организме человека и привести к определённым патофизиологическим состояниям. Наличие в пище кислот из семьи Ω- 3, а особенно ЭПК и ДГК, предотвращает чрезмерное образование в организме арахидоновой кислоты. Снижается интенсивность превращений, ведущих к образованию арахидоновой кислоты АрК.
ЭПК и ДГК это жирные кислоты, которые получаются в преобразованиях из линолевой кислоты. Избыток арахидоновой кислоты может нарушить равновесие физиологичных процессов в организме человека и привести к определённым патофизиологическим состояниям. Наличие в пище кислот из семьи Ω- 3, а особенно ЭПК и ДГК, предотвращает чрезмерное образование в организме арахидоновой кислоты. Снижается интенсивность превращений, ведущих к образованию арахидоновой кислоты АрК.
От полиненасыщенных жирных кислот много пользы
Полиненасыщенные жирные кислоты необходимы для правильного развития молодых организмов, а также поддержания хорошего состояния здоровья человека. Эти кислоты относятся и к семье Ω- 6, и к семье Ω- 3.
К ним относится и линолевая кислота (C18: 2, Ω- 6) и образующиеся из неё в тканях животных и человека жирные кислоты с более длинными цепями — из семьи Ω- 6:
— дигомо гамма линоленовая кислота (ДГЛК) (C20:3, Ω -6) — арахидоновая кислота (АрК) (C20:4, Ω-6) — альфа-линоленовая кислота (C18:3 Ω-3)
и относящиеся к семье Ω -3
эйкозапентаеновая кислота (ЭПК) (C20:5, Ω-3)
докозагексаеновая кислота (ДГК) (C22:6, Ω-3)
Двадцатиуглеродные кислоты — это субстраты для синтеза эйкозаноидов, в состав которых входят необходимые в метаболизме простагландины, простациклины, тромбоксаны, лейкотриены, гидрокси-эпокси- — жирные кислоты, а также липоксины.
Эйкозаноиды- тканевые гормоны и их бесконечный диапазон обязанностей
Эйкозаноиды можно трактовать, как расположенные наиболее внешне медиаторы I-го ряда, которые на уровне клетки, усиливают либо ослабляют регулирующее действие гормонов и нейромедиаторов. Субстраты для синтеза эйкозаноидов находятся в фосфолипидах клеточной мембраны.
В последние годы накоплено много фактов, свидетельствующих о том, что эйкозаноиды проявляют очень широкий спектр действия.
Существенно влияют на регулирование деятельности сердечно-сосудистой системы, насыщение кислородом тканей, а также имеют антиаритмогенное действие (уменьшают риск развития аритмии). Контролируют регулирование артериального давления, равновесие систем свёртывания и противосвёртывания крови, а также стабильности кровеносных сосудов. Регулируют содержание липопротеинов, особенно фракции ЛПВП («хорошего»), триглицеридов и определенных белков липопротеина.
Влияют на настройку выносливости иммунной системы и процессов воспаления, пролиферации (возрождение и размножение) клеток, деятельности гормонов и нейромедиаторов, экспрессии генов, а также деятельность многих органов, напр. мозга, почек, лёгких и системы пищеварения, а также на ощущение боли и много других физиологическо-биохимических процессов.
Влиятельная семья Ω- 3
Установлено, что люди которые едят большое количество продуктов из моря, которые содержат жирные кислоты из семьи Ω-3, реже болеют характерными для населения промышленно развитых западных стран, так называемыми, метаболическими болезнями цивилизации.
Установлено, что у них реже бывают атеросклероз, ишемическая болезнь сердца, рак молочной железы и толстой кишки, а также тромбоз сосудов и астма. Обнаружено также лечебное действие рыбьего жира в экспериментальном кровоизлиянии в мозг, а также при инфаркте миокарда и псориазе.
Собрано много научных данных, указывающих на то, что жирные кислоты из семьи Ω- 3 имеют очень хорошее влияние на сердечно-сосудистую систему. Установлено, что рыбий жир проявляет сильное гипотензивное действие (снижает кровяное давление), поэтому должен быть рекомендован при артериальной гипертензии. Снижает он уровень ЛПОНП, триглицеридов и холестерина в сыворотке крови, особенно общего холестерина, при одновременном увеличении содержания фракции холестерина ЛПВП.
В чём содержатся представители этих семей?
Масло Ω-3 [%] / Ω-6 [%]
Сафлоровое 0 / 77
Подсолнечное 0 / 69
Кукурузное 1 / 61
Соевое 7 / 54
Из грецкого ореха 5 / 51
Кунжутное 1 / 4
Арахисовое 3 / 3
Рапсовое 10 / 22
Льняное 57 / 16
Оливковое 1 / 8
Стрессовые пропорции
В питании наших предков количество жирных кислот омега-6 было в пять раз выше, чем омега- 3.
В настоящее время, из-за изменения в подборе продуктов питания и метода обработки продуктов, пропорции эти изменились и составляют 24:1, а насытить организм жирными кислотами омега-3 стало трудно. Тем более, что источником омега 3 являются скоропортящиеся продукты, которые разрушаются при нагревании.
На протяжении последних 50 лет потребление жирных кислот в западных странах значительно снизилось. Повлияло это на снижение уровня ДГК (очень, очень важная жирная кислота омега- 3) в организме. Большее потребление жирных кислот омега- 6 связано с их наличием в полиненасыщенных маслах и в обработанных продуктах питания. Едим меньше рыбы, необработанных зерен и семян, которые также богаты жирными кислотами омега- 3.
Общее снижение потребления кислот омега- 3 приводит к дефициту ДГК, который угрожает здоровью, особенно здоровью психическому.
Д-р Joseph R. Hibbein и д-р Norman Salem из National Institute of Health в статье, опубликованной на страницах «American Journal of Clinical Nutrition», предполагают, что увеличение количества заболеваний депрессией в Северной Америке на протяжении последнего столетия, следует связывать с постоянным уменьшением потребления ДГК.
Авторы сделали это открытие в 1984 году во время исследований зависимости между низко холестериновым питанием и часто появляющимся депрессивными состоянием у людей.
Объяснить это явление тогда было сложно. Более поздние исследования установили, что люди, живущие близ побережья, питаются в основном свежей, жирной рыбой, такой как лосось и скумбрия. Тем временем люди, которые проживают в глубине суши редко едят рыбу. Открыто также, что чем дальше от побережья, те выше подверженность стрессу как заболеванию.
Вывод был только один: если в питании присутствуют жирные сорта рыбы, которые содержат большое количество жирных омега-3 кислот, то организм легче переносит стресс. Докозагексаеновую кислоту (ДГК) можно также принимать в виде суплемента, лучше всего две — четыре капсулы (по 250 мг) ежедневно.
Жиры – сложные эфиры глицерина и высших карбоновых кислот. Общее название таких соединений – триглицериды
Люди давно научились выделять жир из натуральных объектов и использовать его в повседневной жизни. Жир сгорал в примитивных светильниках, освещая пещеры первобытных людей, жиром смазывали полозья, по которым спускали на воду суда. Жиры – основной источник нашего питания. Но неправильное питание, малоподвижный образ жизни приводит к избыточному весу. Животные пустынь запасают жир как источник энергии и воды. Толстый жировой слой тюленей и китов помогает им плавать в холодных водах Северного Ледовитого океана.Жиры широко распространены в природе. Наряду с углеводами и белками они входят в состав всех животных и растительных организмов и составляют одну из основных частей нашей пищи. Источниками жиров являются живые организмы. Среди животных это коровы, свиньи, овцы, куры, тюлени, киты, гуси, рыбы (акулы, тресковые, сельди). Из печени трески и акулы получают рыбий жир – лекарственное средство, из сельди – жиры, используемые для подкормки сельскохозяйственных животных. Растительные жиры чаще всего бывают жидкими, их называют маслами. Применяются жиры таких растений, как хлопок, лен, соя, арахис, кунжут, рапс, подсолнечник, горчица, кукуруза, мак, конопля, кокос, облепиха, шиповник, масличная пальма и многих других.
Жир сгорал в примитивных светильниках, освещая пещеры первобытных людей, жиром смазывали полозья, по которым спускали на воду суда. Жиры – основной источник нашего питания. Но неправильное питание, малоподвижный образ жизни приводит к избыточному весу. Животные пустынь запасают жир как источник энергии и воды. Толстый жировой слой тюленей и китов помогает им плавать в холодных водах Северного Ледовитого океана.Жиры широко распространены в природе. Наряду с углеводами и белками они входят в состав всех животных и растительных организмов и составляют одну из основных частей нашей пищи. Источниками жиров являются живые организмы. Среди животных это коровы, свиньи, овцы, куры, тюлени, киты, гуси, рыбы (акулы, тресковые, сельди). Из печени трески и акулы получают рыбий жир – лекарственное средство, из сельди – жиры, используемые для подкормки сельскохозяйственных животных. Растительные жиры чаще всего бывают жидкими, их называют маслами. Применяются жиры таких растений, как хлопок, лен, соя, арахис, кунжут, рапс, подсолнечник, горчица, кукуруза, мак, конопля, кокос, облепиха, шиповник, масличная пальма и многих других.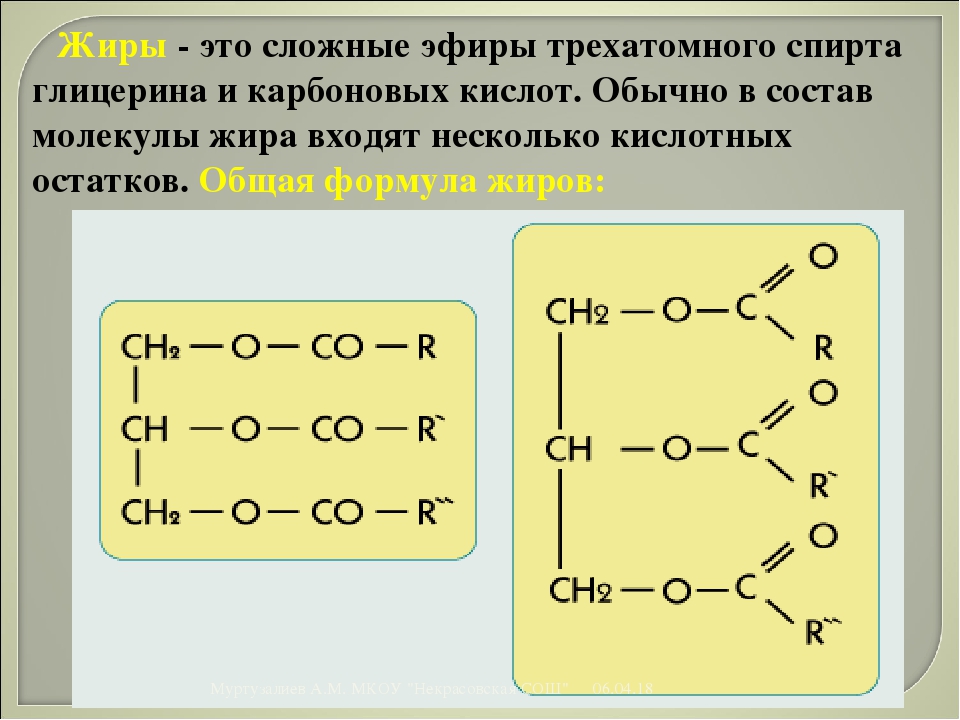
Еще в 17 в. немецкий ученый, один из первых химиков-аналитиков Отто Тахений (1652–1699) впервые высказал предположение, что жиры содержат «скрытую кислоту». В 1741 французский химик Клод Жозеф Жоффруа (1685–1752) обнаружил, что при разложении кислотой мыла (которое готовили варкой жира со щелочью) образуется жирная на ощупь масса. То, что в состав жиров и масел входит глицерин, впервые выяснил в 1779 знаменитый шведский химик Карл Вильгельм Шееле. Впервые химический состав жиров определил в начале прошлого века французский химик Мишель Эжен Шеврёль, основоположник химии жиров, автор многочисленных исследований их природы, обобщенных в шеститомной монографии «Химические исследования тел животного происхождения» г Э. Шеврёль установил строение жиров, благодаря реакции гидролиза жиров в щелочной среде.Он показал, что жиры состоят из глицерина и жирных кислот, причем это не просто их смесь, а соединение, которое, присоединяя воду, распадается на глицерин и кислоты.
Классификация жиров
Животные жиры содержат главным образом глицериды предельных кислот и являются твердыми веществами. Растительные жиры, часто называемые маслами, содержат глицериды непредельных карбоновых кислот. Это, например, жидкие подсолнечное, конопляное и льняное масла.
Растительные жиры, часто называемые маслами, содержат глицериды непредельных карбоновых кислот. Это, например, жидкие подсолнечное, конопляное и льняное масла.
Природные жиры содержат следующие жирные кислоты
Физические свойства жиров
- Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение – рыбий жир). В твёрдых жирах преобладают остатки насыщенных кислот.
- Растительные жиры – масла (подсолнечное, соевое, хлопковое и др.) – жидкости (исключение – кокосовое масло, масло какао-бобов). Масла содержат в основном остатки ненасыщенных (непредельных) кислот.
Химические свойства жиров
1. Гидролиз, или омыление, жиров происходит под действием воды, с участием ферментов или кислотных катализаторов (обратимо) , при этом образуются спирт — глицерин и смесь карбоновых кислот:
При щелочном гидролизе образуются соли высших жирных кислот, называемые мылами. Мыла получаются при гидролизе жиров в присутствии щелочей:
Мыла получаются при гидролизе жиров в присутствии щелочей:
Мыла — это калиевые и натриевые соли высших карбоновых кислот.
2.Гидрирование жиров – превращение жидких растительных масел в твердые жиры – имеет большое значение для пищевых целей. Продукт гидрогенизации масел – твердый жир (искусственное сало, саломас ). Маргарин – пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
Так в промышленности получают маргарин:
В условиях процесса гидрогенизации масел (высокая температура, металлический катализатор) происходит изомеризация части кислотных остатков, содержащих цис-связи С=С, в более устойчивые транс-изомеры. Повышенное содержание в маргарине (особенно, в дешевых сортах) остатков транс-ненасыщенных кислот увеличивает опасность атеросклероза, сердечно-сосудистых и других заболеваний.
Применение жиров
o Пищевая промышленность
o Фармацевтика
o Производство мыла и косметических изделий
o Производство смазочных материалов
10.5. Сложные эфиры. Жиры
Сложные эфиры
–
функциональные производные карбоновых кислот,
в молекулах которых гидроксильная группа (-ОН) замещена на остаток спирта (-
OR
)
Сложные эфиры карбоновых кислот – соединения с общей формулой.
R–COOR» , где R и R» – углеводородные радикалы.
Сложные эфиры предельных одноосновных карбоновых кислот имеют общую формулу:
Физические свойства:
· Летучие, бесцветные жидкости
· Плохо растворимы в воде
· Чаще с приятным запахом
· Легче воды
Сложные
эфиры содержатся в цветах, фруктах, ягодах. Они определяют их специфический
запах.
Являются составной частью эфирных масел (известно около 3000 эф. м. –
апельсиновое, лавандовое, розовое и т. д.)
м. –
апельсиновое, лавандовое, розовое и т. д.)
Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод и фруктов. Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
CH 3 (CH 2) 14 –CO–O–(CH 2) 29 CH 3
Аромат. Структурная формула. |
Название сложного эфира |
Яблоко |
Этиловый эфир 2-метилбутановой кислоты |
Вишня |
Амиловый эфир муравьиной кислоты |
Груша |
Изоамиловый эфир уксусной кислоты |
Ананас |
Этиловый эфир масляной кислоты (этилбутират) |
Банан |
Изобутиловый эфир уксусной кислоты (у изоамилацетата так же напоминает запах банана) |
Жасмин |
Бензиловый эфир уксусной (бензилацетат) |
Краткие названия сложных эфиров строятся по названию радикала (R») в остатке
спирта и названию группы RCOO — в остатке кислоты.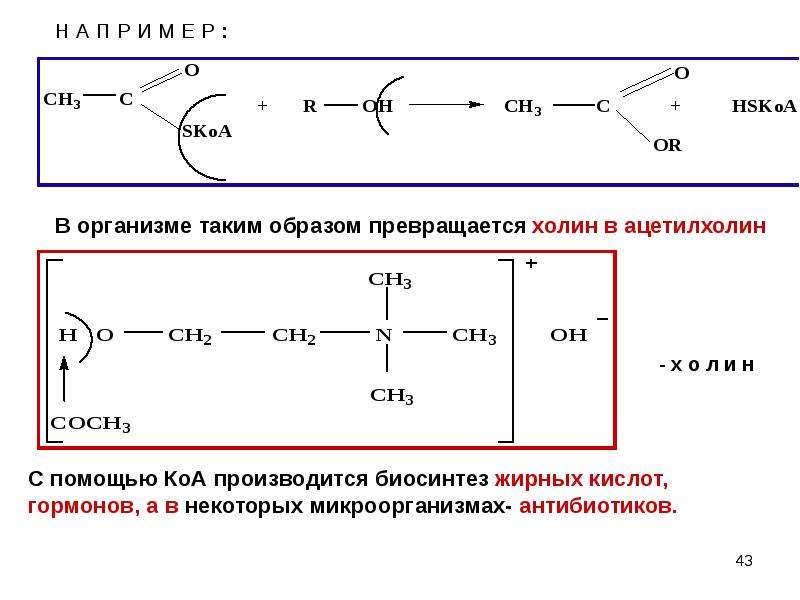 Например,
этиловый эфир уксусной кислотыCH 3 COO
C 2 H 5
называетсяэтил
ацетат
.
Например,
этиловый эфир уксусной кислотыCH 3 COO
C 2 H 5
называетсяэтил
ацетат
.
Применение
· В качестве отдушек и усилителей запаха в пищевой и парфюмерной (изготовление мыла, духов, кремов) промышленности;
· В производстве пластмасс, резины в качестве пластификаторов.
Пластификаторы – вещества, которые вводят в состав полимерных материалов для придания (или повышения) эластичности и (или) пластичности при переработке и эксплуатации.
Применение в медицине
В конце XIX
— начале ХХ века, когда органический синтез делал свои первые шаги, было
синтезировано и испытано фармакологами множество сложных эфиров. Они стали
основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее
и обезболивающее средство широко использовался метилсалицилат, в настоящее
время практически вытесненный более эффективными средствами.
Получение сложных эфиров
Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации ). Катализаторами являются минеральные кислоты.
Реакция этерификации в условиях кислотного катализа обратима. Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира .
RCOOR » + H 2 O ( H +) ↔ RCOOH + R » OH
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат-анион RCOO – не вступает в реакцию с нуклеофильным реагентом – спиртом).
Эта реакция называется омылением сложных эфиров (по аналогии со щелочным гидролизом сложноэфирных связей в жирах при получении мыла).
Жиры, их строение, свойства и применение
«Химия везде, химия во всем:
Во всем, чем мы дышим,
Во всем, что мы пьем,
Во всем, что едим».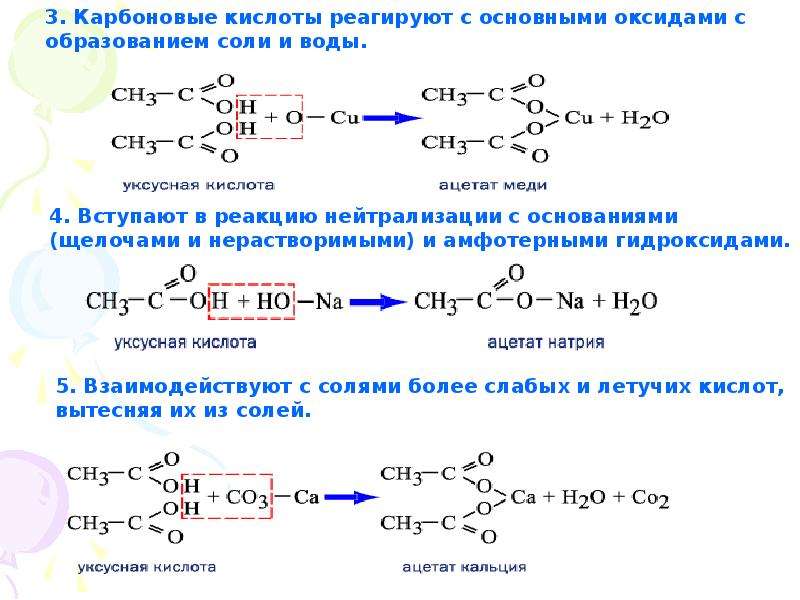
Во всем, что мы носим,
Люди давно научились выделять жир из натуральных объектов и использовать его в повседневной жизни. Жир сгорал в примитивных светильниках, освещая пещеры первобытных людей, жиром смазывали полозья, по которым спускали на воду суда. Жиры – основной источник нашего питания. Но неправильное питание, малоподвижный образ жизни приводит к избыточному весу. Животные пустынь запасают жир как источник энергии и воды. Толстый жировой слой тюленей и китов помогает им плавать в холодных водах Северного Ледовитого океана.
Жиры широко
распространены в природе. Наряду с углеводами и белками они входят в состав
всех животных и растительных организмов и составляют одну из основных частей
нашей пищи. Источниками жиров являются живые организмы. Среди животных это
коровы, свиньи, овцы, куры, тюлени, киты, гуси, рыбы (акулы, тресковые,
сельди). Из печени трески и акулы получают рыбий жир – лекарственное средство,
из сельди – жиры, используемые для подкормки сельскохозяйственных животных. Растительные
жиры чаще всего бывают жидкими, их называют маслами. Применяются жиры таких
растений, как хлопок, лен, соя, арахис, кунжут, рапс, подсолнечник, горчица,
кукуруза, мак, конопля, кокос, облепиха, шиповник, масличная пальма и многих
других.
Растительные
жиры чаще всего бывают жидкими, их называют маслами. Применяются жиры таких
растений, как хлопок, лен, соя, арахис, кунжут, рапс, подсолнечник, горчица,
кукуруза, мак, конопля, кокос, облепиха, шиповник, масличная пальма и многих
других.
Жиры выполняют различные функции: строительную, энергетическую (1 г жира дает 9 ккал энергии), защитную, запасающую. Жиры обеспечивают 50% энергии, требуемой человеку, поэтому человеку необходимо потреблять 70–80 г жиров в день. Жиры составляют 10–20% от массы тела здорового человека. Жиры являются незаменимым источником жирных кислот. Некоторые жиры содержат витамины А, D, Е, К, гормоны.
Многие животные и человек используют жир в качестве теплоизолирующей оболочки, например, у некоторых морских животных толщина жирового слоя достигает метра. Кроме того, в организме жиры являются растворителями вкусовых веществ и красителей. Многие витамины, например витамин А, растворяются только в жирах.
Некоторые животные (чаще водоплавающие птицы) используют жиры для смазки
своих собственных мышечных волокон.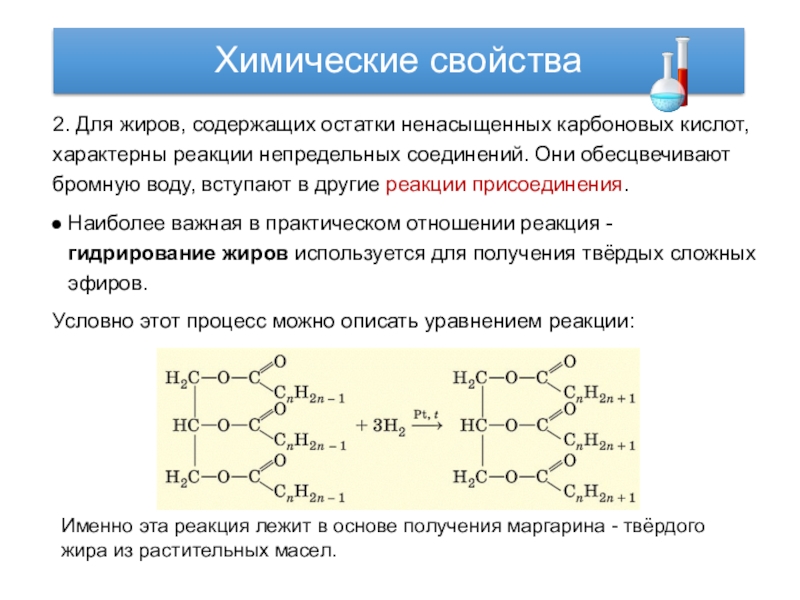
Жиры повышают эффект насыщения пищевыми продуктами, т. к. они перевариваются очень медленно и задерживают наступление чувства голода.
История открытия жиров
Еще в 17 в. немецкий ученый, один из первых химиков-аналитиков Отто Тахений (1652–1699) впервые высказал предположение, что жиры содержат «скрытую кислоту».
В 1741 французский химик Клод Жозеф Жоффруа (1685–1752) обнаружил, что при разложении кислотой мыла (которое готовили варкой жира со щелочью) образуется жирная на ощупь масса.
То, что в состав жиров и масел входит глицерин, впервые выяснил в 1779 знаменитый шведский химик Карл Вильгельм Шееле.
Впервые
химический состав жиров определил в начале прошлого века французский химикМишель
Эжен Шеврёль
, основоположник химии жиров, автор многочисленных исследований
их природы, обобщенных в шеститомной монографии «Химические исследования
тел животного происхождения».
1813 г Э. Шеврёль установил строение жиров, благодаря реакции гидролиза жиров в щелочной среде.Он показал, что жиры состоят из глицерина и жирных кислот, причем это не просто их смесь, а соединение, которое, присоединяя воду, распадается на глицерин и кислоты.
Синтез жиров
В 1854 французский химик Марселен Бертло (1827–1907) провел реакцию этерификации, то есть образования сложного эфира между глицерином и жирными кислотами и таким образом впервые синтезировал жир.
Общая формула жиров (триглицеридов)
Жиры
–
сложные эфиры глицерина и высших карбоновых кислот.
Общее название таких
соединений – триглицериды.
Классификация жиров
Животные жиры содержат главным образом глицериды предельных кислот и
являются твердыми веществами. Растительные жиры, часто называемые маслами,
содержат глицериды непредельных карбоновых кислот.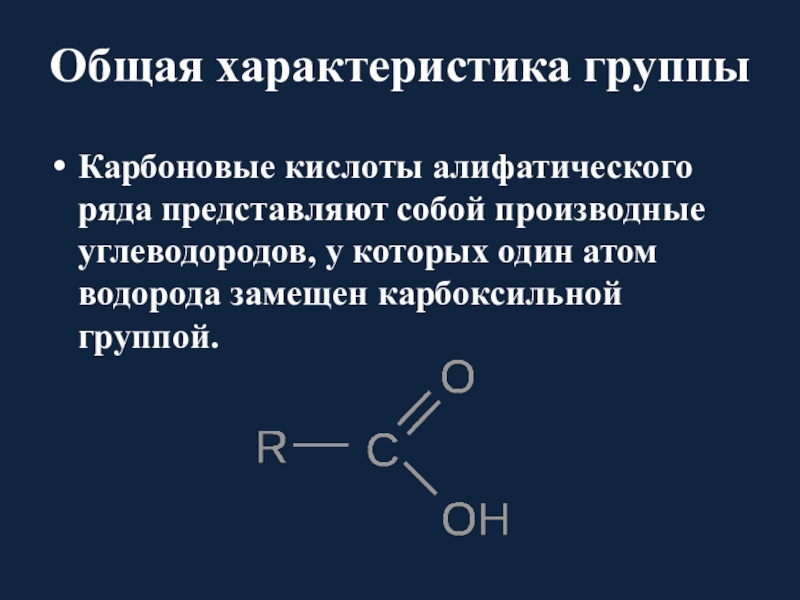 Это, например, жидкие
подсолнечное, конопляное и льняное масла.
Это, например, жидкие
подсолнечное, конопляное и льняное масла.
Природные жиры содержат следующие жирные кислоты
Насыщенные: стеариновая (C 17 H 35 COOH) пальмитиновая (C 15 H 31 COOH) Масляная (C 3 H 7 COOH) |
В СОСТАВЕ ЖИВОТНЫХ ЖИРОВ |
Ненасыщенные : олеиновая (C 17 H 33 COOH, 1 двойная связь) линолевая (C 17 H 31 COOH, 2 двойные связи) линоленовая (C 17 H 29 COOH, 3 двойные связи) арахидоновая (C 19 H 31 COOH, 4 двойные связи, реже встречается) |
В СОСТАВЕ РАСТИТЕЛЬНЫХ ЖИРОВ |
Жиры
содержатся во всех растениях и животных. Они представляют собой смеси полных
сложных эфиров глицерина и не имеют чётко выраженной температуры плавления.
Они представляют собой смеси полных
сложных эфиров глицерина и не имеют чётко выраженной температуры плавления.
· Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение – рыбий жир). В твёрдых жирах преобладают остатки насыщенных кислот.
· Растительные жиры – масла (подсолнечное, соевое, хлопковое и др.) – жидкости (исключение – кокосовое масло, масло какао-бобов). Масла содержат в основном остатки ненасыщенных (непредельных) кислот.
Химические свойства жиров
1. Гидролиз, или омыление , жиров происходит под действием воды, с участием ферментов или кислотных катализаторов (обратимо) , при этом образуются спирт — глицерин и смесь карбоновых кислот:
или щелочей (необратимо)
. При щелочном гидролизе образуются соли
высших жирных кислот, называемые мылами. Мыла получаются при
гидролизе жиров в присутствии щелочей:
Мыла получаются при
гидролизе жиров в присутствии щелочей:
Мыла — это калиевые и натриевые соли высших карбоновых кислот.
2.Гидрирование жиров – превращение жидких растительных масел в твердые жиры – имеет большое значение для пищевых целей. Продукт гидрогенизации масел – твердый жир (искусственное сало, саломас ). Маргарин – пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
Так в промышленности получают маргарин:
В
условиях процесса гидрогенизации масел (высокая температура, металлический
катализатор) происходит изомеризация части кислотных остатков, содержащих
цис-связи С=С, в более устойчивые транс-изомеры. Повышенное содержание в
маргарине (особенно, в дешевых сортах) остатков транс-ненасыщенных кислот
увеличивает опасность атеросклероза, сердечно-сосудистых и других заболеваний.
Реакция получения жиров (этерификация)
Применение жиров
Жиры — продукт питания. Биологическая роль жиров
Животные
жиры и растительные масла, наряду с белками и углеводами – одна из главных
составляющих нормального питания человека. Они являются основным источником
энергии: 1 г жира при полном окислении (оно идет в клетках с участием
кислорода) дает 9,5 ккал (около 40 кДж) энергии, что почти вдвое больше, чем
можно получить из белков или углеводов.
Кроме того, жировые запасы в
организме практически не содержат воду, тогда как молекулы белков и углеводов
всегда окружены молекулами воды. В результате один грамм жира дает почти в 6
раз больше энергии, чем один грамм животного крахмала – гликогена. Таким
образом, жир по праву следует считать высококалорийным «топливом». В основном
оно расходуется для поддержания нормальной температуры человеческого тела, а
также на работу различных мышц, поэтому даже когда человек ничего не делает
(например, спит), ему каждый час требуется на покрытие энергетических
расходов около 350 кДж энергии, примерно такую мощность имеет электрическая
100-ваттная лампочка
.
Для
обеспечения организма энергией в неблагоприятных условиях в нем создаются
жировые запасы, которые откладываются в подкожной клетчатке, в жировой складке
брюшины – так называемом сальнике. Подкожный жир предохраняет организм от
переохлаждения (особенно эта функция жиров важна для морских животных). В
течение тысячелетий люди выполняли тяжелую физическую работу, которая требовала
больших затрат энергии и соответственно усиленного питания. Для
покрытия минимальной суточной потребности человека в энергии достаточно всего
50 г жира. Однако при умеренной физической нагрузке взрослый человек должен
получать с продуктами питания несколько больше жиров, но их количество не
должно превышать 100 г (это дает треть калорийности при диете, составляющей
около 3000 ккал).
Следует отметить, что половина из этих 100 г
содержится в продуктах питания в виде так называемого скрытого жира. Жиры
содержатся почти во всех пищевых продуктах: в небольшом количестве они есть
даже в картофеле (там их 0,4%), в хлебе (1–2%), в овсяной крупе (6%). В молоке
обычно содержится 2–3% жира (но есть и специальные сорта обезжиренного молока).
Довольно много скрытого жира в постном мясе – от 2 до 33%. Скрытый жир
присутствует в продукте в виде отдельных мельчайших частиц. Жиры почти в чистом
виде – это сало и растительное масло; в сливочном масле около 80% жира, в
топленом – 98%. Конечно, все приведенные рекомендации по потреблению жиров –
усредненные, они зависят от пола и возраста, физической нагрузки и
климатических условий. При неумеренном потреблении жиров человек быстро
набирает вес, однако не следует забывать, что жиры в организме могут
синтезироваться и из других продуктов. «Отрабатывать» лишние калории путем
физической нагрузки не так-то просто. Например, пробежав трусцой 7 км,
человек тратит примерно столько же энергии, сколько он получает, съев всего
лишь одну стограммовую плитку шоколада (35% жира, 55% углеводов)
.Физиологи
установили, что при физической нагрузке, которая в 10 раз превышала привычную,
человек, получавший жировую диету, полностью выдыхался через 1,5 часа.
В молоке
обычно содержится 2–3% жира (но есть и специальные сорта обезжиренного молока).
Довольно много скрытого жира в постном мясе – от 2 до 33%. Скрытый жир
присутствует в продукте в виде отдельных мельчайших частиц. Жиры почти в чистом
виде – это сало и растительное масло; в сливочном масле около 80% жира, в
топленом – 98%. Конечно, все приведенные рекомендации по потреблению жиров –
усредненные, они зависят от пола и возраста, физической нагрузки и
климатических условий. При неумеренном потреблении жиров человек быстро
набирает вес, однако не следует забывать, что жиры в организме могут
синтезироваться и из других продуктов. «Отрабатывать» лишние калории путем
физической нагрузки не так-то просто. Например, пробежав трусцой 7 км,
человек тратит примерно столько же энергии, сколько он получает, съев всего
лишь одну стограммовую плитку шоколада (35% жира, 55% углеводов)
.Физиологи
установили, что при физической нагрузке, которая в 10 раз превышала привычную,
человек, получавший жировую диету, полностью выдыхался через 1,5 часа. При
углеводной же диете человек выдерживал такую же нагрузку в течение 4 часов.
Объясняется этот на первый взгляд парадоксальный результат особенностями
биохимических процессов. Несмотря на высокую «энергоемкость» жиров, получение
из них энергии в организме – процесс медленный. Это связано с малой реакционной
способностью жиров, особенно их углеводородных цепей. Углеводы, хотя и дают
меньше энергии, чем жиры, «выделяют» ее намного быстрее. Поэтому перед
физической нагрузкой предпочтительнее съесть сладкое, а не жирное.Избыток в
пище жиров, особенно животных, увеличивает и риск развития таких заболеваний
как атеросклероз, сердечная недостаточность и др. В животных жирах много
холестерина (но не следует забывать, что две трети холестерина синтезируется в
организме из нежировых продуктов – углеводов и белков).
При
углеводной же диете человек выдерживал такую же нагрузку в течение 4 часов.
Объясняется этот на первый взгляд парадоксальный результат особенностями
биохимических процессов. Несмотря на высокую «энергоемкость» жиров, получение
из них энергии в организме – процесс медленный. Это связано с малой реакционной
способностью жиров, особенно их углеводородных цепей. Углеводы, хотя и дают
меньше энергии, чем жиры, «выделяют» ее намного быстрее. Поэтому перед
физической нагрузкой предпочтительнее съесть сладкое, а не жирное.Избыток в
пище жиров, особенно животных, увеличивает и риск развития таких заболеваний
как атеросклероз, сердечная недостаточность и др. В животных жирах много
холестерина (но не следует забывать, что две трети холестерина синтезируется в
организме из нежировых продуктов – углеводов и белков).
Известно, что значительную долю потребляемого
жира должны составлять растительные масла, которые содержат очень важные для
организма соединения – полиненасыщенные жирные кислоты с несколькими двойными
связями. Эти кислоты получили название «незаменимых». Как и витамины, они
должны поступать в организм в готовом виде. Из них наибольшей активностью
обладает арахидоновая кислота (она синтезируется в организме из линолевой),
наименьшей – линоленовая (в 10 раз ниже линолевой). По разным оценкам суточная
потребность человека в линолевой кислоте составляет от 4 до 10 г. Больше всего
линолевой кислоты (до 84%) в сафлоровом масле, выжимаемом из семян сафлора –
однолетнего растения с ярко-оранжевыми цветками. Много этой кислоты также в
подсолнечном и ореховом масле.
Эти кислоты получили название «незаменимых». Как и витамины, они
должны поступать в организм в готовом виде. Из них наибольшей активностью
обладает арахидоновая кислота (она синтезируется в организме из линолевой),
наименьшей – линоленовая (в 10 раз ниже линолевой). По разным оценкам суточная
потребность человека в линолевой кислоте составляет от 4 до 10 г. Больше всего
линолевой кислоты (до 84%) в сафлоровом масле, выжимаемом из семян сафлора –
однолетнего растения с ярко-оранжевыми цветками. Много этой кислоты также в
подсолнечном и ореховом масле.
По мнению диетологов, в сбалансированном рационе
должно быть 10% полиненасыщенных кислот, 60% мононенасыщенных (в основном это
олеиновая кислота) и 30% насыщенных. Именно такое соотношение обеспечивается,
если треть жиров человек получает в виде жидких растительных масел – в
количестве 30–35 г в сутки. Эти масла входят также в состав маргарина, который
содержит от 15 до 22% насыщенных жирных кислот, от 27 до 49% ненасыщенных и от
30 до 54% полиненасыщенных.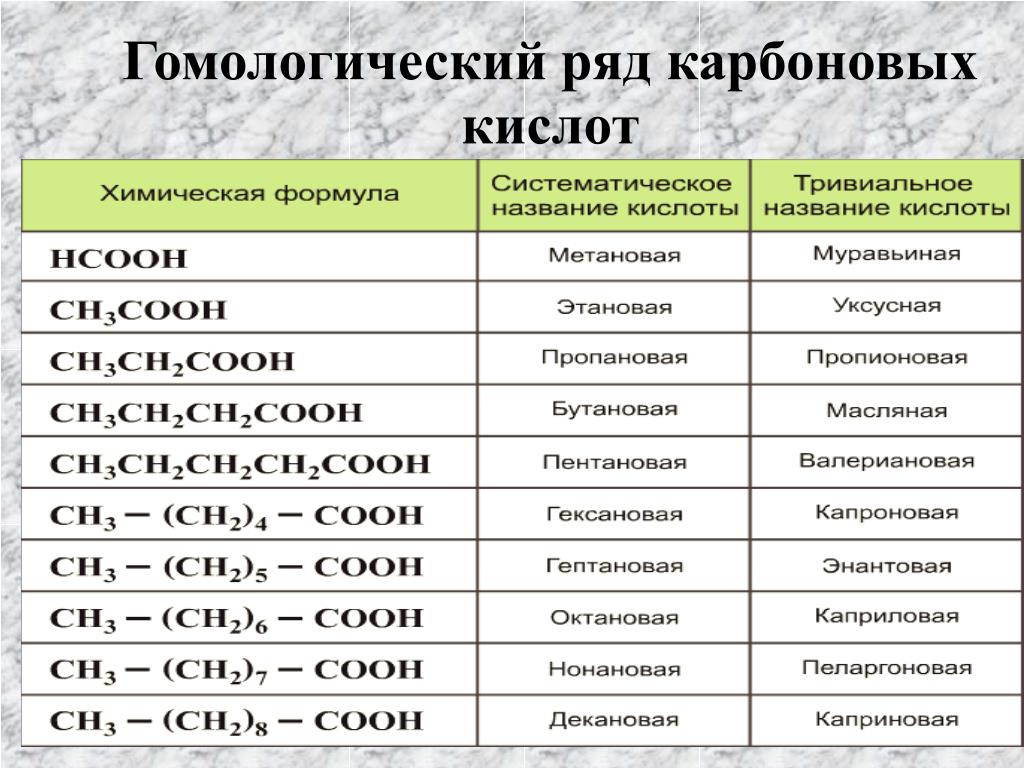 Для сравнения: в сливочном масле содержится 45–50%
насыщенных жирных кислот, 22–27% ненасыщенных и менее 1% полиненасыщенных. В
этом отношении высококачественный маргарин полезнее сливочного масла.
Для сравнения: в сливочном масле содержится 45–50%
насыщенных жирных кислот, 22–27% ненасыщенных и менее 1% полиненасыщенных. В
этом отношении высококачественный маргарин полезнее сливочного масла.
Необходимо помнить!!!
Насыщенные жирные кислоты отрицательно
влияют на жировой обмен, работу печени и способствуют развитию атеросклероза.
Ненасыщенные (особенно линолевая и арахидоновая кислоты) регулируют жировой
обмен и участвуют в выведении холестерина из организма. Чем выше содержание
ненасыщенных жирных кислот, тем ниже температура плавления жира. Калорийность
твердых животных и жидких растительных жиров примерно одинакова, однако
физиологическая ценность растительных жиров намного выше. Более ценными
качествами обладает жир молока. Он содержит одну треть ненасыщенных жирных
кислот и, сохраняясь в виде эмульсии, легко усваивается организмом. Несмотря на
эти положительные качества, нельзя употреблять только молочный жир, так как
никакой жир не содержит идеального состава жирных кислот. Лучше всего
употреблять жиры как животного, так и растительного происхождения. Соотношение
их должно быть 1:2,3 (70% животного и 30% растительного) для молодых людей и
лиц среднего возраста. В рационе питания пожилых людей должны преобладать растительные
жиры.
Лучше всего
употреблять жиры как животного, так и растительного происхождения. Соотношение
их должно быть 1:2,3 (70% животного и 30% растительного) для молодых людей и
лиц среднего возраста. В рационе питания пожилых людей должны преобладать растительные
жиры.
Жиры не только участвуют в обменных процессах, но и откладываются про запас (преимущественно в брюшной стенке и вокруг почек). Запасы жира обеспечивают обменные процессы, сохраняя для жизни белки. Этот жир обеспечивает энергию при физической нагрузке, если с пищей жира поступило мало, а также при тяжелых заболеваниях, когда из-за пониженного аппетита его недостаточно поступает с пищей.
Обильное потребление с пищей
жира вредно для здоровья: он в большом количестве откладывается про запас, что
увеличивает массу тела, приводя порой к обезображиванию фигуры. Увеличивается
его концентрация в крови, что, как фактор риска, способствует развитию
атеросклероза, ишемической болезни сердца, гипертонической болезни и др.
УПРАЖНЕНИЯ
1. Имеется 148 г смеси двух органических соединений одинакового состава С 3 Н 6 О 2 . Определите строение этих соединений и их массовые доли в смеси, если известно, что одно из них при взаимодействии с избытком гидрокарбоната натрия выделяет 22,4 л (н.у.) оксида углерода ( IV ), а другое не реагирует с карбонатом натрия и аммиачным раствором оксида серебра, но при нагревании с водным раствором гидроксида натрия образует спирт и соль кислоты.
Решение:
Известно, что оксид углерода (IV ) выделяется при взаимодействии карбоната натрия с кислотой. Кислота состава С 3 Н 6 О 2 может быть только одна — пропионовая, СН 3 СН 2 СООН.
С 2 Н 5 СООН + N аНСО 3 → C 2 H 5 COONa + CO 2 + Н 2 О.
По условию, выделилось 22,4 л СО 2 ,
что составляет 1 моль, значит кислоты в смеси также было 1 моль. Молярная
масса исходных органических соединений равна:
M
(С 3 Н 6 О 2)
= 74 г/моль, следовательно 148 г составляют 2 моль.
Второе соединение при гидролизе образует спирт и соль кислоты, значит это — сложный эфир:
RCOOR‘ + NaOH → RCOONa + R‘OH.
Составу С 3 Н 6 О 2 отвечают два сложных эфира: этилформиат НСООС 2 Н 5 и метилацетат СН 3 СООСН 3 . Эфиры муравьиной кислоты реагируют с аммиачным раствором оксида серебра, поэтому первый эфир не удовлетворяет условию задачи. Следовательно, второе вещество в смеси — метилацетат.
Поскольку в смеси было по одному молю соединений с одинаковой молярной массой, то их массовые доли равны и составляют 50%.
Ответ. 50% СН 3 СН 2 СООН, 50% СН 3 СООСН 3 .
2. Относительная плотность паров сложного эфира по водороду равна 44. При гидролизе этого эфира образуются двасоединения, при сгорании равных количеств которых образуются одинаковые объемы углекислого газа (при одинаковых условиях).Приведите структурную формулу этого эфира.
Решение:
Общая формула сложных эфиров,
образованных предельными спиртами и кислотами, — С
n
Н 2
n
О 2 . Значение n можно определить из плотности по водороду:
Значение n можно определить из плотности по водороду:
M (С n Н 2 n О 2) = 14 n + 32 = 44 . 2 = 88 г/моль,
откуда n = 4, то есть эфир содержит 4 атома углерода. Поскольку при сгорании спирта и кислоты, образующихся при гидролизе эфира, выделяются равные объемы углекислого газа, то кислота и спирт содержат одинаковое число атомов углерода, по два. Таким образом, искомый эфир образован уксусной кислотой и этанолом и называется этилацетат:
Ответ. Этилацетат, СН 3 СООС 2 Н 5 .
________________________________________________________________
3. При гидролизе сложного эфира, молярная масса которого равна 130 г/моль, образуются кислота А и спирт Б. Определите строение эфира, если известно, что серебряная соль кислоты содержит 59,66% серебра по массе. Спирт Б не окисляется дихроматом натрия и легко реагирует с хлороводородной кислотой с образованием алкилхлорида.
Решение:
Сложный эфир имеет общую
формулу
RCOOR
‘. Известно,
что серебряная соль кислоты,
RCOOAg
, содержит 59,66%серебра,
следовательно молярная масса соли равна:
M
(RCOOAg
) =
M
(А
g
)/0,5966 = 181 г/моль, откуда
M
(R
) =
181-(12+2 . 16+108) = 29 г/моль. Этот радикал — этил, С 2 Н 5 ,
а сложный эфир был образован пропионовой кислотой:
C
2
H
5
COOR
‘.
Известно,
что серебряная соль кислоты,
RCOOAg
, содержит 59,66%серебра,
следовательно молярная масса соли равна:
M
(RCOOAg
) =
M
(А
g
)/0,5966 = 181 г/моль, откуда
M
(R
) =
181-(12+2 . 16+108) = 29 г/моль. Этот радикал — этил, С 2 Н 5 ,
а сложный эфир был образован пропионовой кислотой:
C
2
H
5
COOR
‘.
Молярная масса второго радикала равна: M (R ‘) = M (C 2 H 5 COOR ‘) — М(С 2 Н 5 СОО) = 130-73 = 57 г/моль. Этот радикал имеет молекулярную формулу С 4 Н 9 . По условию, спирт С 4 Н 9 ОН не окисляется Na 2 С r 2 О 7 и легко реагирует с HCl следовательно, этот спирт — третичный, (СН 3) 3 СОН.
Таким образом, искомый эфир образован пропионовой кислотой и трет-бутанолом и называется трет-бутилпропионат:
CH 3 |
||
C 2 H 5 — |
C — O — |
C — CH 3 |
CH 3 |
Ответ
.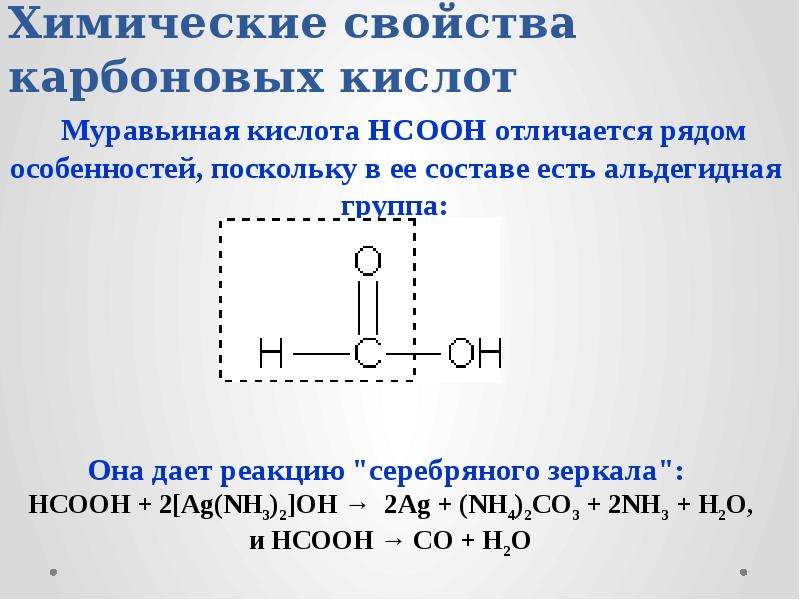 Трет-бутилпропионат.
Трет-бутилпропионат.
________________________________________________________________
4. Напишите две возможные формулы жира, имеющего в молекуле 57 атомов углерода и вступающего в реакцию с иодом в соотношении 1:2. В составе жира имеются остатки кислот с четным числом углеродных атомов.
Решение:
Общая формула жиров:
где R, R’, R » — углеводородные радикалы, содержащие нечетное число атомов углерода (еще один атом из кислотного остатка входит в состав группы -СО-). На долю трех углеводородных радикалов приходится 57- 6 = 51 атом углерода. Можно предположить, что каждый из радикалов содержит по 17 атомов углерода.
Поскольку одна молекула жира может
присоединить две молекулы иода, то на три радикала приходится две двойные
связи или одна тройная. Если две двойные связи находятся в одном радикале,
то в состав жира входят остаток линолевой кислоты (R
= С 17 Н 31)
и два остатка стеариновой кислоты (R
‘ =
R
» = С 17 Н 35). Если
две двойные связи находятся в разных радикалах, то в состав жира входят два
остатка олеиновой кислоты (R
=
R
‘ = С 17
H
33
) и остаток стеариновой кислоты (R
» = С 17 Н 35).
Возможные формулы жира:
Если
две двойные связи находятся в разных радикалах, то в состав жира входят два
остатка олеиновой кислоты (R
=
R
‘ = С 17
H
33
) и остаток стеариновой кислоты (R
» = С 17 Н 35).
Возможные формулы жира:
|
|
________________________________________________________________
5.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. Что такое реакция этерификации.
Что такое реакция этерификации.
2. Какое различие существует в строении твердых и жидких жиров.
3. Каковы химические свойства жиров.
4. Приведите уравнение реакции получения метилформиата.
5. Напишите структурные формулы двух сложных эфиров и кислоты, имеющих состав С 3 Н 6 О 2 . Назовите эти вещества по международной номенклатуре.
6. Напишите уравнения реакций этерификации между: а) уксусной кислотой и 3-метилбутанолом-1; б) масляной кислотой и пропанолом-1. Назовите эфиры.
7. Сколько граммов жира было взято, если для гидрирования образовавшейся в результате его гидролиза кислоты потребовалось 13,44 л водорода (н.у.).
8. Рассчитайте массовую долю выхода сложного эфира, образующегося при нагревании в присутствии концентрированной серной кислоты 32 г уксусной кислоты и 50 г пропанола-2, если при этом образовалось 24 г эфира.
9.
Для гидролиза образца жира массой 221 г понадобилось
150 г раствора гидроксида натрия с массовой долей щелочи 0,2.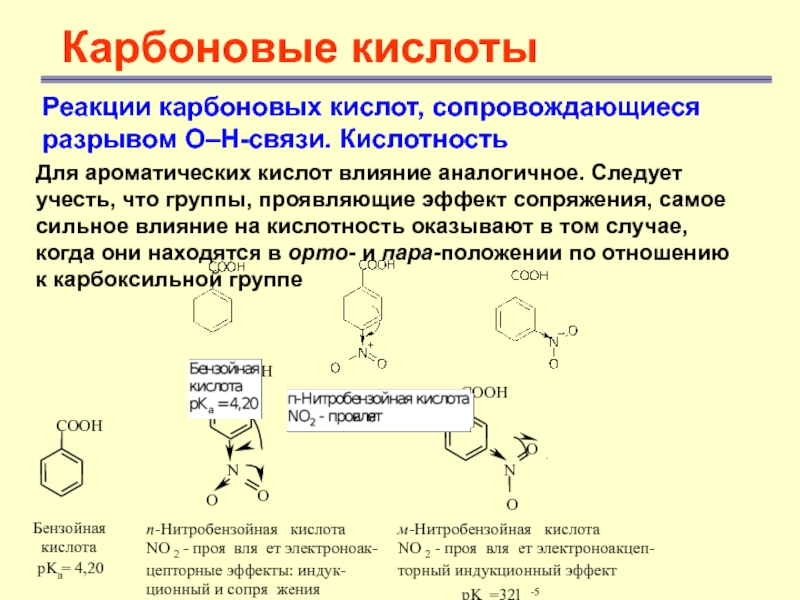 Предложите
структурную формулу исходного жира.
Предложите
структурную формулу исходного жира.
10. Вычислите объем раствора гидроксида калия с массовой долей щелочи 0,25 и плотностью 1,23 г/см 3 , который нужно затратить для проведения гидролза 15 г смеси, состоящей из этилового эфира этановой кислоты, пропилового эфира метановой кислоты и метилового эфира пропановой кислоты.
ВИДЕО ОПЫТ
1. Какая реакция лежит в основе получения сложных эфиров: |
|
а) нейтрализации |
б) полимеризации |
в) этерификации |
г) гидрирования |
2. Сколько изомерных сложных эфиров отвечает формуле С 4 Н 8 О 2: |
|
а) 2 |
|
Жиры и масла — это природные эфиры, которые образованы трехатомным спиртом – глицерином и высшими жирными кислотами с неразветвленной углеродной цепью, содержащими четное число атомов углерода.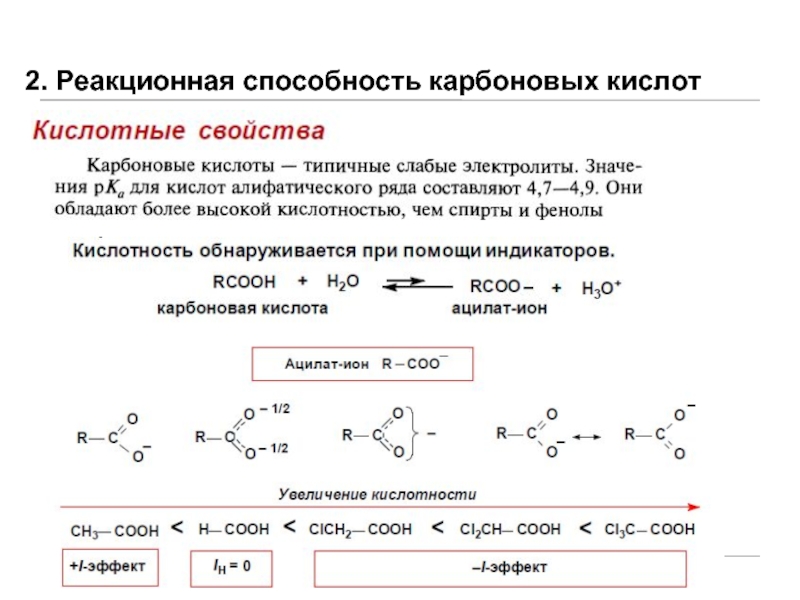 В свою очередь, натриевые или калиевые соли высших жирных кислот называются мылами.
В свою очередь, натриевые или калиевые соли высших жирных кислот называются мылами.
При взаимодействии карбоновых кислот со спиртами (реакция этерификации ) образуются сложные эфиры:
Эта реакция обратима. Продукты реакции могут взаимодействовать друг с другом с образованием исходных веществ — спирта и кислоты. Таким образом, реакция сложных эфиров с водой — гидролиз сложного эфира — обратна реакции этерификации. Химическое равновесие, устанавливающееся при равенстве скоростей прямой (этерификация) и обратной (гидролиз) реакций, может быть смещено в сторону образования эфира присутствием водоотнимающих средств.
Сложные эфиры в природе и технике
Сложные эфиры широко распространены в природе, находят применение в технике и различных отраслях промышленности. Они являются хорошими растворителями
органических веществ, их плотность меньше плотности воды, и они практически не растворяются в ней. Так, сложные эфиры с относительно небольшой молекулярной массой представляют собой легко воспламеняющиеся жидкости с невысокими температурами кипения, имеют запахи различных фруктов. Их применяют в качестве растворителей лаков и красок, ароматизаторов изделий пищевой промышленности. Например, метиловый эфир масляной кислоты имеет запах яблок, этиловый эфир этой кислоты — запах ананасов, изобутиловый эфир уксусной кислоты — запах бананов:
Их применяют в качестве растворителей лаков и красок, ароматизаторов изделий пищевой промышленности. Например, метиловый эфир масляной кислоты имеет запах яблок, этиловый эфир этой кислоты — запах ананасов, изобутиловый эфир уксусной кислоты — запах бананов:
Сложные эфиры высших карбоновых кислот и высших одноосновных спиртов называют восками
. Так, пчелиный воск состоит главным об
разом из эфира пальмитиновой кислоты и мирицилового спирта C 15 H 31 COOC 31 H 63 ; кашалотовый воск — спермацет — сложный эфир той же пальмитиновой кислоты и цетилового спирта C 15 H 31 COOC 16 H 33.
Жиры
Важнейшими представителями сложных эфиров являются жиры.
Жиры — природные соединения, которые представляют собой сложные эфиры глицерина и высших карбоновых кислот.
Состав и строение жиров могут быть отражены общей формулой:
Большинство жиров образовано тремя карбоновыми кислотами: олеиновой, пальмитиновой и стеариновой.
В обычных условиях жиры, содержащие в своем составе остатки непредельных кислот, чаще всего бывают жидкими. Их называют маслами. В основном это жиры растительного происхождения — льняное, конопляное, подсолнечное и другие масла. Реже встречаются жидкие жиры животного происхождения, например рыбий жир. Большинство природных жиров животного происхождения при обычных условиях — твердые (легкоплавкие) вещества и содержат в основном остатки предельных карбоновых кислот, например, бараний жир. Так, пальмовое масло — твердый в обычных условиях жир.
Состав жиров определяет их физические и химические свойства. Понятно, что для жиров, содержащих остатки ненасыщенных карбоновых кислот, характерны все реакции непредельных соединений. Они обесцвечивают бромную воду, вступают в другие реакции присоединения. Наиболее важная в практическом плане реакция — гидрирование жиров. Гидрированием жидких жиров получают твердые сложные эфиры. Именно эта реакция лежит в основе получения маргарина — твердого жира из растительных масел. Условно этот процесс можно описать уравнением реакции:
Они обесцвечивают бромную воду, вступают в другие реакции присоединения. Наиболее важная в практическом плане реакция — гидрирование жиров. Гидрированием жидких жиров получают твердые сложные эфиры. Именно эта реакция лежит в основе получения маргарина — твердого жира из растительных масел. Условно этот процесс можно описать уравнением реакции:
гидролизу :
Мыла
Все жиры, как и другие сложные эфиры, подвергаются гидролизу . Гидролиз сложных эфиров — обратимая реакция. Чтобы сместить равновесие в сторону образования продуктов гидролиза, его проводят в щелочной среде (в присутствии щелочей или Na 2 CO 3). В этих условиях гидролиз жиров протекает необратимо и приводит к образованию солей карбоновых кислот, которые называются мылами. Гидролиз жиров в щелочной среде называют омылением жиров.
При омылении жиров образуются глицерин и мыла — натриевые или калиевые соли высших карбоновых кислот:
Шпаргалка
(реакция этерификации) образуются сложные эфиры:
Эта реакция обратима.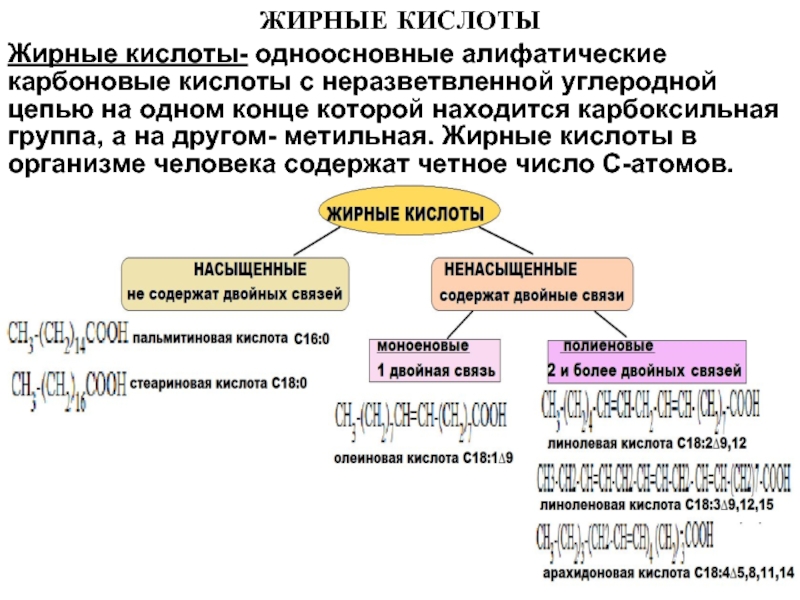 Продукты реакции могут взаимодействовать друг с другом с образованием исходных веществ -спирта и кислоты. Таким образом, реакция сложных эфиров с водой — гидролиз сложного эфира — обратна реакции эте-рификации. Химическое равновесие, устанавливающееся при равенстве скоростей прямой (этерификация) и обратной (гидролиз) реакций, может быть смещено в сторону образования эфира присутствием водоотнимающих средств.
Продукты реакции могут взаимодействовать друг с другом с образованием исходных веществ -спирта и кислоты. Таким образом, реакция сложных эфиров с водой — гидролиз сложного эфира — обратна реакции эте-рификации. Химическое равновесие, устанавливающееся при равенстве скоростей прямой (этерификация) и обратной (гидролиз) реакций, может быть смещено в сторону образования эфира присутствием водоотнимающих средств.
Сложные эфиры в природе и технике
Сложные эфиры широко распространены в природе, находят применение в технике и различных отраслях промышленности (схема 10). Они являются хорошими растворителями органических веществ, их плотность меньше плотности воды, и они практически не растворяются в ней.
Схема 10. Применение сложных эфиров
Так, сложные эфиры с относительно небольшой молекулярной массой представляют собой легковоспламеняющиеся жидкости с невысокими температурами кипения, имеют запахи различных фруктов. Их применяют как растворители лаков и красок, ароматизаторы изделий пищевой промышленности. Например, метиловый эфир масляной кислоты имеет запах яблок, этиловый эфир этой кислоты — запах ананасов, изобутиловый эфир уксусной кислоты — запах бананов.
Например, метиловый эфир масляной кислоты имеет запах яблок, этиловый эфир этой кислоты — запах ананасов, изобутиловый эфир уксусной кислоты — запах бананов.
Сложные эфиры высших карбоновых кислот и высших одноосновных спиртов называют во скажи. Так, пчелиный воск состоит, главным образом, из эфира пальмитиновой кислоты и мирицилового спирта С15Н31СООС31Н63, кашалотовый воск — спермацет — сложный эфир той же пальмитиновой кислоты и цетилового спирта С15Н31СООС16Н33.
Важнейшими представителями сложных эфиров являются жиры.
Жиры — природные соединения, которые представляют собой сложные эфиры глицерина и высших карбоновых кислот.
Состав и строение жиров могут быть отражены общей формулой:
Большинство жиров образовано тремя карбоновыми кислотами — олеиновой, пальмитиновой и стеариновой. Очевидно, две из них — предельные (насыщенные), а олеиновая кислота содержит двойную связь между атомами углерода в молекуле. Таким образом, в состав жиров могут входить остатки как предельных, так и непредельных карбоновых кислот в различных сочетаниях.
Рекомендуем также
27.
 1: Жирные кислоты представляют собой карбоновые кислоты с длинной цепью
1: Жирные кислоты представляют собой карбоновые кислоты с длинной цепью Жирные кислоты представляют собой просто карбоновые кислоты с длинными углеводородными цепями. Длина углеводородной цепи может варьироваться от 10 до 30 атомов углерода (чаще всего 12-18). Неполярная углеводородная алкановая цепь является важным противовесом функциональной группе полярной кислоты. В кислотах с небольшим числом атомов углерода преобладает кислотная функциональная группа, которая придает всей молекуле полярный характер. Однако в жирных кислотах неполярная углеводородная цепь придает молекуле неполярный характер.
-
- Гидрогенизация ненасыщенных жиров и трансжиров
- Насыщенные жиры имеют цепочечную структуру, которая позволяет им очень хорошо складываться, образуя твердое вещество при комнатной температуре. Ненасыщенные жиры не являются линейными из-за углеродов с двойными связями, что приводит к другой молекулярной форме, поскольку углероды sp2 являются тригонально-плоскими.
 Это приводит к тому, что молекулы жира плохо складываются, в результате чего жиры становятся жидкими при комнатной температуре. Ненасыщенные жиры могут быть преобразованы в насыщенные жиры с помощью реакций гидрогенизации.
Это приводит к тому, что молекулы жира плохо складываются, в результате чего жиры становятся жидкими при комнатной температуре. Ненасыщенные жиры могут быть преобразованы в насыщенные жиры с помощью реакций гидрогенизации.
-
- Введение в жирные кислоты
- Жирные кислоты представляют собой карбоновые кислоты с длинными углеводородными цепями. Есть две группы жирных кислот — насыщенные и ненасыщенные. Напомним, что термин «ненасыщенный» относится к наличию одной или нескольких двойных связей между атомами углерода, как в алкенах. В насыщенной жирной кислоте все положения связей между атомами углерода заняты атомами водорода. Точки плавления насыщенных жирных кислот следуют принципу точки кипения, наблюдавшемуся ранее.
-
- Простагландины
- Простагландины были впервые обнаружены и выделены из спермы человека в 1930-х годах Ульфом фон Эйлером из Швеции. Думая, что они происходят из предстательной железы, он назвал их простагландинами. С тех пор было установлено, что они существуют и синтезируются практически в каждой клетке организма. Простагландины похожи на гормоны тем, что действуют как химические мессенджеры, но не перемещаются в другие места, а работают прямо внутри клеток, где они синтезируются.
Миниатюра: шарико-стержневая диаграмма арахидоновой кислоты. (Общественное достояние; SubDural12). Арахидоновая кислота представляет собой полиненасыщенную жирную кислоту, присутствующую в фосфолипидах мембран клеток организма и в изобилии присутствующую в головном мозге, мышцах и печени.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Редуктаза карбоновой кислоты является универсальным ферментом для превращения жирных кислот в топливо и химические продукты.
Abstract
Алифатические углеводороды, такие как жирные спирты и алканы нефтяного происхождения, имеют многочисленные применения в химической промышленности.В последние годы возобновляемый синтез алифатических углеводородов стал возможен благодаря созданию микробов для избыточного накопления жирных кислот. Однако для получения конечных продуктов с желаемыми физико-химическими свойствами (например, жирных альдегидов, алканов и спиртов) необходима дальнейшая конверсия жирной кислоты. Было обнаружено, что редуктаза карбоновой кислоты (CAR) из Mycobacterium marinum превращает широкий спектр алифатических жирных кислот (C 6 – C 18 ) в соответствующие альдегиды.Вместе с широкой субстратной специфичностью альдегидредуктазы или альдегиддекарбонилазы каталитическое превращение жирных кислот в жирные спирты (C 8 –C 16 ) или жирные алканы (C 7 –C 15 ) был воссоздан in vitro. Эта концепция была применена in vivo , в сочетании с тиоэстеразой, зависящей от длины цепи, для создания штаммов Escherichia coli BL21(DE3), которые были способны синтезировать жирные спирты и алканы.Титр жирных спиртов, превышающий 350 мг·л -1 , был получен на минимальных средах с добавлением глюкозы. Кроме того, путем объединения CAR-зависимого пути с экзогенной липазой, генерирующей жирные кислоты, натуральные масла (кокосовое масло, пальмовое масло и масляные тела водорослей) были ферментативно преобразованы в жирные спирты в широком диапазоне длин цепей (C 8 ). –C 18 ). Вместе с дополнительными ферментами широкая субстратная специфичность и кинетические характеристики CAR открывают дорогу для прямого и адаптированного катализируемого ферментами превращения липидов в готовые к использованию химические продукты.
Производство огромного количества химических веществ, которые используются в современном обществе, сильно зависит от ограниченных запасов ископаемого топлива. Экологические проблемы и рост цен на ископаемое топливо стимулировали поиск альтернативных подходов, которые были бы одновременно устойчивыми и возобновляемыми. Одним из таких подходов является использование сконструированных микроорганизмов для каталитического превращения фотосинтетических метаболитов в желаемые конечные продукты (1). Благодаря недавним достижениям в области биологических методов и инструментов, микроорганизмы могут быть сконструированы для производства множества химических веществ на основе недорогих возобновляемых исходных материалов, таких как сахара (2).
Алифатические углеводороды, такие как жирные спирты и алканы, полученные из нефти, находят множество применений в качестве топлива, ароматизаторов, смягчающих средств, пластификаторов, загустителей и моющих средств (рис. 1 A ). В природе алифатическая основа этих химических веществ может быть синтезирована de novo посредством хорошо известного метаболического процесса «синтеза жирных кислот» (3). В этом процессе ацетил-КоА первоначально конденсируется с белком-носителем малонилацила (АСР) с образованием оксоацил-АСР. Повторяющийся цикл реакций, включающий конденсацию Клайзена, восстановление кетонов, дегидратацию и восстановление двойной связи, удлиняет оксоацил-АСР, по две углеродные единицы за раз, с образованием жирного ацил-АСР, необходимого промежуточного соединения для мембранного синтеза.В последние годы с использованием тиоэстераз жирных ацил-АСР, специфичных для цепи, которые расщепляют жирные ацил-АСР с образованием соответствующей жирной кислоты (кислот), путь «синтеза жирных кислот» был использован для получения алифатических углеводородных цепей. (4, 5).
Рис. 1.Конверсия биомассы в жирные спирты и алканы. ( A ) Фотоавтотрофные организмы, собирая световую энергию, способны генерировать первичные источники углерода, такие как глюкоза или липиды, которые могут быть направлены на синтез жирных спиртов и/или алканов.AAR, ацил-АСР редуктаза; ACL, ацил-КоА-лигаза; ACP, белок-носитель ацила; ACR, жирная ацил-КоА-редуктаза [ACR1 (21) и ACR2 (25)] ; ADC, цианобактериальная альдегиддекарбонилаза; AHR, альдегидредуктаза; CAR, редуктаза карбоновой кислоты; ТЭС, тиоэстераза. ( B ) Каталитический цикл CAR, адаптированный из исх. 9. ( i ) Субстрат жирной кислоты проникает в активный центр и связывается вблизи домена АТФ. ( ii ) Аденозильная группа добавляется к жирной кислоте, высвобождая дифосфат.( iii ) Тиоловая группа, расположенная на плече фосфопантетеина (сплошная наклонная линия), реагирует с электрофильной карбонильной группой, что приводит к образованию тиоэфирной связи. AMP высвобождается в процессе. ( iv ) Плечо фосфопантетеина перемещает тиоэфирное промежуточное соединение в домен NADPH. ( v ) Промежуточный тиоэфир восстанавливается путем переноса гидрида из НАДФН с образованием альдегидного продукта. Продукт вместе с НАДФ + высвобождается, и каталитический цикл повторяется.
Однако для получения конечных продуктов с желаемыми физико-химическими свойствами необходима дальнейшая конверсия жирной кислоты, обычно начинающаяся с ее «активации» в жирный ацил-КоА. На основании этого Стин и соавт. (6) разработали путь производства жирных спиртов с использованием жирной ацил-КоА-редуктазы в сочетании с нативной альдегидредуктазой (AHR) (рис. 1 —). Второй недавно обнаруженный путь образования жирных спиртов начинается с нативных жирных кислот в предварительно активированном состоянии путем прямого превращения ацил-АСР в альдегид, катализируемого ацил-АСР-редуктазой, хотя эта система остается плохо изученной (7).
Здесь мы сообщаем об уникальных путях образования как жирных спиртов, так и алканов, которые происходят через другой путь активации жирных кислот, который зависит от класса ферментов, называемых редуктазой карбоновых кислот (CAR). Ранее было известно, что эти ферменты катализируют восстановление ароматических и короткоцепочечных карбоновых кислот до соответствующих альдегидов в присутствии АТФ и НАДФН (8). Центральным каталитическим свойством ферментов CAR является простетическая группа 4′-фосфопантетеин, которая ковалентно связана фосфодиэфирной связью с остатком серина.Образование и вставка этой простетической группы опосредуется фосфопантетеинилтрансферазой (9). В механизме реакции участвуют три ключевых этапа: ( i ) аденилирование субстрата связанной жирной кислоты с образованием комплекса АМФ-ацил жирной кислоты, ( ii ) образование тиоэфирной связи между жирно-ацильной частью и фосфопантетеиновым протезом. группу и ( iii ) восстановление промежуточного тиоэфира до альдегида (рис. 1 B ).
В следующей работе мы ( i ) описываем биохимические свойства, включая профиль субстрата и кинетические характеристики Mycobacterium marinum CAR, ( ii ) демонстрируем, как этот фермент можно применять для микробного производства алканы и спирты, ( iii ) подчеркивают значимость этого фермента в дополнении биологических систем, генерирующих жирные кислоты, и ( iv ) иллюстрируют, как широкая совместимость между CAR и другими нижестоящими ферментами может открыть дорогу для прямого и адаптированного преобразование липидов в готовые к использованию химические товары.
Результаты
Экспрессия и активность CAR in vitro.
Редуктаза карбоновой кислоты из видов Nocardia была ранее обнаружена He et al. (10) и показано, что он проявляет широкую субстратную специфичность по отношению к карбоновым кислотам (8). Мы предположили, может ли наблюдаемая неразборчивость семейства CAR распространяться также на более длинные и линейные жирные кислоты. Была выбрана предполагаемая последовательность CAR из Mycobacterium marinum (инвентарный номер UniProt B2HN69, CAR), которая содержала консенсусные последовательности, характерные для ранее охарактеризованного фермента CAR (10): ( i ) домен АТФ, ( ii ) фосфопантетеиновые присоединения. сайт (LGGXSXXA) и ( iii ) складку Россмана для связывания НАДФН.Фосфопантетеинилтрансфераза, Sfp, из Bacillus subtilis коэкспрессировалась вместе с CAR, поскольку ранее было показано, что это необходимо для максимальной активности (9). Фермент CAR очищали с помощью аффинной хроматографии на основе никеля, и его активность подтверждали in vitro путем окисления НАДФН в присутствии бензойной кислоты ( SI Приложение , рис. S1 и S2). Было обнаружено, что он имеет селективное предпочтение NADPH по сравнению с NADH с очевидными значениями K m 362 ± 13 мкМ, 48 ± 8 мкМ и 115 ± 13 мкМ для бензойной кислоты, НАДФН и АТФ, соответственно, и В макс. из 2.32 ± 0,1 мкмоль·мг -1 CAR ( SI Приложение , рис. S3). Оптимальная активность наблюдалась при pH 7,5 с периодами полураспада in vitro 73, 70 и 48 часов при 26, 30 и 37 °C соответственно, что указывает на относительно стабильный фермент ( SI, Приложение , рис. S4). и С5).
Кинетическая характеристика CAR.
Фермент CAR был дополнительно охарактеризован в отношении алифатического ряда насыщенных и ненасыщенных жирных кислот. Образование альдегидов было обнаружено с помощью ГХ-МС для субстратов в диапазоне от C 4 до C 18 ( SI Приложение , рис.С6). Кажущиеся и наблюдаемые каталитические скорости ( k cat ) затем определяли высокопроизводительным способом путем мониторинга окисления НАДФН. Значения k cat варьировались от 0,3 ± 0,1 до 289 ± 7 мин -1 и постепенно уменьшались с увеличением длины цепи (рис. 2 A ). По сравнению с насыщенным аналогом, ненасыщенные жирные кислоты C 18:1 , C 18:2 и C 18:3 вызывали более высокие скорости реакции, хотя скорость была снижена из-за более высокой степени ненасыщенности.Кажущиеся значения K m , определенные для диапазона субстратов C 4 –C 12 , уменьшались с увеличением длины цепи субстрата, что приводило к улучшению каталитической эффективности ( k cat / K m ) в сторону субстратов с более длинной цепью (рис. 2 B и C и SI Приложение , рис. S7). В целом, биохимические характеристики CAR показывают, что это фермент, который принимает широкий спектр алифатических жирных кислот.
Рис. 2.Кинетическая характеристика CAR и . ( A ) Наблюдаемые и кажущиеся значения k cat были получены для субстратов жирных кислот в диапазоне от C 4 до C 18 , включая ненасыщенные аналоги C 18 . Кроме того, ( B ) K M и ( C ) каталитическая эффективность ( K CAT / K M ) были определены для C 4 -C 12 субстраты жирных кислот.
Зависимое от CAR производство жирных спиртов и алканов in vivo.
Мы рассмотрели возможность использования фермента CAR в качестве биотехнологического катализатора для химической обработки алифатических жирных кислот. Фермент CAR в сочетании с другими ферментами можно использовать для превращения жирных кислот в относительно стабильные конечные продукты алифатических углеводородов, такие как жирные спирты и алканы (11). Для крупномасштабного синтеза этих химических продуктов потребуется постоянное пополнение косубстратов CAR, NADPH и АТФ, чтобы обеспечить экономически устойчивый процесс, что требует подхода in vivo.Основываясь на предыдущем инженерном подходе (6), наряду с новым пониманием ферментативной способности CAR, мы разработали уникальный метаболический путь для синтеза жирных спиртов. Этот путь включал четыре генных продукта: Escherichia coli TesA для высвобождения и метаболического избыточного накопления свободных жирных кислот из нативных метаболитов ацил-АСР/КоА, B. subtilis Sfp для активации фермента CAR, M. marinum CAR для активации и последующего восстановления свободной жирной кислоты до жирного альдегида и ранее охарактеризованный AHR из Synechocystis видов PCC 6803, slr1192 (12) для дальнейшего восстановления жирного альдегида до жирного спирта.Индукция инженерного пути у E. coli в аэробных условиях на сложных средах приводила к накоплению как насыщенных, так и ненасыщенных жирных спиртов (C 12 –C 18 ) с титром ~200 мг·л − 1 культуры (рис. 3 A ). Кроме того, замена AHR на альдегиддекарбонилазу (ADC) приводила к образованию ундекана, тридекана, пентадецена и гептадецена с титром ~2 мг·л -1 культуры (рис. 3 A ).
Рис. 3.Применение фермента CAR для синтеза жирных спиртов и алканов. ( A ) Производство жирных спиртов и алканов in vivo. Введенный метаболический путь графически проиллюстрирован в верхней части A . Рекомбинантные штаммы TPC-slr1192 his (сплошная черная линия) и TPC-ADC his (сплошная синяя линия) культивировали в течение 24 ч при 30 °С, 180 об/мин. Для сравнения также был включен контрольный штамм BL21 (DE3), содержащий «пустые» плазмиды (сплошная серая линия).После экстракции метаболита (методы ) были идентифицированы следующие хроматографические пики: 1, алкан С 11 ; 2, С 13 алкан; 3, С 12 альдегид; 4, С 12 спирт; 5, C 12:1 спирт; 6, С 15:1 алкен; 7, С 14:1 альдегид; 8, C 14:1 спирт; 9, С 14 спирт; 10, С 17:1 алкен; 11, С 14 жирная кислота; 12, С 16:1 спирт; 13, С 16 спирт; 14, С 16:1 жирная кислота; 15, С 16 жирная кислота; 16, С 18:1 спирт; и 17, С 18:1 жирная кислота.( B ) Производство жирных спиртов in vivo в минимальной среде с добавлением глюкозы. Различные штаммы E. coli ( SI, Приложение , Таблица S3) культивировали в минимальной среде с добавлением глюкозы в течение до 48 часов. Внутриклеточное накопление жирных спиртов определяли через определенные промежутки времени. ( C ) Влияние TesA, CAR и Ahr и его на продукцию жирных спиртов in vivo. Все штаммы культивировали в минимальной среде в течение 24 ч при 180 об/мин, 30 °C и количественно определяли общее содержание жирных спиртов в культурах целых клеток (методы ).
Коэкспрессия с
E. coli Ahr приводит к повышенному накоплению жирных спиртов in vivo.По сравнению с другими недавними исследованиями с использованием минимальной среды, производство жирных спиртов in vivo оказалось низким. Титры жирных спиртов достигали только 49 ± 1 мг·л -1 при стехиометрической эффективности 1% (рис. 3 B ), а пик продукции приходился на период от средней экспоненциальной до ранней стационарной фазы. Было обнаружено, что низкий титр жирных спиртов и стехиометрическая эффективность обусловлены плохой конверсией альдегида в спирт, поскольку фракции растворимого лизата показали относительно слабую активность AHR in vitro ( SI Приложение , рис.С8). Чтобы еще больше повысить эффективность и выход сконструированного пути, мы рассмотрели E. coli в качестве возможного источника кандидатов AHR, учитывая, что синтез жирных спиртов происходил даже для штамма TPC, в котором отсутствовал рекомбинантный slr1192 (his) ( Рис. 3 B ). Анализ BLAST показал, что штамм E. coli YjgB (далее Ahr) имеет наибольшее сходство аминокислотной последовательности с slr1192 (сходство 64%) и, кроме того, содержит консервативные остатки цистеина, необходимые для связывания цинка (13) ( SI, Приложение ). , Инжир.С9). Предварительная характеристика подтвердила, что Ahr является альдегидредуктазой, способной принимать широкий спектр коммерчески доступных альдегидов с избирательным предпочтением НАДФН. Замена slr1192 (his) на Ahr his привела к трехкратному увеличению титров жирных спиртов (148 ± 6 мг·л -1 культуры) наряду с улучшением стехиометрической эффективности до 4,3% (рис. 3). Б ). Общая продукция дополнительно повышалась при культивировании на сложных средах или на минимальных средах с повышенным содержанием глюкозы и NH 4 Cl, что приводило к титру 357 ± 3 и 363 ± 15 мг·л -1 (рис.3 C ) соответственно. Было обнаружено, что включение TesA и CAR и CAR вместе с кислородом необходимо для производства жирных спиртов. Повышение урожайности штамма TPC-Ahr his было связано с повышенной активностью AHR, возникающей из-за повышенных уровней Ahr his ( SI Приложение , рис. S8). Мы также отметили, что «his» варианты slr1192 и Ahr приводили к более высоким уровням экспрессии белка по сравнению с их аналогами дикого типа, предполагая, что включение N-концевой последовательности, кодирующей гистидиновую метку, может придавать определенную степень стабильности в (после )транскрипционный и/или (пост)трансляционный уровень.
Метаболическая платформа для широкого спектра синтеза жирных спиртов и алканов.
Как и в случае фермента CAR his , было обнаружено, что Ahr his принимает широкий спектр субстратов со специфичностью в отношении NADPH ( SI Приложение , рис. S10–S12). Это проявление неразборчивости обоих ферментов особенно выгодно, потому что оно потенциально позволяет образовывать конечные продукты с различной длиной цепи. Чтобы продемонстрировать это, была проведена серия реакций in vitro в присутствии как CAR his , так и Ahr his с жирными кислотами (от C 6 до C 16 ) в качестве исходных субстратов.В реакционные смеси добавляли необходимые косубстраты и инкубировали до 4 ч без встряхивания при 30 °С. Было обнаружено, что все протестированные субстраты жирных кислот восстанавливаются до соответствующих им спиртов, что подтверждается ГХ-МС, с выходом конечного продукта до 100% (рис. 4 A ). Субстрат жирных кислот C 8 вызывал самую высокую скорость превращения при 1,12 мкмоль⋅мин -1 ⋅мг общего белка -1 , как установлено по окислению НАДФН (рис. 4 B и SI Приложение ). , Инжир.S13 A – F ). Кроме того, путем замены Ahr his на недавно охарактеризованный рекомбинантный ADC his (7) из Prochlorococcus marinus альдегиды можно направить на образование алканов C 7 –C 15 с выходом продукта не более более 15% (рис. 4 С и СИ Приложение , рис. S13 G – К ). Низкая скорость превращения в алканы неудивительна, учитывая медленный оборот (<10 ч -1 ) фермента декарбонилазы (14).
Рис. 4.Широкодиапазонная конверсия жирных кислот в жирные спирты и алканы. ( A ) Образование жирных спиртов in vitro. Реакции проводили в 50 мМ Tris⋅HCl-буфере, содержащем CAR his (10–200 мкг·мл -1 ), Ahr his (10 мкг·мл -1 ), 1 мМ АТФ, 10 мМ MgCl 2 , 1 мМ НАДФН и 0,25 мМ С 6 – С 16 жирных кислот. ( B ) Скорость превращения жирных кислот в спирты in vitro. Реакции контролировали при 340 нм в течение 6 мин с интервалом 30 с.( C ) Образование алканов in vitro. То же, что и A , за исключением того, что Ahr его был заменен на ADC его . В A и C выход продукта в процентах на субстрат за 4-часовой период указан в скобках над каждым пиком.
Сочетание гидролиза триацилглицерина с CAR-зависимым восстановлением жирных кислот.
Триацилглицерин (TAG), который очень богат жирными ацильными фрагментами, может быть использован в качестве потенциального источника субстратов для фермента CAR.Биохимическое превращение ТАГ в альдегиды можно осуществить в два этапа: ( i ) опосредованный липазой гидролиз ТАГ с образованием глицерина и свободных жирных кислот с последующим ( ii ) восстановлением жирных кислот до соответствующих альдегидов с помощью CAR. . Реакции in vitro, содержащие очищенную липазу и активный CAR вместе с необходимыми косубстратами, инкубировали с ТАГ C 8 в качестве исходного субстрата. На основании эксклюзионной ВЭЖХ наблюдалось истощение ТАГ-субстрата наряду с накоплением альдегидного продукта ( SI Приложение , рис.S14 А ). Исключение фермента CAR или липазы не привело к образованию альдегида, тогда как использование ТАГ C 12 привело к образованию более длинного альдегида C 12 ( SI Приложение , рис. S14 B – Д ).
Дополнение CAR-зависимых путей системами, генерирующими жирные кислоты.
Концепция использования ТАГ для преобразования в жирные спирты получила дальнейшее развитие путем создания биологической системы, которая могла бы преобразовывать натуральные масла, содержащие большое количество ТАГ, в жирные спирты.Мы отметили, что при дополнении CAR-сверхэкспрессированных клеток E. coli рядом жирных кислот (C 4 -C 12 ), помимо глюкозы, можно было обнаружить альдегидные «ароматы» по запаху. Это свидетельствует о том, что свободные жирные кислоты могут поглощаться клетками E. coli и становиться доступными для фермента CAR, за исключением механизма связывания FadD, выдвинутого Klein et al. (15). Исходя из этого, мы пришли к выводу, что свободные жирные кислоты после высвобождения из масляных субстратов экзогенной липазой могут естественным образом ассимилироваться рекомбинантным E.coli , содержащие ферменты CAR и Ahr и его , и метаболически превращаются в соответствующий спирт в присутствии глюкозы. Чтобы проверить это, предварительно индуцированные стационарные клетки PC-Ahr his были дополнены экзогенной липазой Candida rugosa , глюкозой (необходимой для клеточного синтеза кофакторов, АТФ и НАДФН) и тремя различными источниками ТАГ: водоросли ( Chlamydomonas reinhardtii ), кокосовое масло и пальмовое масло. В случае с водорослями для облегчения высвобождения масляных телец использовали встречающийся в природе безклеточный штамм cc406 (16).Как и предполагалось, мы наблюдали образование жирных спиртов C 8 –C 18 , включая их ненасыщенные аналоги, в течение короткого периода времени (5 ч) (рис. 5 и SI Приложение , рис. S15). Максимальная производительность 25,8 ± 0,4, 1,2 ± 0,1 и 2,3 ± 0,4 мкг общего жирного спирта⋅ч -1 ⋅мг -1 массы сухих клеток была получена для субстратов кокосового масла, пальмового масла и масляных телец водорослей. , соответственно, с эффективностью преобразования ∼10–20%.
Рис.5.Конверсия натуральных масел в жирные спирты. Упрощенная схема реакции показана в A . Собранные клетки из предварительно индуцированной культуры PC-Ahr ресуспендировали в среде, забуференной 50 мМ фосфатом калия, с добавлением глюкозы и липазы (0,1–1 мг·мл -1 ) и инкубировали при 30 °C при встряхивании при 150 об/мин в течение до 5 часов в присутствии ( B ) водорослей ( C. reinhardtii штамм cc406) или ( C ) кокосового масла. * Промежуточный продукт жирной кислоты.
Обсуждение
Основываясь на результатах этой работы, фермент CAR имеет значение для синтеза биотоплива и/или химических продуктов, полученных из жирных кислот, благодаря своей каталитической способности превращать ряд жирных кислот в соответствующие жирные альдегиды, последний из которых служит точкой разветвления для синтеза алканов и спиртов.
Высокие уровни продукции жирных спиртов (>350 мг·л -1 ) в этом исследовании были получены в относительно простых условиях без высокоплотного культивирования или изменения генома хозяина.Однако выходы превышают данные, о которых сообщалось в предыдущих работах (6, 7, 17) в отношении производства жирных спиртов в E. coli , в которых максимальная продуктивность ~60 мг·л -1 (C 12 -C 16 ), ~330 мг·л -1 (C 6 -C 10 ) и ~140 мг·л -1 (C 14 -C 18 ) в некоторых случаях только после обширной реинжиниринга организма-хозяина. Тем не менее, стехиометрическая эффективность штаммов, экспрессирующих путь CAR (<5%), намного ниже потенциального максимума, что позволяет предположить, что дальнейшая оптимизация все еще возможна.Прогнозируемое распределение метаболического потока штаммов с максимальным выходом жирных спиртов ( SI Приложение , Стехиометрическая оценка ) показывает значительное перераспределение центрального углеродного метаболизма (высокий поток пентозофосфатного пути и отсутствие продуктов ферментации) по сравнению со штаммами, у которых только биомасса целевая функция. Таким образом, оптимизация метаболизма хозяина и стимуляция биосинтеза жирных кислот (4) могут привести к более высокому выходу жирных спиртов, если предположить, что токсичность жирных спиртов не будет ограничивающей.Производство алканов остается несколько проблематичным в E. coli из-за низкого уровня фермента декарбонилазы (7 ч -1 ) (14) и перехвата нативными альдегидредуктазами (18), которые обычно имеют гораздо большие значения k cat (до 10 5 мин -1 ) (12). Таким образом, высокие титры можно реально ожидать только на фоне E. coli , который лишен большей части, если не всей, активности AHR после того, как были идентифицированы компоненты и/или среда, необходимые для оптимальной активности декарбонилазы.
CAR-зависимый путь можно использовать для комплементации систем, способных генерировать жирные кислоты из таких источников, как жирный ацил-АСР (19) или жирный ацил-КоА, как недавно было показано в подходе обратного β-окисления Dellomonaco et al. (17). Эта концепция была продемонстрирована с помощью пути, основанного на TesA, и путем прямого биохимического превращения масел из растений и цельноклеточных водорослей в жирные спирты. Последний подход представляет особый интерес, поскольку он позволяет получать жирные кислоты из альтернативных биологических источников, таких как растения и водоросли, которые, как известно, накапливают большое количество масел (20).Однако низкие выходы продуктов из таких источников (∼10–20%) ясно указывают на то, что для дальнейшего повышения эффективности превращения этих веществ может потребоваться преодолеть ряд потенциальных метаболических ограничений (например, поглощение жирных кислот и поступление АТФ и НАДФН). системы первого поколения.
Одно интересное наблюдение пути липазы/ТАГ связано с внутриклеточным преобразованием жирных кислот в соответствующие жирные спирты и имеет значение для нашего текущего понимания поглощения жирных кислот прокариотами.Гипотеза, выдвинутая Klein et al. (15) заключается в том, что поглощение жирных кислот тесно связано с их ацилированием до жирного ацил-КоА посредством активности FadD в процессе, известном как «векторное ацилирование». Поскольку CAR не может использовать жирный ацил-КоА в качестве субстрата, это указывает на то, что внутриклеточное поглощение свободной жирной кислоты может происходить независимо от связывающей активности FadD. Диффузионный, триггерный механизм вряд ли объясняет наблюдаемое почти полное поглощение жирных кислот. Скорее, должен быть задействован активный транспортный механизм.Вместе это предполагает, что ( i ) векторное ацилирование не так сильно связано, как считалось ранее, и/или ( ii ) что действует неизвестный механизм, который не зависит от векторного ацилирования. Другая возможность заключается в том, что реакции CAR и AHR вместе способствуют векторному поглощению, предполагая, что быстрое удаление жирных кислот с внутренней мембраны является существенным вкладом FadD в поглощение жирных кислот. С термодинамической точки зрения маловероятно, что CAR сам по себе может заменить FadD, хотя вместе CAR и AHR могут ( SI Приложение , Таблица S1).В любом случае, выяснение механизма было бы полезно для будущей инженерии прокариотических хозяев, зависящих от внешнего источника жирных кислот.
Длина цепи и наличие или отсутствие химических функциональных групп сильно влияют на физико-химические свойства и органолептические характеристики конечных продуктов. Управление этими параметрами потенциально позволит синтезировать ряд конечных углеводородных продуктов с многочисленными приложениями. До сих пор ни в одной системе ни in vitro, ни in vivo не было продемонстрировано преобразование профиля длины цепи жирной кислоты столь широкого, как C 6 , в C 18 .В работе, описанной Steen et al. (6), диапазон длин цепей был ограничен от C 12 до C 16 , ограничение, которое возникает из-за узкого профиля субстрата фермента ACR1 (21). Недавно открытые ацил-АСР-редуктазы цианобактерий также обладают очень узкой специфичностью по длине цепи (от C 14 до C 18 ) (7), в то время как Dellomonaco et al. (17) сообщили о длинах цепей преимущественно в диапазоне от C 4 до C 10 . В настоящем исследовании широкие и перекрывающиеся субстратные профили ферментов CAR, Ahr и ADC позволяют гораздо более широкому спектру продуктов (C 6 – C 18 ), включая как жирные спирты, так и алканы, образовываться из соответствующие жирные кислоты.При условии, что специфичность длины цепи можно контролировать на уровне тиоэстеразы (22), платформа на основе CAR обеспечивает прочную основу для «метаболической настройки» длины цепи алканов и жирных спиртов. Конечно, использование ферментов широкого спектра действия, таких как CAR и ADC, может поставить под угрозу выживаемость и целостность системы-хозяина из-за нежелательной конверсии ключевых метаболитов из других путей. Разработка систем-хозяев для эффективного и высокопродуктивного синтеза узкого диапазона конечных продуктов, скорее всего, будет зависеть от ферментов с ограниченным, а не широким диапазоном субстратной специфичности.Тем не менее, дальнейшие усовершенствования системы могут быть сделаны путем выбора изоформ ферментов с желаемыми кинетическими характеристиками.
Основной причиной разработки CAR-зависимых путей было расширение диапазона длин субстратных цепей синтеза жирных спиртов и алканов. Однако с точки зрения метаболической инженерии эти пути предлагают несколько других потенциальных преимуществ по сравнению с другими известными путями жирных спиртов (рис. 1), которые обобщены в SI, Приложение , таблицы S1 и S2.Во-первых, и CAR, и FadD используют гидролиз АТФ, что приводит к путям с более благоприятным общим стандартным изменением свободной энергии (-35,9 кДж·моль -1 ), чем путь цианобактерий (-3,9 кДж·моль -1 ). ). Во-вторых, каталитические скорости in vitro ферментов, необходимых для CAR-зависимых путей, значительно превышают таковые для AAR- и FadD-зависимых путей. В-третьих, повышенная активность AHR, обеспечиваемая сверхэкспрессией Ahr, сильно стимулирует синтез жирных спиртов (Fig. 3). Кроме того, фермент CAR с его кофактором фосфопантетеином вполне может иметь преимущество перед КоА-зависимым путем FadD.В отличие от FadD, который требует постоянного поступления свободного КоА для активации жирных кислот, ковалентно присоединенный фосфопантетеин образует структурную и химическую предпосылку для активации жирных кислот, что позволяет избежать прямой потребности в КоА. Кроме того, чтобы облегчить двухстадийное превращение жирной кислоты в альдегид, субстрат жирной кислоты остается связанным с CAR (через тиоэфирную связь). Такой механизм, вероятно, дает пространственное и стерическое преимущество по сравнению с путем FadD, который зависит от последовательного высвобождения различных промежуточных соединений из активного центра фермента.Трудно рассуждать об относительной значимости вышеуказанных параметров для потока пути, поскольку существуют и другие неизвестные факторы, такие как локализация субстрата и общая активность ключевых ферментов in vivo (CAR, ACR1 и AAR), которые, вероятно, влияют на функциональность пути. Кроме того, различия в выходе между этим и другими опубликованными исследованиями не могут быть объяснены изменениями в стехиометрии пути, поскольку потенциальный максимальный выход жирных спиртов только на 1,7–1,9% выше для пути цианобактерий ( SI Приложение , Стехиометрическая оценка ). .Тем не менее, когда известно, все вышеперечисленные параметры благоприятны для пути CAR-AHR, что может объяснить его более высокую продуктивность по сравнению с ранее сконструированными путями (6, 7, 17).
Помимо CAR, другим важным компонентом пути, идентифицированным в настоящем исследовании, является Ahr. С точки зрения функциональности фермента он очень выгодно отличается от альдегидредуктазы E. coli , YqhD, и, скорее всего, хорошо подходит для инженерных целей. Хотя активность Ahr недавно была отмечена в (18), мы однозначно демонстрируем, что этот фермент катализирует восстановление алифатических альдегидов до спиртов с субстратным профилем, по крайней мере, от C 4 до C 16 и селективным предпочтение НАДФН.На основании экспериментальной проверки его каталитической активности в этом исследовании, а также в других (18, 23) замена текущего названия гена yjgB, на ahr ( a lde h yde r eductase) предлагается обозначать каталитическую функцию этого продукта гена.
Таким образом, учитывая его способность принимать широкий спектр субстратов алифатических жирных кислот, семейство ферментов CAR, несомненно, будет полезным катализатором для синтеза химических продуктов, полученных из жирных кислот, таких как жирные спирты и алканы.
Методы
Полные протоколы приведены в Приложение SI , Методы .
Штаммы и плазмиды.
Гены, кодирующие M. Marinum Автомобиль и СФР от B. subtilis были оптимизированы кодоном для E.coli (GenScript), тогда как TESA , SLR1192 и AHR были усилены от E .coli BL21(DE3) и Synechocystis видов PCC 6803 геномов методом ПЦР. Плазмидные векторы были сконструированы стандартными методами и описаны в SI, Приложение , Таблицы S3-S5.Множественные гены были собраны в искусственных оперонах (24). Плазмиды использовали для трансформации E. coli BL21 (DE3) с получением штаммов, перечисленных в SI, Приложение , Таблица S6, с генными продуктами, перечисленными в SI, Приложение , Таблица S7.
Экспрессия и очистка белков.
Клетки выращивали в среде Overnight Express Instant TB Medium (Novagen) и лизировали лизоцимом (2 мг·мл -1 ) и 2% (об./об.) гексана. Рекомбинантные белки очищали с помощью геля His-Select Nickel Affinity Gel (Sigma Aldrich) в соответствии с инструкциями производителя.
Характеристика ферментов.
Для анализа CAR реакции содержали CAR (0–10 мкг·мл -1 ), 1 мМ НАДФН, 1 мМ АТФ, 10 мМ MgCl 2 и 0,5 мМ жирных кислот. Для анализов AHR реакции содержали Ahr his (1 или 10 мкг·мл -1 ), 1 мМ NADPH и 0,5 мМ C 4 –C 12 альдегидов или C
Производство жирных спиртов in vivo.
Штаммы культивировали либо в быстродействующей TB-среде Overnight Express (Novagen), либо в определенной минимальной среде. Для количественного определения общего жирного спирта 100 мкл клеточной культуры энергично смешивали с 200 мкл ацетона и микроцентрифицировали (17 000 × г , 5 мин), а полученный супернатант анализировали с помощью ГХ-МС. Все стехиометрические оценки были сделаны в минимальной среде. Если в тексте указана ошибка, она представляет собой SE (SEM, n = 2–4).Расчет стехиометрической эффективности описан в SI Приложение , Методы .
Производство жирных спиртов и алканов in vitro и in vivo.
Синтез алканов in vitro проводили, как описано ранее (14), с добавлением CAR his (100 мкг·мл -1 ), 1 мМ НАДФН, 1 мМ АТФ и 0,5 мМ жирной кислоты (С 4 –C 16 ). Для образования жирных спиртов in vitro ADC his заменяли на Ahr his (10 мкг·мл -1 ).Для превращения ТАГ в альдегиды in vitro субстрат жирной кислоты заменяли липазой (100 мкг·мл -1 ) и 1 мМ суспензиями коммерчески очищенных ТАГ. Для опосредованного липазой образования жирных спиртов in vivo клетки ресуспендировали в калий-фосфатном буфере с источниками ТАГ (1), C. reinhardtii cc406 (2), пальмовым маслом (Afroase) и (3) кокосовым маслом (Biona Organic ).
Благодарности
Мы благодарим Б. А. Небеля за организацию анализа методом эксклюзионной ВЭЖХ, О.Kruse и M. Jokel за предоставление штамма водорослей cc406, N. Marsh за предоставление pET28-ADC и его плазмиды , A. Pasztor и F. Guerrero за клонирование adc и tesA соответственно. Эта работа была поддержана Европейским исследовательским советом в рамках Седьмой рамочной программы Европейского союза (FP7/2007-2013)/Европейского исследовательского совета по соглашению о гранте 260661 (для PRJ) и премии Wolfson Research Merit Award от Королевского общества (для NJT).
Сноски
-
Вклад авторов: М.К.А., Н.Дж.Т. и П.Р.Дж. проектное исследование; М.К.А. проведенное исследование; М.К.А., Нью-Джерси и П.Р.Дж. проанализированные данные; и M.K.A., N.J.T. и P.R.J. написал бумагу.
-
Авторы заявляют об отсутствии конфликта интересов.
-
Эта статья является прямой отправкой PNAS.
-
Эта статья содержит вспомогательную информацию в Интернете по адресу www.pnas.org/lookup/suppl/doi:10.1073/pnas.1216516110/-/DCSupplemental.
Краткое введение в жирные кислоты
Краткое введение в жирные кислоты
(A) Это структура стеариновой кислоты, 18-углеродной насыщенной жирной кислоты.Обычная система нумерации, начиная с карбоновой кислоты, показана синим цветом. Углерод и кислород функциональной группы карбоновой кислоты окрашены в красный цвет. (B) Это структура олеиновой кислоты, 18-углеродного ненасыщенного жира. Углеродные группы функциональной группы алкена, место ненасыщенности, находятся в прямоугольнике со скругленными углами. Поскольку существует только одна двойная связь, олеиновая кислота является примером мононенасыщенной жирной кислоты. Это также иллюстрирует систему маркировки омега, где цифры синего цвета обозначают число от омега-1, углерода, наиболее удаленного от группы карбоновой кислоты, до первого углерода двойной связи.Поскольку первый углерод в двойной связи — это углерод 9, олеиновая кислота является жирной кислотой омега-9. (С) Это линолевая кислота. Чтобы упростить более крупные молекулы, ученые часто используют рисунки с линиями и углами. На этих рисунках каждая линия представляет собой связь, а каждый изгиб — атом углерода. Большинство атомов водорода не показаны, и предполагается, что каждый углерод имеет достаточно атомов водорода, так что каждый углерод имеет четыре связи. Поскольку линолевая кислота имеет более одной двойной связи (у нее две), она является полиненасыщенной жирной кислотой. К этой молекуле применена система нумерации омега.Здесь, считая от омега-конца, первая встречающаяся двойная связь находится на углероде 6, так что это пример жирной кислоты омега-6.
Это изображение связано со следующими страницами Scitable:
Молекулы жирных кислот: роль в передаче клеточных сигналов
Может ли употребление жира быть полезным для нас? Некоторые молекулы жирных кислот на самом деле играют решающую роль в поддержании нашего здоровья и клеточных функций.
Влияние свободных омега-3 карбоновых кислот и фенофибрата на содержание жира в печени у пациентов с гипертриглицеридемией и неалкогольной жировой болезнью печени: двойное слепое рандомизированное плацебо-контролируемое исследование
Задний план: Лечение омега-3 жирными кислотами и фенофибратами снижает уровень триглицеридов в сыворотке крови, но лишь в нескольких исследованиях сравнивали влияние этих препаратов на жировую ткань печени.
Цель: Цель исследования EFFECT I (NCT02354976) состояла в том, чтобы определить влияние свободных омега-3 карбоновых кислот (OM-3CA) и фенофибрата на жир в печени у людей с избыточным весом или ожирением с неалкогольной жировой болезнью печени и гипертриглицеридемией.
Методы: Семьдесят восемь пациентов были рандомизированы для получения пероральных доз 4 г OM-3CA (n = 25), 200 мг фенофибрата (n = 27) или плацебо (n = 26) в течение 12 недель в двойном слепом параллельном исследовании. учиться.Протонная плотность жировой фракции (PDFF) и объем печени, объем поджелудочной железы и объемы жировой ткани оценивали с помощью магнитно-резонансной томографии.
Результаты: Изменения PDFF печени через 12 недель существенно не различались между группами лечения (относительные изменения по сравнению с исходным уровнем: плацебо +4%, OM-3CA -2% и фенофибрат +17%). Распространенный генетический полиморфизм PNPLA3 (I148M) не оказывал существенного влияния на эффекты OM-3CA или фенофибрата на PDFF печени.Лечение фенофибратом значительно увеличивало объемы печени и поджелудочной железы по сравнению с лечением плацебо, а изменения объемов печени и поджелудочной железы имели положительную корреляцию (rho 0,45, P = 0,02). Общий объем жира в печени значительно увеличился у пациентов, принимавших фенофибрат, по сравнению с OM-3CA (+23% против -3%, P = 0,04). По сравнению с OM-3CA фенофибрат увеличивает общий жир и объем печени. Триглицериды сыворотки снижались при приеме OM-3CA (-26%, P = 0,02) и фенофибрата (-38%, P <0,001) по сравнению с плацебо. В отличие от OM-3CA, фенофибрат снижал уровни докозагексаеновой кислоты в плазме и повышал уровни ацетилкарнитина и бутирилкарнитина в плазме, активность дельта-9-десатуразы и концентрацию F2-изопростанов в моче.
Выводы: OM-3CA и фенофибрат снижали уровень триглицеридов в сыворотке, но не уменьшали количество жира в печени. Фенофибрат увеличивает общий объем печени и общий объем жира в печени по сравнению с OM-3CA, что указывает на сложное влияние фенофибрата на метаболизм липидов в печени человека.
Ключевые слова: холестерин; Жировая болезнь печени; липопротеины; Печень; Неалкогольная жировая болезнь печени; жирные кислоты омега-3; PPAR; поджелудочная железа; Триглицериды.
Мечение жирных кислот с помощью связывания холина для обнаружения метаболитов карбоновых кислот в биологических образцах
[1]
Галли, К.; Симопулос, А.П.; Tremoli, E. Влияние жирных кислот и липидов на здоровье и болезнь ; Каргер: Берлин, 1994 .
[2]
Иоффе, Ю.; Коллинз, М.; Goedecke, J. Взаимосвязь между пищевыми жирными кислотами и воспалительными генами в отношении фенотипа ожирения и липидов в сыворотке. Питательные вещества , 2013 , 5 (5), 1672.
[3]
Соардо, Г.; Доннини, Д.; Доменис, Л.; Катена, К.; Де Сильвестри, Д.; Капелло, Д.; Дибенедетто, А .; Карнелутти, А .; Бонасия, В.; Пагано, К.; Сечи, Л.А. Окислительный стресс активируется свободными жирными кислотами в культивируемых гепатоцитах человека. Метаб. Синдр. Относ. Беспорядок. , 2011 , 9 (5), 397-401.
[4]
Морган, А.; Муни, К.; Mc Auley, M. Ожирение и нарушение регуляции метаболизма жирных кислот: значение для здорового старения. Exp Rev. Endocrinol. Метабол. , 2016 , 11 (6), 501-510.
[5]
Эдер, К. Газохроматографический анализ метиловых эфиров жирных кислот. Ж. Хроматогр. Б Биомед. заявл. , 1995 , 671 (1-2), 113-131.
[6]
Чен, С.-Х.; Чуанг, YJ. Анализ жирных кислот методом колоночной жидкостной хроматографии. Анал. Чим. Acta , 2002 , 465 (1-2), 145-155.
[7]
Заикин В.Г.; Халкет, Дж. М. Дериватизация в масс-спектрометрии — 8. Масс-спектрометрия малых молекул с мягкой ионизацией. евро. Дж. Масс-спектр. (Чичестер) , 2006 , 12 (2), 79-115.
[8]
Ци, Б-Л.; Лю, П.; Ван, QY; Кай, WJ; Юань, Б-Ф .; Фэн, YQ. Дериватизация для жидкостной хроматографии-масс-спектрометрии. Тенденция TrAC. Анал. хим. , 2014 , 59 , 121-132.
[9]
Брукс, CJW; Эдмондс, К.Г.; Гаскелл, С.Дж.; Smith, A.G. Производные, подходящие для ГХ-МС. Хим. физ. Липид , 1978 , 21 (4), 403-416.
[10]
Амос, WH; Нил, Р.А. Газовая хроматография-масс-спектрометрия триметилсилильных производных различных метаболитов тиамина. Анал. Биохим. , 1970 , 36 (2), 332-337.
[11]
Ниссен, В.M. Достижения в области приборов для жидкостной хроматографии-масс-спектрометрии и связанных с ними методов введения жидкости. Ж. Хроматогр. А , 1998 , 794 (1-2), 407-435.
[12]
Хо, CS; Лам, CW; Чан, MH; Ченг, RC; Закон, Л.К.; Лит, Л.К.; Нг, К.Ф.; Суэн, М.В.; Тай, Х.Л. Масс-спектрометрия с ионизацией электрораспылением: принципы и клиническое применение. клин. Биохим. , 2003 , 24 (1), 3-12.
[13]
Джемаль, М.; Оуян, З .; Тейтц, Д.С. Оптимизация состава подвижной фазы высокоэффективной жидкостной хроматографии для количественного определения соединения карбоновой кислоты в плазме человека с помощью высокоэффективной жидкостной хроматографии с электрораспылением отрицательных ионов в тандемной масс-спектрометрии. Быстрая общ. Масс-спектр. , 1998 , 12 (8), 429-434.
[14]
Ко, Б.Дж.; Бродбелт, Дж.С. Усиленная диссоциация переноса электронов пептидов, модифицированных на С-конце с фиксированными зарядами. Дж. Ам. соц. Масс-спектр. , 2012 , 23 (11), 1991-2000 гг.
[15]
Фрей, Б.Л.; Круземарк, CJ; Ледвина, А.Р.; Кун, Дж. Дж.; Белшоу, П.Дж.; Смит, Л. М. Ионно-ионные реакции с модифицированными белками с фиксированным зарядом с образованием ионов в одном состоянии с очень высоким зарядом. Междунар. Дж. Масс-спектр. , 2008 , 276 (2-3), 136-143.
[16]
Чемберс, Э.; Вагровски-Диль, Д.М.; Лу, З .; Маццео, Дж. Р. Систематическая и комплексная стратегия снижения матричных эффектов при анализе ЖХ/МС/МС. Ж. Хроматогр. Б , 2007 , 852 (1-2), 22-34.
[17]
Нейзес, Б.; Steglich, W. Простой метод этерификации карбоновых кислот. Ангеванте. хим. Междунар. Эд. англ. , 1978 , 17 (7), 522-524.
[18]
Ян, В.К.; Адамек, Дж.; Ренье, Ф.Э. Усовершенствование анализа жирных кислот методом ЖХ/МС за счет дериватизации и кодирования стабильных изотопов. Анал. хим. , 2007 , 79 (14), 5150-5157.
[19]
Плюскал, Т.; Кастильо, С.; Виллар-Брионес, А.; Oresic, M. MZmine 2: модульная структура для обработки, визуализации и анализа данных молекулярного профиля на основе масс-спектрометрии. Биоинформатика BMC , 2010 , 11 , 395.
[20]
Юнг, К.Ю.; Руццо, В.Л. Анализ основных компонентов для кластеризации данных об экспрессии генов. Биоинформатика , 2001 , 17 (9), 763-774.
[21]
Bylesjö, М.; Ранталайнен, М .; Клоарек, О .; Николсон, Дж. К.; Холмс, Э.; Trygg, J. Дискриминантный анализ OPLS: сочетание сильных сторон классификации PLS-DA и SIMCA. Ж. Хемометр. , 2006 , 20 (8-10), 341-351.
[22]
Исмаил, Р.; Ли, HY; Махьюдин, Н.А.; Абу Бакар, Ф. Исследование линейности пределов обнаружения и количественного определения авермектинов с использованием линейной регрессии. J. Пищевой анальгетик. , 2014 , 22 (4), 407-412.
[23]
Перес-Энсизо, М.; Тененхаус, М. Прогнозирование клинического исхода с помощью данных микрочипов: подход частичного дискриминантного анализа методом наименьших квадратов (PLS-DA). Гул.Жене. , 2003 , 112 (5-6), 581-592.
[24]
Sem, DS Спектральные методы в протеомике ; CRC Press: Флорида, 2007 .
Жирная кислота — The School of Biomedical Sciences Wiki
Из Школы биомедицинских наук Wiki
Жирные кислоты — это карбоновые кислоты с длиной углеродной цепи от 10 до 30 атомов.
Жирные кислоты являются неотъемлемой частью человеческого организма, они входят в состав всех клеточных мембран и являются жизненно важным источником энергии. Жирная кислота состоит из двух функциональных химических областей, одна из которых представляет собой головную часть гидрофильной карбоновой кислоты, которая ковалентно связана с другими жирными кислотами. Второй представляет собой длинную цепь углеводородов, гидрофобных и химически неактивных. Цепь либо насыщенная и не содержит двойных углерод-углеродных связей и максимальное количество атомов водорода (пальмитиновая кислота), либо ненатуральная и содержит двойные связи (олеиновая кислота.) Жирные кислоты в виде триацилглицерина запасаются в цитоплазме некоторых клеток, он состоит из трех цепей жирных кислот, связанных с молекулой глицерина. При использовании в качестве энергии в организме цепи жирных кислот высвобождаются, образуют две углеродные единицы и вступают в тот же метаболизм, что и глюкоза. Жирные кислоты представляют собой распространенный тип липидов, нерастворимых в воде, но растворимых в жирах. Цепи жирных кислот образуют фосфолипиды в клеточных мембранах, причем две жирные кислоты присоединены к глицерину, а третья присоединена к фосфатной группе.Фосфолипиды состоят из гидрофобного хвоста (цепи жирных кислот) и гидрофильной головки (фосфата), что делает их амфифильными. Эти структурные свойства позволяют липидам образовывать липидный бислой, основу клеточной мембраны.
Базовая химия
В жирных кислотах гидрофобная длинная углеродная цепь доминирует по химическим свойствам над гидрофильной карбоксильной группой и придает всей молекуле гидрофобный характер [1] .
Встречающиеся в природе жирные кислоты обычно содержат четное число атомов углерода.Наиболее распространены длиной 16 и 18 атомов. Углеродный скелет неразветвлен, за некоторыми исключениями. Более длинная углеродная цепь способствует более сильным межмолекулярным взаимодействиям. Это означает, что жирные кислоты с более длинной углеродной цепью имеют более высокую температуру плавления (см. Таблицу 1). Некоторые жирные кислоты содержат двойные связи в своей алкильной цепи. Они преимущественно имеют цис-конфигурацию, что приводит к «изломам» в форме цепи, в отличие от прямых насыщенных кислот. Фактически жирные кислоты прямой кислоты могут «упаковываться» ближе друг к другу и, следовательно, иметь более высокие точки плавления из-за более сильных молекулярных взаимодействий (см. Таблицу 1) [2] .
Таблица 1 [3] [4]
| Тривиальное имя | Тривиальное название карбоксилата | Официальное имя | Обозначение | Температура плавления (°С) |
|---|---|---|---|---|
| Лауриновая кислота | лауроил | додеканоил | 12:0 | +44 |
| Миристиновая кислота | миристоил | тетрадеканоил | 14:0 | +54 |
| Пальмитиновая кислота | пальмитоил | гексадеканоил | 16:0 | +63 |
| Стеариновая кислота | стеароил | октадеканоил | 18:0 | +70 |
| Олеиновая кислота | олеоил | цис-9-октадеценоил | 18:1c Δ 9 | +13 |
| Линолевая кислота | линолеил | ди-цис-9,12-октадекадиеноил | 18:2cc Δ 9,12 | -5 |
| Линоленовая кислота | линоленоил | все-цис-9, 12,15-октадекатриеноил | 18:3ccc Δ 9,12,15 | -11 |
| Арахидоновая кислота | арахидоноил | все-цис-5,8,11,14-эйкозатетраеноил | 20:4cccc Δ 5,8,11,14 | -50 |
Номенклатура
Систематические названия жирных кислот получены из названий их исходных углеводородов путем добавления суффикса -oic.Таким образом, жирная кислота с 16 атомами углерода называется гексадекановой кислотой. Мононенасыщенная жирная кислота с 16 атомами углерода называется гексадеценовой кислотой. Жирные кислоты с 2 и 3 двойными связями называются соответственно гексадекадиеновой и гексадекатриеновой. Также широко используются тривиальные имена (см. Таблицу 1). Греческая буква Δ, за которой следует цифра в верхнем индексе, обозначает положение двойной связи. Кроме того, поскольку при физиологических значениях pH жирные кислоты образуют ионы, их целесообразно обозначать соответственно (см. табл. 1) [5] .
Ссылки
- ↑ Charles E. Ophardt, 2003. Virtual Chembook. [онлайн] Доступно на http://www.elmhurst.edu/~chm/vchembook/551fattyacids.html [Проверено 11 января 2011 г.]
- ↑ Джереми М. Берг, Джон Л. Тимочко, Люберт Страйер, 2002. Биохимия. 5-е изд. Нью-Йорк: WH Freeman and Company
- ↑ Charles E. Ophardt, 2003. Virtual Chembook. [онлайн] Доступно на http://www.
